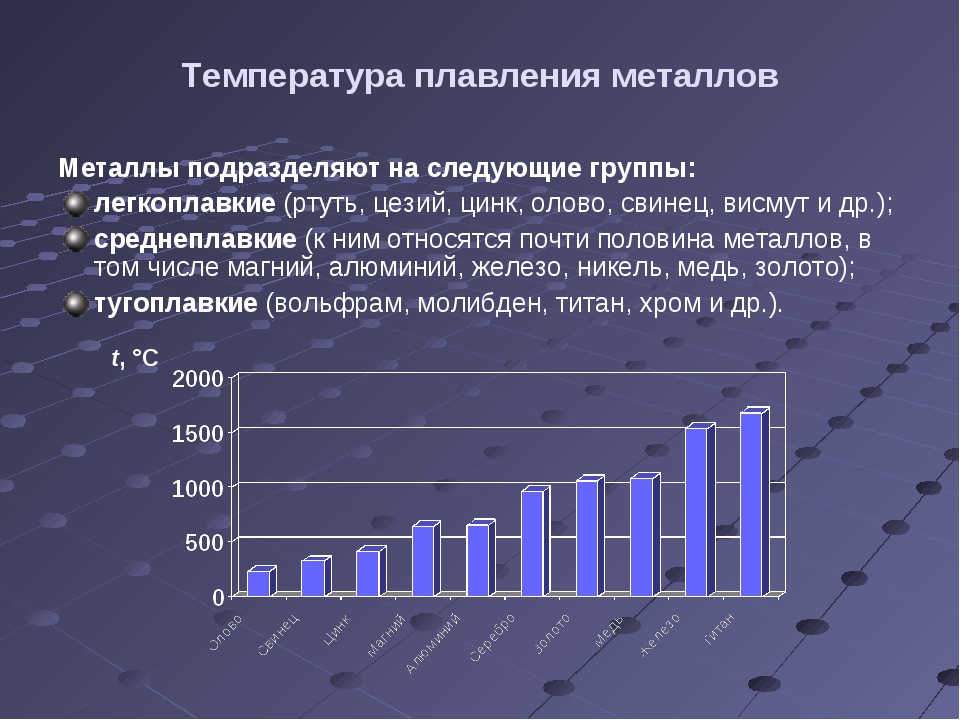
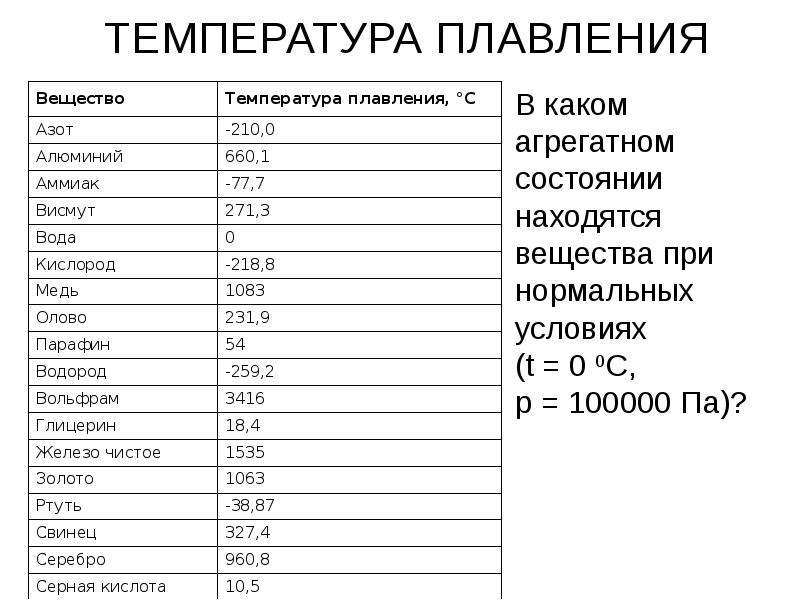
Параметры плавления порошков алюминия с различной дисперсностью
Том 323 № 3 (2013): Химия
С использованием дифференциального термического анализа исследованы параметры плавления (энтальпия плавления, температура плавления) порошков Al с различной дисперсностью. Показано, что при уменьшении диаметра частиц Al от микронного (грубодисперсные промышленные порошки АСД-1, АСД-4) до субмикронного и наноразмерного диапазона (электровзрывные порошки, dср=120 нм) происходит уменьшение величин температуры плавления на 6 градусов и удельной энтальпии плавления на 55 % относительно алюминия в массивном состоянии. На основе данных о составе исследованных образцов установлено, что понижение температуры плавления связано с формированием эвтектической системы Al-Fe с примесями железа (0,1…0,3 мас. %). Уменьшение удельной энтальпии плавления с увеличением дисперсности порошков Al обусловлено понижением доли металлической составляющей в субмикронных и наночастицах за счет влияния поверхностных оксидно-гидроксидных пленок.
Ключевые слова:
алюминий, субмикронные частицы, наночастицы, дифференциальный термический анализ, плавление, энтальпия, температура
Авторы:
Андрей Владимирович Коршунов
Скачать bulletin_tpu-2013-323-3-18.pdfАлюминиевый порошок Al
Оборудование Kermetico HVAF эффективно наносит высокопрочные, плотные и не окисленные алюминиевые покрытия. Низкое содержание кислорода в процессе Kermetico HVAF, высокая и равномерная скорость частиц приводят к высокой плотности покрытия и прочности сцепления.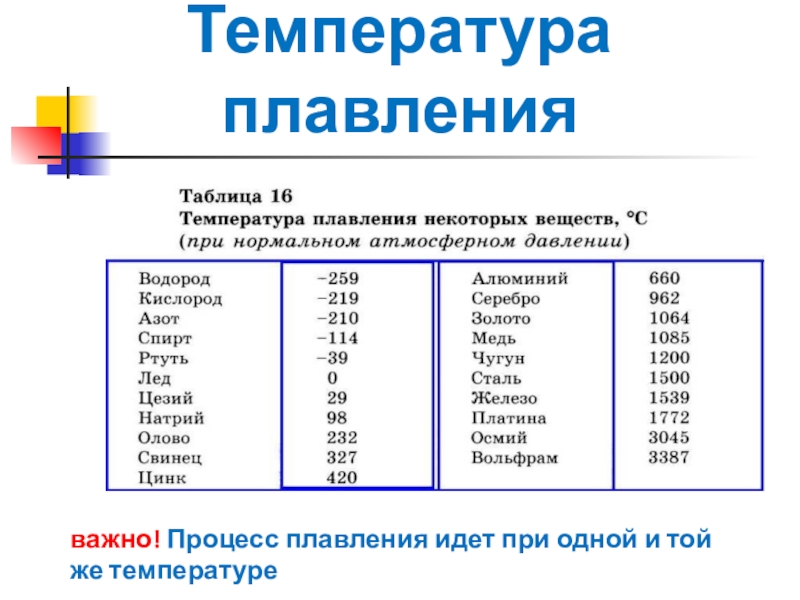
Низкое содержание кислорода в процессе Kermetico HVAF, высокая и равномерная скорость частиц приводят к высокой плотности покрытия и прочности сцепления. Это дает возможность покрывать толстые слои алюминия нашим оборудованием.
Высокоскоростные алюминиевые покрытия
Многочисленные публикации, посвященные распылению алюминия методом HVOF и холодному распылению, показывают промышленную потребность в способе формирования плотного неокисляющегося алюминиевого покрытия.
Покрытые распылением алюминиевые покрытия с такими свойствами используются для ремонта / восстановления изношенных легких деталей, для формирования коррозионно-стойкого слоя с высокой электропроводностью, для защиты магниевых подложек и при производстве присадок.
Нам неизвестно о каких-либо исследованиях, связанных с осаждением алюминиевых покрытий с помощью HVAF, поэтому мы просто распыляем его на месте и производим специализированное оборудование HVAF для напыления материалов с низкой температурой плавления.
Свойства HVAF Al Coatings
Покрытия Kermetico HVAF Al демонстрируют объемную структуру, высокую прочность сцепления и низкий уровень окисления покрытия.
Порошок Al номинального состава (мас.%):
Свойства алюминиевого покрытия
|
Кажущаяся металлографическая пористость |
<1,0% |
|
Твердость, HV |
105 |
|
Максимальная рабочая температура, o C ( o F) |
500 (932) |
|
Максимальная толщина покрытия (при напылении), мм (дюйм) |
12 (0,500) и более |
Микроструктура алюминиевого покрытия Kermetico HVAF, х100
Микрофотография покрытого алюминием слоя Kermetico HVAF, х500
Сравнение методов HVOF, HVAF и холодного распыления для распыления покрытий из чистого алюминия
Температура плавления Al составляет 660 ° C (1220 ° F), а температура кипения составляет 2470 ° C (4,478 ° F).
Коммерчески доступные системы HVOF не предназначены для обработки металлов с низкой температурой плавления. Типичная температура сгорания колеблется от 3100 ° С | 5612 ° F для окси-керосина до 3200 ° C | 5792 ° F для окси-водорода. Оба существенно выше точки кипения алюминия. Это создает риск полного испарения Al внутри камеры сгорания или сопла, накопление Al-конденсата на сопле приводит к засорению и избыточному окислению Al-покрытия. Эти риски делают распыление алюминия HVOF неблагоприятным кандидатом. Это создает риск полного испарения Al внутри камеры сгорания или сопла, накопление Al-конденсата на сопле приводит к засорению и избыточному окислению Al-покрытия. Эти риски делают распыление алюминия HVOF неподходящим кандидатом.
Осаждение Al в холодном распылении труднее, чем в других мягких материалах, таких как Zn и Cu. Это связано с его высокой теплоемкостью, что затрудняет достижение условий нестабильности при сдвиге во время удара, независимо от его низкой температуры плавления и низкого предела текучести. Хотя некоторые хорошие образцы осажденного Al были получены разными исследователями, общая стоимость процесса холодного распыления делает это применение слишком дорогим для промышленного использования.
Хотя некоторые хорошие образцы осажденного Al были получены разными исследователями, общая стоимость процесса холодного распыления делает это применение слишком дорогим для промышленного использования.
Пистолет Kermetico HVAF SL разработан специально для распыления материалов с низкой температурой плавления.
В нем есть:
- более низкие температуры сгорания (1 960–2 100 ° C | 3 560–3 812 ° F), чем температура кипения Al, предотвращающая испарение материала
- кожух инертного газа, минимизирующий окисление
- широкое сопло, предотвращающее засорение сопла
- более высокая скорость частиц, чем у HVOF, и более высокая энергия частиц, чем у холодного спрея
- более низкие инвестиционные затраты и значительно более низкие эксплуатационные расходы, чем HVOF или Cold Spray
Все это приводит к доступным алюминиевым покрытиям с почти нулевой пористостью, нулевой газопроницаемостью и высокой связью.
Типичные области применения алюминиевых покрытий Kermetico HVAFОборудование HVAF для распыления алюминиевых покрытий
Kermetico разработала специализировая горелка для распыления порошков Al и Al: Kermetico SL .
Классный урок на «Радио России – Тамбов», эфир 15 мая 2020 года
Автор ГТРК «ТАМБОВ» На чтение 11 мин. Просмотров 192 Опубликовано
В уроке химии для девятиклассников кандидат технических наук, учитель химии из 29-го тамбовского лицея Елена Эдуардовна Дегтерева рассказывает о способах получения, физических и химических свойствах алюминия.
Алюминий. Получение алюминия. Физические и химические свойства. Применение. Сегодня я хочу рассказать о самом распространённом металле в земной коре, о алюминии. Алюминий по распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Элемент алюминий расположен в III группе, главной подгруппе, 3 периоде периодической системы, порядковый номер 13, относительная атомная масса Ar(Al) → 27.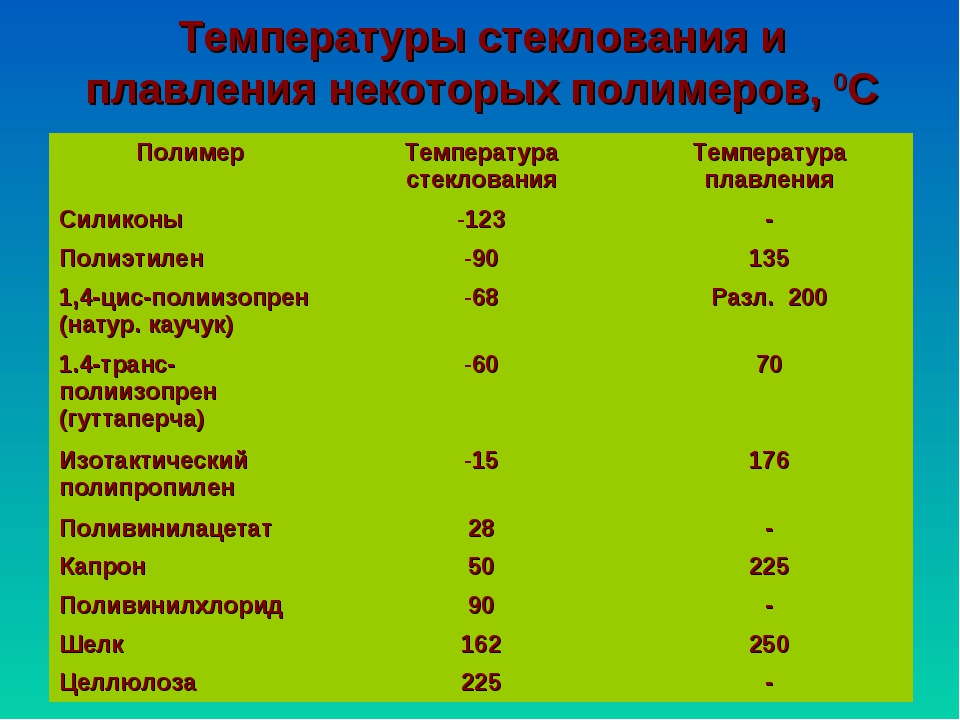 Название элемента образовано от латинского алюмен, так в древности называли квасцы, которые использовали для крашения тканей. Данный элемент носил несколько названий. Так, английский химик и физик Гемфри Дэви, предполагая присутствие его в глиноземе, называл алюминумом. В русской химической литературе 19 века встречаются следующие названия алюминия: глинозем, алумий, алюминий и глиний. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера, т. е. он является переходным элементом и его соединения являются амфотерными. Давайте вспомним, что такое амфотерность. Амфотерность (от др.-греч. ἀμφότεροι «двойственный; обоюдный») — способность химических соединений проявлять в зависимости от условий как
Название элемента образовано от латинского алюмен, так в древности называли квасцы, которые использовали для крашения тканей. Данный элемент носил несколько названий. Так, английский химик и физик Гемфри Дэви, предполагая присутствие его в глиноземе, называл алюминумом. В русской химической литературе 19 века встречаются следующие названия алюминия: глинозем, алумий, алюминий и глиний. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера, т. е. он является переходным элементом и его соединения являются амфотерными. Давайте вспомним, что такое амфотерность. Амфотерность (от др.-греч. ἀμφότεροι «двойственный; обоюдный») — способность химических соединений проявлять в зависимости от условий как 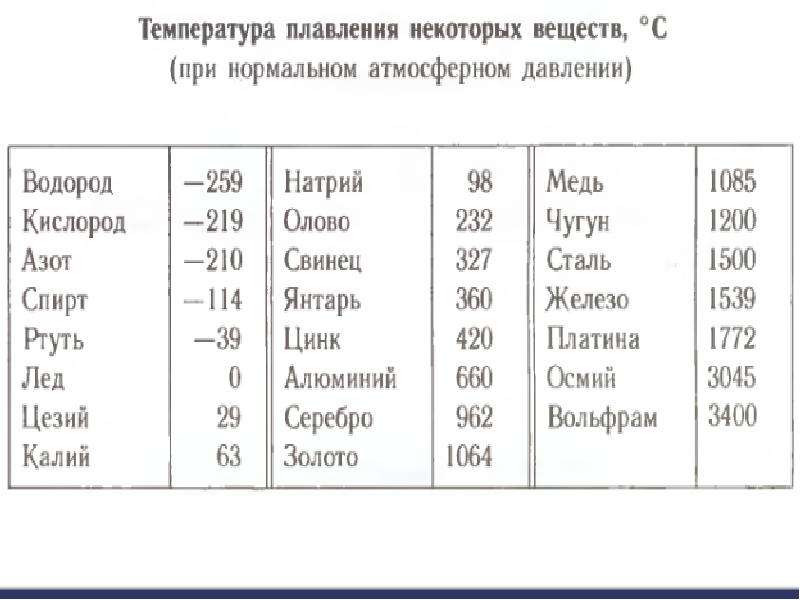 В основном состоянии 2 эл. на 3s-подуровне и 1 эл. на 3р. В возбужденном состоянии на внешнем уровне алюминия находится три неспаренных электрона. Поэтому в соединениях с ковалентной связью алюминий проявляет валентность равную III. Нахождение в природе В природе алюминий в связи с высокой химической активностью встречается почти исключительно в виде соединений. Процент содержания алюминия в земной коре составляет 8,13% массы земной коры. Совместно с кремнием он образует такие известные вам породы и минералы, как алюмосиликаты, слюду, глину. Особое место среди минералов занимает криолит Na3[AlF6] (гексафторалюминат натрия), без которого алюминий вряд ли был вторым после железа по значению металлом. Почему? Об этом мы узнаем чуть позже. Целая группа природных веществ в качестве основного компонента содержит оксид алюминия: это бокситы – основное сырьё для производства алюминия; корунд – одно из самых твёрдых природных веществ.
В основном состоянии 2 эл. на 3s-подуровне и 1 эл. на 3р. В возбужденном состоянии на внешнем уровне алюминия находится три неспаренных электрона. Поэтому в соединениях с ковалентной связью алюминий проявляет валентность равную III. Нахождение в природе В природе алюминий в связи с высокой химической активностью встречается почти исключительно в виде соединений. Процент содержания алюминия в земной коре составляет 8,13% массы земной коры. Совместно с кремнием он образует такие известные вам породы и минералы, как алюмосиликаты, слюду, глину. Особое место среди минералов занимает криолит Na3[AlF6] (гексафторалюминат натрия), без которого алюминий вряд ли был вторым после железа по значению металлом. Почему? Об этом мы узнаем чуть позже. Целая группа природных веществ в качестве основного компонента содержит оксид алюминия: это бокситы – основное сырьё для производства алюминия; корунд – одно из самых твёрдых природных веществ. Его мелкокристаллические непрозрачные разновидности серовато-чёрного цвета называют наждаком и применяют в качестве абразивного материала. Эту же формулу имеет и другое природное соединение — глинозём. Наиболее драгоценными корундами являются рубины и сапфиры. Их окраска обусловлена различными примесями. Так, ион Сr3+ придаёт камню красный цвет (рубин), а ионы Тi 4+, Fe2+, Fe3+ придают синий цвет (сапфир). Эти разновидности благородного корунда наряду с алмазом и изумрудом занимают высшее место в классификации драгоценных камней и применяют для изготовления ювелирных изделий. В настоящее время рубины и сапфиры получают искусственно и используют для технических целей, например, для изготовления деталей часов и других точных приборов. Кристаллы рубинов применяют в лазерах.
Его мелкокристаллические непрозрачные разновидности серовато-чёрного цвета называют наждаком и применяют в качестве абразивного материала. Эту же формулу имеет и другое природное соединение — глинозём. Наиболее драгоценными корундами являются рубины и сапфиры. Их окраска обусловлена различными примесями. Так, ион Сr3+ придаёт камню красный цвет (рубин), а ионы Тi 4+, Fe2+, Fe3+ придают синий цвет (сапфир). Эти разновидности благородного корунда наряду с алмазом и изумрудом занимают высшее место в классификации драгоценных камней и применяют для изготовления ювелирных изделий. В настоящее время рубины и сапфиры получают искусственно и используют для технических целей, например, для изготовления деталей часов и других точных приборов. Кристаллы рубинов применяют в лазерах.  Такую распространённость в наше время алюминий получил благодаря своей лёгкости, прочности и высокой устойчивости к коррозии (к окислению на воздухе). Однако так было не всегда. С начала открытия алюминия датским физиком Хансом Эрстедом в 1825 году и до конца 19 века ещё не было известно о простом получении его из руды и поэтому алюминий получали восстановлением из его хлорида щелочными металлами калием или натрием. Такой способ был очень дорог, а полученный металл стоял дороже золота. В 18-19 веках алюминий был главным ювелирным металлом. Так в 1889 г. британцы, желая почтить богатым подарком великого русского химика Д.И. Менделеева, подарили ему весы из золота и алюминия. С конца 19 века и по сей день Al получают методом электрометаллургии из оксида алюминия, содержащегося в глинозёме и бокситах. Кристаллическая решётка оксида алюминия состоит из сильно поляризованных атомов алюминия и кислорода, силы притяжения между которыми весьма велики. Это обуславливает высокую температуру плавления оксида алюминия – около 2050 оС.
Такую распространённость в наше время алюминий получил благодаря своей лёгкости, прочности и высокой устойчивости к коррозии (к окислению на воздухе). Однако так было не всегда. С начала открытия алюминия датским физиком Хансом Эрстедом в 1825 году и до конца 19 века ещё не было известно о простом получении его из руды и поэтому алюминий получали восстановлением из его хлорида щелочными металлами калием или натрием. Такой способ был очень дорог, а полученный металл стоял дороже золота. В 18-19 веках алюминий был главным ювелирным металлом. Так в 1889 г. британцы, желая почтить богатым подарком великого русского химика Д.И. Менделеева, подарили ему весы из золота и алюминия. С конца 19 века и по сей день Al получают методом электрометаллургии из оксида алюминия, содержащегося в глинозёме и бокситах. Кристаллическая решётка оксида алюминия состоит из сильно поляризованных атомов алюминия и кислорода, силы притяжения между которыми весьма велики. Это обуславливает высокую температуру плавления оксида алюминия – около 2050 оС.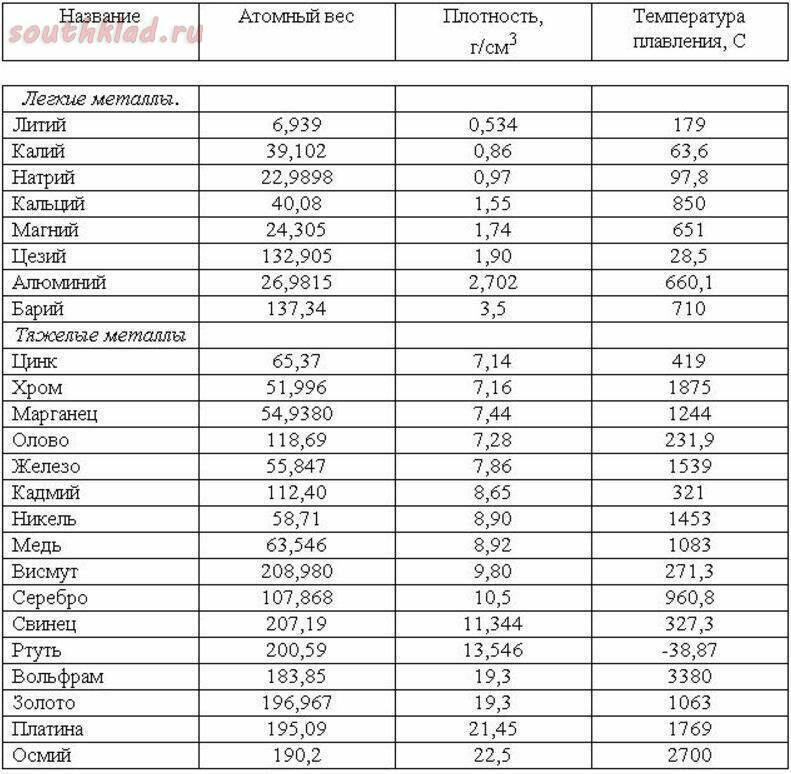 Сложность достижения такой высокой температуры и энергоемкость процесса долгое время относили алюминий к числу труднодоступных металлов. В конце XIX века американский студент –химик Чарльз Мартин Холл обнаружил, что глинозём можно растворить при 950 оС в расплавленном минерале криолите (вот почему он важен для получения алюминия) и электролизом выделить из полученного раствора алюминий. Независимо от Мартина Холла в том же году это открытие сделал французский металлург Поль Луи Туссен Эру. Для того, чтобы иметь более точное представление об электролизе Al2O3 в криолите Na3AlF6 , необходимо уточнить схему электролитической диссоциации Al2O3. Как же он диссоциирует ? Мы знаем, что гидроксид алюминия Al(ОН)3 обладает амфотерными свойствами и его кислотную форму можно представить в виде ортоалюминиемой кислоты Н3AlO3. Этой кислоте соответствует алюминат анион AlO33-.
Сложность достижения такой высокой температуры и энергоемкость процесса долгое время относили алюминий к числу труднодоступных металлов. В конце XIX века американский студент –химик Чарльз Мартин Холл обнаружил, что глинозём можно растворить при 950 оС в расплавленном минерале криолите (вот почему он важен для получения алюминия) и электролизом выделить из полученного раствора алюминий. Независимо от Мартина Холла в том же году это открытие сделал французский металлург Поль Луи Туссен Эру. Для того, чтобы иметь более точное представление об электролизе Al2O3 в криолите Na3AlF6 , необходимо уточнить схему электролитической диссоциации Al2O3. Как же он диссоциирует ? Мы знаем, что гидроксид алюминия Al(ОН)3 обладает амфотерными свойствами и его кислотную форму можно представить в виде ортоалюминиемой кислоты Н3AlO3. Этой кислоте соответствует алюминат анион AlO33-. Формулу алюминиемой соли этой кислоты можно записать AlAlO3. Так ведь это и есть оксид алюминия. Таким образом, в расплаве криолита он диссоциирует, на катион металла и анион кислотного остатка. Поэтому на катоде (отрицательно заряженном электроде) идёт восстановление катиона Al3+ до свободного металла. Катод (-): Al3+ +3е = Al На графитовом аноде (положительно заряженном электроде) окисляется алюминат анион AlO33-. При этом происходит следующий электродный процесс: Анод(+): 4AlO33- -12 е = 2Al2O3 + 3O2 При суммировании левых и правых частей электродных процессов получается молекулярное уравнение электролиза: Процесс проводят в специальных электролитических ваннах, которые одновременно являются катодом. Анодом служат угольные брикеты. Температуру плавления криолита в электролизёре поддерживают благодаря очень большой силе тока, которая достигает 250 кА при напряжении около 4 В.
Формулу алюминиемой соли этой кислоты можно записать AlAlO3. Так ведь это и есть оксид алюминия. Таким образом, в расплаве криолита он диссоциирует, на катион металла и анион кислотного остатка. Поэтому на катоде (отрицательно заряженном электроде) идёт восстановление катиона Al3+ до свободного металла. Катод (-): Al3+ +3е = Al На графитовом аноде (положительно заряженном электроде) окисляется алюминат анион AlO33-. При этом происходит следующий электродный процесс: Анод(+): 4AlO33- -12 е = 2Al2O3 + 3O2 При суммировании левых и правых частей электродных процессов получается молекулярное уравнение электролиза: Процесс проводят в специальных электролитических ваннах, которые одновременно являются катодом. Анодом служат угольные брикеты. Температуру плавления криолита в электролизёре поддерживают благодаря очень большой силе тока, которая достигает 250 кА при напряжении около 4 В. Очевидно, что получение алюминия – очень энергоемкий процесс. Кислород, выделяющийся на аноде, реагирует с углеродом, превращаясь в СО2. При этом угольный анод постепенно «сгорает». Физические свойства алюминия Алюминий как простое вещество представляет собой серебристо-белый металл, достаточно лёгкий (плотность 2,7 г/см3) и относительно легкоплавкий (на бытовой газовой плите с температурой пламени 850оС алюминиевый чайник расплавится, так как температура плавления его 660 оС). На воздухе поверхность металла покрыта тонкой, но очень прочной оксидной плёнкой, предохраняющей его от дальнейшего окисления. Алюминий очень пластичен, его можно прокатывать в фольгу толщиной 0,001 мм. По электро- и теплопроводности он уступает лишь серебру и меди. По сравнению с перечисленными металлами алюминий дешевле. Казалось бы, вот замечательный материал для изготовления высоковольтных линий электропередач! Но мягкость и пластичность алюминия привели бы к тому, что через год под собственной тяжестью провода провисли бы до земли.
Очевидно, что получение алюминия – очень энергоемкий процесс. Кислород, выделяющийся на аноде, реагирует с углеродом, превращаясь в СО2. При этом угольный анод постепенно «сгорает». Физические свойства алюминия Алюминий как простое вещество представляет собой серебристо-белый металл, достаточно лёгкий (плотность 2,7 г/см3) и относительно легкоплавкий (на бытовой газовой плите с температурой пламени 850оС алюминиевый чайник расплавится, так как температура плавления его 660 оС). На воздухе поверхность металла покрыта тонкой, но очень прочной оксидной плёнкой, предохраняющей его от дальнейшего окисления. Алюминий очень пластичен, его можно прокатывать в фольгу толщиной 0,001 мм. По электро- и теплопроводности он уступает лишь серебру и меди. По сравнению с перечисленными металлами алюминий дешевле. Казалось бы, вот замечательный материал для изготовления высоковольтных линий электропередач! Но мягкость и пластичность алюминия привели бы к тому, что через год под собственной тяжестью провода провисли бы до земли. Поэтому в технике, где требуется и прочность конструкции, наряду с лёгкостью и высокой электропроводностью, используют не чистый алюминий, а его сплавы (например с магнием, марганцем, медью и никелем — дюралюминий или с кремнием – силумин). Рассмотрим химические свойства алюминия. В электрохимическом ряду напряжений металлов алюминий близок к щелочным и щелочноземельным металлам и проявляет себя как химически активный металл. В некоторых случаях от протекания возможных при нормальных условиях реакций (например с водой) его спасает оксидная плёнка. В химических реакциях он проявляет восстановительные свойства. Для алюминия во всех соединениях характерна единственно возможная степень окисления +3. Порошкообразный алюминий легко взаимодействует с простыми веществами (неметаллами).
Поэтому в технике, где требуется и прочность конструкции, наряду с лёгкостью и высокой электропроводностью, используют не чистый алюминий, а его сплавы (например с магнием, марганцем, медью и никелем — дюралюминий или с кремнием – силумин). Рассмотрим химические свойства алюминия. В электрохимическом ряду напряжений металлов алюминий близок к щелочным и щелочноземельным металлам и проявляет себя как химически активный металл. В некоторых случаях от протекания возможных при нормальных условиях реакций (например с водой) его спасает оксидная плёнка. В химических реакциях он проявляет восстановительные свойства. Для алюминия во всех соединениях характерна единственно возможная степень окисления +3. Порошкообразный алюминий легко взаимодействует с простыми веществами (неметаллами).- С галогенами (с такими как Cl2 и Вr2). Реакция протекает бурно при комнатной температуре:
 Если смешать порошок алюминия и йода то реакция не начнётся, для инициации реакции в смесь добавляют каплю воды, от которой происходит смачивание компонентов и смесь загорается сама собой с выделением фиолетового дыма из паров йода, таким образом вода в этой реакции является катализатором.
Если смешать порошок алюминия и йода то реакция не начнётся, для инициации реакции в смесь добавляют каплю воды, от которой происходит смачивание компонентов и смесь загорается сама собой с выделением фиолетового дыма из паров йода, таким образом вода в этой реакции является катализатором.- Для начала реакции с другими неметаллами (с S, C, N2, Р), требуется нагревание, зато дальнейшее взаимодействие, сопровождается выделением большого количества теплоты.
- С водородом Al непосредственно не реагирует.

 В результате реакции с водой образуется гидроксид алюминия и водород. 2Al + 6H2O = 2Al(OH)3 + 3H2
В результате реакции с водой образуется гидроксид алюминия и водород. 2Al + 6H2O = 2Al(OH)3 + 3H2- Одно из важнейших химических свойств алюминия – способность вытеснять металлы из их оксидов – используют в металлургии. Этим способом получают хром, железо, марганец, ванадий, титан, цирконий. Этот метод получения простых веществ металлов называется алюмотермией:
 ) = Al2(SO4)3 + 3H2А вот концентрированные серная и азотная кислоты пассивируют алюминий при обычной температуре, образуя на поверхности металла, прочную оксидную плёнку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах. С разбавленной азотной кислотой алюминий реагирует с образованием оксида азота (II): Al + 4HNO3(разб.) = Al(NO3)3 + NO↑ + 2H2O При нагревании Al растворяется в кислотах — окислителях, образующих растворимые соли алюминия: 2Al + 6H2SO4(конц) = 4Al2(SO4)3 + 3SО2↑ + 6H2O Al + 6HNO3(конц) = Al(NO3)3 + 3NO2↑ + 3H2O
) = Al2(SO4)3 + 3H2А вот концентрированные серная и азотная кислоты пассивируют алюминий при обычной температуре, образуя на поверхности металла, прочную оксидную плёнку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах. С разбавленной азотной кислотой алюминий реагирует с образованием оксида азота (II): Al + 4HNO3(разб.) = Al(NO3)3 + NO↑ + 2H2O При нагревании Al растворяется в кислотах — окислителях, образующих растворимые соли алюминия: 2Al + 6H2SO4(конц) = 4Al2(SO4)3 + 3SО2↑ + 6H2O Al + 6HNO3(конц) = Al(NO3)3 + 3NO2↑ + 3H2O- Алюминий – амфотерныйметалл, поэтому он взаимодействует со щелочами.

 Она не только придает красивый внешний вид изделиям и сооружениям, но и защищает их от химического разрушения. Для защиты от солнечных лучей алюминиевой краской покрывают цистерны, предназначенные для перевозки нефтепродуктов и других горючих веществ. Исследуя влияние алюминия на различные пищевые продукты, ученые установили, что при контакте пищи с алюминием не разрушаются витамины. Это открытие послужило причиной широкого применения алюминия в пищевой промышленности, в виде посуды из алюминия, а также в косметике и бытовой химии. Из алюминия изготавливают разнообразную аппаратуру, предназначенную для переработки пищевых продуктов в сахарной, кондитерской, маслобойной и других отраслях промышленности. Сегодня на уроке мы узнали об алюминии: положение этого элемента в Периодической системе, строение его атома, нахождение в природе, физические и химические свойства металла алюминия, получение и применение алюминия.
Она не только придает красивый внешний вид изделиям и сооружениям, но и защищает их от химического разрушения. Для защиты от солнечных лучей алюминиевой краской покрывают цистерны, предназначенные для перевозки нефтепродуктов и других горючих веществ. Исследуя влияние алюминия на различные пищевые продукты, ученые установили, что при контакте пищи с алюминием не разрушаются витамины. Это открытие послужило причиной широкого применения алюминия в пищевой промышленности, в виде посуды из алюминия, а также в косметике и бытовой химии. Из алюминия изготавливают разнообразную аппаратуру, предназначенную для переработки пищевых продуктов в сахарной, кондитерской, маслобойной и других отраслях промышленности. Сегодня на уроке мы узнали об алюминии: положение этого элемента в Периодической системе, строение его атома, нахождение в природе, физические и химические свойства металла алюминия, получение и применение алюминия.Алюминий. Плотность Al 2,7 ка/м3, температура плавления 660° С.
 AI имеет решетку К12.
AI имеет решетку К12.Содержание:
Алюминий
- Плотность Al 2,7 кг / л < 3, температура плавления 660°С. A! Имеет решетку К12. АИ хорошо сваривается во всех видах сварки, но плохо обрабатывается и имеет недостаточные литейные характеристики. Дуктильность прокатанного и обожженного АИ высока (8 = 35%), и прочность на растяжение небольшая (с = 80 МН / м2).
Прочность на растяжение может быть увеличена свободными колесами (cu = 140 Mn / m ’ 2), но пластичность A1 резко снижается(6 <6%). В соответствии с ГОСТ 11069-64, в зависимости от химического состава, Таблица 18.1 Химический состав алюминия (ГОСТ 110Г9-64)
АИ классифицируется следующим образом (таблица 18.1): особая, высокая, техническая чистота Людмила Фирмаль
Химический состав ранга очищенности алюминиевый、% L) (по крайней мере) примеси (Fe, Si, Cu, Zn, Ti) Специальный A999 99.999 0.00! Высокой А995 99.995 0.005 А99 99.99 0. 010 L97 99.97 0.03 А95-99,95-0,05 Технический A85 99.85 0.15 Л8 99.80 0.20 А7 99.70 0.30 А6 99.60 0.40 А5 99.50 0.50 АО 99.00 1.00 В 1.00 99.00 АЭ 99.50-0.50
010 L97 99.97 0.03 А95-99,95-0,05 Технический A85 99.85 0.15 Л8 99.80 0.20 А7 99.70 0.30 А6 99.60 0.40 А5 99.50 0.50 АО 99.00 1.00 В 1.00 99.00 АЭ 99.50-0.50
Примечание » I:1. Знак АИ обозначается буквой «А», что указывает на 0,001-0,6% примесей. 2.Al особой чистоты A999, значение остаточного электрического сопротивления на температуре жидкостного гелия (rv <4-10 ″ * ln-s. h), но очищенность технологии AI обожгла провод p <0.0280 ом mm * / m также потребность обеспечить.
- А1 и его сплавы обладают достаточной коррозионной стойкостью(за счет того, что поверхностная защитная пленка обладает высокими защитными свойствами). Упорные примеси в Си и Ку увеличивают прочность А1, но ухудшают дуктильность и коррозионную устойчивость. СЭ, Си и Al: а и Р-фазы(Аль-Фе-Си).Эти фазы отсутствуют в бинарных системах A1-Fe и Al-Si. ИИ включает Ал3 Фе, а-фаза, P-фазы, а Си. Рис.18. 1 диаграмма состояния системы Al-Fe Fe снижает технические характеристики AI (обработка давлением) и нерастворим в AI(рисунок 18.
 1).
1).
Даже при небольшом содержании Fe образуется эвтектика Fe + AlaFe (l, 7%Fe или 7%AI3Fe). Si не образует А1 и химических соединений(рис. 18.2). . A1 Si также почти нерастворим при комнатной температуре(концентрация Si при 577°C составляет 1,65%, а 300 ° C-0,09%).
Си-А1-это практически неразрешимая Людмила Фирмаль
А Си ведет к образованию. Эвтектика состоит из альтернативной реализации 11,7% SI и обеих фаз. Одновременное действие тройных соединений Fe AC%$ 1 Рис. 18.2. Диаграмма состояния системы Al-S1
Смотрите также:
Решения задач по материаловедению
Будет ли нагревать оксид алюминия (Al2O3) до его температуры плавления, получить чистый Al?
Вы выяснили половину процесса Hall-Heroult . Только плавление глинозема само по себе не освободит кислород. Причина трудно объяснить, не вдаваясь в химическую термодинамику — один из способов думать о ней состоит в том, что самым низким энергетическим состоянием является тот, где кислород связан с оксидом алюминия, где электроны из оксида алюминия были «взяты» кислородом.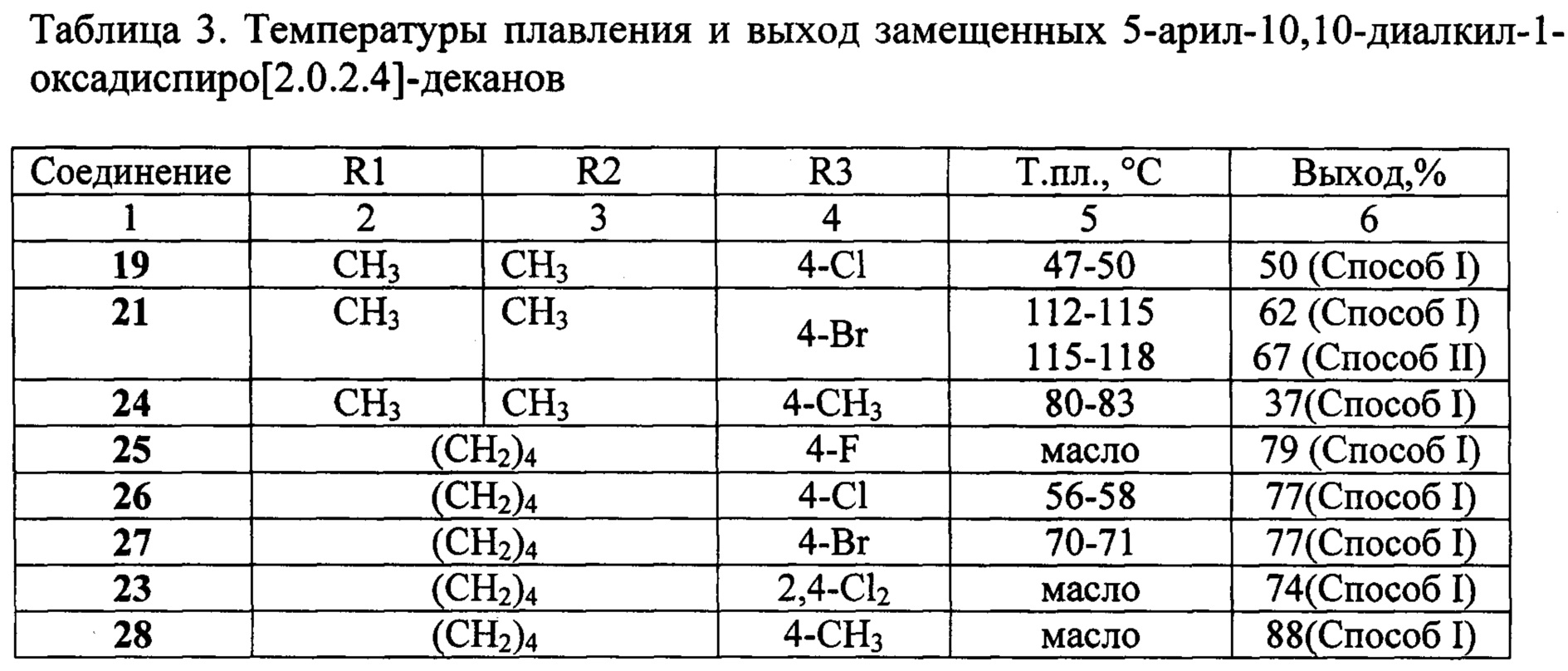 В двухатомном кислороде электроны «разделены» (связи ковалентны), и поэтому полная энергия выше. Это очень краткое и не очень подробное объяснение, но конечным результатом является то, что кислород и алюминий, если им предоставлена возможность, скорее образуют связь, чем нет.
В двухатомном кислороде электроны «разделены» (связи ковалентны), и поэтому полная энергия выше. Это очень краткое и не очень подробное объяснение, но конечным результатом является то, что кислород и алюминий, если им предоставлена возможность, скорее образуют связь, чем нет.
Когда вы добавляете тепловую энергию, если она не изменит этот баланс (это не так, по крайней мере, пока вы не пройдете мимо точки плавления), все, что вы делаете, делает возможным больше для реакции на бывает. Если вы продолжаете идти, вы можете в конечном итоге добавить достаточную тепловую энергию для полного диссоциации глинозема, и в этот момент (в зависимости от того, как вы это сделали) вы могли бы удалить кислород и восстановить алюминий.
Однако — количество энергии, которое потребуется для этого, чрезвычайно велико. Вместо этого оказывается намного проще просто заставить кислород вернуть электроны обратно к алюминию с использованием электрического потенциала. Когда вы это сделаете, вы электролизуете соединение и создаете диатомовый кислород на аноде и алюминии на катоде ,
Процесс Холла-Херуля делает этот еще один шаг, чтобы сделать эту работу еще более низкой (1000 ° С), растворяя глинозем в расплаве криолита . В результате это один из наиболее эффективных (возможно, ) эффективных промышленных процессов для производства алюминия и отвечает за широкую доступность и низкую стоимость алюминия в наше время (а также за существование Alcoa ).
В результате это один из наиболее эффективных (возможно, ) эффективных промышленных процессов для производства алюминия и отвечает за широкую доступность и низкую стоимость алюминия в наше время (а также за существование Alcoa ).
Ваше представление об использовании солнечной энергии неплохое — хотя вы можете быть удивлены тем, сколько энергии вам нужно для производства алюминия — как для его расплавления, так и для электролиза. Одна вещь, которую вы можете изучить, — использовать солнечный тепловой нагрев (например, с коллектором) для расплавления смеси оксида алюминия/криолита, а затем использовать фотогальванику только для этапа электролиза. Это было бы немного дешевле, чем использование электричества только для электроводонагревателя.
Industrially, the cryolite mixture is kept molten by passing a large electric current through it. The electricity is usually produced by power plants, since the amount required is so large (15 kWh/kg according to Alcoa, and that’s just for the electrolysis step!). Although coal and gas power isn’t renewable, the advantages are a relatively low cost per unit of power (which might not stay true in the next few decades) and on-demand power generation (likely to always be a big advantage over solar).
Although coal and gas power isn’t renewable, the advantages are a relatively low cost per unit of power (which might not stay true in the next few decades) and on-demand power generation (likely to always be a big advantage over solar).
Существует также ядерная, гидроэлектроэнергетическая и геотермальная энергия — все это обеспечивает огромные объемы электроэнергии по требованию очень недорого, как только завод будет построен.
Точки плавления и кипения за период 3
Результаты обучения
Изучив эту страницу, вы сможете:
- описывать и объяснять тенденции температур плавления и кипения в течение периода 3
Температуры плавления и кипения
В таблице указаны температуры плавления и кипения элементов от Na до Ar.
| Элемент | Символ | Атомный номер | Точка плавления /K | Точка кипения /К |
|---|---|---|---|---|
| натрий | На | 11 | 371 | 1156 |
| магний | мг | 12 | 922 | 1380 |
| алюминий | Ал | 13 | 933 | 2740 |
| кремний | Си | 14 | 1683 | 2628 |
| фосфор | Р | 15 | 317 | 553 |
| сера | С | 16 | 392 | 718 |
| хлор | Кл | 17 | 172 | 238 |
| аргон | Ар | 18 | 84 | 87 |
Температуры даны в кельвинах, K.
Вы можете легко преобразовать K в °C и обратно:
°С = К + 273 (например, 100 °С = 373 К)
K = °C – 273 (например, 273 K = 0 °C)Строго говоря, должно быть 273,15, а не 273, но менее точное значение допустимо на уровне A.
Описание тренда
На графике показано, как температуры плавления и кипения изменяются в течение периода 3.
На этом графике много всего происходит, поэтому часто проще разделить его на три части.В таблице ниже приведен краткий обзор этих разделов.
| Элементы | Тип элемента | Тип конструкции | Описание |
|---|---|---|---|
| Na, Mg, Al | металл | металлический | т.п. и увеличение п.н. от Na до Al |
| Си | металлоид | гигантский ковалентный | мп больше, чем Al п.  н. между Mg и Al н. между Mg и Al |
| P, S, Cl, Ar | неметаллический | простой молекулярный (Ar одноатомный) | мп и бп убавляются в порядке: S > P > Cl > Ar |
Когда вы нажмете на символ загрузки, вы сможете загрузить график в виде файла изображения или файла PDF, сохранить его данные, аннотировать его и распечатать.Обратите внимание, что графики будут помечены водяными знаками.Когда вещество плавится, некоторые силы притяжения между частицами нарушаются или ослабевают.Частицы могут двигаться вокруг друг друга, но все еще находятся близко друг к другу.
Когда вещество кипит, большая часть оставшихся сил притяжения разрушается. Частицы могут свободно перемещаться и находиться далеко друг от друга.
Чем сильнее силы притяжения, тем больше энергии требуется для их преодоления и тем выше температура плавления или кипения.
× Нажмите на клавишу под графиком, чтобы включить или выключить каждый набор столбцов.

×
Объяснение этой тенденции
Натрий, магний и алюминий
Натрий, магний и алюминий — все это металлы. Они имеют металлическую связь, при которой ядра атомов металла притягиваются к делокализованным электронам.
Переход от натрия к алюминию:
- заряд ядер увеличивается …
- число делокализованных электронов увеличивается …
- поэтому прочность металлического соединения увеличивается и …
- температуры плавления и кипения повышаются.
Металлическую связь часто неправильно описывают как притяжение между положительными ионами металла и делокализованными электронами. Однако металлы по-прежнему состоят из атомов, но внешние электроны не связаны с каким-либо конкретным атомом.
Подобным образом графит (неметалл) также имеет делокализованные электроны. Однако вы не понимаете, что он состоит из ионов углерода.
Кремний
Кремний — это металлоид с гигантской ковалентной структурой. Кремний имеет очень высокую температуру плавления и кипения, потому что: все атомы кремния удерживаются вместе прочными ковалентными связями… для разрыва которых требуется очень большое количество энергии.
Кремний имеет очень высокую температуру плавления и кипения, потому что: все атомы кремния удерживаются вместе прочными ковалентными связями… для разрыва которых требуется очень большое количество энергии.
- атомы кремния притягиваются друг к другу сильными ковалентными связями …
- , которым требуется очень большое количество энергии, чтобы их можно было сломать.
Гигантская решетчатая структура кремния похожа на структуру алмаза. Каждый атом кремния ковалентно связан с четырьмя другими атомами кремния в тетраэдрическом расположении.
Фосфор, сера, хлор и аргон
Эти элементы являются неметаллами. Фосфор, сера и хлор существуют в виде простых молекул, между которыми действуют силы Ван-дер-Ваальса. Аргон одноатомен – он существует в виде отдельных атомов. Между его атомами действуют силы Ван-дер-Ваальса. Температуры плавления и кипения этих элементов очень низкие, потому что:
- Силы Ван-дер-Ваальса — очень слабые силы притяжения …
- мало энергии нужно для их преодоления.

Фосфор существует в виде молекул P 4 , сера существует в виде молекул S 8 , хлор существует в виде молекул Cl 2 , а аргон существует в виде отдельных атомов. Сила ван-дер-ваальсовых сил уменьшается по мере уменьшения размера молекулы, поэтому температуры плавления и кипения уменьшаются в порядке:
S 8 > P 4 > Cl 2 > Ar
Атомы в молекулах фосфора, серы или хлора притягиваются друг к другу ковалентными связями.Эти связи намного сильнее, чем силы Ван-дер-Ваальса между молекулами: ковалентные связи не разрываются при изменении состояния этих элементов.
точек плавления элементов периода 3
В периодичности нам нужно объяснить тенденцию изменения температуры плавления элементов периода 3.
Давайте сначала посмотрим на тренд точки плавления.
Следует отметить несколько моментов:
1.
 Повышение температуры плавления металлов Na, Mg и Al
Повышение температуры плавления металлов Na, Mg и AlПрочность металлических связей связана с валентностью.
В течение периода валентность увеличивается (от валентности 1 в натрии до валентности 3 в алюминии), поэтому атомы металла могут делокализовать больше электронов с образованием большего количества положительно заряженных катионов и большего моря делокализованных электронов.
Поэтому металлическая связь становится прочнее, а температура плавления увеличивается от натрия к алюминию.
На самом деле металлическая связь в натрии и других металлах группы 1 настолько слаба, что температура плавления натрия необычно низка и попадает в область простых молекул.
2. Высокая температура плавления Si
Кремний представляет собой макромолекулу или гигантскую молекулу с сильными и обширными ковалентными связями.
Поэтому для преодоления этих ковалентных связей требуется много энергии, а температура плавления кремния очень высока.
Температура плавления Si является самой высокой среди элементов Периода 3, но обратите внимание, что это не означает, что все гигантские молекулы имеют более высокую температуру плавления, чем все металлы.
В химической связи мы рассматриваем металлическую связь, ионную связь и ковалентную связь как сильные связи, поэтому точки плавления металлов, ионных соединений и гигантских молекул считаются высокими.
Обычно мы не сравниваем температуры плавления металлов, ионных соединений и гигантских молекул.
3. Температура плавления неметаллов уменьшается в порядке S
8 , P 4 , Cl 2Фосфор, сера и хлор существуют в виде простых молекул с молекулярной формулой P 4 , S 8 и Cl 2 соответственно.
Поскольку они неполярны, доминирующими межмолекулярными силами притяжения будут мгновенное дипольное притяжение, индуцированное диполями, или дисперсионные силы, или силы Ван-дер-Ваальса.
Чем больше и более поляризуемо электронное облако, тем сильнее притяжение id-id между молекулами, следовательно, тем выше температура плавления.
Поскольку молекулярная масса и размер электронного облака находятся в порядке S 8 > P 4 > Cl 2 , тренд температуры плавления будет в том же порядке.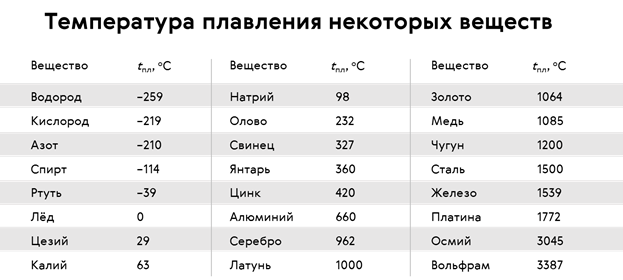
Мы можем использовать температуру плавления натрия в качестве точки отсчета для точек плавления неметаллов:
— P 4 немного ниже Na
— S 8 немного выше Na
— Cl 2 намного ниже Na
Тема: Периодичность, неорганическая химия, химия уровня A, Сингапур
Вернуться к другим предыдущим видеоурокам по неорганической химии.
Было ли это видео A Level Chemistry полезным?
Поставьте лайк этому видео и ПОДЕЛИТЕСЬ им с друзьями!
Присоединяйтесь к моим 2000+ подписчикам на моем канале YouTube, чтобы получать новые видеоуроки по химии каждую неделю.
Посмотрите другие видеоуроки A Level Chemistry здесь!
Нужен опытный репетитор, который сделает для вас химию проще?
Подумайте о том, чтобы записаться на мои уроки химии уровня A Level h3 в Bishan или онлайн-курсы обучения!
Самовосстанавливающийся сплав Al 6061, армированный сплавами с низкой температурой плавления
Действия
‘) var buybox = документ. querySelector(«[data-id=id_»+ метка времени +»]»).parentNode ;[].slice.call(buybox.querySelectorAll(«.вариант-покупки»)).forEach(initCollapsibles) функция initCollapsibles(подписка, индекс) {
var toggle = подписка.querySelector(«.цена-варианта-покупки»)
подписка.classList.remove(«расширенный»)
var form = подписка.querySelector(«.форма-варианта-покупки»)
var priceInfo = подписка.селектор запросов(«.Информация о цене»)
var PurchaseOption = toggle.parentElement если (переключить && форма && priceInfo) {
toggle.setAttribute(«роль», «кнопка»)
toggle.setAttribute(«tabindex», «0») toggle.addEventListener («щелчок», функция (событие) {
var expand = toggle.getAttribute(«aria-expanded») === «true» || ложный
переключать.
querySelector(«[data-id=id_»+ метка времени +»]»).parentNode ;[].slice.call(buybox.querySelectorAll(«.вариант-покупки»)).forEach(initCollapsibles) функция initCollapsibles(подписка, индекс) {
var toggle = подписка.querySelector(«.цена-варианта-покупки»)
подписка.classList.remove(«расширенный»)
var form = подписка.querySelector(«.форма-варианта-покупки»)
var priceInfo = подписка.селектор запросов(«.Информация о цене»)
var PurchaseOption = toggle.parentElement если (переключить && форма && priceInfo) {
toggle.setAttribute(«роль», «кнопка»)
toggle.setAttribute(«tabindex», «0») toggle.addEventListener («щелчок», функция (событие) {
var expand = toggle.getAttribute(«aria-expanded») === «true» || ложный
переключать. setAttribute(«расширенная ария», !расширенная)
form.hidden = расширенный
если (! расширено) {
покупкаOption.classList.add(«расширенный»)
} еще {
покупкаOption.classList.remove(«расширенный»)
}
priceInfo.hidden = расширенный
}, ложный)
}
} функция initKeyControls() {
документ.addEventListener(«keydown», функция (событие) {
if (document.activeElement.classList.contains(«цена-варианта-покупки») && (event.code === «Пробел» || event.code === «Enter»)) {
если (document.activeElement) {
событие.preventDefault()
документ.activeElement.
setAttribute(«расширенная ария», !расширенная)
form.hidden = расширенный
если (! расширено) {
покупкаOption.classList.add(«расширенный»)
} еще {
покупкаOption.classList.remove(«расширенный»)
}
priceInfo.hidden = расширенный
}, ложный)
}
} функция initKeyControls() {
документ.addEventListener(«keydown», функция (событие) {
if (document.activeElement.classList.contains(«цена-варианта-покупки») && (event.code === «Пробел» || event.code === «Enter»)) {
если (document.activeElement) {
событие.preventDefault()
документ.activeElement. click()
}
}
}, ложный)
} функция InitialStateOpen() {
var buyboxWidth = buybox.смещениеШирина
;[].slice.call(buybox.querySelectorAll(«.опция покупки»)).forEach(функция (опция, индекс) {
var toggle = option.querySelector(«.цена-варианта-покупки»)
var form = option.querySelector(«.форма-варианта-покупки»)
var priceInfo = option.querySelector(«.Информация о цене»)
если (buyboxWidth > 480) {
переключить.щелчок()
} еще {
если (индекс === 0) {
переключать.щелчок()
} еще {
toggle.setAttribute («ария-расширенная», «ложь»)
form.
click()
}
}
}, ложный)
} функция InitialStateOpen() {
var buyboxWidth = buybox.смещениеШирина
;[].slice.call(buybox.querySelectorAll(«.опция покупки»)).forEach(функция (опция, индекс) {
var toggle = option.querySelector(«.цена-варианта-покупки»)
var form = option.querySelector(«.форма-варианта-покупки»)
var priceInfo = option.querySelector(«.Информация о цене»)
если (buyboxWidth > 480) {
переключить.щелчок()
} еще {
если (индекс === 0) {
переключать.щелчок()
} еще {
toggle.setAttribute («ария-расширенная», «ложь»)
form. hidden = «скрытый»
priceInfo.hidden = «скрытый»
}
}
})
} начальное состояниеОткрыть() если (window.buyboxInitialized) вернуть
window.buyboxInitialized = истина initKeyControls()
})()
hidden = «скрытый»
priceInfo.hidden = «скрытый»
}
}
})
} начальное состояниеОткрыть() если (window.buyboxInitialized) вернуть
window.buyboxInitialized = истина initKeyControls()
})()АТОМНЫЕ И ФИЗИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ ПЕРИОДА 3 На этой странице описываются и объясняются тенденции изменения атомных и физических свойств элементов 3-го периода от натрия до аргона.Он охватывает энергию ионизации, атомный радиус, электроотрицательность, электропроводность, температуру плавления и температуру кипения. Эти темы рассматриваются в разных местах сайта, и на этой странице все просто собрано вместе со ссылками на исходные страницы, если вам нужна дополнительная информация по конкретным вопросам. Атомные свойства Электронные конструкции В третьем периоде периодической таблицы 3s- и 3p-орбитали заполнены электронами.Напоминаем, что сокращенные версии электронных структур для восьми элементов: .
В каждом случае [Ne] представляет полную электронную структуру атома неона. | |||||||||||||||||||||||||||
Примечание: Если вас не устраивают электронные структуры, обязательно перейдите по этой ссылке, прежде чем двигаться дальше. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу. | |||||||||||||||||||||||||||
Первая энергия ионизации Первая энергия ионизации — это энергия, необходимая для удаления наиболее слабо удерживаемого электрона из одного моля газообразных атомов с образованием 1 моля газообразных ионов, каждый из которых имеет заряд 1+.
Энергия, необходимая для осуществления этого изменения на моль X. Характер первых энергий ионизации за период 3 Обратите внимание, что общая тенденция восходящая, но она прерывается падениями между магнием и алюминием, а также между фосфором и серой. Объяснение шаблона Энергия первой ионизации регулируется:
| |||||||||||||||||||||||||||
Примечание: Если вы не уверены в причинах любого из этих утверждений, вы должны перейти и прочитать страницу об энергиях ионизации, прежде чем двигаться дальше. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||||||||||||||||||||||||
Восходящий тренд В течение всего периода 3 внешние электроны находятся на 3-уровневых орбиталях. Все они находятся на одинаковом расстоянии от ядра и экранируются одними и теми же электронами на первом и втором уровнях. Основное отличие заключается в увеличении количества протонов в ядре при переходе от натрия к аргону. На самом деле увеличение заряда ядра также притягивает внешние электроны ближе к ядру. Это еще больше увеличивает энергию ионизации по мере прохождения периода. Падение по алюминию Можно ожидать, что значение алюминия будет больше, чем значение магния из-за дополнительного протона.Компенсирует это тот факт, что внешний электрон алюминия находится на 3p-орбитали, а не на 3s. 3p-электрон немного дальше от ядра, чем 3s, и частично экранирован 3s-электронами, а также внутренними электронами. Оба эти фактора компенсируют действие лишнего протона. Падение на серу Когда вы переходите от фосфора к сере, что-то дополнительное должно компенсировать эффект дополнительного протона У фосфора и серы экранирование одинаковое (от внутренних электронов и в некоторой степени от 3s-электронов), и электрон удаляется с одинаковой орбитали. Разница в том, что в случае серы удаляемый электрон является одним из пары 3p x 2 . Отталкивание между двумя электронами на одной и той же орбите означает, что электрон легче удалить, чем в противном случае. Атомный радиус Тренд На диаграмме показано, как изменяется атомный радиус по мере прохождения периода 3. Цифры, используемые для построения этой диаграммы, основаны на:
Справедливо сравнивать металлический и ковалентный радиусы, потому что они оба измеряются в тесно связанных условиях. Однако некорректно сравнивать их с радиусом Ван-дер-Ваальса. Общая тенденция к уменьшению размера атомов по всему периоду НЕ нарушается для аргона. | |||||||||||||||||||||||||||
Примечание: Если вы не уверены в способе измерения атомных радиусов, обязательно перейдите по этой ссылке, прежде чем двигаться дальше. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||||||||||||||||||||||||
Объяснение тенденции Металлический или ковалентный радиус будет мерой расстояния от ядра до связывающей пары электронов. Если вы не уверены в этом, вернитесь и перейдите по последней ссылке. От натрия до хлора все связывающие электроны находятся на 3-м уровне, экранируясь электронами на первом и втором уровнях.Увеличение числа протонов в ядре по мере прохождения периода сильнее притягивает к нему связывающие электроны. Величина экранирования постоянна для всех этих элементов. | |||||||||||||||||||||||||||
Примечание: Возможно, вы удивитесь, почему вы не получаете дополнительного экранирования от 3s-электронов в случаях элементов от алюминия до хлора, где в связи участвуют p-электроны. 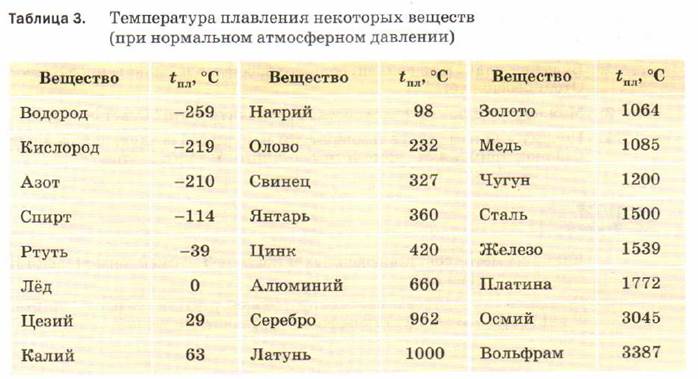 В каждом из этих случаев, прежде чем произойдет связывание, существующие s- и p-орбитали реорганизуются (гибридизуются) в новые орбитали равной энергии.Когда эти атомы связаны, не существует 3s-электронов как таковых. Если вы не знаете о гибридизации, просто проигнорируйте этот комментарий — он вам все равно не понадобится для целей уровня UK A. | |||||||||||||||||||||||||||
Электроотрицательность Электроотрицательность — это мера тенденции атома притягивать связывающую пару электронов. Чаще всего используется шкала Полинга. Фтору (наиболее электроотрицательному элементу) присвоено значение 4.0, а значения варьируются до цезия и франция, которые имеют наименьшую электроотрицательность при 0,7. Тренд Тенденция по периоду 3 выглядит следующим образом: Обратите внимание, что аргон не включен. Электроотрицательность — это склонность атома притягивать 90 557 связывающих 90 558 пар электронов. Объяснение тенденции Тренд объясняется точно так же, как тренд атомных радиусов. По мере прохождения периода связывающие электроны всегда находятся на одном и том же уровне — уровне 3. Они всегда экранируются одними и теми же внутренними электронами. Отличие только в количестве протонов в ядре. По мере перехода от натрия к хлору количество протонов неуклонно увеличивается и, таким образом, сильнее притягивает связывающую пару. | |||||||||||||||||||||||||||
Примечание: Если вы хотите более подробно обсудить электроотрицательность, перейдите по этой ссылке в раздел сайта, посвященный связи. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||||||||||||||||||||||||
Физические свойства В этом разделе рассматриваются электропроводность, температуры плавления и кипения элементов. Конструкции из элементов Структуры элементов меняются по ходу периода.Первые три являются металлическими, кремний — гигантской ковалентной связью, а остальные — простыми молекулами. Три металлические конструкции Натрий, магний и алюминий имеют металлическую структуру. В натрии в металлической связи участвует только один электрон на атом — единственный 3s-электрон. В магнии задействованы оба его внешних электрона, а в алюминии все три. | |||||||||||||||||||||||||||
Примечание. Если вы не уверены в металлическом соединении, перед тем как продолжить, перейдите по этой ссылке.Посмотрите также на дополнительную ссылку на структуры металлов, которые вы найдете внизу этой страницы. Используйте кнопку НАЗАД (или меню GO, или файл HISTORY) в браузере, чтобы вернуться на эту страницу, когда будете готовы. | |||||||||||||||||||||||||||
Другое отличие, о котором вам нужно знать, это то, как атомы упакованы в кристалле металла. Натрий 8-координирован — каждый атом натрия соприкасается только с 8 другими атомами. И магний, и алюминий имеют 12-координацию (хотя и немного по-разному).Это более эффективный способ упаковки атомов, что приводит к меньшему количеству неиспользуемого пространства в металлических структурах и к более прочным связям в металле. | |||||||||||||||||||||||||||
Примечание: Если этот разговор о согласовании для вас ничего не значит, вам нужно заглянуть на страницу о металлоконструкциях, где это объясняется довольно подробно. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||||||||||||||||||||||||
Гигантская ковалентная структура Кремний имеет гигантскую ковалентную структуру, как и алмаз.Крошечная часть структуры выглядит так: Структура скрепляется прочными ковалентными связями во всех трех измерениях. Четыре простые молекулярные структуры Структуры фосфора и серы различаются в зависимости от типа фосфора или серы, о которых вы говорите. Что касается фосфора, я предполагаю обычный белый фосфор. Для серы я предполагаю одну из кристаллических форм — ромбическую или моноклинную серу. Атомы в каждой из этих молекул удерживаются вместе ковалентными связями (кроме, конечно, аргона). В жидком или твердом состоянии молекулы удерживаются близко друг к другу дисперсионными силами Ван-дер-Ваальса. | |||||||||||||||||||||||||||
Примечание: Вы найдете подробное описание дисперсионных сил Ван-дер-Ваальса, если перейдете по этой ссылке Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||||||||||||||||||||||||
Электропроводность
Три металла, конечно же, проводят электричество, потому что делокализованные электроны («море электронов») могут свободно перемещаться в твердом или жидком металле. В случае с кремнием объяснение того, как полупроводники проводят электричество, выходит за рамки курсов химии уровня A. Вы не ожидаете, что структура алмаза будет проводить электричество, но это так! Остальные не проводят электричество, потому что это простые молекулярные вещества. Нет электронов, которые могли бы свободно перемещаться. Точки плавления и кипения На диаграмме показано, как меняются точки плавления и кипения элементов в течение периода.Цифры нанесены в градусах Кельвина, а не в градусах Цельсия, чтобы избежать отрицательных значений. Лучше всего думать об этих изменениях с точки зрения типов структуры, о которых мы говорили далее на странице. Металлоконструкции Температуры плавления и кипения трех металлов повышаются из-за увеличения прочности металлических связей. Количество электронов, которые каждый атом может внести в делокализованное «море электронов», увеличивается.Атомы также становятся меньше и содержат больше протонов по мере перехода от натрия к магнию и алюминию. Притяжение и, следовательно, температуры плавления и кипения увеличиваются, потому что:
| |||||||||||||||||||||||||||
Примечание: Температура кипения является лучшим показателем прочности металлических связей, чем точка плавления.Металлические связи все еще существуют в жидких металлах и не разрушаются полностью до тех пор, пока металл не закипит.  Я не знаю, почему при переходе от магния к алюминию происходит такое незначительное увеличение температуры плавления. Как и следовало ожидать, температура кипения алюминия намного выше, чем у магния. Если вы столкнетесь с объяснением очень небольшого увеличения температуры плавления от магния к алюминию с точки зрения прочности металлической связи, вы должны быть очень осторожны с ним, если оно также не объясняет, почему, несмотря на это, температура кипения алюминия намного выше, чем у магния. | |||||||||||||||||||||||||||
Кремний Кремний имеет высокие температуры плавления и кипения, потому что это гигантская ковалентная структура. Вы должны разорвать прочные ковалентные связи, прежде чем он расплавится или закипит. Поскольку вы говорите о другом типе связи, нецелесообразно пытаться напрямую сравнивать температуры плавления и кипения кремния с алюминием. Четыре молекулярных элемента Фосфор, сера, хлор и аргон являются простыми молекулярными веществами, между молекулами которых существует только ван-дер-ваальсово притяжение. Размеры точек плавления и кипения полностью определяются размерами молекул. Запомните строение молекул: Фосфор Фосфор содержит молекулы P 4 . Чтобы расплавить фосфор, вам не нужно разрывать ковалентные связи — достаточно гораздо более слабых ван-дер-ваальсовых сил между молекулами. Сера Сера состоит из S 8 колец атомов. Молекулы больше, чем молекулы фосфора, поэтому притяжение Ван-дер-Ваальса будет сильнее, что приведет к более высокой температуре плавления и кипения. Хлор Хлор, Cl 2 , представляет собой гораздо меньшую молекулу со сравнительно слабым ван-дер-ваальсовым притяжением, поэтому хлор будет иметь более низкую температуру плавления и кипения, чем сера или фосфор. Аргон Молекулы аргона — это всего лишь отдельные атомы аргона, Ar. | |||||||||||||||||||||||||||
Примечание: На этой странице я описывал один атом аргона как молекулу. Это основано на старом определении слова. В настоящее время IUPAC говорит, что молекула должна иметь более одного атома.Итак, в текущем определении я не должен использовать термин для обозначения аргона. Однако, исключение частиц в аргоне из термина «молекула» только усложняет ход этой страницы — например, это усложняет жизнь, если вы говорите о «молекулярных элементах» и межмолекулярных силах. Нелогично описывать аргон как обладающий межмолекулярными силами, если его основные частицы не являются молекулами. Поэтому я продолжу использовать исходное определение, которое Британская энциклопедия определяет как «наименьшую идентифицируемую единицу, на которую можно разделить чистое вещество и при этом сохранить состав и химические свойства этого вещества». Вам нужно беспокоиться об этом? Почти наверняка нет — мне удалось провести почти 50 лет в образовании по химии, даже не осознавая, что старое определение было изменено, пока кто-то недавно не указал мне на это. | |||||||||||||||||||||||||||
В меню Период 3 . . . В меню неорганической химии.. . В главное меню . . . © Джим Кларк, 2005 г. (последнее изменение: ноябрь 2021 г.) | |||||||||||||||||||||||||||
Исследование композитов Al / легкоплавких металлов / соли для производства водорода — Sheng — 2021 — International Journal of Energy Research
Серия композитов Al-Ga-In-Sn-NaCl была приготовлена механической шаровой мельницей. NaCl способствует дроблению и измельчению частиц в процессе шаровой мельницы, но выделение водорода композитами снижается, когда содержание NaCl превышает 5%. Более высокое отношение композита к воде привело к снижению образования водорода для композита Al-Ga-In-Sn-5% NaCl. Кроме того, по сравнению с чистой водой водородообразование этого композита ниже в растворе NaCl. Эти результаты показывают, что более высокая концентрация ионов в воде не способствует образованию водорода. В процессе гидролиза растворение NaCl в воде увеличивает концентрацию ионов, поэтому избыток NaCl в композите приводит к снижению образования водорода.Кроме того, оптимизация времени измельчения важна для получения водорода. Путем оптимизации времени измельчения до 18 часов выход водорода из композита Al-Ga-In-Sn-5% NaCl достиг 1150 мл g -1 при 25°C. Хотя композиты легко реагируют с влагой воздуха, выход водорода композитов Al-Ga-In-Sn-5% NaCl и Al-Ga-In-Sn-10% NaCl может поддерживать 100% и 94% исходного после пребывание на воздухе в течение 5 и 10 дней.
Более высокое отношение композита к воде привело к снижению образования водорода для композита Al-Ga-In-Sn-5% NaCl. Кроме того, по сравнению с чистой водой водородообразование этого композита ниже в растворе NaCl. Эти результаты показывают, что более высокая концентрация ионов в воде не способствует образованию водорода. В процессе гидролиза растворение NaCl в воде увеличивает концентрацию ионов, поэтому избыток NaCl в композите приводит к снижению образования водорода.Кроме того, оптимизация времени измельчения важна для получения водорода. Путем оптимизации времени измельчения до 18 часов выход водорода из композита Al-Ga-In-Sn-5% NaCl достиг 1150 мл g -1 при 25°C. Хотя композиты легко реагируют с влагой воздуха, выход водорода композитов Al-Ga-In-Sn-5% NaCl и Al-Ga-In-Sn-10% NaCl может поддерживать 100% и 94% исходного после пребывание на воздухе в течение 5 и 10 дней.
Основные моменты
- Серия композитов Al-Ga-In-Sn-NaCl была приготовлена механической шаровой мельницей.

- NaCl способствует дроблению и измельчению частиц в процессе шаровой мельницы, но выделение водорода композитами снижается, когда содержание NaCl превышает 5%.
- Путем оптимизации времени измельчения до 18 часов выход водорода из композита Al-Ga-In-Sn-5% NaCl достиг 1150 мл г -1 при 25°C в чистой воде.
- Выход водорода композитов Al-Ga-In-Sn-5% NaCl и Al-Ga-In-Sn-10% NaCl может поддерживать 100% и 94% исходного после выдержки на воздухе в течение 5 и 10 дней. .
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Температуры плавления MgO под высоким давлением с помощью анализа микротекстуры
Лаброс, С., Хернлунд, Дж. В. и Колтис, Н. Кристаллизующийся плотный магматический океан в основании земной мантии. Природа 450 , 866–869 (2007).
КАС Google Scholar
Ито, Э., Кубо, А., Кацура, Т. и Уолтер, М. Дж. Эксперименты по плавлению мантийных материалов в условиях нижней мантии с последствиями для дифференциации магматического океана. Физ. Планета Земля. Интер. 143–144 , 397–406 (2004).
Google Scholar
Liebske, C. & Frost, D. J. Соотношение фаз плавления в системе MgO-MgSiO3 между 16 и 26 ГПа: значение для плавления в недрах Земли. Планета Земля. науч. лат. 345 , 159–170 (2012).
Google Scholar
Ямадзаки Д.и другие. Генерация давления более 1 Мбар в аппарате с несколькими наковальнями типа Каваи и его применение для сжатия перовскита и стишовита (Mg0,92Fe0,08)SiO3. Физ. Планета Земля. Интер. 228 , 262–267 (2014).
Физ. Планета Земля. Интер. 228 , 262–267 (2014).
КАС Google Scholar
Зерр, А. и Бёлер, Р. Плавление (Mg,Fe)SiO3-перовскита до 625 килобар: указание на высокую температуру плавления в нижней мантии. Наука 262 , 553–555 (1993).
КАС Google Scholar
Зерр, А. и Бёлер, Р. Ограничения температуры плавления нижней мантии из экспериментов высокого давления на MgO и магнезиовюстите. Природа 371 , 506–508 (1994).
КАС Google Scholar
Fiquet, G. et al. Плавка перидотита до 140 гигапаскалей. Наука 329 , 1516–1518 (2010).
КАС Google Scholar
Nomura., et al. Низкая температура на границе ядро-мантия по солидусу пиролита. Наука 343 , 522–525 (2014).
КАС Google Scholar
Татено, С., Хиросе, К. и Охиши, Ю. Эксперименты по плавлению перидотита до самых нижних слоев мантии. Ж. Геофиз. Рез. 119 , 4684–4694 (2014).
КАС Google Scholar
Холланд, К.Г. и Аренс, Т.Дж. Плавление (Mg, Fe)2SiO4 на границе ядра и мантии Земли. Наука 275 , 1623–1625 (1997).
КАС Google Scholar
Акинс, Дж. А., Луо, С., Асимов, П. Д. и Аренс, Т. Дж. Плавление перовскита MgSiO3, вызванное ударом, и последствия для расплавов в самых нижних слоях мантии Земли. Геофиз. Рез. лат. 31 , L14612 (2004).
Google Scholar
McWilliams, R. S. et al. Фазовые превращения и металлизация оксида магния при высоких давлениях и температурах. Наука 338 , 1330–1333 (2012).
КАС Google Scholar
Белоношко А.Б., Дубровинский Л.С. Исследование молекулярной и решеточной динамики системы MgO-SiO2 с использованием переносимого межатомного потенциала. Геохим. Космохим. Acta 60 , 1645–1656 (1996).
КАС Google Scholar
Alfe, D. Кривая плавления MgO на основе моделирования из первых принципов. Физ. Преподобный Летт. 94 , 235701 (2005 г.).
Google Scholar
де Кокер, Н. и Стиксруд, Л. Самосогласованное термодинамическое описание силикатных жидкостей с применением к ударному плавлению периклаза MgO и перовскита MgSiO3. Геофиз. Дж. Междунар. 178 , 162–179 (2009).
КАС Google Scholar
Белоношко А.Б. и др. Плавка MgSiO3 под высоким давлением. Физ. Преподобный Летт. 94 , 195701 (2005 г.).
Физ. Преподобный Летт. 94 , 195701 (2005 г.).
КАС Google Scholar
Стиксруд Л. и Карки Б. Б. Структура и замерзание жидкого MgSiO3 в нижней мантии Земли. Наука 310 , 297–299 (2005).
КАС Google Scholar
де Кокер, Н., Карки, Б. Б. и Стиксруд, Л. Термодинамика жидкой системы MgO-SiO2 в самой нижней мантии Земли из первых принципов. Планета Земля. науч. лат. 361 , 58–63 (2013).
КАС Google Scholar
Отани Э. Законы плавления и уравнения состояния магм при высоком давлении: приложение к геодинамике. Хим. геол. 265 , 279–288 (2009).
КАС Google Scholar
Zhang, L. & Fei, Y. Плавление твердых растворов (Mg,Fe)O при высоком давлении. Геофиз. Рез. лат. 35 , L13302 (2008 г.).
Рез. лат. 35 , L13302 (2008 г.).
Google Scholar
Du, Z. & Lee, K.K.M. Плавление MgO под высоким давлением из твердых растворов (Mg, Fe)O. Геофиз. Рез. лат. 41 , 8061–8066 (2014).
КАС Google Scholar
Ямадзаки Д. и Карато С. Некоторые ограничения физики минералов на реологию и геотермальную структуру нижней мантии Земли. утра. Шахтер. 86 , 385–391 (2001).
КАС Google Scholar
Ямазаки Д., Йошино Т. и Накакуки Т.Взаимосвязь ферропериклаза контролирует морфологию субдуктивных плит в верхней части нижней мантии. Планета Земля. науч. лат. 403 , 352–357 (2014).
КАС Google Scholar
Errandonea, D. et al. Систематика плавления переходных металлов. Физ. B 63 , 132104 (2001).
B 63 , 132104 (2001).
Google Scholar
Эррандонеа, Д., Сомаязулу, М., Хаузерманн, Д. и Мао, Х.К. Плавление тантала при высоком давлении, определенное с помощью рентгеновской дифракции с угловой дисперсией в двусторонней нагреваемой лазером ячейке с алмазными наковальнями. J. Phys. Конденс. Matter 15 , 7635–7649 (2003).
КАС Google Scholar
Kimura, T., Kuwayama, Y. & Yagi, T. Температуры плавления h3O до 72 ГПа, измеренные в ячейке с алмазной наковальней с использованием метода нагрева CO2-лазером. J. Chem. физ. 140 , 074501 (2014).
КАС Google Scholar
Дубровинский Л. С. и Саксена С. К. Термическое расширение периклаза (MgO) и вольфрама (W) до температуры плавления. Физ. хим. Шахтер. 24 , 547–550 (1997).
КАС Google Scholar
Белоношко А. , Дубровинский Л. С. Моделирование индуцированного разрушения и рекристаллизации идеального кристалла MgO при негидростатическом сжатии: приложение к плавлению в ячейке с алмазной наковальней. утра. Шахтер. 82 , 441–451 (1997).
, Дубровинский Л. С. Моделирование индуцированного разрушения и рекристаллизации идеального кристалла MgO при негидростатическом сжатии: приложение к плавлению в ячейке с алмазной наковальней. утра. Шахтер. 82 , 441–451 (1997).
КАС Google Scholar
Kurz, W. & Fisher, D. J. Fundamentals of Solidification Trans Tech Publications (1986).
Simon, F. & Glatzel, G. Bemerkungen zur Schmelzdruckkurve. З. Анорг. Allg. хим. 178 , 309–316 (1929).
КАС Google Scholar
Охтани Э.Распределение температуры плавления и фракционирование в нижней мантии. Физ. Планета Земля. Интер. 33 , 12–25 (1983).
КАС Google Scholar
Speziale, S., Zha, C.S., Duffy, T.S., Hemley, R.J. & Mao, H.K. Квазигидростатическое сжатие оксида магния до 52 ГПа: последствия для уравнения состояния давление-объем-температура. Ж. Геофиз. Рез. 106 , 515–528 (2001).
Ж. Геофиз. Рез. 106 , 515–528 (2001).
КАС Google Scholar
Белер, Р. Эксперименты при высоких давлениях и фазовая диаграмма материалов нижней мантии и ядра. Ред. Геофиз. 38 , 221–245 (2000).
КАС Google Scholar
Фунамори, Н. и Сато, Т. Контраст плотности между силикатными расплавами и кристаллами в глубокой мантии: комплексное представление, основанное на данных статического сжатия. Планета Земля. науч. лат. 295 , 435–440 (2010).
КАС Google Scholar
Видиянторо, С., Горбатов, А., Кеннет, Б. Л. Н. и Фукао, Ю. Улучшение томографии времени распространения поперечной волны с использованием трехмерной трассировки лучей и итеративной инверсии. Геофиз. Дж. Междунар. 141 , 747–758 (2000).
Google Scholar
Фукао Ю.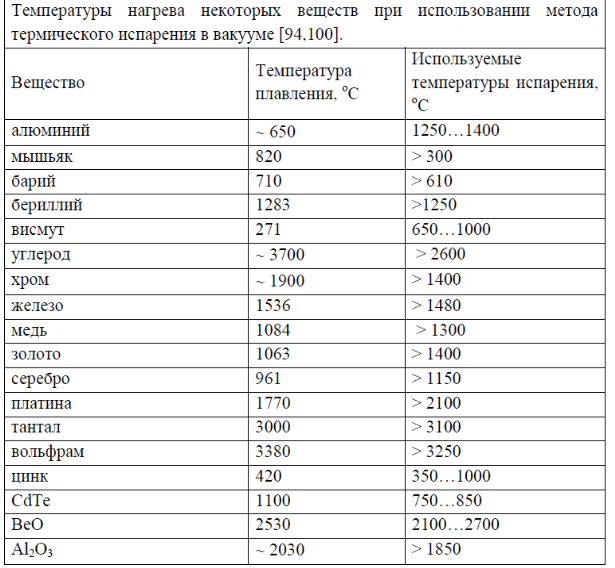 и Обаяши, М. Погруженные плиты, застывшие наверху, проникающие сквозь и застрявшие ниже границы раздела 660 км. Ж. Геофиз. Рез. 118 , 5920–5938 (2013).
и Обаяши, М. Погруженные плиты, застывшие наверху, проникающие сквозь и застрявшие ниже границы раздела 660 км. Ж. Геофиз. Рез. 118 , 5920–5938 (2013).
Google Scholar
Чжан, С. Л., Цай, Л. К., Чен, Дж., Сюй, Дж. А. и Цзин, Ф. К. Плавление Мо в эксперименте с ударной волной. Подбородок. физ. лат. 25 , 2969–2972 (2008).
КАС Google Scholar
Белоношко А.Б. и др. Молибден при высоком давлении и температуре: плавление из другой твердой фазы. Физ. Преподобный Летт. 100 , 135701 (2008 г.).
КАС Google Scholar
Ву, С. Дж., Содерлинд, П., Глосли, Дж. Н. и Клепейс, Дж. Э. Анизотропное пластическое течение, вызванное сдвигом, из объемно-центрированного кубического тантала перед плавлением. Нац. Матер. 8 , 223–228 (2009).
КАС Google Scholar
Акахама Ю.и Кавамура, Х. Рамановская спектроскопия алмазных наковален под высоким давлением до 250 ГПа: метод определения давления в диапазоне давлений в несколько мегабар. J. Appl. физ. 96 , 3748 (2004).
КАС Google Scholar
Мао, Х.К., Белл, П.М., Шейнер, Дж.В. и Стейнберг, Д.Дж. Измерения удельного объема Cu, Mo, Pd и Ag и калибровка рубинового R 1 флуоресцентный манометр от 0.06 до 1 мбар. J. Appl. физ. 49 , 3276 (1978).
КАС Google Scholar
Grüneisen, E. Состояние твердого тела Natl. Администрация космического пространства по воздухоплаванию. (1959).
Martinez, I. et al. Эксперименты по ударному восстановлению доломита и термодинамические расчеты ударной декарбонизации.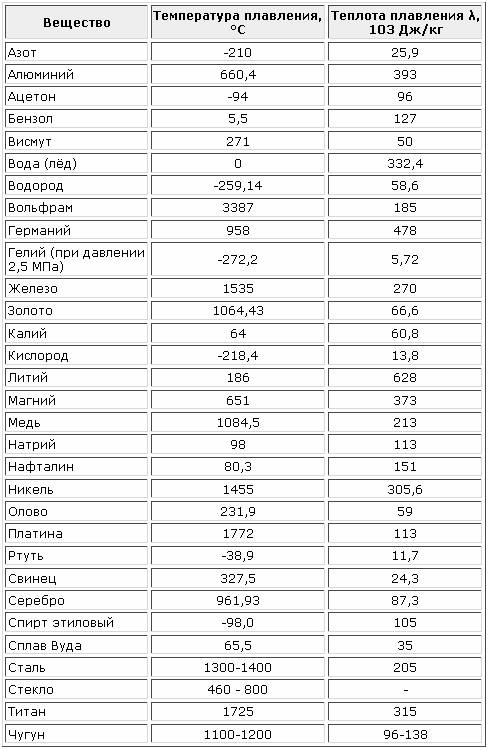


 1).
1).




 Это вызывает большее притяжение между ядром и электронами и, таким образом, увеличивает энергию ионизации.
Это вызывает большее притяжение между ядром и электронами и, таким образом, увеличивает энергию ионизации.
 Вы не сравниваете подобное с подобным. Единственная безопасная вещь, которую можно сделать, это игнорировать аргон в последующем обсуждении.
Вы не сравниваете подобное с подобным. Единственная безопасная вещь, которую можно сделать, это игнорировать аргон в последующем обсуждении. Поскольку аргон не образует ковалентных связей, вы, очевидно, не можете приписать ему электроотрицательность.
Поскольку аргон не образует ковалентных связей, вы, очевидно, не можете приписать ему электроотрицательность. Чтобы понять их, вы должны сначала понять структуру каждого из элементов.
Чтобы понять их, вы должны сначала понять структуру каждого из элементов.

 Проводимость увеличивается по мере перехода от натрия к магнию и алюминию.
Проводимость увеличивается по мере перехода от натрия к магнию и алюминию.
 Их температуры плавления или кипения будут ниже, чем у первых четырех членов периода, имеющих гигантские структуры.
Их температуры плавления или кипения будут ниже, чем у первых четырех членов периода, имеющих гигантские структуры. Возможности ван-дер-ваальсова притяжения между ними очень ограничены, поэтому температуры плавления и кипения аргона снова ниже.
Возможности ван-дер-ваальсова притяжения между ними очень ограничены, поэтому температуры плавления и кипения аргона снова ниже. »
»