Алюминий » Все о металлургии
24.04.2015
Алюминий — важнейший легкий металл, входит в третью группу периодической системы Д.И. Менделеева, атомный номер 13, радиус атома 1,43 А, радиус иона 0,86 А°, атомный вес 26,97.
Электронное строение нейтрального атома алюминия характеризуется заполненным внутренним К-слоем с двумя электронами на 1s-орбите (1s2) и заполненным L-слоем с двумя электронами на 2s-opбитe и шестью электронами на 2р орбите (2s22p6) Во внешнем (валентном) M слое атома алюминия находятся три электрона два на Зх-орбите и один на Зр-орбите (3s23p).
В химических соединениях алюминий обычно трехвалентен (Al3+). Однако в определенных условиях существуют соединения одновалентного (Al+) алюминия (субсоединения), например Al2S, Al2O, AlF, AlCl и др. Энергия ионизации первого Зр-электрона атома алюминия составляет 137,3, а второго и третьего 3s электронов соответственно 430,6 и 652,1 ккал*г-атом. Таким образом, в атоме алюминия Зр-электрон удерживается значительно слабее, чем каждый из парных 35-электронов, и может быть потерян ранее других электронов.

Для алюминия установлено существование трех искусственных радиоактивных изотопов с массовыми числами 26, 28 и 29 и периодами полураспада, соответственно равными 7 сек, 2,3 мин. и 6,7 мин Устойчивых изотопов у алюминия нет.
Элементарная кристаллическая решетка алюминия — куб с центрированными гранями. Размер ребра элементарного куба 4,04 А°.
Плотность алюминия как твердого, так и расплавленного снижается по мере увеличения степени его чистоты Для твердого металла чистотой 99,75% Al плотность составляет 2,703, а для металла чистотой 99,996% Al 2,6989; плотность расплавленного алюминия чистотой 99,75% Al при 1000° равна 2,289.
Температура плавления алюминия возрастает по мере повышения степени его чистоты. Металл чистотой 99,6%) Al плавится при 658,7°, а температура плавления алюминия чистотой 99,996% Al 660,24°.
Увеличение объема алюминия при его плавлении составляет 6,6%.
Температура кипения алюминия при атмосферном давлении близка к 2500° Теплота плавления алюминия: удельная 93 ккал/г и атомная 2520 ккал/г-атом. Атомная теплота испарения алюминия находится в пределах 56 800—62 140 ккал/г-атом Истинная теплоемкость Жидкого алюминия в интервале 982—1273° К может быть принята постоянной и равной 7 кал/г-атом.
Электропроводность алюминия возрастает по мере повышения степени его чистоты. Для твердого металла чистотой 99,5% Al электропроводность составляет 62,5% по отношению к электропроводности ме ди, а для металла чистотой 99,996% Al 64,94%. Наиболее сильное влияние на снижение электропроводности оказывают примеси титана, ванадия, хрома и марганца. Удельное электрическое» сопротивление жидкого алюминия при 950° равно 30*10в-5 ом*см.
Механические свойства алюминия также в сильной степени зависят от его чистоты. Алюминий высокой чистоты значительно мягче, пластичнее технического металла, но обладает пониженной механической прочностью Алюминий чистотой 99,996% Al характеризуется, например, следующими механическими свойствами: сопротивление на разрыв 11,41 кг/мм2 для холоднокатаного металла и 4,81 кг/мм2 для отожженного; сопротивление сжатию соответственно 10,8 и 1,26 кг/мм2 и удлинение 5,5 и 48,8%.
Алюминий обладает большой химической активностью- энергия образования его соединений с кислородом, галоидами, серой и углеродом весьма велика, в ряду напряжений он занимает место среди наиболее электроотрицательных элементов (нормальный электродный потенциал его — 1,36 в).
Отличительной особенностью алюминия является его склонность энергично реагировать с кислородом, в частности с кислородом воздуха. Поэтому на воздухе алюминий покрывается тонкой, но очень проч ной пленкой окиси алюминия. Электронномикроскопические исследования показывают, что эта пленка окиси алюминия сплошная и беспористая.
 Она защищает алюминий от дальнейшего окисления и обусловливает большую коррозионную стойкость металла.
Она защищает алюминий от дальнейшего окисления и обусловливает большую коррозионную стойкость металла.Пленка окиси алюминия на поверхности твердого металла имеет толщину примерно 2*10в-5 см. Интенсивность окисления алюминия возрастает с повышением температуры, в особенности выше точки его плавления, причем зависит от примесей металлов, присутствующих в алюминии Наличие в алюминии примесей магния, кальция, натрия, кремния и меди усиливает его окисление. Сцепление окисной пленки с алюминием в местах нахождения примесей сильно понижается, и эти места уязвимы для коррозии. Напротив, окисная пленка имеет исключительно большое сцепление с поверхностью алюминия высокой степени чистоты, обладающего ничтожным содержанием примесей. Такой металл поэтому оказывается чрезвычайно стойким в отношении химических реагентов (например, неорганических кислот), загрязненной атмосферы, морской воды.
2Аl + 1,5О2 = Al2O8,
экзотермична и идет со значительно большим выделением тепла, чем для многих других металлов.

Теплота окисления алюминия при 22° и постоянном давлении, определенная сжиганием чистейшего электролитического рафинированного алюминия в кислороде, равна 402900±300 кал/г-моль. С помощью весьма точных калориметрических измерений теплота образования All2O3 (корунда) также получена весьма близкой к этой величине: 399 040 кал/г-моль при 25°.
Безводная окись алюминия (глинозем) существует в форме двух модификаций, с которыми приходится иметь дело при производстве глинозема и электролитическом получении алюминия.
Первая из них α-Al2O3, или корунд, встречается в естественных горных породах. Все виды гидратов окиси алюминия (гидроаргиллит, бемит, диаспор) при нагревании до 1200° превращаются в α-Al2O3. Кристаллизуется корунд в гексагональной системе. Корунд отличается высокой твердостью, занимая в минералогической шкале предпоследнее перед алмазом место — девятое. Он практически не гигроскопичен и имеет из всех модификации глинозема наибольший удельный вес (3,9—4,0 г/см3).
Вторая модификация безводного глинозема γ-Al2O3 кристаллизуется в кубической системе.
Технический глинозем, получаемый щелочными способами для электролитического производства алюминия, представляет собой смесь α-Al2O3 и γ-Al2O3, причем содержание корунда составляет 30—45%.
Безводный глинозем является термически стойким окислом с высокой температурой плавления (2050°) и кипения (2980°). Молярная теплота плавления Al2O3 равна 6000 кал/г-моль, а удельная 58,8 кал/г; теплота испарения Al2O3 составляет 11790 кал/г-моль.
В химическом отношении глинозем—типичное амфотерное соединение, основные и кислотные свойства которого выражены примерно в равной степени Поэтому он с одинаковой легкостью растворяется и в кислотах, и в щелочах.
 Наименьшей скоростью растворения обладает при этом α-Al2O3, большей — γ-Al2O3. Особенно же быстро растворяются гидроокиси алюминия, которые в растворах кислот ведут себя как Основания, образуя алюминиевые соли соответствующих кислот, а в растворах оснований проявляют себя как кислоты, давая соли этих оснований — алюминаты.
Наименьшей скоростью растворения обладает при этом α-Al2O3, большей — γ-Al2O3. Особенно же быстро растворяются гидроокиси алюминия, которые в растворах кислот ведут себя как Основания, образуя алюминиевые соли соответствующих кислот, а в растворах оснований проявляют себя как кислоты, давая соли этих оснований — алюминаты.Последние образуются также при непосредственном взаимодействии глинозема с окислами щелочных и щелочноземельных металлов при высоких температурах.
При нагревании Al2O3 в смеси с металлическим алюминием при температуре выше 1200° в вакууме (остаточное давление 10в-3 мм рт. ст.) образуется летучая субокись алюминия Al2O:
Al2O3 (тв) + 4Аl(ж) ⇔ 3Аl2O3 (г),
Интенсивное взаимодействие алюминия с хлором практически происходит выше 100° с образованием хлорида алюминия и выделением 161,4 ккал/г-моль AlCl3. Ниже 440° молекула хлорида алюминия отвечает формуле Al2Cl6; в интервале 440—600° наблюдается частичная диссоциация: Al2Cl6⇔2АlСl3, выше 600° состав хлорида алюминия выражается формулой А1С1з.

При нагревании в инертной атмосфере или в вакууме с металлическим алюминием хлорид алюминия образует субхлорид AlCl. Последний существует только в газовой фазе или в расплавленной среде при высокой температуре, а при охлаждении примерно до 800° вновь распадается на нормальный хлорид алюминия и металлический алюминий:
2Аl(ж) + AlCl3 (г) ⇔ 3АlCl(г).
С фтором алюминий образует фторид алюминия AlF3, который в большой степени отличается от хлорида алюминия по своим свойствам. Если хлорид алюминия является химическим соединением с ковалент ной связью и молекулярной кристаллической решеткой, обладает низкой температурой плавления и кипения (соответственно 190 и 183°), то во фториде алюминия химическая связь в основном ионная, что выра жается его высокой температурой плавления и кипения.
 Так, AlF3 при атмосферном давлении возгоняется, не плавясь, будучи нагрет примерно до 1000—1100°, причем упругость паров AlF3 достигает одной атмосферы при 1260°. В вакууме (остаточное давление 10в-2 мм рт. ст.) AlF3 начинает сублимировать при температуре около 700°. Попытки расплавить AlF3 в бомбе под давлением при температуре около 1500° не дали положительных результатов.
Так, AlF3 при атмосферном давлении возгоняется, не плавясь, будучи нагрет примерно до 1000—1100°, причем упругость паров AlF3 достигает одной атмосферы при 1260°. В вакууме (остаточное давление 10в-2 мм рт. ст.) AlF3 начинает сублимировать при температуре около 700°. Попытки расплавить AlF3 в бомбе под давлением при температуре около 1500° не дали положительных результатов.При нагревании в вакууме или в инертной среде с металлическим алюминием фторид алюминия (так же как и хлорид) образует соединение низшей валентности — субфторид:
С серой алюминий взаимодействует непосредственно при высокой температуре (выше 1000°) с образованием сульфида алюминия Al2S3. Реакция сопровождается выделением большого количества тепла (141 ккал/г-моль Al2S3) При восстановительной плавке сульфида железа с глиноземом также образуется сульфид алюминия. Температура плавления сульфида алюминия 1100°. Он полностью разлагается водой с образованием Al(OH)3 и h3S При нагревании в вакууме смеси Al2S3 и Al до 1300° образуется субсульфид алюминия Al2S, который при охлаждении разлагается на металл и нормальный сульфид
С азотом алюминий непосредственно соединяется при 800° с образованием нитрида AlN.
 Реакция эта сопровождается довольно значительным выделением тепла (74 ккал/г-моль AlN). Чистый нитрид алюминия представляет собой белый порошок, не изменяющийся при нагревании до 2000°. Выше этой температуры он начинает распадаться на элементы, под давлением 4 ат AlN плавится при 2200°. Водой он медленно разлагается на Al(OH)3 и Nh4. Нитрид алюминия кристаллизуется в гексагональной системе. Всегда в тех или иных количествах в алюминиевой ванне образуется карбонитрид алюминия Al5C3N.
Реакция эта сопровождается довольно значительным выделением тепла (74 ккал/г-моль AlN). Чистый нитрид алюминия представляет собой белый порошок, не изменяющийся при нагревании до 2000°. Выше этой температуры он начинает распадаться на элементы, под давлением 4 ат AlN плавится при 2200°. Водой он медленно разлагается на Al(OH)3 и Nh4. Нитрид алюминия кристаллизуется в гексагональной системе. Всегда в тех или иных количествах в алюминиевой ванне образуется карбонитрид алюминия Al5C3N.С углеродом алюминий образует карбид алюминия Al4C3, причем для этого на воздухе смесь угля и алюминия должна быть нагрета примерно до 2000°. В атмосфере водорода или в вакууме порошкообразный алюминий и углеродистый материал реагируют при 1000—1200°. Присутствие криолита облегчает образование карбида алюминия, что, в частности, может быть обусловлено растворением изолирующей пленки Al2O3 с поверхности алюминия в расплавленном криолите, а также и другими причинами.
Реакция образования карбида алюминия из элементов протекает с выделением тепла (63,2 ккал/г-моль Al2O3).
 Чистый карбид алюминия окрашен в ярко-желтый цвет и имеет удельный вес 2,36 г/см3. При нагревании выше 2000° Al4C3 распадается с выделением графита. Вода разлагает карбид алюминия с образованием гидрата окиси алюминия и метана. На воздухе карбид алюминия окисляется, давая глинозем и свободный углерод.
Чистый карбид алюминия окрашен в ярко-желтый цвет и имеет удельный вес 2,36 г/см3. При нагревании выше 2000° Al4C3 распадается с выделением графита. Вода разлагает карбид алюминия с образованием гидрата окиси алюминия и метана. На воздухе карбид алюминия окисляется, давая глинозем и свободный углерод.Пространственная кристаллическая решетка карбида алюминия имеет резко выраженный слоистый характер.
Образование карбида алюминия протекает очень энергично в условиях высоких температур (выше 1000°) при взаимодействии углеродистых материалов с субхлоридом и субфторидом алюминия.
Необходимо также отметить, что при образовании молекулы карбида алюминия из трех атомов углерода и четырех атомов алюминия объем вещества увеличивается на 20%.
В тех или иных количествах Al4C3 всегда образуется в алюминиевой ванне.
С водородом алюминий, по видимому, химически не взаимодействует, однако весьма энергично растворяет его. Растворимость водорода в расплавленном алюминии при 1000° составляет 0,2 см3 в 1 см3 Al В алюминиевой ванне источником водорода является влага, подвергающаяся электролизу с выделением h3 на катоде.

Алюминий впервые в 1825 г. был выделен в свободном виде датским физиком Эрстедом действием амальгамы калия на хлористый алюминий. Позднее, в 1827 г., немецкий химик Велер улучшил способ Эрстеда, заменив амальгаму калия металлическим калием. В 1854 г. Сен Клер-Девилль во Франции применил способ Велера для первого промышленного производства алюминия, внеся в него дальнейшие улучшения: вместо калия им был использован более дешевый натрий, а вместо гигроскопичного хлорида алюминия более стойкий двойной хлорид алюминия и натрия. В 1865 г русским физико-химиком Н. Н. Бекетовым была установлена возможность вытеснения алюминия магнием из криолита. Эта реакция в 1888 г. была применена затем для производства алюминия на первом немецком заводе в Гмеленгене.
Производство алюминия этими так называемыми химическими способами существовало с 1854 по 1890 гг. Однако в течение 35 лет с их помощью было получено в общей сложности всего около 200 т алюминия
В конце 80-х годов прошлого столетия химические способы были вытеснены электролитическим способом, который, обеспечивая значительное технологическое преимущество металлургического процесса, позволил резко снизить стоимость алюминия и создал возможность быстрого развития алюминиевой промышленности.
 Основоположниками современного электролитического способа производства алюминия являются Эру во Франции и Холл в США, которые в 1886 г. независимо друг от друга заявили почти аналогичные патенты на способ получения алюминия электролизом глинозема, растворенного в расплавленном криолите.
Основоположниками современного электролитического способа производства алюминия являются Эру во Франции и Холл в США, которые в 1886 г. независимо друг от друга заявили почти аналогичные патенты на способ получения алюминия электролизом глинозема, растворенного в расплавленном криолите.С момента появления патентов Эру и Холла собственно и начинается современная алюминиевая промышленность, которая за 75 лет своего существования выросла в одну из крупнейших отраслей мирового хозяйства. Особенно сильное развитие алюминиевая промышленность получила в последние 15 лет, что связано как со стратегическим значением алюминия, так и со все расширяющимися областями его технического применения Если в 1946 г мировая выплавка алюминия составила 774 тыс. т, то к 1960 г. она возросла почти в пять раз, достигнув примерно 3,5 млн. г. По общему объему его производства алюминий занимает в настоящее время следующее после железа место, опередив в этом отношении медь Первое место по выплавке алюминия принадлежит США.

Из других капиталистических стран крупную алюминиевую промышленность имеют Канада, Франция, Англия, Италия, ФРГ, Норвегия, Швеция, Япония.
Среди стран народной демократии наиболее развитой алюминиевой промышленностью располагает Венгрия. В начале пятидесятых годов были пущены первые алюминиевые заводы в Польше и Чехословакии Большие перспективы для развития алюминиевой промышленности имеются в Китайской Народной Республике.
Первые попытки организации производства алюминия в нашей стране относятся к 90-м годам прошлого столетия, когда под Москвой для получения алюминия химическим способом был построен небольшой завод, просуществовавший, однако, очень короткое время (с 1885 по 1889 гг.).
В 90-х годах прошлого столетия австрийским химиком Байером в России был разработан щелочной гидрохимический способ производства глинозема из бокситов, играющий основную роль в современной металлургии алюминия.
В начале этого столетия П.П. Федотьевым и другими русскими учеными был выполнен в области изучения современного способа производства алюминия ряд теоретических исследований, получивших мировую известность.
 Однако лишь после Великой Октябрьской социалистической революции были созданы условия для организации и развития алюминиевой промышленности в нашей стране.
Однако лишь после Великой Октябрьской социалистической революции были созданы условия для организации и развития алюминиевой промышленности в нашей стране.Первые опыты электролитического получения алюминия в значительном масштабе были осуществлены в 1929 г. на заводе «Красный Выборжец» в Ленинграде под руководством П.П. Федотьева. В 1930 г. в Ленинграде же был пущен опытный алюминиевый завод, который сыграл большую роль в развитии советской алюминиевой промышленности. На этом заводе в течение четырех лет испытываюсь различное оборудование, обучались кадры рабочих и инженерно-технического персонала для первых алюминиевых предприятий.
В 1932 г. состоялся пуск Волховского алюминиевого завода, со оружейного на рудной базе тихвинских бокситов и электроэнергии Волховской гидроэлектростанции, а в 1933 г. — Днепровского алюминиевого завода на электроэнергии Днепровской гидроэлектростанции К этому же времени были сооружены и пущены Полевской криолитный завод, а также Московский и Днепровский электродные заводы для снабжения алюминиевых заводов фтористыми солями и углеродистыми изделиями
В 1938 г вступил в эксплуатацию Тихвинский глиноземный завод, расположенный в непосредственной близости к месторождению тихвинских бокситов.
 Далее, в 1939 г., был пущен Уральский алюминиевый завод на рудной базе высококачественных североуральских бокситов, а во время Великой Отечественной войны и в последующие годы — еще ряд алюминиевых заводов, расположенных в различных районах страны
Далее, в 1939 г., был пущен Уральский алюминиевый завод на рудной базе высококачественных североуральских бокситов, а во время Великой Отечественной войны и в последующие годы — еще ряд алюминиевых заводов, расположенных в различных районах страныДальнейшее развитие алюминиевой промышленности в нашей стране будет происходить на базе последовательной ее электрификации и, в частности, сооружения мощных гидроэлектростанций. Характерной чертой при этом является продвижение алюминиевой промышленности России в восточные районы в Сибирь, где сооружаются Иркутский и Красноярский алюминиевые заводы (последний на рудной базе местных нефелиновых пород), и в Казахстан, где будет построен Павлодарский алюминиевый завод, рудной базой для которого будут служить тургайские бокситы
Алюминиевая промышленность, созданная в нашей стране за годы советской власти, уже сейчас занимает одно из первых мест в мире, имея все возможности для своего дальнейшего еще более интенсивного развития.
Какая температура плавления алюминия по цельсию
Температура плавления алюминия
Плавление алюминия, как и других веществ, происходит при подводе к нему тепловой энергии, снаружи или непосредственно в его объём, как это происходит, например, при индукционном нагреве.
Температура плавления алюминия зависит от его чистоты:
- Температура плавления сверхчистого алюминия 99,996 %: 660,37 °С.
- При содержании алюминия 99,5 % плавление начинается при 657 °С.
- При содержании алюминия 99,0 % плавление начинается при 643 °С.
Температура плавления алюминия повышается с увеличением давления. Зависимость температуры плавления алюминия от давления представлена на графике ниже.
Температура плавления алюминиевых сплавов
Добавление в алюминий других элементов, в том числе легирующих, снижает температуру его плавления. Так, у некоторых литейных алюминиевых сплавов с большим содержанием кремния и магния температура начала плавления снижается почти до 500 °С.
Вообще, понятие «температура плавления» распространяется только на чистые металлы и другие кристаллические вещества.
У сплавов же нет определённой температуры плавления: процесс их плавления (и затвердевания) происходит в некотором интервале температур.
Температуры солидус и ликвидус алюминиевых сплавов
При плавлении сплава температура начала плавления называется температурой солидус (или точкой слоидус), а температура окончания плавления – температурой ликвидус (или точкой ликвидус).
«Солидус» означает, понятно, твердый, а «ликвидус» — жидкий: при температуре солидуса весь сплав еще твердый, а при температуре ликвидуса – весь уже жидкий.
При затвердевании этого сплава из жидкого состояния температура начала кристаллизации (затвердевания) будет та температурой ликвидус, а конца кристаллизации – та же температура солидус. При температуре сплава между его температурами солидуса и ликвидуса он находится в полужидком-полутвердом, кашеобразном состоянии.
Эвтектическая температура алюминиевых сплавов
Не все сплавы имеют интервал между температурами солидус и ликвидус. Такие сплавы называют эвтектическим.
Например, у алюминиевого сплава с содержанием 12,5 % кремния точки ликвидуса и солидуса сводятся в точку: этот сплав как и чистые металлы имеет не интервал, а точку плавления. Эта точка и температура называются эвтектическими.
Эта точка и температура называются эвтектическими.
Этот сплав относится к знаменитым литейным алюминиево-кремниевым сплавам – силуминам с узким интервалом солидус-ликвидус, что и дает их лучшие литейные свойства.
В двойном сплаве Al-Si температура солидус постоянна и составляет 577 °С. При увеличении содержания кремния температура ликвидус снижается от максимального значения для чистого алюминия 660 °С и до совпадения с температурой солидуса 577 °С при содержании кремния 12,6 %.
Среди других легирующих элементов алюминия сильнее всего понижает температуру плавления магний: эвтектическая температура 450 °С достигается при содержании магния 18,9 %.
Медь дает эвтектическую температуру 548 °С, а марганец – всего лишь 658 °С! Большинство сплавов являются не двойными, а тройными и даже четверными.
Поэтому при совместном влиянии нескольких легирующих элементов температура солидуса – начала плавления или конца затвердевания может быть еще ниже.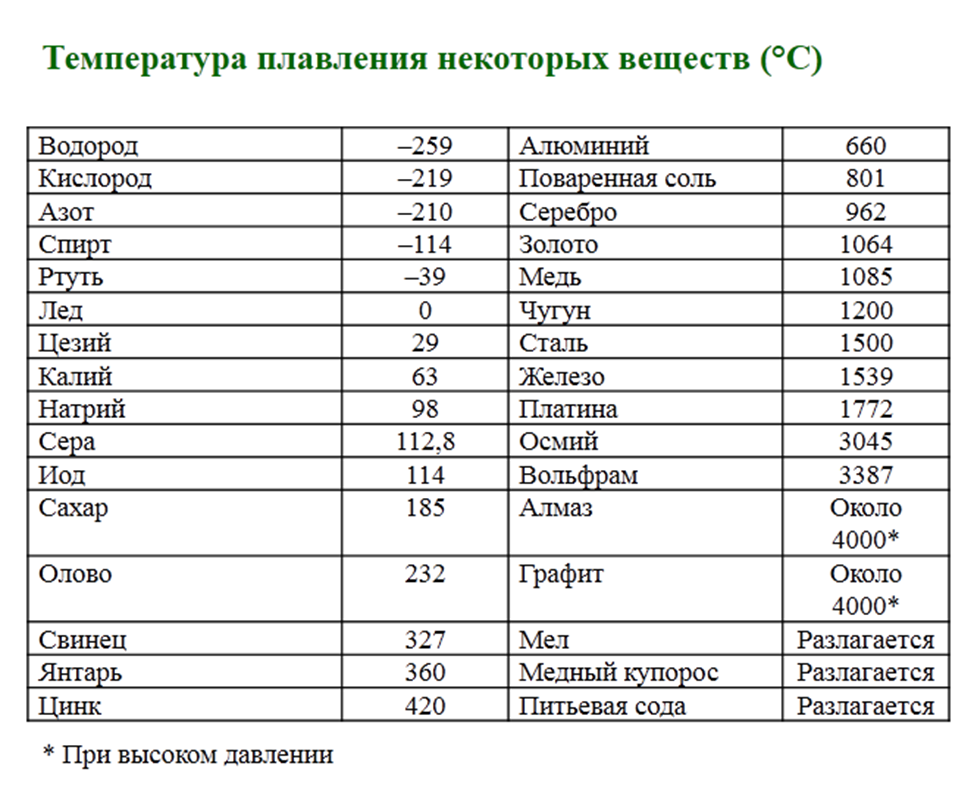
Интервал температуры плавления алюминиевых сплавов
В таблице ниже представлены температуры ликвидуса и солидуса некоторых промышленных деформируемых сплавов. Необходимо иметь в виду, что понятия температур солидус и ликвидус определены для равновесных превращений жидкой фазы в твердую и обратно, то есть при бесконечной длительности процессов. На практике надо делать поправки с учетом скорости нагрева или охлаждения.
Источники: Aluminum and Aluminum Alloys, AMS International, 1993.
Handbook of Aluminum: Vol. 1, ed. G. E. Totten, D. S. MacKenzie
Источник: http://aluminium-guide.ru/temperatura-plavleniya-alyuminiya-i-alyuminievyx-splavov/
Таблица температур плавления различных металлов, и при скольки градусах они плавятся
Каждый металл и сплав имеет собственный уникальный набор физических и химических свойств, среди которых не последнее место занимает температура плавления. Сам процесс означает переход тела из одного агрегатного состояния в другое, в данном случае, из твердого кристаллического состояния в жидкое.
Чтобы расплавить металл, необходимо подводить к нему тепло до достижения температуры плавления. При ней он все еще может оставаться в твердом состоянии, но при дальнейшем воздействии и повышении тепла металл начинает плавиться. Если температуру понизить, то есть отвести часть тепла, элемент затвердеет.
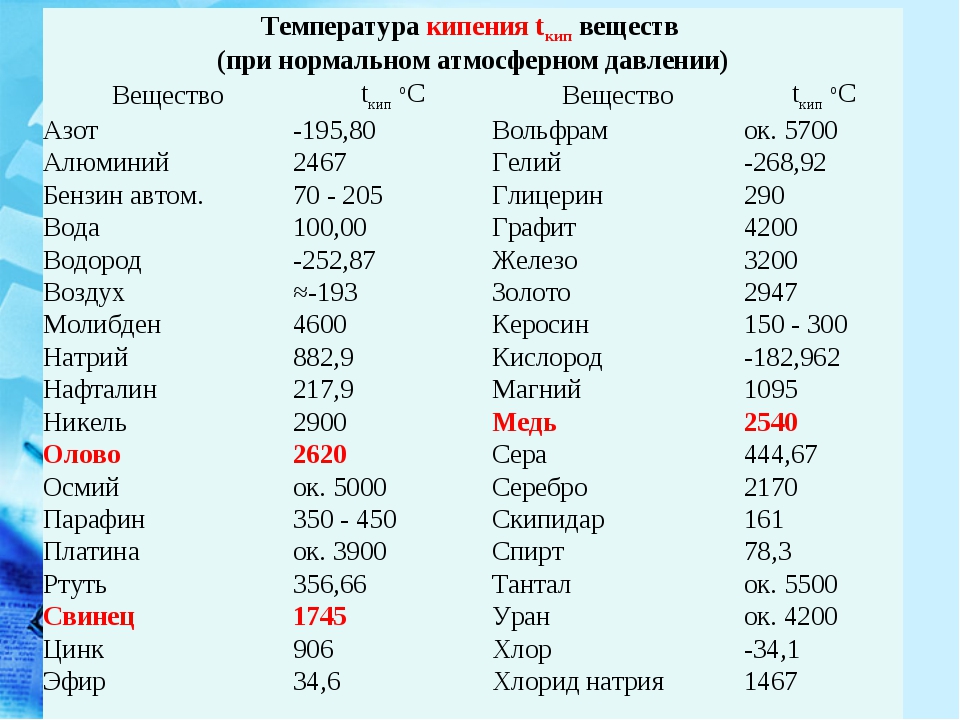
Самая высокая температура плавления среди металлов принадлежит вольфраму: она составляет 3422Со, самая низкая — у ртути: элемент плавится уже при — 39Со. Определить точное значение для сплавов, как правило, не представляет возможности: оно может значительно колебаться в зависимости от процентного соотношения компонентов. Их обычно записывают в виде числового промежутка.
Как происходит
Плавление всех металлов происходит примерно одинаково — при помощи внешнего или внутреннего нагревания. Первый осуществляется в термической печи, для второго используют резистивный нагрев при пропускании электрического тока или индукционный нагрев в высокочастотном электромагнитном поле. Оба варианта воздействуют на металл примерно одинаково.
Оба варианта воздействуют на металл примерно одинаково.
При увеличении температуры увеличивается и амплитуда тепловых колебаний молекул, возникают структурные дефекты решетки, выражающиеся в росте дислокаций, перескоке атомов и других нарушениях.
Это сопровождается разрывом межатомных связей и требует определенного количества энергии. В это же время происходит образование квази-жидкого слоя на поверхности тела.
Период разрушения решетки и накопления дефектов называется плавлением.
Разделение металлов
В зависимости от температуры плавления металлы делятся на:
- Легкоплавкие: им необходимо не более 600Со. Это цинк, свинец, виснут, олово.
- Среднеплавкие: температура плавления колеблется от 600Со до 1600Со. Это золото, медь, алюминий, магний, железо, никель и большая половина всех элементов.

- Тугоплавкие: требуется температура свыше 1600Со, чтобы сделать металл жидким. Сюда относятся хром, вольфрам, молибден, титан.
В зависимости от температуры плавления выбирают и плавильный аппарат. Чем выше показатель, тем прочнее он должен быть. Узнать температуру нужного вам элемента можно из таблицы.
Еще одной немаловажной величиной является температура кипения. Это величина, при которой начинается процесс кипения жидкостей, она соответствует температуре насыщенного пара, который образуется над плоской поверхностью кипящей жидкости. Обычно она почти в два раза больше, чем температура плавления.
Обе величины принято приводить при нормальном давлении. Между собой они прямопропорциональны.
- Увеличивается давление — увеличится величина плавления.
- Уменьшается давление — уменьшается величина плавления.
Таблица легкоплавких металлов и сплавов (до 600С о )
Таблица среднеплавких металлов и сплавов (от 600С о до 1600С о )
Таблица тугоплавких металлов и сплавов (свыше 1600С о )
Источник: https://stanok. guru/stanki/metallorezhuschiy-stanok/temperatura-plavleniya-raznyh-metallov-v-tablice.html
guru/stanki/metallorezhuschiy-stanok/temperatura-plavleniya-raznyh-metallov-v-tablice.html
Плавка алюминия в домашних условиях: пошаговая инструкция. Технология плавки алюминия в домашних условиях :
Алюминий – один из самых распространенных металлов на земле. Он присутствует даже в человеческом организме, так что уж говорить об окружающей действительности.
В каждом доме или личном автомобиле есть алюминиевые функциональные элементы, детали или узлы, которые, увы, достаточно часто ломаются.
Это мебельная и оконная фурнитура, направляющие для дверей и ставен, защелки замков и другие нужные мелочи.
Их можно заменить покупными новыми изделиями, отремонтировать или изготовить самостоятельно. В последних двух случаях и может понадобиться плавка алюминия в домашних условиях.
Характеристики алюминия
Все характеристики металла для домашних самоделок знать необязательно. Но есть несколько моментов, которые могут стать значительными или даже опасными в работе.
Алюминий хорошо поддается литью, плавится при относительно невысокой температуре в 660 °С. Для справки: чугун начинает плавиться при температуре 1100°С, а сталь – 1300 °С.
Поэтому плавка алюминия в домашних условиях на газовой плите трудно осуществима, так как домашние газовые приборы такую температуру обеспечить не могут. Правда, отечественные “кулибины” могут все, но об этом позже.
Снизить температуру плавления алюминия можно, растерев его в порошок или используя в качестве сырья готовый порошковый продукт. Но здесь важным становится еще одно свойство алюминия.
Он достаточно активный металл, который при соединении с кислородом воздуха может воспламениться или просто окислиться. А температура плавления оксида алюминия – больше 2000 °С.
При плавлении оксид все равно образуется, но в небольших количествах, именно он формирует окалину.
Та же активность может сыграть плохую шутку, если в расплавленный металл попадет вода.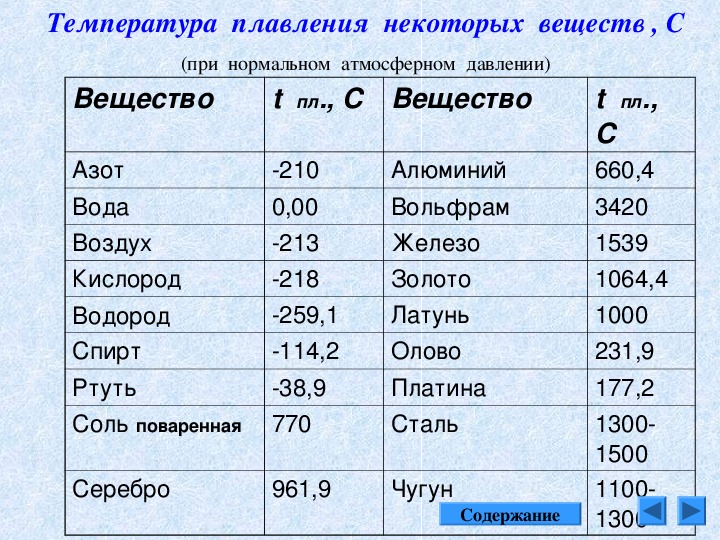 При этом происходит взрыв. Поэтому если в процессе плавки нужно сырье добавлять, то нужно следить, чтобы оно было сухим.
При этом происходит взрыв. Поэтому если в процессе плавки нужно сырье добавлять, то нужно следить, чтобы оно было сухим.
Сырье для плавки
Если предстоит плавка алюминия в домашних условиях, из-за сложности работы с порошковым металлом его в качестве сырья не используют.
Можно приобрести алюминиевую чушку или использовать обычную алюминиевую же проволоку, которую нарезать ножницами на небольшие кусочки и для уменьшения площади контакта с воздухом плотно спрессовать пассатижами.
Если не предполагается особо высокое качество изделия, то можно в качестве сырья использовать любые бытовые предметы, консервные банки без нижнего шва или обрезки профиля.
Вторичное сырье может быть окрашено или испачкано, это не страшно, лишние составляющие отойдут в виде шлаков. Только нужно помнить, что вдыхать пары сгоревшей краски нельзя.
Чтобы из вторичного сырья получилась качественная плавка алюминия в домашних условиях, флюсы, задача которых состоит в том, чтобы связывать и выводить на поверхность расплавленного металла все примеси и загрязнения, лучше приобрести готовые.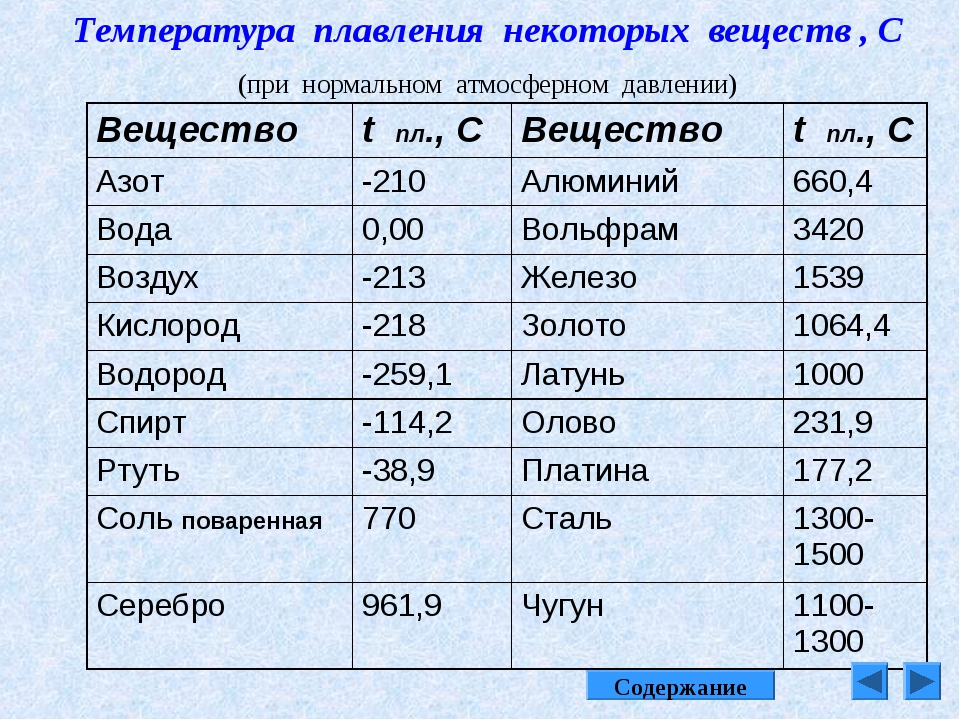 Но можно сделать самостоятельно из технических солей.
Но можно сделать самостоятельно из технических солей.
Покровный флюс готовится из 10 % криолита и по 45 % хлорида натрия и хлорида калия.
В рафинирующий флюс для получения алюминия без пористости добавляют еще 25 % от общей массы фтористого натрия.
Средства индивидуальной защиты при плавке
Плавка алюминия в домашних условиях – процесс небезопасный. Поэтому нужно пользоваться средствами индивидуальной защиты (СИЗ). Даже если такая плавка нужна один раз на минимальном оборудовании, то по меньшей мере нужно защитить руки, например специальными перчатками сварщика, отлично предохраняющими от ожогов, ведь температура жидкого алюминия – больше 600 °С.
Глаза тоже желательно защищать, особенно если плавка происходит достаточно часто, очками или маской. И совсем в идеале работать нужно в специальном костюме металлурга с повышенной стойкостью к огню и высоким температурам.
Если нужен очень чистый алюминий с использованием рафинирующего флюса, то работать следует в химическом респираторе.
Литейная форма
Если требуется только отлить чистый алюминий для припоя, то литейная форма не нужна. Достаточно использовать стальной лист, на котором расплавленный металл остынет. Но если нужно отлить хотя бы простенькую деталь, то понадобится литейная форма.
Литейную форму можно сделать из скульптурного гипса, именно гипса, а не алебастра. Жидкий гипс заливается в смазанную маслом форму, ему дают немного застыть, периодически встряхивая, чтобы вышли пузырьки воздуха, вставляют в него модель и накрывают второй емкостью с гипсом.
В удобном месте нужно в гипс вставить цилиндрический предмет, чтобы в итоге в форме появилось отверстие, так называемый канал, в который будет заливаться расплавленный алюминий.
Когда гипс окончательно застынет, две части формы разъединяются, вынимается модель, и форма с готовым слепком соединяется опять.
Изготовить литейную форму можно и из смеси 75 % формовочного песка, 20 % глины и 5 % каменноугольного песка, которая засыпается в специальный ящик из досок и трамбуется. В утрамбованную землю отжимается модель, получившийся отпечаток присыпается тальком и графитом (угольной пылью), чтобы остывшую алюминиевую деталь можно было легко отделить от формы.
Тигель для плавки
Плавка алюминия в домашних условиях требует наличия специальной емкости с носиком из тугоплавкого материала. Это так называемый тигель.
Тигли могут быть фарфоровые, кварцевые, стальные, чугунные, изготовленные из корунда или графита. В домашних условиях можно использовать покупной тигель или изготовить его, например, из отрезка стальной трубы достаточно большого диаметра.
Правда, для этого нужна болгарка, сварочный аппарат и навыки владения этими инструментами.
Размеры тигля зависят от необходимого количества алюминия, который нужно расплавить. Этот ковш должен равномерно прогреваться, а его тепло – передаваться к сырью.
Этот ковш должен равномерно прогреваться, а его тепло – передаваться к сырью.
Печи для плавки
Технология плавки алюминия в домашних условиях достаточно проста.
В специальном ковше нагревается лом алюминия до температуры, превышающей температуру плавления этого металла, расплав некоторое время выдерживается в разогретом состоянии, с его поверхности снимается шлак, затем чистый металл разливается в форму для остывания. Время плавки зависит от конструкции печи, то есть той температуры, которую она способна обеспечить.
Если используется паяльная лампа или газовая горелка, то они нагревают алюминий сверху. Правда, печь при этом все равно складывается из кирпичей колодцем без связующего раствора, внутри которого будут прогорать угли для нагревания емкости снизу и поддержания ее в нагретом состоянии.
Примерно так же выглядит конструкция печи, если тигель прогревается снизу с помощью обычных дров и фена для сушки волос. Только в этом случае дрова укладываются в кирпичном колодце не на дно, а на решетку, расположенную на первом ряду кирпичей, а в этом ряду оставляется отверстие для металлической трубы, надетой на горловину фена и закрепленной на ней изолентой.
Тиглем в этом случае служит консервная банка, естественно, не алюминиевая, в которой на небольшом расстоянии от верха проделываются диаметрально противоположные сквозные отверстия. В эти отверстия продевается стальной прут, за который банка должна подвешиваться в печи. Фен нужен для нагнетания горячего воздуха в пространство между кирпичами и тиглем.
Иногда вместо кирпичей используют металлическую бочку.
Если плавка должна происходить достаточно часто, то можно своими руками изготовить муфельную печь с вертикальной загрузкой тигля или купить готовую.
Плавка с помощью паяльной лампы
Плавка алюминия в домашних условиях паяльной лампой должна происходить не в помещении. Кроме сырья, паяльной лампы, тиглей и кирпичей, нужно подготовить дрова, пассатижи и стальной прут.
Итак, из кирпичей изготовлен небольшой колодец так, чтобы сверху можно было установить ковш с алюминием и стальной небольшой лист. В колодце разжигается костер, который должен немного прогореть, чтобы образовались угли. Дальше и происходит, собственно, плавка алюминия в домашних условиях. Пошаговая инструкция процесса:
Дальше и происходит, собственно, плавка алюминия в домашних условиях. Пошаговая инструкция процесса:
– На кирпичи устанавливается емкость с сырьем. Ее нужно греть примерно 15 минут.
– После этого на полную мощность включается горелка паяльной лампы и алюминий прогревается сверху.
– В течение нескольких секунд начинается процесс, но для того чтобы прогрев был равномерным, металл в емкости нужно аккуратно перемешивать стальным прутом, придерживая ее пассатижами (не забыв при этом надеть рукавицы). Можно обойтись и без прута, периодически встряхивая ковш с помощью тех же плоскогубцев, но очень осторожно.
– Когда жидкость становится однородной, нужно пассатижами взять емкость и вылить содержимое на прокаленный стальной лист таким образом, чтобы вся образовавшаяся окалина осталась в ковше, а на лист для застывания попал только чистый металл.
Так обычно из вторичного сырья получают чистый алюминий, если с его помощью нужно запаять алюминиевые детали.
Плавка на дровах или газе
Плавка алюминия в домашних условиях на дровах происходит в легких разборных печах. Минусом такого способа является неконтролируемость процесса. Увеличить или уменьшить температуру нагрева невозможно. Вмешаться в процесс возможно, только сняв емкость с алюминием с огня.
Плавка алюминия в домашних условиях на газу – это единственно возможный вариант для квартиры. Греть емкость нужно долго, периодически сливая расплавленный металл. В таком случае отливка выполняется слоями. Для работы понадобятся две металлические емкости таких диаметров, чтобы одна надевалась на другую. Меньшая служит тиглем.
Она с ломом, например нарезанной алюминиевой проволокой, ставится на конфорку, с которой нужно снять рассекатель пламени, бытовой газовой плиты. Над большей емкостью придется предварительно поработать. В ее днище выполняются около десятка небольших отверстий.
В два или три из них вкручиваются болты, которые исполняют роль рукояток, за которые пассатижами раскаленную емкость можно поднять.
Эта емкость кверху дном надевается на тигель. Такая конструкция и позволяет прогревать алюминий. Периодически верхнюю емкость нужно снимать и металлическим прутом или ножом перемешивать лом. Перед тем как слить расплавленный металл, с его поверхности нужно снять шлак.
Плавка алюминия в муфельной печи
Муфельная печь – это уже достаточно серьезное оборудование для получения качественного расплавленного металла. Поэтому при плавке используют флюс для очистки алюминия от примесей. И это уже почти производственный процесс, а не плавка алюминия в домашних условиях.Пошаговая инструкция включает еще и несколько пунктов по подготовке сырья:
- Сначала в тигле расплавляется флюс, которого нужно взять в количестве от 2 до 5 % от веса алюминия, а затем в него добавляется лом.
- Насколько флюс активен, можно определить по поверхности расплава – она должна быть зеркальной. Если это не так, в расплав добавляется еще немного флюса, затем нужно будет добавить его перед окончанием плавки, чтобы шлак было легче удалять с поверхности металла стальной ложкой.

- Плавку нужно вести примерно при 700-750 °С. Это температура красного свечения.
- В процессе плавки может потребоваться добавлять сырье в тигель, так как расплавленный металл сильно уменьшается в объеме.
- Рафинирующий флюс добавляют при необходимости в конце плавки в количестве 0,25 % от веса расплавленного металла. Выдерживание такой пропорции в домашних условиях – задача непростая. После добавления флюса расплав нужно перемешать ложкой, дать постоять около 5 минут, затем снять шлак.
- Когда в результате нагрева алюминий превратился в однородную блестящую каплю, тигель нужно еще некоторое время подержать в печи, чтобы металл стал более текучим.
- Затем алюминий из тигля через носик (в этот момент становится понятно, зачем нужен именно такой ковш) заливается тонкой непрерывной струйкой в форму.
- После полного остывания форма аккуратно разделяется на половинки, из нее извлекается готовая деталь, которую еще нужно окончательно обработать: просверлить отверстия, если нужно, зачистить и наждачной бумагой отшлифовать поверхность.
 Вот и все. Процесс завершен.
Вот и все. Процесс завершен.
Так что не стоит заранее пугаться, если предстоит в домашних условиях расплавить алюминиевый лом, чтобы получить чистый металл или изготовить деталь взамен поломавшейся. Серьезные профессиональные навыки для организации такого литейного производства совсем не нужны. Желание и умелые руки обычного мастера-любителя способны творить чудеса.
Источник: https://BusinessMan.ru/new-plavka-alyuminiya-v-domashnix-usloviyax-poshagovaya-instrukciya-texnologiya-plavki-alyuminiya-v-domashnix-usloviyax.html
Большая Энциклопедия Нефти и Газа
Cтраница 1
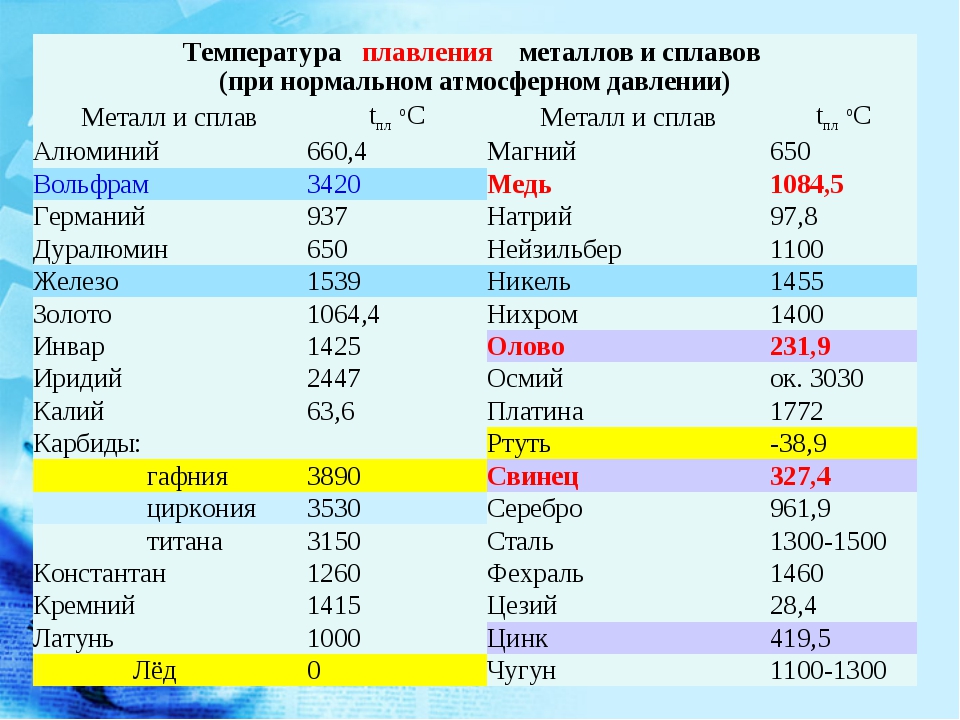
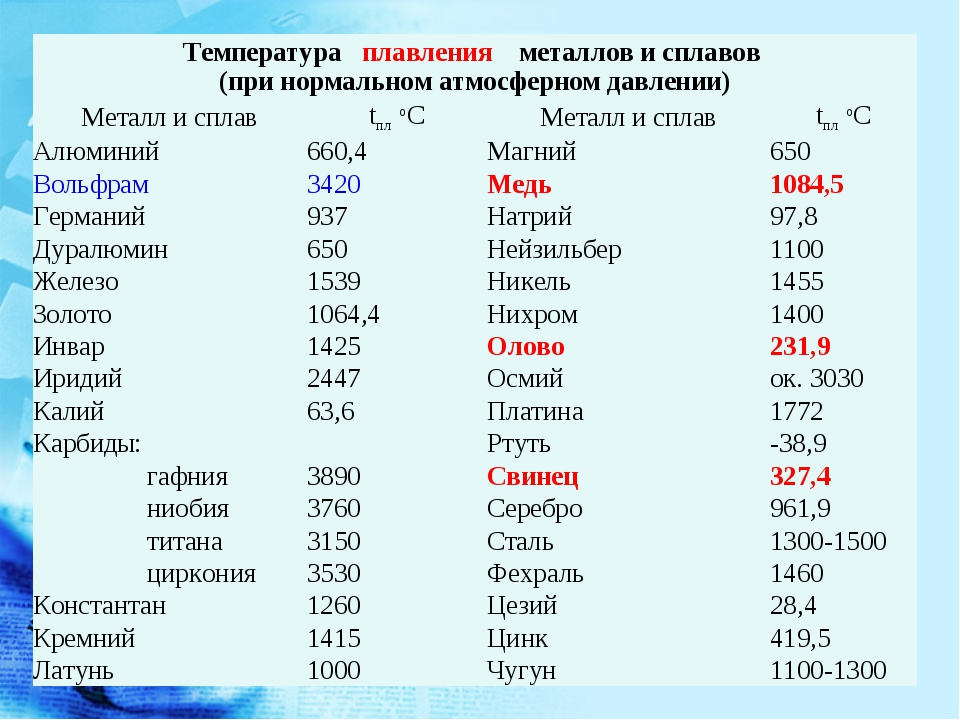
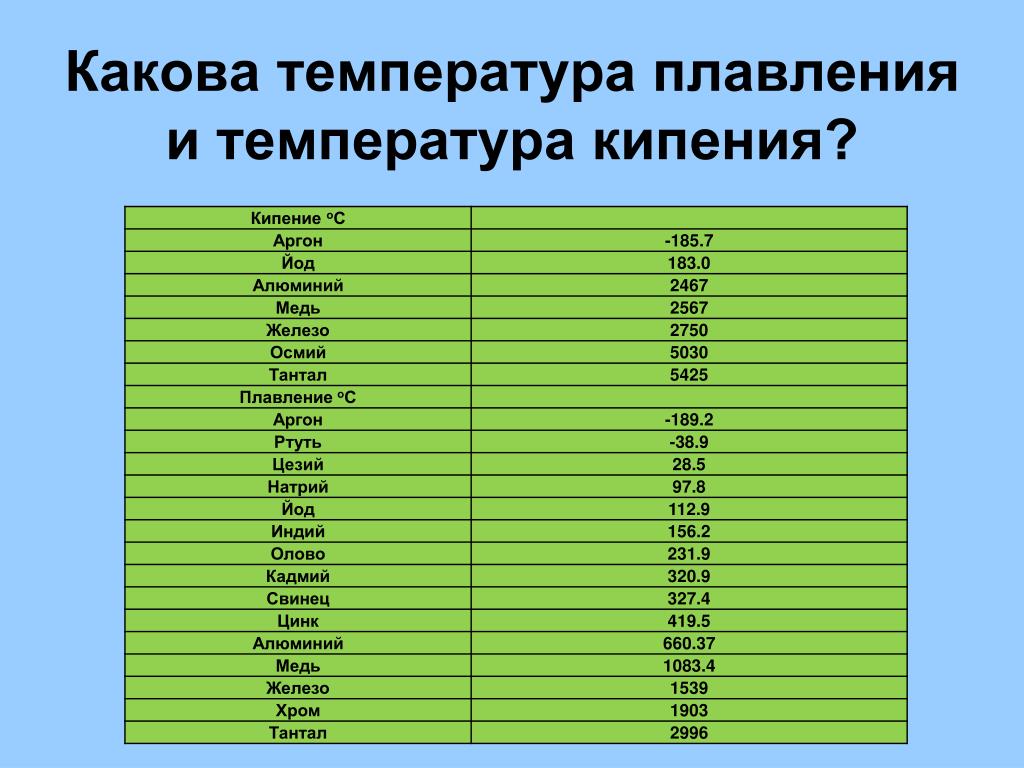
Температура плавления алюминия составляет 660 4 С, температура кипения около 2500 С. [1]
Температура плавления алюминия колеблется в зависимости от его чистоты в границах между 657 и 660 С, а температура кипения 1800 – 2000 С. [2]
Температура плавления алюминия – 660 С, однако для достижения оптимальных условий плавления необходима t 700 – 760 С. Но лак удаляется и при более низких ( – 590 С) температурах. Определяющим является процесс плавки. Следует отметить, что можно снимать лак, нанося лом на поверхность солевого расплава с температурой – 590 С. [4]
Определяющим является процесс плавки. Следует отметить, что можно снимать лак, нанося лом на поверхность солевого расплава с температурой – 590 С. [4]
Температура плавления алюминия равна 658 С, а разливки около 700 – 750 С. Особенностями алюминия являются его легкая окисляемость при высоких температурах и малая плотность 2 5 – 103 кг / м3 в расплавленном состоянии. [5]
Температура плавления алюминия составляет 565 – 578 С, а его оксидной пленки – около 2000 С. [6]
Температура плавления алюминия очень чувствительна к чистоте металла и для высокочистого алюминия ( 99 996 %) составляет 933 4 К ( 660 3 С), а температура начала кристаллизации алюминия по Международной шкале температур ( 1968 г.) считается равной 660 37 С и используется в течение многих десятков лет для калибровки термопар. [7]
Температура плавления алюминия значительно выше, чем свинца, поэтому заливка расплавленного алюминия в рабочий цилиндр невозможна, так как она может приводить к чрезмерному перегреву прессового инструмента и изоляции кабеля. [8]
[8]
Температура плавления алюминия ( 658 С) значительно выше температуры плавления свинца, поэтому заливка расплавленного алюминия в рабочий цилиндр невозможна, так как она может привести к чрезмерному перегреву прессового инструмента и изоляции кабеля. Чтобы избежать перегрева, в рабочий цилиндр загружают не расплавленный алюминий, а предварительно нагретые до 430 – 530 С алюминиевые цилиндрические слитки, диаметр которых меньше внутреннего отверстия цилиндра. [9]
Посколькутемпература плавления алюминия равна 659 С, а коэффициент его расширения вдвое больше, чем у железа, эмали для алюминия должны быть легкоплавкими и иметь большой коэффициент термического расширения. [10]
Разностьтемператур плавления алюминия ( 659) и его окиси приводит к тому, что в расплавленной ванне алюминия пленка окислов, находящаяся в твердом состоянии, препятствует качественному сплавлению металла. [11]
Если достигаетсятемпература плавления алюминия, реакция может протекать со взрывом. При добавлении А1С13 в СС14 индукционный период уменьшается до нуля, а скорость коррозии существенно не меняется. [13]
При добавлении А1С13 в СС14 индукционный период уменьшается до нуля, а скорость коррозии существенно не меняется. [13]
Действительно, температуры плавления алюминия, золота, марганца, железа, хрома, платины равны соответственно 660, 1 063, 1 260, 1 535, 1 615, 1 773 5 С; температура же кипения хрома примерно 2200, меди 2 300, а золота 2 600 С. [14]
Так кактемпература плавления алюминия равна 660, то получаемый алюминий также находится в расплавленном состоянии. При пропускании электрического тока алюминий выделяется на графитовой обкладке электролизера, а кислород – на угольных электродах.
Образующийся расплавленный алюминий время от времени выпускают в формы через специальный канал А. Выделяющийся на анодах кислород окисляет угольные электроды до окиси углерода, поэтому эти электроды по мере сгорания их нижней части опускают вниз.
[15]
Страницы: 1 2 3 4
Источник: http://www.ngpedia.ru/id504003p1.html
Плавление алюминия
Алюминий и его сплавы используются почти во всех сферах промышленности, а также в процессе изготовления предметов домашнего обихода.
В условиях комнатной температуры на алюминии образуется тонкая пленка окиси (А12O3), прочно защищающая его от последующего окисления. Время окисления алюминия с ростом температуры резко увеличивается.
Именно по этой причине в процессе плавки алюминия и его сплавов в плавильных печах поверхность расплавляемого материала и зеркало ванны очень быстро покрывается пленкой окиси.
Печи для плавки алюминия
Зачастую в производстве вторичного алюминия используют отражательные (подовые) печи. Такой тип печей для плавки алюминия отличается большим количеством модификаций. Однако все они приспособлены под стандартную отражательную печь, под специальные условия работы и особую шихту.
Не меньшей популярность пользуются и тигельные печи, в особенностях, на малых производствах.
Производства вторичного алюминия часто используют в качестве плавильных печей роторные печи, в особенности для того, чтобы переплавить лом с высокой удельной поверхностью, к примеру, алюминиевую стружку, а также очень грязный алюминиевый лом.
Всех производителей вторичного алюминия делят на две категории:
- компании, создающие литейные сплавы для изготовителей алюминиевых отливок
- компании, создающие алюминий для раскисления стали.
Обе категории компаний используют в качестве сырья «старый» лом и производственные отходы литейных заводов. На таких заводах помимо введения легирующих составляющих для доводки определенного сплава используют оснащение для очистки алюминиевого расплава и ликвидации нежелательных химических элементов и прочих примесей.
Роторными плавильными печами пользуются именно эти переработчики алюминиевого лома.
Плавление алюминия на литейных предприятиях, которые занимаются производством алюминиевых отливок из вторичного литейного алюминия, осуществляется главным образом в тигельных печах – газовых и электрических, индукционных и сопротивления, и для плавки, и для выдержки алюминия, а также для разливки алюминиевого расплава в подготовленные формы.
Температура плавления окиси алюминия составляет примерно 2050° С, что почти в три раза выше, чем градус плавления алюминия металлического.
На сегодняшний день наиболее популярной является плавка алюминия в пламенных отражательных печах, которые работают на углеродистом топливе, и в электрических печах.
В ходе плавки алюминия в отражательных пламенных печах и в камерных электропечах сопротивления прогрев обособленных кусков садки стартует в области самых высоких температур, т. е. в верхней части. В тоже время поверхность садки с большой скоростью окисляется и поглощает много газов.
Внутри канальной индукционной электропечи расплавление кусков алюминия осуществляется в области наивысших температур под слоем жидкого металла, поверхность которого накрыта пленкой окиси алюминия. Области наивысших температур в канальных электропечах расположена в узком канале и в прилегающих к нему частях шихты.
Металл на поверхности шахты имеет самую низкую температуру, вследствие чего получившиеся отливки из канальных электропечей, имеют в своем составе более низкое количество окислов, чем отливки из печей других видов.
Таким же преимуществом отличаются тигельные индукционные электропечи, в которых по технологическим требованиям в тигле по окончанию каждой плавки остается некоторое количество жидкого металла, примерно 20—35% от емкости тигля печи.Важное свойство жидкого алюминия и его сплавов заключается в его способности поглощать газы, в особенности водород. В пламенных печах много водорода собирается в топочных газах. Помимо этого, в плавильные печи всех видов его можно внести сырой шихтой.
Жидкий алюминий является хорошим растворителем для многих металлов, к примеру, железа. При этом образуются хрупкие соединения FeAl2 и Fe2Al7, которые снижают качество отливок.
Плавление алюминия в домашних условиях
Очень печально, если в доме выходят из строя маленькие, но важные функциональные составляющие, к примеру, направляющие рольставен или раздвижных дверей (могут лопнуть), фурнитура и прочее. Чаще всего такие элементы создают из алюминия.
Искать им замену проблематично, а иногда ликвидировать поломку в функционале двери или окна нужно немедленно, хотя бы временно. Если вы имеете опыт паяния, но большую часть поломок алюминиевой фурнитуры или профиля можно устранить самостоятельно.
Если вы имеете опыт паяния, но большую часть поломок алюминиевой фурнитуры или профиля можно устранить самостоятельно.
Основная проблема – это получение рабочего материала, то есть расплавленного алюминия, при помощи которого будет осуществляться пайка сломанных деталей.Многие не знают, какая температура плавления алюминия. Она составляет около 660 градусов. Стандартная газовая плита не способна разогреть металл до такой температуры.
Что же делать?Для начала необходимо приобрести алюминиевую чушку, но можно и использовать обрезки старого профиля. Чтобы расплавить алюминий понадобится портативная газовая горелка или паяльная лампа. Разные модели этих устройств способны дать температуру в пределах 1000 – 1300 градусов.
Подготовленный материал нужно положить в тугоплавкую емкость, к примеру, из нержавеющей стали. Кроме этого, нужна прокаленная стальная пластина или еще одна емкость, в которую мы будем выливать расплавленный металл.
Последовательность работы:
- создание небольшого «колодца».
 Сверху нужно будет поставить емкость для плавки
Сверху нужно будет поставить емкость для плавки - розжиг костра в «колодце». Это необходимо для поддержания тары в нагретом состоянии, после использования горелки. Также костер поможет прогреть алюминий снизу
- после образования жарких углей можно установить емкость с алюминием. Время плавления алюминия таким образом составляет примерно 15 – 20 минут. Тут же вы можете оставить прогреваться и вторую емкость или пластину
- далее нужно включить газовую горелку на максимум и греть алюминий сверху
- плавка металла начинается почти мгновенно, но цель еще не получена. Главная задача – получение однородного прогрева. Чтобы этого добиться нужно периодически встряхивать емкость
- в процессе плавки образуется оксид алюминия, формирующий окалину
- после этого расплавленный металл нужно вылить на прокаленную стальную поверхность, аккуратно, чтобы не высыпалась окалина. Теперь расплавленный алюминий готов к дальнейшей работе.
| Степень чистоты, % | 99,25 | 99,40 | 99,75 | 99. 97 97 | 99,996 | 99.9998 |
| Плотность при 20°С, г/см3 | 2,727 | 2,706 | 2,703 | 2,6996 | 2,6989 | 2,69808 |
| Степень чистоты, % | 99,25 | 99.40 | 99.75 |
| Плотность, г/см3 | 2,311 | 2,291 | 2,289 |
| Степень чистоты, % | 99,2 | 99,5 | 99,6 | 99,97 | 99,996 |
| Температура плавления, °С | 657 | 658 | 659,7 | 659,8 | 660,24 |
Источник: http://mining-prom.ru/cvetmet/alyuminiy/plavlenie-alyuminiya/
Медь: химический элемент, температура плавления и кипения, пошаговая инструкция
Медь входит в семёрку самых древних металлов, с которыми люди познакомились на самом начальном этапе своего существования. Период с 4 по 3 тысячелетие до нашей эры так и называется медный век в истории развития человечества. Древние люди изготавливали из неё предметы быта, орудия труда и боевое оружие. Это стало возможным благодаря относительно невысокой температуре плавления меди.
Период с 4 по 3 тысячелетие до нашей эры так и называется медный век в истории развития человечества. Древние люди изготавливали из неё предметы быта, орудия труда и боевое оружие. Это стало возможным благодаря относительно невысокой температуре плавления меди.
Купрум: характеристика элемента
Научное наименование меди Cuprum (Купрум) происходит от названия греческого острова Кипр, где медь начали добывать ещё в середине третьего тысячелетия до нашей эры.
В периодической таблице Менделеева химический элемент медь имеет 29 атомный (порядковый) номер, находится в 11 группе четвёртого периода. Принадлежит к пластичным переходным металлам. В чистом виде имеет характерный золотисто-розовый цвет.
Чистую медь легко окислить, поэтому в естественных условиях она всегда образует на своей поверхности тонкую оксидную плёнку, которая придаёт ей красноватый оттенок.
Физические свойства
Это второй металл после серебра по уровню электропроводности, что делает её крайне востребованной в современной электронике. Второе ценное качество — высокая теплопроводность, это позволяет её широко применять во всевозможных теплообменниках и в холодильной аппаратуре.
Второе ценное качество — высокая теплопроводность, это позволяет её широко применять во всевозможных теплообменниках и в холодильной аппаратуре.
- Температура плавления 1083 градуса.
- Температура кипения 2567 градусов.
- Удельное сопротивление при 20 градусах составляет 1,68·10 -3 Ом·м.
- Плотность 8,92 г/см.
Нахождение в природе
В природе встречается в самородном виде и в виде соединений.
Самые крупные месторождения самородной меди находятся в США в районе озера Верхнего. Именно в этом районе был найден самый крупный медный самородок весом 3560 килограмм. А также много самородной меди встречается в рудных горах Германии.
В России и на постсоветском пространстве добыча меди происходит путём извлечения из сульфидной руды. Её можно добыть, извлекая из медного колчедана или халькопирита CuFeS2. Наиболее известны такие месторождения, как Удокан в Забайкалье и Джезказган в Казахстане.
Наиболее известны такие месторождения, как Удокан в Забайкалье и Джезказган в Казахстане.
Сульфиты меди чаще всего образуются в так называемых среднетемпературных гидротермальных жилах. Могут образовываться и в осадочных породах в виде медистых песчаников и сланцев.
Как правило, медная руда всегда добывается открытым способом. Процентное содержание чистой меди в руде составляет от 0,2 до 1,0 процента в зависимости от месторождения.
Медные сплавы
Являются самыми первыми металлическими сплавами, получение которых человечество освоило ещё на самой заре своего развития. При какой температуре плавится медь, зависит от того, в каком сплаве она находится. В настоящее время наиболее известны и востребованы такие сплавы, как:
- Латунь. Сплав с добавление цинка, содержание которого может доходить до 40%. Цинк повышает пластичность и прочность металла. Температура, при которой латунь плавится, составляет 880 — 950 градусов.

- Бронза. Сплав с оловом, с добавлением некоторых других компонентов, таких как кремний, бериллий, свинец. Получать бронзу из меди человек научился ещё в самом начале бронзового века. Бронза не утратила своей актуальности даже с наступлением века железа, например, ещё в начале 20 века стволы пушек изготавливали из так называемой орудийной бронзы. Температура, при которой бронза начинает плавиться, составляет 930 — 1140 градусов.
- Мельхиор. Кроме меди, содержит в своём составе 5−30% никеля. Никель увеличивает прочность медного сплава и повышает его электрическое сопротивление. Кроме того, сильно повышается коррозионная стойкость. Температура плавления — 1170 градусов. По своим внешним характеристикам мельхиор очень похож на серебро, раньше его называли белой медью. Но он обладает более высокой механической прочностью, чем обычное серебро.
- Дюраль, или дюралюминий. Основную массу сплава составляет алюминий 93%, на медь приходится 5%, оставшиеся 2% занимают марганец, железо и магний.
 Название происходит от названия немецкого города Дюрен, где в 1906 году был впервые получен этот высокопрочный сплав алюминия. Одной из его особенностей является тот факт, что его прочностные характеристики с течением времени имеют тенденцию к увеличению. Поэтому он не теряет своей прочности после нескольких лет эксплуатации, как другие металлы. В настоящее время этот сплав является основой самолётостроения.
Название происходит от названия немецкого города Дюрен, где в 1906 году был впервые получен этот высокопрочный сплав алюминия. Одной из его особенностей является тот факт, что его прочностные характеристики с течением времени имеют тенденцию к увеличению. Поэтому он не теряет своей прочности после нескольких лет эксплуатации, как другие металлы. В настоящее время этот сплав является основой самолётостроения. - Ювелирные сплавы. Сплавы меди с золотом. Тем самым увеличивается устойчивость драгметалла к механическим воздействиям и истиранию.
Переплавка меди дома
Этот металл обладает целым набором полезных свойств, которые делают её весьма желанным металлом в домашнем хозяйстве.
А относительно невысокая температура при плавлении и изрядное количество медного лома, которое можно обнаружить на ближайшей свалке, позволяют задавать вопрос о том, как расплавить медь в домашних условиях, не как риторический, а вполне реальный и практический.
График плавления меди
Расплавление любого металла заключается в том, что под воздействием высоких температур разрушается кристаллическая решётка и металл переходит из твёрдого состояния в жидкое. Можно выделить некоторые закономерности, свойственные любому металлу в процессе расплавления:
- Во время нагревания температура внутри металла повышается, но кристаллическая решётка не подвергается разрушению. Металл сохраняет своё твёрдое состояние.
- При достижении температуры плавления, для меди это 1083 градуса, температура внутри металла перестаёт повышаться, несмотря на то что общий нагрев и передача тепла продолжаются.
- После того как вся масса метала переходит в расплавленное состояние, температура внутри металла снова начинает резко повышаться.
В случае процесса охлаждения расплавленного металла происходит всё то же самое, но в обратной последовательности.
Сначала происходит резкое снижение температуры внутри металла, затем на значении 1080 градусов падение температуры прекращается до тех пор, пока вся масса метала не перейдёт в твёрдое состояние.
После этого температура снова начинает резко падать, пока не сравняется с температурой окружающего воздуха и кристаллизация не завершится окончательно.
Температура кипения
Медь начинает активно выделять углерод в виде пузырьков газа при температуре 2560 градусов. Внешне это очень напоминает кипение воды. На самом деле это процесс активного окисления меди, в результате которого металл теряет практически все свои уникальные свойства.
Детали, отлитые из кипящей меди, имеют в своей структуре большое количество пор, которые будут уменьшать механическую прочность материала и ухудшать его декоративные свойства.
Потому в процессе плавки необходимо внимательно следить за температурой и не допускать закипания меди.
Способы плавки
Медный лом можно переплавить в домашних условиях разными способами в зависимости от технического оснащения домашней мастерской. При этом нужно иметь в виду, что придётся нагревать медь не до её температуры плавления, а чуть выше — примерно до 1100−1200 градусов.
Для этих целей годятся следующие приспособления:
- Муфельная печь. Наиболее рациональное решение проблемы расплавления меди, так как такая печь позволяет регулировать температуру во время процесса плавки, что очень удобно. Подобные лабораторные печи оснащены специальным окном из жаропрочного стекла, что позволяет постоянно осуществлять визуальный контроль всего процесса.
- Газовая горелка. Ручная газовая горелка размещается под дном ёмкости из тугоплавкого материала, в которой непосредственно будет размещаться медный лом. Этот способ предполагает наличие тесного контакта расплавляемой массы металла с воздухом, что будет способствовать усилению процесса окисления расплавляемого металла. Чтобы этому как-то противостоять, на расплавляемую массу сверху насыпают слой древесного угля.

- Паяльная лампа. Способ практически ничем не отличается от плавки с помощью газовой горелки. Но в этом случае невозможно достигнуть относительно высоких температур, поэтому он годится для переплавки сплавов меди, которые обладают меньшей температурой плавления, чем чистая медь.
- Кузнечный горн. На раскалённые древесные угли специального костра помещается тугоплавкий тигель с измельчённым металлом. Для ускорения процесса расплавления задействуют обычный бытовой пылесос, включённый в режиме выдувания. Труба пылесоса должна быть небольшого диаметра и иметь металлический наконечник, в противном случае она расплавится. Данный способ подходит для тех, кто занимается плавкой меди дома регулярно и имеет дело с большими объёмами исходного материала, который необходимо отжечь.
- Микроволновая печь. Бытовая мощная микроволновка с небольшими изменениями конструкции может легко плавить довольно большие объёмы медного лома. Для этого необходимо убрать из микроволновки вращающуюся тарелку, а вместо неё поместить соответствующих размеров тигель, который необходимо сделать из тугоплавкого материала, например, из шамотного кирпича.

Пошаговая инструкция
Процесс плавления любого металла происходит поэтапно и подчиняется определённому алгоритму, который одинаков как для промышленного производства, так и для кустарного. Для тех, кто озадачен вопросом плавки меди в домашних условиях, пошаговая инструкция будет выглядеть следующим образом:
- Необходимо взять тугоплавкий тигель. Металл в измельчённом состоянии насыпается в тигель. После этого тигель помещается в предварительно прогретую муфельную печь. С помощью специального окошка наблюдают за процессом расплавления.
- После полного расплавления всего объёма медного лома тигель с помощью специальных длинных щипцов извлекается из печи.
- На поверхности расплавленного металла образуется плёнка его оксида. Эту плёнку необходимо аккуратно сдвинуть в сторону к одной из стенок тигля. Для этих целей используют специальный крючок, изготовленный из тугоплавкого металла.
- После того как металл освобождён от оксидной плёнки, необходимо его очень быстро разлить в предварительно подготовленные формы.

Практические рекомендации
Температура плавления меди в домашних условиях зависит от того, в каком сплаве она содержится.
Техническая чистая медь содержится в проводах и кабелях, а также в обмотках трансформаторов, электродвигателей и генераторов. При этом нужно иметь в виду, что химически чистая медь содержится только в столовых приборах и в прочей кухонной утвари. Во всех остальных случаях в ней присутствуют те или иные вредные компоненты.
В чистом виде обладает повышенной вязкостью в расплавленном состоянии, поэтому отливать из неё изделия сложной конфигурации и небольших размеров очень сложно. Гораздо легче для этих целей использовать латунь.
В сплавах бронзы, изготовленных вначале и середине прошлого века, использовали в качестве компонентов мышьяк и сурьму. Поэтому следует избегать расплавления так называемой старинной бронзы, так как пары мышьяка могут привести к отравлению организма.
Источник: https://remoskop.ru/temperatura-plavleniya-medi-v-domashnih-usloviyah.html
Температура плавления металлов. Самый тугоплавкий и легкоплавкий металл :
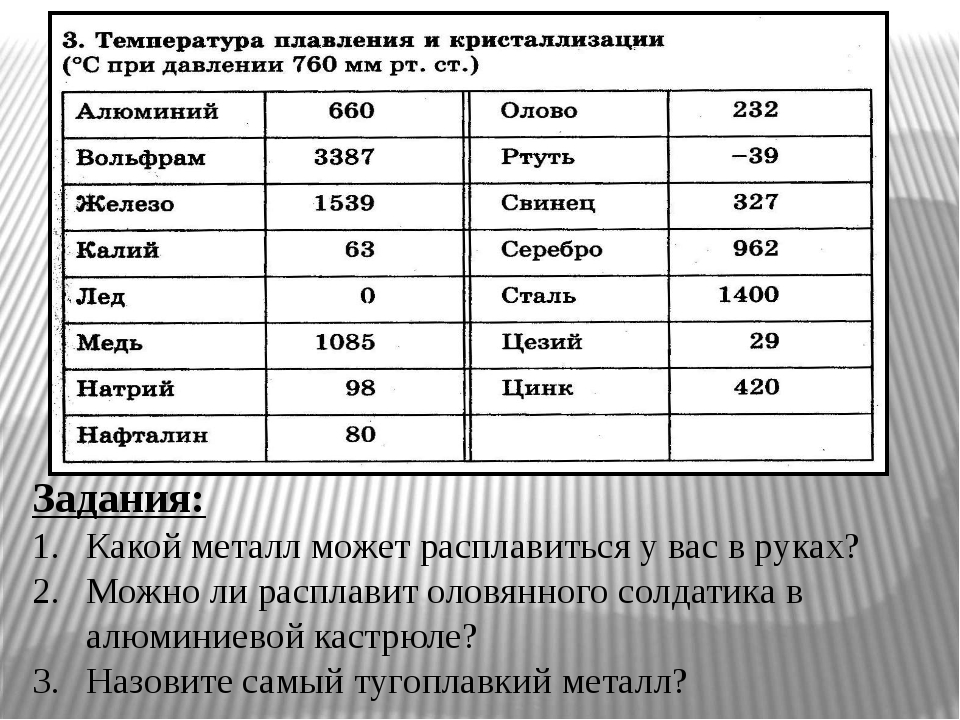
Почти все металлы при нормальных условиях представляют собой твердые вещества. Но при определенных температурах они могут изменять свое агрегатное состояние и становиться жидкими. Давайте узнаем, какая температура плавления металла самая высокая? Какая самая низкая?
Температура плавления металлов
Большая часть элементов периодической таблицы относится к металлам. В настоящее время их насчитывается примерно 96. Всем им необходимы разные условия, чтобы превратиться в жидкость.
Порог нагревания твердых кристаллических веществ, превысив который они становятся жидкими, называется температурой плавления. У металлов она колеблется в пределах нескольких тысяч градусов. Многие из них переходят в жидкость при относительно большом нагревании. Благодаря этому они являются распространенным материалом для производства кастрюль, сковородок и других кухонных приборов.
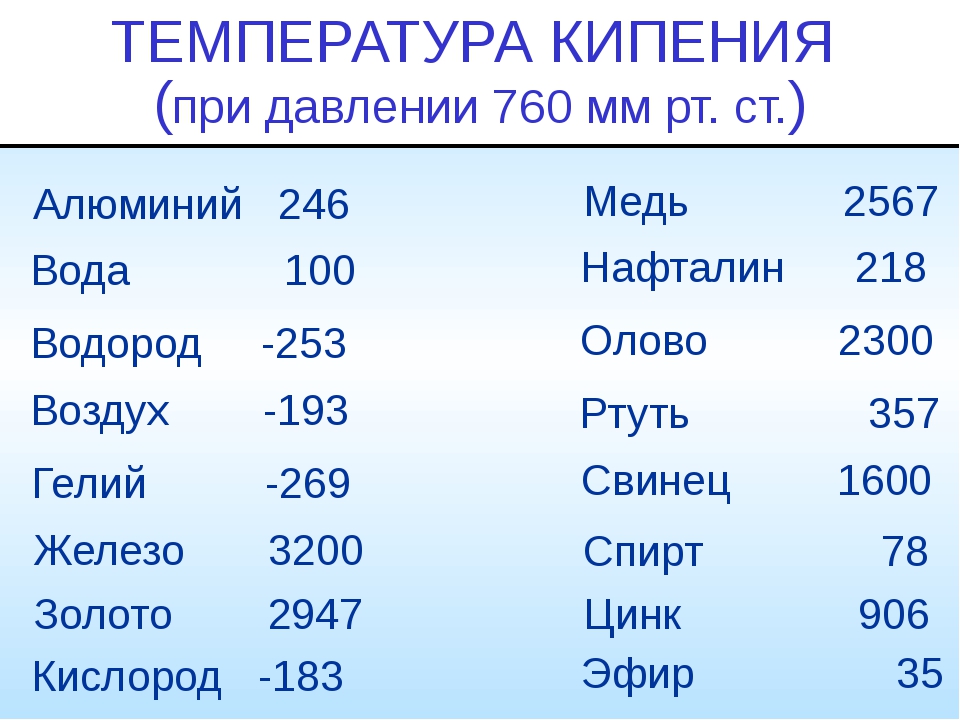
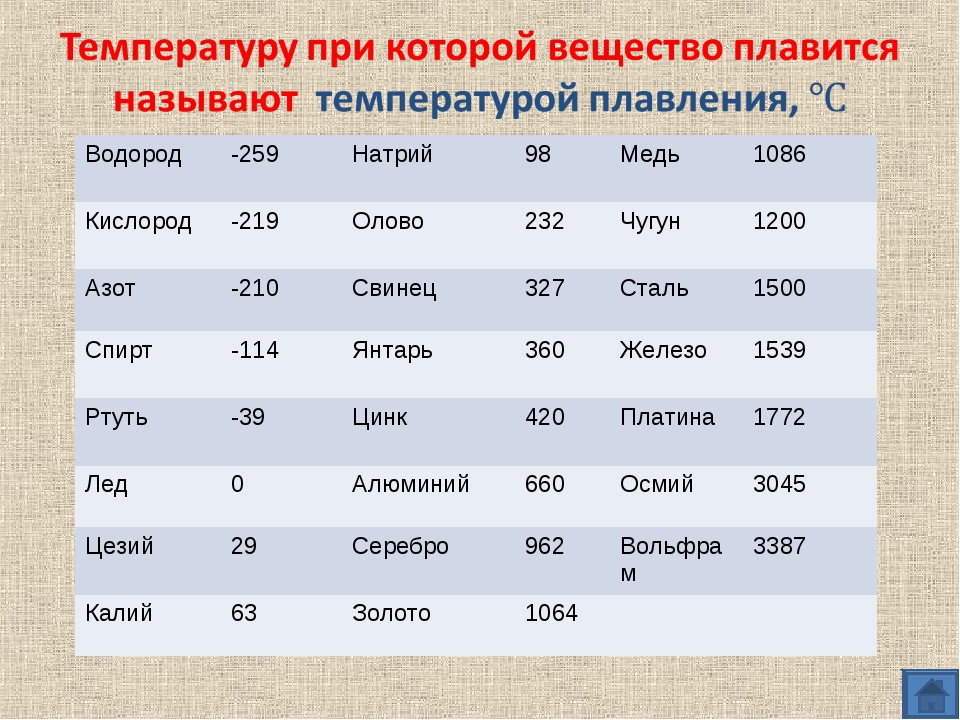
Средние температуры плавления имеют серебро (962 °С), алюминий (660,32 °С), золото (1064,18 °С), никель (1455 °С), платина (1772 °С) и т.д. Выделяют также группу тугоплавких и легкоплавких металлов. Первым, чтобы превратиться в жидкость, нужно больше 2000 градусов Цельсия, вторым – меньше 500 градусов.
К легкоплавким металлам обычно относят олово (232 °C), цинк (419 °C), свинец (327 °C). Однако у некоторых из них температуры могут быть еще ниже. Например, франций и галлий плавятся уже в руке, а цезий можно греть только в ампуле, ведь от кислорода он воспламеняется.
Самые низкие и высокие температуры плавления металлов представлены в таблице:
| Тугоплавкие | Легкоплавкие | ||
| Вольфрам | 3422 °C | Ртуть | -38,87 °C |
| Рений | 3186 °C | Галлий | 26,79 °C |
| Тантал | 3017 °C | Франций | 27 °C |
| Осмий | 3033 °C | Цезий | 28,5 °C |
| Молибден | 2623 °C | Рубидий | 39,31 °C |
| Ниобий | 2477 °C | Калий | 63,5 °C |
| Иридий | 2466 °C | Натрий | 97,8 °C |
Вольфрам
Самая высокая температура плавления – у металла вольфрама.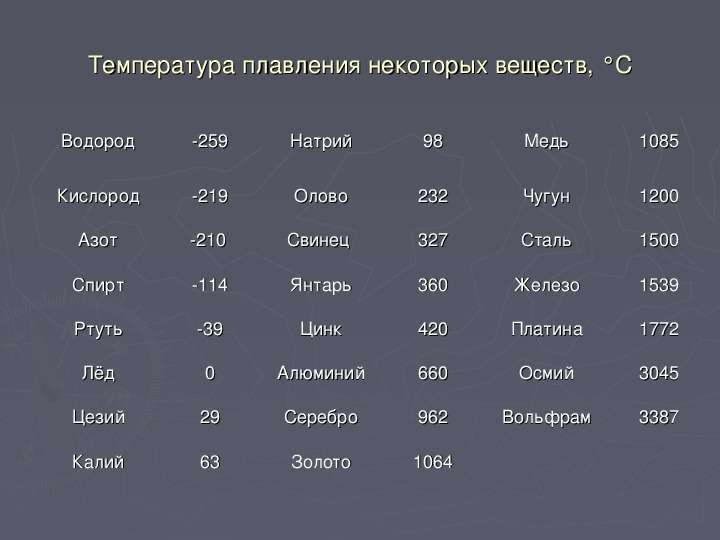 Выше него по этому показателю стоит только неметалл углерод. Вольфрам представляет собой светло-серое блестящее вещество, очень плотное и тяжелое. Он кипит при 5555 °C, что почти приравнивается к температуре фотосферы Солнца.
Выше него по этому показателю стоит только неметалл углерод. Вольфрам представляет собой светло-серое блестящее вещество, очень плотное и тяжелое. Он кипит при 5555 °C, что почти приравнивается к температуре фотосферы Солнца.
При комнатных условиях он слабо реагирует с кислородом и не подвергается коррозии. Несмотря на свою тугоплавкость, он довольно пластичен и поддается ковке уже при нагревании до 1600 °C. Эти свойства вольфрама используют для нитей накаливания в лампах и кинескопах электродов для сварки. Большую часть добытого металла сплавляют со сталью, чтобы повысить ее прочность и твердость.
Широкое применение вольфрам имеет в военной сфере и технике. Он незаменим для изготовления боеприпасов, брони, двигателей и наиболее важных частей военного транспорта и самолетов. Из него также делают хирургические инструменты, ящики для хранения радиоактивных веществ.
Ртуть
Ртуть – единственный металл, температура плавления которого имеет минусовое значение. К тому же это один из двух химических элементов, простые вещества которых при нормальных условиях, существуют в виде жидкостей.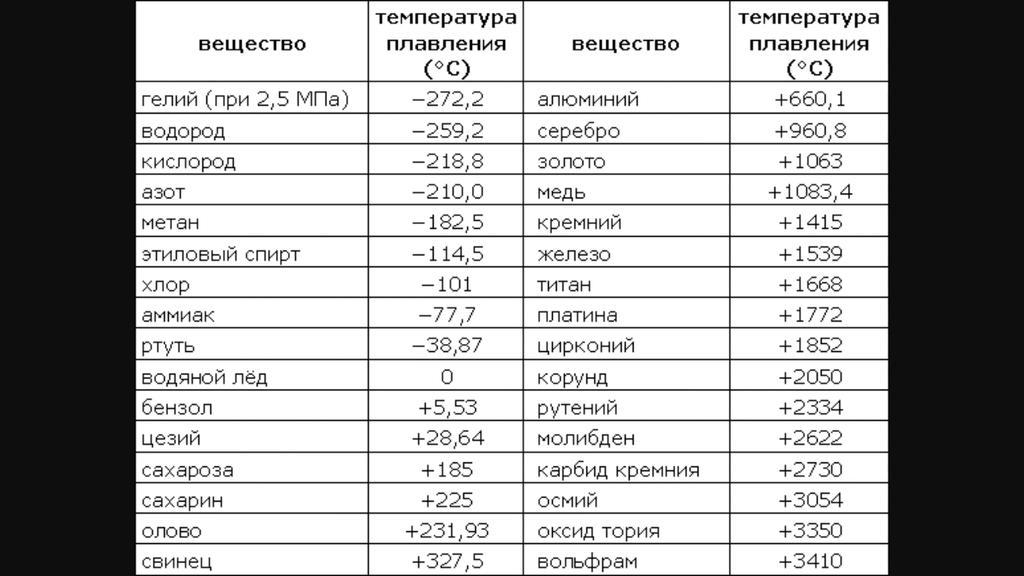 Интересно, что кипит металл при нагревании до 356,73 °C, а это намного выше температуры его плавления.
Интересно, что кипит металл при нагревании до 356,73 °C, а это намного выше температуры его плавления.
Имеет серебристо-белый цвет и ярко выраженный блеск. Она испаряется уже при комнатных условиях, конденсируясь в небольшие шарики. Металл очень токсичен. Он способен накапливается во внутренних органах человека, вызывая болезни головного мозга, селезенки, почек и печени.
Ртуть – один из семи первых металлов, о которых узнал человек. В Средние века она считалась главным алхимическим элементом.
Несмотря на ядовитость, когда-то ее применяли в медицине в составе зубных пломб, а также как лекарство от сифилиса.
Сейчас ртуть почти полностью исключили из медицинских препаратов, но широко используют ее в измерительных приборах (барометрах, манометрах), для изготовления ламп, переключателей, дверных звонков.
Сплавы
Чтобы изменить свойства того или иного металла, его сплавляют с другими веществами. Так, он может не только приобрести большую плотность, прочность, но и снизить или повысить температуру плавления.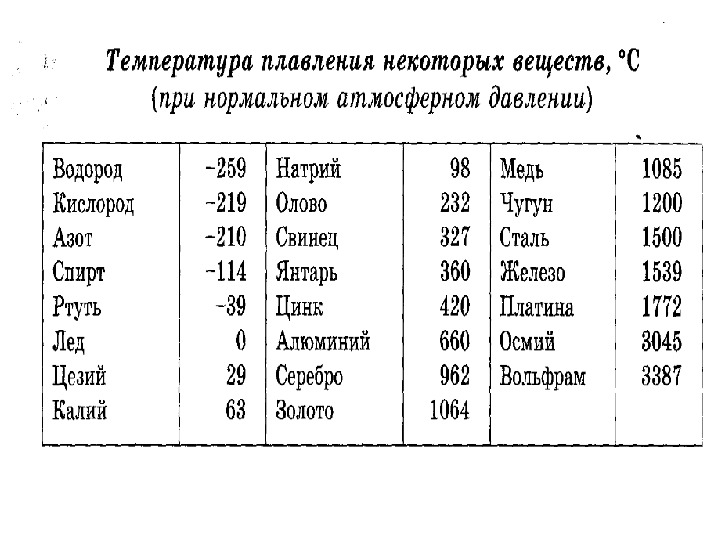
Сплав может состоять из двух или больше химических элементов, но хотя бы один из них должен быть металлом. Такие «смеси» очень часто используют в промышленности, ведь они позволяют получить именно те качества материалов, которые необходимы.
Температура плавления металлов и сплавов зависит от чистоты первых, а также от пропорций и состава вторых. Для получения легкоплавких сплавов чаще всего используют свинец, ртуть, таллий, олово, кадмий, индий.
Те, в составе которых находится ртуть, называются амальгамами. Соединение натрия, калия и цезия в соотношении 12%/47%/41% становится жидкостью уже при минус 78 °C , амальгама ртути и таллия – при минус 61°C.
Самым тугоплавким материалом является сплав тантала и карбидов гафния в пропорциях 1:1 с температурой плавления 4115 °C.
Источник: https://www.syl.ru/article/374078/temperatura-plavleniya-metallov-samyiy-tugoplavkiy-i-legkoplavkiy-metall
Температура плавления алюминия и его преобразование
Температура плавления алюминия и его преобразование.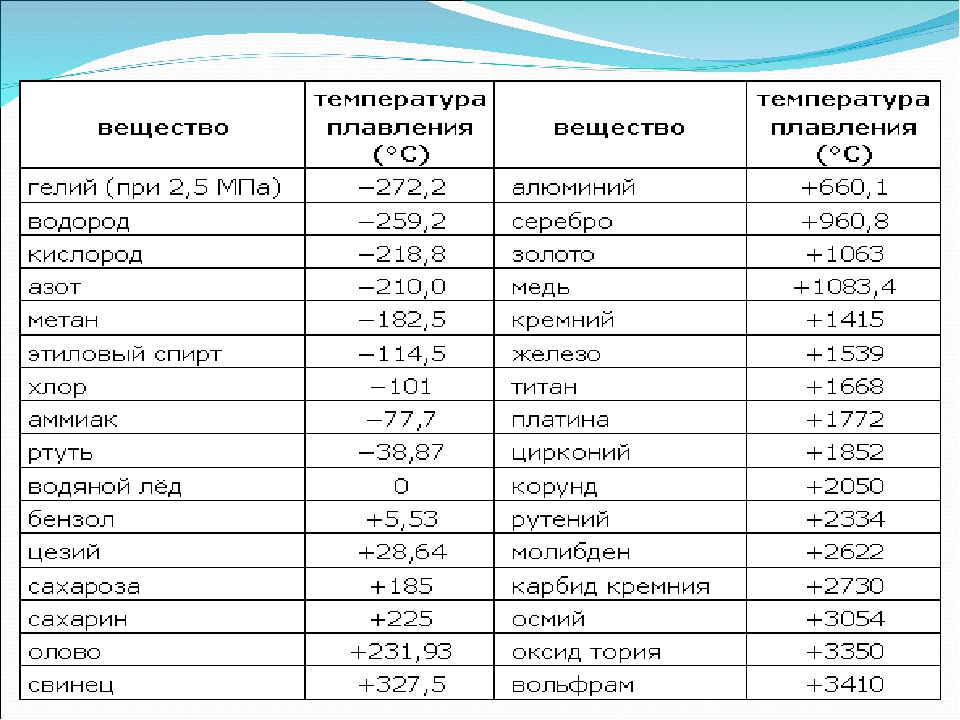 Алюминий- легкий и пластичный металл серебристого цвета. Удельный вес которого 2,7*103 кг/м3, плотность 2,7 г/см3, температура плавления алюминия составляет 660,3 °C .
Алюминий- легкий и пластичный металл серебристого цвета. Удельный вес которого 2,7*103 кг/м3, плотность 2,7 г/см3, температура плавления алюминия составляет 660,3 °C .
Алюминий обладает высокой электропроводностью, коэффициент теплопроводности составляет 180 ккал/м*час*град, поэтому этот металл считается хорошим проводником электроэнергии.
Теплопроводность алюминия больше в пять раз показателей чугуна и в раза три превышает показатель железа.
За счет своего состава этот металл легко раскатать в тонкий лист или же вытянуть в проволоку. На поверхности металла при воздействии с воздухом появляется оксидная пленка, которая создает препятствия окислению и обеспечивает его высокие антикоррозийные свойства. Если нагреть до высоких температур тонкий алюминий, тогда он моментально сгорит и перейдет в состояние оксид алюминия.
Припой для пайки алюминия — основа легкоплавкие материалы
Припои для пайки в основном имеют в своем составе различные химические элементы, они при взаимодействии с алюминием в основном не растворяются. Подходящими припоями для соединения алюминиевых деталей являются тугоплавкие материалы, основу их составляет алюминий и легкоплавкие материалы такие, как кадмий, олово и цинк.
Подходящими припоями для соединения алюминиевых деталей являются тугоплавкие материалы, основу их составляет алюминий и легкоплавкие материалы такие, как кадмий, олово и цинк.
Лучший припой для пайки алюминия, хорошо зарекомендовавший себя на практике, это легкоплавкий материал. При использовании таких компонентов, пайку можно делать при довольно низких температурных показателях и при этом несильно нарушается структура и свойства алюминия. Они являются лучшими припоями для алюминия. При их использовании получается неплохой результат.
Олово и кадмий имеют свои недостатки, они очень подвержены и нестойки к коррозиям и быстрому разрушению материала.
Холодная сварка для алюминия
Если вам нужно произвести мелкие ремонтные работы, то обычную сварку можно заменить, холодной сваркой для алюминия. Специальные устройства деформируют поверхность и скрепляют детали между собой, этот процесс выполняется на обезжиренных, очищенных поверхностях, в результате чего определенные связи атомом расщепляются, и происходит процесс сваривания одно заготовки с другой.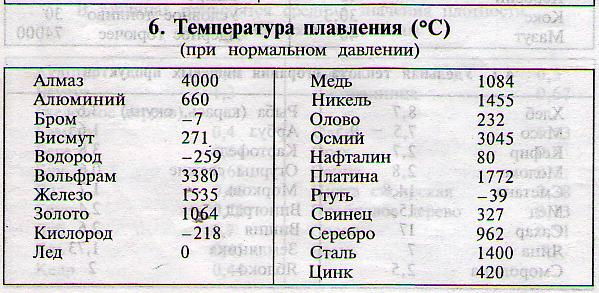
Благодаря холодной сварке соединение можно произвести несколькими способами. Стыковым, шовным, а так же точечным либо при помощи клея.
При всех этих методах происходит монолитное соединение, которое является очень качественным и прочным.
Работать с этим материалом можно и в помещениях, так же он не требует определенной температуры и его не нужно подвергать каким-либо термически обработкам в отличие от обычной дуговой сварки.
Источник: http://DekorMyHome.ru/rukodelie/temperatyra-plavleniia-aluminiia-i-ego-preobrazovanie.html
Цветные металлы и сплавы
Подробности- Подробности
- Опубликовано 27.05.2012 13:22
- Просмотров: 11825
Наибольшее применение в технике имеют следующие цветные металлы: медь, латунь, бронза, алюминий и его сплавы, свинец, олово, цинк.
Медь. Медь представляет собой металл красновато-розового цвета. Температура плавления меди 1083°. Медь обладает высокой электропроводностью, теплопроводностью, пластичностью и стойкостью против атмосферной коррозии. По сравнению со сталью теплопроводность и электропроводность меди выше в шесть раз.
Температура плавления меди 1083°. Медь обладает высокой электропроводностью, теплопроводностью, пластичностью и стойкостью против атмосферной коррозии. По сравнению со сталью теплопроводность и электропроводность меди выше в шесть раз.
Высокая пластичность позволяет производить прокатку ее в холодном состоянии в тонкие листы. Прочность нагартованной меди достигает 40 кг!мм2, а отожженной и литой — 18—20 кг/мм2.
Обычно применяется медь марок МО, M1, М2, МЗ, (М4) (ГОСТ 859-41), отличающихся друг от друга содержанием примесей. Наиболее чистой от примесей является медь марки МО (количество примесей 0,05%) и марки M1 (примесей 0,1%). Чем меньше примесей, тем лучше медь поддается сварке.
При нагревании свыше 600° С прочность меди резко снижается, она становится хрупкой. В жидком состоянии медь легко поглощает газы и окисляется. Это ограничивает ее применение для литых изделий, а также затрудняет сварку. Высокая теплопроводность и жидко текучесть в расплавленном состоянии также затрудняют сварку меди.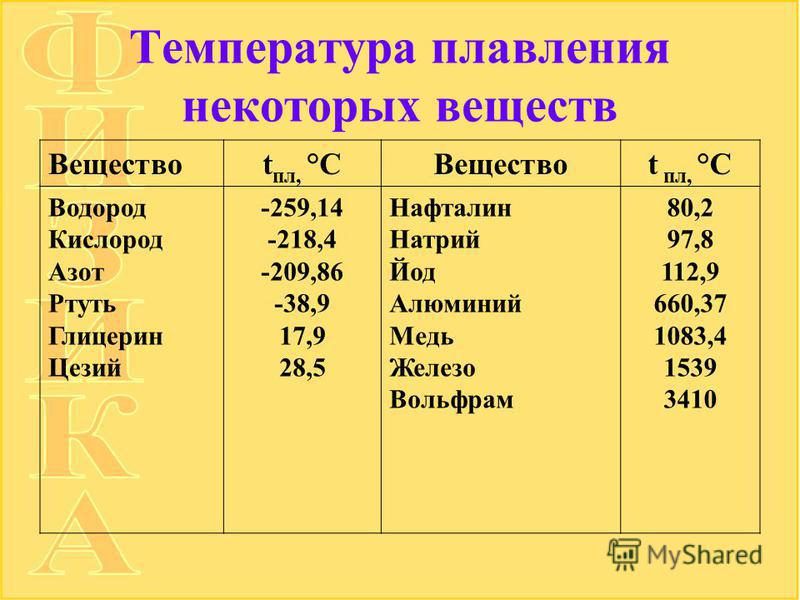
С понижением температуры механические свойства меди не снижаются, что позволяет применять медь в конструкциях, работающих при низкой температуре. Благодаря высокой электропроводности медь широко применяется в электропромышленности, в химическом машиностроении и других отраслях промышленности для изготовления баков, котлов, теплообменной аппаратуры и т. д.
Латунь. Латунь представляет собой сплав меди с цинком золотисто-желтого цвета. Содержание цинка в латуни 20—45%. Температура плавления латуни в зависимости от состава достигает 880— ‘950° С. С увеличением содержания цинка температура плавления понижается. Латунь достаточно хорошо сваривается и прокатывается. Изготовляется и применяется она обычно в виде листов, прутков, трубок и проволоки. Широкое применение латуни обусловливается ее меньшей стоимостью по сравнению с медью.
По ГОСТ 1019-47 латуни разделяются в зависимости от их химического состава на ряд марок: томпак марок Л96 и Л90 (содержание меди 88—97%), полутомпак марок JI80 и Л85 (меди 79— 86%), латунь марок Л62, Л68 и Л70 (цифра обозначает среднее содержание меди). Кроме того, имеются алюминиевые латуни марки ЛА77-2 (меди 76—79%, алюминия в среднем до 2%), марганцовистые, железомарганцовистые и др. Такие латуни обладают повышенной прочностью и вязкостью.
Кроме того, имеются алюминиевые латуни марки ЛА77-2 (меди 76—79%, алюминия в среднем до 2%), марганцовистые, железомарганцовистые и др. Такие латуни обладают повышенной прочностью и вязкостью.
Бронза. Сплавы меди с оловом, марганцем, алюминием, никелем, кремнием, бериллием и другими элементами называют бронзами. Наиболее известны оловянистые бронзы, содержащие олова от 3 до 7%. Оловянистая бронза обладает очень малой усадкой и хорошими литейными свойствами.
Бронзы применяются в промышленности, главным образом в качестве литейного материала для изготовления подшипников и деталей, работающих на трение, а также для различного рода арматуры котлов, аппаратов и т. д.
Температура плавления бронзы зависит от количества в ней примесей и в среднем составляет: для оловянистых бронз 900—950 ° С, для безоловянистых — 950— 1080° С. Бронзы хорошо свариваются.
По ГОСТ 5017-49 различают следующие марки: Бр. ОФ 6,5-0,15 (олова 6—7%, фосфора 0,1—0,25%), Бр. ОФ 4-0,25 (олова 3,5— 4%, фосфора 0,2—0,3%), Бр. ОЦС-4-4-2,5 (олова 3—5%, цинка 3—5%, свинца 1,5—3,5%).
ОЦС-4-4-2,5 (олова 3—5%, цинка 3—5%, свинца 1,5—3,5%).
Алюминий и его сплавы. Алюминий — очень легкий металл, светло-серого, почти белого цвета. Он почти в три раза легче стали. Его удельный вес 2,7 г/см3. Алюминий имеет высокую теплопроводность и электропроводность и хорошо сопротивляется окислению благодаря тонкой, но прочной пленке окислов, защищающей его поверхность. Температура плавления алюминия 658° С. Несмотря на низкую температуру плавления, алюминий требует для расплавления большого количества тепла благодаря своей высокой удельной теплоемкости. Механические свойства чистого алюминия невысоки.
Сплавы алюминия с медью (дюралюминий), с магнием (электрон), с кремнием (силумин) и другие обладают прочностью, близкой к прочности малоуглеродистой стали.
В чистом виде алюминий применяется в электротехнике и химическом машиностроении. Алюминиевые сплавы широко применяются в промышленности в качестве литейного материала, а также в виде листового и сортового металла. Алюминий и его сплавы хорошо свариваются.
Алюминий и его сплавы хорошо свариваются.
Из большого количества алюминиевых сплавов в сварных конструкциях чаще всего применяют алюминиево-марганцевый сплав АМц (содержащий до 1,6% марганца), дюралюминий (марки Д1, Д6, Д16) и др.
Все алюминиевые сплавы могут быть разделены на литейные, из которых изготовляются литые детали, и деформируемые, которые используются для изготовления полуфабрикатов прокаткой, прессованием, ковкой, штамповкой (полосы, листы, трубы и другие профили).
Литейные сплавы обозначаются АЛ1-АЛ13 (ГОСТ 2685-44) и отличаются низкими механическими свойствами (предел прочности от 12 до 28 кг/мм2у относительное удлинение от 0,5 до 9%).
Деформируемые алюминиевые оплавы (ГОСТ 4784-49) делятся на две группы: неупрочняющиеся термической обработкой (сплавы марки АМц, АМг) « упрочняющиеся (Д6, Д16, В95).
Упрочняющиеся оплавы (Д6, Д16) после термической обработки имеют предел прочности 42—46 кг/мм2 и относительное удлинение 15—17%. Такие сплавы обозначаются Д6Т, Д16Т.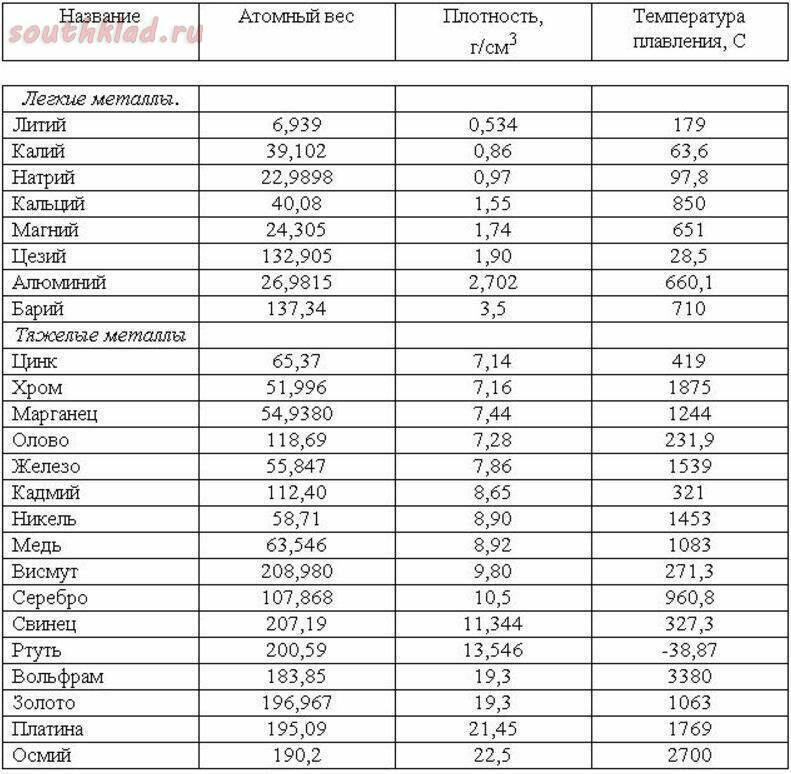
При сварке указанных упрочняющихся сплавов значительный нагрев металла в зоне, расположенной рядом со швом, приводит к понижению механических свойств (предел прочности понижается до 21—22 кг/мм2).
Магний и его сплавы. Чистый магний в машиностроении не применяется. Широко применяются сплавы магния с алюминием, марганцем, цинком. Магниевые сплавы относятся к легчайшим металлам. Их удельный вес равен 1,75—1,85 г/см3. Температура плавления 648—650° С. Магниевые сплавы удовлетворительно свариваются газовой сваркой. Они могут быть как литейные (марки МЛ1-7-МЛ6, ГОСТ 2855-45), так и деформируемые (марки МА1Ч-МА5).
Цинк — металл синевато-белого цвета. Температура плавления 419° С, температура кипения 906° С. Цинк легко окисляется, пары его весьма вредны для здоровья.
Свинец отличается большим удельным весом (11,3 г/см3), малой теплопроводностью (9% от теплопроводности меди), низкой температурой плавления (325° С), малой прочностью на разрыв (1,35 кг/мм2) и значительным относительным удлинением — 50 %.
При нагревании свинец легко окисляется, покрываясь пленкой окиси с температурой плавления 850° С.
Пары и пыль свинца очень ядовиты.
Свинец и его сплавы свариваются удовлетворительно.
Олово — мягкий и вязкий металл серебристо-белого цвета; температура плавления 232° С. Для него характерна хорошая стойкость против окисления на воздухе и слабая окисляемость в воде. Применяется для лужения посуды, изготовления припоев и различных медных сплавов.
Читайте также
Добавить комментарий
Легирование стали алюминием
В предыдущей публикации мы рассмотрели влияние некоторых химических элементов на свойства стали, а именно влияние углерода, кремния, марганца, серы, фосфора.
В данной статье мы рассмотрим такой элемент, как алюминий, и то, как его наличие отражается на свойствах стали.
Алюминий (Al) — серебристо-белый активный металл. Температура плавления 657 °С, температура кипения 1800 °С, плотность — 2,6989 г/см3.
Температура плавления 657 °С, температура кипения 1800 °С, плотность — 2,6989 г/см3.
Устойчивость к коррозии
При соприкосновении с кислородом «чистый» алюминий становится пассивным и образует на своей поверхности тонкую пленку (оксид алюминия), благодаря которой предотвращается образование коррозии, даже в агрессивной среде. Устойчивость Al к коррозии присутствует и при взаимодействии с паром и водой (пресной). Для эксплуатации в соленой воде в алюминий добавляют магний и кремний.
Он растворяется в едких щелочах, соляной и серной кислотах.
Алюминий обладает высокой теплопроводностью и электропроводностью. Благодаря таким свойствам его применяются для изготовления электрических проводов и кабеля.
Раскисление алюминием
Раскисление — снижение содержания кислорода в металле или связывание его в прочные соединения.
Алюминий является сильным раскислителем. Он широко применяется при производстве спокойной стали, да бы избежать образования пористой структуры слитка.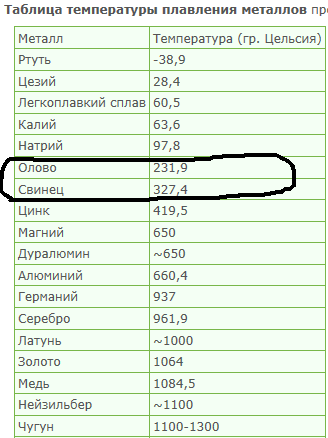
Раскисление производится на этапе выплавки стали, методом введения в металл алюминиевой проволоки, слитков или гранул.
При высоких температурах он хорошо сплавляется с металлами, образуя тем самым прочные, но легкие сплавы.
Алюминий используют с целью удаления кислорода и азота из стали после продувки, что способствует уменьшению старения.
Он способствует удалению кислорода из стали, что так же увеличивает текучесть и ударную вязкость стали.
Наличие Al влияет на размер зерен (они становятся меньше), и придает повышенную жаростойкость. Благодаря этим свойствам его широко применяют при изготовлении азотированной стали, как добавку в ферритную жароустойчивую сталь. Получение стали с мелким зерном, за счет использования алюминия — обеспечивает допустимые показатели пластичности и вязкости.
Стоит отметить, что Al обладает способностью сильно повышать значение напряженности магнитного поля, которое влияет на характеристики размагничивания ферромагнитного и ферримагнитного веществ, поэтому его применяют в качестве легирующего элемента в магнитотвердых сплавах железа, никеля, кобальта, алюминия.
Негативные свойства
Негативными факторами влияния алюминия на сталь считается:
- снижение показателей текучести стали и вероятность (на машинах непрерывной разливки стали) затягивания сталевыпускного отверстия.
- образование сложных неметаллических включений, при соединении алюминия с кислородом, Al2O3 -типа корунд, который является концентратором напряжений при последующей переработке в метизном производстве.
Т.е. существует вероятность образования оксидов алюминия, которые имеют остроугольную форму и могут быть причиной надрывов (например, при волочении катанки).
Данные факторы могут частично нейтрализоваться добавлением кальциевой проволоки (FeCa).
В заключении
В отличии от углерода, серы, фосфора, алюминий не оказывает такого явного влияния на механические характеристики стали, однако содержание алюминия менее определенного уровня ведет к повышению физических и механических свойств, и в тоже время, если алюминия менее 0,002 % — свойства ухудшаются. При содержании в легированной алюминием стали 0,02-0,7% — подавляется процесс старения стали.
При содержании в легированной алюминием стали 0,02-0,7% — подавляется процесс старения стали.
Подведя итоги всего сказанного, отметим, что главные свойства Al:
- хорошее раскисление стали;
- нейтрализация вредного влияния фосфора;
- повышение ударной вязкости стали.
Содержание алюминия менее определенного уровня ведет к повышению физических и механических свойств, и в тоже время, если алюминия менее 0,002 % — свойства ухудшаются.
Опубликовано: 05.02.2016
Физические свойства алюминия — ЛІНОКСА-УКРАЇНА
Алюминий обладает довольно широким спектром ценных свойств: низкой плотностью, высокой теплопроводностью и электропроводностью, пластичностью и коррозионной стойкостью.
Легко поддается ковке, штамповке, прокатке и транспортировке. Алюминий легко сваривается газовыми, контактными и другими способами.
Структура алюминия кубическая, центрированная, параметр а = 4,0413 Å.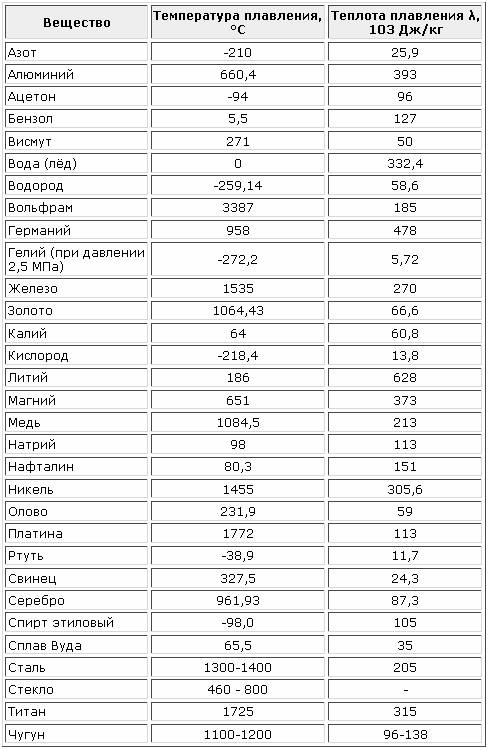
Свойства алюминия, как и всех металлов, во многом зависят от его чистоты. Свойства сверхчистого алюминия (99,996%): плотность (при температуре 20 ° С) 2698,9 кг / м3, температура плавления 660,24 ° С; температура кипения около 2500 ° С; коэффициент теплового расширения (от 20 ° до 100 ° С) 23,86 • 10-6; теплопроводность (при 190 ° С) 343 Вт / м • К [0,82 кал / (см • сек • ° С)], относительная теплоемкость (при 100 ° С) 931,98 Дж / кг • К [0, 2226 кал / (г • ° С)]; электропроводность по сравнению с медью (при 20 ° С) 65,5%. Алюминий не обладает высокой прочностью (предел прочности 50-60 Мн / м2), твердостью (170 Мн / м 2 по Бринеллю), но очень пластичен (до 50%).
Холодная прокатка увеличивает предел прочности алюминия до 115 Mn / м2, твердость до 270 Mn / m2 и относительное удлинение до 5% (1 Mn / m2 ~ и 0,1 кг / мм2). Алюминий легко полируется, анодируется и хорошо отражает свет — почти так же, как серебро (отражает до 90% энергии падающего света).
Алюминий близок к кислороду, покрыт тонкой, но очень прочной пленкой оксида Al2О3 на воздухе, который защищает металл от дальнейшего окисления и определяет его прекрасные антикоррозионные свойства. Прочность окислительной пленки и ее защитные свойства значительно снижаются при добавлении ртути, натрия, магния, меди и т. Д.
Прочность окислительной пленки и ее защитные свойства значительно снижаются при добавлении ртути, натрия, магния, меди и т. Д.
Алюминий устойчив к коррозии, вызванной воздействием атмосферы, морской и пресной воды, практически не взаимодействует с концентрированной или сильно разбавленной азотной кислотой, органическими кислотами, продуктами питания.
таблица по возрастанию в градусах, самая высокая температура плавления
plazmen.ru » Сварка » Какова температура плавления железа
Металлы и сплавы — это незаменимая основа для литейного и ювелирного производства, ковки и многих других сфер. Что бы ни делал человек из металла (какой бы это ни был процесс), для правильной работы ему нужно знать, при какой температуре плавится тот или иной металл. Мы подробно рассмотрим процесс плавления, его отличие от кипения, а также сравним температуры в таблицах.
Процесс плавления металлов.
Что такое температура плавления
Каждый металл имеет неповторимые свойства, и в этот список входит температура плавления. При плавке металл уходит из одного состояния в другое, а именно из твёрдого превращается в жидкое. Чтобы сплавить металл, нужно приблизить к нему тепло и нагреть до необходимой температуры – этот процесс и называется температурой плавления. В момент, когда температура доходит до нужной отметки, он ещё может пребывать в твёрдом состоянии. Если продолжать воздействие – металл или сплав начнет плавиться.
При плавке металл уходит из одного состояния в другое, а именно из твёрдого превращается в жидкое. Чтобы сплавить металл, нужно приблизить к нему тепло и нагреть до необходимой температуры – этот процесс и называется температурой плавления. В момент, когда температура доходит до нужной отметки, он ещё может пребывать в твёрдом состоянии. Если продолжать воздействие – металл или сплав начнет плавиться.
Плавление и кипение – это не одно и то же. Точкой перехода вещества из твердого состояния в жидкое, зачастую называют температуру плавления металла. В расплавленном состоянии у молекул нет определенного расположения, но притяжение сдерживает их рядом, в жидком виде кристаллическое тело оставляет объем, но форма теряется.
При кипении объем теряется, молекулы между собой очень слабо взаимодействуют, движутся хаотично в разных направлениях, совершают отрыв от поверхности. Температура кипения – это процесс, при котором давление металлического пара приравнивается к давлению внешней среды.
Для того, чтобы упростить разницу между критическими точками нагрева мы подготовили для вас простую таблицу:
| Свойство | Температура плавки | Температура кипения |
|---|---|---|
| Физическое состояние | Сплав переходит в расплав, разрушается кристаллическая структура, проходит зернистость | Переходит в состояние газа, некоторые молекулы могут улетать за пределы расплава |
| Фазовый переход | Равновесие между твердым состоянием и жидким | Равновесие давления между парами металла и воздухом |
| Влияние внешнего давления | Нет изменений | Изменения есть, температура уменьшается при разряжении |
При какой температуре плавится
Металлические элементы, какими бы они ни были — плавятся почти один в один. Этот процесс происходит при нагреве. Оно может быть, как внешнее, так и внутреннее. Первое проходит в печи, а для второго используют резистивный нагрев, пропуская электричество либо индукционный нагрев. Воздействие выходит практически схожее. При нагреве, увеличивается амплитуда колебаний молекул. Образуются структурные дефекты решётки, которые сопровождаются обрывом межатомных связей. Под процессом разрушения решётки и скоплением подобных дефектов и подразумевается плавление.
Воздействие выходит практически схожее. При нагреве, увеличивается амплитуда колебаний молекул. Образуются структурные дефекты решётки, которые сопровождаются обрывом межатомных связей. Под процессом разрушения решётки и скоплением подобных дефектов и подразумевается плавление.
У разных веществ разные температуры плавления. Теоретически, металлы делят на:
- Легкоплавкие – достаточно температуры до 600 градусов Цельсия, для получения жидкого вещества.
- Среднеплавкие – необходима температура от 600 до 1600 ⁰С.
- Тугоплавкие – это металлы, для плавления которых требуется температура выше 1600 ⁰С.
Плавление железа
Температура плавления железа достаточно высока. Для технически чистого элемента требуется температура +1539 °C. В этом веществе имеется примесь — сера, а извлечь ее допустимо лишь в жидком виде.
Без примесей чистый материал можно получить при электролизе солей металла.
Плавление чугуна
Чугун – это лучший металл для плавки. Высокий показатель жидкотекучести и низкий показатель усадки дают возможность эффективнее пользоваться им при литье. Далее рассмотрим показатели температуры кипения чугуна в градусах Цельсия:
Высокий показатель жидкотекучести и низкий показатель усадки дают возможность эффективнее пользоваться им при литье. Далее рассмотрим показатели температуры кипения чугуна в градусах Цельсия:
- Серый — температурный режим может достигать отметки 1260 градусов. При заливке в формы температура может подниматься до 1400.
- Белый — температура достигает отметки 1350 градусов. В формы заливается при показателе 1450.
Важно! Показатели плавления такого металла, как чугун – на 400 градусов ниже, по сравнению со сталью. Это значительно снижает затраты энергии при обработке.
Плавление стали
Плавления стали при температуре 1400 °C
Сталь — это сплав железа с примесью углерода. Её главная польза — прочность, поскольку это вещество способно на протяжении длительного времени сохранять свой объем и форму. Связано это с тем, что частицы находятся в положении равновесия. Таким образом силы притяжения и отталкивания между частицами равны.
Справка! Сталь плавится при 1400 градусах по Цельсию.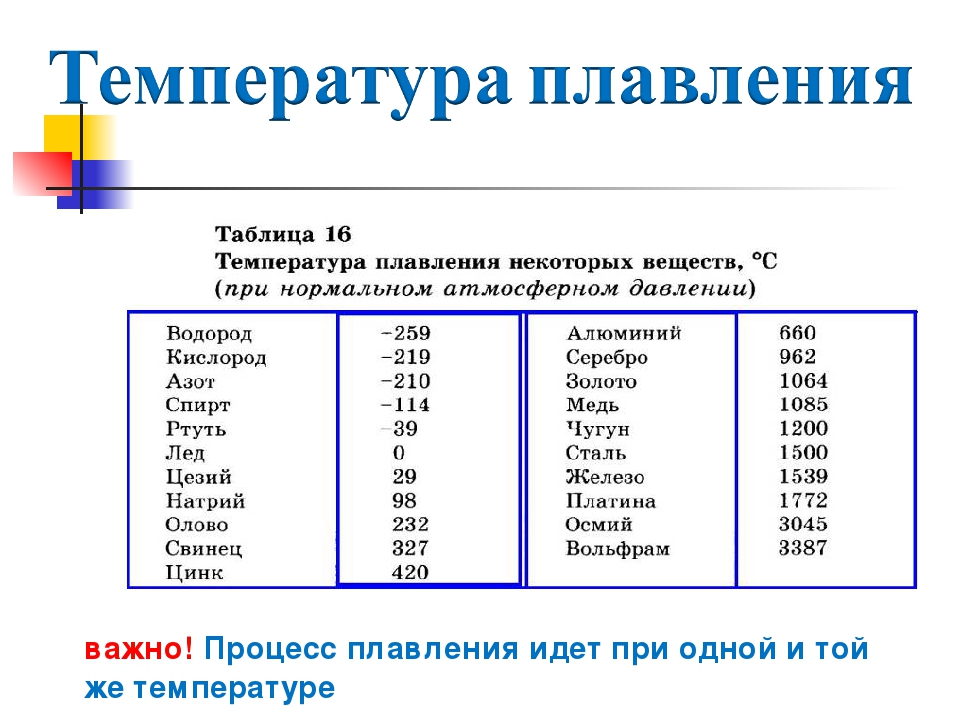
Плавление алюминия и меди
Температура плавления алюминия равна 660 градусам, это означает то, что расплавить его можно в домашних условиях.
Чистой меди – 1083 градусов, а для медных сплавов составляет от 930 до 1140 градусов.
От чего зависит температура плавления
Для разных веществ температура, при которой полностью перестраивается структура до жидкого состояния – разная. Если взять во внимание металлы и сплавы, то стоит подметить такие моменты:
- В чистом виде не часто можно встретить металлы. Температура напрямую зависит от его состава. В качестве примера укажем олово, к которому могут добавлять другие вещества (например, серебро). Примеси позволяют делать материал более либо менее устойчивым к нагреву.
- Бывают сплавы, которые благодаря своему химическому составу могут переходить в жидкое состояние при температуре свыше ста пятидесяти градусов. Также бывают сплавы, которые могут «держаться» при нагреве до трех тысяч градусов и выше.
 С учетом того, что при изменении кристаллической решетки меняются физические и механические качества, а условия эксплуатации могут определяться температурой нагрева. Стоит отметить, что точка плавления металла — важное свойство вещества. Пример этому – авиационное оборудование.
С учетом того, что при изменении кристаллической решетки меняются физические и механические качества, а условия эксплуатации могут определяться температурой нагрева. Стоит отметить, что точка плавления металла — важное свойство вещества. Пример этому – авиационное оборудование.
Термообработка, в большинстве случаев, почти не изменяет устойчивость к нагреву. Единственно верным способом увеличения устойчивости к нагреванию можно назвать внесение изменений в химический состав, для этого и проводят легирование стали.
Таблица температур плавления
Узнать какая нужна температура для плавления металлов, поможет таблица по возрастанию температурных показателей.
| Элемент или соединение | Необходимый температурный режим |
|---|---|
| Литий | +18°С |
| Калий | +63,6°С |
| Индий | +156,6°С |
| Олово | +232°С |
| Таллий | +304°С |
| Кадмий | +321°С |
| Свинец | +327°С |
| Цинк | +420°С |
Таблица плавления среднеплавких металлов и сплавов.
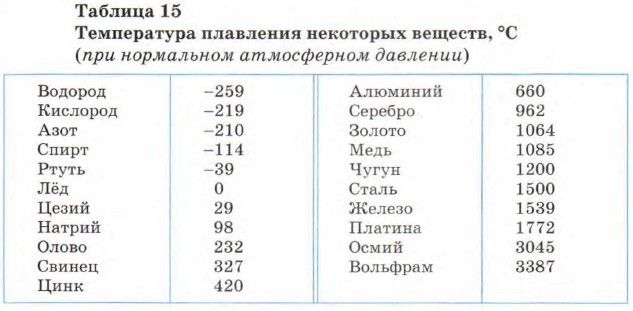
| Элемент либо сплав | Температурный режим |
|---|---|
| Магний | +650°С |
| Алюминий | +660°С |
| Барий | +727°С |
| Серебро | +960°С |
| Золото | +1063°С |
| Марганец | +1246°С |
| Медь | +1083°С |
| Никель | +1455°С |
| Кобальт | +1495°С |
| Железо | +1539°С |
| Дюрали | +650°С |
| Латуни | +950…1050°С |
| Чугун | +1100…1300°С |
| Углеродистые стали | +1300…1500°С |
| Нихром | +1400°С |
Таблица плавления тугоплавких металлов и сплавов.
| Наименование элемента | Температурный режим |
|---|---|
| Титан | +1680°С |
| Платина | +1769,3°С |
| Хром | +1907°С |
| Цирконий | +1855°С |
| Ванадий | +1910°С |
| Иридий | +2447°С |
| Молибден | +2623°С |
| Тантал | +3017°С |
| Вольфрам | +3420°С |
У какого металла самая высокая температура плавления
Вольфрам – самый тугоплавкий металл, 3422 °C (6170 °F).
Твердый, тугоплавкий, достаточно тяжелый материал светло-серого цвета, который имеет металлический блеск. Механической обработке поддается с трудом. При комнатной температуре достаточно хрупок и ломается. Ломкость металла связана с загрязнением примесями углерода и кислорода.
Примечание! Технически, чистый металл при температуре выше четырехсот градусов по Цельсию становится очень пластичным. Демонстрирует химическую инертность, неохотно вступает в реакции с другими элементами. В природе встречается в виде таких сложных минералов, как: гюбнерит, шеелит, ферберит и вольфрамит.
Вольфрам можно получить из руды, благодаря сложным химическим переработкам, в качестве порошка. Используя прессование и спекание, из него создают детали обычной формы и бруски.
Вольфрам — крайне стойкий элемент к любым температурным воздействиям. По этой причине размягчить вольфрам не могли более сотни лет. Не существовало такой печи, которая смогла бы нагреться до нескольких тысяч градусов по Цельсию. Ученым удалось доказать, что это самый тугоплавкий металл. Хотя бытует мнение, что сиборгий, по некоторым теоретическим данным, имеет большую тугоплавкость, но это лишь предположение, поскольку он является радиоактивным элементом и у него небольшой срок существования.
Ученым удалось доказать, что это самый тугоплавкий металл. Хотя бытует мнение, что сиборгий, по некоторым теоретическим данным, имеет большую тугоплавкость, но это лишь предположение, поскольку он является радиоактивным элементом и у него небольшой срок существования.
▷ Какова температура плавления алюминия? 🥇 cultmir.ru
Алюминий – это металл, который находится во втором ряду, а группа 13 – в таблице Менделеева. Это третий самый распространенный элемент после кислорода и кремния, который можно найти в земной коре. Алюминий встречается в природе в соединениях, но никогда не в виде чистого металла. Процесс извлечения алюминия из его соединений сложный и довольно сложный. Алюминий является полезным и распространенным металлом, который известен своим легким весом, пластичностью и устойчивостью к коррозии. Алюминий легче утилизировать, чем очищать от руд. Это также достаточно безопасно, когда он вступает в контакт с кожей и используется вокруг пищи.
Какова температура плавления алюминия?
Точка плавления вещества определяется как температура, при которой вещество изменяется от твердого до жидкого состояния, но при определенном атмосферном давлении. Именно в точке плавления жидкое и твердое состояния вещества находятся в равновесии. Однако температура плавления вещества в основном зависит от давления; он часто специфичен при стандартном давлении в стандартных материалах. Точка плавления вещества также называется ликвидусом, температурой сжижения или солидусом. Температура плавления алюминия составляет 659 градусов по Цельсию или 1218 по Фаренгейту.
Именно в точке плавления жидкое и твердое состояния вещества находятся в равновесии. Однако температура плавления вещества в основном зависит от давления; он часто специфичен при стандартном давлении в стандартных материалах. Точка плавления вещества также называется ликвидусом, температурой сжижения или солидусом. Температура плавления алюминия составляет 659 градусов по Цельсию или 1218 по Фаренгейту.
Какова цель определения температуры плавления вещества?
Температура плавления вещества является существенным физическим свойством. Основная цель определения температур кипения и плавления веществ во время лабораторного эксперимента состоит в том, чтобы использовать результаты, чтобы помочь идентифицировать примеси в этих веществах или неизвестных веществах. Точку плавления неизвестного твердого вещества можно использовать для его идентификации, сравнивая его с множеством других потенциальных твердых веществ и их температур плавления, таким образом, подбирая соответствие для идентификации твердого тела. Кроме того, цель определения температуры плавления вещества состоит в том, чтобы использовать диапазон его температур плавления, чтобы помочь определить его общую чистоту. В связи с этим, чем больше диапазон плавления вещества, тем менее чистым является вещество, в то время как чем больше диапазон температур плавления уменьшается, тем чище вещество.
Кроме того, цель определения температуры плавления вещества состоит в том, чтобы использовать диапазон его температур плавления, чтобы помочь определить его общую чистоту. В связи с этим, чем больше диапазон плавления вещества, тем менее чистым является вещество, в то время как чем больше диапазон температур плавления уменьшается, тем чище вещество.
Факторы, влияющие на температуру плавления веществ
Температура плавления вещества варьируется от одного вещества к другому. Например, в то время как кислород тает при температуре 218 градусов по Цельсию, лед тает при температуре 0 градусов по Цельсию, а алюминий – 219 градусов по Цельсию. Поэтому определенные вещи влияют на температуры плавления разных веществ. Факторы, влияющие на температуру плавления веществ, включают межмолекулярные силы, изменения температуры плавления ионных связей, форму молекул и размер молекул. Чистое соединение, которое является кристаллическим, обычно имеет более точную температуру плавления, поэтому полностью плавится в небольшом диапазоне температур, не превышающем 0,5-1 градуса Цельсия. Если такое вещество содержит даже малейшее количество примесей, в точках замерзания обычно образуется углубление, показывающее увеличение ширины диапазона температур плавления. Если диапазон температур плавления превышает пять градусов, то это означает, что вещество является нечистым ,
Если такое вещество содержит даже малейшее количество примесей, в точках замерзания обычно образуется углубление, показывающее увеличение ширины диапазона температур плавления. Если диапазон температур плавления превышает пять градусов, то это означает, что вещество является нечистым ,
Использование алюминия
Алюминий – один из самых полезных металлов в мире. В чистом виде алюминий в основном используется в электронной промышленности для изготовления жестких дисков, проводниковых дорожек на кремниевых чипах и конденсаторной фольги. Когда металл легируется другими металлами, такими как кремний, цинк, медь и магний, он становится еще прочнее. Еще одним важным применением алюминия является производство банок для напитков и фольги, используемой для защиты продуктов питания и различных кухонных принадлежностей.
АЛЮМИНИЙ
АЛЮМИНИЙАЛЮМИНИЙ
THE ОСНОВЫ
Алюминий встречается в земной коре в больших количествах, чем любой другой
металл. Однако это не бесплатно, а это означает, что людям очень трудно
получить в пригодном для использования виде. Как металл, используемый для многих вещей, он
ценный металл, который можно добыть. Так
Как нам это получить?
Однако это не бесплатно, а это означает, что людям очень трудно
получить в пригодном для использования виде. Как металл, используемый для многих вещей, он
ценный металл, который можно добыть. Так
Как нам это получить?
Как выглядит алюминий?
Алюминий — серебристо-белый металл, из которого очень легко сформовать проволоку или другие полезные формы.
Немного круто Применение для алюминия
Несколько интересных сайтов, которые может быть интересно взглянуть на:
www.ibiblio.org/lou/ball/chronicle: Чувак, который ведет этот сайт, сделал клубок из алюминиевых оберток (Aluminium конечно), что теперь весит три фунта!
www.ntos.demon.co:uk/ball/htm: На этом сайте рассказывается о росте мяча, сделанного из оберток Kit-Kat.
http: /zapatopi. net: «Эффективное и недорогое решение для борьбы с контролем над разумом». У тебя будет
чтобы убедиться.
net: «Эффективное и недорогое решение для борьбы с контролем над разумом». У тебя будет
чтобы убедиться.
ТО ОСНОВЫ
Атомный номер: 13
Атомная масса: 26.9815
Электронная конфигурация основного состояния: [Ne} 3s23p1
Изотоп природного происхождения: 27
| Изотоп | Половина Жизнь | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| АЛ-26 | 730000.5 лет и это самый долгоживущий
известный изотоп. Это бета- и гамма-излучатель, встречается в
метеоры. А в августе 1997 г. был виден яркий метеор Персеида Температура плавления алюминия составляет 933,47 Кельвина, 660,32 градуса Цельсия или 1220,58 градусов по Фаренгейту. Это нормальная температура кипения 2792 Кельвина, 2579 градусов Цельсия или 4566
градусов по Фаренгейту. Показанная кристаллическая структура алюминия является кубической плотнейшей упаковкой. здесь. Алюминий добывается в огромных количествах, так как составной боксит (Al2O3 * h3O). Бокситы также содержат другие примеси и поэтому процесс Байера используется для очистки бокситов и выделения алюминия. Алюминий обычно доступен в виде прутков, листьев, порошка, листов или проволоки. Алюминий может быть легирован медью, магнием или кремний среди других элементов, чтобы сделать его прочнее. Эти сплавы затем могут быть используется для современных самолетов и ракет.для информации о том, что Америка делает в область исследования космоса, посетите www.nasa.gov Может также использоваться в качестве защитного покрытия для видимого света и лучистого
высокая температура. А алюминиевое покрытие не портится, как другие покрытия. Этот
покрытие используется на зеркалах телескопов, декоративной бумаге, упаковках и игрушках. Источники информации CRC Справочник по химии и физике www.weblements.com www.chemicalelements.com Энциклопедия Encarta
Алюминий — Точка плавления — Точка кипенияАлюминий — точка плавления и температура кипенияТемпература плавления алюминия 660 ° C . Температура кипения алюминия 2467 ° C . Обратите внимание, что эти точки связаны со стандартным атмосферным давлением. Точка кипения — насыщение В термодинамике термин насыщение определяет состояние, при котором смесь пара и жидкости может существовать вместе при заданных температуре и давлении. Температура, при которой начинает происходить испарение (кипение) для данного давления, называется температурой насыщения или точкой кипения . Точка плавления — насыщение В термодинамике точка плавления определяет состояние, при котором твердое тело и жидкость могут находиться в равновесии. Добавление тепла превратит твердое вещество в жидкость без изменения температуры.Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда рассматривается как температура обратного перехода от жидкости к твердому телу, она упоминается как точка замерзания или точка кристаллизации. Алюминий — Свойства
– Температура плавления алюминия — thyssenkrupp Materials (Великобритания) Алюминий — один из самых распространенных металлов в земной коре. При какой температуре плавится алюминий?Алюминий имеет более высокую температуру плавления по сравнению с другими металлами, такими как медь, железо и латунь. В чистом виде его температура плавления составляет примерно 660 градусов по Цельсию или 1220 градусов по Фаренгейту. Температура плавления оксида алюминия выше, чем у алюминия в чистом виде. Оксид алюминия плавится примерно при 2000 градусах Цельсия. Вот почему извлечение алюминия из оксида алюминия осуществляется путем электролиза перед плавлением металла. Что касается плавления, то алюминий имеет температуру кипения примерно 2467 градусов Цельсия. Точки плавления и кипения алюминия являются важными факторами, учитывая, что металл обладает исключительными способностями к переработке и может использоваться по-разному без потерь. Почему важно определять температуру плавления алюминия?Температура плавления алюминия или любого другого вещества в этом отношении является важным физическим свойством.Определение точки плавления алюминия помогает идентифицировать примеси в металле или идентифицировать другие неизвестные вещества. Температура плавления также помогает определить общую чистоту металла. При переработке алюминия, если он имеет широкий диапазон плавления, это означает, что в нем больше примесей. Чем больше уменьшается диапазон температур плавления, тем чище вещество. Факторы, влияющие на температуру плавления алюминияВышеуказанная точка плавления соответствует постоянству всех факторов.Но, в зависимости от различных аспектов, температура плавления алюминия может меняться. Если алюминий содержит примеси, температура плавления выше. Также есть вероятность, что она будет варьироваться в широком диапазоне температур. К другим факторам, которые могут повлиять на температуру плавления алюминия и других веществ, относятся состав молекул, насколько плотно атомы упакованы вместе, и приложение давления во время процесса нагрева. Расплавленный алюминий можно формовать и использовать для изготовления одинаковых или разных продуктов. Из-за того, что алюминий легко перерабатывается, его можно плавить и использовать повторно без каких-либо потерь. Помимо того, что это самый распространенный металл, он также является одним из самых экономичных. См. Также: Алюминий магнитный? термодинамика — Как литейные производства предотвращают выкипание цинка при легировании алюминием? Когда сплавы изготавливаются путем смешивания расплавленных металлов (на самом деле сплав должен содержать только один металл и, по крайней мере, одно другое соединение, металл или нет), металлы необходимо нагреть только до их точки плавления, а не полностью до точки кипения. Резюме, TL; DR: Я надеюсь, что приведенный мной пример отвечает на ваш вопрос. Пожалуйста, не стесняйтесь спрашивать какие-либо разъяснения в комментариях ниже.
Температуры плавления металлов | Инженеры EdgeСвязанные ресурсы: материалы Температура плавления металлаИнженерные материалы Точка плавления (или, реже, точка разжижения) твердого вещества — это температура, при которой вещество меняет свое состояние с твердого на жидкое при атмосферном давлении.В точке плавления твердая и жидкая фазы находятся в равновесии. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда рассматривается как температура обратного перехода от жидкости к твердому телу, она упоминается как точка замерзания или точка кристаллизации.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


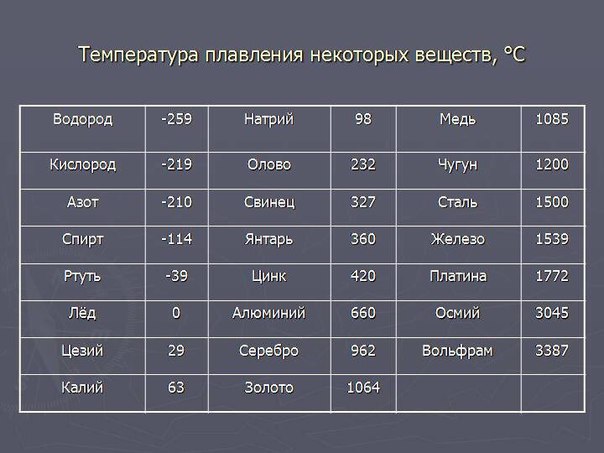


 Вот и все. Процесс завершен.
Вот и все. Процесс завершен. На сегодняшний день наиболее популярной является плавка алюминия в пламенных отражательных печах, которые работают на углеродистом топливе, и в электрических печах.
На сегодняшний день наиболее популярной является плавка алюминия в пламенных отражательных печах, которые работают на углеродистом топливе, и в электрических печах.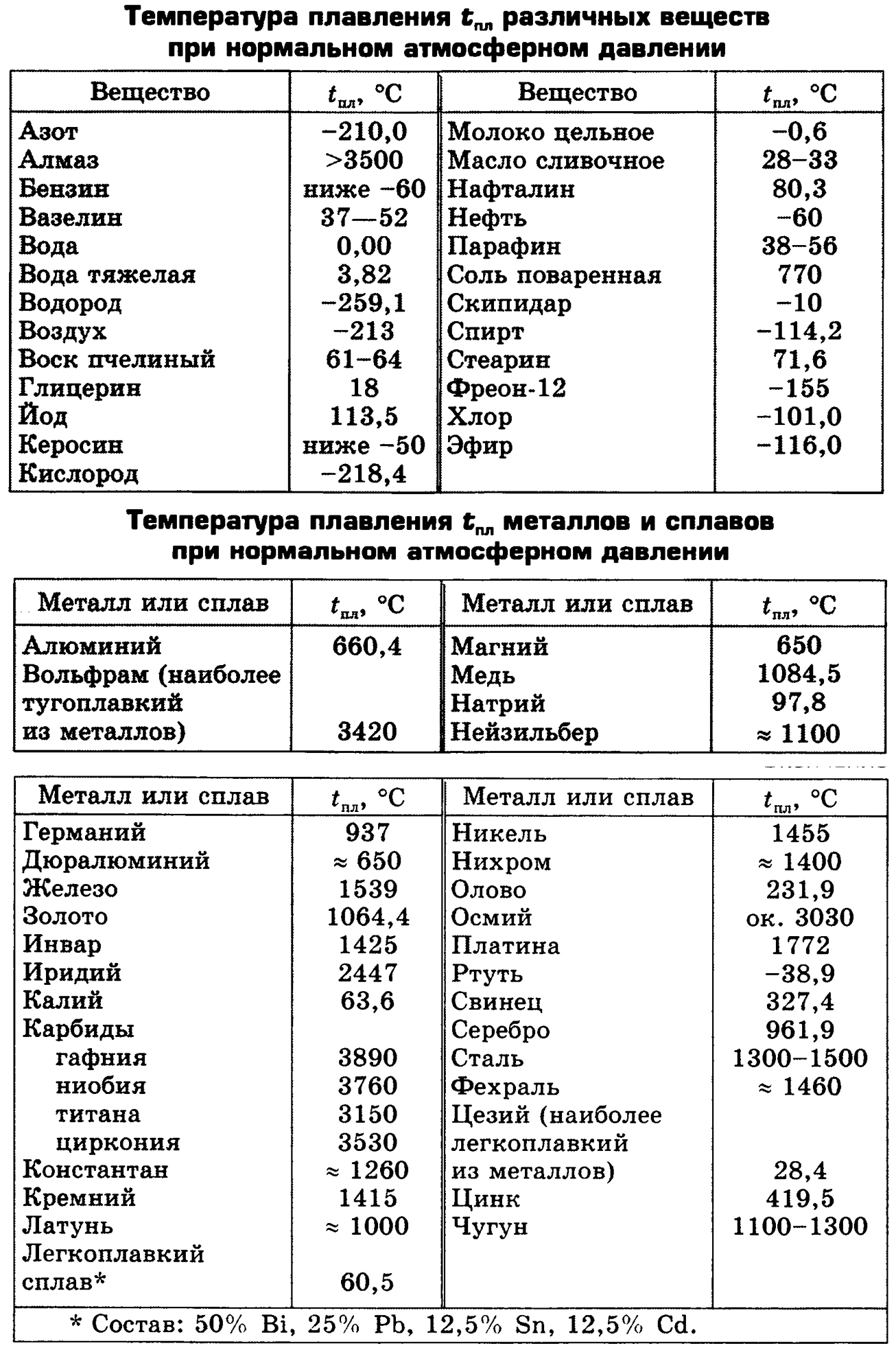 Таким же преимуществом отличаются тигельные индукционные электропечи, в которых по технологическим требованиям в тигле по окончанию каждой плавки остается некоторое количество жидкого металла, примерно 20—35% от емкости тигля печи.Важное свойство жидкого алюминия и его сплавов заключается в его способности поглощать газы, в особенности водород. В пламенных печах много водорода собирается в топочных газах. Помимо этого, в плавильные печи всех видов его можно внести сырой шихтой.
Таким же преимуществом отличаются тигельные индукционные электропечи, в которых по технологическим требованиям в тигле по окончанию каждой плавки остается некоторое количество жидкого металла, примерно 20—35% от емкости тигля печи.Важное свойство жидкого алюминия и его сплавов заключается в его способности поглощать газы, в особенности водород. В пламенных печах много водорода собирается в топочных газах. Помимо этого, в плавильные печи всех видов его можно внести сырой шихтой. Сверху нужно будет поставить емкость для плавки
Сверху нужно будет поставить емкость для плавки
 Название происходит от названия немецкого города Дюрен, где в 1906 году был впервые получен этот высокопрочный сплав алюминия. Одной из его особенностей является тот факт, что его прочностные характеристики с течением времени имеют тенденцию к увеличению. Поэтому он не теряет своей прочности после нескольких лет эксплуатации, как другие металлы. В настоящее время этот сплав является основой самолётостроения.
Название происходит от названия немецкого города Дюрен, где в 1906 году был впервые получен этот высокопрочный сплав алюминия. Одной из его особенностей является тот факт, что его прочностные характеристики с течением времени имеют тенденцию к увеличению. Поэтому он не теряет своей прочности после нескольких лет эксплуатации, как другие металлы. В настоящее время этот сплав является основой самолётостроения.



 С учетом того, что при изменении кристаллической решетки меняются физические и механические качества, а условия эксплуатации могут определяться температурой нагрева. Стоит отметить, что точка плавления металла — важное свойство вещества. Пример этому – авиационное оборудование.
С учетом того, что при изменении кристаллической решетки меняются физические и механические качества, а условия эксплуатации могут определяться температурой нагрева. Стоит отметить, что точка плавления металла — важное свойство вещества. Пример этому – авиационное оборудование.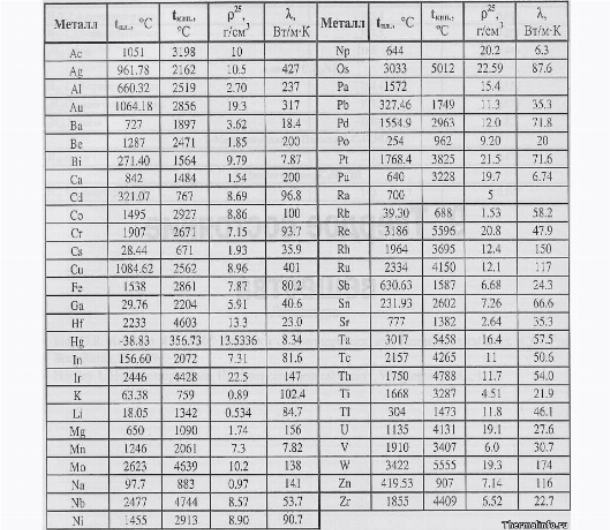 -3 при 293 К
-3 при 293 К  Это
также можно использовать на солнцезащитных очках, например, в очень популярной линии Oakley Polarized.
оттенки. Чтобы увидеть самые крутые очки, посетите сайт www.oakley.com
Это
также можно использовать на солнцезащитных очках, например, в очень популярной линии Oakley Polarized.
оттенки. Чтобы увидеть самые крутые очки, посетите сайт www.oakley.com 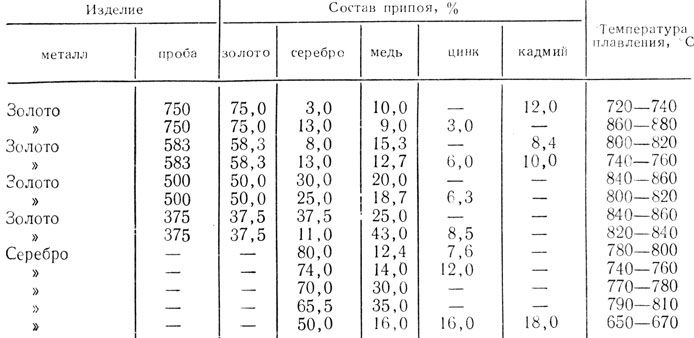 В конце это эм или нум? Оказывается, у нас, британцев, на лицах может быть яйцо, а также немного того, что мы называем алюминием.
В конце это эм или нум? Оказывается, у нас, британцев, на лицах может быть яйцо, а также немного того, что мы называем алюминием. И в то время как железо ржавеет под воздействием элементов, алюминий образует микроскопически тонкий оксидный слой, защищающий его поверхность от дальнейшей коррозии. С этим внушительным резюме неудивительно, что алюминий можно найти во многих других транспортных средствах, включая корабли, автомобили, грузовики, поезда и велосипеды.
И в то время как железо ржавеет под воздействием элементов, алюминий образует микроскопически тонкий оксидный слой, защищающий его поверхность от дальнейшей коррозии. С этим внушительным резюме неудивительно, что алюминий можно найти во многих других транспортных средствах, включая корабли, автомобили, грузовики, поезда и велосипеды.
 Примечательно, что еще один 22-летний француз, Поль Луи Туссен Эру, открыл точно такую же электролитическую технологию почти в то же время, что спровоцировало трансатлантическую гонку патентов. Их наследие, закрепленное как процесс Холла-Эру, остается основным методом производства алюминия в промышленных масштабах — в настоящее время ежегодно производится миллионы тонн алюминия из самой богатой алюминиевой руды, бокситов.
Примечательно, что еще один 22-летний француз, Поль Луи Туссен Эру, открыл точно такую же электролитическую технологию почти в то же время, что спровоцировало трансатлантическую гонку патентов. Их наследие, закрепленное как процесс Холла-Эру, остается основным методом производства алюминия в промышленных масштабах — в настоящее время ежегодно производится миллионы тонн алюминия из самой богатой алюминиевой руды, бокситов. Но, пожалуй, наиболее узнаваемым воплощением алюминия является алюминиевая банка для напитков, сотни миллиардов штук которой производятся ежегодно. Естественно глянцевая поверхность каждой банки служит привлекательным фоном для названия продукта, и хотя ее тонкие стенки могут выдерживать давление до 90 фунтов на квадратный дюйм (в три раза больше, чем в обычной автомобильной шине), к содержимому можно легко получить доступ с помощью просто потяните за язычок. И хотя рафинирование алюминия поглощает значительную часть мировой электроэнергии, алюминиевые банки можно повторно использовать экономично и многократно, каждый раз экономя почти 95% энергии, необходимой для плавки металла.
Но, пожалуй, наиболее узнаваемым воплощением алюминия является алюминиевая банка для напитков, сотни миллиардов штук которой производятся ежегодно. Естественно глянцевая поверхность каждой банки служит привлекательным фоном для названия продукта, и хотя ее тонкие стенки могут выдерживать давление до 90 фунтов на квадратный дюйм (в три раза больше, чем в обычной автомобильной шине), к содержимому можно легко получить доступ с помощью просто потяните за язычок. И хотя рафинирование алюминия поглощает значительную часть мировой электроэнергии, алюминиевые банки можно повторно использовать экономично и многократно, каждый раз экономя почти 95% энергии, необходимой для плавки металла.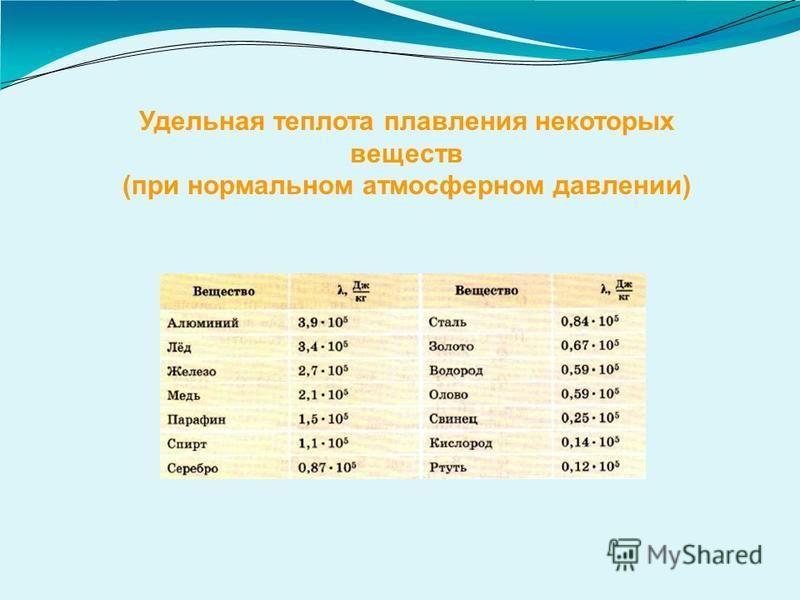 Людям не нужен алюминий, но он попадает в наш организм каждый день — он содержится в воздухе, которым мы дышим, в воде, которую мы пьем, и в пище, которую мы едим.Хотя в пищевых продуктах обычно присутствует небольшое количество алюминия, мы отвечаем за основные источники пищевого алюминия: пищевые добавки, такие как разрыхлители, эмульгаторы и красители. Проглатывание антацидов, отпускаемых без рецепта, может повысить уровень их потребления в несколько тысяч раз. И многие из нас ежедневно наносят дезодоранты, содержащие алюминий, непосредственно на кожу. Что беспокоит, так это то, что несколько исследований выявили, что алюминий является фактором риска как рака груди, так и болезни Альцгеймера.Хотя большинство экспертов по-прежнему не убеждены в доказательствах, алюминий в высоких концентрациях является доказанным нейротоксином, в первую очередь влияющим на кости и мозг. Итак, пока не будут проведены дополнительные исследования, жюри останется открытым. Теперь, возможно, это то, что вас беспокоит во время следующего дальнемагистрального полета.
Людям не нужен алюминий, но он попадает в наш организм каждый день — он содержится в воздухе, которым мы дышим, в воде, которую мы пьем, и в пище, которую мы едим.Хотя в пищевых продуктах обычно присутствует небольшое количество алюминия, мы отвечаем за основные источники пищевого алюминия: пищевые добавки, такие как разрыхлители, эмульгаторы и красители. Проглатывание антацидов, отпускаемых без рецепта, может повысить уровень их потребления в несколько тысяч раз. И многие из нас ежедневно наносят дезодоранты, содержащие алюминий, непосредственно на кожу. Что беспокоит, так это то, что несколько исследований выявили, что алюминий является фактором риска как рака груди, так и болезни Альцгеймера.Хотя большинство экспертов по-прежнему не убеждены в доказательствах, алюминий в высоких концентрациях является доказанным нейротоксином, в первую очередь влияющим на кости и мозг. Итак, пока не будут проведены дополнительные исследования, жюри останется открытым. Теперь, возможно, это то, что вас беспокоит во время следующего дальнемагистрального полета.
 Я Крис Смит, спасибо за внимание и до свидания.
Я Крис Смит, спасибо за внимание и до свидания. Давление, при котором начинается испарение (кипение) для данной температуры, называется давлением насыщения. Если рассматривать температуру обратного перехода от пара к жидкости, то ее называют точкой конденсации.
Давление, при котором начинается испарение (кипение) для данной температуры, называется давлением насыщения. Если рассматривать температуру обратного перехода от пара к жидкости, то ее называют точкой конденсации. е.м.]
е.м.] Он имеет ряд применений, включая использование в кухонной посуде, в промышленности, строительстве, на транспорте и в аэрокосмической отрасли.Его способность противостоять коррозии и подвергаться вторичной переработке являются ключевыми характеристиками.
Он имеет ряд применений, включая использование в кухонной посуде, в промышленности, строительстве, на транспорте и в аэрокосмической отрасли.Его способность противостоять коррозии и подвергаться вторичной переработке являются ключевыми характеристиками. Плавление алюминия имеет жизненно важное значение в процессе переработки.
Плавление алюминия имеет жизненно важное значение в процессе переработки. Это называется понижением температуры плавления. Если алюминий чистый, диапазон температур плавления колеблется в пределах одного или двух градусов Цельсия. Если температура плавления изменяется более чем на пять градусов по Цельсию, это доказывает наличие примесей.
Это называется понижением температуры плавления. Если алюминий чистый, диапазон температур плавления колеблется в пределах одного или двух градусов Цельсия. Если температура плавления изменяется более чем на пять градусов по Цельсию, это доказывает наличие примесей. oC} $, оба металла непременно расплавятся. Но при такой высокой температуре жидкий цинк также выкипит, а пар окислится на воздухе. В этом случае принят метод, заключающийся в том, чтобы сначала нагреть металл с более высокой температурой плавления, а именно медь. Когда она расплавляется, добавляется твердый цинк, который быстро растворяется в жидкой меди до того, как выкипит очень много цинка. Даже в этом случае при изготовлении латуни необходимо делать поправку на неизбежную потерю цинка, которая составляет около одной двадцатой части цинка.Следовательно, при взвешивании металлов перед легированием необходимо добавить дополнительное количество цинка.
oC} $, оба металла непременно расплавятся. Но при такой высокой температуре жидкий цинк также выкипит, а пар окислится на воздухе. В этом случае принят метод, заключающийся в том, чтобы сначала нагреть металл с более высокой температурой плавления, а именно медь. Когда она расплавляется, добавляется твердый цинк, который быстро растворяется в жидкой меди до того, как выкипит очень много цинка. Даже в этом случае при изготовлении латуни необходимо делать поправку на неизбежную потерю цинка, которая составляет около одной двадцатой части цинка.Следовательно, при взвешивании металлов перед легированием необходимо добавить дополнительное количество цинка. Один из способов минимизировать (но не исключить) потери более летучего металла — быстро растворить его в тугоплавком металле и затем охладить раствор.Хотя это не исключает потерь из-за улетучивания, это может значительно уменьшить проблему. И на самом деле, поскольку сплавы часто состоят преимущественно из одного металла, на практике все равно нередко растворять меньшие компоненты в первичном компоненте.
Один из способов минимизировать (но не исключить) потери более летучего металла — быстро растворить его в тугоплавком металле и затем охладить раствор.Хотя это не исключает потерь из-за улетучивания, это может значительно уменьшить проблему. И на самом деле, поскольку сплавы часто состоят преимущественно из одного металла, на практике все равно нередко растворять меньшие компоненты в первичном компоненте.


 Смещение этого факта заключается в том, что внешний электрон алюминия находится на 3p-орбитали, а не на 3s.
Смещение этого факта заключается в том, что внешний электрон алюминия находится на 3p-орбитали, а не на 3s.



 Первые три — металлические, кремний — гигантский ковалентный, а остальные — простые молекулы.
Первые три — металлические, кремний — гигантский ковалентный, а остальные — простые молекулы.
 Что касается фосфора, я беру обычный белый фосфор. Что касается серы, я предполагаю одну из кристаллических форм — ромбическую или моноклинную серу.
Что касается фосфора, я беру обычный белый фосфор. Что касается серы, я предполагаю одну из кристаллических форм — ромбическую или моноклинную серу.






 0
0 2
2