Цвета побежалости | Всё о цветных металлах и сплавах (бронза, медь, латунь и др)
23 декабря, 2018 · 8:19 дп
Цвета побежалости – это радужные разводы соломенного, золотистого, пурпурного, фиолетового и других цветов и оттенков на чистой поверхности нагретого металла, возникающие в результате появления тонкого слоя оксидов. Тонкая оксидная пленка толщиной в несколько молекул возникает на поверхности чистого металла под воздействием локального источника тепла. Цвет зависит от толщины оксидной пленки, поскольку окислы различной толщины по-разному отражают свет.
Этот термин чаще всего используют в металлообработке, термообработке стали.
Например, при сварке металла создаются достаточно высокие температуры для образования цветов побежалости. В технической сварке этого необходимо избегать, так как цвета побежалости ухудшают внешний вид изделий и считаются браком. Однако известно использование цветов побежалости как художественного приема мастерами декоративной сварки. Также цвета побежалости применяют при лазерной маркировке изделий.
Для углеродистой стали характерны следующие переходы цвета: соломенный (+220°C), коричневый (+240°C), пурпурный (+260°C), синий (+300°C), светло-серый (+330-350°С).
Для нержавеющих сталей изменение цвета при нагреве на воздухе наблюдается: светло-соломенный (+300°C), соломенный (+400°C), красно-коричневый (+500°C), фиолетово-синий (+600°C), синий (+700°C). Нередко цвета побежалости на нержавеющей стали путают с радужной окраской, которая может возникать при температурах не выше +100°C (кипение воды). Однако радужная окраска не связана с перегревом стали.
Евгений Лавриненко (dN)
Понравилось это:
Нравится Загрузка…
Похожее
Filed under Интересные факты
Tagged as металлобработка
Как сделать цвета побежалости более яркими? — Термообработка
Если как на картинке, то точно так-же, как и на ней, при помощи фотошопа. А если вживую — тщательно подготовить поверхность. Желательно отполировать. Затем обезжирить. И уже потом греть. Получившуюся оксидную плёнку нужно защитить, иначе долго не протянет. Если получать её на предмете с картинки, тем более долго не протянет. Поскольку глюкофон имеет постоянный контакт с руками, без какого-либо защитного покрытия, оксидная плёнка на нём выдержит пару часов эксплуатации максимум. Кароче, лаком дунуть надо поверх обязательно. По идее, на издаваемых звуках тонкий слой лака сильно не отразится. По крайней мере, видел и слышал просто окрашенные эмалью — вполне себе звучат. Так-же цвета побежалости вполне можно получить химическим путём. Рецептов масса. В интернете есть целые кучи, начиная от классических патин и заканчивая японскими. Рецепты наших патин более понятны и ингредиенты для их приготовления вполне доступны. Но мне почему-то понравилось несколько именно японских рецептов. К сожалению, этим вопросом занимался очень давно, конкретных рецептур по памяти не вспомню. Но было дело, доводилось получать на полированной стали фиолетовые оттенки, так по какому-то японскому рецепту поверхность получалась не просто фиолетовой, а очень насыщенно фиолетовой, аж бархатистой. Выглядело весьма эпично, результат меня тогда сильно впечатлил. В америкосии это даже целое направление хобби у людей. Кто-то марки собирает, кто-то модельки корабликов клеит, а кто-то целыми днями всякие металлы во всякую химию макает и результатам радуется. Погуглите, мне когда-то пара форумов попадалась буржуйских, где они там своими результатами по этой теме делятся и рецептуру выкладывают. В основном конечно народ забавляется с цветными металлами, ну, или например оксидирование титана (как и его анодирование) шибко развиты, но если хорошо порыться, то и для стали рецептов хватает. Или скачайте книжку какую-нибудь. Например:

Визуальные признаки термических поражений на конструкциях из металлов и сплавов.
⇐ ПредыдущаяСтр 13 из 17Следующая ⇒
Деформации
Деформации стальных конструкций наблюдаются почти на любом пожаре.
Известно, что нагрев стали
выше 300-350оС приводит к заметному повышению ее пластичности и сопровождается снижением прочности, у стали могут появиться заметные деформации,
при 500-600оС прочность углеродистой стали снижается вдвое, деформации нагруженных элементов стальных конструкций значительны по величине и 15-20 минутный нагрев может привести к их обрушению.
Температура 450-500 оС считается температурой потери несущей способности стальных изделий.
при 1000оС прочность стали снижается в 10 раз ,
Температура потери несущей способности конструкций из алюминиевых сплавов составляет 250 оС.
Что значит потеря несущей способности у металлоконструкции? В чем она проявляется? Конечно, конструкция не ломается; в первую очередь она гнется, деформируется. Эти деформации при осмотре места пожара можно увидеть и нужно оценить.
Оценка величины и направленности деформаций дает важную информацию об относительной интенсивности и направленности теплового воздействия в тех или иных зонах.
Визуальные признаки деформации, которые следует фиксировать и оценивать:
1. Направление деформации металлических элементов. Металлоконструкции и их отдельные элементы деформируются, как правило, в сторону наибольшего нагрева. Кстати, это свойство не только металлов, но и многих других негорючих материалов, например, стекла.
2. Величина деформации.
С чисто теоретической точки зрения, величина деформации конструкции должна быть пропорциональна температуре и длительности ее нагрева. Поэтому, казалось бы, очевидно, что на месте пожара наиболее «горячей» зоной можно считать ту, в которой металлоконструкция имеет наибольшую деформацию. Однако наибольшая деформация происходит не всегда там, где имела место наибольшая температура или наиболее интенсивный нагрев. Она может быть и там, где конструктивный элемент имеет наибольшую степень свободы или более высокую нагрузку. Если, например, стальная балка перекрытия имеет наибольшую деформацию посередине пролета, то это еще не значит, что именно в этой точке был наиболее интенсивный нагрев — просто здесь на балку действует наибольший изгибающий момент. И тем не менее, на рассредоточенных по зоне горения однотипных и относительно одинаково нагруженных конструкциях оценить степень деформации в сравнении друг с другом очень полезно. Это (при относительно равномерной пожарной нагрузке в помещении) можно рассматривать как явный признак направленности распространения горения.
Чтобы количественно оценить степень деформации, рассчитывают так называемую величину относительной деформации. Это отношение величины прогиба к величине участка конструкции, на которой этот прогиб наблюдается (b/l) (рисунок).
Величина b/l для однотипных конструкций наносится на план места пожара. Такая информация в первом приближении характеризует распределение зон термических поражений на месте пожара и может быть использована в поисках его очага. Эти данные относятся к группе последовательно нарастающих (убывающих) термических поражений.
Требуют серьезного внимания локальные деформации металлоконструкций на отдельных участках, т.е. произвольно расположенные термические поражения. Четко выраженные и значительные по величине локальные деформации возникают, как правило, на начальной стадии пожара, когда горения во всем объеме помещения еще нет и конструкции нагреваются от очага пожара в ограниченной локальной зоне. Если указанное локальное термическое поражение не находит объяснения – оно должно восприниматься как очаговый признак.
Б. Образование окислов на поверхности металла.
Алюминий и его сплавы.
Известно, что на поверхности алюминия и его сплавов уже при комнатных температурах существует микронной толщины окисный слой, который предохраняет алюминий от окисления. Окисел этот выполняет свою функцию и при нагреве алюминиевого изделия на пожаре, вплоть до достижения температуры плавления алюминия. Какой-либо полезной экспертной информации из исследования окисного слоя на алюминии извлечь не удается.
Медь
На поверхности медных изделий до температуры примерно 100 оС — присутствует черная пленка окисла (CuO, окись меди). При нагреве выше 100 оС и достаточной длительности — образуется пленка закиси меди — красного цвета (Cu2O). Это обстоятельство дает возможность в отдельных ситуациях оценивать, превышала ли температура в зоне, где находится медное изделие, указанную температуру.
Сталь
Если поверхность обработанная, гладкая, то первый признак теплового воздействия, который можно обнаружить визуально — цвета побежалости. Они появляются при нагревании стали до температуры 200-300 оС благодаря образованию на ее поверхности пленки окисла микронной толщины. Толщина слоя окисла зависит от температуры, а за счет интерференции света с изменением толщины пленки меняется ее цвет. Таким образом, получается, что цвет пленки окисла («цвет побежалости») зависит от температуры нагрева стали и может использоваться для ее определения. Существует примерно следующая цветовая шкала цветов побежалости на сталях.
| Цвет побежалости | Толщина слоя окисла Мкм | Температура нагрева оС |
| Светло-желтый | 0,04 | 220-230 |
| Соломенно-желтый | 0,045 | 230-240 |
| Оранжевый | 0,05 | 240-260 |
| Красно-фиолетовый | 0,065 | 260-280 |
| Синий | 0,07 | 280-300 |
Следует отметить, что оценка нагрева металлических конструкций по цветам побежалости при поисках очага пожара используется редко. Чаще это делается при установлении причин пожаров, связанных с трением, локальным перегревом в технологических установках, двигателях и т.д.
Окалина.
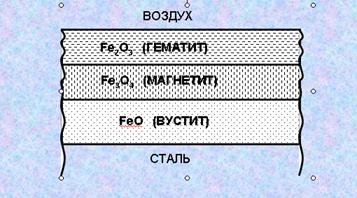
Высокотемпературный окисел — окалина — образуется на сталях обыкновенного качества при температуре более 700оС.
От температуры образования зависит и состав окалины. Она может состоять из трех слоев различных окислов (рисунок) (начиная от поверхности металла):
вустита (оксида двухвалентного железа, FeO), имеющего черный цвет
промежуточного слоя — магнетита (оксида двух-трехвалентного железа, Fe3O4 ,),.
гематита (оксида трехвалентного железа, Fe2O3), имеющего рыжий цвет.
Чередование окислов на поверхности металла связано с разным процентным содержанием кислорода в воздухе на пожаре по мере его развития.
Вначале при относительно высоком содержании кислорода происходит образование гематита. Затем по мере возрастания температуры и убывании кислорода в воздухе под слоем гематита образуется слой магнетита и ниже слой вустита. Таким образом, чем выше температура, тем больше в окалине вустита и меньше гематита
Это обстоятельство позволяет по цвету окалины и ее толщине ориентировочно оценивать температуру нагрева металлоконструкций. Низкотемпературная окалина (700 – 750 оС), в которой мало вустита, обычно имеет рыжеватый оттенок и достаточно тонкая. Окалина, образовавшаяся при 900-1000 оС и более — толстая и черная.
Обязательно надо помнить, что окалина – это очень плотный материал, прочно связанный с самим металлом: поэтому если окисел на поверхности стальной конструкции хоть и имеет рыжий цвет: но рыхлый и непрочный, то это, скорее всего, вообще не окалина, а обыкновенная ржавчина.
Цвет окалины и ее толщина дают возможность примерной оценки температуры нагрева стальных конструкций на пожаре. При этом, однако, не исключены ошибки, поэтому лучше все-таки проводить инструментальные исследования окалины и определять, таким образом, не только температуру, но и длительность нагрева конструкции.
Инструментальные методы исследования окалины будут рассмотрены ниже.
Расплавления и проплавления металла
Расплавления и проплавления (образование сквозных отверстий) металлов и сплавов на пожарах, особенно крупных, встречается не так уж редко. Можно считать, что это наиболее высокая степень термических поражений конструкций и отдельных предметов.
В 70-х годах В.Г.Выскребов (ВНИИСЭ) предложил даже использовать так называемый » метод температур плавлений» для поисков очага пожара. Метод заключался в фиксации мест, где расплавился тот или иной материал, и определении таким образом распределения температурных зон по месту пожара. Известно, например, что температура плавления составляет:
— у алюминия — 600 оС
— бронзы литой — 880-1040 оС
— меди — 1083 оС
— стали — 1300-1400 оС
Таким образом, если в зоне А расплавился алюминиевый провод, то следует сделать вывод, что температура там превышала 600 оС, а в зоне Б, где оплавились медные провода, она была, как минимум, 1080-1090 оС.
Конечно, фиксировать на месте пожара зоны, где расплавился тот или иной материал, весьма полезно. Но считать это самостоятельным методом установления очага пожара было бы неразумно; да и температурные зоны устанавливаются таким путем достаточно условно. Если расплавился алюминий, то это не значит, что температура была 600 оС, она могла быть и 700- 900-1000 оС.
Кроме того, нужно иметь в виду, что «проплавления» в металле могут возникнуть и вовсе при температуре, ниже температуры плавления. Возможно это, как минимум, по двум причинам:
1. Локальный нагрев тонкого стального изделия (листа, проволоки и т.п.) приводит к образованию слоя окалины, соизмеримого по толщине с самим изделием. Окалина, не обладая достаточной механической прочностью затем может выкрошиться, и на изделии после пожара обнаружится «дырка».
* * *
В качестве примера приведем исследование пожара, произошедшего на складе одного из научно-исследовательских институтов. При осмотре места пожара там было обнаружено несколько стоящих вертикально рулонов сетки Рабица, на боку которых имелись вытянутые по вертикали каверны — проплавления сетки. Наличие таких проплавлений показалось дознавателю очень подозрительным — ведь температура плавления стали, как указывалось выше, 1300-1400 оС, и обеспечить такую температуру могло, разве что, применение каких-то таинственных спецсредств поджога. Все оказалось, однако, более прозаично. Когда остатки сетки по периметру прожогов исследовали, то оказалось, что проволочки полностью состоят из оксидов железа (не окисленного железа там уже нет), т.е. сталь полностью превратилась в окалину. Для такого процесса не нужна температура 1300-1400, достаточно и 800-900 оС. Но, тем не менее, почему разрушения имеют такой специфический, локальный характер? Оказалось, что над рулонами сетки, на деревянных антресолях склада хранилось несколько тонн полиэтиленовой пленки. При пожаре полимер плавился, горел, а часть его стекала на расположенные ниже рулоны сетки. Прилипающий к сетке и горящий полимер и привел в конечном счете к образованию столь странных » проплавлений».
* * *
Растворение металла в металле.
Расплавленный в ходе пожара более легкоплавкий металл при попадании на металл более тугоплавкий может привести как бы к «растворению» последнего в расплаве первого металла. Причем происходит это при температуре, ниже температуры плавления «тугоплавкого» металла.
Такой процесс возможен, например, при попадании расплавленного алюминия на медь и ее сплавы. Происходит это за счет образования эвтектического сплава меди с алюминием. Известно, что чистая медь имеет температуру плавления 1083 оС. В то же время эвтектические (совместно плавящиеся) сплавы «медь + расплавленный алюминий» – 660 оС, «медь + расплавленная латунь» — 870-980 оС
Точно также способностью растворяться в расплавленном алюминии обладает сталь.
Растворение стали в алюминии
Растворение происходит в три этапа:
а) окалинообразование на стали, протекающее под воздействием попавшего на нее расплавленного алюминия; (для этого достаточно температуры образования гематита — 700-750 оС)
б) химическое взаимодействие образовавшихся оксидов железа с расплавленным алюминием (термитная реакция):
Fe2O3 + 2Al —> Al2O3 + 2Fe + 847,8 кДж
Реакция эта, как видно из уравнения, сопровождается сильным тепловыделением, что приводит к дополнительному разогреву в зоне реакции и, соответственно, интенсификации последней.
в) растворение восстановленного из окисла железа за счет тепловыделения при термитной реакции (для этого тоже не обязательно достижения температуры плавления стали, например, при температуре 900 оС в алюминии может раствориться до 10 % железа).
Конечным результатом протекания указанных реакций может быть проплавление (дырка) в тонком стальном листе, в стенке стальной трубы и т.д.
Квалификационным признаком, позволяющим отличить такую дырку от проплавления, возникшего, например, под действием электрической дуги, является характерный контур проплавления (в форме лужицы, потека) и тоненькая каемка алюминия, обычно сохраняющаяся по периметру дырки.
Г. Горение металлов и сплавов
Известна способность к горению щелочных и щелочноземельных металлов (K, Na, Mg). Менее известно, однако, что в определенных условиях способны гореть (т.е. взаимодействовать с кислородом воздуха) и другие металлы и сплавы. Примером в данном случае могут быть широко распространенные в качестве конструкционных материалов алюмомагниевые сплавы.
Алюминий, нагретый до 660 оС, несмотря на существование оксидной пленки, все же начинает окисляться тем быстрее, чем ближе его температура к точке плавления, а горение алюминия в кислороде сопровождается значительно большим тепловыделением, чем горение других металлов (1675 кДж/моль).
Температуры самовоспламенения алюмомагниевых сплавов, в зависимости от содержания магния в сплаве могут находиться в пределах 450-560 оС. Наименьшие температуры установлены для сплавов с содержанием магния 45-49%. Они получены методом ДТА для мелкодисперсных порошков (диаметр частиц менее 50 мкм). Известно, что металлы лучше горят в мелкоизмельченном виде, тем не менее, на развившемся пожаре, при хорошей пожарной нагрузке способны гореть и сплавы в виде элементов конструкций. Пожарные, в частности, наблюдают это при пожарах в ангарах из легких металлоконструкций со сгораемым утеплителем.
Повышенное содержание кислорода резко увеличивает возможность загорания и интенсивность горения металлов. Такие ситуации могут сложиться на подводных лодках в медицинских барокамерах, на производствах, связанных с применением газообразного и жидкого кислорода. Наиболее распространенные марки сталей при толщине образца 3 мм и температуре 20 оС способны гореть в кислороде при его давлении 0,02 Мпа, а алюминиевые сплавы (при тех же параметрах) — при давлении 0,1 Мпа. Другие металлы менее склонны к горению в кислороде.
Визуальными признаками горения металлов является разрушение конструкций в зоне горения. От выгоревшей детали часто остается ажурный скелет. Горение часто сопровождается разбрызгиванием металла, в результате чего на месте пожара обнаруживаются множественные мелкие частички металла и его окислов, аналогичные тем, которые образуются при дуговых процессах.
Железо цвета побежалости — Справочник химика 21
Отполированную сталь и железо можно подвергнуть воронению, благодаря чему их поверхность покрывается красивым слоем окисла, стойким по отношению к влаге из воздуха. Для воронения поверхность протирают маслом (минеральным) и, положив на железный лист, нагревают на листе в пламени примуса до выгорания масла и почернения поверхности. Стальную деталь, не прибегая к смазыванию маслом, можно нагреть до появления того или иного цвета побежалости и затем для закрепления его опустить в расплавленный парафин или льняное масло (гл. 2, 2). Нагревая стальную пластинку с одной из ее сторон, можно получить и закрепить целую гамму цветов побежалости. [c.155]Этому опыту было дано такое объяснение. В местах, подвергнутых слабому нагреву, где нет видимых изменений, образовалась тонкая и сплошная пленка окисла. Она защищала металл от соприкосновения с ионами Си , и реакция (У1,6) была невозможна. В зоне цветов побежалости образовавшаяся пленка окисла настолько толста, что не может остаться сплошной, растрескивается и обнажает железо. В местах дефектов пленки происходит реакция ( 1,6). На поверхности, оставшейся холодной, пленки либо нет вообще, либо она настолько пориста, что реакция (VI,6) протекает беспрепятственно, [c.209]
Термический способ (воронение и синение) применяют для обработки мелких проволочных, а также полированных изделий (часовых стрелок и волосков, винтов, лент, пружин и т. п.). Прр воронении изделия смазывают тонким слоем асфальтового или масляного лака, растворимого в бензине, подсушивают на воздухе и загружают (на железных сетках) на 12— 20 мин. в печь при температуре 350—450° С после того как изделия приобрели черную окраску, их выгружают из печи и охлаждают в минеральном масле. В результате такой обработки на металле образуется защитная пленка из окислов железа, на которой имеется тонкий слой сплавленного асфальта или осмоленного масла. Для синения изделия помещают в печь при температуре 310—350° С и выгружают из нее в момент появления на поверхности металла цветов побежалости. Печи снабжены слюдяным или кварцевым стеклом для наблюден ия за ходом процесса. [c.211]
Удельный вес никеля, наносимого гальваническим пз тем, равен 8,9 точка плавления 1455° С. Электрическая проводимость никеля составляет лишь 15% электрической проводимости меди. При высокой температуре на никеле появляются цвета побежалости, однако в окисляющей атмосфере при температуре до 800° С никель не изменяет своих свойств. Обычные загрязнения-железо, марганец, кобальт, кислород (в виде окиси) и сера (в виде сульфида). В щелочах и органических кислотах никель не растворяется, в серной и со- тяной кислотах он растворяется медленно, в азотной кислоте хорошо. [c.149]
Особенности хромового покрытия. Хромовое покрытие стойко против действия большинства газов, щелочей, растворов кислот и солей хром растворяется в горячей серной и азотной кислотах. Блеск и цвет хромового покрытия не изменяются от воздействия атмосферы. При нагревании твердость хро.мового покрытия уменьшается. При температуре нагрева от 200 до 600° С уменьшение твердости происходит медленно, а при температуре свыше 600° С — очень быстро. Для появления цветов побежалости критической температурой является 450° С. При нагреве до температуры, близкой к 450° С, хромовое покрытие начинает менять цвет. С точки зрения противокоррозийной защиты хром как электроотрицательный металл в принципе защищает железо от ржавления. Но поскольку на воздухе хром пассивируется (на покрытии образуется тонкая пленка окиси хрома), то его электроотрицательные и защитные свойства снижаются. Это относится только к тонким пористым хромовым покрытиям. [c.164]
Физические свойства. Уран — блестящий металл, напоминающий по виду в свежем срезе или окисленном состоянии железо. Поверхность свежеполированного металла имеет сильный блеск, но после нескольких часов пребывания на воздухе покрывается цветами побежалости. Уран имеет плотность 19,07 г/сж . Он на 80% тяжелее свинца, пластичен и ковок. [c.9]
Непосредственно вслед за шлифовкой поверхности железа производилось ее окисление. Для получения клиновидных пленок один конец железной полоски нагревался до появления окалины, в то время как другой находился в хорошем контакте с медным зажимом, иногда охлаждаемым проточной водой. Благодаря этому холодный конец образца сохранял свой металлический блеск. Между холодным и горячим концами всегда можно было наблюдать цвета побежалости различных оттенков. [c.25]
Относительно толстые окисные пленки, снятые с железа, имеющего последние цвета побежалости, в проходящем свете дают коричневатую окраску, а в отраженном имеют блестящий, почти металлический вид На более тонких пленках коричневый цвет и металлический блеск становятся менее четкими. [c.80]
Следует заметить, что легкость отделения пленок, возникших при обычных температурах, сильно меняется в зависимости от физического и химического характера железа. Снятие таких пленок со стали обычно невозможно, хотя пленки со стали, нагретой до цветов побежалости, снимаются легко. Применение йодного метода для отделения пленок от железа, обработанного в растворе хромовокислого калия, упомянуто на стр. 379 эти пленки снимаются более легко, чем пленки, возникшие на воздухе. [c.81]
Несколько опытов, произведенных в Кембридже с желе-. 50М, покрытым видимой пленкой, иллюстрируют этот факт. Железо было очищено абразивом, нагрето до полу Гения цвета побежалости первого порядка и испытано в 0,1 Л серной кислоте. Цвета быстро изменились и скоро исчезли. Даже 0,002 М кислота вызывает утонение пленки в течение минуты. Из этого можно было бы сделать тот вывод, что кислота разрушает пленки окиси железа. Тогда опыт был повторен с железом, нагретым до появления более толстых пленок (цвета [c.89]
Если это объяснение правильно, то становится возможным воспрепятствовать. восстановлению пленки (замедляя таким образом ее разрушение) при помощи окислительных агентов. Опыты подтвердили это предположение. Было установлено, что 0,01 М серная кислота, содержащая хромовую кисло Уу (0,1 /П), ие изменяет железо с цветами побежалости, хотя 0,01 М серная кислота (без хромовой кислоты) дает заметное изменение в 5 сек. и полное разрушение более ранних окрасок в 1 йин. [c.90]
Описанные опыты делают очевидным то, что видимые окисные пленки на железной поверхности совершенно у с т о й ч и в ы в кислоте в анодных условиях. Были затем проведены опыты с анодом из железа без цветов побежалости, пассивированного в разбавленной серной кислоте применением тока высокой плотности. В этом случае также было обнаружено, что некоторые короткие перерывы тока могут быть допущены без потери пассивности однако более долгие перерыв
