ЭЛЕКТРОДЫ — это что такое ЭЛЕКТРОДЫ
Электродами называют части проводников гальванической цепи, погруженные в вещества (см. Электролит), подвергаемые действию гальванического тока. Э. устраивают чаще всего из твердых, проводящих ток веществ, т. е. из металла или угля. Жидкие Э. встречаются нередко в лабораторной и заводской практике, примером чему могут служить ртутные Э., а также Э. из других расплавленных металлов. Термин электрод предложен Фарадеем, чтобы им заменить для частных случаев более общий термин «полюсы». Отсюда следует, что электрод может быть характера положительного полюса; такой электрод Фарадей назвал анодом, а электрод характера отрицательного полюса получил название катода. В зависимости от тех химических превращений, которые совершаются при прохождении тока на границе электрод | электролит, Э. бывают обратимые и необратимые. Границу эту принято графически обозначать выше поставленной вертикальной чертой, как и вообще границу двух веществ, на которой могут развиваться электровозбудительные силы. Обратимым электродом называют такой, у которого в месте соприкосновения электрода с электролитом при перемене направления тока совершается химическое прекращение, как раз обратное тому, что совершалось при первоначальном направлении тока. Э., не удовлетворяющие этому требованию, носят название необратимых. Пример обратимого электрода: тяжелый металл (медь цинк, кадмий и др.), погруженный в раствор соли того же металла. При прохождении тока от меди к медному купоросу — растворяется медь, при обратном направлении тока медь осаждается. Кроме качественных требований, обратимый электрод часто должен удовлетворять количественным требованиям. Такой случай наблюдается для газо-платиновых электродов, т. е. для платины, погруженной частью в раствор электролита, частью же в атмосферу газа, выделяющегося при электролизе, хотя бы, например, в атмосферу водорода. Если сила обратного тока будет такова, что у водород-платинового анода будет происходить только растворение водорода, но не будет выделения кислорода, такой электрод обратим для водород-платинового катода.
Обратимым электродом называют такой, у которого в месте соприкосновения электрода с электролитом при перемене направления тока совершается химическое прекращение, как раз обратное тому, что совершалось при первоначальном направлении тока. Э., не удовлетворяющие этому требованию, носят название необратимых. Пример обратимого электрода: тяжелый металл (медь цинк, кадмий и др.), погруженный в раствор соли того же металла. При прохождении тока от меди к медному купоросу — растворяется медь, при обратном направлении тока медь осаждается. Кроме качественных требований, обратимый электрод часто должен удовлетворять количественным требованиям. Такой случай наблюдается для газо-платиновых электродов, т. е. для платины, погруженной частью в раствор электролита, частью же в атмосферу газа, выделяющегося при электролизе, хотя бы, например, в атмосферу водорода. Если сила обратного тока будет такова, что у водород-платинового анода будет происходить только растворение водорода, но не будет выделения кислорода, такой электрод обратим для водород-платинового катода. Обратимые металлические или газо-металлические электроды носят название электродов первого рода. Э. первого рода обратимы для катионов Cu», Zn», Cd», H’ и т. д. (см. Электролитическая диссоциация), а газо-металлические — для О», Cl’ и др. Э. второго рода являются обратимыми для анионов Cl’, Br’, J’ и др. На существование обратимости в этих электродах было впервые указано Нернстом, он же дал и теорию этих электродов. Они представляют металлы, покрытые слоем нерастворимых солей этих металлов, погруженные в раствор соли с тем же анионом, как и у нерастворимой соли. Примером может служить ртутный электрод, покрытый слоем каломели (Hg2Cl2), или серебряный электрод, покрытый слоем хлористого серебра (AgCl), погруженные в раствор хлористого калия. При прохождении тока в одном направлении, когда электрод является анодом, выделяющийся ион хлора, соединяясь с металлом электрода, образует нерастворимую соль, т. е. как бы хлор «осаждается током на электроде»; когда же электрод становится катодом, хлор нерастворимой соли переходит в раствор.
Обратимые металлические или газо-металлические электроды носят название электродов первого рода. Э. первого рода обратимы для катионов Cu», Zn», Cd», H’ и т. д. (см. Электролитическая диссоциация), а газо-металлические — для О», Cl’ и др. Э. второго рода являются обратимыми для анионов Cl’, Br’, J’ и др. На существование обратимости в этих электродах было впервые указано Нернстом, он же дал и теорию этих электродов. Они представляют металлы, покрытые слоем нерастворимых солей этих металлов, погруженные в раствор соли с тем же анионом, как и у нерастворимой соли. Примером может служить ртутный электрод, покрытый слоем каломели (Hg2Cl2), или серебряный электрод, покрытый слоем хлористого серебра (AgCl), погруженные в раствор хлористого калия. При прохождении тока в одном направлении, когда электрод является анодом, выделяющийся ион хлора, соединяясь с металлом электрода, образует нерастворимую соль, т. е. как бы хлор «осаждается током на электроде»; когда же электрод становится катодом, хлор нерастворимой соли переходит в раствор. Эта качественная сторона явлений не дает, конечно, полной картины происходящих процессов и говорит о том, что в таком электроде хлор является как бы металлом, отличающимся только знаком электричества его иона, что важно только для общей характеристики явления. Теория же явления, дающая точное представление, основана на химическом взаимодействии веществ у электрода (см. Ostwald, «Lehrbuch der Allg. Chemie», 878 стр.). Еще сложнее теория обратимых электродов 3-го рода. Эти Э. предложены Лютером, как обратимые для металлов, выделяющих водород из воды и, следовательно, не могущих служить в металлическом состоянии электродами. Остановимся на одном примере обратимого Э. для кальция (Са). Свинцовая пластинка, покрытая слоем смеси солей сернокислого свинца и сернокислого кальция, погруженная в раствор, содержащий хлористый кальций и насыщенный сернокислым свинцом и сернокислым кальцием, представляет, по Лютеру, обратимый Э. для кальция.
Эта качественная сторона явлений не дает, конечно, полной картины происходящих процессов и говорит о том, что в таком электроде хлор является как бы металлом, отличающимся только знаком электричества его иона, что важно только для общей характеристики явления. Теория же явления, дающая точное представление, основана на химическом взаимодействии веществ у электрода (см. Ostwald, «Lehrbuch der Allg. Chemie», 878 стр.). Еще сложнее теория обратимых электродов 3-го рода. Эти Э. предложены Лютером, как обратимые для металлов, выделяющих водород из воды и, следовательно, не могущих служить в металлическом состоянии электродами. Остановимся на одном примере обратимого Э. для кальция (Са). Свинцовая пластинка, покрытая слоем смеси солей сернокислого свинца и сернокислого кальция, погруженная в раствор, содержащий хлористый кальций и насыщенный сернокислым свинцом и сернокислым кальцием, представляет, по Лютеру, обратимый Э. для кальция.
Форма и величина электродов бывает самая разнообразная, в зависимости от тех требований, которым они должны удовлетворять (см. фиг. электродов в статье Электрохимический анализ). Существенной для электрода является та его поверхность, через которую ток попадает в электролит.
фиг. электродов в статье Электрохимический анализ). Существенной для электрода является та его поверхность, через которую ток попадает в электролит.
Если ток электричества (J — сила тока) равномерно распределен по всей поверхности электрода (S), тогда величина J/S носит название плотности тока для данного электрода. Для электрохимических целей часто необходимо хотя бы приблизительное знание этой величины; поэтому вычисляют эту величину делением J на S даже и в таких случаях, когда ток только приблизительно равномерно распределен по электроду. За единицу поверхности электрода принимают 100 квадратных сантиметров и обозначают N.D.100, для измерения же J — обычную величину, т. е. силу тока, равную одному амперу. Так что N.D. 100 = 1,5 А обозначает, что через поверхность электрода в 100 квадратных сантиметров проходит ток силой в 1,5 ампера. Из специальных электродов должно упомянуть о каломельном обратимом электроде второго рода, получившем большое распространением, благодаря постоянству и простой конструкции.
В сосуд (см. фиг.) с впаянной снизу платиновой проволокой, на дне которого находится ртуть, покрытая слоем каломели, наливается нормальный раствор хлористого калия, т. е. 74,6 г в литре раствора, или 0,1 нормальный. Электровозбудительная сила на границе этого электрода и электролита, по Оствальду, в первом случае равна 0,56 вольт, во втором 0,616 вольт. Электрод этот носит название «постоянный каломельный электрод» и применяется в электрохимии (см. статью Электрохимия).
Вл. Кистяковский.
Электроды сравнения-Трубопроводные системы и технологии
Электрод сравнения – это электрод с устойчивым и воспроизводимым потенциалом, который может быть использован для измерения других электрохимических потенциалов. Стационарные электроды сравнения используются для мони- торинга и контроля уровня катодной защиты.
Стационарные электроды сравнения СТЭЛС разработаны для подземного применения и работы в пресной и соленой воде. При этом электроды сравнения имеют высокую стабильность работы в сухих почвах, песках, затопленных и сезонноподтапляемых грун-тах, обладая широким диапазоном рабочих температур (-18…+85°С) и сохраняя работоспособность при замерзании (до -40 °С).
Акционерное общество «Трубопроводные системы и технологии» имеет широкую линейку стационарных электродов, как узконаправленного, так и универсального применения, конструкция которых позволяет гарантировать безотказную работу на протяжении длительного срока при условии соблюдения условий применения изделий.
ПРЕИМУЩЕСТВА И ОСОБЕННОСТИ ЭЛЕКТРОДОВ СРАВНЕНИЯ ЭС-ТСТ-СТЭЛС-Р40
1. Производственные испытания каждого электрода сравнения по 8 параметрам
2. 100% твердое состояние электролита (без неактивных или инертных компонентов)
Наличие твердотельного электролита является обязательным для достижения 30-летнего срока службы.
3. Датчик сернистого водорода (входит в состав электрода сравнения)
Обеспечивает возможность оценки воздействия сернистого водорода на электрод сравнения и приэлектродное пространство.
4. Влагозадерживающая мембрана
Предотвращает выход из строя электрода сравнения под воздействием высоких значений pH грунта.
Монтаж электрода сравнения
5. Ловушка ионов хлорида
Одна из главных причин отказа электродов сравнения – загрязнение хлоридами. В составе медно-сульфатных электродов сравнения используется мембрана, задерживающая ионы хлорида, а также технология улавливания ионов, реализованная в химическом составе электролита, которая связывает эти ионы, для предотвращения их воздействия на сульфат меди.
6. Ловушка ионов сернистого водорода
Сульфиды оказывают разрушающее воздействие на электроды сравнения. Керамическая сенсорная зона всех электродов сравнения СТЭЛС содержит специальный улавливающий состав для нейтрализации этих ионов.
7. Большая площадь поверхности медного электрода (12,5 см
2)Позволяет получить высокую стабильность работы электрода сравнения и продлить срок его службы.
Электрод сравнения со вспомогательным электродом
8. Большая площадь чувствительной поверхности (170 см
2)Позволяет получить высокую чувствительность электрода сравнения и снизить падение напряжения на сопротивлении между электродом сравнения и окружающей средой.
9. Допускается повторное использование
Все электроды сравнения предусматривают возможность ввода в эксплуатацию, вывода из эксплуатации, и затем повторного использования в любой временной последовательности в течение срока службы изделия при условии корректного проведения процедур демонтожа, хранения и монтажа.
10. Допускается замерзание электрода до -40°С
11. Высокая стабильность работы в пустынных и подтопляемых грунтах
12. Возможная комплектация кабелем по требованию заказчика
Что такое электрод? — Определение из Corrosionpedia
Последнее обновление: 4 сентября 2019 г.
Что означает электрод?
Электрод представляет собой электрический проводник, контактирующий с неметаллическими частями цепи, такими как электролит, полупроводник или вакуум. Если в электрохимической ячейке, это также известно как анод или катод. Анод представляет собой электрод, в котором электроны покидают ячейку, и в этой точке происходит окисление.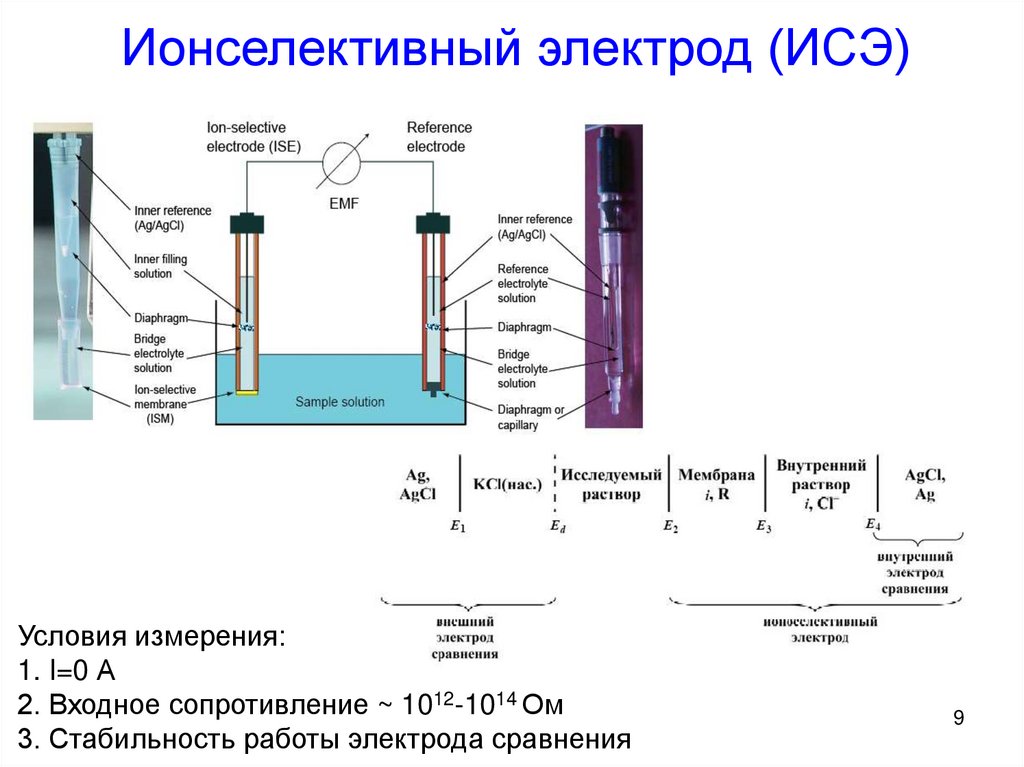
Электрод не может быть закреплен постоянно, поскольку он может играть роль анода или катода, в зависимости от направления потока электронов.
Другой тип — биполярный электрод, который одновременно выполняет роль анода одной ячейки и катода другой ячейки.
Реклама
Коррозионпедия Объясняет Электрод
Заземление проводников необходимо для предотвращения коррозии. Подземные металлы могут подвергаться коррозии из-за наличия блуждающих токов, протекающих в земле. Существует много типов электродов в зависимости от их функции. В электрохимической ячейке электрод называется анодом или катодом, в зависимости от направления потока электронов.
Анод — это клемма или проводник, где электроны покидают электрохимическую ячейку, вызывая окисление в этой области. На катоде электроны входят в ячейку и характеризуются восстановительными реакциями. И анод, и катод могут менять полярность в зависимости от направления тока. Первичные элементы имеют фиксированные аноды и катоды и могут быть только разряжены (но не перезаряжены). В этих клетках реакции не могут быть зарезервированы. Во вторичных клетках химические реакции обратимы. Ячейка перезаряжается в случаях, когда анод становится положительно заряженным электродом, а катод становится отрицательно заряженным электродом.
И анод, и катод могут менять полярность в зависимости от направления тока. Первичные элементы имеют фиксированные аноды и катоды и могут быть только разряжены (но не перезаряжены). В этих клетках реакции не могут быть зарезервированы. Во вторичных клетках химические реакции обратимы. Ячейка перезаряжается в случаях, когда анод становится положительно заряженным электродом, а катод становится отрицательно заряженным электродом.
Коррозия электродов может быть серьезной, особенно когда в электролите присутствуют флуктуирующие потенциалы. Это также серьезно, когда два электрода, используемые в качестве анода и катода, изготовлены из разных металлов. Это можно уменьшить за счет использования ингибиторов и других эффективных методов, которые помогают предотвратить атаки электродов.
Популярным процессом является катодное ингибирование, при котором формируется пассивирующий слой, предотвращающий доступ агрессивных веществ. Он замедляет катодную реакцию, одновременно осаждая эти участки, что значительно снижает скорость коррозии катодного электрода.
Реклама
Поделись этим термином
Связанные термины
- Вспомогательный электрод
- Каломельный электрод
- Электрохимический допуск
- Стеклянный электрод
- Электрод сравнения
- Анодная платформа
- Выходной ток анода
- Анодный ток
- Стандартный электрод
- ИК-кабель
Похожие материалы
- Коррозия и электрические помехи в подземных металлических конструкциях
- Основы катодной защиты
- Введение в гальванику Интервью с Джейн Деббрехт
- Электрохимия коррозии: 6 электрохимических реакций, участвующих в коррозии
- Введение в серию Galvanic: гальваническая совместимость и коррозия
- Обзор измерения потенциала катодной защиты
Теги
Коррозия 101ПодложкиОборудованиеОбщее оборудованиеЭлектрохимическая собственностьЭлектрическая собственностьАктуальные статьи
Покрытия
4 типа покрытий для бетонных полов (и что следует знать о каждом)
Коррозия
21 Типы коррозии и разрушения труб
Покрытия
5 наиболее распространенных типов металлических покрытий, о которых должен знать каждый
Профилактика
Горячее и холодное цинкование: в чем разница?
Электрод.
 Введение, типы и применение
Введение, типы и применениеЭлектроды являются хорошими проводниками электричества. Электроды используются для обеспечения контакта между неметаллическими частями цепи, такими как электролиты, полупроводники, воздух и т. д. Слово «электрод» состоит из двух греческих слов «электрон», что означает «янтарь», и «капюшон», что означает «прочь». Слово Электрод было придумано Уильямом Уэвеллом.
Что такое электрод?
Электрод можно определить как точку, в которой ток входит или выходит из электролита или цепи. Когда ток выходит из электрода, он известен как катод, а когда ток входит в электрод, он известен как анод.
Электроды являются основным компонентом электрохимических элементов. Электрод должен быть хорошим проводником электричества. Хотя существуют и инертные электроды, которые не участвуют в реакции. Электрод может быть из золота, платины, углерода, графита, металла и т. д. Электрод обеспечивает поверхность для окислительно-восстановительных реакций в клетках.
Катод и анод в электрохимических элементах
В электрохимическом элементе электрод называется катодом или анодом. Анод можно определить как электрод, на котором электроны покидают ячейку и происходит окисление, а катод можно определить как электрод, на котором электроны входят в ячейку и происходит восстановление. Любой из двух электродов может стать анодом или катодом в зависимости от направления тока через ячейку. Электрод, который может функционировать как анод в одной ячейке и как катод в другой, называется биполярным электродом.
Первичные элементы – это такие электрохимические элементы, в которых происходят необратимые реакции; вот почему эти тождества катода и анода фиксированы. В этих ячейках анод всегда будет отрицательным, иначе в этот момент произойдет окисление. При этом катод всегда будет положительным или при такой скорости будет происходить снижение. Примером первичной ячейки является гальванический элемент.
Аккумуляторы или электролитические элементы перезаряжаемые; это означает, что в этих клетках происходят обратимые химические реакции. В этих ячейках анод всегда положительный, а катод всегда отрицательный.
Типы электродов
Электроды в основном бывают двух типов – реактивные электроды и инертные электроды
Реактивные электроды – это те электроды, которые принимают участие в реакции, протекающей в ячейке, и могут растворяться в электролите. Примеры реактивного электрода — медный электрод, серебряный электрод, цинковый электрод, медный электрод и т. Д. Они в основном используются в потенциометрической работе.
Инертные электроды – это такие электроды, которые не участвуют в реакции. Примеры инертных электродов – угольный электрод, платиновый электрод и т. д.
Использование электродов
Электроды используются для установления контакта между неметаллическими компонентами цепи в ячейке.

-
Электроды используются для измерения проводимости.
Используются в топливных элементах транспортных средств.
Они используются в медицинских целях, таких как ЭЭГ, ЭКГ, ЭСТ и дефибриллятор.
Они используются для электрофизиологических методов в биомедицинских исследованиях.
Используются при изготовлении электрических стульев.
Используются для гальваники.
Используются для дуговой сварки.
Используются для заземления.



