Страница не найдена — steelfactoryrus.com
Алюминий
Содержание1 Как припаять медь к алюминию1.1 Пайка алюминия1.2 Зачистка под слоем флюса1.3 Абразивные материалы1.4
Своими руками
Содержание1 Искусственный гранит — производство и применение в быту1.1 Из чего состоит искусственный камень1.2
Металл
Содержание1 Виды и классификация измерительного инструмента1.1 Классификация1.2 Строительный измерительный инструмент1.3 Слесарный измерительный инструмент1.4 Столярный измерительный инструмент2
Медь
Содержание1 Монтаж медных труб: подробная инструкция1. 1 Сборка трубопровода при помощи фитингов1.2 Инструменты и материалы1.3
1 Сборка трубопровода при помощи фитингов1.2 Инструменты и материалы1.3
Алюминий
Содержание1 Особенности производства алюминия: расчет сырья и технология добычи1.1 Технологии производства алюминия1.2 Рафинация металла2 Как
Сварка
Содержание1 Какую маску Хамелеон для сварки лучше купить?1.1 Принцип работы1.2 Характеристики2 6 лучших сварочных
Электроды «Монолит»
Тот, кто занимается сваркой в домашних условиях (на даче или загородном коттедже), знает, как важно иметь в наличии хороший сварочный электрод. Конечно, инверторы сделали сварку проще и качественнее, но, как показывает практика, от электрода многое зависит: и качество шва, и минимальное количество шлака, и быстрый розжиг расходника. Современный рынок предлагает огромный ассортимент сварочных электродов. Здесь и огромный модельный ряд, и разнообразие производителей. Но профессионалы пользуются брендовыми материалами, которые, конечно, стоят дороже обычных.
К примеру, известная во всем мире шведская компания «ESAB», выпускающая высокого качества электроды одноименного названия. На самом деле качество сварных стержней отменное, но и стоят они недешево. Поэтому для многих домашних мастеров они не доступны. Украинская компания «Плазмо Тек» сегодня предлагает аналогичные по техническим характеристикам электроды «Монолит РЦ», которые по популярности не уступают шведским аналогам и соответствуют марке «ESAB KO 46.00». Конечно, качество чуть ниже, определенные позиции, касающиеся сварочного процесса, также ниже, но цена все компенсирует.
На самом деле качество сварных стержней отменное, но и стоят они недешево. Поэтому для многих домашних мастеров они не доступны. Украинская компания «Плазмо Тек» сегодня предлагает аналогичные по техническим характеристикам электроды «Монолит РЦ», которые по популярности не уступают шведским аналогам и соответствуют марке «ESAB KO 46.00». Конечно, качество чуть ниже, определенные позиции, касающиеся сварочного процесса, также ниже, но цена все компенсирует.
Технические характеристики
К основным техническим характеристикам относятся вид тока и полярность сварки. Так вот электроды марки «Монолит» можно использовать при сварке постоянным или переменным током. При этом полярность может быть как обратной, так и прямой. Обратная полярность – это когда на деталь подается минус, а на электрод плюс. Соответственно при прямой полярности соединение производится наоборот. Полюса плюс и минус указываются на сварочном инверторе, они соединяются со стержнем и деталью кабелями (проводами).
Очень важный момент при сварке электродами – это возможность варить в разных положениях. Так вот с помощью «Монолита» это делать можно без проблем. Единственная позиция – электрод диаметром 5 мм –им нельзя варить в вертикальном направлении сверху вниз. Сварщик, давно работающий по специальности, знает, что это значит. Как важно иметь возможность варить металлические конструкции и заготовки в разных положениях.
Внимание! Варить сверху вниз электродами марки «Монолит» несложно. Но лучше это делать короткой дугой, то есть, расстояние между концом стержня и сварочной ванной должно быть минимальным.
Чтобы вертикальный шов был максимально качественным, необходимо сварной стержень держать под углом 40-70°. При нижнем положении сварки этот угол должен быть в пределах 20-40°. И еще несколько характеристик сварочных расходников «Монолит».
- Стержни обмазываются рутил-целлюлозным покрытием.
- Их расход (диаметра 3 мм) на 1 кг наплавления – 1,75 кг.

- Коэффициент наплавляемости – 9,5 г/А.ч.
Начинающие сварщики часто неправильно выставляют силу тока на инверторе в соответствии с диаметром используемого расходника. Это всегда сказывается на качестве сварного шва, а соответственно и на качестве самого соединения. Поэтому очень важно правильно соотнести эти два показателя.
Диаметр, мм | Сила тока, А |
2 | 40-80 |
2,5 | 50-90 |
3 | 70-110 |
3,2 | 80-120 |
4 | 110-170 |
5 | 150-220 |
Внимание! Если электрод марки «Монолит» намочился водой или лежал в сыром помещении, то варить им запрещено. Перед началом сварки его надо обязательно прокалить в течение получаса при температуре +120С.
Преимущества
Перед основными электродами разных марок, которые часто используются при сварочных работах в домашних условиях, «Монолит» имеет ряд достоинств. Их оценили все без исключения сварщики: профессионалы и любители.
А именно:
- Стержни легко поджигаются, даже при повторном сварочном процессе.
- У них стабильная дуга без скачков и провалов.
- В процессе сварки металл не разбрызгивается (практически нет брызг).
- Шов получается ровным, равномерно заполненным и скругленным.
- Шлак, который выделяется от обмазки электрода, легко отделяется от зоны сварочной ванны.
- Их можно использовать и с профессиональными сварочными аппаратами, и с бытовыми инверторами малой мощности.
- Если в процессе сварки попался участок с труднодоступной сварочной линией, то сам стержень можно легко согнуть. И в таком состоянии он прекрасно варит, без дефектов и изъянов.
- Для неответственных конструкций этот электрод можно использовать без предварительной очистки свариваемых деталей.
 То есть, нет необходимости зачищать сварные кромки от масла, жира, загрязнений и даже ржавчины.
То есть, нет необходимости зачищать сварные кромки от масла, жира, загрязнений и даже ржавчины.
Все эти описания технических характеристик и преимуществ сварочного электрода марки «Монолит» позволяют новичкам легко справляться со сварочным процессом. Он не залипает, легко варит практически без брызг металла. И при всем при этом шов получается качественным.
Советы начинающему аргонщику, часть 3 — Страница 53 — Аргонодуговая сварка — TIG
Всем привет.
Видимо, вскоре стану начинающим аргонщиком.
Для начала затарился вот таким набором:
Wp-24gf сварочной горелки тело гибким, 80Amp с воздушным охлаждением
Wp-9fv SR-9FV сварочной горелки тело гибким и газовый вентиль, 125amp, Air — с водяным охлаждением
Две горелки, чисто тело.
WP-24 TIG Сварочные Горелки Расходные КИТ 53N14 Колле Тела Глинозема сопло, 13 шт. — цанги и сопла для 24 горелки.
TIG КИТ Удлиненная Глинозема Сопло 796F74 ~ 77 Fit TIG Факел SR PTA WP-9 20 25, 4PK удлиненные сопла от 3Xl до 6L
TIG газовой линзы цанги тело & #10 pyrex чашка комплект дБ SR WP 9 20 25 wig-сварочная горелка 26 шт. — 4 газовые линзы разного диаметра, прозрачные чашки, 4 цанги, 3 колпачка для 9 горелки разной длины.
Tig глинозема керамическая 13N11 7 # Fit TIG сварочные расходные SR пта DB WP 9 20 25 серии, 10PK — 10 сопл средней длины размер 7.
1.5% Lanthanated электрод WL15 золото 1.6 * 150 мм и 1/16 » x6 » x10PK
2% Lanthanated электрод WL20 голубой TIG сварки 6 » x3 / 32 » ( 2.
Баллон, редуктор уже присмотрел.
Подскажите, что еще понадобится?
Горелки заказал только тело, решил что шланг-пакет сделаю сам.
Я так понимаю, для самодельного шланг-пакета удобнее всего отдельные каналы газ и ток? Трубка силикон или резина, какое сечение достаточно, если чисто для газа?
Кабель сложно доставаемый ПЩ или хватит акустического? Больших токов вроде не предполагается.
Штуцеры тоже пожалуй сам сделаю, спецификацию по резьбам уже нашел, все нужное есть.
Сообщение отредактировал Yuriy82: 09 Декабрь 2017 00:36
Сварочный инверторный аппарат Ресанта САИ-140 + сварочные краги и электроды в подарок! 65/5, 71/6/20
Инверторный сварочный аппарат Ресанта САИ-140 предназначен для ручной сварки металлических конструкций покрытым электродом диаметром до 3,2 мм.
Аппарат прост и удобен в работе. Небольшая мощность и размер электрода подходит для пользования дома или на даче, например, сварить забор или мангал. Функция горячего старта упростит начало работы, защитные системы помогут пользоваться аппаратом долго и с удовольствием.
Особенности:
- Небольшой вес и ремень упрощают транспортировку и повышают удобство использования.
- Показатели напряжения холостого хода обеспечивают безопасность при использовании, не теряя эффективности в работе.
Преимущества:
- Низкое энергопотребление позволяет пользоваться любой электросетью даже при напряжении 140В. Кроме того, такой аппарат создаёт минимальное количество электромагнитных помех в такую сеть.
- Простая регулировка, доступная даже для новичков.
- Плата покрыта специальным лаком, который предотвращает короткое замыкание на плате от строительной пыли и металлической стружки.

- Охлаждение сварки за счет вертикальной установки платы и оптимального расположения кулеров, что является уникальным технологическим решением
- Лёгкое и плавное управление силой тока упрощает процесс работы.
- При сварке получаются швы высокого качества за счет легкого поджига дуги и устойчивого горения.
- Функции «ANTI STICK» (анти-залипание) и «HOT START» (горячий старт) повышают удобство и эффективность работы с аппаратом.
- Имеется система защиты от перегрева с индикатором для предотвращения опасных ситуаций.
- Небольшие габариты упрощают транспортировку и повышают удобство использования.
- Малое потребление электроэнергии при высокой мощности.
- Защищен от попадания вертикально падающих капель (класс защиты IP21)
Принцип работы
Заключается в преобразовании переменного напряжения сети частотой 50 Гц в постоянное напряжение величиной в 400 В, которое преобразуется в высокочастотное модулированное напряжение и выпрямляется. Для регулирования сварочного тока используется широтно-импульсная модуляция.
Устройство САИ-140
Изделие выполнено в металлическом корпусе, на передней панели которого расположено:
- Регулятор величины сварочного тока. С помощью регулятора сварочного тока можно выставить нужный ток в зависимости от толщины сварного электрода.
- Силовые разъемы для подключения сварочных кабелей.
- Индикатор «сеть» загорается при включении прибора.
- Индикатор «перегрев» загорается на несколько секунд при включении САИ и при перегреве прибора и выключается после его охлаждения до рабочей температуры.
- Автоматический выключатель, сварочный аппарат Ресанта оснащен автоматом вместо обычного выключателя. Он позволяет работать в сетях со слабой проводкой и сетях, не оснащенных защитой (установлен на задней панели).
Горячий старт (HOT START)
Для обеспечения лучшего поджига дуги в начале сварки, инвертор производит автоматическое повышение сварочного тока. Это позволит значительно облегчить начало сварочного процесса. Благодаря этой функции аппаратом могут работать не только опытные сварщики, но и новички. Эта функция установлена на всех сварочных аппаратах Ресанта.
Это позволит значительно облегчить начало сварочного процесса. Благодаря этой функции аппаратом могут работать не только опытные сварщики, но и новички. Эта функция установлена на всех сварочных аппаратах Ресанта.
Антизалипание (ANTI STICK)
При начале сварки требуется произвести поджиг дуги. Нередко это приводит к залипанию электрода на изделии. В этом случае инвертор сам производит автоматическое снижение сварочного тока, и электрод легко отрывается. В дальнейшем, после отрыва залипшего электрода, инвертор возобновляет установленные параметры сварки. Все САИ оснащены данной функцией.
IGBT
Все без исключения инверторы Ресанта изготовлены на IGBT-транзисторах. Эффект в том, что за счёт них срок использования аппарата увеличивается в 7 раз. Помимо этого уменьшается вес и габариты. У IGBT плата расположена вертикально, пыль на ней не оседает.
|
Диаметр электродов (мм) |
Ток (А) |
|
1,6 |
25-50 |
|
2 |
50-70 |
|
2,5 |
60-90 |
|
3,2 |
90-140 |
|
4 |
|
|
5 |
160-220 |
|
6 |
200-315 |
ПВ (продолжительность включения)
Смысл параметра «ПВ» таков: это время в течение 10-минутного интервала, которое аппарат способен проработать на указанном токе. Это означает, что 70% от 10-минутного интервала (то есть 7 минут) аппарат может непрерывно варить, не отрывая дуги на указанном токе, а остальные 3 минуты он должен «отдыхать» на холостом ходу, при этом нельзя выключать аппарат из сети, что бы работало принудительное охлаждение (вентилятор).
Это означает, что 70% от 10-минутного интервала (то есть 7 минут) аппарат может непрерывно варить, не отрывая дуги на указанном токе, а остальные 3 минуты он должен «отдыхать» на холостом ходу, при этом нельзя выключать аппарат из сети, что бы работало принудительное охлаждение (вентилятор).
Напряжение холостого хода
Чем выше напряжение холостого хода, тем легче зажечь дугу. У данного инвертора оно равно 75 В, дуга зажигается легко, есть возможность варить цветные металлы.
Кабель держателя и массы длинной 2 метра, длина сетевого шнура 1,7 м, длина сварочного аппарата 30 см. Итого 4 метра рабочего пространства. Для более удобной работы достаточно обычного удлинителя нужного сечения.
Электрод из никеля для сварки чугуна Lastek 47E
Беспористая сварка загрязненного чугуна
Ферро-никелевые электроды Lastek 47E предназначены для сваривания и наплавки чугуна.
Благодаря отличным механическим характеристикам и высокой трещиностойкости Lastek 47E особенно
подходит для сваривания толстостенных деталей и для соединения чугуна со сталью. Вследствие
высокого коэффициента переноса металла и хорошего уплотнения этот электрод предпочтительно
применяется для наплавки больших деталей из чугуна, когда используется сварка на постоянном токе
обратной полярности.
Наплавленный металл хорошо обрабатывается.
Сваривание деталей, подверженных концентрированным механическим напряжениям или деталей из
высокопрочного чугуна.
Заполнение усадочных раковин на ламинарном чугуне, сером чугуне со сферическим графитом или
«Meehanite». Ремонт чугунных штампов в автомобильной промышленности.
Механические характеристики
Предел прочности Rm: > 400 Н/мм2
Растяжение A5: > 20%
Вид и полярность сварочного тока
Переменный или постоянный ток, плюс или минус на электроде (смотри рекомендации по
использованию).
Диаметр и сила сварочного тока
| мм. | 3.2 | 4.0 |
| А | 85-115 | 100-145 |
Рекомендации по использованию
Lastek 47E может применяться на переменном или постоянном токе.
Наплавка: постоянный ток, плюс на электроде.
Сваривание и маленькие швы: постоянный ток и минус на электроде.
Пригоден для всех пространственных положений.
При соединении чугуна со сталью 2/3 шва должны быть наложены на чугун и 1/3 на сталь.
Пульсирующая дуга (при постоянном токе, минус на электроде) производит попеременно фазу нагрева
(масло и грязь выжигаются) и фазу наплавления.
Выполнять движения электродом вперед-назад по направлению шва: фаза 1 (вперед) и фаза 2 (назад).
Чтобы уменьшить остаточные напряжения, наплавленный металл можно проковать молотком.
| Бренд | Most |
| Бренд | Most |
| Назначение | Для наплавки, ремонта сварки чугуна и сплавов на основе никеля |
| Артикул | Наименование | Цена | Фотография |
|---|
Что такое симистор, как его проверить
Симистор — полупроводниковый прибор, являющийся разновидностью тиристоров и используемый для коммутации в цепях переменного тока.
Симистор — это разновидность тиристора. Он как и тринистор имеет три вывода, однако p-n-переходов у симистора не три, а целых пять. Характерно для симистора и два устойчивых состояния: «открытое» и «закрытое», при том проводимостью симистора можно управлять в двух направлениях, несмотря на то, что управляющий электрод у него всего один.
По причине такой своей универсальности, именно симистор чаще всего играет роль ключа в цепях переменного тока для управления различного рода устройствами (например двигателем болгарки или стиральной машины).
Взгляните на рисунок. Здесь пять переходов, которые по своему расположению аналогичны двум встречно-параллельно включенным тринисторам. Если приложить к электроду MТ2 плюс, а к MТ1 — минус, то активируется (станет готова к работе) последовательность переходов снизу-вверх n-p-n-p, а при смене полярности в наше распоряжение попадет последовательность переходов сверху-вниз n-p-n-p. И управляющего электрода по прежнему достаточно всего одного.
Итак, для управления состоянием проводимости симистора, установленного в каком-нибудь приборе, на управляющий электрод G симистора подают управляющий импульс, полярность которого указывается относительно вывода MТ1, и зависит она от текущей полярности коммутируемого напряжения, действующего в цепи, то есть от напряжения, приложенного к выводам MT1 и MT2 данного симистора.
Если вывод MT2 находится под положительным напряжением относительно вывода MT1, то переход симистора в проводящее состояние возможен при любой полярности импульса управляющего напряжения, приложенного к выводу G относительно вывода MT1. Если же на выводе MT2 находится минус, а на MT1 – плюс, то к открыванию симистора приведет отрицательная полярность напряжения, приложенного к выводу G.
Чтобы «закрыть» симистор, находящийся в проводящем состоянии, необходимо обесточить коммутируемую симистором цепь (сделать ее ток меньшим, чем ток удержания, характерный для данного симистора).
Из сказанного выше очевидным образом вытекает, что для проверки симистора можно воспользоваться простой универсальной схемой, предназначенной для тестирования, которая содержит два развязанных друг от друга источника питания (например две обмотки трансформатора с выпрямителями и конденсаторами фильтров).
Такую схему каждый сможет собрать себе сам. Два переключателя (SA1 и SA2) служат для изменения полярности в коммутируемой цепи и в цепи питания управляющего электрода. Переключатели (кнопки без фиксации) SB1 и SB2 предназначены соответственно для открывания и для выключения симистора.![]() Лампочка здесь служит индикатором исправности симистора, так как она установлена в цепи, коммутируемой симистором.
Лампочка здесь служит индикатором исправности симистора, так как она установлена в цепи, коммутируемой симистором.
Работает схема так. Когда переключатели SA1 и SA2 пребывают в положении как изображено на рисунке, достаточно нажать на кнопку SB1, чтобы исправный симистор открылся и лампа тут же загорелась. Далее нажимают SB2 – лампа гаснет, так как симистор запирается. После этого переключателем SA1 изменяют полярность управляющего импульса.
Нажатие на SB1 приведет к загоранию лампы. Следующим шагом изменяют полярность в коммутируемой цепи, для чего нажимают на SA2. Теперь лампа должна вспыхивать только тогда, когда на управляющий электрод будет подано напряжение отрицательное, относительно минусового электрода симистора.
Есть более простая схема с батарейкой «крона» и со светодиодами. Данная схема позволяет проверять не только симисторы, но и тринисторы. Переключатель S1 позволяет изменять полярность питания, а кнопки ST1 и ST2 дают в распоряжение пользователю импульсы разной полярности.
Исправный тринистор станет проводить лишь в одном направлении, поэтому только светодиод VD4 будет индикатором. А вот симистор сможет открыться в том направлении, в котором подана полярность питания, и в зависимости от нажатия на кнопку ST1 или ST2. Нажатие на ST2 не должно привести к открыванию симистора, если на нижнем его выводе будет плюс.
Ранее ЭлектроВести писали, что в России на Калининской АЭС было отключено от сети три энергоблока из четырех. Представитель концерна «Росэнергоатом» сказал, что остановка была вызвана отключением одного из трансформаторов тока.
По материалам: electrik.info.
что это такое, плюс или минус, определяем полярность
Часто возникает проблема определения, какой из электродов является катодом, а какой — анодом. Для начала нужно разобраться с терминами.
Понятие катода и анода — простое объяснение
В сложных веществах электроны между атомами в соединениях распределены неодинаково. В результате взаимодействия частицы перемещаются от атома одного вещества к атому другого. Реакция именуется окислительно-восстановительной. Потеря электронов называется окислением, элемент, отдающий электроны — восстановителем.
В результате взаимодействия частицы перемещаются от атома одного вещества к атому другого. Реакция именуется окислительно-восстановительной. Потеря электронов называется окислением, элемент, отдающий электроны — восстановителем.
Присоединение электронов носит название восстановление, принимающий элемент в этом процессе — окислитель. Переход электронов от восстановителя к окислителю может протекать по внешней цепи, и тогда его можно использовать в качестве источника электрической энергии. Устройства, в которых энергия химической реакции превращается в электрическую энергию, называются гальваническими элементами.
Простейший классический пример гальванического элемента — две пластины, изготовленные из различного металла и погруженные в раствор электролита. В такой системе окисление происходит на одном металле, а восстановление — на другом.
ВАЖНО! Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление — катодом.
Из школьных учебников химии известен пример медно-цинкового гальванического элемента, работающего за счет энергии реакции между цинком и сульфатом меди. В устройстве Якоби — Даниэля пластина из меди помещена в раствор сульфата меди (медный электрод), цинковая пластина погружена в раствор сульфата цинка (цинковый электрод). Цинковый электрод отдает катионы в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор обедняется катионами, здесь раствор заряжен отрицательно.
Замыкание внешней цепи заставляет электроны перетекать от цинкового электрода к медному. Равновесные отношения на границах фаз прерываются. Идёт окислительно-восстановительная реакция.
Энергия самопроизвольно протекающей химической реакции превращается в электрическую.
Если химическую реакцию провоцирует внешняя энергия электрического тока, идёт процесс, называемый электролизом. Процессы, протекающие при электролизе, обратны процессам, протекающим при работе гальванического элемента.
ВНИМАНИЕ! Электрод, на котором происходит восстановление, также называется катодом, но при электролизе он заряжен отрицательно, а анод — положительно.
Применение в электрохимии
Аноды и катоды принимают участие во многих химических реакциях:
- Электролиз;
- Электроэкстракция;
- Гальваностегия;
- Гальванопластика.
Электролизом расплавленных соединений и водных растворов получают металлы, производят очистку металлов от примесей и извлечение ценных компонентов (электролитическое рафинирование). Из металла, подлежащего очистке, отливают пластины. Они помещаются в качестве анодов в электролизер. Под воздействием электрического тока металл подвергается растворению. Его катионы переходят в раствор и разряжаются на катоде, образуя осадок чистого металла. Примеси, содержащиеся в первоначальной неочищенной металлической пластине, либо остаются нерастворимыми в виде анодного шлама, либо переходят в электролите, откуда удаляются. Электролитическому рафинированию подвергают медь, никель, свинец, золото, серебро, олово.
Электроэкстракция — процесс выделения металла из раствора в ходе электролиза. Для того чтобы металл перешёл в раствор, его обрабатывают специальными реагентами. В ходе процесса на катоде происходит выделение металла, характеризующегося высокой чистотой. Так получают цинк, медь, кадмий.
Чтобы избежать коррозии, придать прочность, украсить изделие поверхность одного металла покрывают слоем другого. Этот процесс называется гальваностегией.
Гальванопластика — процесс получения металлических копий с объёмных предметов электроосаждением металла.
Применение в вакуумных электронных приборах
Принцип действия катода и анода в вакуумном приборе может продемонстрировать электронная лампа. Она выглядит как герметически запаянный сосуд с металлическими деталями внутри. Прибор используется для выпрямления, генерирования и преобразования электрических сигналов. По числу электродов выделяют:
По числу электродов выделяют:
- диоды;
- триоды;
- тетроды;
- пентоды и т.д.
Диод — вакуумный прибор с двумя электродами, катодом и анодом. Катод подключен к отрицательному полюсу источника питания, анод — к положительному. Предназначение катода — испускать электроны под действием нагрева электрическим током до определенной температуры. Посредством испущенных электронов создается пространственный заряд между катодом и анодом. Самые быстрые электроны устремляются к аноду, преодолевая отрицательный потенциальный барьер объемного заряда. Анод принимает эти частицы. Создается анодный ток во внешней цепи. Электронным потоком управляют с помощью дополнительных электродов, подавая на них электрический потенциал. Посредством диодов переменный ток преобразуется в постоянный.
Применение в электронике
Сегодня используется полупроводниковые типы диодов.
В электронике широко используется свойство диодов пропускать ток в прямом направлении и не пропускать в обратном.
Работа светодиода основана на свойстве кристаллов полупроводников светиться при пропускании через p-n переход тока в прямом направлении.
Гальванические источники постоянного тока — аккумуляторы
Химические источники электрического тока, в которых протекают обратимые реакции, называются аккумуляторами: их перезаряжают и используют многократно.
При работе свинцового аккумулятора происходит окислительно-восстановительная реакция. Металлический свинец окисляется, отдает свои электроны, восстанавливая диоксид свинца, принимающего электроны. Металлический свинец в аккумуляторе — анод, он заряжен отрицательно. Диоксид свинца — катод и заряжен положительно.
По мере разряда аккумулятора расходуются вещества катода и анода и их электролита, серной кислоты. Чтобы зарядить аккумулятор, его подключают к источнику тока (плюсом к плюсу, минусом к минусу). Направление тока теперь обратное тому, какое было при разряде аккумулятора. Электрохимические процессы на электродах «обращаются».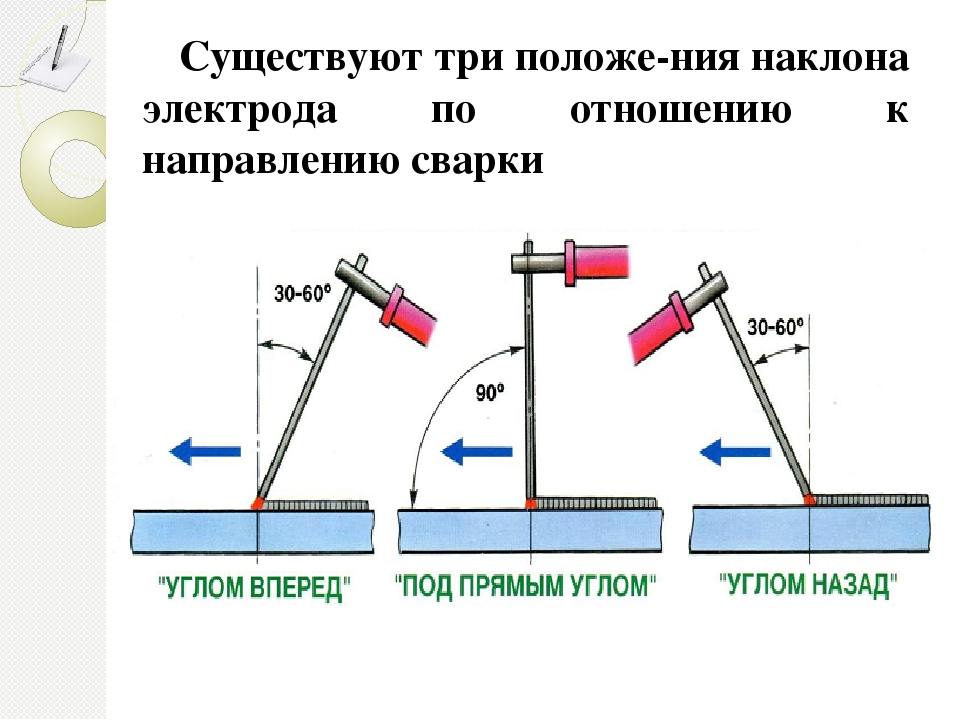 Теперь свинцовый электрод становится катодом, на нем проходит процесс восстановления, а диоксид свинца — анодом, с протекающей процедурой окисления. В аккумуляторе вновь создаются вещества, необходимые для его работы.
Теперь свинцовый электрод становится катодом, на нем проходит процесс восстановления, а диоксид свинца — анодом, с протекающей процедурой окисления. В аккумуляторе вновь создаются вещества, необходимые для его работы.
Почему существует путаница?
Проблема возникает из-за того, что определенный знак заряда не может быть прочно закреплен за анодом или катодом. Часто катодом является положительно заряженный электрод, а анодом — отрицательный. Часто, но не всегда. Все зависит от процесса, протекающего на электроде.
ВНИМАНИЕ! Деталь, которую поместили в электролит, может быть и анодом и катодом. Все зависит от цели процесса: нужно нанести на нее другой слой металла или снять его.
Как определить анод и катод
В электрохимии анод — это электрод, на котором идут процессы окисления, катод — это электрод, где происходит восстановление.
У диода отводы называются анод и катод. Ток будет идти через диод, если отвод анод подключить к «плюсу», отвод «катод» — к «минусу».
У нового светодиода с необрезанными контактами анод и катод определяются визуально по длине. Катод короче.
Если контакты обрезаны, поможет батарейка, приложенная к ним. Свет появится, когда полярности совпадут.
Знак анода и катода
В электрохимии речь правильнее вести не о знаках зарядов электродов, а о процессах, на них идущих. На катоде проходит реакция восстановления, на аноде — окисления.
В электротехнике для протекания тока катод подключают к отрицательному полюсу источника тока, анод — к положительному.
Электрод сравнения серебра / хлорида серебра (1004)
Электрод сравнения серебро / хлорид серебра — это электрод сравнения, который выбирают многие электрохимики. Он широко используется, стабилен, нетоксичен и довольно прочен. Простота и надежность электрода из хлорида серебра и серебра делают его подходящим кандидатом для многих коммерческих приложений, где необходимо измерять или контролировать электрохимический потенциал. Он в основном используется с насыщенным электролитом хлорида калия (KCL), но также может быть заполнен более низкими концентрациями, такими как 1 M KCL, и даже непосредственно в морской воде.
Он в основном используется с насыщенным электролитом хлорида калия (KCL), но также может быть заполнен более низкими концентрациями, такими как 1 M KCL, и даже непосредственно в морской воде.
- Электрод из серебра и хлорида серебра продемонстрировал превосходные характеристики по сравнению с нехлорированными серебряными электродами при использовании для регистрации низкоуровневых потенциалов переменного и постоянного тока. Хлоридированные серебряные электроды представляют меньший низкочастотный «шум», чем золотые или серебряные электроды. Электроды Koslow Silver-Silver Chloride изготовлены из чистого серебра и затем хлорированы для обеспечения стабильности и низких шумовых характеристик. Потенциал серебра / хлорида серебра приблизительно равен (-) 0.199 В относительно нормального водородного электрода (NHE) или -0,047 В относительно насыщенного каломелевого электрода сравнения (SCE) Потенциал электрода стабилен до плюс-минус один милливольт и быстро восстанавливается после небольших скачков температуры.
- Полуэлемент с хлоридом серебра применяется в электроанализе, тестировании и обслуживании аккумуляторов, коррозионных испытаниях, электроаналитических исследованиях, измеряющих потенциалы полуэлементов в свинцово-кислотных аккумуляторах, титровании и многих других электрохимических измерениях.
- Пористый переходной наконечник изготовлен из электропористого стекла KT Glass и может быть заменен в случае повреждения или загрязнения.
- Превосходный перенос ионов и низкий уровень шума
- Идентификационные бирки
- Аккуратно упакованы в удобную картонную коробку и включают инструкции с паспортом безопасности.
Потенциал электрода сравнения серебра / хлорида серебра
| — 244 мВ по сравнению с нормальным водородным электродом (NHE) |
| — 410 мВ по сравнению сЭлектрод сравнения с сульфатом ртути (MSE) |
| — 440 мВ по сравнению с серебром / сульфатом серебра |
youtube.com/embed/d9n3-muB0cw»>
Подробнее:
9009 электроды сравнения используют насыщенный раствор KCL с избытком кристаллов KCL. Иногда на дне электрода можно увидеть бледные белые кристаллы. Дополнительный KCL растворяется в электролите по мере того, как ионы калия и хлора диффундируют через жидкостный переход при обычном использовании.Этот дополнительный буфер KCL продлевает время до того, как эталонная ячейка начинает дрейфовать из-за истощения ионов хлора в электролите.
17.2: Электролиз — Химия LibreTexts
Типичная электролитическая ячейка может быть изготовлена, как показано на рисунке \ (\ PageIndex {1} \). Два электрических проводника (, электроды, ) погружены в жидкость, подлежащую электролизу. Эти электроды часто изготавливаются из инертного материала, такого как нержавеющая сталь, платина или графит.Жидкость, подлежащая электролизу, должна быть способна проводить электричество, поэтому обычно это водный раствор электролита или расплавленное ионное соединение. Электроды подключены проводами к батарее или другому источнику постоянного тока. Этот источник тока можно рассматривать как «электронный насос», который забирает электроны с одного электрода и выталкивает их на другой электрод. Электрод, с которого удаляются электроны, становится положительно заряженным, в то время как электрод, к которому они подводятся, имеет избыток электронов и отрицательный заряд.
Два электрических проводника (, электроды, ) погружены в жидкость, подлежащую электролизу. Эти электроды часто изготавливаются из инертного материала, такого как нержавеющая сталь, платина или графит.Жидкость, подлежащая электролизу, должна быть способна проводить электричество, поэтому обычно это водный раствор электролита или расплавленное ионное соединение. Электроды подключены проводами к батарее или другому источнику постоянного тока. Этот источник тока можно рассматривать как «электронный насос», который забирает электроны с одного электрода и выталкивает их на другой электрод. Электрод, с которого удаляются электроны, становится положительно заряженным, в то время как электрод, к которому они подводятся, имеет избыток электронов и отрицательный заряд.
Отрицательно заряженный электрод притягивает к себе положительные ионы (катионы) из раствора. Он может отдавать часть своих избыточных электронов таким катионам или другим частицам в жидкости, подвергаемой электролизу. Следовательно, этот электрод фактически является восстановителем. В любом электрохимическом элементе (электролитическом или гальваническом) электрод, на котором происходит восстановление , называется катодом .
Положительный электрод, с другой стороны, притягивает к себе отрицательные ионы (анионы). Этот электрод может принимать электроны от этих отрицательных ионов или других частиц в растворе и, следовательно, ведет себя как окислитель. {-} \]
{-} \]
Однако Li + — очень плохой акцептор электронов, и поэтому очень трудно заставить выполняться уравнение \ (\ ref {5} \).{-} \ label {8} \]
Общее уравнение можно получить, умножив уравнение \ (\ ref {7 } \ ) на 2, добавив его к уравнению \ (\ ref {8} \) и сложив H + с OH — , чтобы получить H 2 O:
\ [\ text {2H} _2 \ text {O} (l) \ rightarrow \ text {2H} _2 (g) + \ text {O} _2 (g) \]
На следующем видео показан процесс электролиза воды с использованием серной кислоты в качестве моста для передачи заряда. После завершения электролиза идентичность образующихся газов проверяется с помощью тестов на горючие шины.
Таким образом, этот электролиз обращает спонтанную комбинацию H 2 и O 2 с образованием H 2 O. Обсуждая окислительно-восстановительные реакции, мы упоминаем несколько окислителей, которые, например, достаточно сильны, чтобы окислять H 2 O. В то же время мы описываем восстановители, которые достаточно сильны для восстановления H 2 O, такие как щелочные металлы и более тяжелые щелочноземельные металлы. Как правило, такие вещества нельзя получить электролизом водных растворов, потому что вместо этого H 2 O окисляется или восстанавливается.Вещества, которые подвергаются спонтанной окислительно-восстановительной реакции с H 2 O, обычно получают электролизом расплавов солей или в каком-либо другом растворителе. Однако из этого правила есть некоторые исключения, потому что некоторые электродные реакции протекают медленнее, чем другие. Например, используя таблицу 11.5, мы можем предсказать, что H 2 O является лучшим восстановителем, чем Cl —.
Следовательно, мы ожидаем, что O 2 , а не Cl 2 , будет получен путем электролиза 1 M HCl, что противоречит уравнению \ (\ ref {1} \).Оказывается, что O 2 образуется медленнее , чем Cl 2 , и последний пузырится из раствора до того, как H 2 O может быть окислен. По этой причине Таблицу 1 из раздела Редокс-пары не всегда можно использовать для прогнозирования того, что произойдет при электролизе.
По этой причине Таблицу 1 из раздела Редокс-пары не всегда можно использовать для прогнозирования того, что произойдет при электролизе.
Стандартные электродные потенциалы | Электрохимические реакции
13,6 Стандартные электродные потенциалы (ESCRF)
Стандартные условия (ESCRG)
Стандартные электродные потенциалы являются мерой равновесных потенциалов.Положение этого равновесия может измениться, если вы измените некоторые условия (например, концентрацию, температуру). Поэтому важно использовать стандартные условия:
давление = \ (\ text {101,3} \) \ (\ text {kPa} \) (\ (\ text {1} \) \ (\ text {atm} \))
температура = \ (\ text {298} \) \ (\ text {K} \) (\ (\ text {25} \) \ (\ text {℃} \))
концентрация = \ (\ text {1} \) \ (\ text {мол.{-3} $} \)
Стандартный водородный электрод (ESCRH)
Это разность потенциалов (записанная как напряжение) между двумя электродами, которая заставляет электроны течь от \ (\ color {blue} {\ textbf {анод}} \) к \ (\ color {red} {\ textbf {cathode}} \) через внешнюю цепь гальванического элемента (помните, обычный ток идет в обратном направлении).
Возможно измерение потенциала электрода и электролита.Однако это непростой процесс, и полученное значение будет зависеть от концентрации раствора электролита, температуры и давления.
Способ устранения этих несоответствий — сравнение всех электродных потенциалов со стандартным электродом сравнения . Все эти сравнения выполняются с одинаковыми концентрациями, температурой и давлением. Это означает, что эти значения можно использовать для расчета разности потенциалов между двумя электродами. Это также означает, что потенциалы электродов можно сравнивать без необходимости создания конкретной исследуемой ячейки.
Этот электрод сравнения можно использовать для вычисления относительного потенциала для вещества. В качестве электрода сравнения используется стандартный водородный электрод (рисунок 13.8).
В качестве электрода сравнения используется стандартный водородный электрод (рисунок 13.8).
- Стандартный водородный электрод
Стандартный водородный электрод — это окислительно-восстановительный электрод, который составляет основу шкалы окислительно-восстановительных потенциалов.
Рисунок 13.8: Упрощенная версия стандартного водородного электрода.{-} \) \ (\ rightleftharpoons \) \ (\ text {H} _ {2} (\ text {g}) \)
Стандартный водородный электрод, используемый сейчас, фактически представляет собой потенциал платинового электрода в теоретическом кислотном растворе.
Электродный потенциал водородного электрода в \ (\ text {25} \) \ (\ text {℃} \) оценивается как \ (\ text {4,4} \) \ (\ text {V} \ ). Однако, чтобы использовать его в качестве электрода сравнения, это значение устанавливается на ноль при всех температурах , чтобы его можно было сравнить с другими электродами.
Стандартные электродные потенциалы (ESCRJ)
Чтобы использовал водородный электрод , он должен быть присоединен к исследуемой системе электродов. Например, если вы пытаетесь определить электродный потенциал меди, вам нужно будет подключить медную полуячейку к водородному электроду; если вы пытаетесь определить электродный потенциал цинка, вам нужно будет подключить цинковую полуячейку к водородному электроду и так далее. Рассмотрим подробнее примеры цинка и меди.{-} \) \ (\ to \) \ (\ text {H} _ {2} (\ text {g}) \)
Твердый цинк с большей вероятностью образует ионы цинка, чем газообразный водород — ионы. Упрощенное представление ячейки показано на рисунке 13.9.
Рисунок 13.9: Когда цинк соединен со стандартным водородным электродом, на платиновом (водородном) электроде накапливается относительно небольшое количество электронов. На цинковом электроде много электронов.
При определении стандартных потенциалов восстановления электрода стандартным водородным электродом считается слева (\ (\ text {Pt} (\ text {s}) | \ text {H} _ {2} (\ text {g }), \ text {H} ^ {+} (\ text {aq}) || \)). Таким образом, отрицательное значение означает, что другой элемент или соединение имеет большую тенденцию к окислению, а положительное значение означает, что другой элемент или соединение имеет большую тенденцию к восстановлению.
Таким образом, отрицательное значение означает, что другой элемент или соединение имеет большую тенденцию к окислению, а положительное значение означает, что другой элемент или соединение имеет большую тенденцию к восстановлению.
Вольтметр измеряет разность потенциалов между зарядами этих электродов. В этом случае вольтметр будет показывать \ (- \ text {0,76} \) \ (\ text {V} \), поскольку электрод \ (\ text {Zn} \) имеет относительно большее количество электронов.
Медь
Медь менее склонна к образованию ионов, чем водород, поэтому, если стандартный водородный электрод подключен к медной полуячейке, \ (\ color {red} {\ textbf {медь}} \) будет относительно \ (\ цвет {красный} {\ textbf {менее негативный}} \).{-} \) \ (\ to \) \ (\ text {H} _ {2} (\ text {g}) \)
Ионы меди с большей вероятностью образуют твердую медь, чем ионы водорода, образующие газообразный водород. Упрощенное представление ячейки показано на рисунке 13.10.
Рисунок 13.10: Когда медь подключена к стандартному водородному электроду, на медном электроде накапливается относительно небольшое количество электронов. На водородном электроде много электронов.
Вольтметр измеряет разность потенциалов между зарядами этих электродов.В этом случае вольтметр будет читать \ (\ text {+0,34} \) \ (\ text {V} \), поскольку электрод \ (\ text {Cu} \) имеет относительно меньшее количество электронов.
Напряжения, зарегистрированные при подключении цинка и меди к стандартному водородному электроду, на самом деле являются стандартными электродными потенциалами для этих двух металлов. Важно помнить, что это не абсолютных значений , а потенциалы, которые были измерены на относительно по отношению к потенциалу водорода, если стандартный водородный электрод считается равным нулю.
По соглашению, мы всегда указываем полуреакцию восстановления при задании стандартного потенциала электрода. {-} \)
{-} \)
\ (\ text {+2,87} \)
Таблица 13.{-} \) \ (\ rightleftharpoons \) \ (\ text {Au} \)) означает, что элемент или соединение легко получает электроны. Этот элемент или соединение представляет собой \ (\ color {red} {\ textbf {легко восстанавливается}} \) и, следовательно, является хорошим \ (\ color {red} {\ textbf {окислителем}} \).
\ (\ color {blue} {\ textbf {восстанавливающая способность}} \) (т.е. способность действовать как восстанавливающий агент) элементов или соединений в таблице уменьшается на по мере того, как вы перемещаете вниз на в таблице. .
\ (\ color {red} {\ textbf {окислительная способность}} \) элементов или соединений увеличивается на , когда вы перемещаете вниз на в таблице.{\ circ} \) вычислений. Это потому, что солевой мостик не так эффективен (это всего лишь кусок веревки, пропитанный электролитом). Для достижения наилучших результатов при замачивании струны используйте насыщенный раствор нитрата натрия.
Поднос для кубиков льда, окислительно-восстановительный эксперимент
Цель
Для определения относительной реакционной способности соответствующих металлов и понимания работы простой электрохимической ячейки.
Аппарат
Поднос для кубиков льда, вольтметр и соединительные провода.{-3} $} \) растворов свинца (например, \ (\ text {PbSO} _ {4} \)), магния (например, \ (\ text {MgSO} _ {4} \)), цинка (например, \ (\ text {ZnSO} _ {4} \)) и медь (например, \ (\ text {CuSO} _ {4} \)).
Нить, пропитанная раствором нитрата натрия (\ (\ text {NaNO} _ {3} \)).
Предварительные знания
Электроны движутся от анода к катоду. Обычный ток движется от катода к аноду, поэтому положительный вывод вольтметра будет на катоде, а отрицательный вывод — на аноде. {3} $} \) решений \ (\ text {Pb} \), \ (\ text {Zn} \), \ (\ text {Cu} \) и \ (\ text {Mg} \) в четыре различных углубления для кубиков льда.
{3} $} \) решений \ (\ text {Pb} \), \ (\ text {Zn} \), \ (\ text {Cu} \) и \ (\ text {Mg} \) в четыре различных углубления для кубиков льда.
Они не должны находиться рядом друг с другом, чтобы избежать смешивания растворов.
Прикрепите к зажимам «крокодил» два разных металла. Оберните влажную струну через два используемых раствора (так, чтобы каждый конец струны находился в растворе). Затем поместите металл в соответствующий ионный раствор.
и.{2 +} \) решение.
Используйте комбинации ячеек в следующем порядке:
Pb / Zn; Pb / Cu; Pb / Mg; Zn / Cu; Zn / Mg; Cu / Mg
Определите комбинации металлов, дающие положительный результат.
Составьте таблицу, которая показывает:
комбинация металлов
какой металл является анодом в этой паре металлов
какой металл является катодом в этой паре металлов
Комбинация металлов | Анод | Катод | ||||||||||||||||||
Используйте эту таблицу для ранжирования металлов от самого сильного восстановителя (ранжируйте от самого сильного к самому слабому).
Для каждой комбинации запишите полуреакцию восстановления и полуреакцию окисления, а затем общую реакцию клетки.
Запишите все наблюдения для каждой ячейки.
Вопросы
Объясните, почему напряжения кажутся ниже / выше ожидаемых.
Для чего нужна веревка?
Выводы
В зависимости от электродного потенциала каждого металла один и тот же металл может быть анодом в одной реакции и катодом в другой.Это можно увидеть по положительному или отрицательному показанию вольтметра.
Например, свинец будет восстанавливаться с большей вероятностью, чем цинк, поэтому в этой паре свинец будет катодом, а цинк — анодом. Однако вероятность окисления свинца выше, чем у меди, поэтому в этой паре медь будет катодом, а свинец — анодом.
Зарегистрируйтесь, чтобы получить стипендию и возможности карьерного роста. Используйте практику Сиявулы, чтобы получить наилучшие возможные оценки.
Зарегистрируйтесь, чтобы разблокировать свое будущееТаблица стандартных электродных потенциалов
Упражнение 13.6\ (- \ text {2,37} \) \ (\ text {V} \)
\ (- \ text {0,13} \) \ (\ text {V} \)
\ (- \ text {0,25} \) \ (\ text {V} \)
Какой из металлов окисляется с наибольшей вероятностью?
Ион какого металла восстанавливается с наибольшей вероятностью?
кобальт (III) (фтор не металл)
Какой металл является самым сильным восстановителем?
Если другой электрод изготовлен из магния, происходит ли восстановление или окисление в медной полуреакции? Поясните свой ответ.
Редукция. Приведены значения для полуреакций восстановления. Медь восстанавливается легче (потенциал положительного электрода), чем магний (потенциал отрицательного электрода)
Если другим электродом является олово, происходит ли восстановление или окисление в полуреакции ртути? Поясните свой ответ.
Редукция. Приведены значения для полуреакций восстановления. Ртуть легче восстанавливать (большой потенциал положительного электрода), чем олово (небольшой потенциал отрицательного электрода).{2 +} \)
Самым сильным окислителем является соединение, которое легче всего восстанавливается. Это соединение с наибольшим положительным значением E ° в таблице стандартных восстановительных потенциалов.
Какое вещество является самым сильным окислителем?
Хлор — сильнейший окислитель.
Какое вещество является самым сильным восстановителем?
Кальций — сильнейший восстановитель.
Использование стандартных электродных потенциалов (ESCRK)
Итак, теперь, когда вы понимаете эту полезную таблицу потенциалов восстановления, важно, чтобы вы могли использовать эти значения для расчета разностей потенциальной энергии. Следующие рабочие примеры помогут вам в этом. Во всех этих случаях важно понимать, о чем идет речь.
В этом отработанном примере даны две полуреакции. Оба представлены, как показано в таблице стандартных восстановительных потенциалов, но в действительности восстанавливается только один металл, а другой окисляется.{-} \) \ (\ rightleftharpoons \) \ (\ text {Ag} (\ text {s}) \) (E ° = \ (\ text {+0,80} \) \ (\ text {V} \))
Используйте значения потенциала электрода, чтобы определить, какой металл окисляется, а какой восстанавливается
Оба значения положительны, но у серебра потенциал положительного электрода больше, чем у меди. Следовательно, серебро легче восстанавливается, чем медь, а медь окисляется легче, чем серебро.
Запишите полуреакции восстановления и окисления
Значения E ° взяты из таблицы стандартных понижающих потенциалов.{-} \)
Можно сделать вывод, что магний будет вытеснять серебро из раствора нитрата серебра, так что в растворе будут металлическое серебро и ионы магния.
Если магний способен вытеснить серебро из раствора нитрата серебра, это означает, что металлический магний будет образовывать ионы магния, а ионы серебра станут металлическим серебром. Другими словами, теперь будет серебра металла и раствора нитрата магния .{2 +} \).
Рабочий пример 9: Определение общих реакций
Для ячейки из оксида цинка (\ (\ text {Zn} \)) и золота (III) (\ (\ text {Au} _ {2} \ text {O} _ {3} \)) в растворе \ (\ text {KOH} \) определить:
полуреакции окисления и восстановления
общее вычисленное химическое уравнение
стандартное обозначение ячейки для ячейки
Найдите соответствующие реакции в таблице стандартных электродных потенциалов
В реакции участвуют цинк и золото.{-} \)
Добавьте ионы-наблюдатели и удалите электроны из уравнения
\ (\ text {Au} _ {2} \ text {O} _ {3} (\ text {aq}) + 3 \ text {Zn} (\ text {s}) \) \ (\ to \) \ (2 \ text {Au} (\ text {s}) + 3 \ text {ZnO} (\ text {aq}) \)
Какой материал является анодом, а какой катодом?
Окисление — это потеря электронов на аноде, поэтому анодом является \ (\ text {Zn} (\ text {s}) \).
Восстановление — это усиление электронов на катоде, поэтому катодом является \ (\ text {Au} _ {2} \ text {O} _ {3} \).
Приведите стандартные обозначения клеток для этой реакции
Анод всегда пишется первым (слева): \ (\ text {Zn} (\ text {s}) | \ text {ZnO} (\ text {aq}) \)
Катод всегда пишется вторым (справа): \ (\ text {Au} _ {2} \ text {O} _ {3} (\ text {s}), \ text {Au} (\ text { s}) \)
Следовательно, стандартное обозначение ячеек:
\ (\ text {Zn} (\ text {s}) | \ text {ZnO} (\ text {aq}) || \ text {Au} _ {2} \ text {O} _ {3} (\ текст {s}), \ text {Au} (\ text {s}) \)
В эксперименте по вытеснению вы можете использовать ксилол, толуол или сероуглерод вместо парафина. Однако это не самые лучшие химические вещества для работы. Если вы все же используете одно из этих химикатов, убедитесь, что учащиеся исследуют опасности материалов, с которыми они работают.
Однако это не самые лучшие химические вещества для работы. Если вы все же используете одно из этих химикатов, убедитесь, что учащиеся исследуют опасности материалов, с которыми они работают.
Ученики должны работать с концентрированной сильной кислотой. Концентрированные сильные кислоты могут вызвать серьезные ожоги. Напоминайте учащимся, что при работе со всеми химическими веществами, особенно концентрированными кислотами, необходимо быть осторожными и носить соответствующее защитное снаряжение. Средства защиты включают перчатки, защитные очки и защитную одежду.{3} $} \)), бромная вода, водные растворы хлорида натрия (\ (\ text {NaCl} \)), бромид натрия (\ (\ text {NaBr} \)) и йодид натрия (\ (\ text {NaI} \)), парафин, концентрированный \ (\ text {HCl} \).
5 пробирок, 2 пластиковые капельницы.
Метод
Концентрированный \ (\ text {HCl} \) может вызвать серьезные ожоги. Мы рекомендуем использовать перчатки и защитные очки всякий раз, когда вы работаете с кислотой. Не забудьте добавить кислоту в воду и не вдыхать ее.{3} $} \) концентрированного \ (\ text {HCl} \).
Понаблюдайте за жидкостью и отметьте, что происходит при добавлении \ (\ text {HCl} \), запишите свои наблюдения. Вы образовали раствор хлора в воде .
С помощью пластиковой капельницы перенесите хлористую воду примерно на \ (\ text {1} \) \ (\ text {cm} \) высоту в пробирки с метками A, B и D.
Обратите внимание на любые изменения в пробирке. Запишите все наблюдения.{3} $} \) бромной воды в пробирки с маркировкой C и E.
Обратите внимание на любые изменения в пробирке. Запишите все наблюдения.
С помощью пластиковой капельницы перенесите парафин примерно на \ (\ text {2} \) \ (\ text {cm} \) высоту в каждую пробирку. Закройте пробирку пробкой или резиновой пробкой, крепко удерживая ее на месте большим пальцем, встряхните смесь.
Используйте таблицу окислительно-восстановительного потенциала, чтобы написать общие чистые ионные уравнения для реакций в пробирках B, D и E.
Объясните, используя свое понимание правил растворимости (, как растворяется, как ), почему слой парафина стал окрашенным в пробирках B, D и E. Объясните, что привело к окрашиванию парафина в пробирке C.
Почему в пробирке A не было реакции и изменения цвета?
Результаты
В пробирке присутствует A \ (\ text {Cl} _ {2} \), но он не окрашен, поэтому изменения цвета парафина не наблюдается.{-} \) ионы с образованием \ (\ text {I} _ {2} \), которые превратят парафин в фиолетовый цвет.
Заключение
Молекулы галогена неполярны. Поэтому они растворяются в неполярном растворителе, таком как парафин. Слой парафина станет цвета галогена, присутствующего в растворе. Наиболее вероятно, что из этих трех галогенов восстанавливается хлор, за ним следует бром и затем йод. Это можно увидеть в таблице стандартных электродных потенциалов, поскольку хлор имеет самый большой потенциал положительного электрода из трех галогенов.
Зарегистрируйтесь, чтобы получить стипендию и возможности карьерного роста. Используйте практику Сиявулы, чтобы получить наилучшие возможные оценки.
Зарегистрируйтесь, чтобы разблокировать свое будущееИспользование стандартных электродных потенциалов
Упражнение 13.7Если серебро было добавлено к раствору сульфата меди (II), вытеснит ли оно медь из раствора сульфата меди (II)? Поясните свой ответ.
№
Мы используем таблицу стандартных электродных потенциалов, чтобы найти электродный потенциал для серебра и меди.{-} \) \ (\ rightleftharpoons \) \ (\ text {Cu} (\ text {s}) \) (E ° = \ (\ text {+0,34} \) \ (\ text {V} \))
Серебро имеет большую положительную E °, чем медь. Следовательно, серебро легче восстанавливается (легче образует твердый металл), чем медь (легче образует ионы меди), и оно не сможет вытеснить ионы меди из раствора.
Следовательно, серебро легче восстанавливается (легче образует твердый металл), чем медь (легче образует ионы меди), и оно не сможет вытеснить ионы меди из раствора.
Если цинк добавить в раствор сульфата магния, вытеснит ли цинк магний из раствора? Дайте подробное объяснение своего ответа.{-} \) \ (\ rightleftharpoons \) \ (\ text {Mg} (\ text {s}) \) (E ° = \ (- \ text {2,37} \) \ (\ text {V} \))
Цинк имеет меньшую отрицательную E °, чем магний. Следовательно, цинк легче восстанавливается (легче образует твердый металл), чем магний (легче образует ионы магния), и он не сможет вытеснить ионы магния из раствора.
Если к раствору сульфата кобальта добавить алюминий, вытеснит ли алюминий кобальт из раствора? Дайте подробное объяснение своего ответа.{-} \) \ (\ rightleftharpoons \) \ (\ text {Co} (\ text {s}) \) (E ° = \ (- \ text {0,28} \) \ (\ text {V} \))
Алюминий имеет большую отрицательную E °, чем кобальт. Поэтому алюминий легче окисляется (легче образует ионы алюминия), чем кобальт (легче образует твердый металл), и он сможет вытеснить ионы кобальта из раствора.
ЭДС ячейки (ESCRM)
На примере полуэлементов цинка и меди мы знаем, что когда эти две полуэлементы объединены, цинк будет полуреакцией окисления, а медь — полуреакцией восстановления.{-} \ rightleftharpoons \ text {Zn (s)}} \) (E ° = \ (- \ text {0,76} \) \ (\ text {V} \))
Показания измерителя покажут разность потенциалов между двумя полуэлементами. Это известно как EMF ячейки. Чем выше ЭДС, тем больше энергии выделяется на единицу заряда.
- ЭДС ячейки
ЭДС ячейки определяется как максимальная разность потенциалов между двумя электродами или полуячейками в гальванической ячейке.
ЭДС ячейки такая же, как напряжение на отключенной ячейке (теория электрических цепей , ). {-3} $} \)
{-3} $} \)
Т = \ (\ текст {298} \) \ (\ текст {K} \).
\ (\ _ \ _ \ _ \ _ \ _ \ _ \ _ \ _ \ _ \ _ \ _ \ _ \ _ \ _ \)
В стандартных обозначениях ячеек \ (\ color {blue} {\ textbf {полуячейка анода}} \) всегда пишется на \ (\ color {blue} {\ text {left}} \) и \ ( \ color {red} {\ textbf {катодная полуячейка}} \) всегда пишется на \ (\ color {red} {\ text {right}} \).
\ (\ _ \ _ \ _ \ _ \ _ \ _ \ _ \ _ \ _ \ _ \ _ \ _ \ _ \ _ \)
\ (\ color {blue} {\ text {восстанавливающий агент}} \) используется \ (\ color {blue} {\ text {окисленный}} \).\ (\ color {blue} {\ text {Oxidation}} \) — потеря электронов на \ (\ color {blue} {\ text {анод}} \).
\ (\ color {red} {\ text {окислитель}} \) находится \ (\ color {red} {\ text {уменьшенный}} \). \ (\ color {red} {\ text {Reduction}} \) — это прирост электронов на \ (\ color {red} {\ text {катод}} \).
Важно уметь рассчитать ЭДС электрохимической ячейки. Для расчета ЭДС ячейки:
Причина определения электрода сравнения теперь становится очевидной.Потенциальные различия могут быть рассчитаны на основе электродных потенциалов (определяемых относительно водородной полуячейки) без необходимости каждый раз конструировать сами ячейки.
Можно использовать любое из следующих уравнений:
E ° \ (_ {\ text {(cell)}} = \) E ° (\ (\ color {red} {\ text {полуреакция уменьшения}} \)) — E ° (\ (\ color { синий} {\ text {полуреакция окисления}} \))
E ° \ (_ {\ text {(cell)}} = \) E ° (\ (\ color {red} {\ text {окислитель}} \)) — E ° (\ (\ color {blue} {\ text {восстановитель}} \))
E ° \ (_ {\ text {(cell)}} = \) E ° (\ (\ color {red} {\ text {cathode}} \)) — E ° (\ (\ color {blue} { \ text {анод}} \))
Итак, для ячейки \ (\ text {Zn} \) — \ (\ text {Cu} \):
E ° \ (_ {\ text {(cell)}} = \) \ (\ text {0,34} \) — (\ (- \ text {0,76} \)) = \ (\ text { 0,34} \) + \ (\ text {0,76} \) = \ (\ text {1,10} \) \ (\ text {V} \)
- Стандартный ЭДС
Стандартная ЭДС (E ° \ (_ {\ text {cell}} \)) — ЭДС гальванического элемента, работающего в стандартных условиях.
 Символ ° обозначает стандартные условия.
Символ ° обозначает стандартные условия.
Рабочий пример 10: Расчет ЭДС ячейки
Ячейка содержит твердый свинцовый анод в растворе ионов золота.
Изобразите ячейку в стандартных обозначениях.
Рассчитайте потенциал ячейки (ЭДС) электрохимической ячейки.
Найдите соответствующие реакции в таблице стандартных электродных потенциалов
В реакции участвуют свинец и золото.{-} \) \ (\ rightleftharpoons \) \ (\ text {Au} (\ text {s}) \) (E ° V = \ (\ text {+1,50} \) \ (\ text {V } \))
Какой металл с большей вероятностью будет восстанавливаться, а какой окисляться?
E ° свинца — это небольшое отрицательное значение, а E ° золота — большое положительное число. Следовательно, свинец окисляется легче, чем золото, а золото легче восстанавливается, чем свинец.
Определите, какой металл является катодом, а какой — анодом
Окисление — это потеря на аноде, поэтому анодом является свинец.{3 +} (\ text {aq}) | \ text {Au} (\ text {s}) \)
Рассчитать потенциал ячейки
E ° \ (_ {\ text {(cell)}} = \) E ° \ (_ \ text {(катод)} \) — E ° \ (_ \ text {(анод)} \)
E ° \ (_ {\ text {(cell)}} = \) E ° \ (_ \ text {(gold)} \) — E ° \ (_ \ text {(lead)} \)
= \ (\ text {+1,50} \) — (\ (- \ text {0,13} \))
= \ (\ text {+1,63} \) \ (\ text {V} \)
Рабочий пример 11: Расчет ЭДС ячейки
Рассчитайте потенциал ячейки электрохимической ячейки, в которой происходит следующая реакция, и представьте ячейку в стандартных обозначениях.{-} \) \ (\ rightleftharpoons \) \ (\ text {H} _ {2} (\ text {g}) \) (E ° = \ (\ text {0,00} \) \ (\ text {V} \))
Какой элемент с большей вероятностью будет восстанавливаться, а какой окисляться?
Е ° магния — более отрицательное значение, чем Е ° водорода. {2 +} (\ text {aq}) | \ text {Pt} (\ text {s}) \)
Рассчитать ЭДС ячейки
E ° \ (_ \ text {(ячейка)} \) = E ° \ (_ \ text {(катод)} \) — E ° \ (_ \ text {(анод)} \)
E ° \ (_ \ text {(cell)} \) = E ° \ (_ \ text {(перманганат-ион)} \) — E ° \ (_ \ text {(ион железа)} \) = \ ( \ text {1,52} \) — \ (\ text {0,77} \) = \ (\ text {+0,75} \) \ (\ text {V} \)
Спонтанность (ESCRN)
Самопроизвольное |
положительное ЭДС |
Несамопроизвольное |
отрицательное ЭМП |
Таблица 13.4: Использование ЭМП для определения спонтанности клеток.
Из таблицы потенциалов восстановления (Таблица 13.2) видно, что разные металлы имеют разную химическую активность. Некоторые восстанавливаются легче, чем другие. Вы также можете сказать, что одни окисляются легче, чем другие.
Например, медь (E ° = \ (\ text {+0,34} \) \ (\ text {V} \)) восстанавливается легче, чем цинк (E ° = \ (- \ text {0,76 } \) \ (\ текст {V} \)). Следовательно, если реакция включает восстановление меди и окисление цинка, она будет происходить спонтанно.Однако, если это требует окисления меди и восстановления цинка, это не произойдет самопроизвольно.
Чтобы предсказать, происходит ли реакция спонтанно, вы можете посмотреть на знак значения ЭДС для ячейки. Если ЭДС положительна , тогда реакция будет спонтанной . Если ЭДС отрицательная , тогда реакция будет , а не спонтанной .
Можно провести эксперименты, чтобы предсказать, будет ли реакция спонтанной или нет.{-} {\ text {(aq)}}} \) (E ° = \ (\ text {+1,06} \) \ (\ text {V} \))
ЭДС = E ° (полуреакция восстановления) — E ° (полуреакция окисления)
ЭДС = E ° (свинец) — E ° (бромид)
EMF = \ (- \ text {0,13} \) \ (\ text {V} \) — \ (\ text {1,06} \) = \ (- \ text {1,19} \) \ (\ text {V} \)
Знак ЭДС отрицательный, поэтому эта реакция не будет происходить самопроизвольно. Давайте рассмотрим причины этого более подробно.
Посмотрите на потенциал электрода для первой полуреакции.{-} \) \ (\ to \) \ (\ text {Cu} (\ text {s}) \)
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(сокращение)}} \) — E ° \ (_ {\ text {(окисление)}} \ )
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(медь)}} \) — E ° \ (_ {\ text {(silver)}} \ )
E ° \ (_ {\ text {(cell)}} \) = \ (\ text {+0,34} \) \ (\ text {V} \) — (\ (\ text {+0,80 } \) \ (\ text {V} \)) = \ (- \ text {0,46} \) \ (\ text {V} \)
E ° \ (_ {\ text {(cell)}} \) отрицательный, поэтому эта реакция не является спонтанной.
Напишите уравнение реакции, используя таблицу электродных потенциалов.{-} \) \ (\ rightleftharpoons \) \ (\ text {H} _ {2} (\ text {g}) \) (E ° = \ (\ text {0,00} \) \ (\ text {V} \))
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(сокращение)}} \) — E ° \ (_ {\ text {(окисление)}} \ )
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(водородный ион)}} \) — E ° \ (_ {\ text {(никель)}} \)
E ° \ (_ {\ text {(cell)}} \) = \ (\ text {0,00} \) \ (\ text {V} \) — (\ (- \ text {0,25} \) \ (\ text {V} \)) = \ (\ text {+0,25} \) \ (\ text {V} \)
E ° \ (_ {\ text {(cell)}} \) положительный, поэтому эта реакция спонтанная.{-} \) \ (\ to \) \ (\ text {Mg} (\ text {s}) \)
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(сокращение)}} \) — E ° \ (_ {\ text {(окисление)}} \ )
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(магний)}} \) — E ° \ (_ {\ text {(цинк)}} \ )
E ° \ (_ {\ text {(cell)}} \) = \ (- \ text {2,37} \) \ (\ text {V} \) — (\ (- \ text {0,76 } \) \ (\ text {V} \)) = \ (- \ text {1,61} \) \ (\ text {V} \)
Знак E ° \ (_ {\ text {(cell)}} \) отрицательный, поэтому эта реакция не является спонтанной.{-} \) \ (\ to \) \ (\ text {Ba} (\ text {s}) \)
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(сокращение)}} \) — E ° \ (_ {\ text {(окисление)}} \ )
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(барий)}} \) — E ° \ (_ {\ text {(цинк)}} \ )
E ° \ (_ {\ text {(cell)}} \) = \ (- \ text {2,90} \) \ (\ text {V} \) — (\ (- \ text {0,76 } \) \ (\ text {V} \)) = \ (- \ text {2,14} \) \ (\ text {V} \)
Знак E ° \ (_ {\ text {(cell)}} \) отрицательный, поэтому эта реакция не является спонтанной.{-} \) \ (\ to \) \ (\ text {Cu} (\ text {s}) \)
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(сокращение)}} \) — E ° \ (_ {\ text {(окисление)}} \ )
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(медь)}} \) — E ° \ (_ {\ text {(цинк)}} \ )
E ° \ (_ {\ text {(cell)}} \) = \ (\ text {0,34} \) \ (\ text {V} \) — (\ (- \ text {0,76} \) \ (\ text {V} \)) = \ (\ text {+1,1} \) \ (\ text {V} \)
Знак Е ° \ (_ {\ text {(cell)}} \) положительный, поэтому эта реакция спонтанная.{-} \) \ (\ to \) \ (\ text {Cd} (\ text {s}) \)
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(сокращение)}} \) — E ° \ (_ {\ text {(окисление)}} \ )
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(cadmium)}} \) — E ° \ (_ {\ text {(цинк)}} \ )
E ° \ (_ {\ text {(cell)}} \) = \ (- \ text {0,40} \) \ (\ text {V} \) — (\ (- \ text {0,76 } \) \ (\ text {V} \)) = \ (\ text {+0,36} \) \ (\ text {V} \)
Знак Е ° \ (_ {\ text {(cell)}} \) положительный, поэтому эта реакция спонтанная.{-} \) \ (\ to \) \ (\ text {Cu} (\ text {s}) \)
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(сокращение)}} \) — E ° \ (_ {\ text {(окисление)}} \ )
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(медь)}} \) — E ° \ (_ {\ text {(алюминий)}} \ )
E ° \ (_ {\ text {(cell)}} \) = \ (\ text {+0,34} \) \ (\ text {V} \) — (\ (- \ text {1,66 } \) \ (\ text {V} \)) = \ (\ text {+2,00} \) \ (\ text {V} \)
Знак E ° \ (_ {\ text {(cell)}} \) положительный, поэтому эта реакция является спонтанной.{-} \) \ (\ to \) \ (\ text {Zn} (\ text {s}) \)
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(сокращение)}} \) — E ° \ (_ {\ text {(окисление)}} \ )
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(цинк)}} \) — E ° \ (_ {\ text {(алюминий)}} \ )
E ° \ (_ {\ text {(cell)}} \) = \ (- \ text {0,76} \) \ (\ text {V} \) — (\ (- \ text {1,66 } \) \ (\ text {V} \)) = \ (\ text {+0,90} \) \ (\ text {V} \)
Знак E ° \ (_ {\ text {(cell)}} \) положительный, поэтому эта реакция является спонтанной.{-} \) \ (\ to \) \ (\ text {Na} (\ text {s}) \)
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(сокращение)}} \) — E ° \ (_ {\ text {(окисление)}} \ )
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(натрия)}} \) — E ° \ (_ {\ text {(алюминий)}} \ )
E ° \ (_ {\ text {(cell)}} \) = \ (- \ text {2,71} \) \ (\ text {V} \) — (\ (- \ text {1,66 } \) \ (\ text {V} \)) = \ (- \ text {1,05} \) \ (\ text {V} \)
Знак E ° \ (_ {\ text {(cell)}} \) отрицательный, поэтому эта реакция не является спонтанной.{-} \) \ (\ to \) \ (\ text {Pb} (\ text {s}) \)
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(сокращение)}} \) — E ° \ (_ {\ text {(окисление)}} \ )
E ° \ (_ {\ text {(cell)}} \) = E ° \ (_ {\ text {(свинец)}} \) — E ° \ (_ {\ text {(алюминий)}} \ )
E ° \ (_ {\ text {(cell)}} \) = \ (- \ text {0,13} \) \ (\ text {V} \) — (\ (- \ text {1,66 } \) \ (\ text {V} \)) = \ (\ text {+1,53} \) \ (\ text {V} \)
Знак E ° \ (_ {\ text {(cell)}} \) положительный, поэтому эта реакция является спонтанной.Следовательно, \ (\ text {Pb} (\ text {NO} _ {3}) _ {2} \) нельзя хранить в алюминиевом контейнере.
Гальванические элементыи уравнение Нернста
Учебное пособие по электрохимии: гальванические элементы и уравнение Нернста >> Шаг 2: электрохимический элемент
Шаг 2: Электрохимическая ячейка
В фильме на предыдущей странице, когда цинковая полоска помещается в раствор с ионами Cu 2+ , происходит следующая самопроизвольная окислительно-восстановительная реакция:
| Zn (s) + Cu 2+ (водн.) -> Zn 2+ (водн.) + Cu (s) | Полная окислительно-восстановительная реакция |
В этой окислительно-восстановительной реакции электроны передаются от Zn к Cu 2+ .Ранее мы писали полуреакции, иллюстрирующие природу этого электронного потока:
| Zn (s) -> Zn 2+ (водн.) + 2 e — | Окисление |
| Cu 2+ (водн.) + 2 e — -> Cu (s) | Редукция |
Электрохимическая ячейка заставляет электроны проходить через провод, когда они переходят от Zn к ионам Cu 2+ .
Электрохимическая ячейка состоит из двух «полуячейков», которые соответствуют каждой из вышеуказанных реакций полуячейки. Для полуячейки, соответствующей В реакции окисления полоску металлического Zn помещают в раствор ионов Zn 2+ . Для восстановительной полуячейки полоса металлической Cu помещается в раствор ионов Cu 2+ . Затем мы соединяем эти клетки вместе (используя провод и солевой мост), чтобы создать электрическую цепь. Следующие видео объясняет эту установку и подробно описывает процесс на молекулярном уровне:
После просмотра видео заполните приведенную ниже схему, чтобы определить ключевые компоненты электрохимической ячейки:
Имейте в виду, что в электрохимической ячейке в растворе перемещаются только ионы.Электроны перемещаются между электродами на проводе и никогда не попадают в раствор. Поток электричества в цепи поддерживается электронами, движущимися по проводам, и ионами, движущимися через раствор.
В нашей лаборатории мы будем использовать ячейку Карру, которая обеспечивает более удобное средство для проведения экспериментов с электрохимическими ячейками. Ячейка Карроу имеет
количество лунок, которые служат указанными выше стаканами. В каждой из внешних ячеек находится по полуячейке. Соляной мост, соединяющий два из этих внешних колодцев, проходит
через центр хорошо.Для этого нужно заполнить центральную лунку солевым раствором и с помощью бумаги соединить каждую из внешних лунок с центральной лункой.
Бумага пропитана солевым раствором, чтобы ионы могли проходить через бумагу. (См. Изображение справа).
На изображениях справа показано, как выглядит клетка кару в лаборатории и как мы изображаем ее схематично. На схеме показана ячейка для спонтанной реакции между металлическим Zn и ионами Pb 2+ :
| Zn (s) + Pb 2+ (водн.) -> Zn 2+ (водн.) + Pb (s) | Полная окислительно-восстановительная реакция |
Мы можем понять направление потока электронов, разбив его на полуреакции:
| Zn (s) -> Zn 2+ (водн.) + 2 e — | Окисление |
| Pb 2+ (водн.) + 2 e — -> Pb (s) | Редукция |
Электроны покидают полуячейку Zn и направляются к полуячейке Pb.Удобное сокращенное обозначение для этого:
.Zn (s) | Zn 2+ (водн.) || Pb 2+ (водн.) | Пб (т)
В этом обозначении анод или полуэлемент окисления находится слева, а катод или полуэлемент восстановления — справа. Двойная вертикальная линия || представляет солевой мостик, а одиночная вертикальная линия представляет фазовую границу между твердым металлом и его солевым раствором.
Вольтметр используется для измерения потенциала или напряжения электрохимической ячейки.Вольтметры имеют положительную и отрицательную клеммы, и, как правило, красный провод подключается к положительной клемме, а черный провод — к отрицательной клемме. Знак показания вольтметра говорит нам о самопроизвольном направлении потока электронов. В ячейке: Zn (s) | Zn 2+ (водн.) || Pb 2+ (водн.) | Pb (s) , спонтанная окислительно-восстановительная реакция соответствует потоку электронов от Zn к полуячейке Pb. Если черный провод подключен к Zn-электроду, а красный провод подключен к Pb-электроду, то вольтметр покажет положительное значение.Если мы обратим это, подключив черный провод к Pb-электроду и красный провод к Zn-электроду, то вольтметр покажет отрицательное значение. Помните: если вольтметр показывает положительное значение, то самопроизвольное направление потока электронов — от черного провода к красному. Обычно в электрохимии используются термины «анод и катод». Электроны текут от анода (источника электронов или источника электронов) к катоду (приемнику электронов или приемнику электронов). Если вольтметр показывает положительное значение, черный провод находится на аноде, а красный провод — на катоде.
Видео-вопрос: Ионное уравнение электролиза расплавленной соли бария на отрицательном электроде
Стенограмма видео
Металлический барий можно получить путем электролиза его расплавленной соли. Какое из следующих уравнений показывает реакцию, происходящую на отрицательном электроде? (A) Барий плюс два электрона производит барий два плюс.(B) Барий производит два бария. плюс ион плюс два электрона. (C) Барий два плюс ион плюс два электроны производят барий. (D) Барий два плюс ион плюс два электроны производят два атома бария. Или (E) два плюс ион бария производит барий и два электрона.
Этот вопрос касается электролиз солевого расплава. Этот процесс происходит, когда мы окунаем два электроды, подключенные к батарее, в жидкую форму соли.Жидкая соль состоит из свободно плавающие положительные и отрицательные ионы. В этом вопросе положительные ионы или катионы будут ионами бария. Идентичность отрицательных ионов не важно для ответа на вопрос, поэтому давайте просто воспользуемся хлоридом в качестве пример. Когда цепь включена, ионы будут притягиваться к электродам противоположного заряда. Когда ионы достигают каждого электрода, произойдет реакция.
Этот вопрос спрашивает, что происходит с ионами бария на поверхности электрода, показанного здесь на оставил? Каждый выбор по сути один и тот же три части информации переставлены. Чтобы ответить на этот вопрос, мы должны спросить, когда присутствуют ионы бария? Когда присутствуют атомы бария? И поглощаются ли электроны или выпущен во время этого процесса?
Давайте посмотрим на формулировку вопрос, чтобы понять, что происходит.Как мы только что объяснили, расплавленный соль включает ионы. И электролиз расплавленного соль начинается с ионов. Точно так же, если мы пытаемся получить металлический барий, что должно означать, что атомная форма бария является продуктом Реакция. Это означает, что мы можем исключить выбор (A) и (B) из рассмотрения. Мы хотим, чтобы ион был слева часть уравнения в качестве реагента, и атом должен быть в правой части уравнение как продукт.Мы знаем, что металлический барий образует как продукт реакции. Это будет сделано путем нанесения покрытия на электрод.
Наш следующий вопрос: что происходит? с электронами, чтобы это произошло? При электролизе поток электронов от анода к катоду. Они снимаются с ионов на анод и отдан ионам на катоде. В нашем примере электроны на катоде барию отдаются два плюс-иона.Два плюс заряда бария ион и объединенные два отрицательных заряда двух электронов уравновешиваются. В результате атомы металлического бария форма. Мы можем упростить этот процесс, говоря, что ион бария получил электроны, чтобы сформировать атом. Выбор (E), где электроны продукт реакции, обратная ситуация, когда электроны высвобождаются от иона. Мы хотим, чтобы электроны объединились с ионом, чтобы сформировать атом, как они это делают в вариантах (C) и (D).
Последнее, что нам нужно учитывать будет ли комбинация иона бария и двух электронов производить один атом бария или два атома бария. Проще говоря, правильный ответ выбор (С). Один ион соединяется с электронами, чтобы образуют один атом. Эта реакция описывает то, что происходит на отрицательном электроде, когда мы электролизуем расплавленную соль, содержащую барий. Ион бария получит два электроны с образованием атома металлического бария.Когда атом или ион приобретают электронов, мы называем это сокращением.
Электролиз — один из способов выделения чистые металлы. Фактически, барий был впервые выделен британским химиком сэром Хамфри Дэви в 1808 году, когда он электролизовал расплавленный барий окись. Итак, когда мы получаем металлический барий путем электролиза его расплавленной соли уравнение, показывающее реакцию на отрицательном электроде — выбор (C), ион бария плюс два электрона. производит атом бария.
Испытание пальцевидным электродом сравнения и EL-Software
Иногда электрод сравнения в форме пальца может быть лучше, чем наш стандартный электрод сравнения в форме кольца. Указатель пальца измеряет электрический потенциал в середине стопки, а не на внешнем крае стопки ячеек. Это может помочь минимизировать артефакты, вызванные неоднородностями электрического поля. Палец изготовлен из нержавеющей стали и покрыт полиимидом, за исключением области измерения на конце пальца.Доступны пальцы различной геометрии.–
Палец-электрод сравнения считается полезным для нескольких сценариев:
- Может использоваться как электрод сравнения из нержавеющей стали.
- Пользователь может покрыть его эталонным материалом (например, LTO).
- Пользователь может литиировать или делитировать его на месте после сборки клеток.
Все эти сценарии отлично поддерживаются нашими тестерами батарей PAT, такими как PAT Tester-x-8 и EL-Software.Это показано здесь на примере ячейки, состоящей из NCM и графита. После сборки элемента на палец из нержавеющей стали сначала наносят гальваническое покрытие литием, используя электрод NCM в качестве источника лития.
Предварительное литиирование пальцевидного электрода из нержавеющей стали (R) от электрода NCM (1)
На втором этапе литиированный палец используется в качестве стабильного электрода сравнения при циклировании NCM / графитового элемента. Переключение между двумя режимами легко осуществить в тестовом скрипте.Нет необходимости менять кабельные соединения, как это было бы необходимо с обычным тестером батареи.
После литирования электрод R служит истинным эталоном при циклическом цикле NCM / графитовой ячейки.
Заключение:
EL-Software и PAT-Core делают предварительную литизацию простой задачей.
Общие сведения об анодной и катодной стимуляции
Практикуете ли вы нейрофизиологию в хирургии, в лаборатории или в клинике, вы, вероятно, ежедневно используете электрическую стимуляцию для активации нервной системы.Как вы, вероятно, знаете, стимуляция катодная лучше всего работает в некоторых приложениях, а стимуляция анодная лучше всего работает в других приложениях.
Вооружившись этими знаниями, вы точно знаете, где разместить электроды на теле и куда подключить эти электроды — черный на катоде (-) и красный на аноде (+). Но какая разница? Что такое анодная или катодная стимуляция и почему в некоторых приложениях одна из них работает лучше, чем другая?
Сегодня я надеюсь ответить на некоторые из этих вопросов для вас, потому что я считаю, что понимание полярности стимулов важно, и это сделает вас лучшим нейрофизиологом.
Прежде чем мы поговорим о том, как работают стимуляторы , важно иметь общее представление о том, как работает батарея .
Как работает аккумулятор
Правильный термин для того, что мы часто называем «батареей», — это «элемент», но я собираюсь использовать слово «батарея» для простоты. Итак, батарея является устройством разделения заряда. Он накапливает электрическую энергию, разделяя катионы , и анионы , на два отдельных отсека или терминала (рис. 1).
- Катионы — положительно заряженные ионы (+).
- Анионы — отрицательно заряженные ионы (-).
Если вы обратитесь к иллюстрации на Рисунке 1, вы увидите, что одна клемма батареи содержит избыток катионов (+), и это положительная клемма (+) . Поскольку он содержит катионов (+), положительный (+) вывод батареи называется катодом (+).Другая клемма батареи содержит избыток анионов (-), и это отрицательная клемма (-). Поскольку он содержит анионов (-), отрицательная (-) клемма батареи называется анодом (-).
Когда аккумулятор подключен к нагрузке , в данном случае лампочке, устройство питается от протекающего тока. Обычный ток предполагает, что ток течет от положительной клеммы, через цепь к отрицательной клемме.Это была конвенция , выбранная во время открытия электричества, но они ошибались! Скорее, Электрический ток — это то, что на самом деле происходит, когда электроны (-) выходят из отрицательной клеммы (анода) через цепь и попадают в положительную клемму (катод).
Вывод: в батарее ток течет от анода к катоду. Чтобы узнать больше об аккумуляторах, перейдите сюда.
Как работает электростимулятор
В электрическом стимуляторе поток анионов (-) и катионов (+) контролируется механикой схемы внутри стимулятора.Стимулятор уникален тем, что катод является отрицательным полюсом (-), потому что он разряжает анионы (-), а анод является положительным полюсом (+), потому что он разряжает катионы (+). В конце концов, это фундаментальное различие между батареей и стимулятором.
В зависимости от того, как мы настроим полярность , стимулятор будет выбрасывать катионы или анионы в стимулируемую часть тела.
При катодной стимуляции анионы (-) разряжаются в тело, когда ток течет от катода (-) через ткань и обратно к аноду (+).
При анодной стимуляции катионы (+) разряжаются в тело, когда ток течет от анода (+) через ткань и обратно к катоду (-).
Теперь представим, что мы помещаем электрический стимулятор на поверхность кожи, а под ним проходит нервный пучок (рис. 2).Внутри нервного пучка находится одно нервное волокно (аксон), на котором мы сосредоточимся.
В состоянии покоя внутренняя часть ячейки более негативна, чем внешняя часть ячейки. Это происходит потому, что количество отрицательных зарядов немного больше, чем положительных зарядов внутри клетки (внутриклеточное пространство), и немного большее количество положительных зарядов, чем отрицательных зарядов вне клетки (внеклеточное пространство). Из-за разницы в электричестве ячейка называется поляризованной — как и у магнита, одна сторона более положительная, а другая — отрицательная.Если бы электрический градиент внезапно изменился на противоположный, клетка была бы деполяризованной , и мы могли бы увидеть потенциал действия .
Катодная стимуляция периферических нервов
Когда мы используем термин катодная стимуляция , мы имеем в виду, что отрицательно заряженные анионы (-) текут от катода в ткань и обратно к аноду (рис. 3). Когда электрический ток течет от катода к аноду, отрицательные заряды (анионы) имеют тенденцию накапливаться на внешней поверхности нервной мембраны, поскольку они будут отталкиваться отрицательно заряженным катодом.Это делает внешнюю часть мембраны более негативной. Следовательно, внутренняя часть мембраны становится более положительной из-за накопления положительных ионов внутри. Это приведет к деполяризации , , которая, если она будет достаточной по величине, приведет к потенциалу действия (нервный импульс или активация мышц).
Рисунок 3 иллюстрирует активацию аксона под катодом. В результате стимуляции потенциал действия передается в обоих направлениях по длине нерва, начиная с катода.Но что-то интересное происходит под анодом! Весь отрицательный заряд из внеклеточного пространства притягивается к аноду, в результате чего внешняя часть ячейки становится чрезмерно электрически положительной по сравнению с внутренней частью ячейки. Таким образом, ячейка гиперполяризована под анодом , что означает, что ее очень и очень трудно активировать.
Если вы примените приведенную выше информацию к SSEP срединного нерва (Рисунок 4), то вы увидите, почему анод всегда дистально , а катод всегда проксимально .
Что произойдет, если вы случайно перевернете электроды стимуляции при выполнении теста SSEP? Сложность, с которой вы можете столкнуться при попытке получить SSEP, объясняется явлением анодной блокировки (рис. 3). Таким образом, когда концы биполярных электродов имеют ту же ориентацию, что и волокно, волокно будет деполяризовано под катодом и гиперполяризовано под анодом. Если гиперполяризация достаточно велика, потенциал действия, инициированный под катодом, может не распространяться через область гиперполяризации.В этом случае потенциал действия будет распространяться только в одном направлении. Хотя мы часто говорим о феномене анодной блокировки, вы не увидите этого в клиническом сценарии, если используете соответствующие параметры стимуляции. Для интраоперационного мониторинга ССВП следует использовать супрамаксимальную стимуляцию . Стимул высокой интенсивности преодолеет любые проблемы, которые могут возникнуть в результате анодной блокировки.
Анодная стимуляция периферических нервов
Когда мы используем термин анодная стимуляция , мы имеем в виду, что катионы (+) текут от анода в ткань и обратно к катоду (рис. 5).При воздействии на поверхность нерва анодный ток увеличивает концентрацию катионов (+) во внеклеточном пространстве под анодом. Это приведет к гиперполяризации , , что, как я только что упомянул, переводит клетку в состояние повышенного покоя. Итак, на рисунке 5 мы видим, что аксон нерва деактивируется (гиперполяризуется) под анодом.
Важность ориентации клеток
Во всех примерах, описанных до сих пор, ориентация ячейки под стимулятором была горизонтальной относительно ориентации анода и катода (рисунки 2-5).Обычно это происходит при стимуляции нервов в руках и ногах.
Что произойдет, если ориентация ячейки будет вертикальной относительно ориентации анода и катода? Ответ заключается в том, что обычно все работает точно напротив тому, что мы только что обсудили относительно горизонтально ориентированных ячеек.
Это становится особенно важным в головном мозге, где пирамидные клетки коры головного мозга ориентированы вертикально по отношению к поверхности, которую мы стимулируем.
Анодная стимуляция коры головного мозга
Электростимуляция коры головного мозга используется по многим причинам, но сегодня я собираюсь сосредоточиться на моторных вызванных потенциалах (МВП). Если вы используете электричество (в отличие от магнита), чтобы вызвать MEP в своей клинической практике, надеюсь, вы знаете следующий принцип:
Независимо от того, стимулируете ли вы кожу головы над моторной корой головного мозга или напрямую стимулируете кортикальную поверхность, MEP всегда легче всего выявить и охарактеризовать при использовании анодной, монополярной стимуляции с последовательностью импульсов. С подкорковой стимуляцией все немного меняется, но это тема для другого дня.
Начиная с Фрича и Хитцига (1870), многие исследователи показали, что монополярная стимуляция моторной коры более эффективна с анодом, чем с катодом. Кроме того, монополярная анодная стимуляция, по-видимому, напрямую активирует пирамидные клетки.
Один из предложенных механизмов заключается в том, что анодный ток входит (и гиперполяризует) дендриты на поверхности мозга, затем уходит и деполяризует аксон или тело клетки.Один из способов подумать об этом показан на рисунке 7.
Анодная стимуляция — это просто инъекция положительно заряженных ионов под электрод. Поскольку противоположности притягиваются, отрицательно заряженные ионы мигрируют к самой поверхности коры под анодом. Вы можете думать об этом как о приемнике тока , и следствием этого является гиперполяризация апикальных дендритов пирамидной клетки. Чтобы компенсировать этот сток тока, источник тока генерируется дистально, так что положительно заряженные ионы собираются вокруг другого конца пирамидальной ячейки.Это приводит к деполяризации (активации) тела клетки, бугорка аксона и начального сегмента аксона, образующего кортикоспинальный тракт.
Конечно, не все так просто! Компьютерное моделирование рисует более сложную картину. Как показано на рисунке 8, нервный ответ на стимуляцию, вероятно, представляет собой сложный паттерн деполяризации и гиперполяризации по всей нейронной геометрии клетки, которая зависит от параметров стимуляции и положения нейронов относительно электрода.Ясно, что когда длинная ось клетки ориентирована вертикально относительно ориентации анодного стимулирующего электрода, компьютерное моделирование поддерживает гиперполяризацию апикальных дендритов и деполяризацию вокруг бугорка аксона.
Все сводится к ориентации клетки!
Подумайте об этом … когда вы помещаете монополярный стимулирующий электрод над моторной корой и проводите анодную стимуляцию, ваши самые низкие пороговые значения CMAP исходят от вертикально ориентированных клеток чуть ниже вашего электрода.Если вы делаете транскраниальную МВП, ваш электрод, вероятно, C3 или C4, верно? И электрод — прямо над изображением моторного гомункула. Вам действительно нужно увеличивать интенсивность, чтобы получить MEP от ног, верно? Это связано с тем, что эти клетки «ноги» находятся глубоко в межполушарной щели и , клетки ориентированы горизонтально по отношению к анодному стимулирующему электроду. НО, если вы поменяете полярность и проведете катодную стимуляцию с одного и того же электрода, MEP от ног иногда будет легче вызвать, а руки станут более сложными.Этот феномен лучше всего работает, когда вы стимулируете интенсивность около пороговой. Вы можете использовать это для устранения неполадок ваших MEP. Если вы начинаете стимуляцию и получаете МВП от ног / ступней с меньшей интенсивностью, чем руки / кисти, то ваша полярность, вероятно, обратная.
Список литературы
- Fritsch GT, Hitzig E. 1870. Über die elektrische Erregbarkeit des Grosshirns. Arch Anat Physiol Med Wiss 300–32. Перевод в фон Бонине Г. 1960. Некоторые статьи о коре головного мозга.Спрингфилд (Иллинойс): Чарльз Томас.
- Merrill DR, Bikson M, Jefferys JGR. Электрическая стимуляция возбудимой ткани: разработка эффективных и безопасных протоколов. J Neurosci Methods. 2005 15 февраля; 141 (2): 171-198.
- Наир Д.Р., Берджесс Р., Макинтайр С.К., Людерс Х. Хронические субдуральные электроды в лечении эпилепсии.


 То есть, нет необходимости зачищать сварные кромки от масла, жира, загрязнений и даже ржавчины.
То есть, нет необходимости зачищать сварные кромки от масла, жира, загрязнений и даже ржавчины.
 Символ ° обозначает стандартные условия.
Символ ° обозначает стандартные условия.