ICSC 0656 — ФТОРИД ХЛОРА (III)
ICSC 0656 — ФТОРИД ХЛОРА (III)« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| ФТОРИД ХЛОРА (III) | ICSC: 0656 (Сентябрь 1997) |
| CAS #: 7790-91-2 |
| UN #: 1749 |
| EINECS #: 232-230-4 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее, но способствует возгоранию других веществ. При пожаре выделяет раздражающие или токсичные пары (или газы). Многие реакции могут привести к пожару или взрыву. Риск взрыва при контакте с водой или органическими материалами. При пожаре выделяет раздражающие или токсичные пары (или газы). Многие реакции могут привести к пожару или взрыву. Риск взрыва при контакте с водой или органическими материалами. |
НЕ допускать контакта с легковоспламеняющимися веществами. НЕ допускать контакта с водой. | В случае возникновения пожара в рабочей зоне, использовать надлежащие средства пожаротушения. В случае пожара: охлаждать баллон распыляя воду. НЕ допускать прямого контакта с водой. Бороться с огнем из укрытия. |
| ИЗБЕГАТЬ ЛЮБЫХ КОНТАКТОВ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Ощущения жжения. Кашель. Боли в горле. Затрудненное дыхание. Сбивчивое дыхание. | Применять вентиляцию, местную вытяжку или средства защиты органов дыхания. |
Свежий воздух, покой. Полусидячее положение. Обратиться за медицинской помощью. |
| Кожа | Покраснение. Серьезные ожоги кожи. Боль. Волдыри. | Защитные перчатки. Защитная одежда. | Сначала промыть большим количеством воды в течение не менее 15 минут, затем удалить загрязненную одежду и снова промыть. обратиться за медицинской помощью . |
| Глаза | Покраснение. Боль. Сильные глубокие ожоги. Потеря зрения. | Использовать маску для лица или средства защиты глаз в комбинации со средствами защиты органов дыхания.. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | |||
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Покинуть опасную зону! Проконсультироваться со специалистом! Средства индивидуальной защиты: полный комплект защитной одежды СПЕЦИАЛЬНО РЕКОМЕНДОВАННЫЙ ДЛЯ ЭФФЕКТИВНОЙ ЗАЩИТЫ ОТ трифторида хлора, включая автономный дыхательный аппарат. Вентилировать. Выключите газ в источнике, если это возможно. НИКОГДА не направлять струю воды на жидкость. Вентилировать. Выключите газ в источнике, если это возможно. НИКОГДА не направлять струю воды на жидкость. |
Согласно критериям СГС ООН Транспортировка |
| ХРАНЕНИЕ | |
| Обеспечить огнестойкость. Отдельно от горючих веществ, восстановителей и пищевых продуктов и кормов. Прохладное место. Хранить сухим. | |
| УПАКОВКА | |
| Не перевозить с продуктами питания, кормами для животных и горючими материалами. |
| ФТОРИД ХЛОРА (III) |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: ClF3 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| TLV: 0.1 ppm как STEL |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
Thorough flushing with an inert gas should precede any opening of apparatus that has contained chlorine trifluoride.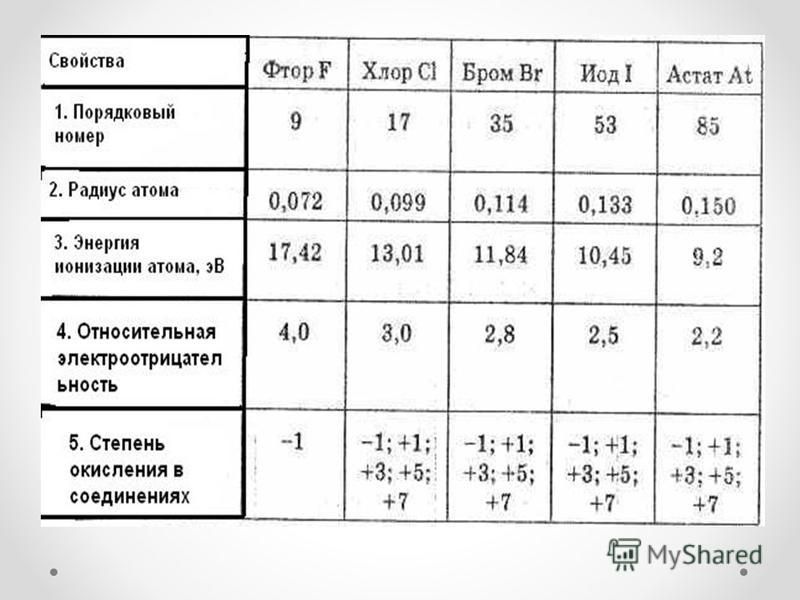 Бурно реагирует с такими средствами пожаротушения, как вода. Значение предельно-допустимой концентрации не должно превышаться во время любой части профессионального воздействия. Симптомы отека легких часто не проявляются, пока не пройдет несколько часов, и они усугубляются физическими усилиями. Поэтому крайне важны отдых и медицинское наблюдение. Следует рассмотреть возможность немедленного проведения соответствующей ингаляционной терапии врачом или уполномоченным на это лицом. В случае отравления этим веществом необходимо специфическое лечение; должны иметься в наличии соответствующие средства с инструкциями. Данные о влиянии этого вещества на здоровье человека являются недостаточными, поэтому необходимо соблюдать предельную осторожность. Do NOT spray water on a leaking cylinder (to prevent corrosion of the cylinder). См. карту ICSC 0283. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Определение галогенов в припое и хлора в печатных платах
Область применения
- Главная
- Область применения
- Фтор, бром и хлор в печатных платах
Отправить запрос
Скачать брошюру
Посмотреть видео
- Применение
- Нормативные документы
- Статьи по теме
|
Разработчик |
MITSUBISHI CHEMICAL ANALYTECH |
|
Приложение |
AQF EM 024E |
|
Оборудование |
AQF-2100H, HF-210, GA-210, ABC-210/ASC240S |
|
Метод |
Ионная хроматография продуктов сжигания |
В настоящее время соединения брома широко используются в производстве антипиренов – веществ, которые замедляют или предотвращают процессы горения и воспламенения. Антипирены применяются для защиты материалов органического происхождения, и в частности, используются в качестве специальных добавок в пластики. Таким образом, важно знать содержание брома в пластмассах, содержащих антипирены.
Антипирены применяются для защиты материалов органического происхождения, и в частности, используются в качестве специальных добавок в пластики. Таким образом, важно знать содержание брома в пластмассах, содержащих антипирены.
Концентрации фтора, хлора, брома, йода и серы в образцах можно точно измерить с применением оборудования для ионной хроматографии с предварительным сжиганием пробы, состоящего из ионного хроматографа с кондуктометрическим детектором и автоматической системы пробоподготовки AQF-2100H, производства Mitsubishi Chemical Analytech.
Подробную информацию о работе прибора можно посмотреть по ссылке
|
Образец |
Печатная плата (отходы производства) |
|||
|
Определяемые компоненты |
Фтор (F), Хлор (Cl), Бром (Br) |
|||
|
Схема анализа |
[Взвешивание образца]-[Сжигание]-[Поглощение газообразных продуктов сжигания]-[Анализ методом ионной хроматографии] |
|||
|
Общие характеристики оборудования |
AQF-2100H |
|||
|
Автоподатчик |
ABC-210/ASC240S |
|||
|
Размер образца, мг |
от 50 до 100 |
|||
|
Лодочка для ввода образцов |
керамическая лодочка для ввода образцов, SXSMBS |
|||
|
Добавки |
отсутствуют |
|||
|
Трубка для сжигания |
трубка из кварца, заполненная кварцевой ватой |
|||
|
Поглотительный раствор |
пероксид водорода/вода |
|||
|
Характеристики оборудования, печь |
HF-210 |
|||
|
Температура печи на входе, °С |
900 |
|||
|
На выходе, °С |
1000 |
|||
|
Поток газа, мл/мин (Ar) |
200 |
|||
|
Поток газа, мл/мин (O2) |
400 |
|||
|
Характеристики оборудования, абсорбер |
GA-210 |
|||
|
Объем поглотительного раствора, мл |
10/20 |
|||
|
Объем петли, мкл |
100 |
|||
|
Поглотительная трубка, мл |
10 |
|||
|
Подача воды |
2 |
|||
|
Поток Ar в порт для увлажнения, мл/мин |
100 |
|||
|
Характеристики оборудования: |
Ионный хроматограф |
|||
|
Производитель |
DIONEX, METROHM и др. |
|||
|
Модель |
DIONEX DX-320 и др. |
|||
|
Детектор |
Кондуктометрический |
|||
|
Колонка |
По указаниям производителя |
|||
|
Элюент |
2,7 мМ Na2CO3/0,3 мМ NaHCO3 |
|||
|
Скорость потока элюента, мл/мин |
1,50 |
|||
|
Подавитель |
ASRS-мм |
|||
|
Время измерений, мин |
15 |
|||
|
Объем петли, мкл |
100, при использовании петли GA-210 |
|||
|
Калибровка (F Cl Br S), ppm |
0,1 ~ 5,0 |
|||
|
Результат |
|||||
|
Элемент |
№1 |
№2 |
№3 |
Среднее значение (ppm) |
Отн. |
|
F (ppm) |
1168 |
971 |
1018 |
1053 |
9,8 |
|
Cl (ppm) |
490 |
380 |
390 |
420 |
14,5 |
|
Br (ppm) |
6,14 |
7,39 |
525 |
6,26 |
17,1 |
|
Примечания:
*Правила работы с реактивами: в соответствии с информацией, приведенной на их этикетках и в паспортах безопасности. *С помощью устройства автоматической смены образцов ASC-240S возможна автоматизация процесса, при использовании которого лодочки для ввода образцов должны быть керамическими TX3SCX. |
|||||
Информация, представленная в приложении, носит справочный характер и не может гарантировать результаты измерений. Пожалуйста, перед измерениями учитывайте условия окружающей среды, внешние факторы и природу образца для получения оптимальных условий анализа.
Фтор. Хлор | АЛХИМИК
Автор Jeremiah На чтение 6 мин Просмотров 321 Опубликовано
Содержание
ФторФтор – газ светло-зеленого цвета (tпл = — 220оС tкип = — 188оС). По поводу истинного цвета фтора возникало немало разногласий: из-за необычайно высокой реакционной способности редко кто осмеливался получать его в достаточном количестве в прозрачном сосуде. Но последующие исследования подтвердили окраску фтора, о которой сообщал ещё Муассан.
Но последующие исследования подтвердили окраску фтора, о которой сообщал ещё Муассан.
Фтор взаимодействует почти со всеми простыми веществами, включая тяжелые инертные газы (Kr, Xe). В его атмосфере загорается даже стекловата (SiO2 + 2F2 = 4HF + O2) и вода (2H2O + 2F2 = 4HF + O2). При этом наряду с кислородом в продуктах реакции присутствуют фториды кислорода OF2, O2F2 и озон O3.
Фтор используют для получения некоторых ценных фторпроизводных углеводородов, обладающих уникальными свойствами, как, например, смазочных веществ, выдерживающих высокую температуру, пластической массы, стойкой к химическим реагентам (тефлон), жидкостей для холодильников (фреонов).
В организме человека фтор содержится в виде нерастворимых фторидов, главным образом фторапатита, и входит в состав костной ткани и зубной эмали. Для укрепления эмали рекомендуют использовать специальные фторсодержащие зубные пасты. С этой же целью фторируют питьевую воду, доводя концентрацию фторид-ионов примерно до 1 мг/л. Однако следует помнить, что в больших количествах растворимые в воде фториды ядовиты.
С этой же целью фторируют питьевую воду, доводя концентрацию фторид-ионов примерно до 1 мг/л. Однако следует помнить, что в больших количествах растворимые в воде фториды ядовиты.
Фториды – соли слабой плавиковой кислоты HF, представляющей собой водный раствор фтороводорода. Молекулы HF в плавиковой кислоте связаны друг с другом настолько прочными водородными связями, что ее состав правильнее было бы передать формулой (HF)n. Поскольку эта кислота (наряду с газообразным фтороводородом) обладает уникальной способностью разъедать стекло, её хранят в полиэтиленовой, свинцовой или парафиновой посуде.
Применение фтористого водорода довольно разнообразно. Безводный HF используют, главным образом, при органических синтезах, а плавиковую кислоту – при получении фторидов, травления стекла, удалении песка с металлических отливок, при анализах минералов и т.д.
Хлор ХлорФизические свойства
При обычных условиях хлор – газ жёлто-зеленого цвета с резким запахом. Он в 2,5 раза тяжелее воздуха, ядовит. Вдыхание даже небольших количеств хлора вызывает раздражение дыхательных путей и кашель. В одном объёме воды при 20оС растворяется 2,5 объема хлора. Раствор хлора в воде называется хлорной водой.
Он в 2,5 раза тяжелее воздуха, ядовит. Вдыхание даже небольших количеств хлора вызывает раздражение дыхательных путей и кашель. В одном объёме воды при 20оС растворяется 2,5 объема хлора. Раствор хлора в воде называется хлорной водой.
Нахождение в природе
Хлор в природе в свободном состоянии практически не встречается. Широко распространены его соединения: каменная соль NaCl, сильвинит KCl ∙ NaCl и карналлит KCl ∙ MgCl2. Большое количество хлоридов содержится в морской воде. Хлор входит в состав зеленого вещества растений – хлорофилла.
Минерал сильвинитПолучение
В промышленности хлор получают электролизом водного раствора или расплава хлорида натрия:
2NaCl + 2H2O → Cl2↑ + H2↑ + 2NaOH
2NaCl → Cl2↑ + 2Na
В лаборатории хлор можно получить действием концентрированной соляной кислоты (при нагревании) на различные окислители, такие как оксид марганца (IV) MnO2, перманганат калия KMnO4, бертолетова соль KClO3 и др. :
:
4HCl + MnO2 = MnCl2 + Cl2↑ + 2H2O
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
Химические свойства
Хлор – химически активное вещество, взаимодействует с простыми и сложными веществами.
Взаимодействие с простыми веществами
Как сильный окислитель хлор реагирует:
а) с водородом:
Cl2 + H2 = 2HCl
б) с металлами:
Cl2 + Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
в) с некоторыми менее электроотрицательными неметаллами:
3Cl2 + 2P = 2PCl3
Cl2 + S = SCl2
С кислородом и азотом хлор непосредственно не взаимодействует.
Взаимодействие со сложными веществами
а) Реакция взаимодействия хлора с водой идет в две стадии. На первой стадии процесса образуются две кислоты – соляная HCl и хлорноватистая HClO:
На первой стадии процесса образуются две кислоты – соляная HCl и хлорноватистая HClO:
Cl2 + H2O ⇄ HCl + HClO
Затем происходит процесс разложения хлорноватистой кислоты:
HClO = HCl + [O]→ атомарный кислород
Образованием атомарного кислорода объясняется окисляющее и отбеливающее действие хлора в воде. В хлорной воде погибают микроорганизмы. Органические красители, помещенные в хлорную воду, обесцвечиваются.
б) Обратите внимание, что с кислотами хлор не реагирует.
в) Взаимодействие хлора с растворами щелочей происходит по-разному в зависимости от условий протекания реакции:
на холоде: Cl2 + 2NaOH = NaCl + NaClO + H2O
при нагревании: 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
г) Хлор взаимодействует с бромидами и йодидами металлов:
Cl2 + 2KBr = 2KCl + Br2↓
Cl2 + 2KI = 2KCl + I2↓
С фторидами металлов хлор не реагирует, так как его окислительная способность ниже окислительной способности фтора:
Cl2 + KF ≠
д) Хлор легко взаимодействует со многими органическими веществами, например с метаном, бензолом и др. :
:
Cl2 + CH4 → CH3Cl + HCl
C6H6 + Cl2 → C6H5Cl + HCl
Хлороводород и соляная кислота
Хлороводород HCl – бесцветный газ с резким запахом, в воде хорошо растворяется, при 0оС в 1 л воды растворяется около 400 л HCl. Раствор хлороводорода в воде имеет кислую реакцию и называется хлороводородной, или соляной кислотой. Соляная кислота является сильной кислотой, обладает всеми общими свойствами кислот.
Соляная кислота – активный химический реагент, она взаимодействует:
- с основаниями и амфотерными гидроксидами:
HCl + NaOH = NaCl + H2O
2HCl + Zn(OH)2 = ZnCl2 + 2H2O
- с основными и амфотерными оксидами:
2HCl + Mg = MgCl2 + H2O
2HCl + ZnO = ZnCl2 + H2O
Реакция соляной кислоты с цинком- с металлами, которые находятся в ряду напряжений до водорода:
Mg + 2HCl = MgCl2 + H2↑
2Al + 6HCl = 2AlCl3 + 3H2↑
- с солями:
2HCl + Na2CO3 = 2NaCl + CO2↑ + H2O
HCl + AgNO3 = AgCl↓ + HNO3
Последняя реакция является качественной реакцией на хлорид-ион.
Хлороводород можно получать:
а) прямым синтезом водорода и хлора;
б) действием концентрированной серной кислоты на твердые хлориды, например:
NaCl + H2SO4(конц) = HCl↑ + NaHSO4
(Отметим, что аналогичным способом можно получать HF, но нельзя получить HBr и HI, так как они являются сильными восстановителями и окисляются серной кислотой до свободных брома и йода).
Применение хлора и хлороводорода. Физиологическая роль соляной кислоты в организме человека
Хлор используется для отбеливания бумаги и тканей, в производстве пластмасс, для дезинфекции питьевой воды. Хлор является исходным веществом при получении таких важнейших продуктов, как хлорная известь, фосген, хлороформ, определенные виды моющих средств, ядохимикатов, каучуков и т.д. Огромное количество хлора используется для синтеза хлороводорода, растворением которого в воде получают соляную кислоту.
В организме человека соляная кислота вырабатывается клетками слизистой желудка. Она играет важную физиологическую роль, так как способствует перевариванию белков и убивает различные болезнетворные бактерии.
Она играет важную физиологическую роль, так как способствует перевариванию белков и убивает различные болезнетворные бактерии.
Скачать:
Скачать бесплатно реферат на тему: «Хлор» [download id=»1939″]
Скачать бесплатно реферат на тему: «Анализ хлорид-иона» [download id=»1238″]
Скачать бесплатно реферат на тему: «Фтор» [download id=»1843″]
Скачать рефераты по другим темам можно здесь
*на изображении записи фотография сильвинитовой шахты
Тема VI. Р-Элементы VII группы: фтор, хлор, бром, йод
По содержанию в организме человека хлор (0,15%) относится к макроэлементам, а остальные элементы этой группы (содержание 10-5%) являются микроэлементами. Хлор и йод относятся к незаменимым элементам, а остальные являются постоянными составными частями тканей.
В
организме все галогены находятся в
степени окисления -1, хлор и бром – в
виде гидратированных ионов, а фтор и
йод, главным образом, в связанной
форме входят в состав некоторых
биоорганических соединений. Вследствие
уменьшения электроотрицательности в
ряду F — С1 — Br — I связь углерода с йодом
наименее полярна, поэтому йод находится
в живых организмах в виде элементоорганических
соединений (со связью С–I).
Вследствие
уменьшения электроотрицательности в
ряду F — С1 — Br — I связь углерода с йодом
наименее полярна, поэтому йод находится
в живых организмах в виде элементоорганических
соединений (со связью С–I).
Фтор. В организме человека масса фтора составляет около 7 мг (10-5%). Соединения фтора концентрируются в костной ткани, ногтях, зубах.
Недостаток фтора в организме приводит к кариесу зубов. В состав эмали зубов входит труднорастворимый фторапатит Ca3(PO4)2∙CaF2. Минеральную основу дентина составляют гидроксоапатит 3Ca3(PO4)2∙Ca(OH)2, хлорапатит 3Ca3(PO4)2∙CaCl2 и фторапатит 3Ca3(PO4)2∙CaF2.
Фторид ионы способствуют осаждению фосфата кальция, образуя защитный слой на поверхности зубов.
Под действием кислот, вырабатываемых бактериями, происходит растворение одной из минеральных основ тканей зубов – гидроксоапатита:
3Ca3(PO4)2∙Ca(OH)2 + 10H+ ® 10Ca2+ + 6H2PO4— + 2H2O
Причем
очень часто разрушению подвергается
не внешняя поверхность зуба, покрытая
слоем эмали, а внутренние участки
дентина. Пока эмаль повреждена
незначительно (имеются предположения),
введение NаF способствует образованию
фторапатита, который облегчает
реминерализацию начавшегося
повреждения.
Пока эмаль повреждена
незначительно (имеются предположения),
введение NаF способствует образованию
фторапатита, который облегчает
реминерализацию начавшегося
повреждения.
Хлор. Хлорид-ионы играют важную биологическую роль. Они активируют некоторые ферменты, создают благоприятную среду для действия протеолитических ферментов желудочного сока. Для выработки соляной кислоты в желудке необходим NаСl. Помимо важной роли соляной кислоты в процессе пищеварения, NаС1 уничтожает различные болезнетворные бактерии (холеры, тифа). В форме соляной кислоты хлорид-ион является необходимым компонентом желудочного сока. Выделение соляной кислоты из клеток слизистой оболочки желудка можно описать следующим уравнением:
H2CO3(кровь) + Cl— ® HCO3—(кровь) + HCl(желудок)
Соляная кислота желудочного сока необходима для перехода фермента пепсина в активную форму. Пепсин обеспечивает переваривание белков путем гидролитического расщепления пептидных связей:
R–CO–NH–R1 + H2O ® R–COOH + R1–NH2
Хлорид-ионы,
образуя ионные слои по обеим сторонам
клеточных мембран, участвуют в создании
электрического мембранного потенциала,
который регулирует ионные потоки через
клеточные мембраны, перенос неорганических
и органических веществ сквозь мембраны,
участвуют в поддержании осмотического
равновесия. Имея оптимальный радиус
для проникновения через мембрану
клеток, хлорид-ионы совместно с ионами
калия и натрия участвуют в создании
определенного осмотического давления
и регуляции водно-солевого обмена.
Имея оптимальный радиус
для проникновения через мембрану
клеток, хлорид-ионы совместно с ионами
калия и натрия участвуют в создании
определенного осмотического давления
и регуляции водно-солевого обмена.
Бром локализуется преимущественно в железах внутренней секреции, в первую очередь в гипофизе. Биологическая роль соединений брома в нормальной жизнедеятельности организма еще недостаточно выяснена. Экспериментально установлено, что соединения брома угнетают функцию щитовидной железы и усиливают активность коры надпочечников.
Йод относится к числу незаменимых биогенных
элементов, и его соединения играют
важную роль в процессах обмена веществ.
Он влияет на синтез некоторых белков,
жиров, гормонов. В организме человека
йода содержится 25 мг (4´10-5 %) и большая его половина находится в
щитовидной железе (в виде гормонов).
Щитовидная железа секретирует гормоны
тироксин и трийодтиронин. Пониженная
активность щитовидной железы (гипотиреоз)
может быть связана с уменьшением её
способности накапливать йодид-ионы, а
также с недостатком в пище йода
(эндемический зоб).
Таким образом, все р-элементы VII группы физиологически активны, хлор и йод незаменимы для нормальной жизнедеятельности организма. В организме галогены взаимозамещаемы, при этом наблюдаются как случаи синергизма, так и антагонизма. Антагонистами йода являются фтор и бром. Конкурируя с йодом, фтор может вытеснять его из йодорганических соединений и подавлять транспорт йода в организме. Поглощению йода щитовидной железой препятствует бром. К синергистам йода относится селен – при дефиците селена йод не усваивается.
Минеральные вещества | Tervisliku toitumise informatsioon
В человеческом организме установлено наличие более 70 химических элементов. Достоверно установлена потребность в более чем 20 биоэлементах. Для обеспечения достаточного количества этих элементов крайне важно, чтобы питание было разнообразным.
Встречающиеся в организме минеральные вещества можно условно разделить на две группы:
- Содержание макроэлементов в организме составляет более 0,01%.
 Ими являются фосфор (P), кальций (Ca), натрий (Na), калий (K), магний (Mg), сера (S), хлор (Cl) (см Таблица 1).
Ими являются фосфор (P), кальций (Ca), натрий (Na), калий (K), магний (Mg), сера (S), хлор (Cl) (см Таблица 1). - Содержание микроэлементов – менее 0,01%, у некоторых даже 0,00001.
Потребность в некоторых микроэлементах установлена, это железо (Fe), цинк (Zn), медь (Cu), йод (I), селен (Se) , марганец (Mn), молибден (Mo), фтор (F), хром (Cr), кобальт (Co), кремний (Si), ванадий (V), бор (B), никель (Ni), мышьяк (As) и олово (Sn).
Помимо них в организме обнаружен целый ряд элементов, функция которых пока не ясна, их появление в организме может быть обусловлено загрязнением окружающей среды и частым соприкосновением с ними. Например, люди, работающие в теплицах, постоянно контактируют с химическими веществами, различные элементы могут быть признаком разного рода заболеваний. В числе таких элементов алюминий (Al), стронций (Sr), барий (Ba), рубидий (Rb), палладий (Pd), бром (Br).
В организм могут попадать и тяжелые, т.е. ядовитые металлы, такие как кадмий (Cd), ртуть (Hg) или свинец (Pb).
Минеральные вещества в нашем организме являются важными компонентами скелета, биологических жидкостей и энзимов и способствуют передаче нервных импульсов.
Люди и животные получают различные биологические элементы из пищи, воды и окружающего воздуха, самостоятельно синтезировать минеральные вещества живые организмы не могут. В растениях минеральные вещества накапливаются из почвы, и их количество зависит от места произрастания и наличия удобрений. В питьевой воде также имеются минеральные вещества, и их содержание зависит от места, откуда получают воду.
Несмотря на то, что человек нуждается в небольших количествах минеральных веществ (макроэлементов в миллиграммах и граммах, микроэлементов – в милли- и микрограммах), в его организме, тем не менее, отсутствуют достаточные запасы минеральных веществ, чтобы нормально перенести их долговременный дефицит. Потребность в минеральных веществах зависит также от возраста, пола и прочих обстоятельств (см Таблица 2). Например, повышенная потребность в железе у женщин связана с менструациями и беременностью, а спортсменам требуется больше натрия, потому что он интенсивно выводится с потом.
Например, повышенная потребность в железе у женщин связана с менструациями и беременностью, а спортсменам требуется больше натрия, потому что он интенсивно выводится с потом.
Чрезмерные количества минеральных веществ могут привести к сбоям в работе организма, потому что, будучи компонентами биоактивных соединений, они оказывают влияние на регуляторные функции. Получать чрезмерные количества минеральных веществ (за исключением натрия) с пищей практически невозможно, однако это может произойти при чрезмерном употреблении биологически активных добавок и обогащенных минеральными веществами продуктов.
Усвоению минеральных веществ могут препятствовать:
- злоупотребление кофе,
- употребление алкоголя,
- курение,
- некоторые лекарства,
- некоторые противозачаточные таблетки,
- определенные вещества, встречающиеся в некоторых продуктах, например, в ревене и шпинате.
Потери минеральных веществ при тепловой обработке продуктов питания значительно меньше, чем потери витаминов. Однако при рафинировании или очистке часть минеральных веществ удаляется. Поэтому важно есть больше цельнозерновых и нерафинированных продуктов. Минеральные вещества могут образовывать соединения с другими веществами, содержащимися в продуктах питания (например, с оксалатами в ревене), в результате чего организм не может их усвоить.
Однако при рафинировании или очистке часть минеральных веществ удаляется. Поэтому важно есть больше цельнозерновых и нерафинированных продуктов. Минеральные вещества могут образовывать соединения с другими веществами, содержащимися в продуктах питания (например, с оксалатами в ревене), в результате чего организм не может их усвоить.
Таблица 1
Названия и источники важнейших минеральных веществ
Обозначение | Название | Лучшие источники * |
Макроэлементы | ||
Na | натрий | поваренная соль (NaCl), готовая еда, сыр, ржаной хлеб, консервы, мясные продукты, оливки, картофельные чипсы |
K | калий | растительные продукты: сушеные фрукты и ягоды, орехи, семена, топинамбур, картофель, редис, капуста, зеленые овощи, мука «Кама», свёкла, банан, ржаной хлеб, смородина, томаты |
Ca | кальций | молоко и молочные продукты (особенно сыр), миндаль, орехи, семена, рыба (с костями), шпинат |
Mg | магний | орехи, семена, мука «Кама», ржаной хлеб, шпинат, бобовые, греча, цельнозерновые продукты, свинина, говядина и курятина, банан, брокколи |
P | фосфор | семена, орехи, молочные продукты (особенно сыр), печень, птица, говядина, ржаной хлеб, рыба, цельнозерновые продукты, бобовые |
S | сера | продукты с белками, содержащими аминокислоты метионин (зерновые, орехи) и цистеин (мясо, рыба, соевые бобы, зерновые) |
Cl | хлор | поваренная соль |
Микроэлементы | ||
Fe | железо | печень, кровяная колбаса, семечки, яйца, изюм, ржаной хлеб, нежирная говядина и свинина, цельнозерновые продукты, греча, клубника |
Zn | цинк | печень, мясо, мука «Кама», семена, орехи, сыр, ржаной хлеб, бобовые, дары моря (крабы, салака), цельнозерновые продукты, яйца |
Cu | медь | печень, какао-порошок, мясо, бобовые, цельнозерновые продукты, семена, орехи, греча, ржаной хлеб, лосось, авокадо, свёкла, дары моря |
I | йод | йодированная соль, рыба и другие дары моря, сыр, яйца, некоторые виды ржаного хлеба и йогурта |
Se | селен | арахис, печень, рыба и дары моря, семена подсолнечника, мясо |
* Количество, содержащееся в 100 г продукта, покрывает не менее 10% суточной потребности взрослой женщины
Таблица 2
Рекомендуемые в зависимости от возраста суточные нормы потребления важнейших минеральных веществ
Возраст | Натрий, мг | Кальций, мг | Калий, г | Магний, мг | Железо, мг | Цинк, мг | Медь, мг | Йод, мкг | Селен, мкг |
Дети |
|
|
|
|
|
|
|
|
|
6–11 месяцев | до 650 | 550 | 1,1 | 80 | 8 | 5 | 0,3 | 60 | 15 |
12–23 месяца | до 830 | 600 | 1,4 | 85 | 8 | 6 | 0,3 | 90 | 25 |
2–5 лет | до 1580 | 600 | 1,8 | 120 | 8 | 6 | 0,4 | 90 | 30 |
6–9 лет | до 1580 | 700 | 2 | 200 | 9 | 7 | 0,5 | 120 | 30 |
Женщины |
|
|
|
|
|
|
|
|
|
10–13 лет | до 2400 | 900 | 2,9 | 300 | 11 | 8 | 0,7 | 150 | 40 |
14–17 лет | до 2400 | 900 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
18–30 лет | до 2400 | 900 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
31–60 лет | до 2400 | 800 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
61–74 лет | до 2400 | 800 | 3,1 | 320 | 10 | 9 | 0,9 | 150 | 50 |
> 75 лет | до 2400 | 800 | 3,1 | 320 | 10 | 9 | 0,9 | 150 | 50 |
Беременные | до 2400 | 900 | 3,1 | 360 | 15 | 10 | 1 | 175 | 60 |
Кормящие матери | до 2400 | 900 | 3,1 | 360 | 15 | 11 | 1,3 | 200 | 60 |
Мужчины |
|
|
|
|
|
|
|
|
|
10–13 лет | до 2400 | 900 | 3,3 | 300 | 11 | 11 | 0,7 | 150 | 40 |
14–17 лет | до 2400 | 900 | 3,5 | 380 | 11 | 12 | 0,9 | 150 | 60 |
18–30 лет | до 2400 | 900 | 3,5 | 380 | 10 | 9 | 0,9 | 150 | 60 |
31–60 лет | до 2400 | 800 | 3,5 | 380 | 10 | 9 | 0,9 | 150 | 60 |
61–74 лет | до 2400 | 800 | 3,5 | 380 | 10 | 10 | 0,9 | 150 | 60 |
> 75 лет | до 2400 | 800 | 3,5 | 380 | 10 | 10 | 0,9 | 150 | 60 |
* Для 18–20-летних рекомендуемая суточная доза составляет 900 мг кальция и 700 мг фосфора.
** Потребность в железе зависит от потери железа при менструациях. Для женщин в постменопаузе рекомендуемая дневная доза железа составляет 10 мг.
*** Для достижения сбалансированного содержания железа во время беременности в организме женщины должны иметься запасы железа как минимум на 500 мг больше, чем до беременности. В двух последних триместрах беременности, в зависимости от уровня железа в организме, может потребоваться дополнительный прием железа.
**** На самом деле, селена можно потреблять больше указанной в таблице рекомендованной дозы, поскольку селен по-разному всасывается из разных источников и происходит постоянное обеднение им поверхности, т.е. таблицы питательной ценности продуктов «не поспевают» за истинным положением дел (в них зачастую указываются значения больше реальных).
Максимальные разовые безопасные дозы минеральных веществ и пищевых добавок:
| Минеральное вещество | Доза |
|---|---|
| Кальций (мг) | 2500 |
| Фосфор (мг) | 3000 |
| Калий (мг) | 3,7* |
| Железо (мг) | 60 |
| Цинк (мг) | 25 |
| Медь (мг) | 5 |
| Йод (мкг) | 600 |
| Селен (мкг) | 300 |
* Только из биоактивных добавок или обогащенной пищи
В поисках неуловимого фтора | Наука и жизнь
Девятый элемент таблицы Менделеева — фтор — наряду с хлором, бромом, йодом и астатом относится к галогенам. Все галогены — активные окислители. Фтор среди них самый агрессивный, поэтому встречается в природе только в виде соединений. Его взаимодействие с другими веществами часто сопровождается воспламенением и даже взрывом. Химики разных стран упорно пытались получить фтор в чистом виде, но это оказалось одной из самых трудных экспериментальных задач за всю историю химии.
Все галогены — активные окислители. Фтор среди них самый агрессивный, поэтому встречается в природе только в виде соединений. Его взаимодействие с другими веществами часто сопровождается воспламенением и даже взрывом. Химики разных стран упорно пытались получить фтор в чистом виде, но это оказалось одной из самых трудных экспериментальных задач за всю историю химии.
Карл Вильгельм Шееле.
Анри Муассан в своей лаборатории проводит эксперимент по получению фтора. В созданном им аппарате два электрода (катод и анод), выполненные из платины, находятся в U-образной трубке, куда залита смесь HF и KF. Прибор помещён в сосуд для охлаждения. При пропускании тока на аноде выделяется фтор, а на катоде водород.
При криогенных температурах (ниже 120К, или –153°С)фтор представляет собой жёлтую жидкость, а при нормальных условиях — бесцветный газ; в толстых слоях он становится зеленовато-жёлтым.
Луи Жак Тенар.
Жозеф Луи Гей-Люссак.
Андре-Мари Ампер.
‹
›
Открыть в полном размере
Первый шаг к открытию фтора сделал в 1771 году шведский химик Карл Вильгельм Шееле (1742—1786). Он знаменит тем, что открыл молибден, барий, хлор, определил в составе воздуха кислород и азот, разработал технологию производства фосфора… Изучая свойства плавикового шпата*, Шееле обнаружил, что при взаимодействии этого минерала с серной кислотой выделяется чрезвычайно активное вещество, способное разъедать всё, с чем вступает в контакт, даже стенки стеклянной лабораторной колбы. В процессе экспериментов Шееле пришёл к выводу, что полученное соединение представляет собой кислоту, впоследствии названную им «плавиковой» (по названию минерала, из которого он её получил).
Он знаменит тем, что открыл молибден, барий, хлор, определил в составе воздуха кислород и азот, разработал технологию производства фосфора… Изучая свойства плавикового шпата*, Шееле обнаружил, что при взаимодействии этого минерала с серной кислотой выделяется чрезвычайно активное вещество, способное разъедать всё, с чем вступает в контакт, даже стенки стеклянной лабораторной колбы. В процессе экспериментов Шееле пришёл к выводу, что полученное соединение представляет собой кислоту, впоследствии названную им «плавиковой» (по названию минерала, из которого он её получил).
Выделить плавиковую кислоту в чистом виде удалось в 1810 году двум французским химикам, Жозефу Луи Гей-Люссаку (1778—1850) и Луи Жаку Тенару (1777—1857). Они сделали это путём перегонки плавикового шпата с серной кислотой в свинцовой или серебряной реторте. Во время эксперимента оба учёных получили серьёзные ожоги и отравления. О том, что плавиковая, или, что то же самое, фтороводородная, кислота содержит в своём составе доселе не известный химический элемент — фтор, ни они, ни тем более Шееле даже не догадывались. В свободном виде элемент фтор был получен лишь 76 лет спустя.
В свободном виде элемент фтор был получен лишь 76 лет спустя.
Первыми жертвами фтора стали два члена Ирландской академии наук, братья Томас и Георг Нокс (Томас погиб от отравления фтороводородом, а Георг стал инвалидом). Список пострадавших пополнили бельгийский химик Полин Лайет, первооткрыватель веселящего газа Гемфри Дэви, французские химики Джером Никлес, Эдмонд Фреми, Антуан Лавуазье, английский электрохимик Георг Гор и многие другие.
Памятуя о трагических событиях, связанных с открытием нового элемента, французский физик и математик Андре-Мари Ампер (1775—1836), сделавший массу выдающихся открытий, среди которых закон взаимодействия между электрическими токами — закон Ампера, предложил назвать его фтором (от греческого φθόΩος — разрушение, порча, вред). Однако закрепилось такое название только в среде русских химиков, во всех других странах прижилось другое — флюор.
Покорить своенравный элемент удалось выдающемуся экспериментатору, французскому химику Анри Муассану (1852—1907). Муассан родился в Тулузе. Семья была небогата, и Анри, с детства проявлявший склонность к наукам, довольно долгое время не занимался ими всерьёз, считая это дело неприбыльным. Он собирался работать в промышленности, мечтал открыть свою маленькую фабрику.
Муассан родился в Тулузе. Семья была небогата, и Анри, с детства проявлявший склонность к наукам, довольно долгое время не занимался ими всерьёз, считая это дело неприбыльным. Он собирался работать в промышленности, мечтал открыть свою маленькую фабрику.
Анри поступил в гимназию небольшого французского городка Мо, но в 1870 году, проучившись пять лет, оставил её, не пройдя «университетский класс», необходимый для поступления в университет. Муассан переехал в Париж, где устроился работать в аптеку. Вскоре молодому человеку представился случай проявить себя. Однажды в аптеку вбежал крайне взволнованный человек, кричавший, что по ошибке проглотил мышьяк. Аптекарь сказал, что, к сожалению, помочь ничем не может, однако Анри предложил попробовать тартратусэметикус (тартрат сурьмы и калия) — средство, вызывающее рвоту. Пациент им воспользовался, и его удалось спасти.
После этого случая Анри решил изучать химию. Он работал в лаборатории Эдмона Фреми, где и заинтересовался фтором. Выяснив, что элемент, который он пытается получить, мгновенно реагирует со всем, с чем вступает в контакт, Анри начал изучать свойства веществ, содержащих фтор. Однако вскоре его переманил профессор Высшей политехнической школы в Париже Пьер Поль Дихерен. К этому времени Муассан закончил Сорбонну. У Дихерена он занялся изучением физиологии растений. Только по
Выяснив, что элемент, который он пытается получить, мгновенно реагирует со всем, с чем вступает в контакт, Анри начал изучать свойства веществ, содержащих фтор. Однако вскоре его переманил профессор Высшей политехнической школы в Париже Пьер Поль Дихерен. К этому времени Муассан закончил Сорбонну. У Дихерена он занялся изучением физиологии растений. Только по
прошествии десяти лет, в середине 1880-х, Муассан вернулся к исследованию фтора, когда получил место в аналитической лаборатории в своём родном городе Мо.
В первой попытке получить фтор в чистом виде Муассан использовал следующую схему: он нагревал смесь фторида свинца (PbF2) и фосфида меди (Cu3P), в результате чего, видимо, получал фторид фосфора (в настоящее время эта довольно редкая реакция получения фторида фосфора не применяется). Муассан считал, что при нагревании фторида фосфора в присутствии кислорода фосфор должен давать оксид, а фтор выделяться в свободном виде.
Для проведения эксперимента нужно было подобрать подходящие условия.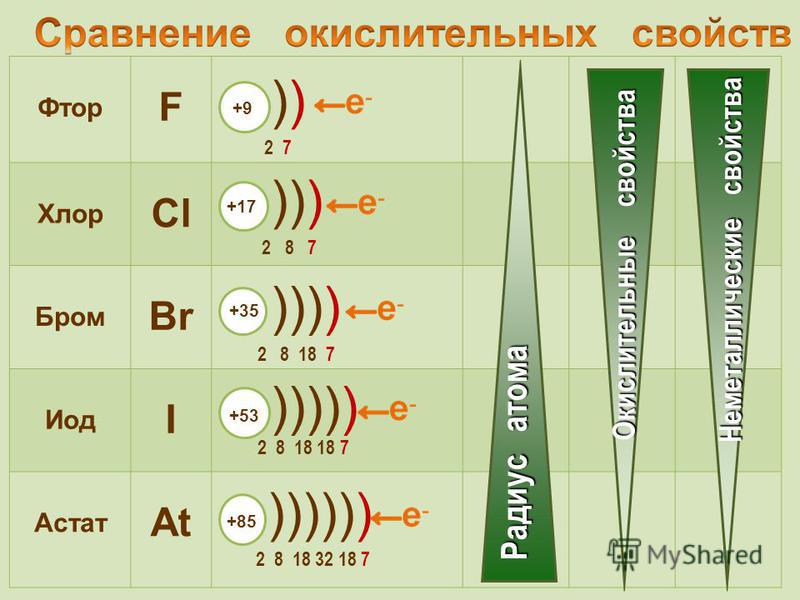 Анри поместил в U-образную трубку губчатую платину и нагрел её. Через трубку он пропустил фторид фосфора. Трубка сильно разогрелась, но выделения фтора не произошло. Через некоторое время трубка лопнула — опыт не удался. Муассан провёл целую серию подобных экспериментов и пришёл к неутешительному выводу: если фтор и выделяется в свободном виде в ходе данных реакций, то при нагревании его и без того высокая реакционная способность повышается ещё больше. Тогда химик решил по-пробовать получить фтор без нагревания, а ещё лучше с охлаждением. Для этого вполне подходил электролиз — процесс, при котором через ячейку, содержащую растворённое вещество, пропускается электрический ток, в результате чего на электродах выделяются компоненты раствора.
Анри поместил в U-образную трубку губчатую платину и нагрел её. Через трубку он пропустил фторид фосфора. Трубка сильно разогрелась, но выделения фтора не произошло. Через некоторое время трубка лопнула — опыт не удался. Муассан провёл целую серию подобных экспериментов и пришёл к неутешительному выводу: если фтор и выделяется в свободном виде в ходе данных реакций, то при нагревании его и без того высокая реакционная способность повышается ещё больше. Тогда химик решил по-пробовать получить фтор без нагревания, а ещё лучше с охлаждением. Для этого вполне подходил электролиз — процесс, при котором через ячейку, содержащую растворённое вещество, пропускается электрический ток, в результате чего на электродах выделяются компоненты раствора.
Муассан решил подвергнуть электролизу какой-нибудь жидкий фторид. Его выбор пал на фторид мышьяка (AsF3). Но данное соединение не проводит электрический ток, что не даёт возможности осуществить электролиз. Тогда Анри попробовал добавить к фториду мышьяка фторид калия (KF) — эта смесь хорошо проводила электрический ток. Однако возникла новая проблема: катод очень быстро покрывался слоем выделяющегося мышьяка, и ток переставал идти через ячейку. Поняв это, Муассан решил работать с фтороводородом (HF), при охлаждении этот газ легко превращался в жидкость. Для улучшения проводимости к фтороводороду он добавил фторид калия.
Однако возникла новая проблема: катод очень быстро покрывался слоем выделяющегося мышьяка, и ток переставал идти через ячейку. Поняв это, Муассан решил работать с фтороводородом (HF), при охлаждении этот газ легко превращался в жидкость. Для улучшения проводимости к фтороводороду он добавил фторид калия.
26 июня 1886 года эксперимент начался. Муассан поместил смесь в платиновую U-образную трубку (в дальнейшем для удешевления процесса он использовал трубку из меди, так как поверхность трубки, покрытая слоем фторида меди, далее уже не реагировала с фтором и не требовала замены), охладил её до –50оС и пропустил через неё электрический ток. На аноде по-прежнему ничего не выделялось. Однако когда учёный достал пробку, закрывавшую анодный отсек, и увидел на ней белый налёт, он понял, что пробка разъедена фтором! Наконец стало понятно, что фтор можно получить электролизом. Оставалось только подобрать материал анода, который фтор не мог бы окислить. Муассан решил использовать в качестве анода флюорит (CaF2). Радости учёного не было предела, когда после очередного эксперимента на аноде начали выделяться пузырьки заветного газа.
Радости учёного не было предела, когда после очередного эксперимента на аноде начали выделяться пузырьки заветного газа.
После повторной и на этот раз успешной демонстрации своего опыта комиссии Французской академии наук (первая демонстрация окончилась неудачей, так как фтороводородная кислота, неоднократно используемая в предыдущих экспериментах, почти не содержала фторида калия и электрический ток в трубке не протекал) многоопытные эксперты признали выдающееся достижение Муассана. Он был удостоен высшей награды академии в виде премии в десять тысяч франков. В том же году он стал профессором токсикологии в Высшей фармацевтической школе. Дважды — в 1896 и 1902 годах — его избирали президентом Французского химического общества. В 1900 году Муассан стал кавалером ордена Почётного легиона, а вскоре и членом Французской академии наук, а также иностранным членом Петербургской академии наук, Лондонского королевского общества, Британского химического общества и многих других.
В 1906 году Анри Муассану была присуждена Нобелевская премия по химии «За получение элемента фтора и введение в лабораторную практику электрической печи, названной его именем». Представляя лауреата на церемонии награждения, представитель Нобелевского комитета И. П. Класон сказал: «Весь мир восхищён великим мастерством экспериментатора, с которым вы выделили и исследовали фтор… Вы сообщили мощный импульс миру технологии, и он ещё не реализован в полной мере».
Представляя лауреата на церемонии награждения, представитель Нобелевского комитета И. П. Класон сказал: «Весь мир восхищён великим мастерством экспериментатора, с которым вы выделили и исследовали фтор… Вы сообщили мощный импульс миру технологии, и он ещё не реализован в полной мере».
Вскоре после возвращения из Стокгольма, 20 февраля 1907 года, Анри Муассан скончался, как считают, из-за острого аппендицита. Хотя не исключена вероятность того, что причиной его смерти стали эксперименты с фтором, ради открытия которого учёные-химики шли на подвиг и даже на смерть.
***
Фтор представляет собой двухатомный газ (формула F2) бледно-жёлтого цвета c резким запахом, напоминающим знакомый многим запах озона или хлора.
***
● Фтор входит в состав эмали зубов (в виде фторапатита Ca5(PO4)3F), поэтому его соединения добавляют в состав зубной пасты.
● Соединения фтора входят в состав оптических стёкол и тефлоновых покрытий.
● Некоторые фториды неметаллов применяют в ракетно-космической отрасли в качестве окислителей ракетного топлива и в атомной промышленности для разделения изотопов урана.
● Соединения фтора служат газообразным изолятором в электротехнике.
● Фторсодержащие полимеры — фторопласты — прекрасные диэлектрики, обладают высокой механической прочностью, стойкостью к действию агрессивных сред и другими привлекательными свойствами. Из них делают трубы, шланги, теплообменники, контейнеры, лабораторную посуду, протезы и многое другое.
Комментарии к статье
* Плавиковый шпат (СаF2) часто называют флюо-ритом — от латинского глагола fluo — течь. Объясняется это тем, что флюорит издавна использовали в качестве добавки к металлическим рудам, чтобы снизить их температуру плавления.
галоген | Элементы, примеры, свойства, использование и факты
Таблица Менделеева
Просмотреть все СМИ
- Ключевые люди:
- Жан-Батист-Андре Дюма
- Похожие темы:
- галогенорганическое соединение йод фтор хлор бром
Просмотреть весь связанный контент →
Популярные вопросы
Что такое галогенные элементы?
Галогенные элементы представляют собой шесть элементов 17-й группы периодической таблицы. Группа 17 занимает вторую колонку справа в периодической таблице и содержит фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Астат и теннессин являются радиоактивными элементами с очень коротким периодом полураспада и поэтому не встречаются в природе.
Группа 17 занимает вторую колонку справа в периодической таблице и содержит фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Астат и теннессин являются радиоактивными элементами с очень коротким периодом полураспада и поэтому не встречаются в природе.
Каковы основные свойства галогенных элементов?
Галогенные элементы очень реакционноспособны. С натрием они производят соли, из которых наиболее известна поваренная соль (хлорид натрия, NaCl). Каждый атом галогена имеет семь валентных электронов на внешней электронной оболочке. Поэтому, когда атом галогена может получить электрон от атома другого элемента, два атома образуют очень стабильное соединение, потому что тогда самая внешняя электронная оболочка атома галогена заполнена.
В каких случаях используются галогеновые элементы?
Хлор используется для очистки воды. Кроме того, хлор входит в состав поваренной соли, хлорида натрия, который является одним из наиболее широко используемых химических соединений. Фтор используется во фторидах, которые добавляют в воду для предотвращения кариеса. Йод используется как антисептик.
Фтор используется во фторидах, которые добавляют в воду для предотвращения кариеса. Йод используется как антисептик.
Почему эти элементы называются галогенами?
При взаимодействии этих элементов с натрием образуются соли. Наиболее известным из них является хлорид натрия или обычная поваренная соль (также называемая галитом). Слово галоген происходит от греческих корней hal-, что означает «соль», и -gen , что означает «производить».
Сводка
Прочтите краткий обзор этой темы
галоген , любой из шести неметаллических элементов, составляющих группу 17 (группа VIIa) периодической таблицы. Галогенсодержащие элементы: фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Им дали название галоген 9.0046 , от греческих корней hal — («соль») и — gen («производить»), потому что все они производят натриевые соли со схожими свойствами, из которых лучше всего подходит хлорид натрия — поваренная соль, или галит. известен.
известен.
Свободные галогены не встречаются в природе из-за их большой реакционной способности. В комбинированной форме фтор является самым распространенным из галогенов в земной коре. Процентное содержание галогенов в изверженных породах земной коры: фтора 0,06, хлора 0,031, брома 0,00016, йода 0,00003. Астатин и теннессин не встречаются в природе, так как состоят только из короткоживущих радиоактивных изотопов.
Галогенные элементы имеют большое сходство друг с другом в их общем химическом поведении и в свойствах их соединений с другими элементами. Однако наблюдается постепенное изменение свойств от фтора через хлор, бром и йод к астату — разница между двумя последовательными элементами наиболее заметна для фтора и хлора. Фтор является наиболее реакционноспособным из галогенов и, фактически, из всех элементов, и у него есть некоторые другие свойства, которые отличают его от других галогенов.
Хлор является наиболее известным из галогенных элементов. Свободный элемент широко используется в качестве реагента для очистки воды и используется в ряде химических процессов. Поваренная соль, хлорид натрия, безусловно, является одним из самых привычных химических соединений. Фториды известны главным образом тем, что их добавляют в воду для предотвращения кариеса, но органические фториды также используются в качестве хладагентов и смазочных материалов. Йод наиболее известен как антисептик, а бром используется в основном для получения соединений брома, которые используются в антипиренах и в качестве пестицидов общего назначения. В прошлом дибромид этилена широко использовался в качестве присадки к этилированному бензину.
Поваренная соль, хлорид натрия, безусловно, является одним из самых привычных химических соединений. Фториды известны главным образом тем, что их добавляют в воду для предотвращения кариеса, но органические фториды также используются в качестве хладагентов и смазочных материалов. Йод наиболее известен как антисептик, а бром используется в основном для получения соединений брома, которые используются в антипиренах и в качестве пестицидов общего назначения. В прошлом дибромид этилена широко использовался в качестве присадки к этилированному бензину.
Викторина «Британника»
Периодическая таблица элементов
Проверьте свою связь с периодической таблицей элементов в этой викторине по всем 118 химическим элементам и их символам. Вы можете быть знакомы с химическими символами водорода и кислорода, но можете ли вы сопоставить такие низкопрофильные элементы, как гадолиний и эрбий, с соответствующими символами?
Вероятно, самое важное обобщение, которое можно сделать о галогенных элементах, состоит в том, что все они являются окислителями; то есть они повышают степень окисления или степень окисления других элементов — свойство, которое раньше приравнивалось к соединению с кислородом, но теперь интерпретируется в терминах переноса электронов от одного атома к другому. При окислении другого элемента восстанавливается сам галоген; т. е. степень окисления 0 свободного элемента снижается до -1. Галогены могут соединяться с другими элементами, образуя соединения, известные как галогениды, а именно фториды, хлориды, бромиды, йодиды и астатиды. Многие из галогенидов можно рассматривать как соли соответствующих галогеноводородов, которые при комнатной температуре и атмосферном давлении представляют собой бесцветные газы и (за исключением фтороводорода) образуют в водном растворе сильные кислоты. Действительно, общий термин 9Соль 0045 получают из каменной или поваренной соли (хлорида натрия). Склонность галогенных элементов к образованию солеобразных (т. е. высокоионных) соединений возрастает в следующем порядке: астат < йод < бром < хлор < фтор. Фториды обычно более стабильны, чем соответствующие хлориды, бромиды или иодиды. (Часто астат опускают из общих рассуждений о галогенах, потому что о нем известно меньше, чем о других элементах.)
При окислении другого элемента восстанавливается сам галоген; т. е. степень окисления 0 свободного элемента снижается до -1. Галогены могут соединяться с другими элементами, образуя соединения, известные как галогениды, а именно фториды, хлориды, бромиды, йодиды и астатиды. Многие из галогенидов можно рассматривать как соли соответствующих галогеноводородов, которые при комнатной температуре и атмосферном давлении представляют собой бесцветные газы и (за исключением фтороводорода) образуют в водном растворе сильные кислоты. Действительно, общий термин 9Соль 0045 получают из каменной или поваренной соли (хлорида натрия). Склонность галогенных элементов к образованию солеобразных (т. е. высокоионных) соединений возрастает в следующем порядке: астат < йод < бром < хлор < фтор. Фториды обычно более стабильны, чем соответствующие хлориды, бромиды или иодиды. (Часто астат опускают из общих рассуждений о галогенах, потому что о нем известно меньше, чем о других элементах.)
Окислительная сила галогенов возрастает в том же порядке, т. е. от астата к фтору. Поэтому из галогенных элементов с наибольшим трудом получается элементарный фтор, с наименьшим — йод. Галогенные элементы как класс относятся к неметаллам, но астат проявляет определенные свойства, напоминающие свойства металлов.
е. от астата к фтору. Поэтому из галогенных элементов с наибольшим трудом получается элементарный фтор, с наименьшим — йод. Галогенные элементы как класс относятся к неметаллам, но астат проявляет определенные свойства, напоминающие свойства металлов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Химическое поведение галогенных элементов удобнее всего обсуждать с точки зрения их положения в периодической таблице элементов. В периодической таблице галогены составляют группу 17 (согласно системе нумерации, принятой Международным союзом теоретической и прикладной химии), группу, непосредственно предшествующую благородным газам. Атомы галогенов несут семь валентных электронов на внешней электронной оболочке. Эти семь крайних электронов находятся на двух различных орбиталях, обозначенных как 9.0045 s (с двумя электронами) и p (с пятью). Потенциально атом галогена может содержать еще один электрон (на орбитали p ), что придаст образующемуся иону галогенида такое же расположение (конфигурацию), что и благородный газ рядом с ним в периодической таблице. Эти электронные конфигурации исключительно стабильны. Эта ярко выраженная склонность галогенов приобретать дополнительный электрон делает их сильными окислителями.
Эти электронные конфигурации исключительно стабильны. Эта ярко выраженная склонность галогенов приобретать дополнительный электрон делает их сильными окислителями.
При комнатной температуре и атмосферном давлении галогенные элементы в свободном состоянии существуют в виде двухатомных молекул. В молекулярном фторе (F 2 ) атомы удерживаются вместе связью, состоящей из объединения p орбиталей каждого атома, при этом такая связь классифицируется как сигма-связь. Следует отметить, что энергия диссоциации фтора (энергия, необходимая для разрыва связи F—F) более чем на 30 % меньше, чем у хлора, но аналогична энергии йода (I 2 ). Слабость одинарной связи F—F по сравнению с хлором можно объяснить небольшим размером фтора, что приводит к уменьшению перекрывания связывающих орбиталей и увеличению отталкивания несвязывающих орбиталей. Однако в йоде p орбитали более размыты, что означает, что связь становится слабее, чем в хлоре или броме.
галоген | Элементы, примеры, свойства, использование и факты
Таблица Менделеева
Просмотреть все СМИ
- Ключевые люди:
- Жан-Батист-Андре Дюма
- Похожие темы:
- галогенорганическое соединение йод фтор хлор бром
Просмотреть всю связанную информацию →
Самые популярные вопросы
Что такое галогенные элементы?
Галогенные элементы представляют собой шесть элементов 17-й группы периодической таблицы. Группа 17 занимает вторую колонку справа в периодической таблице и содержит фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Астат и теннессин являются радиоактивными элементами с очень коротким периодом полураспада и поэтому не встречаются в природе.
Группа 17 занимает вторую колонку справа в периодической таблице и содержит фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Астат и теннессин являются радиоактивными элементами с очень коротким периодом полураспада и поэтому не встречаются в природе.
Каковы основные свойства галогенных элементов?
Галогенные элементы очень реакционноспособны. С натрием они производят соли, из которых наиболее известна поваренная соль (хлорид натрия, NaCl). Каждый атом галогена имеет семь валентных электронов на внешней электронной оболочке. Поэтому, когда атом галогена может получить электрон от атома другого элемента, два атома образуют очень стабильное соединение, потому что тогда самая внешняя электронная оболочка атома галогена заполнена.
В каких случаях используются галогеновые элементы?
Хлор используется для очистки воды. Кроме того, хлор входит в состав поваренной соли, хлорида натрия, который является одним из наиболее широко используемых химических соединений. Фтор используется во фторидах, которые добавляют в воду для предотвращения кариеса. Йод используется как антисептик.
Фтор используется во фторидах, которые добавляют в воду для предотвращения кариеса. Йод используется как антисептик.
Почему эти элементы называются галогенами?
При взаимодействии этих элементов с натрием образуются соли. Наиболее известным из них является хлорид натрия или обычная поваренная соль (также называемая галитом). Слово галоген происходит от греческих корней hal-, что означает «соль», и -gen , что означает «производить».
Сводка
Прочтите краткий обзор этой темы
галоген , любой из шести неметаллических элементов, составляющих группу 17 (группа VIIa) периодической таблицы. Галогенсодержащие элементы: фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Им дали название галоген 9.0046 , от греческих корней hal — («соль») и — gen («производить»), потому что все они производят натриевые соли со схожими свойствами, из которых лучше всего подходит хлорид натрия — поваренная соль, или галит. известен.
известен.
Свободные галогены не встречаются в природе из-за их большой реакционной способности. В комбинированной форме фтор является самым распространенным из галогенов в земной коре. Процентное содержание галогенов в изверженных породах земной коры: фтора 0,06, хлора 0,031, брома 0,00016, йода 0,00003. Астатин и теннессин не встречаются в природе, так как состоят только из короткоживущих радиоактивных изотопов.
Галогенные элементы имеют большое сходство друг с другом в их общем химическом поведении и в свойствах их соединений с другими элементами. Однако наблюдается постепенное изменение свойств от фтора через хлор, бром и йод к астату — разница между двумя последовательными элементами наиболее заметна для фтора и хлора. Фтор является наиболее реакционноспособным из галогенов и, фактически, из всех элементов, и у него есть некоторые другие свойства, которые отличают его от других галогенов.
Хлор является наиболее известным из галогенных элементов. Свободный элемент широко используется в качестве реагента для очистки воды и используется в ряде химических процессов. Поваренная соль, хлорид натрия, безусловно, является одним из самых привычных химических соединений. Фториды известны главным образом тем, что их добавляют в воду для предотвращения кариеса, но органические фториды также используются в качестве хладагентов и смазочных материалов. Йод наиболее известен как антисептик, а бром используется в основном для получения соединений брома, которые используются в антипиренах и в качестве пестицидов общего назначения. В прошлом дибромид этилена широко использовался в качестве присадки к этилированному бензину.
Поваренная соль, хлорид натрия, безусловно, является одним из самых привычных химических соединений. Фториды известны главным образом тем, что их добавляют в воду для предотвращения кариеса, но органические фториды также используются в качестве хладагентов и смазочных материалов. Йод наиболее известен как антисептик, а бром используется в основном для получения соединений брома, которые используются в антипиренах и в качестве пестицидов общего назначения. В прошлом дибромид этилена широко использовался в качестве присадки к этилированному бензину.
Викторина «Британника»
Периодическая таблица элементов
Проверьте свою связь с периодической таблицей элементов в этой викторине по всем 118 химическим элементам и их символам. Вы можете быть знакомы с химическими символами водорода и кислорода, но можете ли вы сопоставить такие низкопрофильные элементы, как гадолиний и эрбий, с соответствующими символами?
Вероятно, самое важное обобщение, которое можно сделать о галогенных элементах, состоит в том, что все они являются окислителями; то есть они повышают степень окисления или степень окисления других элементов — свойство, которое раньше приравнивалось к соединению с кислородом, но теперь интерпретируется в терминах переноса электронов от одного атома к другому. При окислении другого элемента восстанавливается сам галоген; т. е. степень окисления 0 свободного элемента снижается до -1. Галогены могут соединяться с другими элементами, образуя соединения, известные как галогениды, а именно фториды, хлориды, бромиды, йодиды и астатиды. Многие из галогенидов можно рассматривать как соли соответствующих галогеноводородов, которые при комнатной температуре и атмосферном давлении представляют собой бесцветные газы и (за исключением фтороводорода) образуют в водном растворе сильные кислоты. Действительно, общий термин 9Соль 0045 получают из каменной или поваренной соли (хлорида натрия). Склонность галогенных элементов к образованию солеобразных (т. е. высокоионных) соединений возрастает в следующем порядке: астат < йод < бром < хлор < фтор. Фториды обычно более стабильны, чем соответствующие хлориды, бромиды или иодиды. (Часто астат опускают из общих рассуждений о галогенах, потому что о нем известно меньше, чем о других элементах.)
При окислении другого элемента восстанавливается сам галоген; т. е. степень окисления 0 свободного элемента снижается до -1. Галогены могут соединяться с другими элементами, образуя соединения, известные как галогениды, а именно фториды, хлориды, бромиды, йодиды и астатиды. Многие из галогенидов можно рассматривать как соли соответствующих галогеноводородов, которые при комнатной температуре и атмосферном давлении представляют собой бесцветные газы и (за исключением фтороводорода) образуют в водном растворе сильные кислоты. Действительно, общий термин 9Соль 0045 получают из каменной или поваренной соли (хлорида натрия). Склонность галогенных элементов к образованию солеобразных (т. е. высокоионных) соединений возрастает в следующем порядке: астат < йод < бром < хлор < фтор. Фториды обычно более стабильны, чем соответствующие хлориды, бромиды или иодиды. (Часто астат опускают из общих рассуждений о галогенах, потому что о нем известно меньше, чем о других элементах.)
Окислительная сила галогенов возрастает в том же порядке, т. е. от астата к фтору. Поэтому из галогенных элементов с наибольшим трудом получается элементарный фтор, с наименьшим — йод. Галогенные элементы как класс относятся к неметаллам, но астат проявляет определенные свойства, напоминающие свойства металлов.
е. от астата к фтору. Поэтому из галогенных элементов с наибольшим трудом получается элементарный фтор, с наименьшим — йод. Галогенные элементы как класс относятся к неметаллам, но астат проявляет определенные свойства, напоминающие свойства металлов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Химическое поведение галогенных элементов удобнее всего обсуждать с точки зрения их положения в периодической таблице элементов. В периодической таблице галогены составляют группу 17 (согласно системе нумерации, принятой Международным союзом теоретической и прикладной химии), группу, непосредственно предшествующую благородным газам. Атомы галогенов несут семь валентных электронов на внешней электронной оболочке. Эти семь крайних электронов находятся на двух различных орбиталях, обозначенных как 9.0045 s (с двумя электронами) и p (с пятью). Потенциально атом галогена может содержать еще один электрон (на орбитали p ), что придаст образующемуся иону галогенида такое же расположение (конфигурацию), что и благородный газ рядом с ним в периодической таблице. Эти электронные конфигурации исключительно стабильны. Эта ярко выраженная склонность галогенов приобретать дополнительный электрон делает их сильными окислителями.
Эти электронные конфигурации исключительно стабильны. Эта ярко выраженная склонность галогенов приобретать дополнительный электрон делает их сильными окислителями.
При комнатной температуре и атмосферном давлении галогенные элементы в свободном состоянии существуют в виде двухатомных молекул. В молекулярном фторе (F 2 ) атомы удерживаются вместе связью, состоящей из объединения p орбиталей каждого атома, при этом такая связь классифицируется как сигма-связь. Следует отметить, что энергия диссоциации фтора (энергия, необходимая для разрыва связи F—F) более чем на 30 % меньше, чем у хлора, но аналогична энергии йода (I 2 ). Слабость одинарной связи F—F по сравнению с хлором можно объяснить небольшим размером фтора, что приводит к уменьшению перекрывания связывающих орбиталей и увеличению отталкивания несвязывающих орбиталей. Однако в йоде p орбитали более размыты, что означает, что связь становится слабее, чем в хлоре или броме.
галогенорганическое соединение | Определение, примеры, использование и факты
ПВХ
Посмотреть все СМИ
- Ключевые люди:
- Одд Хассель
- Похожие темы:
- диоксин ДДТ хлорфенол Фреон слезоточивый газ
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
органогалогенное соединение , любое из класса органических соединений, содержащих по крайней мере один галоген (фтор [F], хлор [Cl], бром [Br] или йод [I]), связанный с углеродом. Они подразделяются на алкилгалогениды, виниловые, арил- и ацилгалогениды. В алкилгалогенидах все четыре связи с углеродом, несущим галоген, являются одинарными; в виниловых галогенидах углерод, несущий галоген, дважды связан с другим углеродом; в арилгалогенидах углерод, содержащий галоген, является частью ароматического кольца; а в ацилгалогенидах (также называемых галоидокислотами) углерод, содержащий галоген, дважды связан с кислородом. Здесь показаны примеры четырех типов.
Они подразделяются на алкилгалогениды, виниловые, арил- и ацилгалогениды. В алкилгалогенидах все четыре связи с углеродом, несущим галоген, являются одинарными; в виниловых галогенидах углерод, несущий галоген, дважды связан с другим углеродом; в арилгалогенидах углерод, содержащий галоген, является частью ароматического кольца; а в ацилгалогенидах (также называемых галоидокислотами) углерод, содержащий галоген, дважды связан с кислородом. Здесь показаны примеры четырех типов.
Именно тип углерода, с которым непосредственно связан галоген, в первую очередь отвечает за характерные свойства каждого класса. Таким образом, углерод, несущий галоген в аллилхлориде (CH 2 = CHCH 2 Cl), связан одинарной связью с каждым из присоединенных к нему атомов, что делает соединение алкилгалогенидом, даже если двойная связь присутствует в другом месте в цепь. По той же причине бензилхлорид (C 6 H 5 CH 2 Cl) является алкилгалогенидом, а не арилгалогенидом, хотя бензольное кольцо присутствует.
Галогенорганические соединения сильно различаются по химической реакционной способности в зависимости от галогена и класса, к которому они принадлежат, и они могут даже различаться внутри класса. Галогеновый заместитель считается функциональной группой, а превращения галогенорганических соединений относятся к числу наиболее важных в органической химии. Многие галогенорганические соединения, особенно хлорорганические соединения, являются важными промышленными химическими веществами; они используются в качестве растворителей и пестицидов, а также в качестве промежуточных продуктов при получении красителей, лекарств и синтетических полимеров. Более 2000 галогенорганических соединений были идентифицированы как встречающиеся в природе материалы и производятся различными растениями, грибами, бактериями и морскими организмами. Доступны различные синтетические методы для введения галогенов в органические молекулы, и органические соединения галогенов могут быть преобразованы в другие классы функциональных групп надежными методами.
В этой статье обсуждаются алкилгалогениды, виниловые и арилгалогениды; для получения дополнительной информации об ацилгалогенидах см. галогенангидриды и карбоновые кислоты.
При наименовании галогенорганических соединений используются два типа номенклатуры ИЮПАК: заместительный и функциональный класс. В замещающей номенклатуре префикс фтор-, хлор-, бром- или йод- добавляется к названию углеводородного каркаса вместе с числом (называемым локантом), идентифицирующим углерод, к которому присоединен галоген. Заместители, включая галоген, перечислены в алфавитном порядке. Здесь приведены примеры замещающей номенклатуры.
Два отдельных слова используются при наименовании алкилгалогенидов по номенклатуре функциональных классов. Первое слово — это название алкильной группы по ИЮПАК (объяснение номенклатуры ИЮПАК, см. углеводород), а второе — слово фторид , хлорид , бромид или йодид — в зависимости от галоген. Цепь алкильной группы нумеруется, начиная с атома углерода, к которому присоединен галоген.
Цепь алкильной группы нумеруется, начиная с атома углерода, к которому присоединен галоген.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Некоторые хлорированные углеводороды давно известны под общими названиями. К ним относятся CH 2 Cl 2 (метиленхлорид), CHCl 3 (хлороформ), CCl 4 (четыреххлористый углерод), CH 2 = CHCl (винилхлорид) и CH 2 = CCl. 2 (винилиденхлорид).
Сила связи углерод-галоген и реакционная способность
Среди различных классов галогенорганических соединений арилгалогениды имеют самые сильные связи углерод-галоген, а алкилгалогениды самые слабые, как, например, в следующем ряду хлорорганических соединений. (Энергия разрыва связи — это количество энергии, необходимое для разрыва данной связи молекулы в газовой фазе.)
Существует грубая корреляция между прочностью связи и скоростью реакции галогенорганических соединений; например, чем прочнее связь углерод-галоген, тем медленнее скорость реакции. Многие из наиболее распространенных и полезных реакций алкилгалогенидов применительно к виниловым или арилгалогенидам протекают слишком медленно, чтобы их можно было реализовать на практике.
Многие из наиболее распространенных и полезных реакций алкилгалогенидов применительно к виниловым или арилгалогенидам протекают слишком медленно, чтобы их можно было реализовать на практике.
Структура и физические свойства
Алкилгалогениды (RX, где R представляет собой алкильную группу, а X представляет собой F, Cl, Br или I) классифицируются как первичные, вторичные или третичные в соответствии со степенью замещения атома углерода к которому присоединен галоген. В первичном алкилгалогениде углерод, несущий галоген, непосредственно связан с одним другим атомом углерода, во вторичном алкилгалогениде — с двумя, а в третичном алкилгалогениде — с тремя.
Методы, используемые для получения алкилгалогенидов, и реакции, которым подвергаются алкилгалогениды, часто зависят от того, является ли алкилгалогенид первичным, вторичным или третичным.
Заместитель галогена притягивает к себе электроны связи C—X, придавая атому углерода частичный положительный заряд (δ+), а галогену — частичный отрицательный заряд (δ-). Наличие образующейся полярной ковалентной связи делает большинство алкилгалогенидов полярными соединениями. Поскольку диполь связи (мера разделения зарядов) связи C-X представляет собой произведение зарядового члена (наибольшего для фтора и наименьшего для йода) и члена расстояния (наименьшего для фтора и наибольшего для йода), молекулярные дипольные моменты алкилгалогенидов не сильно различаются от одного галогена к другому.
Наличие образующейся полярной ковалентной связи делает большинство алкилгалогенидов полярными соединениями. Поскольку диполь связи (мера разделения зарядов) связи C-X представляет собой произведение зарядового члена (наибольшего для фтора и наименьшего для йода) и члена расстояния (наименьшего для фтора и наибольшего для йода), молекулярные дипольные моменты алкилгалогенидов не сильно различаются от одного галогена к другому.
Наиболее важные реакции галогенорганических соединений включают разрыв связи углерод-галоген в процессах, в которых галоген сохраняет оба электрона от исходной связи и теряется в виде отрицательно заряженного иона (X — ). В соответствии с порядком сил связи углерод-галоген, в котором связь с фтором является самой сильной, а связь с йодом — самой слабой из связей углерод-галоген, фториды обычно считаются наименее реакционноспособными из алкилгалогенидов и йодидов. самый реактивный.
Температуры кипения этилгалогенидов увеличиваются по мере увеличения атомного номера галогена. С увеличением атомного номера галоген становится более поляризуемым, а это означает, что электрическое поле, связанное с атомом, легче искажается присутствием близлежащих электрических полей. Фтор является наименее поляризуемым из галогенов, а йод — наиболее поляризуемым. Повышенная поляризуемость связана с более сильными силами межмолекулярного притяжения лондоновского типа дисперсии ( см. химическая связь: межмолекулярные силы) и, следовательно, с повышенной температурой кипения.
С увеличением атомного номера галоген становится более поляризуемым, а это означает, что электрическое поле, связанное с атомом, легче искажается присутствием близлежащих электрических полей. Фтор является наименее поляризуемым из галогенов, а йод — наиболее поляризуемым. Повышенная поляризуемость связана с более сильными силами межмолекулярного притяжения лондоновского типа дисперсии ( см. химическая связь: межмолекулярные силы) и, следовательно, с повышенной температурой кипения.
Множественное замещение галогена приводит к повышению точки кипения: CH 3 Cl кипит при –24 °C (–11 °F), CH 2 Cl 2 при 40 °C (104 °F), CHCl 3 при 61 °C (142 °F) и CCl 4 при 77 °C (171 °F). Однако множественное замещение фтора является исключением: CH 3 CH 2 F кипит при -32 °C (-26 °F), CH 3 CHF 2 при −25 °C (−13 °F), CH 3 CF 3 при −47 °C (−53 °F) и CF 3 CF 3 при −78 °C ( −108 ° F). Уменьшая молекулярную поляризуемость, многократное замещение фтором ослабляет силу дисперсионных сил между молекулами. В жидком состоянии эти ослабленные силы межмолекулярного притяжения отражаются в необычно низких температурах кипения, а в твердом состоянии они ответственны за новые свойства фторуглеродных полимеров.
Уменьшая молекулярную поляризуемость, многократное замещение фтором ослабляет силу дисперсионных сил между молекулами. В жидком состоянии эти ослабленные силы межмолекулярного притяжения отражаются в необычно низких температурах кипения, а в твердом состоянии они ответственны за новые свойства фторуглеродных полимеров.
Плотность алкилгалогенидов связана с межмолекулярными силами притяжения и стремится к параллельным точкам кипения, причем алкилфториды являются наименее плотными, а алкилйодиды — наиболее плотными. Как правило, алкилфториды и хлориды менее плотны, чем вода, а бромиды и йодиды более плотны, чем вода. Алкилгалогениды не растворяются в воде.
В чем разница между хлором фтором и астатином
Основное различие между хлорфтором и астатом заключается в том, что хлор представляет собой бледно-желто-зеленый газ, а фтор — газ очень бледного цвета, тогда как астат — радиоактивный химический элемент, редко встречающийся в природе.
Хлор, фтор и астат являются тремя членами группы галогенов. Галогены представляют собой химически активные элементы, состоящие из двухатомных молекул и присутствующие слева от инертных газов в периодической таблице элементов.
Галогены представляют собой химически активные элементы, состоящие из двухатомных молекул и присутствующие слева от инертных газов в периодической таблице элементов.
СОДЕРЖАНИЕ
1. Обзор и основные отличия
2. Что такое хлор
3. Что такое фтор
4. Что такое астат
5. Сравнение хлора, фтора и астата в табличной форме
6. Резюме – Сравнение хлора, фтора и астата
Что такое хлор?
Хлор представляет собой газообразное соединение, имеющее химическую формулу Cl2. Он выглядит как бледный желто-зеленый газ при комнатной температуре и давлении. Газообразный хлор действует как чрезвычайно реактивный агент, поэтому он является сильным окислителем. Кроме того, этот газ имеет резкий раздражающий запах, похожий на запах отбеливателя. Название этого газа по классификации ИЮПАК — «молекулярный хлор».
Молярная масса газообразного хлора составляет 70,9 г/моль. Два атома хлора в этой молекуле ковалентно связаны друг с другом. Мы называем его «двухатомным газом», потому что на молекулу приходится два атома, связанных друг с другом. Вдыхание этого газа токсично, а также вызывает раздражение глаз. Газ слабо растворим в воде и может переходить в жидкое состояние при -35°С. Однако мы можем легко сжижать этот газ, применяя соответствующее давление при комнатной температуре. Более того, этот газ не воспламеняется, но может поддерживать горение.
Мы называем его «двухатомным газом», потому что на молекулу приходится два атома, связанных друг с другом. Вдыхание этого газа токсично, а также вызывает раздражение глаз. Газ слабо растворим в воде и может переходить в жидкое состояние при -35°С. Однако мы можем легко сжижать этот газ, применяя соответствующее давление при комнатной температуре. Более того, этот газ не воспламеняется, но может поддерживать горение.
Что еще более важно, этот газ токсичен, если мы его вдыхаем. Газообразный хлор тяжелее обычного воздуха. Поэтому он имеет тенденцию собираться в нижних слоях атмосферы. Его температуры плавления и кипения составляют -101°C и -35°C соответственно. Он используется в качестве дезинфицирующего средства во многих отраслях промышленности, для очистки воды, производства боевых газов и т. д.
Что такое фтор?
Фтор — химический элемент, обозначаемый буквой F. Это галоген (17-я группа) во 2-м периоде периодической таблицы. Атомный номер фтора 9; таким образом, он имеет девять протонов и девять электронов. Его электронная конфигурация записывается как 1s2 2s2 2p5. Поскольку на подуровне p должно быть 6 электронов, чтобы получить неон, электронную конфигурацию благородного газа, фтор обладает способностью притягивать электрон. Согласно шкале Полинга, фтор имеет самую высокую электроотрицательность в периодической таблице, которая составляет около 4.
Его электронная конфигурация записывается как 1s2 2s2 2p5. Поскольку на подуровне p должно быть 6 электронов, чтобы получить неон, электронную конфигурацию благородного газа, фтор обладает способностью притягивать электрон. Согласно шкале Полинга, фтор имеет самую высокую электроотрицательность в периодической таблице, которая составляет около 4.
Атомная масса фтора составляет 18,9984 а.е.м. При комнатной температуре фтор существует в виде двухатомной молекулы (F2). F2 представляет собой бледно-желто-зеленоватый газ с температурой плавления -219°С.°С и температура кипения -188 °С. Среди изотопов фтора F-17 не является стабильным изотопом, и его период полураспада составляет 1,8 часа. Но F-19 — это стабильный изотоп. Распространенность F-19 на земле составляет 100%. Фтор может окислять кислород, и его степень окисления равна -1.
Газообразный фтор плотнее воздуха, и его также можно сжижать и затвердевать. Он очень реакционноспособен; это связано с его высокой электроотрицательностью и слабой связью фтор-фтор. Более того, реакции этого химического вида с большинством других молекул протекают быстро. Из-за реакционной способности в свободном виде не встречается.
Более того, реакции этого химического вида с большинством других молекул протекают быстро. Из-за реакционной способности в свободном виде не встречается.
Астат — высокорадиоактивный элемент, относящийся к группе галогенов. Он имеет химический символ At и атомный номер 85. Мы можем описать астат как самый редкий встречающийся в природе химический элемент в земной коре. Он возникает только как продукт распада различных более тяжелых элементов. Как правило, все изотопы астата являются короткоживущими видами, астатин-210 является наиболее стабильным среди них. Поэтому объемные свойства этого химического элемента точно неизвестны.
Астат, скорее всего, имеет темный и блестящий вид. Это может быть полупроводник или металл. Существует несколько анионных разновидностей астата, которые проявляют свойства соединений йода. Иногда он может проявлять металлические характеристики и может проявлять сходство с серебром.
Основное различие между фтором хлора и астатом заключается в том, что хлор выглядит как бледно-желто-зеленый газ, а фтор — как газ очень бледного цвета, тогда как астат — это радиоактивный химический элемент, редко встречающийся в природе.
На приведенной ниже инфографике представлены различия между хлорфтором и астатом в табличной форме для параллельного сравнения.
Резюме – Хлор, фтор и астат
Хлор, фтор и астат являются тремя членами группы галогенов. Ключевое различие между хлором, фтором и астатом заключается в том, что хлор выглядит как бледный желто-зеленый газ, а фтор — как газ очень бледного цвета, тогда как астат — это радиоактивный химический элемент, который редко встречается в природе.
Ссылка:
1. «Решения для очистки воды». Lenntech Водоподготовка и очистка.
Изображение предоставлено:
1. «Газ хлора в высокой концентрации». Автор Larenmclane — собственная работа (CC BY-SA 4.0) через Commons Wikimedia
2. «Фтор» Автор Albedo-ukr — Изображение: Fluorine.gif (CC BY-SA 2.5) через Commons Wikimedia
Распределение хлора и фтора в донных фораминиферах
Аллен К. А., Хёниш Б., Эггинс С. М., Хейнс Л. Л., Розенталь Ю. и
Ю, Дж.: Прокси-элементы микроэлементов для условий на поверхности океана: синтез
культуральные калибровки планктонных фораминифер // Геохим. Космохим.
Ак., 193, 197–221, 2016. a
и
Ю, Дж.: Прокси-элементы микроэлементов для условий на поверхности океана: синтез
культуральные калибровки планктонных фораминифер // Геохим. Космохим.
Ак., 193, 197–221, 2016. a
Энджелл, Р. В.: Тестовый морфогенез (образование камер) у фораминифер. Spiroloculina hyalina Schulze, J. Foramin. Рез., 10, 89–101, 1980. a, b
Баркер С., Гривз М. и Элдерфилд Х.: Исследование процедур очистки для палеотермометрии фораминифер Mg/Ca // Геохим. Геоф. Geosy., 4, 8407, https://doi.org/10.1029/2003GC000559, 2003. a
Бентов С. и Эрез Дж.: Влияние процессов биоминерализации на Mg состав раковин фораминифер: биологическая перспектива // Геохимия. Геоф. Геос., 7, Q01P08, https://doi.org/10.1029/2005GC001015, 2006. a, b, c
Bonnin, E. A., Zhu, Z., Fehrenbacher, J. S., Russell, A. D., Hönisch, B.,
Сперо, Х. Дж., и Ганьон, А. К.: Субмикронные полосы натрия в культивируемых
Планктонные раковины фораминифер // Геохим. Космохим. Ac., 253, 127–141, https://doi.org/10.1016/j.gca. 2019.03.024, 2019. a
2019.03.024, 2019. a
Boyle, E. A.: Кадмий, цинк, медь и барий в тестах фораминифер , Земля Планета. наук летт., 53, 11–35, https://doi.org/10.1016/0012-821X(81)
-4, 1981. a
Брэнсон О., Качмарек К., Редферн С. А., Мишра С., Лангер Г., Тылишак, Т., Бийма Дж. и Элдерфилд Х.: Координация и распределение B. в фораминиферовом кальците, Планета Земля. наук Письма., 416, 67–72, 2015. a
Брэнсон О., Боннин Э. А., Переа Д. Э., Сперо Х. Дж., Чжу З., Уинтерс М., Хёниш Б., Рассел А. Д., Ференбахер Дж. С. и Ганьон А. К.: Химия в нанометровом масштабе шаблона биоминерализации кальцита: Последствия для состава скелета и зародышеобразования, P. Натл. акад. науч. USA, 113, 12934–12939, 2016. a
Карпентер, Р.: Факторы, контролирующие морскую геохимию фтора, Геохим. Космохим. Ак., 33, 1153–1167, https://doi.org/10.1016/0016-7037(69)
-6, 1969. а, б, в
Дебене, Ж.-П., Гийу, Ж.-Ж., и Лесур, М.: Коллоидный кальцит в
фораминиферовые тесты; кристаллизация и консистенция теста, J. Форамин. рез., 26, 277–288, 1996. а, б, в
Форамин. рез., 26, 277–288, 1996. а, б, в
Дебене, Ж.-П., Гийу, Ж.-Ж., Геслен, Э., Лесур, М., и Редуа, Ф.: Процесс кристаллизации ромбовидных пластинок а-ля Surface d’un test porcelané de foraminifere actuel, Geobios, 31, 295–302, 1998. а, б
Дебене, Ж.-П., Гийу, Ж.-Ж., Геслен, Э., и Лесур, М.: Кристаллизация кальцит в раковинах фораминифер, Микропалеонтология, 46, 87–9.4, 2000. а, б
де Ноойер, Л. Дж., Тойофуку, Т., и Китазато, Х.: Фораминиферы продвигают кальцификация за счет повышения их внутриклеточного pH, P. Натл. акад. науч. США, 106, 15374–15378, 2009. а, б
де Нуйер, Л. Дж., Сперо, Х. Дж., Эрез, Дж., Бийма, Дж., и Рейхарт, Г. Дж.: Биоминерализация перфоратных фораминифер, Earth-Sci. Обр., 135, 48–58, 2014. a, b, c, d
Эггинс С. М., Садеков А. и Де Деккер П.: Модуляция и суточная полосатость
Mg/Ca в Orbulina universa тесты на симбионтный фотосинтез и
дыхание: осложнение для термометрии морской воды?, Планета Земля.
наук Lett., 225, 411–419, 2004. а, б
а, б
Элдерфилд, Х., Бертрам, К. и Эрез, Дж.: Модель биоминерализации для включение микроэлементов в фораминиферовый карбонат кальция, Земля Планета. наук Lett., 142, 409–423, 1996. a
Эрез, Дж.: Источник ионов для биоминерализации фораминифер и их последствия для палеоокеанографических прокси, Rev. Mineral. геохим., 54, 115–149., 2003. a, b
Эванс, Д., Эрез, Дж., Орон, С., и Мюллер, В.: Mg/Ca-температура и взаимосвязь между морской водой и химическим составом в крупном бентосе, обитающем на мелководье. foraminifera Operculina ammonoides , Геохим. Космохим. Ac., 148, 325–342, 2015. a
Ференбахер, Дж. С., Рассел, А. Д., Дэвис, К. В., Ганьон, А. К., Сперо, Х. Дж., Клифф Дж. Б., Чжу З. и Мартин П.: Связь между запускаемыми светом Mg-полосатость и формирование камер в планктонных фораминиферах Неоглобоквадрина Дутертрей , Нац. коммун., 8, 15441, г. 2017. a
Гаттузо, Дж.-П., Эпиталон, Дж.-М., Лавин, Х., и Орр, Дж.: морской карбюратор: морская вода
Химия карбонатов, версия пакета r
3. 2.10, доступно по адресу:
https://CRAN.R-project.org/package=seacarb, последний доступ: 10 ноября 2018 года. : Влияние солености на включение элементов в двух видах бентосных фораминифер с контрастным содержанием магния, Biogeosciences, 15, 2205–2218, https://doi.org/10.5194/bg-15-2205-2018, 2018. a, b, c, d, e, f, g, h
2.10, доступно по адресу:
https://CRAN.R-project.org/package=seacarb, последний доступ: 10 ноября 2018 года. : Влияние солености на включение элементов в двух видах бентосных фораминифер с контрастным содержанием магния, Biogeosciences, 15, 2205–2218, https://doi.org/10.5194/bg-15-2205-2018, 2018. a, b, c, d, e, f, g, h
Geerken, E., de Nooijer, L. J., Roepert, A., Polerecky, L. ., Кинг, Х. Э., и Reichart, G.-J.: Обвязка элементов и органическая облицовка внутри стенок камеры две бентосные фораминиферы, Sci. Респ.-УК, 9, 3598, https://doi.org/10.1038/s41598-019-40298-y, 2019. a, b, c, d, e, f, g
Глок Н., Либетрау В., Фогтс А., и Эйзенхауэр, А.: Органические Неоднородности фораминиферового кальцита, прослеженные по распределению N, S и I, измеренные с помощью NanoSIMS: новый вызов для Палеопрокси на основе соотношения элементов?, Фронт. Науки о Земле, 7, 175, https://doi.org/10.3389/feart.2019.00175, 2019. a
Хемлебен К., Эрсон О., Бертольд В. и Шпиндлер М.: Обызвествление и
формирование камер у фораминифер — краткий обзор, в: Биоминерализация низших растений и животных, под редакцией: Ледбитера, Б. С.С. и Райдинга, Р., Clarendon Press, Оксфорд, 237–249, 1986. a, b, c, d, e
С.С. и Райдинга, Р., Clarendon Press, Оксфорд, 237–249, 1986. a, b, c, d, e
Ichikuni, M.: Поглощение фтора арагонитом, Chem. геол., 27, 207–214, https://doi.org/10.1016/0009-2541(79)
-1, 1979. aДжонкерс, Л., Бузе, Б., Браммер, Г.-Дж. А. и Холл И. Р.: Формирование камеры приводит к полосатости Mg/Ca в планктонных фораминиферах Neogloboquadrina толстокожий , Планета Земля. наук лат., 451, 177–184, 2016. a
Кендрик, М. А.: Галогены в морской воде, морских отложениях и измененных океанических литосферы, в: Роль галогенов в земных и внеземных геохимические процессы, под редакцией: Харлова Д.Е. и Аранович, Л., 591–648, https://doi.org/10.1007/978-3-319-61667-4_9, Springer International Publishing, Cham, 2018. a, b, c
Китано Ю., Окумура М. и Идогаки М.: Включение натрия, хлорида и сульфат с карбонатом кальция // Геохим. Дж., 9, 75–84, 1975. a, b, c, d
Куниока Д., Шираи К., Такахата Н., Сано Ю., Тойофуку Т. и Уджиие Ю.:
Микрораспределение отношений Mg/Ca, Sr/Ca и Ba/Ca в
Тест Pulleniatina obliquiloculata с использованием NanoSIMS:
Значение для механизма жизненного эффекта // Геохим. Геоф.
Геос., 7, 12, https://doi.org/10.1029/2006GC001280, 2006. а, б
Геоф.
Геос., 7, 12, https://doi.org/10.1029/2006GC001280, 2006. а, б
Леа, Д. В., Машиотта, Т. А., и Сперо, Х. Дж.: Контроль магния и поглощение стронция планктонными фораминиферами, определяемое живым культивированием, Геохим. Космохим. Ак., 63, 2369–2379, 1999. a
Ли К., Тонг Л. Т., Миллеро Ф. Дж., Сабина К. Л., Диксон А. Г., Гойет К., Парк Г.-Х., Ваннинхоф Р., Фили Р. А. и Ки Р. М.: Global связи общей щелочности с соленостью и температурой на поверхности воды мирового океана // Геофиз. Рез. Лет., 33, Л19605, https://doi.org/10.1029/2006GL027207, 2006. a
Лу, З., Дженкинс, Х. К., и Рикаби, Р. Э.: Соотношение йода и кальция в морской карбонат как показатель палео-окислительно-восстановительного потенциала во время бескислородных явлений в океане, Геология, 38, 1107–1110, 2010. a
Люкер, Т. Дж., Диксон, А. Г., и Килинг, К. Д.: Ocean p CO 2 рассчитано
от растворенного неорганического углерода, щелочности и уравнений для K1 и K2:
проверка на основе лабораторных измерений p CO 2 в газе и морской воде
в равновесии, Mar. Chem., 70, 105–119, 2000. a
Chem., 70, 105–119, 2000. a
Мартенс, К. С. и Харрис, Р. К.: Ингибирование осаждения апатита в морской среды ионами магния // Геохим. Космохим. Ак., 34, 621–625, 1970. a
Мезгер, Э. М., де Нуойер, Л. Дж., Бертлих, Дж., Бийма, Дж., Нюрнберг, Д., и Райхарт, Г.-Дж.: Планктонные фораминиферовые шипы в сравнении с включением натрия в карбонат раковины в зависимости от солености , Биогеонауки, 16, 1147–1165, https://doi.org/10.5194/bg-16-1147-2019, 2019. a
Миллеро Ф., Хуанг Ф., Чжу Х., Лю Х. и Чжан Дж.-З.: Адсорбция и десорбция фосфата на кальците и арагоните в морской воде, Aquat. Geochem., 7, 33–56, 2001. a
Нерке, Г., Кеул, Н., Лангер, Г., де Нуойер, Л.Дж., Бийма, Дж. и Мейбом, А.: Новая модель биоминерализации и сигнатуры микроэлементов в тестах Foraminifera, Biogeosciences, 10, 6759–6767, https://doi.org/10.5194/bg-10-6759-2013, 2013. a, b, c
Окумура М., Китано Ю. и Идогаки М.: Включение ионов фтора в
кальцит – влияние органических материалов и ионов магния в исходном растворе,
Геохим. Ж., 17, 257–263,
https://doi.org/10.2343/geochemj.17.257, 1983. a
Ж., 17, 257–263,
https://doi.org/10.2343/geochemj.17.257, 1983. a
Окумура М., Китано Ю. и Идогаки М.: Поведение ионов брома во время образование карбоната кальция, Mar. Chem., 19, 109–120, 1986. a
Опдайк Б. Н., Уолтер Л. М. и Хьюстон Т. Дж.: Содержание фтора в фораминиферовый кальцит: связь со средой обитания, изотопный состав кислорода, и химия малых элементов, Геология, 21, 169–172, 1993. a, b, c, d, e, f, g
Paris, G., Fehrenbacher, J. S., Sessions, A. L., Spero, H. J., and Adkins, J. F.: Экспериментальное определение карбонат-ассоциированного сульфата δ 34 S в раковинах планктонных фораминифер // Геохим. Геоф. Геос., 15, 1452–1461, 2014. а, б
Полерецкий Л., Адам Б., Милука Дж., Мусат Н., Вагнер Т. и Кайперс, М. М.: Look@NanoSIMS – инструмент для анализа данных nanoSIMS в экологическая микробиология, Окружающая среда. микробиол., 14, 1009–1023, 2012. a
Рэй, Дж. В. Б., Фостер, Г. Л., Шмидт, Д. Н., и Эллиотт, Т.: Изотопы бора
и B/Ca в бентических фораминиферах: прокси для глубоководных карбонатов
система, планета Земля. наук Lett., 302, 403–413, 2011. a
наук Lett., 302, 403–413, 2011. a
R Основная группа: R: Язык и среда для статистических вычислений, R Фонд статистических вычислений, Вена, Австрия, доступно по адресу: https://www.R-project.org/, последний доступ: 10 ноября 2018 г. a, b, c
Роперт, А.: Распределение элементов изображения в небольших морских кальцификаторах: перспектива NanoSIMS, докторская диссертация, Утрехтские исследования в области наук о Земле, Vol. 201, 232 стр., 2019 г.а. a
Roepert, A.: Дополнительные данные к «Распределению Cl и F в бентосных фораминиферах», 4TU.ResearchData, набор данных, https://doi.org/10.4121/uuid:9951e801-5574-498e-b375-fa6941a0f071, 2019б. а
Розенталь Ю. и Бойл Э. А.: Факторы, контролирующие содержание фтора в планктонные фораминиферы: оценка их палеоокеанографических применимость, Геохим. Космохим. Ac., 57, 335–346, 1993. a, b, c, d
Розенталь Ю., Бойл Э. А. и Слоуи Н.: Контроль температуры на
включение магния, стронция, фтора и кадмия в бентос
раковины фораминифер с отмели Литтл-Багама: перспективы термоклина
палеоокеанография, Геохим. Космохим. Ак., 61, 3633–3643,
https://doi.org/10.1016/S0016-7037(97)00181-6, 1997. a, b
Космохим. Ак., 61, 3633–3643,
https://doi.org/10.1016/S0016-7037(97)00181-6, 1997. a, b
Руд, П. Д. и Аллер, Р. К.: Подвижность фтора во время раннего диагенеза карбонатный осадок: индикатор минеральных преобразований // Геохим. Космохим. Ак., 55, 2491–2509, https://doi.org/10.1016/0016-7037(91)
-F, 1991. aСадеков А.Ю., Эггинс С.М. и де Деккер П.: Характеристика Mg/ Ca распределения планктонных видов фораминифер с помощью электронного микрозонда картографирование, Геохим. Геоф. Геос., 6, 12, https://doi.org/10.1029/2005GC000973, 2005. a
Сперо Х. Дж., Эггинс С. М., Рассел А. Д., Веттер Л., Килберн М. Р. и Хёниш, Б.: Время и механизм внутритестовой изменчивости Mg/Ca в живые планктонные фораминиферы, планета Земля. наук Летт., 409, 32–42, 2015. a
Шафранек Д. и Эрез Дж.: Химия Mg, SO42-, Sr, Na и Cl в живых раковинах фораминифер, в: The 7th International Symp. на Биоминерализация, Монако, Программа и тезисы, 1993. a, b
Танака К., Оно Т., Фудзиока Ю. и Одэ С.: Фторид в несимбиотических кораллах
связанный с карбонатом морской воды, Mar. Chem., 149, 45–50, 2013. а, б
и Одэ С.: Фторид в несимбиотических кораллах
связанный с карбонатом морской воды, Mar. Chem., 149, 45–50, 2013. а, б
Токуяма А., Китано Ю. и Канешима К.: Геохимическое поведение химических видов в процессах известнякообразования. Часть I. Химическая состав кораллов и известняков островов Рюкю // Геохим. Дж., 6, 83–92, 1972. a
Тойофуку, Т., Мацуо, М.Ю., де Ноойер, Л.Дж., Нагаи, Ю., Кавада, С., Фудзита, К., Райхарт Г.-Дж., Номаки Х., Цучия М., Сакагути Х. и Китазато, H.: Накачка протонов сопровождает обызвествление у фораминифер, Nat. коммун., 8, 14145, https://doi.org/10.1038/ncomms14145, 2017. а, б
van Dijk, I., de Nooijer, L.J., and Reichart, G.-J.: Тенденции включения элементов в гиалиновые и фарфоровые фораминиферы в зависимости от p CO 2 , Biogeosciences, 14, 497–510 , https://doi.org/10.5194/bg-14-497-2017, 2017. a, b, c
ван Дейк, И., Баррас, К., де Нуйер, Л. Дж., Муре, А., Геркен , E., Oron, S. и Reichart, G.-J.: Совместное поглощение кальция и неорганического углерода, предполагаемое включением магния и серы в фораминиферовый кальцит, Biogeosciences, 16, 2115–2130, https://doi. org/ 10.5194/bg-16-2115-2019, 2019. a, b, c, d
org/ 10.5194/bg-16-2115-2019, 2019. a, b, c, d
Вей, Т. и Симко, В.: R-пакет «corrplot»: визуализация корреляции Matrix, версия 0.84, доступно по адресу: https://github.com/taiyun/corrplot (последний доступ: 12 ноября 2018 г.), 2017. a, b
Wetmore, K. L.: Формирование камеры в Archaias angulatus , The J. Foramin. Res., 29, 69–74, 1999. a
Wit, J.C., de Nooijer, L.J., Wolthers, M., и Reichart, G.J.: Новый показатель солености, основанный на включении Na в фораминиферовый кальцит, Biogeosciences, 10, 6375 –6387, https://doi.org/10.5194/bg-10-6375-2013, 2013. a, b
Yu, J., Elderfield, H., and Hönisch, B.: B/Ca в планктонных фораминиферах в качестве показателя рН поверхностной морской воды, Палеоокеанография, 22, 2, https://doi.org/10.1029/2006PA001347, 2007. a
Сравнение элементов периодической таблицы | Сравните фтор и хлор
Сравните фтор и хлор
Сравните фтор и хлор на основе их свойств, атрибутов и фактов периодической таблицы. Сравните элементы по более чем 90 свойствам. Все элементы подобных категорий обнаруживают много сходств и различий в своих химических, атомных, физических свойствах и использовании. Эти сходства и различия следует знать, изучая элементы таблицы Менделеева. Вы можете изучить подробное сравнение фтора и хлора с наиболее надежной информацией об их свойствах, атрибутах, фактах, использовании и т. д. Вы можете сравнить F и Cl более чем по 90 такие свойства, как электроотрицательность, степень окисления, атомные оболочки, орбитальная структура, электросродство, физические состояния, электрическая проводимость и многое другое.
Сравните элементы по более чем 90 свойствам. Все элементы подобных категорий обнаруживают много сходств и различий в своих химических, атомных, физических свойствах и использовании. Эти сходства и различия следует знать, изучая элементы таблицы Менделеева. Вы можете изучить подробное сравнение фтора и хлора с наиболее надежной информацией об их свойствах, атрибутах, фактах, использовании и т. д. Вы можете сравнить F и Cl более чем по 90 такие свойства, как электроотрицательность, степень окисления, атомные оболочки, орбитальная структура, электросродство, физические состояния, электрическая проводимость и многое другое.
9 F Fluorine
Swap Chlorine vs Fluorine
Periodic Table Element Comparison
17 Cl Chlorine
Facts
| Name | Fluorine | Chlorine |
| Atomic Number | 9 | 17 |
| Atomic Symbol | F | Cl |
| Atomic Weight | 18. 9984032 9984032 | 35.453 |
| Phase at STP | Gas | Gas |
| Color | Colorless | Yellow |
| Metallic Классификация | Галогены | Галогены |
| Группа периодической таблицы | группа 17 | группа 17 |
| Group Name | fluorine family | fluorine family |
| Period in Periodic Table | period 2 | period 3 |
| Block in Periodic Table | p -block | p -block |
| Electronic Конфигурация | [He] 2s2 2p5 | [Ne] 3s2 3p5 |
| Структура электронной оболочки (количество электронов на оболочку) | 2, 7 | 2, 8, 7 |
| Melting Point | 53.5 K | 171.6 K |
| Boiling Point | 85.03 K | 239.11 K |
| CAS Number | CAS7782-41-4 | CAS7782-50-5 |
| Элементы соседства | Элементы соседства фтора | Элементы соседства хлора |


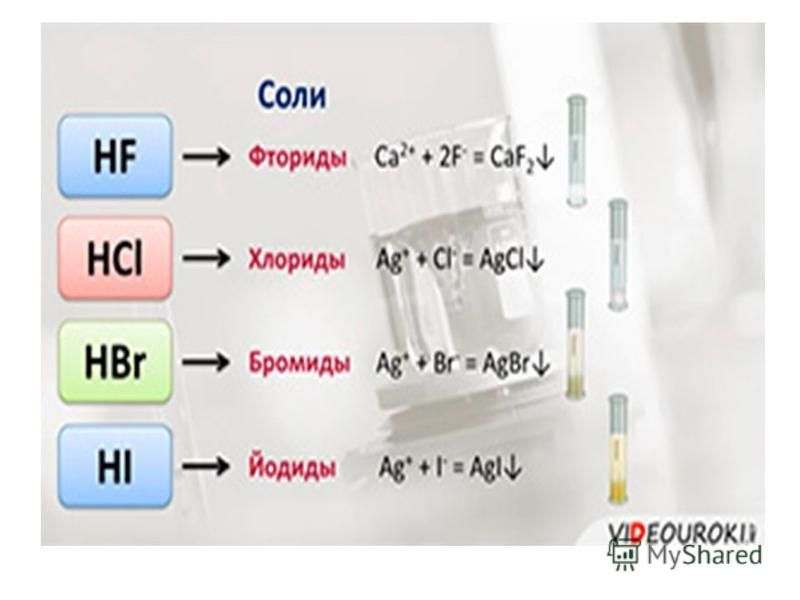
 станд. отклонение (%)
станд. отклонение (%)
 Ими являются фосфор (P), кальций (Ca), натрий (Na), калий (K), магний (Mg), сера (S), хлор (Cl) (см Таблица 1).
Ими являются фосфор (P), кальций (Ca), натрий (Na), калий (K), магний (Mg), сера (S), хлор (Cl) (см Таблица 1).