: Металлургия: образование, работа, бизнес :: MarkMet.ru
СВОЙСТВА И ПРИМЕНЕНИЕ СВИНЦА
Свинец (РЬ) — синевато-серый металл с сильным металлическим блеском в свежем срезе. Латинское название элемента «плумбум» происходит от «плумбум нигрум» — черное олово (в отличие от «плумбум албум»— белое олово). Впоследствии слово «плумбум» стали относить только к свинцу. Свинец является конечным продуктом распада радиоактивных элементов: урана, тория, радия. Обычный свинец является смесью свинца различного происхождения.
В химических соединениях свинец чаще всего двухвалентен, но встречается и четырехвалентный свинец. Кристаллизуется свинец в кубической системе. Тепло- и электропроводность свинца примерно в 10 раз меньше, чем у меди. При низких температурах свинец обладает сверхпроводимостью. Основные свойства свинца приведены ниже:
Атомная масса | 207,2 |
Плотность при 20°С, г/см3 | 11,34 |
Температура, °С |
|
плавления | 327,4 |
кипения | 1750 |
Удельная теплота , кал/г |
|
плавления | 5,75 |
испарения | 206 |
Удельная теплоемкость при , кал/(г·град) | 0,034 |
Теплопроводность при 20°С, кал/(см·сек·град) | 0,83 |
Удельное электросопротивление при 20°С, ом· мм2/м | 0,218 |
Временное сопротивление свинца, кГ/мм2 | 2 |
Относительное удлинение свинца, % | 50-70 |
Свинец — мягкий, ковкий и очень пластичный металл. Он легко прокатывается в тонкие листы и ленты, продавливается на прессах в трубы, из него изготовляют проволоку. Часто свинец прокатывают в виде широких длинных сворачиваемых листов (роллей).
Он легко прокатывается в тонкие листы и ленты, продавливается на прессах в трубы, из него изготовляют проволоку. Часто свинец прокатывают в виде широких длинных сворачиваемых листов (роллей).
В сухом воздухе при нормальной температуре свинец практически не окисляется. Он хорошо сопротивляется воздействию серной кислоты (с концентрацией до 80%) и не растворяется в плавиковой, фосфорной и хромовой кислотах, в большинстве органических кислот и щелочах. Интенсивно растворяется свинец в азотной кислоте.
Мягкая питьевая вода также способна растворять свинец. Слабо действуют на свинец морская вода и рудничные воды.
Газы: хлор, сероводород, сернистый газ, ангидрид серной кислоты почти не действуют на свинец как в сухом, так и во влажном состоянии. В сухих парах брома при низких температурах свинец также устойчив- Под действием фтористого водорода свинец быстро корродирует.
При соединении свинца с кислородом могут образоваться закись свинца Рb2O, окись свинца, или глет, РbО, трехокись свинца Рb2O3, сурик Рb3O4, двуокись свинца РbO2.
Окись свинца легко отдает свой кислород веществам, способным окисляться, и поэтому является сильным окислителем. Она является амфотерным соединением и способна вступать во взаимодействие как с кислотами, так и с основными окислами и почти не разлагается даже при весьма высоких температурах.
(В присутствии кислорода при нагревании до температуры 400—500°С получается сурик по реакции
6 РbО + O2 = 2 Рb3O4.
При более высоких температурах сурик разлагается на глет и кислород.
С серой свинец образует сульфид PbS, который широко распространен в природе в виде минерала свинцового блеска (галенита). В расплавленном состоянии он очень жидкотекуч и легко проникает даже в поры огнеупорных материалов. При нагревании сульфид свинца испаряется. Он легко окисляется воздухом.
Сульфид свинца при высоких температурах взаимодействует с железом, медью, алюминием и марганцем. С сульфидами других металлов он образует штейн.
Пары свинца, а также многие его химические соединения ядовиты. Рекристаллизация свинца происходит при температурах ниже комнатной. Поэтому получить свинец в наклепанном состоянии при комнатной температуре невозможно.
Рекристаллизация свинца происходит при температурах ниже комнатной. Поэтому получить свинец в наклепанном состоянии при комнатной температуре невозможно.
Механические и физико-химические свойства свинца сильно изменяются под влиянием примесей.
Висмут и цинк понижают кислотоупорность свинца. Натрий, кальций и магний резко повышают прочность и твердость свинца, но снижают его химическую стойкость. Медь увеличивает устойчивость свинца против действия серной кислоты. Сурьма повышает твердость и кислотоупорность свинца в отношении серной кислоты. Барий и литий повышают твердость, а кадмий, теллур и олово — твердость и сопротивление усталости свинца.
Большое количество свинца расходуют в настоящее время на производство аккумуляторов и в кабельном производстве, хотя в последнем случае его все в большей мере заменяют синтетическими материалами. Свинец широко применяют для производства различных сплавов, в том числе антифрикционных сплавов (баббитов), свинцовых бронз, свинцовооловянных припоев, легкоплавких свинцовокадмиевооловянных сплавов, типографских сплавов, для производства фольги. Используют его также для сооружений, защищающих от радиоактивных излучений, и для многих других целей.
Используют его также для сооружений, защищающих от радиоактивных излучений, и для многих других целей.
ICSC 0910 — АЦЕТАТ СВИНЦА
ICSC 0910 — АЦЕТАТ СВИНЦА« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| АЦЕТАТ СВИНЦА | ICSC: 0910 (Апрель 2017) |
| CAS #: 301-04-2 |
| UN #: 1616 |
| EINECS #: 206-104-4 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее. При пожаре выделяет раздражающие или токсичные пары (или газы). Мелкодисперсные частицы образуют в воздухе взрывчатые смеси. При пожаре выделяет раздражающие или токсичные пары (или газы). Мелкодисперсные частицы образуют в воздухе взрывчатые смеси. |
Не допускать оседания пыли. Замкнутая система, взрывозащищенное (для пыльной среды) электрическое оборудование и освещение. НЕ допускать контакта с несовместимыми материалами: См. Химические Опасности | Использовать воду распыленную мелкими каплями, пену, сухой порошок. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! СТРОГО СОБЛЮДАТЬ ГИГИЕНИЧЕСКИЕ ТРЕБОВАНИЯ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. Боли в горле. См. проглатывание. | Применять местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. Обратиться за медицинской помощью. |
| Кожа | Покраснение. Боль. | Защитные перчатки. | Снять загрязненную одежду. Промыть кожу большим количеством воды или принять душ. |
| Глаза | Покраснение. Боль. | Использовать закрытые защитные очки или средства защиты глаз в комбинации со средствами защиты органов дыхания.. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Тошнота. Рвота. Брюшные судороги. Запор. Судороги. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. Обратиться за медицинской помощью. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Индивидуальная защита: Респиратор с сажевым фильтром, подходящий для концентрации вещества в воздухе. НЕ допускать попадания этого химического вещества в окружающую среду. Смести просыпанное вещество в закрытые контейнеры. При необходимости, сначала намочить, чтобы избежать появления пыли. Тщательно собрать оставшееся. Затем хранить и утилизировать в соответствии с местными правилами. НЕ допускать попадания этого химического вещества в окружающую среду. Смести просыпанное вещество в закрытые контейнеры. При необходимости, сначала намочить, чтобы избежать появления пыли. Тщательно собрать оставшееся. Затем хранить и утилизировать в соответствии с местными правилами. |
Согласно критериям СГС ООН ОПАСНО Предположительно вызывает ракМожет нанести ущерб способности к деторождению или не рожденному ребенку Может вызвать повреждения органов в результате длительного или многократного воздействия Очень токсичен для водных организмов с долгосрочными последствиями Транспортировка |
| ХРАНЕНИЕ | |
Хранить только в оригинальной упаковке. Отдельно от броматов, кислот и пищевых продуктов и кормов. Хорошо закрывать. Предотвратить попадание продуктов пожаротушения в сточные воды. Хранить в местах не имеющих сливов или доступа к канализации Хорошо закрывать. Предотвратить попадание продуктов пожаротушения в сточные воды. Хранить в местах не имеющих сливов или доступа к канализации |
|
| УПАКОВКА | |
| Не перевозить с продуктами питания и кормами для животных. Загрязняет морскую среду. |
| АЦЕТАТ СВИНЦА | ICSC: 0910 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: C4H6O4Pb / (CH3COO)2Pb |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
Вещество очень токсично для водных организмов. Это вещество может быть опасным для окружающей среды. Особое внимание следует уделять птицам млекопитающим загрязнению почвы качеству воды. Бионакопление этого химического вещества может происходить в растениях животных. Настоятельно рекомендуется не допускать попадания вещества в окружающую среду, поскольку оно является устойчивым. Это вещество может быть опасным для окружающей среды. Особое внимание следует уделять птицам млекопитающим загрязнению почвы качеству воды. Бионакопление этого химического вещества может происходить в растениях животных. Настоятельно рекомендуется не допускать попадания вещества в окружающую среду, поскольку оно является устойчивым. |
| ПРИМЕЧАНИЯ |
|---|
| В зависимости от степени воздействия, рекомендуется периодическое медицинское обследование. The symptoms of acute intoxication do not become manifest until hours have passed. НЕ берите рабочую одежду домой. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
ПАРОЖИДКОСТНОЕ РАВНОВЕСИЕ В СИСТЕМЕ ОЛОВО–СВИНЕЦ В ФОРВАКУУМЕ | Требухов
1. Кунаев А.М., Кожахметов С.М., Ванюков А.В., Полывянный И.Р., Зазубин А.И., Есютин В.С. Основы комплексного использования сырья цветной металлургии (Теория, технология и освоение новых металлургических процессов). Алма-Ата: Наука, 1982. С. 363—373.
2. Воронин Г.Ф., Евсеев А.М. Термодинамические свойства жидких сплавов свинца и олова. Журн. физ. химии. 1959. Т. 33. No. 10. С. 2245—2248.
3. Kendall W.B., Hultgren R. Thermodynamics of the lead-tin system. J. Phys. Chem. 1959. Vol. 63. No. 7. Р. 1158—1160.
4. Mishra G., Kumar Rajendra. Heat contents and heat capacities of liquid lead-tin alloys. Trans. Indian Inst. Met. 1967. Vol. 20. No. 3. Р. 49—52.
5. Heumann T., Wöstmann H. Thermodynamische Daten der Blei-Zinn-Legierungen und der hypothetischen Umwandlung des tetragonalen Zinn in die kubisch flächenzentrierte Modifikation. Z. Metallkd. 1972. Bd. 63. No. 6. S. 332—341.
Z. Metallkd. 1972. Bd. 63. No. 6. S. 332—341.
6. Das S.K., Ghosh A. Thermodynamic measurements in molten Pb—Sn alloys. Metall. Mater. Trans. 1972. Vol. 3. No. 4. Р. 803—806.
7. Бушманов В.Д. Определение теплот смешения в высокотемпературном калориметре. В сб.: Физико-химические исследования жидких металлов и сплавов. Свердловск: УНЦ АН СССР, 1974. No. 29. С. 93—97.
8. Khanna K., Singh P. Entropy of mixing of liquid metal alloys. Physics. 1982. Vol. BC114. No. 2. Р. 174—180 (In Russ.).
9. Sugimoto Eisuke, Kuwata Shigeki, Kozuka Zensaku. Measurement of activity in Pb—Sn and Pb—Sb alloys by EMF using ZrO2(Y2O3) at low temperatures. J. Min. Metall. Inst. Jpn. 1982. Vol. 98. No. 1131. P. 429—435.
10. Попель П.С., Преснякова Е.Л., Павлов В.А., Архангельский Е.Л. Область существования метастабильной квазиэвтектической структуры в системе Sn—Pb. Изв. АН СССР. Металлы. 1985. No. 4. С. 198—201.
11. Попель П.С., Преснякова Е.Л., Павлов В.А., Архангельский Е.Л. О происхождении микрорасслоения эвтектических сплавов Sn—Pb в жидком состоянии.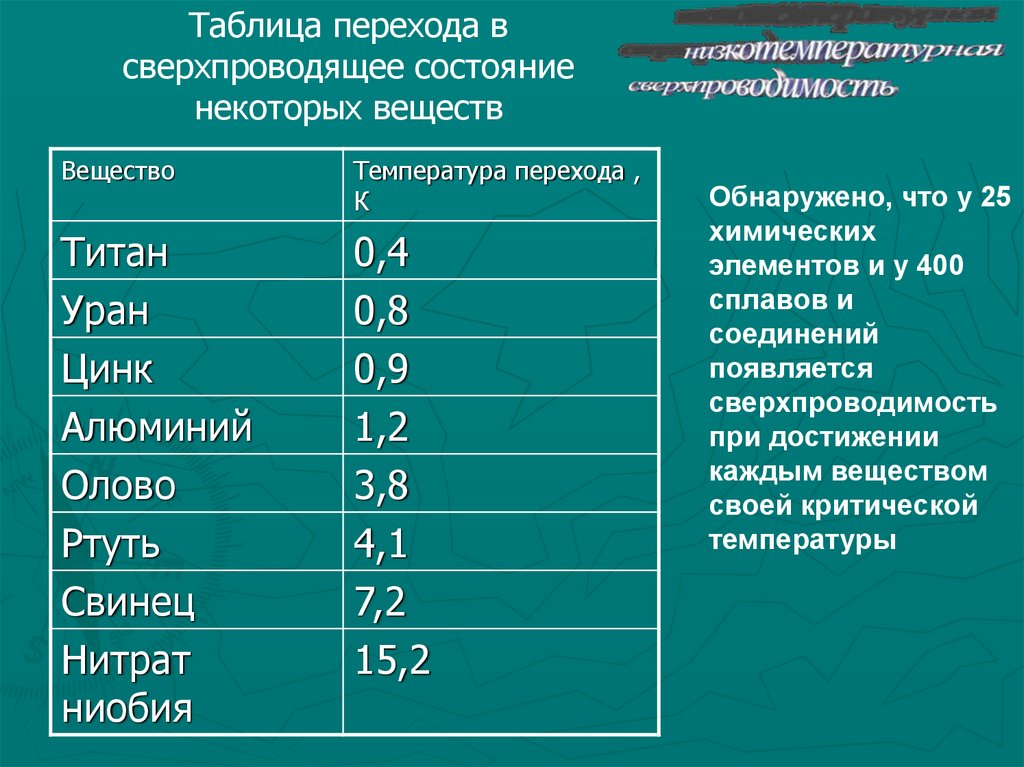 Металлы. 1985. No. 2. С. 53—56.
Металлы. 1985. No. 2. С. 53—56.
12. Попель П.С., Демина Е.Л., Архангельский Е.Л. Плотность и удельное электросопротивление расплавов Sn—Pb в гомогенном и микрорасслоенном состояниях. Изв. АН СССР. Металлы. 1987. No. 3. С. 52—58.
13. Shukla R.K., Dubey A.N., Awasthi P. Excess surface tension and molecular interactions of Pb—Sn molten mixture at elevated temperatures. J. Mol. Liq. 2007. Vol. 135. P. 1—4. DOI:10.1016/j.mollig.2006.07.011.
14. Палатник Л.С., Федоров Г.В., Богатов Н.П. О характере испарения и конденсации сплава Pb—Sn. Физика металлов и металловедение. 1966. Т. 21. No. 5. С. 704—707.
15. Chen Wen, Ye Daluen, Huang Zhijiao, Huang Weishen, Ling Heging, Duan Zhigie. Thermodynamic properties of the lead-tin system. Kunming Univ. Sci. Technol. 1991. Vol. 16. No.1. Р. 34—40.
16. Hultgren R., Orr R.L., Anderson P.D., Kelley K.K. Selected values of thermodynamic properties of metals and alloys. N.Y.: J. Wiley and Sons. 1963.
17. Yong Nian Dai, Bing Yang. Vacuum metallurgy of non-ferrous metals. Beijing: Metall. Industry Press. 2000. Vol. 3. Р. 516—543.
Vacuum metallurgy of non-ferrous metals. Beijing: Metall. Industry Press. 2000. Vol. 3. Р. 516—543.
18. Gierlotka W. Size-dependent thermodynamic description of the binary Pb—Sn system. J. Min. Metall. Sect. B. 2017. Vol. 53. Iss. 3 P. 233—238. DOI:10.2298/JMMB170525019G.
19. Gao J., Xu J., Kong L., Xu B., You Y., Ren J., Li Y., Yang B. Calculation of vapor-liquid equilibria of binary leadbased alloys in vacuum distillation using simplified molecular interaction volume model. Fluid Phase Equilibria. 2018. DOI:10.1016./j.fluid.2018.11.007.
20. Gao J., Xu J., Yang B., Kong L., Xu B., Yoy Y. Isobaric (vapor + liquid) equilibria of binary Pb—Sn and Sb—Sn system at 2 Pa. J. Min. Metall. Sect. B. 2018. Vol. 54. Iss. 2. P. 243—249. DOI:10.2298/JMMB180322012G.
21. Dai H., Tao D.-P. Application of the modified molecular interaction volume model (M-MIVM) to vapor-liquid phase equilibrium of binary alloys in vacuum distillation. Vacuum. 2019. Vol. 163. P. 342—351. DOI:10.1016/j/vacuum. 2019.02.041.
2019.02.041.
22. Ren J., Xu J., Kong L., Yang B., Xu B. Model prediction of activity and vapor-liquid equilibrium of tin based alloy system. Chin. J. Nonferr. Met. 2020. Vol. 30. Iss. 10. P. 2399—2409. DOI:10.11817/j.ysxb.1004.0609.2020-39556.
23. Малышев В.П., Турдукожаева А.М., Оспанов Е.А., Саркенов Б. Испаряемость и кипение простых веществ. М.: Науч. мир, 2010. С. 293—298.
24. Jia G., Yang B., Liu D.-C. Deeply removing lead from Pb—Sn alloy with vacuum distillation. Trans. Nonferr. Met. Soc. China. 2013. Vol. 23. No. 6. P. 1822—1831. DOI:10.1016/S1003-6326(13)62666-7.
25. Володин В.Н. Фазовый переход жидкость—пар в двойных системах свинца при низком давлении. Караганда: Арко, 2012. С. 153—158.
26. Volodin V.N., Tuleushev Yu.Zh. The liquid-vapor phase transition in a copper-calcium system. Russ. J. Phys. Chem. A. 2020. Vol. 94. No. 7. P. 1300—1305. DOI:10.1134/S0036024420070304.
27. Darken L.S., Gurry R.W. Physical chemistry of metals. New York, Toronto, London: McGraw-Hill Book Company, INC. 19/53.
19/53.
28. Clark J.B., Richter P.W. The determination of composition temperature-pressure phase diagrams of binary aloe systems. In: High pressure sci. and technol.: Proc. 7th Intern. AIRAPT Conf. (Le Creusot, 1979). Vol. 1. Oxford. 1980. P. 363—371.
29. Диаграммы состояния двойных металлических систем. Под ред. Н.П. Лякишева. М.: Машиностроение. 2001. Т. 3. Кн. 1. С. 794—795. Diagrams of the state of double metal systems. Ed. N.P. Lyakishev. Moscow: Mashinostroenie, 2001. Vol. 3. B. 1. P. 794—795 (In Russ.).
Быстрое испарение при нагревании Pb(NO/sub 3/)/sub 2/. Доказательства гетерогенных ионно-молекулярных реакций (Журнальная статья)
Быстрое испарение Pb(NO/sub 3/)/sub 2/ при нагревании. Доказательства гетерогенных ионно-молекулярных реакций (Журнальная статья) | ОСТИ.GOVперейти к основному содержанию
- Полная запись
- Другое связанное исследование
Сообщается о масс-спектрометрическом исследовании системы нитрата свинца, в котором нитрат свинца испарялся из зонда накаливания, который нагревался со скоростью 5000°С/с. В этом исследовании использовались методы источника как электронного удара (ЭИ), так и химической ионизации (ХИ). Фрагментарные ионы и продукты разложения наблюдали в условиях ЭУ. В условиях ХИ были обнаружены сольватированные фрагментные ионы и протонированные сольватированные молекулярные ионы. Температурные измерения скоростей испарения проводились путем наблюдения за сопротивлением нити зонда при ее нагревании. Энергии активации, рассчитанные с использованием этих температурных коэффициентов скоростей испарения, показывают, что испарению в условиях КИ способствуют гетерогенные ионно-молекулярные реакции.
В этом исследовании использовались методы источника как электронного удара (ЭИ), так и химической ионизации (ХИ). Фрагментарные ионы и продукты разложения наблюдали в условиях ЭУ. В условиях ХИ были обнаружены сольватированные фрагментные ионы и протонированные сольватированные молекулярные ионы. Температурные измерения скоростей испарения проводились путем наблюдения за сопротивлением нити зонда при ее нагревании. Энергии активации, рассчитанные с использованием этих температурных коэффициентов скоростей испарения, показывают, что испарению в условиях КИ способствуют гетерогенные ионно-молекулярные реакции.
- Авторов:
- Радус, Т П; Удсет, Х. Р.; Фридман, Л.
- Дата публикации:
- Исследовательская организация:
- Брукхейвенская национальная лаборатория, Аптон, Нью-Йорк
- Идентификатор ОСТИ:
- 5619734
- Тип ресурса:
- Журнальная статья
- Название журнала:
- J.
 Phys. хим.; (США)
Phys. хим.; (США)
- Дополнительная информация журнала:
- Объем журнала: 83:23
- Страна публикации:
- США
- Язык:
- Английский
- Тема:
- 37 НЕОРГАНИЧЕСКАЯ, ОРГАНИЧЕСКАЯ, ФИЗИЧЕСКАЯ И АНАЛИТИЧЕСКАЯ ХИМИЯ; НИТРАТЫ СВИНЦА; ПИРОЛИЗ; ЭНЕРГИЯ АКТИВАЦИИ; ЭЛЕКТРОННЫЕ ПУЧКИ; ИСПАРЕНИЕ; ОБОГРЕВ; СТОЛКНОВЕНИЯ ИОНОВ-МОЛЕКУЛ; ИОНИЗАЦИЯ; МОЛЕКУЛЯРНЫЕ ИОНЫ; ТЕМПЕРАТУРНАЯ ЗАВИСИМОСТЬ; БАЛКИ; ЗАРЯЖЕННЫЕ ЧАСТИЦЫ; ХИМИЧЕСКИЕ РЕАКЦИИ; СТОЛКНОВЕНИЯ; РАЗЛОЖЕНИЕ; ЭНЕРГИЯ; СТОЛКНОВЕНИЯ ИОНОВ; ИОНЫ; СОЕДИНЕНИЯ СВИНЦА; ЛЕПТОНОВЫЕ ПУЧКИ; СТОЛКНОВЕНИЯ МОЛЕКУЛ; НИТРАТЫ; АЗОТНЫЕ СОЕДИНЕНИЯ; КИСЛОРОДНЫЕ СОЕДИНЕНИЯ; ПУЧКИ ЧАСТИЦ; ФАЗОВЫЕ ПРЕВРАЩЕНИЯ; ТЕРМОХИМИЧЕСКИЕ ПРОЦЕССЫ; 400201* — Химические и физико-химические свойства
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Радус Т.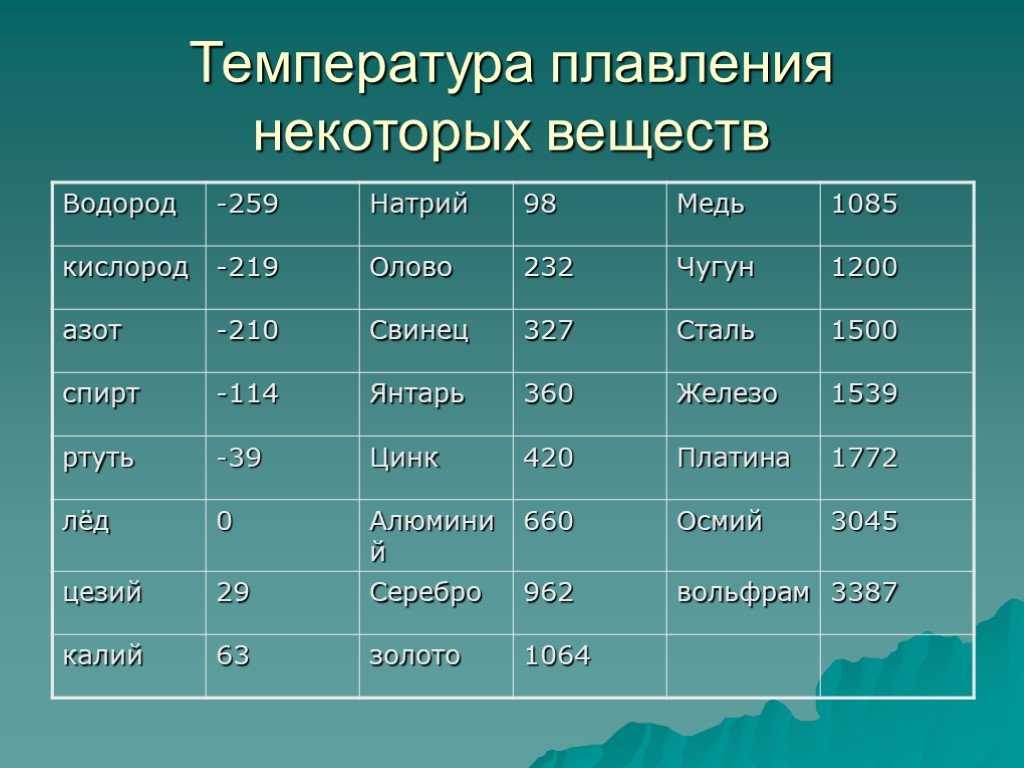 П., Удсет Х.Р. и Фридман Л. . Быстрое испарение Pb(NO/sub 3/)/sub 2/ при нагревании. Доказательства гетерогенных ионно-молекулярных реакций 90–90 . США: Н. П., 1979.
Веб. дои: 10.1021/j100486a007.
П., Удсет Х.Р. и Фридман Л. . Быстрое испарение Pb(NO/sub 3/)/sub 2/ при нагревании. Доказательства гетерогенных ионно-молекулярных реакций 90–90 . США: Н. П., 1979.
Веб. дои: 10.1021/j100486a007.
Копировать в буфер обмена
Радус Т.П., Удсет Х.Р. и Фридман Л. . Быстрое испарение Pb(NO/sub 3/)/sub 2/ при нагревании. Доказательства гетерогенных ионно-молекулярных реакций 90–90 . Соединенные Штаты. https://doi.org/10.1021/j100486a007
Копировать в буфер обмена
Радус, Т.П., Удсет, Х.Р., и Фридман, Л., 1979.
«Быстрое испарение Pb (NO / sub 3 /) / sub 2 / при нагревании. Доказательства гетерогенных ионно-молекулярных реакций». Соединенные Штаты. https://doi.org/10.1021/j100486a007.
Копировать в буфер обмена
@статья{osti_5619734,
title = {Быстрое испарение Pb(NO/sub 3/)/sub 2/ при нагревании. Доказательства гетерогенных ионно-молекулярных реакций},
Доказательства гетерогенных ионно-молекулярных реакций},
автор = {Радус, Т.П. и Удсет, Х.Р. и Фридман, Л.},
abstractNote = {Сообщается о масс-спектрометрическом исследовании системы нитрата свинца, в котором нитрат свинца испарялся из нити зонда, которая нагревалась со скоростью 5000/sup 0/C/с. В этом исследовании использовались методы источника как электронного удара (ЭИ), так и химической ионизации (ХИ). Фрагментарные ионы и продукты разложения наблюдали в условиях ЭУ. В условиях ХИ были обнаружены сольватированные фрагментные ионы и протонированные сольватированные молекулярные ионы. Температурные измерения скоростей испарения проводились путем наблюдения за сопротивлением нити зонда при ее нагревании. Энергии активации, рассчитанные с использованием этих температурных коэффициентов скоростей испарения, показывают, что испарению в условиях ХИ способствуют гетерогенные ионно-молекулярные реакции.},
дои = {10.1021/j100486a007},
URL = {https://www.osti. gov/biblio/5619734},
журнал = {Дж. физ. хим.; (США)},
gov/biblio/5619734},
журнал = {Дж. физ. хим.; (США)},
номер = ,
объем = 83:23,
место = {США},
год = {1979},
месяц = {11}
}
Копировать в буфер обмена
https://doi.org/10.1021/j100486a007
Найти в Google Scholar
Поиск в WorldCat, чтобы найти библиотеки, в которых может храниться этот журнал Вы должны войти в систему или создать учетную запись, чтобы сохранять документы в своей библиотеке.
Аналогичных записей в сборниках OSTI.GOV:
- Аналогичные записи
испарение и водный цикл
• Дом в школе водных наук • Цикл водного цикла •
Компоненты водного цикла »Атмосфера · Конденсация · Evaporation ·
01015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015. · Поток подземных вод · Хранение подземных вод · ICE and Snow · Инфильтрация · Океаны · Осадок · Снежный полет · Springs · STUPERFLOW · SUBLIMAT
· Поток подземных вод · Хранение подземных вод · ICE and Snow · Инфильтрация · Океаны · Осадок · Снежный полет · Springs · STUPERFLOW · SUBLIMAT
Источники/использование: общественное достояние.
Градирни на энергообъекте. Оборудование на энергетических объектах в качестве побочного продукта производит большое количество отработанной тепловой энергии. Предприятия используют воду для охлаждения оборудования, а затем необходимо выпускать воду обратно в окружающую среду. Сброс горячей воды обратно в реки нанесет ущерб экологии, поэтому на многих электростанциях установлены огромные градирни, где горячая вода распыляется внутри, а испарение используется для охлаждения сбрасываемой воды, прежде чем она вернется в окружающую среду.Предоставлено: Алан Кресслер, Геологическая служба США
Что такое испарение и почему оно происходит?
Испарение – это процесс превращения жидкой воды в газообразную воду (водяной пар). Вода перемещается с поверхности Земли в атмосферу путем испарения.
Вода перемещается с поверхности Земли в атмосферу путем испарения.
Испарение происходит, когда энергия (тепло) вызывает разрыв связей, удерживающих молекулы воды вместе. Когда вы кипятите воду на плите, вы нагреваете жидкую воду. Это добавленное тепло разрывает связи, заставляя воду переходить из жидкого состояния в газообразное (водяной пар), которое мы знаем как пар.
Вода легко испаряется при температуре кипения (212° F, 100° C), но испаряется гораздо медленнее при температуре замерзания из-за тепловой энергии, необходимой для испарения воды.
Противоположностью испарения является конденсация. Конденсация – это процесс превращения водяного пара обратно в жидкую воду. Конденсация происходит при охлаждении насыщенного воздуха, например, на внешней стороне стакана с ледяной водой.
Источники/использование: общественное достояние.
Эй, я Дриппи! Знаете ли вы, что в глобальном масштабе количество воды , испаряющей , примерно равно количеству воды , выпадающей в осадок ?
Испарение определяет круговорот воды
Большая часть влаги в атмосфере (около 90 %) поступает из воды, испаряющейся из океанов, морей, озер и рек. (А поскольку более 70 % поверхности Земли покрыто океанами, они вносят большой вклад в общий объем воды, испаряющейся в атмосферу.) Остальная влага в атмосферу поступала от транспирации растений и (очень небольшое количество) от сублимация.
(А поскольку более 70 % поверхности Земли покрыто океанами, они вносят большой вклад в общий объем воды, испаряющейся в атмосферу.) Остальная влага в атмосферу поступала от транспирации растений и (очень небольшое количество) от сублимация.
В глобальном масштабе количество испаряющейся воды примерно равно количеству воды, попадающей на Землю в виде осадков.
Однако это зависит от географического положения. Испарение более распространено над океанами, чем осадки, в то время как над сушей осадков обычно превышает испарение. Большая часть воды, которая испаряется из океанов, выпадает обратно в океаны в виде осадков. Только около 10 процентов воды, испаряемой из океанов, переносится по суше и выпадает в виде осадков. После испарения молекула воды находится в воздухе около 10 дней. Процесс испарения настолько велик, что без осадков сток и подземные воды сток из водоносных горизонтов , океаны станут почти пустыми.
Источники/использование: общественное достояние.
Привет, я Солти, солевой аналог Дриппи! Знаете ли вы, что одним из способов производства поваренной соли является выпаривание соленой воды в выпаривании прудов, метод, используемый людьми на протяжении тысячелетий?Люди используют испарение
Одним из способов производства поваренной соли является выпаривание соленой воды в прудах-испарителях. Этот метод использовался людьми на протяжении тысячелетий.
Морская вода содержит другие ценные минералы, легко получаемые за счет испарения. Вода Мертвого моря идеальна для добычи не только поваренной соли, но и магния, калия, брома. Мертвое море на самом деле представляет собой озеро, расположенное на Ближнем Востоке в пределах замкнутого водораздела и не имеющее путей оттока. Эта замкнутая система бассейнов является аномальной для большинства озер. Вода в основном уходит из озера путем испарения, в результате чего в этой пустынной местности испаряется более 1300-1600 миллиметров воды в год! В результате воды Мертвого моря имеют самую высокую соленость и плотность среди всех морей в мире, слишком высокие для поддержания жизни.
(Источник: Обзор водных ресурсов Ближнего Востока, Проект банков данных о водных ресурсах Ближнего Востока) .
Испарительное охлаждение: дешевый кондиционер!
Источники/использование: общественное достояние.
Карта, показывающая, где испарительные охладители наиболее эффективны в США. Испарительные охладители лучше всего работают в засушливых районах Соединенных Штатов (красные области, отмеченные A), и могут работать в некоторой степени в синих областях, отмеченных B. Но в секции C, во влажных восточных районах США, должны использоваться обычные кондиционеры.Предоставлено: Калифорнийская энергетическая комиссия
Поскольку для разрыва связей, скрепляющих молекулы воды, требуется энергия, испарение удаляет тепло из окружающей среды, что приводит к общему охлаждению. Подумайте о том, когда врач протирает вашу руку спиртовой салфеткой перед тем, как сделать вам инъекцию, — ваша рука кажется холодной. Это потому, что спирт быстро испаряется с поверхности вашей кожи, а вместе с ним и некоторое количество тепла с поверхности вашей руки.
Это потому, что спирт быстро испаряется с поверхности вашей кожи, а вместе с ним и некоторое количество тепла с поверхности вашей руки.
В климате с низкой влажностью и высокой температурой испарительный охладитель может понизить температуру воздуха на 20 градусов по Фаренгейту, одновременно повышая влажность. Как показано на этой карте, испарительные охладители лучше всего работают в засушливых районах США (красные области, отмеченные буквой А), и могут работать в некоторой степени в синих областях, отмеченных буквой В. Но в секции С, во влажных восточных районах США, обычные кондиционеры должны быть использовал.
Испарительные охладители на самом деле довольно простые устройства, по крайней мере, по сравнению с кондиционерами, потому что они всасывают сухой горячий наружный воздух и пропускают его через испарительную подушку, которая остается влажной за счет подачи воды. В домашнем устройстве вентилятор прогоняет воздух через подушку, в результате чего вода в подкладке испаряется, в результате чего воздух становится более холодным, который затем прокачивается по дому. Энергии потребляется значительно меньше, чем при использовании кондиционера.
Энергии потребляется значительно меньше, чем при использовании кондиционера.
10.10: Энтальпия плавления и энтальпия испарения
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 49664
- Ed Vitz, John W. Moore, Justin Shorb, Xavier Prat-Resina, Tim Wendorff, & Adam Hahn 9000 Education 9EDL Chemical Library (5CDL 9000 Education 9000 Education)0006
Когда тепло подается к твердому телу (например, льду) с постоянной скоростью с помощью электрического нагревательного змеевика, мы обнаруживаем, что температура неуклонно растет до тех пор, пока не будет достигнута точка плавления и не станут очевидными первые признаки образования жидкости, что может быть видно на графике ниже. После этого, даже несмотря на то, что мы по-прежнему подводим тепло к системе, температура остается постоянной, пока присутствуют как жидкость, так и твердое тело. На приведенном ниже графике это представлено плоской линией, где энергия добавляется ко льду, но температура не меняется. Вся энергия, добавляемая в систему на этом этапе, используется для преобразования твердого льда в жидкую воду.
После этого, даже несмотря на то, что мы по-прежнему подводим тепло к системе, температура остается постоянной, пока присутствуют как жидкость, так и твердое тело. На приведенном ниже графике это представлено плоской линией, где энергия добавляется ко льду, но температура не меняется. Вся энергия, добавляемая в систему на этом этапе, используется для преобразования твердого льда в жидкую воду.
Изображение предоставлено Кавангом через Wikimedia Commons
Это макроскопическое поведение совершенно ясно демонстрирует, что к твердому телу должна быть подведена энергия, чтобы расплавить его. На микроскопическом уровне плавление включает в себя разделение молекул, которые притягиваются друг к другу. Это требует увеличения потенциальной энергии молекул, а необходимую энергию обеспечивает нагревательный змеевик. Кинетическая энергия молекул (вращение, вибрация и ограниченный перенос) остается постоянной во время фазовых переходов, потому что температура не меняется. 9{o} \text{C}] h3O(l)} \nonumber \]
9{o} \text{C}] h3O(l)} \nonumber \]
\[\треугольник H_m = 6,01 \frac {\text{кДж}}{\text{моль}} \nonumber \]
Выбранные молярные энтальпии плавления сведены в таблицу \(\PageIndex{1}\). Твердые тела, такие как лед, которые имеют сильные межмолекулярные силы, имеют гораздо более высокие значения, чем такие, как CH 4 со слабыми. Обратите внимание, что энтальпии плавления и испарения меняются с температурой.
Когда жидкость кипит, изменение температуры в зависимости от подведенного тепла аналогично тому, которое наблюдается при плавлении. Когда тепло подается с постоянной скоростью к жидкости при атмосферном давлении, температура повышается до тех пор, пока не будет достигнута точка кипения. После этого температура остается постоянной до 9{o} \text{C}] h3O(g)} \nonumber \]
\[\треугольник H_m = 40,67 \frac {\text{кДж}}{\text{моль}} \nonumber \]
тепла поглощается при кипении жидкости, потому что молекулы, удерживаемые вместе за счет взаимного притяжения в жидкости, отталкиваются друг от друга при образовании газа. Такое разделение требует энергии. В общем, необходимая энергия отличается от одной жидкости к другой в зависимости от величины межмолекулярных сил. Таким образом, мы можем ожидать, что жидкости с сильными межмолекулярными силами будут иметь более высокие энтальпии испарения. Список энтальпий парообразования, приведенный в таблице, подтверждает это.
Такое разделение требует энергии. В общем, необходимая энергия отличается от одной жидкости к другой в зависимости от величины межмолекулярных сил. Таким образом, мы можем ожидать, что жидкости с сильными межмолекулярными силами будут иметь более высокие энтальпии испарения. Список энтальпий парообразования, приведенный в таблице, подтверждает это.
| Вещество | Формула | ΔH(плавление) / кДж моль -1 | Точка плавления / K | ΔH(испарение) / кДж моль -1 | Точка кипения/К | (ΔH v /T b ) / JK -1 моль -1 |
|---|---|---|---|---|---|---|
| Неон | Не | 0,33 | 24 | 1,80 | 27 | 67 |
| Кислород | О 2 | 0,44 | 54 | 6,82 | 90,2 | 76 |
| Метан | Ч 4 | 0,94 | 90,7 | 8.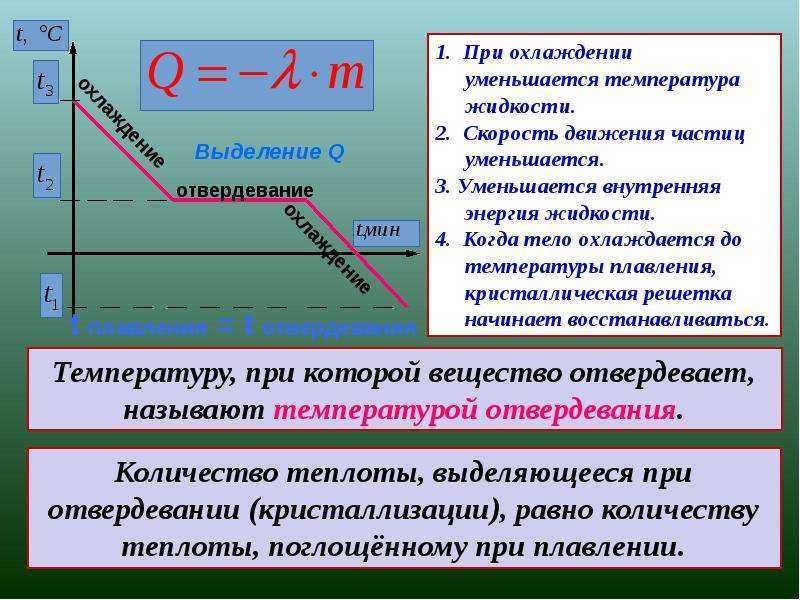 18 18 | 112 | 73 |
| Этан | С 2 Н 6 | 2,85 | 90,0 | 14,72 | 184 | 80 |
| Хлор | Класс 2 | 6,40 | 172,2 | 20.41 | 239 | 85 |
| Четыреххлористый углерод | ККл 4 | 2,67 | 250,0 | 30. 00 00 | 350 | 86 |
| Вода* | Н 2 О | 6.00678 при 0°C, 101 кПа 6.354 при 81,6°C, 2,50 МПа | 273,1 | 40.657 при 100°C, 45.051 при 0°C, 46.567 при -33°C | 373,1 | 109 |
| n -Нонан | С 9 Н 20 | 19,3 | 353 | 40,5 | 491 | 82 |
| Меркурий | рт. ст. ст. | 2,30 | 234 | 58,6 | 630 | 91 |
| Натрий | На | 2,60 | 371 | 98 | 1158 | 85 |
| Алюминий | Ал | 10,9 | 933 | 284 | 2600 | 109 |
| Свинец | Пб | 4,77 | 601 | 178 | 2022 | 88 |
*www1. lsbu.ac.uk/water/data.html
lsbu.ac.uk/water/data.html
Еще две особенности стола заслуживают упоминания. Одна из них заключается в том, что энтальпия испарения вещества всегда выше энтальпии его плавления. Когда твердое тело плавится, молекулы не отделяются друг от друга почти так же, как при кипении жидкости. Во-вторых, существует тесная корреляция между энтальпией парообразования и температурой кипения, измеряемой по термодинамической шкале температур. Периодические тренды температуры кипения точно следуют периодическим трендам теплоты парообразования. Если мы разделим одно на другое, мы обнаружим, что результат часто находится в диапазоне от 75 до 9.0 Дж К –1 моль –1 . Поэтому в первом приближении энтальпия испарения жидкости пропорциональна термодинамической температуре кипения жидкости . Этот интересный результат называется правилом Трутона . Эквивалентное правило не выполняется для слияния. Энергия, необходимая для плавления твердого тела, и температура, при которой это происходит, зависят от структуры кристалла, а также от величины межмолекулярных сил.
\[\треугольник H_m = 4,77 \frac {\text{кДж}}{\text{моль}} \nonumber \]
\[100 \text{g} ~\times~ \frac {1 \text{моль Pb}}{207,2 ~\text{г}~ \text{Pb}} ~\times ~\frac{4,77~ \text{кДж}}{\text{моль }} = 2,30~ \text{кДж} \nonumber \]
(2) Чтобы растопить 100 г воды:
\[100 \text{g} ~\times~ \frac {1 \text{mol}} {18,0 ~\text{г}}~ \times~ \frac{6,01~ \text{кДж}}{\text{моль}} = 33,4~ \text{кДж} \nonumber \]
(3) Испарить 100 г воды:
\[100 \text{g} ~\times ~\frac {1 \text{mol}}{18.0~ \text{g}} ~\times ~\frac{40.657~ \text{kJ}}{\text {моль}} = 226~ \text{кДж} \nonumber \]
Может показаться удивительным, что для плавления или испарения 100 г свинца требуется гораздо меньше тепла, чем для плавления или испарения воды. Во-первых, температура, при которой плавится вещество, не имеет ничего общего с энтальпией плавления, хотя на практике нам пришлось бы добавлять больше тепла, чтобы получить свинец до точки плавления. Молярная энтальпия плавления на самом деле меньше для свинца из-за меньшей энергии связи между частицами.

 Выделяет токсичные и едкие испарения, содержащие оксиды свинца и уксусную кислоту. Интенсивно Реагирует с броматами и кислотами. Приводит к появлению опасности взрыва.
Выделяет токсичные и едкие испарения, содержащие оксиды свинца и уксусную кислоту. Интенсивно Реагирует с броматами и кислотами. Приводит к появлению опасности взрыва.
 Может привести к гемолитической анемии, нервным расстройствам и ухудшению рабты почек. Эффект от воздействия может проявляться с задержкой. Необходимо медицинское обследование.
Может привести к гемолитической анемии, нервным расстройствам и ухудшению рабты почек. Эффект от воздействия может проявляться с задержкой. Необходимо медицинское обследование.
 Phys. хим.; (США)
Phys. хим.; (США)