Плавление — это… Что такое Плавление?
переход вещества из кристаллического (твёрдого) состояния в жидкое; происходит с поглощением теплоты (Фазовый переход I рода). Главными характеристиками П. чистых веществ являются Температура плавления (Тпл) и теплота, которая необходима для осуществления процесса П. (Теплота плавления Qпл). Температура П. зависит от внешнего давления р; на диаграмме состояния (См. Диаграмма состояния) чистого вещества эта зависимость изображается кривой плавления (кривой сосуществования твёрдой и жидкой фаз, AD или AD’ на рис. 1). П. сплавов (См. Сплавы) и твёрдых растворов происходит, как правило, в интервале температур (исключение составляют эвтектики (См. Эвтектика) с постоянной Тпл). Зависимость температуры начала и окончания П. сплава от его состава при данном давлении изображается на диаграммах состояния специальными линиями (кривые ликвидуса и солидуса, см. Двойные системы)Процесс П. играет важную роль в природе (П. снега и льда на поверхности Земли, П. минералов в её недрах и т.д.) и в технике (производство металлов и сплавов, литьё в формы и др.).
Лит.: Френкель Я. И., Кинетическая теория жидкостей, Собр. избр. трудов, т. 3, М. —Л., 1959; Данилов В. И., Строение и кристаллизация жидкости, К., 1956; Глазов В. М., Чижевская С. Н., Глаголева Н. Н., Жидкие полупроводники, М., 1967; Уббелоде А., Плавление и кристаллическая структура, пер. с англ., М., 1969; Любов Б. Я., Теория кристаллизации в больших объемах, М. (в печати).
Б. Я. Любов.
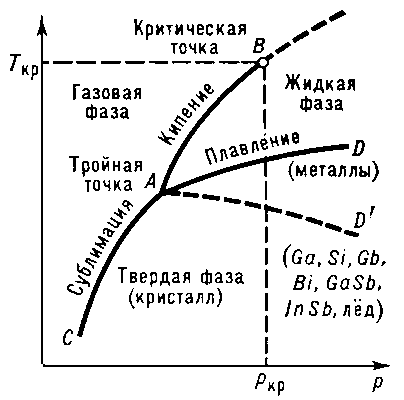
Рис. 1. Диаграмма состояния чистого вещества. Линии AD и AD’ — кривые плавления, по линии AD’ плавятся вещества с аномальным изменением объёма при плавлении.
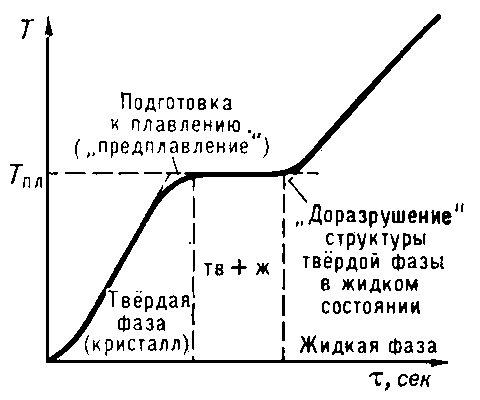
Рис. 2. Остановка температуры при плавлении кристаллического тела. По оси абсцисс отложено время τ, пропорциональное равномерно подводимому к телу количеству теплоты.
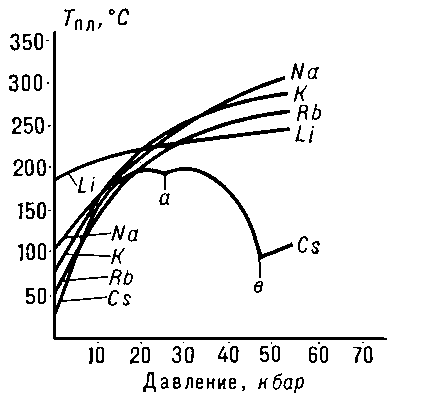
Рис. 3. Изменение температуры плавления Тпл (°С) щелочных металлов с увеличением давления p (кбар). Кривая плавления Cs указывает на существование у него при высоких давлениях двух полиморфных превращений (а и в).
Плавление — это… Что такое Плавление?
Плавле́ние —это процесс перехода тела[источник не указан 1003 дня] из кристаллического твёрдого состояния в жидкое. Плавление происходит с поглощением удельной теплоты плавления и является фазовым переходом первого рода.
Способность плавиться относится к физическим свойствам вещества [1]
При нормальном давлении, наибольшей температурой плавления среди металлов обладает вольфрам (3422 °C), среди простых веществ — углерод (по разным данным 3500 — 4500 °C[2]) а среди произвольных веществ — карбид тантала-гафния Ta4HfC5 (4216 °C). Можно считать, что самой низкой температурой плавления обладает гелий: при нормальном давлении он остаётся жидким при сколь угодно низких температурах.
Многие вещества при нормальном давлении не имеют жидкой фазы. При нагревании они путем сублимации сразу переходят в газообразное состояние.
Плавление смесей и твёрдых растворов
У сплавов, как правило, нет определённой температуры плавления; процесс их плавления происходит в конечном диапазоне температур. На диаграммах состояния «температура — относительная концентрация» имеется конечная область сосуществования жидкого и твёрдого состояния, ограниченная кривыми ликвидуса и солидуса. Аналогичная ситуация имеет место и в случае многих твёрдых растворов.
Фиксированной температуры плавления нет также у аморфных тел; они переходят в жидкое состояние постепенно, размягчаясь при повышении температуры.
Кинетика плавления

Природа плавления
Поясним вначале, почему при некоторой температуре тело предпочитает разорвать часть межатомных связей и из упорядоченного состояния (кристалл) перейти в неупорядоченное (жидкость).
Как известно из термодинамики, при фиксированной температуре тело стремится минимизировать свободную энергию . При низких температурах второе слагаемое (произведение температуры и энтропии) несущественно, и в результате всё сводится к минимизации обычной энергии . Состояние с минимальной энергией — это кристаллическое твёрдое тело. При повышении температуры, второе слагаемое становится всё важнее, и при некоторой температуре оказывается выгоднее разорвать некоторые связи. При этом обычная энергия слегка повысится, но при этом сильно возрастет и энтропия, что в результате приведёт к понижению свободной энергии.
Динамика плавления
В динамике, плавление происходит следующим образом. При повышении температуры тела увеличивается амплитуда тепловых колебаний его молекул, и время от времени возникают дефекты решетки. Каждый такой дефект требует определённого количества энергии, поскольку он сопровождается разрывом некоторых межатомных связей. Стадия рождения и накопления дефектов называется стадией предплавления. Кроме того, на этой стадии, как правило, возникает квази-жидкий слой на поверхности тела. При некоторой температуре концентрация дефектов становится столь большой, что приводит к потере ориентационного порядка в образце.
Плавление в двумерных системах
В двумерных или квази-двумерных системах кристалл является гораздо более шатким объектом, чем в трёхмерном случае, а именно у двумерного кристалла нет дальнего позиционного порядка. (Для сравнения: в одномерном случае кристалл при конечной температуре вообще не может быть стабильным!) Как выяснилось, это приводит к тому, что плавление двумерного кристалла происходит в два этапа. Вначале кристалл переходит в так называемую
См. также
Примечания
Ссылки
Что такое плавление в физике? Определение, формула :: SYL.ru
Вся наблюдаемая в природе материя существует в 3 состояниях: газообразном, жидком и твердом. Нахождение вещества в конкретном состоянии определяется его физико-химическими свойствами, а также внешними условиями. В статье подробно рассматривается процесс перехода материи из твердого состояния в жидкое, то есть дается развернутый ответ на вопрос: «Что такое плавление?».
Особенности строения твердых и жидких тел

Перед тем как дать ответ на вопрос о том, что такое плавление, следует рассмотреть особенности строения твердых и жидких тел.
Первые характеризуются наличием постоянной формы, любому изменению которой они оказывают сопротивление. Твердые тела обладают упругостью, отсутствием текучести. Расстояния между частицами, образующими твердое тело, являются небольшими, а силы связи между этими частицами являются значительными в сравнении с таковыми для жидкостей и газов. Силы связи в твердых телах могут иметь различную химическую природу (ван-дер-ваальсовые, металлические, ковалентные, ионные). Существует два способа организации твердых тел:
- кристаллические структуры, когда атомы или молекулы тела расположены в определенных позициях в пространстве, например, металлы;
- аморфные структуры, в которых атомы или молекулы расположены хаотичным способом, например, стекло.
В жидкостях атомы и молекулы расположены дальше друг от друга, чем в твердых телах, поэтому они слабее связаны. Жидкость сохраняет объем при данных условиях, но не сохраняет форму и обладает хорошей текучестью. Частицы жидкости расположены хаотично относительно друг друга.
Следует отметить важный момент, атомы или молекулы в твердом теле находятся в определенных положениях, которые они очень медленно изменяют (например, в процессах диффузии), а вот частицы жидкости постоянно перескакивают из одного положения в другое.
Кинетическая и потенциальная энергия
Чтобы понять, что такое плавление в физике, необходимо ясно представлять соотношение кинетической и потенциальной энергии в твердых и жидких телах.
Потенциальная энергия характеризует работу, которую нужно затратить, чтобы распылить данное тело в пространстве на составляющие его частицы. Для описания этой величины вводят понятие энергии связи, которая обозначает работу, необходимую для того, чтобы оторвать от тела один атом или молекулу и удалить его/ее на бесконечность. Например, типичные значения энергии связи для твердых тел составляют несколько электрон-вольт, эти же значения для жидкостей на порядок меньше.
Кинетическая энергия характеризует интенсивность движения атомов и молекул. В случае конденсированных сред эта энергия прямо пропорционально зависит от температуры.
В твердых телах кинетическая энергия при комнатных температурах составляет несколько сотых электрон-вольт, то есть она в 100 раз меньше потенциальной. Атомы и молекулы в твердых телах находятся как бы в потенциальной яме и колеблются около устойчивых определенных положений. Выбраться они могут из этих положений, если флуктуации кинетической энергии окажутся значительными, или если сама потенциальная яма невелика, например, когда поблизости имеется какой-либо дефект.
Кинетическая энергия атомов и молекул в жидкости приблизительно равна их потенциальной энергии, то есть составляет несколько десятых электрон-вольт при комнатной температуре. Это означает, что каждая частица, составляющая жидкость, постоянно перепрыгивает из одного места в другое. Хорошим доказательством этого факта является Броуновское движение.
Определение процесса плавления

Что такое плавление в физике? Определение этому явлению можно дать следующее: под плавлением понимают переход из твердого состояния вещества в жидкое в результате увеличения его температуры. То есть если постоянно нагревать твердое тело, то молекулы или атомы, которые его составляют, начинают увеличивать свою кинетическую энергию. И это происходит до тех пор, пока эта энергия не сравняется с энергией связи, после чего частота прыжков атомов (молекул) значительно возрастает, и твердый материал начинает плавиться.
Яркими примерами плавления являются процессы таяния льда или переход в расплавленное состояние какого-либо металла или сплава.
Плавление — фазовый переход первого рода

Согласно своему определению, плавление является переходом первого рода, поскольку при нем происходит поглощение теплоты. При этом температура всей системы в процессе плавления не изменяется и является постоянной величиной. Этот факт объясняется тем, что подводимое к телу тепло расходуется не на увеличение кинетической энергии атомов и молекул, а на разрыв прочных химических связей между ними. Только после того, как все связи в твердом теле будут разрушены, дальнейший подвод тепла к уже жидкому веществу приведет к увеличению его температуры.
Сам процесс плавления не происходит спонтанно, а развивается в определенном промежутке времени, когда жидкая и твердая фазы сосуществуют в равновесии друг с другом.
Таким образом, плавление — это эндотермический процесс, что означает, что он идет с поглощением теплоты. Обратный процесс, при котором жидкость затвердевает, называется кристаллизацией.
Температура плавления
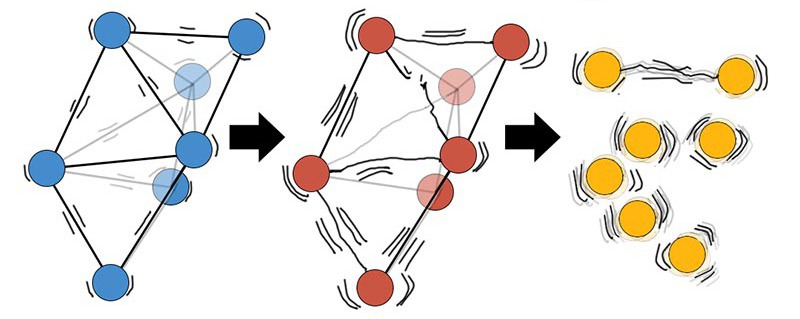
Как было сказано выше, плавление происходит при определенной температуре, которая называется точкой плавления. От чего зависит эта физическая величина? Во-первых, от энергии связи частиц, составляющих твердое тело, чем эта энергия больше, тем больше температура плавления. Например, тугоплавкий металл ниобий плавится при температуре 2742 К, а энергия связи на атом у этого металла равна 7,6 эВ, другой тугоплавкий металл вольфрам, имеет энергию связи 8,9 эВ и плавится при значительно большей температуре 3695 К.
Во-вторых, точка плавления определяется внешними условиями. В частности, при увеличении давления она также возрастает.
В-третьих, на эту величину для данного вещества сильно влияют примеси. Как правило, примеси приводят к понижению точки плавления.
Теплота плавления
Теперь перейдем от определения плавления к формуле, которая количественно описывает этот процесс. Когда происходит плавление, то внешний подвод тепла расходуется на разрыв связей в твердом теле и его перевод в жидкое состояние. Энергия, которую необходимо затратить, чтобы определенное количество твердого вещества, находящегося при температуре плавления, перешло в жидкое состояние называется теплотой плавления. Формула в этом случае записывается так: λ=Q/m, где Q — количество теплоты, m — масса тела.
Значение теплоты плавления λ зависит от физико-химических свойств материала. Например, для льда это значение составляет 333,55 Дж/г или 6,02 кДж/моль, а для железа 13,81 кДж/моль. Значения приведены при давлении 1 атмосфера.
Плавления кристаллов
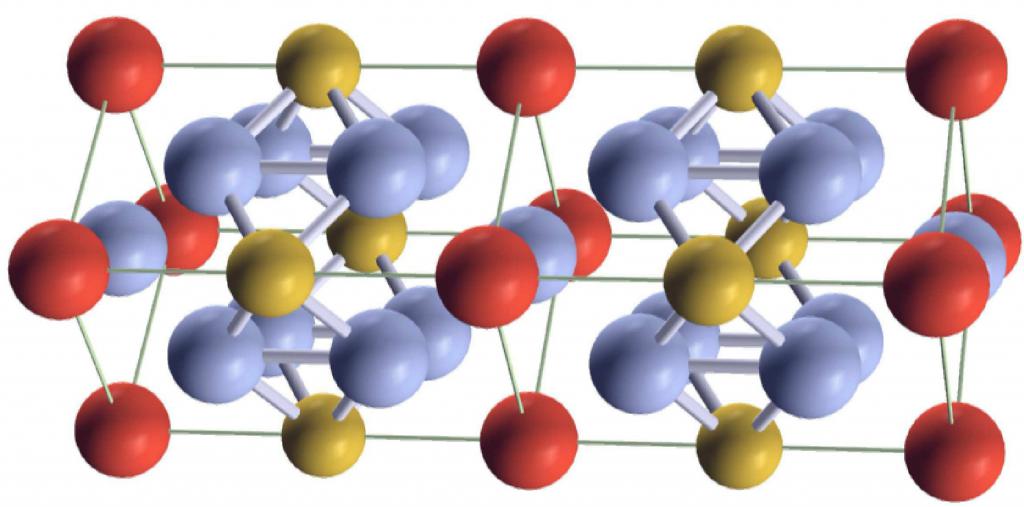
Эти твердые тела представляют собой определенное пространственное расположение частиц, которые их образуют. Оно известно под названием кристаллической решетки. Существуют много разных кристаллических решеток, каждая из которых реализуется в определенном классе веществ. Например, металлы, как правило, существуют в виде ОЦК (объемно-центрированная кубическая) и ГЦК (гранецентрированная кубическая) решеток. Понятие о температуре плавления справедливо только для кристаллов.
Плавление аморфных тел

Поскольку в аморфных материалах атомы (молекулы) расположены хаотически, то и энергии связей между ними будут различными. Этот факт объясняет, почему для аморфных материалов не существует определенной точки плавления, а сам процесс плавления происходит в температурном интервале, который, как правило, составляет несколько десятков градусов.
ПЛАВЛЕНИЕ — это… Что такое ПЛАВЛЕНИЕ?
— переход вещества изкристаллич. твёрдого состояния в жидкое. П. происходит с поглощением теплакак фазовый переход1-го рода, оно состоит в позиционном разупорядочениисистемы: регулярное пространственное расположение атомов (молекул) сменяетсянерегулярным при незначит. изменении ср. расстояний между ними. ТемператураП. Т пл зависит от давления Р. Для двух- и многоатомныхмолекул при П. наблюдается также ориентационное разупорядочение, у нек-рыхвеществ оно предшествует П.
Линия фазового равновесия кристалл — жидкость, начинается в тройной точке А чистого вещества (рис. 1) и прослеживаетсядо давлений ~10ГПа. Если в системе происходит полиморфное превращение (см. Полиморфизм), толиния П. имеет излом в тройной точке кристалл I — кристалл II — жидкость. 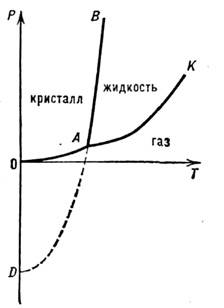
Рис. 1. Линия плавления АВ на диаграммесостояния чистого вещества: А— тройная точка равновесия кристалл- жидкость — газ, К — критическая точка, AD — экстраполяциялинии плавления за тройную точку.
Для большинства веществ темп-ра П. увеличиваетсяс ростом давления, dT пл/dP > 0. Но для воды, Ga,Bi, Sb, нек-рых сплавов dT пл/dP< 0 в окрестноститройной точки А. При плавлении энтропия S возрастает,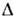 S= S ж — S крист > 0, т. е. теплота плавления .= Т
S= S ж — S крист > 0, т. е. теплота плавления .= Т 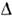 S положительна.(Известно исключение, относящееся к 3 Не при Т< 0,32К. Оно связано с явлением преимущественного ориентац. упорядочения ядерныхспинов в жидкой фазе.) Тогда, согласно Клапейрона — Клаузиуса уравнению,dP/dT =
S положительна.(Известно исключение, относящееся к 3 Не при Т< 0,32К. Оно связано с явлением преимущественного ориентац. упорядочения ядерныхспинов в жидкой фазе.) Тогда, согласно Клапейрона — Клаузиуса уравнению,dP/dT =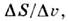 знак dP/dT совпадает со знаком скачка объёма
знак dP/dT совпадает со знаком скачка объёма 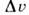 = v ж — v крист Для нормально плавящихсявеществ объём при П. увеличивается,
= v ж — v крист Для нормально плавящихсявеществ объём при П. увеличивается,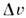 T пл при атм. давлении, S/R(R — газовая постоянная )и объёма
T пл при атм. давлении, S/R(R — газовая постоянная )и объёма 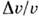 крист для нек-рых веществ.
крист для нек-рых веществ.
Вещество | T пл,К | 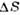 /R /R | 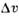 /v крист /v крист | Вещество | Т пл,К | 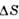 /R /R | 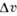 /v крист /v крист | |
Аr | 83,8 | 1 ,69 | 0,142 | Сu | 1358 | 1,15 | 0,046 | |
Хе | 161,3 | 1,71 | 0,151 | Аu | 1338 | 1,15 | 0,055 | |
N2 | 63,2 | 1 ,37 | 0,072 | Zn | 692,7 | 1,25 | 0,041 | |
O2 | 54,4 | 0,99 | 0,075 | А1 | 933 | 1,36 | 0,064 | |
СН 4 | 90,7 | 1,24 | 0,081 | Pb | 600,2 | 1,00 | 0,037 | |
C6H6 | 278,6 | 4,25 | 0,133 | Fe | 1811 | 1,01 | 0,039 | |
C6F14 | 185,0 | 4,96 | 0,091 | Ni | 1728 | 1,23 | 0,063 | |
Na | 370,8 | 0,86 | 0,026 | NaCl | 1073 | 3,37 | 0,250 | |
К | 335,7 | 0,86 | 0,025 | KC1 | 1043 | 3,12 | 0,173 |
Из табл. видно, что для простых веществ 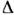 S/R лежитв интервале 0,86 — 1,71 (
S/R лежитв интервале 0,86 — 1,71 (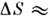 7,2 — 14,2 Дж/моль х К). Более высокие значения
7,2 — 14,2 Дж/моль х К). Более высокие значения 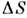 характерны для веществ, у к-рых при П. возбуждаются дополнительные (напр.,ориентацпонные) степени свободы (С 6 Н 6, C6F14 и др.) или перестраивается электронная структура (Si, Ge, Bi и др.). Увеличениеобъёма у металлов значительно меньше, чем у инертных газов и ионных солей. Т пл элементов от их ат. номера Z немонотоннаи обнаруживает периодичность (рис. 2). Похожий вид имеет зависимость от . теплотыплавления L.
характерны для веществ, у к-рых при П. возбуждаются дополнительные (напр.,ориентацпонные) степени свободы (С 6 Н 6, C6F14 и др.) или перестраивается электронная структура (Si, Ge, Bi и др.). Увеличениеобъёма у металлов значительно меньше, чем у инертных газов и ионных солей. Т пл элементов от их ат. номера Z немонотоннаи обнаруживает периодичность (рис. 2). Похожий вид имеет зависимость от . теплотыплавления L.
Термодинамич. движущей силой П. являетсяотклонение двухфазной системы от равновесия. Мерой этого отклонения служитразность химических потенциалов 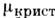 ( Т, (Т, 0. Стационарное состояние обеспечивается подводом тепла к границераздела фаз при постоянном внеш. давлении. П. — результат конкуренции двухфаз, каждая из к-рых устойчива по отношению к малым возмущениям..
( Т, (Т, 0. Стационарное состояние обеспечивается подводом тепла к границераздела фаз при постоянном внеш. давлении. П. — результат конкуренции двухфаз, каждая из к-рых устойчива по отношению к малым возмущениям..
П. сопровождается скачкообразным изменением S,v и внутр. энергии при медленном изобарич. нагревании образца. ПриП. не только теряется регулярность структуры (дальний порядок в расположенииатомов), но существенно изменяется в среднем и координация соседних атомов(ближний порядок).
Зависимость между Т и Р налинии П. приближённо передаётся эмпирич. ур-нием ( Р/Р 0)+1 = ( Т/Т п) с. Здесь с1 — индивидуальнаяпостоянная, к-рую следует рассматривать как параметр термодинамич. подобиявеществ относительно П., значения Т 0 и Р 0 (Т п — темп-pa плавления при Р = 0, Р 0 = -Р при T= 0) получены экстраполяцией линии П. за тройную точку(ли ния АД на рис. 1). Для нормально плавящихся веществ Р0.0.
Физически продолжение линии фазового равновесияза тройную точку возможно. Обе сосуществующие фазы при этом находятся врастянутом состоянии и удовлетворяют условию 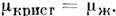 Эмпирич. ур-ние приводит к асимптотике dP/dT
Эмпирич. ур-ние приводит к асимптотике dP/dT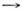 0при Т
0при Т 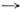 0,к-рая согласуется с теоремой Нернста. Поиск высокотемпературной асимптотикилиний П. не привёл к универсальному результату. В отличие от равновесияжидкость — пар критическая точка на линии равновесия кристалл — жидкостьне обнаружена. Её появление считается невозможным, что объясняется различиемсимметрии кристалла и жидкости.
0,к-рая согласуется с теоремой Нернста. Поиск высокотемпературной асимптотикилиний П. не привёл к универсальному результату. В отличие от равновесияжидкость — пар критическая точка на линии равновесия кристалл — жидкостьне обнаружена. Её появление считается невозможным, что объясняется различиемсимметрии кристалла и жидкости.
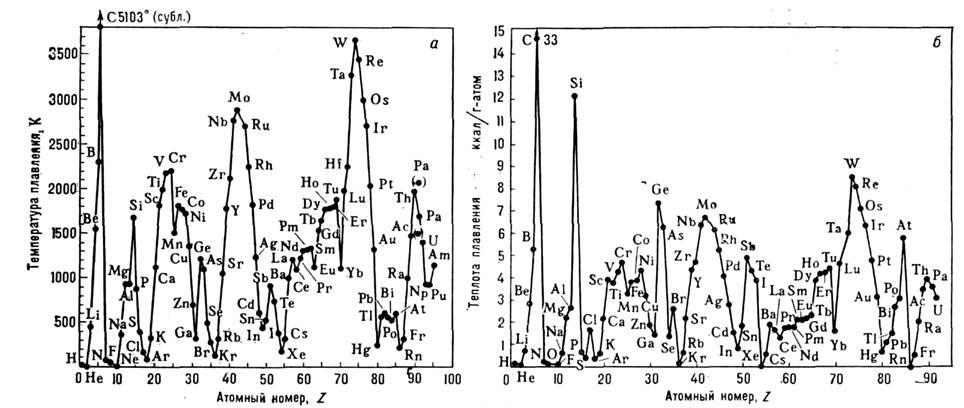
Рис. 2. Зависимость температуры ( а )и теплоты ( б) плавления элементов от их атомного номера Z.
При П. имеет место размерный эффект: темп-paП. TR малых частиц (R — эфф. радиус частицы) ниже, Т пл больших кристаллов. Эффект связан с поверхностнойэнергией, к-рая относительно велика для малых частиц. Напр., для Sn Т ПЛ=505 К, TR 480;460; 415 К соответственно для R= 10; 6; 4 нм.
480;460; 415 К соответственно для R= 10; 6; 4 нм.
П. частично аморфных веществ, напр. полимеров, х). Вид простой диаграммысостояний показан на рис. 3. Система образует непрерывный ряд растворовв жидком и кристаллич. состояниях. Равновесные составы жидкой ( х ж )и кристаллич. ( х крист) фаз при заданной темп-ре Т1 определяются, как показано на рис. 3.
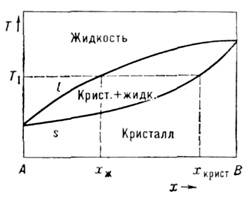
Рис. 3. Диаграмма состояния кристалл -жидкость двухкомпонентной системы, х— атомная (молекулярная) долякомпонента В в растворе.
Относит. количества фаз зависят от исходнойконцентрации однородной системы и определяются из условия сохранения масскомпонент. Верхняя линия l наз. кривой ликвидуса, нижняя линия s- кривой солидуса.
П. и кристаллизация играют важнуюроль в природе: образование снега и льда, вечной мерзлоты, процессы вовнутр. слоях Земли, вулканич. явления. П. — составная часть мн. процессовв технике (произ-во чистых металлов и сплавов, стекла, изделий из них).
Лит.: Френкель Я. И., Кинетическаятеория жидкостей, Л., 1975; Любов Б. Я., Теория кристаллизации в большихобъемах, М., 1975; Тонков Е. Ю., Фазовые диаграммы элементов при высокомдавлении, М., 1979; Уббелоде А. Р., Расплавленное состояние вещества, пер. В. П. Скрипов.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
Плавление — Википедия. Что такое Плавление

Плавле́ние — это процесс перехода тела из кристаллического твёрдого состояния в жидкое, то есть переход вещества из одного агрегатного состояния в другое. Плавление происходит с поглощением теплоты плавления и является фазовым переходом первого рода, которое сопровождается скачкообразным изменением теплоёмкости в конкретной для каждого вещества температурной точке превращения — температура плавления.
Способность плавиться относится к физическим свойствам вещества[1]
При нормальном давлении, наибольшей температурой плавления среди металлов обладает вольфрам (3422 °C), среди простых веществ — углерод (по разным данным 3500 — 4500 °C[2]) а среди произвольных веществ — карбид тантала-гафния Ta4HfC5 (3942 °C). Можно считать, что самой низкой температурой плавления обладает гелий: при нормальном давлении он остаётся жидким при сколь угодно низких температурах.
Многие вещества при нормальном давлении не имеют жидкой фазы. При нагревании они путём сублимации сразу переходят в газообразное состояние.
Плавление смесей и твёрдых растворов
У сплавов, как правило, нет определённой температуры плавления; процесс их плавления происходит в конечном диапазоне температур. На диаграммах состояния «температура — относительная концентрация» имеется конечная область сосуществования жидкого и твёрдого состояния, ограниченная кривыми ликвидуса и солидуса. Аналогичная ситуация имеет место и в случае многих твёрдых растворов.
Фиксированной температуры плавления нет также у аморфных тел; они переходят в жидкое состояние постепенно, размягчаясь при повышении температуры.
Кинетика плавления

Технически плавление вещества осуществляется с помощью подвода тепловой энергии снаружи образца (внешний нагрев, например, в термической печи) или непосредственно во всём его объёме (внутренний нагрев, например, резистивный нагрев при пропускании тока через образец, или индукционный нагрев в высокочастотном электро-магнитном поле). Способ плавления не влияет на основные характеристики процесса — температуру и скрытую теплоту плавления, но определяет внешнюю картину плавления, например, появление квази-жидкого слоя на поверхности образца при внешнем нагреве.
Считается, что плавление характеризуется потерей дальнего ориентационного межатомного порядка в кристалле с переходом к «жидкоподобному» или «газоплотному» беспорядку.
Природа плавления
Поясним вначале, почему при некоторой температуре тело предпочитает разорвать часть межатомных связей и из упорядоченного состояния (кристалл) перейти в неупорядоченное (жидкость).
Как известно из термодинамики, при фиксированной температуре тело стремится минимизировать свободную энергию F=E−TS{\displaystyle F=E-TS}. При низких температурах второе слагаемое (произведение температуры и энтропии) несущественно, и в результате всё сводится к минимизации обычной энергии E{\displaystyle E}. Состояние с минимальной энергией — это кристаллическое твёрдое тело. При повышении температуры, второе слагаемое становится всё важнее, и при некоторой температуре оказывается выгоднее разорвать некоторые связи. При этом обычная энергия E{\displaystyle E} слегка повысится, но при этом сильно возрастет и энтропия, что в результате приведёт к понижению свободной энергии.
Динамика плавления
Тепловые колебания атомов в решетке кристалла: точки — атомы, соединяющие линейные отрезки — межатомные связи Поведение атомов жидкости после перехода кристалла через точку плавления, как в среднем постоянные для заданной температуры разрывы и восстановления межкластерных и внутрикластерных межатомных связей (короткие утолщенные отрезки — разорванные связи)[3]Изначально, в умозрительном, т.е. не количественном, представлении считалось, что в динамике плавление происходит следующим образом. При повышении температуры тела увеличивается амплитуда тепловых колебаний его молекул, и время от времени возникают структурные дефекты решётки в виде перескоков атомов, роста дислокаций и других нарушений кристаллической решетки[4]. Каждый такой дефект, возникновение и перемещение дислокаций требуют определённого количества энергии, поскольку сопровождается разрывом некоторых межатомных связей. Стадия рождения и накопления дефектов называется стадией предплавления. Кроме того, на этой стадии, как правило, при внешнем нагреве возникает квази-жидкий слой на поверхности тела. Считается, что при некоторой температуре концентрация дефектов становится столь большой, что приводит к потере ориентационного порядка в образце, т.е. плавлению.
Однако, в связи с тем, что механизм термодеструкции кристалла за счёт образования дефектов и роста дислокаций, протекающей в широком диапазоне температур, не приводит к фазовому превращению 1-го рода, то есть к скачку термодинамических характеристик вещества в конкретной, фиксированной для каждого вещества температурной точке, то Линдеман[5] развил простые представления о ходе процесса плавления, согласно которым амплитуда колебания частиц в точке плавления увеличивается настолько, что становится сравнимой с межатомным расстоянием в кристаллической решётке и приводит к разрушению решётки и потере ориентационного межатомного порядка. Фактически этот «фактор плавления» является основой большинства моделей с определяющей ролью отталкивающей части потенциала парного взаимодействия и наложением условий перехода от порядка к «жидкоподобному» или «газоплотному» беспорядку, рассчитываемых методами Монте-Карло и молекулярной динамики[6][7][8]. Однако, было установлено[9], что в точке плавления среднеквадратичное смещение атомов из состояния равновесия составляет всего около 1/8 межатомного расстояния, что исключает модель Линдемана, то есть соударение атомов как «фактор плавления». При этом энергия атомов оказывается существенно ниже потенциальной энергии атомизации кристаллической решётки.
Теоретические исследования В. Андреева[10][11] показали, что динамика плавления кристаллического тела, как фазового превращения 1-го рода, определяется (в отличие от модели накопления дефектов и дислокаций и модели Линдемана) «катастрофичеким» (crash — [крэш]) конформационным преобразованием (инвертированием) структуры группы атомов при их тепловых колебаниях с амплитудами, меньшими межатомных расстояний в решетке, сопровождаемым разрушением межатомной связи при преодолении потенциального барьера инвертирования в фиксированной температурной точке с затратой постоянной величины энергии, ниже энергии атомизации решетки, и равной удельной теплоте плавления. Этот механизм приводит к подтверждаемой экспериментально кластерной структуре связанного (конденсированного) жидкого состояния с постоянным (для заданной температуры) средним числом разрывающихся и восстанавливающихся межкластерных и внутрикластерных межатомных связей, обеспечивающих сохранение объёма и определяющих подвижность (текучесть) и химическую активность жидкости. С ростом температуры количество атомов в кластерах уменьшается за счет увеличения разорванных связей. Образующиеся свободные атомы (молекулы) испаряются с поверхности жидкости или остаются в межкластерном пространстве в качестве растворённого газа (пара). При температуре кипения вещество переходит в моноатомное (мономолекулярное) газообразное (парообразное) состояние.
Плавление в двумерных системах
В двумерных или квази-двумерных системах кристалл является гораздо более шатким объектом, чем в трёхмерном случае, а именно у двумерного кристалла нет дальнего позиционного порядка. Для сравнения, в одномерном случае кристалл при конечной температуре вообще не может быть стабильным.
Как выяснилось, это приводит к тому, что плавление двумерного кристалла происходит в два этапа. Вначале кристалл переходит в так называемую гексатическую фазу, в которой теряется ближний позиционный порядок, но сохраняется ориентационный, а затем происходит потеря и ориентационного порядка и тело становится жидким.
Примечания
- ↑ С. Т. Жуков Химия 8-9 класс, Глава 1. Основные представления и понятия химии
- ↑ Разброс экспериментальных данных связан, по видимому, с фазовым переходом графит-карбин и различной скоростью нагрева при измерениях. Климовский И. И., Марковец В. В. Влияние фазового перехода графит-карбин на излучательную способность графитовых образцов при их нагревании до температур 3000 K и более // International Scientific Journal for Alternative Energy and Ecology. — 2007. — № 6 (50). — С. 50-59.
- ↑ Андреев В. Д. Избранные проблемы теоретической физики.. — Киев: Аванпост-Прим,. — 2012.
- ↑ Мейер К. Физико-химическая кристаллография, М., «Металлография», 1972
- ↑ Lindemann F. A. // Phys.Z., 1910, v.11, p.609
- ↑ Wood W. W., Jacobson J. D. Preliminary Results from a Recalculation of the Monte Carlo Equation of State of Hard Spheres // J. Chem. Phys.. — 1957. — № 27. — С. 1207. — DOI:10.1063/1.1743956.
- ↑ Alder B. J., Wainwright T. E. Phase Transition in Elastic Disks // Phys. Rev.. — 1962. — № 127. — С. 359. — DOI:10.1103/PhysRev.127.359.
- ↑ Hoover W. G., Gray S. G., Johnson K. W. Thermodynamic Properties of the Fluid and Solid Phases for Inverse Power Potentials // J. Chem. Phys.. — 1971. — № 55. — С. 1128. — DOI:10.1063/1.1676196.
- ↑ Пайнс Д. Элементарные возбуждения в твёрдых телах. М., Мир, 1965.
- ↑ Андреев В. Д. Крэш (crash)-конформационная кинематика ковалентной решетки алмаза при плавлении. // Журнал структурной химии. — 2001. — № 3. — С. 486-495.
- ↑ Андреев В. Д. «Фактор плавления» при межатомных взаимодействиях в алмазной решетке. // Химическая физика. — 2002. — № 8,т.21. — С. 35-40.
Ссылки
ПЛАВЛЕНИЕ — это… Что такое ПЛАВЛЕНИЕ?
плавление — таяние; плавка, купеляция, топка, топление. Ant. застывание Словарь русских синонимов. плавление сущ.) Словарь русских синонимов. Контекст 5.0 Информатик. 2012 … Словарь синонимов
ПЛАВЛЕНИЕ — ПЛАВЛЕНИЕ, переход вещества из твердого кристаллического состояния в жидкое. Плавление фазовый переход 1 го рода. При постоянном внешнем давлении плавление чистого вещества происходит при постоянной температуре, называемой температурой плавления … Современная энциклопедия
Плавление — ПЛАВЛЕНИЕ, переход вещества из твердого кристаллического состояния в жидкое. Плавление фазовый переход 1 го рода. При постоянном внешнем давлении плавление чистого вещества происходит при постоянной температуре, называемой температурой плавления … Иллюстрированный энциклопедический словарь
ПЛАВЛЕНИЕ — переход твердого кристаллического вещества в жидкое состояние (фазовый переход первого рода). При постоянном внешнем давлении плавление чистого вещества происходит при постоянной температуре (tпл), называется температурой плавления; tпл при… … Большой Энциклопедический словарь
ПЛАВЛЕНИЕ — переход в ва из кристаллич. (твёрдого) состояния в жидкое, происходит с поглощением теплоты (фазовый переход I рода). Гл. хар ками П. чистых в в явл. температура плавления (Tпл) и теплота плавления (Lпл). Темп pa П. зависит от внеш. давления р;… … Физическая энциклопедия
плавление — и устарелое плавление … Словарь трудностей произношения и ударения в современном русском языке
ПЛАВЛЕНИЕ — ПЛАВЛЕНИЕ, плавления, мн. нет, ср. (спец.). Состояние по гл. плавиться, процесс перехода из твердого состояния в жидкое под воздействием высокой температуры. Точка плавления (температура, при которой вещество начинает плавиться). Толковый словарь … Толковый словарь Ушакова
плавление — ПЛАВИТЬ, влю, вишь; вленный; несов., что. Делать жидким, нагревая, накаливая. П. металл. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ПЛАВЛЕНИЕ — ср., ·длит. плавка жен., ·об. действие по гл. Плавка лесу, гонка. Плавка металлов, топка. Замечательно, что и топить, также как плавить, относится к огню и к воде. Плавеж муж. плавка скота, переправа вплавь; | самое место в реке, удобное для… … Толковый словарь Даля
плавление — Фазовый переход вещества из кристаллического состояния в жидкое. [Сборник рекомендуемых терминов. Выпуск 103. Термодинамика. Академия наук СССР. Комитет научно технической терминологии. 1984 г.] Тематики термодинамика EN fusionmelting DE… … Справочник технического переводчика
ПЛАВЛЕНИЕ — это… Что такое ПЛАВЛЕНИЕ?
плавление — таяние; плавка, купеляция, топка, топление. Ant. застывание Словарь русских синонимов. плавление сущ.) Словарь русских синонимов. Контекст 5.0 Информатик. 2012 … Словарь синонимов
ПЛАВЛЕНИЕ — ПЛАВЛЕНИЕ, переход вещества из твердого кристаллического состояния в жидкое. Плавление фазовый переход 1 го рода. При постоянном внешнем давлении плавление чистого вещества происходит при постоянной температуре, называемой температурой плавления … Современная энциклопедия
Плавление — ПЛАВЛЕНИЕ, переход вещества из твердого кристаллического состояния в жидкое. Плавление фазовый переход 1 го рода. При постоянном внешнем давлении плавление чистого вещества происходит при постоянной температуре, называемой температурой плавления … Иллюстрированный энциклопедический словарь
ПЛАВЛЕНИЕ — переход твердого кристаллического вещества в жидкое состояние (фазовый переход первого рода). При постоянном внешнем давлении плавление чистого вещества происходит при постоянной температуре (tпл), называется температурой плавления; tпл при… … Большой Энциклопедический словарь
ПЛАВЛЕНИЕ — переход в ва из кристаллич. (твёрдого) состояния в жидкое, происходит с поглощением теплоты (фазовый переход I рода). Гл. хар ками П. чистых в в явл. температура плавления (Tпл) и теплота плавления (Lпл). Темп pa П. зависит от внеш. давления р;… … Физическая энциклопедия
плавление — и устарелое плавление … Словарь трудностей произношения и ударения в современном русском языке
ПЛАВЛЕНИЕ — ПЛАВЛЕНИЕ, плавления, мн. нет, ср. (спец.). Состояние по гл. плавиться, процесс перехода из твердого состояния в жидкое под воздействием высокой температуры. Точка плавления (температура, при которой вещество начинает плавиться). Толковый словарь … Толковый словарь Ушакова
плавление — ПЛАВИТЬ, влю, вишь; вленный; несов., что. Делать жидким, нагревая, накаливая. П. металл. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ПЛАВЛЕНИЕ — ср., ·длит. плавка жен., ·об. действие по гл. Плавка лесу, гонка. Плавка металлов, топка. Замечательно, что и топить, также как плавить, относится к огню и к воде. Плавеж муж. плавка скота, переправа вплавь; | самое место в реке, удобное для… … Толковый словарь Даля
ПЛАВЛЕНИЕ — ПЛАВЛЕНИЕ, процесс перехода из твердого (аморфного или кристаллического) состояния в жидкое. Каждое вещество плавится при вполне определенной для него t°, к рая называется точкой П. Эта t° зависит от.внешнего давления^ Точка П.… … Большая медицинская энциклопедия
плавление — Фазовый переход вещества из кристаллического состояния в жидкое. [Сборник рекомендуемых терминов. Выпуск 103. Термодинамика. Академия наук СССР. Комитет научно технической терминологии. 1984 г.] Тематики термодинамика EN fusionmelting DE… … Справочник технического переводчика
