Химические свойства меди, температура плавления, плотность, цвет, молярная масса, валентность, удельный вес, формула меди и ее сплавов, степень окисления, физические свойства
Химические свойства меди определяются положением ее в периодической системе Д. И. Менделеева. Обозначение данного металла Cu (купрум, cuprum), он имеет 29-й порядковый номер, находится в первой группе (побочной подгруппе), в 4 большом периоде.
Выделяется отдельный ее вид: черновая медь, которая является при конвертировании продукта кислородом. Атомная (молярная) масса равна 63,5 г/моль, молекулярная масса — 63,5 а. е. м.
В зависимости от соединения, в котором металл находится, он может иметь валентность +1 и +2, но в редких случаях степень окисления может быть +3 и +5, что является исключением. Строение атома Cu и электронная формула показаны на рисунке:
Кристаллическая решетка меди представляет собой каркас в форме куба, который образован прямыми линиями. Решетка довольно прочная, молекулярная, так как в узлах находятся молекулы.
Содержание
Физические свойства и характеристика
Медь в чистом виде – это довольно ковкий, тягучий, вязкий металл, имеющий красновато-коричневый цвет.
Его твердость достигается путем добавления в состав различных примесей. Она имеет высокую электропроводность и теплопроводность, но примеси, которые зачастую добавляют в сплав, ухудшают эти показатели.
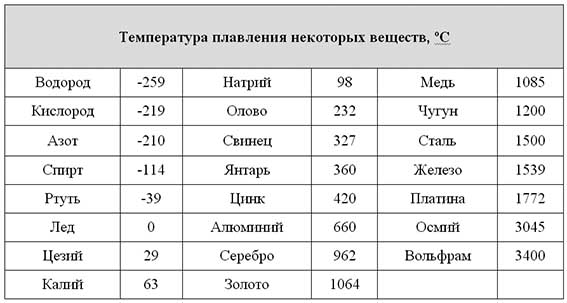
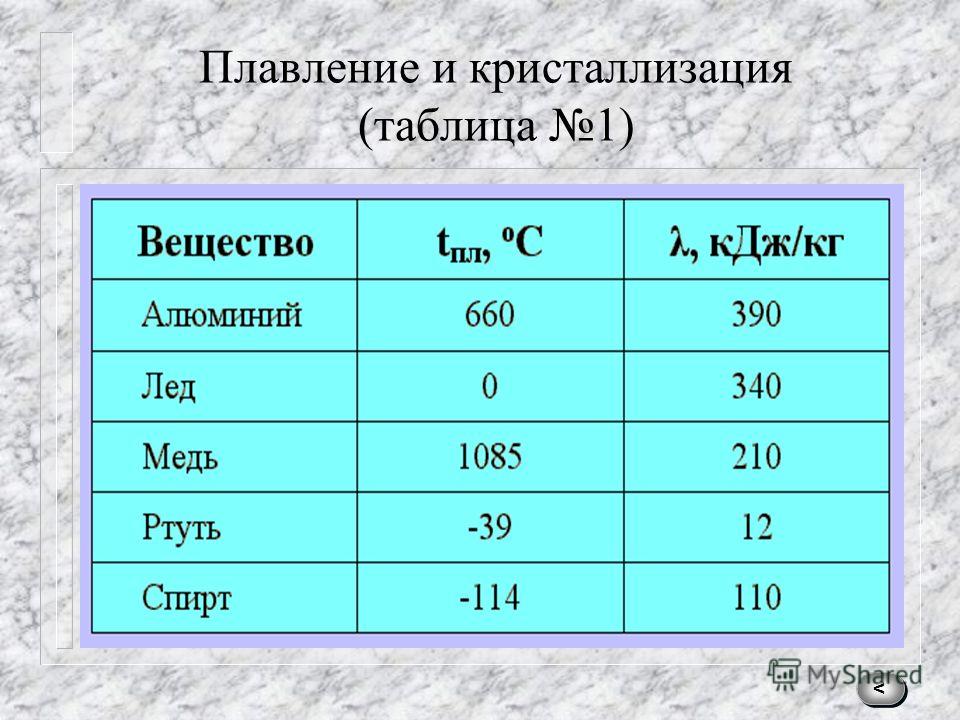
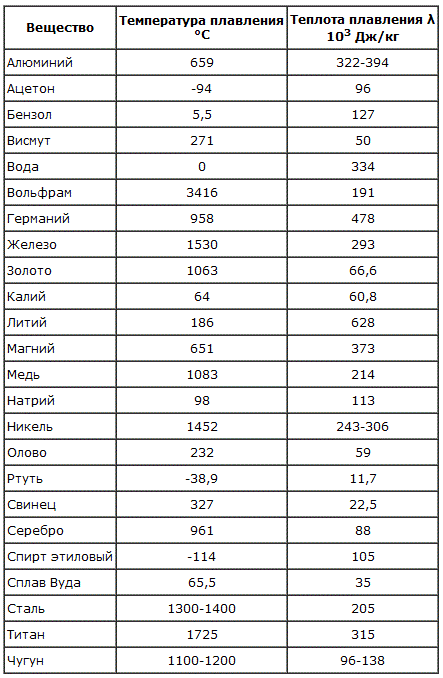
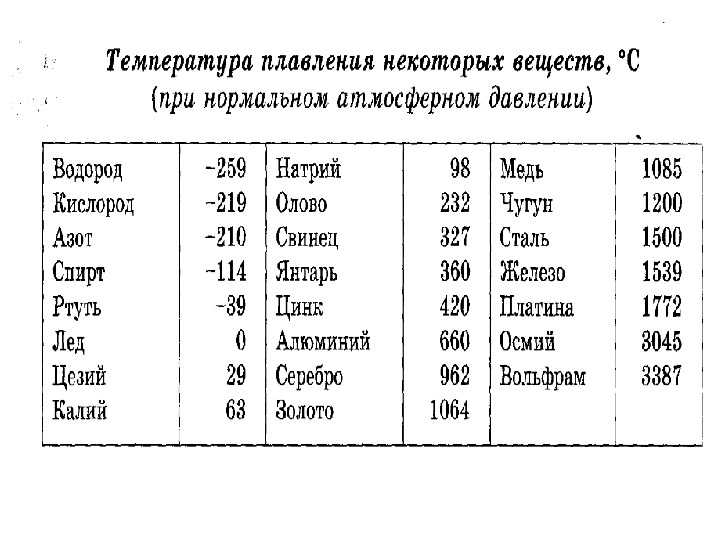
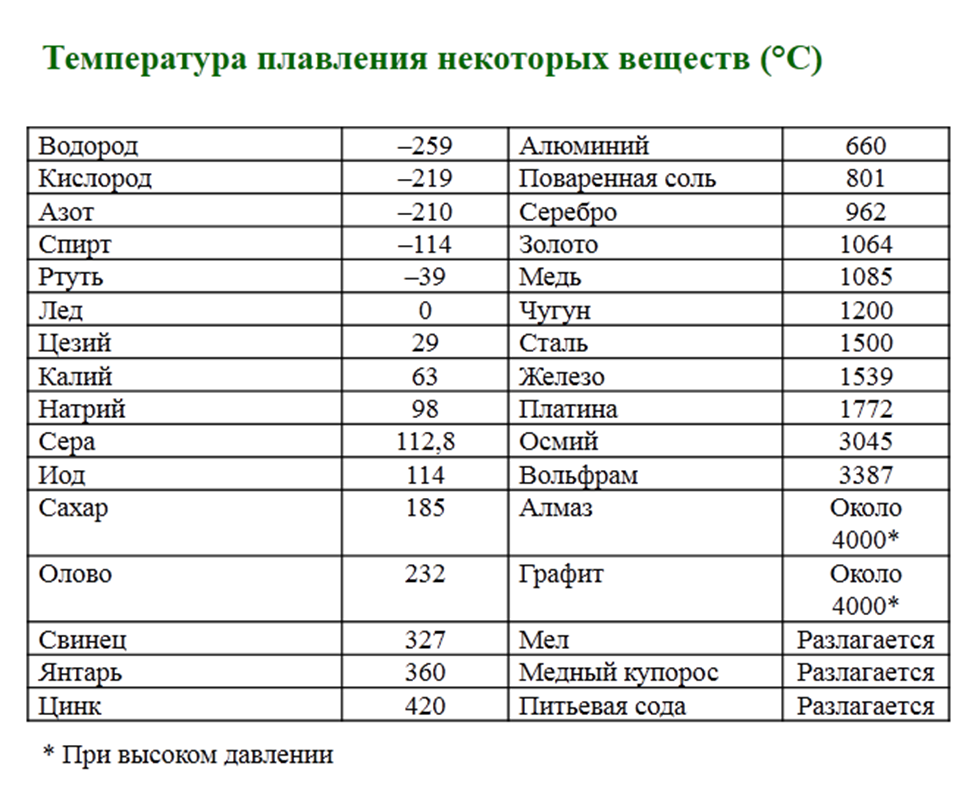
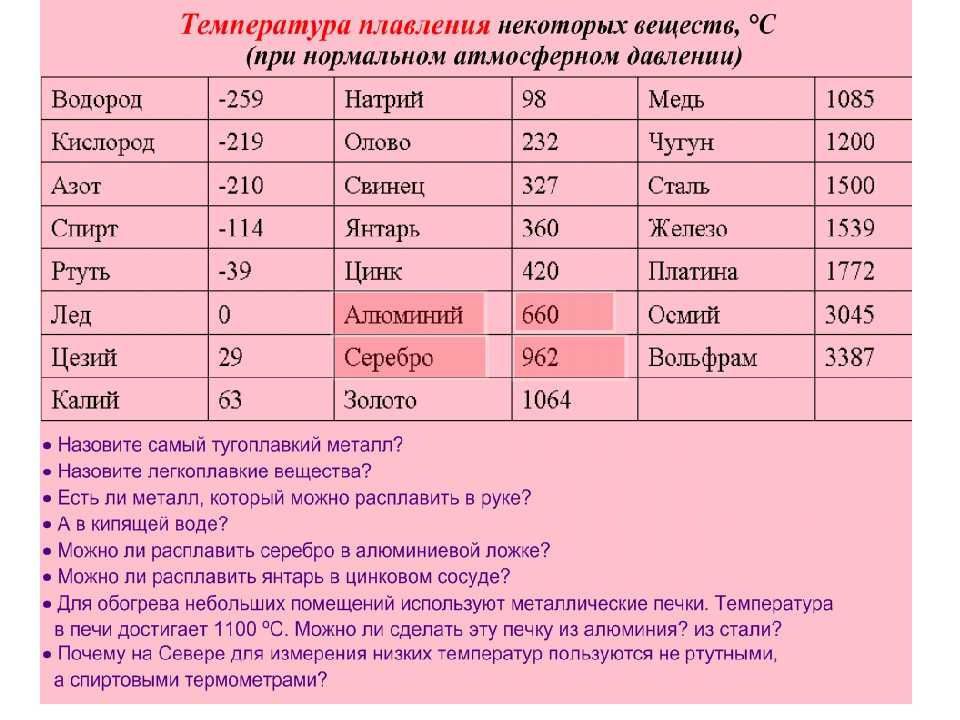
Преимуществом данного металла является устойчивость к коррозии. Температура плавления равна 1085 градусов по Цельсию, а температура кипения – 2562 градуса. Плотность равна 8900 кг/м3. Удельный вес равен 8930 кг/м3.
Медь в чистом виде является диамагнетиком, то есть магнитными свойствами не обладает. Магнититься могут только ее сплавы, где концентрация непосредственно самой меди не более 50%.
С чем реагирует
Медь НЕ реагирует с водородом, углеродом, азотом, а так же кремнием.
Реагирует с кислотами и солями, оксидами, галогенами, кислородом и неметаллами, но не может реагировать со щелочами, так как находится в электрохимическом ряду после водорода.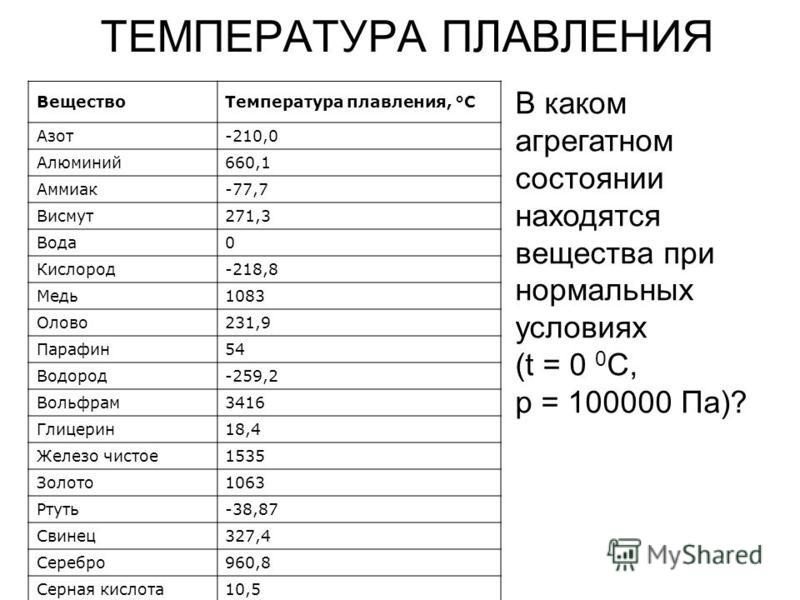 Так же не может реагировать с фтором, бромом, хлором.
Так же не может реагировать с фтором, бромом, хлором.
Отношение к кислороду
По отношению к кислороду металл проявляет слабую активность, но при длительном нахождении на воздухе покрывается очень тонкой, почти незаметной зеленоватой пленкой, которая и является оксидом меди.
В зависимости от температуры, при которой протекает реакция, купрум образует 2 оксида: CuO и Cu2O.
Взаимодействие с водой
По причине того, что медь находится в ряду электрохимического напряжения после водорода, она не вытесняет водород из воды. Но если присутствует кислород, водород может вытеснять молекулы металла, за счет чего и происходит окислительно-восстановительная реакция.
Реакции с кислотами
Из-за своего положения в электрохимическом ряду, не вытесняет водород из кислот, поэтому некоторые из них на нее не действуют. Но при достаточном доступе кислорода, растворяются в них, образуя соответствующие кислотам соли.
Отношение к галогенам и неметаллам
С галогенами медь реагирует довольно хорошо. В обычных условиях изменения не особо заметны, но на поверхности со временем образуется очень тонкий слой галогенидов. А при повышенных температурах реакция происходит очень быстро и бурно.
В обычных условиях изменения не особо заметны, но на поверхности со временем образуется очень тонкий слой галогенидов. А при повышенных температурах реакция происходит очень быстро и бурно.
Cu реагирует с серой, в зависимости от температуры образуются следующие сульфиды: Сu2S, CuS.
Может образовывать йодиды (с йодом).
Реакции с оксидами неметаллов
Медь может реагировать не со всеми оксидами неметаллов, что зависит от неметалла, температуры и других условий протекания химической реакции.
Химические свойства меди
Одновалетной
Ион Cu+ крайне неустойчив, особенно в водных растворах. Примерами одновалентной меди могут служить:
- оксид (I) – Cu2O,
- сульфид (I) – С
Двухвалентной
Это наиболее характерная степень окисления для меди. Так же более устойчивая и распространенная, например:
- оксид (II) – CuO,
- соли.
Трехвалентной
Наиболее редкая и нестабильная степень окисления этого металла, которая является исключением, например:
- оксид (III) – Cu2O3,
- купрат (III).

Заключение
Медь – распространенное вещество, которое незаменимо во многих отраслях, так как является очень гибким и плавким. Имеет высокие показатели, во многом сравнимые с железом, что позволяет изготавливать из нее многие незаменимые детали в производстве и механике.
Основные свойства и температура плавления серебра
В чистом виде серебро, обозначаемое Ag (с латинского – Argentum), обладает низкой твердостью, за счет чего редко используется для производства различных предметов интерьера, посуды, ювелирных украшений и других декоративных предметов. Температура плавления серебра составляет около 960 °С при атмосферном давлении. Для указанных целей применяется смесь серебра и меди, цинка и кадмия, которые позволяют в результате получать прочный и износостойкий конечный продукт. При этом при добавлении примесей температура плавления снижается, что несколько облегчает процесс.
Содержание
- 1 Важные характеристики серебра
- 2 Влияние других металлов
Важные характеристики серебра
Такой сравнительно мягкий металл, как Argentum, можно расплавить при температуре 961 °С. Плотность его составляет 10,5 г/см³, а твердость по Бринеллю – 25. Имеется существенный недостаток – подверженность воздействию воздуха. Образование со временем на украшениях и прочих предметах налета сульфида объясняется их взаимодействием с содержащимся в воздухе сероводородом.
Интересным качеством считается также его температура кипения – 2210 °С. Еще серебро за счет блестяще-белого цвета обладает удивительно высокой отражающей способностью, которая равняется примерно 95%. К тому же по сравнению с любыми другими известными металлами, серебро имеет наиболее высокую электро- и теплопроводность, благодаря чему широко используется в химической и медицинской промышленности, а также в процессах производства современной техники. На сегодняшний день используют следующие пробы металла:
- 999;
- 960;
- 925;
- 916;
- 875;
- 800;
- 750.

Чем выше проба, тем выше и температура плавления. Процент содержания чистого металла равен первым двум цифрам числа пробы. К примеру, 999 – 99,9%, 925 – 92,5% и т.д. Сплавы, имеющие в составе менее 91% металла, расплавляются при 780 °С.
Для создания ювелирных изделий зачастую применяют 960, 925 и 875 пробы. При этом 925 и 960 пробы считаются наиболее востребованными для ювелиров, поскольку предметы из них обладают благородным цветом, высокими антикоррозийными свойствами, твердостью и устойчивостью к влиянию окружающей среды.
Влияние других металлов
Как уже ранее упоминалось, очень часто используются сплавы вместе с медью, к которым добавляют небольшое количество никеля, цинка, кадмия и прочих примесей. Температура плавления серебра с медью значительно снижается при вводе цинка. Помимо этого, указанные примеси улучшают качество конечных продуктов.
Так, к примеру, при вводе 1% никеля, прочность изделия повысится, а при содержании 2,6% примеси – продукт получиться ломким. При включении в смесь с медью более 9% олова, сплав начнет плавиться и окисляться, а также конечный продукт получится довольно хрупким. По этим же причинам не добавляется более 6% алюминия.
Таким образом, предпочтение отдается добавлению к чистому серебру наиболее приемлемого для него металла – меди. Допустимая норма добавления составляет 5-50%. Это позволит получать как приемлемое качество готовых изделий, так и внешне близкий по цвету чистый металл.
WebWISER — Главная
WISER — это система, предназначенная для оказания помощи аварийно-спасательным службам при инцидентах с опасными материалами. Известные вещества Поиск вещества в базе данных известных веществ WISER. Помогите определить химическое вещество Определите неизвестное химическое вещество на основе его физических свойств, симптомов воздействия, окружающей среды и других критериев. Инструменты Ознакомьтесь с общими инструментами и справочными материалами. Последние новости
WebWISER лучше всего просматривать в следующих браузерах (указанная версия или выше): Internet Explorer 9, Firefox 26, Safari 7 или Google Chrome 30. WISER также доступен как отдельное приложение для ПК и различных мобильных платформ. включая устройства iOS и Android. Посетите домашнюю страницу WISER для бесплатных загрузок и получения дополнительной информации о WISER. | Другие ресурсы для чрезвычайных ситуаций с химическими веществами в NLM
Other Chemical Emergency Resources
|
Медь (Cu) — атомный номер 29
Произносится
KOP-er
Медь — красновато-оранжевый металл с атомным номером 29 в периодической таблице.
 Это переходный металл, расположенный в 11-й группе периодической таблицы. Он имеет обозначение Cu.
Это переходный металл, расположенный в 11-й группе периодической таблицы. Он имеет обозначение Cu. Медь (Cu) — мягкий и ковкий металл с высокой тепло- и электропроводностью. В отличие от многих переходных металлов, он имеет розовато-оранжевый цвет. Он имеет широкий спектр применения, но в основном в качестве электрического проводника и строительного материала из-за его прочности и низкой стоимости. Медь — один из немногих металлов на Земле, который естественным образом встречается в земной коре. Благодаря своему относительному изобилию в земной коре он уже много лет широко используется человеком. Впервые он был использован около 8000 г. до н.э., что привело к созданию бронзы, когда ее плавили с оловом около 3500 г. до н.э. Название «медь» происходит от древнеанглийского Coper, происхождение которого можно проследить до латинского Cuprum. Соли меди широко используются в промышленности, например, сульфат меди в виде светло-голубого раствора или оксид меди в виде черного или зеленого порошка в зависимости от степени его окисления.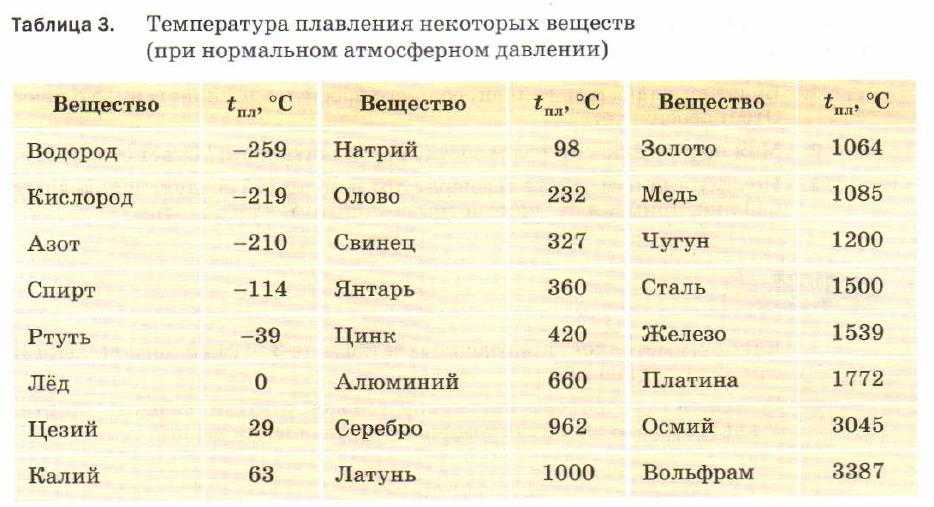 Медь широко используется в биологических соединениях, содержащихся в ферментах и крови. Он также используется в антимикробных приложениях для уничтожения бактерий. Он находится в группе 11 и имеет температуру плавления 1084°C и точку кипения 2562°C, являясь твердым металлом при комнатной температуре.
Медь широко используется в биологических соединениях, содержащихся в ферментах и крови. Он также используется в антимикробных приложениях для уничтожения бактерий. Он находится в группе 11 и имеет температуру плавления 1084°C и точку кипения 2562°C, являясь твердым металлом при комнатной температуре.
Загрузите медь в виде изображения для печати и с полным масштабированием
Получите бесплатную загрузку здесь (JPEG, PDF, SVG)
Часто задаваемые вопросы
Какова температура плавления меди?
Медь имеет температуру плавления 1083°C, что означает, что при 1083°C она превратится в жидкость.
Какова температура кипения меди?
Медь имеет температуру кипения 2567°C, что означает, что при 2567°C она превратится в газ.
Что такое электроотрицательность меди?
Электроотрицательность меди 1,9. Электроотрицательность — это мера того, насколько сильно атомы притягивают к себе связывающие электроны.
Обнаружен
Известен древним.
Дата открытия
9000 г. до н.э.
Что такое Теплота испарения меди?
Медь имеет теплоту парообразования 300,3 кДж/моль.
Применение
Наиболее часто используется в качестве электрического проводника. Также используется в производстве водопроводных труб. Его сплавы используются в ювелирных изделиях и монетах.
Источники
Чистая медь редко встречается в природе. Обычно встречается в сульфидах, таких как халькопирит (CuFeS2), ковелин (CuS), халькозин (Cu2S) или оксиды, такие как куприт (Cu2O).
Об авторе
Натан М.
Автор
Натан имеет степень бакалавра биомедицинской химии в Уорикском университете и степень бакалавра биомедицинских наук в Университете Вулверхэмптона, Великобритания. Предмет Натана варьируется от общей химии до органической химии. Натан также создал учебную программу «Разрушение атома» на странице курса.
Цитация
«медь», опубликованная 30 декабря 2019 года.




 Испанские переводы этого контента скоро появятся.
Испанские переводы этого контента скоро появятся. Эта экспериментальная функция ограничена только данными ERG. Испанские переводы будут добавлены позже.
Эта экспериментальная функция ограничена только данными ERG. Испанские переводы будут добавлены позже. ниже.
ниже.
 Будьте в курсе последней информации из следующего:
Будьте в курсе последней информации из следующего: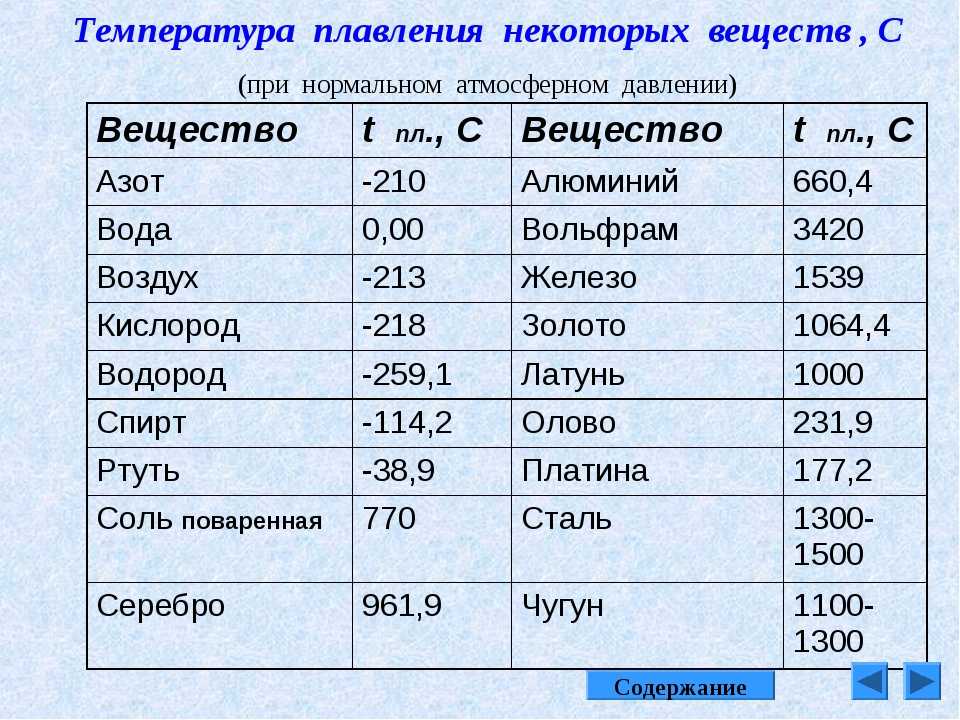
 ..
..