Как выплавлялась сталь | Политех (Политехнический музей)
17 октября 1855 г. английский изобретатель Генри Бессемер запатентовал новый процесс изготовления стали. Политех решил проследить историю развития металлургии от глиняных кузнечных горнов до мартеновских печей с магнезитовой футеровкой.
Цивилизация — это металл, начиная с первых неловких попыток обработки самородных металлов, и до ультрасовременных сложных сплавов. Недаром историки разделяют развитие человечества на этапы, начиная с каменного века: медный, бронзовый и, наконец, железный.
Самородные металлы встречаются довольно редко, поэтому начиная с медного века люди учились выплавлять их из руды. Хотя первое знакомство человека с железом сегодня относят еще к 3–4 тысячелетию до н.э., считается, что «настоящий» железный век наступил лишь около VIII в. до н.э. Во всяком случае, в 1200 г. до н.э. древние греки воевали с троянцами еще медным и бронзовым оружием.
Получать медь и бронзу (сплав меди с оловом) не особенно сложно. Во-первых, самородная медь распространена достаточно широко. Во-вторых, температура ее плавления — около 1350 °С, и в простейшем случае достаточно насыпать руду в каменный или глиняный тигель, и поставить его в кузнечный горн. Вскоре можно будет отделить шлак от вполне чистого металла.
Дорога к веку железа
Температура плавления железа — уже почти 1540 °С. Его получение потребовало печей более совершенной конструкции и более горячих. Чтобы повысить разогрев, воздух в них нагнетали мехами, а сами глиняные печи часто делали «глухими»: чтобы извлечь готовый металл и шлаки, печь приходилось разбирать, а для новой плавки складывать заново. Вдобавок, поддерживать высокую температуру удавалось только в небольших по размерам объемах. Производительность такой металлургии была невысока, а выплавленное железо исключительно дорогим.
Полудоменная печь XV века с водяным дутьем (Штирия)Широко доступным железо стало только в XIV–XV вв. , когда появились доменные печи, выплавка в которых может происходить непрерывно — разбирать ее нет нужды. Железная руда, чередуясь с топливом, засыпается в доменную печь сверху, а снизу подается разогретый воздух и извлекается шлак, а также чугун, сплав железа со сравнительно высоким количеством углерода.
, когда появились доменные печи, выплавка в которых может происходить непрерывно — разбирать ее нет нужды. Железная руда, чередуясь с топливом, засыпается в доменную печь сверху, а снизу подается разогретый воздух и извлекается шлак, а также чугун, сплав железа со сравнительно высоким количеством углерода.
Первым топливом доменных печей стал уголь — сперва древесный, потом каменный, — а с XVIII в. его вытесняет кокс, продукт нагревания угля без доступа кислорода.
Температура в доменной печи так высока, что складывать ее потребовалось из кирпичей, сделанных лишь из особых, огнеупорных сортов глины. В те годы самой стойкой показала себя белая глина (каолин), состоящая, в основном, из водных силикатов алюминия. Глину обжигали, чтобы удалить воду и спечь, получив шамот, затем его перемалывали и после добавления дополнительных ингредиентов формовали в кирпичи.
Стоит заметить, что кузнецы Средних веков относились к чугуну пренебрежительно: при всей своей высокой твердости, он исключительно хрупок и обычной ковке молотом не поддавался. Однако после того, как из него стали лить ядра, пушки, а затем рельсы и мосты, именно он стал основным для черной металлургии. «Доменно–каолинная» технология просуществовала несколько столетий, вплоть до начала XIX в.
Однако после того, как из него стали лить ядра, пушки, а затем рельсы и мосты, именно он стал основным для черной металлургии. «Доменно–каолинная» технология просуществовала несколько столетий, вплоть до начала XIX в.
Стальная революция
Следующий прорыв связан с созданием технологий получения из чугуна еще более удобных сплавов железа — сталей. Для этого требуется всего лишь снизить содержание углерода, однако долгое время добиться этого можно было лишь очень долгим и сложным способом, включавшим дополнительную проковку. Сталь не была массовой до тех пор, пока в 1780-х не появился новый революционный метод пудлингования.
В пудлинговой печи контакта чугуна с топливом не происходило. Уголь сгорал в очаге, тепло от которого направлялось к рабочему пространству, превращая загруженный чугун в тестообразную массу. При этом стены печи покрывали слоем глины, смешанной с оксидами железа, которые помогали углероду в расплавленном чугуне окисляться. При огромной температуре и за счет особого покрытия углерод и примеси выгорали, и в расплаве появлялись кристаллы достаточно чистого железа. Собрав их в комок, рабочие вытаскивали его из печи и отправляли на проковку.
При огромной температуре и за счет особого покрытия углерод и примеси выгорали, и в расплаве появлялись кристаллы достаточно чистого железа. Собрав их в комок, рабочие вытаскивали его из печи и отправляли на проковку.
Вскоре для пудлинговых и доменных печей было найдено и новое огнеупорное покрытие, способное выдерживать температуры, намного выше, чем шамот. Кремнезем — диоксид кремния — при нагревании спекается в огнеупорную стекловидную массу. Уже в 1820-х в Англии, где вовсю бушевала промышленная революция, была разработана технология получения огнеупорных кирпичей из богатой кремнеземом динасовой глины.
Вскоре доменные и пудлинговые печи начинают работу во всех развитых странах: с 1819 г. — во Франции, с 1835 г. — в Австрии, а в 1837 г. и в России открылся первый пудлинговый Камско-Воткинский завод. Металлургия стала обеспечивать возрастающие потребности человечества в «черном» металле. Континенты рассекли железные дороги, в моря вышли железные пароходы, артиллерия вооружилась внушительными пушками.
Между Бессемером и Мартеном
Потребности цивилизации в стали все росли, и технологии быстро совершенствовались. В середине XIX в. Генри Бессемер нашел, что «обезуглероживание» чугуна станет более эффективным, если сквозь ванну с расплавом продувать воздух. Однако бессемеровской переделке поддавался далеко не любой чугун: если он содержал фосфор, то при нагревании до красного каления резко терял всю свою прочность.
Изобретатель Генри Бессемер
Железные руды с низким содержанием фосфора достаточно редки, удалить же его из чугуна в печи не позволяла простая химия: шамотные и динасовые кирпичи создают в ней кислую среду, в которой нужные реакции не протекают. Решение нашлось лишь в 1877 г., когда Сидни Томас и Перси Джилькрист получили патент на новую технологию переделки чугуна — с добавлением связывающей фосфор извести и с облицовкой печи из материалов, содержащих щелочные оксиды магния и кальция.
В самой Англии к новому процессу отнеслись с недоверием. Вплоть до начала ХХ в. металл, изготовленный по этой технологии, ценился не слишком высоко, и даже фирма Lloyd’s брала повышенную плату за страхование судов, изготовленных из «томасовского» металла. Такой консерватизм обошелся англичанам дорого: к концу XIX в. Германия, вооружившись методом Томаса, стала металлургическим и промышленным лидером Европы.
Вплоть до начала ХХ в. металл, изготовленный по этой технологии, ценился не слишком высоко, и даже фирма Lloyd’s брала повышенную плату за страхование судов, изготовленных из «томасовского» металла. Такой консерватизм обошелся англичанам дорого: к концу XIX в. Германия, вооружившись методом Томаса, стала металлургическим и промышленным лидером Европы.
Распространение томасовского процесса привело к тому, что с 1880-х внутренние поверхности сталеплавильных печей все чаще отделывали щелочными (основными) огнеупорами. Изготовленные, например, из минерала магнезита, они позволили поднять температуру до 1700 °С и открыли дорогу новой металлургической технологии — пришло время мартеновских печей.
Эра Мартена
Идею о превращении мягкого железа в сталь погружением его в расплав чугуна еще в 1722 г. высказал Рене Реомюр (тот самый, который изобрел спиртовой термометр и предложил свою температурную шкалу). Однако температура для этого требовалась настолько высокая, что реализовать процесс было невозможно вплоть до появления печей нового типа.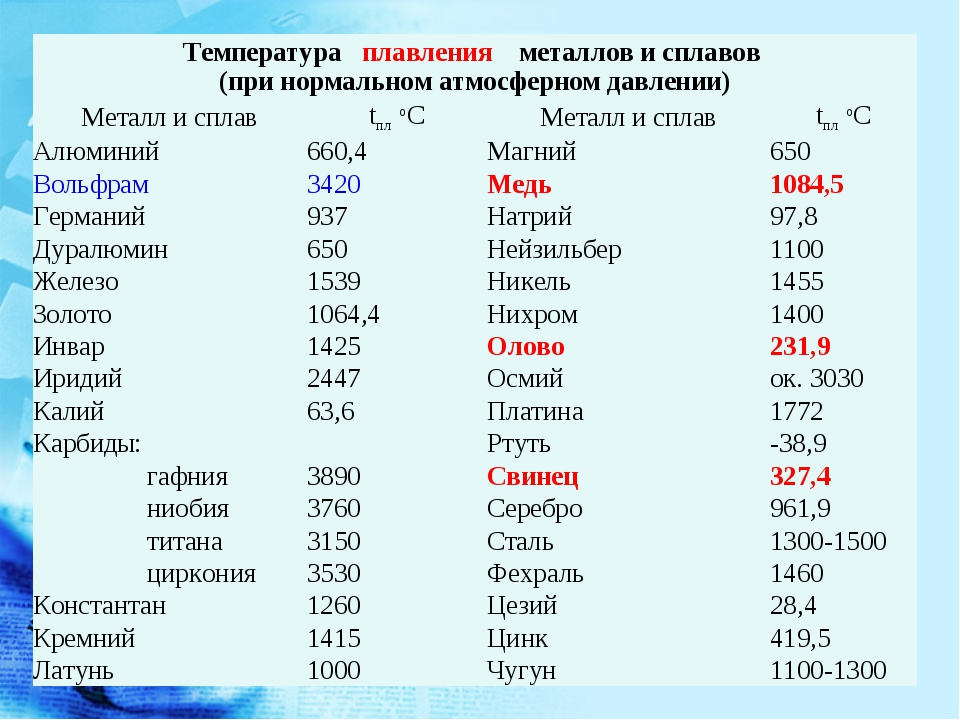
Первый шаг к ним сделал Фридрих Сименс, придумавший подавать в печь воздух, предварительно прошедший через систему труб и как следует прогретый. А завершил работу Пьер Мартен, который в 1860-х запатентовал процесс, позволявший расплавлять чугун, загружать его металлоломом или рудой — и получать сталь нужного качества и состава.
Первые мартеновские печи облицовывались по-старинке, денисовскими кирпичами, но вскоре их вытеснили более выносливые основные огнеупоры, получаемые из обожженного магнезита. Помимо прочего, они позволяли работать с большим спектром железных руд — и в 1880 г. на территории современной Польши была получена первая сталь, выплавленная в мартеновской печи с использованием магнезитовых огнеупоров.
В следующие десятилетия весь мир принялся осваивать внезапно ставший таким важным магнезит. Его добыча и производство из него огнеупорных изделий одно за другим начинаются в Австро-Венгрии, Германии, США, а около 1896 г. и на Урале было открыто огромное Саткинское месторождение. С началом нового века здесь открывается новый магнезитовый завод — впоследствии одно из передовых предприятий советской промышленности, а сегодня — ключевая часть компании «Магнезит», ведущего поставщика огнеупорных изделий для всей российской металлургии. Впрочем, это уже совсем другая история.
и на Урале было открыто огромное Саткинское месторождение. С началом нового века здесь открывается новый магнезитовый завод — впоследствии одно из передовых предприятий советской промышленности, а сегодня — ключевая часть компании «Магнезит», ведущего поставщика огнеупорных изделий для всей российской металлургии. Впрочем, это уже совсем другая история.
Железа не было, потому, что не хватало температуры для его плавки? | Огниво
Здравы будьте! Я очень благодарен Вам, что читаете мои размышления и помогаете найти ответы на вопросы.
В конце статьи буду себя разоблачать… 🙁
Эта статья написана в продолжении темы, ( вот эта статья) почему бронзовый век был раньше железного, если железо делать на порядок проще нежели бронзу. Это как сначала придумать компьютер а потом калькулятор уже. В комментариях, основным доводом, служит то, что для выплавки железа была необходима температура гораздо большая нежели для бронзы. А вот её обеспечить не могли. Я попробую доказать, что могли.
А вот её обеспечить не могли. Я попробую доказать, что могли.
Сыродутные печи. Фото из яндекс картинок
Температура выплавки бронзы порядка 950 градусов.(дописал — цитата — « Бронзы могут выплавляться при более низкой температуре, так как большинство примесей (мышьяк, сурьма, олово и др.) значительно понижают температуру плавления. Например, у бронзы с 20% мышьяка точка плавления почти на 400°С ниже, чем у чистой меди (1085°С)»». )
Я зацепился вот за цитату из википедии:
Восстановление железа (освобождение от кислорода) из болотных и озёрных руд начинается при температуре 400 °C, а при 700—800 °C получается так называемое губчатое железо. Специальные горнообразные печи — домницы —вмещали по 1,5-2 пуда руды. В древности их делали на возвышенных местах, чтобы использовать силу ветра для усиления горения.
Что же мы тут видим? Получить железо, да, зашлакованное и которое надо было кучу раз перековывать и всё-равно оно оставалось мягким, но это было железо, сырьё для которого валялось буквально под ногами, в отличии от меди и олова.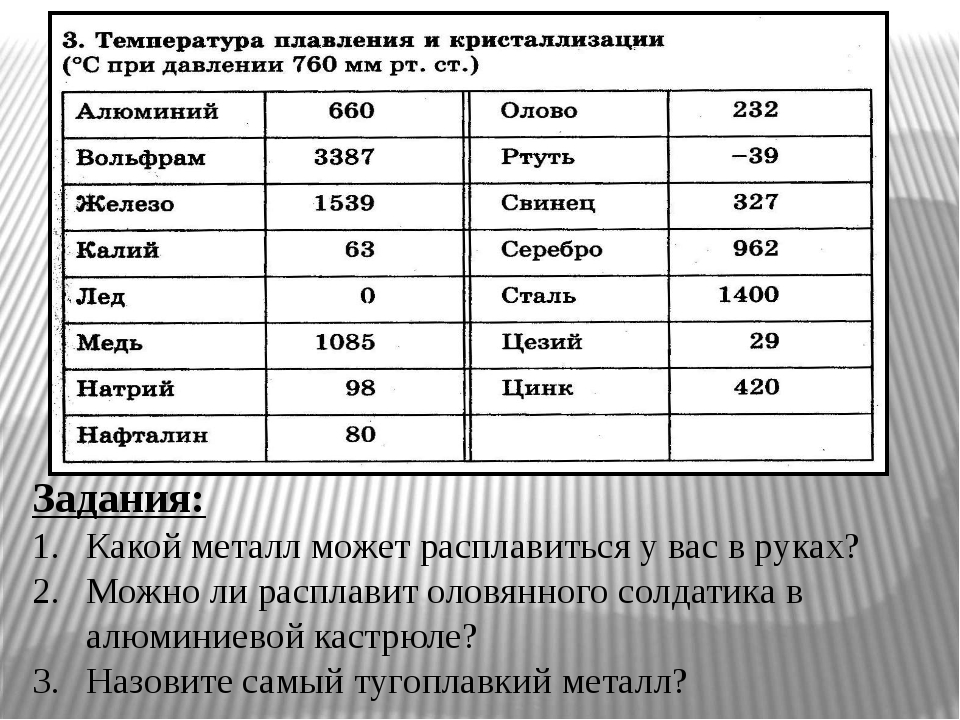
Крица — продукт из сыродутной печи.
Скажите процесс перековки очень муторный и тяжёлый? А я вот не поверю, чтоб люди придумавшие легировать медь оловом и не додумались к мельнице молот пристроить и ковать себе во здравие! вари эти крицы в каждом дворе -кидай под молоты- выбивай шлак!
Молот водяной мельницыМолот водяной мельницы
Дальше интересней. Что нужно, чтобы это губчатое железо стало резко улучшать своё качество? Правильно — нагреть до 900 градусов! При этой температуре углерод начинает «растворятся » в уастените.. мм. короче в железе том, что в печке — тем самым повышая его качество. Далее приведу цитату из статьи Цитата немного скучная, но для понимания процесса — важная. (взял тут — https://www.mednyobraz.ru/stat/5-drevnyayarus/97-metallurgiya-drevnej-rusi-i-rekonstrukcziya-drevnerusskogo-sposoba-vyplavki-zheleza.html)
То есть, стоило древним металлургам перейти через критическую черту в 900°С — и магическим образом все свойства получаемого ими железа стали улучшаться.Всё больше и больше углерода попадало из аустенита в перлит, в перлите росло количество цементита по отношению к ферриту, а само железо становилось всё лучше и лучше, превращаясь шаг за шагом в качественную углеродистую сталь.
Кроме того, дополнительные количества углерода позволяли радикально снижать температуру плавки и уходить от нужных раннее примесей-шлаков, которые использовались в кричном сыродутном процессе для снижения температуры плавки железа. Это отчётливо можно увидеть на первой диаграмме — если чистое железо плавится при 1535°С, то железо, содержащее около 4% углерода — уже при 1100°С.
Вот та диаграмма.
Люди!!! Человеки!! Я не технолог и мне не легко во всём этом разобраться, но получается, что получить чугун можно уже при 1100 градусах! А это всего на 150 градусов больше чем плавление бронзы! Следующий вопрос а зачем нам чугун? Так от чугуна до стали один шаг!
Но нам же надо было доказать, что дело не температурах, что бронзу плавили а железо нет! Что печек таких не было. Так? Так вот — были.
Так? Так вот — были.
Длинные выводы:
Считаю доказанным, что процесс плавления (получения) железа не сложнее процесса получения Бронзы. меди и их смешения для получения бронзы.
отступление.
Есть достойное мнение,из комментариев предыдущей статьи, что олово с медью не смешивали потом. Просто смешивали две руды медную и оловянную и плавили вместе — вот тебе и бронза. И вроде бы логично, но! Как определяли процент содержания меди в медной руде и олова в оловянной, чтоб в итоге получилась смесь в нужной пропорции меди и олова? Иначе выйдет не бронза а…ммм хреновая бронза. 🙂 🙂 А находки археологов говорят о весьма высоком качестве оной! Хотя могли и экспериментальным путём подбирать из каждой партии руд. Но это дикие трудозатраты. Да и перебирать тонны руд вручную для отделения олова ( а его в руде 02 -2%) это вам не это!
Ну и вот такая вот интересенка в качестве эпилога:
» Выплавка в сыродутной печи применялась в XII веке до н. э. Также отмечается использование железа при выплавке и изготовлении орудий и инструментов в 1200г до н.э. Уже в первом тысячелетии до н.э.
э. Также отмечается использование железа при выплавке и изготовлении орудий и инструментов в 1200г до н.э. Уже в первом тысячелетии до н.э.
использовалось кованое железо. Об обработке железа упоминается в первой книге Библии (Быт 4:22)». «В Китае чугунные изделия восходят к V веку до нашей эры, самые ранние доменные печи, производящие чугун в «Чушках» , который мог переплавляться в очищенный чугун , датируются III—II веками до нашей эры» Википедия. Напомню — бронзовый век закончился в 1200 году до н. э. Значит был чугун во времена Бронзовой эры. Был.
И неужели, если при перековке использовали меха, наши предки не заметили, что дутьё воздуха поднимает температуру и не дунули в фурму сыродутной печи мехом, чтоб поднять температуру плавления? Я бы дунул! ( я всё ещё про плавку металла сейчас. 🙂 ) Другое дело, что тогда получался чугун, а его перегонять в сталь якобы не умели и выкидывали. Но тут встаёт вопрос булата в первом веке до нашей эры… В общем загадок тьма.
В этой части, я несколько разоблачу себя на основе Ваших комментариев.
«Автор делает классическую ошибку — «бронзовый век» — это не век бронзы, а век, от которого можно обнаружить визуально-тактильно только бронзу. »
Да. Я согласен. Возможность получения железа в те времена — считаю доказанным этой статьёй. Действительно железные изделия могли просто не долежать.
Автор, почитайте. Вполне доступно.
https://elementy.ru/nauchno-populyarnaya_biblioteka/434789/Priznaki_drevnosti_kitayskikh_bronzovykh_splavov?utm_referrer=https%3A%2F%2Fzen.yandex.com
Прекрасная статья, и несмотря на вопросы, которые у меня возникли при её прочтении и допущения (сложность обработки и редкость минерала содержащего и медь и олово) в тексте,вполне можно сделать выводы, что бронза тех времен это не только медь и олова но и сплавы «случайных» металлов с медью.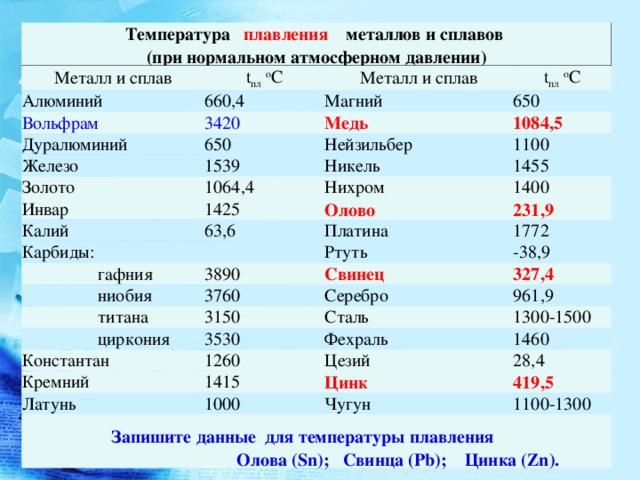 Однако так и остаётся, для меня загадкой, Как лили вот такие сосуды…и чем их обрабатывали. Если такую штуку начистить…Ух!! А сейчас так сделают?? 🙂
Однако так и остаётся, для меня загадкой, Как лили вот такие сосуды…и чем их обрабатывали. Если такую штуку начистить…Ух!! А сейчас так сделают?? 🙂
Благо дарю Вам. С уважением к Вашему мнению — Крес.
Предыдущая статья по этой теме — вот она
Приглашаю обсудить вопрос, как ещё наши предки могли выплавлять стекло и металлы без использования печей вообще! Плавильные зеркала!
Ещё я писал про:
Стоматология прошлого — как мотиватор жить сейчас. Поверьте, после просмотра Вы поймёте, что не так уж всё плохо…
Кирпичная цивилизация
Стекольная цивилизация
Бойницы китайской стены
Моноцикл — назад в будущее?
Асфальт из свиного дерь… навоза???
Зачем трактору пятое колесо.
Ну и темы никак не связанные с историей
Гравировка по стеклу своими руками — моё увлечение 🙂
Восстание из пепла — или как реально восстановить здоровье после 40лет личный опыт.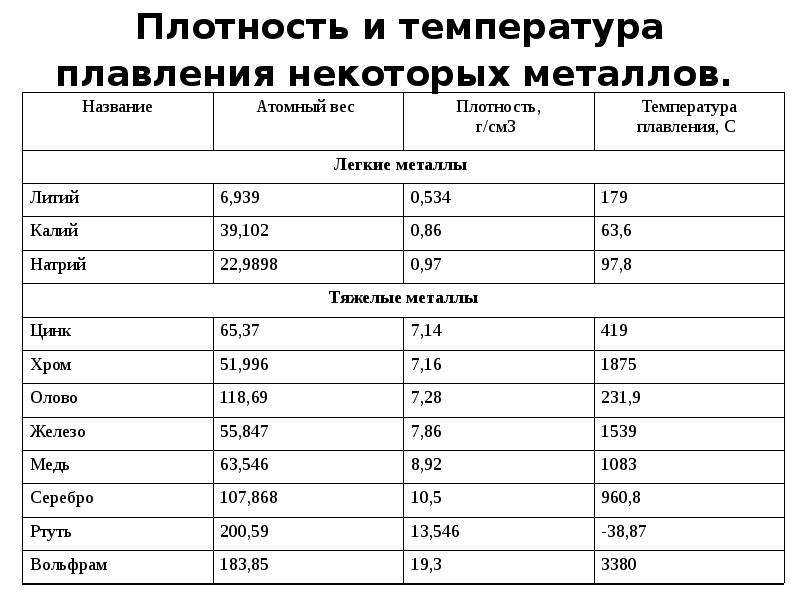 часть первая.
часть первая.
Прикольные конструкции велосипедных сидений. Так- поржать.
Урок 12. медь. цинк. титан. хром. железо. никель. платина — Химия — 11 класс
Химия, 11 класс
Урок № 12. Медь. Цинк. Титан. Хром. Железо. Никель. Платина
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению основных металлов побочной подгруппы или Б-группы: меди, цинка, титана, хрома, железа, никеля и платины, их физическим и химическим свойствам, способам получения и применению.
Глоссарий
Катализатор – вещество, которое ускоряет химическую реакцию.
Пассивация – переход металла в неактивное состояние из-за образования на его поверхности оксидной плёнки. Может усиливаться концентрированными кислотами.
Проскок электрона
– отступление от общей для большинства элементов последовательности заполнения электронных оболочек.Хромирование/никелирование – покрытие поверхности металла другим, более устойчивым, для предотвращения коррозии.
Цинковая обманка (ZnS) – сложно идентифицируемое соединение цинка, подверженное сильному влиянию примесей на ее внешний вид.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Медь
Электронная конфигурация
Медь является металлом, расположенным в I группе побочной подгруппе и имеет следующую электронную конфигурацию:
1s2
Рисунок 1 – Электронная конфигурация атома меди
Мы видим, что у меди наблюдается проскок электрона – отступление от общей для большинства элементов последовательности заполнения электронных оболочек. По принципу наименьшей энергии электронные орбитали должны заполняться в следующем порядке:
По принципу наименьшей энергии электронные орбитали должны заполняться в следующем порядке:
1s → 2s → 2p → 3s → 3p → 4s → 3d …
Но для некоторых атомов энергетически более выгодно иметь наполовину (5 электронов, дальше увидим у хрома) или полностью заполненную (10 электронов, как у меди) 3d-орбиталь.
Медь имеет две валентности: 1 и 2 и проявляет степени окисления +1 и +2.
Физические свойства
Медь обладает следующими физическими свойствами
Таблица 1 – Основные физические свойства меди
Свойство | Значение |
Цвет | Светло-розовый |
Структура | Тягучая, вязкая, легко прокатывается |
Температура плавления, °С | 1083 |
Нахождение в природе
В природе медь встречается в самородном виде, а также в составе некоторых минералов:
- медный блеск, Cu2S;
- куприт, Cu2O;
- медный колчедан, CuFeS;
- малахит, (CuOH)2CO3.

Способы получения меди
Основными способами получения меди являются:
- Восстановление коксом и оксидом углерода (II). Таким образом получают медь из куприта:
Cu2O + С = 2Сu + CO
Cu2O + CO = 2Cu + CO2
- Обжиг в специальных печах до оксидов. Данный способ подходит для сульфидных и карбонатных руд.
- Электролиз. Единственный из перечисленных способов, который позволяет получить медь без примесей.
Химические свойства
При комнатной температуре медь не вступает в реакции с большинством соединений. При повышенной температуре ее реакционная способность резко возрастает.
Реакции с простыми веществами:
2Cu + O2 = 2CuO
2Cu + Cl2 = 2CuCl2
Cu + S = CuS
Реакции со сложными веществами:
Cu + 2H2SO4(конц) = CuSO4 + SO2↑ +2H2O
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO↑ + 4H2O
Применение
Широкое применение находит как сама медь, так и её соединения. В чистом виде она используется для производства проводов, кабелей, теплообменных аппаратов, а также входит в состав многих сплавов.
В чистом виде она используется для производства проводов, кабелей, теплообменных аппаратов, а также входит в состав многих сплавов.
Соединения меди, например, медный купорос CuSO4∙5H2O используется для защиты растений, а гидроксид меди является качественным реагентом для определения альдегидной группы у органических соединений, а также наличия глицерина (дает голубое окрашивание раствора).
Цинк
Электронная конфигурация
Цинк является металлом, расположенным в II группе побочной подгруппе, и имеет следующую электронную конфигурацию:
Рисунок 2 – Электронная конфигурация атома цинка
В связи с тем, что 4s-орбиталь заполнена, цинк может находиться в единственной степени окисления, равной +2.
Физические свойства
Цинк обладает следующими физическими свойствами
Таблица 2 – Основные физические свойства цинка
Свойство | Значение |
Цвет | Голубовато-серебристый |
Структура | Хрупок |
Температура плавления, °С | 419,5 |
Нахождение в природе
В природе цинк встречается только в связанном состоянии, а именно в цинковом шпате ZnCO3 и цинковой обманке ZnS. Свое название цинковая обманка получила за то, что его сложно идентифицировать, поскольку он может выглядеть совершенно по-разному: быть различного цвета и структуры в зависимости от посторонних примесей.
Свое название цинковая обманка получила за то, что его сложно идентифицировать, поскольку он может выглядеть совершенно по-разному: быть различного цвета и структуры в зависимости от посторонних примесей.
Способы получения цинка
Чистый цинк получают обжигом с последующим восстановлением:
ZnS + O2 = ZnO + SO2↑
ZnO + C = Zn + CO↑
Химические свойства
Цинк является довольно устойчивым металлом, поскольку на воздухе покрывается оксидной пленкой, и в дополнение практически не взаимодействует с водой при нормальных условиях. Но так же, как и медь, становится более активным при повышении температуры.
Реакции с простыми веществами:
2Zn + O2 = 2ZnO
2Zn + Cl2 = 2ZnCl2
Zn + S = ZnS
Реакции со сложными веществами:
Zn + 2NaOH(крист) = NaZnO2 + H2↑
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Применение
Цинк является коррозионно-устойчивым металлом, поэтому он нашёл применение в производстве защитных покрытий металлов, гальванических элементов, а также как компонент сплавов.
Титан
Электронная конфигурация
Титан является элементом IV группы побочной подгруппы и имеет следующее электронное строение:
Рисунок 3 – Электронная конфигурация атома титана
Данная конфигурация позволяет атому титана проявлять две степени окисления: +2 и +4.
Физические свойства
Титан обладает следующими физическими свойствами:
Таблица 3 – Основные физические свойства титана
Свойство | Значение |
Цвет | Серебристо-белый |
Структура | Высокая прочность и взякость |
Температура плавления, °С | 1665 |
Нахождение в природе
В природе титан можно найти в составе таких минералов, как:
- титаномагнетит, FeTiO3∙Fe3O4;
- ильменит, FeTiO3;
- рутил, TiO2.
Способы получения титана
В связи с тем, что в природе не существует титановых руд, человеку приходится извлекать его путём хлорирования рудных концентратов с их последующим восстановлением с помощью магния или натрия.
TiCl4 + 2Mg = Ti + 2MgCl2
Для удаления примесей магния и его соли полученную смесь продуктов нагревают под вакуумом.
Химические свойства
Титан является очень активным металлом, но его оксидная пленка не даёт ему взаимодействовать при нормальных условиях ни с морской водой, ни даже с «царской водкой». Поэтому все реакции протекают при повышенных температурах.
Реакции с простыми веществами:
Ti + 2Cl2 = TiCl4
Ti + O2 = TiO2
Азотная кислота действует на титан только в форме порошка, в то время как разбавленная серная кислота реагирует с металлом:
2Ti + 3H2SO4 = Ti2(SO4)3 + 3H2↑
Применение
Титан и его сплавы отличает не только коррозионная стойкость, но и лёгкость, прочность. В связи с этим он активно используется при построении космических ракет, самолётов, подлодок и морских судов. Титан не взаимодействует с тканями организмов, из-за чего используется в хирургии.
Хром
Электронная конфигурация
Хром находится в IV группе побочной подгруппе и имеет следующее электронное строение:
Рисунок 4 – Электронная конфигурация атома хрома
Так как для атома хрома энергетически более выгодно иметь наполовину заполненную 3d-орбиталь, у него, как и у меди, наблюдается проскок электрона, что позволяет ему находиться в степенях окисления от +1 до +6, но наиболее устойчивыми являются +2, +3, +6.
Физические свойства
Хром обладает следующими физическими свойствами:
Таблица 4 – Основные физические свойства хрома
Свойство | Значение |
Цвет | Серебристо-белый с металлическим блеском |
Структура | Твердый |
Температура плавления, °С | 1890 |
Нахождение в природе
В природе большая часть хрома заключена в составе хромистого железняка Fe(CrO2)2. Иногда может встречаться в виде оксида хрома (III) и других соединениях.
Иногда может встречаться в виде оксида хрома (III) и других соединениях.
Способы получения хрома
Из хромистого железняка путем восстановлением углем при высоких температурах получают смесь железа и хрома – феррохром:
FeO + Cr2O3 + 3C = Fe + 2Cr + 3CO↑
Для получения чистого хрома проводят восстановление оксида хрома (III) алюминием:
Cr2O3 + 2Al = 2Cr + Al2O3
Химические свойства
Как и все вышеописанные металлы, хром покрыт оксидной плёнкой, которую трудно растворить даже сильными кислотами. Благодаря ней он обладает высокой стойкости к коррозии, поэтому начинает реагировать с разбавленными растворами кислот лишь спустя время. Концентрированные кислоты, такие как HNO3 и H2SO4, пассивируют оксидную пленку (укрепляют ее).
Применение
Благодаря своей коррозионной стойкости, хром используют в качестве защитных покрытий (хромируют поверхности металлов и сплавов). Также используется для создания легированных сталей, речь о которых пойдет в следующем уроке.
Также используется для создания легированных сталей, речь о которых пойдет в следующем уроке.
Железо
Железо – металл, с которым мы чаще всего сталкиваемся в нашей жизни, поэтому переоценить его значимость для человека невозможно. Он является самым распространенным после алюминия и составляет 5% земной коры. Теперь перейдем к рассмотрению его строения и свойств.
Электронная конфигурация
Железо находится в VII группе Б-подгруппе и имеет такое электронное строение, которое позволяет ему находиться в двух степенях окисления: +2 и +3. Конечно, в теории железо может выступать в качестве шестивалентного металла, но из-за пространственных затруднений ему не удается образовать такое количество связей. Поэтому такое состояние является неустойчивым для данного металла.
Рисунок 5 – Электронная конфигурация атома железа
Физические свойства
Железо обладает следующими физическими свойствами:
Таблица 5 – Основные физические свойства железа
Свойство | Значение |
Цвет | Серебристо-белый |
Структура | Мягкий, пластичный |
Температура плавления, °С | 1539 |
Нахождение в природе
Встречается железо в виде различных соединений: оксидов, сульфидов, силикатов.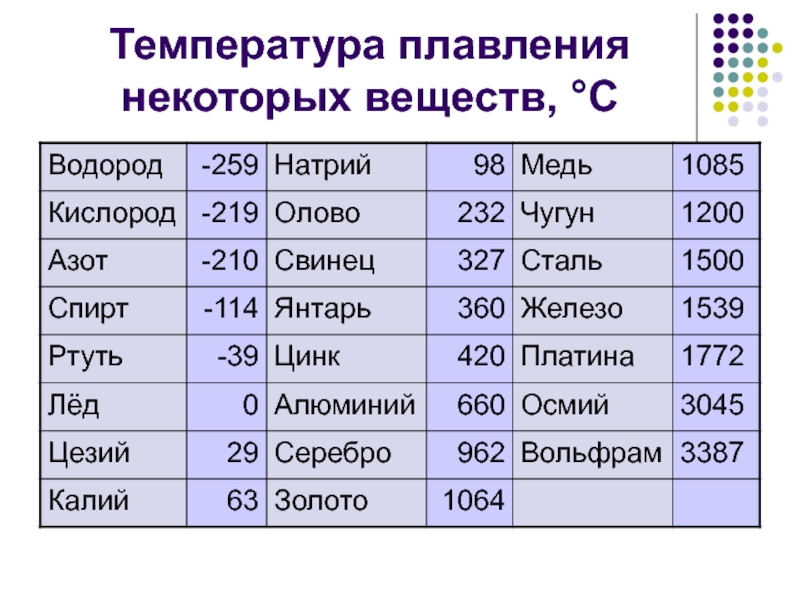 В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.
В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.
Способы получения железа
Существует множество способов получения железа, и отличаются они друг от друга степенью его чистоты и требуемым типом конечного продукта.
- Восстановлением из оксидов (железо пирофорное).
- Электролизом водных растворов его солей (железо электролитическое).
- Разложением пентакарбонила железа Fe(CO)5 при нагревании до t 250°С.
- Методом зонной плавки (получение особо чистого железа).
- Технически чистое железо (около 0,16% примесей углерода, кремния, марганца, фосфора, серы и др.) выплавляют, окисляя компоненты чугуна в мартеновских сталеплавильных печах и в кислородных конверторах.
- Сварочное или кирпичное железо получают, окисляя примеси малоуглеродистой стали железным шлаком или путём восстановления руд твёрдым углеродом.
Химические свойства
Под воздействием высоких температур железо взаимодействует с простыми веществами:
2Fe + 3O2 = Fe2O3 ∙FeO
В ходе данной реакции происходит получение смеси оксидов, которую иногда записывают в виде общей формулы Fe3O4.
2Fe + 3Cl2 = 2FeCl3
Fe + S = FeS
Взаимодействует с разбавленными кислотами, причем с соляной кислотой происходит образование соли только двухвалентного железа:
Fe + 2HCl(разб) = FeCl2 + H2↑
При комнатной температуре железо пассивируется концентрированными кислотами, но при высоких температурах вступает в реакцию окисления:
2Fe + 6H2SO4(конц) = Fe2(SO4)3 + 3SO2 + 6H2O
Вступает в реакцию обмена с солями, образованными катионами более слабых металлов:
Fe + CuSO4 = FeSO4 + Cu↓
Применение
Про области применения железа можно говорить достаточно долго, поэтому выделим основные направления:
- В связи с его способностью быстро намагничиваться, его используют в трансформаторах и электромоторах.
- Основная масса железа расходуется на производство различных сплавов, таких как чугун и сталь.

Никель и платина
Далее стоит обратить на два металла: никель и платина. Как нам известно, они имеют схожие области применения, но отличаются по цене и качеству, потому предлагаю сравнить их.
Электронная конфигурация
Электронное строение металлов выглядит следующим образом:
Ni …3s2 3p6 3d8 4s2
Характерные степени окисления: + 2 и +3, но последняя является неустойчивой.
Pt …5s2 5p6 5d9 6s1
Характерные степени окисления: + 2 и +4.
Физические свойства
Таблица 5 – Основные физические свойства железа
Свойство | Значение | |
Ni | Pt | |
Цвет | Серебристо-белый | Белый |
Структура | Очень твердый | Пластичный |
Температура плавления, °С | 1453 | 1769 |
Химические свойства
Никель при повышенных температурах реагирует с галогенами с образованием солей, и с кислородом с образованием оксида никеля (II), в то время как платина очень устойчива к любым взаимодействиям. Реагирует с серой и галогенами в мелкораздробленном виде.
Реагирует с серой и галогенами в мелкораздробленном виде.
Никель медленно взаимодействует с разбавленными кислотами, когда платина реагирует только с «царской водкой».
Применение
Оба металла активно используются в переработке нефти в качестве катализаторов.
Катализатор – вещество, которое ускоряет химическую реакцию.
Каждые 2-3 года закупаются тонны реагентов, в составе которых всего несколько десятых процента платины или никеля, но именно они определяют их стоимость.
Также они используются в составе высококачественных сплавов, а никель – как антикоррозионное покрытие.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи на вычисление количества исходного реагента.
Условие задачи: При растворении меди в растворе концентрированной азотной кислоты выделилось 2 л газа. Вычислите массу прореагировавшей меди.
Шаг первый. Напишем уравнение реакции и определим, какой газ выделился, расставим коэффициенты.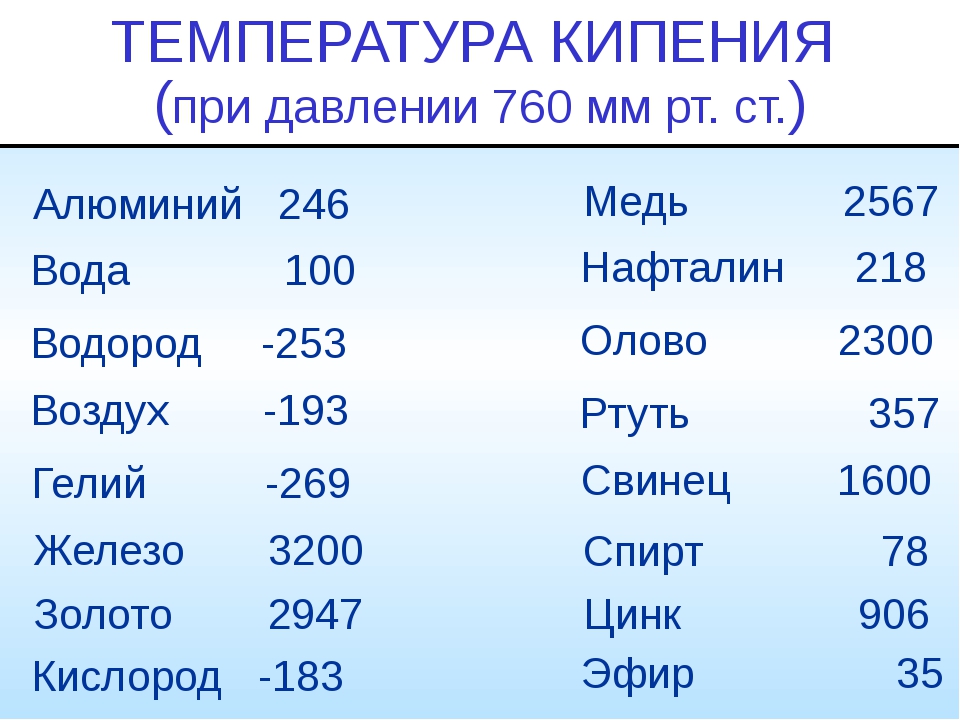
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2↑ + 2H2O
Шаг второй. Вычислим количество вещества газа:
Шаг третий. Вычислим количество вещества меди:
По уравнению реакции: n(Cu) = 0,5n(NO2), тогда
n(Cu) = 0,5 ∙ 0,089 = 0,044 (моль)
Шаг четвёртый. Вычислим массу меди:
m(Cu) = 0,044 ∙ 46 = 2,024 (г)
Ответ: 2,024 (г).
- Решение задачи на выход продукта.
Условия задачи: при обжиге 8,515 г сульфида цинка с последующим восстановлением оксида с помощью угля выделилось 3,45 л газа. Рассчитайте выход реакции обжига, если выход реакции восстановления равен 60%.
Шаг первый. Запишем уравнения реакций и вычислим молярные массы компонентов:
ZnS + O2 = ZnO + SO2↑
ZnO + C = Zn + CO↑
M (ZnO) = 81 г/моль
Шаг второй. Вычислим количество вещества газа:
Шаг третий. Вычислим массу оксида цинка:
Так как выход реакции составил 60%, то
n (ZnO) = 0,6n (CO) = 0,6 ∙ 0,154 = 0,0924 (моль)
Шаг четвёртый.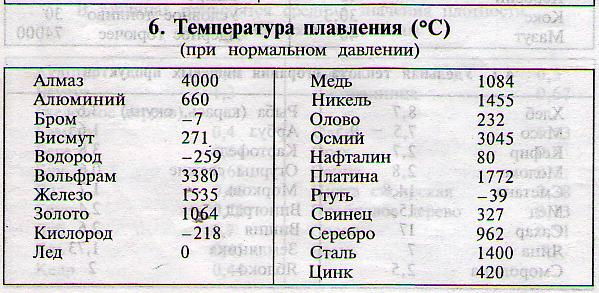 Вычислим массу оксида цинка:
Вычислим массу оксида цинка:
Шаг пятый. Вычислим выход реакции:
Ответ: 87, 89%.
Европейская металлургия от костра до мартена / Хабр
На протяжении всей истории человечества образ хозяйствования нашей цивилизации определяли металлы. Вообще говоря, все первые металлы, открытые человечеством, стоят правее водорода в электрохимическом ряду напряжений металлов. Это так просто потому, что все остальные по закону неумолимой термодинамики будут окислены во влажных и окислительных условиях атмосферы и литосферы. Точнее говоря, те, что правее водорода, тоже будут окислены – но сильно позже. А пока что встречайте: медь, серебро, золото, сурьма!
Справа все интересующие нас металлы, а заодно ртуть и платина. Не влезли палладий и висмут, но они встречаются реже метеоритов
Все эти элементы при определенной доле удачи могут быть встречены в самородном виде – неслыханное счастье для тех, кому до того предстояло пользоваться каменными орудиями труда.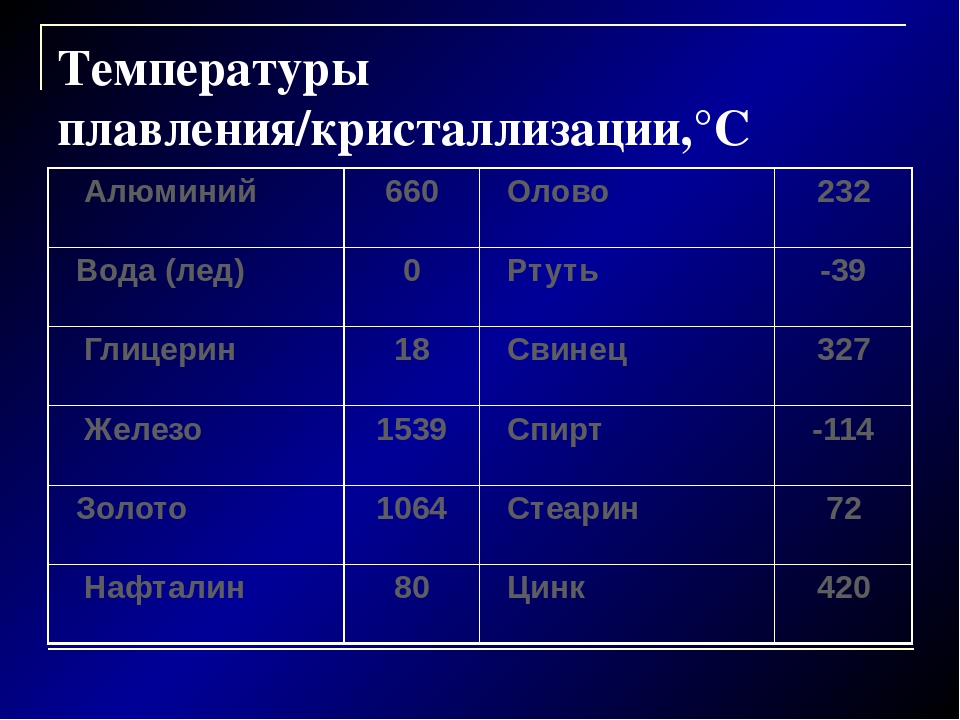 Металлу можно придавать почти любую форму, он не раскалывается, а деформируется при ударах, а еще его можно затачивать и делать качественно лучшие орудия труда. Золото, серебро и медь уже к позднему неолиту вовсю использовались для изготовления украшений, а в 6 тысячелетию человечество открыло для себя медные инструменты. Однако самым лучшим доступным металлом было, конечно, железо. Для того, чтобы найти его в чистом виде, нужно поистине дьявольское везение – оно встречается только в упавших метеоритах и является настоящей царской прерогативой (так, кинжал из гробницы Тутанхамона сделан именно из такого железа).
Металлу можно придавать почти любую форму, он не раскалывается, а деформируется при ударах, а еще его можно затачивать и делать качественно лучшие орудия труда. Золото, серебро и медь уже к позднему неолиту вовсю использовались для изготовления украшений, а в 6 тысячелетию человечество открыло для себя медные инструменты. Однако самым лучшим доступным металлом было, конечно, железо. Для того, чтобы найти его в чистом виде, нужно поистине дьявольское везение – оно встречается только в упавших метеоритах и является настоящей царской прерогативой (так, кинжал из гробницы Тутанхамона сделан именно из такого железа).
Новую веху в истории обработки металлов ознаменовала восстановительная металлургия. Люди открыли, что, если спекать некоторые минералы с углем, в камешках получившегося шлака заблестят кусочки меди. Это позволило человечеству перейти на небывало высокий по сравнению с неолитом уровень технологий. Новые медные инструменты и так были на порядок лучше каменных, но теперь они стали по-настоящему доступны. Вскоре появились первые печи для плавки меди, которые, например, можно найти в древних городах Анатолии. Так, первое найденное литое изделие датируется 5000 г. до н. э.
Вскоре появились первые печи для плавки меди, которые, например, можно найти в древних городах Анатолии. Так, первое найденное литое изделие датируется 5000 г. до н. э.
диаграмма Эллингема
Теперь сделаем небольшое отступление обратно к современности и обратим свои взоры на диаграмму Эллингема. Эта диаграмма показывает нам, насколько при разных температурах стабильны различные оксиды. Также она позволяет легко определить, восстановит ли углерод или угарный газ нужный оксид до металла при данной температуре – для этого всего лишь нужно посмотреть, в какой точке линия С и СО становится ниже линии соответствующего металла. Из нее можно понять, например, что даже при небольшом нагревании и углеродом, и угарным газом медь восстановится со свистом, а вот чтобы восстановить железо, придется хорошенько постараться (но все же меньше, чем для многих других металлов).
Проблема состоит не только в этом. Мало просто восстановить металл, необходимо его еще и расплавить, иначе вместо слитка, которому можно придать любую форму, получится просто серый (в случае железа) или красный (в случае меди) порошок. Поэтому для эффективного изготовления железных изделий нужна такая печь, которая сможет расплавить железо. Однако построить ее не так-то просто, первые железоделательные печи появились на территории той же Анатолии у хеттов примерно к 1200 г. до н. э. До этого человечество обходилось медью или бронзой – сплавом меди с мышьяком или оловом (бронза была попрочнее меди, дольше изнашивалась и плавилась при меньшей температуре).
Поэтому для эффективного изготовления железных изделий нужна такая печь, которая сможет расплавить железо. Однако построить ее не так-то просто, первые железоделательные печи появились на территории той же Анатолии у хеттов примерно к 1200 г. до н. э. До этого человечество обходилось медью или бронзой – сплавом меди с мышьяком или оловом (бронза была попрочнее меди, дольше изнашивалась и плавилась при меньшей температуре).
Сыродутная печь
Такие требования сформировали облик европейской железной металлургии на многие века. Схема печи оставалась общей: высокая глиняная/земляная труба, в которой вперемежку уложены слои железной руды (как правило, болотной бурой слизи или каменной руды) и древесный уголь. Все это мероприятие было крайне малопрофитным в смысле целевого продукта, в железо превращалось около 30% руды в лучшем случае. Несмотря на это, железные орудия были на порядок выгоднее орудия из любого другого металла, доступного европейцам, из-за не в пример большего качества.
Описанный выше способ выплавки железа назывался сыродутным. Получившийся кусок железа содержал крайне большое количество шлаков, поэтому его проковывали большое количество раз. При этом получившееся железо обладало существенным недостатком. При получении оно было крайне твердым и незатачиваемым (так как содержало большое количество углерода), а при дальнейшем выгорании – очень мягким. Поэтому единственным способом получить нормальное, функциональное изделие было сваривание нескольких пакетов железа методом проковки сложенных слоев железа, просыпанных между собой бурой. Усовершенствовав технологи многократной проковки заготовки до предела и чередуя мягкие и твердые слои железа, человечество научилось изготавливать булатную сталь – один из лучших видов металлургической продукции своего времени.
Одним из основных шлаков в металлургическом производстве Средневековья был чугун. Он выплавлялся из руды раньше всех, потому что в нем больше углерода, а, чем больше в каком-либо твердом веществе примеси, тем ниже его температура плавления. Также чугун крайне хрупок и тяжел, что затрудняло его применение в металлургии. Довольно большая часть железа всегда уходила в шлаки в виде чугуна, откуда его было уже не выдернуть. В больших по размеру печах (штукофенах и блауофенах) с четырех-пятиметровыми «резервуарами» для руды и угля в чугун и шлак уходило просто огромное количество железа. Обычно из чугуна потом изготавливали низкотехнологические изделия типа кувалд, ядер и прочего. Забавный факт – и по сей день шлаки металлургического производства используются в дорожном строительстве как материал для брусчатки.
Также чугун крайне хрупок и тяжел, что затрудняло его применение в металлургии. Довольно большая часть железа всегда уходила в шлаки в виде чугуна, откуда его было уже не выдернуть. В больших по размеру печах (штукофенах и блауофенах) с четырех-пятиметровыми «резервуарами» для руды и угля в чугун и шлак уходило просто огромное количество железа. Обычно из чугуна потом изготавливали низкотехнологические изделия типа кувалд, ядер и прочего. Забавный факт – и по сей день шлаки металлургического производства используются в дорожном строительстве как материал для брусчатки.
Схема современной доменной печи
Следующей вехой развития железного производства стали доменные печи. Человечество догадалось, что, если печь сделать достаточно большой, можно будет подбрасывать в нее уголь и руду прямо в процессе плавки, а железо, сталь, чугун и шлаки сливать из нее через отдельные летки. Этот процесс в 15-16 вв. стал очередным технологическим бумом для Европы – несмотря на то, что доменную печь нельзя было останавливать, а угля и руды она жрала абсолютно непомерное количество, она позволила европейцам превзойти весь мир по выплавке металла на душу населения, а, следовательно, по артиллерийской мощи.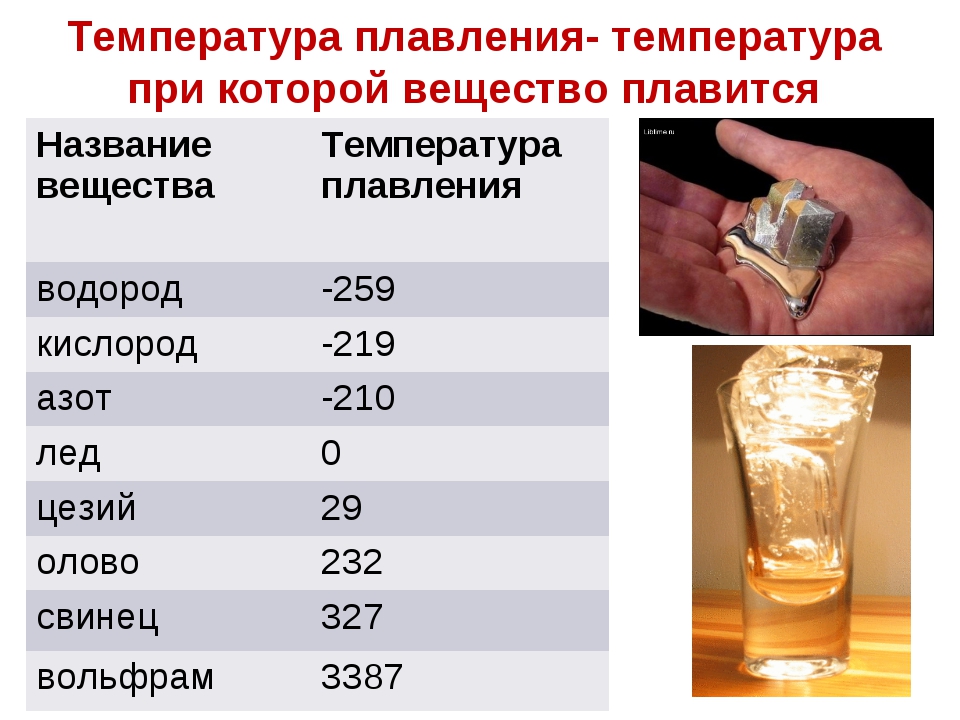
С учетом роста населения и постоянно растущего спроса на железо его производство на душу населения в 11-13 вв. достигало порядка килограмма на человека в год. Для сравнения – современный небольшой ножик весит порядка 200 граммов, лезвие небольшого топора – около 700 граммов, а ведь еще нужно на чем-то готовить, чем-то строить, опять же всяческие метизы типа гвоздей, скоб, крюков и прочего. В итоге мы понимаем, что уровень сыродутной металлургии даже с учетом перекрытия некоторых потребностей другими металлами давал ужасающе мало.
Ситуация менялась, как ни парадоксально, с увеличением количества металлических изделий – можно было срубать больше деревьев, прокапывать более глубокие шахты, возводить более сложные конструкции. Производство росло в геометрической прогрессии – размер печей для выплавки железа все увеличивался, увеличивался от простой сыродутной печи к штукофену и блауофену и наконец-то вырос до настоящей домны с непрерывным циклом выплавки. И тут понеслась – положительная обратная связь сделала свое дело.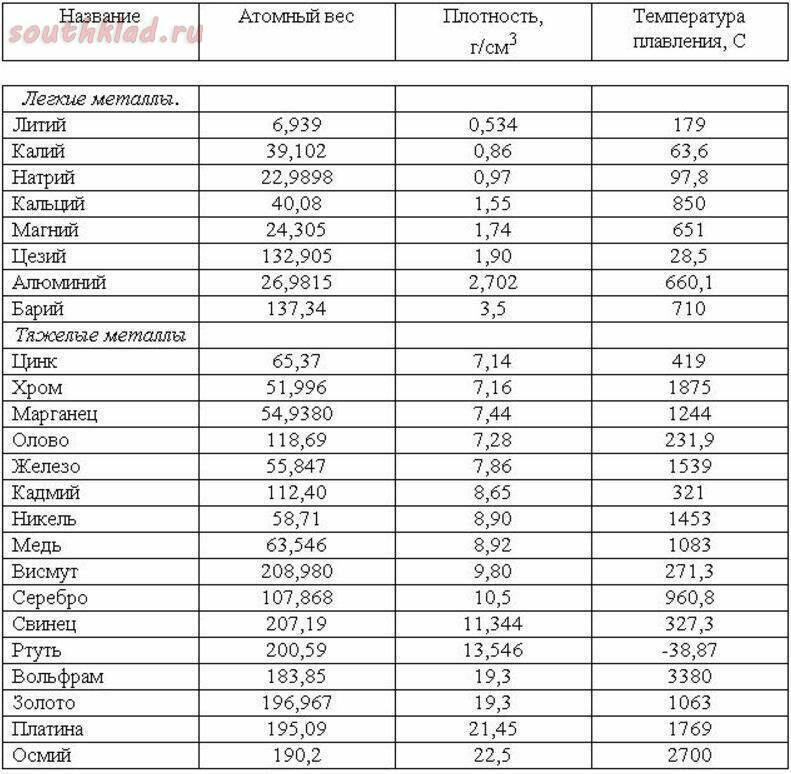
Всеевропейское внедрение в 15-16 веках доменной печи сразу, буквально за несколько десятилетий, увеличило количество производимого на душу населения железа втрое, а то и вчетверо. Нашей цивилизации впервые стали по-настоящему доступны каменные железные руды. Забегая вперед, скажу, что в Швеции, стране, которая на тот момент поставляла больше половины всего европейского железа, к 18 веку производство достигло невероятных 20 кг железа на человека. Впрочем, до обогащения и прочих технологических процессов мы пока еще не дошли – пока что это просто загрузка печи камнями руды, углем и флюсом – специальным веществом, чтобы снизить количество примесей в плаве и уменьшить температуру плавления.
Проблемой доменного производства была необходимость в огромном количестве качественного древесного угля – каменный уголь содержал много вредных для железа примесей, поэтому деревья приходилось вырубать в огромных масштабах. Об экологии тогда никто не заботился, но бескрайние леса были, очевидно, не во всех странах.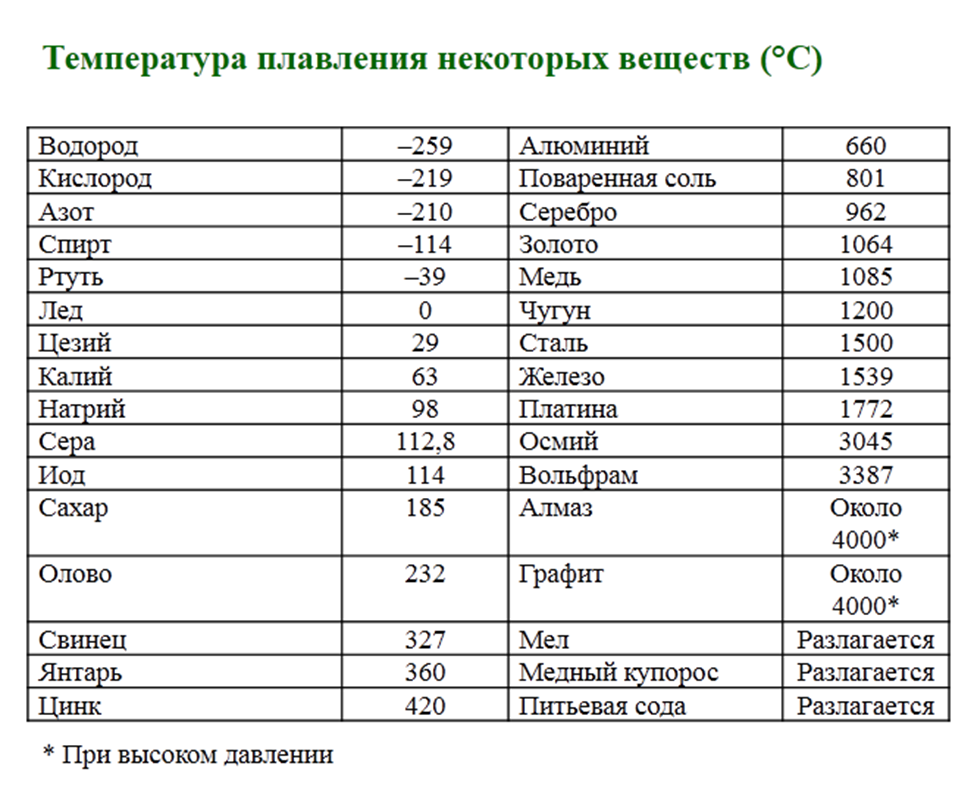 Также откровенным минусом все еще был уход огромного количества железа в чугун, хрупкий и потому не годный для создания инструментов и метизов. Единственной масштабной отраслью применения чугуна было артиллерийское дело – на отливку пушек и ядер шли многие тонны чугуна. И вот тут человечество сделало пока чисто эмпирическое, но очень важное открытие – из чугуна при высокой температуре может выгорать углерод. Естественно, ни о каком углероде речь тогда не шла, но этот факт позволил железоделательному производству перейти еще на один технологический уровень выше.
Также откровенным минусом все еще был уход огромного количества железа в чугун, хрупкий и потому не годный для создания инструментов и метизов. Единственной масштабной отраслью применения чугуна было артиллерийское дело – на отливку пушек и ядер шли многие тонны чугуна. И вот тут человечество сделало пока чисто эмпирическое, но очень важное открытие – из чугуна при высокой температуре может выгорать углерод. Естественно, ни о каком углероде речь тогда не шла, но этот факт позволил железоделательному производству перейти еще на один технологический уровень выше.
Все помнят, как в морозилке замерзает соленая вода? Образуется большая ледышка, самого рассола становится меньше, концентрация соли в нем растет. Похожий процесс происходит и при плавлении чугуна на воздухе. Углерод из него частично выгорает, частично переходит в жидкую фазу, а на дне печи начинают образовываться кристаллы железа. Это явление заметил английский металлург Генри Корт, и вскоре практика пудлингования – перемешивания расплава чугуна вошла в Британии в крайне широкое распространение.
Печь для пудлингования. 1) Под 2) Труба с клапаном для регулирования силы тяги 3) Порог, отделяющий металл в рабочем объёме от топлива 4) Колосниковая решётка, на которой находится горящее топливо (уголь) 5) Боковое окно для пудлинговщика 6) Окно для заброса топлива
Как происходило пудлингование? Сначала в печи, обложенной огнеупорной футеровкой (отделка печи, позволяющая оградить тело печи от разрушительного влияния расплавов) без доступа открытого пламени расплавлялся чугун. По прошествии некоторого времени рабочие засовывали в расплав огромные железные штанги (около 40 килограммов весом) и начинали интенсивно перемешивать его. Вскоре на штангах выкристаллизовывалось чистое железо, температура плавления которого намного выше, чем у чугуна. Далее получившуюся крицу вынимали из расплава, проковывали и разделяли на слитки.
Естественно, процесс этот был далеко не из самых легких, однако он позволил высвободить для промышленности огромное количество чистого железа и разом решить проблему переизбытка чугуна.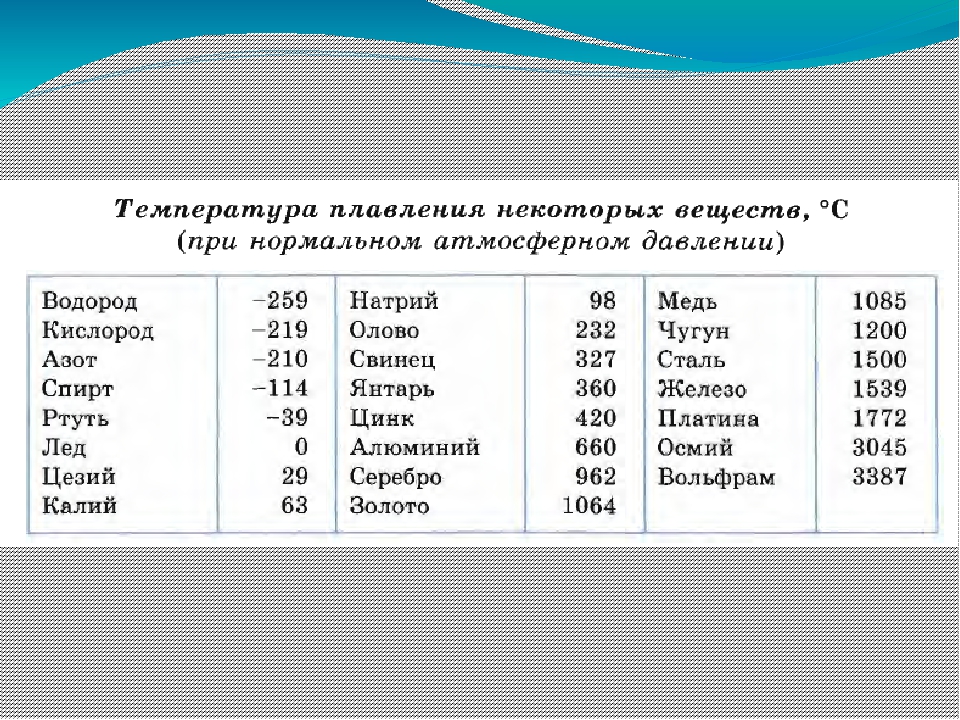 Процесс пудлингования доминировал в металлургии на протяжении практически ста лет, после чего был вытеснен сразу тремя способами – бессемеровским (открытым Генри Бессемером в 1856 году), томасовским (открытым в 1878 году Сидни Гилкристом Томасом) и мартеновским.
Процесс пудлингования доминировал в металлургии на протяжении практически ста лет, после чего был вытеснен сразу тремя способами – бессемеровским (открытым Генри Бессемером в 1856 году), томасовским (открытым в 1878 году Сидни Гилкристом Томасом) и мартеновским.
Принцип работы любого конвертера
Бессемеровский и томасовский процессы довольно схожи. В качестве основного реактора используется веретенообразная печь с огнеупорной футеровкой (в случае бессемеровского процесса – кислой, содержащей SiO2, в случае томасовского – основной, содержащей доломит CaCO3xMgCO3). В процессе плавки печь нагревается, опять же, без доступа открытого пламени, после чего продувается сжатым воздухом через сопла, расположенные в дне печи. Расплав поддерживается в горячем состоянии из-за процесса окисления примесей руды, проходящего с выделением температуры. Далее полученное железо подвергается дополнительному науглероживанию с образованием стали. Основное отличие двух способов состоит в химическом составе плава.
В томасовском процессе могут быть использованы загрязненные серой и фосфором руды – продукты окисления фосфора и серы связываются материалом футеровки, давая окисляющий железо углекислый газ. У этого способа есть недостаток – фосфор и сера удаляются из плава не в полном объеме, поэтому железо получается более ломким. В бессемеровском же процесса футеровка печи не позволяет использовать основные флюсы, что делает его более требовательным к качеству руды. Однако этот способ дает более качественное железо, что и определило его производственное преимущество в долгосрочной перспективе.
Настало время сказать несколько слов и про мартеновский процесс. Он был открыт в 1864 году французским инженером Пьером Мартеном. Основное его отличие от бессемеровского и томасовского способов состоит в том, что газообразное топливо (обычно природный газ или коксовый газ) подаются прямо в зону плавки, где расплавляют чугун и одновременно окисляют его. Мартеновский процесс получил особенно широкое распространение в качестве способа передельной металлургии, которая использует для выплавки новой стали железный лом.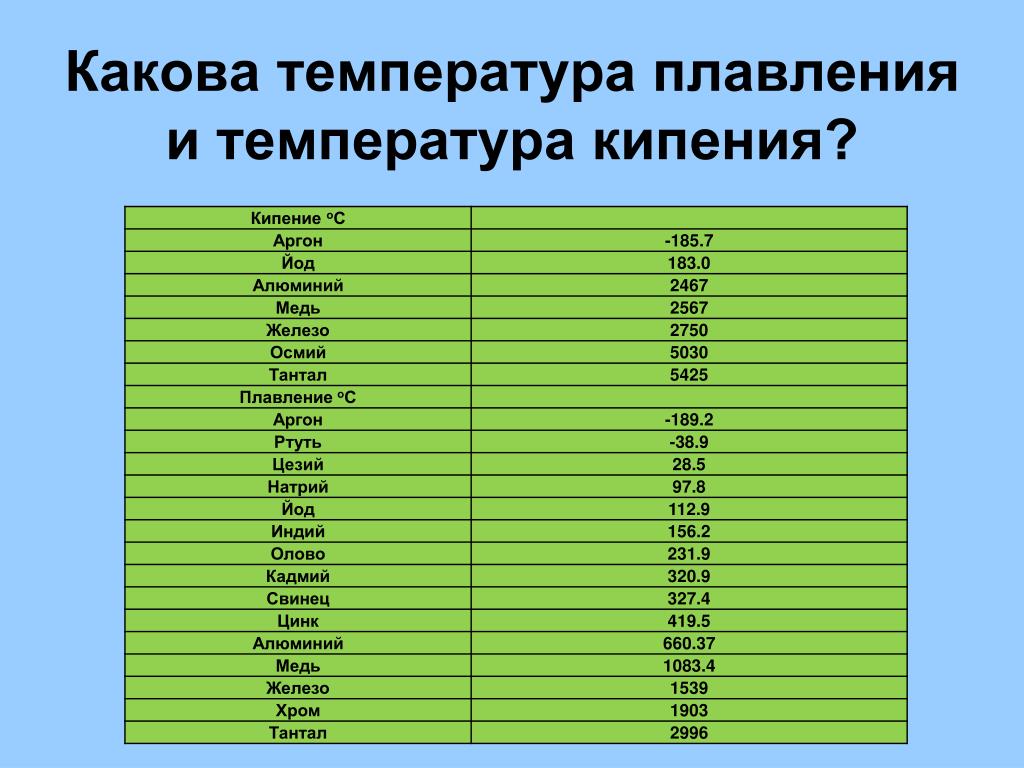
Сейчас практически все процессы старины глубокой (кроме доменной выплавки, конечно) уже ушли в прошлое. Их заместили новые гиганты – конвертерно-кислородный (переиначенный бессемеровский) и электродуговой способы выплавки стали. Однако история их, как мне кажется, довольно увлекательна, чтобы помнить ее и интересоваться ей.
Божественно прекрасный томасовский конвертер
Автор: Павел Ильчук
VPS
серверы от Маклауд быстрые и безопасные.
Зарегистрируйтесь по ссылке выше или кликнув на баннер и получите 10% скидку на первый месяц аренды сервера любой конфигурации!
таблица по возрастанию в градусах, самая высокая температура плавления
Таблица температур плавления
Узнать какая нужна температура для плавления металлов, поможет таблица по возрастанию температурных показателей.
| Элемент или соединение | Необходимый температурный режим |
| Литий | +18°С |
| Калий | +63,6°С |
| Индий | +156,6°С |
| Олово | +232°С |
| Таллий | +304°С |
| Кадмий | +321°С |
| Свинец | +327°С |
| Цинк | +420°С |
Таблица плавления среднеплавких металлов и сплавов.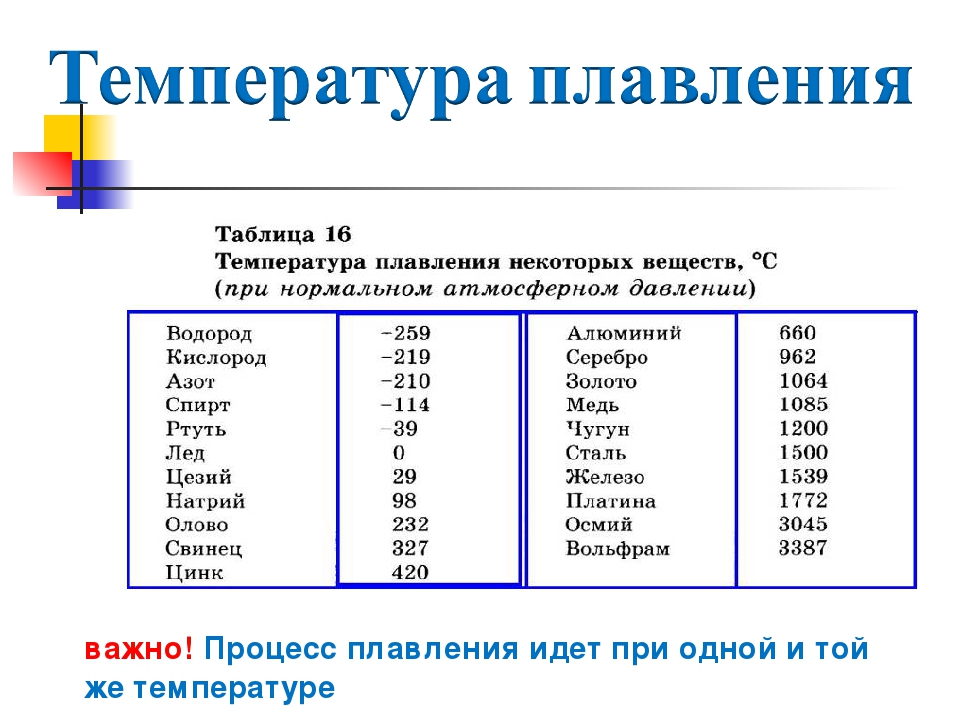
| Элемент либо сплав | Температурный режим |
| Магний | +650°С |
| Алюминий | +660°С |
| Барий | +727°С |
| Серебро | +960°С |
| Золото | +1063°С |
| Марганец | +1246°С |
| Медь | +1083°С |
| Никель | +1455°С |
| Кобальт | +1495°С |
| Железо | +1539°С |
| Дюрали | +650°С |
| Латуни | +950…1050°С |
| Чугун | +1100…1300°С |
| Углеродистые стали | +1300…1500°С |
| Нихром | +1400°С |
Таблица плавления тугоплавких металлов и сплавов.
| Наименование элемента | Температурный режим |
| Титан | +1680°С |
| Платина | +1769,3°С |
| Хром | +1907°С |
| Цирконий | +1855°С |
| Ванадий | +1910°С |
| Иридий | +2447°С |
| Молибден | +2623°С |
| Тантал | +3017°С |
| Вольфрам | +3420°С |
Классификация металлов по температуре плавления
Разные металлы могут переходить в жидкое состояние при разной температуре. Вследствие этого выделяют определённую классификацию. Их делят следующим образом:
Вследствие этого выделяют определённую классификацию. Их делят следующим образом:
- Легкоплавкие — те элементы, которые могут становиться жидкими уже при температуре ниже 600 градусов. К ним относят цинк, олово, свинец и пр. Их можно расплавить даже в домашних условиях — просто нужно разогреть при помощи плиты или паяльника. Такие виды нашли применение в технике и электронике. Они используются для соединения элементов из металла и движения электрического тока. Олово плавится при 232 градусах, а цинк — при 419 градусах.
- Среднеплавкие — элементы, которые начинают расплавляться при температуре от шестисот до тысячи шестисот градусов. Эти элементы используют по большей части для строительных элементов и металлоконструкций, то есть при создании арматур, плит и строительных блоков. В эту группу входят: железо, медь, алюминий. Температура плавления алюминия сравнительно низка и составляет 660 градусов. А вот железо начинает переходить в жидкое состояние лишь при температуре 1539 градусов.
 Это один из самых распространенных металлов, используемых в промышленности, особенно в автомобильной. Однако железо подвержено коррозии, то есть ржавчине, поэтому ему требуется специальная поверхностная обработка. Его необходимо покрывать краской или олифой, и не допускать попадание влаги.
Это один из самых распространенных металлов, используемых в промышленности, особенно в автомобильной. Однако железо подвержено коррозии, то есть ржавчине, поэтому ему требуется специальная поверхностная обработка. Его необходимо покрывать краской или олифой, и не допускать попадание влаги. - Тугоплавкие — это такие материалы, которые расплавляются и становятся жидкими при температуре выше 1600 градусов. В эту группу относят вольфрам, титан, платину, хром и т. п. Они используются в ядерной промышленности и для некоторых машинных деталей. Они могут применяться для расплавки других металлов, изготовления высоковольтных проводов или проволоки. Платину можно расплавить при 1769 градусах, а вольфрам — при 3420 °C.
Читать также: Устройство для размагничивания инструмента
Единственный элемент, который при обычных условиях находится в жидком состоянии — это ртуть. Температура его плавления составляет минус 39 градусов и его пары являются ядовитыми, поэтому его используют только в лабораториях и закрытых ёмкостях.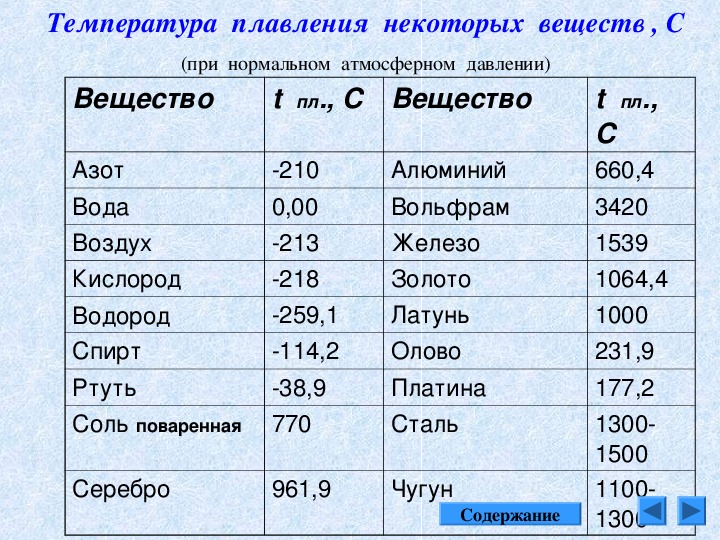
Почти все металлы при нормальных условиях представляют собой твердые вещества. Но при определенных температурах они могут изменять свое агрегатное состояние и становиться жидкими. Давайте узнаем, какая температура плавления металла самая высокая? Какая самая низкая?
Что такое температура плавления
Каждый металл имеет неповторимые свойства, и в этот список входит температура плавления. При плавке металл уходит из одного состояния в другое, а именно из твёрдого превращается в жидкое. Чтобы сплавить металл, нужно приблизить к нему тепло и нагреть до необходимой температуры – этот процесс и называется температурой плавления. В момент, когда температура доходит до нужной отметки, он ещё может пребывать в твёрдом состоянии. Если продолжать воздействие – металл или сплав начнет плавиться.
Интересное: Контроль неразрушающий соединения сварные методы ультразвуковые
Плавление и кипение – это не одно и то же. Точкой перехода вещества из твердого состояния в жидкое, зачастую называют температуру плавления металла. В расплавленном состоянии у молекул нет определенного расположения, но притяжение сдерживает их рядом, в жидком виде кристаллическое тело оставляет объем, но форма теряется.
В расплавленном состоянии у молекул нет определенного расположения, но притяжение сдерживает их рядом, в жидком виде кристаллическое тело оставляет объем, но форма теряется.
При кипении объем теряется, молекулы между собой очень слабо взаимодействуют, движутся хаотично в разных направлениях, совершают отрыв от поверхности. Температура кипения – это процесс, при котором давление металлического пара приравнивается к давлению внешней среды.
Для того, чтобы упростить разницу между критическими точками нагрева мы подготовили для вас простую таблицу:
| Свойство | Температура плавки | Температура кипения |
| Физическое состояние | Сплав переходит в расплав, разрушается кристаллическая структура, проходит зернистость | Переходит в состояние газа, некоторые молекулы могут улетать за пределы расплава |
| Фазовый переход | Равновесие между твердым состоянием и жидким | Равновесие давления между парами металла и воздухом |
| Влияние внешнего давления | Нет изменений | Изменения есть, температура уменьшается при разряжении |
При какой температуре плавится
Металлические элементы, какими бы они ни были — плавятся почти один в один..png) Этот процесс происходит при нагреве. Оно может быть, как внешнее, так и внутреннее. Первое проходит в печи, а для второго используют резистивный нагрев, пропуская электричество либо индукционный нагрев. Воздействие выходит практически схожее. При нагреве, увеличивается амплитуда колебаний молекул. Образуются структурные дефекты решётки, которые сопровождаются обрывом межатомных связей. Под процессом разрушения решётки и скоплением подобных дефектов и подразумевается плавление.
Этот процесс происходит при нагреве. Оно может быть, как внешнее, так и внутреннее. Первое проходит в печи, а для второго используют резистивный нагрев, пропуская электричество либо индукционный нагрев. Воздействие выходит практически схожее. При нагреве, увеличивается амплитуда колебаний молекул. Образуются структурные дефекты решётки, которые сопровождаются обрывом межатомных связей. Под процессом разрушения решётки и скоплением подобных дефектов и подразумевается плавление.
У разных веществ разные температуры плавления. Теоретически, металлы делят на:
- Легкоплавкие – достаточно температуры до 600 градусов Цельсия, для получения жидкого вещества.
- Среднеплавкие – необходима температура от 600 до 1600 ⁰С.
- Тугоплавкие – это металлы, для плавления которых требуется температура выше 1600 ⁰С.
Плавление железа
Температура плавления железа достаточно высока. Для технически чистого элемента требуется температура +1539 °C. В этом веществе имеется примесь — сера, а извлечь ее допустимо лишь в жидком виде.
Интересное: Описание прямой и обратной полярности при сварке
Без примесей чистый материал можно получить при электролизе солей металла.
Плавление чугуна
Чугун – это лучший металл для плавки. Высокий показатель жидкотекучести и низкий показатель усадки дают возможность эффективнее пользоваться им при литье. Далее рассмотрим показатели температуры кипения чугуна в градусах Цельсия:
- Серый — температурный режим может достигать отметки 1260 градусов. При заливке в формы температура может подниматься до 1400.
- Белый — температура достигает отметки 1350 градусов. В формы заливается при показателе 1450.
Важно! Показатели плавления такого металла, как чугун – на 400 градусов ниже, по сравнению со сталью. Это значительно снижает затраты энергии при обработке.
Плавление стали
Плавления стали при температуре 1400 °C
Сталь — это сплав железа с примесью углерода. Её главная польза — прочность, поскольку это вещество способно на протяжении длительного времени сохранять свой объем и форму. Связано это с тем, что частицы находятся в положении равновесия. Таким образом силы притяжения и отталкивания между частицами равны.
Связано это с тем, что частицы находятся в положении равновесия. Таким образом силы притяжения и отталкивания между частицами равны.
Справка! Сталь плавится при 1400 °C.
Плавление алюминия и меди
Температура плавления алюминия равна 660 градусам, это означает то, что расплавить его можно в домашних условиях.
Чистой меди – 1083 градусов, а для медных сплавов составляет от 930 до 1140 градусов.
Прочность металлов
Помимо способности перехода из твердого в жидкое состояние, одним из важных свойств материала является его прочность — возможность твердого тела сопротивлению разрушению и необратимым изменениям формы. Основным показателем прочности считается сопротивление возникающее при разрыве заготовки, предварительно отожженной. Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Обозначение прочности принято в МПа — Мега Паскалях.
Существуют следующие группы прочности металлов:
- Непрочные. Их сопротивление не превышает 50МПа.
 К ним относят олово, свинец, мягкощелочные металлы
К ним относят олово, свинец, мягкощелочные металлы - Прочные, 50−500МПа. Медь, алюминий, железо, титан. Материалы этой группы являются основой многих конструкционных сплавов.
- Высокопрочные, свыше 500МПа. Например, молибден и вольфрам.
Таблица прочности металлов
| Металл | Сопротивление, МПа |
| Медь | 200−250 |
| Серебро | 150 |
| Олово | 27 |
| Золото | 120 |
| Свинец | 18 |
| Цинк | 120−140 |
| Магний | 120−200 |
| Железо | 200−300 |
| Алюминий | 120 |
| Титан | 580 |
Наиболее распространенные в быту сплавы
Как видно из таблицы, точки плавления элементов сильно разнятся даже у часто встречающихся в быту материалов.
Так, минимальная температура плавления у ртути -38,9 °C, поэтому в условиях комнатной температуры она уже в жидком состоянии. Именно этим объясняется то, что бытовые термометры имеют нижнюю отметку в -39 градусов Цельсия: ниже этого показателя ртуть переходит в твердое состояние.
Именно этим объясняется то, что бытовые термометры имеют нижнюю отметку в -39 градусов Цельсия: ниже этого показателя ртуть переходит в твердое состояние.
Припои, наиболее распространенные в бытовом применении, имеют в своем составе значительный процент содержания олова, имеющего точку плавления 231.9 °C, поэтому большая часть припоев плавится при рабочей температуре паяльника 250−400°C.
Помимо этого, существуют легкоплавкие припои с более низкой границей расплава, до 30 °C и применяются тогда, когда опасен перегрев спаиваемых материалов. Для этих целей существуют припои с висмутом, и плавка данных материалов лежит в интервале от 29,7 — 120 °C.
Расплавление высокоуглеродистых материалов в зависимости от легирующих компонентов лежит в границах от 1100 до 1500 °C.
Точки плавления металлов и их сплавов находятся в очень широком температурном диапазоне, от очень низких температур (ртуть) до границы в несколько тысяч градусов. Знание этих показателей, а так же других физических свойств очень важно для людей, которые работают в металлургической сфере.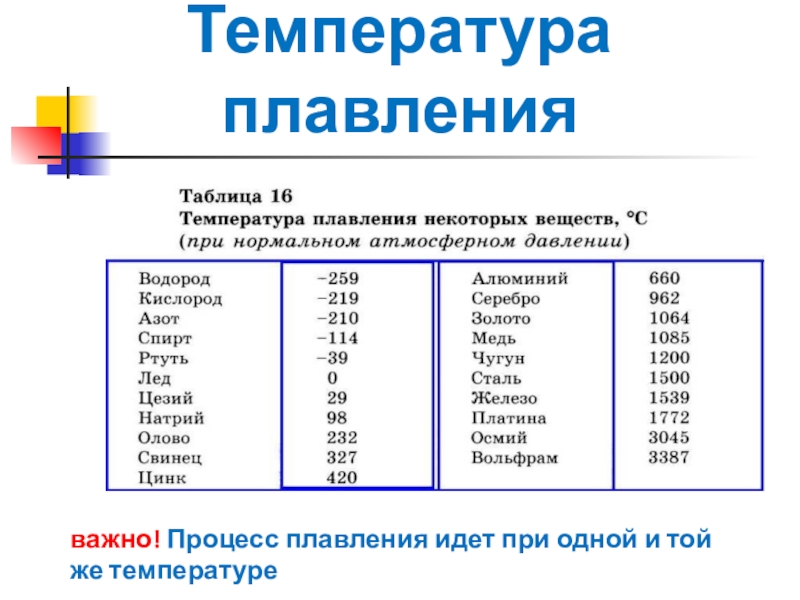 Например, знание того, при какой температуре плавится золото и другие металлы пригодятся ювелирам, литейщикам и плавильщикам.
Например, знание того, при какой температуре плавится золото и другие металлы пригодятся ювелирам, литейщикам и плавильщикам.
Металлы плавятся, как правило, при очень высокой температуре, которая может достигать более 3 тыс. градусов. Хотя некоторые из них можно расплавить в домашних условиях, например, свинец или олово. А вот ртуть плавят при температуре минус 39 градусов. В домашних условиях этого добиться не удастся. Температура плавления — это один из важных показателей производства не только самого металла, но и его сплавов. Выплавляя сырье, специалисты учитывают и другие физические и химические свойства руды и металла.
Читать также: Гидроцилиндр из домкрата своими руками
От чего зависит температура плавления
Для разных веществ температура, при которой полностью перестраивается структура до жидкого состояния – разная. Если взять во внимание металлы и сплавы, то стоит подметить такие моменты:
- В чистом виде не часто можно встретить металлы. Температура напрямую зависит от его состава.
 В качестве примера укажем олово, к которому могут добавлять другие вещества (например, серебро). Примеси позволяют делать материал более либо менее устойчивым к нагреву.
В качестве примера укажем олово, к которому могут добавлять другие вещества (например, серебро). Примеси позволяют делать материал более либо менее устойчивым к нагреву. - Бывают сплавы, которые благодаря своему химическому составу могут переходить в жидкое состояние при температуре свыше ста пятидесяти градусов. Также бывают сплавы, которые могут «держаться» при нагреве до трех тысяч градусов и выше. С учетом того, что при изменении кристаллической решетки меняются физические и механические качества, а условия эксплуатации могут определяться температурой нагрева. Стоит отметить, что точка плавления металла — важное свойство вещества. Пример этому – авиационное оборудование.
Интересное: Особенности контроля сварных соединений
Термообработка, в большинстве случаев, почти не изменяет устойчивость к нагреву. Единственно верным способом увеличения устойчивости к нагреванию можно назвать внесение изменений в химический состав, для этого и проводят легирование стали.
Железо и его свойства
Железо — это химический элемент, который в таблице Менделеева находится под номером 26.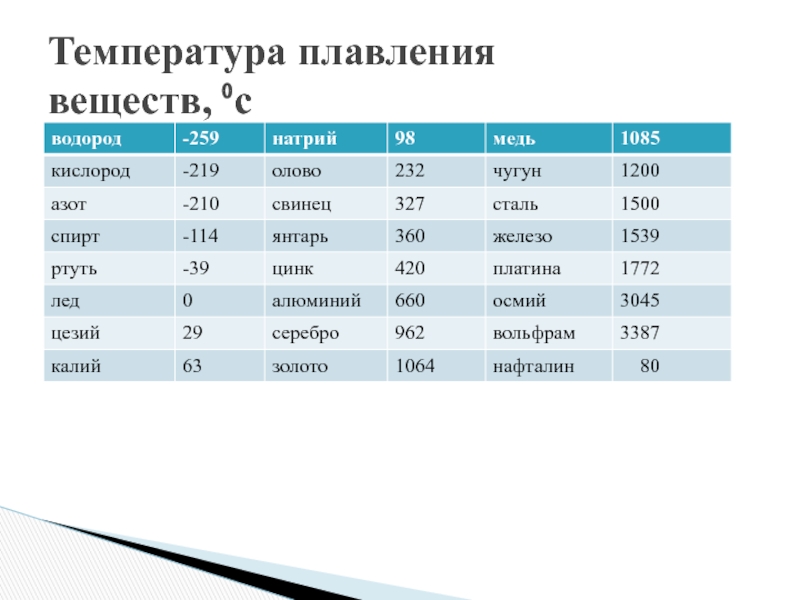 Это один из самых распространенных элементов во всей Солнечной системе. Согласно материалам исследований, в составе ядра Земли находится примерно 79−85% этого вещества. В земной коре его тоже присутствует большое количество, но оно уступает алюминию.
Это один из самых распространенных элементов во всей Солнечной системе. Согласно материалам исследований, в составе ядра Земли находится примерно 79−85% этого вещества. В земной коре его тоже присутствует большое количество, но оно уступает алюминию.
В чистом виде металл имеет белый цвет с чуть серебристым оттенком. Он пластичен, но имеющиеся в нем примеси могут определять его физические свойства. Реагирует на магнит.
Железо присутствует в воде. В речных водах его концентрация равна примерно 2 мг/л металла. В морской воде его содержание может быть ниже в сто или даже тысячу раз.
Оксид железа — это основная форма, добыча которой осуществляется и которая находится в природе. Оксидное железо может располагаться в самой верхней части земной коры и быть составляющей осадочных образований.
Элемент, находящийся на двадцать шестом месте в таблице Менделеева, может иметь несколько степеней окисления. Именно они определяют его геохимическую особенность нахождения в определенной среде.
В ядре Земли металл присутствует в нейтральной форме.
У какого металла самая высокая температура плавления
Вольфрам – самый тугоплавкий металл, 3422 °C (6170 °F).
Твердый, тугоплавкий, достаточно тяжелый материал светло-серого цвета, который имеет металлический блеск. Механической обработке поддается с трудом. При комнатной температуре достаточно хрупок и ломается. Ломкость металла связана с загрязнением примесями углерода и кислорода.
Примечание! Технически, чистый металл при температуре выше четырехсот градусов по Цельсию становится очень пластичным. Демонстрирует химическую инертность, неохотно вступает в реакции с другими элементами. В природе встречается в виде таких сложных минералов, как: гюбнерит, шеелит, ферберит и вольфрамит.
Вольфрам можно получить из руды, благодаря сложным химическим переработкам, в качестве порошка. Используя прессование и спекание, из него создают детали обычной формы и бруски.
Вольфрам — крайне стойкий элемент к любым температурным воздействиям.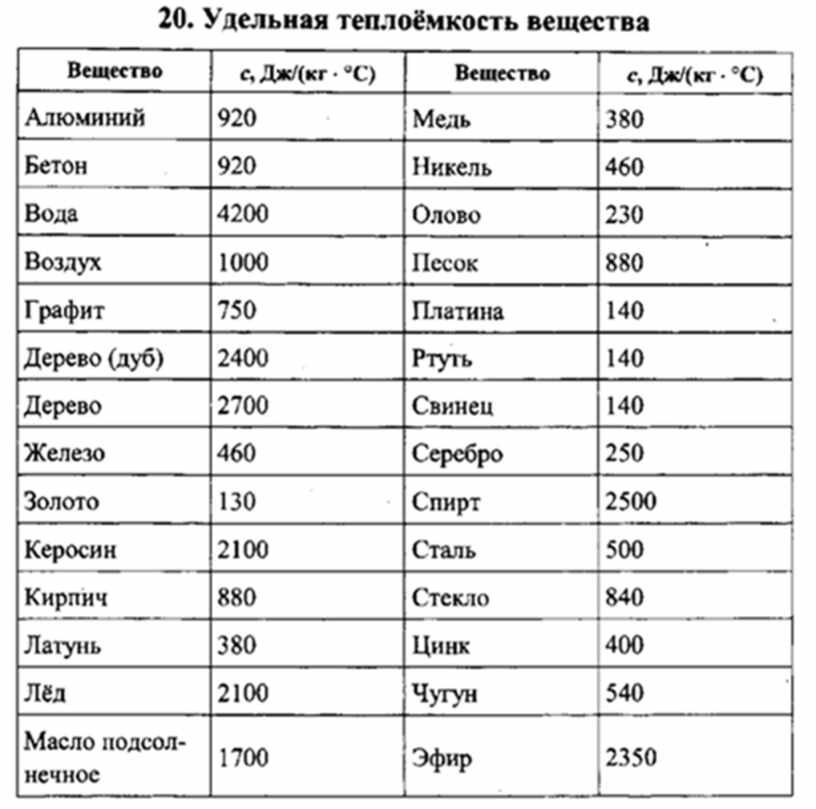 По этой причине размягчить вольфрам не могли более сотни лет. Не существовало такой печи, которая смогла бы нагреться до нескольких тысяч градусов по Цельсию. Ученым удалось доказать, что это самый тугоплавкий металл. Хотя бытует мнение, что сиборгий, по некоторым теоретическим данным, имеет большую тугоплавкость, но это лишь предположение, поскольку он является радиоактивным элементом и у него небольшой срок существования.
По этой причине размягчить вольфрам не могли более сотни лет. Не существовало такой печи, которая смогла бы нагреться до нескольких тысяч градусов по Цельсию. Ученым удалось доказать, что это самый тугоплавкий металл. Хотя бытует мнение, что сиборгий, по некоторым теоретическим данным, имеет большую тугоплавкость, но это лишь предположение, поскольку он является радиоактивным элементом и у него небольшой срок существования.
температура плавления, плотность и удельный объем
В металлургической промышленности одним из основных направлений считается литье металлов и их сплавов по причине дешевизны и относительной простоты процесса. Отливаться могут формы с любыми очертаниями различных габаритов, от мелких до крупных; это подходит как для массового, так и для индивидуального производства.
Литье является одним из древнейших направлений работы с металлами, и начинается примерно с бронзового века: 7−3 тысячелетия до н. э. С тех пор было открыто множество материалов, что приводило к развитию технологии и повышению требований к литейной промышленности.
В наши дни существует много направлений и видов литья, различающихся по технологическому процессу. Одно остается неизменным — физическое свойство металлов переходить из твердого состояния в жидкое, и важно знать то, при какой температуре начинается плавление разных видов металлов и их сплавов.
Процесс плавления металла
Данный процесс обозначает собой переход вещества из твердого состояния в жидкое. При достижении точки плавления металл может находиться как в твердом, так и в жидком состоянии, дальнейшее возрастание приведет к полному переходу материала в жидкость.
То же самое происходит и при застывании — при достижении границы плавления вещество начнет переходить из жидкого состояния в твердое, и температура не изменится до полной кристаллизации.
При этом следует помнить, что данное правило применимо только для чистого металла. Сплавы не имеют четкой границы температур и совершают переход состояний в некотором диапазоне :
- Солидус — линия температуры, при которой начинает плавиться самый легкоплавкий компонент сплава.

- Ликвидус — окончательная точка плавления всех компонентов, ниже которой начинают появляться первые кристаллы сплава.
Точно измерить температуру плавления таких веществ невозможно, точкой перехода состояний указывается числовой промежуток.
В зависимости от температуры, при которой начинается плавление металлов, их принято разделять на :
- Легкоплавкие, до 600 °C. К ним относятся олово, цинк, свинец и другие.
- Среднеплавкие, до 1600 °C. Большинство распространенных сплавов, и такие металлы как золото, серебро, медь, железо, алюминий.
- Тугоплавкие, свыше 1600 °C. Титан, молибден, вольфрам, хром.
Также существует и температура кипения — точка, при достижении которой расплавленный металл начнет переход в газообразное состояние. Это очень высокая температура, как правило, в 2 раза превышающая точку расплава.
Влияние давления
Температура плавления и равная ей температура затвердевания зависят от давления, возрастая с его повышением.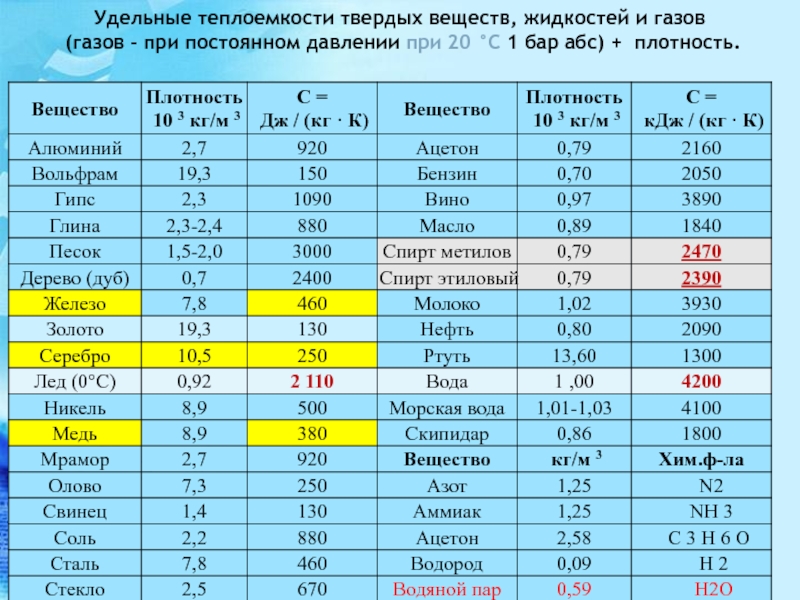 Это обусловлено тем, что при повышении давления атомы сближаются между собой, а для разрушения кристаллической решетки их нужно отдалить. При повышенном давлении требуется большая энергия теплового движения и соответствующая ей температура плавления увеличивается.
Это обусловлено тем, что при повышении давления атомы сближаются между собой, а для разрушения кристаллической решетки их нужно отдалить. При повышенном давлении требуется большая энергия теплового движения и соответствующая ей температура плавления увеличивается.
Существуют исключения, когда температура, необходимая для перехода в жидкое состояние, при повышенном давлении уменьшается. К таким веществам относят лёд, висмут, германий и сурьма.
Таблица температур плавления
Любому человеку, связанному с металлургической промышленностью, будь то сварщик, литейщик, плавильщик или ювелир, важно знать температуры, при которых происходит расплав материалов, с которыми он работает. В нижеприведенной таблице указаны точки плавления наиболее распространенных веществ.
Таблица температур плавления металлов и сплавов
Помимо таблицы плавления, существует много других вспомогательных материалов. Например, ответ на вопрос, какова температура кипения железа лежит в таблице кипения веществ. Помимо кипения, у металлов есть ряд других физических свойств, как прочность.
Помимо кипения, у металлов есть ряд других физических свойств, как прочность.
Прочность металлов
Помимо способности перехода из твердого в жидкое состояние, одним из важных свойств материала является его прочность — возможность твердого тела сопротивлению разрушению и необратимым изменениям формы. Основным показателем прочности считается сопротивление возникающее при разрыве заготовки, предварительно отожженной. Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Обозначение прочности принято в МПа — Мега Паскалях.
Существуют следующие группы прочности металлов :
- Непрочные. Их сопротивление не превышает 50МПа. К ним относят олово, свинец, мягкощелочные металлы
- Прочные, 50−500МПа. Медь, алюминий, железо, титан. Материалы этой группы являются основой многих конструкционных сплавов.
- Высокопрочные, свыше 500МПа. Например, молибден и вольфрам.
Таблица прочности металлов
Наиболее распространенные в быту сплавы
Как видно из таблицы, точки плавления элементов сильно разнятся даже у часто встречающихся в быту материалов.
Так, минимальная температура плавления у ртути -38,9 °C, поэтому в условиях комнатной температуры она уже в жидком состоянии. Именно этим объясняется то, что бытовые термометры имеют нижнюю отметку в -39 градусов Цельсия: ниже этого показателя ртуть переходит в твердое состояние.
Припои, наиболее распространенные в бытовом применении, имеют в своем составе значительный процент содержания олова, имеющего точку плавления 231.9 °C, поэтому большая часть припоев плавится при рабочей температуре паяльника 250−400°C.
Помимо этого, существуют легкоплавкие припои с более низкой границей расплава, до 30 °C и применяются тогда, когда опасен перегрев спаиваемых материалов. Для этих целей существуют припои с висмутом, и плавка данных материалов лежит в интервале от 29,7 — 120 °C.
Расплавление высокоуглеродистых материалов в зависимости от легирующих компонентов лежит в границах от 1100 до 1500 °C.
Точки плавления металлов и их сплавов находятся в очень широком температурном диапазоне, от очень низких температур (ртуть) до границы в несколько тысяч градусов. Знание этих показателей, а так же других физических свойств очень важно для людей, которые работают в металлургической сфере. Например, знание того, при какой температуре плавится золото и другие металлы пригодятся ювелирам, литейщикам и плавильщикам.
Знание этих показателей, а так же других физических свойств очень важно для людей, которые работают в металлургической сфере. Например, знание того, при какой температуре плавится золото и другие металлы пригодятся ювелирам, литейщикам и плавильщикам.
Каждый металл и сплав имеет собственный уникальный набор физических и химических свойств, среди которых не последнее место занимает температура плавления. Сам процесс означает переход тела из одного агрегатного состояния в другое, в данном случае, из твердого кристаллического состояния в жидкое. Чтобы расплавить металл, необходимо подводить к нему тепло до достижения температуры плавления. При ней он все еще может оставаться в твердом состоянии, но при дальнейшем воздействии и повышении тепла металл начинает плавиться. Если температуру понизить, то есть отвести часть тепла, элемент затвердеет.
Самая высокая температура плавления среди металлов принадлежит вольфраму : она составляет 3422С о, самая низкая — у ртути: элемент плавится уже при — 39С о. Определить точное значение для сплавов, как правило, не представляет возможности: оно может значительно колебаться в зависимости от процентного соотношения компонентов. Их обычно записывают в виде числового промежутка.
Определить точное значение для сплавов, как правило, не представляет возможности: оно может значительно колебаться в зависимости от процентного соотношения компонентов. Их обычно записывают в виде числового промежутка.
Как происходит
Плавление всех металлов происходит примерно одинаково — при помощи внешнего или внутреннего нагревания. Первый осуществляется в термической печи, для второго используют резистивный нагрев при пропускании электрического тока или индукционный нагрев в высокочастотном электромагнитном поле. Оба варианта воздействуют на металл примерно одинаково.
При увеличении температуры увеличивается и амплитуда тепловых колебаний молекул , возникают структурные дефекты решетки, выражающиеся в росте дислокаций, перескоке атомов и других нарушениях. Это сопровождается разрывом межатомных связей и требует определенного количества энергии. В это же время происходит образование квази-жидкого слоя на поверхности тела. Период разрушения решетки и накопления дефектов называется плавлением.
В зависимости от температуры плавления металлы делятся на:
В зависимости от температуры плавления выбирают и плавильный аппарат . Чем выше показатель, тем прочнее он должен быть. Узнать температуру нужного вам элемента можно из таблицы.
Еще одной немаловажной величиной является температура кипения. Это величина, при которой начинается процесс кипения жидкостей, она соответствует температуре насыщенного пара, который образуется над плоской поверхностью кипящей жидкости. Обычно она почти в два раза больше, чем температура плавления.
Обе величины принято приводить при нормальном давлении. Между собой они прямопропорциональны .
- Увеличивается давление — увеличится величина плавления.
- Уменьшается давление — уменьшается величина плавления.
Таблица легкоплавких металлов и сплавов (до 600С о)
Таблица среднеплавких металлов и сплавов (от 600С о до 1600С о)
Таблица тугоплавких металлов и сплавов (свыше 1600С о)
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления. При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
Наиболее низкая температура плавления у ртути — она плавится даже при -39 °C, самая высокая у вольфрама — 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Как происходит процесс
Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой — плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании. Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты . Воздействие при этом примерно одинаковое.
Воздействие при этом примерно одинаковое.
Когда происходит нагревание , усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки , сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от градуса, при котором плавятся металлы, они разделяются на:
- легкоплавкие — до 600 °C: свинец, цинк, олово;
- среднеплавкие — от 600 °C до 1600 °C: золото, медь, алюминий, чугун, железо и большая часть всех элементов и соединений;
- тугоплавкие — от 1600 °C: хром, вольфрам, молибден, титан.
В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат. Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина — градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
Таблица характеристик
Металлы и сплавы — непременная основа для ковки , литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота , ограды из чугуна, ножи из стали или браслеты из меди) , для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий — 660 °C;
- температура плавления меди — 1083 °C;
- температура плавления золота — 1063 °C;
- серебро — 960 °C;
- олово — 232 °C. Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
- свинец — 327 °C;
- температура плавления железо — 1539 °C;
- температура плавления стали (сплав железа и углерода) — от 1300 °C до 1500 °C.
 Она колеблется в зависимости от насыщенности стали компонентами;
Она колеблется в зависимости от насыщенности стали компонентами; - температура плавления чугуна (также сплав железа и углерода) — от 1100 °C до 1300 °C;
- ртуть — -38,9 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл — ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления. Например, у золота он 2660 °C, у алюминия — 2519 °C , у железа — 2900 °C, у меди — 2580 °C, у ртути — 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов — у рения — 5596 °C . Наибольшая температура кипения — у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов . Самым лёгким металлом является литий, самым тяжёлым — осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа — очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа — очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах — это теплопроводность металлов . Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл — серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Температура плавления, наряду с плотностью, относится к физическим характеристикам металлов . Температура плавления металла — температура, при которой металл переходит из твердого состояния, в котором находится в нормальном состоянии (кроме ртути), в жидкое состояние при нагревании. При плавлении объем металла практически не изменяется, поэтому на температуру плавления нормальное атмосферное давление не влияет .
Температура плавления металлов находится в диапазоне от -39 градусов Цельсия до +3410 градусов . Для большинства металлов температура плавления высокая, однако, некоторые металлы можно расплавить в домашних условиях при нагревании на обычной горелке (олово, свинец).
Классификация металлов по температуре плавления
- Легкоплавкие металлы , температура плавления которых колеблется до 600 градусов Цельсия, например цинк, олово, висмут .
- Среднеплавкие металлы , которые плавятся при температуре от 600 до 1600 градусов Цельсия: такие как алюминий, медь, олово, железо .
- Тугоплавкие металлы , температура плавления которых достигает более 1600 градусов Цельсия — вольфрам, титан, хром и др.
- — единственный металл, находящийся при обычных условиях (нормальное атмосферное давление, средняя температура окружающей среды) в жидком состоянии. Температура плавления ртути составляет порядка -39 градусов по Цельсию.

Таблица температур плавления металлов и сплавов
| Металл | Температура плавления, градусов Цельсия |
| Алюминий | 660,4 |
| Вольфрам | 3420 |
| Дюралюмин | ~650 |
| Железо | 1539 |
| Золото | 1063 |
| Иридий | 2447 |
| Калий | 63,6 |
| Кремний | 1415 |
| Латунь | ~1000 |
| Легкоплавкий сплав | 60,5 |
| Магний | 650 |
| Медь | 1084,5 |
| Натрий | 97,8 |
| Никель | 1455 |
| Олово | 231,9 |
| Платина | 1769,3 |
| Ртуть | –38,9 |
| Свинец | 327,4 |
| Серебро | 961,9 |
| Сталь | 1300-1500 |
| Цинк | 419,5 |
| Чугун | 1100-1300 |
При плавлении металла для изготовления металлических изделий-отливок от температуры плавления зависит выбор оборудования, материала для формовки металла и др.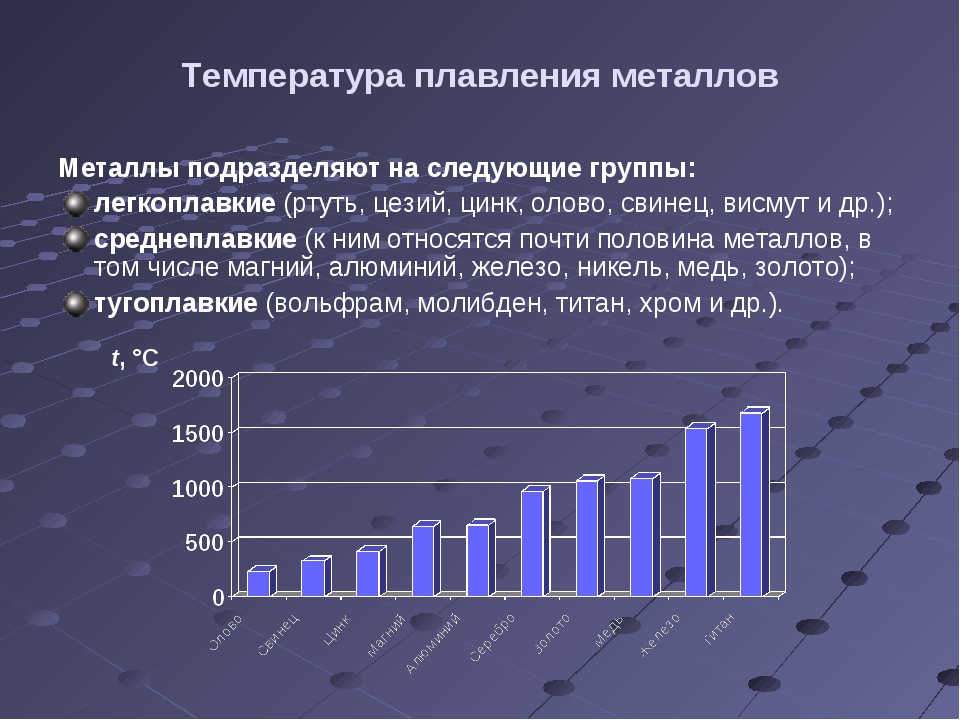 Следует также помнить, что при легировании металла другими элементами температура плавления чаще всего снижается .
Следует также помнить, что при легировании металла другими элементами температура плавления чаще всего снижается .
Интересный факт
Не стоит путать понятия «температура плавления металла» и «температура кипения металла» — для многих металлов эти характеристики существенно отличаются: так, серебро плавится при температуре 961 градус по Цельсию, а закипает только при достижении нагрева до 2180 градусов.
Температура плавления металла – это минимальная температура, при которой он переходит из твердого состояния в жидкое. При плавлении его объем практически не изменяется. Металлы классифицируют по температуре плавления в зависимости от степени нагревания.
Легкоплавкие металлы
Легкоплавкие металлы имеют температуру плавления ниже 600°C. Это цинк, олово, висмут. Такие металлы можно расплавить в домашних условиях, разогрев их на плите, или с помощью паяльника. Легкоплавкие металлы используются в электронике и технике для соединения металлических элементов и проводов для движения электрического тока.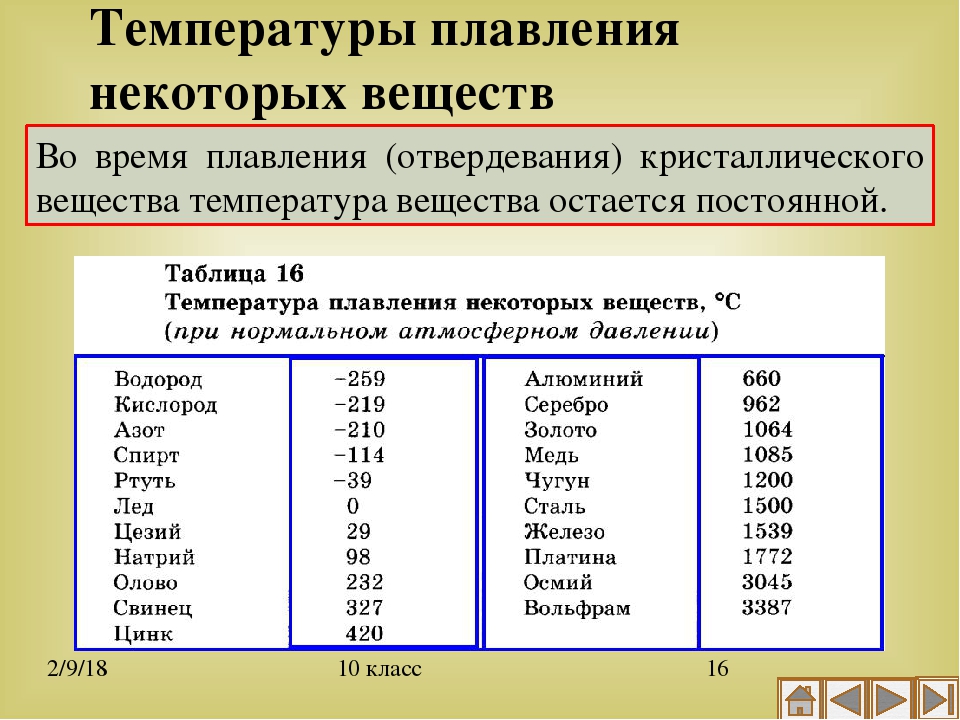 Температура плавления олова составляет 232 градуса, а цинка – 419.
Температура плавления олова составляет 232 градуса, а цинка – 419.
Среднеплавкие металлы
Среднеплавкие металлы начинают переходить из твердого в жидкое состояние при температуре от 600°C до 1600°C. Они используются для изготовления плит, арматур, блоков и других металлических конструкций, пригодных для строительства. К этой группе металлов относятся железо, медь, алюминий, они также входят в состав многих сплавов. Медь добавляют в сплавы драгоценных металлов, таких как золото, серебро, платина. Золото 750 пробы на 25% состоит из лигатурных металлов, в том числе и меди, которая придает ему красноватый оттенок. Температура плавления этого материала равна 1084 °C. А алюминий начинает плавиться при относительно низкой температуре, составляющей 660 градусов Цельсия. Это легкий пластичный и недорогой металл, который не окисляется и не ржавеет, поэтому широко используется при изготовлении посуды. Температура плавления железа равна 1539 градусов. Это один из самых популярных и доступных металлов, его применение распространено в строительстве и автомобильной промышленности. Но ввиду того, что железо подвергается коррозии, его нужно дополнительно обрабатывать и покрывать защитным слоем краски, олифы или не допускать попадания влаги.
Но ввиду того, что железо подвергается коррозии, его нужно дополнительно обрабатывать и покрывать защитным слоем краски, олифы или не допускать попадания влаги.
Тугоплавкие металлы
Температура тугоплавких металлов выше 1600°C. Это вольфрам, титан, платина, хром и другие. Их используют в качестве источников света, машинных деталей, смазочных материалов, а также в ядерной промышленности. Из них изготавливают проволоки, высоковольтные провода и используют для расплавки других металлов с более низкой температурой плавления. Платина начинает переходить из твердого в жидкое состояние при температуре 1769 градусов, а вольфрам – при температуре 3420°C.
Ртуть – единственный металл, находящийся в жидком состоянии при обычных условиях, а именно, нормальном атмосферном давлении и средней температуре окружающей среды. Температура плавления ртути составляет минус 39°C. Этот металл и его пары являются ядовитыми, поэтому он используется только в закрытых емкостях или в лабораториях. Распространенное применение ртути – градусник для измерения температуры тела.
Распространенное применение ртути – градусник для измерения температуры тела.
Металлы плавятся, как правило, при очень высокой температуре, которая может достигать более 3 тыс. градусов. Хотя некоторые из них можно расплавить в домашних условиях, например, свинец или олово. А вот ртуть плавят при температуре минус 39 градусов. В домашних условиях этого добиться не удастся. Температура плавления — это один из важных показателей производства не только самого металла, но и его сплавов. Выплавляя сырье, специалисты учитывают и другие физические и химические свойства руды и металла.
Железо и его свойства
Железо — это химический элемент, который в таблице Менделеева находится под номером 26. Это один из самых распространенных элементов во всей Солнечной системе. Согласно материалам исследований, в составе ядра Земли находится примерно 79−85% этого вещества . В земной коре его тоже присутствует большое количество, но оно уступает алюминию.
В чистом виде металл имеет белый цвет с чуть серебристым оттенком. Он пластичен, но имеющиеся в нем примеси могут определять его физические свойства. Реагирует на магнит.
Он пластичен, но имеющиеся в нем примеси могут определять его физические свойства. Реагирует на магнит.
Железо присутствует в воде. В речных водах его концентрация равна примерно 2 мг/л металла. В морской воде его содержание может быть ниже в сто или даже тысячу раз.
Оксид железа — это основная форма, добыча которой осуществляется и которая находится в природе. Оксидное железо может располагаться в самой верхней части земной коры и быть составляющей осадочных образований.
Элемент, находящийся на двадцать шестом месте в таблице Менделеева, может иметь несколько степеней окисления. Именно они определяют его геохимическую особенность нахождения в определенной среде. В ядре Земли металл присутствует в нейтральной форме.
Добыча полезных ископаемых
Руд, в которых присутствует железо, существует несколько. Однако, в качестве сырья для производства железа в промышленности используют в основном следующие:
- магнезитовую руду;
- гетитовую руду;
- гематитовую руду.

А также часто встречаются такие разновидности руды:
Существует еще минерал под названием мелантерит . Его используют преимущественно в фармацевтической промышленности. Из себя он представляет зелёного цвета хрупкие кристаллы, в которых присутствует стеклянный блеск. Из него производят лекарственные препараты, в составе которых имеется ферум.
Основным месторождением этого металла является Южная Америка, а именно Бразилия.
Плавление железа и необходимая температура
Точкой плавления металла называют такую минимальную температуру, при которой он переходит из твердого состояния в жидкое. При этом в объеме он практически остается неизменным.
Металл могут производить из руды различными способами, но самый основной из них — это доменный . Помимо доменного, используют еще выплавку железа при помощи обжига измельченной руды с примесью глины. Из полученной смеси формируют окатыши, которые обрабатываются в печи с последующим восстановлением водородом. Далее плавление железа осуществляется в электрической печи.
Далее плавление железа осуществляется в электрической печи.
Температура плавления железа весьма высока. Для технически чистого элемента она составляет +1539 °C. В этом веществе присутствует примесь — Сера, которую можно извлечь лишь в жидком виде. Без примесей чистый материал получают при электролизе солей металла.
Классификация металлов по температуре плавления
Разные металлы могут переходить в жидкое состояние при разной температуре. Вследствие этого выделяют определённую классификацию. Их делят следующим образом:
- Легкоплавкие — те элементы, которые могут становиться жидкими уже при температуре ниже 600 градусов. К ним относят цинк, олово, свинец и пр. Их можно расплавить даже в домашних условиях — просто нужно разогреть при помощи плиты или паяльника. Такие виды нашли применение в технике и электронике. Они используются для соединения элементов из металла и движения электрического тока. Олово плавится при 232 градусах, а цинк — при 419 градусах.

- Среднеплавкие — элементы, которые начинают расплавляться при температуре от шестисот до тысячи шестисот градусов. Эти элементы используют по большей части для строительных элементов и металлоконструкций, то есть при создании арматур, плит и строительных блоков. В эту группу входят: железо, медь, алюминий. Температура плавления алюминия сравнительно низка и составляет 660 градусов. А вот железо начинает переходить в жидкое состояние лишь при температуре 1539 градусов. Это один из самых распространенных металлов, используемых в промышленности, особенно в автомобильной. Однако железо подвержено коррозии, то есть ржавчине, поэтому ему требуется специальная поверхностная обработка. Его необходимо покрывать краской или олифой, и не допускать попадание влаги.
- Тугоплавкие — это такие материалы, которые расплавляются и становятся жидкими при температуре выше 1600 градусов. В эту группу относят вольфрам, титан, платину, хром и т. п. Они используются в ядерной промышленности и для некоторых машинных деталей.
 Они могут применяться для расплавки других металлов, изготовления высоковольтных проводов или проволоки. Платину можно расплавить при 1769 градусах, а вольфрам — при 3420 °C.
Они могут применяться для расплавки других металлов, изготовления высоковольтных проводов или проволоки. Платину можно расплавить при 1769 градусах, а вольфрам — при 3420 °C.
Единственный элемент, который при обычных условиях находится в жидком состоянии — это ртуть. Температура его плавления составляет минус 39 градусов и его пары являются ядовитыми, поэтому его используют только в лабораториях и закрытых ёмкостях.
Температуру плавления металлов, которая изменяется от малейшего (-39 °С для ртути) до наибольшего (3400 °С для вольфрама), а также плотность металлов в твердом состоянии при 20 °С и плотности жидких металлов при температуре плавления приведены в таблице плавки цветных металлов.
Таблица 1. Плавки цветных металлов
Атомная масса | Температура плавления t пл , °С | Густота ρ , г/см 3 | ||
твердого при 20 °С | редкого при t пл | |||
Алюминий | ||||
Вольфрам | ||||
Марганец | ||||
Молибден | ||||
Цирконий | ||||
Сварка и плавка цветных металлов
Сварка меди . Температура плавки металла Cu, почти в шесть раз превышает температуру плавки стали, медь интенсивно поглощает и растворяет различные газы, образуя с кислородом оксиды. Оксид меди II с медью образует эвтектику, температура плавления которой (1064°С) ниже температуры плавления меди (1083°С). При затвердевании жидкой меди эвтектика располагается по границам зерен, делает медь хрупкой и склонной к образованию трещин. Поэтому основной задачей при сварке меди является защита его от окисления и активное раскисление сварочной ванны.
Температура плавки металла Cu, почти в шесть раз превышает температуру плавки стали, медь интенсивно поглощает и растворяет различные газы, образуя с кислородом оксиды. Оксид меди II с медью образует эвтектику, температура плавления которой (1064°С) ниже температуры плавления меди (1083°С). При затвердевании жидкой меди эвтектика располагается по границам зерен, делает медь хрупкой и склонной к образованию трещин. Поэтому основной задачей при сварке меди является защита его от окисления и активное раскисление сварочной ванны.
Наиболее распространенное газовое сварки меди ацетиленокисневим пламенем с помощью горелок, которые в 1,5…2 раза мощнее горелки для сварки сталей. Присадочным металлом есть медные прутки, содержащие фосфор и кремний. Если толщина изделий более 5…6 мм, их сначала подогревают до температуры 250…300°С. Флюсами при сварке является прожаренная бура или смесь, состоящую из 70% буры и 30% борной кислоты. Чтобы повысить механические свойства и улучшить структуру наплавленного металла, медь после сварки проковывают при температуре около 200…300°С. Потом ее снова нагревают до 500-550°С и охлаждают в воде. Медь сваривают также электродуговым способом электродами, в струе защитных газов, под слоем флюса, на конденсаторных машинах, способом трения.
Потом ее снова нагревают до 500-550°С и охлаждают в воде. Медь сваривают также электродуговым способом электродами, в струе защитных газов, под слоем флюса, на конденсаторных машинах, способом трения.
Сварка латуни . Латунь – это сплав меди с цинком (до 50%). Основное загрязнение при этом – испарение цинка, в итоге чего шов теряет свои качества, в нем возникают поры. Латунь, как и медь, в основном сваривают ацетиленовым окислительным пламенем, при котором на поверхности ванны создается пленка тугоплавкого оксида цинка, уменьшающая дальнейшее выгорание и испарение цинка. Флюсы используют такие же, как и при сварке меди. Они создают на поверхности ванны шлаки, которые связывают оксиды цинка и затрудняют выход паров из сварочной ванны. Латунь сваривают также в защитных газах и на контактных машинах.
Сварка бронзы . В большинстве случаев бронза – это литейный материал, поэтому
сварку применяют при исправлении дефектов или во время ремонта. Чаще всего применяют сварку металлическим электродом. Присадочным металлом является прутки того самого состава, что и основной металл, а флюсами или электродным покрытием – хлористые и фтористые соединения калия и натрия.
Чаще всего применяют сварку металлическим электродом. Присадочным металлом является прутки того самого состава, что и основной металл, а флюсами или электродным покрытием – хлористые и фтористые соединения калия и натрия.
. Основными факторами, затрудняющими сварку алюминия, является низкая температура его плавления (658°С), большая теплопроводность (примерно в 3 раза выше теплопроводности стали), образование тугоплавких оксидов алюминия, которые имеют температуру плавления 2050°С, поэтому технология плавки цветных металлов, таких как медь или бронза, не подходит для плавки алюминия. Кроме того, эти оксиды слабо реагируют как с кислыми, так и основными флюсами, поэтому плохо удаляются из шва.
Чаще всего используют газовую сварку алюминия ацетиленовым пламенем. В последние годы значительно распространилось также автоматическая дуговая сварка металлическими электродами под флюсом и в среде аргона. При всех способах сварки, кроме аргонодуговой, применяют флюсы или электродные покрытия, в состав которых входят фтористые и хлористые соединения лития, калия, натрия и других элементов.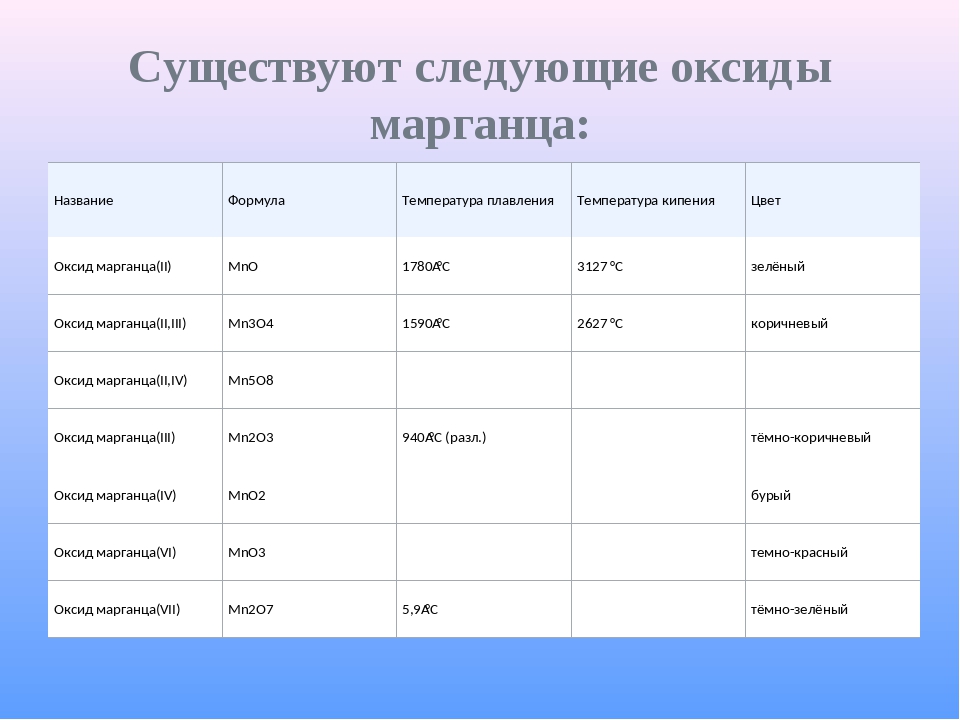 Как присадочный металл при всех способах сварки используют проволоку или стержни того же состава, что и основной металл.
Как присадочный металл при всех способах сварки используют проволоку или стержни того же состава, что и основной металл.
Алюминий хорошо сваривается электронным лучом в вакууме, на контактных машинах, электрошлаковым и другими способами.
Сварка сплавов алюминия . Сплавы алюминия с магнием и цинком сваривают без
особых осложнений, так же как и алюминий. Исключением является дюралюминий – сплавы алюминия с медью. Эти сплавы термически упрочняются после закалки и следующего старения. Когда температура плавки цветных металлов свыше 350°С в них происходит снижение прочности, которое не восстанавливается термической обработкой. Поэтому при сварке дюралюминия в зоне термического влияния прочность уменьшается на 40…50%. Если дюралюминий сваривать в защитных газах, то такое снижение может быть восстановлено термической обработкой до 80…90% по отношению к прочности основного металла.
Сварка магниевых сплавов . При газовой сварке обязательно применяют фторидные флюсы, которые в отличие от хлоридных не вызывают коррозии сварных соединений. Дуговая сварка магниевых сплавов металлическими электродами через низкое качество сварных швов до настоящего времени не применяется. При сварке магниевых сплавов наблюдается значительный рост зерна в около шовных участках и сильное развитие столбчатых кристаллов в сварном шве. Поэтому предел прочности сварных соединений составляет 55…60% предела прочности основного металла.
Дуговая сварка магниевых сплавов металлическими электродами через низкое качество сварных швов до настоящего времени не применяется. При сварке магниевых сплавов наблюдается значительный рост зерна в около шовных участках и сильное развитие столбчатых кристаллов в сварном шве. Поэтому предел прочности сварных соединений составляет 55…60% предела прочности основного металла.
Таблица 2. Физические свойства промышленных цветных металлов
Свойства | М еталл | |||||||||||
Атомный номер | ||||||||||||
Атомная масса | ||||||||||||
при температурте 20 °С, кг/м 3 | ||||||||||||
Температура плавления, °С | ||||||||||||
Температура кипения, °С | ||||||||||||
Атомный диаметр, нм | ||||||||||||
Скрытая теплота плавления, кДж/кг | ||||||||||||
Скрытая теплота испарения, | ||||||||||||
Удельная теплоемкость при температуре 20 °С, Дж/(кг . | ||||||||||||
Удельная теплопроводность, 20 °С, Вт/(м —°С) | ||||||||||||
Коэффициент линейного расширения при температуре 25 °С, 10 6 — ° С — 1 | ||||||||||||
Удельное электросопротивление при температуре 20°С, мкОм —м | ||||||||||||
Модуль нормальной упругости, ГПа | ||||||||||||
Модуль сдвига, ГПа | ||||||||||||
Тигельная плавка
Неотъемлемой составляющей производства металла и металлических изделий, является использование во время производственного процесса тиглей для производства, выплавки и переплавки как черного, так и цветного металла. Тигли — это неотъемлемая часть металлургического оборудования при отливании разнообразных металлов, сплавов, и тому подобное.
Тигли — это неотъемлемая часть металлургического оборудования при отливании разнообразных металлов, сплавов, и тому подобное.
Керамический тигель для плавки цветных металлов используется для плавки металлов (меди, бронзы) с древнейших времен.
температура плавления, плотность и удельный объем. Физические характеристики, состав и особенности металла железа Температура кипения железного гвоздя
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления. При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
Наиболее низкая температура плавления у ртути — она плавится даже при -39 °C, самая высокая у вольфрама — 3422 °C.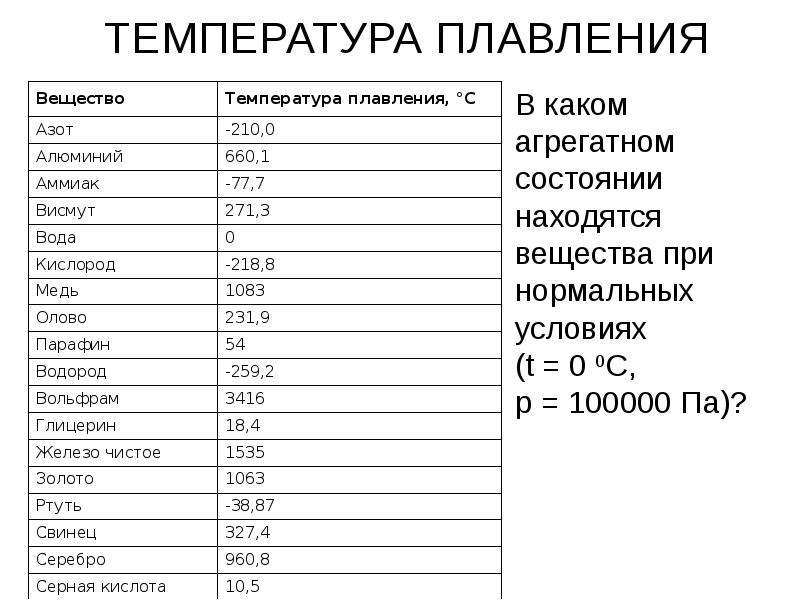 Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Как происходит процесс
Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой — плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании. Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты . Воздействие при этом примерно одинаковое.
Когда происходит нагревание , усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки , сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от градуса, при котором плавятся металлы, они разделяются на:
- легкоплавкие — до 600 °C: свинец, цинк, олово;
- среднеплавкие — от 600 °C до 1600 °C: золото, медь, алюминий, чугун, железо и большая часть всех элементов и соединений;
- тугоплавкие — от 1600 °C: хром, вольфрам, молибден, титан.

В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат. Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина — градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
Таблица характеристик
Металлы и сплавы — непременная основа для ковки , литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота , ограды из чугуна, ножи из стали или браслеты из меди) , для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий — 660 °C;
- температура плавления меди — 1083 °C;
- температура плавления золота — 1063 °C;
- серебро — 960 °C;
- олово — 232 °C. Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
- свинец — 327 °C;
- температура плавления железо — 1539 °C;
- температура плавления стали (сплав железа и углерода) — от 1300 °C до 1500 °C. Она колеблется в зависимости от насыщенности стали компонентами;
- температура плавления чугуна (также сплав железа и углерода) — от 1100 °C до 1300 °C;
- ртуть — -38,9 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл — ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления.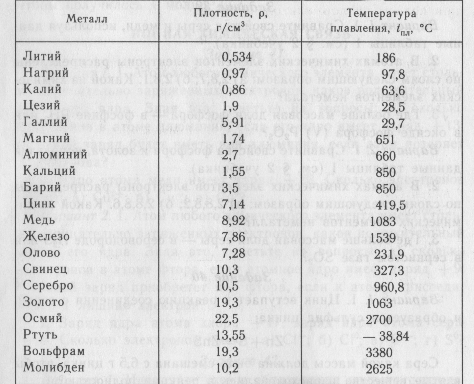 Например, у золота он 2660 °C, у алюминия — 2519 °C , у железа — 2900 °C, у меди — 2580 °C, у ртути — 356,73 °C.
Например, у золота он 2660 °C, у алюминия — 2519 °C , у железа — 2900 °C, у меди — 2580 °C, у ртути — 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов — у рения — 5596 °C . Наибольшая температура кипения — у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов . Самым лёгким металлом является литий, самым тяжёлым — осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа — очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах — это теплопроводность металлов . Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл — серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Температура плавления, наряду с плотностью, относится к физическим характеристикам металлов . Температура плавления металла — температура, при которой металл переходит из твердого состояния, в котором находится в нормальном состоянии (кроме ртути), в жидкое состояние при нагревании. При плавлении объем металла практически не изменяется, поэтому на температуру плавления нормальное атмосферное давление не влияет .
Температура плавления металлов находится в диапазоне от -39 градусов Цельсия до +3410 градусов . Для большинства металлов температура плавления высокая, однако, некоторые металлы можно расплавить в домашних условиях при нагревании на обычной горелке (олово, свинец).
Классификация металлов по температуре плавления
- Легкоплавкие металлы , температура плавления которых колеблется до 600 градусов Цельсия, например цинк, олово, висмут .

- Среднеплавкие металлы , которые плавятся при температуре от 600 до 1600 градусов Цельсия: такие как алюминий, медь, олово, железо .
- Тугоплавкие металлы , температура плавления которых достигает более 1600 градусов Цельсия — вольфрам, титан, хром и др.
- — единственный металл, находящийся при обычных условиях (нормальное атмосферное давление, средняя температура окружающей среды) в жидком состоянии. Температура плавления ртути составляет порядка -39 градусов по Цельсию.
Таблица температур плавления металлов и сплавов
| Металл | Температура плавления, градусов Цельсия |
| Алюминий | 660,4 |
| Вольфрам | 3420 |
| Дюралюмин | ~650 |
| Железо | 1539 |
| Золото | 1063 |
| Иридий | 2447 |
| Калий | 63,6 |
| Кремний | 1415 |
| Латунь | ~1000 |
| Легкоплавкий сплав | 60,5 |
| Магний | 650 |
| Медь | 1084,5 |
| Натрий | 97,8 |
| Никель | 1455 |
| Олово | 231,9 |
| Платина | 1769,3 |
| Ртуть | –38,9 |
| Свинец | 327,4 |
| Серебро | 961,9 |
| Сталь | 1300-1500 |
| Цинк | 419,5 |
| Чугун | 1100-1300 |
При плавлении металла для изготовления металлических изделий-отливок от температуры плавления зависит выбор оборудования, материала для формовки металла и др. Следует также помнить, что при легировании металла другими элементами температура плавления чаще всего снижается .
Следует также помнить, что при легировании металла другими элементами температура плавления чаще всего снижается .
Интересный факт
Не стоит путать понятия «температура плавления металла» и «температура кипения металла» — для многих металлов эти характеристики существенно отличаются: так, серебро плавится при температуре 961 градус по Цельсию, а закипает только при достижении нагрева до 2180 градусов.
Температура плавления металла – это минимальная температура, при которой он переходит из твердого состояния в жидкое. При плавлении его объем практически не изменяется. Металлы классифицируют по температуре плавления в зависимости от степени нагревания.
Легкоплавкие металлы
Легкоплавкие металлы имеют температуру плавления ниже 600°C. Это цинк, олово, висмут. Такие металлы можно расплавить в домашних условиях, разогрев их на плите, или с помощью паяльника. Легкоплавкие металлы используются в электронике и технике для соединения металлических элементов и проводов для движения электрического тока.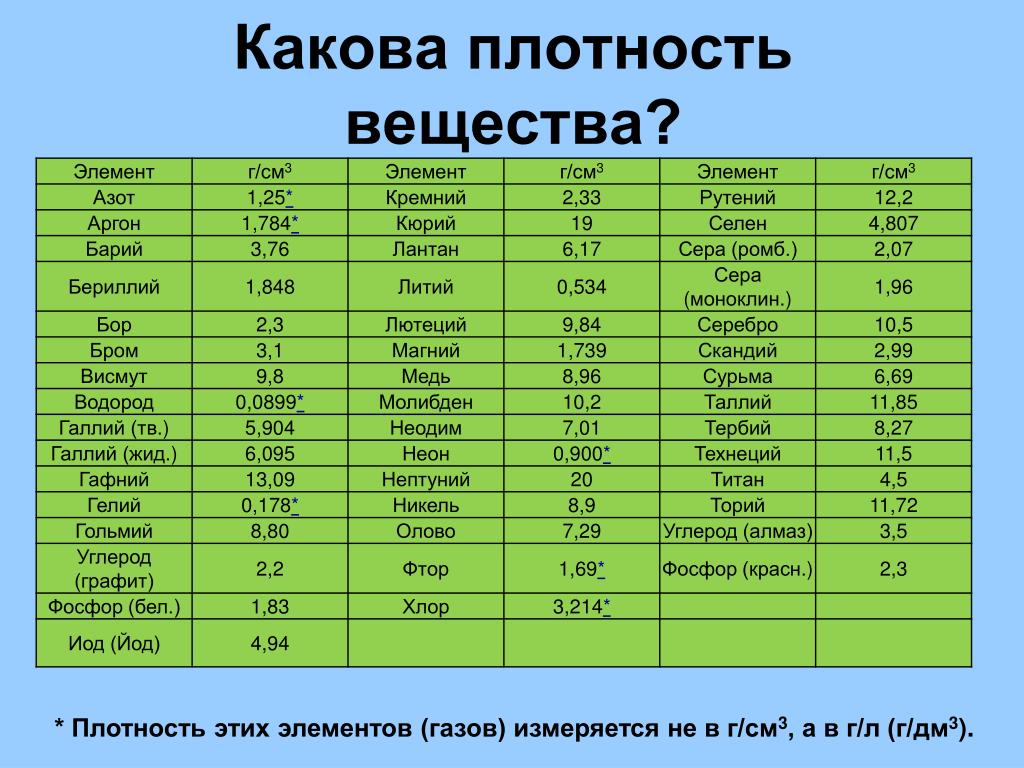 Температура плавления олова составляет 232 градуса, а цинка – 419.
Температура плавления олова составляет 232 градуса, а цинка – 419.
Среднеплавкие металлы
Среднеплавкие металлы начинают переходить из твердого в жидкое состояние при температуре от 600°C до 1600°C. Они используются для изготовления плит, арматур, блоков и других металлических конструкций, пригодных для строительства. К этой группе металлов относятся железо, медь, алюминий, они также входят в состав многих сплавов. Медь добавляют в сплавы драгоценных металлов, таких как золото, серебро, платина. Золото 750 пробы на 25% состоит из лигатурных металлов, в том числе и меди, которая придает ему красноватый оттенок. Температура плавления этого материала равна 1084 °C. А алюминий начинает плавиться при относительно низкой температуре, составляющей 660 градусов Цельсия. Это легкий пластичный и недорогой металл, который не окисляется и не ржавеет, поэтому широко используется при изготовлении посуды. Температура плавления железа равна 1539 градусов. Это один из самых популярных и доступных металлов, его применение распространено в строительстве и автомобильной промышленности. Но ввиду того, что железо подвергается коррозии, его нужно дополнительно обрабатывать и покрывать защитным слоем краски, олифы или не допускать попадания влаги.
Но ввиду того, что железо подвергается коррозии, его нужно дополнительно обрабатывать и покрывать защитным слоем краски, олифы или не допускать попадания влаги.
Тугоплавкие металлы
Температура тугоплавких металлов выше 1600°C. Это вольфрам, титан, платина, хром и другие. Их используют в качестве источников света, машинных деталей, смазочных материалов, а также в ядерной промышленности. Из них изготавливают проволоки, высоковольтные провода и используют для расплавки других металлов с более низкой температурой плавления. Платина начинает переходить из твердого в жидкое состояние при температуре 1769 градусов, а вольфрам – при температуре 3420°C.
Ртуть – единственный металл, находящийся в жидком состоянии при обычных условиях, а именно, нормальном атмосферном давлении и средней температуре окружающей среды. Температура плавления ртути составляет минус 39°C. Этот металл и его пары являются ядовитыми, поэтому он используется только в закрытых емкостях или в лабораториях. Распространенное применение ртути – градусник для измерения температуры тела.
Распространенное применение ртути – градусник для измерения температуры тела.
– первый по значимости и распространенности конструкционный материал. Известен он с глубокой древности, а свойства его таковы, что когда железо научились выплавлять в значимом количестве, металл вытеснил все остальные сплавы. Наступил век железа и, судя по , время это закончится нескоро. Данная статья расскажет вам, какова удельная плотность железа, какая у него температура плавления в чистом виде.
Железо – типичный металл, причем химически активный. Вещество вступает в реакцию при нормальной температуре, а нагрев или повышение влажности значительно увеличивают его реакционноспособность. Железо корродирует на воздухе, горит в атмосфере чистого кислорода, а в виде мелкой пыли способно воспламениться и на воздухе.
Чистому железу присуща ковкость, однако в таком виде металл встречается очень редко. На деле под железом подразумевают сплав с небольшими долями примесей – до 0,8%, которому присущи мягкость и ковкость чистого вещества. Значение для народного хозяйства имеет сплавы с углеродом – сталь, чугун, нержавеющая сталь.
Значение для народного хозяйства имеет сплавы с углеродом – сталь, чугун, нержавеющая сталь.
Железу присущ полиморфизм: выделяют целых 4 модификации, отличающиеся структурой и параметрами решетки:
- α-Fe – существует от нуля до +769 С. Имеет объемно-центрированную кубическую решетку и является ферромагнетиком, то есть, сохраняет намагниченность в отсутствие внешнего магнитного поля. +769 С – точки Кюри для металла;
- от +769 до +917 С появляется β-Fe. От α-фазы она отличается лишь параметрами решетки. Практически все физические свойства при этом сохраняются за исключением магнитных: железо становится парамагнетиком, то есть, способность намагничиваться оно утрачивает и втягивается в магнитное поле. Металловедение β-фазу как отдельную модификацию не рассматривает. Поскольку переход не влияет на значимые физические характеристики;
- в диапазоне от 917 до 1394 С существует γ-модификация, которой присуща гранецентрированная кубическая решетка;
- при температуре выше +1394 С появляется δ-фаза, для которой характерна объемно-центрированная кубическая решетка.

При высоком давлении, а также при легировании металла некоторыми добавками образуется ε- фаза с гексагонической плотноупакованной решеткой.
Температура фазовых переходов заметно изменяется при легировании тем же углеродом. Собственно, сама способность железа образовать столько модификаций служит основой обработки стали в разных температурных режимах. Без таких переходов металл не получил бы столь широкого распространения.
Теперь настал черед свойств металла железа.
О структуре железа рассказывает этот видеосюжет:
Свойства и характеристики металла
Железо – достаточно легкий, умеренно тугоплавкий металл, серебристо-серого цвета. Легко реагирует с разбавленными кислотами и поэтому считается элементом средней активности. На воздухе – сухом, металл постепенно покрывается пленкой оксида, которая препятствует дальнейшей реакции.
Но при самой небольшой влажности вместо пленки появляется ржавчина – рыхлая и неоднородная по составу.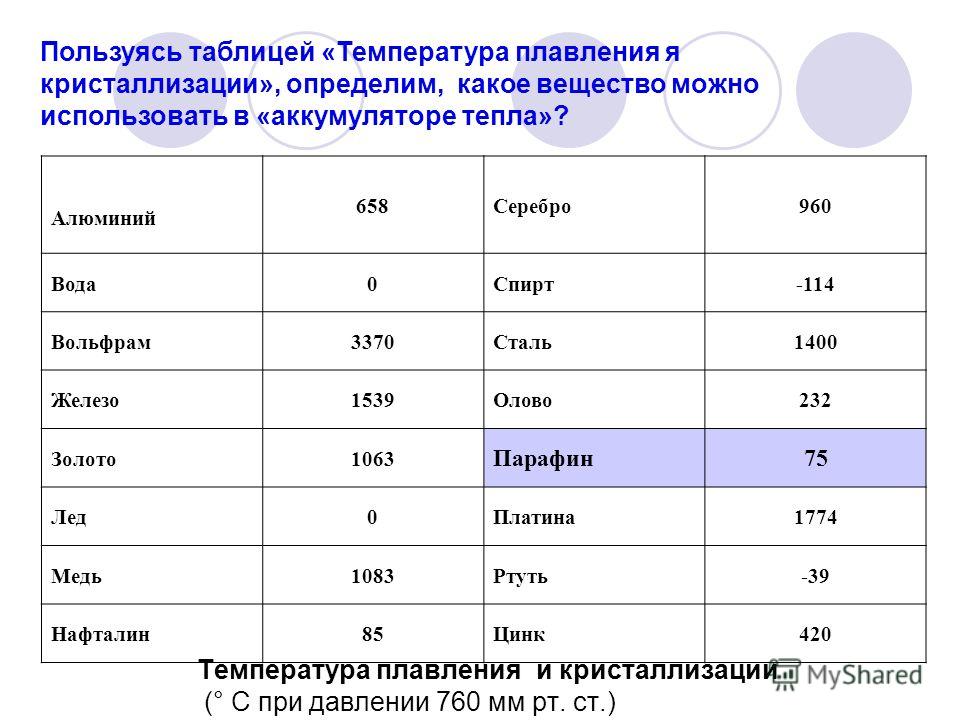 Ржавчина дальнейшей коррозии железа не препятствует. Однако физические свойства металла, а, главное, его сплавов с углеродом таковы, что, несмотря на низкую коррозийную стойкость, использование железа более чем оправдано.
Ржавчина дальнейшей коррозии железа не препятствует. Однако физические свойства металла, а, главное, его сплавов с углеродом таковы, что, несмотря на низкую коррозийную стойкость, использование железа более чем оправдано.
Масса и плотность
Молекулярная масса железа составляет 55,8, что указывает на относительную легкость вещества. А какая же у железа плотность? Такой показатель определяется фазовой модификацией:
- α-Fe – 7,87 г/куб. см при 20 С, и 7,67 г/куб. см при 600 С;
- γ-фаза отличается еще более низкой плотностью – 7,59 г/куб см при 1000С;
- плотность δ-фазы составляет 7,409 г/куб см.
С повышением температуры плотность железа закономерно падает.
А теперь давайте узнаем, какова температура плавления железа по Цельсию, сравнивая ее, например, с или чугуном.
Температурный диапазон
Металл относится к умеренно тугоплавким, что означает сравнительно невысокую температуру изменения агрегатного состояния:
- температура плавления – 1539 С;
- температура кипения – 2862 С;
- температура Кюри, то есть, утраты способности к намагничиванию – 719 С.

Стоит иметь в виду, что когда говорят о температуре плавления или кипения, имеют дело с δ-фазой вещества.
Данное видео поведает вам о физических и химических свойствах железа:
Механические характеристики
Железо и его сплавы настолько распространены, что хотя и стали использоваться позже чем, например, и , стали своеобразными эталонами. Когда сравнивают металлы, указывают на железо: крепче, чем сталь, мягче железа в 2 раза и так далее.
Характеристики приводятся для металла, включающего малые доли примесей:
- твердость по шкале Мооса – 4–5;
- твердость по Бринеллю – 350–450 Мн/кв. м. Причем у химически чистого железа твердость выше – 588–686;
Показатели прочности исключительно сильно зависят от количества и характера примесей. Эта величина регламентируется ГОСТом для каждой марки сплава или чистого метала. Так, предел прочности на сжатие для нелегированной стали составляет 400–550 МПа. При закалке этой марки предел прочности при растяжении увеличивается до 700 МПа.
- ударная вязкость металла составляет 300 Мн/кв м;
- предел текучести –100 Мн/кв. м.
О том, что надо для определения удельной теплоемкости железа, узнаем далее.
Теплоемкость и теплопроводность
Как и всякий металл, железо проводит тепло, хотя показатели его в этой области невысоки: по теплопроводности металл уступает алюминию – в 2 раза меньше, и – в 5 раз.
Теплопроводность при 25 С составляет 74,04 вт/(м·К). Величина зависит от температуры;
- при 100 к теплопроводность составляет 132 [Вт/(м.К)];
- при 300 К – 80,3 [Вт/(м.К)];
- при 400 – 69,4 [Вт/(м.К)];
- а при 1500 – 31,8 [Вт/(м.К)].
- Коэффициент температурного расширения при 20 С – 11,7·10-6.
- Теплоемкость металла определяется его фазовой структурой и довольно сложно зависит от температуры. С повышением до 250 С, теплоемкость медленно увеличивается, затем резко возрастает до достижения точки Кюри, а потом начинается снижаться.

- Удельная теплоемкость в температурном диапазоне от 0 до 1000С составляет 640,57 дж/(кг·К).
Электропроводность
Железо проводит ток, но далеко не так хорошо, как медь и серебро. Удельное электрическое сопротивление металла при нормальных условиях – 9,7·10-8 ом·м.
Поскольку железо является ферромагнетиком, его показатели в этой области более значимы:
- магнитная индукция насыщения составляет 2,18 Тл;
- магнитная проницаемость – 1,45.106.
Токсичность
Металл не представляет опасности для человеческого организма. стали и изготовления изделий из железа могут быть опасными, но только за счет высоких температур и тех добавок, которые используют при производстве различных сплавов. Отходы железа – металлолом, представляют опасность для окружающей среды, но вполне умеренную, поскольку металл ржавеет на воздухе.
Железо не обладает биологической инертностью, поэтому как материал для протезирования не используется. Однако в человеческом организме этот элемент играет одну из важнейших ролей: нарушение в усвоении железа или недостаточное количество последнего в рационе гарантирует в лучшем случае анемию.
Однако в человеческом организме этот элемент играет одну из важнейших ролей: нарушение в усвоении железа или недостаточное количество последнего в рационе гарантирует в лучшем случае анемию.
Усваивается железо с большим трудом – 5–10% от всего количества, поступаемого в организм, или 10–20%, если наблюдается его недостаток.
- Обычная суточная потребность в железе составляет 10 мг для мужчин и 20 мг для женщин.
- Токсическая доза – 200 мг/сутки.
- Летальная – 7–35 г. Получить такое количество железа практически невозможно, поэтому отравление железом встречается крайне редко.
Железо – металл, чьи физические характеристики, в частности, прочность, можно существенно изменить, прибегая к механической обработке или добавке очень небольшого количества легирующих элементов. Эта особенность в сочетании с доступностью и легкостью добычи металла делает железо самым востребованным конструкционным материалом.
Еще больше о свойствах железа расскажет специалистка в видео ниже:
В таблице представлена температура плавления металлов t пл , их температура кипения t к при атмосферном давлении, плотность металлов ρ при 25°С и теплопроводность λ при 27°С.
Температура плавления металлов, а также их плотность и теплопроводность приведены в таблице для следующих металлов: актиний Ac, серебро Ag, золото Au, барий Ba, берилий Be, кальций Ca, кадмий Cd, кобальт Co, хром Cr, цезий Cs, галлий Ga, гафний Hf, ртуть Hg, индий In, иридий Ir, калий K, литий Li, нептуний Np, осмий Os, протактиний Pa, свинец Pb, палладий Pd, полоний Po, плутоний Pu, радий Ra, рубидий Pb, рений Re, родий Rh, рутений Ru, сурьма Sb, стронций Sr, тантал Ta, технеций Tc, торий Th, таллий Tl, уран U, ванадий V, цинк Zn, цирконий Zr.
По данным таблицы видно, что температура плавления металлов изменяется в широком диапазоне (от -38,83°С у до 3422°С у вольфрама). Низкой положительной температурой плавления обладают такие металлы, как литий (18,05°С), цезий (28,44°С), рубидий (39,3°С) и другие щелочные металлы.
Наиболее тугоплавкими являются следующие металлы: гафний, иридий, молибден, ниобий, осмий, рений, рутений, тантал, технеций, вольфрам. Температура плавления этих металлов выше 2000°С.
Приведем примеры температуры плавления металлов , широко применяемых в промышленности и в быту:
- температура плавления алюминия 660,32 °С;
- температура плавления меди 1084,62 °С;
- температура плавления свинца 327,46 °С;
- температура плавления золота 1064,18 °С;
- температура плавления олова 231,93 °С;
- температура плавления серебра 961,78 °С;
- температура плавления ртути -38,83°С.
Максимальной температурой кипения из металлов, представленных в таблице, обладает рений Re — она составляет 5596°С. Также высокими температурами кипения обладают металлы, относящиеся к группе с высокой температурой плавления.
В таблице находится в диапазоне от 0,534 до 22,59 , то есть самым легким металлом является , а самым тяжелым металлом осмий. Следует отметить, что осмий имеет плотность большую, чем и даже плутония при комнатной температуре.
В таблице изменяется от 6,3 до 427 Вт/(м·град), таким образом хуже всего проводит тепло такой металл, как нептуний, а лучшим теплопроводящим металлом является серебро.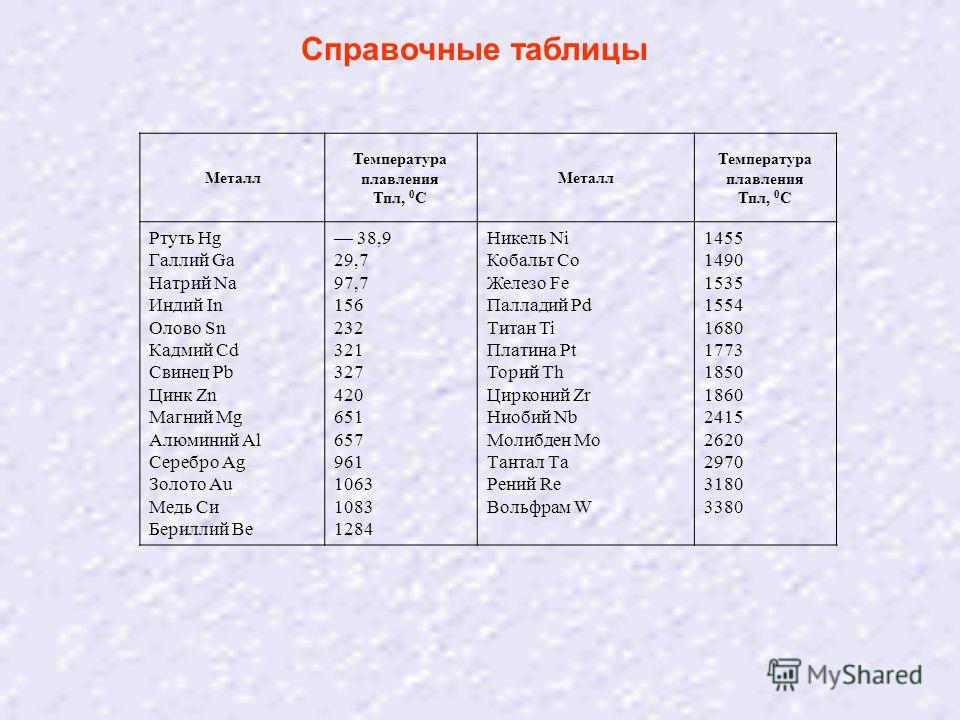
Температура плавления стали
Представлена таблица значений температуры плавления стали распространенных марок. Рассмотрены стали для отливок, конструкционные, жаропрочные, углеродистые и другие классы сталей.
Температура плавления стали находится в диапазоне от 1350 до 1535°С. Стали в таблице расположены в порядке возрастания их температуры плавления.
| Сталь | t пл, °С | Сталь | t пл, °С |
|---|---|---|---|
| Стали для отливок Х28Л и Х34Л | 1350 | Коррозионно-стойкая жаропрочная 12Х18Н9Т | 1425 |
| Сталь конструкционная 12Х18Н10Т | 1400 | Жаропрочная высоколегированная 20Х23Н13 | 1440 |
| Жаропрочная высоколегированная 20Х20Н14С2 | 1400 | Жаропрочная высоколегированная 40Х10С2М | 1480 |
| Жаропрочная высоколегированная 20Х25Н20С2 | 1400 | Сталь коррозионно-стойкая Х25С3Н (ЭИ261) | 1480 |
| Сталь конструкционная 12Х18Н10 | 1410 | Жаропрочная высоколегированная 40Х9С2 (ЭСХ8) | 1480 |
| Коррозионно-стойкая жаропрочная 12Х18Н9 | 1410 | Коррозионно-стойкие обыкновенные 95Х18…15Х28 | 1500 |
| Сталь жаропрочная Х20Н35 | 1410 | Коррозионно-стойкая жаропрочная 15Х25Т (ЭИ439) | 1500 |
| Жаропрочная высоколегированная 20Х23Н18 (ЭИ417) | 1415 | Углеродистые стали | 1535 |
Источники:
- Волков А.
 И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с. - Физические величины. Справочник. А. П. Бабичев, Н. А. Бабушкина, А. М. Братковский и др.; Под ред. И. С. Григорьева, Е. З. Мейлихова. — М.: Энергоатомиздат, 1991. — 1232 с.
В металлургической промышленности одним из основных направлений считается литье металлов и их сплавов по причине дешевизны и относительной простоты процесса. Отливаться могут формы с любыми очертаниями различных габаритов, от мелких до крупных; это подходит как для массового, так и для индивидуального производства.
Литье является одним из древнейших направлений работы с металлами, и начинается примерно с бронзового века: 7−3 тысячелетия до н. э. С тех пор было открыто множество материалов, что приводило к развитию технологии и повышению требований к литейной промышленности.
В наши дни существует много направлений и видов литья, различающихся по технологическому процессу. Одно остается неизменным — физическое свойство металлов переходить из твердого состояния в жидкое, и важно знать то, при какой температуре начинается плавление разных видов металлов и их сплавов.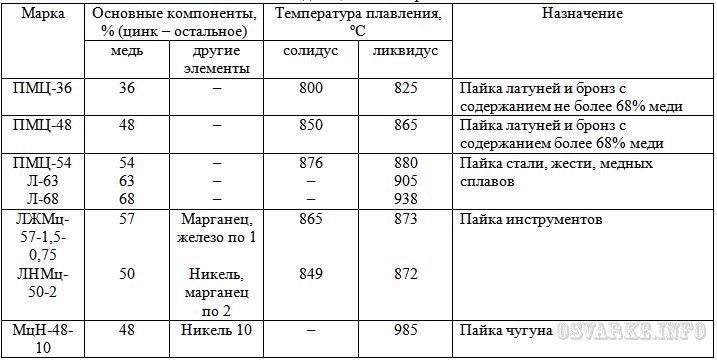
Процесс плавления металла
Данный процесс обозначает собой переход вещества из твердого состояния в жидкое. При достижении точки плавления металл может находиться как в твердом, так и в жидком состоянии, дальнейшее возрастание приведет к полному переходу материала в жидкость.
То же самое происходит и при застывании — при достижении границы плавления вещество начнет переходить из жидкого состояния в твердое, и температура не изменится до полной кристаллизации.
При этом следует помнить, что данное правило применимо только для чистого металла. Сплавы не имеют четкой границы температур и совершают переход состояний в некотором диапазоне :
- Солидус — линия температуры, при которой начинает плавиться самый легкоплавкий компонент сплава.
- Ликвидус — окончательная точка плавления всех компонентов, ниже которой начинают появляться первые кристаллы сплава.
Точно измерить температуру плавления таких веществ невозможно, точкой перехода состояний указывается числовой промежуток.
В зависимости от температуры, при которой начинается плавление металлов, их принято разделять на :
- Легкоплавкие, до 600 °C. К ним относятся олово, цинк, свинец и другие.
- Среднеплавкие, до 1600 °C. Большинство распространенных сплавов, и такие металлы как золото, серебро, медь, железо, алюминий.
- Тугоплавкие, свыше 1600 °C. Титан, молибден, вольфрам, хром.
Также существует и температура кипения — точка, при достижении которой расплавленный металл начнет переход в газообразное состояние. Это очень высокая температура, как правило, в 2 раза превышающая точку расплава.
Влияние давления
Температура плавления и равная ей температура затвердевания зависят от давления, возрастая с его повышением. Это обусловлено тем, что при повышении давления атомы сближаются между собой, а для разрушения кристаллической решетки их нужно отдалить. При повышенном давлении требуется большая энергия теплового движения и соответствующая ей температура плавления увеличивается.
Существуют исключения, когда температура, необходимая для перехода в жидкое состояние, при повышенном давлении уменьшается. К таким веществам относят лёд, висмут, германий и сурьма.
Таблица температур плавления
Любому человеку, связанному с металлургической промышленностью, будь то сварщик, литейщик, плавильщик или ювелир, важно знать температуры, при которых происходит расплав материалов, с которыми он работает. В нижеприведенной таблице указаны точки плавления наиболее распространенных веществ.
Таблица температур плавления металлов и сплавов
Помимо таблицы плавления, существует много других вспомогательных материалов. Например, ответ на вопрос, какова температура кипения железа лежит в таблице кипения веществ. Помимо кипения, у металлов есть ряд других физических свойств, как прочность.
Прочность металлов
Помимо способности перехода из твердого в жидкое состояние, одним из важных свойств материала является его прочность — возможность твердого тела сопротивлению разрушению и необратимым изменениям формы. Основным показателем прочности считается сопротивление возникающее при разрыве заготовки, предварительно отожженной. Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Обозначение прочности принято в МПа — Мега Паскалях.
Основным показателем прочности считается сопротивление возникающее при разрыве заготовки, предварительно отожженной. Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Обозначение прочности принято в МПа — Мега Паскалях.
Существуют следующие группы прочности металлов :
- Непрочные. Их сопротивление не превышает 50МПа. К ним относят олово, свинец, мягкощелочные металлы
- Прочные, 50−500МПа. Медь, алюминий, железо, титан. Материалы этой группы являются основой многих конструкционных сплавов.
- Высокопрочные, свыше 500МПа. Например, молибден и вольфрам.
Таблица прочности металлов
Наиболее распространенные в быту сплавы
Как видно из таблицы, точки плавления элементов сильно разнятся даже у часто встречающихся в быту материалов.
Так, минимальная температура плавления у ртути -38,9 °C, поэтому в условиях комнатной температуры она уже в жидком состоянии. Именно этим объясняется то, что бытовые термометры имеют нижнюю отметку в -39 градусов Цельсия: ниже этого показателя ртуть переходит в твердое состояние.
Припои, наиболее распространенные в бытовом применении, имеют в своем составе значительный процент содержания олова, имеющего точку плавления 231.9 °C, поэтому большая часть припоев плавится при рабочей температуре паяльника 250−400°C.
Помимо этого, существуют легкоплавкие припои с более низкой границей расплава, до 30 °C и применяются тогда, когда опасен перегрев спаиваемых материалов. Для этих целей существуют припои с висмутом, и плавка данных материалов лежит в интервале от 29,7 — 120 °C.
Расплавление высокоуглеродистых материалов в зависимости от легирующих компонентов лежит в границах от 1100 до 1500 °C.
Точки плавления металлов и их сплавов находятся в очень широком температурном диапазоне, от очень низких температур (ртуть) до границы в несколько тысяч градусов. Знание этих показателей, а так же других физических свойств очень важно для людей, которые работают в металлургической сфере. Например, знание того, при какой температуре плавится золото и другие металлы пригодятся ювелирам, литейщикам и плавильщикам.
Ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после ).
Смотрите так же:
СТРУКТУРА
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация — γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а 0 = 3,63), а низкотемпературная — α-Fe-решетку центрированного куба типа α-Fe (a 0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С -а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит).
 Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА
В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса.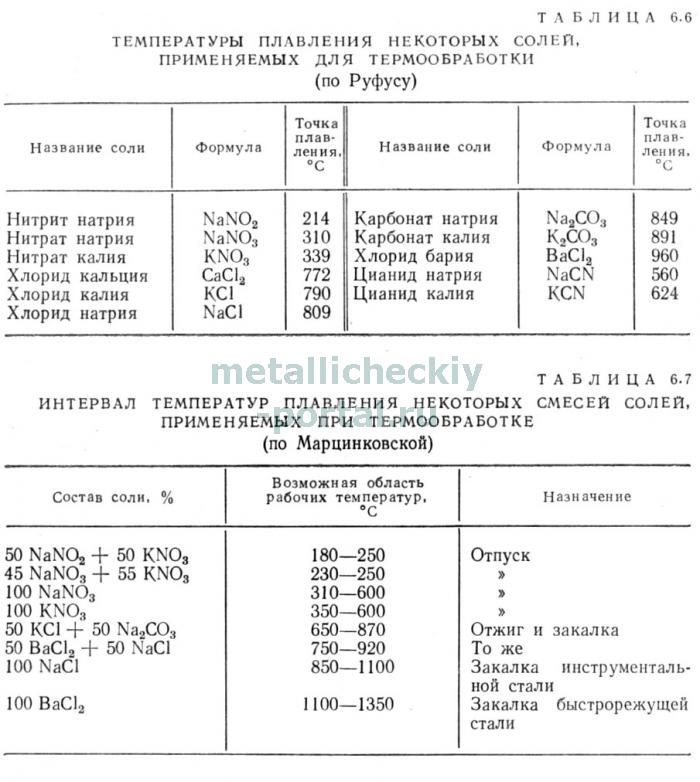 Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, — единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe 2 O 4 , Fe 3 O 4 ; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH 2 O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe 3 (PO 4) 2 ·8H 2 O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe 2 O 4 , Fe 3 O 4 ; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH 2 O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe 3 (PO 4) 2 ·8H 2 O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Содержание железа в морской воде — 1·10 −5 -1·10 −8 %
В промышленности железо получают из железной руды, в основном из гематита (Fe 2 O 3) и магнетита (FeO·Fe 2 O 3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C.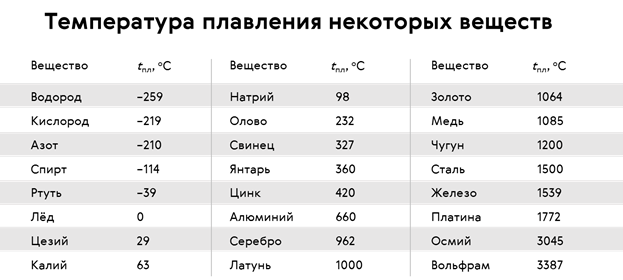 В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
ПРОИСХОЖДЕНИЕ
Происхождение теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe 1-x S) и когенит (Fe 3 C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO) n . В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
ПРИМЕНЕНИЕ
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железо (англ. Iron) — Fe
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.57
| Strunz (8-ое издание) | 1/A.07-10 |
| Nickel-Strunz (10-ое издание) | 1.AE.05 |
| Dana (7-ое издание) | 1.1.17.1 |
Новая теория объясняет, как металлы плавятся и замерзают
Физики обнаружили, как работает процесс плавления при экстремальных давлениях, таких как те, что находятся внутри ядра Земли.
Ученые разработали новую теорию замерзания и плавления таких металлов, как железо или медь.
Новые результаты опубликованы онлайн в научном журнале Nature Communications.
Ученые, стоящие за новым исследованием, надеются, что теория приблизит их к пониманию того, как металлы развиваются под экстремальным давлением внутри Земли и как жидкие металлы затвердевают, отдавая тепло окружающей среде и охлаждаясь.
Температура плавления увеличивается с давлением
Новые результаты показывают, как температура плавления вещества (точка плавления) изменяется при более высоком давлении.
Новая модель описывает, как кристалл переходит в жидкость при различных давлениях. Предсказания модели соответствуют фактическим наблюдениям. (Иллюстрация: Ульф Педерсен)
«Температура плавления обычно увеличивается, когда мы увеличиваем давление. Например, железо плавится при температуре 1538 градусов по Цельсию при давлении в одну атмосферу.Но при высоком давлении ядра Земли железо сначала плавится при температуре более 5000 градусов», — говорит ведущий автор Ульф Рорбек Педерсен из Университета Роскилле, Дания.
«Вопрос в том, как меняются явления таяния и замерзания при увеличении давления. Интересным предположением является теория Линдеманна 1910 года», — говорит Педерсен.
Когда вы нагреваете кристалл, молекулы начинают двигаться, поскольку они вибрируют вокруг своих положений внутри кристалла. Линдеманн предполагает, что в какой-то момент вибрации становятся настолько сильными, что кристалл просто разрушается и плавится.
Линдеманн предполагает, что в какой-то момент вибрации становятся настолько сильными, что кристалл просто разрушается и плавится.
«Теперь мы впервые можем понять, насколько сильными должны быть вибрации, прежде чем кристалл расплавится, и это зависит от давления, что противоречит тому, что думал Линдеманн», — говорит Педерсен.
Физики теперь могут предсказать, как быстро плавится жидкость при достижении точки плавления и, наоборот, как быстро организуются атомы, когда вещество начинает кристаллизоваться.
Подробнее: Прорыв в физике может привести к новому взгляду на магнетизм
Взгляд на то, как долго экзопланеты сохраняют тепло
Теперь физики могут начать отвечать на такие ключевые вопросы, как: почему металл плавится и замерзает при определенном давлении? Затем они могут рассчитать, как этот процесс меняется в разных условиях, например, при экстремальных давлениях.
«Я надеюсь, что нашу теорию можно будет использовать для моделирования экстремальных условий, которые встречаются в центре Земли и на других планетах, включая экзопланеты», — говорит Педерсен.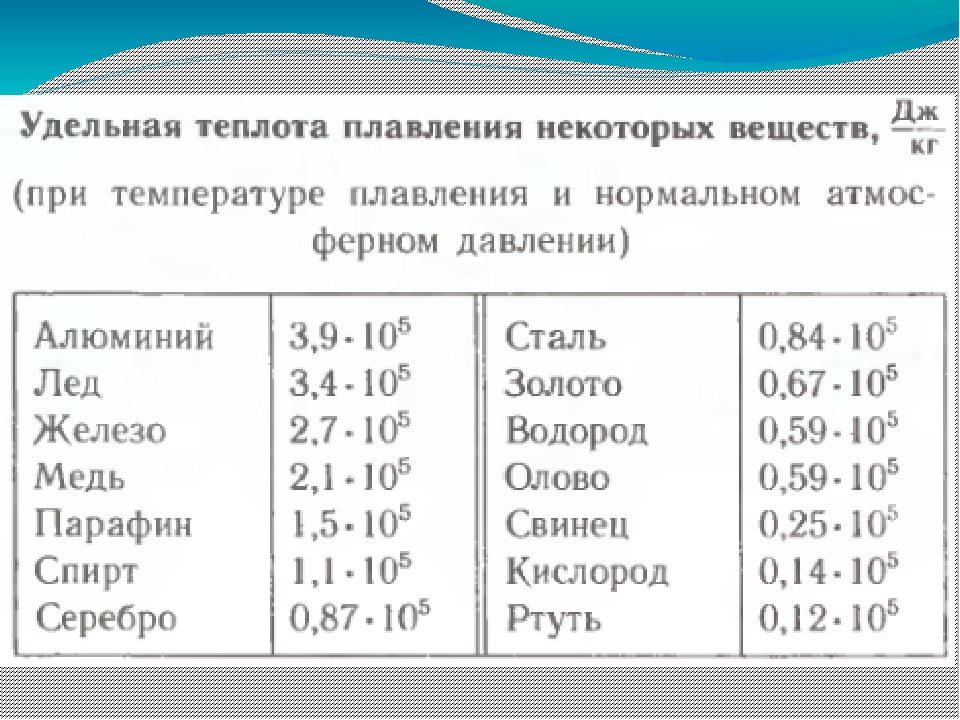
«Теория может сказать нам, как быстро растут внутренние кристаллы, что упрощает расчет времени, необходимого для остывания планеты», — говорит он.
Новые результаты могут показать, как долго экзопланеты — планеты, вращающиеся вокруг звезд, отличных от Солнца, — могут оставаться теплыми достаточно долго, чтобы поддерживать жидкую воду на своей поверхности и, следовательно, жизнь.
Подробнее: Новое открытие: малые планеты имеют круговые орбиты
————-
Прочтите датскую версию этой статьи на Videnskab.dk
Переведено: Katrin Jex
Научные ссылки
Внешние ссылки
Связанный контент
Новое открытие: малые планеты имеют круговые орбиты
Ученые разрабатывают новый метод измерения орбит планет.Это может дать важные подсказки о том, как сформировались планеты и есть ли на них потенциал для жизни.
2012 г.: Планета X движется по курсу столкновения с Землей?
Согласно интернет-группам, которые считают, что в 2012 году Земля столкнется с Планетой X, также известной как Нибиру, приближается конец света. Но астрономы говорят, что ничто не указывает на то, что конец света не за горами.
НАСА обнаружило самую маленькую планету
Космический телескоп НАСА «Кеплер» обнаружил самую маленькую из всех известных планет за пределами нашей Солнечной системы. Он такой же маленький, как наша собственная Луна.
Познакомьтесь с планетой-близнецом Земли
Все взгляды и все телескопы устремлены на недавно открытую планету, поразительно похожую на нашу.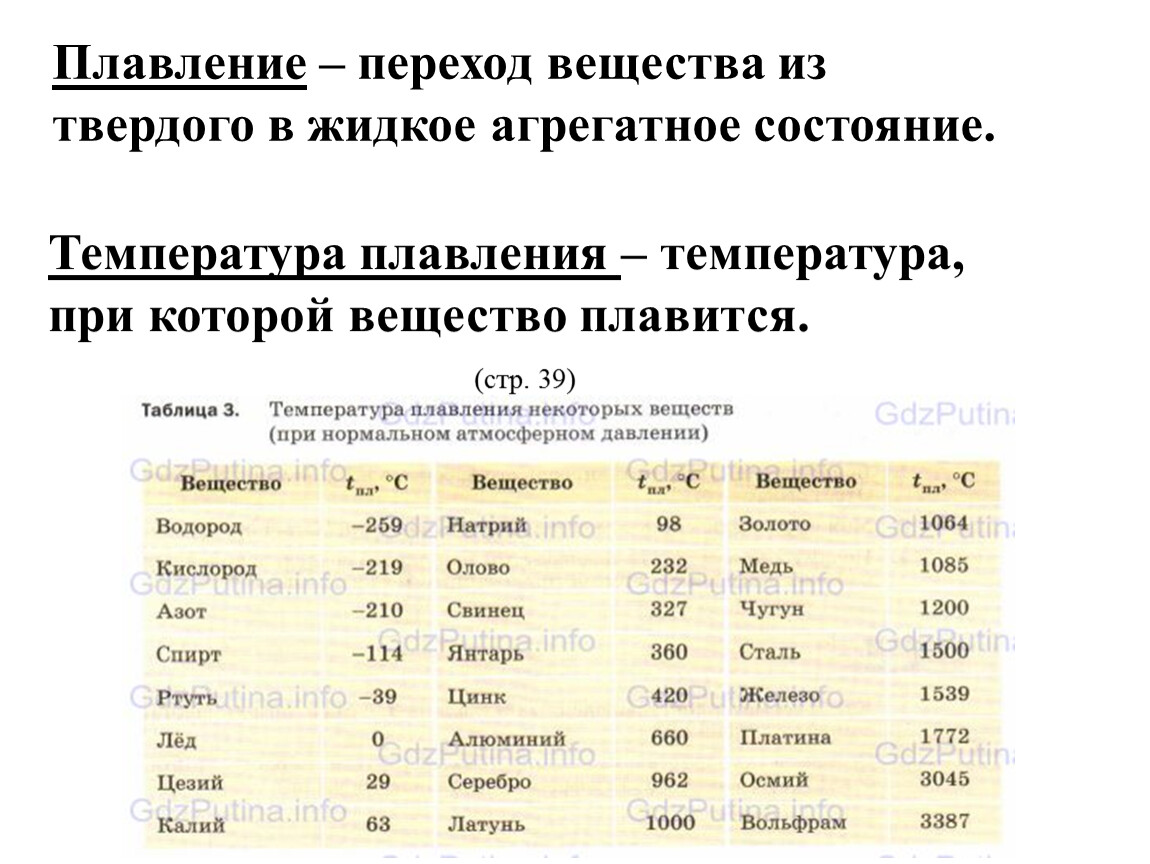
Недавно открытая планетная система меняет наше представление о формировании планет
Новые данные миссии НАСА «Кеплер» открыли то, что считалось трудным: планетарная система, которая вращается вокруг двух звезд. Нам нужно изменить наши теории, говорит датский астроном.
Железо — информация об элементе, свойства и использование
Стенограмма:
Химия в ее стихии: железо
(Промо)
Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Здравствуйте, на этой неделе мы обратимся к одному из самых важных элементов в организме человека. Это то, что делает возможным обмен веществ, и разве мы просто не знаем об этом. Есть вызовы железного человека, лидеры с железным кулаком и те, у кого, как говорят, есть железо в душе. Но у элемента номер 26 есть и темная сторона, потому что его мощный химический состав означает, что это также плохая новость для клеток мозга, как объясняет лауреат Нобелевской премии Кэри Маллис
Это то, что делает возможным обмен веществ, и разве мы просто не знаем об этом. Есть вызовы железного человека, лидеры с железным кулаком и те, у кого, как говорят, есть железо в душе. Но у элемента номер 26 есть и темная сторона, потому что его мощный химический состав означает, что это также плохая новость для клеток мозга, как объясняет лауреат Нобелевской премии Кэри Маллис
Кэри Маллис
Для человеческого мозга железо необходимо, но смертельно опасно.Он существует на Земле в основном в двух степенях окисления — FeII и FeIII. FeIII преобладает в пределах нескольких метров от атмосферы, которая около двух миллиардов лет назад превратила 20% кислорода, окисляя это железо до состояния плюс три, которое практически нерастворимо в воде. Это изменение относительно обильного и растворимого FeII тяжело отразилось почти на всем живом в то время.
Выжившие наземные и обитающие в океане микробы разработали растворимые молекулы сидерофоров, чтобы восстановить доступ к этому обильному, но иначе недоступному жизненно важному ресурсу, который использовал гидроксаматные или катехоловые хелатирующие группы, чтобы вернуть FeIII в раствор.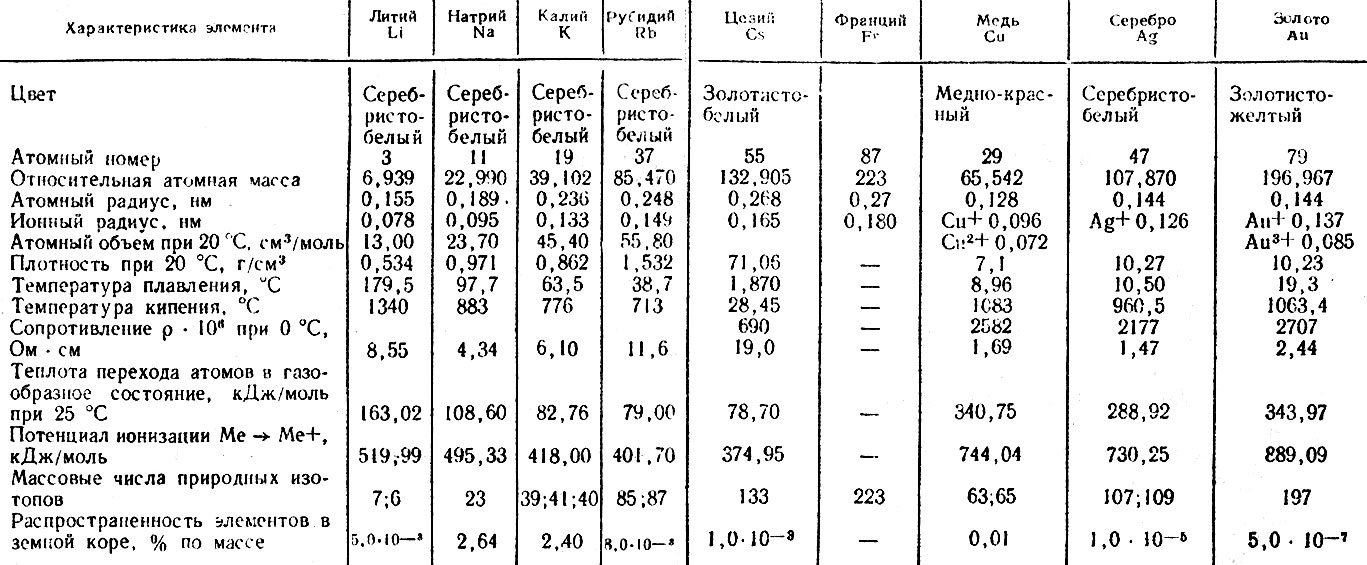 Со временем появились высшие организмы, включая животных. А животные использовали энергию рекомбинации кислорода с углеводородами и углеводами в растительной жизни, чтобы обеспечить движение. Железо было необходимо для этого процесса.
Со временем появились высшие организмы, включая животных. А животные использовали энергию рекомбинации кислорода с углеводородами и углеводами в растительной жизни, чтобы обеспечить движение. Железо было необходимо для этого процесса.
Но ни одно животное, тем не менее, не смогло адекватно справиться в долгосрочной перспективе — то есть в течение восьмидесятилетней жизни — с тем фактом, что железо необходимо для преобразования солнечной энергии в движение, но практически нерастворимо в воде при нейтральной температуре. рН и, что еще хуже, токсичен.
Углерод, сера, азот. кальций, магний, натрий и, может быть, десять других элементов также участвуют в жизни, но ни один из них не обладает силой железа для перемещения электронов, и ни один из них не может полностью разрушить всю систему. Железо делает. Для поддержания железа в определенных полезных и безопасных конфигурациях развились системы — ферменты, использующие его каталитическую силу, или трансферрины и гемосидерин, которые перемещают и сохраняют железо. Но они не идеальны. Иногда атомы железа находятся не на своем месте, и не существует известных систем для повторного захвата железа, осажденного внутри клетки.
Но они не идеальны. Иногда атомы железа находятся не на своем месте, и не существует известных систем для повторного захвата железа, осажденного внутри клетки.
В некоторых тканях клетки, перегруженные железом, могут быть переработаны или уничтожены, но это не работает для нейронов.
За время своего существования нейроны образуют тысячи отростков, формируя сети соединений с другими нейронами. В процессе развития мозга взрослого человека большой процент клеток полностью уничтожается, а некоторые добавляются новые. Это процесс обучения. Но как только область мозга заработала и работает, биологически ничего нельзя сделать, если большое количество ее клеток перестает работать по какой-либо причине.
И медленная ползучесть осаждающегося железа в течение многих десятилетий, пожалуй, чаще всего является этой причиной. В менее сложных тканях, таких как печень, могут быть активированы новые стволовые клетки, но в мозгу необходимы тренированные, структурно сложные, взаимосвязанные нейроны с тысячами проекций, которые накапливаются в течение всей жизни обучения. Таким образом, в результате возникают медленно прогрессирующие нейродегенеративные заболевания, такие как болезни Паркинсона и Альцгеймера.
Таким образом, в результате возникают медленно прогрессирующие нейродегенеративные заболевания, такие как болезни Паркинсона и Альцгеймера.
Этот же основной механизм может привести к различным заболеваниям.Есть двадцать или тридцать белков, которые имеют дело с железом в мозге — удерживают железо и передают его с места на место. Каждый новый индивидуум, наделенный новым набором хромосом, наделен новым набором этих белков. Некоторые комбинации будут лучше других, а некоторые будут опасны по отдельности и вместе.
Мутация в гене, кодирующем один из этих белков, может нарушить его функцию, что приведет к потере атомов железа. Эти атомы, потерянные из химических групп, которые их удерживают, не всегда безопасно возвращаются в какую-либо структуру, такую как трансферрин или гемоферритин.Некоторые из них вступят в реакцию с водой и будут потеряны навсегда. Только они не совсем потеряны. Они накапливаются в неудачных типах клеток, которые были назначены местами для экспрессии белков с наибольшей утечкой железа. И оксиды железа не просто занимают критическое место. Железо очень реактивно. Печально известные «активные формы кислорода», которые, как подозревают, вызывают так много возрастных заболеваний, могут просто происходить из различных форм железа.
И оксиды железа не просто занимают критическое место. Железо очень реактивно. Печально известные «активные формы кислорода», которые, как подозревают, вызывают так много возрастных заболеваний, могут просто происходить из различных форм железа.
Настало время специалистам по химии, с прицелом на химию железа, обратить внимание на нейродегенеративные заболевания.
Крис Смит
Кэри Маллис рассказывает историю о железе, элементе, без которого мы не можем обойтись, но который в то же время может стать ключом к нашему неврологическому падению. В следующий раз на Химия в своем Элементе Джонни Болл расскажет историю Марии Кюри и элемента, который она открыла и назвала в честь своей родины.
Джонни Болл
Смоляная урановая руда, содержащая уран, оказалась слишком радиоактивной, чтобы это можно было объяснить содержанием урана.Они просеивали и сортировали вручную унцию за унцией через тонны урановой смолы в сквозняке, в морозном сарае, прежде чем в конце концов были обнаружены крошечные количества полония.
Крис Смит
Так что будь радиоактивным или хотя бы активным подкастом и присоединяйся к нам, чтобы узнать загадочную историю о полонии в программе Chemistry in its Element, которая выйдет на следующей неделе. Я Крис Смит, спасибо, что выслушали, увидимся в следующий раз.
(Акция)
(Конец акции)
%PDF-1.4 % 1 0 объект >поток 2022-01-13T16:00:41-08:002013-11-19T16:08:24+05:302022-01-13T16:00:41-08:00LaTeX с пакетом гиперрефiText 4.2.0 от 1T3XTuuid:e375662c-9641- 485b-923b-c6037c577d56uuid: 4297f37c-866b-4462-9b48-db986327a728
aip.org true10.1063 / 1.48344372013-11-2010.1063 / 1.4834437http: //dx.doi.org/10.1063/1.4834437doi: 10,1063 / 1,4834437Разница между железом и бронзой
Железо против бронзы
Железо и бронза — два металла, которые использовались с незапамятных времен. Это были первые металлы, открытые человеком. Ну, железо и бронза во многом различаются, например, по своим свойствам и использованию.
Это были первые металлы, открытые человеком. Ну, железо и бронза во многом различаются, например, по своим свойствам и использованию.
Что касается происхождения двух металлов, то первой была обнаружена бронза. Бронза была обнаружена около 3000 г. до н.э., а железо начали использовать в 1000 г. до н.э.
Ну что бронза, а что железо? Бронза – это сплав олова/меди. С другой стороны, железо является металлом природного происхождения.
Одно из различий между двумя металлами заключается в том, что бронза более плотная, чем железо.В отличие от бронзы, железо легко сгибается. Еще одна вещь, которую можно увидеть, это то, что бронза может быть прочнее простого железа, но слабее науглероженного железа.
При сравнении температур плавления железо имеет более высокую температуру плавления. В то время как железо имеет температуру плавления 1600 градусов по Цельсию, бронза имеет температуру плавления 1000 градусов по Цельсию.
Ну, бронзу легче отлить, но сложнее ковать. При нагревании железо сохраняет тепло, а бронза сразу остывает. Еще одно отличие, которое можно увидеть, заключается в том, что железо ржавеет, а бронза — нет.В отличие от бронзы железо обладает магнитными свойствами.
При нагревании железо сохраняет тепло, а бронза сразу остывает. Еще одно отличие, которое можно увидеть, заключается в том, что железо ржавеет, а бронза — нет.В отличие от бронзы железо обладает магнитными свойствами.
Бронза также менее хрупкая, чем железо. Это затрудняет работу с бронзовыми металлами. При сравнении цвета двух металлов чистое железо имеет серебристо-белый цвет, тогда как бронза имеет медно-желтый или темно-серый цвет.
Хотя оба металла используются в промышленных целях, бронза широко используется в деталях машин, так как она вызывает меньшее трение, чем железо.
Резюме
1. Бронза – сплав олова и меди.С другой стороны, железо является металлом природного происхождения.
2. Бронза плотнее железа.
3. В то время как железо имеет температуру плавления 1600 градусов по Цельсию, бронза имеет температуру плавления 1000 градусов по Цельсию.
4. Бронзу легче отлить, но сложнее ковать.
5. Железо ржавеет, а бронза нет.
6. В отличие от бронзы железо обладает магнитными свойствами.
7. Бронза также менее хрупкая, чем железо. Это затрудняет работу с бронзовыми металлами.
8. Бронза прочнее простого железа, но слабее науглероженного железа.
Последние сообщения Prabhat S (посмотреть все): Если вам понравилась эта статья или наш сайт. Пожалуйста, распространите информацию. Поделитесь им с друзьями/семьей.
Cite
APA 7
S, P. (2010, 17 марта). Разница между железом и бронзой. Разница между похожими терминами и объектами. http://www.differencebetween.сеть/объект/разница-между-железом-и-бронзой/.
MLA 8
S, Прабхат. «Разница между железом и бронзой». Разница между похожими терминами и объектами, , 17 марта 2010 г., http://www.differencebetween.net/object/difference-between-iron-and-bronze/.
Ковкость и пластичность металлов
Для того чтобы легко понять два замечательных свойства ковкости и пластичности, которые в настоящее время так хорошо используются почти во всех областях механики, будет удобно подумать о ковкости или пластичные металлы, такие как свинец, олово, медь, кованое железо и сталь, как субстанции, которые можно перемещать, как тесто, которые можно раскатывать, как валиком, которые можно удлинять, вытягивая руками, которые можно впрыснуть через отверстие под давлением, как макароны, или даже что тесто можно снова вытолкнуть или собрать обратно в его первоначальную массу теста, то есть, если используются надлежащие средства для аккуратного выполнения операции, и это может быть сделано без нарушения непрерывности частиц, из которых состоит масса.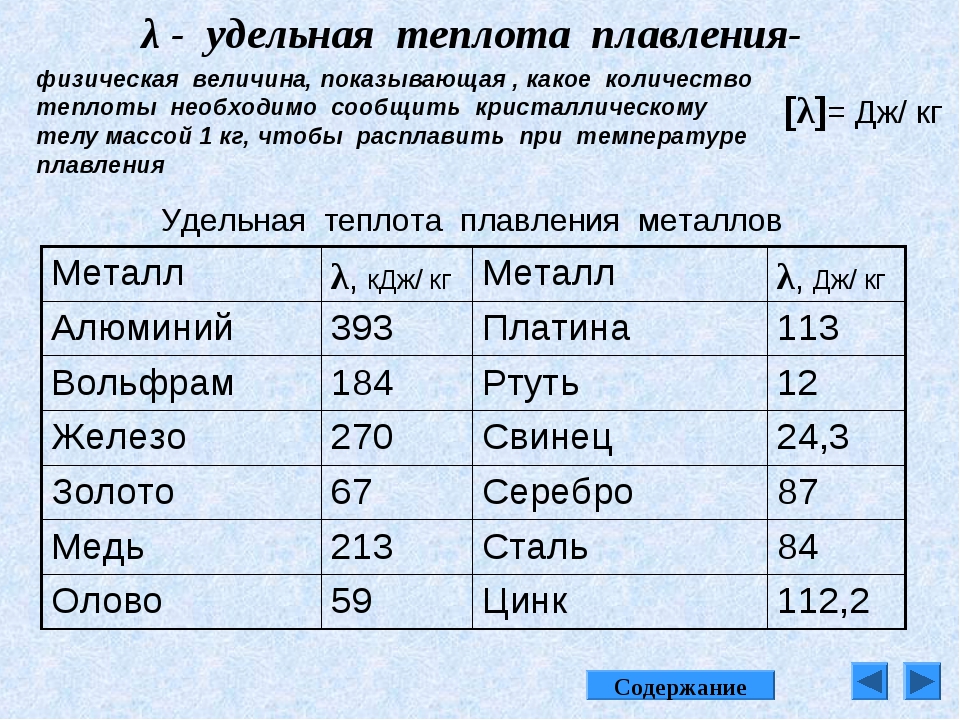 Такое утверждение может показаться невероятным, но теперь я буду перечислять многое, связанное с металлом! Я гораздо более чудесен, чем то, что я сказал о металле, и даже более странен, чем изменение в тесте. при перегоне состояния бисквита от процесса выпечки.
Трудно понять возможность податливости и пластичности, не осознавая в полной мере, что их частицы в определенном смысле жидкие, и что это связано с молекулярным строением, не настолько жидким, как вода, деготь или битум. но все же жидкость, которая будет течь при достаточном давлении, и так же, как эти жидкости требуют времени, когда на них действует сила тяжести, так и металлы требуют большего времени и большей силы, чем сила тяжести, причем скорость течения определяется природой металла. , более мягкие металлы требуют меньшего давления и текут быстрее, чем более твердые; а в случае со сталью течение чрезвычайно медленное, но с нажимом, временем и терпением его также можно преодолеть и заставить плавно течь в любую форму или форму, пока оно находится в твердом состоянии.
Такое утверждение может показаться невероятным, но теперь я буду перечислять многое, связанное с металлом! Я гораздо более чудесен, чем то, что я сказал о металле, и даже более странен, чем изменение в тесте. при перегоне состояния бисквита от процесса выпечки.
Трудно понять возможность податливости и пластичности, не осознавая в полной мере, что их частицы в определенном смысле жидкие, и что это связано с молекулярным строением, не настолько жидким, как вода, деготь или битум. но все же жидкость, которая будет течь при достаточном давлении, и так же, как эти жидкости требуют времени, когда на них действует сила тяжести, так и металлы требуют большего времени и большей силы, чем сила тяжести, причем скорость течения определяется природой металла. , более мягкие металлы требуют меньшего давления и текут быстрее, чем более твердые; а в случае со сталью течение чрезвычайно медленное, но с нажимом, временем и терпением его также можно преодолеть и заставить плавно течь в любую форму или форму, пока оно находится в твердом состоянии. может быть, чем любой другой человек в отношении исследования естественных законов, по которым течение твердых тел управляется при различных обстоятельствах, и самым интересным моментом из всего является большое сходство, которое существует между потоком твердого металла и течению воды — что в потоке твердых тел из отверстия те же сходящиеся токи, вихри и что количество выходящего металла зависит от тех же условий, что и вода при выходе из отверстий другого устройства, и только отличается степенью.С незапамятных времен золото знакомо человеку как текучий металл, одновременно ковкий и пластичный. Именно благодаря этим свойствам золото может быть выковано в листы настолько тонкие, что требуется двести девяносто тысяч, чтобы получить один дюйм толщиной, или его можно вытянуть в проволоку настолько тонкую, что унция веса удлинится на расстояние пятьдесят миль. Текучесть действия, происходящего при чеканке соверена или другого койла, очень очевидна. Этот процесс не является простой штамповкой, как его обычно считают, но частицы золота действительно должны течь таким же образом, как жидкость, из одной части штампа в другую, чтобы заполнить более глубокие слои.
может быть, чем любой другой человек в отношении исследования естественных законов, по которым течение твердых тел управляется при различных обстоятельствах, и самым интересным моментом из всего является большое сходство, которое существует между потоком твердого металла и течению воды — что в потоке твердых тел из отверстия те же сходящиеся токи, вихри и что количество выходящего металла зависит от тех же условий, что и вода при выходе из отверстий другого устройства, и только отличается степенью.С незапамятных времен золото знакомо человеку как текучий металл, одновременно ковкий и пластичный. Именно благодаря этим свойствам золото может быть выковано в листы настолько тонкие, что требуется двести девяносто тысяч, чтобы получить один дюйм толщиной, или его можно вытянуть в проволоку настолько тонкую, что унция веса удлинится на расстояние пятьдесят миль. Текучесть действия, происходящего при чеканке соверена или другого койла, очень очевидна. Этот процесс не является простой штамповкой, как его обычно считают, но частицы золота действительно должны течь таким же образом, как жидкость, из одной части штампа в другую, чтобы заполнить более глубокие слои. углубления штампа из неглубокой части пространства, и таким образом образуют совершенную монету из проникающего повсюду прилива золота.Однако, поскольку золото не является одним из самых распространенных металлов прикладной механики, его присутствие в мастерской встречается реже, чем некоторые другие, уже перечисленные bsen.
Металлы свинец и олово одновременно ковкие и ковкие, но их ковкость, или свойство растекания, намного больше, чем их пластичность, или свойство волочения; и оба, будучи мягкими и обладая свойством текучести в исключительной степени, таким образом, они могут быть разбрызганы или свернуты в любую форму или в любую форму трубы или листа, так что недостаток пластичности едва ощущается,
Диаграмма (рис.1) объяснит природу устройства, используемого для распыления этих металлов в твердом состоянии. Представляет собой мощный шприц, наполненный твердым металлом, с давлением o;]. поршень варьируется в зависимости от размеров; в некоторых требуется сила две тысячи тун. В более ранних машинах устройство было точно таким же, как и в обычном шприце, как показано на рис.
углубления штампа из неглубокой части пространства, и таким образом образуют совершенную монету из проникающего повсюду прилива золота.Однако, поскольку золото не является одним из самых распространенных металлов прикладной механики, его присутствие в мастерской встречается реже, чем некоторые другие, уже перечисленные bsen.
Металлы свинец и олово одновременно ковкие и ковкие, но их ковкость, или свойство растекания, намного больше, чем их пластичность, или свойство волочения; и оба, будучи мягкими и обладая свойством текучести в исключительной степени, таким образом, они могут быть разбрызганы или свернуты в любую форму или в любую форму трубы или листа, так что недостаток пластичности едва ощущается,
Диаграмма (рис.1) объяснит природу устройства, используемого для распыления этих металлов в твердом состоянии. Представляет собой мощный шприц, наполненный твердым металлом, с давлением o;]. поршень варьируется в зависимости от размеров; в некоторых требуется сила две тысячи тун. В более ранних машинах устройство было точно таким же, как и в обычном шприце, как показано на рис. 1, но было обнаружено, что жидкость создавала давление металла внутри шприца. такое чрезмерное трение о внутреннюю поверхность, что несколько частей быстро изнашиваются; но благодаря небольшой модификации, более соответствующей здравым принципам, недостаток был устранен.В устройстве, показанном на рис. 2, поршень содержит отверстие и, прижимаясь к верхней поверхности металла, заставляет его оставаться в состоянии покоя внутри сосуда; но так как давление жидкости одинаково во всех направлениях, твердое тело находит отверстие как точку с меньшим сопротивлением, следовательно, оно течет наружу непрерывным потоком, тем самым избегая трения твердого свинца внутри цилиндра. Таким образом, можно заметить, что свинцовый или оловянный стержень можно выдавливать любой формы и размеров в зависимости от матрицы или отверстия.В Королевском арсенале можно увидеть свинец, разбрызгиваемый таким образом в непрерывный стержень, а затем намотанный на катушки, как пряжа. снова разматываться и превращаться в пули с помощью самодействующей прессующей машины; но все несколько процессов полностью обусловлены свойством текучести.
1, но было обнаружено, что жидкость создавала давление металла внутри шприца. такое чрезмерное трение о внутреннюю поверхность, что несколько частей быстро изнашиваются; но благодаря небольшой модификации, более соответствующей здравым принципам, недостаток был устранен.В устройстве, показанном на рис. 2, поршень содержит отверстие и, прижимаясь к верхней поверхности металла, заставляет его оставаться в состоянии покоя внутри сосуда; но так как давление жидкости одинаково во всех направлениях, твердое тело находит отверстие как точку с меньшим сопротивлением, следовательно, оно течет наружу непрерывным потоком, тем самым избегая трения твердого свинца внутри цилиндра. Таким образом, можно заметить, что свинцовый или оловянный стержень можно выдавливать любой формы и размеров в зависимости от матрицы или отверстия.В Королевском арсенале можно увидеть свинец, разбрызгиваемый таким образом в непрерывный стержень, а затем намотанный на катушки, как пряжа. снова разматываться и превращаться в пули с помощью самодействующей прессующей машины; но все несколько процессов полностью обусловлены свойством текучести. Мужской механизм очень подчинен, может. варьироваться в любой степени, как того могут потребовать обстоятельства,
Трубы изготавливаются с той же легкостью, что и стержни, простой вставкой стального штифта с размером требуемого отверстия, помещаемого на дно цилиндра точно по центру отверстия, таким образом образуя кольцевое пространство, через которое металл течет наружу непрерывной трубой; или, сделав эту трубу достаточно большого диаметра, а затем разрезав ее стационарным ножом, когда она выходит из машины, труба превращается в лист свинца, который с помощью подходящих роликов можно наматывать на катушку в виде длинной ленты. паутина свинцового листа, или свинцовый лист может .раскатывать роликами. В обоих случаях приходится совершать одну и ту же механическую работу; соответствующее трение является спорным моментом.
Весьма необычный результат был получен при попытке сковать латунные трубы, которые широко используются в качестве труб паровых котлов и для целей газоснабжения. Эта латунь состояла из 60 частей меди и 40 частей цинка, а также из различных других пропорций, но, как ни странно, трубы, которые таким образом распылялись, были из цинка, а не из латуни; большая часть меди осталась в сосуде и отказывалась течь.
Мужской механизм очень подчинен, может. варьироваться в любой степени, как того могут потребовать обстоятельства,
Трубы изготавливаются с той же легкостью, что и стержни, простой вставкой стального штифта с размером требуемого отверстия, помещаемого на дно цилиндра точно по центру отверстия, таким образом образуя кольцевое пространство, через которое металл течет наружу непрерывной трубой; или, сделав эту трубу достаточно большого диаметра, а затем разрезав ее стационарным ножом, когда она выходит из машины, труба превращается в лист свинца, который с помощью подходящих роликов можно наматывать на катушку в виде длинной ленты. паутина свинцового листа, или свинцовый лист может .раскатывать роликами. В обоих случаях приходится совершать одну и ту же механическую работу; соответствующее трение является спорным моментом.
Весьма необычный результат был получен при попытке сковать латунные трубы, которые широко используются в качестве труб паровых котлов и для целей газоснабжения. Эта латунь состояла из 60 частей меди и 40 частей цинка, а также из различных других пропорций, но, как ни странно, трубы, которые таким образом распылялись, были из цинка, а не из латуни; большая часть меди осталась в сосуде и отказывалась течь. Из этого мы не должны заключать, что медь не будет течь, а скорее, что соединение между цинком и медью было меньше, чем давление, необходимое для того, чтобы заставить медь течь; смесь могла быть скорее механической, чем химической, или температура могла быть такой, что цинк находился слишком близко к температуре плавления. Каким бы ни было объяснение, предмет стоит дальнейшего эксперимента. В любой такой операции чем ближе свинец или другой металл к жидкому состоянию, тем легче ее выполнить; но он должен быть твердым.Свинец или олово могут быть раскатаны до любой степени, либо по отдельности, либо вместе, либо с тонким покрытием из олова или другого металла на одной или обеих сторонах свинца, чтобы иметь мертвое вещество, но все же покрытое оловом. поверхность, возможно, не толще, если такова, как лист, называемый фольгой, таким образом сочетая экономию, почти без каких-либо недостатков, для многих целей.
Красивой иллюстрацией текучести олова является изготовление немецкой капсулы, в которой краска для художников изготавливается для продажи и использования.
Из этого мы не должны заключать, что медь не будет течь, а скорее, что соединение между цинком и медью было меньше, чем давление, необходимое для того, чтобы заставить медь течь; смесь могла быть скорее механической, чем химической, или температура могла быть такой, что цинк находился слишком близко к температуре плавления. Каким бы ни было объяснение, предмет стоит дальнейшего эксперимента. В любой такой операции чем ближе свинец или другой металл к жидкому состоянию, тем легче ее выполнить; но он должен быть твердым.Свинец или олово могут быть раскатаны до любой степени, либо по отдельности, либо вместе, либо с тонким покрытием из олова или другого металла на одной или обеих сторонах свинца, чтобы иметь мертвое вещество, но все же покрытое оловом. поверхность, возможно, не толще, если такова, как лист, называемый фольгой, таким образом сочетая экономию, почти без каких-либо недостатков, для многих целей.
Красивой иллюстрацией текучести олова является изготовление немецкой капсулы, в которой краска для художников изготавливается для продажи и использования. Оловянная пуговица, как на рис. 3, кладется в углубление штампа с сильным нажатием; затем соответствующий пуансон или штамп, немного меньшего размера, ударяют по нему резким ударом, оставляя, таким образом, из-за разницы размеров, кольцевого пространства между ними, когда металл сразу брызжет вверх, как вода, но со скоростью, намного превышающей скорость, которую может уследить глаз, превращая таким образом его в совершенную капсулу Форма пуансона и штампа зависит на этом изделии, но во всех случаях должен быть обеспечен доступ атмосферы при удалении из штампов.контроля, и, зная простые законы, он может модифицировать аппарат тысячами различных способов, чтобы произвести все, что может потребоваться.
Оловянная пуговица, как на рис. 3, кладется в углубление штампа с сильным нажатием; затем соответствующий пуансон или штамп, немного меньшего размера, ударяют по нему резким ударом, оставляя, таким образом, из-за разницы размеров, кольцевого пространства между ними, когда металл сразу брызжет вверх, как вода, но со скоростью, намного превышающей скорость, которую может уследить глаз, превращая таким образом его в совершенную капсулу Форма пуансона и штампа зависит на этом изделии, но во всех случаях должен быть обеспечен доступ атмосферы при удалении из штампов.контроля, и, зная простые законы, он может модифицировать аппарат тысячами различных способов, чтобы произвести все, что может потребоваться.
Сварка, пайка и точки плавления обычных металлов
В мире стали и металлов обычным процессом является соединение двух или более металлических деталей. Для этой цели используется несколько распространенных форматов, включая сварку и пайку, и выбор зависит от нескольких важных факторов.
В Wasatch Steel мы предоставляем широкий спектр услуг и продукции из стали, от стальных труб и прутков до стальных труб и множества других вариантов.В сегодняшнем блоге мы рассмотрим как сварку, так и пайку, а также фактор, который имеет жизненно важное значение в обоих процессах: температура плавления. Оттуда мы углубимся в общие температуры плавления как для стали, так и для некоторых других типов металлов на тот случай, если вам когда-нибудь понадобится базовая справочная информация по комбинированию различных металлов.
Сварка Против. Пайка
Как известно, процесс сварки включает в себя соединение двух секций данного металла путем нагревания обеих секций до точки плавления. Это приводит к образованию пула жидкого расплава, и молекулы из каждой области металла могут полностью смешиваться — часто в этот пул также добавляется третий металл.Когда металл заканчивает остывать, в результате получается полностью сплавленный материал, который был связан вместе.
Пайка, с другой стороны, представляет собой процесс, в котором используется кислородно-ацетиленовая горелка для нагрева присадочного металла, чаще всего латунного сплава. Смысл использования такого наполнителя заключается в том, что он будет иметь более низкую температуру плавления, чем два металла, которые на самом деле объединяются — когда он плавится, он втягивается в стык между ними. Когда он остывает, он обеспечивает комбинированное соединение, даже не требуя полного расплавления двух металлов.Это означает, что соединение не такое прочное, как сварка.
Смысл использования такого наполнителя заключается в том, что он будет иметь более низкую температуру плавления, чем два металла, которые на самом деле объединяются — когда он плавится, он втягивается в стык между ними. Когда он остывает, он обеспечивает комбинированное соединение, даже не требуя полного расплавления двух металлов.Это означает, что соединение не такое прочное, как сварка.
В каждом из этих случаев, как вы могли догадаться, понимание температуры плавления металла жизненно важно. Если вы комбинируете два металла с разной температурой плавления, например, в обычных процессах соединения меди и стали, пайка часто является лучшим процессом. С другой стороны, для тех, кто объединяет два одинаковых или похожих металла, сварка обычно является лучшим выбором.
Общие температуры плавления металлов
Вот общие температуры плавления многих распространенных металлов (имейте в виду, что они будут несколько варьироваться в зависимости от точного состава сплава):
- Сталь: 2500 градусов по Фаренгейту (используется для всех последующих списков)
- Нержавеющая сталь: 2750 градусов
- Свинец: 621 градус (один из самых низких доступных)
- Алюминий: 1218 градусов (может варьироваться в широких пределах в зависимости от добавок легирующих металлов)
- Бронза: 1675 градусов (выше для подшипниковой бронзы и кремниевой бронзы)
- Латунь: 1700 градусов
- Медь: 1981 градус
- Чугун: 2200 градусов
- Никель: 2646 градусов
- Железо: 2800 градусов
- Кованое железо: 2700 градусов
- Вольфрам: 6150 градусов
Чтобы узнать больше о температурах плавления различных металлов или стальных сплавов, а также о наших стальных продуктах или услугах, обратитесь к сотрудникам Wasatch Steel сегодня.

 Всё больше и больше углерода попадало из аустенита в перлит, в перлите росло количество цементита по отношению к ферриту, а само железо становилось всё лучше и лучше, превращаясь шаг за шагом в качественную углеродистую сталь.
Всё больше и больше углерода попадало из аустенита в перлит, в перлите росло количество цементита по отношению к ферриту, а само железо становилось всё лучше и лучше, превращаясь шаг за шагом в качественную углеродистую сталь.

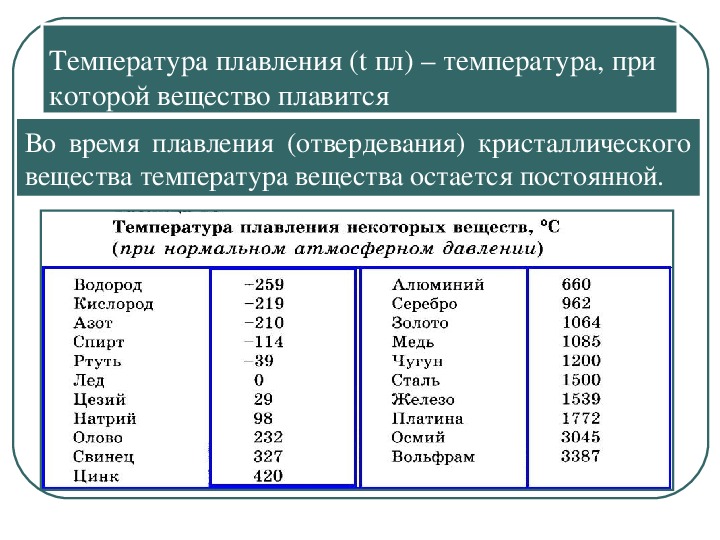 Это один из самых распространенных металлов, используемых в промышленности, особенно в автомобильной. Однако железо подвержено коррозии, то есть ржавчине, поэтому ему требуется специальная поверхностная обработка. Его необходимо покрывать краской или олифой, и не допускать попадание влаги.
Это один из самых распространенных металлов, используемых в промышленности, особенно в автомобильной. Однако железо подвержено коррозии, то есть ржавчине, поэтому ему требуется специальная поверхностная обработка. Его необходимо покрывать краской или олифой, и не допускать попадание влаги.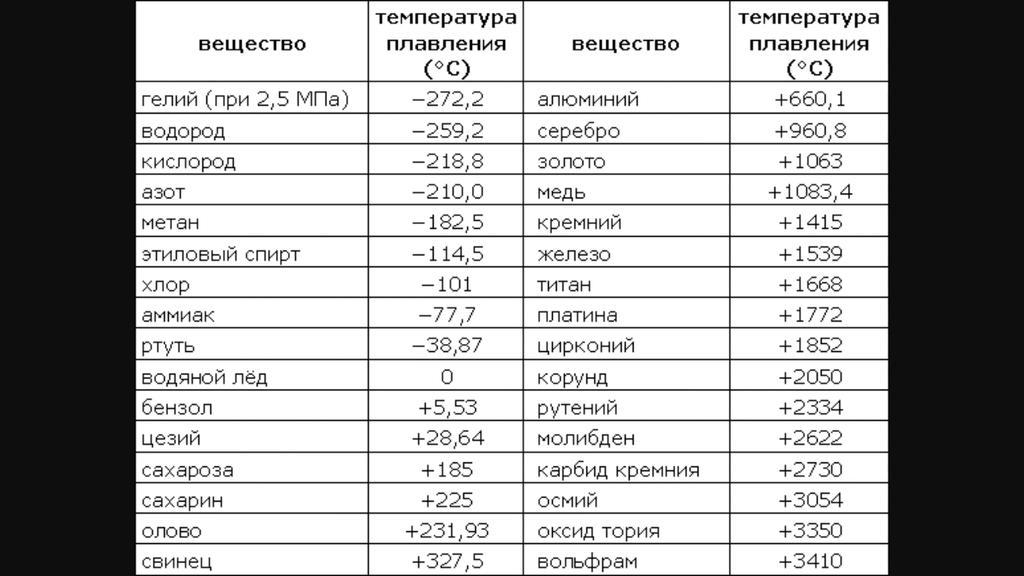 К ним относят олово, свинец, мягкощелочные металлы
К ним относят олово, свинец, мягкощелочные металлы В качестве примера укажем олово, к которому могут добавлять другие вещества (например, серебро). Примеси позволяют делать материал более либо менее устойчивым к нагреву.
В качестве примера укажем олово, к которому могут добавлять другие вещества (например, серебро). Примеси позволяют делать материал более либо менее устойчивым к нагреву. В ядре Земли металл присутствует в нейтральной форме.
В ядре Земли металл присутствует в нейтральной форме.
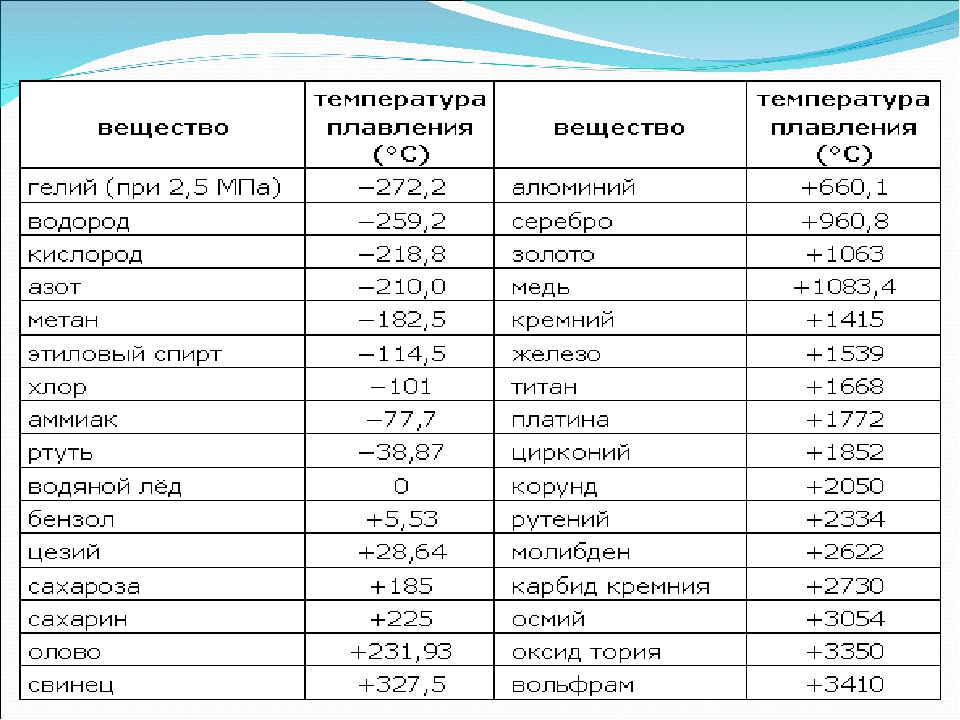 Она колеблется в зависимости от насыщенности стали компонентами;
Она колеблется в зависимости от насыщенности стали компонентами;


 Они могут применяться для расплавки других металлов, изготовления высоковольтных проводов или проволоки. Платину можно расплавить при 1769 градусах, а вольфрам — при 3420 °C.
Они могут применяться для расплавки других металлов, изготовления высоковольтных проводов или проволоки. Платину можно расплавить при 1769 градусах, а вольфрам — при 3420 °C. °С)
°С) 

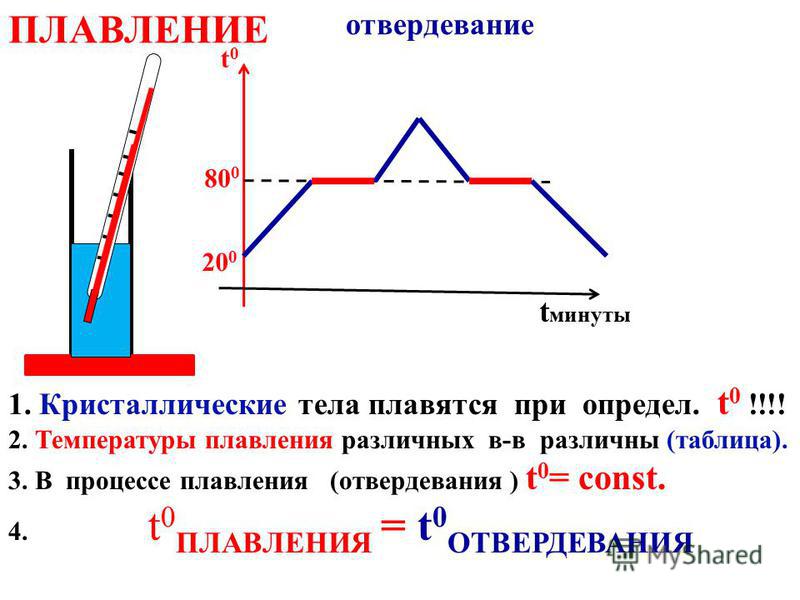
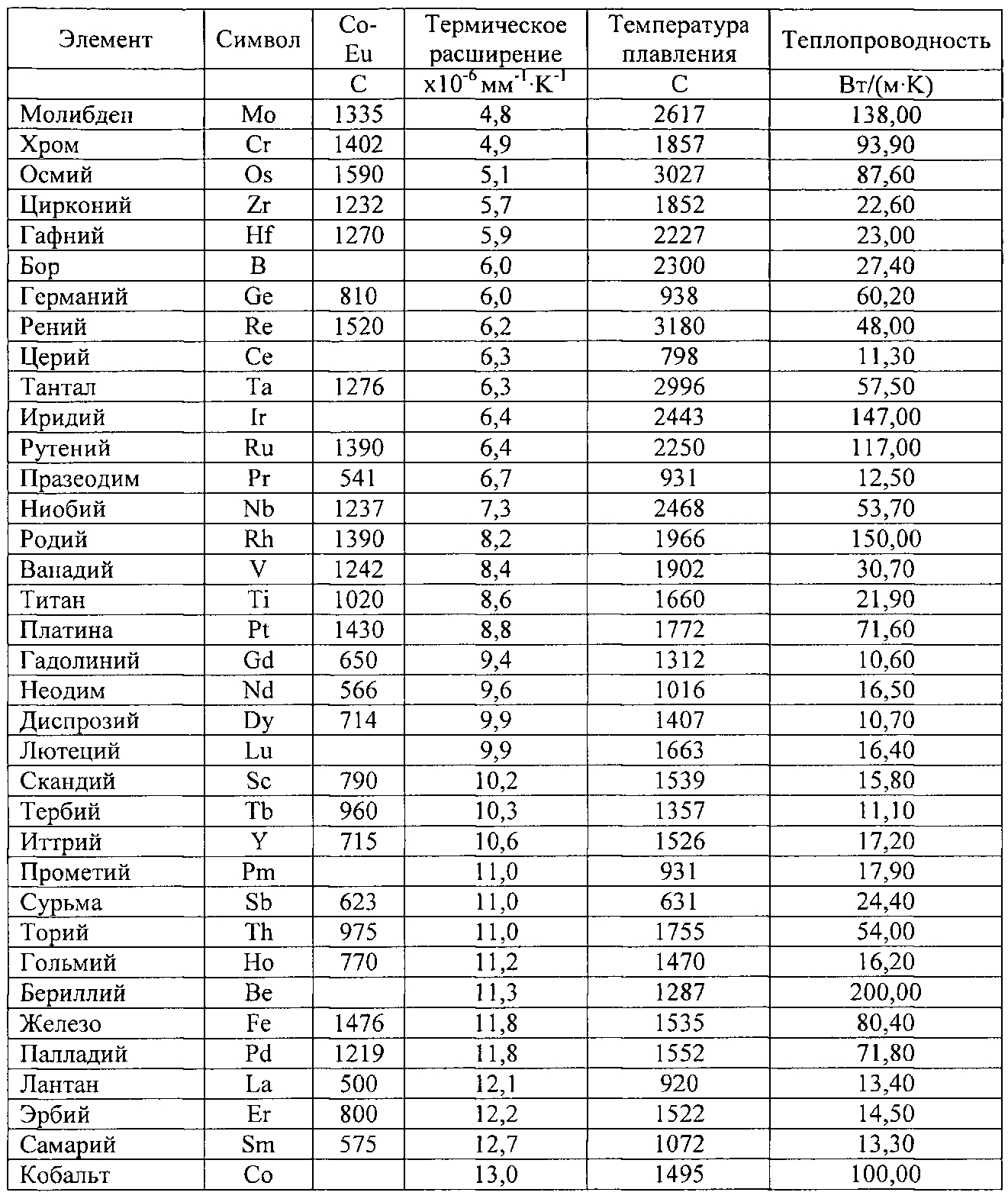
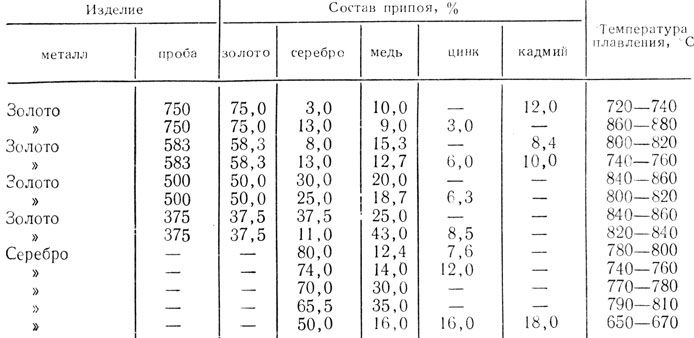 И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с. Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами. Главными рудами являются оксиды гематита Fe 2 O 3 и магнетита Fe 3 O 4 и его карбонатного сидерита FeCO 3 .Железо также образует оксидные минералы лепидокрокит и гетит, каждый из которых имеет общую формулу FeO(OH). Железо встречается с марганцем и цинком в оксидном минерале франклините. Другой оксид с бором (борат) с железом, титаном и магнием – варвикит. Вольфрам встречается с железом и марганцем в минеральном вольфрамите.
Главными рудами являются оксиды гематита Fe 2 O 3 и магнетита Fe 3 O 4 и его карбонатного сидерита FeCO 3 .Железо также образует оксидные минералы лепидокрокит и гетит, каждый из которых имеет общую формулу FeO(OH). Железо встречается с марганцем и цинком в оксидном минерале франклините. Другой оксид с бором (борат) с железом, титаном и магнием – варвикит. Вольфрам встречается с железом и марганцем в минеральном вольфрамите.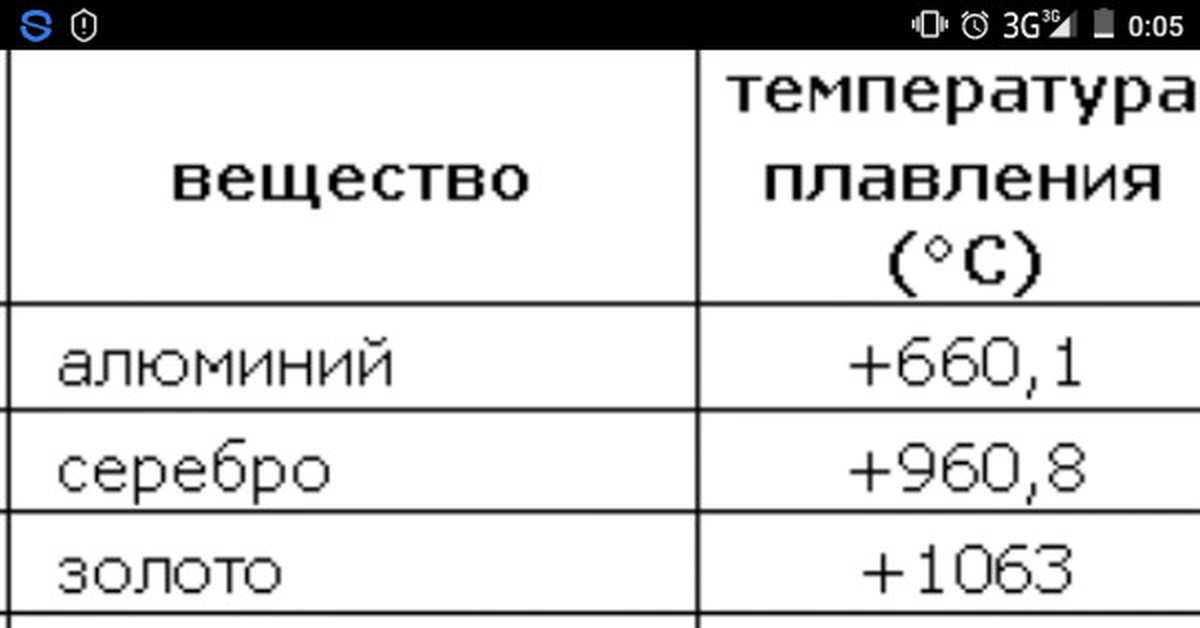 Железо образует некоторые фосфаты, такие как вивианит. Титан и железо вместе образуют оксид ильменита FeTiO 3 .Хром и железо вместе образуют оксид хромита FeCr 2 O 4 . Железо образует оксидный минерал с титаном, свинцом и марганцем, называемый сенаитом. Железо соединяется в сульфид с медью и сурьмой, называемый тетраэдритом. Сульфид с сурьмой образует минерал бертьерит. Сульфиды с медью включают борнит Cu 5 FeS 4 и кубанит CuFe 2 S 3 . Сульфид, образованный оловом, свинцом и сурьмой, называется цилиндрритом. Железо содержится в минерале нагьягите, сульфиде, наряду с золотом, свинцом, сурьмой и теллуром.Теннантит представляет собой сульфид, содержащий железо, мышьяк, медь и сурьму. Германит представляет собой сульфид, который содержит медь, германий и железо. В сульфидном бетехтините соединяются свинец, медь и железо. Кобальт соединяется с железом и мышьяком в сульфидном глаукодоте, (Co,Fe)AsS. Цинк и железо образуют сульфидный вюртцит (Zn, Fe)S.
Железо образует некоторые фосфаты, такие как вивианит. Титан и железо вместе образуют оксид ильменита FeTiO 3 .Хром и железо вместе образуют оксид хромита FeCr 2 O 4 . Железо образует оксидный минерал с титаном, свинцом и марганцем, называемый сенаитом. Железо соединяется в сульфид с медью и сурьмой, называемый тетраэдритом. Сульфид с сурьмой образует минерал бертьерит. Сульфиды с медью включают борнит Cu 5 FeS 4 и кубанит CuFe 2 S 3 . Сульфид, образованный оловом, свинцом и сурьмой, называется цилиндрритом. Железо содержится в минерале нагьягите, сульфиде, наряду с золотом, свинцом, сурьмой и теллуром.Теннантит представляет собой сульфид, содержащий железо, мышьяк, медь и сурьму. Германит представляет собой сульфид, который содержит медь, германий и железо. В сульфидном бетехтините соединяются свинец, медь и железо. Кобальт соединяется с железом и мышьяком в сульфидном глаукодоте, (Co,Fe)AsS. Цинк и железо образуют сульфидный вюртцит (Zn, Fe)S.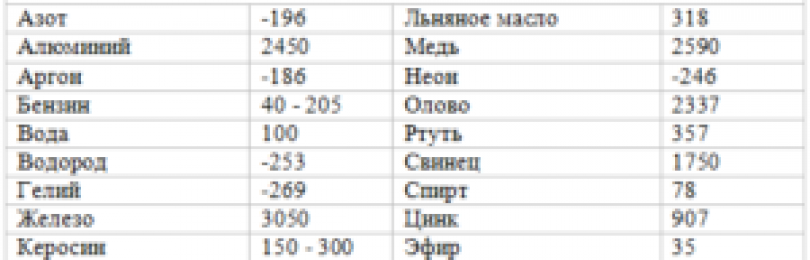
 Никель-железные метеориты довольно распространены.
Никель-железные метеориты довольно распространены. Производственный процесс устраняет почти весь фосфор, серу и кремний, которые присутствуют в обычном чугуне. Диапазон содержания углерода для сталей составляет от 0,1 до 1,5%. Низкоуглеродистые стали (
Производственный процесс устраняет почти весь фосфор, серу и кремний, которые присутствуют в обычном чугуне. Диапазон содержания углерода для сталей составляет от 0,1 до 1,5%. Низкоуглеродистые стали (