Титан (элемент) | это… Что такое Титан (элемент)?
У этого термина существуют и другие значения, см. Титан.
| 22 | Титан |
Ti 47,867 | |
| 3d24s2 | |
Тита́н (лат. Titanium; обозначается символом Ti) — элемент побочной подгруппы четвёртой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 22. Простое вещество титан (CAS-номер: 7440-32-6) — лёгкий металл серебристо-белого цвета. Существует в двух кристаллических модификациях: α-Ti с гексагональной плотноупакованной решёткой, β-Ti с кубической объёмно-центрированной упаковкой, температура полиморфного превращения α↔β 883 °C[1]. Температура плавления 1660±20 °C[2].
Содержание
|
История
Открытие TiO2 сделали практически одновременно и независимо друг от друга англичанин У. Грегор и немецкий химик М. Г. Клапрот. У. Грегор, исследуя состав магнитного железистого песка (Крид, Корнуолл, Англия, 1791), выделил новую «землю» (оксид) неизвестного металла, которую назвал менакеновой. В 1795 г. немецкий химик Клапрот открыл в минерале рутиле новый элемент и назвал его титаном. Спустя два года Клапрот установил, что рутил и менакеновая земля — оксиды одного и того же элемента, за которым и осталось название «титан», предложенное Клапротом. Через 10 лет открытие титана состоялось в третий раз. Французский учёный Л. Воклен обнаружил титан в анатазе и доказал, что рутил и анатаз — идентичные оксиды титана.
Первый образец металлического титана получил в 1825 году Й. Я. Берцелиус. Из-за высокой химической активности титана и сложности его очистки чистый образец Ti получили голландцы А. ван Аркел и И. де Бур в 1925 году термическим разложением паров иодида титана TiI4.
Я. Берцелиус. Из-за высокой химической активности титана и сложности его очистки чистый образец Ti получили голландцы А. ван Аркел и И. де Бур в 1925 году термическим разложением паров иодида титана TiI4.
Происхождение названия
Металл получил своё название в честь титанов, персонажей древнегреческой мифологии, детей Геи. Название элементу дал Мартин Клапрот в соответствии со своими взглядами на химическую номенклатуру в противовес французской химической школе, где элемент старались называть по его химическим свойствам. Поскольку немецкий исследователь сам отметил невозможность определения свойств нового элемента только по его оксиду, он подобрал для него имя из мифологии, по аналогии с открытым им ранее ураном.
Однако согласно другой версии, публиковавшейся[источник не указан 312 дней] в журнале «Техника-Молодежи» в конце 1980-х, новооткрытый металл обязан своим именем не могучим титанам из древнегреческих мифов, а Титании — королеве фей в германской мифологии (жена Оберона в шекспировском «Сне в летнюю ночь»). Такое название связано с необычайной «лёгкостью» (малой плотностью) металла.
Такое название связано с необычайной «лёгкостью» (малой плотностью) металла.
Нахождение в природе
Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре 0,57 % по массе, в морской воде 0,001 мг/л[3]. В ультраосновных породах 300 г/т, в основных — 9 кг/т, в кислых 2,3 кг/т, в глинах и сланцах 4,5 кг/т. В земной коре титан почти всегда четырёхвалентен и присутствует только в кислородных соединениях. В свободном виде не встречается. Титан в условиях выветривания и осаждения имеет геохимическое сродство с Al2O3. Он концентрируется в бокситах коры выветривания и в морских глинистых осадках. Перенос титана осуществляется в виде механических обломков минералов и в виде коллоидов. До 30 % TiO2 по весу накапливается в некоторых глинах. Минералы титана устойчивы к выветриванию и образуют крупные концентрации в россыпях. Известно более 100 минералов, содержащих титан. Важнейшие из них: рутил TiO2, ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит CaTiO3, титанит CaTiSiO5. Различают коренные руды титана — ильменит-титаномагнетитовые и россыпные — рутил-ильменит-цирконовые.
Различают коренные руды титана — ильменит-титаномагнетитовые и россыпные — рутил-ильменит-цирконовые.
Месторождения
Месторождения титана находятся на территории ЮАР, России, Украины, Китая, Японии, Австралии, Индии, Цейлона, Бразилии, Южной Кореи, Казахстана[4].
Запасы и добыча
Основные руды: ильменит (FeTiO3), рутил (TiO2), титанит (CaTiSiO5).
На 2002 год, 90 % добываемого титана использовалось на производство диоксида титана TiO2. Мировое производство диоксида титана составляло 4,5 млн т. в год. Подтверждённые запасы диоксида титана (без России) составляют около 800 млн т. На 2006 год, по оценке Геологической службы США, в пересчёте на диоксид титана и без учёта России, запасы ильменитовых руд составляют 603—673 млн т., а рутиловых — 49.7—52.7 млн т[5]. Таким образом, при нынешних темпах добычи мировых разведанных запасов титана (без учёта России) хватит более, чем на 150 лет.
Россия обладает вторыми в мире, после Китая, запасами титана. Минерально-сырьевую базу титана России составляют 20 месторождений (из них 11 коренных и 9 россыпных), достаточно равномерно рассредоточенных по территории страны. Самое крупное из разведанных месторождений (Ярегское) находится в 25 км от города Ухта (Республика Коми). Запасы месторождения оцениваются в 2 миллиарда тонн руды со средним содержанием диоксида титана около 10 %[6].
Минерально-сырьевую базу титана России составляют 20 месторождений (из них 11 коренных и 9 россыпных), достаточно равномерно рассредоточенных по территории страны. Самое крупное из разведанных месторождений (Ярегское) находится в 25 км от города Ухта (Республика Коми). Запасы месторождения оцениваются в 2 миллиарда тонн руды со средним содержанием диоксида титана около 10 %[6].
Крупнейший в мире производитель титана — российская компания «ВСМПО-АВИСМА»[7].
Получение
Брусок кристаллического титана (чистота 99,995 %, вес ≈283 г, длина ≈14 см, диаметр ≈25 мм), изготовленный на заводе «Уралредмет» иодидным методом ван Аркеля и де Бура
Как правило, исходным материалом для производства титана и его соединений служит диоксид титана со сравнительно небольшим количеством примесей. В частности, это может быть рутиловый концентрат, получаемый при обогащении титановых руд. Однако запасы рутила в мире весьма ограничены, и чаще применяют так называемый синтетический рутил или титановый шлак, получаемые при переработке ильменитовых концентратов.
Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4:
Образующиеся пары TiCl4 при 850 °C восстанавливают магнием:
Полученную титановую «губку» переплавляют и очищают. Рафинируют титан иодидным способом или электролизом, выделяя Ti из TiCl
Физические свойства
Титан — легкий серебристо-белый металл. Существует в двух кристаллических модификациях: α-Ti с гексагональной плотноупакованной решёткой (a=2,951 Å; с=4,679 Å[8]; z=2; пространственная группа C6mmc), β-Ti с кубической объёмноцентрированной упаковкой (a=3,269 Å; z=2; пространственная группа Im3m), температура перехода α↔β 883 °C, ΔH перехода 3,8 кДж/моль. Точка плавления 1660±20 °C, точка кипения 3260 °C, плотность α-Ti и β-Ti соответственно равна 4,505 (20 °C) и 4,32 (900 °C) г/см³[1], атомная плотность 5,71·1022 ат/см³[источник не указан 1191 день]. Пластичен, сваривается в инертной атмосфере. Удельное сопротивление 0,42 мкОм·м при 20 °C
Существует в двух кристаллических модификациях: α-Ti с гексагональной плотноупакованной решёткой (a=2,951 Å; с=4,679 Å[8]; z=2; пространственная группа C6mmc), β-Ti с кубической объёмноцентрированной упаковкой (a=3,269 Å; z=2; пространственная группа Im3m), температура перехода α↔β 883 °C, ΔH перехода 3,8 кДж/моль. Точка плавления 1660±20 °C, точка кипения 3260 °C, плотность α-Ti и β-Ti соответственно равна 4,505 (20 °C) и 4,32 (900 °C) г/см³[1], атомная плотность 5,71·1022 ат/см³[источник не указан 1191 день]. Пластичен, сваривается в инертной атмосфере. Удельное сопротивление 0,42 мкОм·м при 20 °C
Имеет высокую вязкость, при механической обработке склонен к налипанию на режущий инструмент, и поэтому требуется нанесение специальных покрытий на инструмент, различных смазок.
При обычной температуре покрывается защитной пассивирующей плёнкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной).
Титановая пыль имеет свойство взрываться. Температура вспышки 400 °C. Титановая стружка пожароопасна.
Химические свойства
Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок, а также в тонкой стружке или проволоке титан пирофорен[9].
Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF, H3PO4 и концентрированной H2SO4).
Легко реагирует даже со слабыми кислотами в присутствии комплексообразователей, например, с плавиковой кислотой HF он взаимодействует благодаря образованию комплексного аниона [TiF6]2−.
При нагревании на воздухе до 1200 °C Ti загорается с образованием оксидных фаз переменного состава TiOx. Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2. Гидроксид TiO(OH)2·xH 2O и диоксид TiO2амфотерны.
TiO2 взаимодействует с серной кислотой при длительном кипячении. При сплавлении с содой Na2CO3 или поташом K2CO3 оксид TiO2 образует титанаты:
При нагревании Ti взаимодействует с галогенами. Тетрахлорид титана TiCl4 при обычных условиях — бесцветная жидкость, сильно дымящая на воздухе, что объясняется гидролизом TiCl4 содержащимися в воздухе парами воды и образованием мельчайших капелек HCl и взвеси гидроксида титана.
Восстановлением TiCl4водородом, алюминием, кремнием, другими сильными восстановителями, получен трихлорид и дихлорид титана TiCl3 и TiCl2 — твёрдые вещества, обладающие сильными восстановительными свойствами. Ti взаимодействует с Br2 и I
С азотом N2 выше 400 °C титан образует нитрид TiNx(x=0,58-1,00). При взаимодействии титана с углеродом образуется карбид титана TiCx (x=0,49-1,00).
При нагревании Ti поглощает H2 с образованием соединения переменного состава TiHх (x=1,3 — 2). При нагревании эти гидриды разлагаются с выделением H2. Титан образует сплавы со многими металлами.
Применение
| В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. |
Часы из титанового сплава
В чистом виде и в виде сплавов
Титановый памятник Гагарину на Ленинском проспекте в Москве- Металл применяется в: химической промышленности (реакторы, трубопроводы, насосы, трубопроводная арматура), военной промышленности (бронежилеты, броня и противопожарные перегородки в авиации, корпуса подводных лодок), промышленных процессах (опреснительных установках, процессах целлюлозы и бумаги), автомобильной промышленности, сельскохозяйственной промышленности, пищевой промышленности, украшениях для пирсинга, медицинской промышленности (протезы, остеопротезы), стоматологических и эндодонтических инструментах, зубных имплантатах, спортивных товарах, ювелирных изделиях (Александр Хомов), мобильных телефонах, лёгких сплавах и т.
 д. Является важнейшим конструкционным материалом в авиа-, ракето-, кораблестроении.
д. Является важнейшим конструкционным материалом в авиа-, ракето-, кораблестроении. - Титановое литье выполняют в вакуумных печах в графитовые формы. Также используется вакуумное литье по выплавляемым моделям. Из-за технологических трудностей, в художественном литье используется ограниченно. Первой в мировой практике монументальной литой скульптурой из титана является памятник Юрию Гагарину на площади его имени в Москве
- Титан является легирующей добавкой во многих легированных сталях и большинстве спецсплавов.
- Нитинол (никель-титан) — сплав, обладающий памятью формы, применяемый в медицине и технике.
- Алюминиды титана являются очень стойкими к окислению и жаропрочными, что в свою очередь определило их использование в авиации и автомобилестроении в качестве конструкционных материалов.
В виде соединений
- Белый диоксид титана (TiO2) используется в красках (например, титановые белила), а также при производстве бумаги и пластика.
 Пищевая добавка E171.
Пищевая добавка E171. - Титанорганические соединения (напр. тетрабутоксититан) применяются в качестве катализатора и отвердителя в химической и лакокрасочной промышленности.
- Неорганические соединения титана применяются в химической электронной, стекловолоконной промышленности в качестве добавки или покрытий.
- Карбид титана, диборид титана, карбонитрид титана — важные компоненты сверхтвёрдых материалов для обработки металлов.
- Нитрид титана применяется для покрытия инструментов, куполов церквей и при производстве бижутерии, т.к. имеет цвет, похожий на золото.
- Титанат бария BaTiO3, титанат свинца PbTiO3 и ряд других титанатов —- сегнетоэлектрики.
Существует множество титановых сплавов с различными металлами. Легирующие элементы разделяют на три группы, в зависимости от их влияния на температуру полиморфного превращения: на бета-стабилизаторы, альфа-стабилизаторы и нейтральные упрочнители. Первые понижают температуру превращения, вторые повышают, третьи не влияют на неё, но приводят к растворному упрочнению матрицы.
Анализ рынков потребления
В 2005 компания Titanium Corporation опубликовала следующую оценку потребления титана в мире:
- 60 % — краска;
- 20 % — пластик;
- 13 % — бумага;
- 7 % — машиностроение.
Цены
| В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. |
15-25 $ за килограмм, в зависимости от чистоты.
Чистота и марка чернового титана (титановой губки) обычно определяется по её твёрдости, которая зависит от содержания примесей. Наиболее распространены марки ТГ100 и ТГ110.
Цена ферротитана (минимум 70 % титана) на 22.12.2010 $6,82 за килограмм. На 01.01.2010 цена была на уровне $5,00 за килограмм.
В России цены на титан на начало 2012 года составляли 1200-1500 руб/кг.
Физиологическое действие
Примечания
- ↑ 1 2 3 Редкол.:Зефиров Н. С. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1995. — Т. 4. — С. 590-592. — 639 с. — 20 000 экз. — ISBN 5—85270—039—8
- ↑ J.P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965
- ↑ Месторождение титана
- ↑ Ильменит, рутил, титаномагнетит — 2006 г.
- ↑ Титан. Информационно-аналитический центр «Минерал».
 Архивировано из первоисточника 21 августа 2011. Проверено 19 ноября 2010.
Архивировано из первоисточника 21 августа 2011. Проверено 19 ноября 2010. - ↑ Корпорация ВСМПО-АВИСМА
- ↑ Koncz, St; Szanto, St.; Waldhauser, H., Der Sauerstoffgehalt von Titan-jodidstäben, Naturwiss. 42 (1955) pp.368-369
- ↑ Титан — статья из Химической энциклопедии
- ↑ Искусство литья в ХХ веке
Ссылки
- Титан на Webelements
- Титан в Популярной библиотеке химических элементов
- Титан и его сплавы
- Добыча титана и циркония на «Центральном» в Тамбовской области обещает быть одной из самых дешёвых в мире
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
Титан – элемент, который интересует учёных и производство уже более двухсот лет
Металлы тысячи лет служат прочной основой цивилизации. Вспомним: уже в эпоху позднего каменного века – неолита – человек научился использовать самородные металлы и метеоритное железо и обнаружил в кострах необычные бесформенные пористые камни, в которых были металлические вкрапления.
Вспомним: уже в эпоху позднего каменного века – неолита – человек научился использовать самородные металлы и метеоритное железо и обнаружил в кострах необычные бесформенные пористые камни, в которых были металлические вкрапления.
Однако огонь не только дал людям хорошую пищу, теплое жильё, выжигал леса под пашню и плавил самородный металл. При горении древесины выделялась тепловая энергия, и образовывался углерод, и вдруг некоторые камни и почва «превращались» в металлы.
Самыми первыми металлами, которые человечество научилось выплавлять, были медь, свинец, олово, а также сплавы из них – бронза и латунь.
Металлы существенно изменили быт людей. Создавалась новая техника для обработки земли, строительства, охоты и, к сожалению, – для войн. (И если вникнуть с историю техники, то можно убедиться в том, что улучшали в первую очередь качество вооружений).
Человечество пребывало ещё в бронзовом веке, когда в различных регионах планеты уже создавали сплавы на основе железа.
Наступил железный век. Тысячелетиями усовершенствовались технологии литья чугунных орудий и различных механизмов, стальных клинков. Алхимики и химики выделяли из природных минералов металлические соединения и открывали новые металлы, возникла и развивалась металлургия – наука о производстве металлов.
С XVII века развернулась индустриализация. Для техники, новых видов транспорта, мостов, промышленных зданий потребовалось много металла, в первую очередь – высококачественной стали.
Эти задачи решали «методом проб и ошибок», а к концу XIX века – и на основе фундаментальных научных исследований. В металлургии, кроме химических процессов, для нагрева и плавления начали применять электрическую энергию.
Но темпы научно-технического прогресса продолжали расти. Во второй половине прошлого века создавались ракеты, атомные электростанции, суперистребители, мощные турбины, новые классы кораблей и многое другое, неизвестное и немыслимое. Техника нового поколения работала при сверхвысоких давлениях и ударах, невиданных ранее высоких и, наоборот, очень низких (криогенно стойких) температурах, а также при других экстремальных нагрузках.
Конечно, металлурги продолжали создавать новые специальные типы сталей. Например, для повышения жаропрочности добавили в сплав вольфрам, ванадий, молибден. Но сталь от этого становилась ещё тяжелее. А масса многих машин и аппаратов должна быть как можно меньше. Требовались сплавы прочнее стали, жаростойкие и криогенностойкие, нержавеющие и не растворяющиеся в агрессивных средах.
В первой половине прошлого века уже начали широко применять лёгкий металл — алюминий и его сплавы. И хотя прочность их была намного меньше, чем у стали, они очень пригодились для лёгких конструкций, таких ответственных, как самолёты и дирижабли, и даже некоторые корабли.
Алюминий и его сплавы не ржавеют и не разъедаются почти никакими кислотами, поэтому из них изготовляют химическое оборудование, различную утварь. В электротехнике чистый алюминий пригодился из-за хорошей электропроводимости, а сплав алюминия с кремнием обладает отличными литейными свойствами и из него отливают корпуса двигателей внутреннего сгорания для автомобилей и самолётов.
Но алюминиевые сплавы сравнительно легкоплавкие. Необходимо было найти металл и создать из него сплавы лучше и легче, чем сплавы из железа.
И такой металл нашёлся. Причём, если железная руда и бокситы (сырьё для алюминия) сконцентрированы в определённых залежах, то сырьё для металла, отвечающего требованиям научно-технического прогресса, оказалось буквально под ногами, в виде песка или в виде руды.
Вспомним, что земная поверхность состоит из соединений металлов и неметаллов, ими покрыто дно морей и океанов, они растворены в морской воде. Вот только выделить металл из его соединений бывает совсем не просто. И тысячелетний путь, пройденный человечеством в поисках металлургических технологий, часто не подходил для того, чтобы «добыть» новый металл и организовать его производство. Вот и над укрощением крайне необходимого для современной техники металла специалисты работают уже более двухсот лет.
Одним из «любимых» занятий химиков прошлых веков было определять состав «земель», попадавшихся под руку. В 1791 году англичанин У. Грегор, исследуя состав магнитного железистого песка с пляжа Корнуолла, выделил новую «землю» (оксид) неизвестного металла.
В 1791 году англичанин У. Грегор, исследуя состав магнитного железистого песка с пляжа Корнуолла, выделил новую «землю» (оксид) неизвестного металла.
А через четыре года независимо от него немец Мартин Генрих Клапрот (1743—1817) открыл в минерале рутиле новый элемент. Немецкий исследователь отметил невозможность определения свойств нового элемента только по его оксиду и назвал его титаном – в честь стойких борцов с богами Олимпа из древнегреческой мифологии.
Немного ранее он же открыл металл, который назвал ураном. Клапрот установил, что рутил и «земля Трегора»— оксиды одного и того же химического элемента, за которым и осталось название «титан».
В свободном виде титан не встречается, но зато находится на 10-м месте по распространённости в природе: в рутиле, ильмените, перовските, титаните, других минералах и в морских глинистых отложениях.
Первый образец металлического титана удалось выделить из оксида в 1825 году химику Каролингского университета (Швеция) Йёнсу Якобу Берцелиусу (1779-1848). Однако его способ был настолько сложным, а сам титан оказался настолько химически активным, что никто не увидел перспективы в его применении.
Однако его способ был настолько сложным, а сам титан оказался настолько химически активным, что никто не увидел перспективы в его применении.
Только спустя 100 лет голландцы А. ван Аркел и И. де Бур в 1925 году, применив технологию термического разложения паров йодида титана (TiI4), наконец получили чистый титан.
Этот йодидный способ применяют для получения небольших количеств титана очень высокой чистоты (до 99,99%). Титановую губку помещают в реторту и нагревают до 100 – 200°С; внутрь реторты вводят и разбивают ампулу с йодом, взаимодействующим с титаном по реакции Ti+2I2 → TiI4. (В принципе, можно применять и другие галогениды). Разложение TiI4 на Ti+2I2 и выделение титана происходит на титановых проволоках, натянутых в реторте, нагретых до 1300- 1400°С пропусканием тока.
Было установлено, что титан – лёгкий прочный металл серебристо-белого цвета. Температура его плавления 16600С, точка кипения 32600C. Металл существует в двух модификациях: α-Ti и β-Ti, плотность которых, соответственно, равна 4,505 и 4,32 г/см3. Между прочим, титановая пыль при температуре 4000С взрывается. Пожароопасна и титановая стружка.
Металл существует в двух модификациях: α-Ti и β-Ti, плотность которых, соответственно, равна 4,505 и 4,32 г/см3. Между прочим, титановая пыль при температуре 4000С взрывается. Пожароопасна и титановая стружка.
Ряд особых физико-химических свойств титана, прежде всего высокая удельная прочность (отношение прочности к удельному весу), большая коррозионная стойкость во многих агрессивных средах, хорошая обрабатываемость давлением и другие ценные технологические свойства делают его.
Действительно, в середине прошлого века научно-технический прогресс без титана и его сплавов начал «пробуксовывать». И пришлось, не считаясь с затратами, искать способы промышленного производства важнейшего материала.
Естественно, что перво-наперво попробовали выплавить титан так, как выплавляют из железных руд чугун («Страна знаний», 2015, №8). Концентрат титановой руды начали плавить в смеси с древесным углём или антрацитом в электродуговой печи и получили шлак из окиси титана и различных примесей.
Но «отобрать» кислород у титана непросто, поэтому на втором этапе решили использовать более активный элемент – хлор.
В специальную печь, в нижней части которой нагревается угольная пластина при пропускании через неё электрического тока, загружают титановый шлак, а через фурмы задувают хлор. И при температуре 800-12500С образуются пары четырёххлористого титана, а также хлориды других примесей. Пары очищают от твёрдых частиц, охлаждают в конденсаторах, и получают жидкий четырёххлористый титан.
Экспериментаторы нашли и другие способы получения титана. Не будем их описывать подробно. Отметим только, что получить четырёххлористый титан можно в хлоратоpax непрерывного действия, в солевом расплаве, в кипящем слое.
А научную основу третьего этапа – термитные реакции заложил Николай Николаевич Бекетов (1827-1911) («Страна знаний», 2015 № 4).
Магниетермию выполняют в герметичных реакторах (ретортах) из нержавеющей стали, установленных в электрических печах сопротивления. Из реторты откачивают воздух, заполняют её инертным газом аргоном, заливают туда расплавленный магний и, постепенно, – жидкий четырёххлористый титан. Титан восстанавливается магнием по реакции TiCl4+2Mg=Ti+2MgCl2 с выделением большого количества тепла.
Из реторты откачивают воздух, заполняют её инертным газом аргоном, заливают туда расплавленный магний и, постепенно, – жидкий четырёххлористый титан. Титан восстанавливается магнием по реакции TiCl4+2Mg=Ti+2MgCl2 с выделением большого количества тепла.
Необходимая по технологии температура 800-900°С поддерживается в реакторе дозированной подачей TiCl4. (Вместо магния иногда применяют натрий, и этот способ восстановления называют натриетермическим.) Правда, к сожалению, получается не плотный слиток, а пористая титановая губка (до 60% Ti). С подобной железной заготовкой – «крицей» имели дело металлурги-кузнецы в древности. («Страна знаний», 2015, № 8).
К сожалению, при проковке этой губки чистый титан получать не удавалось. Необходимо было разрабатывать ещё одну технологическую операцию – переплавлять эту смесь так, чтобы избавить её от примесей.
И здесь наступил следующий этап «борьбы человека с титаном». Теперь из губчатого титана требовалось выплавить плотные, без пор и включений металлические заготовки для проката или отливок. В середине ХХ века перед мировой металлургией открылся очередной этап покорения своенравного металла – придание ему нужных для новой техники качеств.
В середине ХХ века перед мировой металлургией открылся очередной этап покорения своенравного металла – придание ему нужных для новой техники качеств.
Результаты работ засекречивали: основными заказчиками были творцы новой военной техники. Решением задач переплава и сварки в принципе и применительно к конкретному производству занимались десятки институтов и лабораторий в СССР, США, Великобритании, Франции и ещё в некоторых странах. Работали интенсивно – гонка вооружений уже набрала обороты.
Установка для электронно-лучевого переплавав ИЭС им. Е.О.Патона
Работы по исследованию и разработке металлургических и сварочных процессов применительно к титану были начаты в Институте электросварки им. Е.О. Патона (ИЭС) НАН Украины в конце 50-х годов прошлого века под общим руководством академика Бориса Евгеньевича Патона (род. 1918).
Вскоре в Киеве впервые в мире были разработаны самые эффективные технологии получения слитков титана и его сплавов из первичной шихты и из вторичных отходов. Для решения проблемы пригодились знания, накопленные в процессе создания новых сварочных технологий и электрошлакового переплава.
Для решения проблемы пригодились знания, накопленные в процессе создания новых сварочных технологий и электрошлакового переплава.
Сотрудники ИЭС им. Е.О. Патона применили энергию электронных лучей, дуговой плазмы, индукционный и электрошлаковый нагрев. Каждый из процессов имеет свои преимущества и используется для производства металла с конкретными свойствами, именно такими, какие требуются для ответственных конструкций.
Мощный электронный луч плавит заготовки в вакууме под давлением 0,01- 0,1 Па. Технологические процессы обеспечивают удаление посторонних примесей и растворённого газа, позволяют получать слитки титана и его сплавов с однородной бездефектной структурой. Для их внедрения было создано семейство многоцелевых промышленных плавильных электронно-лучевых установок (ЭЛУ).
В плазменно-дуговых электропечах заготовки расплавляют одним или несколькими дугами, сжатыми потоками аргона в плазмотронах. Плазменно-дуговая печь позволяет выплавлять титановые слитки непосредственно из кусковой шихты (губчатого титана), минуя операцию прессования заготовок.
Одним из наиболее универсальных независимых источников нагрева является высокочастотное магнитное поле, создаваемое электрическим током в индукторе. Особенности индукционного нагрева, в том числе интенсивное перемешивание жидкого металла, гарантируют выравнивание химического состава, возможность выдерживать металл в жидком состоянии неограниченное время в вакууме, обеспечивают высокое качество отливок.
Альтернативой переплаву в вакуумных условиях является электрошлаковый переплав. Для него не требуется такого сложного оборудования, строгого выдерживания режима плавки, и при достаточно высоком качестве себестоимость работ самая низкая. Наилучшего качества удаётся достичь в печах камерного типа.
Схема электропечи для получениячетырёххлористого титана:
1 – корпус печи;
2 – футеровка;
3 – угольная набойка;
4 – токоподводящие графитовые
электроды;
5– устройство загрузки шихты;
6 – брикетная шихта;
7, 8 –трубки для подачи хлора;
9 – отверстие для удаления
парогазовой смеси.

В ИЭС была разработана технология магнитоуправляемой электрошлаковой плавки для производства сплавов титана с любым большим количеством компонентов. Наиболее существенными преимуществами этой технологии являются возможность рафинирования низкосортного дешёвого сырья от вредных примесей, высокая плотность литья, меньшие затраты технологической электроэнергии и сравнительно дешёвое оборудование.
И чем дешевле становилось производство титана и сплавов с качествами, необходимыми для ответственных изделий, тем больше была в них потребность. Только в СССР за короткое время производство титановой продукции было налажено на двух десятках заводов.
Для экономии дорогого металла в тех конструкциях, где требовалась стойкость к агрессивным средам, но не важен был вес изделия, были разработаны способы изготавливать биметалл. В 1980-х годах было освоено производство биметаллических листов путём горячей прокатки заготовок. И самым лучшим конструкционным материалом является композиция сталь+титан, т. е. сталь, плакированная (покрытая) титаном.
е. сталь, плакированная (покрытая) титаном.
В ИЭС им. Е.О. Патона открыт цех «Титан», который может выпускать до 1500 т титановых слитков в год для проката высококачественных полуфабрикатов.
Так, из таких сплавов толщиной 200-250 мм на Феодосийском судостроительном заводе «Море» были изготовлены крыльевые устройства для морских судов. В 2009 году была создана технология электронно-лучевой плавки крупногабаритных слитков жаропрочных сплавов на основе титана.
Впервые в мире получен слиток диаметром 840 мм из жаропрочного титанового сплава ВТ3-1, а вскоре был получен слиток диаметром 1100 мм, длиной до 4000 мм, массой 16 тонн.
Впервые в мировой практике в цехе «Титан» спроектирована, изготовлена и запущена в эксплуатацию электронно-лучевая установка для получения титановых слитков недроблёных блоков губчатого титана. Для изготовления атомных и химических реакторов ИЭС им. Е.О. Патона налажено производство полых слитков, из которых раскатывают титановые кольца диаметром до 2000 мм.
Впервые в мире были изготовлены бесшовные титановые трубы длиной до 9000 мм из трубной заготовки.
Всё большее применение в гражданских отраслях промышленности находят как традиционные титановые сплавы, так и новые титановые сплавы с уникальными физико-химическими характеристиками. Титан является одним из наиболее распространённых геттерных (от «геттер» — газопоглотитель, вещество, поглощающее и прочно удерживающее газы, кроме инертных) материалов, используемых в высоковакуумных насосах.
Детальное изучение коррозийной стойкости сплава Т100 в разнообразных агрессивных средах, в том числе и в биологических, показало его перспективность для применения в медицине для изготовления эндопротезов и медицинских инструментов.
Для потребностей стоматологии в ИЭС им. Е.О. Патона разработан титановый сплав системы Ti-Al-Nb-Zr.
Одним из важнейших потребителей титановых сплавов в Украине является аэрокосмический комплекс. В конструкциях самолётов масса деталей из титановых сплавов составляет 8 – 9 % массы планёра. Это, главным образом, тяжело нагруженные силовые элементы, такие как подкосы и цилиндры шасси, кронштейны системы управления, детали механизации крыла, противопожарные перегородки, грузовые дорожки настила.
Это, главным образом, тяжело нагруженные силовые элементы, такие как подкосы и цилиндры шасси, кронштейны системы управления, детали механизации крыла, противопожарные перегородки, грузовые дорожки настила.
Из титановых сплавов изготавливают трубопроводы, теплообменники, компенсаторы и другие узлы самолетов.
В химической, пищевой промышленности из сплавов титана делают реакторы, трубопроводы, насосы, трубопроводную арматуру, опреснительные установки и др.
Первой в мировой практике монументальной скульптурой из титана является памятник Юрию Гагарину на площади его имени в Москве.
Титановые сплавы имеют наиболее высокую удельную прочность среди всех металлических материалов. Титан используют для легирования сталей и создания спецсплавов. Разработано множество сплавов титана с различными металлами. Нитинол (никель-титан) — сплав, обладающий памятью формы, применяется в медицине и технике.
Алюминиды титана являются очень стойкими к окислению и жаропрочными. Карбид, диборид, карбонитрид титана — важные компоненты сверхтвёрдых материалов для обработки металлов.
Карбид, диборид, карбонитрид титана — важные компоненты сверхтвёрдых материалов для обработки металлов.
Титановые сплавы используются при изготовлении спортивных товаров, мобильных телефонов, часов, бронежилетов.
На любые металлы, керамику, стекло и многие другие материалы можно напылить нитрид титана, который имеет цвет золота, но, в отличие от него, это тончайшее покрытие очень прочное и во много раз дешевле. Технология напыления разработана в Физико-техническом институте в Харькове и широко применяется для покрытия металлом инструментов, зубных коронок, посуды, куполов церквей и изделий бижутерии.
Крупнейшими в мире сварными конструкциями из титановых сплавов являются малошумные тяжёлые ракетные подводные крейсера стратегического назначения (ТРКСН проекта 941, шифр «Акула», по классификации НАТО – «Typhoon»). Первый из 12 кораблей был построен в Северодвинске на «Севморзаводе» в сентябре 1979 года по технологиям, разработанным в ИЭС им. Е.О. Патона.
Нигде в мире больше нет подводных кораблей водоизмещением 28500 т, длиной 172,8м, шириной 23,3м. Этот крейсер может погружаться на глубину 500 м и идти там со скоростью 27 узлов. Конструкция ТРКСН выполнена по типу катамарана из двух раздельных прочных корпусов (диаметр каждого 7,2 м), между которыми расположены отсеки управления, торпедный и ракетный.
Этот крейсер может погружаться на глубину 500 м и идти там со скоростью 27 узлов. Конструкция ТРКСН выполнена по типу катамарана из двух раздельных прочных корпусов (диаметр каждого 7,2 м), между которыми расположены отсеки управления, торпедный и ракетный.
Использование титановых сплавов позволило уменьшить массу корпуса, увеличить глубину погружения, уменьшить магнитное поле. Конечно, и в странах НАТО имеются титановые лодки, но их тактико-технических данные хуже.
Несмотря на явные успехи в покорении титана, учёные продолжают совершенствовать его производство, а конструкторы и инженеры – создавать новую технику.
Сейчас мировое производство титана составляет около 4,5 млн т. в год. При нынешних темпах его потребления мировых разведанных запасов титана хватит более, чем на 150 лет.
А.П. Лютый, кандидат технических наук, завод «Днепроспецсталь», г. Запорожье
Глава 4. ЗНАКОМЬТЕСЬ — ТИТАН!. Металл Века
Глава 4. ЗНАКОМЬТЕСЬ — ТИТАН!
ЛЕГКАЯ СТАЛЬ
Брусок металла неяркого серебристо-серого цвета. ”Сталь” — привычно мелькает в сознании. Но стоит взять брусок в руку, как на мгновение возникает ощущение нереальности происходящего: металл оказывается удивительно, неправдоподобно легким. Это не сталь, а титан.
”Сталь” — привычно мелькает в сознании. Но стоит взять брусок в руку, как на мгновение возникает ощущение нереальности происходящего: металл оказывается удивительно, неправдоподобно легким. Это не сталь, а титан.
Любопытно наблюдать за реакцией людей, плохо знакомых с цветными металлами, когда к ним в руки попадает какой- нибудь предмет из титана. Первоначальное удивление (темный металл, а такой легкий!) сменяется недоумением, а затем убеждением, что их «разыгрывают”, и они пытаются разобраться, где же скрывается подвох: вертят предмет в руках, говорят, что внутри металла имеются пустоты и тому подобное. Но никакого подвоха нет. Титан действительно почти вдвое легче железа и всего лишь в полтора раза тяжелее алюминия. Один кубический сантиметр железа имеет массу 7,8 грамма, алюминия — 2,7, титана — 4,5 грамма. Надо признать все же, что 4,5 грамма в кубическом сантиметре не так уж и мало, особенно если учесть, что в кубическом сантиметре магния содержится 1,7 грамма, а такой металл, как литий, вдвое легче воды.
Поскольку к легким относят металлы, удельная масса которых не превышает 5 граммов на кубический сантиметр, то титан, следовательно, самый тяжелый среди легких металлов. Но и ”самый тяжелый”, он все-таки по праву принадлежит к числу легких металлов.
Однако легкость сама по себе еще ничего не решает. Легок натрий, но он плавится уже при температуре около 100 °С и как щелочной металл настолько активен, что его нельзя хранить на открытом воздухе. Хранят этот элемент в керосине. Еще легче и активнее металл литий. Он, как и остальные щелочные металлы, так непрочен, что легко режется обыкновенным ножом.
Мы привыкли к тому, что всякий конструкционный материал имеет свои достоинства и недостатки. Если алюминий,
например, почти в три раза легче стали, то он и в несколько раз менее прочен и плавится уже при 660 градусах, тогда как точка плавления стали находится выше 1500 °С. Примерно то же самое можно сказать и о магнии.
Интересно, а насколько титан уступает стали по прочности? Титан не уступает стали: он в полтора раза прочнее! Но, может быть, этот металл плавится при невысоких температурах? Титан плавится только при 1660 °С, то есть при более высокой температуре, чем железо и сталь. Так что не зря титан отливает стальным блеском: этот отлив не обманывает.
Так что не зря титан отливает стальным блеском: этот отлив не обманывает.
Но, кроме хорошей прочности, конструкционный материал обязательно должен иметь и такое важное качество, как пластичность. Пластичность — это способность материала изменять свою форму не разрушаясь, и именно в этой способности титану долго было отказано. Еще в сороковые годы нашего века о титане писали, что он ”хрупок и легко превращается в порошок при дроблении в ступке”. Любопытна и следующая запись: «Попытки вытянуть проволоку из титана безуспешны”.
Меньше всего хотелось бы иронизировать над автором приведенных строк, тем более что он поставил перед собой задачу ”заполнить досадный пробел в литературе, посвященной столь важному и интересному химическому элементу”.
На протяжении полутора столетий подлинных свойств металла не знал никто в мире. Но как только стали получать титан достаточной степени чистоты, сразу выяснилось, что причиной хрупкости металла являются примеси, а чистый титан очень пластичный материал. Его куют, как железо, вытягивают в проволоку, прокатывают в листы, трубы, ленты и даже в фольгу толщиной в сотые доли миллиметра.
Его куют, как железо, вытягивают в проволоку, прокатывают в листы, трубы, ленты и даже в фольгу толщиной в сотые доли миллиметра.
Титан — более упругий металл, чем магний и алюминий, но менее упругий, чем сталь. Он гораздо тверже алюминия, магния, меди, железа и почти не уступает особо обработанным легированным сталям. Титан — один из немногих металлов, которые наряду с высокой прочностью и пластичностью обладают хорошей вязкостью, то есть противостоят воздействию ударов. Этот металл характеризуется еще и таким ценным свойством, как отличная выносливость.
Важный показатель любого металла — предел текучести. Чем он выше, тем лучше металл сопротивляется нагрузкам, стремящимся смять его, изменить размеры и форму изготовленной из него детали. У титана предел текучести весьма высок: в два с половиной раза выше, чем у железа, в три с лишним раза выше, чем у меди, и почти в 18 раз превосходит этот же показатель для алюминия.
Итак, титан гораздо прочнее и легче обычной углеродистой стали, получаемой из чугуна. Но в современном машиностроении широко распространены не столько углеродистые, сколько легированные стали, то есть сплавы на основе железа с добавками никеля, хрома, марганца, молибдена, вольфрама, а также других цветных и редких металлов. Легированные стали значительно прочнее углеродистых и в несколько раз прочнее технического титана. Выходит, что титан все-таки уступает стали? Нет не уступает! Титан тоже можно легировать и тогда получают сплавы, прочность которых в два- три раза больше прочности чистого титана.
Но в современном машиностроении широко распространены не столько углеродистые, сколько легированные стали, то есть сплавы на основе железа с добавками никеля, хрома, марганца, молибдена, вольфрама, а также других цветных и редких металлов. Легированные стали значительно прочнее углеродистых и в несколько раз прочнее технического титана. Выходит, что титан все-таки уступает стали? Нет не уступает! Титан тоже можно легировать и тогда получают сплавы, прочность которых в два- три раза больше прочности чистого титана.
Титановые сплавы — это, быть может, самые совершенные материалы, которыми располагает современная техника. Они превосходят все другие распространенные металлы по такому важному показателю, как удельная прочность. Что это такое? Не что иное, как прочность, приходящаяся на единицу массы.
Чтобы нагляднее постичь это, представим себе такую картину. На помост выходят тяжелоатлеты. Вряд ли нас удивит то, что грузный человек поднимает большую тяжесть. Ведь так оно и должно быть: те, кто полегче, обладают, как правило, меньшей силой, а от массивного, с мощными бицепсами атлета мы ждем и высокого результата. Не зря же в тяжелоатлетическом спорте введены различные весовые категории. А теперь вообразим, что после этого тяжелоатлета на помост вышел скромный, на первый взгляд ничем не примечательный спортсмен, худощавый, среднего роста и с первой попытки покорил тот же самый вес. Кто же из них сильнее? Конечно же, худощавый!
Не зря же в тяжелоатлетическом спорте введены различные весовые категории. А теперь вообразим, что после этого тяжелоатлета на помост вышел скромный, на первый взгляд ничем не примечательный спортсмен, худощавый, среднего роста и с первой попытки покорил тот же самый вес. Кто же из них сильнее? Конечно же, худощавый!
Такую же аналогию можно провести относительно титановых сплавов и специальных сталей. Титановые сплавы почти вдвое легче, а нагрузки выдерживают почти такие же.
Если бы все достоинства титана заключались только в его легкости и прочности, то и этого было бы уже достаточно для развития титановой промышленности, так как и в этом случае игра стоила свеч и нашлось бы немало отраслей, заинтересованных в таком материале. Но, помимо прочности и легкости, титан отличается еще и замечательной стойкостью против коррозии.
Глава 11. Суд
Глава 11. Суд
Суд как суд. Обычный советский. Всё было предрешено заранее. После двух заседаний в июне 1986 г. МВТС под председательством академика А. П. Александрова, где доминировали работники Министерства среднего машиностроения — авторы проекта реактора, была объявлена
Суд
Суд как суд. Обычный советский. Всё было предрешено заранее. После двух заседаний в июне 1986 г. МВТС под председательством академика А. П. Александрова, где доминировали работники Министерства среднего машиностроения — авторы проекта реактора, была объявлена
ТИТАН В ПРИРОДЕ
ТИТАН В ПРИРОДЕ Титан входит в первую десятку самых распространенных элементов нашей планеты.В пятнадцатикилометровой толще земной коры его более половины процента: почти все кристаллические горные породы, пески, глины и прочие составляющие поверхности нашей планеты
ИОДИДНЫЙ ТИТАН
ИОДИДНЫЙ ТИТАН Титан, полученный из тетрахлорида с помощью натрия, по мнению голландских исследователей ван Аркеля и де Бура, непременно должен содержать много оксидов и нитридов, загрязняющих материал и тем самым изменяющих его свойства. Эти ученые пришли к выводу, что
ТИТАН В РЯДУ ЭЛЕМЕНТОВ
ТИТАН В РЯДУ ЭЛЕМЕНТОВ
серебристо-серого цвета металлы, имеющие одинаковую шестигранную кристаллическую решетку и обладающие очень похожими свойствами. Цирконий был открыт двумя годами раньше титана тем же Клапротом, а гафний — один из самь*х молодых элементов. Его
Цирконий был открыт двумя годами раньше титана тем же Клапротом, а гафний — один из самь*х молодых элементов. Его
Глава 3. ТИТАН В НАСТОЯЩЕМ И БУДУЩЕМ
Глава 3. ТИТАН В НАСТОЯЩЕМ И БУДУЩЕМ ПЕРЕДНИЙ КРАЙ МЕТАЛЛУРГИИ Создание крупной титановой промышленности стало возможным только на базе последних достижений вакуумной металлургии. Титановая индустрия — крайне сложное производство и поэтому оно осуществляется только
ТИТАН УСТАРЕЛ?
ТИТАН УСТАРЕЛ? ”Титан, получивший за свои высокие механические свойства прозвище богатырского металла, только-только начал получать широкое распространение в сверхзвуковой авиации и ракетостроении, а некоторые специалисты считают, что он уже устарел. Таково, например,
ТИТАН — ХРАНИТЕЛЬ ГОРЮЧЕГО?
ТИТАН — ХРАНИТЕЛЬ ГОРЮЧЕГО?
Автомобиль будущего — это не просто иная форма кузова, новые конструкционные материалы и технические параметры. И вовсе не обязательно — высокие скорости и мощный двигатель. Скорее даже напротив. Массовый автомобиль должен быть в первую
И вовсе не обязательно — высокие скорости и мощный двигатель. Скорее даже напротив. Массовый автомобиль должен быть в первую
Глава 6
Глава 6 ВСТУПЛЕНИЕВ СУДЬБУШТУРМПеред боевым командиром, лишившимся возможности продолжать службу не только на подводных лодках, но и на надводных военных кораблях, было два проторенных пути. Первый — продолжать службу в штабах или управлениях. Второй путь —
Глава 2
Глава 2 НА ПЕРЕДОВОЙПЕРЕЛОМ1943 год начинался в новых условиях. Потери немцев под Сталинградом: 175 тысяч убитых и 137 тысяч пленных, 23 дивизии в окружении — эти цифры потрясли весь мир. Громадный успех менял всю обстановку на фронтах. Оживились даже союзники. Италия
Глава 3
Глава 3
СЛОЖНЫЙФАРВАТЕРС МЕРТВОЙ ТОЧКИКак будет развиваться дальше эта необычная и обыденная история? История, так похожая на те, что разыгрываются вокруг нас и с нами в повседневной и всегда такой неповторимой жизни. События в личной жизни Берга назревали.В наркомате
События в личной жизни Берга назревали.В наркомате
Глава 4
Глава 4 КОНЕЦ!9 МАЯЕще один год позади. Встреча нового, 1945 года в стране прошла спокойно. Наши войска уже дрались близ Будапешта, и каждый день ожидалось сообщение о его взятии. Союзники, увы, не очень старались, и немцы их изрядно поколачивали. Но теперь развязка близилась,
Глава 1
Глава 1 И В ШУТКУ, И ВСЕРЬЕЗЦУНАМИЧудеса и впрямь случаются во все времена, даже в области медицины. Полтора года Берг боролся за жизнь. Смерть отступила. После трехстороннего инфаркта, поразившего его 20 июня 1956 года в поезде на пути из Ленинграда в Москву, проходят многие и
Глава 4
Глава 4
ВСТРЕЧА НА ВЕРШИНЕРОЗЫ И РЫБАЧитаешь «Проблемные записки», и бросается в глаза органическое переплетение многочисленных научных направлений, тесное содружество разных секций. Секция бионики, например, изучает живые организмы с целью перенесения в технику
Секция бионики, например, изучает живые организмы с целью перенесения в технику
Глава 5
Глава 5 САМЫЙ СЧАСТЛИВЫЙ ДЕНЬПРАВЫ ЛИ ЙОГИ!Мальчишка, чтобы сделать снежную бабу, скатал в ладонях маленький комок снега, бросил его на землю, покатил, и комочек стал расти, наслаиваясь новыми снежными пластами. Катить его труднее и труднее… Мальчишка вытирает варежкой
47. Титан и его сплавы
47. Титан и его сплавы Титан и сплавы на его основе обладают высокой коррозионной стойкостью и удельной прочностью. Недостатки титана: его активное взаимодействие с атмосферными газами, склонность к водородной хрупкости.Азот, углерод, кислород и водород, упрочняя титан,
Взгляд на различия между титаном и нержавеющей сталью – CROSSTRAXX
Многие предприятия и отрасли промышленности используют титан и/или нержавеющую сталь в своей повседневной деятельности. Основное различие между этими двумя веществами заключается в том, что титан — это металл, а нержавеющая сталь — металлический сплав. Продолжайте читать, чтобы лучше понять последствия этой разницы, а также составить более четкое представление о других различиях, существующих между титаном и нержавеющей сталью.
Основное различие между этими двумя веществами заключается в том, что титан — это металл, а нержавеющая сталь — металлический сплав. Продолжайте читать, чтобы лучше понять последствия этой разницы, а также составить более четкое представление о других различиях, существующих между титаном и нержавеющей сталью.
Металлический элемент титан имеет серебристо-серую окраску. Его атомный номер — 22, а символ химического элемента — Ti. Он предлагает высокое соотношение прочности к весу, создавая чрезвычайно прочное вещество. Титан также обладает высокой эффективностью теплопередачи и высокой устойчивостью к коррозии. В результате очень желательно использовать его в определенных отраслях, таких как строительство, где изменения температуры и элементы погоды могут оказывать неблагоприятное воздействие на компоненты конструкции.
Титан обладает высоким уровнем механической прочности, что делает его чрезвычайно прочным. Его низкая плотность делает его легким, что повышает его востребованность в определенных отраслях. Его коррозионная стойкость обнаруживается во многих областях, что делает его очень устойчивым к коррозии, создаваемой широким спектром щелочей, кислот, промышленных химикатов и природных вод.
Его коррозионная стойкость обнаруживается во многих областях, что делает его очень устойчивым к коррозии, создаваемой широким спектром щелочей, кислот, промышленных химикатов и природных вод.
Что такое нержавеющая сталь?
Нержавеющая сталь — это легированная сталь, что означает, что это сталь, объединенная с одним или несколькими элементами для изменения ее характеристик. Легирование относится к процессу смешивания более чем одного металла вместе. Что касается нержавеющей стали, она часто изготавливается из примерно десяти-тридцати процентов хрома и семидесяти процентов железа, чтобы придать ей коррозионную стойкость, а также способность хорошо выдерживать изменения температуры.
Когда в смесь добавляются другие элементы, это обычно делается для повышения способности стали сопротивляться коррозии или окислению. В некоторых случаях добавляется определенный элемент, чтобы стимулировать уникальные характеристики определенного типа нержавеющей стали. Хотя они не всегда добавляются в легированную сталь, в смесь металлов иногда включают один или несколько следующих элементов: титан, медь, алюминий, сера, никель, селен, ниобий, азот, фосфор или молибден. Определенные металлы, которые были добавлены в сталь для производства нержавеющей стали, известны как легирующие элементы.
Хотя они не всегда добавляются в легированную сталь, в смесь металлов иногда включают один или несколько следующих элементов: титан, медь, алюминий, сера, никель, селен, ниобий, азот, фосфор или молибден. Определенные металлы, которые были добавлены в сталь для производства нержавеющей стали, известны как легирующие элементы.
В чем разница между титаном и нержавеющей сталью?
Основное различие между нержавеющей сталью и титаном заключается просто в том, что нержавеющая сталь является металлическим сплавом, а титан — металлом. Уникальные характеристики нержавеющей стали создаются путем добавления в нее легирующих металлов, в то время как характеристики титана естественным образом присутствуют в ней.
Существуют обстоятельства, которые часто предполагают, что одно вещество лучше другого подходит для использования в конкретном проекте или деятельности. Например, некоторые производители часто отдают предпочтение титану из-за его уникальных качеств, обеспечивающих прочность и долговечность при низкой плотности. Поэтому, когда вес является более важным фактором, чем прочность, часто предпочтение отдается титану. И наоборот, нержавеющая сталь предпочтительнее в отраслях, в которых вес важнее прочности. Хотя титан не такой плотный, как сталь, он такой же прочный, что делает его очень подходящим для конкретных отраслей, таких как аэрокосмическая промышленность, где требуется более низкая плотность в дополнение к прочности.
Поэтому, когда вес является более важным фактором, чем прочность, часто предпочтение отдается титану. И наоборот, нержавеющая сталь предпочтительнее в отраслях, в которых вес важнее прочности. Хотя титан не такой плотный, как сталь, он такой же прочный, что делает его очень подходящим для конкретных отраслей, таких как аэрокосмическая промышленность, где требуется более низкая плотность в дополнение к прочности.
Титан дороже, чем нержавеющая сталь, что делает его дорогостоящим для некоторых отраслей, таких как строительство, где требуются большие количества. Поэтому, когда деньги являются важной частью уравнения, нержавеющая сталь иногда предпочтительнее титана, если оба материала считаются подходящими.
Титан чрезвычайно биосовместим, то есть нетоксичен для человеческого организма. Поэтому он регулярно используется в медицинской промышленности в качестве отличного источника запасных частей, таких как имплантаты тазобедренного сустава, протезы коленного сустава, чехлы для кардиостимуляторов и черепно-лицевые пластины для человеческого тела. Он также используется в стоматологической промышленности для зубных имплантатов, растущей области стоматологии. Благодаря своей биосовместимости титан обычно используется для изготовления ювелирных изделий, коррозионной стойкости и легкости по сравнению с нержавеющей сталью.
Он также используется в стоматологической промышленности для зубных имплантатов, растущей области стоматологии. Благодаря своей биосовместимости титан обычно используется для изготовления ювелирных изделий, коррозионной стойкости и легкости по сравнению с нержавеющей сталью.
Нержавеющая сталь обладает как свариваемостью, так и формуемостью, что позволяет легко придавать ей форму, что повышает ее популярность для использования в ряде отраслей. Из-за своего блестящего внешнего вида нержавеющая сталь часто используется для изготовления предметов домашнего обихода, таких как кухонные кастрюли и сковородки, а также для изготовления товаров медицинского назначения, таких как раковины, столешницы, переносные тележки, стеллажи и столы.
Нержавеющая сталь подвержена усталости и разрушению, а титан обладает высокой устойчивостью к усталости, вызванной колебаниями температуры. Таким образом, титан является лучшим выбором, когда колебания температуры приводят к экстремальным максимумам или минимумам.
Нержавеющая сталь и титан используются в различных отраслях промышленности по всему миру. Оба очень долговечны, устойчивы к коррозии и прочны. Как правило, выбор металла определяется характером его использования.
Титан
Титан и его сплавы имеют очень благоприятное соотношение прочности и массы. Они также устойчивы к коррозии, поскольку на их поверхности образуется тонкий, но очень прочный оксидный слой. Таким образом, они используются там, где важны прочность, легкость и устойчивость к коррозии. Хотя использование титана ограничено его высокой стоимостью, появляются новые процессы, которые, вероятно, значительно снизят затраты, что позволит более широко использовать титан и его сплавы.
Использование титана
Рисунок 1 Использование титана.
Почти весь титан используется в виде сплава с другими металлами. К наиболее важным легирующим металлам относятся алюминий, ванадий, молибден, марганец, железо, олово, хром и цирконий. Один из наиболее часто используемых имеет состав 90% титана, 6% алюминия, 4% ванадия, который часто представляется как Ti-6AI-4V.
Один из наиболее часто используемых имеет состав 90% титана, 6% алюминия, 4% ванадия, который часто представляется как Ti-6AI-4V.
Крупнейшим потребителем титановых сплавов является аэрокосмическая промышленность, использующая их в основных планерах (корпусах) самолетов, а также в различных частях двигателей, шасси и гидравлических трубах (рис. 2).
|
Из-за своей прочности и устойчивости к химическому воздействию металл и сплавы используются там, где другие материалы (даже нержавеющая сталь) могут быстро изнашиваться, например, в морской воде. Они используются в судовых гребных винтах и на опреснительных установках, а также в реакторах и трубопроводах химических заводов.
Они используются в судовых гребных винтах и на опреснительных установках, а также в реакторах и трубопроводах химических заводов.
Ежегодно в мире используется более 1000 тонн титановых сплавов для изготовления имплантатов для хирургии, включая детали для замены тазобедренного и коленного суставов (рис. 3). Они также используются в зубных имплантатах в качестве корней для сменных зубов и в случае кардиостимуляторов.
|
В последнее время верхняя поверхность некоторых зданий была облицована листами из чистого титана, что привело к впечатляющему эффекту (рис. 4).
|
Годовое производство титана
| Мир | 171 000 тонн |
| Китай | 80 000 тонн |
| Россия | 42 000 тонн |
| Япония | 30 000 тонн |
| Казахстан | 9 000 тонн |
| Украина | 9 000 тонн |
Данные из:
US Geological Survey, Mineral Commodity Summaries, 2016.
Данные США недоступны.
Производство титана
Титан составляет 0,63% земной коры и является четвертым по распространенности конструкционным металлом после алюминия, железа и магния.
Месторождения титана, добыча которых экономически выгодна, находятся по всему миру. Основными рудами являются рутил (TiO 2 ) и ильменит (FeTiO 3 ) в отложениях пляжного песка (Западная Австралия), ильменит-гематит (Канада) и ильменит-магнетит (Украина) в отложениях твердых пород (рис. 5). Хотя рутил встречается реже и дороже, чем ильменит, он используется чаще, поскольку не содержит соединений железа и, следовательно, его легче обрабатывать. Однако ильменит иногда обрабатывают для удаления железа и получения «синтетического» рутила.
Рисунок 5. Хранение тяжелого минерального концентрата, содержащего рутил, ильменит и 9циркон 0090 и другие тяжелые минералы, не представляющие ценности. Затем он будет дополнительно обработан
для отделения рутила перед началом процесса извлечения титана.
С любезного разрешения Iluka Resources.
Процесс Кролла
Большая часть титана производится из руд, содержащих диоксид титана, с использованием длительного четырехстадийного процесса:
а) хлорирование руды до хлорида титана(IV)
b) очистка хлорида титана(IV)
c) восстановление хлорида титана(IV) до губчатого титана
d) переработка губчатого титана
(a) Хлорирование руды до хлорида титана(IV)
Диоксид титана термически стабилен и очень устойчив к химическому воздействию. Его нельзя восстановить с помощью углерода, монооксида углерода или водорода, а восстановление более электроположительными металлами является неполным. Однако, если оксид превращается в хлорид титана (IV), путь к титану становится жизнеспособным, поскольку хлорид легче восстанавливается.
Сухая руда вместе с коксом подается в хлоратор, образуя псевдоожиженный слой. После предварительного нагрева слоя теплоты реакции с хлором достаточно для поддержания температуры на уровне 1300 К:
(b) Очистка хлорида титана(IV)
Сырой хлорид титана(IV) очищают перегонкой после химической обработки сероводородом или минеральным маслом для удаления оксихлорида ванадия, VOCl 3 , который кипит при той же температуре, что и хлорид титана (IV). Конечным продуктом является чистый (> 99,9%) хлорид титана (IV), который можно использовать либо для получения титана, либо окисляя для получения диоксида титана для пигментов.
Конечным продуктом является чистый (> 99,9%) хлорид титана (IV), который можно использовать либо для получения титана, либо окисляя для получения диоксида титана для пигментов.
Резервуары для хранения должны быть полностью сухими, так как продукт подвергается быстрому гидролизу в присутствии воды с образованием плотных белых паров хлористого водорода:
(c) Восстановление хлорида титана(IV) до губчатого титана
Хлорид титана(IV) представляет собой летучую жидкость. Его нагревают для получения пара, который подают в реактор из нержавеющей стали, содержащий расплавленный магний (в избытке), предварительно нагретый примерно до 800 К в атмосфере аргона. Экзотермические реакции с образованием хлоридов титана (III) и титана (II) вызывают быстрое повышение температуры примерно до 1100 К. Эти хлориды восстанавливаются медленно, поэтому для завершения процесса восстановления температуру повышают до 1300 К. Тем не менее, это длительный процесс:
Через 36-50 часов реактор вынимают из печи и оставляют охлаждаться не менее чем на четыре дня.
Непрореагировавший магний и смесь хлорида/титана выделяют, измельчают и выщелачивают разбавленной соляной кислотой для удаления хлорида магния. В альтернативном методе, используемом в Японии, хлорид магния вместе с непрореагировавшим магнием удаляют из титана путем высокотемпературной вакуумной перегонки.
Хлорид магния электролизуется для получения магния для стадии восстановления, а хлор рециркулируется для стадии хлорирования руды.
Титан очищается высокотемпературной вакуумной перегонкой. Металл представляет собой пористую гранулу, называемую губкой. Его можно перерабатывать на месте или продавать другим компаниям для преобразования в титановые изделия.
Рисунок 6. Краткая информация о преобразовании титановой руды в полезные продукты.
(d) Обработка титановой губки
Поскольку титановая губка легко вступает в реакцию с азотом и кислородом при высоких температурах, губку необходимо обрабатывать в вакууме или в инертной атмосфере, такой как аргон. На этом этапе может быть включен лом титана, а также могут быть добавлены другие металлы, если требуется титановый сплав. Обычный метод заключается в сжатии материалов вместе для создания большого блока, который затем становится электродом в тигле для электродуговой плавки. Между тиглем и электродом образуется дуга, в результате чего электрод вплавляется в тигель, где он охлаждается и образует большой слиток. Это может быть повторено для получения слитка «второй плавки» более высокого качества.
На этом этапе может быть включен лом титана, а также могут быть добавлены другие металлы, если требуется титановый сплав. Обычный метод заключается в сжатии материалов вместе для создания большого блока, который затем становится электродом в тигле для электродуговой плавки. Между тиглем и электродом образуется дуга, в результате чего электрод вплавляется в тигель, где он охлаждается и образует большой слиток. Это может быть повторено для получения слитка «второй плавки» более высокого качества.
ITP Armstrong Process
Титан и его сплавы могут быть получены из хлорида титана(IV) с использованием натрия вместо магния. Хотя химия не нова, в настоящее время разработан непрерывный, а не периодический процесс, что значительно снижает затраты.
Рисунок 7. Непрерывный процесс восстановления хлорида титана(IV).
Пары хлорида титана(IV) вводят в поток расплавленного натрия и хлорид восстанавливают до металла. Титан и хлорид натрия образуются в виде твердых веществ и извлекаются из потока натрия путем фильтрации.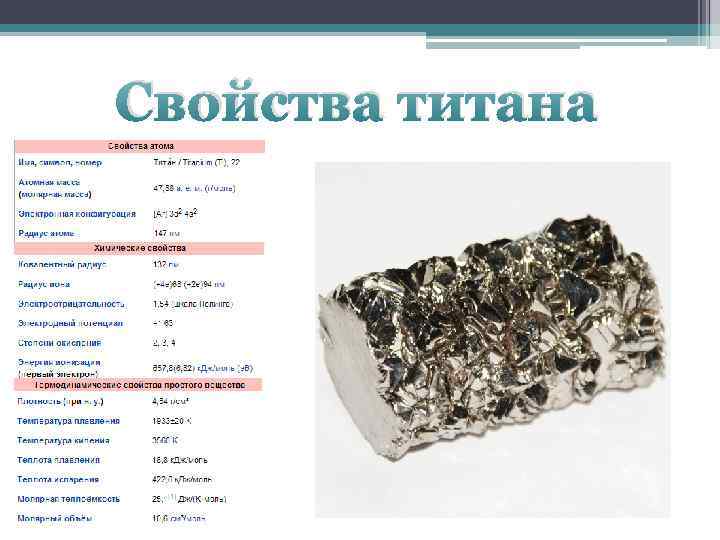 После удаления остаточного натрия металлический титан можно отделить от соли простой промывкой. Хлорид натрия сушат, нагревают до расплавления и подвергают электролизу, получая натрий для повторного использования и хлор для начальной стадии хлорирования.
После удаления остаточного натрия металлический титан можно отделить от соли простой промывкой. Хлорид натрия сушат, нагревают до расплавления и подвергают электролизу, получая натрий для повторного использования и хлор для начальной стадии хлорирования.
Если исходный хлорид титана (IV) тщательно смешать с правильными пропорциями других хлоридов металлов перед подачей в поток жидкого натрия, в результате получится порошок титанового сплава очень высокого качества, что является одним из основных преимуществ этого процесса. Например, Ti-6Al-4V получают путем включения в сырье хлорида алюминия и хлорида ванадия(IV) в правильных пропорциях.
FFC Cambridge Process
Исследования в Кембридже (Великобритания) привели к разработке электролитического метода восстановления диоксида титана непосредственно до титана.
диоксид итана (обычно рутил) измельчают в порошок, а затем превращают в гранулы, которые действуют как катод. Их помещают в ванну с расплавленным хлоридом кальция и соединяют с металлическим стержнем, выполняющим роль проводника. Ячейка укомплектована угольным анодом. При подаче напряжения оксид титана восстанавливается до титана, а ионы оксида притягиваются к углеродному аноду
Ячейка укомплектована угольным анодом. При подаче напряжения оксид титана восстанавливается до титана, а ионы оксида притягиваются к углеродному аноду
, который окисляется до монооксида углерода и диоксида углерода (рис. 8).
Рисунок 8. Электролитическое восстановление оксида титана(IV).
Если применяется гораздо более высокое напряжение, механизм будет другим. Кальций осаждается на катоде и реагирует с диоксидом титана с образованием титана, а ионы кальция регенерируются.
Этот процесс намного проще, чем существующие методы, работает при более низких температурах (экономия затрат на энергию) и оказывает меньшее воздействие на окружающую среду. У него есть потенциал для значительного снижения производственных затрат, что позволяет использовать преимущества металлического титана для более широкого спектра конечных продуктов.
Процесс также рассматривается для производства других металлов, например, тантала.
Дата последнего изменения: 5 октября 2016 г.
В чем разница между скандием и титаном
Основное различие между скандием и титаном заключается в том, что скандий — очень легкий металл, тогда как титан .
Титан — это металл, наиболее известный своей прочностью. Некоторые сплавы титана могут быть такими же прочными, как сталь. Хотя скандий — прочный металл, он не такой прочный, как титан.
СОДЕРЖАНИЕ
1. Обзор и ключевые отличия
2. Что такое скандий
3. Что такое титан
4. Сравнение скандия и титана в табличной форме
5. Резюме – Скандий и титан Что такое скандий
Скандий — это химический элемент, имеющий химический символ Sc и атомный номер 21. Это серебристо-белое металлическое вещество, принадлежащее к d-блоку периодической таблицы элементов. Мы можем классифицировать его как редкоземельный элемент. Это твердое вещество при комнатной температуре и давлении, имеющее высокие температуры плавления и кипения. Кроме того, мы можем наблюдать скандий во многих месторождениях редкоземельных и урановых соединений. Однако этот металл добывается из рудников этого типа на очень немногих рудниках в мире; поэтому он малодоступен, а получение металлического скандия затруднено.
Однако этот металл добывается из рудников этого типа на очень немногих рудниках в мире; поэтому он малодоступен, а получение металлического скандия затруднено.
Природное залегание скандия можно считать первичным. Он имеет гексагональную плотноупакованную кристаллическую структуру. Это парамагнитный металл, названный в честь Скандинавии, где в 1879 году Лар Фредрик Нильсон сделал открытие. Он может приобретать желтоватый или розоватый оттенок при окислении воздухом. Кроме того, этот металл подвержен атмосферным воздействиям и может медленно растворяться в разбавленных кислотах. Однако скандий не реагирует со смесью азотной и плавиковой кислот в пропорции 1:1. В основном это связано с образованием непроницаемого пассивного слоя.
Основным катионом, образованным скандием, является катион +3. Этот катион имеет очень похожие свойства с ионами иттрия, а не с ионами алюминия. Следовательно, мы можем классифицировать этот металл как лантаноидоподобное химическое вещество. Оксиды и гидроксиды этого металла в основном амфотерны. Кроме того, он образует галогениды, псевдогалогениды, органические производные, а также некоторые необычные степени окисления.
Кроме того, он образует галогениды, псевдогалогениды, органические производные, а также некоторые необычные степени окисления.
С точки зрения применения скандия, он в основном используется для производства скандий-алюминиевого сплава для производства мелких компонентов аэрокосмической промышленности. Более того, радиоактивный изотоп скандия (Sc-46) используется на нефтеперерабатывающих заводах в качестве трассирующего агента.
Что такое Титан?
Титан — это химический элемент, имеющий символ Ti и атомный номер 22. Это элемент d-блока, и мы можем отнести его к категории металлов. Титан имеет серебристо-серо-белый металлический вид. Кроме того, это переходный металл. Титан обладает высокой прочностью по сравнению с его низкой плотностью. Что еще более важно, он устойчив к коррозии при воздействии морской воды, царской водки и хлора.
Рисунок 02: Металлический титан
Для металлического титана стандартный атомный вес составляет 47,86 а. е.м. Он находится в группе 4 и периоде 4 периодической таблицы. Электронная конфигурация титана [Ar] 3d2 4s2. Этот металл существует в твердом состоянии при стандартной температуре и давлении. Кроме того, температура плавления и температура кипения этого металла составляют 1668°С и 3287°С соответственно. Наиболее распространенная и стабильная степень окисления этого металла +4.
е.м. Он находится в группе 4 и периоде 4 периодической таблицы. Электронная конфигурация титана [Ar] 3d2 4s2. Этот металл существует в твердом состоянии при стандартной температуре и давлении. Кроме того, температура плавления и температура кипения этого металла составляют 1668°С и 3287°С соответственно. Наиболее распространенная и стабильная степень окисления этого металла +4.
В дополнение к высокому соотношению прочности к весу металлический титан обладает пластичностью и блеском. В зависимости от его высокой температуры плавления этот металл важен как тугоплавкий материал. Кроме того, титан является парамагнитным и имеет низкую электрическую и тепловую проводимость. Мы можем найти металлический титан, обычно в виде оксида титана, в большинстве магматических пород и в отложениях, полученных из этих пород. Кроме того, титан является девятым по распространенности элементом в земной коре. Металлический титан обычно встречается в таких минералах, как анатаз, брукит, ильменит, перовскит, рутил и титанит.

 1 В чистом виде и в виде сплавов
1 В чистом виде и в виде сплавов д. Является важнейшим конструкционным материалом в авиа-, ракето-, кораблестроении.
д. Является важнейшим конструкционным материалом в авиа-, ракето-, кораблестроении. Пищевая добавка E171.
Пищевая добавка E171. Архивировано из первоисточника 21 августа 2011. Проверено 19 ноября 2010.
Архивировано из первоисточника 21 августа 2011. Проверено 19 ноября 2010.