Удельная теплота плавления — Википедия
Материал из Википедии — свободной энциклопедии
Уде́льная теплота́ плавле́ния (также: энтальпия плавления; также существует равнозначное понятие уде́льная теплота́ кристаллиза́ции) — количество теплоты, которое необходимо сообщить одной единице массы кристаллического вещества в равновесном изобарно-изотермическом процессе, чтобы перевести его из твёрдого (кристаллического) состояния в жидкое (то же количество теплоты выделяется при кристаллизации вещества).
Единица измерения — Дж/кг. Теплота плавления — частный случай теплоты термодинамического фазового перехода.
Удельная теплота плавления обозначается буквой λ{\displaystyle \lambda } (греческая буква лямбда). Формула расчёта удельной теплоты плавления:
- λ=Qm,{\displaystyle \lambda ={\frac {Q}{m}},}
где Q{\displaystyle Q} — количество теплоты, полученное веществом при плавлении (или выделившееся при кристаллизации), m{\displaystyle m} — масса плавящегося (кристаллизующегося) вещества. Удельная теплота плавления всегда положительна; единственное известное исключение — гелий под высоким давлением
Значения удельной теплоты плавления некоторых веществ[править | править код]
- Енохович А. С. Краткий справочник по физике. — М.: «Высшая школа», 1976. — С. 114. — 288 с.
- ↑ Atkins, Peter & Jones, Loretta (2008), Chemical Principles: The Quest for Insight (4th ed.), W. H. Freeman and Company, с. 236, ISBN 0-7167-7355-4
- ↑ Hoffer J. K., Gardner W. R., Waterfield C. G., Phillips N. E. Thermodynamic properties of 4He. II. The bcc phase and the P-T and VT phase diagrams below 2 K (англ.) // Journal of Low Temperature Physics (англ.)русск. : journal. — 1976. — April (vol. 23, no. 1). — P. 63—102. — doi:10.1007/BF00117245. — Bibcode: 1976JLTP…23…63H.
просто и доходчиво – формула, таблица
Почему твердое тело становится жидким?Под плавлением в физике подразумевают процесс превращения тела из твердого состояния в жидкое, под действием температуры. Классическим повсеместным примером плавления из жизни является таяние льдов, их превращение в воду, или превращение твердого куска олова в жидкий припой под действием паяльника. Передача тому или иному телу определенного количества тепла может изменить его агрегатное состояние, это удивительное свойство твердых тел превращаться в жидкие под действием температуры имеет большое значение для науки и техники. Ученым (а также техникам, инженерам) важно знать при каких температурах плавятся те или иные металлы (а порой и не только металлы), и для этого в физику вошло такое понятие как «удельная теплота плавления». О том, что означает удельная теплота плавления, какая ее формула расчета, читайте далее.
Почему твердое тело становится жидким?
Но давайте для начала разберем, как происходит сам процесс плавления на атомно-молекулярном уровне. Как мы знаем, в любом твердом теле все атомы и молекулы находятся четко и упорядочено в узлах кристаллической решетки, благодаря этому твердое тело и является твердым.
Но что происходит, если мы начинает это самое гипотетическое твердо тело сильно нагревать – под действием температуры атомы и молекулы резко увеличивают свою кинетическую энергию и по достижении определенных критических значений, они начинают покидать кристаллическую решетку, вырываться из нее. А само твердое тело начинает буквально распадаться, превращаясь в некое жидкое вещество – так происходит плавление.
При этом процесс плавления происходит не резким скачком, а постепенно. Также стоит заметить, что плавление относится к эндотермическим процессам, то есть процессам, при которых происходит поглощение теплоты.
Процесс обратный к плавлению называют кристаллизацией – это когда тело из жидкого состояния наоборот превращается в твердое. Если вы оставите воду в морозилке, она через какое-то время превратится в лед – это самый типичный пример кристаллизации из реальной жизни.
Определение удельной теплоты плавления
Удельной теплотой плавления называют физическую величину равную количеству тепла (в джоулях), которое необходимо передать твердому телу массой 1 кг, чтобы полностью перевести его в жидкое состояние. Удельную теплоту плавления обозначают греческой буквой «лямбда» – λ.
Формула удельной теплоты плавление выглядит так:
λ = Q/m
Где m – масса плавящегося вещества, а Q – количество тепла, переданное веществу при плавлении.
Зная значение удельной теплоты плавления, мы можем определить, какое количество тепла необходимо передать для тела с той или иной массой, для его полного расплавления:
Q = λ * m
Для разных веществ удельная теплота плавления была определена экспериментально.
Единица удельной теплоты плавления
Многих интересует вопрос, в каких единицах измеряется удельная теплота плавления. Так вот, удельная теплота плавления измеряется в Джоулях на килограмм – Дж/кг.
Таблица удельной теплоты плавления
Значение удельной теплоты для разных веществ: золота, серебра, цинка, олова и многих других металлов можно найти в специальных таблицах и справочниках. Обычно эти значения приводятся в виде таблицы.
Вашему вниманию таблица удельной теплоты плавления разных веществ
| Вещество | 105 * Дж/кг | ккал/кг | Вещество | 105 * Дж/кг | ккал/кг |
| Алюминий | 3,8 | 92 | Ртуть | 0,1 | 3,0 |
| Железо | 2,7 | 65 | Свинец | 0,3 | 6,0 |
| Лед | 3,3 | 80 | Серебро | 0,87 | 21 |
| Медь | 1,8 | 42 | Сталь | 0,8 | 20 |
| Нафталин | 1,5 | 36 | Цинк | 1,2 | 28 |
| Олово | 0,58 | 14 | Платина | 1,01 | 24,1 |
| Парафин | 1,5 | 35 | Золото | 0,66 | 15,8 |
Интересный факт: самым тугоплавким металлом на сегодняшний день является карбид тантала – ТаС. Для его плавления необходима температура 3990 С. Покрытия из ТаС применяют для защиты металлических форм, в которых отливают детали из алюминия
Рекомендованная литература и полезные ссылки
- Енохович А. С. Краткий справочник по физике. — М.: «Высшая школа», 1976. — С. 114. — 288 с.
- Atkins, Peter & Jones, Loretta (2008), Chemical Principles: The Quest for Insight (4th ed.), W. H. Freeman and Company, с. 236, ISBN 0-7167-7355-4
- Hoffer J. K., Gardner W. R., Waterfield C. G., Phillips N. E. Thermodynamic properties of 4He. II. The bcc phase and the P-T and VT phase diagrams below 2 K (англ.) // Journal of Low Temperature Physics (англ.)русск. : journal. — 1976. — April (vol. 23, no. 1). — P. 63—102. — DOI:10.1007/BF00117245. — Bibcode: 1976JLTP…23…63H.
Удельная теплота плавления, видео

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Enthalpy of Fusion.
| ЗАДАЧНИК ОНЛ@ЙН БИБЛИОТЕКА 1 БИБЛИОТЕКА 2 | Удельная теплота плавления. Удельная теплота парообразования (испарения). Критические параметры некоторых веществ. Удельная теплота сгорания.Удельная теплота плавления металлов
Удельная теплота плавления некоторых веществ (при нормальном атмосферном давлении)
Изменение объемов веществ при их плавленииВ таблице укзан объем жидкости Vж, образующийся при плавлении твердых
тел из различных веществ объемом 1000 см
Большинство веществ при переходе из твердого состояния в жидкое увеличивает свой объем. Исключение составляют лед, висмут и некоторые другие вещества. Удельная теплота испарения (парообразования) воды при различной температуре | ||||
t, oC | Удельная теплота испарения | t, oC | Удельная теплота испарения | ||
кДж/кг | калл/кг | кДж/кг | калл/кг | ||
| 0 | 2501 | 597 | 80 | 2308 | 551 |
| 5 | 2489 | 594 | 100 | 2256 | 539 |
| 10 | 2477 | 592 | 160 | 2083 | 497 |
| 15 | 2466 | 589 | 200 | 1941 | 464 |
| 18 | 2458 | 587 | 300 | 1404 | 335 |
| 20 | 2453 | 586 | 370 | 438 | 105 |
| 30 | 2430 | 580 | 374 | 115 | 27 |
| 50 | 2382 | 569 | 374,15* | 0 | 0 |
* При температуре 374,15 oC и давлении 22,13 Па (225,64 ат) вода находится в критическом состоянии. В этом состоянии жидкость и ее насыщенный пар обладают одиноковыми свойствами — разница между водой и ее насыщенным паром исчезает.
Изменение объемов жидкостей при испарении и газов (паров) при конденсации
Испаряющаяся жидкость | Vг, л | Конденсирующийся газ (пар) | Vж, л |
| Азот | 716 | Азот | 1,42 |
| Вода (при ) | 1780 | Водяной пар | 0,737 |
| Воздух | 749 | Воздух | 1,38 |
| Гелий | 774 | Гелий | 1,31 |
| Кислород | 886 | Кислород | 1,15 |
| Метан | 656 | Метан | 1,55 |
В таблице указан объем газа (пара), образующегося при испарении 1л жидкости, взятой при температу ре 20 oС и нормальном атмосферном давлении, а также объем жидкости образующейся при конденсации 1 м3 газа (пара).
Удельная теплота парообразования жидкостей и расплавленных металлов
(при температуре кипения и нормальном атмосферном давлении)Жидкость | Удельная теплота испарения | Жидкость | Удельная теплота испарения | ||
кДж/кг | кал/кг | кДж/кг | кал/кг | ||
| Азот жидкий | 201 | 48 | Водород жидкий | 450 | 108 |
| Алюминий | 9200 | 2200 | Воздух | 197 | 47 |
| Бензин | 230-310 | 55-75 | Гелий жидкий | 23 | 5,5 |
| Висмут | 840 | 200 | Железо | 6300 | 1500 |
| Вода (при t=0 oC) | 2500 | 597 | Керосин | 209-230 | 50-55 |
| Вода (при t=20 oC) | 2450 | 586 | Кислород жидкий | 214 | 51 |
| Вода (при t=100 oC) | 2260 | 539 | Магний | 5440 | 1300 |
| Вода (при t=370 oC) | 440 | 105 | Медь | 4800 | 1290 |
| Вода (при t=374,15 oC) | 0 | 0 | Олово | 3010 | 720 |
| Ртуть | 293 | 70 | |||
| Свинец | 860 | 210 | |||
| Спирт этиловый | 906 | 216 | |||
| Эфир этиловый | 356 | 85 | |||
Удельная теплота испарения (парообразования) некоторых твердых веществ
Вещество | Удельная теплота испарения | Вещество | Удельная теплота испарения | ||
кДж/кг | калл/кг | кДж/кг | калл/кг | ||
| Йод | 226 | 54 | Мышяк | 427 | 102 |
| Камфара | 387,2 | 92,5 | Сухой лед | 586 | 140 |
| Лед | 2834 | 677 | |||
Примечание. Непосредственный переход вещества из твердого состояния в газообразное, минуя превращение в жидкое состояние, называется сублимацией.
Критические параметры некоторых веществ
Вещество | Критическая температура, oC | Критическая плотность, кг/м3 | Критическое давление | |
МПа | ат | |||
| Азот | -147.1 | 311 | 3.39 | 34.6 |
| Аммиак | 132.4 | 235 | 11.5 | 117 |
| Ацетилен | 35.7 | 231 | 6.24 | 63.7 |
| Вода | 374.2 | 307 | 22.13 | 225.65 |
| Водород | -239.9 | 31.0 | 1.30 | 13.5 |
| Воздух | -140.7 | 350 | 3.77 | 38.5 |
| Гелий | -267.9 | 69.3 | 0.23 | 2.3 |
| Кислород | -118.8 | 430 | 5.04 | 51.4 |
| Нафталин | 469 | 314 | 3.98 | 40.6 |
| Оксид углерода (II) | -139 | 301 | 3.5 | 36 |
| Оксид углерода (IV) | 31.0 | 460 | 7.35 | 75.0 |
| Спирт | 243.5 | 276 | 6.38 | 65.2 |
| Хлор | 144.0 | 573 | 7.70 | 78.5 |
| Эфир | 193.8 | 260 | 3.60 | 37.0 |
Удельная теплота сгорания некоторых пищевых продуктов
Продукт | Удельная теплота сгорания | Продукт | Удельная теплота сгорания | ||
кДж/кг | калл/кг | кДж/кг | калл/кг | ||
| Батоны простые | 10470 | 2500 | Мясо куриное | 5380 | 1280 |
| Виноград | 2400 | 700 | Огурцы свежие | 570 | 140 |
| Говядина | 7520 | 1800 | Окунь, щука | 3520 | 840 |
| Земляника садовая | 1730 | 443 | Сахар | 17150 | 4100 |
| Картофель | 3770 | 900 | Сметана | 14800 | 3530 |
| Кефир | 2700 | 640 | Смородина черная | 2470 | 590 |
| Малина | 1920 | 460 | Хлеб пшеничный | 8930 | 2130 |
| Масло сливочное | 32700 | 7800 | Хлеб ржаной | 8620 | 2060 |
| Молоко | 2800 | 670 | Яблоки | 2010 | 480 |
| Морковь | 1720 | 400 | Яйца | 6900 | 1650 |
| Мороженое сливочное | 7500 | 1790 | |||
Удельная теплота сгорания различных видов топлива и некоторых веществ
Топливо, вещество | Удельная теплота сгорания | |
МДж/кг | калл/кг | |
| Условное топливо | 29,3 | 7000 |
Твердое | ||
| Антрацит | 26,8-31,4 | 6400-7500 |
| Древесный уголь | 31,5-34,4 | 7500-8200 |
| Дрова (воздушно-сухие) | 8,4-11 | 2000-2500 |
| Каменный уголь | ≈ 27 | ≈ 6500 |
| Порох | 3,8 | 900 |
| Сланцы горючие | 7,5-15,0 | 1800-3600 |
| Твердые ракетные топлива | 4,2-10,5 | 100-2500 |
| Торф | 10,5-14,5 | 2500-3500 |
| Тротил (взрывчатое вещество) | 15 | 3600 |
| Уголь: | ||
| канско-акчинский | 15,5 | 3700 |
| подмосковный | 10,5 | 2500 |
| челябинский | 14,6 | 3500 |
| экибастузский | 16,1 | 3840 |
Жидкое | ||
| Бензин | 44-47 | 10500-11200 |
| Дизельное автотракторное | 42,7 | 10200 |
| Керосин | 44-46 | 10500-11000 |
| Нефть | 43,5-46 | 10400-11000 |
| Спирт | 27,0 | 6450 |
| Топливо для ЖРД (керосин + жидкий кислород) | 9,2 | 2200 |
| Топливо для реактивных двигателей самолетов (ТС-1) | 42,9 | 10250 |
Газообразное | ||
| Ацетилен | 48,1 | 11500 |
| Водород | 120 | 28600 |
| Газ природный | 41-49 | 9800-11700 |
| Метан | 50,0 | 11950 |
| Оксид углерода (II) | 10,1 | 2420 |
…
Удельная теплота плавления — СПИШИ У АНТОШКИ
Для того, чтобы расплавить какое-либо вещество в твердом состоянии, необходимо его нагреть.Опыты показывают, что для разных веществ одной массы требуется разное количество теплоты для полного его расплавления.
То есть существует определенная величина, от которой зависит, сколько тепла необходимо поглотить веществу для расплавления. И величина эта различна для разных веществ. Эта величина в физике называется удельная теплота плавления вещества. Удельная теплота плавления показывает, какое кол теплоты необходимо для полного превращения 1 кг вещества из твердого состояния в жидкое, взятого при температуре плавления.Обозначают удельную теплоту плавления греческой буквой λ (лямбда), а единицей измерения является 1 Дж/кг.
Формула удельной теплоты плавления
Удельная теплота плавления находится по формуле:
λ = Q/m,
где Q – это количество теплоты, необходимое для того, чтобы расплавить тело массой m.
Удельная теплота плавления некоторых веществ представлена в таблицеКоличество теплоты, необходимой для плавления вещества, равно произведению удельной теплоты плавления на массу данного вещества.
Q = λ*m,
Опять-таки из опытов известно, что при отвердевании вещества выделяют такое же количество тепла, которое требовалось затратить на их расплавление. Молекулы, теряя энергию, образуют кристаллы, будучи не в силах сопротивляться притяжению других молекул. И опять-таки, температура тела не будет понижаться вплоть до того момента, пока не отвердеет все тело, и пока не выделится вся энергия, которая была затрачена на его плавление. То есть удельная теплота плавления показывает, как сколько надо затратить энергии, чтобы расплавить тело массой m, так и сколько энергии выделится при отвердевании данного тела.
Q = λ*m
Когда тело кристаллизуется, Q пишется со знаком «-», так как тепло выделяется.
ФИЗИКА: ЗАДАЧИ на плавление и отвердевание
Задачи на плавление и отвердевание с решениями
Формулы, используемые на уроках «Задачи на плавление и отвердевание».
Название величины | Обозначение | Единица измерения | Формула |
Масса | m | кг | m = Q / λ |
Температура | t | °С | |
Температура плавления | tпл | °С | |
Удельная теплоемкость | с | Дж/кг°С | |
Удельная теплота плавления | λ | Дж/кг | λ = Q / m |
Количество теплоты при нагревании | Q | Дж | Q=cm(t2–t1) |
Количество теплоты при плавлении | Q | Дж | Q = λm |
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1. Для приготовления чая турист положил в котелок лёд массой 2 кг, имеющий температуру 0°С. Какое количество теплоты необходимо для превращения этого льда в кипяток при температуре 100°С? Энергию, израсходованную на нагревание котелка, не учитывать.

Задача № 2. Сколько энергии нужно затратить, чтобы расплавить лёд массой 4 кг при температуре 0°С?

Задача № 3. Сколько энергии требуется затратить, чтобы расплавить свинец массой 20 кг при температуре плавления? Сколько энергии понадобится для этого, если начальная температура свинца 27 °С?

Задача № 4. Какую энергию нужно затратить, чтобы расплавить кусок льда массой 5 кг, взятый при температуре -10 °С?

Задача № 5. Какую энергию нужно затратить, чтобы расплавить кусок меди массой 2 кг, взятый при температуре 25 °С?

Задача № 6. Алюминиевый и медный бруски массой 1 кг каждый нагреты до температуры их плавления. Для плавления какого тела потребуется больше количества теплоты? На сколько больше?

Задача № 7. Во сколько раз плавление куска железа массой 1 кг требует больше энергии, чем плавление той же массы белого чугуна, серебра, серого чугуна и ртути, нагретых до своей температуры плавления?

Задача № 8. Какое количество теплоты поглощает при плавлении кусок свинца массой 1 г, начальная температура которого 27 °С; олова массой 10 г, взятого при температуре 32 °С?

Задача № 9. Объем формы для пищевого льда равен 750 см3. Сколько энергии отдают вода и лед форме и окружающему ее воздуху в холодильнике, если у воды начальная температура 12 °С, а температура образовавшегося льда равна -5 °С?

Задача № 10. Железная заготовка, охлаждаясь от температуры 800 до 0 °С, растопила лед массой 3 кг, взятый при 0 °С. Какова масса заготовки, если вся энергия, выделенная ею, пошла на плавление льда?

Краткая теория для решения Задачи на плавление и отвердевание.


Это конспект по теме «Задачи на плавление и отвердевание». Выберите дальнейшие действия:
Лёд — Википедия
Лёд — вода в твёрдом агрегатном состоянии[2].
Льдом иногда называют некоторые вещества в твёрдом агрегатном состоянии, которым свойственно иметь жидкую или газообразную форму при комнатной температуре; в частности, сухой лёд, аммиачный лёд или метановый лёд.
В настоящее время известны три аморфных разновидности и 17 кристаллических модификаций льда. Фазовая диаграмма на рисунке справа показывает, при каких температурах и давлениях существуют некоторые из этих модификаций (более полное описание см. ниже).
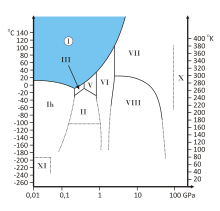
В природных условиях Земли вода образует кристаллы одной кристаллической модификации — гексагональной сингонии (лёд Ih). Во льду Ih каждая молекула Н2O окружена четырьмя ближайшими к ней молекулами, находящимися на одинаковых расстояниях от неё, равных 2,76 Å и размещённых в вершинах правильного тетраэдра.
Кристаллическая структура льда Ih. Серыми пунктирными линиями показаны водородные связи.Ажурная кристаллическая структура такого льда приводит к тому, что его плотность, равная 916,7 кг/м³ при 0 °C, меньше плотности воды (999,8 кг/м³) при той же температуре. Поэтому вода, превращаясь в лёд, увеличивает свой объём примерно на 9 %[3]. Лёд, будучи легче жидкой воды, образуется на поверхности водоёмов, что препятствует дальнейшему замерзанию воды.
Высокая удельная теплота плавления льда, равная 330 кДж/кг, (для сравнения — удельная теплотa плавления железа равна 270 кДж/кг), служит важным фактором в обороте тепла на Земле. Так, чтобы растопить 1 кг льда или снега, нужно столько же тепла, сколько требуется, чтобы нагреть литр воды на 80 °C.
Лёд встречается в природе в виде собственно льда (материкового, плавающего, подземного), а также в виде снега, инея, изморози. Под действием собственного веса лёд приобретает пластические свойства и текучесть.
Природный лёд обычно значительно чище, чем вода, так как при кристаллизации воды в первую очередь в решётку встают молекулы воды (см. зонная плавка). Лёд может содержать механические примеси — твёрдые частицы, капельки концентрированных растворов, пузырьки газа. Наличием кристалликов соли и капелек рассола объясняется солоноватость морского льда.

На Земле[править | править код]
Общие запасы льда на Земле около 30 млн км³. Основные запасы льда на Земле сосредоточены в полярных шапках (главным образом, в Антарктиде, где толщина слоя льда достигает 4 км).
В океане[править | править код]
Вода в мировом океане солёная и это препятствует образованию льда, поэтому лёд образуется только в полярных и субполярных широтах, где зима долгая и очень холодная. Замерзают некоторые неглубокие моря, расположенные в умеренном поясе. Различают однолетние и многолетние льды. Морской лёд может быть неподвижным, если связан с сушей, или плавучим, то есть дрейфующим. В океане встречаются льды, отколовшиеся от ледников суши и спустившиеся в океан в результате абляции — айсберги.
В космосе[править | править код]
Имеются данные о наличии льда на планетах Солнечной системы (например, на Марсе), их спутниках, на карликовых планетах и в ядрах комет.

Ледяная гидросмесь. В конце 1980-х годов лаборатория Аргонн разработала технологию изготовления ледяной гидросмеси (Ice Slurry), способной свободно течь по трубам различного диаметра, не собираясь в ледяные наросты, не слипаясь и не забивая системы охлаждения[4]. Солёная водяная суспензия состояла из множества очень мелких ледяных кристалликов округлой формы. Благодаря этому сохраняется подвижность воды и, одновременно, с точки зрения теплотехники она представляет собой лёд, который в 5—7 раз эффективнее простой холодной воды в системах охлаждения зданий. Кроме того, такие смеси перспективны для медицины. Опыты на животных показали, что микрокристаллы смеси льда прекрасно проходят в довольно мелкие кровеносные сосуды и не повреждают клетки. «Ледяная кровь» удлиняет время, в течение которого можно спасти пострадавшего. Скажем, при остановке сердца это время удлиняется, по осторожным оценкам, с 10—15 до 30—45 минут[4].
Использование льда в качестве конструкционного материала широко распространено в приполярных регионах для строительства жилищ — иглу. Лёд входит в состав предложенного Д. Пайком материала пайкерит, из которого предлагалось сделать самый большой в мире авианосец. Использование льда для постройки искусственных островов описывается в фантастическом романе «Ледяной остров».
| Фаза | Характеристики[5][6] |
|---|---|
| Аморфный лёд | Аморфный лёд не обладает кристаллической структурой. Он существует в трех формах: аморфный лёд низкой плотности (LDA), образующийся при атмосферном давлении и ниже, аморфный лёд высокой плотности (HDA) и аморфный лёд очень высокой плотности (VHDA), образующийся при высоких давлениях. Лёд LDA получают очень быстрым охлаждением жидкой воды («сверхохлаждённая стекловидная вода», HGW), или конденсацией водяного пара на очень холодной подложке («аморфная твёрдая вода», ASW), или путём нагрева высокоплотностных форм льда при нормальном давлении («LDA»). |
| Лёд Ih | Обычный гексагональный кристаллический лёд. Почти весь лёд на Земле относится ко льду Ih, и только очень малая часть — ко льду Ic. |
| Лёд Ic | Метастабильный кубический кристаллический лёд. Атомы кислорода расположены как в кристаллической решётке алмаза. Его получают при температуре в диапазоне от −133 °C до −123 °C, он остаётся устойчивым до −73 °C, а при дальнейшем нагреве переходит в лёд Ih. Он изредка встречается в верхних слоях атмосферы. |
| Лёд II | Тригональный кристаллический лёд с высокоупорядоченной структурой. Образуется изо льда Ih при сжатии и температурах от −83 °C до −63 °C. При нагреве он преобразуется в лёд III. |
| Лёд III | Тетрагональный кристаллический лёд, который возникает при охлаждении воды до −23 °C и давлении 300 МПа. Его плотность больше, чем у воды, но он наименее плотный из всех разновидностей льда в зоне высоких давлений. |
| Лёд IV | Метастабильный тригональный лёд. Его трудно получить без нуклеирующей затравки. |
| Лёд V | Моноклинный кристаллический лёд. Возникает при охлаждении воды до −20 °C и давлении 500 МПа. Обладает самой сложной структурой по сравнению со всеми другими модификациями. |
| Лёд VI | Тетрагональный кристаллический лёд. Образуется при охлаждении воды до −3 °C и давлении 1,1 ГПа. В нём проявляется дебаевская релаксация. |
| Лёд VII | Кубическая модификация. Нарушено расположение атомов водорода; в веществе проявляется дебаевская релаксация. Водородные связи образуют две взаимопроникающие решётки. |
| Лёд VIII | Более упорядоченный вариант льда VII, где атомы водорода занимают, очевидно, фиксированные положения. Образуется изо льда VII при его охлаждении ниже 5 °C. |
| Лёд IX | Тетрагональная метастабильная модификация. Постепенно образуется изо льда III при его охлаждении от −65 °C до −108 °C, стабилен при температуре ниже −133 °C и давлениях между 200 и 400 МПа. Его плотность 1,16 г/см³, то есть, несколько выше, чем у обычного льда. |
| Лёд X | Симметричный лёд с упорядоченным расположением протонов. Образуется при давлениях около 70 ГПа. |
| Лёд XI | Ромбическая низкотемпературная равновесная форма гексагонального льда. Является сегнетоэлектриком. |
| Лёд XII | Тетрагональная метастабильная плотная кристаллическая модификация. Наблюдается в фазовом пространстве льда V и льда VI. Можно получить нагреванием аморфного льда высокой плотности от −196 °C до примерно −90 °C и при давлении 810 МПа. |
| Лёд XIII | Моноклинная кристаллическая разновидность. Получается при охлаждении воды ниже −143 °C и давлении 500 МПа. Разновидность льда V с упорядоченным расположением протонов. |
| Лёд XIV | Ромбическая кристаллическая разновидность. Получается при температуре ниже −155 °C и давлении 1,2 ГПа. Разновидность льда XII с упорядоченным расположением протонов. |
| Лёд XV | Псевдоромбическая кристаллическая разновидность льда VI с упорядоченным расположением протонов. Можно получить путём медленного охлаждения льда VI примерно до −143 °C и давлении 0,8-1,5 ГПа[7]. |
| Лёд XVI | Кристаллическая разновидность льда с наименьшей плотностью (0,81 г/см3)[8] среди всех экспериментально полученных форм льда. Имеет строение топологически эквивалентное полостной структуре КС-II (англ. sII) газовых гидратов. |
| Лёд XVII | Кристаллическая разновидность льда с меньшей кристаллографической плотностью (0,85 г/см3)[9], чем у других экспериментально полученных форм льда. Его структура, как и у льда XVI, сходна с клатратной структурой газовых гидратов. Получается при температуре 280 К и давлении ~ 400 МПа. Его номинальный состав (Н2О)2Н2 с тремя формульными единицами на элементарную ячейку. |
Новые исследования формирования водяного льда на ровной поверхности меди при температурах от −173 °C до −133 °C показали, что сначала на поверхности возникают цепочки молекул шириной около 1 нм не гексагональной, а пентагональной структуры[10].
-

Дрейфующий лёд в Арктике
Лёд в период летней навигации
-

-

Образование ниласа
Снежницы на ледяном поле
- ↑ Петрушевский Ф. Ф., Гершун А. Л. Лед, в физике // Энциклопедический словарь — СПб.: Брокгауз — Ефрон, 1896. — Т. XVII. — С. 471–473.
- ↑ РМГ 75-2014. Измерения влажности веществ. Термины и определения, 2015, с. 1.
- ↑ Замерзающая вода выдавливает дно металлической ёмкости (видео)
- ↑ 1 2 Хирурги наполнят тела пациентов текущим льдом
- ↑ Фазы льда (англ.) (неопр.) (недоступная ссылка). Дата обращения 5 февраля 2009. Архивировано 25 марта 2009 года.
- ↑ Ледяные узоры высокого давления (неопр.) (недоступная ссылка). Дата обращения 6 февраля 2009. Архивировано 18 февраля 2009 года.
- ↑ Впервые получен лёд XV
- ↑ Andrzej Falenty, Thomas C. Hansen & Werner F. Kuhs. Formation and properties of ice XVI obtained by emptying a type sII clathrate hydrate // Nature. — Vol. 516, P. 231—233 (11 December 2014) — Falenty Andrzej, Hansen Thomas C., Kuhs Werner F. Formation and properties of ice XVI obtained by emptying a type sII clathrate hydrate // Nature. — 2014. — Декабрь (т. 516, № 7530). — С. 231—233. — ISSN 0028-0836. — doi:10.1038/nature14014. [исправить]
- ↑ Timothy A. Strobel, Maddury Somayazulu, Stanislav V. Sinogeikin, Przemyslaw Dera & Russell J. Hemley. Hydrogen-stuffed, quartz-like water ice // Journal of the American Chemical Society. — Vol. 138. — P. 13786-13789 (19 August 2016) — Strobel Timothy A., Somayazulu Maddury, Sinogeikin Stanislav V., Dera Przemyslaw, Hemley Russell J. Hydrogen-Stuffed, Quartz-like Water Ice // Journal of the American Chemical Society. — 2016. — 18 октября (т. 138, № 42). — С. 13786—13789. — ISSN 0002-7863. — doi:10.1021/jacs.6b06986. [исправить].
- ↑ A one-dimensional ice structure built from pentagons. Nature Materials. 8 March 2009 (англ.)
Конспект «Плавление и кристаллизация» — УчительPRO
«Плавление и кристаллизация.
Удельная теплота плавления»
Плавление
Плавление — это процесс превращения вещества из твёрдого состояния в жидкое.
Наблюдения показывают, что если измельчённый лёд, имеющий, например, температуру 10 °С, оставить в тёплой комнате, то его температура будет повышаться. При 0 °С лёд начнет таять, а температура при этом не будет изменяться до тех пор, пока весь лёд не превратится в жидкость. После этого температура образовавшейся изо льда воды будет повышаться.
Это означает, что кристаллические тела, к которым относится и лед, плавятся при определённой температуре, которую называют температурой плавления. Важно, что во время процесса плавления температура кристаллического вещества и образовавшейся в процессе его плавления жидкости остаётся неизменной.
В описанном выше опыте лёд получал некоторое количество теплоты, его внутренняя энергия увеличивалась за счёт увеличения средней кинетической энергии движения молекул. Затем лёд плавился, его температура при этом не менялась, хотя лёд получал некоторое количество теплоты. Следовательно, его внутренняя энергия увеличивалась, но не за счёт кинетической, а за счёт потенциальной энергии взаимодействия молекул. Получаемая извне энергия расходуется на разрушение кристаллической решетки. Подобным образом происходит плавление любого кристаллического тела.
Аморфные тела не имеют определённой температуры плавления. При повышении температуры они постепенно размягчаются, пока не превратятся в жидкость.
Кристаллизация
Кристаллизация — это процесс перехода вещества из жидкого состояния в твёрдое состояние. Охлаждаясь, жидкость будет отдавать некоторое количество теплоты окружающему воздуху. При этом будет уменьшаться её внутренняя энергия за счёт уменьшения средней кинетической энергии его молекул. При определённой температуре начнётся процесс кристаллизации, во время этого процесса температура вещества не будет изменяться, пока всё вещество не перейдет в твёрдое состояние. Этот переход сопровождается выделением определённого количества теплоты и соответственно уменьшением внутренней энергии вещества за счёт уменьшения потенциальной энергии взаимодействия его молекул.
Таким образом, переход вещества из жидкого состояния в твёрдое состояние происходит при определённой температуре, называемой температурой кристаллизации. Эта температура остаётся неизменной в течение всего процесса плавления. Она равна температуре плавления этого вещества.

На рисунке приведён график зависимости температуры твёрдого кристаллического вещества от времени в процессе его нагревания от комнатной температуры до температуры плавления, плавления, нагревания вещества в жидком состоянии, охлаждения жидкого вещества, кристаллизации и последующего охлаждения вещества в твёрдом состоянии.
Удельная теплота плавления
Различные кристаллические вещества имеют разное строение. Соответственно, для того, чтобы разрушить кристаллическую решётку твёрдого тела при температуре его плавления, необходимо ему сообщить разное количество теплоты.
Удельная теплота плавления — это количество теплоты, которое необходимо сообщить 1 кг кристаллического вещества, чтобы превратить его в жидкость при температуре плавления. Опыт показывает, что удельная теплота плавления равна удельной теплоте кристаллизации.
Удельная теплота плавления обозначается буквой λ. Единица удельной теплоты плавления — [λ] = 1 Дж/кг.
Значения удельной теплоты плавления кристаллических веществ приведены в таблице. Удельная теплота плавления алюминия 3,9*105 Дж/кг. Это означает, что для плавления 1 кг алюминия при температуре плавления необходимо затратить количество теплоты 3,9*105 Дж. Этому же значению равно увеличение внутренней энергии 1 кг алюминия.
Чтобы вычислить количество теплоты Q, необходимое для плавления вещества массой m, взятого при температуре плавления, следует удельную теплоту плавления λ умножить на массу вещества: Q = λm.
Эта же формула используется при вычислении количества теплоты, выделяющегося при кристаллизации жидкости.

Конспект урока «Плавление и кристаллизация. Удельная теплота плавления».
Следующая тема: «Тепловые машины. ДВС. Удельная теплота сгорания топлива».



