Алюминий и сплавы. Свойства.
Свойства алюминия
Алюминий и его сплавы имеют малую плотность 2,64— 2,89 г/см3. Прочностные же свойства зависят от легирования, термической обработки, степени деформирования и могут достигать высоких значений. По прочности многие алюминиевые сплавы не уступают конструкционным сталям.
Чистый алюминий (суммарное содержание примесей не более 0,05%) имеет гранецентрированную кубическую решетку с параметрами 4,04 А. Температура его плавления 659,8—660,2° С, температура кипения 1800—2500° С.
Для сплавов алюминия электропроводность составляет 30—50% электропроводности меди, а для чистого алюминия 62—65% электропроводности меди.
Алюминий окисляется с образованием окисной пленки Аl203, которая защищает его от дальнейшего окисления,Химический состав деформируемых и литейных алюминиевых сплавов по ГОСТам 4784—65 и 2685—63.
Из алюминиевых сплавов в основном изготовляют конструкции, работающие при сравнительно низких температурах не свыше 350° С.
Характеристики длительной прочности термически не упрочняемых сплавов обычно ниже, чем термически упрочняемых.
Длительные выдержки сплавов типа авиаль при температурах свыше 80—100° С приводят к их упрочнению и снижению пластических свойств. Исследованиями, проведенными авторами, установлено, что относительное удлинение снижается при указанных условиях с 20—25% (исходное состояние после закалки и естественного старения) до 1—2%. Подобное ухудшение свойств, при которых возможно хрупкое разрушение конструкций, является существенным препятствием применения сплавов такого типа для работы при температурах выше 80° С.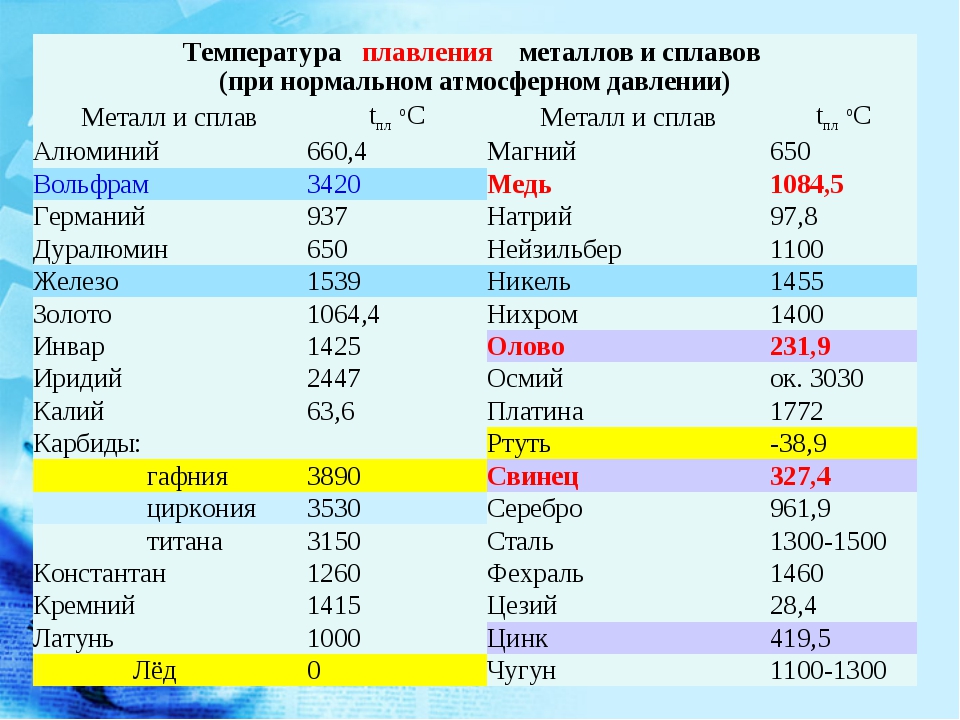
Циклическая прочность
Циклическая прочность деформируемых сплавов при симметричном изгибе на базе 5*108циклов составляет 3,5 кГ/мм2 для сплава А ДМ, 4,2—6,3 кГ/мм2 для сплава АДН, 5—6,5 кГ/мм2 для сплава АМцАМ, 15 кГ/мм2 для сплава В95.
Области применения литейных сплавов различны. Сплавы группы I рекомендуют для литья в песчаные формы, кокиль и для литья под давлением. Сплав АЛ22 обычно применяют в закаленном состоянии, а сплав АЛ23 и АЛ29 — в литом. Сплавы группы II имеют высокие литейные свойства благодаря наличию в сплавах двойной эвтектики, которая уменьшает также литейную усадку и склонность к образованию горячих трещин. Сплавы AЛ2, АЛ4 и АЛ9 обладают повышенной коррозионной стойкостью, поэтому их применяют для изделий, работающих во влажной и морской средах. С целью получения заданных механических свойств отливки подвергают термической обработке по различным режимам.
Сплавы группы III обладают высокими механическими свойствами, особенно пределом текучести и повышенной жаропрочностью.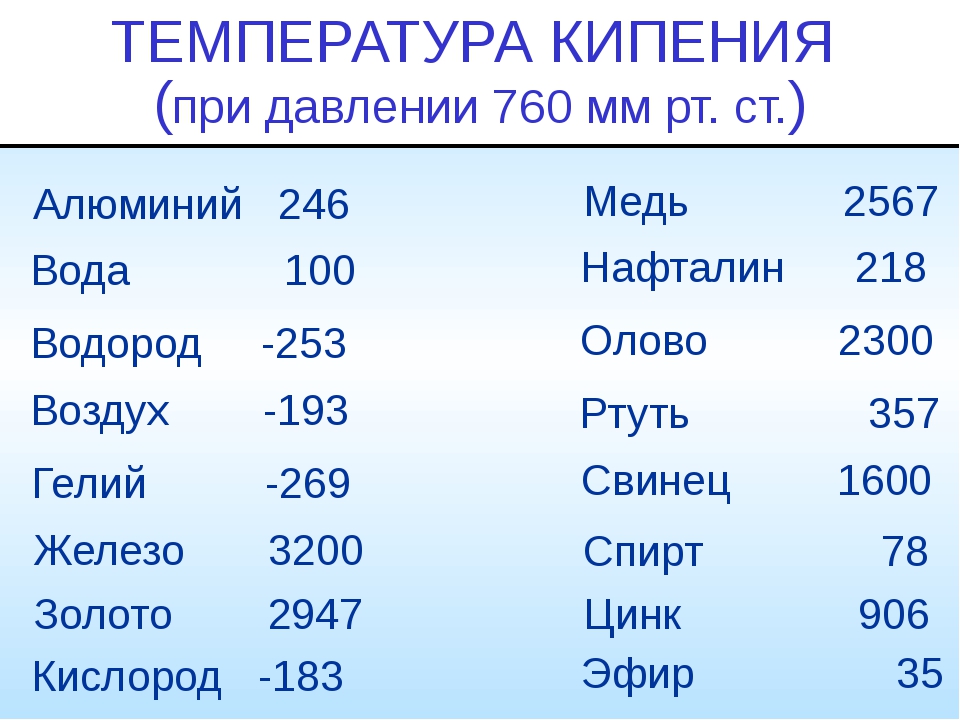 У этих сплавов пониженные литейные свойства и коррозионная стойкость, кроме того, они склонны к образованию горячих трещин. Для выполнения отливок сложной формы такие сплавы не рекомендуют. Сплав АЛ7 применяют для деталей, испытывающих средние нагрузки и температуры не свыше 200° С. Сплав АЛ 19 по сравнению с АЛ 17 имеет более высокую жаропрочность (в 2 раза), и применяют его для силовых деталей в условиях статических и ударных нагрузок при температурах до 300° С.
У этих сплавов пониженные литейные свойства и коррозионная стойкость, кроме того, они склонны к образованию горячих трещин. Для выполнения отливок сложной формы такие сплавы не рекомендуют. Сплав АЛ7 применяют для деталей, испытывающих средние нагрузки и температуры не свыше 200° С. Сплав АЛ 19 по сравнению с АЛ 17 имеет более высокую жаропрочность (в 2 раза), и применяют его для силовых деталей в условиях статических и ударных нагрузок при температурах до 300° С.
Сплавы группы IV применяют для всех способов литья. По литейным свойствам они менее технологичны, чем сплавы II.
Сплавы группы V применяют для самых разнообразных деталей, работающих при высоких температурах. К этой группе относятся также самозакаливающиеся сплавы.
Механические свойства
Механические свойства всех вышеуказанных, литейных сплавов зависят от режимов термической обработки, определяющей структурное и фазовое состояние сплавов.
Высокая коррозионная стойкость алюминия объясняется образованием окисиой пленки Аl203.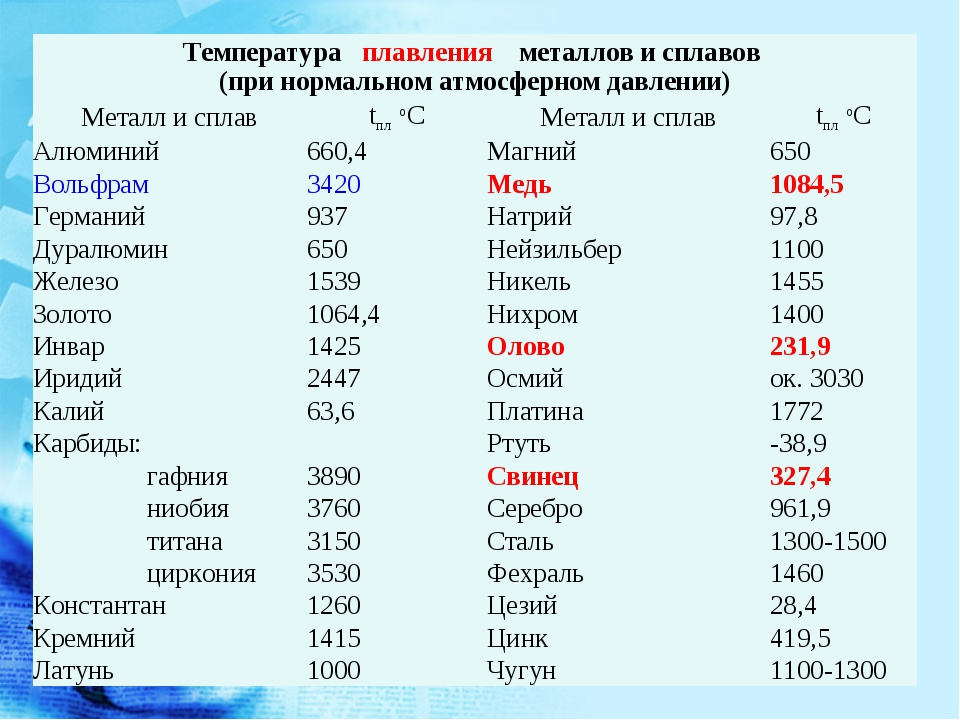 Коррозионная стойкость алюминия зависит от влияния агрессивной среды на растворимость защитной окисной пленки, от чистоты обработки поверхности и режима термической обработки. Чистый алюминий обладает высокой стойкостью в сухом и влажном воздухе. В азотной кислоте концентрации 30—50% при увеличении температуры скорость коррозии алюминия возрастает. При концентрации азотной кислоты выше 80% коррозия резко снижается. Алюминий обладает высокой стойкостью в разбавленной серной кислоте и в концентрированной при 20° С. Средние концентрации серной кислоты (более 40%) наиболее опасны для алюминия. При комнатных температурах алюминий устойчив в фосфорной и уксусных кислотах. Такие, как муравьиная, щавелевая, трихлоруксусная и другие хлороорганические кислоты значительно разрушают алюминий. В растворах едких щелочей окисная пленка алюминия растворяется. Растворы углекислых солей калия и натрия оказывают меньшее влияние на скорость коррозии алюминия.
Коррозионная стойкость алюминия зависит от влияния агрессивной среды на растворимость защитной окисной пленки, от чистоты обработки поверхности и режима термической обработки. Чистый алюминий обладает высокой стойкостью в сухом и влажном воздухе. В азотной кислоте концентрации 30—50% при увеличении температуры скорость коррозии алюминия возрастает. При концентрации азотной кислоты выше 80% коррозия резко снижается. Алюминий обладает высокой стойкостью в разбавленной серной кислоте и в концентрированной при 20° С. Средние концентрации серной кислоты (более 40%) наиболее опасны для алюминия. При комнатных температурах алюминий устойчив в фосфорной и уксусных кислотах. Такие, как муравьиная, щавелевая, трихлоруксусная и другие хлороорганические кислоты значительно разрушают алюминий. В растворах едких щелочей окисная пленка алюминия растворяется. Растворы углекислых солей калия и натрия оказывают меньшее влияние на скорость коррозии алюминия.
Алюминий при температурах до 300° С обладает хорошей стойкостью в жидких металлических средах, например, натрии.
Коррозионная стойкость алюминия в воде и водяном паре при повышенных температурах (выше 200° С) зависит от чистоты алюминия. Если происходит движение среды, то скорость коррозии повышается в 10—60 раз.
Основными видами коррозии алюминиевых сплавов является межкристаллитная коррозия и коррозия под напряжением. Для повышения коррозионных свойств применяют защитные покрытия, такие, как плакирование, оксидные пленки, лакокрасочные покрытия, смазки, хромовые или никель-хромовые гальванические покрытия.
Технология производства
Технология производства и термическая обработка могут оказывать существенное влияние на коррозионные свойства сплавов. Сплавы АД, АД1, АМц, АМг2 и АМгЗ мало чувствительны к методам производства. Коррозионная стойкость сплавов АМг5, АМгб во многом зависит от методов производства. У этих сплавов при длительном нагреве на 60—70° С проявляется склонность к межкристаллитной коррозии и коррозии под напряжением.
Сплавы Д1, Д18, Д16 и типа В95 имеют пониженную коррозионную стойкость. Подобные сплавы применяют с соответствующей защитой от коррозии. Сплавы типа авиаль обладают высокой коррозионной стойкостью в воде высокой чистоты с добавлением углекислого газа при температурах до 100° С.
Подобные сплавы применяют с соответствующей защитой от коррозии. Сплавы типа авиаль обладают высокой коррозионной стойкостью в воде высокой чистоты с добавлением углекислого газа при температурах до 100° С.
При изучении влияния облучения на некоторые характеристики алюминия установлено, что после облучения интегральным потоком 1,1 х 1019 нейтрон/см2 при 80° С критическое напряжение сдвига увеличивается в 5 раз. При этом электросопротивление алюминия повышается на 30%. Влияние облучения на электрическое и критическое сопротивления сдвигу снимается при температуре около 60° С.
Из разработанных свариваемых, термически обрабатываемых, самозакаливающихся при сварке сплавов, наиболее характерны сплавы системы Аl—Zn—Mg. Однако, обладая удовлетворительными прочностными свойствами, они склонны к коррозии под напряжением и замедленному разрушению. Такая склонность вызвана переходом от зонной к фазовой стадии старения даже при комнатных температурах эксплуатации сварных соединений.
Высокая стойкость
К самозакаливающимся сплавам относится сплав 01911, по химическому составу он является среднелегированным сплавом системы Аl—Zn-Mg. Высокая стойкость против коррозии под напряжением обеспечивается суммарным содержанием цинка и магния до 6,5% и дополнительным введением марганца, хрома, меди и циркония. Причем медь ухудшает свариваемость сплава, поэтому для его сварки применяют проволоку марки 01557, аналогичную по химическому составу сплаву АМг5, но с добавкой циркония й хрома. Сплавы Д20 и АК8 достаточно прочны, но имеют низкую общую коррозионную стойкость. Они обладают высокой стойкостью против коррозии под напряжением и замедленного разрушения.
Перспективными являются спеченные сплавы. К числу жаростойких относятся сплавы типа САП, которые можно применять для конструкций, работающих при температурах до 400—500° С.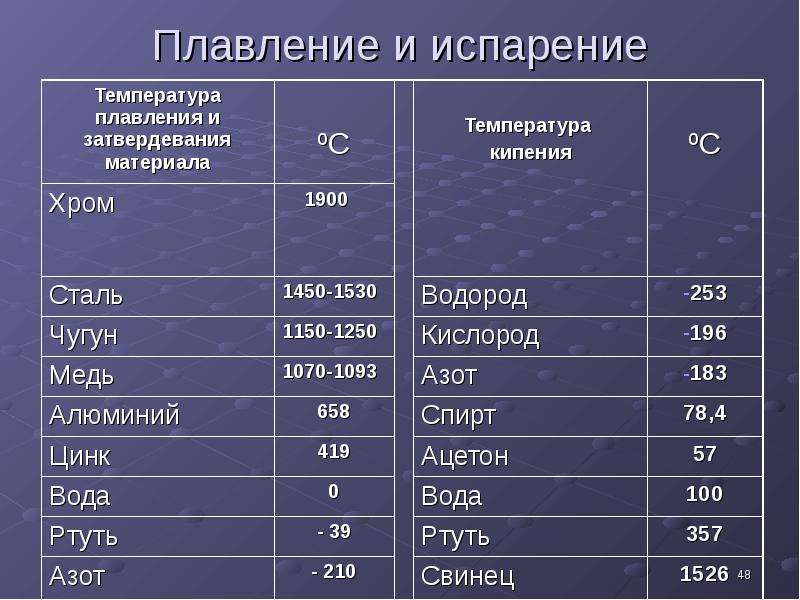
Из сплавов САП-1 (6,0—9,0% А1203) и САП-2 (9,1 — 13,0% А1203) изготовляют такие же полуфабрикаты, как из алюминиевых сплавов. Сплав САП-3 применяют только для прессованных полуфабрикатов. Наибольшая масса прессованных полуфабрикатов до 400 кг. Размеры изготовляемых листов 1000 X Х7000 мм при толщине от 0,8 до 10 мм.
Сплавы имеют высокие прочностные свойства. Так у сплава САП-1 при 20° С ов = 35 кГ/мм2, а у САП-3 40 кГ/мм2. Подобными свойствами обладает сплав САС-1 (25—30% Si и 7% Nі), получаемый из распыленного порошка. Он износостоек, достаточно прочен (<та = 25,0-28,0 кГ/мм2
), имеет коэффициент линейного расширения, близкий к стали, и высокий модуль упругости.Сплавы САС-1 и САП не склонны к коррозии под напряжением и замедленным разрушениям. Сплав САП можно применять при сравнительно высоких температурах эксплуатации. При сварке этих сплавов обычно применяют присадочную проволоку марки АМг6.
При сварке этих сплавов обычно применяют присадочную проволоку марки АМг6.
Материалы с сатйа: http://ruswelding.com
Цинк и его сплавы — производство, свойства, виды и применение
Цинк — хрупкий голубовато-белый металл. В природе без примесей не встречается. В 1738 году Уильям Чемпион добыл чистые пары цинка с помощью конденсации. В периодической системе Менделеева находится под номером 30 и обозначается символом Zn.
Свойства цинка
Химические свойства цинка
Цинк — активный металл. При комнатной температуре тускнеет и покрывается слоем оксида цинка.
- Вступает в реакцию со многими неметаллами: фосфором, серой, кислородом.
- При повышении температуры взаимодействует с водой и сероводородом, выделяя водород.
- При сплавлении с щелочами образует цинкаты — соли цинковой кислоты.
- Реагирует с серной кислотой, образуя различные вещества в зависимости от концентрации кислоты.

- При сильном нагревании вступает в реакции со многими газами: газообразным хлором, фтором, йодом.
- Не реагирует с азотом, углеродом и водородом.
Физические свойства цинка
Цинк — твердый металл, но становится пластичным при 100–150 °C. При температуре выше 210 °С может деформироваться. Температура плавления — очень низкая для металлов. Несмотря на это, цинк имеет хорошую электропроводность.
- Плотность — 7,133 г/см³.
- Теплопроводность — 116 Вт/(м·К).
- Температура плавления цинка — 419,6 °C.
- Температура кипения — 906,2 °C.
- Удельная теплота испарения — 114,8 кДж/моль.
- Удельная теплота плавления — 7,28 кДж/моль.
- Удельная магнитная восприимчивость — 0,175·10-6.
- Предел прочности при растяжении — 200–250 Мн/м2.
Подробный химический состав цинка различных марок указан в таблице ниже.
| Обозначение марок | Цинк, не менее | Примесь, не более | |||||||
| свинец | кадмий | железо | медь | олово | мышьяк | алюминий | всего | ||
| ЦВ00 | 99,997 | 0,00001 | 0,002 | 0,00001 | 0,00001 | 0,00001 | 0,0005 | 0,00001 | 0,003 |
| ЦВ0 | 99,995 | 0,003 | 0,002 | 0,002 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,005 |
| ЦВ | 99,99 | 0,005* | 0,002 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,01 |
| Ц0А | 99,98 | 0,01 | 0,003 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,02 |
| Ц0 | 99,975 | 0,013 | 0,004 | 0,005 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,025 |
| Ц1 | 99,95 | 0,02 | 0,01 | 0,01 | 0,002 | 0,001 | 0,0005 | 0,005 | 0,05 |
| Ц2 | 98,7 | 1,0 | 0,2 | 0,05 | 0,005 | 0,002 | 0,01 | 0,010** | 1,3 |
| Ц3 | 97,5 | 2,0 | 0,2 | 0,1 | 0,05 | 0,005 | 0,01 | — | 2,5 |
* В цинке, применяемом для производства сплава марки ЦАМ4-1о, массовая доля свинца должна быть не более 0,004%.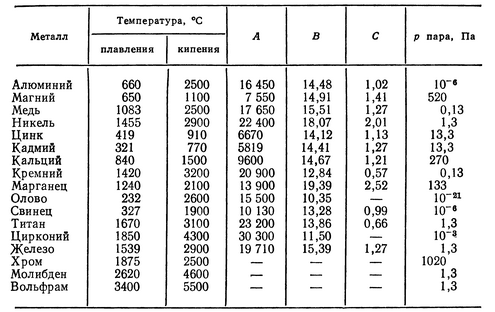 ** В цинке, применяемом для проката, массовая доля алюминия должна быть не более 0,005%.
** В цинке, применяемом для проката, массовая доля алюминия должна быть не более 0,005%.
|
|||||||||
Содержание примесей в цинке зависит от способа производства и качества сырья.
В России основной процент цинка получают гидрометаллургическим способом — металл восстанавливают из солей в растворах. Такой способ позволяет получить наиболее чистый металл. Но часть цинка обрабатывают при высоких температурах. Такой метод называют пирометаллургическим.
Свинец — особая примесь в цинке, так как основная его часть оседает из-за нерастворимых анодов, содержащихся в металле. Катодный цинк, помимо всех указанных примесей, состоит из хлора и фтора.
Как примеси изменяют свойства цинка
Производители ограничивают содержание кадмия, олова и свинца в литейных сплавах цинка, чтобы подавить межкристаллитную коррозию.
Олово — вредная примесь. Металл не растворяется и выделяется из расплава — способствует ломкости цинковых отливок. Кадмий напротив — растворяется в цинке и снижает его пластичность в горячем состоянии. Свинец увеличивает растворимость металла в кислотной среде.
Кадмий напротив — растворяется в цинке и снижает его пластичность в горячем состоянии. Свинец увеличивает растворимость металла в кислотной среде.
Железо повышает твердость цинка, но снижает его прочность. Вместе с тем оно усложняет процесс заполнения форм при литье.
Медь увеличивает твердость цинка, но уменьшает его пластичность и стойкость при коррозии. Содержание меди также мешает рекристаллизации цинка.
Наиболее вредная примесь — мышьяк. Даже при небольшом ее количестве металл становится хрупким и менее пластичным.
Чтобы избежать растрескивания кромок при горячей прокатке цинка, содержание сурьмы не должна быть выше 0,01%. В горячем состоянии она увеличивает твердость цинка, лишая его хорошей пластичности.
Сплавы цинка
Сплавы на цинковой основе с добавлением меди, магния и алюминия имеют низкую температуру плавления и обладают хорошей текучестью. Они легко поддаются обработке, свариванию и паянию.
Латунь
Различают латуни двухкомпонентные и многокомпонентные.
Двухкомпонентная латунь — сплав цинка с высоким содержанием меди. Существует желтая латунь с медью в количестве 67%, золотистая медь или томпак — 75%, и зеленая — 60%. Такие сплавы могут деформироваться при температуре 300 °C.
Многокомпонентные латуни, помимо 2-х основных металлов, состоят из других добавок: никеля, железа, свинца или марганца. Каждый из элементов влияет на свойства сплава.
ЦАМ
ЦАМ — семейство цинковых сплавов. В их состав входят магний, алюминий и медь. Такие сплавы цинка используются в литейном производстве. В них содержится алюминий в количестве 4%.
Основная область применения сплавов ЦАМ — литье цинка под давлением. Сплавы этого семейства обладают низкой температурой плавления и хорошими литейными свойствами. Их высокопрочность позволяет производить прочные и сложные детали.
Вирениум
Сплав состоит из цинка (24,5%), меди (70%), никеля (5,5%).
Производств цинка
Добыча металла
Цинк как самородный металл в природе не встречается. Добывается из полиметаллических руд, содержащих 1–4% металла в виде сульфида, а также меди, свинца, золота, серебра, висмута и кадмия. Руды обогащаются селективной флотацией и получаются цинковые концентраты (50–60% Zn).
Добывается из полиметаллических руд, содержащих 1–4% металла в виде сульфида, а также меди, свинца, золота, серебра, висмута и кадмия. Руды обогащаются селективной флотацией и получаются цинковые концентраты (50–60% Zn).
Концентраты цинка обжигают в печах. Сульфид цинка переводится в оксид ZnO. При этом выделяется сернистый газ SO2, который используется в производстве серной кислоты.
Получение металла
Существуют два способа получения чистого цинка из оксида ZnO.
Самый древний метод — дистилляционный. Обожженный концентрированный состав подвергают термообработке, чтобы придать ему зернистость и газопроницаемость.
Затем концентрат восстанавливают коксом или углем при температуре 1200–1300 °C. В процессе образуются пары металла, которые конденсируют и разливают в изложницы. Жидкий металл отстаивают от железа и свинца при температуре 500 °C. Так достигается цинк чистотой 98,7%.
Иногда используется сложная и дорогая обработка цинка ректификацией — разделением смесей за счет обмена теплом между паром и жидкостью.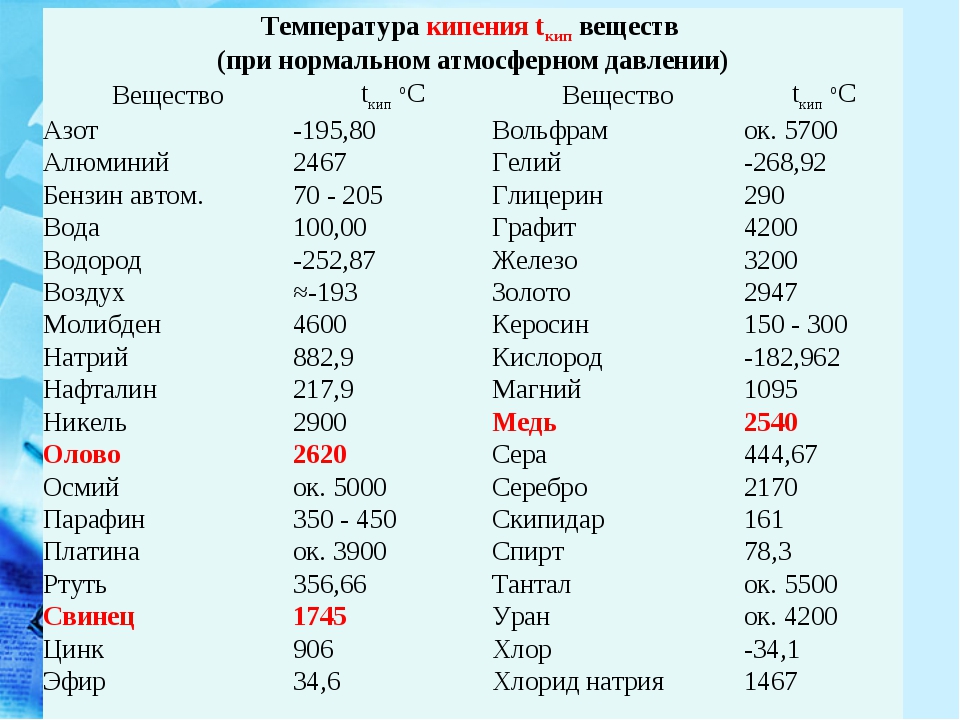 Такая чистка позволяет получить металл чистотой 99,995% и извлечь кадмий.
Такая чистка позволяет получить металл чистотой 99,995% и извлечь кадмий.
Второй метод производства цинка — электролитический. Обожженный концентрат обрабатывается серной кислотой. Готовый сульфатный раствор очищается от примесей, после чего подвергается электролизу в свинцовых ваннах. Цинк дает осадок на алюминиевых катодах. Полученный металл удаляют с ванн и плавят в индукционных печах. После этого получается электролитный цинк чистотой 99,95%.
Литье металла
Горячий цинк — жидкий и текучий металл. Благодаря таким свойствам он легко заполняется в литейные формы.
Примеси влияют на величину натяжения поверхности цинка. Технологические свойства металла можно улучшить, добавив небольшое количество лития, магния, олова, кальция, свинца или висмута.
Чем выше температура перегрева цинка, тем лучше он заполняет формы. При литье металла в чугунные изложницы его объем уменьшается на 1,6%. Это затрудняет получение крупных и длинных цинковых отливок.
Применение цинка
Для защиты металлов от коррозии
Чистый цинк используется для защиты металлов от коррозии. Основу покрывают тонкой пленкой. Этот процесс называется металлизацией.
Основу покрывают тонкой пленкой. Этот процесс называется металлизацией.
В автомобильной отрасли
Сплавы на цинковой основе используют для оформления декора автомобильного салона, в производстве ручек дверей, замков, зеркал и корпусов стеклоочистителей.
В автомобильные покрышки добавляют окись цинка, которая повышает качество резины.
В батарейках, аккумуляторах и других химических источниках тока цинк используется как материал для отрицательного электрода. В производстве электромобилей применяются цинк-воздушные аккумуляторы, которые обладают высокой удельной энергоемкостью.
В производстве ювелирных украшений
Ювелиры добавляют цинк в сплавы на основе золота. В итоге они легко поддаются ковке и становятся пластичными — прочно соединяют мелкие детали изделия между собой.
Металл также осветляет ювелирные изделия, поэтому его часто используют в изготовлении белого золота.
В медицине
Окись цинка применяется в медицине как антисептическое средство.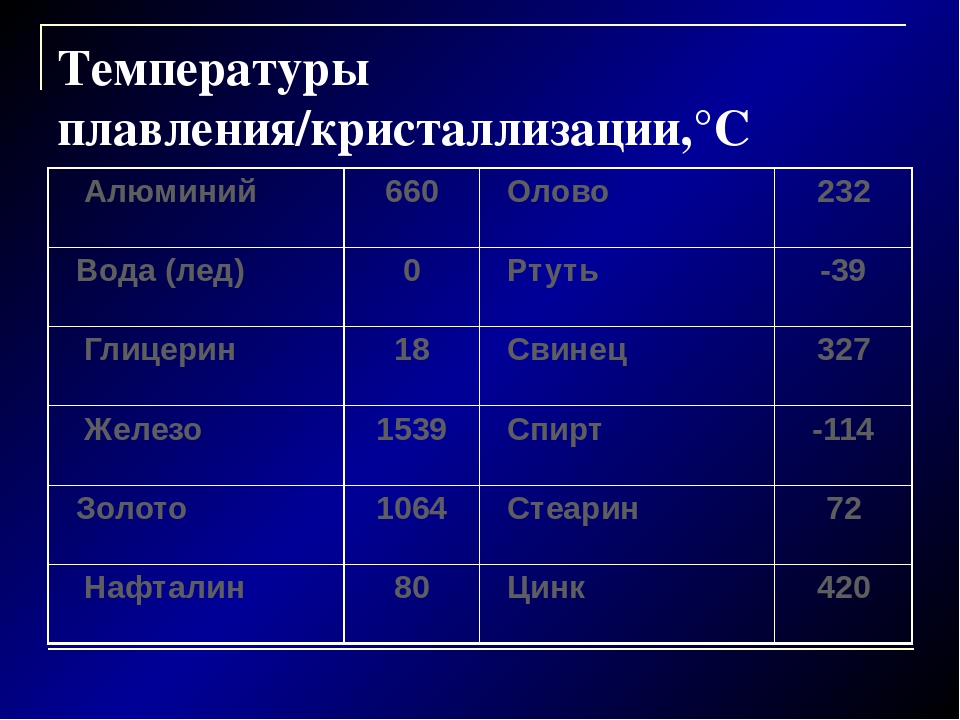 Окись добавляют в мази и другие составы для заживления ран.
Окись добавляют в мази и другие составы для заживления ран.
Благодаря своим свойствам, цинк широко применяется в различных областях промышленности. Металл пользуется спросом из-за относительно низкой цены и хороших физических свойств.
Алюминиевый порошок Al
Оборудование Kermetico HVAF эффективно наносит высокопрочные, плотные и не окисленные алюминиевые покрытия. Низкое содержание кислорода в процессе Kermetico HVAF, высокая и равномерная скорость частиц приводят к высокой плотности покрытия и прочности сцепления.
Низкое содержание кислорода в процессе Kermetico HVAF, высокая и равномерная скорость частиц приводят к высокой плотности покрытия и прочности сцепления. Это дает возможность покрывать толстые слои алюминия нашим оборудованием.
Высокоскоростные алюминиевые покрытия
Многочисленные публикации, посвященные распылению алюминия методом HVOF и холодному распылению, показывают промышленную потребность в способе формирования плотного неокисляющегося алюминиевого покрытия.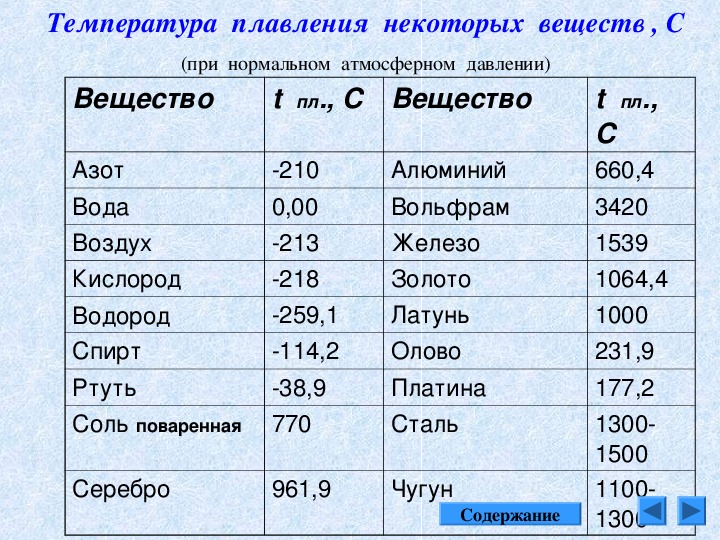
Покрытые распылением алюминиевые покрытия с такими свойствами используются для ремонта / восстановления изношенных легких деталей, для формирования коррозионно-стойкого слоя с высокой электропроводностью, для защиты магниевых подложек и при производстве присадок.
Нам неизвестно о каких-либо исследованиях, связанных с осаждением алюминиевых покрытий с помощью HVAF, поэтому мы просто распыляем его на месте и производим специализированное оборудование HVAF для напыления материалов с низкой температурой плавления.
Свойства HVAF Al Coatings
Покрытия Kermetico HVAF Al демонстрируют объемную структуру, высокую прочность сцепления и низкий уровень окисления покрытия.
Порошок Al номинального состава (мас.%):
Свойства алюминиевого покрытия
|
Кажущаяся металлографическая пористость |
<1,0% |
|
Твердость, HV |
105 |
|
Максимальная рабочая температура, o C ( o F) |
500 (932) |
|
Максимальная толщина покрытия (при напылении), мм (дюйм) |
12 (0,500) и более |
Микроструктура алюминиевого покрытия Kermetico HVAF, х100
Микрофотография покрытого алюминием слоя Kermetico HVAF, х500
Сравнение методов HVOF, HVAF и холодного распыления для распыления покрытий из чистого алюминия
Температура плавления Al составляет 660 ° C (1220 ° F), а температура кипения составляет 2470 ° C (4,478 ° F).
Коммерчески доступные системы HVOF не предназначены для обработки металлов с низкой температурой плавления. Типичная температура сгорания колеблется от 3100 ° С | 5612 ° F для окси-керосина до 3200 ° C | 5792 ° F для окси-водорода. Оба существенно выше точки кипения алюминия. Это создает риск полного испарения Al внутри камеры сгорания или сопла, накопление Al-конденсата на сопле приводит к засорению и избыточному окислению Al-покрытия. Эти риски делают распыление алюминия HVOF неблагоприятным кандидатом. Это создает риск полного испарения Al внутри камеры сгорания или сопла, накопление Al-конденсата на сопле приводит к засорению и избыточному окислению Al-покрытия. Эти риски делают распыление алюминия HVOF неподходящим кандидатом.
Осаждение Al в холодном распылении труднее, чем в других мягких материалах, таких как Zn и Cu. Это связано с его высокой теплоемкостью, что затрудняет достижение условий нестабильности при сдвиге во время удара, независимо от его низкой температуры плавления и низкого предела текучести.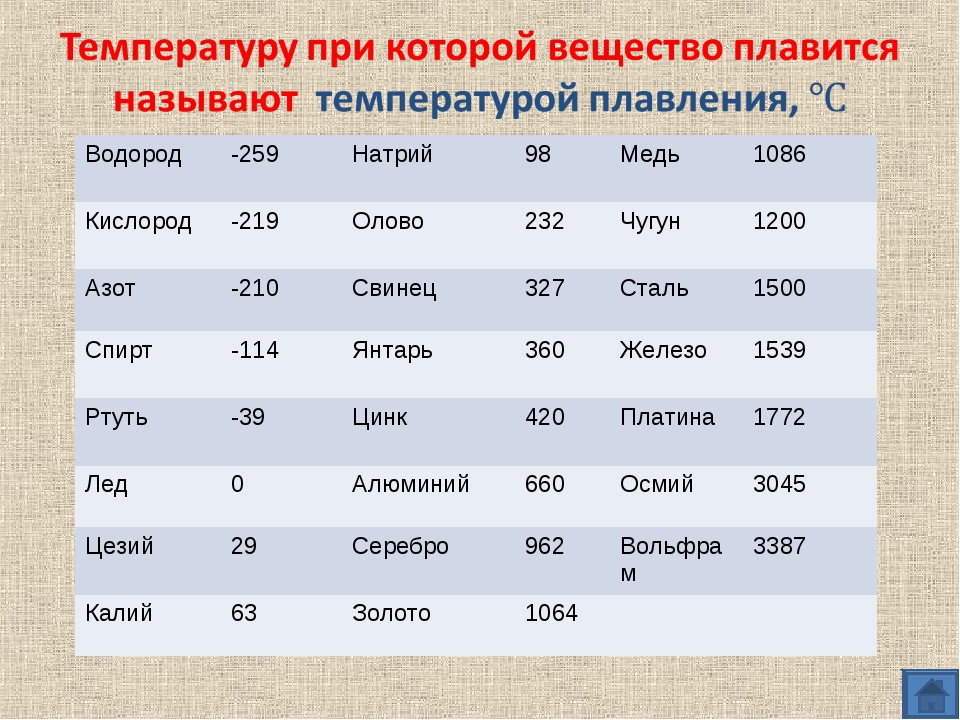 Хотя некоторые хорошие образцы осажденного Al были получены разными исследователями, общая стоимость процесса холодного распыления делает это применение слишком дорогим для промышленного использования.
Хотя некоторые хорошие образцы осажденного Al были получены разными исследователями, общая стоимость процесса холодного распыления делает это применение слишком дорогим для промышленного использования.
Пистолет Kermetico HVAF SL разработан специально для распыления материалов с низкой температурой плавления.
В нем есть:
- более низкие температуры сгорания (1 960–2 100 ° C | 3 560–3 812 ° F), чем температура кипения Al, предотвращающая испарение материала
- кожух инертного газа, минимизирующий окисление
- широкое сопло, предотвращающее засорение сопла
- более высокая скорость частиц, чем у HVOF, и более высокая энергия частиц, чем у холодного спрея
- более низкие инвестиционные затраты и значительно более низкие эксплуатационные расходы, чем HVOF или Cold Spray
Все это приводит к доступным алюминиевым покрытиям с почти нулевой пористостью, нулевой газопроницаемостью и высокой связью.
Типичные области применения алюминиевых покрытий Kermetico HVAFОборудование HVAF для распыления алюминиевых покрытий
Kermetico разработала специализировая горелка для распыления порошков Al и Al: Kermetico SL .
118 элементов. Глава 13: от глиния до алюминия
Элемент: алюминий (Aluminium, Aluminum)
Химический символ: Al
Порядковый номер: 13
Год открытия: 1824 (предсказан в 1782 А.Лавуазье)
Стандартная атомная масса: 26.9815384(3)
Температура плавления: 933.47 К
Температура кипения: 2743 К
Плотность при стандартных условиях: 2.70 г/cм3
Скорость звука в алюминии: 5000 м/с
Число стабильных изотопов: 1
Кристаллическая решётка: гексагональная
Соединения алюминия известны человечеству еще с древности. Латинское слово alumen – «горькая соль» – означало квасцы. Двойной сульфат одно- и трёхвалентного металла в кристаллогидратной форме. Причем в роли трёхвалентного металла чаще всего выступал алюминий. Собственно говоря, на английском квасцы до сих пор называются alum. Так что с этимологией нашего элемента все достаточно просто.
Соответственно, и использует соединения алюминия человечество даже еще раньше, чем познакомилось с квасцами. Главный признак материальной культуры, который позволяет отличать людей древности – это керамика. Которая делается из глины. А что такое глина? Оксид кремния, оксид алюминия и вода.
Алюминиевые квасцы
Другое дело, что все не очень просто с открытием, и еще сложнее – с использованием алюминия как металла. Дело в том, что далеко не сразу стало понятно, что в квасцах и в глине есть новый элемент, еще позже его сумели выделить, а уж получать в промышленных масштабах так, чтобы это было выгодно, смогли и вовсе относительно недавно. Но обо всем по порядку.
Если говорить о металлическом алюминии, то, как это водится, история начинается с легенды. В 80-е-90-е годы особенно ходила легенда о том, что императору Тиберию поднесли то ли корону, то ли чашу, изготовленную из ранее неизвестного металла, который удалось добыть из глины. Чаша блестела подобно серебру, но при этом была лёгкой. Император был впечатлён открытием, но при этом испугался, что новый металл может привести к обесцениванию серебра и золота. Дальше следовал распространенный в «историях» сюжет: император выяснил, что секрет нового металла известен только мастеру – и приказал отрубить ему голову (хотя в стиле Тиберия было бы затравить львами или распять). Для достоверности ссылались на римские источники, конкретно – Плиния Старшего.
Но если заглянуть в первоисточник, мы увидим, что, во-первых, Плиний пересказывает слухи, а во-вторых, речь вообще не о металле («не выиграл, а проиграл, и не в лотерею, а в карты»):
«Рассказывают, что при принцепсе Тиберии был придуман такой состав стекла, что оно было гибким, и тогда мастерская этого мастера полностью была уничтожена, чтобы не понизились цены на металлы, медь, серебро, золото, однако слух этот был скорее упорным, чем верным».
Так что даже если и было что, то гибкое стекло, полученное неким добавлением глинозема в шихту, а не алюминий. А человечеству по-прежнему оставался алюм – то бишь, квасцы, которые в эпоху крестовых походов стали объектом торговли.
В 1530 году Парацельс отделил квасцы от «простых» сульфатов («витриолей» в алхимии), назвав их «солью земли». В 1595 году немецкий врач и химик Андреас Либавий показал, что синий и зеленый «витриоли» и квасцы образованы одной и той же кислотой (серной), но разными землями. Напомним, что «земли» –это не планеты у других звезд (сейчас в ходу термин «суперземли»), а оксиды металлов. Нетрудно догадаться, что синий витриоль – это медный купорос, а зеленый – железный. Для неоткрытой «земли», которая образует «алюм», Либавий придумал термин «алюмина».
Андреас Либавий
И только в конце XVIII века Лавуазье показал, что «алюмина» представляет собой оксид неизвестного металла. Но его еще предстояло открыть. Попытки выделить алюминий из алюмины продолжались 40 лет. Только в 1824 году датский физик и химик Ганс Христиан, но не Андерсен, а Эрстед сумел получить чистый (сравнительно) алюминий реакцией безводного хлорида алюминия с амальгамой калия.
Ганс Христиан Эрстед
Дальше эстафету подхватил Фридрих Вёлер, который всесторонне исследовал новый металл.
Однако казалось бы – человечество получило прекрасный легкий металл, который мог бы быть отличной заменой железу. Сырья для металла – огромное количество, глина есть почти везде. И при этом он оставался безумно дорогим металлом: уж очень затратным оказалось его получение.
Ходит легенда о том, что император Наполеон на свои пиры делал ложки из алюминия. К сожалению, Бонапарт не мог этого делать, поскольку скончался на Острове святой Елены за три года до экспериментов Эрстеда. Тем не менее, на обедах у Наполеона III действительно была посуда из алюминия, который был тогда дороже золота.
Кстати, именно Наполеон III и спонсировал исследования Анри Сент-Клер Девиля, которые позволили бы дешево получать алюминий в промышленных масштабах. Император планировал применять алюминий в армии.
С дороговизной алюминия связана и легенда про Дмитрия Ивановича Менделеева, которая гласит,: что англичане, решив почтить его заслуги в химии, подарили ему аналитические весы с чашами из чистого алюминия, которые были гораздо дороже золота. Но вот незадача – известность Менделеев получил уже в 1870-х (мы же все помним, когда юбилей таблицы Менделеева?), а с 1855 до 1859 год стоимость алюминия упала с $500 до $40 за фунт. Конечно, еще дорого, но уже не дороже золота (которое почти весь XIX век стоило чуть дороже 20 долларов за тройскую унцию – то есть под 300 долларов за фунт). Впрочем, кто знает, может быть, весы действительно дарили.
Любопытный факт: в знаменитом энциклопедическом словаре Брокгауза и Ефрона было ДВЕ статьи об алюминии. На совершенно разные буквы. И на букву «Г» статья была даже чуть побольше. Дело в том, что на рубеже XIX-XX веков для названия «металла, не найденного до сих пор в природе в свободном состоянии» в русском языке было целых два слова: собственно «алюминий» и «глиний».
Динамо-машина Грамма позволила получать алюминий дешево и массово
Тем не менее, к массовому использованию алюминий был еще непригоден. Конечно, еще в 1854 году создатель знаменитой горелки Роберт Бунзен получил его электрохимически. Но до изобретения динамоэлектрической машины французом Зенобом Теофилом Граммом и трехфазного тока нашим соотечественником Михаилом Доливо-Добровольским алюминиевой промышленности «ловить» было нечего. Так что в 1890-х годах процесс пошел.
Процитируем справочник: «Главное применение алюминия – конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость (на воздухе алюминий мгновенно покрывается прочной плёнкой Al2O3, которая препятствует его дальнейшему окислению), высокая теплопроводность, неядовитость его соединений».
Впрочем, до 1940-х годов, когда массово начали строить цельнометаллические самолеты из дюралюминия (для упрочнения алюминий стали сплавлять с медью и магнием), настолько массовым производство еще не было, а с 1940 годов оно растет в геометрической прогрессии – при этом сырья хватает. На первом месте по производству находится Китай, на втором – Россия.
Мировое производство алюминия
Если же говорить о химии алюминия, то она тоже богата. Химики умудряются наблюдать экзотические соединения алюминия со степенью окисления (I)и (II). Галогениды алюминия типа AlIпрекрасно существуют в газовой фазе, а оксиды AlOфиксируют при взрывах. Кстати, о взрывах – порошок алюминия с оксидами металлов (чаще всего – железа) интенсивно горит, выдавая температуру за две тысячи градусов. Зажигательные снаряды – дело страшное. Они горят без кислорода, их не потушить водой, а максимальная температура – 3500 градусов. Впрочем, термитная сварка – дело вполне себе мирное.
Горение термитной смеси
Ну и напоследок расскажем об очень необычном повороте судьбы. Помните, некогда алюминий стоил дороже золота? Так вот, сейчас ученые научились делать буквально – золотой алюминий. Причем для этого не нужен философский камень или краска. Достаточно направить на поверхность алюминия в жидкости мощный лазер на парах меди. Тогда происходит процесс абляции – частички металла уносятся с поверхности, образуя на ней наногрибочки. Поскольку такие образования имеют размер, сопоставимый с длиной волны – цвет металла меняется на золотистый. Но дело не только в краске. Как показали эксперименты изобретателя «золотого алюминия» Георгия Шафеева в Институте общей физики РАН, такой металл еще и меняет коэффициент смачивания, становится гидрофобным. Какой от этого толк? Если обработать таким образом корпус самолета, то он никогда не будет обледеневать.
Литература:
1.Plinius. Hist. Nat. XXXVI. 66, 195; Плиний Старший. Естествознание. Об искусстве / пер. с лат. Г.А. Тароняна. М., 1994. С. 146
Сравните следующие вещества: а) медь и алюминий;
Сравните следующие вещества: а) медь и алюминий; б) уксусную кислоту и этиловый спирт.
Ответа)
| Свойства вещества | Медь | Алюминий |
|---|---|---|
| Агрегатное состояние | Твердое тело | Твердое тело |
| Цвет | Золотисто-розовый | Серебристо-белый |
| Запах | Без запаха | Без запаха |
| Пластичность | Пластичный | Пластичный |
| Растворимость в воде | Не растворим | Не растворим |
| Температура плавления | 1083°C | 660°C |
| Температура кипения | 2567°C | 2519°C |
| Плотность | 8,92 г/см3 | 2,7 г/см3 |
| Теплопроводность | Отличная теплопроводность | Отличная теплопроводность |
| Электропроводность | Отличный проводник | Отличный проводник |
б)
| Свойства вещества | Уксусная кислота | Этиловый спирт |
|---|---|---|
| Агрегатное состояние | Жидкость | Жидкость |
| Цвет | Бесцветный | Бесцветный |
| Запах | Характерный запах | Характерный запах |
| Вкус | Кислый | Жгучий вкус |
| Растворимость в воде | Растворим | Растворим |
| Температура плавления | 16,75°C | -114,3°C |
| Температура кипения | 118,1°C | 78,4°C |
| Плотность | 1,05 г/см3 | 0,79 г/см3 |
gomolog.ru1https://gomolog.ru/reshebniki/7-klass/gabrielyan-2019/9/1.html
gomolog.ru11https://gomolog.ru/reshebniki/7-klass/gabrielyan-2019/9/1.html
фактов об алюминии | Живая наука
Алюминий: его не просто можно найти в холодильнике, обернутым вокруг остатков недельной давности. Этот элемент является вторым по распространенности металлическим элементом в земной коре после кремния. Он используется в банках из-под газировки и другой упаковке, в самолетах и автомобилях, и даже в этом шикарном iPhone 6.
Огромный объем алюминия — около 8 процентов земной коры по весу, по данным Университета Висконсина — позволяет легко брать его с собой. этот металл как должное.Но алюминий легкий (по данным Геологической службы США в три раза меньше стали или меди), его легко формовать, складывать и утилизировать. Он устойчив к коррозии и выдерживает многократное использование.
Самое забавное в алюминии то, что он вообще не должен быть таким полезным. Металл на самом деле окисляет или легко теряет электроны — тот же тип реакции, который вызывает ржавчину железа. Однако, в отличие от хлопьевидного оксида железа, продукт этой реакции, оксид алюминия, прилипает к исходному металлу, защищая его от дальнейшего разложения, согласно данным Университета Висконсина.
Just the Facts
- Атомный номер (количество протонов в ядре): 13
- Символ атома (в Периодической таблице элементов): Al
- Атомный вес (средняя масса атома): 26,9815386
- Плотность : 2,70 грамма на кубический сантиметр
- Фаза при комнатной температуре: твердое вещество
- Точка плавления: 1220,58 градусов по Фаренгейту (660,32 градуса Цельсия)
- Точка кипения: 4566 градусов F (2519 градусов C)
- Количество изотопов (одинаковых атомов элемент с разным числом нейтронов): 22, один стабильный
- Наиболее распространенные изотопы: Al-27 (стабильный) и Al-26 (радиоактивный; период полураспада 730 000 лет)
Алюминий образуется в звездах в реакции синтеза в который магний улавливает лишний протон, согласно Chemicool, химическому сайту, созданному Дэвидом Д.Сю из Массачусетского технологического института. Однако в природе он не встречается в чистом виде; В земной коре алюминий чаще всего встречается в виде соединения, называемого квасцами (сульфат калия и алюминия).
По данным Национального ускорительного завода Томаса Джефферсона, датскому химику Гансу Кристиану Эрстеду впервые удалось извлечь алюминий из квасцов в 1825 году. Позже ученые усовершенствовали процесс получения алюминия для получения квасцов, но не смогли снизить цену до практического уровня.На протяжении десятилетий алюминий ценился больше, чем золото: Наполеон III, первый президент Второй французской республики с 1848 года, с гордостью обслуживал своих самых почетных гостей, используя алюминиевые тарелки и столовые приборы, потому что это был такой редкий металл, согласно The Aluminium Ассоциация. Согласно статье 1911 года в журнале Good Housekeeping Magazine, Наполеон III также сделал алюминиевую погремушку для своего сына.
Наконец, в 1886 году французский инженер Поль Эру и выпускник химического факультета Оберлина Чарльз Холл независимо друг от друга изобрели процесс, в котором оксид алюминия плавится в криолите (фторид натрия-алюминия) и подвергается воздействию электрического тока, согласно American Chemical Общество.По данным ACS, процесс Холла-Эру все еще используется для производства алюминия сегодня, наряду с процессом Байера, который извлекает алюминий из бокситовой руды.
Единственная стабильная форма алюминия — это Al-27, а период полураспада большинства изотопов составляет всего миллисекунды, то есть они исчезают менее чем за мгновение ока. Но у Al-26, радиоактивного изотопа алюминия с самым долгим сроком существования, период полураспада составляет около 730 000 лет. Согласно исследованию, опубликованному в январе 2006 года в журнале Nature, этот изотоп находится в областях звездообразования в галактике.В этом исследовании исследователи НАСА использовали обнаруживаемые вспышки Al-26, чтобы определить сверхновые звезды или взрывы звезд. Используя эти отпечатки пальцев Al-26, ученые подсчитали, что сверхновая в галактике Млечный Путь происходит в среднем каждые 50 лет и что каждый год рождается семь новых звезд.
Кто знал?
- Алюминий в изобилии: в 2012 году, по данным Агентства по охране окружающей среды США (EPA), только для контейнеров и упаковки было произведено 1,9 миллиона тонн алюминия.Еще 1,7 млн тонн пошло на бытовую технику, запчасти для автомобилей и другие товары длительного пользования.
- По данным Chemicool, один Боинг-747 содержит 147 000 фунтов (более 66 000 кг) алюминия.
- Не пытайтесь делать это дома (если у вас нет вытяжного шкафа). Алюминиевый порошок плюс йод плюс несколько капель воды создают настоящую картину: облака токсичного пурпурного пара йода, а затем внезапное пламя. Реакция — это демонстрация того, насколько химически активным может быть алюминий.
- Переработка! По данным EPA, переработка алюминия требует всего 5 процентов энергии, необходимой для извлечения нового алюминия из руды.По состоянию на 2012 год около 55 процентов алюминиевых банок для напитков отправлялось в мусорную корзину.
- Вершина памятника Вашингтону увенчана алюминиевой пирамидой диаметром 8,9 дюйма (22,6 сантиметра). Алюминиевый колпачок изначально служил вершиной громоотвода монумента, хотя его пришлось дополнить медными стержнями, когда стало ясно, что сам колпачок не может предотвратить повреждение, согласно статье 1995 года в Journal of the Minerals, Metals and Материалы общества.
- Этой банки кока-колы, возможно, не хватило надолго.По данным Алюминиевой ассоциации, возврат алюминиевой банки после переработки занимает всего 60 дней, как и новой.
- Trippy: По данным Алюминиевой ассоциации, около 75 процентов всего когда-либо производимого алюминия все еще используется благодаря переработке.
Текущие исследования
Возможно, самое известное появление алюминия в недавних исследованиях произошло в 2011 году, когда он сыграл роль в присуждении Нобелевской премии по химии. Лауреат премии, материаловед Дэн Шехтман из Израильского технологического института Технион открыл квазикристаллы, молекулярные структуры неповторяющихся структур.Материал, в котором Шехтман открыл эти квазикристаллы, представлял собой смесь марганца и алюминия.
По словам Юньтян Чжу, профессора материаловедения и инженерных наук в Университете штата Северная Каролина, на рынке представлены сотни алюминиевых сплавов или смесей с другими металлами. Сам по себе алюминий легкий, но слабый, поэтому для придания ему большей мускулатуры добавляют другие металлы.
Чжу и его коллеги довели эту концепцию до крайности, создав алюминий, прочный, как сталь, сообщили они в статье, опубликованной в журнале Nature Communications в 2010 году.Подвергнув алюминий, смешанный с небольшим количеством магния и цинка, экстремальному давлению, исследователи обнаружили, что они могут измельчать зерна алюминия до наноразмеров. Эти более мелкие зерна позволяют сплаву двигаться, поэтому он не становится хрупким и не трескается, как керамика, под давлением. Но движение достаточно сдержанное, чтобы материал оставался очень прочным.
«Наноструктура очень затрудняет перемещение дислокации, но в то же время, когда вы прикладываете достаточно высокую силу, она позволяет ей двигаться», — сказал Чжу Live Science.
В настоящее время исследователи могут производить только небольшие количества этого сверхпрочного алюминиевого сплава за раз, а это означает, что коммерческое применение пока невозможно.
Тем временем в Орегоне исследователи используют передовые технологии для изучения алюминия на водной основе или соединений алюминия, образующихся в воде, особенно оксидов алюминия. Оксиды алюминия — это соединения, в состав которых входят как алюминий, так и кислород.
«Оксид алюминия, особенно в виде пленки, используется во многих различных отраслях промышленности», — сказал Дуглас Кеслер, директор Центра устойчивой химии материалов при Университете штата Орегон.Эти пленки создают хорошие устойчивые к царапинам и коррозии барьеры; Оксиды алюминия также используются при очистке воды для осаждения крошечных частиц, сказал Кеслер Live Science.
Кеслер и его команда работают над анализом чернильных растворов, которые можно нагревать и сушить до пленок оксида алюминия.
«У нас нет химических методов, которые позволяют нам одновременно с такими растворами определять как состав, так и структуру, молекулярную структуру того, что находится в растворе», — сказал Кеслер.«Итак, мы взяли несколько совершенно новых лазерных технологий и объединили их с мощными вычислениями, чтобы иметь возможность одновременно определять состав и структуру».
Как только они поймут решения, сказал Кеслер, исследователи смогут лучше контролировать процесс производства пленок и научиться делать их энергоэффективными способами. Прямо сейчас команда больше всего заинтересована в использовании пленок для туннелирования электронов. По словам Кеслера, помещая пленку очень чистого оксида алюминия между двумя электродами, ученые очень близки к тому, чтобы заставить электроны прыгать с одного электрода на другой, не взаимодействуя с пленкой: «По сути, мгновенный переход от одного электрода к другому, «- сказал Кеслер.
Это устройство туннелирования электронов можно использовать как дешевый и простой переключатель, сказал Кеслер.
Дополнительные ресурсы
Следите за Live Science @livescience , Facebook и Google+ .
Температуры плавления и кипения за период 3
Результаты обучения
Изучив эту страницу, вы сможете:
- описывает и объясняет тенденции в температурах плавления и кипения за период 3
Температура плавления и кипения
В таблице указаны температуры плавления и кипения элементов от Na до Ar.
| Элемент | Символ | Атомный номер | Точка плавления / K | Точка кипения / K |
|---|---|---|---|---|
| натрий | Na | 11 | 371 | 1156 |
| магний | мг | 12 | 922 | 1380 |
| алюминий | Al | 13 | 933 | 2740 |
| кремний | Si | 14 | 1683 | 2628 |
| фосфор | -П | 15 | 317 | 553 |
| сера | S | 16 | 392 | 718 |
| хлор | Класс | 17 | 172 | 238 |
| аргон | Ar | 18 | 84 | 87 |
Температура дана в кельвинах, К.
Вы можете легко преобразовать K в ° C и обратно:
° C = K + 273 (например, 100 ° C = 373 K)
K = ° C — 273 (например, 273 K = 0 ° C)Строго говоря, это должно быть 273,15, а не 273, но менее точное значение приемлемо на уровне A.
Описание тренда
График показывает, как точки плавления и кипения меняются в течение периода 3.
На этом графике много чего происходит, поэтому часто бывает проще разделить его на три части.В таблице ниже дается краткое описание этих разделов.
| Элементы | Тип элемента | Тип конструкции | Описание |
|---|---|---|---|
| Na, Mg, Al | металл | металлик | т. Пл. И увеличение п.п. от Na к Al |
| Si | металлоид | гигантский ковалентный | м.д. больше, чем Al п.н. между Mg и Al |
| P, S, Cl, Ar | неметалл | простой молекулярный (Ar одноатомный) | мп и убавление п.п. в порядке: S> P> Cl> Ar |
Нажав на символ загрузки, вы сможете загрузить график в виде файла изображения или файла PDF, сохранить его данные, аннотировать их и распечатать.Обратите внимание, что графики будут помечены водяными знаками.Когда вещество плавится, некоторые силы притяжения между частицами разрушаются или ослабляются.Частицы могут перемещаться друг вокруг друга, но при этом остаются близко друг к другу.
Когда вещество закипает, большая часть оставшихся сил притяжения разрушается. Частицы могут свободно перемещаться и находятся далеко друг от друга.
Чем сильнее силы притяжения, тем больше энергии требуется для их преодоления и тем выше температура плавления или кипения.
× Нажмите кнопку под графиком, чтобы включить или выключить каждый набор полос.
×
Объяснение этой тенденции
Натрий, магний и алюминий
Натрий, магний и алюминий — все металлы. Они имеют металлическую связь, в которой ядра атомов металлов притягиваются к делокализованным электронам.
Переход от натрия к алюминию:
- заряд на ядрах увеличивается…
- количество делокализованных электронов увеличивается…
- , поэтому прочность металлического соединения увеличивается и…
- точки плавления и кипения увеличиваются.
Металлическую связь часто неправильно описывают как притяжение между положительными ионами металлов и делокализованными электронами. Однако металлы по-прежнему состоят из атомов, но внешние электроны не связаны с каким-либо конкретным атомом.
Подобным образом графит (неметалл) также имеет делокализованные электроны. Однако вы не понимаете, что он состоит из ионов углерода.
Кремний
Кремний — это металлоид с гигантской ковалентной структурой.Кремний имеет очень высокую температуру плавления и кипения, потому что: все атомы кремния удерживаются вместе прочными ковалентными связями … для разрыва которых требуется очень большое количество энергии.
- атомы кремния притягиваются друг к другу прочными ковалентными связями…
- , которые требуют очень большого количества энергии, чтобы их можно было сломать.
Гигантская кристаллическая структура кремния подобна структуре решетки алмаза. Каждый атом кремния ковалентно связан с четырьмя другими атомами кремния в тетраэдрическом расположении.
Фосфор, сера, хлор и аргон
Эти элементы не являются металлами. Фосфор, сера и хлор существуют в виде простых молекул, между которыми действуют силы Ван-дер-Ваальса. Аргон одноатомен — он существует в виде отдельных атомов. Между его атомами действуют силы Ван-дер-Ваальса. Температуры плавления и кипения этих элементов очень низкие, потому что:
- Силы Ван-дер-Ваальса — очень слабые силы притяжения…
- требуется немного энергии для их преодоления.
Фосфор существует в виде молекул P 4 , сера существует в виде молекул S 8 , хлор существует в виде молекул Cl 2 , а аргон существует в виде отдельных атомов. Сила сил Ван-дер-Ваальса уменьшается по мере уменьшения размера молекулы, поэтому точки плавления и кипения уменьшаются в следующем порядке:
S 8 > P 4 > Cl 2 > Ar
Атомы в молекулах фосфора, серы или хлора притягиваются друг к другу ковалентными связями.Эти связи намного сильнее, чем силы Ван-дер-Ваальса между молекулами: ковалентные связи не разрываются при изменении состояния этих элементов.
Физические характеристики оксида алюминия
Оксид алюминия — это соединение, состоящее из алюминия и кислорода. Несмотря на металлическое название, он считается керамическим. Его промышленное использование включает определенные типы освещения, такие как натриевые лампы, а развивающаяся нанотехнологическая промышленность использует оксид алюминия в качестве проводника электричества в микроскопических схемах.Оксид алюминия может быть сформирован в волокна тоньше человеческого волоса, что также делает их полезными для фильтрации ДНК.
Общие свойства
Оксид алюминия представляет собой белое порошкообразное вещество без запаха. Он не токсичен, но пыль оксида алюминия, переносимая по воздуху, может представлять опасность на производстве, поэтому при длительном воздействии рекомендуется носить маски. Оксид алюминия очень тяжелый; куб из оксида алюминия со стороной 1 метр весит около 7200 фунтов.
Промышленные свойства
Из компаунда оксида алюминия можно производить механическую обработку или формование в твердые, износостойкие материалы, подходящие для использования в различных промышленных целях.К ним относятся направляющие для проводов, уплотнения для машин, измерительные приборы и высокотемпературные электрические изоляторы.
Химические свойства
Оксид алюминия не растворяется в воде и имеет очень высокую температуру плавления — 2000 ° C или около 3600 F. Его температура кипения чрезвычайно высока — 5400 F. Химическая формула объединяет два атома алюминия с тремя атомами кислорода, который выражается как Al2O3. Это электрический резистор, в отличие от своего родственника из алюминия. Уровень сопротивления меняется в зависимости от чистоты материала.Оксид алюминия не реагирует легко с большинством материалов, но он очень реактивен по отношению к трифториду хлора и оксиду этилена. Смешивание оксида алюминия с любым из этих химикатов вызывает пожар.
Механические свойства
Оксид алюминия — очень твердый материал, почти до уровня алмазов, поэтому он обладает отличными износостойкими свойствами. Он обладает высокой коррозионной стойкостью и высокой температурной стабильностью, низким тепловым расширением и благоприятным соотношением жесткости к массе. Поскольку оксид алюминия имеет отличный электрический резистор, он часто используется в конденсаторах в качестве диэлектрика, поскольку часть, удерживающая заряды в устройстве, разделена.
Атомная масса алюминия
Рассчитайте количество ионов алюминия, присутствующих в 0,051 г оксида алюминия. Название: Алюминий Символ: Al Атомный номер: 13 Атомная масса: 26,9 Число протонов / электронов: 13 Число нейтронов: 14 Классификация: Другие металлы Открытие: 1825 г. Открыватель: Ганс Кристиан Эрстед Использование: самолеты, банки с газировкой. Алюминий является элементом 13-й группы и третьего периода таблицы Менделеева. Элемент Обозначение Атомный вес Атомы Массовый процент; Алюминий: Al: 26.9815386: 1: 100.0000: Состав в массовых процентах: Состав в атомных процентах: Примеры реакций для Al. Элемент имеет атомную массу 93 г / моль и плотность 11,5 г / см3. Атомная масса (Да) Изотопное содержание (количественная доля) 27 Al: 26,981 5384 (3) 1: Алюминий является моноизотопным элементом, и его атомный вес определяется исключительно его изотопом 27 Al. Пояснение к видео. Алюминий имеет 22 изотопа. Атомный номер алюминия равен 13. В химии вес по формуле — это величина, вычисляемая путем умножения атомного… Итак, Учитывая, что длина ребра кубической системы = 4 A o =.5. Какова масса 4 моль атомов алюминия (атомная масса алюминия = 27)? Ганс Кристиан Эрстед, датский химик, первым произвел крошечные количества… 3071 просмотров. Около 8,2% земной коры состоит из алюминия. Алюминий имеет обозначение Al. В последний раз Комиссия пересматривала стандартный атомный вес алюминия в 2017 году на основе последней оценки атомной массы, проведенной IUPAP. Его плотность 2. Ответил Ханиша Вьяс | 30 октября 2013 г., 18:39. 6. Стандартный атомный вес 26,981 5385 (7).B. Атомный номер = 13, атомная масса = 26,98, 13 протонов, 13 электронов, 14 нейтронов. Примечание: атомный номер, Z представляет количество протонов в данном атоме. Okorder.com — профессиональный поставщик и производитель алюминиевой атомной массы, предлагающий комплексные комплексные услуги, включая расценки в режиме реального времени и онлайн-отслеживание грузов. Переработка алюминиевого лома позволяет сэкономить более 90% энергии, необходимой для отделения алюминия от бокситов. Атомный радиус: 1,82 Å; Атомный объем: 10 см 3 / моль; Ковалентный радиус: 1.18Å; Поперечное сечение (захват тепловых нейтронов) σ a / barns: 0,232; Кристаллическая структура: кубическая грань центрированная; Электронная конфигурация: 1s 2 2s 2 p 6 3s 2 p 1; Электронов на энергетический уровень: 2,8,3 Модель оболочки; Ионный радиус: 0,535Å; Заливка Орбиталь: 3п 1; Количество электронов (без заряда): 13; Количество… Химический символ алюминия — Al. Это список химических элементов, отсортированный по атомной массе (или наиболее стабильному изотопу) и имеющий цветовую кодировку в соответствии с типом элемента. Приведены атомный номер каждого элемента, имя, символ элемента, а также номера группы и периода в периодической таблице.Алюминий — это металл группы 13 с атомным номером 13 в периодической таблице. Атомные данные алюминия (Al) для алюминия (Al) Атомный номер = 13 Атомный вес = 26,98154 Ссылка E95: Изотоп: Масса: Изобилие: Вращение: Маг Момент: 27 Al: 26,981540: 100%: 5/2 +3,6415: Измельченный Al I Состояние 1s 2 2s 2 2p 6 3s 2 3p 2 P 1/2 Энергия ионизации 48278,48 см-1 (5,985768 эВ) Арт. Атомная масса (m a или m) — это масса атома. Какова его масса, если у алюминия атомный номер 13 и 14 протонов? Если длина его элементарной ячейки по краю составляет 300 мкм, укажите тип элементарной ячейки.7 г c м — 3. Алюминий (атомная масса = 27) кристаллизуется в кубической системе с длиной ребра 4A. Крот — выбор химиков-единичных. Алюминий. В этом видео объясняется формульная единица… Учитывая, что M = 93 г · моль-1 d = 11,5 г · см-3 a =… Вот набор… Алюминий (атомная масса = 27 … химия. Атомная структура алюминия. 4 × 1 0-8 см плотность = 2. Далее. Алюминий (атомная масса 26,98 г / моль) кристаллизуется в гранецентрированной кубической ячейке. Каждый атом алюминия содержит 18 протонов. Это определяется путем взятия атомного веса элемента в периодической таблице. , и записав его как г / моль.Атомный номер Z алюминия Al равен 13. Атомная масса элемента — это средняя масса атомов элемента, измеренная в единицах атомной массы (а.е.м., также известная как дальтон, D). Железо является переходным металлом в группе 8 и имеет атомный номер 26 в периодической таблице. С 1961 года стандартной единицей атомной массы была одна двенадцатая массы атома изотопа углерода 12. Изотоп — это один из двух или более видов атомов одного и того же химического элемента, которые имеют разные атомные массовые числа (протоны + нейтроны).Атомный вес… C. 4. Уравнение: Тип реакции: Al + O 2… Джон… Горячие продукты. Сколько граммов оксида магния образуется, когда 4,8 грамма магния соединяются с 3,2 граммами кислорода? Впервые выделен Гансом Кристианом Эрстедом из Дании в 1825 году. Число в скобках указывает на погрешность в «краткой записи», определенную в справочнике ИЮПАК, «где стандартная погрешность дана в… Протоны и нейтроны ядра составляют почти всю общую массу атомов, включая электроны и ядерную связь. … Вдобавок алюминий имеет атомный радиус 143.14:00. 0. Поделиться Ответом. Это видео объясняет атомную массу, относительную атомную массу и изотопы. Основным недостатком его использования является большое количество энергии, необходимое для его переработки из обычной руды, боксита. Алюминий — это изобильный, легкий и прочный металл, нашедший множество применений. Этот вопрос немного запутан. Атомная масса или относительная изотопная масса относится к массе отдельной частицы и, следовательно, связана с определенным конкретным изотопом элемента. Соединение: Моли: Вес, г: Al: Элементный состав Al.D. 2. Чтобы измерить количество атомов в образце, вы должны выяснить, сколько молей содержит элемент образца. 27 — масса алюминия. Медная фольга для ламинирования кабелей, фольга и… Поделиться. От латинского слова «alumen», что означает «квасцы». gt_ gt_ Ответ дан 2 мая 2017 г. Атомная масса Al = 27 u) Ответ: 1 моль оксида алюминия (Al 2 O 3) = 2 × 27 + 3 × 16 = 102 г Мы знаем, 102 г оксида алюминия (Al 2 O 3) = 6,022 × 10 23 молекулы оксида алюминия (Al 2 O 3) Мы знаем, количество атомов… За исключением 26 Al, все радиоизотопы имеют период полураспада менее 7 минут, в большинстве случаев менее секунды.Учитывая это, можете ли вы указать количество электронов в атоме алюминия и количество нейтронов, содержащихся в ядре. Источники, факты, использование, дефицит (SRI), подкасты, алхимические символы, видео и изображения. 26 Al радиоактивен с периодом полураспада 0,705 (24) млн лет, что слишком мало для выживания… Джона Адни. Древние греки и римляне использовали квасцы в медицине как вяжущее средство и в процессах окрашивания. Название: Висмут Символ: Bi Атомный номер: 83 Атомная масса: 208,9 Количество протонов / электронов: 83 Количество нейтронов: 126 Классификация: Открытие других металлов:… Более 99.9% природного алюминия составляет 13 Al 27. Требуемая масса O 2 = 3/4 × 32 = 24 г. Запрос. Количество нейтронов зависит от изотопной формы алюминия. 1: 3/4. Атомный номер (# Z #) алюминия # 13 #. Таким образом, его ядро содержит 13 протонов. Атомная масса O 2 = 2 × 16 = 32 г. Этот вопрос входит в состав раздела Атомы -> Протоны, нейтроны, электроны. 7 г c м — 3 и массой = 27 г / моль Итак, количество… 12H 2 O) и оксид алюминия (Al 2 O 3). Число протонов в алюминии — 13. Производится 26 Al… Молярная масса элемента — это масса в граммах 1 моля элемента.Мольное соотношение алюминия и кислорода может быть выражено как: Al: O 2. Атомный вес, также называемый относительной атомной массой, отношение средней массы атомов химического элемента к некоторому стандарту. Атомная масса переносится атомным ядром, которое занимает только около 10 -12 от общего объема атома или меньше, но оно содержит весь положительный заряд и не менее 99,95% от общей массы атома. Оно равно числу Авогадро (6,02 X 1023) атомов. Al: Атомный номер: 13: Атомная масса: 26,982 атомных единиц массы: Количество протонов: 13: Количество нейтронов: 14: Количество электронов: 13: Точка плавления: 660.37 ° C: Точка кипения: 2467 ° C: Плотность: 1,738 грамма на кубический сантиметр: Нормальная Фаза: Твердое вещество: Семейство: Другие металлы: Период: 3: Стоимость: 1,32 доллара за фунт (2007) Происхождение названия: От латинского слова alumen : Дата открытия: 1825 год в Копенгагене,… »Точка кипения» Точка плавления »Изобилие» Состояние на STP »Год открытия в алюминии. На вопрос Luckygoogles, последнее обновление: 24 ноября 2020 г. + ответ. ЖЕСТКИЙ. Атомный вес алюминия 26,9815385 ед. Или г / моль. Это ион. Ученые подозревали, что металл существует в квасцах еще в 1787 году, но у них не было способа извлечь его до 1825 года.Алюминий или алюминий (13 Al) имеет 22 известных изотопа от 22 Al до 43 Al и 4 известных изомера. Только 27 Al (стабильный изотоп) и 26 Al (радиоактивный изотоп, t 1/2 = 7,2 × 10 5 y) встречаются в природе. однако 27 Al почти полностью состоит из природного алюминия. Мы финансируемся CNBM Group, предприятием из списка Fortune 500 и крупнейшей компанией по производству алюминиевых атомных масс в Китае. Какова плотность (в г / см3) алюминия? Отвечать. E. 3. Массовый процент: Алюминий: Al: 26,981538: 1: 25,688%: Углерод: C: 12,0107: 3: 34,305%: Азот: N: 14.0067: 3: 40.006% ›› Расчет молекулярной массы химического соединения. Количество атомов алюминия в элементарной ячейке составляет: A. Молярная масса алюминия составляет 26,982 г / моль. Алюминий лишь на треть плотнее железа, но некоторые из его сплавов, например… Ответить анонимно; Ответить позже; Копировать ссылку; 3 ответа. Выключатель; Флаг; Закладка; 39. Атомная масса — это абсолютная масса, относительная изотопная масса — это число без пропорций и без единиц. Атомная масса любого элемента (кроме водорода с атомным числом 1u) в основном (примерно) вдвое больше его атомного номера (для элементов с более низкими атомными номерами, как я видел).Следовательно, есть 13 протонов. Температура плавления алюминия составляет 660,5 ° C, а температура кипения — 2467 ° C. Стандартный раствор алюминия, подходящий для атомно-абсорбционной спектрометрии, 1 мг / мл Al, 1000 ppm Al Алюминий, пена, 150×150 мм, толщина 10 мм, насыпная плотность 0,2 г / см3, пористость 0,93, алюминий марки 6101, 98,5% массы Al = 27 AMU Масса O = 16 AMU. Итак, масса «молекулы» Al2O3 = 2×27 + 3×16 = 102 AMU. Итак, 1 моль ОКСИДА АЛЮМИНИЯ будет весить 102 г. 1 моль любого чистого вещества содержит число молекул Авоградо, то есть 6.23. Молярная масса Al составляет 26,98153860 ± 0,00000080 г / моль. Название соединения — алюминий. Преобразование между массой алюминия и молями. Элемент Алюминий (Al), группа 13, атомный номер 13, p-блок, масса 26,982. Поставщик и производитель атомной массы алюминия из Китая. KM91b Al II Основное состояние 1s 2 2s 2 2p 6 3s 2 1 S 0 Энергия ионизации 151862,5 см-1… Атомная масса Al = 27г. Похожие видео. Атомная масса и изотопы. Его атомный номер 13, а символ — Al. Масса Al = 8,1 Атомная масса Al = 27 г · моль-1 Число атомов = Число молей x 6.022 x10 23 Так как одна ГЦК-единица содержит 4 атома Следовательно, количество элементарных ячеек имеет 1,8066 x10 23 атома. Атомы алюминия с числом электронов менее 18 являются катионами, а атомы алюминия с числом электронов более 18 — анионами. Изотоп алюминия определяется числом его нейтронов. Этот химический элемент получил свое название от латинского выражения… (Атомная масса также называется атомной массой, но термин «масса» больше… Введите химическую формулу: просмотрите список распространенных химических соединений. Al имеет заряд +3, и это означает, что Al потерял 3 своих валентных электрона.Его символ элемента — Al, а его атомная масса — 26,98. 4: 3. Грамм-атомная масса алюминия составляет примерно 27 (посмотрите на периодическую таблицу, если вам нужны более значимые числа; я не припоминаю их с головы до ног). Атомная масса — это средневзвешенное значение всех изотопов этого элемента, в котором масса каждого изотопа умножается на содержание этого конкретного изотопа. Где 27 — массовое число, А; 13 — атомный номер Z. (Подсказка: масса иона такая же, как у атома того же элемента.Алюминий (алюминий) — это элемент, который имеет атомный номер 13 в периодической таблице. ›› Дополнительная информация о молярной массе и молекулярной массе. Хотя единицей массы СИ является килограмм (символ: кг), атомная масса часто выражается в дальтонах, не относящихся к системе СИ (символ: Да или и), где 1 дальтон определяется как 1 ⁄ 12 массы отдельного человека. атом углерода-12 в состоянии покоя. Концепция родинки — Часть 1. Катион, если быть более точным. Подход к решению Вопроса: — 1-м находим массу 1 моля (это…Metallic Bonding — Chemistry LibreTexts
В начале 1900-х Пауль Дрюде предложил теорию металлических связей «моря электронов», моделируя металлы как смесь атомных ядер (атомные ядра = положительные ядра + внутренняя оболочка электронов) и валентности. электроны.Металлические связи возникают между атомами металлов. В то время как ионные связи соединяют металлы с неметаллами, металлическая связь соединяет большую часть атомов металла . Лист алюминиевой фольги и медная проволока — это места, где можно увидеть в действии металлическое соединение.
Металлы, как правило, имеют высокие температуры плавления и кипения, что свидетельствует о прочных связях между атомами. Даже мягкий металл, такой как натрий (точка плавления 97,8 ° C), плавится при значительно более высокой температуре, чем элемент (неон), предшествующий ему в Периодической таблице.Натрий имеет электронную структуру 1s 2 2s 2 2p 6 3s 1 . Когда атомы натрия собираются вместе, электрон на 3s-атомной орбитали одного атома натрия делит пространство с соответствующим электроном на соседнем атоме, образуя молекулярную орбиталь — примерно так же, как образуется ковалентная связь.
Разница, однако, заключается в том, что к каждому атому натрия прикасаются восемь других атомов натрия — и совместное использование происходит между центральным атомом и 3s-орбиталями на всех восьми других атомах.К каждому из этих восьми, в свою очередь, прикасаются восемь атомов натрия, которые, в свою очередь, касаются восьми атомов — и так далее, и так далее, пока вы не поглотите все атомы в этом куске натрия. Все из 3s-орбиталей на всех атомах перекрываются, давая огромное количество молекулярных орбиталей, которые простираются по всему куску металла. Конечно, должно быть огромное количество молекулярных орбиталей, потому что любая орбиталь может содержать только два электрона.
Электроны могут свободно перемещаться внутри этих молекулярных орбиталей, поэтому каждый электрон отделяется от своего родительского атома.Считается, что электроны делокализованы. Металл удерживается вместе сильными силами притяжения между положительными ядрами и делокализованными электронами (рис. \ (\ PageIndex {1} \)).
Рисунок \ (\ PageIndex {1} \): Металлическая связь: Модель электронного моря: Положительные атомные ядра (оранжевые кружки) окружены морем делокализованных электронов (желтые кружки).Иногда его описывают как «массив положительных ионов в море электронов». Если вы собираетесь использовать это представление, будьте осторожны! Металл состоит из атомов или ионов? Он состоит из атомов.+} \).
Пример \ (\ PageIndex {1} \): Металлическое соединение из магния
Используйте модель моря электронов, чтобы объяснить, почему магний имеет более высокую температуру плавления (650 ° C), чем натрий (97,79 ° C).
Решение
Если вы проработаете тот же аргумент выше для натрия с магнием, вы получите более сильные связи и, следовательно, более высокую температуру плавления.
Магний имеет внешнюю электронную структуру 3s 2 . Оба этих электрона становятся делокализованными, поэтому «море» имеет вдвое большую электронную плотность, чем в натрии.Остальные «ионы» также имеют в два раза больший заряд (если вы собираетесь использовать этот конкретный взгляд на металлическую связь), поэтому между «ионами» и «морем» будет больше притяжения.
Более реалистично, каждый атом магния имеет 12 протонов в ядре по сравнению с 11 натрием. В обоих случаях ядро экранировано от делокализованных электронов одинаковым количеством внутренних электронов — 10 электронов в 1s 2 2s 2 2p 6 орбиталей. Это означает, что чистое притяжение от ядра магния будет 2+, но только 1+ от ядра натрия.
Таким образом, в магнии будет не только большее количество делокализованных электронов, но также будет большее притяжение к ним со стороны ядер магния. Атомы магния также имеют немного меньший радиус, чем атомы натрия, поэтому делокализованные электроны находятся ближе к ядрам. У каждого атома магния также двенадцать ближайших соседей, а не восемь у натрия. Оба эти фактора еще больше увеличивают прочность связи.
Примечание: Переходные металлы обычно имеют особенно высокие температуры плавления и кипения.Причина в том, что они могут вовлекать в делокализацию как 3d-электроны, так и 4s. Чем больше электронов вы можете задействовать, тем сильнее будет притяжение.
Объемные свойства металлов
Металлы обладают несколькими уникальными качествами, такими как способность проводить электричество и тепло, низкую энергию ионизации и низкую электроотрицательность (поэтому они легко отдают электроны с образованием катионов). Их физические свойства включают блестящий (блестящий) вид, а также они пластичны и пластичны.Металлы имеют кристаллическую структуру, но легко деформируются. В этой модели валентные электроны свободны, делокализованы, подвижны и не связаны с каким-либо конкретным атомом. В данной модели может быть:
- Проводимость : Поскольку электроны свободны, если бы электроны из внешнего источника были вставлены в металлический провод на одном конце (рис. \ (\ PageIndex {2} \)), электроны прошли бы через провод и вышли наружу. на другом конце с той же скоростью (проводимость — это движение заряда).
- Ковкость и Пластичность : Модель металлов с электронным морем не только объясняет их электрические свойства, но также их пластичность и пластичность. Море электронов, окружающее протоны, действует как подушка, и поэтому, когда, например, по металлу ударяют молотком, общий состав структуры металла не повреждается и не изменяется.Протоны могут быть перегруппированы, но море электронов приспосабливается к новому образованию протонов и сохраняет металл нетронутым. Когда один слой ионов в электронном море движется в одном пространстве относительно слоя под ним, кристаллическая структура не разрушается, а только деформируется (Рисунок \ (\ PageIndex {3} \)).
- Теплоемкость : Это объясняется способностью свободных электронов перемещаться по твердому телу.
- Блеск : Свободные электроны могут поглощать фотоны в «море», поэтому металлы выглядят непрозрачными. Электроны на поверхности могут отражать свет с той же частотой, с которой свет падает на поверхность, поэтому металл кажется блестящим.
Однако эти наблюдения являются только качественными, а не количественными, поэтому они не могут быть проверены. Теория «моря электронов» сегодня выступает лишь как упрощенная модель того, как работает металлическая связь.
В расплавленном металле металлическая связь все еще присутствует, хотя упорядоченная структура нарушена. Металлическая связь не разрушается полностью, пока металл не закипит. Это означает, что температура кипения на самом деле является лучшим показателем прочности металлической связи, чем температура плавления.При плавлении связь ослабляется, а не разрывается. Прочность металлической связи зависит от трех факторов:
- Число электронов, делокализованных из металла
- Заряд катиона (металл).
- Размер катиона.
Сильная металлическая связь будет результатом более делокализованных электронов, что приведет к увеличению эффективного ядерного заряда на электронах на катионе, в результате чего размер катиона будет меньше.Металлические связи прочные и требуют большого количества энергии для разрыва, поэтому металлы имеют высокие температуры плавления и кипения. Теория металлической связи должна объяснить, как такое большое количество связей может происходить с таким небольшим количеством электронов (поскольку металлы расположены в левой части периодической таблицы и не имеют большого количества электронов в их валентных оболочках). Теория также должна учитывать все уникальные химические и физические свойства металла.
Расширение диапазона возможного соединения
Ранее мы утверждали, что связь между атомами можно классифицировать как диапазон возможных связей между ионными связями (полная передача заряда) и ковалентными связями (полностью разделенными электронами).Когда два атома со слегка различающейся электроотрицательностью объединяются и образуют ковалентную связь, один атом притягивает электроны больше, чем другой; это называется полярной ковалентной связью. Однако простая «ионная» и «ковалентная» связь — идеализированные концепции, и большинство связей существует в двумерном континууме, описываемом треугольником Ван Аркеля-Кетелаара (рис. \ (\ PageIndex {4} \)).
Рисунок \ (\ PageIndex {4} \): треугольник Ван Аркеля-Кетелаара отображает разницу в электроотрицательности (\ (\ Delta \ chi \)) и средней электроотрицательности в связи (\ (\ sum \ chi \)).верхняя область — это область, где связи в основном ионные, нижняя левая область — это металлическая связь, а нижняя правая область — это ковалентная связь.Треугольники связи или треугольников Ван Аркеля – Кетелаара треугольников (названных в честь Антона Эдуарда ван Аркеля и Дж. А. А. Кетелаара) — это треугольники, используемые для отображения различных соединений с различной степенью ионной, металлической и ковалентной связи. В 1941 году ван Аркель выделил три экстремальных материала и связанные с ними типы склеивания. Используя 36 элементов основной группы, таких как металлы, металлоиды и неметаллы, он разместил ионные, металлические и ковалентные связи в углах равностороннего треугольника, а также предложил промежуточные соединения.Треугольник связей показывает, что химические связи — это не просто особые связи определенного типа. Скорее, типы связей взаимосвязаны, и разные соединения имеют разную степень разного характера связывания (например, полярные ковалентные связи).
Видео \ (\ PageIndex {1} \): Что такое Треугольник Связи Ван Аркеля-Кетелаара?Использование электроотрицательности — два составных средних значения электроотрицательности по оси x рисунка \ (\ PageIndex {4} \).
\ [\ sum \ chi = \ dfrac {\ chi_A + \ chi_B} {2} \ label {sum} \]
и разность электроотрицательностей по оси ординат,
\ [\ Delta \ chi = | \ chi_A — \ chi_B | \ label {diff} \]
можно оценить доминирующую связь между соединениями.В правой части рисунка \ (\ PageIndex {4} \) (от ионной до ковалентной) должны быть соединения с различной разницей в электроотрицательности. Соединения с одинаковой электроотрицательностью, такие как \ (\ ce {Cl2} \) (хлор), помещаются в ковалентный угол, а в ионном углу есть соединения с большой разницей электроотрицательностей, такие как \ (\ ce {NaCl} \) ( столовая соль). Нижняя сторона (от металлической до ковалентной) содержит соединения с разной степенью направленности связи. С одной стороны, это металлические связи с делокализованными связями, а с другой — ковалентные связи, в которых орбитали перекрываются в определенном направлении.Левая часть (от ионной до металлической) предназначена для делокализованных связей с различной разностью электроотрицательностей.
Три крайности в отношениях
Всего:
- Металлические облигации имеют низкое значение \ (\ Delta \ chi \) и низкое среднее значение \ (\ sum \ chi \).
- Ионные связи имеют от умеренного до высокого \ (\ Delta \ chi \) и умеренные значения среднего \ (\ sum \ chi \).
- Ковалентные связи имеют среднее значение \ (\ sum \ chi \) от среднего до высокого и могут существовать с умеренно низким значением \ (\ Delta \ chi \).
Пример \ (\ PageIndex {2} \)
Используйте таблицы электроотрицательностей (Таблица A2) и рисунок \ (\ PageIndex {4} \) для оценки следующих значений
- разница в электроотрицательности (\ (\ Delta \ chi \))
- средняя электроотрицательность в связи (\ (\ sum \ chi \))
- процентный ионный характер
- вероятный тип облигации
для выбранных соединений:
- \ (\ ce {AsH} \) (например, в арсине \ (AsH \))
- \ (\ ce {SrLi} \)
- \ (\ ce {KF} \).
Решение
а: \ (\ ce {AsH} \)
- Электроотрицательность \ (\ ce {As} \) составляет 2,18
- Электроотрицательность \ (\ ce {H} \) составляет 2,22
Использование формул \ ref {sum} и \ ref {diff}:
\ [\ begin {align *} \ sum \ chi & = \ dfrac {\ chi_A + \ chi_B} {2} \\ [4pt] & = \ dfrac {2.18 + 2.22} {2} \\ [4pt] & = 2.2 \ end {align *} \]
\ [\ begin {align *} \ Delta \ chi & = \ chi_A — \ chi_B \\ [4pt] & = 2.18 — 2.22 \\ [4pt] & = 0,04 \ end {align *} \]
- Из рисунка \ (\ PageIndex {4} \) видно, что связь довольно неполярная и имеет низкоионный характер (10% или меньше).
- Связь находится в середине ковалентной связи и металлической связи
b: \ (\ ce {SrLi} \)
- Электроотрицательность \ (\ ce {Sr} \) составляет 0,95
- Электроотрицательность \ (\ ce {Li} \) составляет 0,98
Использование формул \ ref {sum} и \ ref {diff}:
\ [\ begin {align *} \ sum \ chi & = \ dfrac {\ chi_A + \ chi_B} {2} \\ [4pt] & = \ dfrac {0.95 + 0,98} {2} \\ [4pt] & = 0,965 \ end {align *} \]
\ [\ begin {align *} \ Delta \ chi & = \ chi_A — \ chi_B \\ [4pt] & = 0.98 — 0.95 \\ [4pt] & = 0.025 \ end {align *} \]
- Из рисунка \ (\ PageIndex {4} \) видно, что связь довольно неполярная и имеет низкий ионный характер (~ 3% или меньше).
- Склеивание вероятно металлическое.
c: \ (\ ce {KF} \)
- Электроотрицательность \ (\ ce {K} \) составляет 0,82
- Электроотрицательность \ (\ ce {F} \) равна 3.98
Использование формул \ ref {sum} и \ ref {diff}:
\ [\ begin {align *} \ sum \ chi & = \ dfrac {\ chi_A + \ chi_B} {2} \\ [4pt] & = \ dfrac {0.82 + 3.98} {2} \\ [4pt] & = 2.4 \ end {align *} \]
\ [\ begin {align *} \ Delta \ chi & = \ chi_A — \ chi_B \\ [4pt] & = | 0,82 — 3,98 | \\ [4pt] & = 3.16 \ end {align *} \]
- Из рисунка \ (\ PageIndex {4} \) видно, что связь довольно полярная и имеет высокий ионный характер (~ 75%).
- Связь, вероятно, ионная.
Упражнение \ (\ PageIndex {2} \)
Сравните связывание \ (\ ce {NaCl} \) и тетрафторида кремния.
- Ответ
\ (\ ce {NaCl} \) представляет собой ионную кристаллическую структуру и электролит при растворении в воде; \ (\ Delta \ chi = 1.58 \), среднее \ (\ sum \ chi = 1.79 \), а тетрафторид кремния ковалентный (молекулярный, неполярный газ; \ (\ Delta \ chi = 2.08 \), средний \ ( \ sum \ chi = 2,94 \).
Авторы и авторство
Физические свойства элементов периода 3
Эта страница описывает и объясняет тенденции изменения атомных и физических свойств элементов периода 3 от натрия до аргона.Он охватывает энергию ионизации, атомный радиус, электроотрицательность, электропроводность, температуру плавления и кипения.
Электронные структуры
В периоде 3 Периодической таблицы 3s и 3p-орбитали заполняются электронами. Ниже приведены сокращенные электронные конфигурации для восьми элементов Периода 3:
| Na | [Ne] 3s 1 |
| мг | [Ne] 3s 2 |
| Al | [Ne] 3s 2 3p x 1 |
| Si | [Ne] 3s 2 3p x 1 3p y 1 |
| п. | [Ne] 3s 2 3p x 1 3p y 1 3p z 1 |
| S | [Ne] 3s 2 3p x 2 3p y 1 3p z 1 |
| Класс | [Ne] 3s 2 3p x 2 3p y 2 3p z 1 |
| Ар | [Ne] 3s 2 3p x 2 3p y 2 3p z 2 |
В каждом случае [Ne] представляет полную электронную конфигурацию атома неона.- \]
Молярная первая энергия ионизации — это энергия, необходимая для выполнения этого изменения на моль \ (X \).
Схема первых энергий ионизации в периоде 3
В течение периода наблюдается общая тенденция к росту, но эта тенденция прерывается снижением содержания магния и алюминия, а также фосфора и серы.
Объяснение паттерна
Энергия первой ионизации зависит от четырех факторов:
- заряд ядра;
- расстояние внешнего электрона от ядра;
- — степень экранирования внутренними электронами;
- , находится ли электрон один на орбитали или один в паре.
Восходящая тенденция: В течение всего периода 3 внешние электроны находятся на трехуровневых орбиталях. Эти электроны находятся примерно на одинаковом расстоянии от ядра и экранированы соответствующими электронами на орбиталях с главными атомными номерами n = 1 и n = 2. Определяющим фактором увеличения энергии является увеличение количества протонов в ядре от натрия до аргона. Это создает большее притяжение между ядром и электронами и, таким образом, увеличивает энергию ионизации.Увеличивающийся заряд ядра также притягивает внешние электроны к ядру, дополнительно увеличивая энергию ионизации в течение периода.
Уменьшение алюминия : можно ожидать, что значение для алюминия будет больше, чем для магния из-за дополнительных протонов. Однако этот эффект компенсируется тем фактом, что внешний электрон алюминия занимает 3p-орбиталь, а не 3s-орбиталь. 3p-электрон немного дальше от ядра, чем 3s-электрон, и частично экранирован 3s-электронами, а также внутренними электронами.Оба эти фактора компенсируют эффект дополнительного протона.
Уменьшение содержания серы: В этом случае нечто иное, кроме перехода с 3s-орбитали на 3p-орбиталь, должно компенсировать эффект дополнительного протона. Экранирование (от внутренних электронов и, в некоторой степени, от 3s-электронов) идентично для фосфора и серы, и электрон удаляется с идентичной орбитали. Разница в том, что в случае серы удаляемый электрон является одним из пары 3p x 2 .Отталкивание между двумя электронами на одной орбитали создает среду с более высокой энергией, благодаря чему электрон легче удалить, чем предполагалось.
Атомный радиус
На диаграмме ниже показано, как изменяется атомный радиус в периоде 3.
Цифры, использованные для построения этой диаграммы, основаны на:
- металлические радиусы для Na, Mg и Al; Ковалентные радиусы
- для Si, P, S и Cl;
- — радиус Ван-дер-Ваальса для Ar (который не образует сильных связей).
Уместно сравнить металлический и ковалентный радиусы, потому что они оба измеряются в условиях сильной связи. Однако эти радиусы нельзя сравнивать с радиусом Ван-дер-Ваальса, что делает диаграмму обманчивой. Общая тенденция к уменьшению размера атомов за период не нарушается на аргоне. Для удобства и ясности в этом обсуждении не используется аргон.
Объяснение тенденции
Металлический или ковалентный радиус — это мера расстояния от ядра до связывающей пары электронов.От натрия до хлора все связывающие электроны находятся на трехуровневом уровне и экранированы электронами первого и второго уровней. Увеличение числа протонов в ядре за период сильнее притягивает связывающие электроны. Количество скрининга является постоянным в периоде 3.
Электроотрицательность
Электроотрицательность — это мера тенденции атома притягивать связывающую пару электронов. Чаще всего используется шкала Полинга. Фтору (наиболее электроотрицательному элементу) присвоено значение 4.0, и значения уменьшаются в сторону цезия и франция, которые являются наименее электроотрицательными при 0,7.
Тренд
Тренд периода 3 выглядит следующим образом:
Аргон не включен; поскольку он не образует ковалентных связей, его электроотрицательность нельзя приписать.
Объяснение тенденции
Объяснение такое же, как и для тенденции атомных радиусов. В течение периода валентные электроны каждого атома находятся на трехуровневом уровне.Они экранированы такими же внутренними электронами. Единственное отличие — количество протонов в ядре. От натрия к хлору число протонов постоянно увеличивается, и поэтому связующая пара более плотно притягивается.
Физические свойства
В этом разделе обсуждается электропроводность, а также точки плавления и кипения элементов периода 3. Для этого обсуждения необходимо понимание структуры каждого элемента.
Конструкции элементов
Структуры элементов меняются в разные периоды.Первые три — металлические, кремний — сетчатый, ковалентный, а остальные — простые молекулы.
Три металлических конструкции
Натрий, магний и алюминий имеют металлические структуры. В натрия в металлической связи участвует только один электрон на атом, единственный 3s-электрон. В магнии задействованы оба его внешних электрона, а в алюминии — все три. Одно из ключевых различий, о котором следует помнить, — это способ упаковки атомов в металлическом кристалле. Натрий 8-координирован, при этом каждый атом натрия взаимодействует только с 8 другими атомами.Магний и алюминий скоординированы по 12, поэтому упаковываются более эффективно, создавая меньше пустого пространства в металлических конструкциях и более прочное соединение в металле.
Ковалентная структура сети
Кремний имеет сетчатую ковалентную структуру, как у алмаза. Показан репрезентативный разрез этой структуры:
Структура удерживается прочными ковалентными связями во всех трех измерениях.
Четыре простые молекулярные структуры
Структура фосфора и серы варьируется в зависимости от типа рассматриваемого фосфора или серы.В данном случае рассматривается белый фосфор и одна из кристаллических форм серы — ромбическая или моноклинная. Эти структуры показаны ниже:
Помимо аргона, атомы в каждой из этих молекул удерживаются вместе ковалентными связями. В жидком или твердом состоянии молекулы удерживаются в непосредственной близости от дисперсионных сил Ван-дер-Ваальса.
Электропроводность
- Натрий, магний и алюминий являются хорошими проводниками электричества.Электропроводность увеличивается от натрия до магния и до алюминия.
- Кремний — полупроводник.
- Фосфор, сера, хлор и аргон не проводят ток.
Три металла проводят электричество, потому что делокализованные электроны (как в модели «моря электронов») могут свободно перемещаться по твердому или жидкому металлу. Химия полупроводников для таких веществ, как кремний, выходит за рамки большинства курсов химии вводного уровня. Остальные элементы не проводят электричество, потому что представляют собой простые молекулярные вещества.без свободных, делокализованных электронов ..
Температура плавления и кипения
График показывает, как точки плавления и кипения элементов меняются по мере продвижения в течение периода. Цифры отображаются в градусах Кельвина, а не в ° C, чтобы избежать отрицательных температур.
Металлоконструкции
Температуры плавления и кипения у трех металлов увеличиваются из-за увеличения прочности их металлических связей. Число электронов, которые каждый атом может внести в делокализованное «море электронов», увеличивается.Атомы также становятся меньше и имеют больше протонов по мере перехода от натрия к магнию и алюминию. Аттракционы и, следовательно, температуры плавления и кипения увеличиваются, потому что:
- Ядра атомов заряжены более положительно.
- «Море» более отрицательно заряжено.
- «Море» все больше приближается к ядрам и, следовательно, сильнее притягивается.
Кремний
Кремний имеет высокие температуры плавления и кипения из-за его сетчатой ковалентной структуры.Плавление или кипение кремния требует разрыва прочных ковалентных связей. Из-за двух разных типов связи в кремнии и алюминии нет смысла напрямую сравнивать две точки плавления и кипения.
Четыре молекулярных элемента
Фосфор, сера, хлор и аргон — это простые молекулярные вещества, между молекулами которых только ван-дер-ваальсовы притяжения. Их точки плавления или кипения ниже, чем у первых четырех членов периода, которые имеют сложную структуру.Величины точек плавления и кипения полностью зависят от размеров молекул, которые снова показаны для справки:
- Фосфор: элементарный фосфор имеет тетраэдрическое расположение P 4 . Плавящийся фосфор не разрывает ковалентных связей; вместо этого он разрушает гораздо более слабые силы Ван-дер-Ваальса между молекулами.
- Сера: элементарная сера образует кольца атомов S 8 . Молекулы больше, чем молекулы фосфора, и поэтому притяжение Ван-дер-Ваальса сильнее, что приводит к более высокой температуре плавления и кипения.
- Хлор: Хлор, Cl 2 , представляет собой молекулу гораздо меньшего размера со сравнительно слабым ван-дер-ваальсовым притяжением, поэтому хлор будет иметь более низкую температуру плавления и кипения, чем сера или фосфор.
- Аргон: элементарный аргон одноатомен. Возможности притяжения Ван-дер-Ваальса между атомами аргона очень ограничены, поэтому точки плавления и кипения аргона снова ниже.
алюминиевых сплавов | Encyclopedia.com
Примечание: эта статья, первоначально опубликованная в 1998 году, была обновлена в 2006 году для электронной книги.
Обзор
Алюминий находится в строке 2, группе 13 периодической таблицы. Таблица Менделеева — это диаграмма, которая показывает, как химические элементы связаны друг с другом. Элементы в одном столбце обычно имеют схожие химические свойства. Первым элементом этой группы является бор . Однако бор сильно отличается от всех других членов семейства. Поэтому группа 13 известна как семейство алюминия.
Алюминий является третьим по распространенности элементом в земной коре, уступая кислороду и кремнию. Это самый распространенный металл. Поэтому несколько удивительно, что алюминий был открыт только относительно поздно в истории человечества. Алюминий в природе встречается только в соединениях, а не в чистом виде. Удалить алюминий из его соединений довольно сложно. Недорогой метод производства чистого алюминия не был разработан до 1886 года.
СИМВОЛ
Al
АТОМНОЕ ЧИСЛО
13
АТОМНАЯ МАССА
26.98154
3 Группа Алюминий
ПРОИЗВОДСТВО
uh-LOO-min-um
Сегодня алюминий является наиболее широко используемым металлом в мире после железа . Он используется в производстве автомобилей, упаковочных материалов, электрического оборудования, машин и строительства. Алюминий также идеально подходит для пивных банок и банок для безалкогольных напитков и фольги, потому что его можно плавить и повторно использовать или перерабатывать.
Открытие и присвоение названия
Алюминий был назван в честь одного из его наиболее важных соединений — квасцов. Квасцы представляют собой соединение калия, алюминия, серы, и кислорода. Химическое название — сульфат алюминия калия, KAl (SO 4 ) 2 .
Никто не знает, когда квасцы впервые были использованы человеком. Древние греки и римляне знали сложные квасцы. Он был добыт в ранней Греции, где был продан туркам. Турки использовали это соединение, чтобы сделать красивый краситель, известный как красный индейка. Записи указывают на то, что римляне использовали квасцы еще в первом веке до нашей эры.
Эти первые люди использовали квасцы как вяжущее средство и протраву. Вяжущее вещество — это химическое вещество, которое заставляет кожу стягиваться. При попадании квасцов на порез кожа закрывается и начинает заживать.При крашении ткани используется протрава. Немногие натуральные красители прилипают непосредственно к ткани. Протравы связываются с тканью, а краситель — с протравой.
Со временем химики постепенно начали понимать, что квасцы могут содержать новый элемент. В середине 1700-х годов немецкий химик Андреас Сигизмунд Маргграф (1709-82) утверждал, что открыл новую «землю» под названием глинозем в квасцах. Но он не смог удалить чистый металл из квасцов.
Первым, кто выполнил эту задачу, был датский химик и физик Ганс Кристиан Эрстед (1777–1851).Эрстед нагревает смесь глинозема и амальгамы калия. Амальгама — это сплав металла и ртути. В этой реакции Эрстед произвел алюминиевую амальгаму — металлический алюминий в сочетании с ртутью. Однако он не смог отделить алюминий от ртути.
Сегодня алюминий является наиболее широко используемым металлом в мире после железа.
Чистый металлический алюминий был окончательно произведен в 1827 году немецким химиком Фридрихом Вёлером (1800-82). Велер использовал метод, усовершенствованный английским химиком сэром Хэмфри Дэви (1778-1829), которому удалось выделить несколько элементов в течение его жизни.(См. Врезку о Дэви в записи Calc ). Велер нагрел смесь хлорида алюминия и металлического калия. Будучи более активным, калий заменяет алюминий, как показано ниже:
Затем чистый алюминий можно собрать в виде серого порошка, который необходимо расплавить, чтобы получить блестящий алюминий, наиболее знакомый потребителям.
После работы Велера было возможно, но очень дорого, производить чистый алюминий. Он стоил так дорого, что его практически не было коммерческого использования.
Ряд химиков осознали, насколько важно найти менее дорогой способ получения алюминия. В 1883 году русский химик В. А. Тюрин нашел менее затратный способ получения чистого алюминия. Он пропустил электрический ток через расплавленную (расплавленную) смесь криолита и хлорида натрия и хлорида (обычная поваренная соль). Криолит представляет собой фторид натрия и алюминия (Na 3 AlF 6 ). В течение следующих нескольких лет аналогичные методы выделения алюминия были разработаны другими европейскими химиками.
Самый значительный прорыв в исследованиях алюминия был сделан студентом колледжа в Соединенных Штатах. Чарльз Мартин Холл (1863-1914) был студентом Оберлинского колледжа в Оберлине, штат Огайо, когда он заинтересовался проблемой производства алюминия. Используя самодельное оборудование в сарае за своим домом, он добился успеха, пропустив электрический ток через расплавленную смесь криолита и оксида алюминия (Al 2 O 3 ).
Метод Холла был намного дешевле любого предыдущего метода.После его открытия цена на алюминий упала примерно с 20 долларов за кг (10 долларов за фунт) до менее 1 доллара за кг (примерно 0,4 доллара за фунт). Исследования Холла превратили алюминий из полудрагоценного металла в металл, который можно использовать во многих повседневных изделиях.
Что в имени?
В Северной Америке алюминий пишется с одним i и произносится как uh-LOO-min-um. В других странах мира добавляется второй i, что делает его алюминиевым, и произносится это слово al-yoo-MIN-ee-um.
Физические свойства
Алюминий — это металл серебристого цвета со слегка голубоватым оттенком.Он имеет температуру плавления 660 ° C (1220 ° F) и температуру кипения 2327–2450 ° C (4221–4442 ° F). Плотность составляет 2,708 грамма на кубический сантиметр. Алюминий пластичен и податлив. Пластичный означает, что его можно натянуть на тонкую проволоку. Податливый означает, что его можно расколоть в тонкие листы.
Алюминий — отличный проводник электричества. Серебро и медь — лучшие проводники, чем алюминий, но намного дороже. Инженеры ищут способы чаще использовать алюминий в электрооборудовании из-за его более низкой стоимости.
Химические свойства
Алюминий обладает одним интересным и очень полезным свойством. Во влажном воздухе он медленно соединяется с кислородом с образованием оксида алюминия:
Оксид алюминия образует очень тонкое беловатое покрытие на металлическом алюминии. Покрытие предотвращает дальнейшую реакцию металла с кислородом и защищает металл от дальнейшей коррозии (ржавления). Оксид алюминия легко увидеть на алюминиевой садовой мебели и неокрашенной обшивке дома.
Алюминий — довольно активный металл.Реагирует со многими горячими кислотами. Также реагирует со щелочами. Щелочь — это химическое вещество, обладающее свойствами, противоположными кислотам. Гидроксид натрия (обыкновенный щелок) и известковая вода являются примерами щелочей. Элемент не может реагировать с и кислотами и щелочами. Такие элементы называются амфотерными.
Алюминий также быстро реагирует с горячей водой. В порошкообразной форме он быстро загорается при воздействии пламени.
Алюминий: драгоценный металл?
B До того, как химики разработали недорогие способы производства чистого алюминия, он считался в некоторой степени драгоценным металлом.Фактически, в 1855 году на Парижской выставке был выставлен слиток из чистого металлического алюминия. Его поместили рядом с драгоценностями французской короны!
Алюминий — отличный проводник электричества.
Встречаемость в природе
Содержание алюминия в земной коре оценивается примерно в 8,8 процента. Он встречается во многих различных минералах.
Боксит, сложная смесь соединений, состоящих из алюминия, кислорода и других элементов, является основным коммерческим источником алюминия.
Большие запасы бокситов находятся в Австралии, Бразилии, Гвинее, Ямайке, России и США. Крупнейший производитель металлического алюминия — США; штаты, производящие больше всего алюминия, — это Монтана, Орегон, Вашингтон, Кентукки, Северная Каролина, Южная Каролина и Теннесси.
Изотопы
Существует только один естественный изотоп алюминия, алюминий-27. Изотопы — это две или более формы элемента. Изотопы отличаются друг от друга по своему массовому числу.Число, написанное справа от названия элемента, является массовым числом. Массовое число представляет собой количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого элемента может варьироваться. Каждая вариация — изотоп.
Алюминий содержит шесть радиоактивных изотопов. Радиоактивный изотоп испускает либо энергию, либо субатомные частицы, чтобы уменьшить атомную массу и стать стабильным. Когда излучение вызывает изменение числа протонов, атом уже не тот элемент.Частицы и энергия, испускаемые ядром, называются излучением. Процесс распада одного элемента на другой известен как радиоактивный распад.
Радиоактивный изотоп алюминия не используется в коммерческих целях.
Добыча
Производство алюминия — это двухэтапный процесс. Во-первых, оксид алюминия отделяется от боксита с помощью процесса Байера. В этом процессе боксит смешивается с гидроксидом натрия (NaOH), который растворяет оксид алюминия. Остальные соединения в боксите остались позади.
Затем оксид алюминия обрабатывают способом, аналогичным методу Холла. Природного криолита не хватает для производства всего необходимого алюминия, поэтому для этой цели производят синтетический (искусственный) криолит. Химическая реакция с синтетическим криолитом такая же, как и с природным криолитом. Около 21 миллионов метрических тонн алюминия было произведено в 1996 году с помощью этого двухэтапного процесса.
Области применения
Алюминий используется как чистый металл, в сплавах и в различных соединениях.Сплав получают путем плавления и последующего смешивания двух или более металлов. Смесь имеет свойства, отличные от свойств отдельных металлов. Алюминиевые сплавы классифицируются по пронумерованным рядам в соответствии с другими элементами, которые они содержат.
Класс 1000 зарезервирован для сплавов почти чистого металлического алюминия. Однако они, как правило, менее прочные, чем другие сплавы алюминия. Эти металлы используются в конструктивных элементах зданий, в качестве декоративной отделки, в химическом оборудовании и в качестве отражателей тепла.
Серия 2000 — это сплавы меди и алюминия. Они очень прочные, устойчивы к коррозии (ржавчине) и могут обрабатывать или обрабатывать очень легко. Некоторые применения алюминиевых сплавов серии 2000 — это обшивка грузовиков и конструктивные элементы самолетов.
Серия 3000 состоит из сплавов алюминия и марганца . Эти сплавы не так прочны, как серия 2000, но они также хорошо обрабатываются. Сплавы этой серии используются для кухонной утвари, резервуаров для хранения, алюминиевой мебели, дорожных знаков и кровли.
Сплавы серии 4000 содержат кремний. Они имеют низкие температуры плавления и используются для изготовления припоев и для придания металлу серой окраски. Припои — это легкоплавкие сплавы, используемые для соединения двух металлов друг с другом. Серии 5000, 6000 и 7000 включают сплавы, состоящие из магния, магния и кремния и цинка, соответственно. Они используются в производстве кораблей и лодок, деталей для кранов и артиллерийских установок, мостов, конструктивных элементов зданий, автомобильных деталей и компонентов самолетов.
Наибольшее разовое использование алюминия используется в транспортной отрасли (28 процентов). Производители автомобилей и грузовиков любят алюминий и алюминиевые сплавы, потому что они очень прочные, но при этом легкие. Компании все больше используют алюминиевые изделия в электромобилях. Эти автомобили должны быть легкими для экономии заряда аккумулятора. General Motors, Ford и Chrysler объявили о новых передовых конструкциях автомобилей, в которых алюминиевые изделия будут использоваться более широко. Производители алюминия также планируют выпускать более широкий ассортимент колес как для легковых, так и для грузовых автомобилей.
Двадцать три процента всего производимого алюминия идет на упаковку. Алюминиевая фольга, банки для пива и безалкогольных напитков, тюбики с краской и контейнеры для домашних продуктов, таких как аэрозольные баллончики, — все это сделано из алюминия.
Четырнадцать процентов всего алюминия идет на строительство. Окна и дверные коробки, экраны, кровля и сайдинг, а также при строительстве мобильных домов и конструктивных элементов зданий используются алюминий.
Остальные 35 процентов алюминия идут на производство разнообразной продукции, включая электрические провода и приборы, автомобильные двигатели, системы отопления и охлаждения, мосты, пылесосы, кухонную утварь, садовую мебель, тяжелую технику и специализированное химическое оборудование.
Соединения
Относительно небольшое количество алюминия используется для изготовления большого количества различных соединений алюминия. К ним относятся:
сульфат алюминия-аммония (Al (NH 4 ) (SO 4 ) 2 ): протравы, водоочистка и очистка сточных вод, производство бумаги, пищевая добавка, дубление кожи
борат алюминия (Al 2 O 3 B 2 O 3 ): производство стекла и керамики
боргидрид алюминия (Al (BH 4 ) 3 : добавка в топливо для реактивных двигателей
хлорид алюминия (AlCl 3 ): производство красок, антиперспирантов, нефтепереработка, производство синтетического каучука
фторосиликат алюминия (Al 2 (SiF 6 ) 3 ): производство синтетических драгоценных камней, стекла и керамики
гидроксид алюминия (Al (OH) 3 ): антациды, протравы, очистка воды, производство стекла и керамики, гидроизоляция тканей
фосфат алюминия (AlPO 4 ): производство стекла, керамики, целлюлозно-бумажных изделий, косметика, лакокрасочные материалы, а также при производстве стоматологического цемента
сульфат алюминия или квасцы (Al 2 (SO 4 ) 3 ): производство бумаги, протравы, систем пожаротушения, очистки воды и очистки сточных вод, пищевая добавка, огнестойкий и антипирен, дубление кожи
Воздействие на здоровье
Функции алюминия в организме человека неизвестны.

