Газ аргон – химические свойства и сфера применения
В переводе с греческого «argon» означает «медленный» или «неактивный». Такое определение газ аргон получил благодаря своим инертным свойствам, позволяющим широко его использовать во многих промышленных и бытовых целях.
Химический элемент Ar
Ar – 18-й элемент периодической таблицы Менделеева, относящийся к благородным инертным газам. Данное вещество является третьим после N (азота) и O (кислорода) по содержанию в атмосфере Земли. В обычных условиях – бесцветен, не горюч, не ядовит, без вкуса и запаха.
Другие свойства газа аргона:
- атомная масса: 39,95;
- содержание в воздухе: 0,9% объема и 1,3% массы;
- плотность в нормальных условиях: 1,78 кг/м³;
- температура кипения: -186°С.
На рисунке название химического элемента и его свойства
Данный элемент был открыт Джоном Стреттом и Уильямом Рамзаем при исследовании состава воздуха. Несовпадение плотности при различных химических испытаниях натолкнуло ученых на мысль, что в атмосфере помимо азота и кислорода присутствует инертный тяжелый газ. В итоге в 1894 г. было сделано заявление об открытии химического элемента, доля которого в каждом кубометре воздуха составляет 15 г.
Как добывают аргон
Ar не поддается изменениям в процессе его использования и всегда возвращается в атмосферу. Поэтому ученые считают данный источник неисчерпаемым. Он добывается как сопутствующий продукт при разделении воздуха на кислород и азот посредством низкотемпературной ректификации.
Для реализации этого метода применяются специальные воздухоразделительные аппараты, состоящие из колонн высокого, низкого давления и конденсатора-испарителя. В результате процесса ректификации (разделения) получается аргон с небольшими примесями (3-10%) азота и кислорода. Чтобы произвести очистку, примеси убираются с помощью дополнительных химических реакций. Современные технологии позволяют достичь 99,99% чистоты данного продукта.
Представлены установки по производству данного химического элемента
Хранится и транспортируется газ аргон в стальных баллонах (ГОСТ 949-73), которые имеют серый окрас с полосой и соответствующей надписью зеленого цвета. При этом процесс наполнения емкости должен полностью соответствовать технологическим нормам и правилам безопасности. Детальную информацию о специфике заполнения газовых баллонов можно прочитать в статье: баллоны со сварочной смесью – технические особенности и правила эксплуатации.
Где применяется газ аргон
Данный элемент имеет достаточно большую сферу применения. Ниже приведены основные области его использования:
- заполнение внутренней полости ламп накаливания и стеклопакетов;
- вытеснение влаги и кислорода для долгого хранения пищевых продуктов;
- огнетушащее вещество в некоторых системах тушения пожара;
- защитная среда при сварочном процессе;
- плазмообразующий газ для плазменной сварки и резки.
В сварочном производстве он применяется как защитная среда в процессе сварки редких металлов (ниобия, титана, циркония) и их сплавов, легированный сталей разных марок, а также алюминиевых, магниевых и хромоникелевых сплавов. Для черных металлов, как правило, применяют смесь Ar с другими газами – гелием, кислородом, углекислотой и водородом.
Вид защитной среды при сварочном процессе, которую создает аргон
Являясь тяжелее воздуха, аргоновая струя надежно защищает металл во время сварки. Инертный газ на протяжении длительного времени является защитой для расплавленной и нагретой металлической поверхности. Больше о сварочном процессе с применением аргоновой защитной среды читайте в статье: сварка аргоном – технология и режимы работы оборудования.
Меры предосторожности при эксплуатации
Данный химический элемент не представляет абсолютно никакой опасности для окружающей среды, но при большой концентрации оказывает удушающее воздействие на человека. Он нередко скапливается в районе пола в недостаточно проветриваемых помещениях, а при значительном уменьшении содержание кислорода может привести к потере сознания и даже смертельному исходу. Поэтому важно следить за концентрацией кислорода в закрытом помещении, которая не должна падать ниже 19%.
Еще мы советуем посмотреть третью часть обучения сварке в защитной среде аргона:
Жидкий Ar способен вызвать обморожение участков кожи и повредить слизистую оболочку глаз, поэтому в процессе работы важно использовать спецодежду и защитные очки. При работе в атмосфере этого газа с целью предотвращения удушения необходимо применять изолирующий кислородный прибор или шланговый противогаз.
Заправить баллоны аргоном можно в компании «Промтехгаз», где соблюдается правильная технология заправки и предоставляется качественное обслуживание.
Если вы интересуетесь другими техническими газами, информацию можете найти здесь.
Благородные газы — Википедия
| Группа → | 8 | ||||||
|---|---|---|---|---|---|---|---|
| ↓ Период | |||||||
| 1 | |||||||
| 2 | |||||||
| 3 | |||||||
| 4 |
| ||||||
| 5 |
| ||||||
| 6 |
| ||||||
| 7 |
| ||||||
Благоро́дные га́зы (также ине́ртные[2] или ре́дкие га́зы[3]) — группа химических элементов со схожими свойствами: при нормальных условиях они представляют собой одноатомные газы без цвета, запаха и вкуса с очень низкой химической реактивностью[en]. К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). Формально к этой группе также причисляют недавно открытый оганесон (Og), однако его химические свойства почти не исследованы.
В первых 6 периодах периодической таблицы химических элементов инертные газы относятся к последней, 8-й группе. Согласно старой европейской системе нумерации групп периодической таблицы, группа инертных газов обозначается VIIIA (главная подгруппа 8-й группы, или подгруппа гелия), согласно старой американской системе — VIIIB; кроме того, в некоторых источниках, особенно в старых, группа инертных газов обозначается цифрой 0, ввиду характерной для них нулевой валентности. Возможно, что из-за релятивистских эффектов элемент 7-го периода 4-й группы флеровий обладает некоторыми свойствами благородных газов[4]. Он может заменить в периодической таблице оганесон[5]. Благородные газы химически неактивны и способны участвовать в химических реакциях лишь при экстремальных условиях.
Характеристики благородных газов объяснены современными теориями структуры атома: их электронные оболочки из валентных электронов являются заполненными, тем самым позволяя участвовать лишь в очень малом количестве химических реакций: известны всего несколько сотен химических соединений этих элементов.
Неон, аргон, криптон и ксенон выделяют из воздуха специальными установками, используя при этом методы сжижения газов и фракционированной конденсации. Источником гелия являются месторождения природного газа с высокой концентрацией гелия, который отделяется с помощью методов криогенного разделения газов. Радон обычно получают как продукт радиоактивного распада радия из растворов соединений этого элемента.
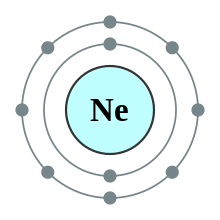 Неон, как и все благородные газы, имеет заполненную электронную оболочку. Все атомы благородных газов имеют на внешней орбите 8 электронов. Исключением является гелий (только 2 электрона)
Неон, как и все благородные газы, имеет заполненную электронную оболочку. Все атомы благородных газов имеют на внешней орбите 8 электронов. Исключением является гелий (только 2 электрона)Благородные газы не поддерживают горения и не возгораются при нормальных условиях.
| № | Элемент | № электронов/электронной оболочки |
|---|---|---|
| 2 | гелий | 2 |
| 10 | неон | 2, 8 |
| 18 | аргон | 2, 8, 8 |
| 36 | криптон | 2, 8, 18, 8 |
| 54 | ксенон | 2, 8, 18, 18, 8 |
| 86 | радон | 2, 8, 18, 32, 18, 8 |
Соединения[править | править код]
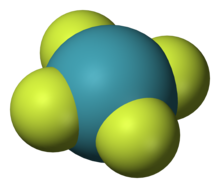 Структура тетрафторида ксенона XeF4, одного из первых когда-либо обнаруженных соединений благородных газов
Структура тетрафторида ксенона XeF4, одного из первых когда-либо обнаруженных соединений благородных газовИнертные газы отличаются химической неактивностью (отсюда и название). Тем не менее, в 1962 году Нил Барлетт показал, что все они при определённых условиях могут образовывать соединения (особенно охотно со фтором). Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8). Радон тоже имеет высокую химическую активность (по сравнению с лёгкими инертными газами), но он радиоактивен и быстро распадается, поэтому подробное изучение его химических свойств осложнено, в отличие от ксенона.
Оганесон, несмотря на его принадлежность к 18-й группе периодической таблицы, может не являться инертным газом, так как предполагается, что при нормальных условиях в силу релятивистских эффектов, влияющих на движение электронов вблизи его ядра с высоким зарядом, он будет находиться в твёрдом состоянии[6].
Инертные газы бесцветны, прозрачны и не имеют запаха и вкуса. В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов и планет земной группы. Гелий является вторым (после водорода) по распространённости элементом во Вселенной, однако для Земли он является редким газом, который улетучился в космос во время образования планеты. Почти весь добываемый гелий является радиогенным продуктом происходящего в течение миллиардов лет в недрах Земли альфа-распада урана, тория и их дочерних элементов; лишь малая часть земного гелия сохранилась от эпохи образования Солнечной системы. Аналогично, по большей части радиогенным является и аргон, возникший в результате постепенного радиоактивного распада калия-40.
При нормальных условиях все элементы 8-й группы (кроме, возможно, оганесона) являются одноатомными газами. Их плотность растёт с увеличением номера периода. Плотность гелия при нормальных условиях примерно в 7 раз меньше плотности воздуха, тогда как радон почти в восемь раз тяжелее воздуха.
При нормальном давлении температуры плавления и кипения у любого благородного газа отличаются менее чем на 10 °C; таким образом, они остаются жидкими лишь в малом температурном интервале. Температуры сжижения и кристаллизации растут с ростом номера периода. Гелий под атмосферным давлением вообще не становится твёрдым даже при абсолютном нуле — единственный из всех веществ.
Инертные газы не обладают химической токсичностью. Однако атмосфера с увеличенной концентрацией инертных газов и соответствующим снижением концентрации кислорода может оказывать удушающее действие на человека, вплоть до потери сознания и смерти[7][8]. Известны случаи гибели людей при утечках инертных газов.
Ввиду высокой радиоактивности всех изотопов радона он является радиотоксичным. Наличие радона и радиоактивных продуктов его распада во вдыхаемом воздухе вызывает стохастические эффекты хронического облучения, в частности рак.
Инертные газы обладают биологическим действием, которое проявляется в их наркотическом воздействии на организм и по силе этого воздействия располагаются по убыванию в следующем порядке (в сравнении приведены также азот и водород): Xe — Kr — Ar — N2 — H2 — Ne — He. При этом ксенон и криптон проявляют наркотический эффект при нормальном барометрическом давлении, аргон — при давлении свыше 0,2 МПа (2 атм), азот — свыше 0,6 МПа (6 атм), водород — свыше 2,0 МПа (20 атм). Наркотическое действие неона и гелия в опытах не регистрируются, так как под давлением раньше возникают симптомы «нервного синдрома высокого давления» (НСВД)[9].

Лёгкие инертные газы имеют очень низкие точки кипения и плавления, что позволяет их использовать в качестве холодильного агента в криогенной технике. Жидкий гелий, который кипит при 4,2 К (−268,95 °C), используется для получения сверхпроводимости — в частности, для охлаждения сверхпроводящих обмоток электромагнитов, применяемых, например, для магнитно-резонансной томографии и других приложений ядерного магнитного резонанса. Жидкий неон, хотя его температура кипения (–246,03 °C) и не достигает таких низких значений как у жидкого гелия, также находит применение в криогенике, потому что его охлаждающие свойства (удельная теплота испарения) более чем в 40 раз лучше, чем у жидкого гелия, и более чем в три раза лучше, чем у жидкого водорода.
Гелий, благодаря его пониженной растворимости в жидкостях, особенно в липидах, используется вместо азота как компонент дыхательных смесей для дыхания под давлением (например, при подводном плавании). Растворимость газов в крови и биологических тканях растёт под давлением. В случае использования для дыхания обычного воздуха или других азотсодержащих дыхательных смесей это может стать причиной эффекта, известного как азотное отравление.
Благодаря меньшей растворимости в липидах, атомы гелия задерживаются клеточной мембраной, и поэтому гелий используется в дыхательных смесях, таких как тримикс и гелиокс, уменьшая наркотический эффект газов, возникающий на глубине. Кроме того, пониженная растворимость гелия в жидкостях тела позволяет избежать кессонной болезни при быстром всплытии с глубины. Уменьшение остатка растворённого газа в теле означает, что во время всплытия образуется меньшее количество газовых пузырьков; это уменьшает риск газовой эмболии. Другой инертный газ, аргон, рассматривается как лучший выбор для использования в качестве прослойки к сухому костюму[10][неавторитетный источник?
Аргон, наиболее дешёвый среди инертных газов (его содержание в атмосфере составляет около 1 %), широко используется при сварке в защитных газах, резке и других приложениях для изоляции от воздуха металлов, реагирующих при нагреве с кислородом (и азотом), а также для обработки жидкой стали. Аргон также применяется в люминесцентных лампах для предотвращения окисления разогретого вольфрамового электрода. Также, ввиду низкой теплопроводности, аргон (а также криптон) используют для заполнения стеклопакетов.
После крушения дирижабля «Гинденбург» в 1937 году огнеопасный водород был заменен негорючим гелием в качестве заполняющего газа в дирижаблях и воздушных шарах, несмотря на снижение плавучести на 8,6 % по сравнению с водородом. Несмотря на замену, катастрофа оказала непропорционально большое влияние на всю область герметичных летательных аппаратов легче воздуха и подорвала планы по расширению этой области авиации более чем на полвека. Они стали популярнее только в последнее время, с развитием нановолоконных тканей и альтернативной энергетики.
- Беннетт, Питер; Эллиотт, Дэвид. The Physiology and Medicine of Diving (неопр.). — SPCK Publishing, 1998. — ISBN 0-7020-2410-4.
- Bobrow Test Preparation Services. CliffsAP Chemistry (неопр.). — CliffsNotes (англ.)русск., 2007. — ISBN 0-470-13500-X.
- Гринвуд, Н.Н.; Ёрншо, A. Chemistry of the Elements (неопр.). — 2nd. — Oxford:Butterworth-Heinemann, 1997. — ISBN 0-7506-3365-4.
- Хардинг, Чарли Дж.; Джейнс, Роб. Elements of the P Block (неопр.). — Royal Society of Chemistry, 2002. — ISBN 0-85404-690-9.
- Холловэй, Джон. Noble-Gas Chemistry (неопр.). — Лондон: Methuen Publishing (англ.)русск., 1968. — ISBN 0-412-21100-9.
- Менделеев, Дмитрий (англ.)русск.. Основы Химии (неопр.). — 7-е.
- Оджима, Минору; Подосек, Франк. Noble Gas Geochemistry (неопр.). — Cambridge University Press, 2002. — ISBN 0-521-80366-7.
- Вайнхольд, Ф.; Лэндис, C. Valency and bonding (неопр.). — Cambridge University Press, 2005. — ISBN 0-521-83128-8.
- Скерри, Эрик. The Periodic Table, Its Story and Its Significance (англ.). — Oxford University Press, 2007. — ISBN 0-19-530573-6.
| |||||
Аргон: применение, получение, история
Авторы:
сотрудники компании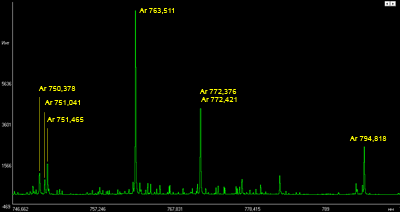
Аналитические линии плазмообразующего газа (аргона) на фрагменте спектра образца углеродистой низколегированной стали
Аргон – элемент с атомной массой 39,944 и порядковым номером 18. Принадлежит к 8-ой группе главной подгруппы таблицы Менделеева, относится к благородным инертным одноатомным газам. Не обладает ни запахом, ни цветом, ни вкусом. Негорючий и невзрывоопасный.
История открытия Аргона
Впервые неизвестный до этого газ, при химических и физических экспериментах, обнаружил в 1785 году Генри Кавендиш — английский физик и химик. Но он не смог разгадать загадку и прекратил исследования. Позднее на записи Кавендиша обратил внимание Джеймс Максвелл.
И лишь спустя более ста лет, в 1894 году, химик Уильям Рамзай и физик Джон Уильям Стретт (Лорд Рэлей) сделали доклад об открытии нового элемента, который, за свою химическую неактивность, назвали аргоном. Это случилось в Оксфорде на собрании Британской ассоциации естествоиспытателей, физиков и химиков. Название нового газа произошло от греческого слова ἀργός, что в переводе означает — неактивный, медленный.
Спустя еще 10 лет, эти ученые получили Нобелевские премии за исследования газов, открытие аргона и других инертных газов в атмосфере.
Получение Аргона
Аргон — наиболее распространенный в воздухе инертный газ. В 1 м3 содержится примерно 0,09 см3 ксенона, 1,1 см3 криптона, 5,2 см3 гелия, 18,2 см3 неона, 9000 см3 аргона.
В атмосфере Земли аргон занимает третье место. На первом – азот, на втором — кислород. В процентном отношении это примерно 0,93% по объёму или 1.3% по массе. По этой причине он является самым легкодоступным и недорогим инертным газом.
Получение и промышленное производство этого газа происходит как выделение сопутствующего газа при добыче азота и кислорода из атмосферного воздуха. Наиболее простой метод — это глубокое охлаждение и ректификация с последующей доочисткой от примесей.
Кроме того, аргон получают при производстве аммиака. Доочистку аргона осуществляют по технологии гидрирования с платиновым катализатором или адсорбционным методом с использованием молекулярных сит или активного угля.
Применение Аргона
Основными потребителями аргона являются:
Металлургия. Применение аргона в современных технологических процессах выплавки стали — продувка расплава в ковше. Эта операция выполняет несколько функций: охлаждение металла, ускорение плавления вводимых в ковш лигатур и раскислителей, гомогенизация металла по химическому составу и температуре, очищение от неметаллических включений, образующихся от раскисляющих и легирующих добавок, углеродное раскисление металла и его обезуглероживание, удаление водорода и азота, ускорение десульфурации (удаление серы из расплава), вдувание раскисляющих и легирующих порошкообразных добавок.
В металлургии высококачественных сплавов аргон используется для защиты расплава от контакта с воздухом во время выплавки и разливки. Высокотемпературная обработка титана и его сплавов требует защитной аргоновой атмосферы. Незаменим аргон и в технологиях обработки таких редких металлов как цирконий, вольфрам, тантал, ниобий, бериллий, гафний и др.
Металлообрабатывающая промышленность. Основное использование аргона — создание защитной завесы при электродуговой (АРДЭС), контактной и лазерной сварке, термообработке. Аргон — плазмообразующий газ в установках сварки и резки активных, редких металлов, сплавов на их основе, например, алюминиевых и магниевых, нержавеющих, хромоникелевых, жаропрочных сплавов и легированных сталей.
Радиоэлектронная промышленность. Здесь аргон незаменим для создания инертной среды в установках плазменного напыления, заполнение колб электрических и люминесцентных ламп, электровакуумных приборов, газосветной рекламы. Например, сине-голубое свечение получается при заполнении трубок аргоном с парами ртути.
Пищевая промышленность. Благодаря своей химической нейтральности, аргон широко используют как пропеллтен («выталкивающий» газ) в аэрозольных упаковках, антифламинг (вещество снижающее образование пены) и «упаковочный» газ в пищевой промышленности.
Спектральный анализ и метрология. В данной сфере аргон наиболее часто используется как газ-носитель, инертная среда и плазмообразующий газ в контрольно-измерительных приборах, а также при производстве поверочных газовых смесей (ПГС) для различных газоанализаторов.
В данной сфере применения чистота аргона имеет ключевое значение. Даже при минимальных отклонениях качества аргона от соответствующих ГОСТов и ТУ, регламентированных для использования в конкретных приборах, изменяются условия работы и анализа, что приводит к серьезным искажениям результатов измерений, нарушению работоспособности оборудования, снижению качества продукции, снижению ресурса фильтров и, как следствие, серьезным экономическим убыткам.
Для предотвращения вышеописанного, могут использоваться специализированные фильтры, а также установки доочистки аргона (инертных газов) лабораторного или промышленного назначения.

Так как наша компания занимается разработкой и производством спектрометров, применение аргона в этих приборах мы решили рассмотреть более подробно. Ниже в статье этому будет посвящена отдельная глава.
Прочие сферы применения. Огнетушительные установки, заполнение стеклопакетов и поддув сухих гидрокостюмов водолазов для лучшей теплоизоляции, в медицине — очистка разрезов при хирургическом вмешательстве, в химической промышленности — инертная среда для нестабильных на воздухе соединений, а так же в прочих областях промышленности.
Продолжение >
аргон — это… Что такое аргон?
АРГО́Н -а; м. [от греч. argon — недеятельный]. Химический элемент (Ar), инертный газ без цвета и запаха, входящий в состав воздуха (применяется для наполнения электрических ламп, в металлургии, химии и т.п.).
◁ Арго́новый, -ая, -ое. А-ые трубки реклам.
АРГО́Н (лат. Аrgon), Ar (читается «аргон»), химический элемент с атомным номером 18, атомная масса 39,948. Относится к группе инертных, или благородных (см. БЛАГОРОДНЫЕ ГАЗЫ), газов (восьмая группа периодической системы), замыкает третий период. Природный аргон состоит из трех стабильных нуклидов (см. НУКЛИД) : 36Ar (0,337%), 38Ar(0,063%) и 40Ar(99,600%).Радиус нейтрального атома аргона 0,192 нм. Электронная конфигурация нейтрального невозбужденного атома 1s22s2p63s2p6. Энергии последовательной ионизации нейтрального атома равны, соответственно, 15,759, 27,63, 40,91, 59,8 и 75 эВ. Простое вещество аргон — газ без запаха, цвета и вкуса.
История открытия
К открытию аргона привело обнаруженное в 1892 году английским физиком Дж. Рэлеем (см. РЭЛЕЙ Джон Уильям) небольшое (всего на 0,13%) превышение плотности азота, выделяемого из воздуха, над плотностью «химического» азота, возникающего при термическом разложении нитрита аммония NH4NO2.
Вместе с другим английским физиком У. Рамзаем (см. РАМЗАЙ Уильям) Дж. Рэлей в 1894 году выделил из воздуха примесь более тяжелого (по сравнению с азотом) газа, который отличался одноатомным составом молекул и практически полной химической недеятельностью (аргон не вступает ни в какие химические реакции). Именно из-за своей удивительной химической инертности новый газ и получил свое название (греч. аrgos — неактивный).
Аргон в природе
Аргон распространен в природе только в свободном виде. В земной коре его содержание составляет 1,2·10-4%, в морской воде — 0,45·10-4%. В атмосферном воздухе содержится 0,93% аргона по объему (9,34 л в 1м3). Это значительно больше, чем содержание в воздухе всех остальных инертных газов вместе взятых. Воздух служит неиссякаемым источником для получения аргона.
Обращает на себя внимание преобладание в смеси природных нуклидов аргона самого тяжелого — аргона-40. Это связано с тем, что 40Ar постоянно образуется за счет распада радиоактивного калия-40. В 1 т калия за год при радиоактивном распаде калия-40 путем захвата орбитального электрона (так называемый электронный захват (см. ЭЛЕКТРОННЫЙ ЗАХВАТ), или К-захват; на этот тип радиоактивного распада калия-40 приходится 12% от всех актов распада этого природного радионуклида) образуется всего около 3100 атомов аргона-40. Но калий — один из самых распространенных на Земле элементов, да и время, прошедшее за долгую историю Земли, исчисляется миллиардами лет. Поэтому 40Ar накопился в земной атмосфере в значительных количествах.
Преобладание тяжелого аргона-40 в природной смеси изотопов этого элемента приводит к тому, что атомная масса элемента аргона оказывается немного выше, чем следующего за ним в периодической системе элемента калия. Однако, когда Менделеев создавал свою знаменитую таблицу, проблема, как разместить калий и аргон, у него не возникала, так как аргон был открыт спустя почти 30 лет после открытия периодического закона, и в таблицу (в группу, которой тогда присвоили номер ноль) попал только в начале 20-го века. В настоящее время аргон, как и другие инертные газы, включают в восьмую группу периодической системы элементов.
Получение
В промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот.
Физические свойства
Аргон — одноатомный газ с температурой кипения (при нормальном давлении) –185,9 °C (немного ниже, чем у кислорода, но немного выше, чем у азота), температура плавления –189,3°C. Критическая температура –122,43 °C, критическое давление 4,86 МПа. Плотность при нормальных условиях 1,7839 кг/м3.
В 100 мл воды при 20 °C растворяется 3,3 мл аргона, в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде.
Как уже говорилось, химических соединений не образует. Однако со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом (см. ФЕНОЛ), гидрохиноном (см. ГИДРОХИНОН) и другими), образует соединения включения (клатраты (см. КЛАТРАТЫ)), где атом аргона, как своего рода «гость», находится в полости, образованной в кристалической решетке молекулами вещества-хозяина.
Применение
Аргон широко используют для создания инертной и защитной атмосферы, прежде всего при термической обработке легко окисляющихся металлов (аргоновая плавка, аргоновая сварка и другие). В атмосфере аргона получают кристаллы полупроводников и многие другие сверхчистые материалы. Аргоном часто заполняют электрические лампочки (для замедления испарения вольфрама (см. ВОЛЬФРАМ) со спирали).
При пропускании электрического разряда через стеклянную трубку, заполненную аргоном, наблюдается сине-голубое свечение, что широко используется, например, в светящейся рекламе. В геохронологии (см. ГЕОХРОНОЛОГИЯ) по оределению соотношения изотопов 40Ar/40К устанавливают возраст минераллов.
Где применяют газ аргон?
Аргон представляет собой одноатомный инертный газ, он не имеет вкуса, запаха и цвета. А в периодической таблице Менделеева порядковый номер аргона восемнадцатый. Стоит сказать, что этот газ в природных условиях распространен не в соединениях химического характера, а в свободном виде. Воздух нашей планеты содержит в себе 0,95 % аргона. Кстати, этот газ есть в морской воде и земной коре.
Аргон впервые был открыт в 1882 году Джоном Рэлеем, знаменитым английским физиком. Благодаря опытам и научным экспериментам Рэлей обнаружил, что переработанный литр азота более увесист, чем тот же литр вещества, полученного после распада азотистого соединения.
Опубликованное открытие позволило выдвинуть гипотезы о том, что имеются существенные разницы о величинах плотности газа, полученного двумя совершенно разными способами. Физики предположили что азот, выделившийся из воздуха, имеет в себе неизвестный газ с более высокой плотностью. Опыты продолжились, и позже был выделен аргон. Это самый инертный из газов, известных в девятнадцатом веке. В 1894 году учеными был сделан официальный доклад об аргоне и его свойствах.
Свойства аргона
Аргон является одноатомным газом. Он не имеет запаха, лишен цвета и вкуса. В стандартных атмосферных условиях плотность аргона составляет 1, 7839 кг/ м3. Примерно в ста миллилитрах обычной воды может раствориться около трех миллилитров аргона.
Температура кипения газа составляет минус 185 градусов по Цельсию, а температура плавления равна 189 градусам. У аргона имеется два химических соединения (HArF и CU(Ar)O). Эти соединения получаются при низкой минусовой температуре. Синтезируют аргон при помощи процедуры разделения воздуха на азот и кислород.
Применение газа
Аргон стоит довольно дешево и при этом он очень востребован в разнообразных промышленных сферах. Например, этот газ имеется в обычных лампах накаливания. Когда-то давно для этих целей использовался азот. Этот газ используется также в металлургической промышленности и в подобных смежных отраслях.
Плюс использования данного газа заключается в том, что он помогает не допустить вредный контакт металла с воздухом. Аргон используется в медицине. Он инертен, и это позволяет очищать инструменты, им также обрабатывают гидрокостюмы и используют как пропеллент для обычных аэрозольных упаковок.
В нашей компании вы можете купить аргон в баллонах с доставкой или самовывозом.
Меры безопасности
Аргон не взрывоопасен и не токсичен для человека. Но его высокая концентрация в воздухе может нанести вред человеку, так как может начаться кислородное голодание мозга, сопровождающееся потерей сознания и резкими головокружениями. Хоть аргон и не горючее вещество, но обращаться с ним надо аккуратно, так как при его нагревании повышается и его давление.
Контакт с жидкостью, содержащий аргон может вызвать серьезное обморожение конечностей. А при попадании аргона в глаза наступает потеря зрения, и появляются ожоги сетчатки. Поэтому при работе с аргоном следует обязательно носить защитную спецодежду и респираторы.
Следует помнить и о том, что аргон тяжелее воздуха в своем газообразном состоянии. И утечка газа из баллона может серьезно повлиять на физическое состояние человека. Обычно в промышленности при работе с аргоном используется шланговый противогаз или изолирующий прибор. Внимательно отслеживается уровень аргона в окружающем воздухе. По всем нормативам кислорода в помещении должно быть не менее девятнадцати процентов.
Аргон | Наука | Fandom
https://ru.wikipedia.org/wiki/%D0%90%D1%80%D0%B3%D0%BE%D0%BD
Арго́н — химический элемент с атомным номером 18. Третий по распространённости элемент в атмосфере — 0,93 % по объёму.
| Аргон(Ar) | |
|---|---|
| Атомный номер | 18 |
| Внешний вид | |
| Свойства атома | |
| Атомная масса (молярная масса) | 39,948 а. е. м. (г/моль) |
| Радиус атома | 2- пм |
| Энергия ионизации (первый электрон) | 1519,6(15,75) кДж/моль (эВ) |
| Электронная конфигурация | [Ne] 3s2 3p6 |
| Химические свойства | |
| Ковалентный радиус | 98 пм |
| Радиус иона | n/a пм |
| Электроотрицательность (по Полингу) | 0,0 |
| Электродный потенциал | 0 |
| Степени окисления | n/a |
| Термодинамические свойства | |
| Плотность | (при -186 °C)1,40 г/см³ |
| Удельная теплоёмкость | 0,138 Дж/(K·моль) |
| Теплопроводность | 0,0177 Вт/(м·K) |
| Температура плавления | 83,8 K |
| Теплота плавления | n/a кДж/моль |
| Температура кипения | 87,3 K |
| Теплота испарения | 6,52 кДж/моль |
| Молярный объём | 24,2 см³/моль |
| Кристаллическая решётка | |
| Структура решётки | кубическая гранецентрированая |
| Период решётки | 5,260 Å |
| Отношение c/a | n/a |
| Температура Дебая | 85,00 K |
К открытию аргона привело обнаруженное в 1892 году английским физиком Лордом Джоном Рэлеем небольшое (всего на 0,13 %) превышение плотности азота, выделяемого из воздуха, над плотностью «химического» азота, возникающего при термическом разложении нитрита аммония NH4NO2. Вместе с другим английским физиком Уильям Рамзаем, Лорд Джон Рэлей в 1894 году выделил из воздуха примесь более тяжёлого (по сравнению с азотом) газа, который отличался одноатомным составом молекул и практически полной химической недеятельностью. Известно единственное химическе соединение аргона HArF (Nature 406, 874, (2000)). Затем были открыты остальные инертные газы.
Происхождение названияПравить
Именно из-за своей удивительной химической инертности новый газ и получил своё название (греч. αργός — неактивный).
Аргон распространён в природе только в свободном виде. В земной коре его содержание составляет 1,2•10-4 %, в морской воде — 0,45•10-4 %. В атмосферном воздухе содержится 0,93 % аргона по объёму (9,34 л в 1м3). Это значительно больше, чем содержание в воздухе всех остальных инертных газов вместе взятых. Воздух служит неиссякаемым источником для получения аргона.
Обращает на себя внимание преобладание в смеси природных нуклидов аргона самого тяжёлого — аргона-40. Это связано с тем, что 40Ar постоянно образуется за счёт распада радиоактивного калия-40. В 1 т калия за год при радиоактивном распаде калия-40 путём захвата орбитального электрона (так называемый электронный захват, или К-захват; на этот тип радиоактивного распада калия-40 приходится 12 % от всех актов распада этого природного радионуклида) образуется всего около 3100 атомов аргона-40. Но калий — один из самых распространённых на Земле элементов, да и время, прошедшее за долгую историю Земли, исчисляется миллиардами лет. Поэтому 40Ar накопился в земной атмосфере в значительных количествах.
Преобладание тяжёлого аргона-40 в природной смеси изотопов этого элемента приводит к тому, что атомная масса элемента аргона оказывается немного выше, чем следующего за ним в периодической системе элемента калия. Однако, когда Менделеев создавал свою знаменитую таблицу, проблема, как разместить калий и аргон, у него не возникала, так как аргон был открыт спустя почти 30 лет после открытия периодического закона, и в таблицу (в группу, которой тогда присвоили номер ноль) попал только в начале 20-го века. В настоящее время аргон, как и другие инертные газы, включают в восьмую группу периодической системы элементов.
В промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот. При температуре -185,9°C аргон конденсируется, при -189,4°С — кристаллизуется.
Аргон — одноатомный газ с температурой кипения (при нормальном давлении) –185,9° C (немного ниже, чем у кислорода, но немного выше, чем у азота). В 100 мл воды при 20° C растворяется 3,3 мл аргона, в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде.
Как уже говорилось, химических соединений не образует. Однако со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина.
Аргон широко используют для создания инертной и за
особенности технологии и применение технического газа
Аргон является одним из наиболее распространенных химических элементов, представленных в атмосфере планеты Земля, занимая третье место после азота и кислорода. В то же время получение аргона – это ответственный и сложный с технологической точки зрения процесс, справиться с которым могут только настоящие профессионалы. Его особенность заключается в том, что в сфере промышленности этот инертный газ получают путем разделения воздуха на азот и O2.
Но есть и определенная сложность – температура кипения этого вещества находится между температурами кипения этих двух газов. Если быть более точным, то она менее чем на 3 градуса отличается от значения, при котором происходит закипание O2. Из-за этого разделить две фракции ректификационным методом невероятно сложно. Ведь Ar будет просто распределяться между другими веществами-компонентами воздуха, присоединяясь к кислороду в большинстве случаев.
Но широкое распространение Ar и его востребованность в самых различных сферах деятельности заставили человечество разрабатывать все более новые способы и технологические методы, позволяющие сделать процесс получения аргона более простым, удобным и эффективным. При этом многие из них связаны с получением технических газов, прошедших глубокую очистку (по теме особо чистых газообразных веществ вы можете прочитать наш отдельный материал).
Что представляет собой аргон?
Это одноатомный инертный газ, который не имеет какого-либо запаха, цвета и вкуса. Он является одним из основных компонентов воздуха, а также в больших количествах содержится в атмосфере нашей планеты. Температура его кипения составляет минус 185.9 градусов по Цельсию, при этом такая отметка находится очень близко от отметки кипения O2. Следует обратить внимание, что, находясь в воздухе в больших концентрациях, он может быть опасен для человека, так как вытесняет кислород и приводит к проявлению симптомов кислородного голодания.
Согласно государственным стандартам (ГОСТ) находящийся в газообразном состоянии Ar должен храниться и транспортироваться в специально предназначенных для этого газовых баллонах, сделанных с применением стального сплава. Чистое вещество должно находиться в емкостях, обладающих соответствующим окрасом и маркировкой – баллон серого цвета с зеленой надписью: «Аргон чистый».
В каких сферах его применяют?
С каждым годом Ar становится все более популярным и востребованным. Уникальный по своим свойствам инертный газ применяется в различных сферах деятельности человека, к которым можно отнести:
- Использование лазерного оборудования – он является обязательным элементом системы лазера.
- Производство источников света. В первую очередь к ним следует отнести классические лампы накаливания, внутреннее пространство которых заполняется Ar (в итоге это позволяет максимально повысить эксплуатационные характеристики такой лампочки).
- Изготовление пластиковых окон. Его используют для заполнения пространства внутри стеклопакета, что значительно увеличивает теплоизоляционные качества готовой оконной конструкции.
- Работу газовых систем для тушения пожаров. Одноатомный газ является одним из основных компонентов, используемых в огнетушительных установках (подробнее прочесть об использовании систем газового пожаротушения вы можете здесь).
- Применение в сфере пищевой промышленности. Здесь он встречается в качестве распространенной пищевой добавки, а также при создании особой среды или упаковки, позволяющей продлить срок службы различных продуктов питания.
Отдельно следует отметить аргоновую сварку – технологию, позволяющую выполнять работы по свариванию различных металлов и неметаллов. В этом случае Ar выступает в качестве основного компонента для создания специальной защитной среды, в том числе при применении метода дуговой, контактной или лазерной сварки. Сотрудникам автомобильных сервисов может быть интересна наша статья, которая посвящена сварке литых дисков с использованием аргоновой сварки.
Как получают аргон в промышленных условиях?
Отвечая на вопрос о том, как получают аргон, следует отметить, что это достаточно непростая задача. Чаще всего для этого применяют технологию низкотемпературной ректификации воздуха, в процессе которой происходит разделение воздуха на разные фракции – O2 и азот. При этом сам Ar добывают в качестве побочного продукта.
установка адсорбции
Суть технологии заключается в том, что при ректификации Ar улетучивается и поднимается вверх по колоне вслед за азотом. Под воздействием низких температур он превращается в конденсат и опускается вниз. После этого из аппарата отводят так называемую аргонную фракцию. Это смесь, основную часть которой составляет кислород, в то время как процент Ar в ней обычно не превышает 12% (также такая фракция может содержать до 0.5% азота).
генератор
Затем в процессе получения аргона фракцию снова подвергают ректификации по аналогичной технологии в результате чего получают «сырой аргон». Находясь в виде пара, он может содержать от 75% до 95% чистого вещества. После этого сырой продукт подвергают очистке путем введения в него H2 и специального катализатора, в результате чего содержащийся в смеси кислород затрачивается на окисление водорода.
схема сепарационной установки
Отечественные производители обычно предлагают Ar, в котором содержание чистого вещества варьируется в пределах от 99.9% до 99.99%. При этом существует еще и особо чистый газ, объем примесей в котором очень мал – не более 0.005% гелия и 0.001% O2.
Выводы о применении и получении аргона
Ar является одним из самых распространенных газов, который в то же время очень непросто получить в чистом виде. Его добывают несколькими способами, а впоследствии используют в различных сферах деятельности человека, в том числе на производстве, при проведении сварочных работ или в лазерных установках.
Если вы желаете купить Ar высокой степени очистки, то вы можете обратиться в компанию «ПРОМТЕХГАЗ». Для этого нужно пройти по ссылке http://www.propangaz.ru/?id=20. Специалисты компании не только расскажут вам о том, как получают аргон, но и предложат наиболее выгодную стоимость на него.
