Как варить чугун электросваркой | ММА сварка для начинающих
Как варить чугун электросваркой или сварка чугунаКак варить чугун электросваркой или сварка чугуна
Чугун — это особый сплав железа и углерода, который имеет температуру плавления гораздо меньше чем у стали. При всем этом, расплавленный чугун, очень быстро затвердевает, образуя на поверхности крупные поры из-за выделения газов. Вследствие этого, варить чугун электросваркой, непросто, поскольку нужно иметь не только специально предназначенные для этого электроды по чугуну, но и определённые знания.
Что касается электродов для сварки чугуна, то они имеют в составе обмазки особые компоненты, которых нет в рутиловых электродах. В состав электродной обмазки входят такие компоненты, как: термит, ферросилиций, алюминий, жидкое стекло, и, некоторые другие компоненты. Отличной альтернативой электродам для чугуна, являются графитовые электроды. Они позволяют варить чугун электросваркой, точно так же, как угольные и вольфрамовые электроды.
В отличие от сварки стали, сварка чугуна требует особой подготовки поверхности. Подготовка чугуна перед сваркой позволит не допустить появление многих дефектов. О том, как варить чугун электросваркой, будет рассказано в этой статье сайта mmasvarka.ru.
Подготовка чугуна к сварке
Чтобы сварить чугун его нужно должным образом подготовить. Свариваемые поверхности необходимо зачистить наждаком или болгаркой, можно использовать для этого и щетку по металлу. Для заваривания трещин в чугуне, дефектные места, также подвергаются особой подготовке.
В первую очередь, трещины необходимо немного расширить, делается это чаще всего механическим путём (вырубкой металла). Разделка трещин должна быть осуществлена, таким образом, чтобы дефект увеличился в разменах, не менее чем на 5 мм с обеих сторон. Концы трещин после разделки необходимо засверлить, чтобы остановить их дальнейшее распространение.
Электроды для сварки чугуна
Для того чтобы варить чугун электросваркой потребуются следующие виды электродов:
- Для сварки ковкого чугуна — электроды ЦЧ-4, ОЗЧ-2 и ОЗЧ-6 или электроды МНЧ-2;
- Для сварки серого чугуна, применяются электроды ОЗЧ-2, ОЗЧ-4 и ОЗЧ-6, ОЗЖН-1 и ОЗЖН-2, а также электроды МНЧ-2;
- Для сварки высокопрочного чугуна, можно использовать электроды МНЧ-2, ОЗЧ-3 или электроды ОЗЖН.

Варить чугун рекомендуется на малых токах и непрерывно. Сварка чугунных изделий угольными электродами, производится только на постоянных токах прямой полярности.
Как варить чугун электросваркой
Сварка чугуна электродами осуществляется за несколько этапов, включая этап подготовки свариваемых изделий.
Для того чтобы варить чугун в домашних условиях, потребуются следующие инструменты для сварки:
- Сварочный инвертор;
- Электроды, рекомендуется брать электроды не более 3 мм диаметром;
- Болгарка или щетка по металлу;
- Маска сварщика;
- Молоток для удаления шлака и проковки сварного шва.
Как и положено, сначала производится подготовка изделия. На данном этапе чугун зачищается, осуществляется распил трещин и других дефектов.
Затем следует нагревание чугунной детали и её сваривание. На данном этапе очень важно избежать не только перегрева поверхности, но и не допустить её резкого остывания. По этой причине, силу тока для сварки чугуна следует выбирать несколько меньших значений, чем при сварке стали.
На данном этапе очень важно избежать не только перегрева поверхности, но и не допустить её резкого остывания. По этой причине, силу тока для сварки чугуна следует выбирать несколько меньших значений, чем при сварке стали.
Для заваривания трещин в чугуне, как было сказано ранее, вести корневой шов нужно непрерывно, то есть, без колебаний. При всем этом, очень важно не перегревать околошовную зону, поскольку температура выше 80°С, является уже критической. Вследствие этого для заваривания чугуна подходит многопроходная сварка, когда сварочный шов наплавляется за несколько проходов.
Чтобы сварить чугун, сначала необходимо выполнить наплавку металла с краёв фаски, затем, по мере расплавления металла, заполнить им сварочный шов. Обязательно после каждого прохода необходимо не забывать, и делать «по горячему» проковку валика.
Еще статьи про сварку:Как варить чугун электродами и инверторной сваркой | Сварка и Пайка
Чугун — достаточно востребованный металл, из которого изготовлены многие приборы, начиная от сантехнических и заканчивая отопительными. Поэтому рано или поздно, но появляется острая необходимость заварить изделия из чугуна.
Поэтому рано или поздно, но появляется острая необходимость заварить изделия из чугуна.
Сварка чугуна в домашних условиях достаточно сложное мероприятие, которое помимо специальных расходных материалов, также потребует наличие кое-каких знаний. Нужно знать, какими электродами варить чугун, как подобрать сварочный ток, и как правильно подготовить чугунные изделия к свариванию.
Какие сложности при сварке чугуна возникают?
Главная трудность, с которой придётся столкнуться в процессе сварки чугуна, это появление трещин при резком нагревании и остывании заготовок. Чугун, достаточно хрупкий металл, поэтому он легко лопается.
Решить данную проблему можно, если чётко придерживаться определённой технологии сваривания чугуна.
Способы сварки чугуна
Существует несколько основных способов сварки чугуна. Чугун варят посредством горячей и полугорячей сварки, а также, соединяют холодной сваркой.
Чтобы варить чугун в домашних условиях при помощи электродов, потребуются специальные стержни по чугуну.
Какие электроды для сварки чугуна использовать
Электрод ЭМЧС — изготавливаются из проволоки с небольшим содержанием углерода и имеют тройную обмазку. Благодаря этому улучшается качество сварного шва, предотвращается сильное окисление металла. Электроды ЭМЧС применяются для сварки небольших чугунных заготовок при низкой температуре плавления.
Электроды ЦЧ-4 — не менее популярная марка электродов по чугуну. Благодаря многокомпонентному стержню, сварной шов получается прочным и ровным. Сварку данными электродами по чугуну можно осуществлять при любой температуре.
Электроды МНЧ-1 — хоть и достаточно дорогие электроды для сварки чугуна, но зато позволяют укрепить сварной шов и добиться его максимально пластичности.
Как варить чугун электродами
Поскольку чугун хрупкий металл, его нельзя сильно перегревать в процессе сваривания. Также важно не охлаждать слишком быстро сваренные заготовки, что может привести к появлению трещин и деформаций.
Также важно не охлаждать слишком быстро сваренные заготовки, что может привести к появлению трещин и деформаций.
При сваривании чугуна электродами следует придерживаться вот таких правил:
- Переключить инвертор в обратную полярность. Плюсовой вывод должен быть подключён к электроду, а минусовой, к свариваемому чугуну.
- Выставить самый маленький сварочный ток, который только допустим для какого-то конкретного диаметра электродов.
- Осуществляя сварку чугуна электродами нельзя слишком перегревать металл. Поэтому длина одного непрерывного шва не должна составлять более 3 см.
- Следует все время давать заготовке остыть, чтобы исключить перегрев металла.
Как видно, технология сварки чугуна достаточно сложная. Нужно знать, что и как делать, в какой именно последовательности. Обязательно первый и последний шов проковываются при помощи молотка, не применяя слишком большого усилия.
Вам также может понравиться:
#сварка #сварщик #как варить чугун #строительство #ремонт
Электроды для сварки чугуна
Чугун представляет собой сплав железа и углерода с добавлением примесей и легирующих добавок. Данный материал имеет широкое распространение во многих сферах. Сварка чугуна характеризуется несколькими особенностями, которые необходимо учитывать при проведении работ. В зависимости от структуры сплава выделяют белые и серые чугуны. Какие нужны электроды для сварки различных разновидностей чугуна, мы рассмотрим далее.
Подготовка чугуна к сварке
Основополагающим этапом для успешного проведения сварки является подготовка. Сваривать чугун необходимо после выполнения следующих операций:
- Трещины следует разделать, для этого используются механические и термические способы. Разделка способствует достаточной проварке дефекта.
- При работе с толстостенными деталями грамотная разделка кромок предотвратит перекалку изделия и гарантирует равномерный нагрев.

- Сваривание тонкого металла требует применение графитовых теплоотводящих подкладок, которые предотвратят прожиг и помогут сохранить первоначальную форму изделия.
- Заготовки перед осуществлением сварочного процесса нужно очистить от различного вида загрязнений: пыль, мусор, ржавчина.
- Массивные и тяжелые изделия необходимо зафиксировать с помощью прихваток, удерживающих всю конструкцию.
- В зависимости от выбранного способа сварки, изделие следует прогреть до необходимой температуры. Горячая сварка подразумевает предварительный нагрев заготовки до 600-650°С; полугорячая — до 400-450°С, холодная сварка не требует прогрева детали.
Какой нужен электрод, в зависимости от выбранной технологии, давайте рассмотрим далее.
Какие электроды используют для сварки чугуна
В данном разделе рассмотрим какими электродами можно заварить чугун.
1 Для выполнения работ по свариванию ответственных конструкций следует применять специальные электроды по чугуну. Для предотвращения образования трещин нужно осуществлять соединение горячим методом. Следует выделить наиболее популярные марки, которые применяются для сварки чугуна:
- медные стержни ОЗЧ-2 и ОЗЧ-6;
- никелевые прутки ОЗЧ-3, ОЗЧ-4, ОЗЖН-1;
- железно-медно-никелевые расходники МНЧ-2.
Некоторые марки электродов являются универсальным (МНЧ-2), другие предназначены для определенных видов работ и материалов.
Варить ковкий чугун рекомендуется с помощью электродов ОЗЧ-2, ОЗЧ-6, ЦЧ-4, МНЧ-2.
Варить литой чугун нужно электродами ОЗЧ-3, ОЗЖН-1 и ОЗЖН-2.
Для сварки серого чугуна подойдут электроды ОЗЧ-2, ОЗЧ-4, ОЗЧ-6, ОЗЖН, а также МНЧ-2.
Среди прутков иностранного производства следует выделить ОК 92.18, ZELLER 855. Первая марка предназначена для высокопрочного, серого и ковкого чугунов. Вторая используется для всех видов, сварка может выполняться в любом пространственном положении.
Каким электродом лучше варить чугун каждый сварщик сможет ответить самостоятельно после практического применения или теоретического сравнения.
2 Можно варить чугун и обычными электродами, которые также называют стальными или материалами общего назначения. Наиболее распространенными электродами подобного типа являются марки АНО, УОНИ и другие. Обычные расходники применяются при выполнении неответственных работ, при сваривании рядовых конструкций и в тех случаях, когда к металлу шва не предъявляются особые требования. Обусловлено это невысоким качеством металла шва.
Мы не советуем использовать не предназначенные для чугуна электроды, ввиду низкого качества сварного шва.
3 Для исправления дефектов в литых изделиях применяются чугунные электроды. Данные материалы представляют собой литые стержни с покрытием: МНЧ-1, ОЗБ-2М, ОЗЧ-1. Сварка с помощью перечисленных прутков может осуществляться холодным и полугорячим методами.
4 Неплавящиеся электроды: вольфрамовые, графитовые и угольные — используются достаточно редко. Их стоимость выше всех перечисленных расходников. Применение прутков подобных типов подразумевает наличие особых условий. Рабочий процесс характеризуется повышенным уровнем затрат: трудовых и финансовых. Кроме этого, во время сварки могут возникнуть определенные сложности. Наиболее распространенным способом сваривания с помощью неплавящихся электродов является AC TIG.
Какими электродами варить чугун со сталью
Потребность в соединении изделий из чугуна и стали возникает достаточно часто. Поэтому важно знать с помощью каких электродов следует проводить сваривание данных материалов различных по структуре. Варить сталь и чугун рекомендуется следующими марками:
Электроды ЦЧ-4 применяется при холодной, полугорячей и горячей технологиях. Предназначена для устранения дефектов и наплавки. Данная марка может применяться для наложения первого слоя, чтобы для наплавления последующих слоев можно было применить обычные прутки.
Электроды Ficast NiFe K и ZELLER 855 обеспечивают получение металла шва со схожими характеристиками: прочность; без трещин; легкая обрабатываемость.
Преимущества электродов ОК NIFE-CL-A (ОК 92.58): возможность выполнения сварки в любом положении; подходит для выполнения большого спектра работ.
Большой выбор сварочных электродов в Новокузнецке
8-950-587-78-68 8-909-511-21-45 Прайс
Электроды для сварки чугуна
| Марка | Производитель | Øмм |
|---|---|---|
| ЦЧ-4 | Томск, Омск, Москва. | 3, 4, 5 |
| ОЗЧ-2, ОЗЧ-6 | — | 3, 4, 5 |
| МНЧ-2 | — | 3, 4, 5 |
| ОЗЧ-3, ОЗЧ-4 | — | 3, 4 |
Как сварить металл с чугуном
Сваривание металла с чугуном очень частое явление в наше время. Многие люди применяют его при машиностроении, станкостроении, металлургической и других видах промышленности. До нашего времени чугун – это один из основных металлов, которые применяют при создании практически всех конструкций из металла. Чугунные изделия очень выгодны для своих хозяев, потому что имеют сравнительно невысокую стоимость, но имеют много преимуществ.
Чугун имеет способность приглушивать вибрацию, а также высокоизносоустойчив и имеет хорошие литейные свойства. По причине широкого применения чугун часто приходится сваривать с другими металлами. Сварка чугуна прочно засела в чугунно-литейном производстве. Он используется для ремонта оборудования на некоторых заводах, а также для того чтобы устранять некоторые дефекты чугунных отливок.
Швы, которые наложены на чугун могут быть, как долговечными так и не очень все зависит от того, какой тип электродов Вы выберите. В чугунных конструкций может быть множество дефектов из-за того что чугун является хрупким металлом. Так какими же все-таки электродами варить чугун?
В основном для сварки чугуна используются электроды ОЗЧ-2, ЦЧ-4, МНЧ-2, ОЗЧ-4 и другие. Электроды для сварки чугуна очень разнообразны, поэтому от правильного выбора электрода будет зависеть долговечность изделия. Для начала давайте узнаем немного подробнее об этих электродах. ЦЧ-4 предназначены для холодной и горячей сварки, а также для ремонтных наплавок, напаек и заварок дефектов литья.![]()
Электроды ОЗЧ-2, как и предыдущие, ЦЧ-4, предназначены для горячей или холодной сварки и заварки дефектов литья. Сваривание происходит в вертикальном, и нижнем положении шва с использованием постоянного тока обратной полярности. При использовании этих электродов лучше всего отдать предпочтение сварке тонкостенных конструкций.
Перед началом сваривания нужно подогреть изделие до температуры около 630 градусов по Цельсию. Сваривание нужно производить без остывания изделия, потому что на нем образуется трещина или излом. Лучше всего оставлять остывать изделие, плотно укрыв его любыми теплоизоляционным материалом. Однако для более качественного результата Вы можете воспользоваться печью, которую использовали для нагревания изделия до нужной температуры.
Многие умельцы в сфере сваривания пользуются и другими приемами при сварке чугуна с металлом, однако из этой статьи Вы узнали основной и самый лучший способ сварки. Самое главное – это то, что производить такое сваривание может даже новичок, а профессиональных сварщиков не так-то и много. В любом случае, независимо от того кто Вы: профессионал или новичок – сварка чугуна со сталью Вам по силам.
Какими электродами варить лучше | Выбор под задачу
Сварочный электрод представляет собой стержень относительно небольшого размера, который изготавливается из различных металлов и обладает электропроводными свойствами. Его основное назначение – подача тока во время сваривания. То, насколько качественным будет шов, во многом зависит от выбранного электрода. Учитывая, что существует достаточно большое количество разновидностей, возникает вопрос «какие электроды лучше для решения определенной задачи?»
Ключевые критерии выбора
Выбирая, каким электродом варить металл, нужно учитывать такие параметры:
-
Диаметр стержня.
 Подбирается в зависимости от толщины свариваемой конструкции. Самые тонкие стержни имеют диаметр 1,6 мм. Они предназначаются для соединения листов не толще 2 мм, тогда как стержни диаметром 5-6 мм позволяют сваривать листы толщиной до 13 мм.
Подбирается в зависимости от толщины свариваемой конструкции. Самые тонкие стержни имеют диаметр 1,6 мм. Они предназначаются для соединения листов не толще 2 мм, тогда как стержни диаметром 5-6 мм позволяют сваривать листы толщиной до 13 мм.
- Сила сварочного тока. Данный параметр рассчитывается таким образом, чтобы на каждый миллиметр стержня приходилось порядка 30-40 Ампер тока. Если сваривание производится в вертикальном положении, сила тока уменьшается на 15%.
-
Марка металла. Каждая из них имеет свой уникальный химический состав и физические свойства. Так, например, для работы с жароустойчивыми сталями нужно использовать электроды, обеспечивающие температуру порядка 1100°С.
Следует учесть, что сила сварочного тока не должна быть слишком низкой, поскольку это приведет к залипанию наконечника. Если же значения будут чрезмерно высокими, дуга будет хорошо гореть, однако таким образом поверхность материала можно прожечь. В таком режиме стержни, имеющие небольшой диаметр, сгорают очень быстро, не справляясь со своей задачей.
В таком режиме стержни, имеющие небольшой диаметр, сгорают очень быстро, не справляясь со своей задачей.
Важно и то, из каких компонентов состоит обмазка стержня. Как правило, их 6-12. При этом каждый компонент отвечает за создание среды, необходимой для образования прочных швов со стабильными характеристиками.
Основные из них:- слой целлюлозы – создает облако газа с восстанавливающим агентом;
- фторид кальция – делает оксиды железа более плавкими, а выделяемый газ стабилизирует процесс горения;
- карбонаты – отвечают за образование шлаков;
- ферроматериалы (Mg и Si) – раскисляют шов после сваривания;
- диоксид титана – позволяет шлаку затвердевать, что улучшает текучесть расплава;
- камедь с элементами глины – делает покрытие более прочным;
- железный порошок – улучшает качество шва путем выравнивания температуры.
Необходимо, чтобы материал электродов и тип свариваемых металлов совпадали по своим характеристикам.
Сварка углеродистых и низколегированных сталей
В данном случае основную роль играет материал покрытия электрода. Так, для сваривания кипящих марок стали (имеет низкое содержание углеродов и слабораскисленная) подходит любая обмазка. Чтобы сваривать полуспокойные стали, которые имеют большую толщину листов, требуется основное или рутиловое покрытие. При сваривании конструкций из спокойной стали при низких температурах или при динамических нагрузках, также используются электроды с основным покрытием.
Нестабильное горение дуги может ухудшить качество шва и не позволит нормально сваривать металлоконструкции с помощью переменного тока. Лучше всего дуга горит при наличии целлюлозного, кислого и рутилового покрытия. В таком случае можно пользоваться сварочными трансформаторами. Кроме того, нужно тщательно очистить свариваемые кромки от ржавчины, масла и грязи, дабы избежать образования пара.
Чем проводится сварка и наплавка чугуна
Процедура позволяет устранить дефекты в чугунных отливках, а также восстановить поврежденные и израсходовавшие эксплуатационный ресурс детали. В результате получается сталь, различные сплавы, в основе которых – медь, никель и т. д. Лучше всего с вышеописанной задачей справляются модели марок ЦЧ-4, ОЗЧ-2, ОЗЧ-6 и похожие. В отдельных случаях, например во время ремонта чугунных тюбингов при сильном загрязнении и высокой влажности целесообразно использовать марки ОЗЛ-25Б, ОЗЛ-27 и ОЗЛ-28.
В результате получается сталь, различные сплавы, в основе которых – медь, никель и т. д. Лучше всего с вышеописанной задачей справляются модели марок ЦЧ-4, ОЗЧ-2, ОЗЧ-6 и похожие. В отдельных случаях, например во время ремонта чугунных тюбингов при сильном загрязнении и высокой влажности целесообразно использовать марки ОЗЛ-25Б, ОЗЛ-27 и ОЗЛ-28.
Сварка цветных металлов
Каждый из этих металлов имеет свой порог плавления и физико-химические свойства. Так, например, интенсивная окисляемость не позволяет проводить сварку титана и его сплавов. В случае с алюминием, процесс усложняет окисная пленка, которая плавится при температуре 2060°С, а для того чтобы расплавить сам алюминий достаточно 660°С. Образовавшаяся из-за окиси пленка, может привести к нарушению целостности швов и снижению их прочности. Убирается она благодаря добавлению хлористых и фтористых солей щелочных и щелочно-земельных металлов.
Медь также имеет свои проблемы при сваривании – в шве под воздействием пузырьков газа (в особенности кислорода и водорода) образовываются поры. Во избежание этого медь должна быть хорошо раскисленной, а до начала сварки следует хорошо зачистить кромки. В свою очередь, бронза отличается высокой хрупкостью, а никель и его сплавы чувствительны к растворенным в сварочной ванне газам – азоту, кислороду и водороду. В результате этого процесса в металлоконструкции возникают горячие трещины и поры.
Во избежание этого медь должна быть хорошо раскисленной, а до начала сварки следует хорошо зачистить кромки. В свою очередь, бронза отличается высокой хрупкостью, а никель и его сплавы чувствительны к растворенным в сварочной ванне газам – азоту, кислороду и водороду. В результате этого процесса в металлоконструкции возникают горячие трещины и поры.
Резка металла
Резка металлоконструкций дугой применяется для установки и ремонта различных конструкций из металла. Она не отличается эффективностью, от нее не стоит ждать «красивого» шва, как и точного реза.
Тем не менее, такой способ резки не требует дополнительного оборудования и высококвалифицированных работников. Он легко осваивается новичком. Резка электродуговой сваркой часто применяют при обучении, в частности осваивании принципов работы с инвертором. Нередко подобный метод используют домашние мастера для недорогой резки металлов.
Сварка легированных сталей с повышенной теплоустойчивостью
Легированные теплоустойчивые стали свариваются специальными электродами, обеспечивающими определенную жаропрочность сварных соединений. Полученная конструкция должна выдерживать значительные механические нагрузки и высокие температуры.
Полученная конструкция должна выдерживать значительные механические нагрузки и высокие температуры.
Также минимизируется вероятность образования трещин при температурных перепадах. Так, при температурах до 475°С, используются модели из молибдена наподобие Э-09М, а при температурах до 540°С – модели с высоким содержанием хрома и молибдена (Э-09МХ, Э-09Х1М, Э-09Х2М1 и Э-05Х2М). В Э-10Х5МФ высокое содержание хрома, благодаря чему ими можно сваривать конструкции из стали с соответствующим химическим составом.
Какими электродами варить высоколегированную сталь
Такие стали, содержат 13% хрома и обладают антикоррозийными свойствами. В данном случае металлический шов должен быть устойчив к воздействию атмосферных осадков в слабо агрессивных средах, жаростойким (максимальная температура 650°С) и жаропрочным (максимальная температура 550°С).
Такими свойствами обладают модели типа Э-12Х13 марок ЛМЗ-1, АНВ-1 и т. п. Если же в стали пониженное содержание углерода и имеется легирование никелем предпочтение лучше отдать изделиям под индексом Э-06Х13Н. Если же нужно сварить листы стали, содержащие 25% хрома, лучше всего подойдут варианты типа Э-08Х24Н6ТАФМ, делающие готовый шов пластичным, ударопрочным и коррозиестойким.
Если же нужно сварить листы стали, содержащие 25% хрома, лучше всего подойдут варианты типа Э-08Х24Н6ТАФМ, делающие готовый шов пластичным, ударопрочным и коррозиестойким.
Сварки разнородных сталей и сплавов
Речь идет о сталях и сплавах, которые имеют уникальные физико-механические качества, химический состав, а также способность к свариваемости. Такие стали могут быть углеродистыми и легированными, высокопрочными, теплоустойчивыми, а также высоколегированными.
Сваривание сталей и сплавов с разнородной структурой также имеет ряд характерных особенностей. Чтобы избежать образования трещин, участков с неоднородной структурной в месте оплавления, а также чрезмерного роста остаточных напряжений используются модели наподобие АНЖР-1, ОЗЛ-27, НИАТ-5, ЭА-395/9, ОЗЛ-25Б, ИМЕТ-10 и ЦТ-28, обладающие специальными свойствами.
Совместимость со сварочным аппаратом
Выбирая, какими электродами варить сталь, необходимо учитывать не только тип материала, для которого они предназначены, но и особенности сварочного аппарата.
Помимо этого, у сварочных аппаратов есть ограничение по силе тока. Этот диапазон накладывает собственные рамки на использование электродов по диаметру. Как определить подходят ли расходные материалы? Достаточно взглянуть на таблицу ниже:
Получите 10 самых читаемых статей + подарок!
*
Подписаться
Как нужно варить чугун электросваркой?
Чугун относится к трудносвариваемым сплавам. Это обусловлено его склонностью к трещинообразованию при охлаждении после нагрева, образованию отбеленных зон с повышенной твердостью в результате выгорания кремния, резкому переходу из твердого состояния в жидкое. Поэтому выполняется преимущественно ремонтная сварка (устранение трещин и других дефектов), а возможна она только при условии использования специальных электродов и соблюдения некоторых рекомендаций.
Это обусловлено его склонностью к трещинообразованию при охлаждении после нагрева, образованию отбеленных зон с повышенной твердостью в результате выгорания кремния, резкому переходу из твердого состояния в жидкое. Поэтому выполняется преимущественно ремонтная сварка (устранение трещин и других дефектов), а возможна она только при условии использования специальных электродов и соблюдения некоторых рекомендаций.
Методы сварки чугуна
Варить сплав можно 2-мя методами:
- Горячий – выполняется предварительный подогрев детали до температуры 600-650 °C. Данный способ применяется только в промышленных условиях.
- Холодный – подходит для домашних условий. Главное – избегать перегрева и исключить быстрое охлаждение.
Для холодной электросварки чугуна применяются электроды:
- Стальные малоуглеродистые (УОНИ-13/45, АНО-4). В этом случае для увеличения прочности сварного соединения устанавливаются шпильки.
- Специальные – ОЗЧ-2 и ОЗЧ-6 (с содержанием железного порошка в составе покрытия), МНЧ-2 (состоят из никеля, меди и железа).
 ОЗЖН-1, ОЗЧ-3 и ОЗЧ-4 содержат до 90 % никеля.
ОЗЖН-1, ОЗЧ-3 и ОЗЧ-4 содержат до 90 % никеля. - Чугунные – ЦЧ-4. Этой маркой электродов можно варить даже чугун со сталью.
Можно самостоятельно изготовить железно-медные стержни – на обычные углеродистые (УОНИ-13/45 или АНО-4) наматывается по спирали медная (ни в коем случае не латунная, которая выделяет в атмосферу ядовитые вещества) проволока сечением до 2 мм.
Рекомендации по сварке чугунных изделий
Высокие требования выдвигаются к подготовке свариваемой поверхности:
- Дефекты удаляются механическим или ручным способом. Трещины рекомендуется разделать на всю глубину их залегания, а концы закруглить.
- Места сварки очищаются угловой шлифмашинкой от окалины и других посторонних включений.
- Масляные пятна с поверхности устраняются пламенем газокислородной горелки или с помощью растворителей.
Электросварка чугуна выполняется в нижнем положении из-за его повышенной жидкотекучести. Категорически запрещено принудительное охлаждение – ведет к образованию трещин. Варить нужно вразбежку отдельными валиками, не допуская перегрева. Чтобы предупредить вытекание металла, используются графитовые подложки.
Варить нужно вразбежку отдельными валиками, не допуская перегрева. Чтобы предупредить вытекание металла, используются графитовые подложки.
Также применяется метод отжигающих валиков – при наложении 2-го и последующих первые швы прогреваются повторно и остывают медленнее, что позволяет снизить степень отбеливания и получить более мягкий сплав.
При охлаждении в сварном соединении возникают напряжения, которые можно частично снять путем проковки швов после сварки. Удары наносятся молотком весом до 1,5 кг с закругленным бойком непосредственно по шву. Поскольку чаще всего при ремонте чугунных изделий производится многопроходная сварка, проковке подвергаются все валики кроме первого – из-за ударов в нем могут образоваться трещины.
Ремонтная сварка чугуна электродами по чугуну
В современном машиностроении, станкостроении, металлургической промышленности и т.п. до настоящего времени чугун является одним из основных конструкционных материалов. Простая и дешевая технология изготовления чугунных изделий, хорошие литейные свойства чугуна, его высокая износоустойчивость к концентраторам напряжений, способность гасить вибрацию благодаря своей структуре, хорошая обрабатываемость способствует его широкому применению в народном хозяйстве. Вместе с тем чугун не лишен отрицательных свойств — низкая прочность серого чугуна и практически полное отсутствие пластичности, обусловленное наличием в металлургической матрице структурно свободного графита.
Вместе с тем чугун не лишен отрицательных свойств — низкая прочность серого чугуна и практически полное отсутствие пластичности, обусловленное наличием в металлургической матрице структурно свободного графита.
Сварка спецэлектродами прочно заняла место в чугунно-литейном производстве, главным образом при ремонте вышедшего из строя оборудования и устранения дефектов чугунных отливок.
Качество сварных швов и наплавленных поверхностей во многом определяет работоспособность конструкций из чугуна и, в свою очередь, зависит от свойств сварочных материалов.
Многообразие дефектов по характеру и размерам, марок чугуна, конфигурации и массы чугунных изделий, их толщины и условий эксплуатации, а также требований к сварным соединениям вызывает необходимость выбора в каждом конкретном случае сварочных электродов по чугуну различных марок и технологии сварки чугунных изделий.
Ниже приведены ответы на вопросы, поступающие в консультационную службу ООО «Сатурн», касающиеся выбора электродов по чугуну и способов сварки чугуна специальными электродами.
Вопрос: Какие сварочные электроды для сварки чугуна и электроды по чугуну выпускаются
Ответ: В настоящее время выпускается целая гамма электродов для сварки чугуна на базе никеля и его сплавов, а также на основе меди и железа.
Электроды по чугуну ЦЧ-4 предназначены для холодной и горячей сварки, ремонтной наплавки и заварки дефектов литья в деталях из серого, высокопрочного и ковкого чугуна, а также сварки таких чугунов со сталью. Этими электродами можно осуществлять наплавку одного-двух слоев на изношенные чугунные детали под последующую наплавку специальными электродами сварочными. Сварка производится в нижнем положении шва постоянным током обратной полярности. В случаях обеспечения высокого напряжения (более 70 В) холостого хода сварочного трансформатора и малой длине сварочных кабелей — сварка переменным током.
Электроды по чугуну ОЗЧ-2 — предназначены для холодной сварки, наплавки и заварки дефектов литья в деталях из серого и ковкого чугуна. Сварку производят в нижнем и вертикальном положениях шва постоянным током обратной полярности. Электроды для сварки чугуна ОЗЧ-6 предназначены для холодной сварки деталей из серого и ковкого чугуна, предпочтительно при ремонте тонкостенных конструкций. Сварка производится в нижнем и вертикальном положениях шва постоянным током обратной полярности.
Сварку производят в нижнем и вертикальном положениях шва постоянным током обратной полярности. Электроды для сварки чугуна ОЗЧ-6 предназначены для холодной сварки деталей из серого и ковкого чугуна, предпочтительно при ремонте тонкостенных конструкций. Сварка производится в нижнем и вертикальном положениях шва постоянным током обратной полярности.
Электроды по чугуну МНЧ-2 предназначены для холодной сварки, наплавки и заварки дефектов литья в деталях из серого, высокопрочного и ковкого чугуна. Обеспечивают получение наплавленного металла с высокой плотностью и технологичностью при обработке резанием, когда к изделию предъявляют повышенные требования по чистоте поверхности после механической обработки, а также коррозионностойкого в жидкостных агрессивных средах и горячих газах. Сварку производят в нижнем, вертикальном и ограниченно потолочном положениях шва постоянным током обратной полярности.
Электроды для сварки чугуна — ОЗЖН-1 и электроды по чугуну ОЗЖН-2 предназначены для холодной сварки, наплавки и заварки дефектов литья в деталях из серого и высокопрочного чугуна. Применяются для многослойной заварки крупных дефектов или наплавки больших объемов металла совместно с электродами по чугуну марок ОЗЧ-3 или МНЧ-2, в следующей последовательности: электродами марки ОЗЧ-3 или МНЧ-2 выполняется первый и последний слои, промежуточные слои выполняются спецэлектродами марок ОЗЖН-1 или ОЗЖН-2. Сварку выполняют в нижнем и вертикальном положениях шва постоянным током обратной полярности.
Применяются для многослойной заварки крупных дефектов или наплавки больших объемов металла совместно с электродами по чугуну марок ОЗЧ-3 или МНЧ-2, в следующей последовательности: электродами марки ОЗЧ-3 или МНЧ-2 выполняется первый и последний слои, промежуточные слои выполняются спецэлектродами марок ОЗЖН-1 или ОЗЖН-2. Сварку выполняют в нижнем и вертикальном положениях шва постоянным током обратной полярности.
Электроды по чугуну ОЗЧ-4 предназначены для холодной сварки и наплавки деталей из серого и высокопрочного чугуна. Применяют для сварки и наплавки последних слоев поверхностей, когда к наплавленному слою предъявляются повышенные требования к износостойкости в условиях трения металла о металл, достаточной сопротивляемости ударам, высокой технологичности при обработке резанием. Сварку производят в нижнем и вертикальном положениях шва постоянным током обратной полярности.
Вопрос: Какими электродами для сварки чугуна можно заварить лопнувшую чугунную станину станка и другое подобное оборудование?
Ответ: Прежде всего, надо определить, в каких условиях это оборудование будет работать в дальнейшем. При значительных вибрационных и силовых нагрузках на станину сварку производят электродами по чугуну ЦЧ-4 с предварительным подогревом изделия до 600-650°С. кромки в месте излома или трещины следует разделать клейсместером или каким-либо другим инструментом. Разделка может быть односторонней при небольшой толщине изделия и двусторонней Х-образной при большой толщине. Сварку спецэлектродами производят, не давая изделию остыть до полной заварки излома или трещины. Охлаждение надо обеспечить медленное, желательно вместе с печью, в которой подогревалась деталь, если позволяют ее размеры, или укутав изделие теплоизоляционными материалами.
При значительных вибрационных и силовых нагрузках на станину сварку производят электродами по чугуну ЦЧ-4 с предварительным подогревом изделия до 600-650°С. кромки в месте излома или трещины следует разделать клейсместером или каким-либо другим инструментом. Разделка может быть односторонней при небольшой толщине изделия и двусторонней Х-образной при большой толщине. Сварку спецэлектродами производят, не давая изделию остыть до полной заварки излома или трещины. Охлаждение надо обеспечить медленное, желательно вместе с печью, в которой подогревалась деталь, если позволяют ее размеры, или укутав изделие теплоизоляционными материалами.
При незначительных нагрузках на станину можно применить электроды по чугуну марок МНЧ-2 или ОЗЧ-3. Сварку в этом случае производят «по-холодному», по разделанным и тщательно зачищенным кромкам небольшими валиками длиной 20-30 мм с охлаждением на воздухе каждого валика до температуры не выше 60°С и проковкой наложенного валика легкими ударами молотка.
Вопрос: Какими электродами можно произвести сварку чугунных водопроводных труб и заварить сколы и трещины радиаторов отопления?
Ответ: Следует отметить, что очень плохо сваривается чугун, долгое время находившийся под воздействием водяного пара или высоких температур. Для ремонта приходится принимать специальные меры. Иногда сварка вообще невозможна из-за сильного окисления внутренних поверхностей труб и радиаторов.
Новые и мало работавшие чугунные водопроводные трубы можно сваривать сварочными электродами МНЧ-2. Перед сваркой проводят обработку кромок труб (кос кромок под угол не менее 30°) резцом, фрезой или абразивным инструментом. Сварка должна выполняться при положительной температуре окружающего воздуха. При толщине стенки трубы до 5 мм выполняют сварку за один проход, небольшими валиками длиной 20-30 мм с охлаждением на воздухе каждого валика до температуры не выше 60°С. валики располагают по трубе диаметрально противоположно. Многослойную сварку труб с толщиной стенки более 5 мм выполняют небольшими валиками с охлаждением на воздухе каждого валика.
Многослойную сварку труб с толщиной стенки более 5 мм выполняют небольшими валиками с охлаждением на воздухе каждого валика.
Трещины и сколы на новых радиаторах отопления сваривают электродами по чугуну марки ОЗЧ-6. Место сварки зачищают от краски и ржавчины до чистого металла. Сварку производят короткими валиками длиной 30-50 мм в нижнем положении с охлаждением каждого валика на воздухе до температуры не выше 100°С и проковкой наложенного валика легкими ударами молотка.
Вопрос: Чем и как заварить трещину в чугунном корпусе редуктора?
Ответ: Корпуса редукторов изготавливаются из серого литьевого чугуна, и из-за особенностей структуры такого чугуна корпус долгое время работающего редуктора начинает «слезиться», т.е. структура чугуна пропитывается маслом, которым редуктор заполняется.
Трещину или скол в новом или мало работавшем редукторе можно заварить электродами для сварки чугуна ОЗЧ-6 или электроды по чугуну ОЗЧ-2. Перед сваркой кромки трещины или скола обрабатывают режущим или абразивным инструментом до чистого металла на всю длину трещины. Сварку электродом производят в нижнем положении на постоянном токе обратной полярности короткими валиками длиной не более 30-50 мм с50°С и проковкой каждого валика легкими ударами молотка. Диаметр электродов подбирают так, чтобы закончить сварку трещины за один проход.
Сварку электродом производят в нижнем положении на постоянном токе обратной полярности короткими валиками длиной не более 30-50 мм с50°С и проковкой каждого валика легкими ударами молотка. Диаметр электродов подбирают так, чтобы закончить сварку трещины за один проход.
Вопрос: Треснул выпускной чугунных коллектор автомобиля. Возможна ли заварка трещины?
Ответ: Выпускной коллектор автомобиля работает в условиях высоких температур и сильного загрязнения внутренней поверхности выхлопными газами. Через несколько лет эксплуатации автомобиля структура чугуна, из которого сделан коллектор, насыщается выхлопными газами, иногда до такой степени, что сварка становится невозможной.
В случае недолгой эксплуатации сварку можно производить электродами марки ОЗЛ-25Б. Перед сваркой тщательно осматривают поверхность коллектора, т.к. чаще всего растрескивание происходит сразу в нескольких местах. Затем зачищают поверхность вокруг выявленных трещин от нагара и грязи и проводят разделку кромок трещин фрезой или абразивным инструментом. Сварку производят на постоянном токе обратной полярности короткими валиками длиной 20-30 мм с проковкой каждого валика легкими ударами молотка и охлаждением наложенного валика до комнатной температуры. Важно не перегреть сварной шов, т.к. перегрев вызывает немедленное растрескивание в околошовной зоне. Сварку выполняют за один проход.
Сварку производят на постоянном токе обратной полярности короткими валиками длиной 20-30 мм с проковкой каждого валика легкими ударами молотка и охлаждением наложенного валика до комнатной температуры. Важно не перегреть сварной шов, т.к. перегрев вызывает немедленное растрескивание в околошовной зоне. Сварку выполняют за один проход.
Вопрос: Чем и как сварить чугун со сталью?
Ответ: Мы рекомендуем для сварки чугуна со сталью использовать электроды для сварки чугуна ЦЧ-4. Сварку производят -по очищенным от загрязнений кромкам на постоянном токе обратной полярности. Если сварочный трансформатор имеет напряжение холостого хода не более 70 В, возможна сварка переменным током. Если нет возможности провести подогрев свариваемых деталей до температуры 600-650°С перед сваркой и выполнить медленное охлаждение их после сварки, сварку ведут на холодном металле короткими валиками длиной 25-35 мм с поваликовым охлаждением на воздухе до температуры не выше 60°С. Эти марки для чугуна целесообразно применять и когда после сварки шов не подвергают обработке резанием.
Эти марки для чугуна целесообразно применять и когда после сварки шов не подвергают обработке резанием.
Для загрязненного чугуна и для получения обрабатываемого резанием шва применяют электроды по чугуну ОЗЛ-25Б. Сварку производят на постоянном токе обратной полярности во всех пространственных положениях короткими валиками длиной 20-30 мм с охлаждением каждого валика до температуры ниже 60°С на воздухе.
Вопрос: Каким образом можно восстановить изношенную поверхность детали из ковкого чугуна?
Ответ: В таких случаях целесообразно применение сварочных электродов для сварки чугуна марок ЦЧ-4 и ОЗЧ-4. Первые один-два слоя выполняют спецэлектродами ЦЧ-4, а последний -электродами ОЗЧ-4. Сварку электродами ЦЧ-4 производят валиками длиной до 100 мм с поваликовым охлаждением на воздухе до температуры не выше 60°С на постоянном токе обратной полярности. Электродами ОЗЧ-4 при наложении последнего слоя валики не должны быть длиннее 50 мм, охлаждение каждого валика на воздухе до температуры 50°С.
Все рассмотренные примеры сварки чугуна покрытыми электродами по чугуну позволяют производить мелкий и крупный ремонт оборудования по холодному металлу. Применение таких электродов для сварки чугуна обеспечивает достижение приемлемых компромиссных решений между технико-экономическими возможностями производства и требованиями, предъявляемыми к качеству восстановления
Вопрос: Умельцы сваривают чугун электродами, предназначенными для сварки сталей. Зачем использовать дорогостоящие марки для сварки чугуна?
Сварка чугуна марками для сталей – взамен электродов по чугуну наиболее доступный способ сварки. Однако в большинстве случаев он дает очень низкое качество сварного соединения и, как правило, сиюминутную выгоду. Почему столь доступный метод не приветствуется специалистами, очевидно из приведенных ниже фактов.
При сварке стальными электродами вследствие проплавленного чугуна содержание углерода в металле шва очень велико (1,1-1,8%). Это способствует образованию в шве трещин. Быстрое охлаждение, имеющее место при холодной сварке, приводит к значительному повышению твердости наплавленного металла и металла зоны термического влияния, где чугун приобретает структуру белого чугуна, характеризующегося высокой твердостью и хрупкостью. Места сварки, выполненные стальными марками вместо электродов по чугуну, не поддаются обработке режущим инструментом. В металле шва зачастую появляются поры из-за повышенного содержания газов в чугуне. Образование трещин и пор значительно снижает прочность и плотность сварного соединения.
Быстрое охлаждение, имеющее место при холодной сварке, приводит к значительному повышению твердости наплавленного металла и металла зоны термического влияния, где чугун приобретает структуру белого чугуна, характеризующегося высокой твердостью и хрупкостью. Места сварки, выполненные стальными марками вместо электродов по чугуну, не поддаются обработке режущим инструментом. В металле шва зачастую появляются поры из-за повышенного содержания газов в чугуне. Образование трещин и пор значительно снижает прочность и плотность сварного соединения.
Для улучшения качества сварного соединения чугуна применяют электроды малого диаметра и пониженную силу тока, чтобы уменьшить тепловое воздействие дуги на чугун. Сварку чугуна ведут короткими участками, вразброс, стараясь как можно меньше проплавлять чугун. С целью усиления связи наплавленного металла с чугуном при сварке деталей, требующих достаточной прочности сварных соединений, применяют стальные шпильки (ввертыши). Шпильки ввертывают в тело свариваемой чугунной детали. Выступающую часть шпилек обваривают по периметру, а затем сваривают со всей массой наплавленного металла.
Выступающую часть шпилек обваривают по периметру, а затем сваривают со всей массой наплавленного металла.
В отличие от сварки электродами по чугуну прочность металла, наплавленного стальными марками, примерно в два раза выше прочности чугуна. Поэтому толщина наплавленного металла должна составлять примерно 50% от толщины стенки детали в месте сварки. Излишнее количество наплавленного металла нежелательно, так как при этом увеличиваются усадочные напряжения и появляется опасность образования трещин.
Наилучшие результаты сварки чугуна получают при использовании марки УОНИ-13/55, вместо электродов для сварки чугуна. Но чрезмерный нагрев детали при сварке приводит к образованию трещин в зоне термического влияния. Поэтому при сварке не следует допускать нагрев свариваемой детали выше 40-500С на расстоянии 100 мм от шва.
Процесс сварки чугуна начинается с обварки шпилек кольцевыми швами. Обварка должна вестись вразброс с целью избежания сильного местного перегрева детали. После обварки всех шпилек накладывают кольцевые швы, пока вся поверхность завариваемого участка не будет покрыта слоем наплавленного металла. Крайние ряды шпилек обваривают лишь после того, как весь участок будет полностью заварен. Для обварки шпилек и нанесения облицовочного слоя следует применять электроды малого диаметра (2-2,5 мм), для окончательной заварки трещины можно использовать диаметр от 3 до 4 мм.
После обварки всех шпилек накладывают кольцевые швы, пока вся поверхность завариваемого участка не будет покрыта слоем наплавленного металла. Крайние ряды шпилек обваривают лишь после того, как весь участок будет полностью заварен. Для обварки шпилек и нанесения облицовочного слоя следует применять электроды малого диаметра (2-2,5 мм), для окончательной заварки трещины можно использовать диаметр от 3 до 4 мм.
Если оценить необходимые трудозатраты по подготовке к сварке и низкую вероятность получения качественного соединения, станет очевидным тот факт, что следует выбирать более дорогие, но более эффективные сварочные электроды по чугуну, например, ОЗЧ-4, МНЧ-2, электроды для сварки чугуна ОЗЖН-1.
Вопрос: Объясните, пожалуйста, сущность проковки чугунного металла шва. Каковы возможность и полезность этого технологического приема?
Сварочные напряжения, возникающие в чугунной конструкции в результате нагрева, могут быть сняты почти полностью, если в шве и зоне термического влияния создать дополнительные пластические деформации. Этого можно достичь проковкой швов. Проковку проводят в процессе остывания металла при температурах 4500С и выше, либо 1500С и ниже. В интервале температур 400-2000С в связи с пониженной пластичностью чугуна при его поковке возможно образование надрывов. Специальный нагрев сварного соединения чугуна для выполнения проковки, как правило, не требуется. Удары наносят вручную молотком массой 0,6-1,2 кг с закругленным бойком или пневматическим молотком с небольшим усилием до изменения рисунка шва. При многослойной сварке чугуна проковывают каждый слой, за исключением первого, в котором от удара могут возникнуть трещины, и облицовочного. Этот прием весьма эффективен для снятия напряжений при заварке трещин и замыкающих швов в жестких контурах деталей и узлов из конструкционных сталей и чугуна.
Этого можно достичь проковкой швов. Проковку проводят в процессе остывания металла при температурах 4500С и выше, либо 1500С и ниже. В интервале температур 400-2000С в связи с пониженной пластичностью чугуна при его поковке возможно образование надрывов. Специальный нагрев сварного соединения чугуна для выполнения проковки, как правило, не требуется. Удары наносят вручную молотком массой 0,6-1,2 кг с закругленным бойком или пневматическим молотком с небольшим усилием до изменения рисунка шва. При многослойной сварке чугуна проковывают каждый слой, за исключением первого, в котором от удара могут возникнуть трещины, и облицовочного. Этот прием весьма эффективен для снятия напряжений при заварке трещин и замыкающих швов в жестких контурах деталей и узлов из конструкционных сталей и чугуна.
Проковка сварного соединения способствует также повышению усталостной прочности конструкции.
Подавление 4-аминопиридином медленного Ca2 + -активированного тока K + в пирамидных нейронах CA1 гиппокампа крысы
Abstract
Влияние 4-аминопиридина (4-AP) на медленную постгиперполяризацию (sAHP), наблюдаемую после высокочастотной дендритной или соматическая активация была исследована на пирамидных нейронах СА1 гиппокампа крысы (ПК).
 Внутриклеточные записи были получены от дистальных апикальных дендритов и сомат, и для вызова сАГП использовались импульсы надпорогового деполяризующего тока.SAHP блокировался низкими концентрациями карбахолина (Cch), но нечувствителен к высоким концентрациям апамина.
Внутриклеточные записи были получены от дистальных апикальных дендритов и сомат, и для вызова сАГП использовались импульсы надпорогового деполяризующего тока.SAHP блокировался низкими концентрациями карбахолина (Cch), но нечувствителен к высоким концентрациям апамина.В присутствии внеклеточного 4-AP, первый вызванный дендритный sAHP был снижен по сравнению с максимальным sAHP, вызванным в отсутствие 4-AP. Снижение было очевидным при субмиллимолярной концентрации и увеличивалось примерно до 80% с 4 мМ 4-АР.
Стабильность блока, индуцированного 4-АР, зависела от типа аниона, используемого в растворе электрода.С электродами, содержащими K + ацетат (KAc) или K + метилсульфат (KMeSO 4 ), блок постепенно удалялся в течение первых 300-400 секунд записи. С электродами, содержащими KCl, блок оставался стабильным и был на 10% больше, чем полученный с ацетатом. Подробные исследования показали, что внутриклеточный ацетат способствует устранению индуцированного 4-AP блока в зависимости от активности.

Внутриклеточное введение 4-AP также индуцировало ацетат-чувствительный блок дендритного sAHP.
4-AP также блокировал соматический sAHP, и стабильность блока показывала ту же чувствительность к анионам, что и дендритный sAHP.
Таким образом, 4-AP, по-видимому, блокирует медленный Ca 2+ -активированный ток K + , лежащий в основе sAHP, сложным образом, что является чувствительным к определенным типам анионов.
Ключевые слова: 4-аминопиридин, Ca 2+ -активированный K + ток , sAHP, ацетат, MeSO 4 , хлорид, дендриты, пирамидные нейроны, CA1, гиппокамп
Введение
Большинство типы нейронов содержат большое количество различных типов токов K + , которые участвуют в регуляции многих аспектов поведения нейронов, таких как возбудимость мембраны, реполяризация потенциалов действия, частота возбуждения, высвобождение передатчика и действие передатчика (Halliwell, 1990; Буря, 1990). Кроме того, конкретный состав различных типов токов K + часто является одним из ключевых факторов при определении характеристик данного типа нейрона и, следовательно, в конечном итоге различных функциональных областей в центральной нервной системе. Поэтому важно изучить отдельные типы токов K + , чтобы получить больше информации об их кинетике, фармакологии и молекулярной структуре. Важным инструментом исследования ионных токов является использование химических соединений для избирательной активации или блокировки отдельных токов.Однако одна из проблем со многими соединениями, используемыми для блокирования токов K + , заключается в их общем отсутствии специфичности и различной активности в различных типах препаратов (Cook & Quast, 1990), что делает интерпретацию результатов, полученных с этими препаратами в лучшем случае сложно. Одной группой соединений, которые широко используются в качестве блокаторов тока K + , являются аминопиридины и, в частности, соединение 4-AP, которое вместе с тетраэтиламмонием является одним из наиболее часто используемых блокаторов каналов K + .
Кроме того, конкретный состав различных типов токов K + часто является одним из ключевых факторов при определении характеристик данного типа нейрона и, следовательно, в конечном итоге различных функциональных областей в центральной нервной системе. Поэтому важно изучить отдельные типы токов K + , чтобы получить больше информации об их кинетике, фармакологии и молекулярной структуре. Важным инструментом исследования ионных токов является использование химических соединений для избирательной активации или блокировки отдельных токов.Однако одна из проблем со многими соединениями, используемыми для блокирования токов K + , заключается в их общем отсутствии специфичности и различной активности в различных типах препаратов (Cook & Quast, 1990), что делает интерпретацию результатов, полученных с этими препаратами в лучшем случае сложно. Одной группой соединений, которые широко используются в качестве блокаторов тока K + , являются аминопиридины и, в частности, соединение 4-AP, которое вместе с тетраэтиламмонием является одним из наиболее часто используемых блокаторов каналов K + . Селективность и эффективность 4-AP сильно зависит от типа нейрона и исследуемого тока K + (Cook & Quast, 1990). В нейронах млекопитающих несколько типов потенциал-зависимых токов K + блокируются 4-AP, но с заметной разницей в чувствительности. При субмиллимолярной концентрации 4-AP в первую очередь блокирует быстро активирующий-неинактивирующий ток K + , называемый I D . В миллимолярной концентрации 4-AP также блокирует переходный ток K + , обозначаемый I A , а при концентрациях выше 5 мМ действует задержанный выпрямляющий ток K + (Storm, 1990).Что касается различных типов активированных Ca 2+ токов K + в нейронах, аминопиридины обычно не действуют или усиливают этот тип тока K + (Segal & Barker, 1986; Cook & Quast, 1990; Storm, 1990; Osmanovic & Shefner, 1993). Эффект усиления, скорее всего, является косвенным и вызван увеличением притока Ca 2+ во время обжига в результате либо блокирования вышеупомянутых зависимых от напряжения токов K + , либо прямого воздействия на высокопороговое зависящее от напряжения Ca 2 + токов (Сигал и Баркер, 1986).
Селективность и эффективность 4-AP сильно зависит от типа нейрона и исследуемого тока K + (Cook & Quast, 1990). В нейронах млекопитающих несколько типов потенциал-зависимых токов K + блокируются 4-AP, но с заметной разницей в чувствительности. При субмиллимолярной концентрации 4-AP в первую очередь блокирует быстро активирующий-неинактивирующий ток K + , называемый I D . В миллимолярной концентрации 4-AP также блокирует переходный ток K + , обозначаемый I A , а при концентрациях выше 5 мМ действует задержанный выпрямляющий ток K + (Storm, 1990).Что касается различных типов активированных Ca 2+ токов K + в нейронах, аминопиридины обычно не действуют или усиливают этот тип тока K + (Segal & Barker, 1986; Cook & Quast, 1990; Storm, 1990; Osmanovic & Shefner, 1993). Эффект усиления, скорее всего, является косвенным и вызван увеличением притока Ca 2+ во время обжига в результате либо блокирования вышеупомянутых зависимых от напряжения токов K + , либо прямого воздействия на высокопороговое зависящее от напряжения Ca 2 + токов (Сигал и Баркер, 1986). Однако существует несколько примеров активированных Ca 2+ токов K + , которые блокируются 4-AP. В магноцеллюлярных нейросекреторных клетках крысы кратковременный ток K + , активированный Ca 2+ , блокируется 4-AP с IC 50 около 1 мМ (Bourque, 1988). Также в нерабочих миометрических клетках беременных человека был описан ток K + , активированный Ca 2+ с высокой проводимостью, который блокируется 4-AP (0,1 — 1 мМ) (Khan et al ., 1997).
Однако существует несколько примеров активированных Ca 2+ токов K + , которые блокируются 4-AP. В магноцеллюлярных нейросекреторных клетках крысы кратковременный ток K + , активированный Ca 2+ , блокируется 4-AP с IC 50 около 1 мМ (Bourque, 1988). Также в нерабочих миометрических клетках беременных человека был описан ток K + , активированный Ca 2+ с высокой проводимостью, который блокируется 4-AP (0,1 — 1 мМ) (Khan et al ., 1997).
Как и во многих типах нейронов, ПК CA1 гиппокампа обладают медленным током K + , активированным Ca 2+ , который активируется притоком Ca 2+ во время соматического возбуждения. Этот ток отвечает за адаптацию частоты всплесков, наблюдаемую при высокочастотном возбуждении, а также за следующие sAHP (Lancaster & Adams, 1986; Storm, 1990). Сходный тип тока также наблюдается во внутриклеточных записях от апикальных дендритов CA1 PC (Andreasen & Lambert, 1995b). Настоящее исследование основано на предварительном наблюдении, что всякий раз, когда присутствовал 4-AP, амплитуда sAHP, опосредованного дендритным током K + , активированным Ca 2+ , была меньше, чем амплитуда sAHP, вызванного в отсутствие 4- AP. Это было неожиданно, учитывая выраженное увеличение притока Ca 2+ , наблюдаемое во время перфузии с 4-AP (Andreasen & Lambert, 1995a). Эти наблюдения позволили предположить, что 4-AP может оказывать неизвестное до сих пор действие на медленные токи K + , активированные Ca 2+ .Из-за важности 4-AP как инструмента в исследовании токов K + настоящее исследование было предпринято с целью детального изучения этого нового действия 4-AP. Представлены доказательства, которые показывают, что 4-AP действительно блокирует как дендритный, так и соматический медленный ток K + , активированный Ca 2+ , в зависимости от концентрации. Кроме того, исследование показало, что стабильность индуцированного 4-AP блока была чувствительна к внутриклеточному присутствию анионов ацетата или MeSO 4 .
Настоящее исследование основано на предварительном наблюдении, что всякий раз, когда присутствовал 4-AP, амплитуда sAHP, опосредованного дендритным током K + , активированным Ca 2+ , была меньше, чем амплитуда sAHP, вызванного в отсутствие 4- AP. Это было неожиданно, учитывая выраженное увеличение притока Ca 2+ , наблюдаемое во время перфузии с 4-AP (Andreasen & Lambert, 1995a). Эти наблюдения позволили предположить, что 4-AP может оказывать неизвестное до сих пор действие на медленные токи K + , активированные Ca 2+ .Из-за важности 4-AP как инструмента в исследовании токов K + настоящее исследование было предпринято с целью детального изучения этого нового действия 4-AP. Представлены доказательства, которые показывают, что 4-AP действительно блокирует как дендритный, так и соматический медленный ток K + , активированный Ca 2+ , в зависимости от концентрации. Кроме того, исследование показало, что стабильность индуцированного 4-AP блока была чувствительна к внутриклеточному присутствию анионов ацетата или MeSO 4 .
Методы
Подготовка срезов
Эксперименты проводили на срезах гиппокампа, полученных от 75 крыс-самцов линии Wistar (250-300 г). После анестезии хлороформом крысу декапитировали, мозг быстро удаляли и помещали в раствор Рингера с буфером HEPES (N- [2-гидроксиэтил] пиперазин-N ‘- [2-этансульфоновая кислота]) (см. Ниже) при 4 ° C. . Гиппокамп отделяли и разрезали срезы (толщиной 400 мкм) на измельчителе тканей McIlwain. Один срез был немедленно перенесен в записывающую камеру и помещен на сетку из нейлоновой сетки на границе раздела между теплым (31-33 ° C) стандартным раствором Рингера (см. Ниже) и теплым увлажненным карбогеном (95% O 2 и 5 % CO 2 ).Скорость перфузионного потока составляла 1 мл мин -1 . Перед началом записи срезу давали отдохнуть не менее 1 часа. Оставшиеся срезы помещали в забуференный раствор Рингера HEPES, барботировали карбогеном и хранили при комнатной температуре.
Электрофизиологические измерения и анализ данных
Внутриклеточные записи с ПК CA1 были сделаны с использованием микроэлектродов из боросиликатного стекла (внешний диаметр 1,2 мм, Clark Electromedical), заполненных KMeSO 4 (2 M), KAc (2-4 M), KCl ( 2 — 3 M) или различные комбинации KAc и KCl. В некоторых экспериментах 4-AP (50 — 250 мМ) применяли внутриклеточно, растворенным в 4 M KAc. Во всех случаях сопротивление наконечника составляло 60–90 МОм. Проникновения дистальных апикальных дендритов были сделаны на расстоянии не менее 250 мкм от поверхностной границы пирамидального слоя, и записи были идентифицированы как дендритные на основании их сходства с теми, о которых сообщалось ранее по гистохимически подтвержденным записям дендритов (Andreasen & Lambert, 1995a). Проникновения принимались для анализа, если мембранный потенциал покоя (RMP) был стабильным и был более отрицательным, чем -50 мВ, а входное сопротивление мембраны (R в ) было ≥10 МОм.
В некоторых экспериментах 4-AP (50 — 250 мМ) применяли внутриклеточно, растворенным в 4 M KAc. Во всех случаях сопротивление наконечника составляло 60–90 МОм. Проникновения дистальных апикальных дендритов были сделаны на расстоянии не менее 250 мкм от поверхностной границы пирамидального слоя, и записи были идентифицированы как дендритные на основании их сходства с теми, о которых сообщалось ранее по гистохимически подтвержденным записям дендритов (Andreasen & Lambert, 1995a). Проникновения принимались для анализа, если мембранный потенциал покоя (RMP) был стабильным и был более отрицательным, чем -50 мВ, а входное сопротивление мембраны (R в ) было ≥10 МОм.
Использовались обычные методы записи с использованием усилителя с высоким входным сопротивлением (Axoclamp 2A, Axon Instruments Inc.) с устройствами балансировки моста и ввода тока. Результаты были оцифрованы в режиме онлайн с использованием аналого-цифрового преобразователя Labmaster и программного обеспечения для сбора данных pCLAMP (Axon Instruments Inc. ) и записаны для автономного анализа с использованием модифицированного цифрового аудиопроцессора (Sony PCM-701es) и видеомагнитофона. Если не указано иное, импульсная парадигма, используемая для вызова sAHP, состояла из начального короткого гиперполяризующего импульса тока (интенсивность: -0.3 нА, длительность: 50 мс) с последующим надпороговым импульсом деполяризующего тока (длительность: 50 или 300 мс). Парадигма импульсов повторялась со стандартной частотой 0,1 Гц. Целью начального импульса гиперполяризующего тока было обеспечение адекватного баланса моста и отслеживание изменений R в во время экспериментов. В контрольных условиях сначала определялась взаимосвязь между амплитудой sAHP и силой тока и, исходя из этого, интенсивность (в диапазоне от 1 до 1.6 нА), что обеспечивало максимальную активацию sAHP. В присутствии 4-AP, который значительно увеличивает возбудимость дистальных апикальных дендритов (Andreasen & Lambert, 1995a), использовалась фиксированная интенсивность 0,6 нА, которая достоверно вызывала заметный выброс соединения во всех протестированных дендритах.
) и записаны для автономного анализа с использованием модифицированного цифрового аудиопроцессора (Sony PCM-701es) и видеомагнитофона. Если не указано иное, импульсная парадигма, используемая для вызова sAHP, состояла из начального короткого гиперполяризующего импульса тока (интенсивность: -0.3 нА, длительность: 50 мс) с последующим надпороговым импульсом деполяризующего тока (длительность: 50 или 300 мс). Парадигма импульсов повторялась со стандартной частотой 0,1 Гц. Целью начального импульса гиперполяризующего тока было обеспечение адекватного баланса моста и отслеживание изменений R в во время экспериментов. В контрольных условиях сначала определялась взаимосвязь между амплитудой sAHP и силой тока и, исходя из этого, интенсивность (в диапазоне от 1 до 1.6 нА), что обеспечивало максимальную активацию sAHP. В присутствии 4-AP, который значительно увеличивает возбудимость дистальных апикальных дендритов (Andreasen & Lambert, 1995a), использовалась фиксированная интенсивность 0,6 нА, которая достоверно вызывала заметный выброс соединения во всех протестированных дендритах. Составной пикинг определяется как всплеск, состоящий из начального быстрого, зависимого от Na + пика, за которым следует один или несколько вторичных медленных пиков переменной амплитуды, активируемых Ca 2+ (Andreasen & Lambert, 1995a).Пример составного пика показан на.
Составной пикинг определяется как всплеск, состоящий из начального быстрого, зависимого от Na + пика, за которым следует один или несколько вторичных медленных пиков переменной амплитуды, активируемых Ca 2+ (Andreasen & Lambert, 1995a).Пример составного пика показан на.
Влияние внеклеточного 4-AP на дендритный sAHP. (Aa) Дендритные реакции на два деполяризующих импульса тока (интенсивность: 0,6 и 1,4 нА; 300 мс). (Ab) Начальный кластер всплесков на (Aa) показан в увеличенном масштабе времени. Обратите внимание на наличие сложных пиков (отмеченных *) при высокой интенсивности стимуляции. (B) Дендритный ответ на импульс деполяризующего тока (1,2 нА) до и после 8 мин перфузии карбахолином (Cch, 1 мкМ).Обратите внимание, что как sAHP (dep) , так и sAHP блокируются Cch, тогда как начальный быстрый компонент постимпульсной после гиперполяризации не изменяется. (C) В присутствии 4-AP (4 мМ) деполяризующий импульс тока (интенсивность: 0,6 нА; 300 мс) первоначально вызывал повторяющееся срабатывание соединения с последующим небольшим sAHP. Повторная стимуляция приводила к прогрессивному увеличению как sAHP (dep) , так и sAHP. Импульсу деполяризующего тока предшествует небольшой импульс гиперполяризующего тока (интенсивность: -0.3 нА, 50 мс). Цифры после каждой кривой на этом и следующих рисунках указывают время, в которое был вызван ответ. (D) Усредненное изменение амплитуды sAHP, вызванных в отсутствие или в присутствии 4-AP (4 мМ). Каждая точка представляет собой среднее значение ± стандартное отклонение. ( n равно 10 и 6 в отсутствие и в присутствии 4-AP соответственно). RMP: (A) -73 мВ; (B) -65 мВ; (C) -68 мВ.
Повторная стимуляция приводила к прогрессивному увеличению как sAHP (dep) , так и sAHP. Импульсу деполяризующего тока предшествует небольшой импульс гиперполяризующего тока (интенсивность: -0.3 нА, 50 мс). Цифры после каждой кривой на этом и следующих рисунках указывают время, в которое был вызван ответ. (D) Усредненное изменение амплитуды sAHP, вызванных в отсутствие или в присутствии 4-AP (4 мМ). Каждая точка представляет собой среднее значение ± стандартное отклонение. ( n равно 10 и 6 в отсутствие и в присутствии 4-AP соответственно). RMP: (A) -73 мВ; (B) -65 мВ; (C) -68 мВ.
Амплитуда sAHP была рассчитана как разность между предымпульсным мембранным потенциалом (V m ), измеренным непосредственно перед импульсом деполяризующего тока, и постимпульсным V m , измеренным через 150 мс после импульса тока. (видеть ).Причина выбора постимпульсной задержки в 150 мс заключалась в том, чтобы минимизировать загрязнение от начального быстрого компонента постимпульсной постгиперполяризации, которое длится около 50 мс (Andreasen & Lambert, 1995b). Все анализы были выполнены с использованием программного обеспечения pCLAMP. Для экспоненциальной подгонки данных использовалась моноэкспоненциальная функция со следующим выражением:
Все анализы были выполнены с использованием программного обеспечения pCLAMP. Для экспоненциальной подгонки данных использовалась моноэкспоненциальная функция со следующим выражением:
где y o — амплитуда при t , равная нулю, y — амплитуда в момент времени t , a определяется как y max −y o (y max — максимальная амплитуда) и τ постоянная времени.Экспоненциальная аппроксимация была выполнена с использованием Sigmaplot (SPSS Inc.). Значения даны как среднее ± s.e.m. если не указано иное. Данные были статистически оценены с использованием парного теста Стьюдента t и считались значимыми при P ≤0,05.
Лекарства и растворы
Состав забуференного HEPES раствора Рингера (в мМ): NaCl 120, KCl 2,00, KH 2 PO 4 1,25, NaHCO 3 20, кислота HEPES 6,6, соль HEPES 2,6, CaCl 2 2, MgSO 4 2, D-глюкоза 10; барботировали карбоген (pH 7. 4). Состав стандартного раствора Рингера (в мМ): NaCl 124, KCl 3,25, NaH 2 PO 4 1,25, NaHCO 3 20, CaCl 2 2, MgSO 4 2, D-глюкоза. 10, барботировали карбогеном (pH 7,3). Все эксперименты проводились в присутствии DL-2-амино-5-фосфоновалериановой кислоты (AP5, 50 мкМ), 6-циано-7-нитрохиноксалин-2,3-диона (CNQX, 10 мкМ), метобромида бикукуллина (BIC, 10 мкМ) и CGP 55845A (2 мкМ) для блокирования рецепторов N-метил-D-аспартата (NMDA), не-NMDA, γ-аминомасляной кислоты (ГАМК) A и GABA B соответственно.Если не указано иное, 4-AP перфузировали в течение не менее 30 минут до начала записи, чтобы стабилизировать эффекты 4-AP.
4). Состав стандартного раствора Рингера (в мМ): NaCl 124, KCl 3,25, NaH 2 PO 4 1,25, NaHCO 3 20, CaCl 2 2, MgSO 4 2, D-глюкоза. 10, барботировали карбогеном (pH 7,3). Все эксперименты проводились в присутствии DL-2-амино-5-фосфоновалериановой кислоты (AP5, 50 мкМ), 6-циано-7-нитрохиноксалин-2,3-диона (CNQX, 10 мкМ), метобромида бикукуллина (BIC, 10 мкМ) и CGP 55845A (2 мкМ) для блокирования рецепторов N-метил-D-аспартата (NMDA), не-NMDA, γ-аминомасляной кислоты (ГАМК) A и GABA B соответственно.Если не указано иное, 4-AP перфузировали в течение не менее 30 минут до начала записи, чтобы стабилизировать эффекты 4-AP.
Все фармакологические соединения готовили в водных исходных растворах, концентрация которых в 100–1000 раз превышала требуемую конечную концентрацию, и при необходимости разбавляли стандартным раствором Рингера. 4-AP, BIC и Cch были приобретены у Sigma, AP5 и CNQX у Tocris, ацетат натрия был приобретен у Merck, апамин был приобретен у Alomone Labs, а CGP 55845A был любезно предоставлен Novartis.
Результаты
Пассивные мембранные свойства пирамидных нейронов CA1
Представленные здесь данные основаны на 190 интрадендритных и 14 интрасоматических записях с ПК CA1. Из 190 внутридендритных записей 151 была выполнена с помощью KAc-содержащих электродов со средним RMP -66,5 ± 0,3 мВ и средним R в 30 ± 0,7 МОм. Тридцать четыре записи были выполнены с электродами, содержащими KCl, со средним RMP -66,8 ± 0,6 мВ и средним R в из 39.8 ± 2,2 МОм. Остальные пять записей были выполнены с помощью KMeSO 4 , содержащего электроды со средним RMP -67 ± 2 мВ и средним R в 47,8 ± 6,9 МОм. Не было значительной разницы в RMP между тремя группами, но R в был значительно выше ( P <0,001) при использовании электродов, содержащих KCl и KMeSO 4 . Девять интрасоматических записей были выполнены с электродами, содержащими KAc, со средним RMP -66,1 ± 0,8 мВ и средним R в из 40.8 ± 2,2 МОм. Остальные записи были выполнены с электродами, содержащими KCl, со средним RMP -65,8 ± 1,5 мВ и средним R в 50,6 ± 5,2 МОм. Между двумя группами не было значительной разницы.
Остальные записи были выполнены с электродами, содержащими KCl, со средним RMP -65,8 ± 1,5 мВ и средним R в 50,6 ± 5,2 МОм. Между двумя группами не было значительной разницы.
Влияние внеклеточного 4-AP на медленную дендритную постгиперполяризацию
В присутствии CNQX (10 мкМ), AP5 (50 мкМ), BIC (10 мкМ) и CGP 55845A (2 мкМ), которые составляют контрольную среду , надпороговая деполяризация дендритной мембраны вызвала сложный ответ, состоящий из начального кластера шипов, за которым следует медленная гиперполяризация (sAHP (dep) ,).После окончания импульса тока мембрана на несколько секунд гиперполяризуется относительно RMP (). Эта постимпульсная постгиперполяризация часто имела начальную фазу быстрого затухания, за которой следовала длительная фаза медленного затухания (sAHP,). Размер sAHP (dep) и постимпульсный sAHP зависит от количества, частоты и типа всплесков, вызванных во время текущего импульса, и особенно ярко выражен, когда присутствуют всплески Ca 2+ , как в сложных всплесках ( ). Как проиллюстрировано в, существует тесная корреляция между размером sAHP (dep) и размером sAHP, что указывает на то, что sAHP возникает из-за продолжающейся активации того же медленного Ca 2+ -активированного K + , который вызывает sAHP (dep) (Andreasen & Lambert, 1995b).Как sAHP (dep) , так и sAHP блокируются низкими концентрациями карбахолина (, n = 4), указывая на то, что медленный дендритный ток K + , активированный дендритным Ca 2+ , аналогичен току, опосредующему соответствующий соматический sAHP (Lancaster & Nicoll, 1987; Stocker et al ., 1999).
Как проиллюстрировано в, существует тесная корреляция между размером sAHP (dep) и размером sAHP, что указывает на то, что sAHP возникает из-за продолжающейся активации того же медленного Ca 2+ -активированного K + , который вызывает sAHP (dep) (Andreasen & Lambert, 1995b).Как sAHP (dep) , так и sAHP блокируются низкими концентрациями карбахолина (, n = 4), указывая на то, что медленный дендритный ток K + , активированный дендритным Ca 2+ , аналогичен току, опосредующему соответствующий соматический sAHP (Lancaster & Nicoll, 1987; Stocker et al ., 1999).
Как сообщалось ранее (Andreasen & Lambert, 1995a), присутствие 4-AP (4 мМ) приводило к повторяющемуся срабатыванию сложных спайков во время деполяризующего импульса тока ().В контрольной среде добавление соединений всегда было связано с очень выраженным sAHP (). Однако в присутствии 4-АР (4 мМ) как sAHP (dep) , так и постимпульсный sAHP были изначально очень маленькими или даже отсутствовали, несмотря на выраженный выброс соединения (). В 75% (6/8) экспериментов, проведенных в присутствии 4-AP, повторная активация с частотой 0,1 Гц приводила к прогрессивному увеличению размера sAHP (dep) и sAHP с сопутствующим уменьшением срабатывание во время текущего импульса ().В остальных 25% экспериментов sAHP (dep) и sAHP были заблокированы в течение всего периода регистрации (300 — 400 с). В то время как V m оставался постоянным во время записи, R в часто уменьшался после первых нескольких стимуляций, как показано на. Однако не было корреляции между изменением R в и постепенным увеличением sAHP (dep) и sAHP. В среднем средняя амплитуда первого sAHP, вызванного в присутствии 4 мМ 4-AP, составляла 1.4 ± 0,4 мВ ( n = 6,), что было значительно ( P <0,001) меньше максимальной амплитуды sAHP, вызванных в отсутствие 4-AP (7,22 ± 0,8 мВ, n = 10). Кроме того, в течение первых 450 секунд регистрации sAHP, вызванные в контрольной среде, показали небольшое снижение до среднего значения 5,7 ± 0,7 мВ ( n = 6), которое, однако, было незначительным.
В 75% (6/8) экспериментов, проведенных в присутствии 4-AP, повторная активация с частотой 0,1 Гц приводила к прогрессивному увеличению размера sAHP (dep) и sAHP с сопутствующим уменьшением срабатывание во время текущего импульса ().В остальных 25% экспериментов sAHP (dep) и sAHP были заблокированы в течение всего периода регистрации (300 — 400 с). В то время как V m оставался постоянным во время записи, R в часто уменьшался после первых нескольких стимуляций, как показано на. Однако не было корреляции между изменением R в и постепенным увеличением sAHP (dep) и sAHP. В среднем средняя амплитуда первого sAHP, вызванного в присутствии 4 мМ 4-AP, составляла 1.4 ± 0,4 мВ ( n = 6,), что было значительно ( P <0,001) меньше максимальной амплитуды sAHP, вызванных в отсутствие 4-AP (7,22 ± 0,8 мВ, n = 10). Кроме того, в течение первых 450 секунд регистрации sAHP, вызванные в контрольной среде, показали небольшое снижение до среднего значения 5,7 ± 0,7 мВ ( n = 6), которое, однако, было незначительным. Однако в присутствии 4-AP sAHP прогрессивно увеличивался до максимального значения плато 10,1 ± 2.2 мВ после 350 с записи, после чего следует небольшой выброс (). Что касается первого sAHP, вызванного в контрольной среде, первый sAHP, вызванный в присутствии 4-AP, снижался в зависимости от концентрации, как показано на. Здесь усредненная амплитуда первого sAHP, вызванного в контрольной среде, была установлена на 100%. В присутствии 0,25 и 0,5 мМ 4-АР амплитуда исходной sAHP снижалась до 82,8 ± 3,7% и 80,7 ± 6,7% соответственно, что не было значимым ( P > 0.05). Однако при 2, 4 и 8 мМ амплитуда первого sAHP была значительно ( P <0,001) снижена до 56 ± 6,7%, 19,4 ± 5,8% и 6,1 ± 6,25% соответственно от sAHP, вызванных в контрольная среда. На фиг.1 изображена средняя амплитуда sAHP, зарегистрированных в отсутствие или в присутствии различных концентраций 4-AP, в зависимости от времени записи. Данные, собранные в отсутствие 4-AP, были усреднены (90 · 105 n 90 · 106 = 10) и нормализованы по отношению к первому вызванному sAHP.
Однако в присутствии 4-AP sAHP прогрессивно увеличивался до максимального значения плато 10,1 ± 2.2 мВ после 350 с записи, после чего следует небольшой выброс (). Что касается первого sAHP, вызванного в контрольной среде, первый sAHP, вызванный в присутствии 4-AP, снижался в зависимости от концентрации, как показано на. Здесь усредненная амплитуда первого sAHP, вызванного в контрольной среде, была установлена на 100%. В присутствии 0,25 и 0,5 мМ 4-АР амплитуда исходной sAHP снижалась до 82,8 ± 3,7% и 80,7 ± 6,7% соответственно, что не было значимым ( P > 0.05). Однако при 2, 4 и 8 мМ амплитуда первого sAHP была значительно ( P <0,001) снижена до 56 ± 6,7%, 19,4 ± 5,8% и 6,1 ± 6,25% соответственно от sAHP, вызванных в контрольная среда. На фиг.1 изображена средняя амплитуда sAHP, зарегистрированных в отсутствие или в присутствии различных концентраций 4-AP, в зависимости от времени записи. Данные, собранные в отсутствие 4-AP, были усреднены (90 · 105 n 90 · 106 = 10) и нормализованы по отношению к первому вызванному sAHP. Для компенсации вышеупомянутого истощения данные, собранные в присутствии 4-AP, были усреднены ( n от 8 до 5) и нормализованы по отношению к sAHP, записанным на контрольном носителе в соответствующее время записи.Временной ход начального увеличения sAHP был адекватно описан моноэкспоненциальной функцией (см. Методы), дающей следующие постоянные времени: 46,0 с (0,25 мМ), 60,2 с (2 мМ), 136,9 с (4 мМ) и 62,1 с. (8 мМ). За исключением постоянной времени 4 мМ 4-АР, эти результаты показывают, что динамика начального увеличения не зависит от концентрации. Причина большей постоянной времени в присутствии 4 мМ 4-AP в настоящий момент не очевидна. В присутствии 4-AP, вплоть до 4 мМ, амплитуда sAHP достигала аналогичного максимального плато примерно на 40-50% больше, чем амплитуда sAHP, вызванная в отсутствие 4-AP.В присутствии 8 мМ плато было несколько ниже, но все же выше, чем у контрольной среды после 300 с записи (). Большая амплитуда, достигаемая в присутствии 4-AP, вероятно, связана с увеличением пиков соединения.
Для компенсации вышеупомянутого истощения данные, собранные в присутствии 4-AP, были усреднены ( n от 8 до 5) и нормализованы по отношению к sAHP, записанным на контрольном носителе в соответствующее время записи.Временной ход начального увеличения sAHP был адекватно описан моноэкспоненциальной функцией (см. Методы), дающей следующие постоянные времени: 46,0 с (0,25 мМ), 60,2 с (2 мМ), 136,9 с (4 мМ) и 62,1 с. (8 мМ). За исключением постоянной времени 4 мМ 4-АР, эти результаты показывают, что динамика начального увеличения не зависит от концентрации. Причина большей постоянной времени в присутствии 4 мМ 4-AP в настоящий момент не очевидна. В присутствии 4-AP, вплоть до 4 мМ, амплитуда sAHP достигала аналогичного максимального плато примерно на 40-50% больше, чем амплитуда sAHP, вызванная в отсутствие 4-AP.В присутствии 8 мМ плато было несколько ниже, но все же выше, чем у контрольной среды после 300 с записи (). Большая амплитуда, достигаемая в присутствии 4-AP, вероятно, связана с увеличением пиков соединения. Эти результаты показывают, что 4-AP блокирует ток, лежащий в основе sAHP (dep) и sAHP в зависимости от концентрации, и что блок снимается в течение начальных 300-400 секунд стимуляции.
Эти результаты показывают, что 4-AP блокирует ток, лежащий в основе sAHP (dep) и sAHP в зависимости от концентрации, и что блок снимается в течение начальных 300-400 секунд стимуляции.
Эффект 4-AP зависит от концентрации и активности.(A) 4-AP-индуцированное снижение амплитуды первого вызванного sAHP. Здесь все данные (среднее ± стандартное отклонение, n указано в скобках над каждой полосой) были нормализованы по отношению к первому sAHP, вызванному в контрольной среде. (*) указывает на статистическую значимость. (B) показывает усредненное изменение амплитуды sAHP, вызванных в присутствии различных концентраций 4-AP. Планки погрешностей опущены для ясности, а линии представляют собой наилучшее моноэкспоненциальное соответствие. (C) Это показывает зависящее от времени изменение sAHP, зарегистрированное в присутствии 4-AP (4 мМ).После достижения максимального плато стимуляция была остановлена на 6½ минут, а затем продолжена. Во время паузы было восстановлено 70% блокировки. RMP: -65 мВ.
RMP: -65 мВ.
Если активация тока, лежащего в основе sAHP, важна для устранения блока, вызванного 4-AP, должна быть возможность восстановить блок, введя паузу в активации sAHP. Для проверки этого прогноза были проведены эксперименты, в которых стимуляция продолжалась до тех пор, пока амплитуда sAHP не достигала плато, в этот момент стимуляция была остановлена на несколько минут, а затем продолжена.Эти эксперименты проводились в присутствии 4 или 8 мМ 4-АР. Один из примеров такого эксперимента показан на. Здесь sAHP вызывались в присутствии 4 мМ 4-AP, и пауза длилась 6 1/2 мин. После паузы большая часть индуцированного 4-AP блока восстановилась, и стимуляция привела к повторному удалению блока. Оценка количества блоков, восстановленных после паузы, была рассчитана с использованием следующего уравнения:
где A, и B, — амплитуда первого и последнего sAHP, соответственно, вызванных до паузы, а C — амплитуда первого sAHP, вызванного после паузы. Этот метод игнорирует любое замедление, которое могло произойти во время паузы, которое могло бы привести к смещению результатов в сторону небольшого завышения количества повторно установленного блока. Однако, как видно на фигуре, количество выбега во время паузы было минимальным. В примере на, пауза привела к восстановлению около 70% блока. В среднем 5-минутная пауза привела к восстановлению 39,8 ± 11,1% (среднее ± стандартное отклонение, n = 5) от первоначального блока. Увеличение паузы до 5-10 минут увеличило количество восстанавливаемых блоков до 61.3 ± 18,5% ( n = 3), и в одном эксперименте, в котором запись дендритов сохранялась достаточно долго, чтобы ввести 16-минутную паузу, блок был почти полностью восстановлен (91,7%). Количество блока, полученного во время паузы, не зависело от того, использовалось 4 или 8 мМ 4-АР. Вместе эти результаты показывают, что активация тока, лежащего в основе sAHP, необходима как для индукции, так и для поддержания процесса разблокировки.
Этот метод игнорирует любое замедление, которое могло произойти во время паузы, которое могло бы привести к смещению результатов в сторону небольшого завышения количества повторно установленного блока. Однако, как видно на фигуре, количество выбега во время паузы было минимальным. В примере на, пауза привела к восстановлению около 70% блока. В среднем 5-минутная пауза привела к восстановлению 39,8 ± 11,1% (среднее ± стандартное отклонение, n = 5) от первоначального блока. Увеличение паузы до 5-10 минут увеличило количество восстанавливаемых блоков до 61.3 ± 18,5% ( n = 3), и в одном эксперименте, в котором запись дендритов сохранялась достаточно долго, чтобы ввести 16-минутную паузу, блок был почти полностью восстановлен (91,7%). Количество блока, полученного во время паузы, не зависело от того, использовалось 4 или 8 мМ 4-АР. Вместе эти результаты показывают, что активация тока, лежащего в основе sAHP, необходима как для индукции, так и для поддержания процесса разблокировки.
Влияние внутриклеточного 4-AP на дендритный sAHP
Из исследований влияния 4-AP на потенциал-зависимые токи K + выясняется, что 4-AP в основном действует из цитоплазматического участка мембраны (Thompson, 1982 ; Kirsch & Narahashi, 1983; Kirsch & Drewe, 1993a; Kirsch et al ., 1993b; Яо и Цзэн, 1994; Russell и др. , 1994; Стивенс и др. , 1994; Yamane et al ., 1995; Jerng et al ., 1999). Поэтому было проверено, оказывает ли внутриклеточный 4-AP эффект, подобный внеклеточному 4-AP. Следующие эксперименты были выполнены с электродами, содержащими 4-АР (50-250 мМ), и стимуляция была начата, как только проникновение стабилизировалось. Примерные следы одного такого эксперимента показаны на. Здесь стимуляция была начата через 80 с после проникновения в дистальный апикальный дендрит электродом, содержащим 100 мМ 4-АР.Наблюдаемые изменения были аналогичны изменениям, наблюдаемым при внеклеточном 4-AP, с прогрессивным увеличением постимпульсного sAHP и сопутствующим уменьшением возбуждения (). Внутриклеточно примененный 4-AP также усиливал активацию больших шипов Ca 2+ , однако этот эффект был несколько ненадежным, иногда приводя к ответу с небольшим или отсутствующим Ca 2+ -компонентом и, соответственно, уменьшенным sAHP. показывает зависящее от времени изменение sAHP, показанное на. Как и в случае внеклеточного 4-AP, амплитуда первого вызванного sAHP была снижена по сравнению с амплитудой sAHP, вызванного в контрольной среде без 4-AP.Кроме того, sAHP также увеличивалось по амплитуде до достижения максимального плато примерно через 150-200 с. Обратите внимание на отсутствие изменений в sAHP после небольшого Ca 2+ -компонента. Из 15 экспериментов три были исключены из дальнейшего анализа, поскольку добавление соединения увеличивалось параллельно с sAHP. Пять экспериментов были исключены из-за нестабильности sAHP и / или быстрого истощения sAHP. В оставшихся семи экспериментах sAHP увеличивалось по амплитуде, хотя предыдущий компонент Ca 2+ оставался неизменным или даже уменьшался.
Внутриклеточно примененный 4-AP также усиливал активацию больших шипов Ca 2+ , однако этот эффект был несколько ненадежным, иногда приводя к ответу с небольшим или отсутствующим Ca 2+ -компонентом и, соответственно, уменьшенным sAHP. показывает зависящее от времени изменение sAHP, показанное на. Как и в случае внеклеточного 4-AP, амплитуда первого вызванного sAHP была снижена по сравнению с амплитудой sAHP, вызванного в контрольной среде без 4-AP.Кроме того, sAHP также увеличивалось по амплитуде до достижения максимального плато примерно через 150-200 с. Обратите внимание на отсутствие изменений в sAHP после небольшого Ca 2+ -компонента. Из 15 экспериментов три были исключены из дальнейшего анализа, поскольку добавление соединения увеличивалось параллельно с sAHP. Пять экспериментов были исключены из-за нестабильности sAHP и / или быстрого истощения sAHP. В оставшихся семи экспериментах sAHP увеличивалось по амплитуде, хотя предыдущий компонент Ca 2+ оставался неизменным или даже уменьшался. показывает среднее изменение амплитуды sAHP в этих семи экспериментах. Данные, полученные в присутствии 4-AP, были нормализованы по отношению к sAHP, вызванным в контрольной среде в соответствующее время записи (как на фиг. И). Амплитуда первого вызванного sAHP была значительно ( P <0,05) снижена до 60,9 ± 5,8% ( n = 7) sAHP, вызванного в отсутствие 4-AP. В среднем активация первого sAHP происходила через 82,9 ± 37,7 с (среднее ± стандартное отклонение) после проникновения. Амплитуда sAHP достигла максимального плато примерно через 100 с, что было почти таким же большим, как полученное с внеклеточным 4-AP (сравните и).Подгонка начальных 120 с к моноэкспоненциальной функции дала постоянную времени 81,3 с, что было немного больше, чем измеренная при большинстве концентраций внеклеточного 4-AP.
показывает среднее изменение амплитуды sAHP в этих семи экспериментах. Данные, полученные в присутствии 4-AP, были нормализованы по отношению к sAHP, вызванным в контрольной среде в соответствующее время записи (как на фиг. И). Амплитуда первого вызванного sAHP была значительно ( P <0,05) снижена до 60,9 ± 5,8% ( n = 7) sAHP, вызванного в отсутствие 4-AP. В среднем активация первого sAHP происходила через 82,9 ± 37,7 с (среднее ± стандартное отклонение) после проникновения. Амплитуда sAHP достигла максимального плато примерно через 100 с, что было почти таким же большим, как полученное с внеклеточным 4-AP (сравните и).Подгонка начальных 120 с к моноэкспоненциальной функции дала постоянную времени 81,3 с, что было немного больше, чем измеренная при большинстве концентраций внеклеточного 4-AP.
Внутриклеточно примененный 4-AP также блокировал дендритный sAHP. (A) Наложение ответа номер 1 и 17, записанного с помощью электрода, содержащего 4-AP (100 мМ). Первый ответ был получен через 80 с после проникновения. RMP: −62 мВ. (B) Показывает зависящее от времени изменение амплитуды sAHP, показанное на (A). Закрашенные и открытые кружки показывают ответы, в которых пиковое соединение содержало большой или малый компонент Ca 2+ , соответственно.SAHP, наблюдаемые после добавления большого количества Ca 2+ -компонента, изменились таким же образом, как sAHP, вызванные в присутствии внеклеточного 4-AP. Линия — это просто линия тренда. (C) показывает усредненное (среднее ± стандартное отклонение, n = 7) изменение во времени амплитуды sAHP, зарегистрированное с помощью электродов, содержащих 4-AP (50-250 мМ). Контрольные данные идентичны показанным на. Данные, измеренные в присутствии 4-AP, были нормализованы по отношению к sAHP, вызванным в аналогичное время, но в отсутствие 4-AP.
RMP: −62 мВ. (B) Показывает зависящее от времени изменение амплитуды sAHP, показанное на (A). Закрашенные и открытые кружки показывают ответы, в которых пиковое соединение содержало большой или малый компонент Ca 2+ , соответственно.SAHP, наблюдаемые после добавления большого количества Ca 2+ -компонента, изменились таким же образом, как sAHP, вызванные в присутствии внеклеточного 4-AP. Линия — это просто линия тренда. (C) показывает усредненное (среднее ± стандартное отклонение, n = 7) изменение во времени амплитуды sAHP, зарегистрированное с помощью электродов, содержащих 4-AP (50-250 мМ). Контрольные данные идентичны показанным на. Данные, измеренные в присутствии 4-AP, были нормализованы по отношению к sAHP, вызванным в аналогичное время, но в отсутствие 4-AP.
Ацетат модулирует индуцированный 4-AP блок дендритного sAHP
Существует несколько доказательств того, что анионы могут влиять на многие аспекты поведения нейронов, такие как активация Ca 2+ -активированного K + каналы и отсроченное выпрямление каналов K + (Adams & Oxford, 1983; Cullen & Carlen, 1992; Zhang et al . , 1994), внутриклеточное высвобождение Ca 2+ (Morita et al ., 1980 ) и активация G-белков (Nakajima et al ., 1992). Более того, органические и неорганические анионы часто имеют противоположные эффекты (Morita et al ., 1980; Adams & Oxford, 1983; Zhang et al ., 1994). Все описанные до сих пор результаты были получены с электродами, содержащими ацетат органического аниона. Чтобы исследовать важность типа используемого аниона, эксперименты были повторены с электродами, содержащими KCl (2–3 M) и KMeSO 4 (2 M). С обоими типами анионов амплитуда первого sAHP, вызванного в присутствии 4-AP (4 мМ), была небольшой, учитывая выраженный выброс соединения, вызванный во время деполяризующего импульса тока.Однако наблюдалась заметная разница в величине разблокировки. С электродами, содержащими KMeSO 4 , sAHP постепенно увеличивалось, как это было видно с электродами, содержащими KAc, от начального значения 2,3 ± 0,7 мВ ( n = 5) до 8,6 ± 0,7 мВ после 300-400 с записи (не показано).
, 1994), внутриклеточное высвобождение Ca 2+ (Morita et al ., 1980 ) и активация G-белков (Nakajima et al ., 1992). Более того, органические и неорганические анионы часто имеют противоположные эффекты (Morita et al ., 1980; Adams & Oxford, 1983; Zhang et al ., 1994). Все описанные до сих пор результаты были получены с электродами, содержащими ацетат органического аниона. Чтобы исследовать важность типа используемого аниона, эксперименты были повторены с электродами, содержащими KCl (2–3 M) и KMeSO 4 (2 M). С обоими типами анионов амплитуда первого sAHP, вызванного в присутствии 4-AP (4 мМ), была небольшой, учитывая выраженный выброс соединения, вызванный во время деполяризующего импульса тока.Однако наблюдалась заметная разница в величине разблокировки. С электродами, содержащими KMeSO 4 , sAHP постепенно увеличивалось, как это было видно с электродами, содержащими KAc, от начального значения 2,3 ± 0,7 мВ ( n = 5) до 8,6 ± 0,7 мВ после 300-400 с записи (не показано). Однако с электродами, содержащими KCl, амплитуда первого sAHP не изменилась даже после 300-400 с записи (). Таким образом, эти результаты показывают, что существует какое-то взаимодействие между анионами и блоком, индуцированным 4-AP, однако они не дают никаких указаний на то, способствует ли ацетат или MeSO 4 удалению блока или Cl — стабилизирует его.Для изучения этого было проведено сравнение ацетатных электродов с электродами, содержащими Cl — . Поскольку загрузка клеток Cl — может оказывать угнетающее действие на sAHP (Zhang et al ., 1994), дендритный sAHP сначала был охарактеризован в отсутствие 4-AP. В целом контрольные sAHP, полученные с помощью Cl —, были аналогичны таковым, зарегистрированным с ацетатом, за исключением того, что их средний размер был несколько меньше (4,75 ± 0,42 мВ, 90 · 105 n 90 · 106 = 6). Однако эта разница была незначительной (0.05 < P <0,1). В присутствии 4-АР (4 мМ) добавка соединения была аналогична той, что наблюдалась с ацетатом (сравните и).
Однако с электродами, содержащими KCl, амплитуда первого sAHP не изменилась даже после 300-400 с записи (). Таким образом, эти результаты показывают, что существует какое-то взаимодействие между анионами и блоком, индуцированным 4-AP, однако они не дают никаких указаний на то, способствует ли ацетат или MeSO 4 удалению блока или Cl — стабилизирует его.Для изучения этого было проведено сравнение ацетатных электродов с электродами, содержащими Cl — . Поскольку загрузка клеток Cl — может оказывать угнетающее действие на sAHP (Zhang et al ., 1994), дендритный sAHP сначала был охарактеризован в отсутствие 4-AP. В целом контрольные sAHP, полученные с помощью Cl —, были аналогичны таковым, зарегистрированным с ацетатом, за исключением того, что их средний размер был несколько меньше (4,75 ± 0,42 мВ, 90 · 105 n 90 · 106 = 6). Однако эта разница была незначительной (0.05 < P <0,1). В присутствии 4-АР (4 мМ) добавка соединения была аналогична той, что наблюдалась с ацетатом (сравните и). Однако, несмотря на значительное увеличение притока Ca 2+ , за ответом следовала постдеполяризация (DAP), а не sAHP (). В большинстве случаев изначально был небольшой sAHP, который со временем превратился в DAP. Поскольку не было разницы между результатами, полученными с 2 и 3 М KCl, все данные этих экспериментов были объединены. В, средние результаты с ( n = 11) и без ( n = 6) 4-AP нанесены на график в зависимости от времени записи.Амплитуда первого sAHP, вызванного в присутствии 4-AP, составляла 0,4 ± 0,6 мВ, что значительно отличалось ( P <0,001) от амплитуды максимального sAHP, вызванного в отсутствие 4-AP. Среднее снижение первого вызванного sAHP было больше для Cl — , чем для электродов, содержащих ацетат (91,5% по сравнению с 81,5%), что указывает на более эффективный блок с Cl — в качестве аниона. Более того, блок оставался стабильным с течением времени и фактически демонстрировал тенденцию к увеличению, что приводило к превращению sAHP в DAP примерно через 200 с стимуляции ().
Однако, несмотря на значительное увеличение притока Ca 2+ , за ответом следовала постдеполяризация (DAP), а не sAHP (). В большинстве случаев изначально был небольшой sAHP, который со временем превратился в DAP. Поскольку не было разницы между результатами, полученными с 2 и 3 М KCl, все данные этих экспериментов были объединены. В, средние результаты с ( n = 11) и без ( n = 6) 4-AP нанесены на график в зависимости от времени записи.Амплитуда первого sAHP, вызванного в присутствии 4-AP, составляла 0,4 ± 0,6 мВ, что значительно отличалось ( P <0,001) от амплитуды максимального sAHP, вызванного в отсутствие 4-AP. Среднее снижение первого вызванного sAHP было больше для Cl — , чем для электродов, содержащих ацетат (91,5% по сравнению с 81,5%), что указывает на более эффективный блок с Cl — в качестве аниона. Более того, блок оставался стабильным с течением времени и фактически демонстрировал тенденцию к увеличению, что приводило к превращению sAHP в DAP примерно через 200 с стимуляции (). Чтобы решить, является ли ацетат, который способствует удалению блока, или Cl —, который его стабилизирует, вышеупомянутые эксперименты были повторены с использованием электродов, содержащих различные комбинации KCl и KAc. Во-первых, записи были выполнены с использованием электродов, содержащих KAc (2 M), которые дали качественно аналогичные результаты, как при использовании 4 M KAc (). Амплитуда первого вызванного sAHP была такого же размера (1,6 ± 0,8 мВ, n = 5), как и динамика увеличения sAHP.Однако максимальная амплитуда, полученная после разблокировки, была несколько меньше. Подобные результаты были также получены, когда KAc (2 M) был объединен с KCl (2 M), за исключением того, что максимальная амплитуда теперь была несколько больше (). С электродами, содержащими KAc (1 M) и KCl (3 M), амплитуда первого sAHP составляла 2,03 ± 1,3 мВ (90 · 105 n 90 · 106 = 3), и только в одном случае sAHP наблюдалось увеличение с течением времени (не показано). . Как указывалось ранее, не наблюдалось увеличения sAHP с электродами, содержащими только 2 М KCl.
Чтобы решить, является ли ацетат, который способствует удалению блока, или Cl —, который его стабилизирует, вышеупомянутые эксперименты были повторены с использованием электродов, содержащих различные комбинации KCl и KAc. Во-первых, записи были выполнены с использованием электродов, содержащих KAc (2 M), которые дали качественно аналогичные результаты, как при использовании 4 M KAc (). Амплитуда первого вызванного sAHP была такого же размера (1,6 ± 0,8 мВ, n = 5), как и динамика увеличения sAHP.Однако максимальная амплитуда, полученная после разблокировки, была несколько меньше. Подобные результаты были также получены, когда KAc (2 M) был объединен с KCl (2 M), за исключением того, что максимальная амплитуда теперь была несколько больше (). С электродами, содержащими KAc (1 M) и KCl (3 M), амплитуда первого sAHP составляла 2,03 ± 1,3 мВ (90 · 105 n 90 · 106 = 3), и только в одном случае sAHP наблюдалось увеличение с течением времени (не показано). . Как указывалось ранее, не наблюдалось увеличения sAHP с электродами, содержащими только 2 М KCl. Таким образом, вместе эти эксперименты показывают, что именно присутствие ацетата в зависимости от концентрации изменяет взаимодействие между 4-AP и током, опосредующим sAHP.
Таким образом, вместе эти эксперименты показывают, что именно присутствие ацетата в зависимости от концентрации изменяет взаимодействие между 4-AP и током, опосредующим sAHP.
Анионы влияют на стабильность индуцированного 4-AP блока. (Aa) Наложение ответов (число: 1, 16, 32 и 48), записанных с помощью электрода, содержащего 3 M KCl, в присутствии 4-AP (4 мМ). Обратите внимание на постимпульсный DAP. Пунктирной линией отмечен предимпульсный RMP. (Ab) Показывает один из ответов в расширенном масштабе времени.RMP: −70 мВ. (B) Сравнение sAHPs, вызванных 2-3 M KCl-содержащими электродами в отсутствие или в присутствии 4-AP (4 мМ). В отсутствие 4-AP ( n = 6) sAHP оставалось относительно постоянным со средней амплитудой около 5 мВ. В присутствии 4-AP ( n = 8) sAHP почти блокировался и превращался в DAP примерно через 200 мс записи. (C) показывает зависящее от времени изменение sAHP, вызванное в присутствии 4-AP (4 мМ) и зарегистрированное с помощью электродов, содержащих либо 2 M KAc ( n, = 5), 2 M KAc и 2 M KCl ( n = 7) или 2-3 M KCl ( n = 11). Постепенное удаление блока, вызванного 4-АР, наблюдается только тогда, когда в электродах присутствует ацетат. Все даты представлены как среднее ± стандартное отклонение.
Постепенное удаление блока, вызванного 4-АР, наблюдается только тогда, когда в электродах присутствует ацетат. Все даты представлены как среднее ± стандартное отклонение.
Было показано, что внеклеточный ацетат модулирует активацию sAHP, возможно, за счет активации аденозиновых рецепторов, эффект, который, по крайней мере частично, блокируется загрузкой клетки ацетатом (Cullen & Carlen, 1992). Однако внеклеточная перфузия ацетатом в концентрациях (0,5 — 1 мМ), которые дают максимальный эффект на sAHP в гранулярных клетках (Cullen & Carlen, 1992), не влияет на стабильность индуцированного 4-AP блока sAHP. регистрировали с электродами, содержащими KCl ( n = 3, не показаны).
Из приведенных выше экспериментов можно предсказать, что если ПК уже загружены анионом, когда вводится 4-АР, sAHP должен блокироваться, когда анион является Cl —, но увеличиваться, когда анион является ацетатом. Чтобы проверить это предсказание, 4-АР (2-4 мМ) добавляли к перфузионной среде после того, как были записаны от 10 до 16 контрольных ответов. При использовании электродов, содержащих Cl — , введение 4-AP привело к прогрессивному снижению sAHP, как и прогнозировалось, с максимальным эффектом, полученным примерно через 300 с ( n = 5,).Снижение sAHP происходило, несмотря на сопутствующее увеличение пиков соединения (). В примере, показанном в, эффект 4-AP был частично обращен, однако это не было согласованным открытием. Неожиданно подобный эффект наблюдался при использовании электродов, содержащих ацетат (). Как и ожидалось, введение 4-AP привело к увеличению как размера составного шипа, так и частоты срабатывания (). Однако в то же время произошло неожиданное снижение sAHP до тех пор, пока оно не было заблокировано, несмотря на продолжающееся увеличение количества выстрелов ( n = 5,).Блок имел такой же ход времени, как и у Cl —, и также был стабильным до тех пор, пока присутствовал 4-AP. При возврате в контрольную среду реверсирования не наблюдалось.
При использовании электродов, содержащих Cl — , введение 4-AP привело к прогрессивному снижению sAHP, как и прогнозировалось, с максимальным эффектом, полученным примерно через 300 с ( n = 5,).Снижение sAHP происходило, несмотря на сопутствующее увеличение пиков соединения (). В примере, показанном в, эффект 4-AP был частично обращен, однако это не было согласованным открытием. Неожиданно подобный эффект наблюдался при использовании электродов, содержащих ацетат (). Как и ожидалось, введение 4-AP привело к увеличению как размера составного шипа, так и частоты срабатывания (). Однако в то же время произошло неожиданное снижение sAHP до тех пор, пока оно не было заблокировано, несмотря на продолжающееся увеличение количества выстрелов ( n = 5,).Блок имел такой же ход времени, как и у Cl —, и также был стабильным до тех пор, пока присутствовал 4-AP. При возврате в контрольную среду реверсирования не наблюдалось.
Перфузия 4-AP индуцировала стабильный блок независимо от используемого аниона. Это показывает эффект введения 4-AP (4 мМ) во время записи с использованием электрода, содержащего KCl (A) или KAc (B). (Aa) показывает изменение во времени амплитуды sAHP во время перфузии 4-AP. Время, в течение которого производилась перфузия 4-AP, указано заштрихованными полосами.(Ab) показывает типичные ответы, вызванные до и во время перфузии 4-AP, в моменты времени, обозначенные (i) и (ii) в (Aa). (Ва) показывает зависящее от времени изменение sAHP, записанное с помощью электрода, содержащего KAc, во время перфузии 4-AP. (Bb) показывает примерные ответы, записанные в моменты времени, отмеченные (i) и (ii) в (Ba). RMP: (A) -70 мВ; (B) -68 мВ.
Это показывает эффект введения 4-AP (4 мМ) во время записи с использованием электрода, содержащего KCl (A) или KAc (B). (Aa) показывает изменение во времени амплитуды sAHP во время перфузии 4-AP. Время, в течение которого производилась перфузия 4-AP, указано заштрихованными полосами.(Ab) показывает типичные ответы, вызванные до и во время перфузии 4-AP, в моменты времени, обозначенные (i) и (ii) в (Aa). (Ва) показывает зависящее от времени изменение sAHP, записанное с помощью электрода, содержащего KAc, во время перфузии 4-AP. (Bb) показывает примерные ответы, записанные в моменты времени, отмеченные (i) и (ii) в (Ba). RMP: (A) -70 мВ; (B) -68 мВ.
Влияние апамина на 4-AP-чувствительный дендритный sAHP
Обычно считается, что медленный ток K + , активированный Ca 2+ , опосредующий соматический sAHP в пирамидных нейронах CA1, нечувствителен к пчелиному ядовитый токсин апамин (Sah, 1996).Однако теперь появились доказательства наличия апамин-чувствительного AHP (Norris et al . , 1998; Sah & Clements, 1999; Stocker et al ., 1999). В настоящем исследовании перфузия с высокой концентрацией (1 мкМ) апамина в течение более 25 минут не оказывала влияния на дендритный 4-AP-чувствительный sAHP ( n = 2, не показано). Более того, в пяти других экспериментах, в которых срез инкубировали с апамином (1 мкМ) в течение не менее 30 90 · 105 мин 90 · 106, все еще могли быть вызваны большие sAHP, которые во всех отношениях напоминали вызванные в контрольной среде и которые были чувствительны к 4 -AP.Три из этих экспериментов были выполнены с электродами, содержащими KAc. Таким образом, эти эксперименты убедительно свидетельствуют о том, что ток, чувствительный к 4-AP, опосредующий дендритный sAHP, нечувствителен к апамину.
, 1998; Sah & Clements, 1999; Stocker et al ., 1999). В настоящем исследовании перфузия с высокой концентрацией (1 мкМ) апамина в течение более 25 минут не оказывала влияния на дендритный 4-AP-чувствительный sAHP ( n = 2, не показано). Более того, в пяти других экспериментах, в которых срез инкубировали с апамином (1 мкМ) в течение не менее 30 90 · 105 мин 90 · 106, все еще могли быть вызваны большие sAHP, которые во всех отношениях напоминали вызванные в контрольной среде и которые были чувствительны к 4 -AP.Три из этих экспериментов были выполнены с электродами, содержащими KAc. Таким образом, эти эксперименты убедительно свидетельствуют о том, что ток, чувствительный к 4-AP, опосредующий дендритный sAHP, нечувствителен к апамину.
Эффект внеклеточного 4-AP на соматический sAHP
4-AP воздействовал на соматический sAHP так же, как и на дендритный sAHP. При перфузии 4-AP (4 мМ) соматический sAHP, зарегистрированный либо с KAc-содержащими ( n = 2), либо с KCl-содержащими ( n = 2) электродами, заметно снижался (), несмотря на сопутствующее увеличение частоты возбуждения. ().Как описано выше для дендритного sAHP, стабильность индуцированного 4-AP блока соматического sAHP также была чувствительна к типу аниона, используемого в регистрирующем электроде. Когда записи были начаты после того, как 4-AP (4 мМ) присутствовал в течение более 30 минут, первая sAHP, зарегистрированная с электродами, содержащими KAc, имела усредненную амплитуду 4,66 ± 1,4 мВ ( n = 7, среднее ± стандартное отклонение) и прогрессивно увеличивался в течение следующих 300 с в среднем до 8,2 ± 1,9 мВ (). Однако с электродами, содержащими KCl, первая вызванная sAHP имела усредненную амплитуду 1.3 ± 1,3 мВ ( n = 3, среднее ± стандартное отклонение) и оставалось стабильным с амплитудой 1,7 ± 1,0 мВ после 600 секунд записи ().
().Как описано выше для дендритного sAHP, стабильность индуцированного 4-AP блока соматического sAHP также была чувствительна к типу аниона, используемого в регистрирующем электроде. Когда записи были начаты после того, как 4-AP (4 мМ) присутствовал в течение более 30 минут, первая sAHP, зарегистрированная с электродами, содержащими KAc, имела усредненную амплитуду 4,66 ± 1,4 мВ ( n = 7, среднее ± стандартное отклонение) и прогрессивно увеличивался в течение следующих 300 с в среднем до 8,2 ± 1,9 мВ (). Однако с электродами, содержащими KCl, первая вызванная sAHP имела усредненную амплитуду 1.3 ± 1,3 мВ ( n = 3, среднее ± стандартное отклонение) и оставалось стабильным с амплитудой 1,7 ± 1,0 мВ после 600 секунд записи ().
Влияние 4-AP на соматически вызванный sAHP. Это показывает эффект введения 4-AP (4 мМ) во время записи с электродом, содержащим KAc. (Aa) показывает изменение во времени амплитуды соматического sAHP во время перфузии 4-AP. Время, в течение которого перфузировалось 4-AP, показано заштрихованной полосой. (Ab) Наложение ответов, вызванных до и во время перфузии 4-AP, в моменты времени, обозначенные (i) и (ii) в (Aa).(B) Наложение первого ответа и ответа, вызванного после 200 с записи с помощью электрода, содержащего KAc, в присутствии 4-AP (4 мМ). Обратите внимание на начальный небольшой sAHP и постепенное увеличение амплитуды sAHP в течение следующих 200 с. (C) Наложение первого отклика и отклика, вызванного после 600 с записи с электродом, содержащим KCl, в присутствии 4-AP (4 мМ). Обратите внимание, что, несмотря на высокую частоту срабатывания, sAHP блокируется на весь период записи.RMP: (A) -72 мВ; (B) -62 мВ; (C) -65 мВ.
(Ab) Наложение ответов, вызванных до и во время перфузии 4-AP, в моменты времени, обозначенные (i) и (ii) в (Aa).(B) Наложение первого ответа и ответа, вызванного после 200 с записи с помощью электрода, содержащего KAc, в присутствии 4-AP (4 мМ). Обратите внимание на начальный небольшой sAHP и постепенное увеличение амплитуды sAHP в течение следующих 200 с. (C) Наложение первого отклика и отклика, вызванного после 600 с записи с электродом, содержащим KCl, в присутствии 4-AP (4 мМ). Обратите внимание, что, несмотря на высокую частоту срабатывания, sAHP блокируется на весь период записи.RMP: (A) -72 мВ; (B) -62 мВ; (C) -65 мВ.
Обсуждение
4-аминопиридин блокирует медленный Ca
2+ -активированный K + ток Из настоящего исследования можно сделать два основных вывода: (1) 4-AP блокирует медленный Ca 2+ -активированные токи K + , опосредующие соматический и дендритный sAHP в CA1 PC; (2) ацетат анионов и MeSO 4 некоторым сложным образом вмешивается в блок, индуцированный 4-AP.
Доказательств блокады sAHP, индуцированной 4-AP, несколько.Во-первых, когда sAHP вызывается в присутствии 4-AP, амплитуда первого sAHP снижается по сравнению с амплитудой максимального sAHP, вызванного в контрольной среде. Эффект зависел от концентрации, при этом снижение составляло около 44%, полученное при использовании 2 мМ 4-AP, и полное блокирование, полученное при использовании 8 мМ. Уже при субмиллимолярных концентрациях 4-AP снижал sAHP, хотя и незначительно. Однако эксперименты, проведенные с электродами, содержащими KAc, показывают, что метод, используемый для оценки действия лекарства, недооценивает эффект 4-AP.Причина этого заключается в следующем: удаление индуцированного 4-AP блока выявляет sAHP с максимальной амплитудой, которая на 40-50% больше, чем максимальная амплитуда sAHP, вызванная в контрольной среде. Причина этого — усиливающий эффект 4-AP на образование соединений в апикальных дендритах (Andreasen & Lambert, 1995a). Таким образом, при использовании sAHP, вызванного после полного удаления блока, индуцированного 4-AP, в качестве эталона, снижение, полученное даже при субмиллимолярной концентрации 4-AP, является значительным. Во-вторых, эксперименты по перфузии, в которых 4-AP вводили во время записи с ацетатными или содержащими Cl — электродами, ясно показали, что 4-AP значительно снижает амплитуду sAHP, несмотря на сопутствующее увеличение количества пиков соединения и / или частоты срабатывания ( и ). В-третьих, когда 4-AP применялся внутриклеточно, первый вызванный sAHP также снижался по сравнению с аналогичным sAHP, вызванным в отсутствие 4-AP. Также здесь снижение было очень выраженным по сравнению с амплитудой sAHP, вызванной после удаления блока ().Быстрое действие внутриклеточно применяемого 4-AP поддерживает высокую скорость связывания 4-AP. Индукция блока, по-видимому, не зависит от использования в том смысле, что полученная степень восстановления была очень похожей, независимо от того, присутствовал ли 4-AP до начала эксперимента или применялся ли он во время эксперимента (сравните и). Таким образом, 4-AP, по-видимому, блокирует медленные Ca 2+ -активированные каналы K + , опосредующие дендритные и соматические sAHP в зависимости от концентрации с относительно быстрой скоростью включения.
Во-вторых, эксперименты по перфузии, в которых 4-AP вводили во время записи с ацетатными или содержащими Cl — электродами, ясно показали, что 4-AP значительно снижает амплитуду sAHP, несмотря на сопутствующее увеличение количества пиков соединения и / или частоты срабатывания ( и ). В-третьих, когда 4-AP применялся внутриклеточно, первый вызванный sAHP также снижался по сравнению с аналогичным sAHP, вызванным в отсутствие 4-AP. Также здесь снижение было очень выраженным по сравнению с амплитудой sAHP, вызванной после удаления блока ().Быстрое действие внутриклеточно применяемого 4-AP поддерживает высокую скорость связывания 4-AP. Индукция блока, по-видимому, не зависит от использования в том смысле, что полученная степень восстановления была очень похожей, независимо от того, присутствовал ли 4-AP до начала эксперимента или применялся ли он во время эксперимента (сравните и). Таким образом, 4-AP, по-видимому, блокирует медленные Ca 2+ -активированные каналы K + , опосредующие дендритные и соматические sAHP в зависимости от концентрации с относительно быстрой скоростью включения. Эффективные концентрации находятся в диапазоне концентраций, обычно используемых для блокировки различных типов зависимых от напряжения K + -каналов. Кроме того, отсутствие зависимости от использования указывает на то, что 4-AP может связываться с каналами K + , когда они находятся в их закрытом состоянии покоя.
Эффективные концентрации находятся в диапазоне концентраций, обычно используемых для блокировки различных типов зависимых от напряжения K + -каналов. Кроме того, отсутствие зависимости от использования указывает на то, что 4-AP может связываться с каналами K + , когда они находятся в их закрытом состоянии покоя.
Возможный механизм действия 4-аминопиридина
Существует несколько возможных механизмов, с помощью которых 4-AP может блокировать медленный ток K + , активированный Ca 2+ .Одна возможность состоит в том, что 4-AP снижает приток Ca 2+ во время пикового возбуждения и тем самым активацию тока K + . Это, однако, не кажется вероятным, учитывая заметное увеличение частоты пиков и / или срабатываний соединения в присутствии 4-AP (, и). Исследования также показали, что 4-AP фактически увеличивает приток Ca 2+ за счет стимулирующего действия на высоковольтные активированные каналы Ca 2+ (Segal & Barker, 1986). Вторая возможность состоит в том, что 4-AP изменяет аффинность связывания Ca 2+ медленных Ca 2+ -активированных каналов K + .Несмотря на то, что представленные здесь результаты не могут исключить эту возможность, насколько мне известно, взаимодействие между 4-АР и кальций-связывающими белками до сих пор не описано. Третий, более вероятный механизм заключается в том, что 4-AP связывается непосредственно с комплексом каналов K + с сайтом, который доступен, когда каналы находятся в их закрытом состоянии покоя. Из исследований большого количества различных 4-AP-чувствительных токозависимых токов K + , показывающих, что 4-AP работает в основном с цитоплазматической стороны мембраны в своей катионной форме, а также при внеклеточном применении (Thompson, 1982; Кирш и Нарахаши, 1983; Кирш и Древе, 1993a; Кирш и др. ., 1993b; Яо и Цзэн, 1994; Russell и др. , 1994; Стивенс и др. , 1994; Yamane и др.
Вторая возможность состоит в том, что 4-AP изменяет аффинность связывания Ca 2+ медленных Ca 2+ -активированных каналов K + .Несмотря на то, что представленные здесь результаты не могут исключить эту возможность, насколько мне известно, взаимодействие между 4-АР и кальций-связывающими белками до сих пор не описано. Третий, более вероятный механизм заключается в том, что 4-AP связывается непосредственно с комплексом каналов K + с сайтом, который доступен, когда каналы находятся в их закрытом состоянии покоя. Из исследований большого количества различных 4-AP-чувствительных токозависимых токов K + , показывающих, что 4-AP работает в основном с цитоплазматической стороны мембраны в своей катионной форме, а также при внеклеточном применении (Thompson, 1982; Кирш и Нарахаши, 1983; Кирш и Древе, 1993a; Кирш и др. ., 1993b; Яо и Цзэн, 1994; Russell и др. , 1994; Стивенс и др. , 1994; Yamane и др. ., 1995). В настоящем исследовании есть два наблюдения, которые указывают на то, что 4-AP также блокирует медленный ток K + , активированный Ca 2+ , главным образом из цитоплазматического участка мембраны. Во-первых, при внутриклеточном применении снижение sAHP было установлено в течение 82,9 с после проникновения, такое быстрое действие соответствует цитоплазматическому сайту связывания, потому что при рН цитоплазмы большинство молекул 4-AP будет в катионной форме. и лишь небольшая часть сможет выбраться наружу.Вторая причина заключается в том, что на блок, индуцированный 4-AP, ацетат влияет только тогда, когда он применяется внутриклеточно. Следует отметить, что с использованием техники подготовки и регистрации нельзя исключить дополнительный внеклеточный сайт связывания.
., 1995). В настоящем исследовании есть два наблюдения, которые указывают на то, что 4-AP также блокирует медленный ток K + , активированный Ca 2+ , главным образом из цитоплазматического участка мембраны. Во-первых, при внутриклеточном применении снижение sAHP было установлено в течение 82,9 с после проникновения, такое быстрое действие соответствует цитоплазматическому сайту связывания, потому что при рН цитоплазмы большинство молекул 4-AP будет в катионной форме. и лишь небольшая часть сможет выбраться наружу.Вторая причина заключается в том, что на блок, индуцированный 4-AP, ацетат влияет только тогда, когда он применяется внутриклеточно. Следует отметить, что с использованием техники подготовки и регистрации нельзя исключить дополнительный внеклеточный сайт связывания.
Детальные исследования взаимодействия между 4-AP и различными типами потенциал-управляемых каналов K + показали, что 4-AP связывается с сайтом на цитоплазматической половине сегмента S6 или рядом с ним, который формирует цитоплазматический вестибюль каналы (Kirsch & Drewe, 1993a; Kirsch et al . , 1993b; Jerng et al ., 1999). К настоящему времени идентифицированы три гена, SK1, SK2 и SK3, которые кодируют каналы K + , активированные Ca 2+ с низкой проводимостью, также называемые каналами SK (Köhler et al ., 1996). Общая структура этих SK-каналов очень похожа на структуру потенциалозависимых каналов K + с высокой степенью гомологии в области пор между сегментами S5 и S6 (Köhler et al ., 1996; Vergara et al. al ., 1998; Дойл и др. ., 1998). 4-AP-чувствительные Ca 2+ -активированные каналы K + , исследованные в настоящем исследовании, по-видимому, отличаются от каналов SK тем, что они нечувствительны к апамину и BIC в концентрациях, которые могут блокировать каналы SK (Debarbieux и др. ., 1998; Khawaled и др. ., 1999; Shah & Haylett, 2000; Stocker et al. ., 1999). Даже в этом случае исследования одноканальных каналов K + , обеспечивающих нечувствительную к апамину часть sAHP, показали, что основная структура каналов аналогична структуре каналов SK (Sah & Isaacson, 1995; Sah, 1996; Vergara ).
, 1993b; Jerng et al ., 1999). К настоящему времени идентифицированы три гена, SK1, SK2 и SK3, которые кодируют каналы K + , активированные Ca 2+ с низкой проводимостью, также называемые каналами SK (Köhler et al ., 1996). Общая структура этих SK-каналов очень похожа на структуру потенциалозависимых каналов K + с высокой степенью гомологии в области пор между сегментами S5 и S6 (Köhler et al ., 1996; Vergara et al. al ., 1998; Дойл и др. ., 1998). 4-AP-чувствительные Ca 2+ -активированные каналы K + , исследованные в настоящем исследовании, по-видимому, отличаются от каналов SK тем, что они нечувствительны к апамину и BIC в концентрациях, которые могут блокировать каналы SK (Debarbieux и др. ., 1998; Khawaled и др. ., 1999; Shah & Haylett, 2000; Stocker et al. ., 1999). Даже в этом случае исследования одноканальных каналов K + , обеспечивающих нечувствительную к апамину часть sAHP, показали, что основная структура каналов аналогична структуре каналов SK (Sah & Isaacson, 1995; Sah, 1996; Vergara ). и др., ., 1998; Hirschberg et al ., 1998; Sah & Clements, 1999). Следовательно, есть соблазн предположить, что сайт связывания 4-AP должен находиться в области пор 4-AP-чувствительных Ca 2+ -активированных каналов K + . Подобное расположение также было предложено для связывания 4-AP с активированным Ca 2+ каналом K + с высокой проводимостью в нерабочих миометрических клетках беременных человека, которые также имеют область пор, которая является высококонсервативной с потенциал-зависимыми K + каналов (Хан и др. ., 1997).
и др., ., 1998; Hirschberg et al ., 1998; Sah & Clements, 1999). Следовательно, есть соблазн предположить, что сайт связывания 4-AP должен находиться в области пор 4-AP-чувствительных Ca 2+ -активированных каналов K + . Подобное расположение также было предложено для связывания 4-AP с активированным Ca 2+ каналом K + с высокой проводимостью в нерабочих миометрических клетках беременных человека, которые также имеют область пор, которая является высококонсервативной с потенциал-зависимыми K + каналов (Хан и др. ., 1997).
Органические анионы модифицируют блок, индуцированный 4-AP
С помощью электродов, содержащих ацетат или MeSO 4 , индуцированный 4-AP блок sAHP постепенно удалялся в течение начальных 300-400 с стимуляции (и), что может указывать на какую-то разблокировку, зависящую от активности. Это дополнительно поддерживается возможностью восстановить блокировку путем введения паузы в активации sAHP. Напротив, при использовании неорганического аниона Cl — индуцированный 4-AP блок был стабильным и в среднем на 10% больше, чем блок, полученный с электродами, содержащими KAc.Следовательно, кажется, что тип используемого аниона также важен для удаления 4-AP из медленных Ca 2+ -активированных каналов K + . Использование электродов с различными комбинациями ацетата и Cl — показало, что удаление блока происходило только при наличии ацетата и надежно только при концентрациях ацетата ≥2 М. Кроме того, стабильность блока наблюдалась с электродами, содержащими Cl — . указывает на то, что активация каналов K + , активированных Ca 2+ , сама по себе недостаточна для обеспечения разблокировки.Таким образом, нет никаких сомнений в том, что загрузка клетки ацетатом или MeSO 4 каким-то образом отвечает за удаление 4-AP из комплекса каналов. Возможных объяснений действия ацетата может быть несколько. Один из них может происходить через изменение внутриклеточного pH, к которому большинство типов ионных каналов очень чувствительно (Tombaugh & Somjen, 1996), однако восстановление блока в этом случае не должно быть возможным в постоянном присутствии ацетата.
Напротив, при использовании неорганического аниона Cl — индуцированный 4-AP блок был стабильным и в среднем на 10% больше, чем блок, полученный с электродами, содержащими KAc.Следовательно, кажется, что тип используемого аниона также важен для удаления 4-AP из медленных Ca 2+ -активированных каналов K + . Использование электродов с различными комбинациями ацетата и Cl — показало, что удаление блока происходило только при наличии ацетата и надежно только при концентрациях ацетата ≥2 М. Кроме того, стабильность блока наблюдалась с электродами, содержащими Cl — . указывает на то, что активация каналов K + , активированных Ca 2+ , сама по себе недостаточна для обеспечения разблокировки.Таким образом, нет никаких сомнений в том, что загрузка клетки ацетатом или MeSO 4 каким-то образом отвечает за удаление 4-AP из комплекса каналов. Возможных объяснений действия ацетата может быть несколько. Один из них может происходить через изменение внутриклеточного pH, к которому большинство типов ионных каналов очень чувствительно (Tombaugh & Somjen, 1996), однако восстановление блока в этом случае не должно быть возможным в постоянном присутствии ацетата. Другой механизм может заключаться в активации внеклеточных аденозиновых рецепторов.Однако в настоящем исследовании внеклеточный ацетат не влиял на блокировку, индуцированную 4-АР, что исключает эту возможность и дополнительно поддерживает прямое действие внутриклеточного ацетата. Третье и более правдоподобное объяснение состоит в том, что ацетат напрямую взаимодействует со связыванием 4-АР с активированными Ca 2+ каналами K + , что приводит к удалению 4-АР. Если да, то как тогда можно восстановить блок, просто вставив паузу в активацию каналов? Одно из объяснений может заключаться в том, что связывание ацетата, а не несвязывание 4-AP зависит от активности.Возможно, что связывание Ca 2+ с 4-AP-чувствительным Ca 2+ -активированным каналом K + приводит к конформационным изменениям, как предполагалось для каналов SK (Keen et al ., 1999), открывающий сайт связывания ацетата. Связывание ацетата с комплексом каналов могло, в свою очередь, привести к изменению сродства к 4-AP.
Другой механизм может заключаться в активации внеклеточных аденозиновых рецепторов.Однако в настоящем исследовании внеклеточный ацетат не влиял на блокировку, индуцированную 4-АР, что исключает эту возможность и дополнительно поддерживает прямое действие внутриклеточного ацетата. Третье и более правдоподобное объяснение состоит в том, что ацетат напрямую взаимодействует со связыванием 4-АР с активированными Ca 2+ каналами K + , что приводит к удалению 4-АР. Если да, то как тогда можно восстановить блок, просто вставив паузу в активацию каналов? Одно из объяснений может заключаться в том, что связывание ацетата, а не несвязывание 4-AP зависит от активности.Возможно, что связывание Ca 2+ с 4-AP-чувствительным Ca 2+ -активированным каналом K + приводит к конформационным изменениям, как предполагалось для каналов SK (Keen et al ., 1999), открывающий сайт связывания ацетата. Связывание ацетата с комплексом каналов могло, в свою очередь, привести к изменению сродства к 4-AP. Это означает, что ацетат сможет связываться с каналами только после связывания Ca 2+ . В настоящих экспериментальных условиях это в первую очередь будет происходить во время надпорогового деполяризующего импульса тока, когда внутриклеточный Ca 2+ поднимется выше уровня покоя.Если стимуляция прекращена, внутриклеточная концентрация Ca 2+ снизится до уровней покоя, и Ca 2+ покинет свой сайт связывания на каналах K + , что приведет к обращению конформационных изменений, делая сайт связывания ацетата недоступным. снова. Во время паузы ацетат затем развязывается, позволяя 4-AP повторно связываться с каналом, несмотря на присутствие ацетата. Для полного восстановления блока, вызванного 4-AP, пауза должна быть более 15 минут, что указывает на то, что расщепление ацетата является медленным процессом.Эта гипотеза не противоречит результатам, полученным при совместном внутриклеточном применении 4-АР и ацетата. Во время задержки между проникновением и началом стимуляции (83 с) каналы K + , активированные Ca 2+ , будут находиться в своем закрытом состоянии, и 4-AP будет иметь доступ к своему сайту связывания.
Это означает, что ацетат сможет связываться с каналами только после связывания Ca 2+ . В настоящих экспериментальных условиях это в первую очередь будет происходить во время надпорогового деполяризующего импульса тока, когда внутриклеточный Ca 2+ поднимется выше уровня покоя.Если стимуляция прекращена, внутриклеточная концентрация Ca 2+ снизится до уровней покоя, и Ca 2+ покинет свой сайт связывания на каналах K + , что приведет к обращению конформационных изменений, делая сайт связывания ацетата недоступным. снова. Во время паузы ацетат затем развязывается, позволяя 4-AP повторно связываться с каналом, несмотря на присутствие ацетата. Для полного восстановления блока, вызванного 4-AP, пауза должна быть более 15 минут, что указывает на то, что расщепление ацетата является медленным процессом.Эта гипотеза не противоречит результатам, полученным при совместном внутриклеточном применении 4-АР и ацетата. Во время задержки между проникновением и началом стимуляции (83 с) каналы K + , активированные Ca 2+ , будут находиться в своем закрытом состоянии, и 4-AP будет иметь доступ к своему сайту связывания. Как только начинается стимуляция, Ca 2+ начинает связываться с каналами, делая доступным сайт связывания для ацетата; Затем ацетат свяжется, а 4-AP расщепится.Известно, что анионы влияют на различные типы каналов K + либо напрямую (Adams & Oxford, 1983; Zhang et al ., 1994), либо косвенно через вторичных мессенджеров (Morita et al ., 1980; Nakajima ). et al ., 1992). В случае отсроченного выпрямления каналов K + в аксонах гигантских кальмаров неорганические анионы, такие как фторид, F — и Cl — уменьшают этот ток, тогда как органические анионы этого не делают (Adams & Oxford, 1983).Интересно, что этому блоку, индуцированному анионами, можно частично противодействовать, добавляя низкие концентрации ионов 4-АР или тетраэтиламмония. Таким образом, взаимодействие между анионами, 4-AP и белками каналов K + имеет приоритет.
Как только начинается стимуляция, Ca 2+ начинает связываться с каналами, делая доступным сайт связывания для ацетата; Затем ацетат свяжется, а 4-AP расщепится.Известно, что анионы влияют на различные типы каналов K + либо напрямую (Adams & Oxford, 1983; Zhang et al ., 1994), либо косвенно через вторичных мессенджеров (Morita et al ., 1980; Nakajima ). et al ., 1992). В случае отсроченного выпрямления каналов K + в аксонах гигантских кальмаров неорганические анионы, такие как фторид, F — и Cl — уменьшают этот ток, тогда как органические анионы этого не делают (Adams & Oxford, 1983).Интересно, что этому блоку, индуцированному анионами, можно частично противодействовать, добавляя низкие концентрации ионов 4-АР или тетраэтиламмония. Таким образом, взаимодействие между анионами, 4-AP и белками каналов K + имеет приоритет.
Интересным наблюдением было то, что 4-AP, когда вводился во время записи с электродами, содержащими ацетат, давал уменьшение sAHP и, кроме того, блок оставался стабильным в течение всего периода записи (и). С другой стороны, когда использовался Cl —, введение 4-AP приводило к прогрессивному снижению sAHP, как и ожидалось, до уровня, аналогичного тому, который наблюдался, когда 4-AP присутствовал до начала эксперимента. .Тот факт, что с электродами, содержащими ацетат, стабильность индуцированного 4-AP блока зависела от того, был ли 4-AP был введен до или после нагрузки ацетатом, нелегко объяснить с помощью вышеприведенной гипотезы. Однако одна возможность состоит в том, что длительное воздействие 4-AP каким-то образом подготовило медленные Ca 2+ -активированные каналы K + для связывания ацетата. Недавно сообщалось, что 4-AP в используемом здесь диапазоне концентраций увеличивает активность фосфолипазы C, что приводит к увеличению внутриклеточного инозитолтрифосфата и диацилглицерина в нейронах и астроцитах (Grimaldi et al ., 2001). Это может приводить к увеличению активности Ca 2+ -кальмодулинкиназы и / или протеинкиназы C, которые затем посредством фосфорилирования могут запускать медленные Ca 2+ -активированные каналы K + .
С другой стороны, когда использовался Cl —, введение 4-AP приводило к прогрессивному снижению sAHP, как и ожидалось, до уровня, аналогичного тому, который наблюдался, когда 4-AP присутствовал до начала эксперимента. .Тот факт, что с электродами, содержащими ацетат, стабильность индуцированного 4-AP блока зависела от того, был ли 4-AP был введен до или после нагрузки ацетатом, нелегко объяснить с помощью вышеприведенной гипотезы. Однако одна возможность состоит в том, что длительное воздействие 4-AP каким-то образом подготовило медленные Ca 2+ -активированные каналы K + для связывания ацетата. Недавно сообщалось, что 4-AP в используемом здесь диапазоне концентраций увеличивает активность фосфолипазы C, что приводит к увеличению внутриклеточного инозитолтрифосфата и диацилглицерина в нейронах и астроцитах (Grimaldi et al ., 2001). Это может приводить к увеличению активности Ca 2+ -кальмодулинкиназы и / или протеинкиназы C, которые затем посредством фосфорилирования могут запускать медленные Ca 2+ -активированные каналы K + . Причина, по которой разблокирование наблюдается только в том случае, если 4-AP присутствует в течение некоторого времени, а не во время начальной перфузии 4-AP, может заключаться в том, что требуется некоторое время, чтобы внутриклеточная концентрация 4-AP стала достаточно высокой для повышения активности. ПЛК. Одна вещь, которая, кажется, возражает против этого, — это эксперименты, в которых 4-AP и ацетат вводили совместно внутриклеточно.Здесь наблюдалась разблокировка, хотя 4-AP присутствовал в среднем только около 90 с. Причина этого может заключаться в том, что из-за более высокой концентрации 4-AP в электроде внутриклеточная концентрация 4-AP увеличивается намного быстрее, чем при внесении 4-AP внеклеточно.
Причина, по которой разблокирование наблюдается только в том случае, если 4-AP присутствует в течение некоторого времени, а не во время начальной перфузии 4-AP, может заключаться в том, что требуется некоторое время, чтобы внутриклеточная концентрация 4-AP стала достаточно высокой для повышения активности. ПЛК. Одна вещь, которая, кажется, возражает против этого, — это эксперименты, в которых 4-AP и ацетат вводили совместно внутриклеточно.Здесь наблюдалась разблокировка, хотя 4-AP присутствовал в среднем только около 90 с. Причина этого может заключаться в том, что из-за более высокой концентрации 4-AP в электроде внутриклеточная концентрация 4-AP увеличивается намного быстрее, чем при внесении 4-AP внеклеточно.
Подводя итог, настоящее исследование предоставляет доказательства индуцированного 4-AP блока дендритного и соматического медленного Ca 2+ -активированного тока K + в ПК CA1 гиппокампа. Предполагается, что 4-AP связывается непосредственно с цитоплазматическими сайтами этого канала и что сайт связывания доступен, когда канал находится в закрытом состоянии покоя. Хотя 4-AP-чувствительные Ca 2+ -активированные каналы K + кажутся отличными от SK-каналов, важно отметить, что настоящее исследование не исключает возможности того, что 4-AP также влияет на Каналы СК. Внутриклеточная нагрузка ацетата или MeSO 4 приводила к сложному, зависящему от активности удалению индуцированного 4-AP блока, тогда как блок был стабильным при использовании Cl —. Анион-зависимое удаление наблюдалось только тогда, когда 4-AP уже присутствовал при начале записи.Когда 4-AP вводился во время записи, стабильный блок sAHP индуцировался независимо от типа аниона, используемого в растворе электрода. Настоящее исследование важно не только в отношении действия 4-AP, но также подчеркивает необходимость рассмотрения влияния различных типов органических и неорганических анионов на кинетику ионных каналов, взаимодействия лекарств, системы вторичных мессенджеров и т. Д. Исследование также показывает, что использование различных анионов в сочетании с 4-AP может быть потенциально полезным для изучения функционального значения и молекулярной структуры медленных Ca 2+ -активированных токов K + .
Хотя 4-AP-чувствительные Ca 2+ -активированные каналы K + кажутся отличными от SK-каналов, важно отметить, что настоящее исследование не исключает возможности того, что 4-AP также влияет на Каналы СК. Внутриклеточная нагрузка ацетата или MeSO 4 приводила к сложному, зависящему от активности удалению индуцированного 4-AP блока, тогда как блок был стабильным при использовании Cl —. Анион-зависимое удаление наблюдалось только тогда, когда 4-AP уже присутствовал при начале записи.Когда 4-AP вводился во время записи, стабильный блок sAHP индуцировался независимо от типа аниона, используемого в растворе электрода. Настоящее исследование важно не только в отношении действия 4-AP, но также подчеркивает необходимость рассмотрения влияния различных типов органических и неорганических анионов на кинетику ионных каналов, взаимодействия лекарств, системы вторичных мессенджеров и т. Д. Исследование также показывает, что использование различных анионов в сочетании с 4-AP может быть потенциально полезным для изучения функционального значения и молекулярной структуры медленных Ca 2+ -активированных токов K + .
Последние достижения и перспективы двумерных электродов на основе Ti для электрохимического накопления энергии
Двумерные (2D) наноматериалы на основе титана (Ti) были тщательно исследованы из-за их небольшого расширения при деформации, большого количества путей диффузии ионов, высокой безопасности и низкой стоимости. Тем не менее, такие нанолисты на основе Ti обычно обладают плохой электропроводностью и могут легко переупаковываться. Были предприняты большие усилия для решения этих проблем на основе стратегий нанотехнологий и нанотехнологий.В этом обзоре мы рассматриваем недавний прогресс в создании и применении двумерных наноструктур на основе Ti в электрохимических накопителях энергии, таких как суперконденсаторы, литий-ионные аккумуляторы, натрий-ионные аккумуляторы и другие поливалентные металло-ионные аккумуляторы, с акцентом на по кристаллической структуре, электрохимическому механизму накопления энергии и усовершенствованным методам определения характеристик in situ . Наконец, включена перспектива, чтобы выделить проблемы и перспективы использования 2D-материалов на основе Ti для дальнейшего повышения производительности устройств накопления энергии.
Наконец, включена перспектива, чтобы выделить проблемы и перспективы использования 2D-материалов на основе Ti для дальнейшего повышения производительности устройств накопления энергии.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй снова?Мутантный рак p53 перепрограммирует макрофаги в опухоль, поддерживающую макрофаги, через экзосомные miR-1246
Клеточные линии
Использовали следующие линии клеток человека: HCT116 и DLD-1 (p53 изогенная панель WT, null и mutp53, полученная из лаборатории Bert. Фогельштейн в Университете Джона Хопкинса), HT29 (Американская коллекция типовых культур (ATCC)), h458 (ATCC).Все клеточные линии были аутентифицированы с использованием анализа с короткими тандемными повторами 62 (Национальная лаборатория исследований рака им. Фредерика) и проверены в базе данных STR (http://strdb.cogcell.org/search_strname.php). Клетки HCT116 культивировали в Mckoy’s 5A, клетки HT29 в DMEM, DLD-1 и h458 культивировали в RPMI 1640. Все линии были дополнены 10% обедненным экзосомами FBS (SBI), сыворотка для клеток h458 не содержала тетрациклина. (ГИБКО). Кроме того, во все среды добавляли 100 мкг мл -1 пенициллина и 100 мкг мл -1 стрептомицина.Все клеточные линии были протестированы на загрязнение микоплазмами и содержались во влажной атмосфере при 5% CO 2 при 37 ° C. Клетки HT29 вводили с помощью стабильной трансфекции shRNA либо скремблированными неспецифическими олигонуклеотидами (ShCon), либо специфическими олигонуклеотидами, нацеленными на p53 (Shp53).
Фогельштейн в Университете Джона Хопкинса), HT29 (Американская коллекция типовых культур (ATCC)), h458 (ATCC).Все клеточные линии были аутентифицированы с использованием анализа с короткими тандемными повторами 62 (Национальная лаборатория исследований рака им. Фредерика) и проверены в базе данных STR (http://strdb.cogcell.org/search_strname.php). Клетки HCT116 культивировали в Mckoy’s 5A, клетки HT29 в DMEM, DLD-1 и h458 культивировали в RPMI 1640. Все линии были дополнены 10% обедненным экзосомами FBS (SBI), сыворотка для клеток h458 не содержала тетрациклина. (ГИБКО). Кроме того, во все среды добавляли 100 мкг мл -1 пенициллина и 100 мкг мл -1 стрептомицина.Все клеточные линии были протестированы на загрязнение микоплазмами и содержались во влажной атмосфере при 5% CO 2 при 37 ° C. Клетки HT29 вводили с помощью стабильной трансфекции shRNA либо скремблированными неспецифическими олигонуклеотидами (ShCon), либо специфическими олигонуклеотидами, нацеленными на p53 (Shp53). Плазмиды были сконструированы с двумя отдельными наборами олигонуклеотидов со следующими последовательностями: ctccactacaactacatgtgta или cccggcgcacagaggaagagaa и использованы для нокдауна p53, чтобы исключить нецелевые эффекты. Клетки h458 были сконструированы и вставлены с помощью векторов индуцируемой трансактивации.Полноразмерную кДНК р53 вставляли в вектор pLenti6.3 / TO / V5-DEST (Invitrogen). Четыре различные мутации (V157F, R175H, R249S и R273H) были созданы посредством сайт-направленного мутагенеза с использованием набора для сайт-направленного мутагенеза QuikChange II XL (Agilent Technologies). Сначала трансактиватор был преобразован (pLenti3.3 / TR -Invitrogen) и выбран (G418). После получения стабильной линии полноразмерные лентивирусные векторы трансдуцировали после отбора бластицидина.
Плазмиды были сконструированы с двумя отдельными наборами олигонуклеотидов со следующими последовательностями: ctccactacaactacatgtgta или cccggcgcacagaggaagagaa и использованы для нокдауна p53, чтобы исключить нецелевые эффекты. Клетки h458 были сконструированы и вставлены с помощью векторов индуцируемой трансактивации.Полноразмерную кДНК р53 вставляли в вектор pLenti6.3 / TO / V5-DEST (Invitrogen). Четыре различные мутации (V157F, R175H, R249S и R273H) были созданы посредством сайт-направленного мутагенеза с использованием набора для сайт-направленного мутагенеза QuikChange II XL (Agilent Technologies). Сначала трансактиватор был преобразован (pLenti3.3 / TR -Invitrogen) и выбран (G418). После получения стабильной линии полноразмерные лентивирусные векторы трансдуцировали после отбора бластицидина.
Выделение моноцитов и культура макрофагов
Кровь была получена от здоровых доноров в банке крови Национального института здоровья после получения информированного согласия всех субъектов и рекомендаций банка крови Национального института здоровья. PBMC из лейкоцитов выделяли центрифугированием в градиенте плотности Histopaque-1077 (Sigma-Aldrich) при 400 × g в течение 20 мин. Впоследствии PBMC подверглись отрицательной селекции на моноциты CD14 с использованием набора EasySep ™ Human Monocyte Enrichment Kit (StemCell Technologies) в соответствии с инструкциями производителя. Отобранные моноциты затем высевали в шесть лунок по 5 × 10 6 на лунку в среде для прикрепления моноцитов (PromoCell). Через 1 час неприлипшие клетки удаляли повторной промывкой, а оставшуюся прилипшую фракцию культивировали тремя различными способами, как указано ниже: (1) В среде DXF (Promocell) для неактивированных макрофагов M0.(2) В среде активации M1 (Promocell) для классически активированных макрофагов M1. (3) В среде активации M2 (PromoCell) для альтернативно активированных макрофагов M2. Через 6 дней добавляли дополнительную порцию свежей среды вместе с LPS + IFN-γ (50 нг мл -1 для макрофагов M1), IL-4 (50 нг мл -1 для макрофагов M2) или без дополнительных цитокинов ( для макрофагов M0).
PBMC из лейкоцитов выделяли центрифугированием в градиенте плотности Histopaque-1077 (Sigma-Aldrich) при 400 × g в течение 20 мин. Впоследствии PBMC подверглись отрицательной селекции на моноциты CD14 с использованием набора EasySep ™ Human Monocyte Enrichment Kit (StemCell Technologies) в соответствии с инструкциями производителя. Отобранные моноциты затем высевали в шесть лунок по 5 × 10 6 на лунку в среде для прикрепления моноцитов (PromoCell). Через 1 час неприлипшие клетки удаляли повторной промывкой, а оставшуюся прилипшую фракцию культивировали тремя различными способами, как указано ниже: (1) В среде DXF (Promocell) для неактивированных макрофагов M0.(2) В среде активации M1 (Promocell) для классически активированных макрофагов M1. (3) В среде активации M2 (PromoCell) для альтернативно активированных макрофагов M2. Через 6 дней добавляли дополнительную порцию свежей среды вместе с LPS + IFN-γ (50 нг мл -1 для макрофагов M1), IL-4 (50 нг мл -1 для макрофагов M2) или без дополнительных цитокинов ( для макрофагов M0). Еще через 3 дня (день 9) среду заменяли и добавляли цитокины, как в день 6. Все эксперименты проводили между 10 и 12 днями.
Еще через 3 дня (день 9) среду заменяли и добавляли цитокины, как в день 6. Все эксперименты проводили между 10 и 12 днями.
Совместное культивирование опухолевых клеток и макрофагов
Выделенные моноциты высевали в нижнюю камеру шестилуночного аппарата с размером пор 0,4 мкм (Corning, Lowell, MA, USA) и дифференцировали в макрофаги, как описано выше. Через 6 дней опухолевые клетки (HCT116, HT29, h458 или DLD-1) высевали в верхние вставки и совместно культивировали в течение дополнительных 3-5 дней. Плотность клеток была следующей: HCT116—1,5 × 10 4 клеток / вставка, HT29— 5 × 10 4 клеток / вставка, h458—3 × 10 4 клеток / вставка и DLD-1—3 × 10. 4 ячеек / вставка.
Выделение экзосом из клеток и плазмы
Клетки выращивали в колбах Т162 см 2 (3 × 10 6 на колбу) в течение 5–6 дней. Затем среду собирали и центрифугировали при 500 × g в течение 5 минут с последующей стадией центрифугирования 15000 × g в течение 30 минут для удаления клеточного мусора. Затем среду фильтровали с использованием фильтра с размером пор 0,22 мкм (Steriflip, Millipore). Собранные среды затем ультрацентрифугировали при 100000 × g на 1.5 часов при 4 ° C. Осадок экзосом промывали 24 мл PBS с последующей второй стадией ультрацентрифугирования при 100000 × g в течение 1,5 ч при 4 ° C. После этого супернатант отбрасывали. Экзосомы, использованные для экстракции РНК, ТЕМ и NTA, ресуспендировали в 50 мкл PBS. Пять микролитров этих образцов экзосом использовали для анализа NanoSight LM10 (NanoSight Ltd) после разведения 1: 100 в PBS. Экзосомы, используемые для экстракции белка, ресуспендировали в 20–30 мкл лизирующего буфера RIPA. Для экзосом, выделенных из образцов плазмы, взятых у пациентов-людей, замороженную плазму размораживали на льду, 500 мкл бесклеточной плазмы разводили в 24 мл PBS и фильтровали через фильтр 0.Пористый фильтр 2 мкм. После этого образцы обрабатывали, как указано выше.
Затем среду фильтровали с использованием фильтра с размером пор 0,22 мкм (Steriflip, Millipore). Собранные среды затем ультрацентрифугировали при 100000 × g на 1.5 часов при 4 ° C. Осадок экзосом промывали 24 мл PBS с последующей второй стадией ультрацентрифугирования при 100000 × g в течение 1,5 ч при 4 ° C. После этого супернатант отбрасывали. Экзосомы, использованные для экстракции РНК, ТЕМ и NTA, ресуспендировали в 50 мкл PBS. Пять микролитров этих образцов экзосом использовали для анализа NanoSight LM10 (NanoSight Ltd) после разведения 1: 100 в PBS. Экзосомы, используемые для экстракции белка, ресуспендировали в 20–30 мкл лизирующего буфера RIPA. Для экзосом, выделенных из образцов плазмы, взятых у пациентов-людей, замороженную плазму размораживали на льду, 500 мкл бесклеточной плазмы разводили в 24 мл PBS и фильтровали через фильтр 0.Пористый фильтр 2 мкм. После этого образцы обрабатывали, как указано выше.
Анализ отслеживания наночастиц
Анализ отслеживания наночастиц Измерения выполняли с использованием прибора NanoSight NS500 (NanoSight NTA 2. 3) в соответствии с инструкциями производителя. Образцы обрабатывали в двух экземплярах и разбавляли PBS (1: 100) перед анализом. Настройки NTA после сбора данных были оптимизированы и поддерживались постоянными между образцами, для каждого образца были записаны три видеоролика продолжительностью 60 секунд, которые были проанализированы для получения среднего, модового и медианного размера частиц вместе с оценкой количества частиц.
3) в соответствии с инструкциями производителя. Образцы обрабатывали в двух экземплярах и разбавляли PBS (1: 100) перед анализом. Настройки NTA после сбора данных были оптимизированы и поддерживались постоянными между образцами, для каждого образца были записаны три видеоролика продолжительностью 60 секунд, которые были проанализированы для получения среднего, модового и медианного размера частиц вместе с оценкой количества частиц.
Электронная микроскопия
Экзосомы получали, как описано ранее 63 . Вкратце, экзосомы фиксировали 2% параформальдегидом, адсорбировали на сетках из углеродной пленки, фиксировали 1% глутаральдегидом, промывали водой и затем окрашивали уранилоксалатом. Затем образцы заливали смесью 9: 1 2% метилцеллюлозы и 4% уранилацетата. Затем внедренные образцы анализировали с помощью электронной микроскопии. Изображения были записаны на TEM Hitachi H7650 с камерой AMT CCD 2k × 2k.
Градиент плотности Optiprep
Прерывистые градиенты йодиксанола (по 6 мл каждый), содержащие 40, 20, 10 и 5% растворы йодиксанола, были приготовлены разбавлением исходного раствора OptiPrep ™ (60%) водного йодиксанола (Sigma-Aldrich) с 0,25 м сахарозы / 10 мМ Трис, pH 7,5. Каждый препарат экзосом индивидуально накладывали на градиент, и центрифугирование выполняли при 100000 × g в течение 18 часов при 4 ° C. Восемь отдельных фракций градиента по 3 мл (с возрастающей плотностью) собирали вручную и задавали значения от F1 до F8.Фракции разбавляли 20 мл PBS и центрифугировали при 100000 × g в течение 1,5 ч при 4 ° C и ресуспендировали либо в 50 мкл PBS, либо в 20 мкл буфера RIPA, в зависимости от последующего применения.
Каждый препарат экзосом индивидуально накладывали на градиент, и центрифугирование выполняли при 100000 × g в течение 18 часов при 4 ° C. Восемь отдельных фракций градиента по 3 мл (с возрастающей плотностью) собирали вручную и задавали значения от F1 до F8.Фракции разбавляли 20 мл PBS и центрифугировали при 100000 × g в течение 1,5 ч при 4 ° C и ресуспендировали либо в 50 мкл PBS, либо в 20 мкл буфера RIPA, в зависимости от последующего применения.
Вестерн-блоттинг
Клетки и экзосомы лизировали в буфере RIPA (Cell Signaling). Нагрузку образца нормализовали в соответствии с набором для анализа белков BCA (Pierce), и белки разделяли в соответствии с электрофоретическим градиентом через полиакриламидные гели. Влажный электрофоретический перенос использовали для переноса белков в геле на 0.Мембраны из ПВДФ с размером пор 45 мкм (Novex). Белковый блот блокировали в течение 1 ч при комнатной температуре с помощью стартового блока (Thermo) и инкубировали в течение ночи при 4 ° C со следующими первичными антителами: анти-калнексин (Abcam, ab22595), анти-Alix (Cell Signaling, 3A9), анти -TSG-101 (Abcam, ab83), анти-CD9 (SBI, ExoAb-kit-1). Все антитела разводили 1: 1000. После этого вторичные антитела, конъюгированные с пероксидазой хрена (HRP) (EMD Millipore, 12-348 и 12-349, 1: 5000), инкубировали в течение 40 минут при комнатной температуре.Промывки после инкубации антител проводили на орбитальном шейкере три раза с 10-минутными интервалами с TBS-Tween20. Блоты проявляли с помощью суперсигнальных хемилюминесцентных реагентов Dura и Pico (Thermo). Необрезанные версии всех изображений вестерн-блоттинга представлены в конце дополнительной информации, прилагаемой к этой статье.
Все антитела разводили 1: 1000. После этого вторичные антитела, конъюгированные с пероксидазой хрена (HRP) (EMD Millipore, 12-348 и 12-349, 1: 5000), инкубировали в течение 40 минут при комнатной температуре.Промывки после инкубации антител проводили на орбитальном шейкере три раза с 10-минутными интервалами с TBS-Tween20. Блоты проявляли с помощью суперсигнальных хемилюминесцентных реагентов Dura и Pico (Thermo). Необрезанные версии всех изображений вестерн-блоттинга представлены в конце дополнительной информации, прилагаемой к этой статье.
TP53 секвенирование.
ДНК экстрагировали из образцов ткани FFPE с использованием набора QIAmp DNA FFPE Tissue (Qiagen) в соответствии с протоколами производителя.Геномные библиотеки получали с использованием методов секвенирования меченных ампликонов, описанных ранее 64 . Библиотеки были количественно определены с помощью набора для количественной оценки библиотек KAPA qPCR и секвенированы на секвенаторах MiSeq или HiSeq (Illumina) с использованием протоколов секвенирования парных концов 150 или 125 пар оснований. Считанные данные были демультиплексированы в соответствии с характерными для образца штрих-кодами и выровнены по эталонному геному (hg19) с помощью BWA (0.7.5a). Мутации вызывались и количественно оценивались с помощью настраиваемых конвейеров вызова, как описано ранее 65.
Считанные данные были демультиплексированы в соответствии с характерными для образца штрих-кодами и выровнены по эталонному геному (hg19) с помощью BWA (0.7.5a). Мутации вызывались и количественно оценивались с помощью настраиваемых конвейеров вызова, как описано ранее 65.
Выделение РНК и количественная ПЦР
РНК клеток и экзосом выделяли с использованием набора miRNeasy Micro Kit (Qiagen) в соответствии с протоколом производителя. РНК количественно определяли с помощью Nanodrop ND-1000 (Thermo Fisher Scientific) и подвергали обратной транскрипции с помощью набора для обратной транскрипции TaqMan MicroRNA для анализа miRNA (Applied Biosystems, Foster City, California) или набора для обратной транскрипции кДНК High capacity (Applied Biosystems). Количественная ПЦР выполнялась с использованием тестов TaqMan (Applied Biosystems, Foster City, California) в соответствии с инструкциями производителя с использованием системы RT-PCR 7500 HT в реальном времени (Applied Biosystems, Foster City). Все зонды TaqMan были приобретены в Applied Biosystems. Все микроРНК были нормализованы до RNU48 с использованием метода -ΔCt, в то время как экспрессия мРНК была нормализована до GAPDH. И GAPDH, и RNU48 были протестированы на различия между группами лечения, и было обнаружено, что они находятся на аналогичных уровнях. Были использованы следующие зонды Taqman:
Все зонды TaqMan были приобретены в Applied Biosystems. Все микроРНК были нормализованы до RNU48 с использованием метода -ΔCt, в то время как экспрессия мРНК была нормализована до GAPDH. И GAPDH, и RNU48 были протестированы на различия между группами лечения, и было обнаружено, что они находятся на аналогичных уровнях. Были использованы следующие зонды Taqman:
CXCL8 (IL-8) ID анализа: Hs00174103m1,
ID анализа TNF-α: Hs00174128m1
ID анализа IL-10: Hs00961622m1
CCL200 ID анализа
CCL200234 : Hs00998133m1
Идентификатор анализа VEGFA: Hs00
Идентификатор анализа GAPDH: Hs0278624g1
Идентификатор анализа miR-1246: CS6RNBN
miR-4454 Идентификатор анализа:
miR-4454 ID анализа: 4618100306mat 9000UR-4454 ID анализа Hs009000R-9000R-9000R-2148 был извлечен из тканей колоректального рака с использованием Trizol в соответствии с инструкциями производителя и проанализирован на массивах Affymetrix U133A.Данные были импортированы и нормализованы RMA с помощью Partek Genomics Suite 6. 5. Для набора миметиков / ингибиторов miR-1246: Общую РНК выделяли с помощью микронабора miRNAeasy от Qiagen. Качество РНК проверяли на Agilent Bioanalyzer. Все образцы, использованные для анализа на микрочипах, имели высокий балл (RIN> 9). РНК (100 нг) подвергали обратной транскрипции и амплифицировали с использованием набора реагентов GeneChip WT plus Reagent, следуя протоколу, предложенному производителем. КДНК смысловой цепи фрагментировали и метили с использованием набора для мечения концевых концов Affymetrix WT.Четыре реплики каждой группы гибридизовали с мышью Affymetrix (человек) Gene ST 1.0 GeneChip в печи для гибридизации Affymetrix при 45 ° C, 60 об / мин в течение 16 часов. Промывку и окрашивание проводили на Affymetrix Fluidics Station 450 и сканировали на сканере Affymetrix GeneChip 3000. Данные собирали с использованием программного обеспечения Affymetrix AGCC и анализировали с помощью программного обеспечения BRB-ArrayTools.
5. Для набора миметиков / ингибиторов miR-1246: Общую РНК выделяли с помощью микронабора miRNAeasy от Qiagen. Качество РНК проверяли на Agilent Bioanalyzer. Все образцы, использованные для анализа на микрочипах, имели высокий балл (RIN> 9). РНК (100 нг) подвергали обратной транскрипции и амплифицировали с использованием набора реагентов GeneChip WT plus Reagent, следуя протоколу, предложенному производителем. КДНК смысловой цепи фрагментировали и метили с использованием набора для мечения концевых концов Affymetrix WT.Четыре реплики каждой группы гибридизовали с мышью Affymetrix (человек) Gene ST 1.0 GeneChip в печи для гибридизации Affymetrix при 45 ° C, 60 об / мин в течение 16 часов. Промывку и окрашивание проводили на Affymetrix Fluidics Station 450 и сканировали на сканере Affymetrix GeneChip 3000. Данные собирали с использованием программного обеспечения Affymetrix AGCC и анализировали с помощью программного обеспечения BRB-ArrayTools.
Набор цитокинов
Proteome Profiler Human Cytokine Array Kit, Panel A (R&D) использовали в соответствии с инструкциями производителя. Среды собирали через 3 дня совместного культивирования.
Среды собирали через 3 дня совместного культивирования.
Наностринговый анализ экспрессии miRNA
Профилирование уровней экзосомальных miRNA было выполнено с использованием технологии Nanostring (Ncounter Human v2 miRNA Expression Assay) для анализа miRNA 800 человеческих miRNA. Вся подготовка и обработка образцов выполнялись в соответствии с протоколом производителя. Гибридизированные зонды очищали и подсчитывали на nCounter Prep Station и цифровом анализаторе (NanoString) в соответствии с инструкциями производителя.Для каждого анализа выполнялось сканирование с высокой плотностью (600 полей зрения). Исходные данные были нормализованы до 100 лучших miR с использованием программного обеспечения nSolver analysis 2.5 (Nanostring).
Иммуногистохимия (ИГХ)
Для анализа ИГХ были использованы следующие антитела: анти-p53 (DO7, sc47698, Santa Cruz; 1: 100), анти-CD206 (ab64693, Abcam; 1: 1500), анти-цитокератин 20 (MA5-13263), анти-CD163 (NCL-CD163, Novocastra-Leica; 1: 100) и анти-FOXP3 (ab22510, Abcam; 1: 200). ИГХ проводили на залитых парафином тканях.Разоблачение поиска антигена проводили методом теплового извлечения антигена в 10 мМ лимонной кислоте (pH 6,0). Использовали систему обнаружения UltraVision LP (# TL-060-HD, Thermo Scientific, Bioanalytica, Греция) в соответствии с инструкциями производителя. Для проявления окраски использовали тетрагидрохлорид 3,3′-диаминобензидина (Sigma) и гематоксилин в качестве контрастного красителя. Оценка р53 выполнялась, как описано ранее 12,62 . Оценку CD206, CD163 и FOXP3 проводили путем подсчета количества положительных иммунных клеток в поле высокого увеличения (увеличение × 400) внутри опухолевых гнезд во всей раковой ткани и отдельно в инвазивном фронте.Клетки Купфера в печени человека, а также в плаценте человека служили в качестве положительного контроля для окрашивания CD163 и CD206. Миндалины человека использовали в качестве положительного контроля для окрашивания FOXP3. Три независимых наблюдателя провели исследование слайдов с минимальной вариабельностью между наблюдателями.
ИГХ проводили на залитых парафином тканях.Разоблачение поиска антигена проводили методом теплового извлечения антигена в 10 мМ лимонной кислоте (pH 6,0). Использовали систему обнаружения UltraVision LP (# TL-060-HD, Thermo Scientific, Bioanalytica, Греция) в соответствии с инструкциями производителя. Для проявления окраски использовали тетрагидрохлорид 3,3′-диаминобензидина (Sigma) и гематоксилин в качестве контрастного красителя. Оценка р53 выполнялась, как описано ранее 12,62 . Оценку CD206, CD163 и FOXP3 проводили путем подсчета количества положительных иммунных клеток в поле высокого увеличения (увеличение × 400) внутри опухолевых гнезд во всей раковой ткани и отдельно в инвазивном фронте.Клетки Купфера в печени человека, а также в плаценте человека служили в качестве положительного контроля для окрашивания CD163 и CD206. Миндалины человека использовали в качестве положительного контроля для окрашивания FOXP3. Три независимых наблюдателя провели исследование слайдов с минимальной вариабельностью между наблюдателями.
Масс-спектрометрия
Кондиционированные среды собирали и концентрировали с использованием концентратора 3k MWCO (Amicon). Затем белки осаждали ацетоном. Осадки протеина солюбилизировали в 6 м мочевины в 100 мМ бикарбонате аммония и расщепляли трипсином в растворе после восстановления и алкилирования йодацетамидом.Полученные пептиды обессоливали на спин-колонке C18 (Pierce) и лиофилизировали. Высушенные пептиды солюбилизировали в 2% ацетонитриле, 0,5% уксусной кислоте, 97,5% воды для анализа на масс-спектрометре Orbitrap Fusion (Thermo). Proteome Discoverer 1.4 (Thermo) использовался для поиска данных о человеческих белках из базы данных UniProt с использованием SequestHT и MSAmanda. Узел Percolator использовался для оценки и ранжирования совпадений пептидов с использованием коэффициента ложного обнаружения 1%.
Проточная цитометрия
Макрофаги отделяли с использованием среды для отделения макрофагов (Promocell).Суспензии единичных клеток окрашивали антителами, специфичными к CD14 (BD Biosciences, 1: 100), CD163 (BD Biosciences, 1: 100) и CD206 (BD Biosciences, 1: 100). В каждом эксперименте в качестве эталона использовали изотипический контроль для каждого антитела. Приблизительно 1 × 10 5 событий было собрано для каждого образца на FACSCalibur (Becton Dickinson), двойном лазере, проточном цитометре с использованием программного обеспечения CellQuest Pro (BD Biosciences) и проанализировано с использованием программного обеспечения FlowJo (Tree Star Inc, Калифорния, США).
В каждом эксперименте в качестве эталона использовали изотипический контроль для каждого антитела. Приблизительно 1 × 10 5 событий было собрано для каждого образца на FACSCalibur (Becton Dickinson), двойном лазере, проточном цитометре с использованием программного обеспечения CellQuest Pro (BD Biosciences) и проанализировано с использованием программного обеспечения FlowJo (Tree Star Inc, Калифорния, США).
Анализ фагоцитоза
После совместного культивирования с опухолевыми клетками, как указано в разделе совместного культивирования, макрофаги собирали с использованием раствора для отделения макрофагов (Promocell) и повторно высевали на восьмикамерное предметное стекло (Lab-tek) при плотность 50 × 10 4 клеток / лунка.На следующий день среду удаляли из лунок и заменяли свежей средой, содержащей Zymosan A BioParticles (Alexa-488, Molecular Probes) в соотношении 100 частиц / клетка в течение 2 часов. Затем макрофаги промывали холодным PBS, фиксировали в 4% PFA, устанавливали и анализировали на предмет фагоцитированных частиц с помощью флуоресцентного микроскопа.
Анализы инвазии / миграции
Измерение импеданса проводили с помощью анализатора клеток в реальном времени ACEA xCELLigence ® (RTCA) DP (Roche Diagnostics, Mannheim, Germany).Все эксперименты проводились в соответствии с инструкциями производителя. Вкратце, электроды из золотой пленки, нанесенные на верхнюю камеру электродных матриц «CIM-plate 16», были покрыты матригелем в течение 2 часов для анализа инвазии, в то время как матригель не использовался для мониторинга миграции. Клетки высевали при плотности 5000–10 000 клеток / лунку.
Анализ внеклеточной деградации матрикса
Мы провели этот анализ с использованием теста QCM ™ Gelatin Invadopodia Assay в соответствии с инструкциями производителя.Вкратце, после совместного культивирования макрофаги удаляли с использованием раствора для отделения макрофагов (Promocell) и высевали на восьмилуночные предметные стекла, покрытые желатином из cy-3. Клетки культивировали на желатиновой матрице в течение 24 часов, а затем окрашивали FITC-фаллоидином и DAPI для визуализации клеток и участков деградации желатина. Для количественного определения активности разложения изображения были получены в конфокальном микроскопе Zeiss LSM 710 (Carl Zeiss), а программное обеспечение Zen light использовалось для профилирования соотношения сигналов между FITC и Cy-3.
Для количественного определения активности разложения изображения были получены в конфокальном микроскопе Zeiss LSM 710 (Carl Zeiss), а программное обеспечение Zen light использовалось для профилирования соотношения сигналов между FITC и Cy-3.
Гибридизация in situ
МикроРНК-зонд LNA TM , меченный двойным DIG (hsa-miR-1246, 610948-360, Exiqon), использовали для визуализации miR-1246. Зонд LNA TM Scramble-miR (699004-360, Exiqon) и зонд LNA TM U6 snRNA (U6, hsa / mmu / rno, 699002-360, Exiqon), зонды с двойной DIG-меткой использовались в качестве отрицательных и положительные контроли соответственно. В соответствии с инструкциями производителя (инструкция по эксплуатации v3.0). Nuclear Fast Red использовался в качестве контрастного красителя. Оценку проводили путем подсчета количества положительных раковых клеток и отдельно стромальных клеток с интенсивным темно-синим сигналом на поле высокой мощности (увеличение × 400).
Флуоресцентная гибридизация in situ — иммунофлуоресценция
Для совместного обнаружения in situ мы последовательно использовали двухэтапный иммунофлуоресцентный процесс: (1) FISH с использованием технологии заблокированной нуклеиновой кислоты (LNA), разработанной Exiqon, обеспечивающей превосходные свойства гибридизации для обнаружение miR-1246. Для дальнейшего повышения чувствительности обнаружения мы использовали зонд с двойной DIG-меткой (hsa-miR-1246, 610948-360, Exiqon), визуализированный с помощью Tyramide Signal Amplification (TSA) Plus Fluorescein System (обновленная версия стандартных тирамидных систем, TSA TM). Plus Fluorescein System, NEL741B001KT, Perkin Elmer), (2) обнаружение IF с использованием анти-CD206 (ab64693, Abcam) или анти-CD163 (NCL-CD163, Novocastra-Leica). Все зонды разводят в 1 × буфере ISH микроРНК в соответствии с инструкцией по эксплуатации v3.0 от Exiqon. Для FISH мы использовали овцы-анти-DIG-POD (11207733910, Roche) перед инкубацией с усилением тирамидного сигнала. Для ИФ мы использовали следующие вторичные антитела: Alexa Fluor ® козлиные анти-кроличьи (568) (A-11011, ThermoFisher Scientific, Invitrogen) и Alexa Fluor ® козы-антимышиные (568) (A-11004). , ThermoFisher Scientific, Invitrogen) связывание с анти-CD206 и анти-CD163 соответственно. Реагент SlowFade ® Gold с DAPI (S36938, Life Technologies) использовался в качестве среды для закрепления.
Для дальнейшего повышения чувствительности обнаружения мы использовали зонд с двойной DIG-меткой (hsa-miR-1246, 610948-360, Exiqon), визуализированный с помощью Tyramide Signal Amplification (TSA) Plus Fluorescein System (обновленная версия стандартных тирамидных систем, TSA TM). Plus Fluorescein System, NEL741B001KT, Perkin Elmer), (2) обнаружение IF с использованием анти-CD206 (ab64693, Abcam) или анти-CD163 (NCL-CD163, Novocastra-Leica). Все зонды разводят в 1 × буфере ISH микроРНК в соответствии с инструкцией по эксплуатации v3.0 от Exiqon. Для FISH мы использовали овцы-анти-DIG-POD (11207733910, Roche) перед инкубацией с усилением тирамидного сигнала. Для ИФ мы использовали следующие вторичные антитела: Alexa Fluor ® козлиные анти-кроличьи (568) (A-11011, ThermoFisher Scientific, Invitrogen) и Alexa Fluor ® козы-антимышиные (568) (A-11004). , ThermoFisher Scientific, Invitrogen) связывание с анти-CD206 и анти-CD163 соответственно. Реагент SlowFade ® Gold с DAPI (S36938, Life Technologies) использовался в качестве среды для закрепления. Положительный и отрицательный контроль метода проверяли с использованием меченой двойным DIG малой ядерной РНК U6 (U6, hsa / mmu / rno, 699002-360, Exiqon) и зондов Scramble-miR (699004-360, Exiqon) соответственно. Чтобы исключить ложноположительное окрашивание, мы провели параллельный эксперимент, исключая каждый раз один из следующих основных реагентов: miR-1246 или анти-CD206 или анти-CD163.
Положительный и отрицательный контроль метода проверяли с использованием меченой двойным DIG малой ядерной РНК U6 (U6, hsa / mmu / rno, 699002-360, Exiqon) и зондов Scramble-miR (699004-360, Exiqon) соответственно. Чтобы исключить ложноположительное окрашивание, мы провели параллельный эксперимент, исключая каждый раз один из следующих основных реагентов: miR-1246 или анти-CD206 или анти-CD163.
Рост опухоли in vivo
Рост и метастазирование опухолей (HCT116, вставленный с вектором mCherry_luciferase) отслеживали с помощью биолюминесцентной визуализации с использованием системы визуализации IVIS.Для визуализации сигнала биолюминесценции опухолевых клеток мышам внутрибрюшинно вводили 100 мкл 10 мг / мл калиевой соли d-люциферина -1 (растворенной в PBS) и снимали изображения биолюминесценции через 10 мин. Изображения были проанализированы с помощью программы Living-Image. Области интереса (ROI) были обозначены обведением каждой области интереса, включая опухоли, легкие и печень, а также пустым фоном в качестве внутреннего контроля.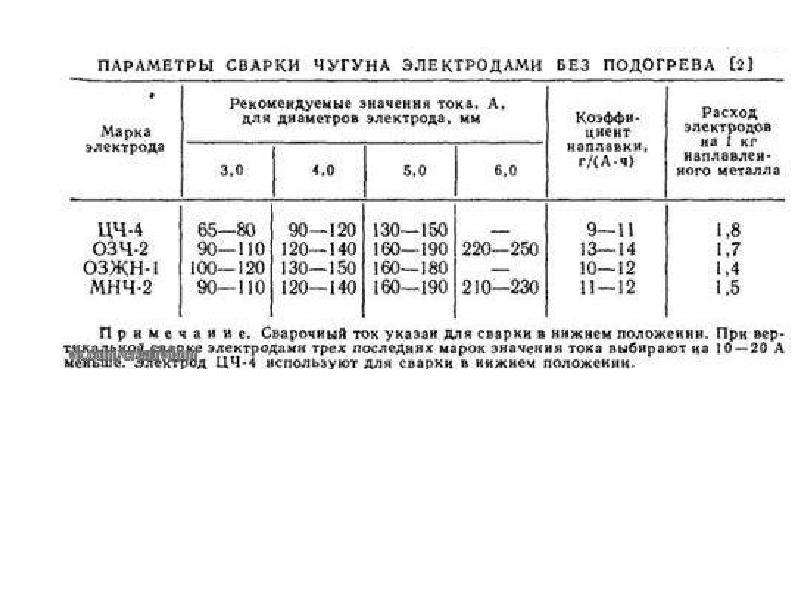 Общая (сумма интенсивности сигнала по всей области интереса), средняя (средняя интенсивность сигнала в любой точке области интереса) и максимальная (наибольшая интенсивность сигнала в любой точке области интереса) эффективности излучения регистрировались для каждой интересующей области.
Общая (сумма интенсивности сигнала по всей области интереса), средняя (средняя интенсивность сигнала в любой точке области интереса) и максимальная (наибольшая интенсивность сигнала в любой точке области интереса) эффективности излучения регистрировались для каждой интересующей области.
Внутриселезеночная инъекция
Всего 5 × 10 5 клеток HCT116 смешивали с 10 5 M2 макрофагов, ресуспендировали в 60 мкл PBS и вводили в нижний полюс селезенки с помощью иглы 29G. Скос иглы наблюдали через капсулу селезенки, чтобы избежать инъекции клеток под селезенку. При инъекции наблюдалось побеление селезенки и кровеносных сосудов.
Статистика
Результаты выражены в виде среднего значения ± SEM. Статистический анализ проводился с использованием программного обеспечения Graphpad / Prism.Средние непрерывные переменные результата были протестированы с помощью двустороннего критерия Стьюдента t . Кумулятивные вероятности общей выживаемости и безрецидивной выживаемости были рассчитаны с помощью метода Каплана-Мейера; и лог-ранговый тест использовался для оценки их статистической значимости. P Значения менее 0,05 считались статистически значимыми.
P Значения менее 0,05 считались статистически значимыми.
Одобрение исследования
Все протоколы, использованные для экспериментов на животных в этом исследовании, были утверждены Руководством / политикой ACUC NCI-Bethesda (ACUC No.LHC-010).
Доступность данных
Данные по экспрессии генов депонированы в базе данных GEOprofiles под кодами доступа GSE44861 и GSE107870. MiR-Chip для данных экзосом, на которые ссылаются во время исследования, доступны в общедоступном репозитории на веб-сайте EVpedia под названием исследования «Cooks». Данные масс-спектрометрии депонированы в базе данных massIVE под инвентарным номером MSV000082047. Авторы заявляют, что все другие данные, подтверждающие выводы этого исследования, доступны в статье и файлах с дополнительной информацией, а также у соответствующего автора по разумному запросу.
Метаболический стресс обратимо активирует светочувствительные каналы дрозофил TRP и TRPL In vivo
Реферат
Дрозофила транзиентный рецепторный потенциал (TRP) является прототипом нового семейства канальных белков, лежащих в основе опосредованного фосфоинозитидом 2+ Ca Вход. Хотя начальные стадии этого сигнального каскада хорошо известны, нисходящие события, ведущие к открытию TRP каналов, все еще остаются неясными. В настоящем исследовании мы применили регистрацию целых клеток и измерения концентрации Ca 2+ с помощью ионоселективных микроэлектродов в глазах нормальной и мутантной Drosophila для выделения TRP и TRP-подобных (TRPL) -зависимых токов. .Мы сообщаем, что аноксия быстро и обратимо деполяризует фоторецепторы и вызывает приток Ca 2+ в эти клетки в темноте. Мы также показываем, что открытия светочувствительных каналов, которые опосредуют эти эффекты, могут быть получены митохондриальными разобщителями или истощением АТФ в фоторецепторных клетках, тогда как эффекты освещения и все формы метаболического стресса были аддитивными. Эффекты, аналогичные тем, которые обнаруживаются у мух дикого типа, также были обнаружены у мутантов с сильными дефектами родопсина, Gq-белка или фосфолипазы C, что указывает на то, что метаболический стресс действует на поздней стадии каскада фототрансдукции.
Хотя начальные стадии этого сигнального каскада хорошо известны, нисходящие события, ведущие к открытию TRP каналов, все еще остаются неясными. В настоящем исследовании мы применили регистрацию целых клеток и измерения концентрации Ca 2+ с помощью ионоселективных микроэлектродов в глазах нормальной и мутантной Drosophila для выделения TRP и TRP-подобных (TRPL) -зависимых токов. .Мы сообщаем, что аноксия быстро и обратимо деполяризует фоторецепторы и вызывает приток Ca 2+ в эти клетки в темноте. Мы также показываем, что открытия светочувствительных каналов, которые опосредуют эти эффекты, могут быть получены митохондриальными разобщителями или истощением АТФ в фоторецепторных клетках, тогда как эффекты освещения и все формы метаболического стресса были аддитивными. Эффекты, аналогичные тем, которые обнаруживаются у мух дикого типа, также были обнаружены у мутантов с сильными дефектами родопсина, Gq-белка или фосфолипазы C, что указывает на то, что метаболический стресс действует на поздней стадии каскада фототрансдукции. Генетическое устранение как TRP, так и TRPL каналов предотвращало эффекты аноксии, митохондриальных разобщителей и истощения АТФ, тем самым демонстрируя, что каналы TRP и TRPL являются специфическими мишенями метаболического стресса. Эти результаты проливают новый свет на свойства каналов TRP и TRPL, показывая, что необходим конститутивный АТФ-зависимый процесс, чтобы держать эти каналы закрытыми в темноте, требование, которое сделало бы их чувствительными к метаболическому стрессу.
Генетическое устранение как TRP, так и TRPL каналов предотвращало эффекты аноксии, митохондриальных разобщителей и истощения АТФ, тем самым демонстрируя, что каналы TRP и TRPL являются специфическими мишенями метаболического стресса. Эти результаты проливают новый свет на свойства каналов TRP и TRPL, показывая, что необходим конститутивный АТФ-зависимый процесс, чтобы держать эти каналы закрытыми в темноте, требование, которое сделало бы их чувствительными к метаболическому стрессу.
Белок транзиентного рецепторного потенциала (TRP) дрозофилы (Minke et al., 1975; Montell and Rubin, 1989) и его гомологичный белок TRP-подобный (TRPL) (Phillips et al., 1992) представляют собой белки фоторецепторных каналов, которые активируются каскадом передачи сигналов липидов инозита (Devary et al., 1987; Bloomquist et al., 1988). Эти каналы составляют основной путь входа Ca 2+ в фоторецепторные клетки (Hardie and Minke, 1992; Peretz et al., 1994a, b; Hardie, 1996; Niemeyer et al., 1996). Мутант trp был выделен как спонтанно возникающий мутант с временным рецепторным потенциалом (Cosens and Manning, 1969; Minke et al., 1975). Впоследствии был выделен мутант trpl (Niemeyer et al., 1996), а у двойного мутанта trpl; trp ответ на свет отменен, что указывает на то, что TRP и TRPL составляют все активируемые светом каналы или необходимы для их активации (Niemeyer et al., 1996; Reuss et al., 1997; Scott et al., 1997).
Мутант trp был выделен как спонтанно возникающий мутант с временным рецепторным потенциалом (Cosens and Manning, 1969; Minke et al., 1975). Впоследствии был выделен мутант trpl (Niemeyer et al., 1996), а у двойного мутанта trpl; trp ответ на свет отменен, что указывает на то, что TRP и TRPL составляют все активируемые светом каналы или необходимы для их активации (Niemeyer et al., 1996; Reuss et al., 1997; Scott et al., 1997).
Клонирование и секвенирование белка TRP Drosophila (Montell and Rubin, 1989) привело к открытию нового семейства канальных белков, связанных с TRP, которые сохраняются на протяжении всей эволюции от Caenorhabditis elegans до человека (для обзор, см. Birnbaumer et al., 1996; Фрил, 1996; Минке и Селинджер, 1996; Монтелл, 1997; Путни и Маккей, 1999; Harteneck et al., 2000). Гетерологическая экспрессия TRP Drosophila продемонстрировала, что TRP является первой молекулярно идентифицированной субъединицей канала, которая может быть активирована истощением запасов Ca 2+ (Vaca et al. , 1994; Petersen et al., 1995; Gillo et al., 1996; Сюй и др., 1997). Это делает белок TRP канала Drosophila ценным инструментом для изучения механизма, лежащего в основе опосредованного фосфоинозитидом входа Ca 2+ и роли TRP позвоночных в этом процессе (Berridge, 1995; Birnbaumer et al., 1996; Фрил, 1996; Киселев и др., 1998; Путни и Маккей, 1999). В самом деле, Drosophila TRP и TRPL каналы довольно уникальны среди членов растущего семейства TRP-связанных каналов, потому что физиологическая функция TRP каналов in vivo известна только для Drosophila . Следовательно, знание свойств Drosophila TRP и TRPL каналов может пролить свет на возможную функцию и механизмы стробирования гомологов TRP позвоночных.
, 1994; Petersen et al., 1995; Gillo et al., 1996; Сюй и др., 1997). Это делает белок TRP канала Drosophila ценным инструментом для изучения механизма, лежащего в основе опосредованного фосфоинозитидом входа Ca 2+ и роли TRP позвоночных в этом процессе (Berridge, 1995; Birnbaumer et al., 1996; Фрил, 1996; Киселев и др., 1998; Путни и Маккей, 1999). В самом деле, Drosophila TRP и TRPL каналы довольно уникальны среди членов растущего семейства TRP-связанных каналов, потому что физиологическая функция TRP каналов in vivo известна только для Drosophila . Следовательно, знание свойств Drosophila TRP и TRPL каналов может пролить свет на возможную функцию и механизмы стробирования гомологов TRP позвоночных.
В настоящем исследовании мы обнаружили, что несколько процессов, вызывающих метаболический стресс, быстро активируют каналы TRP и TRPL в темноте in vivo . Устойчивый эффект метаболического стресса выявил редкое свойство канальных белков. Таким образом, хотя маловероятно, что истощение АТФ является физиологическим механизмом, лежащим в основе активации TRP и TRPL, этот поразительный феномен дает представление о физиологических свойствах каналов TRP и TRPL и делает современные модели механизма их активации сомнительными.
Таким образом, хотя маловероятно, что истощение АТФ является физиологическим механизмом, лежащим в основе активации TRP и TRPL, этот поразительный феномен дает представление о физиологических свойствах каналов TRP и TRPL и делает современные модели механизма их активации сомнительными.
МАТЕРИАЛЫ И МЕТОДЫ
Мухи. Белоглазый Drosophila melanogaster штамма Oregon-R (WT), Musca domestica и Calliphora erythrocephala использовали для экспериментов, как указано. Белоглазые мутанты Drosophila включали trp P343 , norpA P24 , ninaE ora , Gαq1 , а также двойной мутант trpl
15 302 trp .
Электрофизиология, измерения [K + ] и [Ca 2+ ]. Внутриклеточные записи и записи электроретинограммы (ERG) интактной Drosophila выполняли, как описано ранее (Peretz et al., 1994a). Для измерения изменений концентрации Ca 2+ и K + основной метод, применяемый к крупным мухам (Sandler and Kirschfeld, 1991) и к Drosophila (Peretz et al. , 1994a), был выполнен, как описано ранее. в деталях.Препарат Drosophila был идентичен препарату для внутриклеточной регистрации и регистрации ERG. Использовались как двуствольные, так и одноцилиндровые электроды. При использовании одностержневого ионоселективного электрода его вставляли чуть ниже неповрежденной роговицы, а электрод сравнения помещали в электродный гель отдельно на неповрежденную роговицу в центре глаза. Не было обнаружено значительных различий в результатах двух методов, за исключением того, что одноствольный метод вызывал меньшее повреждение глаза (Peretz et al., vk1994a). Для силанизации ионоселективного ствола использовали пары N , N , диметилтриметилсилиламин (Fluka 41720) при 200 ° C по методике Муньоса и др. (1983). Смесь сенсоров Ca 2+ была основана на нейтральном носителе ETH 1001, ионофоре кальция I – Cocktail A (артикул 21048, Fluka D-7910, Ной-Ульм, Германия). Его делали сиропом, добавляя поливинилхлорид (13–16%) и тетрагидрофуран (Aldrich, Milwaukee, WI).
, 1994a), был выполнен, как описано ранее. в деталях.Препарат Drosophila был идентичен препарату для внутриклеточной регистрации и регистрации ERG. Использовались как двуствольные, так и одноцилиндровые электроды. При использовании одностержневого ионоселективного электрода его вставляли чуть ниже неповрежденной роговицы, а электрод сравнения помещали в электродный гель отдельно на неповрежденную роговицу в центре глаза. Не было обнаружено значительных различий в результатах двух методов, за исключением того, что одноствольный метод вызывал меньшее повреждение глаза (Peretz et al., vk1994a). Для силанизации ионоселективного ствола использовали пары N , N , диметилтриметилсилиламин (Fluka 41720) при 200 ° C по методике Муньоса и др. (1983). Смесь сенсоров Ca 2+ была основана на нейтральном носителе ETH 1001, ионофоре кальция I – Cocktail A (артикул 21048, Fluka D-7910, Ной-Ульм, Германия). Его делали сиропом, добавляя поливинилхлорид (13–16%) и тетрагидрофуран (Aldrich, Milwaukee, WI). Смесь сенсоров K + представляла собой ионофор калия I – коктейль B (арт.-Nr.60398, Флука). Значение темноты сетчатки [Ca 2+ ] из в Drosophila , использованное для расчета [Ca 2+ ], составляло 1,43 мм. Это значение было определено в предыдущих исследованиях (Peretz et al., 1994a). Сообщаемый сигнал Ca 2+ во всех записях был дифференциальным: потенциал, измеренный ERG-электродом, вычитался из потенциала Ca 2+ -чувствительного электрода, чтобы получить сигнал Ca, который является мерой [Ca 2 + ] из .
Смесь сенсоров K + представляла собой ионофор калия I – коктейль B (арт.-Nr.60398, Флука). Значение темноты сетчатки [Ca 2+ ] из в Drosophila , использованное для расчета [Ca 2+ ], составляло 1,43 мм. Это значение было определено в предыдущих исследованиях (Peretz et al., 1994a). Сообщаемый сигнал Ca 2+ во всех записях был дифференциальным: потенциал, измеренный ERG-электродом, вычитался из потенциала Ca 2+ -чувствительного электрода, чтобы получить сигнал Ca, который является мерой [Ca 2 + ] из .
Световая стимуляция. Для всех измерений оранжевый свет (OG 590, краевой фильтр Шотта) от ксеноновой лампы высокого давления (PTI, LPS 220, работающая на 50 Вт) подводился к сложному глазу либо с помощью оптоволокна (у неповрежденных мух). ) или как эпи-освещение через линзу объектива ( in situ, ). Максимальная сила света на поверхности глаза была на 1.0 log единицы выше интенсивности для полумаксимальной реакции наиболее распространенного типа фоторецепторов мух (тип R1-6).
Аноксия. Аноксию получали путем продувки азотом (N 2 ) брюшной полости и грудной клетки мухи.Начало и смещение аппликации N 2 сопровождалось артефактом напряжения, вероятно, из-за вызванного N 2 движения глазных мышц (см. Рис. 1, звездочка , ).
Записи всей клетки. Для регистрации патч-клампа целых клеток диссоциированные Drosophila ommatidia получали из недавно появившихся мух (<1 часа после эклозии), и регистрировали патч-зажим целых клеток, как описано ранее (Peretz et al., 1994a). .Для текущих измерений данные были взяты с частотой 1000 Гц с использованием карты Digidata и проанализированы с помощью программного обеспечения pClamp 7.0 (Axon Instruments).
Решение. Раствор ванны содержал (в мм): 120 NaCl, 5 KCl, 10 буфер TES ( N -трис- (гидроксиметил) -метил-2-аминоэтансульфоновая кислота, pH 7,15), 4 MgSO 4 , 1,5 CaCl 2 (кроме случая, когда использовалась среда с низким содержанием Ca 2+ , как указано). Для всех экспериментов использовалось внутреннее решение, которое блокировало каналы K + .Пипетка для регистрации целых клеток содержала (в мм): 120 CsCl, 15 тетраэтиламмоний (TEA) Cl, 2 MgSO 4 , 10 буфер TES, pH 7,15, 4 MgATP, 0,4 Na 2 GTP, 1 NAD. В части экспериментов АТФ и НАД не включались. Внешний раствор перфузировали через перфузионную систему со скоростью 25 камер в минуту.
Для всех экспериментов использовалось внутреннее решение, которое блокировало каналы K + .Пипетка для регистрации целых клеток содержала (в мм): 120 CsCl, 15 тетраэтиламмоний (TEA) Cl, 2 MgSO 4 , 10 буфер TES, pH 7,15, 4 MgATP, 0,4 Na 2 GTP, 1 NAD. В части экспериментов АТФ и НАД не включались. Внешний раствор перфузировали через перфузионную систему со скоростью 25 камер в минуту.
РЕЗУЛЬТАТЫ
Аноксия деполяризует фоторецепторы мух в темноте
Предыдущие исследования физиологии сетчатки медоносной пчелы показали, что фоторецепторные клетки насекомых быстро деполяризуются во время применения аноксии в темноте, но лежащий в основе молекулярный механизм не ясен (Dimitracos и Цакопулос, 1985; Минке и Цакопулос, 1986).Изучение эффектов аноксии на фоторецепторы Drosophila , вероятно, предоставит важную информацию о молекулярном механизме, лежащем в основе действия аноксии, благодаря силе генетики Drosophila . Детальные измерения потребления кислорода сетчаткой медоносной пчелы показывают, что скорость потребления кислорода ( Q ) в темноте имеет средний уровень Q = 30 мкл O 2 / см 3 фоторецепторной ткани на минута (Tsacopoulos et al., 1981). Поразительно, что ретиналь Q мухи Calliphora , который сохраняется в темноте, в три раза выше (Hamdorf and Kaschef, 1964). Таким образом, ожидается, что продувка N 2 над мухой резко снизит парциальное давление кислорода (pO 2 ) сетчатки. Учитывая высокую скорость потребления кислорода тканями, N 2 должен в дальнейшем привести к снижению pO 2 до аноксического уровня (Ставенга и Тинберген, 1983; Димитракос и Цакопулос, 1985).
Детальные измерения потребления кислорода сетчаткой медоносной пчелы показывают, что скорость потребления кислорода ( Q ) в темноте имеет средний уровень Q = 30 мкл O 2 / см 3 фоторецепторной ткани на минута (Tsacopoulos et al., 1981). Поразительно, что ретиналь Q мухи Calliphora , который сохраняется в темноте, в три раза выше (Hamdorf and Kaschef, 1964). Таким образом, ожидается, что продувка N 2 над мухой резко снизит парциальное давление кислорода (pO 2 ) сетчатки. Учитывая высокую скорость потребления кислорода тканями, N 2 должен в дальнейшем привести к снижению pO 2 до аноксического уровня (Ставенга и Тинберген, 1983; Димитракос и Цакопулос, 1985).
Эксперименты на фиг. 1 проверяли, наблюдается ли быстрая деполяризация, вызванная аноксией, которая была описана для фоторецепторов медоносных пчел, также в клетках сетчатки мух in vivo . Применение N 2 к интактным мухам Drosophila во время внеклеточных записей из глаза приводило к двухфазному отрицательному изменению напряжения роговицы в темноте. Начальная фаза имела медленное время нарастания и небольшую амплитуду, тогда как последующая фаза имела гораздо более быстрое время нарастания и большую амплитуду ( стрелка ).Изменение напряжения достигало стабильного уровня во время аноксии и сопровождалось устранением отрицательного внеклеточного ответа роговицы на свет (ERG) (рис. 1 a ). Как отрицательное напряжение роговицы изменяется в темноте, так и инактивация ERG быстро восстанавливается после удаления аноксии (рис. 1 a ). В сетчатке медоносной пчелы освещение одной интенсивной вспышкой света вызывает падение pO 2 до 40 мм рт. Ст. (Tsacopoulos and Lehmenkuhler, 1977).Соответственно, ожидается, что эффект освещения будет добавлен к эффекту аноксии. Действительно, освещение значительно ускоряет начало большей реакции на аноксию, предполагая, что аноксия и свет действуют синергетически (Рис.1 a , снизу ).
Начальная фаза имела медленное время нарастания и небольшую амплитуду, тогда как последующая фаза имела гораздо более быстрое время нарастания и большую амплитуду ( стрелка ).Изменение напряжения достигало стабильного уровня во время аноксии и сопровождалось устранением отрицательного внеклеточного ответа роговицы на свет (ERG) (рис. 1 a ). Как отрицательное напряжение роговицы изменяется в темноте, так и инактивация ERG быстро восстанавливается после удаления аноксии (рис. 1 a ). В сетчатке медоносной пчелы освещение одной интенсивной вспышкой света вызывает падение pO 2 до 40 мм рт. Ст. (Tsacopoulos and Lehmenkuhler, 1977).Соответственно, ожидается, что эффект освещения будет добавлен к эффекту аноксии. Действительно, освещение значительно ускоряет начало большей реакции на аноксию, предполагая, что аноксия и свет действуют синергетически (Рис.1 a , снизу ).
Аноксия вызывала быструю и обратимую деполяризацию фоторецепторов мух в темноте и отменяла световое возбуждение. a , Верхняя панель , Записи изменения внеклеточного напряжения интактного глаза Drosophila в ответ на оранжевый свет (OG590, ослабленный на 1 логарифмическую единицу, на всех рисунках) с последующим применением аноксии ( N 2 , как указано) и дополнительными световыми импульсами, которые проверяют выход из аноксии.Световой монитор указан ниже ( LM ). Обратите внимание, что второй световой импульс на верхней панели и третий импульс на нижней панели не вызвали никакого ответа. Стрелка указывает начало второй фазы реакции на кислородное голодание большей амплитуды. Артефакты движения, которые, вероятно, возникли в результате движений мушиного глаза после аноксии, обозначены звездочкой (на всех рисунках). a , Нижняя панель , Эксперименты с верхними следами были повторены на другой мухе Drosophila , за исключением того, что дополнительный импульс оранжевого света применялся во время начальной реакции на аноксию небольшой амплитуды.
a , Верхняя панель , Записи изменения внеклеточного напряжения интактного глаза Drosophila в ответ на оранжевый свет (OG590, ослабленный на 1 логарифмическую единицу, на всех рисунках) с последующим применением аноксии ( N 2 , как указано) и дополнительными световыми импульсами, которые проверяют выход из аноксии.Световой монитор указан ниже ( LM ). Обратите внимание, что второй световой импульс на верхней панели и третий импульс на нижней панели не вызвали никакого ответа. Стрелка указывает начало второй фазы реакции на кислородное голодание большей амплитуды. Артефакты движения, которые, вероятно, возникли в результате движений мушиного глаза после аноксии, обозначены звездочкой (на всех рисунках). a , Нижняя панель , Эксперименты с верхними следами были повторены на другой мухе Drosophila , за исключением того, что дополнительный импульс оранжевого света применялся во время начальной реакции на аноксию небольшой амплитуды. 1-минутный перерыв обозначен на нижних графиках . b , Верхняя панель , Эксперименты a ( верхних следов ) были повторены на неповрежденной мушке Musca . Нижняя панель , Внутриклеточные записи от одной фоторецепторной клетки в ответ на оранжевые световые импульсы и аноксию. Обратите внимание, что начальная небольшая и медленная реакция на аноксию отсутствует.
1-минутный перерыв обозначен на нижних графиках . b , Верхняя панель , Эксперименты a ( верхних следов ) были повторены на неповрежденной мушке Musca . Нижняя панель , Внутриклеточные записи от одной фоторецепторной клетки в ответ на оранжевые световые импульсы и аноксию. Обратите внимание, что начальная небольшая и медленная реакция на аноксию отсутствует.
Эффекты аноксии, подобные тем, которые показаны на рис.1 a , также наблюдались во время внеклеточных и внутриклеточных записей от более крупных мух Musca (рис.1 b ) и Calliphora ( n = 5). Внутриклеточные записи фоторецепторов интактного глаза Musca показали, что аноксия вызвала быструю деполяризацию, которая сопровождалась обратимым исчезновением рецепторного потенциала в ответ на свет (Рис.1 b , снизу ). Начальное небольшое и медленное изменение напряжения в ответ на аноксию, которое наблюдалось во внеклеточных записях (рис. 1 a ), отсутствовало во внутриклеточных записях, что позволяет предположить, что эта фаза не возникает в фоторецепторных клетках (см. Ниже) .Таким образом, рисунок 1 демонстрирует, что аноксия деполяризует фоторецепторные клетки мухи. Мостовые измерения в фоторецепторах Musca и Calliphora во время внутриклеточных записей показали, что зависимая от аноксии деполяризация сопровождалась увеличением амплитуды проводимости, аналогичным тому, которое вызывается интенсивным светом ( n = 4). Взятые вместе, очевидный синергизм между реакцией на аноксию и свет, увеличением проводимости и отменой реакции на свет предполагает, что аноксия прямо или косвенно открывает светочувствительные каналы в темноте (см. Ниже).
1 a ), отсутствовало во внутриклеточных записях, что позволяет предположить, что эта фаза не возникает в фоторецепторных клетках (см. Ниже) .Таким образом, рисунок 1 демонстрирует, что аноксия деполяризует фоторецепторные клетки мухи. Мостовые измерения в фоторецепторах Musca и Calliphora во время внутриклеточных записей показали, что зависимая от аноксии деполяризация сопровождалась увеличением амплитуды проводимости, аналогичным тому, которое вызывается интенсивным светом ( n = 4). Взятые вместе, очевидный синергизм между реакцией на аноксию и свет, увеличением проводимости и отменой реакции на свет предполагает, что аноксия прямо или косвенно открывает светочувствительные каналы в темноте (см. Ниже).
Большая фаза вызванной аноксией деполяризации возникает из-за активации каналов TRP и TRPL
Известно, что аноксия вызывает снижение градиента K + фоторецепторных клеток беспозвоночных, вызванное ингибированием насоса Na-K (Dimitracos и Цакопулос, 1985).![]() Кроме того, аноксия увеличивает клеточный Ca 2 (Lo et al., 1980), что может открывать активированные Ca 2+ каналы K + . Накопление K + во внеклеточном пространстве приводит к деполяризации фоторецепторных клеток (Coles and Tsacopoulos, 1979; Dimitracos and Tsacopoulos, 1985; Minke and Tsacopoulos, 1986; Sandler and Kirschfeld, 1991).Контрольные эксперименты на рисунке 2 были разработаны, чтобы продемонстрировать, что большая фаза деполяризации возникла из-за специфической активации каналов TRP и TRPL, а не из-за ингибирования насоса Na-K или других механизмов, вызывающих накопление внешнего K + . Мы одновременно измеряли изменения напряжения и внеклеточную концентрацию K + ([K + ] из ) с использованием селективных микроэлектродов K + . Рисунок 2 a показывает у мух WT, что реакция ERG на освещение сопровождалась обратимым увеличением [K + ] из во время освещения, как сообщалось ранее (Coles and Tsacopoulos, 1979; Dimitracos and Tsacopoulos, 1985; Minke and Tsacopoulos, 1986; Sandler, Kirschfeld, 1991).
Кроме того, аноксия увеличивает клеточный Ca 2 (Lo et al., 1980), что может открывать активированные Ca 2+ каналы K + . Накопление K + во внеклеточном пространстве приводит к деполяризации фоторецепторных клеток (Coles and Tsacopoulos, 1979; Dimitracos and Tsacopoulos, 1985; Minke and Tsacopoulos, 1986; Sandler and Kirschfeld, 1991).Контрольные эксперименты на рисунке 2 были разработаны, чтобы продемонстрировать, что большая фаза деполяризации возникла из-за специфической активации каналов TRP и TRPL, а не из-за ингибирования насоса Na-K или других механизмов, вызывающих накопление внешнего K + . Мы одновременно измеряли изменения напряжения и внеклеточную концентрацию K + ([K + ] из ) с использованием селективных микроэлектродов K + . Рисунок 2 a показывает у мух WT, что реакция ERG на освещение сопровождалась обратимым увеличением [K + ] из во время освещения, как сообщалось ранее (Coles and Tsacopoulos, 1979; Dimitracos and Tsacopoulos, 1985; Minke and Tsacopoulos, 1986; Sandler, Kirschfeld, 1991). Аноксия индуцировала небольшое накопление K + с относительно короткой задержкой, за которой следовала большая фаза увеличения [K + ] из ( стрелка ). Чтобы определить, какая часть сигнала K + связана с активацией каналов TRP и TRPL, мы повторили измерения [K + ] out в двойном мутанте trpl 302 ; trp P343 , в котором отсутствуют каналы TRP и TRPL.В мутантах trpl 302 ; trp P343 , у которых световая реакция была полностью устранена (Scott et al., 1997), наблюдались только начальные медленные и меньшие сигналы, достигающие устойчивого состояния, что указывает на что небольшая, но не большая фаза изменения напряжения является результатом накопления K + во внеклеточном пространстве. Поскольку эта медленная фаза не наблюдалась во внутриклеточных записях, она может отражать деполяризацию некоторых других типов клеток, возможно, пигментных (глиальных) клеток, которые очень чувствительны, намного больше, чем клетки фоторецепторов, к внешнему [K + ] (Coles и Tsacopoulos, 1979) (см.
Аноксия индуцировала небольшое накопление K + с относительно короткой задержкой, за которой следовала большая фаза увеличения [K + ] из ( стрелка ). Чтобы определить, какая часть сигнала K + связана с активацией каналов TRP и TRPL, мы повторили измерения [K + ] out в двойном мутанте trpl 302 ; trp P343 , в котором отсутствуют каналы TRP и TRPL.В мутантах trpl 302 ; trp P343 , у которых световая реакция была полностью устранена (Scott et al., 1997), наблюдались только начальные медленные и меньшие сигналы, достигающие устойчивого состояния, что указывает на что небольшая, но не большая фаза изменения напряжения является результатом накопления K + во внеклеточном пространстве. Поскольку эта медленная фаза не наблюдалась во внутриклеточных записях, она может отражать деполяризацию некоторых других типов клеток, возможно, пигментных (глиальных) клеток, которые очень чувствительны, намного больше, чем клетки фоторецепторов, к внешнему [K + ] (Coles и Tsacopoulos, 1979) (см. Обсуждение).Большая фаза, которая зависит от наличия каналов TRP и TRPL (рис.2 b ), отражает отток K + из фоторецепторной ячейки, как и ожидалось, от K + , действующего как противоион для Na . + и Ca 2+ через светочувствительные каналы (Ranganathan et al., 1991; Hardie, Minke, 1992).
Обсуждение).Большая фаза, которая зависит от наличия каналов TRP и TRPL (рис.2 b ), отражает отток K + из фоторецепторной ячейки, как и ожидалось, от K + , действующего как противоион для Na . + и Ca 2+ через светочувствительные каналы (Ranganathan et al., 1991; Hardie, Minke, 1992).
Измерения [K + ] out в WT и мутанта trpl 302 ; trp 343 показывают, что только вторая и большая фаза ответа на аноксию возникает в результате активации Каналы TRP и TRPL. a , изменение внеклеточного напряжения ( ERG , верхняя панель , черный ) и потенциометрические измерения с помощью селективного микроэлектрода K + ( E K , нижняя панель , дюйм красный ) в ответ на оранжевый свет и аноксию у дикого типа ( WT ) Drosophila . В среднем максимальное значение Δ [K + ] out во время аноксии составляло 7,26 ± 1,83 мм ( n = 4), если предположить, что [K + ] из в темноте составляет 4 мм (Sandler and Киршфельд, 1991). Калибровка применяется как для ERG, так и для потенциометрических измерений с селективным микроэлектродом K + . b , Эксперименты a были повторены на двойном мутанте trpl 302 ; trp 343 . Обратите внимание, что нет реакции на свет, а вторая фаза ответа на аноксию отсутствует. В среднем максимальная Δ [K + ] из составляла 2,64 ± 0,54 мм ( n = 4) во время аноксии.
Калибровка применяется как для ERG, так и для потенциометрических измерений с селективным микроэлектродом K + . b , Эксперименты a были повторены на двойном мутанте trpl 302 ; trp 343 . Обратите внимание, что нет реакции на свет, а вторая фаза ответа на аноксию отсутствует. В среднем максимальная Δ [K + ] из составляла 2,64 ± 0,54 мм ( n = 4) во время аноксии.
Аноксия обратимо открывает каналы TRP и TRPL в темноте на поздней стадии каскада
Измерения напряжения или [K + ] out не различают прямую активацию светочувствительных каналов и вторичную активацию через другие каналы [в основном, управляемые по напряжению каналы K + (Hardie et al., 1991)]. Хорошо известно, что поступление Ca 2+ в фоторецепторы происходит почти исключительно через каналы TRP и TRPL (Hardie, Minke, 1992; Peretz et al., 1994а). Поэтому мы измерили приток Ca 2+ во время аноксии, чтобы определить специфический компонент ответа на аноксию, который возникает непосредственно в результате активации этих каналов. Мы также использовали мутанты Drosophila , которые дефектны по белкам, важным для каскада фототрансдукции, чтобы локализовать стадию трансдукции, которая лежит в основе эффектов аноксии. Используя Ca 2+ -селективные микроэлектроды, мы измерили у мух дикого типа хорошо описанное снижение внеклеточной концентрации Ca 2+ ([Ca 2+ ] из ) во время освещения (рис.3 a ) (см. Также Sandler and Kirschfeld, 1991; Peretz et al., 1994a). Снижение [Ca 2+ ] из во время освещения возникает из-за притока Ca 2+ в фоторецепторные клетки, вызванного открытием каналов TRP и TRPL (Peretz et al., 1994a). Применение аноксии действительно вызывало после задержки снижение [Ca 2+ ] из (фиг.3 a , дно ). В отличие от сигнала K + , сигнал Ca 2+ не показал короткофазный отклик на аноксию с короткой задержкой, а показал только большую фазу, время нарастания и кинетику которой были аналогичны большей фазе напряжения.
Мы также использовали мутанты Drosophila , которые дефектны по белкам, важным для каскада фототрансдукции, чтобы локализовать стадию трансдукции, которая лежит в основе эффектов аноксии. Используя Ca 2+ -селективные микроэлектроды, мы измерили у мух дикого типа хорошо описанное снижение внеклеточной концентрации Ca 2+ ([Ca 2+ ] из ) во время освещения (рис.3 a ) (см. Также Sandler and Kirschfeld, 1991; Peretz et al., 1994a). Снижение [Ca 2+ ] из во время освещения возникает из-за притока Ca 2+ в фоторецепторные клетки, вызванного открытием каналов TRP и TRPL (Peretz et al., 1994a). Применение аноксии действительно вызывало после задержки снижение [Ca 2+ ] из (фиг.3 a , дно ). В отличие от сигнала K + , сигнал Ca 2+ не показал короткофазный отклик на аноксию с короткой задержкой, а показал только большую фазу, время нарастания и кинетику которой были аналогичны большей фазе напряжения. изменение записано с того же глаза.Это наблюдение указывает на то, что в ответ на аноксию большая фаза деполяризации и приток Ca 2+ вызываются открытием светочувствительных каналов. На фигуре 3 b показано, что освещение слепого мутанта norpA P24 , в котором отсутствует светоактивированная фосфолипаза C (PLC) (Bloomquist et al., 1988; Pearn et al., 1996), не вызывало любая реакция на свет, контролируемая либо напряжением, либо [Ca 2+ ] из , изменяется, как ожидалось (рис.3 б ). Применение аноксии в темноте вызывало ответ по напряжению, подобный таковому у WT, с начальной маленькой фазой и последующей большей фазой. Сигнал кальция, который сопровождал большую фазу изменения напряжения, был сходным у WT и мутанта, за исключением более быстрого начала у мутанта и выброса после отключения аноксии (рис. 3). Мы также исследовали влияние аноксии на мутант ninaE или , который является нулевым мутантом опсина Rh2 (O’Tousa et al.
изменение записано с того же глаза.Это наблюдение указывает на то, что в ответ на аноксию большая фаза деполяризации и приток Ca 2+ вызываются открытием светочувствительных каналов. На фигуре 3 b показано, что освещение слепого мутанта norpA P24 , в котором отсутствует светоактивированная фосфолипаза C (PLC) (Bloomquist et al., 1988; Pearn et al., 1996), не вызывало любая реакция на свет, контролируемая либо напряжением, либо [Ca 2+ ] из , изменяется, как ожидалось (рис.3 б ). Применение аноксии в темноте вызывало ответ по напряжению, подобный таковому у WT, с начальной маленькой фазой и последующей большей фазой. Сигнал кальция, который сопровождал большую фазу изменения напряжения, был сходным у WT и мутанта, за исключением более быстрого начала у мутанта и выброса после отключения аноксии (рис. 3). Мы также исследовали влияние аноксии на мутант ninaE или , который является нулевым мутантом опсина Rh2 (O’Tousa et al. , 1989), а также на мутанте Gαq1 , который имеет сильно сниженный уровень светоактивированного G-белка (Scott et al., 1995). Эффекты аноксии на этих мутантов были аналогичны тем, которые наблюдались у мух дикого типа, за исключением того, что у мутанта Gαq1 латентность начала большей фазы ответа на аноксию была примерно в два раза больше по сравнению с диким типом ( n = 3, см. Ниже). Таким образом, результаты показывают, что аноксия влияет на позднюю стадию каскада фототрансдукции после активации PLC.
, 1989), а также на мутанте Gαq1 , который имеет сильно сниженный уровень светоактивированного G-белка (Scott et al., 1995). Эффекты аноксии на этих мутантов были аналогичны тем, которые наблюдались у мух дикого типа, за исключением того, что у мутанта Gαq1 латентность начала большей фазы ответа на аноксию была примерно в два раза больше по сравнению с диким типом ( n = 3, см. Ниже). Таким образом, результаты показывают, что аноксия влияет на позднюю стадию каскада фототрансдукции после активации PLC.
Аноксия активировала каналы TRP и TRPL как у WT ( a ), так и у нулевого мутанта PLC ( norpA P24 , b ), что контролировалось притоком Ca 2+ . Изменение внеклеточного напряжения ( ERG , верхние следы в a и b , в черный ) и потенциометрические измерения с Ca 2+ -селективным микроэлектродом ( E Ca , снизу показаны трассы как в , а , так и в b , в красный ) в ответ на оранжевый свет и аноксию у WT Drosophila и norpA мутанта P24 . Обратите внимание, что у мутанта norpA P24 нет ответа на свет, и начальная медленная фаза электрического ответа на аноксию отсутствует в сигналах Ca 2+ как дикого типа, так и мутанта. Калибровки для записей ERG обозначены цветом черный , а калибровки для потенциометрических измерений с помощью Ca 2+ -селективного микроэлектрода обозначены красным цветом (на рисунках 3 и 4).
Обратите внимание, что у мутанта norpA P24 нет ответа на свет, и начальная медленная фаза электрического ответа на аноксию отсутствует в сигналах Ca 2+ как дикого типа, так и мутанта. Калибровки для записей ERG обозначены цветом черный , а калибровки для потенциометрических измерений с помощью Ca 2+ -селективного микроэлектрода обозначены красным цветом (на рисунках 3 и 4).
Дополнительная демонстрация того, что аноксия открывает каналы TRP и TRPL в темноте, была получена путем измерения притока Ca 2+ в мутанте trp , в котором отсутствует TRP, и в двойном мутанте trpl; trp , в котором отсутствуют оба канала (Скотт и др., 1997). Ответ ERG на свет мутанта trp P343 показал типичное снижение по отношению к исходному уровню во время освещения, тогда как сигнал Ca 2+ был временным и относительно небольшим, как сообщалось ранее (рис. 4 a ) (Peretz et al. , 1994a). Применение аноксии к мутанту trp P343 первоначально активировало медленную и небольшую фазу ответного напряжения (фиг.4 a ). Однако, в отличие от WT и других мутантов, упомянутых выше, значительно меньшая амплитуда второй более быстрой фазы напряжения и сигнала Ca 2+ наблюдалась у мух trp P343 (рис.4 а , 5). Небольшой сигнал Ca 2+ в ответ на свет и аноксию у мутанта отражает приток Ca 2+ в фоторецепторы через каналы TRPL (Peretz et al., 1994a).
, 1994a). Применение аноксии к мутанту trp P343 первоначально активировало медленную и небольшую фазу ответного напряжения (фиг.4 a ). Однако, в отличие от WT и других мутантов, упомянутых выше, значительно меньшая амплитуда второй более быстрой фазы напряжения и сигнала Ca 2+ наблюдалась у мух trp P343 (рис.4 а , 5). Небольшой сигнал Ca 2+ в ответ на свет и аноксию у мутанта отражает приток Ca 2+ в фоторецепторы через каналы TRPL (Peretz et al., 1994a).
Генетическая элиминация TRP ( a ) привела к снижению притока Ca 2+ через оставшиеся каналы TRPL в ответ на аноксию, тогда как устранение как TRP, так и TRPL ( b , c ) ) практически исключили TRP- и TRPL-зависимые сигналы и приток Ca 2+ .Та же парадигма, что и на рисунке 3, была повторена на рисунке 4, за исключением того, что нулевой мутант trp trp P343 ( a ) и нулевой двойной мутант trpl 302 ; trp P343 (in использовались две разные мухи) ( b , c ). Обратите внимание, что у мутанта trp P343 вторая фаза электрического ответа на аноксию и приток Ca 2+ были относительно небольшими, но сохранялись, пока применялась аноксия, в отличие от кратковременных ответов на свет.Также обратите внимание, что у мутанта trpl; trp отсутствует реакция на свет и что отсутствует вторая фаза электрического ответа на аноксию. Отрицательный малый и медленный сигнал Ca 2+ в c выявил изменчивость знака и проявился только у 30% мутантных мух.
Обратите внимание, что у мутанта trp P343 вторая фаза электрического ответа на аноксию и приток Ca 2+ были относительно небольшими, но сохранялись, пока применялась аноксия, в отличие от кратковременных ответов на свет.Также обратите внимание, что у мутанта trpl; trp отсутствует реакция на свет и что отсутствует вторая фаза электрического ответа на аноксию. Отрицательный малый и медленный сигнал Ca 2+ в c выявил изменчивость знака и проявился только у 30% мутантных мух.
Гистограммы, показывающие максимальные изменения напряжения, которые включают как медленную, так и быструю фазы ( слева ) и Δ [Ca 2+ ] out ( справа ), в ответ на аноксию в WT, Мутанты trp и trpl; trp .Планки погрешностей — SEM.
Интересной характеристикой реакции на аноксию мутанта trp P343 является наличие поддерживаемого компонента как в сигналах напряжения, так и в сигналах Ca 2+ , пока применялась аноксия, как в WT (рис. а ). Этот поддерживаемый ответ на аноксию у мутанта резко контрастирует с кратковременным характером ответа на непрерывный свет.
а ). Этот поддерживаемый ответ на аноксию у мутанта резко контрастирует с кратковременным характером ответа на непрерывный свет.
Чтобы твердо установить, что приток Ca 2+ в ответ на аноксию вызван активацией каналов TRP и TRPL, мы измерили [Ca 2+ ] из в ответ на аноксию у двойного мутанта trpl 302 ; трп P343 .У этого мутанта реакция на свет полностью устранена (рис. 2 b , 4 b ) (Scott et al., 1997). Применение аноксии вызывало только начальное небольшое изменение напряжения, без последующего большего изменения напряжения или какого-либо значительного изменения [Ca 2+ ] из в течение первых 2 минут аноксии (рис. 4 b , 5) . У некоторых (~ 30%) мутантных мух наблюдались очень небольшие изменения в [Ca 2+ ] из (рис. 4 c ).Эти небольшие изменения в [Ca 2+ ] o были переменными по знаку и амплитуде и могут отражать активацию обменника Na-Ca, работающего в прямом или обратном режиме, вызванную переменным восстановлением Na + или Ca 2+ градиентов по клеткам во время аноксии у некоторых уязвимых мух (Hardie, 1995).
Отсутствие практически какого-либо притока Ca 2+ в двойном мутанте trpl; trp в ответ на аноксию (рис.5) предполагает, что механизм, контролирующий открытие каналов TRP и TRPL, является целью аноксии. .
Ингибирование митохондрий имитировало эффекты аноксии
in vivo Известно, что фоторецепторные клетки мух имеют большое количество митохондрий (Boschek, 1971). Чтобы выяснить, связаны ли эффекты аноксии на сетчатке Drosophila с нарушением функции митохондрий, на интактный глаз были нанесены 2,4-динитрофенол (DNP) и карбонилцианид m хлорфенилгидразон (CCCP). DNP и CCCP — известные разобщители окислительной цепи для производства АТФ в митохондриях (McLaughlin and Dilger, 1980).На фигуре 6 a показано, что нанесение DNP на интактные глаза Drosophila дикого типа индуцировало отрицательное изменение напряжения и отменяло световое возбуждение аналогично большей фазе ответа на аноксию. Эффект DNP был частично обратимым через ~ 20 мин после аппликации ( n = 3). Аналогичные измерения, проведенные на двойном мутанте trpl 302 ; trp P343 (рис. 6 b ), показали меньшие и более медленные изменения напряжения, как в случае аноксии (см. Ниже).Аналогичные результаты были получены после применения CCCP ( n = 3). Измерения [Ca 2+ ] из не могли быть получены, потому что DNP сильно снижает чувствительность Ca 2+ -селективных микроэлектродов. Воздействие ДНП на мух дикого типа усиливалось в сочетании с аноксией или освещением, что позволяет предположить, что световая стимуляция и все формы метаболического стресса были аддитивными (см. Ниже). Эти эксперименты также предполагают, что разобщители митохондрий имитировали эффекты аноксии у мух дикого типа посредством воздействия на каналы TRP и TRPL.Записи целых клеток в отдельных фоторецепторных клетках добавили более убедительные доказательства к исследованиям in vivo .
Аналогичные измерения, проведенные на двойном мутанте trpl 302 ; trp P343 (рис. 6 b ), показали меньшие и более медленные изменения напряжения, как в случае аноксии (см. Ниже).Аналогичные результаты были получены после применения CCCP ( n = 3). Измерения [Ca 2+ ] из не могли быть получены, потому что DNP сильно снижает чувствительность Ca 2+ -селективных микроэлектродов. Воздействие ДНП на мух дикого типа усиливалось в сочетании с аноксией или освещением, что позволяет предположить, что световая стимуляция и все формы метаболического стресса были аддитивными (см. Ниже). Эти эксперименты также предполагают, что разобщители митохондрий имитировали эффекты аноксии у мух дикого типа посредством воздействия на каналы TRP и TRPL.Записи целых клеток в отдельных фоторецепторных клетках добавили более убедительные доказательства к исследованиям in vivo .
Разобщитель митохондрий 2,4-динитрофенол ( DNP ) имитировал эффекты аноксии, что контролировалось изменениями внеклеточного напряжения. a , Парадигма на Рисунке 1 a была повторена в WT Drosophila, , за исключением того, что дополнительная пипетка, содержащая 1 или 10 мм DNP в растворе Рингера, была вставлена в сетчатку, и DNP применялся инъекцией давления (во время 30-секундный перерыв в a и b ).Подсчитано, что DNP разводится в глазу в 10-40 раз. Контрольные инъекции раствора Рингера без ДНП не дали результата. b , парадигма a была повторена в двойном мутанте trpl 302 ; trp P343 .
a , Парадигма на Рисунке 1 a была повторена в WT Drosophila, , за исключением того, что дополнительная пипетка, содержащая 1 или 10 мм DNP в растворе Рингера, была вставлена в сетчатку, и DNP применялся инъекцией давления (во время 30-секундный перерыв в a и b ).Подсчитано, что DNP разводится в глазу в 10-40 раз. Контрольные инъекции раствора Рингера без ДНП не дали результата. b , парадигма a была повторена в двойном мутанте trpl 302 ; trp P343 .
Митохондриальные разобщители и истощение АТФ активируют каналы TRP и TRPL в темноте
in situ Ожидается, что нарушение функции митохондрий приведет к истощению АТФ из фоторецепторных клеток.Чтобы более точно исследовать, активирует ли истощение АТФ из фоторецепторных клеток каналы TRP и TRPL, мы использовали записи патч-кламп целых клеток в изолированных препаратах омматидий (Hardie, 1991; Ranganathan et al. , 1991; Hardie and Minke, 1992). . Когда АТФ и α-никотинамидадениндинуклеотид (НАД) были исключены из пипетки для регистрации клеток WT, несколько световых импульсов средней интенсивности индуцировали внутренний ток в темноте после задержки 108,5 ± 10,4 с ( n = 8, от время установления записи всей клетки).Этот ток сопровождался исчезновением реакции на свет и повышенным уровнем шума (Рис. 7 a ). Включение АТФ и НАД в пипетку предотвращало индукцию входящего темнового тока за счет повторного освещения в течение, по крайней мере, 6 мин ( n = 12). Это наблюдение предполагает, что, хотя известно, что световые импульсы снижают уровень АТФ в фоторецепторных клетках (Dimitracos and Tsacopoulos, 1985), добавление экзогенного АТФ и НАД, вероятно, предотвращало истощение АТФ за счет освещения в течение как минимум 6 минут.Нанесение 0,1 мм DNP на ванну (рис.7 b ) во время записи с помощью пипеток без АТФ и НАД индуцировало внутренний ток в темноте у мух WT после задержки всего 19,7 ± 3,5 с ( n = 4) (Рис.
, 1991; Hardie and Minke, 1992). . Когда АТФ и α-никотинамидадениндинуклеотид (НАД) были исключены из пипетки для регистрации клеток WT, несколько световых импульсов средней интенсивности индуцировали внутренний ток в темноте после задержки 108,5 ± 10,4 с ( n = 8, от время установления записи всей клетки).Этот ток сопровождался исчезновением реакции на свет и повышенным уровнем шума (Рис. 7 a ). Включение АТФ и НАД в пипетку предотвращало индукцию входящего темнового тока за счет повторного освещения в течение, по крайней мере, 6 мин ( n = 12). Это наблюдение предполагает, что, хотя известно, что световые импульсы снижают уровень АТФ в фоторецепторных клетках (Dimitracos and Tsacopoulos, 1985), добавление экзогенного АТФ и НАД, вероятно, предотвращало истощение АТФ за счет освещения в течение как минимум 6 минут.Нанесение 0,1 мм DNP на ванну (рис.7 b ) во время записи с помощью пипеток без АТФ и НАД индуцировало внутренний ток в темноте у мух WT после задержки всего 19,7 ± 3,5 с ( n = 4) (Рис. 7 b ). Когда DNP (0,1 мм) был включен в раствор пипетки (без АТФ и NAD), внутренний ток индуцировался менее чем за 30 секунд ( n = 4) от начала регистрации целых клеток.
7 b ). Когда DNP (0,1 мм) был включен в раствор пипетки (без АТФ и NAD), внутренний ток индуцировался менее чем за 30 секунд ( n = 4) от начала регистрации целых клеток.
Функциональный анализ отдельных клеток по записям целых клеток от недавно вылетевших мух, показывающий, что истощение АТФ активирует каналы TRP и TRPL клеток WT.Отсутствие АТФ и НАД из записывающей пипетки (на всех графиках) вызывало после нескольких световых импульсов или после применения ДНФ конститутивную активацию светочувствительных каналов. Эта активность канала была обозначена появлением переходной фазы, за которой последовал устойчивый зашумленный входящий ток, который имел все характеристики тока, зависящего от TRP или TRPL. Ни один из этих токов не наблюдался в присутствии АТФ и НАД в пипетке или до того, как был индуцирован темновой внутренний ток.Это было продемонстрировано применением скачков напряжения в темноте во время записи целых клеток с фоторецепторных ячеек, которые выявили только небольшие токи утечки ( c , слева ). Создание записей для целых клеток происходило за 10 секунд до начала следов на этом рисунке. a , Типичные индуцированные светом токи клетки WT в ответ на три оранжевых света сопровождались появлением медленного входящего тока в темноте, когда раствор пипетки не содержал АТФ и НАД.Напряжение на мембране поддерживали на уровне -50 мВ. Верхние линии в каждой паре указывают продолжительность стимулов оранжевого света. b . Возникновение темнового входящего тока было ускорено применением 0,1 мм DNP ( стрелка , в другой ячейке). Входящий ток индуцировался через 19,7 ± 3,5 с после применения DNP ( n = 4) по сравнению с 108,5 ± 19,7 с ( n = 8) без применения DNP в аналогичных условиях записи ( a ).Обратите внимание, что после того, как был индуцирован темновой внутренний ток, не было получено дополнительной реакции на свет. c , Сравнение семейств следов тока, вызванных серией скачков напряжения в диапазоне от -100 до +80 мВ с шагом 20 мВ ( нижний ряд ), от фоторецепторов мух дикого типа при следующих условия: в темноте до того, как был индуцирован входящий ток, на пике входящего тока на 1,5 мм внешний Ca 2+ , после того, как Ca 2+ был удален из внешней среды (0 Ca 2+ ), и после 10 мкмLa 3+ наносили на внешнюю среду (как указано).
Создание записей для целых клеток происходило за 10 секунд до начала следов на этом рисунке. a , Типичные индуцированные светом токи клетки WT в ответ на три оранжевых света сопровождались появлением медленного входящего тока в темноте, когда раствор пипетки не содержал АТФ и НАД.Напряжение на мембране поддерживали на уровне -50 мВ. Верхние линии в каждой паре указывают продолжительность стимулов оранжевого света. b . Возникновение темнового входящего тока было ускорено применением 0,1 мм DNP ( стрелка , в другой ячейке). Входящий ток индуцировался через 19,7 ± 3,5 с после применения DNP ( n = 4) по сравнению с 108,5 ± 19,7 с ( n = 8) без применения DNP в аналогичных условиях записи ( a ).Обратите внимание, что после того, как был индуцирован темновой внутренний ток, не было получено дополнительной реакции на свет. c , Сравнение семейств следов тока, вызванных серией скачков напряжения в диапазоне от -100 до +80 мВ с шагом 20 мВ ( нижний ряд ), от фоторецепторов мух дикого типа при следующих условия: в темноте до того, как был индуцирован входящий ток, на пике входящего тока на 1,5 мм внешний Ca 2+ , после того, как Ca 2+ был удален из внешней среды (0 Ca 2+ ), и после 10 мкмLa 3+ наносили на внешнюю среду (как указано).
В trp P343 или в двойном мутанте trpl 302 ; trp P343 темновой ток не возникал во время длительных записей (<10 мин) с использованием пипеток без АТФ и НАД ( n = 6). Нанесение 0,1 мм DNP либо на ванну, либо в пипетку вызывало зашумленный внутренний ток небольшой амплитуды у trp мух (рис. 8 a , слева ) ( n = 5). В двойном мутанте trpl 302 ; trp P343 , DNP (нанесенный либо в ванну, либо в пипетку) или CCCP без АТФ и NAD в пипетке не оказали влияния (рис.8 b ) ( n = 8), даже после инкубации в течение 16 мин.
Рис. 8. Влияние DNP на мутанты Drosophila . a , Относительно медленная индукция небольшого и шумного входящего тока в темноте наблюдалась в trp P343 после нанесения 0,1 мм DNP ( стрелка ) во время записи без АТФ и НАД в пипетке. Входящие токи не могли быть индуцированы без применения DNP в аналогичных условиях регистрации. Правые кривые показывают семейство кривых тока, вызванных серией ступеней напряжения, как на рис. 7 c при 1,5 мм внешнего Ca 2+ . Подобные семейства токовых следов аналогичной амплитуды наблюдались на среде 0 Ca 2+ ( n = 3). b , Запись из trpl 302 ; trp P343 двойной мутант с использованием пипеток, в которых АТФ и НАД были исключены и 0,1 мм DNP был нанесен на внешнюю среду, как указано.Никакого темнового внутреннего тока не наблюдалось даже через 16 мин после начала записи целых клеток. Правые кривые показывают семейство кривых тока, вызванных серией ступеней напряжения, как на рис. 7 c на 1,5 мм внешнего Ca 2+ . Аналогичные результаты были получены для четырех разных ячеек, в которые ДНФ был включен в записывающую пипетку. Обратите внимание, что ни светоиндуцированные токи, ни внутренние токи в темноте не могли быть индуцированы у двойного мутанта.
Правые кривые показывают семейство кривых тока, вызванных серией ступеней напряжения, как на рис. 7 c при 1,5 мм внешнего Ca 2+ . Подобные семейства токовых следов аналогичной амплитуды наблюдались на среде 0 Ca 2+ ( n = 3). b , Запись из trpl 302 ; trp P343 двойной мутант с использованием пипеток, в которых АТФ и НАД были исключены и 0,1 мм DNP был нанесен на внешнюю среду, как указано.Никакого темнового внутреннего тока не наблюдалось даже через 16 мин после начала записи целых клеток. Правые кривые показывают семейство кривых тока, вызванных серией ступеней напряжения, как на рис. 7 c на 1,5 мм внешнего Ca 2+ . Аналогичные результаты были получены для четырех разных ячеек, в которые ДНФ был включен в записывающую пипетку. Обратите внимание, что ни светоиндуцированные токи, ни внутренние токи в темноте не могли быть индуцированы у двойного мутанта. c , Влияние DNP (нанесенного с помощью пипетки) на мутанты ninaE ora , Gα q1 и norpA P24 .Дорожки представляют собой семейства следов тока, вызванных серией ступеней напряжения, как на Рисунке 7 c на 1,5 мм внешнего Ca 2+ . Типичный TRP-зависимый ток наблюдается только в клетках, в которых записывающая пипетка включает 0,1 мм DNP, но не в контрольных клетках той же сетчатки, как указано. Аналогичные результаты были получены от трех до шести различных клеток каждого мутанта. Следы, записанные от мутанта Gα q1 , не показаны. Нижняя калибровка применяется ко всем семействам токовых трасс, вызванных серией скачков напряжения.
c , Влияние DNP (нанесенного с помощью пипетки) на мутанты ninaE ora , Gα q1 и norpA P24 .Дорожки представляют собой семейства следов тока, вызванных серией ступеней напряжения, как на Рисунке 7 c на 1,5 мм внешнего Ca 2+ . Типичный TRP-зависимый ток наблюдается только в клетках, в которых записывающая пипетка включает 0,1 мм DNP, но не в контрольных клетках той же сетчатки, как указано. Аналогичные результаты были получены от трех до шести различных клеток каждого мутанта. Следы, записанные от мутанта Gα q1 , не показаны. Нижняя калибровка применяется ко всем семействам токовых трасс, вызванных серией скачков напряжения.
Входящий ток клеток WT, который индуцировался в темноте после освещения или применения DNP в отсутствие АТФ и NAD, имел все характеристики TRP-зависимого тока (Hardie and Minke, 1994a, b). В ячейках WT при нулевом внешнем Ca 2+ ток показывал внутреннее и внешнее выпрямление (рис. 7 c ) (0 ммCa 2+ , n = 7), тогда как амплитуда входящего тока при отрицательном удерживании потенциалы сильно снижались в присутствии в среде Ca 2+ (рис.7 c ) (1,5 ммCa 2+ , n = 12). La 3+ , мощный блокатор каналов Ca 2+ , который имитирует фенотип trp (Hochstrate, 1989; Suss Toby et al., 1991; Hardie and Minke, 1992, 1994a; Niemeyer et al., 1996) , полностью блокировал ток, зависящий от TRP (рис. 7 c , справа ) ( n = 5), как описано ранее (Hardie and Minke, 1994a). В мутанте trp после применения DNP результирующий входящий ток имел все характеристики TRPL-зависимого тока мух мутанта trp .Он имел небольшую амплитуду, высокий уровень шума (Рис.8 a ) и практически полное отсутствие внутреннего выпрямления (Рис.8 a , справа ) даже на уровне 0 Ca 2+ ( n = 3). (см. также Hardie and Minke, 1994b; Reuss et al.
7 c ) (0 ммCa 2+ , n = 7), тогда как амплитуда входящего тока при отрицательном удерживании потенциалы сильно снижались в присутствии в среде Ca 2+ (рис.7 c ) (1,5 ммCa 2+ , n = 12). La 3+ , мощный блокатор каналов Ca 2+ , который имитирует фенотип trp (Hochstrate, 1989; Suss Toby et al., 1991; Hardie and Minke, 1992, 1994a; Niemeyer et al., 1996) , полностью блокировал ток, зависящий от TRP (рис. 7 c , справа ) ( n = 5), как описано ранее (Hardie and Minke, 1994a). В мутанте trp после применения DNP результирующий входящий ток имел все характеристики TRPL-зависимого тока мух мутанта trp .Он имел небольшую амплитуду, высокий уровень шума (Рис.8 a ) и практически полное отсутствие внутреннего выпрямления (Рис.8 a , справа ) даже на уровне 0 Ca 2+ ( n = 3). (см. также Hardie and Minke, 1994b; Reuss et al. , 1997). Эффекты DNP были аддитивными со светом или отсутствием АТФ и НАД; таким образом, освещение ускоряет начало действия DNP, тогда как включение ATP и NAD в пипетку увеличивает латентность активации TRP-канала до 2–4 мин (WT, n = 4).
, 1997). Эффекты DNP были аддитивными со светом или отсутствием АТФ и НАД; таким образом, освещение ускоряет начало действия DNP, тогда как включение ATP и NAD в пипетку увеличивает латентность активации TRP-канала до 2–4 мин (WT, n = 4).
Чтобы твердо установить, что эффект DNP в наших экспериментальных условиях действует исключительно на каналы TRP и TRPL, мы исследовали влияние DNP на изолированные омматидии нулевого мутанта родопсина, ninaE или , на гипоморф G. -белковый мутант, Gαq1, и на нулевом мутанте PLC, norpA P24 . Эксперименты, изображенные на Фигуре 8 c , показывают, что включение 0,1 мм DNP в записывающую пипетку вызывало у вышеуказанных мутантов открытие каналов со свойствами, типичными для каналов TRP.Это было выявлено семейством следов тока, измеренных при переменном мембранном напряжении (рис. 8 c ) ( n = 3–5 для каждого мутанта). Контрольные эксперименты, которые проводились на омматидиях этих мутантов в темноте, когда DNP не вводили в записывающую пипетку и не наносили в ванну, не показали этих токов во время записи, по крайней мере, 6 мин (рис. 8 c ) ( n = 3–6 для каждого мутанта). TRP-зависимый ток индуцировался DNP менее чем за 30 секунд с момента установления регистрации целых клеток в мутантах norpA P24 и ninaE или , но намного медленнее (2–3 мин) в Gαq1 мутант ( n = 4), что согласуется с измерениями in vivo у этого мутанта.
8 c ) ( n = 3–6 для каждого мутанта). TRP-зависимый ток индуцировался DNP менее чем за 30 секунд с момента установления регистрации целых клеток в мутантах norpA P24 и ninaE или , но намного медленнее (2–3 мин) в Gαq1 мутант ( n = 4), что согласуется с измерениями in vivo у этого мутанта.
Таким образом, результаты показывают, что удаление АТФ и НАД из записывающей пипетки в сочетании с условиями, которые истощают АТФ из митохондрий, открывают каналы TRP и TRPL в темноте, влияя на позднюю стадию каскада трансдукции.
ОБСУЖДЕНИЕ
Белки каналов TRP являются основными кандидатами на роль поверхностных мембран, фосфоинозитид-опосредованных каналов входа Ca 2+ не только в Drosophila , но и в тканях млекопитающих, в которых было идентифицировано большое количество гомологов TRP ( Birnbaumer et al., 1996; Гарсия и Шиллинг, 1997; Монтелл, 1997; Патни и Маккей, 1999). Хотя недавно было предложено несколько механизмов для учета стробирования TRP (Birnbaumer et al., 1996; Kiselyov et al., 1998; Chyb et al., 1999; Hofmann et al., 1999; Putney and McKay, 1999; Ma et al., ., 2000), механизм стробирования TRP каналов остается неизвестным (Berridge et al., 2000).
Хотя недавно было предложено несколько механизмов для учета стробирования TRP (Birnbaumer et al., 1996; Kiselyov et al., 1998; Chyb et al., 1999; Hofmann et al., 1999; Putney and McKay, 1999; Ma et al., ., 2000), механизм стробирования TRP каналов остается неизвестным (Berridge et al., 2000).
В настоящем исследовании мы продемонстрировали, что метаболический стресс в интактном глазу Drosophila быстро и обратимо активировал светочувствительные каналы TRP и TRPL.Зависимость мембранного потенциала от окислительного метаболизма — общая черта мелких нервных клеток (Payne, 1981). Сообщалось о быстрой деполяризации стимулированных аноксических фоторецепторов для различных видов беспозвоночных (Baumann and Mauro, 1973; Wong et al., 1976; Payne, 1981; Dimitracos and Tsacopoulos, 1985), а также о значительном снижении градиента K + . были продемонстрированы в фоторецепторах пчел во время аноксии (Dimitracos and Tsacopoulos, 1985). Наше исследование показывает, что накопление внешнего K + было в основном вторичным по отношению к открытию каналов TRP и TRPL. При исследовании фоторецепторов саранчи было высказано предположение, что деполяризация, вызванная аноксией, является результатом случайной остаточной активации светочувствительных каналов (Payne, 1981). Ни в одном из предыдущих исследований не было однозначной демонстрации того, что светочувствительные каналы являются основными мишенями аноксии, и была продемонстрирована их молекулярная идентификация. Комбинация мутантов Drosophila , у которых светочувствительные каналы были удалены генетически, вместе с измерениями притока Ca 2+ , которые функционально идентифицируют эти каналы, позволили однозначно продемонстрировать, что аноксия быстро, обратимо и специфически активирует светочувствительные каналы TRP и TRPL.
При исследовании фоторецепторов саранчи было высказано предположение, что деполяризация, вызванная аноксией, является результатом случайной остаточной активации светочувствительных каналов (Payne, 1981). Ни в одном из предыдущих исследований не было однозначной демонстрации того, что светочувствительные каналы являются основными мишенями аноксии, и была продемонстрирована их молекулярная идентификация. Комбинация мутантов Drosophila , у которых светочувствительные каналы были удалены генетически, вместе с измерениями притока Ca 2+ , которые функционально идентифицируют эти каналы, позволили однозначно продемонстрировать, что аноксия быстро, обратимо и специфически активирует светочувствительные каналы TRP и TRPL.
Настоящее исследование демонстрирует, что активация TRP и TRPL в темноте является результатом истощения АТФ. Истощение АТФ, вероятно, непосредственно активирует каналы, а не более ранние стадии каскада трансдукции по следующим причинам. (1) Аноксия активировала каналы TRP и TRPL на стадии ниже PLC, потому что аноксия индуцировала приток Ca 2+ в нуль-мутанте PLC, norpA P24 . (2) Активация более ранних стадий приводит к возникновению унитарных событий (квантовых выступов) (Scott, Zuker, 1998; Chyb et al., 1999), тогда как здесь было показано, что истощение АТФ вызывает плавный ответ с шумом канала (см. Также Hardie and Minke, 1994a). (3) Применение аноксии к нулевому мутанту trp in vivo и нанесение DNP in situ приводило к сохранению отверстий в каналах TRPL. Это наблюдение предполагает, что поддерживаемые отверстия берут начало на предположительно поздней стадии, которая лежит в основе временного ответа на свет мутантов trp (Scott et al., 1997).
(2) Активация более ранних стадий приводит к возникновению унитарных событий (квантовых выступов) (Scott, Zuker, 1998; Chyb et al., 1999), тогда как здесь было показано, что истощение АТФ вызывает плавный ответ с шумом канала (см. Также Hardie and Minke, 1994a). (3) Применение аноксии к нулевому мутанту trp in vivo и нанесение DNP in situ приводило к сохранению отверстий в каналах TRPL. Это наблюдение предполагает, что поддерживаемые отверстия берут начало на предположительно поздней стадии, которая лежит в основе временного ответа на свет мутантов trp (Scott et al., 1997).
Результаты показывают, что митохондрии являются основной мишенью аноксии, ведущей к снижению клеточного АТФ. Действительно, предыдущие исследования на большой мухе Calliphora продемонстрировали, что нанесение N 2 быстро и обратимо ингибировало специфическую временную зеленую флуоресценцию, которая обычно возникает из функциональных митохондрий в глазу (Stavenga and Tinbergen, 1983).
Наблюдение, что нарушение функции митохондрий ведет к открытию TRP и TRPL каналов, имеет важное значение для предыдущих исследований.В этих исследованиях активация различных TRP-каналов была получена несколькими способами, включая окислительный стресс (Balzer et al., 1999) и применение полиненасыщенных жирных кислот (PUFAs) (Chyb et al., 1999). Последнее представляет особый интерес, поскольку было показано, что линолевая кислота и несколько других длинноцепочечных жирных кислот действуют как эффективные разобщители митохондрий в различных клетках (Arslan et al., 1984; Hermesh et al., 1998). Наши результаты, таким образом, предполагают, что действие ПНЖК на каналы TRP и TRPL является непрямым и является результатом их действия как разобщителей митохондрий.
Механизм, лежащий в основе активации каналов TRP и TRPL за счет истощения АТФ, не ясен. Однако необходимость подачи АТФ в темноте с высокой скоростью для правильного функционирования каналов TRP и TRPL объясняет хорошо известный, но необъяснимый феномен высокой скорости потребления кислорода сетчаткой насекомых в темноте (Tsacopoulos et al. ., 1981). Результаты, таким образом, предполагают, что конститутивный АТФ-зависимый процесс, действующий на поздней стадии каскада фототрансдукции, необходим, чтобы держать TRP- и TRPL-каналы закрытыми в темноте.Это делает эти каналы чрезвычайно чувствительными к аноксии и может приводить к гибели клеток при метаболическом стрессе не только в Drosophila , но также и в клетках позвоночных, которые экспрессируют каналы TRP (Balzer et al., 1999). Таким образом, настоящее исследование обеспечивает новую мишень для метаболического стресса с возможными последствиями для повреждения мозга, поскольку активация TRP вызывает массивный приток Ca 2+ , а гомологи TRP экспрессируются в мозге (Garcia and Schilling, 1997; Putney and McKay, 1999). ; Harteneck et al., 2000). Недавнее исследование показало, что специфические мутации в трансмембранном домене TRP канала Drosophila, которые вызывают конститутивную активацию TRP каналов, приводят к быстрой гибели фоторецепторных клеток in vivo (Yoon et al.
., 1981). Результаты, таким образом, предполагают, что конститутивный АТФ-зависимый процесс, действующий на поздней стадии каскада фототрансдукции, необходим, чтобы держать TRP- и TRPL-каналы закрытыми в темноте.Это делает эти каналы чрезвычайно чувствительными к аноксии и может приводить к гибели клеток при метаболическом стрессе не только в Drosophila , но также и в клетках позвоночных, которые экспрессируют каналы TRP (Balzer et al., 1999). Таким образом, настоящее исследование обеспечивает новую мишень для метаболического стресса с возможными последствиями для повреждения мозга, поскольку активация TRP вызывает массивный приток Ca 2+ , а гомологи TRP экспрессируются в мозге (Garcia and Schilling, 1997; Putney and McKay, 1999). ; Harteneck et al., 2000). Недавнее исследование показало, что специфические мутации в трансмембранном домене TRP канала Drosophila, которые вызывают конститутивную активацию TRP каналов, приводят к быстрой гибели фоторецепторных клеток in vivo (Yoon et al. , 2000).
, 2000).
Настоящее исследование открывает новое направление исследований, которое может привести к выяснению стробирования TRP и объяснить многие из, казалось бы, противоречивых отчетов о фармакологических свойствах и механизме активации каналов TRP (Putney and McKay, 1999; Harteneck et al., 2000).
Сноски
Это исследование было поддержано грантами Национальных институтов здравоохранения (EY 03529), Израильского научного фонда (ISF), Фонда Минервы, Американо-израильского фонда двусторонних исследований (BSF) и Немецко-израильского фонда. Фонд (GIF). Мы благодарим докторов наук. C. S. Zuker для мутантов trpl и Gα q1 и W. L. Pak для мутантов trp P343 и trpl 302 ; trp P343 двойной мутант.Мы также благодарим докторов наук. Р. К. Харди, З. Селинджер и З. Паруш за стимулирующие обсуждения, а также З. Селинджеру и М. Трейнину за критическое прочтение этой рукописи.

Корреспонденцию следует направлять Баруху Минке, отдел физиологии, Медицинская школа Хадасса Еврейского университета, Иерусалим
, Израиль. Электронная почта: minke {at} md2.huji.ac.il.
Микродомены мускариновых рецепторов ацетилхолина и Ins (1,4,5) P3 создают «Ins (1,4,5) P3-соединения» и сайты инициации волны Ca2 + в гладких мышцах | Журнал клеточной науки
Ткань замораживали в жидкости N 2 сразу после вскрытия и гомогенизировали (200 мг ткани на мл) либо в буфере RIPA, либо в буфере для лизиса на основе тритона [20 мМ Tris Base, 150 мМ NaCl, 1% Triton X-100 , 5 мМ ЭДТА (pH 7.4)], оба из которых содержат ингибиторы протеаз, измельчением пестиками из трубки Эппендорфа и многократным встряхиванием. Гомогенаты осветляли центрифугированием (5 мин при 13 200 об / мин) и супернатант разделяли на объемы 100 мкл и хранили при -80 ° C. Перед проведением вестерн-блоттинга лизат разбавляли в 4 раза буфером для лизиса. Для каждой дорожки, которую предстоит запустить, был подготовлен образец путем добавления 5 мкл × 5-PLB [40 мл глицерина (18%), 120 мл 10% SDS (5,5%), 50 мл 1 M Трис (pH 6,5) (0,23 M ), 50 мг бромфенолового синего (0,023%), 10 мл β-меркаптоэтанола (4.5%)] в дозатор Эппендорфа, содержащий 20 мкл разбавленного лизата (т.е. каждая дорожка содержала лизат из ~ 1 мг ткани). Затем образцы нагревали при 99 ° C в течение 5 минут и центрифугировали в импульсном режиме, затем загружали в полиакриламидные гели (7% для блоттинга InsP 3 R, 10% для mAChR) вместе с 10 мкл стандарта HiMark Prestained HMW Protein Standard и прогоняли при 200 В в течение 1–2 часов (2 часа для 7% геля, 1 час для 10% геля) с использованием рабочего буфера 0,25 М глицина, 0,025 М трис, 0,1% SDS. Затем белки переносили на нитроцеллюлозную мембрану электроблоттингом в течение 1.5–2 часа (1,5 часа для блоттинга mAChR, 2 часа для блоттинга InsP3R) с использованием ячейки Bio-Rad Mini Trans-Blot с ограничивающим напряжением / током 100 В / 400 мА и 25 мМ Трис, 192 мМ глицина, 20% MeOH, буфер для переноса pH 8,0.
Для каждой дорожки, которую предстоит запустить, был подготовлен образец путем добавления 5 мкл × 5-PLB [40 мл глицерина (18%), 120 мл 10% SDS (5,5%), 50 мл 1 M Трис (pH 6,5) (0,23 M ), 50 мг бромфенолового синего (0,023%), 10 мл β-меркаптоэтанола (4.5%)] в дозатор Эппендорфа, содержащий 20 мкл разбавленного лизата (т.е. каждая дорожка содержала лизат из ~ 1 мг ткани). Затем образцы нагревали при 99 ° C в течение 5 минут и центрифугировали в импульсном режиме, затем загружали в полиакриламидные гели (7% для блоттинга InsP 3 R, 10% для mAChR) вместе с 10 мкл стандарта HiMark Prestained HMW Protein Standard и прогоняли при 200 В в течение 1–2 часов (2 часа для 7% геля, 1 час для 10% геля) с использованием рабочего буфера 0,25 М глицина, 0,025 М трис, 0,1% SDS. Затем белки переносили на нитроцеллюлозную мембрану электроблоттингом в течение 1.5–2 часа (1,5 часа для блоттинга mAChR, 2 часа для блоттинга InsP3R) с использованием ячейки Bio-Rad Mini Trans-Blot с ограничивающим напряжением / током 100 В / 400 мА и 25 мМ Трис, 192 мМ глицина, 20% MeOH, буфер для переноса pH 8,0. После электроблоттинга мембрану удалили и заблокировали в 5% обезжиренном растворе сухого молока в PBS в течение ночи при 4 ° C. После двух 5-минутных промываний в PBS-T (0,05% твин в PBS) мембрану зондировали с помощью разведения первичных антител 1-500 (кроличьи поликлональные анти-mAChR3 и мышиные моноклональные анти-InsP 3 R1) в 5% сухое молоко в ФБС-Т на 1 ч.После трех 5-минутных и двух 15-минутных промываний мембрану инкубировали в разведении 1-1000 вторичных антител (против HRP мыши и против HRP кролика) в 5% сухом молоке в PBS-T в течение 1 часа с последующими двумя 5 минут и две 10 минут стирки. Все отмывки и инкубации антител проводили при комнатной температуре на орбитальном шейкере (~ 50 об / мин). Затем полосы белка детектировали с помощью усиленной хемилюминесценции с использованием субстрата для вестерн-блоттинга ECL Пирса и отображали с помощью системы X-OMAT.
После электроблоттинга мембрану удалили и заблокировали в 5% обезжиренном растворе сухого молока в PBS в течение ночи при 4 ° C. После двух 5-минутных промываний в PBS-T (0,05% твин в PBS) мембрану зондировали с помощью разведения первичных антител 1-500 (кроличьи поликлональные анти-mAChR3 и мышиные моноклональные анти-InsP 3 R1) в 5% сухое молоко в ФБС-Т на 1 ч.После трех 5-минутных и двух 15-минутных промываний мембрану инкубировали в разведении 1-1000 вторичных антител (против HRP мыши и против HRP кролика) в 5% сухом молоке в PBS-T в течение 1 часа с последующими двумя 5 минут и две 10 минут стирки. Все отмывки и инкубации антител проводили при комнатной температуре на орбитальном шейкере (~ 50 об / мин). Затем полосы белка детектировали с помощью усиленной хемилюминесценции с использованием субстрата для вестерн-блоттинга ECL Пирса и отображали с помощью системы X-OMAT.
Новая теоретическая основа для одновременного измерения возбуждающей и тормозной проводимости
Образец цитирования: Müller-Komorowska D, Parabucki A, Elyasaf G, Katz Y, Beck H, Lampl I (2021) Новая теоретическая основа для одновременного измерения возбуждающей проводимости. и тормозящие проводимости.PLoS Comput Biol 17 (12):
e1009725.
https://doi.org/10.1371/journal.pcbi.1009725
и тормозящие проводимости.PLoS Comput Biol 17 (12):
e1009725.
https://doi.org/10.1371/journal.pcbi.1009725
Редактор: Руне В. Берг, Копенгагенский университет, ДАНИЯ
Поступила: 19 апреля 2021 г .; Принят к печати: 6 декабря 2021 г .; Опубликован: 28 декабря 2021 г.
Авторские права: © 2021 Müller-Komorowska et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Весь код и большинство результатов моделирования доступны по адресу https://github.com/danielmk/ENCoI. Данные, не включенные в репозиторий, можно смоделировать с помощью предоставленного кода.
Финансирование: Эта работа была поддержана грантами от DFG-SFB 1089 (для HB и IL), 01EW1606 — DeCipher EraNet Neuron (для HB и IL), Израильского научного фонда (ISF 1539/17 и ISF Bikura 2799 / 20) (в Иллинойс), Фонд Минервы (в Иллинойс) и Human Frontier Science Program (HFSP) (в Иллинойс). Иллинойс занимает должность профессора Нормана и Хелен Ашер. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Иллинойс занимает должность профессора Нормана и Хелен Ашер. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Возбуждение нейронов организовано взаимодействием возбуждающих и тормозных сигналов. Следовательно, изучение их взаимоотношений имеет решающее значение для решения фундаментальных вопросов клеточной и системной нейробиологии.Было высказано предположение, что нарушение отношений между этими входами сопровождает многие неврологические заболевания и, в частности, эпилептические припадки. Принято считать, что такие припадки сопровождаются и даже вызываются нарушением соотношения возбуждение-торможение и их временных соотношений [1–3].
Наиболее широко используемым методом для изолированного измерения тормозных и возбуждающих входов является метод фиксации напряжения. Чтобы выявить возбуждающие синаптические токи, мембранный потенциал фиксируется напряжением около обратного потенциала торможения (около -80 мВ), а тормозные синаптические токи выявляются, когда напряжение фиксируется около возбуждающего реверсивного потенциала (около 0 мВ).Таким образом, записи с фиксацией напряжения использовались для изучения механизмов избирательности признаков корковых клеток, принадлежащих к разным модальностям [4–13]. Записи токового зажима также позволяют изолировать возбуждающую и тормозную проводимости, что достигается путем подачи постоянных положительных или отрицательных токов, которые приближают мембранный потенциал к потенциалу разворота этих двух типов входов [8–10,14–18].
Чтобы выявить возбуждающие синаптические токи, мембранный потенциал фиксируется напряжением около обратного потенциала торможения (около -80 мВ), а тормозные синаптические токи выявляются, когда напряжение фиксируется около возбуждающего реверсивного потенциала (около 0 мВ).Таким образом, записи с фиксацией напряжения использовались для изучения механизмов избирательности признаков корковых клеток, принадлежащих к разным модальностям [4–13]. Записи токового зажима также позволяют изолировать возбуждающую и тормозную проводимости, что достигается путем подачи постоянных положительных или отрицательных токов, которые приближают мембранный потенциал к потенциалу разворота этих двух типов входов [8–10,14–18].
Подходы к зажимам напряжения и тока имеют несколько общих черт. В обоих случаях возбуждение и ингибирование регистрируются в различных испытаниях, а проводимость оценивается путем подгонки усредненных данных с уравнением мембранного потенциала (уравнение 1 ниже).Следовательно, эти методы дают только усредненную картину и, таким образом, не могут уловить мгновенное и основанное на испытании понимание взаимосвязи между возбуждением и торможением.
Мгновенная связь между возбуждением и торможением in vivo была выявлена с использованием другого подхода, основанного на открытии того факта, что мембранный потенциал близлежащих кортикальных клеток у анестезированных животных сильно синхронизирован [19,20]. Этот подход состоит в деполяризации одной клетки для выявления ее тормозных входов и одновременной гиперполяризации соседней клетки для выявления ее возбуждающих входов.Это показало, что возбуждающие и тормозящие синаптические входы сильно коррелированы у анестезированных и бодрствующих грызунов [21,22], и было использовано для изучения степени корреляции во время осцилляторной активности нейронов [23]. Однако этот подход зависит от регистрации сильно коррелированных клеток, что в основном наблюдается у глубоко анестезированных животных. Методы оценки возбуждающих и тормозных входов отдельной клетки во время единичных испытаний были разработаны ранее [24–28]. Однако эти методы делают важные предположения о динамике и статистике входов. Важно отметить, что все эти методы основаны на возникновении флуктуаций мембранного потенциала при оценке возбуждающей и тормозной проводимости. Ясно, что изменения проводимости иногда не сопровождаются каким-либо изменением мембранного потенциала, как ожидалось, когда клетка получает тонический шунтирующий синаптический сигнал с реверсивным потенциалом, близким к потенциалу покоя клетки.
Важно отметить, что все эти методы основаны на возникновении флуктуаций мембранного потенциала при оценке возбуждающей и тормозной проводимости. Ясно, что изменения проводимости иногда не сопровождаются каким-либо изменением мембранного потенциала, как ожидалось, когда клетка получает тонический шунтирующий синаптический сигнал с реверсивным потенциалом, близким к потенциалу покоя клетки.
Мы описываем новую теоретическую основу для одновременного измерения возбуждающей и тормозной проводимости при токовых зажимах в одном испытании с высоким временным разрешением, не делая статистических предположений о входных данных.Он основан на частотном анализе реакции нейронов на ток, состоящий из двух синусоидальных компонентов, и позволяет измерять возбуждающую и тормозную проводимости одновременно с мембранным потенциалом как функцию времени. Мы демонстрируем этот метод in-silico, используя моделирование точечного нейрона, получающего возбуждающие и тормозящие синаптические входы, а также в реалистичной модели пирамидных клеток, когда синапсы распределяются дальше от сомы. Наконец, мы описываем ограничения этого подхода в записи патч-кламп целых клеток, полученных с использованием современных внутриклеточных усилителей.
Наконец, мы описываем ограничения этого подхода в записи патч-кламп целых клеток, полученных с использованием современных внутриклеточных усилителей.
Результаты
Преобразование мембранного потенциала и полной проводимости в проводимость E и I
Мы стремились разработать метод, который обеспечивает способ одновременного измерения возбуждающей и тормозной проводимости в одном испытании с высоким временным разрешением во время записи с токовыми клещами. Мы начнем с мембранного уравнения (1) для пассивных синаптических входов точечного нейрона, которое можно перестроить, чтобы изолировать возбуждающую и тормозную проводимости, как показано в уравнении (2).
(1)Замена V ( т ) — V л , V ( т ) — V e , V ( — ) V i с V l ( t ), V e ( t ), V i (9010) соответственно и предполагая, что общая проводимость равна сумме тормозной и возбуждающей проводимости г с ( t ) = г i ( t ) + g e ( т ) получаем: (2)
Уравнение (2) показывает, что два входа могут быть изолированы, если известны следующие параметры: В ( t ), мембранное напряжение; г л , герметичность; г с ( т ), общая синаптическая проводимость; V l , V e , V i , равновесные потенциалы индивидуальных проводимостей; C , емкость мембраны; I , ток стимула. На рис. 1 показано, как это уравнение работает в моделируемом точечном нейроне, где эти параметры действительно известны. Мы демонстрируем эту трансформацию, показывая подавляющие возбуждающие и тормозящие воздействия, а также ступенчатое изменение проводимости. Однако он работает для любого типа и динамики возбуждающих и тормозных входов.
На рис. 1 показано, как это уравнение работает в моделируемом точечном нейроне, где эти параметры действительно известны. Мы демонстрируем эту трансформацию, показывая подавляющие возбуждающие и тормозящие воздействия, а также ступенчатое изменение проводимости. Однако он работает для любого типа и динамики возбуждающих и тормозных входов.
Рис. 1. G e и g i можно получить из V (t) и общего g.
A. Моделирование коррелированных возбуждающих (зеленый) и тормозных (красный) синаптических входов (торможение с задержкой на 4 мс после возбуждения), которые подавляли согласно математическому описанию кратковременной синаптической депрессии (STD, Markram and Tsodyks, 1997).Это исходные данные, которые стремится выявить метод. B. Моделирование мембранного потенциала пассивного точечного нейрона (R = 300 МОм, C = 0,15 нФ, метод Эйлера, dt = 0,0005 с), получающего входные данные в A, с общей проводимостью, показанной ниже. Мы предполагаем, что эти два вектора измеримы. Короткий импульс тестового тока был введен в раннюю часть трассы. C Результат преобразования V (t), его производной (не показана) и полной синаптической проводимости в g e и g i с использованием уравнений (1 и 2).
Мы предполагаем, что эти два вектора измеримы. Короткий импульс тестового тока был введен в раннюю часть трассы. C Результат преобразования V (t), его производной (не показана) и полной синаптической проводимости в g e и g i с использованием уравнений (1 и 2).
https://doi.org/10.1371/journal.pcbi.1009725.g001
Как мы находим эти параметры в экспериментальных условиях? Обычно считается, что равновесные потенциалы известны и определяются из внутриклеточных и внеклеточных концентраций ионов. Проводимость утечки и емкость мембраны могут быть измерены при введении ступеней гиперполяризующего тока. Напряжение также легко определить с помощью токовых клещей. Однако разработка метода регистрации мембранного потенциала и одновременного измерения проводимости в каждый момент времени была сложной задачей.Как мы описываем ниже, мы можем теоретически оценить общую проводимость ячейки, измерив отклик напряжения во время подачи тока, состоящего из двух высокочастотных синусоидальных компонентов. Мы начнем с анализа импеданса пассивных цепей, представляющих упрощенный точечный нейрон с помощью пипетки с патч-зажимом, и описания взаимосвязи между импедансом и проводимостью клетки.
Мы начнем с анализа импеданса пассивных цепей, представляющих упрощенный точечный нейрон с помощью пипетки с патч-зажимом, и описания взаимосвязи между импедансом и проводимостью клетки.
Соотношение импеданс-проводимость в пассивном точечном нейроне
Чтобы разработать метод, который может быть практически использован для записи пластыря целых клеток, мы включили сопротивление пипетки пластыря в наш анализ.Как показано ниже, сопротивление электрода влияет на измерение импеданса ячейки, поэтому его нельзя игнорировать. Мы проанализировали в частотной области импеданс цепи, состоящей из записывающего электрода ( R s ) и упрощенного точечного нейрона (состоящего из проводимости, г (т) (равно г ). l + g e (t) + g i (t) ) и конденсатор, C ).Импеданс этой цепи определяется уравнением 3 ( w = 2πf , j — мнимая единица, а f — частота в герцах). Проводимость ячейки ( г (т) ) и сопротивление пипетки ( R с (t) могут изменяться со временем, и, следовательно, также полное сопротивление цепи ( Z (t) ).
Проводимость ячейки ( г (т) ) и сопротивление пипетки ( R с (t) могут изменяться со временем, и, следовательно, также полное сопротивление цепи ( Z (t) ).
На рис. 2 показана взаимосвязь между импедансом g и для различных частот (для постоянных значений).Он также показывает, что в присутствии R s кривые импеданс-частота пересекаются друг с другом по мере увеличения частоты, что приводит к положительной взаимосвязи между импедансом цепи и g для большого диапазона g (сравните Рис. 2A и 2C). Наличие R s также сохраняет фазу почти постоянной для разных частот и значений g (Рис 2D). Таким образом, сопротивление электрода оказывает заметное влияние на общий импеданс этой цепи, и его нельзя игнорировать при подаче высокочастотного синусоидального тока в ячейки.
Рис. 2. Частотные кривые импеданса пассивных электрических цепей для различных значений проводимости.
A. Зависимость абсолютного импеданса от частоты для различных значений модельной проводимости. Обратите внимание, что ни одна из кривых не пересекается. B. Кривые абсолютного импеданса как функция проводимости вместе с фазовыми кривыми между действительной и мнимой частями импеданса. Каждая линия представляет различную частоту (от 50 Гц до 500 Гц, шаг 50 Гц, от самой низкой (бледно-голубой или красный) до самой высокой (глубокие цвета), как указано в тексте (Fr = [50: 50: 500]) выше.Также представлены фазовые кривые между напряжением и током для тех же частот. C-D. То же, но когда RC-цепь также последовательно подключена к резистору (R s ). Обратите внимание на то, что в c кривые пересекаются на высоких частотах, а в d — фаза почти постоянна. Параметры фиксированной цепи: R с = 30 МОм, C = 0,15 нФ.
https://doi.org/10.1371/journal.pcbi.1009725.g002
Эксперимент in-silico
В следующих разделах мы покажем реакцию точечного нейрона на введение тока (рис. 3D), состоящую из двух синусоидальных компонентов (уравнение (4), w 1 = 2πf 1 , w 2 = 2πf 2 ):
(4)
может быть использован для измерения изменений возбуждающей и тормозной проводимости, наложенных на модель (рис. 2B) в одном испытании.Хотя реакция напряжения в нашем моделировании колеблется в большом диапазоне более 35 мВ (рис. 3C), большая часть падения напряжения происходит на электродном резисторе, как видно, когда мы устанавливаем R s на ноль (рис. 3E). Из-за низкочастотной фильтрации входа за счет пассивных свойств ячейки при подаче высокочастотного синусоидального тока колебания напряжения на самой мембране чрезвычайно ослабляются, в результате чего амплитуда от пика до пика составляет менее 6 мВ.Такие небольшие колебания вряд ли вызовут какой-либо собственный ток, управляемый напряжением. Обратите внимание, что значение сопротивления электрода учитывает как сопротивление пипетки, так и сопротивление доступа.
3D), состоящую из двух синусоидальных компонентов (уравнение (4), w 1 = 2πf 1 , w 2 = 2πf 2 ):
(4)
может быть использован для измерения изменений возбуждающей и тормозной проводимости, наложенных на модель (рис. 2B) в одном испытании.Хотя реакция напряжения в нашем моделировании колеблется в большом диапазоне более 35 мВ (рис. 3C), большая часть падения напряжения происходит на электродном резисторе, как видно, когда мы устанавливаем R s на ноль (рис. 3E). Из-за низкочастотной фильтрации входа за счет пассивных свойств ячейки при подаче высокочастотного синусоидального тока колебания напряжения на самой мембране чрезвычайно ослабляются, в результате чего амплитуда от пика до пика составляет менее 6 мВ.Такие небольшие колебания вряд ли вызовут какой-либо собственный ток, управляемый напряжением. Обратите внимание, что значение сопротивления электрода учитывает как сопротивление пипетки, так и сопротивление доступа. В нашем моделировании мы установили сопротивление электрода на 30 МОм, что выше, чем для типичного сопротивления доступа в записях in vitro, но находится в пределах диапазона записей in vivo [29]. Ток и напряжение используются для расчета всех пассивных свойств моделируемой ячейки в одном испытании (т.е.е., R с (t) , g (t) и C ). Все вычисления являются аналитическими, и приближение выполняется только при оценке емкости ячейки, как показано ниже. Как описано выше, оценка проводимости клетки позволяет нам измерить возбуждающую и тормозную проводимость.
В нашем моделировании мы установили сопротивление электрода на 30 МОм, что выше, чем для типичного сопротивления доступа в записях in vitro, но находится в пределах диапазона записей in vivo [29]. Ток и напряжение используются для расчета всех пассивных свойств моделируемой ячейки в одном испытании (т.е.е., R с (t) , g (t) и C ). Все вычисления являются аналитическими, и приближение выполняется только при оценке емкости ячейки, как показано ниже. Как описано выше, оценка проводимости клетки позволяет нам измерить возбуждающую и тормозную проводимость.
Рис. 3. Измерение полного импеданса в одной пробной модели точечного нейрона.
A. Смоделированный мембранный потенциал точечного нейрона при получении синаптических проводимостей, как показано в B. (возбуждение — зеленый, торможение — красный). C-D. Отклик напряжения смоделированного нейрона I, принимающего синаптические входы, описанные в b, и вводимый током, состоящим из двух синусоидальных компонентов (d, 0,375 нА, 210 Гц и 315 Гц). «Запись» производилась через электрод с сопротивлением 30 МОм, и, таким образом, большая часть падения напряжения из-за введенного тока происходила через электрод. E. Фактическое изменение напряжения на мембране было небольшим (как «зарегистрировано», когда сопротивление электрода было установлено на ноль). F-I. кривые напряжения и тока при фильтрации на двух частотах, используемых для формирования тока. Обратите внимание на небольшие колебания напряжения. J Кривые импеданса для каждой из двух частот, полученные путем деления преобразования Гильберта напряжения и тока, показанных в F-I, и последующего взятия абсолютных значений. Краевой эффект фильтрации наблюдается вблизи нулевого и конечного времен трасс.
«Запись» производилась через электрод с сопротивлением 30 МОм, и, таким образом, большая часть падения напряжения из-за введенного тока происходила через электрод. E. Фактическое изменение напряжения на мембране было небольшим (как «зарегистрировано», когда сопротивление электрода было установлено на ноль). F-I. кривые напряжения и тока при фильтрации на двух частотах, используемых для формирования тока. Обратите внимание на небольшие колебания напряжения. J Кривые импеданса для каждой из двух частот, полученные путем деления преобразования Гильберта напряжения и тока, показанных в F-I, и последующего взятия абсолютных значений. Краевой эффект фильтрации наблюдается вблизи нулевого и конечного времен трасс.
https://doi.org/10.1371/journal.pcbi.1009725.g003
Измерение полной проводимости ячейки
Первым шагом к измерению возбуждающей и тормозной проводимости ячейки с помощью подачи синусоидальных токов является измерение ее общей емкости. Емкость ячейки обычно оценивается по реакции на скачок тока. Также доступны другие методы такой оценки, такие как использование короткого импульса [30,31] и дисперсионный анализ реакции на введение шума [32]. Здесь мы показываем, что емкость ячейки может быть хорошо оценена по отклику на любую из двух частот, составляющих синусоидальный ток (уравнение (4)). Мы исходим из предположения, что при высокой частоте тока ( w * C >> g (t) 2 ) мы можем пренебречь g (t) 2 в знаменателях. второго и третьего слагаемых в уравнении 3.Следовательно, на таких частотах сопротивление электрода ( R s ) относительно больше, чем второй член, и, таким образом, вторым членом можно пренебречь. В этом случае общий импеданс цепи в основном определяется сопротивлением электрода и емкостью ячейки, поскольку последняя потребляет большую часть синусоидального тока, который вводится в ячейку. Здесь мы игнорируем любую паразитную емкость в записывающей системе, например, записывающей пипетки, но ниже мы покажем, что эту емкость можно частично компенсировать в автономном режиме.
Емкость ячейки обычно оценивается по реакции на скачок тока. Также доступны другие методы такой оценки, такие как использование короткого импульса [30,31] и дисперсионный анализ реакции на введение шума [32]. Здесь мы показываем, что емкость ячейки может быть хорошо оценена по отклику на любую из двух частот, составляющих синусоидальный ток (уравнение (4)). Мы исходим из предположения, что при высокой частоте тока ( w * C >> g (t) 2 ) мы можем пренебречь g (t) 2 в знаменателях. второго и третьего слагаемых в уравнении 3.Следовательно, на таких частотах сопротивление электрода ( R s ) относительно больше, чем второй член, и, таким образом, вторым членом можно пренебречь. В этом случае общий импеданс цепи в основном определяется сопротивлением электрода и емкостью ячейки, поскольку последняя потребляет большую часть синусоидального тока, который вводится в ячейку. Здесь мы игнорируем любую паразитную емкость в записывающей системе, например, записывающей пипетки, но ниже мы покажем, что эту емкость можно частично компенсировать в автономном режиме. Емкость ячейки можно оценить по соотношению амплитуды и фаз напряжения между напряжением и током. Эти отношения могут быть аппроксимированы уравнением (5) (см. Также фазовые кривые на рис. 2D), полученным из уравнения 3, когда w * C >> g .
Емкость ячейки можно оценить по соотношению амплитуды и фаз напряжения между напряжением и током. Эти отношения могут быть аппроксимированы уравнением (5) (см. Также фазовые кривые на рис. 2D), полученным из уравнения 3, когда w * C >> g .
Для того, чтобы такая оценка была действительной (т. Е. Для получения уравнения (5) из (3)), частота каждой из двух составляющих тока должна быть достаточно высокой. Например, для ячейки со средней проводимостью 1/100 МОм и общей емкостью 0.15 нФ, записано с помощью электрода 10 МОм ( R с ), соотношение ~ 88 между (w * C) 2 и g 2 будет получено при 100 Гц. Поскольку импеданс второго члена в уравнении (3) для этого примера составляет ~ 1 МОм, что намного меньше, чем R с (10 МОм), мы пренебрегаем этим членом. Таким образом, емкость может быть получена из уравнения (5), если мы можем оценить сопротивление электрода и соотношение фаз между током и напряжением. Мы делаем это в одном испытании, когда вводится синусоидальный ток, сначала измеряя сопротивление электрода ( R s , est ) из отношения абсолютных значений быстрого преобразования Фурье (БПФ) напряжение и ток на частоте подаваемого тока после того, как обе трассы были полосно отфильтрованы на одной из двух частот (F1 или F2, с использованием «полосовой» функции Matlab, реализующей фильтр с конечной импульсной характеристикой ( FIR )).Важно отметить, что этот расчет выполняется для временного окна, в течение которого стимуляция не осуществляется (например, за 1 секунду до стимуляции). Затем два вектора ( FV , FI , напряжение и ток с полосовой фильтрацией) используются для оценки R s . Для измерения емкости мы даем приблизительную оценку R s , отмеченную звездочкой. Более точная оценка R s будет предоставлена позже.
Мы делаем это в одном испытании, когда вводится синусоидальный ток, сначала измеряя сопротивление электрода ( R s , est ) из отношения абсолютных значений быстрого преобразования Фурье (БПФ) напряжение и ток на частоте подаваемого тока после того, как обе трассы были полосно отфильтрованы на одной из двух частот (F1 или F2, с использованием «полосовой» функции Matlab, реализующей фильтр с конечной импульсной характеристикой ( FIR )).Важно отметить, что этот расчет выполняется для временного окна, в течение которого стимуляция не осуществляется (например, за 1 секунду до стимуляции). Затем два вектора ( FV , FI , напряжение и ток с полосовой фильтрацией) используются для оценки R s . Для измерения емкости мы даем приблизительную оценку R s , отмеченную звездочкой. Более точная оценка R s будет предоставлена позже.
Фаза между FV и FI вычисляется на основе преобразования Гильберта FV (оператор H, для F1 или F2) с использованием функции Matlab «гильберта» и усреднения по времени: (7)
Усреднение выполняется для того же временного окна, что и выше, в течение которого стимуляция не осуществляется (например, за 1 секунду до этого). Тригонометрические отношения между действительной и мнимой частями в уравнении (5) описаны в уравнении (8), что позволяет оценить общую емкость ячейки, учитывая, что измерены значения R s и θ est как описано в уравнениях (6) и (7): (8)
В примере, показанном на рисунках 2 и 3, реальная емкость была установлена на 0.15 нФ и была оценена как 0,149 нФ. Обратите внимание, что оценка C также может быть получена при установке R s на ноль с аналогичной точностью.
Затем мы используем расчетную емкость ячейки, чтобы измерить проводимость ячейки и получить более точное измерение сопротивления электрода, как с течением времени, в одном испытании. В этом расчете эти значения будут измеряться на основе аналитического решения уравнения 3, на этот раз без каких-либо приближений.Здесь мы используем тот факт, что ток содержит две синусоидальные составляющие, имеющие две разные частоты (F1 и F2, например, 210 Гц и 315 Гц, как используется в примере). Поскольку Z (f) уменьшается с увеличением частоты (рис. 2), увеличение частоты, хотя и обеспечивает более высокое временное разрешение, уменьшит отношение сигнал / шум при наличии шума. Затем напряжение и ток проходят полосовую фильтрацию на двух частотах (рис. 3F – 3I, из-за разрешения экрана отображаются в виде цветных пятен).Обратите внимание на небольшие модуляции сигналов напряжения с полосовой фильтрацией, которые составляют порядка 1 мВ. Эти модуляции возникают в результате изменений проводимости клетки во время моделирования синаптических входов в соответствии с соотношениями между ними, как показано на рис. 2. Для каждой полосы напряжения и тока с полосовой фильтрацией: FV 1 ( t ), FV 2 ( t ), FI 1 ( t ), FI 2 ( t ) мы вычислили преобразования Гильберта ( HFV 1 ( t ), HFV 2 ( t ), HFI 1 ( t ), HFI 2 ( t ), используя функцию Matlab ‘hilbert’).
В этом расчете эти значения будут измеряться на основе аналитического решения уравнения 3, на этот раз без каких-либо приближений.Здесь мы используем тот факт, что ток содержит две синусоидальные составляющие, имеющие две разные частоты (F1 и F2, например, 210 Гц и 315 Гц, как используется в примере). Поскольку Z (f) уменьшается с увеличением частоты (рис. 2), увеличение частоты, хотя и обеспечивает более высокое временное разрешение, уменьшит отношение сигнал / шум при наличии шума. Затем напряжение и ток проходят полосовую фильтрацию на двух частотах (рис. 3F – 3I, из-за разрешения экрана отображаются в виде цветных пятен).Обратите внимание на небольшие модуляции сигналов напряжения с полосовой фильтрацией, которые составляют порядка 1 мВ. Эти модуляции возникают в результате изменений проводимости клетки во время моделирования синаптических входов в соответствии с соотношениями между ними, как показано на рис. 2. Для каждой полосы напряжения и тока с полосовой фильтрацией: FV 1 ( t ), FV 2 ( t ), FI 1 ( t ), FI 2 ( t ) мы вычислили преобразования Гильберта ( HFV 1 ( t ), HFV 2 ( t ), HFI 1 ( t ), HFI 2 ( t ), используя функцию Matlab ‘hilbert’). Эти комплексные векторы затем используются для расчета импеданса ячейки на двух частотах с течением времени:
(9)
(10)
Эти комплексные векторы затем используются для расчета импеданса ячейки на двух частотах с течением времени:
(9)
(10)
Абсолютные значения этих комплексных векторов, показанные на рис. 3J, демонстрируют кривые, форма которых аналогична общей проводимости клетки (утечка плюс синаптическая проводимость). Обратите внимание, что когда проводимость ячейки увеличивается во время активации этих входов, сопротивление также увеличивается. Это происходит только при наличии R s , как показано на рис.
Эти два вектора импеданса затем используются вместе для решения уравнения 3 и получения решения для R s (t) и g (t) (когда z 1 ≠ z 2 , C — расчетная емкость). С этой целью мы использовали Mathematica (Wolfram) для решения двух уравнений для абсолютных значений z 1 и z 2 (« Решить [Abs (r + 1 / (g + I * w1 * c)) = = Abs (z1) && Abs (r + 1 / (g + I * w2 * c)) = = Abs (z2), {r, g}] ”, I = мнимая единица в Mathematica (Wolfram) ) , который дает следующие решения для R s и g (здесь Z 1 и Z 2 являются комплексными векторами, зависящими от времени, j — мнимая единица, а C — расчетная емкость): (11) (12)
В уравнениях (11) и (12) z 1 , z 2 , а также R s , est ( t ) являются переменными, зависящими от времени. Идентичная оценка будет получена в уравнении 12 после замены w 1 и z 1 на w 2 и z 2 . На рис. 4A мы снова построили две кривые импеданса, а также включили сопротивление электрода ( R s , est ( t )), которое лишь немного превышает его реальное значение, используемое в моделировании. . Расчетная общая проводимость представлена на рис. 4C.Обратите внимание, что расчетная общая проводимость практически идентична по форме и величине сумме проводимости утечки, возбуждения и подавления, используемой для моделирования мембранного потенциала в этом примере.
Идентичная оценка будет получена в уравнении 12 после замены w 1 и z 1 на w 2 и z 2 . На рис. 4A мы снова построили две кривые импеданса, а также включили сопротивление электрода ( R s , est ( t )), которое лишь немного превышает его реальное значение, используемое в моделировании. . Расчетная общая проводимость представлена на рис. 4C.Обратите внимание, что расчетная общая проводимость практически идентична по форме и величине сумме проводимости утечки, возбуждения и подавления, используемой для моделирования мембранного потенциала в этом примере.
Рис. 4. Измерение g e и g i в одном испытании на основе измерений импеданса — моделирование точечного нейрона.
A. Кривые абсолютного импеданса для каждой частоты (как показано на рис. 2). B. Мембранный потенциал после фильтрации компонентов на введенных частотах. C. Измеренные проводимость и сопротивление электрода (показаны на A) были получены из кривых абсолютного импеданса (уравнения (11), (12)) и расчетной емкости. D. Возбуждающая и тормозная проводимости оценивались по очищенному напряжению и измеренной проводимости (уравнения 1, 2). На вставках показаны расширенные данные для первых синаптических ответов, наложенные на реальные проводимости (тонкие линии) (масштабные линейки — 100 мс и 10 нСм. E. Измеренные возбуждающие и тормозящие значения в сопоставлении с реальными значениями, которые использовались для моделирования.
C. Измеренные проводимость и сопротивление электрода (показаны на A) были получены из кривых абсолютного импеданса (уравнения (11), (12)) и расчетной емкости. D. Возбуждающая и тормозная проводимости оценивались по очищенному напряжению и измеренной проводимости (уравнения 1, 2). На вставках показаны расширенные данные для первых синаптических ответов, наложенные на реальные проводимости (тонкие линии) (масштабные линейки — 100 мс и 10 нСм. E. Измеренные возбуждающие и тормозящие значения в сопоставлении с реальными значениями, которые использовались для моделирования.
https://doi.org/10.1371/journal.pcbi.1009725.g004
Оценка возбуждающей и тормозной проводимости на основе проводимости клетки и мембранного потенциала
После оценки общей проводимости уравнения (1) и (2) используются для вычисления возбуждающей и тормозной проводимости, как описано выше. Поскольку в ячейку вводится синусоидальный ток (с двумя частотными компонентами), мы блокируем полосовой фильтр вокруг каждой частоты (+ — 5 Гц), чтобы получить чистую версию мембранного потенциала. Прежде чем использовать уравнения (1) и (2), нам необходимо вычислить мембранный потенциал покоя и соответствующую ему проводимость утечки. Мы делаем это путем нахождения среднего напряжения в очищенном мембранном потенциале для нижнего 5 -го процентиля вектора полной проводимости, который, как мы предполагаем, отражает состояние покоя, в котором не вызываются синаптические входы (т. Е. g l , есть ). Соответствующие значения мембранного потенциала для этого 5-го процентиля проводимости использовали для расчета среднего потенциала покоя ( В, , ).Синаптическая проводимость просто определяется выражением: g s , est ( t ) = g est ( t ) — g l , est (разница между общей проводимостью и проводимостью утечки). В преобразовании, представленном в уравнениях (1) и (2), мы предполагаем, что нам доступны реверсивные потенциалы возбуждения и торможения (т.
Прежде чем использовать уравнения (1) и (2), нам необходимо вычислить мембранный потенциал покоя и соответствующую ему проводимость утечки. Мы делаем это путем нахождения среднего напряжения в очищенном мембранном потенциале для нижнего 5 -го процентиля вектора полной проводимости, который, как мы предполагаем, отражает состояние покоя, в котором не вызываются синаптические входы (т. Е. g l , есть ). Соответствующие значения мембранного потенциала для этого 5-го процентиля проводимости использовали для расчета среднего потенциала покоя ( В, , ).Синаптическая проводимость просто определяется выражением: g s , est ( t ) = g est ( t ) — g l , est (разница между общей проводимостью и проводимостью утечки). В преобразовании, представленном в уравнениях (1) и (2), мы предполагаем, что нам доступны реверсивные потенциалы возбуждения и торможения (т. е. 0 мВ и -70 мВ). Емкость и общая проводимость получаются, как описано выше.Результаты этих вычислений показаны на рис. 4D. Наши расчеты показали, что расчетные проводимости почти идентичны реальным входам моделируемой ячейки (сравните рисунки 3B и 4D). Отметим, что наш метод позволяет оценить проводимость даже при выходе тонического сигнала, что продемонстрировано ступенчатым изменением возбуждения и торможения (показано между 3–4 секундами). Фактически, корреляция Пирсона между реальными входными данными и предполагаемыми входными данными для этого смоделированного примера была чрезвычайно высокой: 0.999 для возбуждения и 0,996 для торможения (фиг. 3E).
е. 0 мВ и -70 мВ). Емкость и общая проводимость получаются, как описано выше.Результаты этих вычислений показаны на рис. 4D. Наши расчеты показали, что расчетные проводимости почти идентичны реальным входам моделируемой ячейки (сравните рисунки 3B и 4D). Отметим, что наш метод позволяет оценить проводимость даже при выходе тонического сигнала, что продемонстрировано ступенчатым изменением возбуждения и торможения (показано между 3–4 секундами). Фактически, корреляция Пирсона между реальными входными данными и предполагаемыми входными данными для этого смоделированного примера была чрезвычайно высокой: 0.999 для возбуждения и 0,996 для торможения (фиг. 3E).
Вычисление возбуждающей и тормозной проводимости ячейки, встроенной в сбалансированную сеть
Мы спросили, можно ли использовать наш подход для выявления лежащих в основе возбуждающей и тормозной проводимости модельного коркового нейрона, встроенного в активную сеть, где он получает возбуждающие и тормозящие сигналы. Поэтому мы использовали моделирование корковой сети в сбалансированном асинхронном состоянии [33], чтобы получить возбуждающие и тормозные синаптические входы отдельной клетки (любезно предоставленные доктором Др.Майкл Окун, Лестерский университет). Мы использовали эти проводимости при моделировании одиночной ячейки, в которой мы вводили ток с двумя синусоидальными составляющими (210 Гц и 315 Гц) через электрод 50 МОм и измеряли отклик ячейки до (рис.5) и после фильтрации две синусоидальные составляющие мембранного потенциала (рис. 5B, черная кривая, которая почти идеально совмещается с кривой, полученной без ввода тока, синяя кривая).
Поэтому мы использовали моделирование корковой сети в сбалансированном асинхронном состоянии [33], чтобы получить возбуждающие и тормозные синаптические входы отдельной клетки (любезно предоставленные доктором Др.Майкл Окун, Лестерский университет). Мы использовали эти проводимости при моделировании одиночной ячейки, в которой мы вводили ток с двумя синусоидальными составляющими (210 Гц и 315 Гц) через электрод 50 МОм и измеряли отклик ячейки до (рис.5) и после фильтрации две синусоидальные составляющие мембранного потенциала (рис. 5B, черная кривая, которая почти идеально совмещается с кривой, полученной без ввода тока, синяя кривая).
Рис. 5. Оценка корреляции между возбуждающей и тормозной проводимостью нейрона, встроенного в сбалансированные / несбалансированные сети.
A. Возбуждающая и тормозная проводимости, взятые из моделирования сети (см. Текст), были использованы для моделирования отклика точечного нейрона, записанного с помощью пипетки 50 МОм при вводе синусоидального тока 210 Гц и 315 Гц 0,5 нА. B. Напряжение в A было «очищено» от синусоидальной составляющей (черная кривая), и оно отображается вместе с характеристикой напряжения ячейки, когда не подавался ток, наложенным на «очищенное» напряжение. C-D. Расчетная возбуждающая и тормозная проводимости, наложенные на наложенные проводимости моделируемой ячейки. E, G. Цветные линии описывают взаимные корреляции между наложенной и оцененной возбуждающей и тормозной проводимостью для сбалансированной корковой динамики. F. Корреляции между измеренными g e и g i (синяя линия) и между наложенными g e и g i (черная линия). H-J. Тот же анализ, что и для e-g, но после сдвига тормозного входа на 10 секунд для имитации некоррелированных возбуждающих и тормозных входов.
B. Напряжение в A было «очищено» от синусоидальной составляющей (черная кривая), и оно отображается вместе с характеристикой напряжения ячейки, когда не подавался ток, наложенным на «очищенное» напряжение. C-D. Расчетная возбуждающая и тормозная проводимости, наложенные на наложенные проводимости моделируемой ячейки. E, G. Цветные линии описывают взаимные корреляции между наложенной и оцененной возбуждающей и тормозной проводимостью для сбалансированной корковой динамики. F. Корреляции между измеренными g e и g i (синяя линия) и между наложенными g e и g i (черная линия). H-J. Тот же анализ, что и для e-g, но после сдвига тормозного входа на 10 секунд для имитации некоррелированных возбуждающих и тормозных входов.
https://doi.org/10. 1371/journal.pcbi.1009725.g005
1371/journal.pcbi.1009725.g005
Затем мы использовали наши вычисления для оценки возбуждающей и тормозной проводимости (рис. 5C и 5D). Однако обратите внимание, что для обоих входов расчетная проводимость более отрицательная, чем ожидалось. Это просто потому, что проводимость утечки была оценена на основе процентиля 5 – общей проводимости клетки, но поскольку синаптическая активность сохранялась на протяжении всей трассы, проводимость утечки отражает смесь истинной проводимости утечки и некоторой базовой синаптической активности.Тем не менее, оценочные возбуждающие и тормозные синаптические проводимости были очень похожи на те, которые использовались в качестве входных данных (рис. 5E и 5G), и, как и реальные входные данные, расчетные проводимости E и I сильно коррелировали (рис. 5F). Наш подход также оказался успешным при измерении входов E и I, когда они не коррелированы (рис. 5H и 5J, путем сдвига тормозящего входа на 10 секунд относительно возбуждения). Действительно, как и ожидалось для этого случая, корреляция между измеренными входными данными не была измерена (рис. 5I).Таким образом, наш подход позволяет точно оценить возбуждающие и тормозящие входы в различных условиях без необходимости принимать во внимание динамические и статистические свойства возбуждающих и тормозных входов.
5I).Таким образом, наш подход позволяет точно оценить возбуждающие и тормозящие входы в различных условиях без необходимости принимать во внимание динамические и статистические свойства возбуждающих и тормозных входов.
Измерение входов E и I при больших изменениях сопротивления доступа
Изменения в сопротивлении доступу из-за неполного разрыва мембраны или из-за движения записанной клетки и препарата, прижимающего пипетку к мембране, являются хорошо известными ограничениями записи пластыря целой клетки.Однако одно из преимуществ подхода заключается в его способности отслеживать изменения электрода и сопротивления доступа и учитывать их при вычислении полной проводимости ячейки с высоким временным разрешением. Мы демонстрируем это, моделируя быстрые изменения сопротивления электродов во время записи in-silico (рис. 6, синаптические входы идентичны тем, которые использовались на рис. 3). Эти изменения привели к зашумленным измерениям импеданса (рис. 6А). Однако, поскольку мы можем измерить сопротивление доступу с течением времени ( R s ( t ) est ) и всего г (т) одновременно (уравнения (11) и ( 12)) с последующим измерением возбуждения и ингибирования, как описано в уравнении (2), изменения сопротивления электрода не оказали видимого влияния на способность точно оценивать тормозную и возбуждающую проводимости (рис. 6D и 6E).
6D и 6E).
Рис. 6. Измерения g e и g i точны, даже если сопротивление электрода нестабильно.
A. Кривые абсолютного импеданса для каждой отображаемой частоты вместе с измеренным сопротивлением электрода. Чтобы модулировать сопротивление электрода, мы сгладили нормально распределенный шумовой сигнал нижних частот и добавили его к фиксированному сопротивлению. Все остальные параметры входов идентичны показанным на рисунках 3 и 4. B-E. Анализ зависимости напряжения точечного нейрона, обработанного таким же образом, как показано на рисунках 2 и 3.Обратите внимание на точные оценки g e и g i (сравните с рис. 3B).
https://doi.org/10.1371/journal.pcbi.1009725.g006
Измерение входов E и I при наличии реалистичного шума
Затем мы спросили, насколько чувствительны наши измерения при наличии реалистичного шума. Поэтому мы использовали типичный патч-электрод для записи кривой напряжения в установке среза при размещении электрода вне нейрона (любезно предоставлено доктором. Александр Биншток, Еврейский университет). Затем мы добавили этот шум к нашему смоделированному напряжению перед измерением возбуждения и торможения (рис. 7). Пример напряжения в отсутствие инжекции синусоидального тока показан на вставке на рис. 7A (шкала напряжения 0,5 мВ). Несмотря на присутствие такого шума (стандартное отклонение 0,04 мВ) и одновременно более шумное измерение (рис. 7D) возбуждения и торможения, их значения близко соответствовали тем, которые мы вводили в качестве входных данных при моделировании (рис. 7E).
Александр Биншток, Еврейский университет). Затем мы добавили этот шум к нашему смоделированному напряжению перед измерением возбуждения и торможения (рис. 7). Пример напряжения в отсутствие инжекции синусоидального тока показан на вставке на рис. 7A (шкала напряжения 0,5 мВ). Несмотря на присутствие такого шума (стандартное отклонение 0,04 мВ) и одновременно более шумное измерение (рис. 7D) возбуждения и торможения, их значения близко соответствовали тем, которые мы вводили в качестве входных данных при моделировании (рис. 7E).
Рис. 7. Измерения g e и g i точны при наличии реалистичного зарегистрированного шума.
A. Кривые абсолютного импеданса для каждой частоты, изображенные вместе с измеренным сопротивлением электрода, когда реальный шум, записанный на этапе in vitro, был добавлен к смоделированному напряжению перед измерением. На вставке показан график напряжения в отсутствие синусоидальной инжекции (масштабные полосы: 0,5 с, 0,5 мВ). Все остальные параметры входов идентичны показанным на рисунках 3 и 4. B-E. Анализ зависимости напряжения точечного нейрона, обработанного таким же образом, как показано на рисунках 2, 3 и 6. Обратитесь к рисунку 3B для получения достоверных данных g e и g i .
Все остальные параметры входов идентичны показанным на рисунках 3 и 4. B-E. Анализ зависимости напряжения точечного нейрона, обработанного таким же образом, как показано на рисунках 2, 3 и 6. Обратитесь к рисунку 3B для получения достоверных данных g e и g i .
https://doi.org/10.1371/journal.pcbi.1009725.g007
Компенсация емкости электрода
В приведенных выше расчетах мы предполагали, что записи производятся пипеткой с нулевой емкостью. Однако емкость электрода может сильно повлиять на измерения с использованием нашего нового алгоритма.Большая часть паразитной емкости записывающих пипеток формируется из-за разделения раствора внутри стеклянных пипеток по сравнению с внешними. Экспериментально его можно уменьшить, но нельзя устранить, покрывая пипетку гидрофобным материалом [34]. Емкость пипетки ( C p , проиллюстрировано на фиг. 8) также может быть нейтрализована электронной схемой внутриклеточного усилителя с использованием цепи положительной обратной связи. В нашем эксперименте in-silico мы показываем, что C p может сильно повлиять на измерение, поскольку емкость пипетки потребляет часть введенного синусоидального тока.В результате измерения импеданса для двух частот (z 1 и z 2 ) меньше, чем ожидалось, для ячейки и только для R s (рис. 8B, Rs составляет 20 МОм, а кривые значительно ниже этого значения). Это, в свою очередь, приводит к гораздо более высокой проводимости утечки и совершенно неверной оценке синаптических проводимостей на основе уравнений (11) и (12). В целом, наши оценки могут быть ошибочными, что приводит к отрицательной вызванной тормозной проводимости (рис. 8D).
В нашем эксперименте in-silico мы показываем, что C p может сильно повлиять на измерение, поскольку емкость пипетки потребляет часть введенного синусоидального тока.В результате измерения импеданса для двух частот (z 1 и z 2 ) меньше, чем ожидалось, для ячейки и только для R s (рис. 8B, Rs составляет 20 МОм, а кривые значительно ниже этого значения). Это, в свою очередь, приводит к гораздо более высокой проводимости утечки и совершенно неверной оценке синаптических проводимостей на основе уравнений (11) и (12). В целом, наши оценки могут быть ошибочными, что приводит к отрицательной вызванной тормозной проводимости (рис. 8D).
Рис. 8. Вычислительный подход для компенсации паразитной емкости для измерения возбуждения и торможения в модели in-silico.
A. «Настоящие» входы в эксперименте in-silico и схема, представляющая конфигурацию записи. Обратите внимание на C p , паразитную емкость электрода (R s ). Б-Д. Измерение импеданса с последующим расчетом проводимости и входов E и I с использованием подхода, описанного на рисунках 3 и 4. E-G. Аналогичные измерения при пересчете импеданса на каждой частоте с использованием формул (13) — (18) для вычитания влияния емкости пипетки.
Б-Д. Измерение импеданса с последующим расчетом проводимости и входов E и I с использованием подхода, описанного на рисунках 3 и 4. E-G. Аналогичные измерения при пересчете импеданса на каждой частоте с использованием формул (13) — (18) для вычитания влияния емкости пипетки.
https://doi.org/10.1371/journal.pcbi.1009725.g008
Чтобы компенсировать снижение импеданса из-за емкости пипетки, мы оценили Cp, а затем использовали это значение для корректировки измеренного импеданса. Здесь мы показываем теоретическую проводимость (Y, Y = 1 / Z) на каждой из двух частот для эквивалентной схемы ячейки, записанной с помощью пипетки, которая имеет паразитную емкость, как показано на рис.8.Вторые члены в следующих уравнениях отображают проводимость паразитной емкости (уравнения (13) — (15) были получены из схемы, представленной на рис. 8, G — полная проводимость элемента).
(13) (14)Из этих двух уравнений и замены на Y 1 (и Y 2 ), C p получается следующим образом: (15)
Однако значения Y и Y 2 неизвестны, и мы их ищем. Однако мы обнаружили, что вторым членом ( Y 1 -Y 2 ) можно пренебречь, поскольку он намного меньше по сравнению со значением 1/ Z 1 −1 / Z 2 . Например, для параметров, используемых в этом моделировании, отношение между последним и первым членами составляет ~ 200, что явно оправдывает наше следующее приближение, в котором мы используем измеренные кривые импеданса, как сделано с использованием уравнений (9) и (10) ( показаны как измеренные ниже Z 1 и Z 2 , оба зависят от времени).
Однако мы обнаружили, что вторым членом ( Y 1 -Y 2 ) можно пренебречь, поскольку он намного меньше по сравнению со значением 1/ Z 1 −1 / Z 2 . Например, для параметров, используемых в этом моделировании, отношение между последним и первым членами составляет ~ 200, что явно оправдывает наше следующее приближение, в котором мы используем измеренные кривые импеданса, как сделано с использованием уравнений (9) и (10) ( показаны как измеренные ниже Z 1 и Z 2 , оба зависят от времени).
Затем мы используем это оценочное значение C p (усредненное для выбранного временного окна (например, 1S) до стимуляции в предположении, что синаптические входы в это время молчат) для вычисления оценочного полное сопротивление элемента и электрода, как теоретически ожидается (), которое получается путем вычитания из двух измеренных кривых Z составляющей C p , est после перестановки уравнений 13 и 14: (17) (18)
Новые векторы Z ‘ затем используются в качестве входных данных, как описано выше в уравнениях (11) и (12), и последующий процесс, как описано выше. Этот подход значительно улучшил измерение возбуждения и торможения (рис. 8E – 8G). Следовательно, этот компонент анализа, который можно включать и выключать, может помочь решить анализ реальных записей, где паразитная емкость всегда существует.
Этот подход значительно улучшил измерение возбуждения и торможения (рис. 8E – 8G). Следовательно, этот компонент анализа, который можно включать и выключать, может помочь решить анализ реальных записей, где паразитная емкость всегда существует.
Измерение синаптической проводимости в морфологически реалистичных нейронах
Чтобы оценить, как наш метод разрешает дендритную проводимость, мы смоделировали морфологически реалистичную пирамидную клетку CA1 [35]. Мы равномерно распределяем 50 тормозных и 50 возбуждающих синапсов проксимальнее сомы.Мы поняли, что из-за утечки введенного синусоидального тока в дендриты расчетная проводимость утечки намного превышает ее фактическое значение. В случае проксимальных синаптических входов меньше тока уходит к дендритам во время активации этих входов по сравнению с условиями до стимуляции. Мы компенсировали это изменение, динамически изменяя силу утечки проводимости в каждый момент времени на основе оценки общей синаптической проводимости перед расчетом возбуждающей и тормозной проводимости (уравнения (1) и (2)) с использованием этого эмпирического уравнения: (19)
Такое изменение эквивалентно динамическому изменению электротонической длины ячеек, которое, как известно, вызывает ошибки пространственного зажима [36–38]. Он показывает, что при слабом проксимальном синаптическом входе эта функция сильно снижает вновь вычисленную проводимость утечки ( g ′ l ( t )), как и ожидалось, и что это позволяет компенсировать утечку тока. Однако, когда синаптические входы становятся сильнее, функция увеличивает утечку, поскольку ожидается, что меньший ток уйдет к дендритам из-за шунтирующего эффекта входа.
Он показывает, что при слабом проксимальном синаптическом входе эта функция сильно снижает вновь вычисленную проводимость утечки ( g ′ l ( t )), как и ожидалось, и что это позволяет компенсировать утечку тока. Однако, когда синаптические входы становятся сильнее, функция увеличивает утечку, поскольку ожидается, что меньший ток уйдет к дендритам из-за шунтирующего эффекта входа.
Хотя эти синапсы в среднем находятся на расстоянии 129,92 мкм (± 47,83 мкм стандартное отклонение) от сомы, наш метод разрешает возбуждающую и тормозную проводимость в одном испытании, по крайней мере, так же, как измерения фиксации напряжения во время двух отдельных испытаний.Когда синапсы перемещаются дальше, на промежуточное расстояние 238,69 мкм (± 39,71 мкм стандартное отклонение), наш метод занижает проводимость в той же степени, что и фиксация напряжения (рис. 9B). В большинстве биологических условий синапсы не ограничиваются узкой частью дендрита. Следовательно, мы равномерно распределили синапсы в любом месте апикального дендритного дерева (рис. 9C). Это привело к образованию синапсов со средним расстоянием до сомы 309,92 мкм (± 164,46 мкм стандартное отклонение). В этом случае наш метод по-прежнему следует за проводимостью, но хуже по сравнению с фиксатором напряжения.Поскольку качество измерения, казалось, снижалось с увеличением расстояния, мы провели больше симуляций, чтобы количественно оценить взаимосвязь между соматическим расстоянием и качеством записи.
9C). Это привело к образованию синапсов со средним расстоянием до сомы 309,92 мкм (± 164,46 мкм стандартное отклонение). В этом случае наш метод по-прежнему следует за проводимостью, но хуже по сравнению с фиксатором напряжения.Поскольку качество измерения, казалось, снижалось с увеличением расстояния, мы провели больше симуляций, чтобы количественно оценить взаимосвязь между соматическим расстоянием и качеством записи.
Рис. 9. Измерение изменений проводимости дендритных синапсов.
A. Тормозящие и возбуждающие синапсы были размещены проксимальнее (129,92 мкм ± 47,83 мкм стандартное отклонение) от сомы, и все измерения проводились на соме. Одновременные измерения проводимости по крайней мере так же точны, как и отдельные записи фиксации напряжения для этих проксимальных синапсов. B. Тормозящие и возбуждающие синапсы были размещены на промежуточном расстоянии (238,69 мкм ± 39,71 мкм стандартное отклонение). Одновременные измерения проводимости и фиксация напряжения хорошо коррелируют с временной динамикой, но недооценивают амплитуду. C Для распределенных синапсов (309,92 мкм ± 164,46 мкм стандартное отклонение) одновременные измерения проводимости занижают величину истинной проводимости, но все же следуют динамике времени.
C Для распределенных синапсов (309,92 мкм ± 164,46 мкм стандартное отклонение) одновременные измерения проводимости занижают величину истинной проводимости, но все же следуют динамике времени.
https://doi.org/10.1371/journal.pcbi.1009725.g009
Измерения проводимости проксимальных входов стабильны и надежны
Чтобы исследовать взаимосвязь между качеством измерения и синаптическим расстоянием до сомы, мы смоделировали один возбуждающий и единственный тормозной синапс в одном и том же дендритном сегменте. Как и выше, мы обнаружили, что можем надежно изолировать проводимость, когда пара синапсов находится близко к соме (рис. 10А). При крайне дистальной локализации синапсов измерение становится ненадежным.Даже фиксатор напряжения перестает следовать временной динамике. Чтобы количественно оценить степень, в которой наши измерения соответствуют временной динамике тока, мы рассчитали коэффициент корреляции между измерением и истинной проводимостью. Мы обнаружили, что измерения очень надежны для синапсов с соматическим расстоянием менее 400 мкм (рис. 10C). Выше этого расстояния качество измерения проводимости возбуждения резко ухудшается (рис. 10B и 10C).
Мы обнаружили, что измерения очень надежны для синапсов с соматическим расстоянием менее 400 мкм (рис. 10C). Выше этого расстояния качество измерения проводимости возбуждения резко ухудшается (рис. 10B и 10C).
Рис. 10. Одновременные измерения проводимости точны для синапсов размером до 400 мкм, но выше не подходят.
A. Одновременные измерения проводимости являются очень точными для возбуждающих и тормозных проксимальных синапсов. B. Для чрезвычайно дистальных синапсов наши одновременные измерения проводимости становятся неточными. Цветовая легенда, как указано выше. C. Коэффициент корреляции для многих синапсов подтверждает, что одновременные измерения проводимости не менее точны, чем фиксация напряжения ниже соматического расстояния 400 мкм. Для более удаленных синапсов метод измерения проводимости резко нарушает проводимость возбуждения.
https://doi.org/10.1371/journal.pcbi.1009725.g010
Обсуждение
Мы описываем новую схему для оценки возбуждающих и тормозных синаптических проводимостей нейрона при токовом зажиме в одном испытании с высоким временным разрешением, отслеживая траекторию мембранного потенциала. Мы показываем, что метод позволяет оценивать эти входы также в морфологически реалистичной модели нейрона. Описанная выше работа является теоретической и закладывает основу для будущих экспериментальных работ.
Мы показываем, что метод позволяет оценивать эти входы также в морфологически реалистичной модели нейрона. Описанная выше работа является теоретической и закладывает основу для будущих экспериментальных работ.
Метод основан на теории анализа электрических цепей с течением времени, когда в ячейку подается сумма двух синусоидальных токов. Это позволяет нам измерять возбуждающую и тормозную проводимость и в то же время отслеживать мембранный потенциал.
Мы продемонстрировали метод моделирования точечного нейрона и реалистичного моделирования пирамидальной клетки, получающей проксимальные и равномерно распределенные синаптические входы. Для точечного нейрона мы показали, что можем выявить время и величину подавляющих возбуждающих и тормозных синаптических входов с высоким временным разрешением и точностью выше 99% (рис. 3 и 4).В другом примере мы использовали наш метод для выявления этих входов во время асинхронного сбалансированного коркового состояния и показали, что динамика возбуждения и торможения может быть измерена с высокой точностью. Важно отметить, что эти оценки были получены в результате единичных испытаний и позволили получить естественную динамику мембранного потенциала, отфильтровав синусоидальные компоненты ответа на введенный ток. Следовательно, наш метод особенно подходит для оценки возбуждения и торможения, когда эти входные данные не привязаны к стереотипным внешним или внутренним событиям, например, во время текущей деятельности.Отметим, что при подаче высокочастотного тока (от пары сотен герц и выше) напряжение падает в основном на регистрирующем электроде. Здесь мы настроили амплитуду тока для создания синусоидальных колебаний в несколько милливольт на клеточной мембране, которые должны иметь минимальное влияние на зависящую от напряжения внутреннюю и синаптическую проводимость при выполнении записи в реальных нейронах.
Важно отметить, что эти оценки были получены в результате единичных испытаний и позволили получить естественную динамику мембранного потенциала, отфильтровав синусоидальные компоненты ответа на введенный ток. Следовательно, наш метод особенно подходит для оценки возбуждения и торможения, когда эти входные данные не привязаны к стереотипным внешним или внутренним событиям, например, во время текущей деятельности.Отметим, что при подаче высокочастотного тока (от пары сотен герц и выше) напряжение падает в основном на регистрирующем электроде. Здесь мы настроили амплитуду тока для создания синусоидальных колебаний в несколько милливольт на клеточной мембране, которые должны иметь минимальное влияние на зависящую от напряжения внутреннюю и синаптическую проводимость при выполнении записи в реальных нейронах.
Сравнение с другими методами
Измерение средней возбуждающей и тормозной проводимости одиночных клеток : Возбуждающая и тормозная синаптические проводимости отдельной клетки измерялись как при фиксации напряжения, так и при записи фиксатора тока, фокусируясь на in-vivo на основных механизмах избирательности признаков в сенсорной реакции корковых клеток и о роли ингибирования в формировании настроенного сенсорного ответа кортикальных нейронов млекопитающих [6,8,39]. Методы измерения проводимости также использовались для выявления лежащих в основе возбуждающей и тормозящей проводимости во время продолжающихся колебаний мембранного потенциала вверх и вниз, которые характеризуют активность медленноволнового сна [40,41]. Достоинства и недостатки этих методов рассмотрены в [29]. Общим для этих методов измерения проводимости является требование усреднить данные по нескольким повторам, инициированным стереотипным событием (например, время сенсорной стимуляции или фаза нарастания состояния Up), а затем усреднить испытания при различных удерживающих потенциалах.Затем усредненные данные аппроксимируются уравнением мембранного потенциала (предполагая, что реверсивные потенциалы известны), чтобы выявить проводимость возбуждения и ингибирования в каждый момент времени. Однако эти методы не могут выявить торможение и возбуждение одновременно в одной пробе, а только оценить усредненные отношения. Предлагаемый нами метод, с другой стороны, позволяет проводить одновременные измерения в течение одного испытания.
Методы измерения проводимости также использовались для выявления лежащих в основе возбуждающей и тормозящей проводимости во время продолжающихся колебаний мембранного потенциала вверх и вниз, которые характеризуют активность медленноволнового сна [40,41]. Достоинства и недостатки этих методов рассмотрены в [29]. Общим для этих методов измерения проводимости является требование усреднить данные по нескольким повторам, инициированным стереотипным событием (например, время сенсорной стимуляции или фаза нарастания состояния Up), а затем усреднить испытания при различных удерживающих потенциалах.Затем усредненные данные аппроксимируются уравнением мембранного потенциала (предполагая, что реверсивные потенциалы известны), чтобы выявить проводимость возбуждения и ингибирования в каждый момент времени. Однако эти методы не могут выявить торможение и возбуждение одновременно в одной пробе, а только оценить усредненные отношения. Предлагаемый нами метод, с другой стороны, позволяет проводить одновременные измерения в течение одного испытания. Важно отметить, что, поскольку нет необходимости деполяризовать или гиперполяризовать клетку, наш метод позволяет измерять синаптические проводимости при потенциале покоя клетки, потенциально получая измерения проводимости, зависящей от напряжения, по мере того, как они прогрессируют во время реакции напряжения на синаптические входы.Отметим, что наш метод разделяет основной подход к анализу точечных нейронов с использованием теории частотного анализа электрических цепей с методами измерения емкости [42,43].
Важно отметить, что, поскольку нет необходимости деполяризовать или гиперполяризовать клетку, наш метод позволяет измерять синаптические проводимости при потенциале покоя клетки, потенциально получая измерения проводимости, зависящей от напряжения, по мере того, как они прогрессируют во время реакции напряжения на синаптические входы.Отметим, что наш метод разделяет основной подход к анализу точечных нейронов с использованием теории частотного анализа электрических цепей с методами измерения емкости [42,43].
Альтернативный подход для оценки возбуждающей и тормозной проводимости отдельной клетки был продемонстрирован для ганглиозных клеток сетчатки [44]. В этом исследовании фиксированное напряжение чередовалось между реверсивным потенциалом возбуждения и торможения с частотой 50 Гц, а ток измерялся в конце каждого шага.Это исследование выявило сильный коррелированный шум в силе обоих типов синаптических входов. Однако, в отличие от метода, предложенного здесь, лежащие в основе проводимости не обнаруживаются одновременно и — из-за зажима — естественная динамика мембранного потенциала полностью недоступна, что не позволяет исследовать роль внутренней динамики, зависимой от напряжения, в генерации подпороговой активности нейронов.
Единичные пробные измерения g
e (t) и g i (t) при различных предположениях о синаптической динамике. Теоретические и экспериментальные подходы, основанные на динамике возбуждающей и тормозной проводимости в одном испытании, были ранее предложены. Соответственно, возбуждение и торможение выявляются по записям токовых клещей, в которые ток не подается. Были предложены подходы, основанные на байесовских методах, которые используют несколько зарегистрированных испытаний [25], а также была предложена оценка этих входных данных в одном испытании, но не было возможности отслеживать быстрые изменения этих проводимостей [24].Группа других вычислительных методов [26–28] показала, что возбуждающая и тормозная проводимости могут быть выявлены в одном испытании при анализе мембранного потенциала и его распределения. Общим для всех этих методов является требование наблюдать явные колебания мембранного потенциала. Однако наш метод позволяет выявить эти входы, даже если не наблюдается изменения мембранного потенциала из-за синаптического входа (за исключением реакции на введенный синусоидальный ток). Изменения проводимости часто ожидаются даже тогда, когда мембранный потенциал стабилен, например, когда клетка получает тонический вход (см. Ступенчатое изменение возбуждения и торможения на рисунках 3 и 4, от 3 до 4 секунд, что приводит к постоянному мембранному потенциалу. значение) и когда существует постоянный баланс возбуждающего и тормозного токов.
Изменения проводимости часто ожидаются даже тогда, когда мембранный потенциал стабилен, например, когда клетка получает тонический вход (см. Ступенчатое изменение возбуждения и торможения на рисунках 3 и 4, от 3 до 4 секунд, что приводит к постоянному мембранному потенциалу. значение) и когда существует постоянный баланс возбуждающего и тормозного токов.
Парные внутриклеточные записи.
Существенная синхронность синаптических входов между соседними кортикальными клетками [19,21,45,46] позволяет непрерывно контролировать как возбуждающую, так и тормозную активность в локальной сети во время текущей и вызванной активности. Аналогичный подход был также использован для изучения взаимосвязей между этими входами в зрительной коре головного мозга бодрствующих мышей [22], а также гамма-активностью в срезах [4]. Хотя парные записи очень эффективны при изучении взаимосвязей между этими входами в локальной сети, такие записи не предоставляют окончательной информации о входах отдельной ячейки.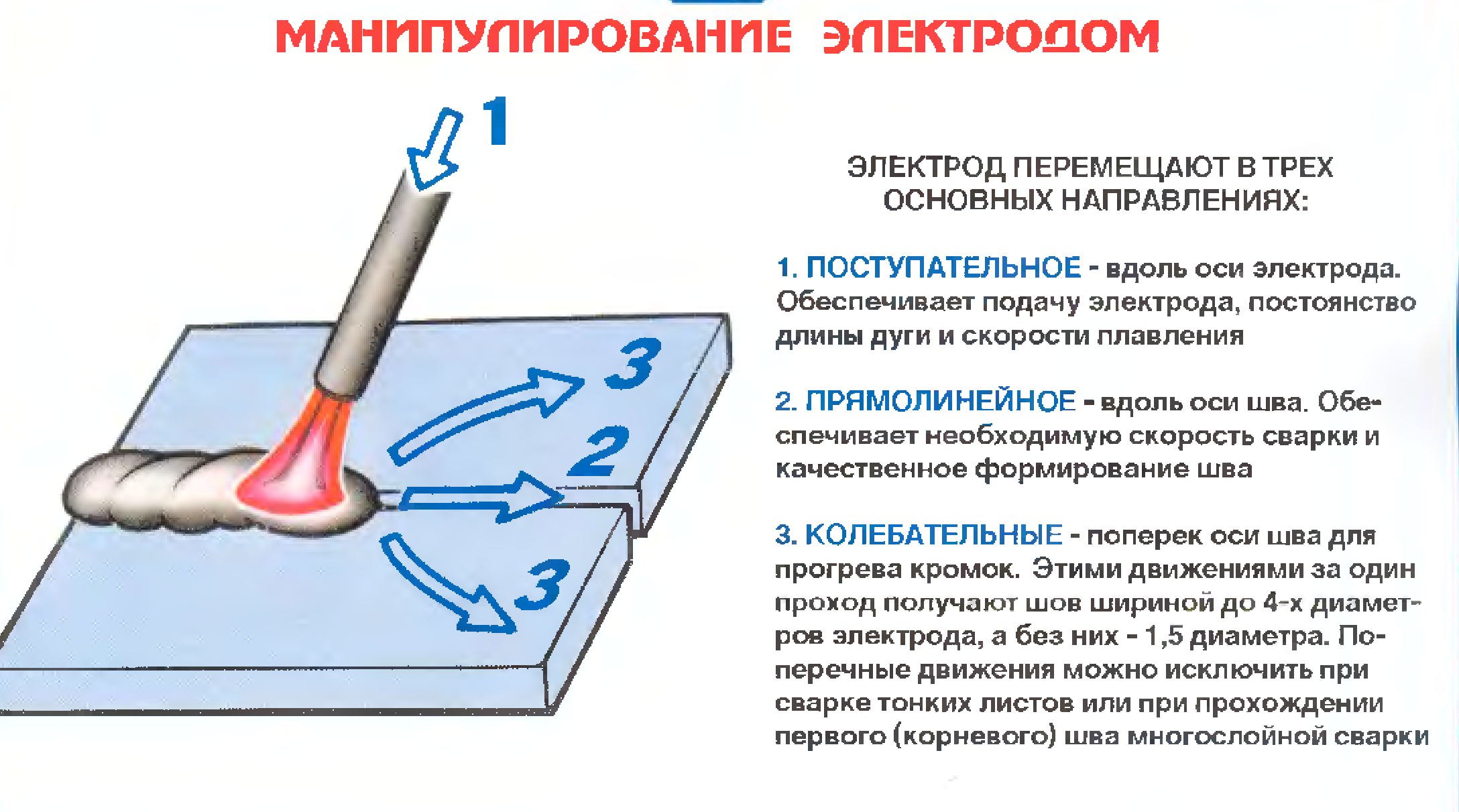 Более того, хотя мгновенная взаимосвязь между возбуждающими и тормозящими входами может быть выявлена с помощью этого парного подхода к записи, максимальная предполагаемая степень предполагаемой корреляции между возбуждением и торможением ограничена степенью корреляции между ячейками для каждого входа, которая может изменяться в зависимости от стимуляции. состояния или состояния мозга [47–49]. Например, уменьшение корреляции между возбуждением, измеренным в одной ячейке, и ингибированием, измеренным в другой ячейке, может действительно предполагать меньшую корреляцию между этими входами для каждой ячейки, но это также может быть результатом снижения синхронности между ячейками, без любое изменение степени корреляции между возбуждением и торможением каждой клетки.Эта оговорка о парных записях не позволяет нам обнаружить, например, если корковая активность смещается между сбалансированным и несбалансированным состояниями [50,51]. Одновременное измерение возбуждающей и тормозной проводимости отдельной клетки в разных состояниях позволит решить эти и другие вопросы.
Более того, хотя мгновенная взаимосвязь между возбуждающими и тормозящими входами может быть выявлена с помощью этого парного подхода к записи, максимальная предполагаемая степень предполагаемой корреляции между возбуждением и торможением ограничена степенью корреляции между ячейками для каждого входа, которая может изменяться в зависимости от стимуляции. состояния или состояния мозга [47–49]. Например, уменьшение корреляции между возбуждением, измеренным в одной ячейке, и ингибированием, измеренным в другой ячейке, может действительно предполагать меньшую корреляцию между этими входами для каждой ячейки, но это также может быть результатом снижения синхронности между ячейками, без любое изменение степени корреляции между возбуждением и торможением каждой клетки.Эта оговорка о парных записях не позволяет нам обнаружить, например, если корковая активность смещается между сбалансированным и несбалансированным состояниями [50,51]. Одновременное измерение возбуждающей и тормозной проводимости отдельной клетки в разных состояниях позволит решить эти и другие вопросы.
Ограничения
Теоретически, увеличение частоты синусоидальных форм вводимого тока в нашем методе улучшает временную точность при измерении синаптических проводимостей.Однако это происходит за счет чувствительности, которая уменьшается с увеличением частоты (уравнение 3 и рис. 2). В наших симуляциях мы ограничили частоту подаваемого тока примерно до 350 Гц. В этом диапазоне наши симуляции, отображающие реалистичные пассивные клеточные свойства и типичную сенсорную вызванную проводимость, приведут к четкой модуляции напряжения при подаче синусоидального тока ~ 1 нА. При полосовой фильтрации напряжения модуляция составляет всего лишь мВ, но все же превышает уровень шума оборудования.
Мы показываем, что изменения сопротивления доступа из-за неполного разрыва мембраны или других факторов, таких как механическая вибрация, вызывающая перемещение мембраны относительно пипетки, можно хорошо измерить и компенсировать (рис. 6). Следовательно, наш подход может быть реализован для оценки возбуждающих и тормозных входов клетки в этих реальных условиях.
Еще одним аспектом, который может снизить чувствительность нашего метода, является наличие паразитной емкости пипетки. Мы разработали модульный компонент для анализа, который можно использовать для корректировки некоторых из этих паразитных емкостей (рис. 8).Важно отметить, что для измерения этой паразитной емкости и компенсации ее влияния не требуется никаких дополнительных измерений, кроме введенных синусоидальных волн, выполненных за одну пробу. Тем не менее, когда паразитная емкость намного выше, чем было продемонстрировано здесь, этот подход не может обеспечить хорошую оценку синаптической проводимости. Следовательно, все равно потребуется особая осторожность, чтобы максимально снизить паразитную емкость.
Мы демонстрируем при моделировании морфологически реалистичных нейронов, что мы можем оценить проксимальные синаптические входы в одном испытании, используя наш подход.Хотя мы недооценили эти входные данные по сравнению с смоделированными экспериментами с фиксацией напряжения, их форма и взаимосвязь сохранялись в наших измерениях, если входные данные воздействовали на дендриты, не более чем на 400 мкм от сомы нашей реализации пирамидальной ячейки. Несмотря на то, что это ограничение следует учитывать в реальных записях, эти данные также предполагают, что метод обеспечит адекватную оценку ближайших входных сигналов.
Несмотря на то, что это ограничение следует учитывать в реальных записях, эти данные также предполагают, что метод обеспечит адекватную оценку ближайших входных сигналов.
Возможное применение метода измерения несинаптических собственных проводимостей
Наш метод также может использоваться, когда зависящие от напряжения проводимости развиваются естественным образом, поскольку мы можем измерять эти входные данные при потенциале покоя ячейки, пока синусоидальные колебания через мембрану из-за вводимого тока малы.Таким образом, такой подход можно использовать при выполнении фармакологических тестов, таких как тестирование эффектов модуляторов, агонистов и антагонистов различных ионных каналов. Благодаря возможности измерить эти входные данные в одном испытании, динамика эффектов может быть изучена в быстрых временных масштабах, одновременно исследуя влияние таких препаратов на оба входа.
Таким образом, наше теоретическое исследование показывает, что синаптическая и другие проводимости могут быть измерены с высоким временным разрешением в одном испытании, когда клетки регистрируются с их потенциалом покоя. Необходимы дополнительные исследования, чтобы выяснить, можно ли успешно использовать этот подход во время физиологических записей реальных нейронов.
Необходимы дополнительные исследования, чтобы выяснить, можно ли успешно использовать этот подход во время физиологических записей реальных нейронов.
Реализуемость техники в реальных записях
Ожидаемое отношение сигнал / шум, основанное на добавлении реалистичного шума (рис. 7), достаточно велико для измерения возбуждающего и тормозящего воздействия во время записи in vitro. Однако очевидно, что эту структуру необходимо протестировать на реальных записях нейронов. Мы полностью раскрываем, что мы пытались протестировать метод на реальных записях и обнаружили, что в большинстве наших записей, не показанных здесь, измерения были безуспешными.Проведя тесты на импульсную характеристику усилителя, мы обнаружили, что это является результатом активной цепи обратной связи в наших внутриклеточных усилителях. В настоящее время мы совершенствуем схему усилителя и параллельно разрабатываем алгоритмы, которые будут учитывать частотные характеристики этих усилителей.
% PDF-1. 6
%
143 0 объект
> / Метаданные 140 0 R / Страницы 132 0 R / StructTreeRoot 466 0 R / Тип / Каталог >>
эндобдж
140 0 объект
> поток
uuid: 2d474cf6-bedc-48ed-99cd-34c1c5ec80c4adobe: docid: indd: 4c6d5a75-144d-11e2-a268-e21a583052eeproof: pdf90dc5b53-144b-11ee2ee-a268dc5b53-144b-11ee2ee-a268db53-144b-11ee2ee-a268d2dbee2: indbee2e-a268d2d2e3d2e3d2e3d2d2e8d2e3d1e8e2e8d2e8d2e3db2e2d2e2db2e2e8d2e8d2e3 СсылкаStream300.00300.00Inchesuuid: 2BE753D4159A11DCA41F922B4DDDCBCDuuid: 2BE753D3159A11DCA41F922B4DDDCBCD
6
%
143 0 объект
> / Метаданные 140 0 R / Страницы 132 0 R / StructTreeRoot 466 0 R / Тип / Каталог >>
эндобдж
140 0 объект
> поток
uuid: 2d474cf6-bedc-48ed-99cd-34c1c5ec80c4adobe: docid: indd: 4c6d5a75-144d-11e2-a268-e21a583052eeproof: pdf90dc5b53-144b-11ee2ee-a268dc5b53-144b-11ee2ee-a268db53-144b-11ee2ee-a268d2dbee2: indbee2e-a268d2d2e3d2e3d2e3d2d2e8d2e3d1e8e2e8d2e8d2e3db2e2d2e2db2e2e8d2e8d2e3 СсылкаStream300.00300.00Inchesuuid: 2BE753D4159A11DCA41F922B4DDDCBCDuuid: 2BE753D3159A11DCA41F922B4DDDCBCD
 0072.00Inchesuuid: 8b3e64b2-4b2e-4fc2-9569-5e0529c4faf8uuid: D2202F1F13B111E2A209C0A81BD
0072.00Inchesuuid: 8b3e64b2-4b2e-4fc2-9569-5e0529c4faf8uuid: D2202F1F13B111E2A209C0A81BD 0 Ложь конечный поток
эндобдж
132 0 объект
>
эндобдж
466 0 объект
>
эндобдж
866 0 объект
>
эндобдж
867 0 объект
>
эндобдж
868 0 объект
> / Pa5 871 0 R / Pa6 872 0 R / Pa7 873 0 R / Pa9 874 0 R / A15 + 1> / A12 + 1> / Pa5 + 1> / A8 + 1> / A5 + 1> / A16 + 1 > / Pa9 + 1> / A10 875 0 R / A11 876 0 R / A12 877 0 R / A13 878 0 R / A14 879 0 R / A2 + 1> / A15 880 0 R / A16 881 0 R / A13 + 1 > / Pa6 + 1> / A10 + 1> / A9 + 1> / Pa0 + 1> / A2 882 0 R / A3 883 0 R / A5 884 0 R / A7 885 0 R / A8 886 0 R / A9 887 0 R / A3 + 1> / A14 + 1> / Pa7 + 1> / A11 + 1> / Pa1 + 1 >>>
эндобдж
869 0 объект
>
эндобдж
870 0 объект
>
эндобдж
871 0 объект
>
эндобдж
872 0 объект
>
эндобдж
873 0 объект
>
эндобдж
874 0 объект
>
эндобдж
875 0 объект
>
эндобдж
876 0 объект
>
эндобдж
877 0 объект
>
эндобдж
878 0 объект
>
эндобдж
879 0 объект
>
эндобдж
880 0 объект
>
эндобдж
881 0 объект
>
эндобдж
882 0 объект
>
эндобдж
883 0 объект
>
эндобдж
884 0 объект
>
эндобдж
885 0 объект
>
эндобдж
886 0 объект
>
эндобдж
887 0 объект
>
эндобдж
1443 0 объект
>
эндобдж
1447 0 объект
>
эндобдж
1448 0 объект
>
эндобдж
1449 0 объект
>
эндобдж
1451 0 объект
>
эндобдж
1452 0 объект
>
эндобдж
1453 0 объект
>
эндобдж
1455 0 объект
>
эндобдж
1456 0 объект
>
эндобдж
1457 0 объект
>
эндобдж
1459 0 объект
>
эндобдж
1460 0 объект
>
эндобдж
1461 0 объект
>
эндобдж
1463 0 объект
>
эндобдж
1464 0 объект
>
эндобдж
1465 0 объект
>
эндобдж
1467 0 объект
>
эндобдж
1468 0 объект
>
эндобдж
1469 0 объект
>
эндобдж
1471 0 объект
>
эндобдж
1472 0 объект
>
эндобдж
1473 0 объект
>
эндобдж
1475 0 объект
>
эндобдж
1476 0 объект
>
эндобдж
1477 0 объект
>
эндобдж
1479 0 объект
>
эндобдж
1480 0 объект
>
эндобдж
1481 0 объект
>
эндобдж
1483 0 объект
>
эндобдж
1484 0 объект
>
эндобдж
1485 0 объект
>
эндобдж
1487 0 объект
>
эндобдж
1488 0 объект
>
эндобдж
1489 0 объект
>
эндобдж
1491 0 объект
>
эндобдж
1492 0 объект
>
эндобдж
1493 0 объект
>
эндобдж
1495 0 объект
>
эндобдж
1496 0 объект
>
эндобдж
1497 0 объект
>
эндобдж
1499 0 объект
>
эндобдж
1500 0 объект
>
эндобдж
1501 0 объект
>
эндобдж
1503 0 объект
>
эндобдж
1504 0 объект
>
эндобдж
1505 0 объект
>
эндобдж
1507 0 объект
>
эндобдж
1508 0 объект
>
эндобдж
1509 0 объект
>
эндобдж
1511 0 объект
>
эндобдж
1512 0 объект
>
эндобдж
1513 0 объект
>
эндобдж
1515 0 объект
>
эндобдж
1516 0 объект
>
эндобдж
1517 0 объект
>
эндобдж
1519 0 объект
>
эндобдж
1520 0 объект
>
эндобдж
1521 0 объект
>
эндобдж
1523 0 объект
>
эндобдж
1524 0 объект
>
эндобдж
1525 0 объект
>
эндобдж
1527 0 объект
>
эндобдж
1528 0 объект
>
эндобдж
1529 0 объект
>
эндобдж
1531 0 объект
>
эндобдж
1532 0 объект
>
эндобдж
1533 0 объект
>
эндобдж
1335 0 объект
>
эндобдж
1334 0 объект
>
эндобдж
1342 0 объект
>
эндобдж
1344 0 объект
>
эндобдж
1345 0 объект.
0 Ложь конечный поток
эндобдж
132 0 объект
>
эндобдж
466 0 объект
>
эндобдж
866 0 объект
>
эндобдж
867 0 объект
>
эндобдж
868 0 объект
> / Pa5 871 0 R / Pa6 872 0 R / Pa7 873 0 R / Pa9 874 0 R / A15 + 1> / A12 + 1> / Pa5 + 1> / A8 + 1> / A5 + 1> / A16 + 1 > / Pa9 + 1> / A10 875 0 R / A11 876 0 R / A12 877 0 R / A13 878 0 R / A14 879 0 R / A2 + 1> / A15 880 0 R / A16 881 0 R / A13 + 1 > / Pa6 + 1> / A10 + 1> / A9 + 1> / Pa0 + 1> / A2 882 0 R / A3 883 0 R / A5 884 0 R / A7 885 0 R / A8 886 0 R / A9 887 0 R / A3 + 1> / A14 + 1> / Pa7 + 1> / A11 + 1> / Pa1 + 1 >>>
эндобдж
869 0 объект
>
эндобдж
870 0 объект
>
эндобдж
871 0 объект
>
эндобдж
872 0 объект
>
эндобдж
873 0 объект
>
эндобдж
874 0 объект
>
эндобдж
875 0 объект
>
эндобдж
876 0 объект
>
эндобдж
877 0 объект
>
эндобдж
878 0 объект
>
эндобдж
879 0 объект
>
эндобдж
880 0 объект
>
эндобдж
881 0 объект
>
эндобдж
882 0 объект
>
эндобдж
883 0 объект
>
эндобдж
884 0 объект
>
эндобдж
885 0 объект
>
эндобдж
886 0 объект
>
эндобдж
887 0 объект
>
эндобдж
1443 0 объект
>
эндобдж
1447 0 объект
>
эндобдж
1448 0 объект
>
эндобдж
1449 0 объект
>
эндобдж
1451 0 объект
>
эндобдж
1452 0 объект
>
эндобдж
1453 0 объект
>
эндобдж
1455 0 объект
>
эндобдж
1456 0 объект
>
эндобдж
1457 0 объект
>
эндобдж
1459 0 объект
>
эндобдж
1460 0 объект
>
эндобдж
1461 0 объект
>
эндобдж
1463 0 объект
>
эндобдж
1464 0 объект
>
эндобдж
1465 0 объект
>
эндобдж
1467 0 объект
>
эндобдж
1468 0 объект
>
эндобдж
1469 0 объект
>
эндобдж
1471 0 объект
>
эндобдж
1472 0 объект
>
эндобдж
1473 0 объект
>
эндобдж
1475 0 объект
>
эндобдж
1476 0 объект
>
эндобдж
1477 0 объект
>
эндобдж
1479 0 объект
>
эндобдж
1480 0 объект
>
эндобдж
1481 0 объект
>
эндобдж
1483 0 объект
>
эндобдж
1484 0 объект
>
эндобдж
1485 0 объект
>
эндобдж
1487 0 объект
>
эндобдж
1488 0 объект
>
эндобдж
1489 0 объект
>
эндобдж
1491 0 объект
>
эндобдж
1492 0 объект
>
эндобдж
1493 0 объект
>
эндобдж
1495 0 объект
>
эндобдж
1496 0 объект
>
эндобдж
1497 0 объект
>
эндобдж
1499 0 объект
>
эндобдж
1500 0 объект
>
эндобдж
1501 0 объект
>
эндобдж
1503 0 объект
>
эндобдж
1504 0 объект
>
эндобдж
1505 0 объект
>
эндобдж
1507 0 объект
>
эндобдж
1508 0 объект
>
эндобдж
1509 0 объект
>
эндобдж
1511 0 объект
>
эндобдж
1512 0 объект
>
эндобдж
1513 0 объект
>
эндобдж
1515 0 объект
>
эндобдж
1516 0 объект
>
эндобдж
1517 0 объект
>
эндобдж
1519 0 объект
>
эндобдж
1520 0 объект
>
эндобдж
1521 0 объект
>
эндобдж
1523 0 объект
>
эндобдж
1524 0 объект
>
эндобдж
1525 0 объект
>
эндобдж
1527 0 объект
>
эндобдж
1528 0 объект
>
эндобдж
1529 0 объект
>
эндобдж
1531 0 объект
>
эндобдж
1532 0 объект
>
эндобдж
1533 0 объект
>
эндобдж
1335 0 объект
>
эндобдж
1334 0 объект
>
эндобдж
1342 0 объект
>
эндобдж
1344 0 объект
>
эндобдж
1345 0 объект.



 Подбирается в зависимости от толщины свариваемой конструкции. Самые тонкие стержни имеют диаметр 1,6 мм. Они предназначаются для соединения листов не толще 2 мм, тогда как стержни диаметром 5-6 мм позволяют сваривать листы толщиной до 13 мм.
Подбирается в зависимости от толщины свариваемой конструкции. Самые тонкие стержни имеют диаметр 1,6 мм. Они предназначаются для соединения листов не толще 2 мм, тогда как стержни диаметром 5-6 мм позволяют сваривать листы толщиной до 13 мм.
 ОЗЖН-1, ОЗЧ-3 и ОЗЧ-4 содержат до 90 % никеля.
ОЗЖН-1, ОЗЧ-3 и ОЗЧ-4 содержат до 90 % никеля. Внутриклеточные записи были получены от дистальных апикальных дендритов и сомат, и для вызова сАГП использовались импульсы надпорогового деполяризующего тока.SAHP блокировался низкими концентрациями карбахолина (Cch), но нечувствителен к высоким концентрациям апамина.
Внутриклеточные записи были получены от дистальных апикальных дендритов и сомат, и для вызова сАГП использовались импульсы надпорогового деполяризующего тока.SAHP блокировался низкими концентрациями карбахолина (Cch), но нечувствителен к высоким концентрациям апамина.
