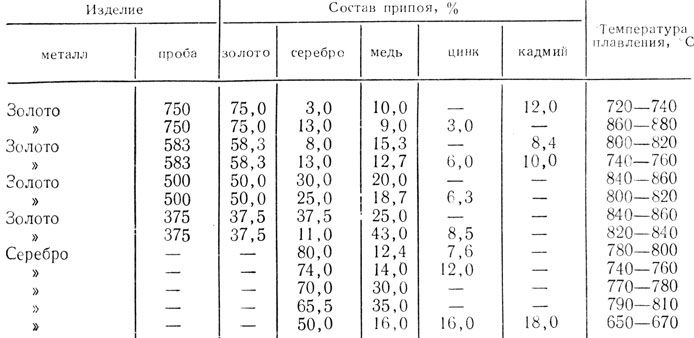
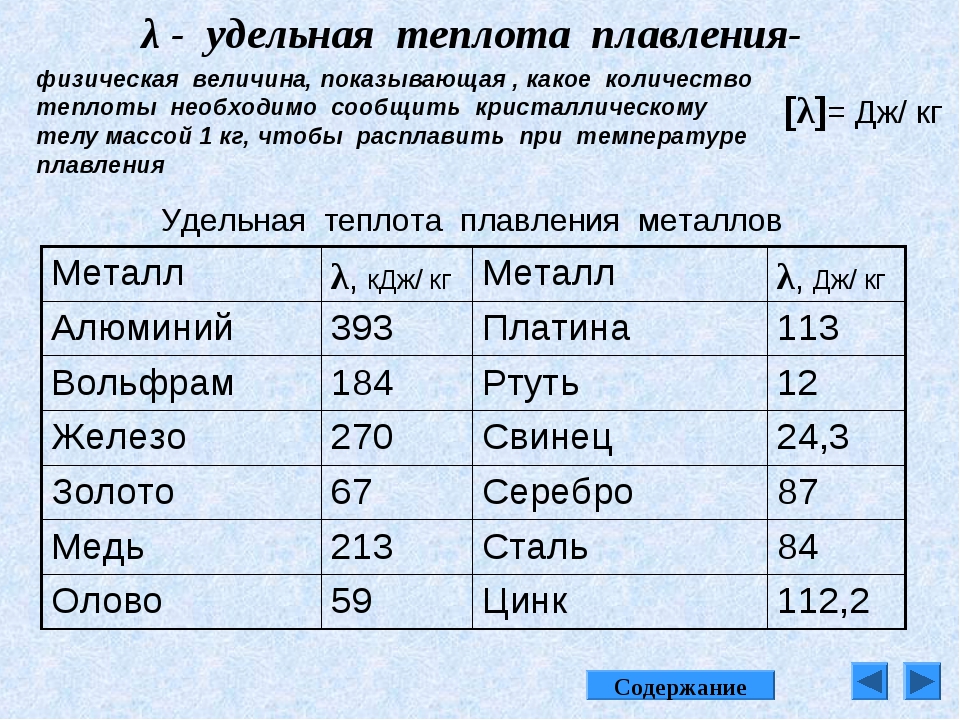
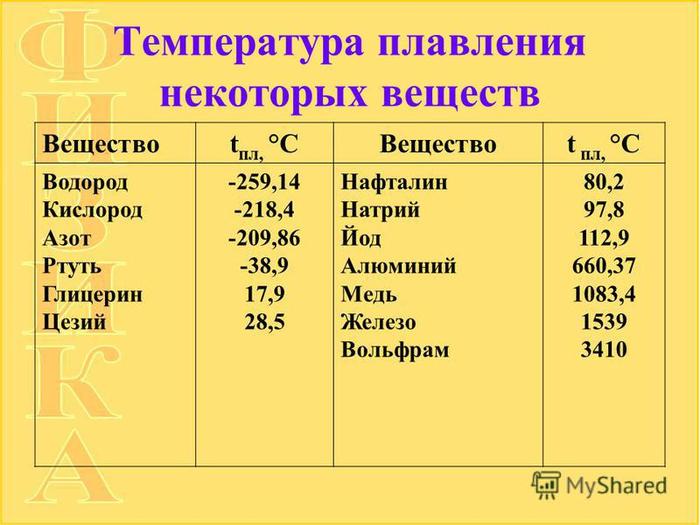
Температура плавления меди – при какой температуре плавится медь
Благодаря тому, что температура плавления меди достаточно невысокая, этот металл стал одним из первых, которые древние люди начали использовать для изготовления различных инструментов, посуды, украшений и оружия. Самородки меди или медную руду можно было расплавить на костре, что, собственно, и делали наши далекие предки.
Этап плавления меди
Несмотря на активное применение человечеством с древних времен, медь не является самым распространенным природным металлом. В этом отношении она значительно уступает остальным элементам и занимает в их ряду только 23-е место.
Как плавили медь наши предки
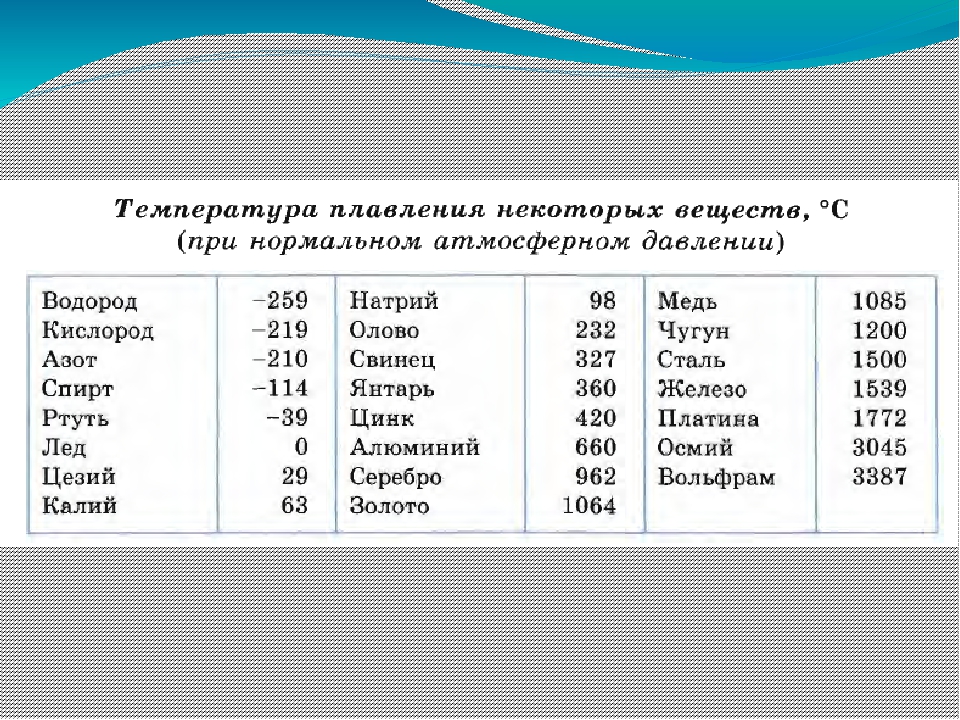
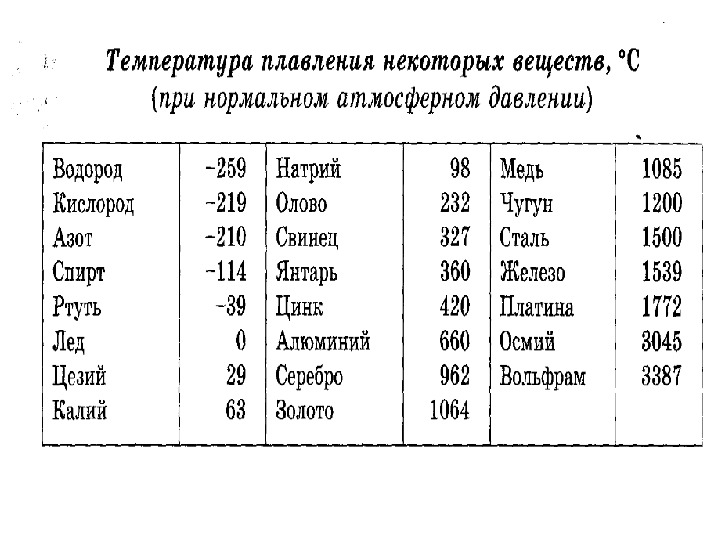
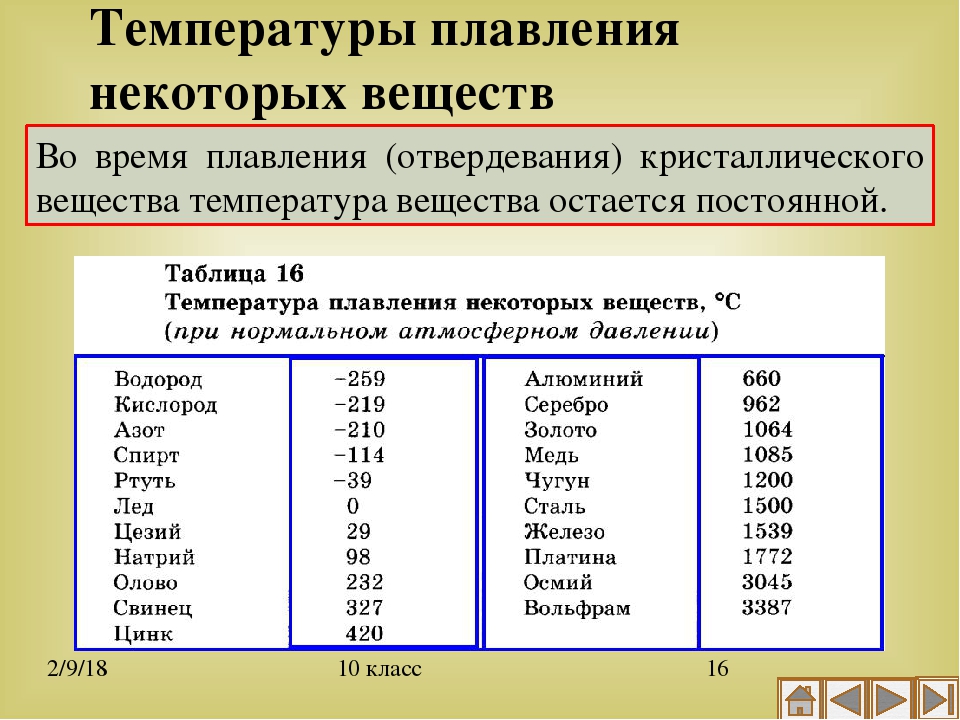
Благодаря невысокой температуре плавления меди, составляющей 1083 градуса Цельсия, наши далекие предки не только успешно получали из руды чистый металл, но и изготавливали различные сплавы на его основе. Чтобы получить такие сплавы, медь нагревали и доводили до жидкого расплавленного состояния.
Какие процессы происходят при плавлении меди
Что характерно, температуры плавления меди и сплавов, полученных на ее основе, отличаются. При добавлении в медь олова, имеющего меньшую температуру плавления, получают бронзу с температурой плавления 930–1140 градусов Цельсия. А сплав меди с цинком (латунь) плавится при 900–10500 Цельсия.
Во всех металлах в процессе плавления происходят одинаковые процессы. При получении достаточного количества теплоты при нагревании кристаллическая решетка металла начинает разрушаться. В тот момент, когда он переходит в расплавленное состояние, его температура не повышается, хотя процесс передачи ему теплоты при помощи нагрева не прекращается.
Диаграмма состояния системы хром-медь
При охлаждении происходит противоположный процесс: сначала температура резко снижается, затем на некоторое время останавливается на постоянной отметке. После того, как весь металл перейдет в твердую фазу, температура снова начинает снижаться до полного его остывания.
Как плавление, так и обратная кристаллизация меди, связаны с параметром удельной теплоты. Данный параметр характеризует удельное количество теплоты, которая требуется для того, чтобы перевести металл из твердого состояния в жидкое. При кристаллизации металла такой параметр характеризует количество теплоты, которое он отдает при остывании.
Более подробно узнать о плавлении меди помогает фазовая диаграмма, показывающая зависимость состояния металла от температуры. Такие диаграммы, которые можно составить для любых металлов, помогают изучать их свойства, определять температуры, при которых они кардинально меняют свои свойства и текущее состояние.
Кроме температуры плавления, у меди есть и температура кипения, при которой расплавленный металл начинает выделять пузырьки, наполненные газом. На самом деле никакого кипения меди не происходит, просто этот процесс внешне очень его напоминает. Довести до такого состояния ее можно, если нагреть до температуры 2560 градусов.
Как понятно из всего вышесказанного, именно невысокую температуру плавления меди можно назвать одной из основных причин того, что сегодня мы можем использовать этот металл, обладающий многими уникальными характеристиками.
Оценка статьи:
Загрузка…Поделиться с друзьями:
Страница не найдена |
Страница не найдена | 404. Страница не найдена
Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
202122232425262728293031
15161718192021
22232425262728
2930
Архивы
Метки
Настройки
для слабовидящих
Железо и его соединения
Учитель химии Уразгельдиева Айымгул Мадиевна
ОСШ имени Жангирхана, Бокейординского района, ЗКО
Урок химии на тему «Железо и его соединения».
Дата: 03 март 2017 год Класс: 10 В класс
Образовательная цель: обеспечить усвоение знаний о важнейших соединениях железа +2 и +3, качественных реакциях на ионы железа +2 и +3, биологической роли железа, используя опорные знания о строении железа, демонстрацию занимательных опытов, лабораторную работу, сообщения учащихся, мультимедийное приложение.
Задачи:
Продолжить формировать умения составлять схемы строения атома, электронную формулу, графическую формулу; на основе этого определять степени окисления, окислитель, восстановитель.
Систематизировать знания о характере оксидов и гидроксидов со степенями окисления +2 и +3 на примере оксидов и гидроксидов железа +2 и +3.
Формировать умения сравнивать свойства важнейших соединений железа(II) и железа(III), научиться определять с помощью качественных реакций соединения, содержащие ионы Fe2+, Fe3+
Совершенствовать умения школьников из предложенных формул составлять генетические ряды, осуществлять цепочки превращений, составлять уравнения химических реакций.

Совершенствовать навыки работы с реактивами при выполнении опытов, соблюдать правила по ТБ.
Раскрыть значение железа в природе и жизни человека.
Развивающая цель:
мыслительных способностей: умения пользоваться опорными знаниями, умения сравнивать, обобщать, делать выводы, объяснять ход эксперимента;
навыков самостоятельности при работе с учебником, инструктивной картой и реактивами;
исследовательских навыков при исследовании свойств соединений железа(II) и железа (III) и проведении качественных реакций;
способности к рефлексии, коммуникативные умения.
Воспитывающая цель:
положительной мотивации обучения, используя привлечение учащихся к подготовке занимательных опытов, сообщений о роли железа, лабораторной работы, мультимедийного сопровождения;
чувство ответственности при подготовке сообщений, выполнения домашнего задания;
правильной самооценки.

Тип урока: Комбинированный. Сообщение новых знаний и их совершенствование.
Вид урока: Лабораторный.
Оборудование: Периодическая система химических элементов Д. И. Менделеева, таблица растворимости веществ, таблица “Генетические ряды неорганических веществ”, инструктивные карты к лабораторной работе, тесты, презентация “Соединения железа”, Коллекция минералов: красный железняк, бурый железняк, магнитный железняк, железный колчедан.
Реактивы:
На столах учащихся:
растворы: FeCI2, FeCI3, KSCN, желтая кровяная соль K4[Fe(CN)6], красная кровяная соль K3[Fe(CN)6], NaOH, соли: FeSO4•7H2O, FeCI3, Fe2(SO4)3•9H2O
Для занимательного опыта: скальпель, вата, пинцет, растворы: FeCI3 растворы: FeCI 3, KSCN, желтая кровяная соль K4[Fe(CN)6], красная кровяная соль K3[Fe(CN)6], нашатырный спирт.
Проверка домашнего задания. Важнейшие d— элементы. Медь. Цинк. Хром.
Учащиеся делятся на три группы А, В, С, которые заранее получают задания по соответствующим темам для подготовки рассказов, сообщений, стихотворений, геологических карт, дополнительного материала по данной теме.
Оформление доски.
Доска разделена на три части в соответствии с маршрутами:
А — медь; В — цинк; С — хром. Указаны этапы маршрутов с заданиями, проверка которых осуществляется у доски. Также используем презентацию, в которой указаны все этапы маршрутов с заданиями.
Этап I. Собери рюкзак, с геологическим молотком за открытиями
Предварительно учитель рассказывает немного о положении металлов в периодической системе химических элементов.
Далее учитель предлагает учащимся устно рассказать о положении меди, цинка, хрома в периодической системе химических элементов.
Пример ответа группы А – медь: Медь — элемент побочной подгруппы I группы. Относится к d — элементам. На последнем энергетическом уровне атома находится 1 e. Радиус у атома меди меньше радиуса атомов металлов главной подгруппы. Это малоактивный металл. С кислородом образует оксид меди (II), в котором проявляет степень окисления +2, и оксид меди (I), в котором проявляет степень окисления +1. Оксиды и гидроксиды меди носят основной характер.
+ 29Cu 1S2/2S22p6/3S2 3p63d10/4S1 т.к. в атомах меди десятый d — электрон поместился на третий d-подуровень в результате “провала” с четвертого s-подуровня, то этот электрон подвижный. Поэтому медь в соединениях проявляет степени окисления +1 (например, Сu2О) и +2 (например, СuО).
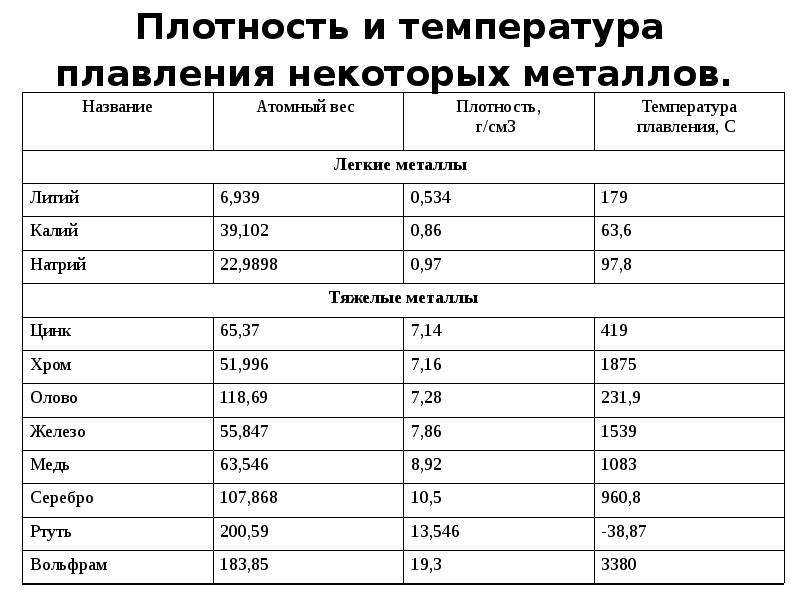
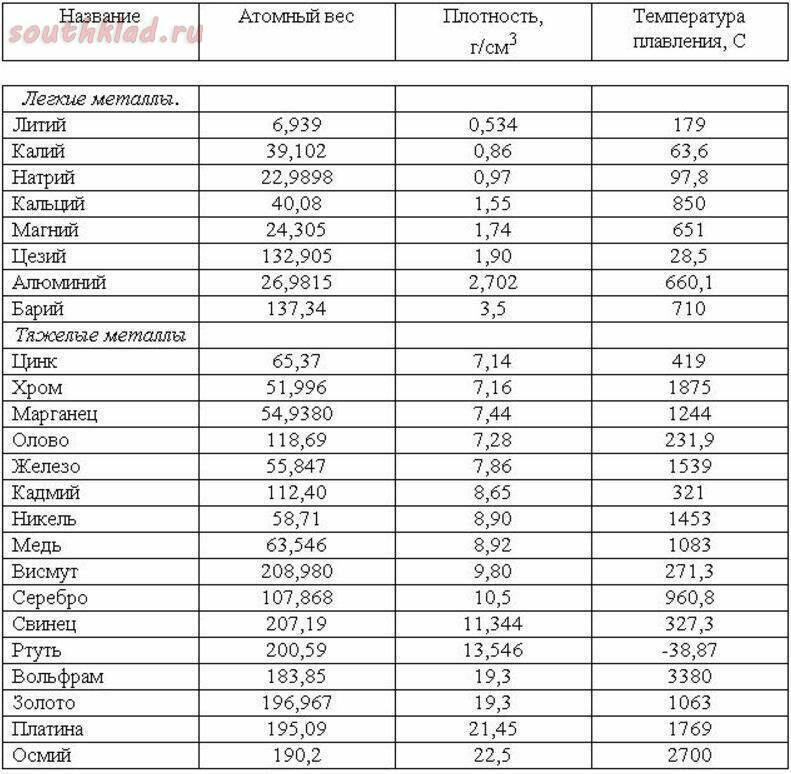
Медь – блестящий металл светло-розового цвета, тягучий, вязкий , легко прокатывается. Т.плавления 1083°С, Плотность 8,9 г/см3 . Отличный проводник электрического тока (уступает только серебру).
Т.плавления 1083°С, Плотность 8,9 г/см3 . Отличный проводник электрического тока (уступает только серебру).
Пример ответа группы В – цинк: Цинк – элемент побочной группы ІІ группы. Относится к d — элементам. В атоме цинка последний d –подуровень полностью завершен и энергетически устойчив, поэтому цинк в химических реакциях может отдавать только два s-электрона с последнего уровня, проявляя степень окисления +2.
+ 30Zn 1S2/2S22p6/3S2 3p63d10/4S2
Физические свойства. Голубовато-серебристый металл. Т. плавл. 419,5°; т. кип. 906,2°; плотн. 7,14; давл. паров 0,0013 мм рт. ст. (300). Растворяется в кислотах и щелочах. Нижний предел взрывоопасной концентрации цинковой пыли в воздухе .
Пример ответа группы В – хром: Хром – это белый с голубоватым отливом блестящий металл, очень твердый (плотность 7, 2 г/см3), температура плавления 1890
Хром при обычных условиях неактивный металл. Это объясняется тем, что его поверхность покрыта оксидной пленкой (Сr2О3). При нагревании оксидная пленка разрушается, и хром реагирует с простыми веществами при высокой температуре
хром…3s23p63d54s1
+2,+3,+6
Говорит учитель: “Итак, мы выполнили с вами поставленную задачу — т. е. рассмотрели положение металлов в периодической системе химических элементов, таким образом, рюкзак нами собран”
Этап II.
Вызываем к доске представителей от каждой группы, которые берут конверты с тестовыми заданиями, которые соответствуют названию каждой группы. Число тестовых заданий в конверте соответствует числу учащихся в каждой группе.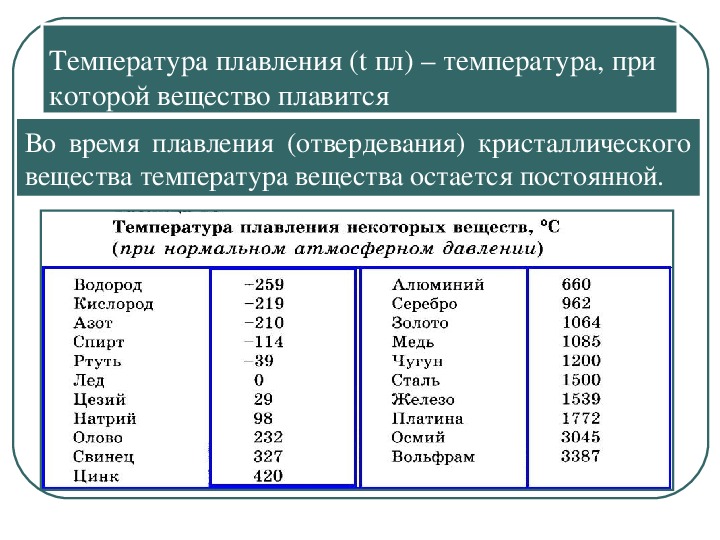
Представители, получившие конверты, раздают тестовые задания всем членам своей группы, которые по мере готовности отвечают на вопросы, остальные учащиеся проверяют правильность ответа.
Примерные тестовые задания, находящиеся в конвертах для группы А – медь:
1. Какие физические свойства характеризуют медь:
А) Металл светло-розового цвета, тягучий, вязкий, легко прокатывается в листы. (+)
Б) Серебристо-белый металл. В) Металл голубовато-серебристого цвета.
2. Выберите свойства, которые характерны для меди:
А) Отличный проводник электрического тока (уступает только серебру). (+)
Б) При температуре 100-150С хорошо прокатывается в листы. Выше 200С становится очень хрупким.
В) Сравнительно легкий, немного тяжелее алюминия, но в три раза прочнее его.
3. Какова температура плавления меди?
А) Температура плавления 1890С. Б) Температура плавления 1083С. (+)
(+)
В) Тугоплавкий металл, температура плавления1665°С, в обычных условиях отличается высокой прочностью и вязкостью.
4. С каким из перечисленных веществ будет реагировать медь?
А) H2S04 конц. (+) Б) Cl2 (+) В) NaOH Г) H2O Д) O2 (+) Е) HNO3 конц. (+)
5. Какими двумя веществами, из перечисленных, вы воспользовались бы для получения меди?
А) O2 (+) Г) HNO3 Б) Fe Д) Сu2S (+) В) Al Е) SO2
6. Каким соединением меди определяют альдегидную группу в органических соединениях?
А) СuCl2 Б) СuO В) Сu(OH)2 (+)
Примерные тестовые задания, находящиеся в конвертах для группы В – цинк:
1. Какие физические свойства характеризуют цинк?
Какие физические свойства характеризуют цинк?
А) Металл голубовато-серебристого цвета.
Б) Металл серебристо-белого цвета с металлическим блеском по внешнему виду похожий на сталь.
В) Металл светло-розового цвета, тягучий, вязкий, легко прокатывается в листы.
2. Выберите свойства, которые характерны для цинка:
А) Отличный проводник электрического тока (уступает только серебру).
Б) При температуре 100-150°С хорошо прокатывается в листы. Выше 200°С становится очень хрупким.
В) Сравнительно легкий, немного тяжелее алюминия, но в три раза прочнее его.
3. Какова температура плавления цинка?
А) Температура плавления 1890С. Б) Температура плавления 419,5С.
В) Тугоплавкий металл, температура 1665С, в обычных условиях отличается высокой прочностью и вязкостью.
4.С какими из перечисленных веществ будет реагировать цинк?
А) NаOH Б) О2 В) S Г) H2O Д) CuСl2 Е) NаOH+H20
5. Какими двумя веществами вы воспользовались бы для получения цинка?
Какими двумя веществами вы воспользовались бы для получения цинка?
А) H2SO4 Б) MgO В) С Г) NaOH Д) O2 Е) H2S
6. Какие соединения цинка обладают амфотерными свойствами?
А) ZnO Б) Na2ZnO2 В) Zn(OH)2
Примерные тестовые задания, находящиеся в конвертах для группы В – цинк:
1. Какие физические свойства характеризуют хром?
А) Металл светло-розового цвета, тягучий, вязкий, легко прокатывается в листы.
Б) Металл серебристо-белого цвета с металлическим блеском по внешнему виду похожий на сталь.
В) Металл голубовато-серебристого цвета.
2. Выберите свойства, которые характерны для хрома:
А) Отличный проводник электрического тока (уступает только серебру).
Б) При температуре 100-150°С хорошо прокатывается в листы. Выше 200°С становится очень хрупким.
В) При комнатной температуре стоек и к воде и к воздуху. Разбавленная серная и соляная кислота растворяют металл с выделением водорода.
3. Какова температура плавления хрома?
А) Температура плавления 1890°С. Б) Температура плавления 1083°С.
В) Плавится при температуре 419,5°С.
4.С какими из перечисленных веществ будет реагировать хром?
А) N2 Б) H2SO4 В) HNO3 Г) Сl2 Д) NaOH Е) HСl
5. Какими двумя веществами из перечисленных вы воспользовались бы для получения хрома?
А) O2 Б) H2SO4 В) Al Г) С Д) NО2 Е) NaOH
6. Какие соединения хрома обладают амфотерными свойствами?
А) Сr O3 Б) Cr2O3 В) H2CrO4 Г) Cr(OH)3 Д) СrO E) Сг(OH)2
И так мы повторили домашнее задание, теперь хочу загадать вам загадку.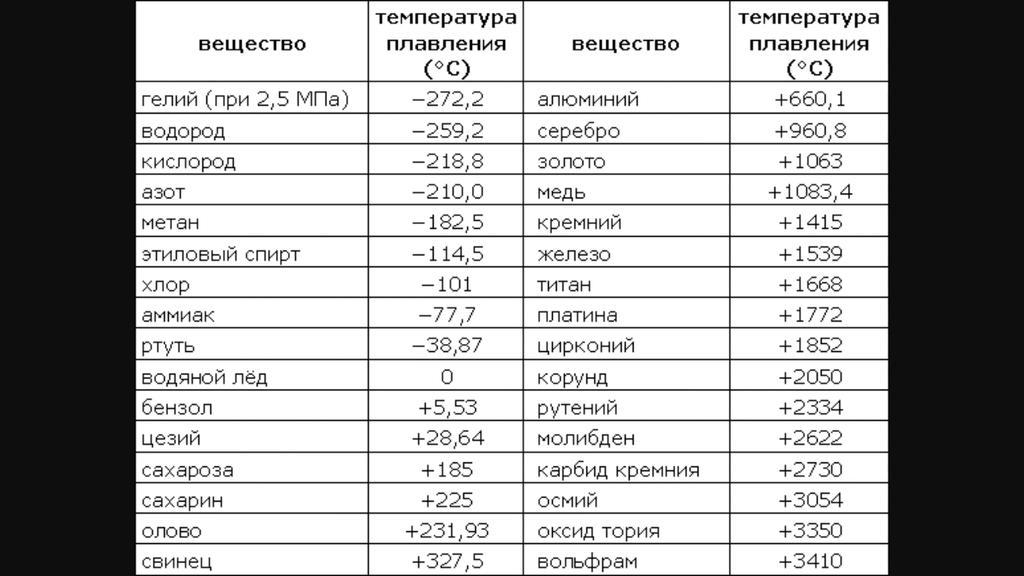 Давайте послушаем.
Давайте послушаем.
Ход урока
1. Организационный момент.
Среди металлов самый славный
Важнейший древний элемент.
В тяжелой индустрии – главный
Знаком с ним школьник и студент.
Родился в огненной стихии
А сплав его течет рекой.
Важнее нет в металлургии
Он нужен всей стране родной.
О каком металле идет речь?
(Это железо.)
Учитель: Сегодня на уроке мы продолжим изучение металла 8 группы, побочной подгруппы Fe и рассмотрим его соединения.
2. Проверка знаний (индивидуальный опрос).
Цель: повторение изученного материала, необходимого для открытия “нового знания” и выявления затруднений в работе учащихся.
1-й ученик. Написать на доске схему строения атома железа, электронную и графическую формулы. Какие степени окисления может проявлять железо? Окислитель или восстановитель?
Проверка: (Презентация. Слайд 8)
2-й ученик.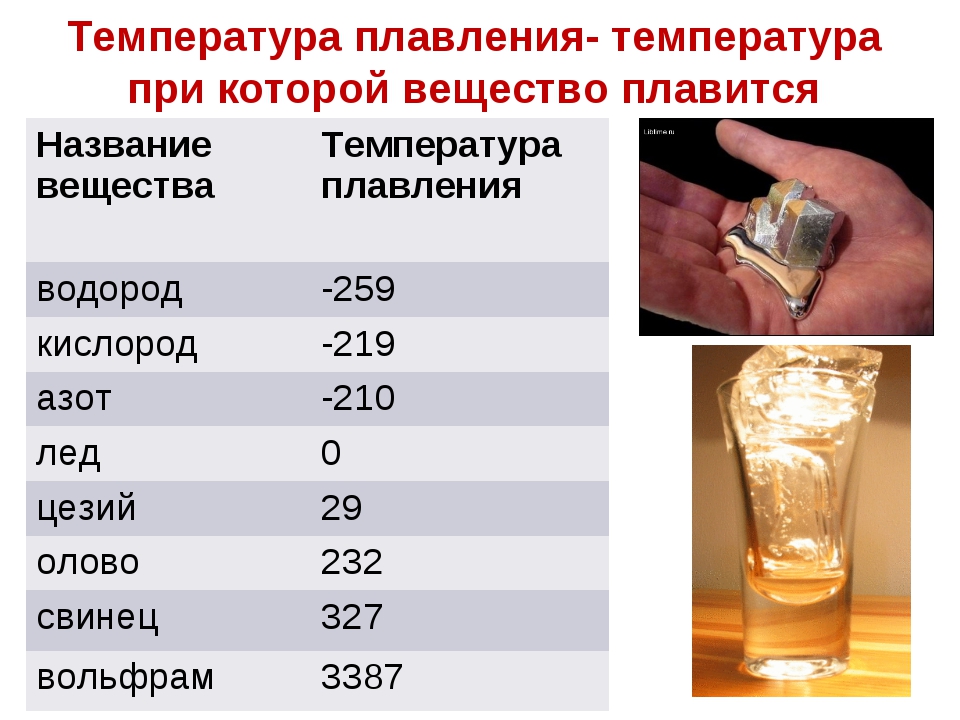 Написать на доске уравнения реакций взаимодействия железа с простыми веществами: хлором, серой, кислородом. Расставить степени окисления, уравнять методом электронного баланса. Проверка (Слайд 18-19)
Написать на доске уравнения реакций взаимодействия железа с простыми веществами: хлором, серой, кислородом. Расставить степени окисления, уравнять методом электронного баланса. Проверка (Слайд 18-19)
3-й ученик. Написать уравнения реакций взаимодействия железа со сложными веществами: с растворами кислот, солей, водой при нагревании. Для одной из реакций ионного обмена написать полное и сокращенное ионное уравнение. (Слайд 20-21)
Fe + H₂SO₄ → FeSO₄ + H₂
4-й ученик. Рассказать о распространенности железа в земной коре. Среди предложенных образцов выбрать важнейшие руды железа и назвать их.
Учитель: Железо дает два ряда соединений, соответствующих степени окисления +2, +3. Степень окисления Fe зависит от окислительной способности реагирующего вещества. У сильных окислителей железо принимает степень окисления +3, у более слабых +2.
Ученики записывают схему в тетрадь. (Слайд 22)
4. Актуализация знаний
Цель: на основе имеющихся знаний о металлах подготовить учащихся к восприятию новых знаний о соединениях железа.
5. Формирование знаний о получении гидроксидов железа и качественных реакциях на ионы Fe2+, Fe3+.
Учитель: Как можно получить гидроксиды железа в лаборатории?
Предполагаемый ответ: нерастворимые основания можно получить при взаимодействии раствора соответствующей соли со щелочью.
Лабораторный опыт 1. Получение гидроксида железа(II) и гидроксида железа(III) (Приложение 1)
(Выполняют по инструкции в парах.)
Получить гидроксиды железа в лаборатории можно взаимодействием солей железа со щелочью.
а) Налейте в пробирку 1 мл раствора хлорид железа(II). Добавьте к нему по каплям раствор гидроксида натрия до появления явных признаков химической реакции. Отметьте цвет образовавшегося осадка. Записать уравнения реакций.
Отметьте цвет образовавшегося осадка. Записать уравнения реакций.
б) К хлориду железа(III) прилейте по каплям раствор гидроксида натрия до появления явных признаков химической реакции. Отметьте цвет образовавшегося осадка.
Что наблюдаете? Записать уравнения реакции.
Слайд 6 – уравнение реакций (самопроверка)
Вывод: Это один из способов распознавания соединений железа с различной степенью окисления, качественные реакции на ионы Fe2+ Fe3+.Fe(OH)2 окисляется на воздухе: сначала зеленеет, потом приобретает бурую окраску.
(Демонстрация разрезанного яблока и пробирки с Fe(OH)2, на стенках которой видно как осадок становится бурого цвета.)
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 (Слайд 8)
Лабораторный опыт 2. (Приложение 1) Качественная реакция на ион Fe3+
1. Реактив – роданид калия KSCN.
Реактив – роданид калия KSCN.
К раствору хлорида железа(III) добавить одну каплю раствора роданида калия (KSCN). Перемешайте содержимое пробирки и рассмотрите на свету. Отметьте цвет.
Результат воздействия – интенсивно красный цвет
FeCl3 + 3KSCN = Fe (SCN)3 + 3KCl.
2. Реактив – желтая кровяная соль K4 [Fe(CN)6]
г) К раствору хлорида железа(III) Во 2-ю пробирку добавьте 1–2 капли раствора гексацианоферрата(II) калия K4[Fe(CN)6] (желтой кровяной соли). Перемешайте содержимое пробирки, отметьте цвет.
Результат воздействия – синий осадок берлинской лазури.
K4 [Fe(CN)6] + FeCI3 = 3KCI + KFe[Fe(CN)6]
Лабораторный опыт 3.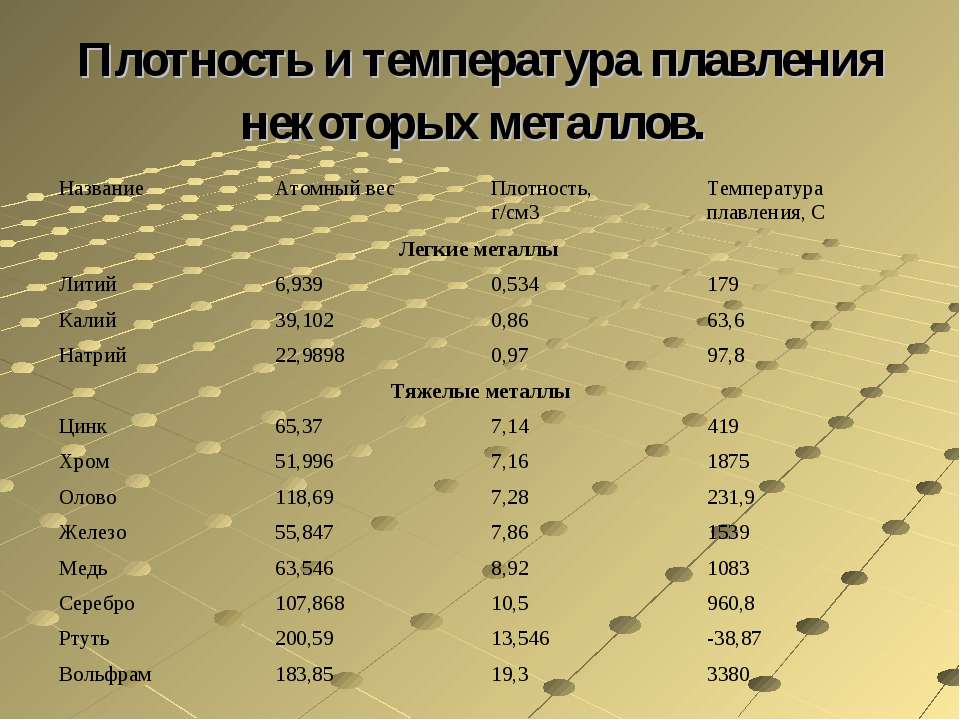 Качественная реакция на ион Fe2+.
Качественная реакция на ион Fe2+.
Реактив – красная кровяная соль K3[Fe(CN)6].
Налейте в пробирку 1 мл раствора хлорида железа(II). Добавьте к нему по каплям раствор осадка.гексацианоферрата(III) калия K3[Fe(CN)6] (красной кровяной соли). Отметьте цвет осадка.
Результат воздействия – синий осадок (турнбулевой сини)
FeCI2 + K3[Fe(CN)6] = 2КCI + KFe[Fe(CN)6]↓
Вывод:
Реактивами на ионы Fe2+ являются щелочи и красная кровяная соль K3[Fe(CN)6].
Реактивами на ионы Fe3+ являются щелочи, роданид калия и желтая кровяная соль K4[Fe(CN)6].

Учащиеся записывают уравнения качественных реакций в тетради и выводы.
6. Первичное закрепление знаний. (Работа по цепочке.)
Перечислите, какие соединения образует железо со степенью окисления +2.
Каков характер оксида и гидроксида железа(II)?
Перечислите формулы соединений железа со степенью окисления +3.
Каков характер оксида и гидроксида железа(III)?
Как можно получить гидроксиды железа?
По каким признакам можно распознать осадки гидроксида железа(II) и гидроксида железа(III)?
При помощи каких качественных реакций можно распознать соли железа(II) и соли железа(III)?
9. Формирование знаний о соединениях железа, имеющих наибольшее практическое значение.
(Самостоятельная работа с учебником и образцами минералов.)
Задания для самостоятельной работы
Рассмотреть образцы выданных вам минералов, отметить их агрегатное состояние, цвет.

Выписать в тетради формулы, название этих соединений, их практическое значение.
10. Первичное закрепление.
Ребята, давайте еще раз повторим, что мы сегодня изучили.
Формы и способы организации учебной деятельности (по “цепочке” учащиеся повторяют все вопросы этого урока, используя слайды презентации учителя,)
Выявление возможных затруднений и способы их коррекции.
11. Контроль знаний. Тест.
Тест по теме:
Металл, реагирующий с серной кислотой при обычных условиях :
А) серебро; б) медь; в) железо; г) ртуть.
Металл, взаимодействующий с водой при обычных условиях:
А) натрий; б) медь; в) железо; г) ртуть .
Возможные степени окисления атома железа:
А) +2; б) +2, +3; в) 0, +2, +3, +6.
Вещество, в котором степень окисления железа +3:
А) NaFeO2 б) FeO3 в) FeCl2 г) FeCO3 .
Пластинка, вытесняющая медь из раствора ее солей:
А) железная б) серебряная в) золотая .
Среда, в которой коррозия железа идет наиболее быстро:
А) вода; б) воздух; в) влажный воздух.
Характер оксида железа (II) :
А) кислотный; б) основный; в) амфотерный.
Характер оксида железа (III) :
А) кислотный; б) основный; в) амфотерный.
Укажите вещество, взаимодействующее с железом:
А) кислород; б) сероводород; в) углекислый газ.
Укажите вещество, взаимодействующее с оксидом железа (III)
А) кислород; б) вода; в) серная кислота.
Укажите металл, более активный, чем железо:
А) кальций; б) медь; в) олово.
12. Осуществить превращение FeCl3 → Fe(OH)3 можно с помощью:
А) кислоты; б) воды; в) щелочи.
Установите соответствие:
Тип реакции Исходные вещества
1) соединения а) Fe(OH)3 →
2) разложения б) Fe + H2SO4 →
3) замещения в) Fe + ZnSO4 →
4) обмена г) Fe(OH)3 + NaOH →
д) Fe + Cl2 →
е) Fe + O2 →
Установите соответствие:
Исходные вещества Продукты реакции
1) Fe + H2SO4 → а) Fe(OH)3 + NaCl
2) Fe + Cl2 → б) Fe(OH)2 + NaCl
3) Fe + HCl → в) FeCl2
4) FeCl2 + NaOH → г) FeCl2 +H2
д) FeCl3
е) FeSO4 + H2
Задача: На сколько граммов увеличится масса железной пластинки, опущенной в раствор СuS04, если при этом на пластинке оказалось 20,8 г металлической меди?
Х г — 20,8 г
56 г — 64 г
Х = 18,2 г железа растворилось => m (Fе) увеличилась на 20,8 г-18,2 г = 2,6 г
ОТВЕТ : 2, 6 г.
12. Подведение итогов. Выставление оценок.
Д/З. § 6.5 стр.186 упр. 7 письменно,
13. Рефлексия учебной деятельности на уроке.
Зафиксировать новое знание, полученное на уроке.
Оценить собственную деятельность на уроке.
Оценить учебную деятельность класса.
Зафиксировать неразрешенные затруднения как направления будущей учебной деятельности.
Обсудить и записать домашнее задание.
Литература:
Венецкий С. И. В мире металлов. М., 1988.
Габриелян О. С. Химия 9 класс, М.: Дрофа, 2010 Химия – 9 с. 76–82.
Денисова В. Г. Химия. 9 класс: поурочные планы по учебнику О. С. Габриеляна – Волгоград: Учитель, 2009.
Книга для чтения по неорганической химии. Под ред. В. А. Крицмана. М., 1979.
Мезин Н. А. Занимательно о железе. М., Металлургия, 1977.

Пузынина М. А. Занимательный час “Чудеса своими руками” Химия в школе. 1991. № 5. С. 66–67.
Какова температура плавления цинк
Температура – плавление – цинк
Температура плавления цинка 419 С, Цинк обладает невысокими механическими свойствами, при нормальной температуре хрупкий, от ударов молотка крошится, а при температуре 100 – 150 С становится ковким и тягучим и хорошо прокатывается в листы. Кислоты и щелочи разъедают цинк, а чистая вода не разрушает его. Из-за низких механических свойств цинк в чистом виде для изготовления деталей не применяется. [1]
При температуре плавления цинка 419 практически установлено, что температура цинковой ванны должна быть около 450 и не выше 480, так как в противном случае толщина покрытия падает, растет угар цинка и повышается износ стенок ванны, обычно изготовляемой из железа. Расплавленный цинк должен быть возможно более чистым. Содержание железа в расплавленном цинке не допускается выше 0 05 %, так как в противном случае повышается температура плавления цинка. Вследствие того, что покрытие цинком становится тем более хрупким, чем выше содержание в нем железоцинкового сплава, в практике внимательно следят за систематическим удалением со дна ванны гартцинка и за соблюдением особых мер, предупреждающих его взмучивание. Накопление окиси цинка в расплавленном металле за счет окисления цинка кислородом воздуха приводит к увеличению вязкости расплава, а также к образованию хрупких покрытий. [2]
Вследствие того, что покрытие цинком становится тем более хрупким, чем выше содержание в нем железоцинкового сплава, в практике внимательно следят за систематическим удалением со дна ванны гартцинка и за соблюдением особых мер, предупреждающих его взмучивание. Накопление окиси цинка в расплавленном металле за счет окисления цинка кислородом воздуха приводит к увеличению вязкости расплава, а также к образованию хрупких покрытий. [2]
Производить шерардизацию при температурах выше температуры плавления цинка , не рекомендуется, так как в этом случае расплавленные частицы цинка обволакиваются пленкой окиси цинка, создающей препятствие для взаимного слияния расплавленных частиц. После нагревания барабан охлаждается до комнатной температуры. Неостывший барабан открывать нельзя, так как возможно сгорание шерардизирующей смеси. Готовые изделия выбрасываются в сито, через которое отсеивается цинковая пыль. [3]
Если измерения вести при температурах ниже температуры плавления цинка , то кривые по повышению напряжения хорошо совпадают с кривыми по понижению напряжения. На катоде при этом выделяется цинк в форме дендритов. При измерениях выше температуры плавления цинка некоторое деполяризующее действие оказывает реакция восстановления цинком сульфатов до сульфидов, хотя и в этом случае после охлаждения в католите можно обнаружить цинк в виде королька. [4]
На катоде при этом выделяется цинк в форме дендритов. При измерениях выше температуры плавления цинка некоторое деполяризующее действие оказывает реакция восстановления цинком сульфатов до сульфидов, хотя и в этом случае после охлаждения в католите можно обнаружить цинк в виде королька. [4]
Во время нагревания температура нагревания должна быть немного ниже температуры плавления цинка . [5]
При прохождении тока короткого замыкания суженные места вставки быстро нагреваются до температуры плавления цинка , и плавкая вставка плавится одновременно во всех суженных местах. [6]
Должен знать: кинематические, электрические схемы оцинковального агрегата непрерывного действия в пределах выполняемой работы и правила наладки его; температуру плавления цинка и влияние температуры расплавленного цинка на толщину слоя покрытия; физико-химические свойства цинка и химикатов, применяемых для оцинкования, в пределах выполняемой работы; виды дефектов и причины некачественной подготовки поверхности листов и стальной проволоки. [7]
[7]
Цинк в чистом виде применяют в основном для оцин-кования стали, в электрических батареях и элементах. Температура плавления цинка равна 419 С. [8]
Так, например, при температуре плавления цинка 419 С и олова 232 С латунь и бронза имеют температуру плавления 800 – 950 С. Возникает опасность испарения легкоплавких компонентов. [10]
Повышение температуры вызывает более интенсивное образование диффузионных слоев покрытия, но при толщине выше некоторой предельной покрытие становится рыхлым, легко спадает с поверхности изделия на дно ванны. Температура расплава в ванне ( при температуре плавления цинка 419 С) поддерживается на уровне 450 С и не превышает 480 С. При более высокой температуре недопустимо снижается толщина покрытия, уменьшается срок службы стенок ванны, изготовляемой обычно из стали. Холодные ванны ( при температуре расплава менее 450 С) дают грубые и не-равномерные по толщине покрытия при повышенном расходе цинка на покрытие. Необходимо систематически удалять со дна ванны гартцинк и соблюдать особые меры, предупреждающие взмучивание его.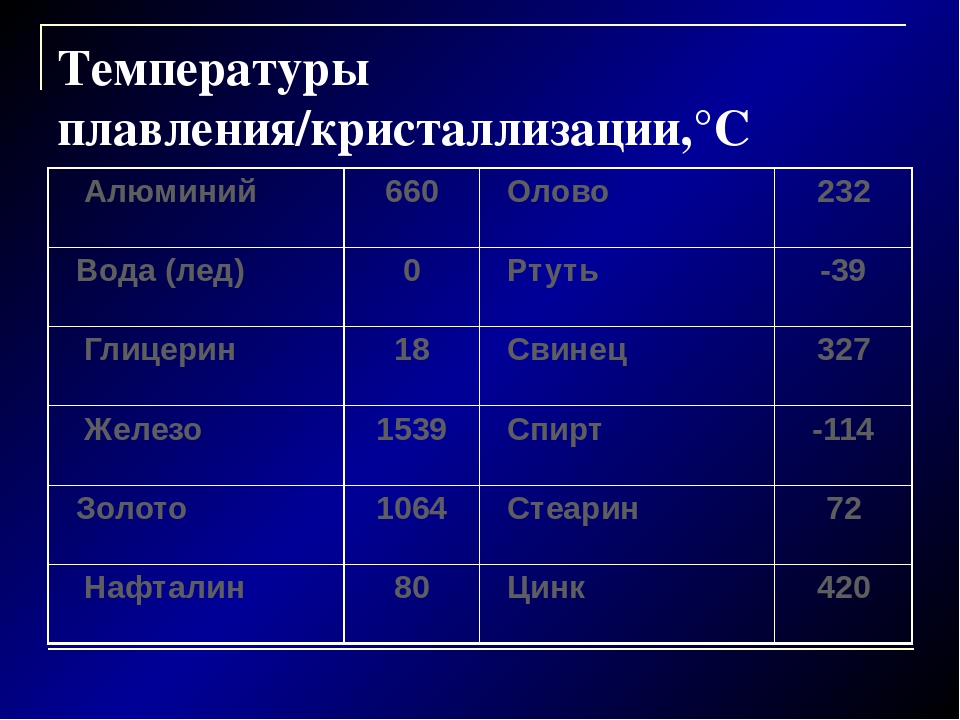 Расплавленный металл постепенно загрязняется окисью цинка вследствие окисления цинка кислородом воздуха. Это увеличивает вязкость расплава, а также вызывает образование хрупких покрытий. [11]
Расплавленный металл постепенно загрязняется окисью цинка вследствие окисления цинка кислородом воздуха. Это увеличивает вязкость расплава, а также вызывает образование хрупких покрытий. [11]
Читать также: Как натянуть цепь на бензопиле хускварна
Повышение Температуры вызывает более интенсивное образование диффузионных слоев покрытия, но при толщине выше некоторой предельной покрытие становится рыхлым, легко спадает с поверхности изделия на дно ванны. Температура расплава в ванне ( при температуре плавления цинка 419 С) поддерживается1 на уровне 450 С и не превышает 480 С. При более высокой тймпературе недопустимо снижается толщина покрытия, уменьшается срок службы стенок ванны, изготовляемой обычно из стали. Холодные ванны ( при температуре расплава менее 450 С) дают грубые и неравномерные по толщине покрытия при повышенном расходе цинка на покрытие. Необходимо систематически удалять со дна ванны гартцинк и соблюдать особые меры, предупреждающие взмучивание его. Расплавленный металл постепенно загрязняется окисью цинка вследствие окисления цинка кислородом воздуха. Это увеличивает вязкость расплава, а также вызывает образование хрупких покрытий. [13]
Это увеличивает вязкость расплава, а также вызывает образование хрупких покрытий. [13]
Применение цинковых плавких вставок в предохранителях ПР объясняется не только указанными выше преимуществами их по сравнению с вставками из свинца и из его сплавов с оловом. Большое значение имеет и то, что при применении цинковой вставки температура внутри трубки в эксплуатации не может быть выше температуры плавления цинка , равной 420 С. С, что может привести к сильному обугливанию внутренней поверхности фибровой трубки и порче изоляции подводящих проводов. [15]
Цинк — хрупкий металл белого цвета с голубым оттенком. На воздухе покрывается тонкой оксидной плёнкой. Латунь (медно-цинковый сплав) использовали ещё до нашей эры в Древней Греции и Древнем Египте. На сегодняшний день цинк — один из самых важных для многих отраслей человеческой деятельности. Он незаменим в промышленности, медицине. Важен для нормального функционирования человеческого организма
Свойства цинка
Химические свойства цинка
Цинк — активный металл. При комнатной температуре тускнеет и покрывается слоем оксида цинка.
При комнатной температуре тускнеет и покрывается слоем оксида цинка.
- Вступает в реакцию со многими неметаллами: фосфором, серой, кислородом.
- При повышении температуры взаимодействует с водой и сероводородом, выделяя водород.
- При сплавлении с щелочами образует цинкаты — соли цинковой кислоты.
- Реагирует с серной кислотой, образуя различные вещества в зависимости от концентрации кислоты.
- При сильном нагревании вступает в реакции со многими газами: газообразным хлором, фтором, йодом.
- Не реагирует с азотом, углеродом и водородом.
Физические свойства цинка
Цинк — твердый металл, но становится пластичным при 100–150 °C. При температуре выше 210 °С может деформироваться. Температура плавления — очень низкая для металлов. Несмотря на это, цинк имеет хорошую электропроводность.
- Плотность — 7,133 г/см³.
- Теплопроводность — 116 Вт/(м·К).
- Температура плавления цинка — 419,6 °C.
- Температура кипения — 906,2 °C.

- Удельная теплота испарения — 114,8 кДж/моль.
- Удельная теплота плавления — 7,28 кДж/моль.
- Удельная магнитная восприимчивость — 0,175·10-6.
- Предел прочности при растяжении — 200–250 Мн/м 2 .
Подробный химический состав цинка различных марок указан в таблице ниже.
| Обозначение марок | Цинк, не менее | Примесь, не более | |||||||
| свинец | кадмий | железо | медь | олово | мышьяк | алюминий | всего | ||
| ЦВ00 | 99,997 | 0,00001 | 0,002 | 0,00001 | 0,00001 | 0,00001 | 0,0005 | 0,00001 | 0,003 |
| ЦВ0 | 99,995 | 0,003 | 0,002 | 0,002 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,005 |
| ЦВ | 99,99 | 0,005* | 0,002 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,01 |
| Ц0А | 99,98 | 0,01 | 0,003 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,02 |
| Ц0 | 99,975 | 0,013 | 0,004 | 0,005 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,025 |
| Ц1 | 99,95 | 0,02 | 0,01 | 0,01 | 0,002 | 0,001 | 0,0005 | 0,005 | 0,05 |
| Ц2 | 98,7 | 1,0 | 0,2 | 0,05 | 0,005 | 0,002 | 0,01 | 0,010** | 1,3 |
| Ц3 | 97,5 | 2,0 | 0,2 | 0,1 | 0,05 | 0,005 | 0,01 | – | 2,5 |
* В цинке, применяемом для производства сплава марки ЦАМ4-1о, массовая доля свинца должна быть не более 0,004%. ** В цинке, применяемом для проката, массовая доля алюминия должна быть не более 0,005%. ** В цинке, применяемом для проката, массовая доля алюминия должна быть не более 0,005%. | |||||||||
Содержание примесей в цинке зависит от способа производства и качества сырья.
В России основной процент цинка получают гидрометаллургическим способом — металл восстанавливают из солей в растворах. Такой способ позволяет получить наиболее чистый металл. Но часть цинка обрабатывают при высоких температурах. Такой метод называют пирометаллургическим.
Свинец — особая примесь в цинке, так как основная его часть оседает из-за нерастворимых анодов, содержащихся в металле. Катодный цинк, помимо всех указанных примесей, состоит из хлора и фтора.
Химические и физические свойства и история металла
Несмотря на использование с давних времён в различных целях, чистый цинк получить никак не удавалось. Только в начале восемнадцатого века Уильям Чемпион сумел открыть способ выделения этот элемент из руды с помощью дистилляции. В 1838 году он запатентовал своё открытие, а спустя 5 лет, в 1843 году, Уильямом Чемпионом был запущен первый в истории завод по выплавке этого металла. Спустя некоторое время Андреас Сигизмунд Маргграф открыл ещё один метод. Этот способ был признан более совершенным. Поэтому именно Маргграфа зачастую считают открывателем чистого цинка. Последующие открытия только поспособствовали расширению его популярности.
Спустя некоторое время Андреас Сигизмунд Маргграф открыл ещё один метод. Этот способ был признан более совершенным. Поэтому именно Маргграфа зачастую считают открывателем чистого цинка. Последующие открытия только поспособствовали расширению его популярности.
Месторождения и получение
Самородного цинка в природе не существует. Сегодня используется около 70 минералов, из которых его выплавляют. Самый известный — сфалерит (цинковая обманка), который содержится в незначительных количествах в организме человека и животных, а также в некоторых растениях. Больше всего — в фиалке.
Цинковые минералы добывают в Казахстане, Боливии, Австралии, Иране, России. Лидеры по производству — Китай, Австралия, Перу, США, Канада, Мексика, Ирландия, Индия.
На сегодняшний день самый популярный метод получения чистого металла — электролитический. Чистота получаемого металла почти стопроцентная (возможны лишь небольшие примеси в объёме не более нескольких сотых процента. В целом они незначительны, поэтому такой цинк считается чистым).
Общее производство цинка во всём мире оценивается примерно в более чем десять миллионов тонн в год.
Читать также: Кнопка для реверса электродвигателя
Свойства металла и использование в производстве
Цвет чистого металла — серебристо-белый. Довольно хрупок при температуре двадцать-двадцать пять градусов (т.е. комнатной), особенно если содержит примеси. При нагревании до 100 — 150 градусов по Цельсию металл становится пластичным и ковким. При разогревании выше чем сто-сто пятьдесят градусов хрупкость опять возвращается.
- Температура плавления цинка — 907 градусов по Цельсию.
- Относительная атомная масса цинка — 65,38 а. е. м. ± 0,002 а. е. м.
- Плотность цинка — 7,14 г/см 3 .
Металл цинк занимает четвертое место по использованию в различных сферах производства:
- Он применяется при добыче и обработке золотой и серебряной руды.
- Оцинковка защищает сталь от коррозии.
- Важную роль металл играет в батарейках и аккумуляторах.

- С помощью цинковых пластинок печатаются иллюстрации в журналах и книгах.
- В медицине цинковая окись используется как антисептик.
- Применяется в автомопроизводстве.
Области применения
Цинк, как элемент, содержится в достаточном количестве в земной коре и в водных ресурсах.
- При производстве масляных красок.
- При изготовлении резиновых шин.
- В медицине.
- Способен восстанавливать благородные металлы.
- Применяется в качестве защитного средства от коррозии.
- Используется в полиграфической промышленности.
- Применяется при изготовлении аккумуляторов.
Половина всего производства цинка идет на выполнение функции «защита от коррозии». Благодаря свои свойством из цинка с успехом отливают ответственные детали (например, для самолетов). Цинк широко применяется совместно с медью и свинцом.
Цинк так же использует в виде порошка для осуществления ряда химико-технологических процессов.
О том, как снять цинк, вам поведает данное видео:
Содержание в организме человека и продуктах питания
Организм человека обычно содержит около двух граммов цинка. Многие ферменты содержат в себе этот металл. Элемент играет роль в синтезе важных гормонов, таких как тестостерон и инсулин. Элемент крайне необходим для полноценного функционирования мужских половых органов. Кстати, он даже помогает нам справиться с сильным похмельем. С его помощью выводится из нашего организма лишний алкоголь.
Многие ферменты содержат в себе этот металл. Элемент играет роль в синтезе важных гормонов, таких как тестостерон и инсулин. Элемент крайне необходим для полноценного функционирования мужских половых органов. Кстати, он даже помогает нам справиться с сильным похмельем. С его помощью выводится из нашего организма лишний алкоголь.
Недостаток цинка в рационе может привести к множеству нарушений функций организма. Такие люди подвержены депрессии, постоянной усталости, нервозности. Дневная норма для взрослого мужчины — 11 миллиграммов в день, для женщины — 8 миллиграмм.
Содержание в продуктах (в миллиграммах на 100 грамм продукта):
- устрицы — 40 мг;
- отруби — 16 мг;
- семена тыквы — 10 ;
- печень говяжья — 8 мг;
- говядина — 8 мг;
- баранина — 6 мг;
- семена подсолнуха — 5 мг;
- сыр — 4 мг;
- овёс — 4 мг;
- курица — 3 мг;
- орехи грецкие — 3 мг;
- фасоль — 3 мг;
- свинина — 3 мг;
- шоколад — 2 мг;
- кукуруза — 0,5 мг;
- бананы — 0,15 мг.

Избыток элемента в человеческом организме также приводит к серьёзным проблемам, поэтому не стоит хранить продукты в цинковой посуде.
Цинк
— хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка). Эссенциальный (незаменимый) микроэлемент тканей человека. По количественному соотношению в организме занимает второе, после железа, место. Ему принадлежит ключевая роль в регенерации поврежденных тканей, так как без цинка нарушается синтез нуклеиновых кислот и белка.
Смотрите так же:
СВОЙСТВА
При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). Имеет низкую температуру плавления. Объем металла при плавлении увеличивается в соответствии со снижением плотности. С повышением температуры уменьшается кинетическая вязкость и электропроводность цинка и возрастает его удельное электрическое сопротивление. При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка. Является диамагнетиком.
При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка. Является диамагнетиком.
Как примеси изменяют свойства цинка
Производители ограничивают содержание кадмия, олова и свинца в литейных сплавах цинка, чтобы подавить межкристаллитную коррозию.
Олово — вредная примесь. Металл не растворяется и выделяется из расплава — способствует ломкости цинковых отливок. Кадмий напротив — растворяется в цинке и снижает его пластичность в горячем состоянии. Свинец увеличивает растворимость металла в кислотной среде.
Железо повышает твердость цинка, но снижает его прочность. Вместе с тем оно усложняет процесс заполнения форм при литье.
Медь увеличивает твердость цинка, но уменьшает его пластичность и стойкость при коррозии. Содержание меди также мешает рекристаллизации цинка.
Наиболее вредная примесь — мышьяк. Даже при небольшом ее количестве металл становится хрупким и менее пластичным.
Чтобы избежать растрескивания кромок при горячей прокатке цинка, содержание сурьмы не должна быть выше 0,01%. В горячем состоянии она увеличивает твердость цинка, лишая его хорошей пластичности.
В горячем состоянии она увеличивает твердость цинка, лишая его хорошей пластичности.
Читать также: Платохонингование блока цилиндров что это
ЗАПАСЫ И ДОБЫЧА
Среднее содержание цинка в земной коре — 8,3·10 -3 %, в основных извержённых породах его несколько больше (1,3·10 -2 %), чем в кислых (6·10 -3 %). Цинк — энергичный водный мигрант, особенно характерна его миграция в термальных водах вместе со свинцом. Из этих вод осаждаются сульфиды цинка, имеющие важное промышленное значение. Цинк также энергично мигрирует в поверхностных и подземных водах, главным осадителем для него является сероводород, меньшую роль играет сорбция глинами и другие процессы.
Месторождения цинка известны в Иране, Австралии, Боливии, Казахстане. В России крупнейшим производителем свинцово-цинковых концентратов является ОАО «ГМК Дальполиметалл»
Читать также: Вибратор для бетонных работ
Цинк добывают из полиметаллических руд, содержащих 1—4% Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60% Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Основной способ получения цинка — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах.
Руды обогащают селективной флотацией, получая цинковые концентраты (50—60% Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Основной способ получения цинка — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах.
Что такое цинк
Понятие и особенности
Для начала вашему вниманию предлагается общая характеристика цинка. Этот продукт является не только необходимым производственным металлом, но и важным биологическим элементом. В любом живом организме он присутствует до 4 % от всех элементов.Самые богатые месторождения цинка это Боливия, Иран, Казахстан и Австралия. В нашей стране одним из крупных производителей считается предприятие ОАО «ГМК Дальполиметалл».
Если рассматривать цинк со стороны периодической системе Менделеева, то он относится к переходным металлам и имеет следующие характеристики:
- Номер по порядку: 30
- Масса: 65,37.
- Степень окисления — +2.
- Цвет: синевато-белый.
Если рассматривать цинк со стороны простого вещества, то этот материал имеет следующие характеристики:
- Вид материала – металл.
- Цвет – серебристо-голубой.
- Покрытие – защищен оксидной пленкой, под которой скрывается блеск и сияние.
Цинк содержится в коре земли. Доля металла в ней не очень большая: всего 0,0076%.
Как единичного материала цинка не существует. Он входит в состав многих руд и минералов.
- Наиболее распространенными являются: цинковая обманка, клейофан, марматит. Кроме этого, цинк можно встретить в следующих природных материалах: вюртцит, франкленит, цинкит, смитсонит, каламин, виллемит.
- Спутниками цинка обычно являются: германий, кадмий, таллий, галлий, индий, кадмий.

- Наиболее популярными являются сплавы цинка и алюминия, меди, олова, никеля.
О роли цинка в нашей жизни расскажут специалист в этом видео:
Металлы-конкуренты
С цинком могут конкурировать только 4 металла: титан, алюминий, хром и медь. Описанные материалы имеют следующие характеристики:
- Алюминий: серебристо-белый цвет, хорошо проводит электричество и тепло, поддается обработке давлением, устойчив к коррозии, имеет низкую плотность, применяется в процессе производства стали (для повышения жаростойкости).
- Титан: серебристо-белый цвет, большая температура плавления, при соприкосновении с воздухом окисляется, низкая теплопроводность, легко поддается ковке и штамповке, при высокой температуре на поверхности образуется прочная защитная пленка.
- Хром: синевато-блестящий цвет, высокая твердость, хрупкость, стойкость к окислению в условиях атмосферы и воды, используется для декоративного покрытия.

- Медь: красный металл, имеет высокую пластичность, хорошую электропроводность, высокую теплопроводность, стойкость к коррозионным процессам, применяется в кровельных материалах.
Для строительных целей наиболее часто (кроме цинка) применяют и другие цветные металлы. К ним относятся: бронза, латунь, силумин, баббит, дюралюминий и несколько других.
Плюсы и минусы
Плюсы:
- Хорошая жидкотекучесть, благодаря чему легко заполняются литейные формы.
- Высокая пластичность во время проката.
- Чистый цинк хорошо поддается ковке.
- Благодаря своим свойствам и воздействию температуры способен принимать различные состояния.
- Отлично защищает изделие от коррозии, благодаря чему охотно пользуется спросом в строительстве и машиностроении.
- При нагреве вместе с фосфором или серой может взорваться.
- На воздухе теряет блеск.
- При комнатной температуре имеет маленькую пластичность.
- Не находится в природе в чистом виде.

Читать также: Антенна для цифрового приема без приставки
Масса, механические, химические и физические свойства цинка, его основные характеристики будут рассмотрены нами ниже.
ПРОИСХОЖДЕНИЕ
Цинк в природе как самородный металл не встречается. Известно 66 минералов цинка, в частности цинкит, сфалерит, виллемит, каламин, смитсонит, франклинит. Наиболее распространенный минерал — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Из-за трудности определения этого минерала его называют обманкой (др.-греч. σφαλερός — обманчивый). Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента № 30: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
ПРИМЕНЕНИЕ
Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций).
Цинк используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах.
Пластины цинка широко используются в полиграфии, в частности, для печати иллюстраций в многотиражных изданиях. Для этого с XIX века применяется цинкография — изготовление клише на цинковой пластине при помощи вытравливания кислотой рисунка в ней. Примеси, за исключением небольшого количества свинца, ухудшают процесс травления.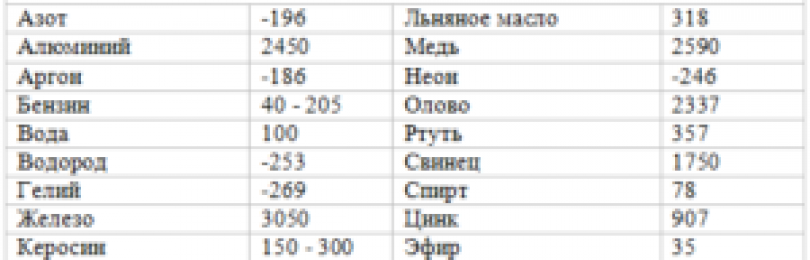 Перед травлением цинковую пластину подвергают отжигу и прокатывают в нагретом состоянии.
Перед травлением цинковую пластину подвергают отжигу и прокатывают в нагретом состоянии.
Цинк вводится в состав многих твёрдых припоев для снижения их температуры плавления.
Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Цинк — важный компонент латуни. Сплавы цинка с алюминием и магнием (ЦАМ, ZAMAK) благодаря сравнительно высоким механическим и очень высоким литейным качествам очень широко используются в машиностроении для точного литья. В частности, в оружейном деле из сплава ZAMAK (-3, −5) иногда отливают затворы пистолетов, особенно рассчитанных на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов, масштабные модели и всевозможные миниатюры, а также любые другие изделия, требующие точного литья при приемлемой прочности.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.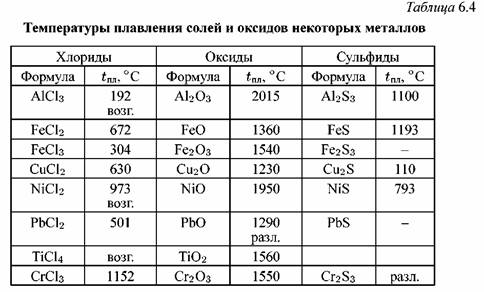
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники. Сульфид цинка — составная часть многих люминофоров. Фосфид цинка используется в качестве отравы для грызунов.
Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.
Сплавы цинка
Сплавы на цинковой основе с добавлением меди, магния и алюминия имеют низкую температуру плавления и обладают хорошей текучестью. Они легко поддаются обработке, свариванию и паянию.
Латунь
Различают латуни двухкомпонентные и многокомпонентные.
Двухкомпонентная латунь — сплав цинка с высоким содержанием меди. Существует желтая латунь с медью в количестве 67%, золотистая медь или томпак — 75%, и зеленая — 60%. Такие сплавы могут деформироваться при температуре 300 °C.
Многокомпонентные латуни, помимо 2-х основных металлов, состоят из других добавок: никеля, железа, свинца или марганца.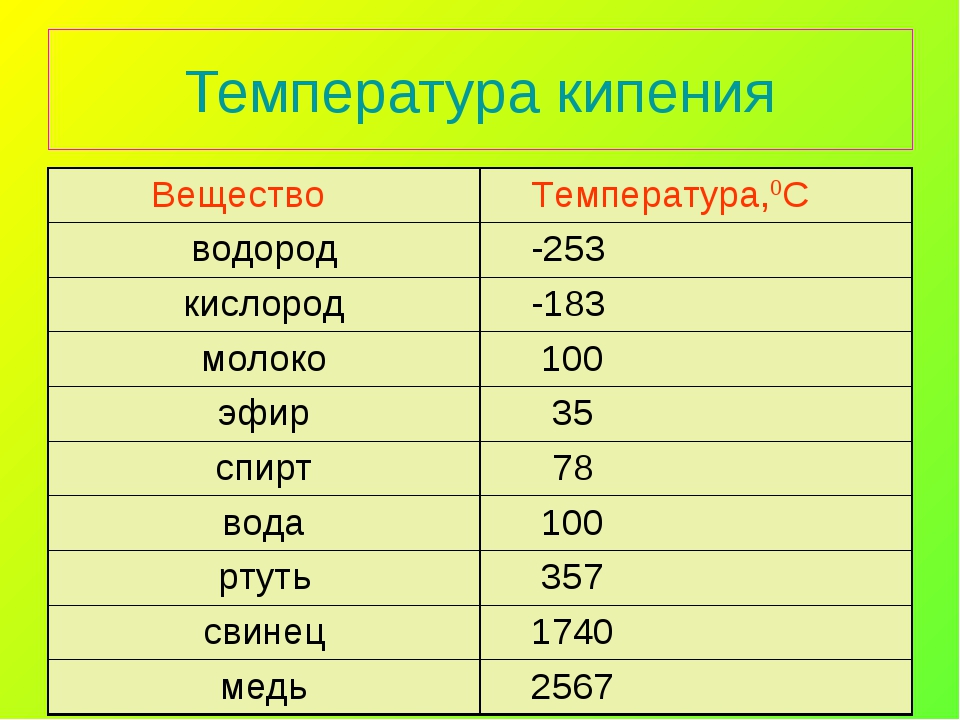 Каждый из элементов влияет на свойства сплава.
Каждый из элементов влияет на свойства сплава.
ЦАМ — семейство цинковых сплавов. В их состав входят магний, алюминий и медь. Такие сплавы цинка используются в литейном производстве. В них содержится алюминий в количестве 4%.
Основная область применения сплавов ЦАМ — литье цинка под давлением. Сплавы этого семейства обладают низкой температурой плавления и хорошими литейными свойствами. Их высокопрочность позволяет производить прочные и сложные детали.
Вирениум
Сплав состоит из цинка (24,5%), меди (70%), никеля (5,5%).
Применение металлов и их сплавов — урок. Химия, 8–9 класс.
О том, что свойства металлов меняются при их сплавлении, стало известно ещё в древности. \(5\) тысяч лет тому назад наши предки научились делать бронзу — сплав олова с медью. Бронза по твёрдости превосходит оба металла, входящие в её состав.
Свойства чистых металлов, как правило, не соответствуют необходимым требованиям, поэтому практически во всех сферах человеческой деятельности используют не чистые металлы, а их сплавы..png)
Сплав — это материал, который образуется в результате затвердения расплава двух или нескольких отдельных веществ.
В состав сплавов кроме металлов могут входить также неметаллы, например, такие как углерод или кремний.
Добавляя в определённом количестве примеси других металлов и неметаллов, можно получить многие тысячи материалов с самыми разнообразными свойствами, в том числе и такими, каких нет ни у одного из составляющих сплав элементов.
Сплав по сравнению с исходным металлом может быть:
- механически прочнее и твёрже,
- со значительно более высокой или низкой температурой плавления,
- устойчивее к коррозии,
- устойчивее к высоким температурам,
- практически не менять своих размеров при нагревании или охлаждении и т. д.
Например, чистое железо — сравнительно мягкий металл. При добавлении в железо углерода твёрдость его существенно возрастает. По количеству углерода, а следовательно, и по твёрдости, различают сталь (содержание углерода менее \(2\) % по массе), чугун (\(С\) — более \(2\) %). Но не только углерод изменяет свойства стали. Добавленный в сталь хром делает её нержавеющей, вольфрам делает сталь намного более твёрдой, добавка марганца делает сплав износостойким, а ванадия — прочным.
Но не только углерод изменяет свойства стали. Добавленный в сталь хром делает её нержавеющей, вольфрам делает сталь намного более твёрдой, добавка марганца делает сплав износостойким, а ванадия — прочным.
Применение сплавов в качестве конструкционных материалов
Сплавы, используемые для изготовления различных конструкций, должны быть прочными и легко обрабатываемыми.
В строительстве и в машиностроении наиболее широко используются сплавы железа и алюминия.
Такие сплавы железа, как стали, отличаются высокой прочностью и твёрдостью. Их можно ковать, прессовать, сваривать.
Чугуны используют для изготовления массивных и очень прочных деталей. Например, раньше из чугуна отливали радиаторы центрального отопления, канализационные трубы, до сих пор изготавливают котлы, перила и опоры мостов. Изделия из чугуна изготавливаются с применением литья.
Сплавы алюминия, используемые в конструкциях, наряду с прочностью должны отличаться лёгкостью. Дюралюминий, силумин — сплавы алюминия, они незаменимы в самолёто-, вагоно- и кораблестроении.
Дюралюминий, силумин — сплавы алюминия, они незаменимы в самолёто-, вагоно- и кораблестроении.
В некоторых узлах самолётов используются сплавы магния, очень лёгкие и жароустойчивые.
В ракетостроении применяют лёгкие и термостойкие сплавы на основе титана.
Для улучшения ударопрочности, коррозионной стойкости, износоустойчивости сплавы легируют — вводят специальные добавки. Добавка марганца делает сталь ударопрочной. Чтобы получить нержавеющую сталь, в состав сплава вводят хром.
| Рис. \(1\). Конструкция из стальных балок | Рис. \(2\). Радиатор центрального отопления | Рис. \(3\). Детали, отлитые из чугуна |
Инструментальные сплавы
Инструментальные сплавы предназначены для изготовления режущих инструментов, штампов и деталей точных механизмов.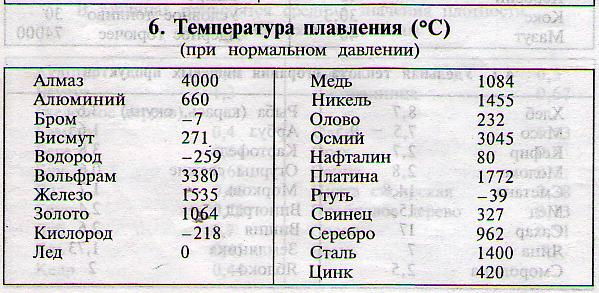 Такие сплавы должны быть износостойкими и прочными, причём при разогревании их прочность не должна существенно уменьшаться. Таким требованиям отвечают, например, нержавеющие стали, которые прошли специальную обработку (закалку).
Такие сплавы должны быть износостойкими и прочными, причём при разогревании их прочность не должна существенно уменьшаться. Таким требованиям отвечают, например, нержавеющие стали, которые прошли специальную обработку (закалку).
Добавление к сплавам веществ, улучшающих их свойства, называют легированием.
Для придания необходимых свойств инструментальные стали, как правило, легируют вольфрамом, ванадием или хромом.
Применение сплавов в электротехнической промышленности, электронике и приборостроении
Сплавы служат незаменимым материалом при изготовлении особо чувствительных и высокоточных приборов, различного рода датчиков и преобразователей энергии.
Например, на изготовление сердечников трансформаторов и деталей реле идёт сплав никеля. Отдельные детали электромоторов изготавливаются из сплавов кобальта.
Сплав никеля с хромом — нихром, отличающийся высоким сопротивлением — используется для изготовления нагревательных элементов печей и бытовых электроприборов.
Из сплавов меди в электротехнической промышленности и в приборостроении наиболее широкое применение находят латуни и бронзы.
Латуни незаменимы при изготовлении приборов, деталью которых являются запорные краны. Такие приборы используются в сетях подачи газа и воды.
Бронзы идут на изготовление пружин и пружинящих контактов.
| Рис. \(4\). Нагревательные элементы бытовых электроприборов | Рис. \(5\). Краны для водопроводов | Рис. \(6\). Металлическая пружина |
Применение легкоплавких сплавов
Главным востребованным свойством легкоплавких сплавов является заданная низкая температура плавления. Это свойство, в частности, используется для пайки микросхем. Кроме того, эти сплавы должны иметь определённую плотность, прочность на разрыв, химическую инертность, теплопроводность.
Легкоплавкие сплавы производят из висмута, свинца, кадмия, олова и других металлов. Такие сплавы используют в термодатчиках, термометрах, пожарной сигнализации, например, сплав Вуда. А также в литейном деле для производства выплавляемых моделей, для фиксации костей и протезирования в медицине.
Сплав натрия с калием (температура плавления \(–\)\(12,5\) °С) используется как теплоноситель для охлаждения ядерных реакторов.
| Рис. \(7\). Припой (сплав для паяния) имеет невысокую температуру плавления | Рис. \(8\). Легкоплавкие сплавы незаменимы в датчиках пожарной сигнализации |
Применение сплавов в ювелирном деле
Применение в чистом виде драгоценных металлов в ювелирном деле не всегда оправдано и целесообразно из-за их дороговизны, физических и химических особенностей.
Для придания ювелирным изделиям из золота большей твёрдости и износостойкости используются сплавы с другими металлами.
Самая лучшая добавка — это серебро (понижает температуру плавления) и медь (повышает твёрдость). Чистое золото используют очень редко, так как оно слишком мягкое, легко деформируется и царапается.
Из сплавов золота с \(10–30\) % других благородных металлов (платины или палладия) изготавливают форсунки лабораторных приборов, а из сплава с \(25–30\) % серебра — ювелирные изделия и электрические контакты.
| Рис. \(9\). Ювелирные изделия из сплавов золота |
Сплавы в искусстве
Оловянная бронза (сплав меди с оловом) — один из первых освоенных человеком сплавов металлов. Она обладает большей, по сравнению с чистой медью, твёрдостью, прочностью и более легкоплавка. Бронзы успешно применяют для получения сложных по конфигурации отливок, включая художественное литьё. Классической маркой бронзы является колокольная бронза.
Классической маркой бронзы является колокольная бронза.Одно из новых направлений в искусстве — производство художественных литых изделий из чугуна. Литые изделия из чугуна существенно превосходят по качеству кованые изделия.
Чугун — металл гораздо более хрупкий и не такой ковкий, как сталь. Но даже из такого, казалось бы, грубого материала можно получать настоящие произведения литейного искусства способом литья, например, такие как литые лестницы или решётки на окна. Такие изделия подвержены лишь поверхностной коррозии и не требуют тщательного ухода.
Рис. \(10\). Бронзовая скульптура
| Рис. \(11\). Колокола из специального сорта бронзы | Рис. \(12\). Чугунная лестница — практично и красиво |
Источники:
Рис. 1. Конструкция из стальных балок https://cdn.pixabay.com/photo/2019/09/07/16/14/steel-scaffolding-4459235_960_720. jpg
jpg
Рис. 2. Радиатор центрального отопления https://cdn.pixabay.com/photo/2017/10/12/19/00/radiator-2845463_960_720.jpg
Рис. 3. Детали, отлитые из чугуна https://cdn.pixabay.com/photo/2017/10/15/18/47/fence-2854829_960_720.jpg
Рис. 4. Нагревательные элементы бытовых электроприборов https://upload.wikimedia.org/wikipedia/ru/7/7d/%D0%9A%D0%B8%D0%BF%D1%8F%D1%82%D0%B8%D0%BB%D1%8C%D0%BD%D0%B8%D0%BA.JPG Общественное достояние
Рис. 5. Запорные краны для водопроводов https://cdn.pixabay.com/photo/2020/02/01/21/11/water-crane-4811466_960_720.jpg
Рис. 6. Металлическая пружина https://cdn.pixabay.com/photo/2020/03/08/16/03/spring-4912865_960_720.jpg
Рис. 7. Припой (сплав для паяния) https://cdn.pixabay.com/photo/2018/04/01/06/13/soldering-3280085_960_720.jpg
Рис. 8. Легкоплавкие сплавы https://cdn.pixabay.com/photo/2014/11/10/08/09/fire-detector-525147_960_720.jpg
Рис. 9. Ювелирные изделия из сплавов золота https://cdn.pixabay.com/photo/2013/07/25/11/52/watch-166849_960_720. jpg
jpg
Рис. 10. Бронзовая скульптура https://cdn.pixabay.com/photo/2016/01/26/19/35/bronze-statue-1163163_960_720.jpg
Рис. 11. Колокола https://cdn.pixabay.com/photo/2017/06/17/19/30/bells-2413297_960_720.png
Рис. 12. Чугунная лестница https://cdn.pixabay.com/photo/2021/01/11/10/51/passage-5907911_960_720.jpg
ресурсов ювелира — точки плавления
Удельный вес металла или сплава — это просто вес одного кубического сантиметра в граммах. Когда удобнее работать с тройскими весами, количество унций на кубический дюйм любого металла или сплава можно найти, умножив его удельный вес на константу 0,52686.
| Температура плавления и масса различных металлов и сплавов | |||||
| Металл | Символ | Температура плавления ºF | Температура плавления ºC | Удельная Плотность | Вес в тройке унций / Cu In |
| Алюминий | Al | 1220 | 660 | 2. 70 70 | 1,423 |
| Сурьма | Сб | 1167 | 630 | 6,62 | 3,448 |
| Бериллий | Be | 2340 | 1280 | 1,82 | 0,959 |
| висмут | Bi | 520 | 271 | 9.80 | 5,163 |
| Кадмий | Кд | 610 | 321 | 8,65 | 4,557 |
| Углерод | С | – | – | 2,22 | 1,170 |
| Хром | Cr | 3430 | 1890 | 7.19 | 3,788 |
| Кобальт | Co | 2070 | 1132,2 | 8,9 | 4,689 |
| Медь | Cu | 1981 | 1083 | 8,96 | 4,719 |
| Золото, чистое 24 карата | Au | 1945 | 1063 | 19. 32 32 | 10,180 |
| Иридий | Ir | 4449 | 2454 | 22,50 | 11,849 |
| Утюг | Fe | 2802 | 1539 | 7,87 | 4,145 |
| Свинец | Пб | 621 | 327 | 11.34 | 5,973 |
| Магний | мг | 1202 | 650 | 1,75 | 0,917 |
| Марганец | млн | 2273 | 1245 | 7,43 | 3,914 |
| молибден | Пн | 4760 | 2625 | 10.20 | 5,347 |
| Никель | Ni | 2651 | 1455 | 8,90 | 4,691 |
| Осмий | Ос | 4892 | 2700 | 22,50 | 11,854 |
| Палладий | Pd | 2831 | 1555 | 12. 00 00 | 6.322 |
| фосфор | П | 111 | 44 | 1,82 | 0,959 |
| Платина, чистая | Pt | 3224 | 1773 | 21,45 | 11.301 |
| 15% Irid Plat | – | 3310 | 1821 | 21.59 | 11.301 |
| 10% Irid Plat | – | 3250 | 1788 | 21,54 | 11,349 |
| 5% Irid Plat | – | 3235 | 1779 | 21,50 | 11,325 |
| Родий | Rh | 3571 | 1966 | 12.44 | 6.553 |
| Рутений | Ру | 4500 | 2500 | 12.20 | 6,428 |
| Кремний | Si | 2605 | 1430 | 2,33 | 1,247 |
| Серебро, чистое | Ag | 1761 | 961 | 10. 49 49 | 5,525 |
| Серебро, стерлинговое серебро | – | 1640 | 893 | 10,36 | 5,457 |
| Серебро, Монета | – | 1615 | 879 | 10,31 | 5,430 |
| Олово | Sn | 450 | 232 | 7.30 | 3.846 |
| цинк | Zn | 787 | 419 | 7,10 | 3,7758 |
Каковы точки кипения и плавления меди? — Easierwithpractice.com
Каковы точки кипения и плавления меди?
Медь (Cu) в чистом виде — это красновато-коричневый металл с высокой пластичностью и ковкостью.Атомный вес 63,54, атомный номер 29, плотность 8,94 г / см3. Температура плавления составляет 1083 ° C с температурой кипения 2595 ° C.
Какова температура плавления меди?
1 984 ° F (1085 ° C)
Что такое точка плавления в градусах Цельсия?
Таблица Цельсия
| Цельсия (° C) | по Фаренгейту (° F) | Температура |
|---|---|---|
| 0 ° С | 32,0 ° F | точка замерзания / плавления воды |
| 21 ° С | 69.8 ° F | Комнатная температура |
| 37 ° С | 98,6 ° F | Средняя температура тела |
| 100 ° С | 212.0 ° F | точка кипения воды |
Что тает при градусах Цельсия?
Точки плавления различных металлов
| Точки плавления | ||
|---|---|---|
| Металлы | по Фаренгейту (ж) | по Цельсию (c) |
| Серебро, чистое | 1761 | 961 |
| Серебро, стерлинговое серебро | 1640 | 893 |
| Сталь углеродистая | 2500-2800 | 1371-1540 |
Что такое температура плавления ДНК?
Температура плавления (Tm) определяется как температура, при которой 50% двухцепочечной ДНК превращается в однониточную ДНК. Чем выше температура плавления, тем выше содержание гуанин-цитозина (ГЦ) в ДНК.
Чем выше температура плавления, тем выше содержание гуанин-цитозина (ГЦ) в ДНК.
В чем разница между температурой плавления и температурой кипения?
Постоянная температура, при которой твердое вещество превращается в жидкость, называется точкой плавления. Пример: кубики льда начинают таять и переходят из твердого состояния в жидкое при температуре 0 ° C. Постоянная температура, при которой жидкость начинает превращаться в газ, называется точкой кипения.
Означает ли более высокая точка кипения более высокая температура плавления?
Как и следовало ожидать, сила межмолекулярных водородных связей и диполь-дипольных взаимодействий отражается в более высоких температурах кипения.Применяются все те же принципы: более сильные межмолекулярные взаимодействия приводят к более высокой температуре плавления.
Что такое точка плавления и температура кипения воды?
Повышение температуры выше точки кипения, 212 ° F (100 ° C), приводит к превращению воды из жидкости в газ (водяной пар). Точки плавления / замерзания и кипения изменяются с давлением. При более низком давлении или на большей высоте точка кипения ниже. На уровне моря чистая вода кипит при 212 ° F (100 ° C).
Точки плавления / замерзания и кипения изменяются с давлением. При более низком давлении или на большей высоте точка кипения ниже. На уровне моря чистая вода кипит при 212 ° F (100 ° C).
Что имеет низкие температуры плавления и кипения?
Когда низкомолекулярные вещества плавятся или кипят, преодолеваются именно эти слабые межмолекулярные силы.Ковалентные связи не разрываются. Для преодоления межмолекулярных сил требуется относительно небольшая энергия, поэтому мелкомолекулярные вещества имеют низкие температуры плавления и кипения.
Что имеет более высокую температуру плавления и кипения?
металлов
Какие факторы влияют на температуру кипения?
Температура кипения жидкости зависит от температуры, атмосферного давления и давления пара жидкости. Когда атмосферное давление сравняется с давлением пара жидкости, начнется кипение.
Какое соединение имеет высокую температуру плавления и кипения?
Поскольку для разрушения этих сил необходимо подавать большое количество тепловой энергии, ионные соединения обычно имеют высокие температуры плавления и кипения. Например, NaCl, составная часть которого показана на Рисунке 1, имеет температуру плавления и кипения 801 ° C и 1465 ° C соответственно.
Например, NaCl, составная часть которого показана на Рисунке 1, имеет температуру плавления и кипения 801 ° C и 1465 ° C соответственно.
Почему соли имеют высокие температуры плавления и кипения?
Для преодоления сильных электростатических сил притяжения между противоположно заряженными ионами требуется много энергии, поэтому ионные соединения имеют высокие температуры плавления и кипения.Чем больше заряд на ионах, тем сильнее силы, удерживающие их вместе.
Почему у соли высокая температура кипения и высокая температура плавления?
Хлорид натрия также относится к ионным соединениям. Катион натрия (Na +) и анион хлорида (Cl-) образуют прочную ионную связь, разрушение которой требует много энергии. Отсюда высокая температура плавления и кипения. В результате электростатическое притяжение больше, ионная связь сильнее, температура плавления выше.
Почему температура плавления высокая?
Сила притяжения Сильное притяжение между молекулами приводит к более высокой температуре плавления. В общем, ионные соединения имеют высокие температуры плавления, потому что электростатические силы, связывающие ионы, — ион-ионное взаимодействие — являются сильными.
В общем, ионные соединения имеют высокие температуры плавления, потому что электростатические силы, связывающие ионы, — ион-ионное взаимодействие — являются сильными.
Какова температура кипения меди? — AnswersToAll
Какова температура кипения меди?
2562 ° C
Медь / точка кипения
Какова температура плавления твердой меди?
1084 ° C
Медь: 1084 ° C (1983 ° F)
Какова степень плавления меди?
1083 градуса Цельсия
Медь имеет относительно высокую температуру плавления — 1083 градуса Цельсия (1982 F), но если у вас есть подходящее оборудование, вы можете расплавить ее дома.
Где точка плавления меди?
1084,62 ° C
Точки плавления металлов и чистых элементов
| Атомный # | Элемент | Температура плавления (° C) |
|---|---|---|
| 24 | Хром | 1907 ° С |
| 27 | Кобальт | 1495 ° С |
| 29 | Медь | 1084,62 ° С |
| 96 | Кюрий | 1340 ° С |
Какой металл имеет самую высокую температуру кипения?
Вольфрам
Химическим элементом с самой низкой точкой кипения является гелий, а элементом с самой высокой точкой кипения является вольфрам.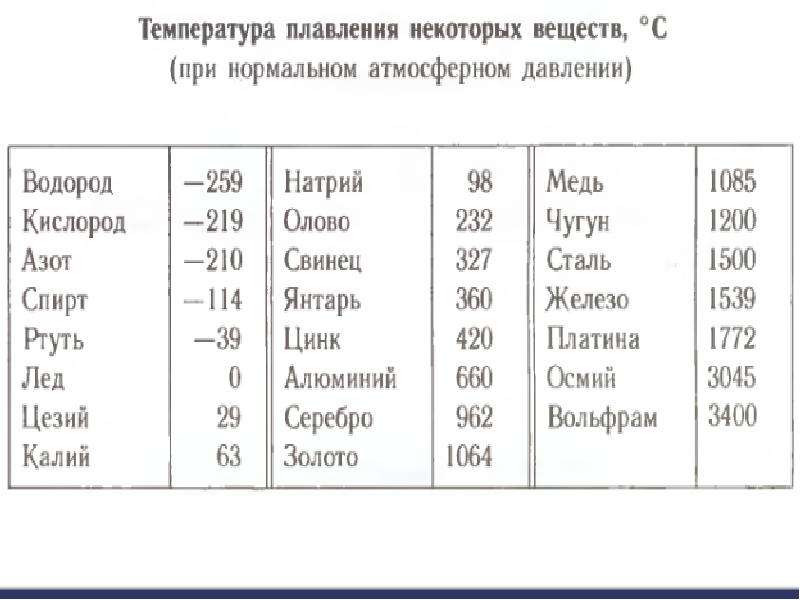
Можно ли плавить медь пропановой горелкой?
Чтобы плавить медь с пропаном в ремесленных целях, вам понадобится газовая печь, рассчитанная на плавку менее 500 граммов. Медь плавится при температуре около 2000 градусов по Фаренгейту, и вам нужно, чтобы ваша печь достигла этой температуры примерно за пять минут.
В каких предметах домашнего обихода больше всего меди?
Бытовая техника Холодильники, плиты и кондиционеры, в частности, являются отличными источниками меди, поскольку они требуют более мощного источника питания и, как правило, содержат толстый изолированный медный провод.
Можно ли плавить золото пропановой горелкой?
Многим нравится плавить его и делать свои собственные золотые творения. Поскольку золото имеет умеренно низкую температуру плавления металла, его можно плавить с помощью стандартной пропановой горелки. После расплавления золото можно заливать в формы для застывания или измельчать молотком на тонкие полоски.
Достаточно ли горячего пропана, чтобы плавить медь?
Медь плавится при температуре около 2000 градусов по Фаренгейту, и вы хотите, чтобы ваша печь достигла этой температуры примерно за пять минут.Теперь вы можете плавить медь для металлообработки без сильфона.
Какие предметы содержат больше всего меди?
Вот 8 продуктов с высоким содержанием меди.
- Печень. Мясные субпродукты, такие как печень, чрезвычайно питательны.
- Устрицы. Устрицы — это вид моллюсков, который часто считается деликатесом.
- Спирулина.
- Грибы шиитаке.
- Орехи и семена.
- Лобстер.
- Листовая зелень.
- Темный шоколад.
Какие предметы домашнего обихода сделаны из меди?
Как и ваша бытовая техника: холодильники, стиральные машины, сушилки, микроволновые печи и посудомоечные машины — все они содержат медную проводку. Из-за высокой степени теплопроводности меди резервуары для горячей воды покрыты медью, а бытовые нагревательные элементы, такие как печи и электрические чайники, изготовлены из меди.
Crucible 101: Температура плавления | Настольная печь
Тигель 101
Самый простой способ предоставить информацию о температурах плавления для различных распространенных металлов — это таблица, которую мы приводим ниже:
| Металл | Цельсия | Фаренгейта | ||
|---|---|---|---|---|
| Алюминий | 659 | 1218 | ||
| Латунь | 900-940 | 7 910-17824 | 900-940 | 7 910-17824 |
| Золото | 1063 | 1946 | ||
| Серебро | 961 | 1762 |
Как чистота влияет на температуры плавления и разливки?
Тем не менее, стоит упомянуть, что хотя это общие температуры плавления металлов (в зависимости от чистоты могут быть различия), существует другая температура заливки .При заливке в графитовую форму слишком горячий металл просачивается внутрь формы, а не затвердевает при контакте, оставляя шероховатую и неровную поверхность. Температура разливки будет выше, чем температура плавления (поскольку точная температура плавления также является температурой замерзания; металл должен успеть заполнить форму до затвердевания). Хитрость заключается в том, чтобы знать, при какой температуре находится металл внутри печь; Лучше всего выливать металл прямо из печи, если он не слишком горячий. В более совершенных печах для плавления металлов должен быть возможен лучший контроль температуры.Таблица для температур заливки :
Температура разливки будет выше, чем температура плавления (поскольку точная температура плавления также является температурой замерзания; металл должен успеть заполнить форму до затвердевания). Хитрость заключается в том, чтобы знать, при какой температуре находится металл внутри печь; Лучше всего выливать металл прямо из печи, если он не слишком горячий. В более совершенных печах для плавления металлов должен быть возможен лучший контроль температуры.Таблица для температур заливки :











 Сплавы слева или справа от этого эвтектического состава не изменяются напрямую из твердого состояния в жидкое, а проходят через «мягкий» диапазон, где сплав представляет собой комбинацию твердого и жидкого.
Сплавы слева или справа от этого эвтектического состава не изменяются напрямую из твердого состояния в жидкое, а проходят через «мягкий» диапазон, где сплав представляет собой комбинацию твердого и жидкого.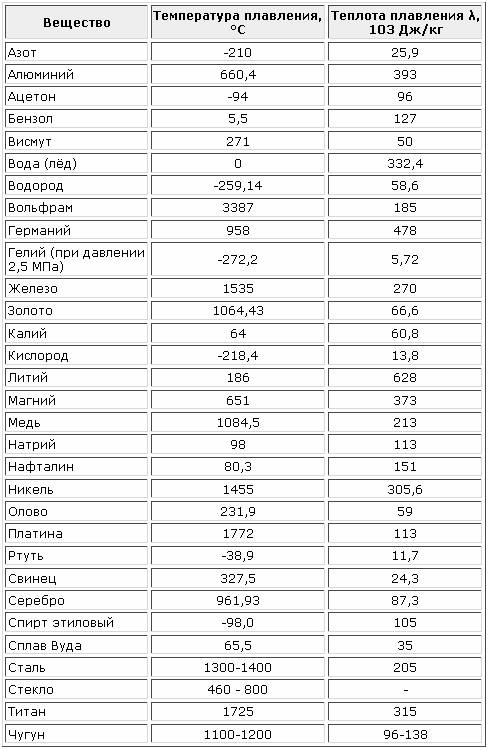 (A) В результате медленного нагрева AWS BAg-1 в печи не происходит ликвации с присадочными металлами, имеющими узкий интервал плавления 20 ° F (11 ° C). (B) В результате медленного нагрева AWS BAg-2 в печи остается большой череп из-за ликвации, вызванной широким диапазоном плавления 70 ° F (39 ° C). (C) В результате быстрого нагрева AWS BAg-2 остается небольшой череп.
(A) В результате медленного нагрева AWS BAg-1 в печи не происходит ликвации с присадочными металлами, имеющими узкий интервал плавления 20 ° F (11 ° C). (B) В результате медленного нагрева AWS BAg-2 в печи остается большой череп из-за ликвации, вызванной широким диапазоном плавления 70 ° F (39 ° C). (C) В результате быстрого нагрева AWS BAg-2 остается небольшой череп.  Поэтому важно выбрать присадочный металл, температура ликвидуса которого ниже температуры солидуса обоих соединяемых основных металлов.Перед тем, как приступить к пайке, следует учесть несколько других факторов. Примеры приведены ниже.
Поэтому важно выбрать присадочный металл, температура ликвидуса которого ниже температуры солидуса обоих соединяемых основных металлов.Перед тем, как приступить к пайке, следует учесть несколько других факторов. Примеры приведены ниже. Например, в сборке из нержавеющей стали, которая подвергается ступенчатой пайке, может быть Silvaloy 630, который плавится и течет между 1275 ° F-1475 ° F (690 ° C-801 ° C) для первого соединения, а затем Silvaloy 560 (1143 ° C). F-1205 ° F / 618 ° C-651 ° C) для второго стыка.
Например, в сборке из нержавеющей стали, которая подвергается ступенчатой пайке, может быть Silvaloy 630, который плавится и течет между 1275 ° F-1475 ° F (690 ° C-801 ° C) для первого соединения, а затем Silvaloy 560 (1143 ° C). F-1205 ° F / 618 ° C-651 ° C) для второго стыка. При выборе присадочного металла для пайки важно учитывать характер плавления, а именно температуру ликвидуса.
При выборе присадочного металла для пайки важно учитывать характер плавления, а именно температуру ликвидуса.
 При переработке алюминия, если он имеет широкий диапазон плавления, это означает, что в нем больше примесей.Чем больше уменьшается диапазон температур плавления, тем чище вещество.
При переработке алюминия, если он имеет широкий диапазон плавления, это означает, что в нем больше примесей.Чем больше уменьшается диапазон температур плавления, тем чище вещество.
 жидкий. Чтобы расплавить металл, его нужно нагреть до необходимой температуры — этот процесс называется
точка плавления.
жидкий. Чтобы расплавить металл, его нужно нагреть до необходимой температуры — этот процесс называется
точка плавления.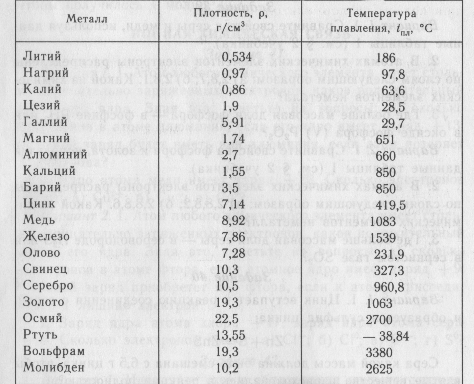

 9
9 5
5 2
2 6
6 134
134 2
2 2
2 4
4 6
6 6
6 4
4 6
6 6
6 2
2