Капиллярный метод контроля. Применение
- Главная
- Пресс-центр
- Статьи
- Капиллярный метод контроля. Применение
9 октября 2019
Статьи
Что такое капиллярный контроль?
Капиллярный контроль пенетрантами – это самый простой и самый распространенный из методов неразрушающего контроля по наличию дефектов невидимых невооруженным глазом на открытых поверхностях.
Распространенность данного метода обуславливается не своей экономичностью и быстротой, но и тем, что требует минимального обучения по сравнению с другими методами контроля.
Для чего используют жидкие пенетранты
Инспекция жидкими пенетрантами используется для обнаружения любых поверхностных неоднородностей, таких как усталостные трещины, трещины возникающие при закалке и шлифовании, а также пористости, расслоения (непровары) и дефектов имеющих выход на поверхность объектов контроля.
Где применяют капиллярный контроль
Может использоваться капиллярный контроль на таких материалах, как алюминий, магний, латунь, медь, чугун, сталь, нержавеющая сталь, карбиды, резина, стеллит, некоторые виды пластмасс и керамики.
Отметим, что несмотря на распространенное мнение, не только сварные швы являются наиболее часто проверяемым элементом. Капиллярный контроль применяют при дефектовке деталей, пластин, труб, отливок и поковок.
Метод испытания на проницаемость жидкости используется в таких сферах промышленности как судостроение, автомобилестроение и авиастроение, строительство аппаратов и резервуаров, производство деталей и запасных частей.
Как применяют пенетранты при капиллярном методе контроля
Сам процесс обнаружения дефектов капиллярным методом может проводиться при видимом дневном свете (красный проникающий краситель) и / или под УФ-светом с использованием флуоресцентных пенетрантов. Метод капиллярного контроля характерен тем, что, в отличие от контроля магнитных частиц (MT), дефекты или неровности могут быть доказаны и на немагнитных материалах. При таком методе тестирования очень важен правильный выбор самого пенетранта.
|
|
|
|
Тест на проникновение |
Тест на проникновение |
Виды пенетрантов
Все представленные у нас пенетранты классифицируются по уровням чувствительности.
Пенетрант красного цвета (видимый краситель) — имеет довольно низкую чувствительность.
Красный и флуоресцентный пенетрант, смывается водой и растворителем. Тип III согласно EN 571-1
- На основе минерального масла. Содержит гликоль
- Подходит для всех металлов. Без аэо-красителей
- Удобный в применении на особо гладких поверхностях (низкое поверхностное натяжение пенетранта)
Протестирован и одобрен в диапазоне рабочих температур: от -30 °C (пенетрант MR 312) от -10 °C (для остальных) до +50 °C, в комбинации с очистителями MR 79, MR 85, MR 88 и проявителем MR 70
Флуоресцентный пенетрант — содержит два или более красителей (обычно зелено-желтого цвета) — является наиболее чувствительным для выявления самых мелких дефектов.
- Водостойкий флуоресцентный пенетрант, тип I согласно DIN EN ISO 3452-1: 2013
- Без минерального масла
- Очень хорошая биоразлагаемость в соответствии с EN ISO 9888
- Подходит для всех металлов
- Температура обработки от +10 до + 50 ° C
Так же, пенетранты делятся в зависимости от того, как они удаляются с поверхности, после получения результата. Пенетранты могут быть моющимися (удаляются водой), удаляются растворителем или специальным эмульгатором, который является липофильным (на масляной основе) или гидрофильным (на водной основе).
Пенетранты могут быть моющимися (удаляются водой), удаляются растворителем или специальным эмульгатором, который является липофильным (на масляной основе) или гидрофильным (на водной основе).
При выборе уровня чувствительности необходимо учитывать множество факторов, в том числе условия, в которых будет проводиться испытание, чистота поверхности образца и размер искомых дефектов.
Преимущества капиллярного контроля:
- Высокая чувствительность (могут быть обнаружены небольшие разрывы, трещины)
- Отсутствие ограничений по материалу (могут быть проверены металлические и неметаллические, магнитные и немагнитные, а также проводящие и непроводящие материалы)
- Экспресс-проверка больших площадей и объемов (экономия времени и средств)
- Подходит для деталей сложной формы
- Оценка производятся непосредственно на поверхности детали и представляют собой полную визуализацию дефекта поверхности
- Портативный (материалы доступны в аэрозольных баллончиках)
- Низкая стоимость (материалы и сопутствующее оборудование относительно недороги)
Начните сотрудничество с индивидуальной консультации по подбору инструментов и услуг. | Заказать услугу |
Подписаться на
рассылку
Будьте в курсе последних новостей отрасли
Подписаться
Публикации
Товары
Поделиться
Назад к списку
Капиллярный контроль — виды, особенности и этапы
- Главная
- Поддержка
- Статьи
- Капиллярный контроль — виды, особенности и этапы
25.10.2016
Капиллярный контроль сварных соединений
Капиллярный метод контроля основан на проникновении индикаторной жидкости (пенетранта) в поверхностные дефекты и последующей регистрации индикаторных следов визуальным способом или с помощью дополнительных средств.
Требования к капиллярному контролю
Данный способ неразрушающего контроля используется только при наличии поверхностных или сквозных дефектов. Необходимыми условиями успешного проведения капиллярной дефектоскопии являются отсутствие загрязнения на поверхности объекта, хорошая смачиваемость пенетрантом поверхности контроля, при этом глубина дефекта (несплошности) должна значительно превышать ширину ее раскрытия.
Необходимыми условиями успешного проведения капиллярной дефектоскопии являются отсутствие загрязнения на поверхности объекта, хорошая смачиваемость пенетрантом поверхности контроля, при этом глубина дефекта (несплошности) должна значительно превышать ширину ее раскрытия.
Этапы проведения капиллярного контроля
- Подготовка объекта к контролю. Включает в себя: очистку поверхности измеряемого объекта и измеряемых дефектов (снятие загрязнений, лакокрасочных покрытий), сушка поверхности перед нанесением пенетрантов.
Способы подготовки:- механический — очистка струёй абразивного материала (песком, дробью, косточковой крошкой) или механической обработкой;
- паровой — очистка при помощи паров органических растворителей;
- растворяющий — очистка промывкой, протирка с применением воды, водных моющих растворов или легколетучих растворителей;
- химический — очистка жидкими химическими реактивами;
- электрохимический — очистка водными растворами химических реактивов с одновременным воздействием электрического тока;
- ультразвуковой — очистка растворителями, водой или водными растворами химических соединений в ультразвуковом поле с использованием ультразвукового капиллярного эффекта;
- анодно-ультразвуковой — очистка водными растворами химических реактивов с одновременным воздействием ультразвука и электрического тока;
- тепловой — очистка прогревом при температуре, не вызывающей недопустимых изменений материала контролируемого объекта и окисления его поверхности;
- сорбционный — очистка смесью сорбента и быстросохнущего органического растворителя, наносимой на очищаемую поверхность, выдерживаемой и удаляемой после высыхания.

Необходимые способы очистки, их сочетание и требуемую чистоту контролируемых поверхностей определяют в технической документации на контроль. При заданном высоком классе чувствительности контроля предпочтительны не механические, а химические и электрохимические способы очистки, в том числе с воздействием ультразвука или электрического тока. Эффективность этих способов обусловлена оптимальным выбором очищающих составов, режимов очистки, сочетанием и последовательностью используемых способов очистки, включая сушку.
- Нанесение дефектоскопических материалов. Заключается в нанесении индикаторных жидкостей (пенетрантов) на поверхности и в полости дефектов и удалении излишка пенетрантов.
Способы нанесения:- капиллярный — самопроизвольное заполнение полостей дефектов индикаторным пенетрантом, наносимым на контролируемую поверхность смачиванием, погружением, струёй, распылением сжатым воздухом, хладоном или инертным газом;
- вакуумный — заполнение полостей дефектов индикаторным пенетрантом при давлении в их полостях менее атмосферного;
- компрессионный — заполнение полостей дефектов индикаторным пенетрантом при воздействии на него избыточного давления;
- ультразвуковой — заполнение полостей дефектов индикаторным пенетрантом в ультразвуковом поле с использованием ультразвукового капиллярного эффекта;
- деформационный — заполнение полостей дефектов индикаторным пенетрантом при воздействии на объект контроля упругих колебаний звуковой частоты или статического нагружения, увеличивающего минимальный размер дефектов.

Способ нанесения
- Обнаружение дефектов и расшифровка полученных данных.
- Очистка объекта
Гост капиллярный метод контроля
Капиллярная дефектоскопия регламентируется по ГОСТ 18442-80 «Контроль неразрушающий. Капиллярные методы» и ГОСТ 24522-80 «Контроль неразрушающий капиллярный. Термины и определения».
К списку статей
Капиллярный метод неразрушающего контроля — презентация онлайн
Похожие презентации:
Технология перевозочного процесса
Организация работы и расчет техникоэкономических показателей участка механической обработки детали
Грузоподъемные машины.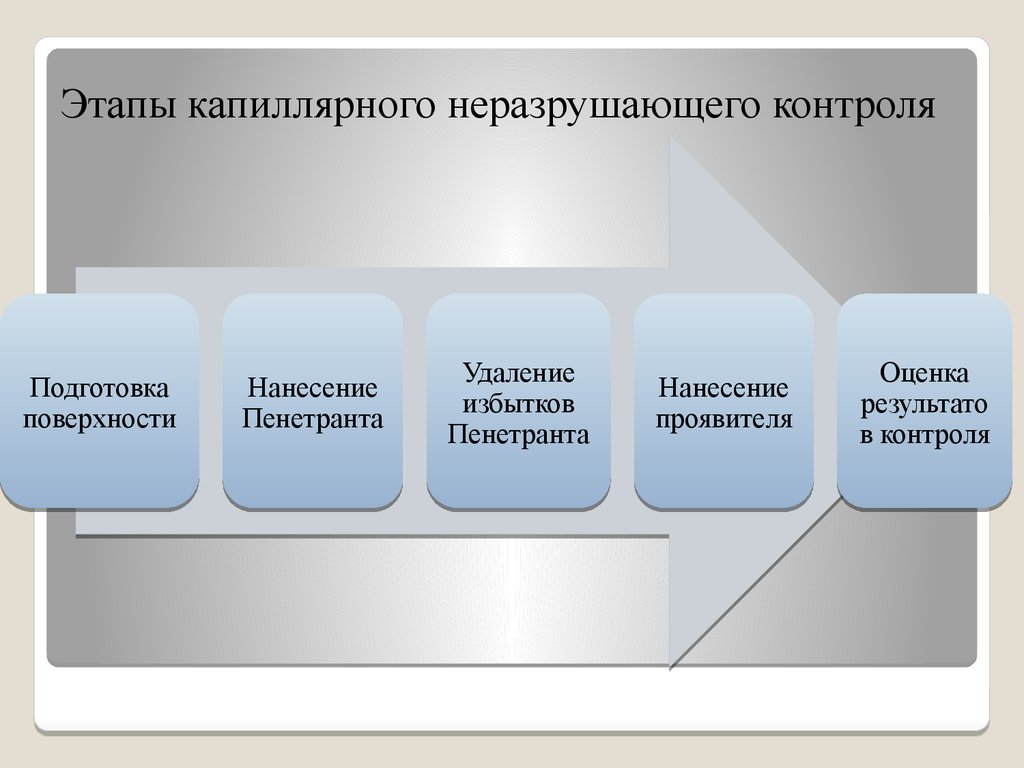 (Лекция 4.1.2)
(Лекция 4.1.2)
Безопасное проведение работ на высоте
Геофизические исследования скважин
Система охлаждения ДВС
Эксплуатация нефтяных и газовых скважин. Курс лекций в слайдах
Требования безопасности при выполнении работ на высоте
Проект по технологии «Скалка» (6 класс)
Конструкции распределительных устройств. (Лекция 15)
1. Капиллярный метод неразрушающего контроля
Выполнил: магистрант гр М-61Калугина А.В.
Проверил: Кононова М.С.
2. Неразрушающий контроль
Неразрушающий контроль (НК) — область науки и техники,охватывающая исследования физических принципов, разработку,
совершенствование и применение методов, средств и технологий
технического контроля объектов, не разрушающего и не
ухудшающего их пригодность и эксплуатацию.
Неразрушающие методы контроля (дефектоскопия) –методы
контроля материалов (изделий), используемые для обнаружения
нарушения сплошности или однородности макроструктуры,
отклонений химического состава (дефектов) и других целей, не
требующих разрушения образцов материала и/или изделия в
целом.

3. Перечень объектов контроля
1.2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
Системы газоснабжения (газораспределения).
Подъемные сооружения.
Объекты горнорудной промышленности.
Объекты угольной промышленности.
Оборудование нефтяной и газовой промышленности.
Оборудование металлургической промышленности.
Оборудование взрывопожароопасных и химически опасных
производств.
Объекты железнодорожного транспорта.
Объекты хранения и переработки зерна.
Здания и сооружения (строительные объекты).
Оборудование электроэнергетики.
5. Метод капиллярного контроля
Капиллярная дефектоскопия – метод контроля,основанный
на
проникновении
определенных
контрастных веществ в поверхностные дефектные слои
контролируемого изделия под действием капиллярного
(атмосферного) давления, в результате последующей
обработки
проявителем
повышается
светои
цветоконтрастность дефектного участка относительно
неповрежденного, с выявлением количественного и
качественного состава повреждений
6.
 Физические основы капиллярного контроляМетод контроля проникающими веществами является одним
Физические основы капиллярного контроляМетод контроля проникающими веществами является однимиз методов неразрушающего контроля, при котором дефекты
материала, выходящие на поверхность, делаются видимыми.
Принцип контроля проникающими веществами основывается
на том, что жидкость — проникающее вещество — проникает в
дефекты твердого материала выходящие на поверхность.
7. Методы капиллярного контроля
1.2.
Метод проникающих растворов — жидкостный
метод капиллярного неразрушающего контроля,
основанный на использовании в качестве
проникающего вещества жидкого индикаторного
раствора.
Метод фильтрующихся суспензий — жидкостный
метод капиллярного неразрушающего контроля,
основанный на использовании в качестве жидкого
проникающего вещества индикаторной суспензии,
которая образует индикаторный рисунок из
отфильтрованных частиц дисперсной фазы.
Капиллярный метод контроля используется в следующих целях:
1.
 обнаружение слабовидимых или невидимых поверхностных, а
обнаружение слабовидимых или невидимых поверхностных, атакже сквозных недостатков изделия, к которым можно отнести
трещины, непровары, поры, свищи, межкристаллическую
коррозию и т. п.;
2. определение положения таких дефектов на изделии, их
ориентации и протяженности по поверхности.
Все капиллярные методы неразрушающего контроля могут
применяться для исследования изделий, изготовленных из
различных материалов: стекла, керамики, пластмассы, металла
(черного и цветного). Такие изделия могут иметь всевозможные
формы
и
размеры,
изготавливаться
для
авиационной,
ракетостроительной
и
судостроительной
промышленности,
металлургической, химической, энергетической отраслей и др .
9. Этапы капиллярного неразрушающего контроля
Подготовкаповерхности
Нанесение
Пенетранта
Удаление
избытков
Пенетранта
Нанесение
проявителя
Оценка
результато
в контроля
Предварительная очистка
Механически, щеткой
Струйным методом
Обезжиривание горячим
паром
Очистка растворителем
Предварительная просушка
Нанесение пенетранта
Погружение в ванну
Нанесение кистью
Нанесение из аэрозоли /
распылителя
Нанесение
электростатическим
способом
Промежуточная очистка
Пропитанной водой не
ворсистой тканью или
губкой
Пропитанной водой
кистью
Сполоснуть водой
Пропитанной
специальным
растворителем не
ворсистой тканью или
губкой
Сушка
Высушить на воздухе
Протереть не ворсистой
тканью
Обдуть чистым, сухим
воздухом
Высушить теплым
воздухом
Нанесение проявителя
Погружением
(проявитель на водной
основе)
Нанесение из аэрозоли /
распылителя (проявитель
на спиртовой основе)
Электростатическое
нанесение (проявитель на
спиртовой основе)
Нанесение сухого
проявителя (при сильной
пористости поверхности)
Проверка поверхности и
документирование
Контроль при дневном
или искусственном
освещении мин.

500 Lux(EN 5711/EN3059)
При использовании
флуоресцентного
пенетранта:
Освещение: < 20 Lux
Интенсивность УФ:
1000μW/cm2
Документация на
прозрачной пленке
Фотооптическое
документирование
Документирование с
помощью фото- или
видеосъемки
На контролируемой поверхности не допускается наличие заусенцев,
сварочных брызг, наплывов пайки, окалины, шлака, ржавчины, подрезов,
а также лакокрасочных покрытий, окисной пленки, органических
веществ (жир, масло) и других загрязнений.
Механическая отчистка
поверхности
Распыление
отчистителя
Высушивание
поверхности
12. Применение Пенетранта
Распыление Пенетрантана подготовленную поверхность
Проникновение Пенетранта в
дефекты
13. Удаление Пенетранта
Удаление Пенетранта сухойили смаченной очистителем
салфеткой
Поверхность отчищена, а Пенетрант
остался внутри
14. Применение проявителя
Встряхиваем емкостьс проявителем
Проявитель напыляется
в 2 – 3 слоя с расстояния
20 – 30 см.

Проявитель напыляется
в 2 – 3 слоя с расстояния
20 – 30 см.
15. Оценка результатов контроля
Выявление дефектов можно производить через 5 минут послевысыхания проявителя. Скорость проявления, глубина цвета, так
же как и рисунок индикаторного следа указывает на тип дефекта.
Красные линии показывают трещины, складки, отсутствие
сплавления. Тонкие трещины проявляются в виде точек,
образующих прямую или кривую линию. Пористость проявляется
в виде рассеянных красных точек.
Признак дефекта
в сварном шве
Наличие трешин
Наличие тонкой
трешины
Наличие пористости
16. Применение флуоресцентных Пенетрантов
В состав Пенетранта могут входить специальные флуоресцентныевещества, т.е. вещества, дающие яркое свечение при облучении их
ультрафиолетовым светом. При использовании флуоресцентных
Пенетрантов этапы подготовки поверхности, нанесения Пенетранта и
нанесения Проявителя не отличаются от соответствующих этапов при
цветном капиллярном контроле.
 Имеются отличия в стадиях удаления
Имеются отличия в стадиях удаленияПенетранта и оценки результатов контроля. Эти этапы проводятся при
ультрафиолетовом освещении в затемненном помещении.
При
применении
флуоресцентных
Пенетрантов
дефекты проявляются под
ультрафиолетовом
свете
в
виде
яркосветящихся линий
17. Выбор метода капиллярного контроля
Важными преимуществами, ведущими к использованиюкапиллярного метода контроля, являются следующие:
1. контроль всей поверхности;
2. контроль сильно деформированных частей;
3. массовый контроль деталей;
4. контроль больших изделий;
5. контроль деталей из различного материала;
Методы капиллярного контроля, используемые в
промышленных отраслях
English Русский Правила
Капиллярный метод контроля сварных швов
Контроль сварных швов является основным способом определить их качества.
Существует несколько технологических контрольных методов, которые сегодня применяются при проверке сварочных швов, основной из них – капиллярный контроль. Он является неразрушающим и включает в себя несколько вариантов проведения данного процесса с использование разных расходных материалов. С его помощью определяются наружные поверхностные и внутренние дефекты или их отсутствие, а также изменения в зоне нагрева двух соединяемых заготовок.
Он является неразрушающим и включает в себя несколько вариантов проведения данного процесса с использование разных расходных материалов. С его помощью определяются наружные поверхностные и внутренние дефекты или их отсутствие, а также изменения в зоне нагрева двух соединяемых заготовок.
Капиллярным контролем сварных соединений можно выявить практически все дефекты шва: поры, трещины, раковины, прожоги и непровары. Можно определить, как расположен дефект в плане его ориентации к поверхности сварного шва, можно определить размеры изъянов. Капиллярный метод контроля используется при сварке любых металлов (черных и цветных), пластмасс, стекла, керамики и так далее. То есть, это контроль имеет обширную область применения при определении дефектов в сварочных швах.
Суть всего контрольного процесса заключается в том, что, используя специальные жидкости (индикаторы), которые имеют свойство глубоко проникать в любые материалы, если в них есть пустоты, просачиваться сквозь него и появляться на противоположной стороне от места их нанесения. То есть, проникая в тело металла, индикаторные жидкости оставляют следы, по которым и определяются дефекты. Такие следы можно обнаружить визуально, а можно использовать для их определения специальные приборы преобразователи. Все современные методы контроля сварных швов капиллярным способом регламентируются ГОСТами.
То есть, проникая в тело металла, индикаторные жидкости оставляют следы, по которым и определяются дефекты. Такие следы можно обнаружить визуально, а можно использовать для их определения специальные приборы преобразователи. Все современные методы контроля сварных швов капиллярным способом регламентируются ГОСТами.
Содержание
- 1 Классификация капиллярного контроля
- 2 Как применяется технология капиллярной дефектоскопии
- 2.1 Подготовка сварного шва к контролю
- 2.2 Нанесение индикатора
- 2.3 Очистка от индикатора
- 2.4 Нанесение проявителя
- 2.5 Способы выявления дефектов сварного шва
- 3 Повторный контроль
- 4 Контроль капиллярный керосином
Классификация капиллярного контроля
Существует две категории капиллярного контроля сварных швов: основные и комбинированные. Первый подразумевает под собой чисто капиллярный контроль, второй – это объединение нескольких неразрушающих способов контроля, в состав которых входит и капиллярный.
К основным методам можно отнести:
- В зависимости от того, какой проникающий раствор для этого используется: это растворы и фильтрующие суспензии.
- В зависимости от того, каким способом считывать получаемую информацию: цветовой (он же хроматический), яркостный (он же ахроматический), люминесцентный и люминесцентно-хроматический.
К комбинированным: электростатический, магнитный, электроиндукционный, радиационная технология поглощения или излучения. Во всех них используются проникающие индикаторные жидкости, то есть, применяется капиллярный вариант, но считывание информации происходит по-разному. В основном же на группы эта категория делится по характеру воздействия на поверхность сварного шва.
Как применяется технология капиллярной дефектоскопии
В принцип метод достаточно прост. Необходимо поверхность сварочного шва очистить и хорошо высушить. После этого на нее наносится проникающая жидкость, остатки которой через некоторое время надо полностью удалить. Остальная же часть проникнет внутрь тела металла. Далее на обработанную поверхность наносится проявитель, который просто вытянет из дефектов оставшуюся в металле жидкость. Она проявится на поверхности в виде рисунков, которые и обозначат количество, форму и вид изъяна. Но это просто всего лишь на словах. Сам же процесс – достаточно серьезное мероприятия, поэтому к нему надо относиться со всем внимание и точно следовать технологически этапам, принимая во внимание нюансы.
Остальная же часть проникнет внутрь тела металла. Далее на обработанную поверхность наносится проявитель, который просто вытянет из дефектов оставшуюся в металле жидкость. Она проявится на поверхности в виде рисунков, которые и обозначат количество, форму и вид изъяна. Но это просто всего лишь на словах. Сам же процесс – достаточно серьезное мероприятия, поэтому к нему надо относиться со всем внимание и точно следовать технологически этапам, принимая во внимание нюансы.
Подготовка сварного шва к контролю
Как и в случае со сваркой, металл соединения необходимо очистить от всех загрязнений. Для этого можно использовать химический способ или механический, обычно, как показывает практика, специалисты применяют комбинацию из двух вариантов. То есть, зачищают металлическую поверхность наждачкой или железной щеткой, а после обрабатывают растворителем или спиртом.
Правда, механическую чистку рекомендуется применять лишь в том случае, если валик имеет пористую поверхность, или она имеет перепады и глубокие подрезы. Все дело в том, что поверхностные дефекты сварного шва при обработке жесткими материалами затираются, поэтому и не проявляются после их обработки проникающими жидкостями.
Все дело в том, что поверхностные дефекты сварного шва при обработке жесткими материалами затираются, поэтому и не проявляются после их обработки проникающими жидкостями.
Что касается химикатов, которые используются для чистки поверхности шва, то их необходимо обязательно после окончания чистящего процесса удалять тепловой водой или другими реагентами. Просто они могут вступать в реакцию с жидкостями для контроля, тем самым выдавая неверные показатели. И последнее – это хорошо просушить поверхность металла. Таким образом, достигается полное отсутствие воды и растворителей.
Нанесение индикатора
Существует несколько способов нанесения индикаторной жидкости.
- Обычный капиллярный метод – это когда жидкость наносится на проверяемую поверхность, и она сама по капиллярам металла проникает внутрь валика. Нанесение может производиться обычным смачивание, капельным распылением или струей, погружением сваренных заготовок в индикаторную жидкость.
- Компрессионный – это когда жидкость подается на поверхность сварного шва под давлением.
 Таким образом, она быстрее проникает внутрь дефектов, вытесняя из них воздух.
Таким образом, она быстрее проникает внутрь дефектов, вытесняя из них воздух. - Вакуумный – это противоположность компрессионному. В данном случае заготовки помещаются в вакуумную установку, вследствие чего из пор, раковин и трещин отсасывается воздух. Далее наносится жидкий индикатор, который заполняет их, потому что внутри полостей давление намного меньше, чем атмосферное.
- Деформационный. На индикатор воздействуют, к примеру, звуковыми волнами, под действием которых он и проникает внутрь металла. При этом размер изъяна немного увеличивается, то есть, происходит его деформация.
- Ультразвуковой – это когда заполнение производится под действием ультразвука.
Все данные способы проникновения жидкости в тело металла должны производиться при температуре 10-50С.
Очистка от индикатора
Проводя очистку поверхности валика, необходимо понимать, что нельзя удалять жидкость с поверхностных дефектов. Чем можно чистить.
- Теплой водой, температура которой не превышает +50С.
 Это можно проводить при помощи тряпки или губки.
Это можно проводить при помощи тряпки или губки. - Растворителем. Сначала поверхность высушивают, а затем тряпкой, смоченной в растворителе, производится протирание поверхности.
- Эмульгаторами: на водной или масляной основе. Сначала удаляется с поверхности проникающая жидкость, и сразу наносятся эмульгаторы, которые снимаются тряпкой.
- Комбинированный вариант. Сначала поверхность омывается водой, после используется растворитель.
Обязательно поверхность сварочного шва после чистки индикаторной жидкости высушивается. Здесь можно использовать разные методы, главное – не повышать температуру валика выше +50С. К примеру, можно просто протереть поверхность неворсистой тряпочкой, можно просто нагреть заготовки, или использовать фен для удаления влаги.
Нанесение проявителя
Этот процесс в технологии капиллярного контроля сварных соединений должен проводиться сразу же после окончания сушки металла после очищения его поверхности. Для этого можно использовать разные проявители.
- Сухой. Его наносят на поверхность равномерным слоем без утолщений или снижения толщины. Для этого обычно используется обычное напыление. Важно – данный вид проявителя применяется только в сочетании флуоресцентными индикаторами.
- Жидкий на основе водной суспензии. Его наносят или методом распыления, или замачиванием валика, путем утопления свариваемых заготовок в жидкий проявитель. Важно – утопление производится в самые короткие сроки, после чего вся жидкость удаляется методом принудительной просушки.
- Жидкий на основе растворителя. Наносится обычным распылением так, чтобы слой проявителя на поверхности остался равномерным.
- Жидкий в виде водного раствора. Все то же самое, что и в случае проявителя на основе суспензии.
Обычно процесс проявления длиться 10-30 минут в зависимости от выбранного материала. Если появляется необходимость, то время можно увеличить.
Способы выявления дефектов сварного шва
Процесс выявления можно начинать сразу после нанесения проявителя. Но лучше, если после того как полностью закончится процесс проявления. Для этого можно использовать увеличительные стекла (лупы) или специальные очки.
Но лучше, если после того как полностью закончится процесс проявления. Для этого можно использовать увеличительные стекла (лупы) или специальные очки.
Если капиллярная дефектоскопия сварного шва проводилась с помощью флуоресцентных индикаторов, то использовать для контроля специальные очки фотохроматического типа не надо. Просто оператор должен проводить контроль в темном помещении. Он должен в него войти и в течение 5 минут привыкнуть к темноте. После чего и начать процесс выявления дефектов. Сам контроль проводится под действием ультрафиолетового освещения. Оно может быть общим или зонированным (освещается только участок, где лежит сваренная конструкция). Самое важное, чтобы в поле зрения оператора не попадали отсвечивающие предметы, их просто не должно быть в помещении.
Если используются цветные индикаторы, то их проявление можно наблюдать и при дневном, и при искусственном свете. Главное, чтобы на поверхности контролируемого металла не было бликов, а мощность светового потока составляло не менее 500 лк.
Повторный контроль
Если по каким-то причинам итоги капиллярного контроля оказались неудовлетворительными, то можно провести повторный контроль. Он проводится точно так же, как и первый, с использованием все тех же технологий и индикаторов. Нельзя использовать индикаторные жидкости другой марки от другого производителя. Самое важное – это очистить металлическую поверхность от старых материалов (проявителя и индикатора). Все остальные действия от очистки до проявления проводятся точно также.
Контроль капиллярный керосином
Керосин является полярно-активной жидкостью с низкой вязкостью, отсюда и большая его проникающая способность. Обычно с его помощью выискиваются дефекты сварных швов диаметром 0,1 мм при толщине стыка в 25 мм. И раньше, и сейчас керосин используется для контроля сварки резервуаров, которые работают под давлением. Сам процесс достаточно простой.
Для этого понадобиться керосин и меловой раствор, который наносится на обратную сторону сварного шва. По сути, раствор будет выполнять функции индикатора, на котором проявятся керосиновые пятна. Саму жидкость можно распылить на поверхность, смочить ею валик или просто уложить по стыку смоченную в керосине ленты или тряпку. После определенного времени с обратной стороны начнут проявляться масляные пятна, хорошо видимые на меловой поверхности. Нередко в керосин добавляют яркие пигменты, чтобы увеличить чувствительность контроля.
По сути, раствор будет выполнять функции индикатора, на котором проявятся керосиновые пятна. Саму жидкость можно распылить на поверхность, смочить ею валик или просто уложить по стыку смоченную в керосине ленты или тряпку. После определенного времени с обратной стороны начнут проявляться масляные пятна, хорошо видимые на меловой поверхности. Нередко в керосин добавляют яркие пигменты, чтобы увеличить чувствительность контроля.
Как и все капиллярные способы контроля с использование индикаторных жидкостей, керосин наносится на испытуемые поверхности сварных валиков разными способами.
- Вакуумным, для чего используются специальные вакуумные установки переносного типа. Их устанавливают со стороны нанесенной меловой смеси.
- Пневматический. Поверхность валика, смоченную керосином, обдувают потоком сжатого воздуха при давлении 0,3-0,4 МПа.
- Вибрационный. Проникновение материала проходит под действием ультразвуковых колебаний.
Используя керосин при капиллярном контроле сварочных швов, необходимо применять материал с большой чистотой. Ведь примеси только увеличивают вязкость керосина, что делает его проникающие свойства низкими. А это может привести к неопределению самых маленьких дефектов, что отразиться на искаженной информации о качестве сварочного шва.
Ведь примеси только увеличивают вязкость керосина, что делает его проникающие свойства низкими. А это может привести к неопределению самых маленьких дефектов, что отразиться на искаженной информации о качестве сварочного шва.
Капиллярные способы контроля на сегодняшний день считаются самыми простыми, но в то же время самыми дешевыми и эффективными. Именно поэтому они чаще других способов сегодня используются при проверке сварочных конструкций
Капиллярный метод контроля и диагностики
Капиллярный метод контроля (eng. penetrant testing) — это универсальный метод в сфере неразрушающего контроля и диагностики, основанный на процессе проникновения пенетрантных / капиллярных жидких веществ в поверхностные/сквозные дефекты (трещины), несплошности на поверхности металлов, некоторых пластиков и керамических материалов, стекла и т. д., при условии, что несплошности открыты для поверхности, в результате чего повышается свето- и цветоконтрастность дефектного участка относительно неповрежденного.
Капиллярный метод контроля (eng. penetrant testing) — это универсальный метод в сфере неразрушающего контроля и диагностики, основанный на процессе проникновения пенетрантных / капиллярных жидких веществ в поверхностные/сквозные дефекты (трещины), несплошности на поверхности металлов, некоторых пластиков и керамических материалов, стекла и т. д., при условии, что несплошности открыты для поверхности, в результате чего повышается свето- и цветоконтрастность дефектного участка относительно неповрежденного.
Сама процедура капиллярного контроля основана на том факте, что красный или зеленый флуоресцентный пенетрант (благодаря своим специфическим характеристикам) не только оптимально распределяется по поверхности, но и проникает в каждую неоднородность, открытую на поверхности.
Капиллярный метод контроля соответствует ГОСТ 18442-8 и EN ISO 3452-1:201
Определение технических терминов
Пенетрант (лат. penetratio — проникать) — жидкое вещество со специализированным химико-физическим составом, применяемое в методе контрастной и люминесцентной дефектоскопии. Обычные пенетранты дают окрашенный индикаторный след дефекта при наблюдении в обычном освещении (дневной свет, лампы накаливания) , а люминесцентные светятся при освещении в ультрафиолетовом свете. Так же широко применяют комбинированный метод работы с пенетрантами.
penetratio — проникать) — жидкое вещество со специализированным химико-физическим составом, применяемое в методе контрастной и люминесцентной дефектоскопии. Обычные пенетранты дают окрашенный индикаторный след дефекта при наблюдении в обычном освещении (дневной свет, лампы накаливания) , а люминесцентные светятся при освещении в ультрафиолетовом свете. Так же широко применяют комбинированный метод работы с пенетрантами.
Очиститель – материал, предназначенный для удаления избытка индикаторного пенетранта с поверхности объекта контроля перед нанесением проявителя.
Проявитель — это белый сорбент, представленный (обычно) в форме порошка или суспензии, который предназначенный для извлечения (за счет капиллярных сил) индикаторного пенетранта из капиллярной полости несплошности (трещины) с целью образования четкого индикаторного рисунка и создания контрастирующего с ним фона. Так же, по цвету проявитель создает контрастный для глаза рисунок на поверхности контролируемого объекта для уверенного обнаружения индикаторных следов дефектов.
Эмульгатор (или гаситель пенетранта по ГОСТ 18442-80) — это дефектоскопический материал для капиллярного контроля, применяемый для промежуточной очистки поверхности при использовании постэмульгируемого пенетранта. В процессе эмульгирования оставшийся на поверхности пенетрант взаимодействует с эмульгатором. Впоследствии, полученная смесь удаляется водой. Целью процедуры является очистка поверхности от избытка пенетранта.
Различают пенетранты по колористическим и физическим признакам индикаторного пенетранта
| Физическое состояние | Колористический признак | Описание |
| Раствор | Ахроматический | Черный, серый, бесцветный |
| Цветной | Характерный цветовой тон при наблюдении в видимом излучении | |
| Люминесцентный | Представляет видимое излучение под действием длинноволнового ультрафиолетового излучения | |
| Люминесцентно-цветной | Имеет характерный цветовой тон при наблюдении в видимом излучении и люминесцирует под воздействием длинноволнового ультрафиолетового излучения | |
| Суспензия | Люминесцентный или цветной | Скопление люминесцентных или цветных частиц суспензии в устье дефекта |
Метод капиллярного контроля универсален тем, что не требует особого длительного обучения, а так же экономичен и менее опасен в сравнении с другими способами контроля и диагностики.
Сферы применения
Капиллярный метод применяют впри контроле сварных швов, литых деталей, в таких отрослях как:
●судостроении
●автомобиле
●авиастроении
●приборостроении
●резервуаростроении
● нефтегазовая отрасль
Капиллярная дефектоскопия может проводиться при дневном свете (красный пенетрант) и/или в УФ-свете флуоресцентными пенетрантами.
Процедура контроля капиллярным методом
Применение капиллярного метода тестирования состоит из четырех отдельных этапов обработки, для которых необходимы следующие продукты:
- Предварительная очистка (MR ® Remover)
- Нанесение пенетранта (MR ® Penetrant)
- Удаление излишков пенетранта (MR ® Remover или вода)
- Применение проявителя (MR® Developer белый)
Разберем каждый этап подробнее.
1. Предварительная очистка.
Необходимо провести предварительную очистку поверхности и непосредственно самой полости дефекта от загрязнений, жира, лакокрасочных покрытий и других материалов, путем их механического удаления и/или при помощи специальных растворителей (очистителей). Неорганические загрязнения требуют преимущественно механической очистки, а органические – применения специальных составов (очистителей). Таким образом мы подготавливаем контролируемую поверхность (деталь) к следующему этапу и обеспечиваем необходимый контакт пенетранта с материалом для беспрепятственного проникновения в полость дефекта.
2. Нанесение пенетранта.
Нанесение пенетранта может проводиться распылением, капиллярным, вакуумным, компрессионным и другими способами. Наиболее распространен капиллярный способ, при котором происходит заполнение полостей пенетрантом при смачивании поверхности с помощью распыления или нанесения кистевым способом.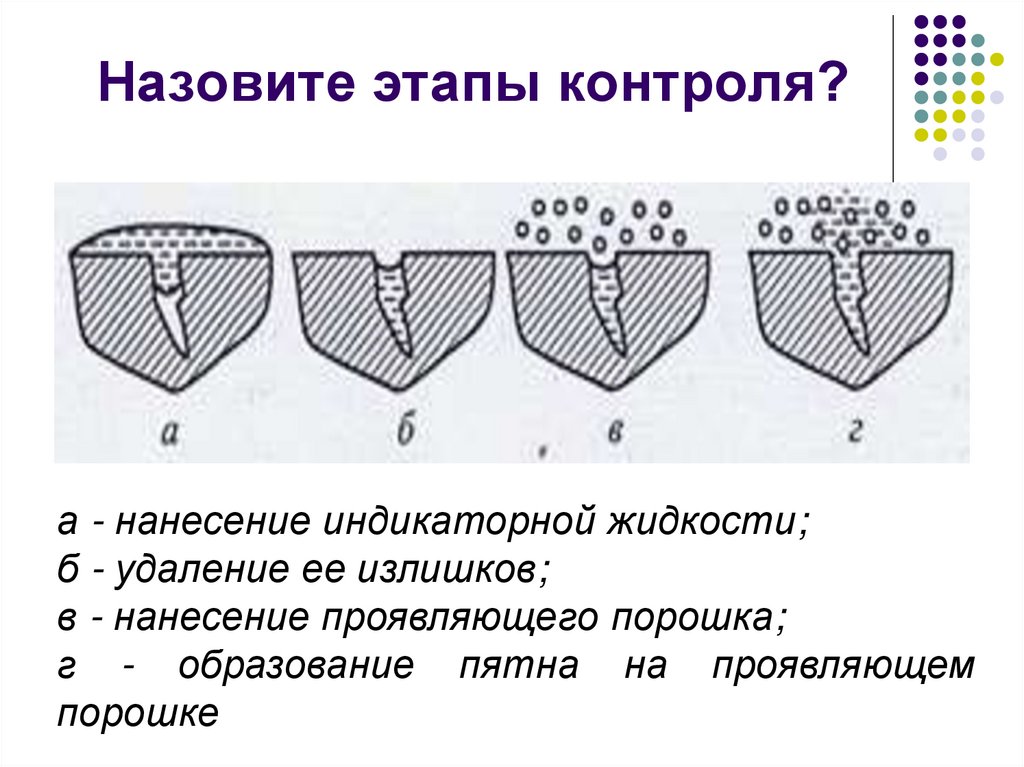 Однако на рынке появился еще один способ удобного нанесения пенетранта. MR Chemie предлагает альтернативу стандартным методам нанесения — это MR ® Piccolo-Pen «быстрая ручка для мелких неровностей поверхности» предназначена для быстрого и специального использования и уже доказала свою эффективность на практике.
Однако на рынке появился еще один способ удобного нанесения пенетранта. MR Chemie предлагает альтернативу стандартным методам нанесения — это MR ® Piccolo-Pen «быстрая ручка для мелких неровностей поверхности» предназначена для быстрого и специального использования и уже доказала свою эффективность на практике.
Благодаря своим особым физико — химическим свойствам, пенетрант после нанесения проникает в мельчайшие несплошности, имеющие выход на поверхность контролируемого объекта. Рекомендуемое время контакта от 5 до 30 мин. при температуре 5-50 Сº.
3.Удаление излишков пенетранта.
Излишек пенетранта удаляется удобным способом , например салфеткой, промыванием водой, либо используя тот же самый очиститель, который применялся при очистке от загрязнений. Важно отметить, что сам пенетрант нужно удалять только с поверхности, а ни коем образом не из самой полости дефекта! Чаще всего рекомендуется наносить очиститель на салфетку, а не на контролируемую поверхность.
4. Применение проявителя.
Нанесение проявителя (обычно белого цвета) проводится после полной просушки, тонким ровным слоем. Проявитель используют в форме суспензии или порошка.
Контроль. Процесс диагностики и контроля проводится после окончания процесса проявки и заканчивается согласно разным стандартам не более чем через 30 мин. Интенсивность окраски говорит о глубине дефекта, чем бледнее окраска, тем дефект мельче. Интенсивную окраску имеют глубокие трещины.
После проведения контроля проявитель удаляется водой или очистителем.
В результате на белом фоне проявителя контрастным ярким цветом (как правило, красным) проявляются дефекты , а индикаторные следы несплошностей проявляются уже после высыхания проявителя.
Обнаружение дефектов. Трещины, складки, несплавления в сварных швах обнаруживаются в виде цветных линий. Глубокие дефекты могут проявляться в виде точек, образующих линию. Поры обнаруживаются в виде рассеянных скоплений точек. При применении люминесцентных (флюоресцентных) пенетрантов исследование результатов происходит при ультрафиолетовом освещении в темном помещении. Дефекты проявляются в виде светящихся линий и точек желто-зеленых оттенков.
Поры обнаруживаются в виде рассеянных скоплений точек. При применении люминесцентных (флюоресцентных) пенетрантов исследование результатов происходит при ультрафиолетовом освещении в темном помещении. Дефекты проявляются в виде светящихся линий и точек желто-зеленых оттенков.
Хоть метод капиллярного контроля и диагностики довольно прост в применение , однако он не является полностью безопасным. При его использовании необходимо предпринять все меры предосторожности, предусмотренные правилами техники безопасности.
Капиллярный контроль несет в себе такие опасности как :
- пожаро- и взрывоопасность материалов;
- ввиду летучести и паров составляющих дефектоскопические материалы , а так же ультрафиолетовое излучение — необходимо защищать органы дыхания, открытые участки тела и все слизистые ;
Специалист должен проводить контроль капиллярным методом в помощении с вытяжной вентиляцией не менее чем с трехкратным обменом воздуха. Работающий должен находиться в потоке чистого воздуха, поступающего к месту работы со скоростью 1–1,7 м/с. Надо постоянно следить за предельно допустимыми концентрациями дефектоскопических материалов в воздухе, предусмотренными санитарно-гигиеническими требованиями к воздуху рабочей зоны.
Работающий должен находиться в потоке чистого воздуха, поступающего к месту работы со скоростью 1–1,7 м/с. Надо постоянно следить за предельно допустимыми концентрациями дефектоскопических материалов в воздухе, предусмотренными санитарно-гигиеническими требованиями к воздуху рабочей зоны.
Eco-Line.
На данный момент есть производитель пенетрантов, который заботится о безопасности и об экологичности применения капиллярного контроля. Производитель MR CHEMIE , создал линейку Eco-Line — это инновационный ответ на ужесточение маркировки продукции в соответствии с регламентом REACH, GHS и CLP . Продукция серии ECO-Line была разработана с творческим подходом и нацелена на снижение уровня опасностей для пользователя и для окружающей среды. Продукция Eco-line не имеет таких знаков опасности, как:
ПРЕИМУЩЕСТВА С ПЕРВОГО ВЗГЛЯДА:
✅ Нет декларации об опасных ингредиентах
✅ Не воспламеняется
✅ Без растворителей
✅ Слабый запах
✅ Биоразлагаемый
✅ Без летучих органических соединений
Как у любого метода контроля, у капиллярного тоже есть и недостатки. Например, при помощи капиллярной дефектоскопии невозможно выявить внутренние несплошности, не имеющих выхода на поверхность. Выявление поверхностных несплошностей, имеющих ширину раскрытия более 500 мкм, капиллярными методами контроля не гарантируется.
Например, при помощи капиллярной дефектоскопии невозможно выявить внутренние несплошности, не имеющих выхода на поверхность. Выявление поверхностных несплошностей, имеющих ширину раскрытия более 500 мкм, капиллярными методами контроля не гарантируется.
3. КАПИЛЛЯРНЫЙ МЕТОД НЕРАЗРУШАЮЩЕГО КОНТРОЛЯ
Неразрушающий контроль проникающими веществами основан на проникновении веществ в полости дефектов контролируемого объекта. Контроль проникающими веществами как вид неразрушающего контроля в зависимости от типа выявляемых дефектов разделяют на два подвида:
•капиллярный – для выявления поверхностных дефектов;
•течеискание – для выявления сквозных дефектов.
Всвою очередь капиллярный нерузрушающий контроль (КНК)
итечеискание разделяют на методы в зависимости от вида первичного информативного параметра (типа проникающего вещества) и способа получения первичной информации.
КНК обычно используют для обнаружения дефектов, не видимых невооруженным глазом. Его абсолютную чувствительность определяют средним раскрытием дефекта типа трещин длиной 3–5 мм, выявляемого с заданной вероятностью (рис. 3.1).
Его абсолютную чувствительность определяют средним раскрытием дефекта типа трещин длиной 3–5 мм, выявляемого с заданной вероятностью (рис. 3.1).
Индикаторные рисунки, образующиеся при контроле, либо обладают способностью люминесцировать в ультрафиолетовых лучах, либо имеют окраску, вызываемую избирательным поглощением (отражением) части падающих на них световых лучей. Линии индикаторного рисунка имеют ширину от 0,05 до 0,3 мм, яркостный контраст 30–60% и более, а также высокий цветовой контраст. Это значительно выше соответствующих параметров поверхностных дефектов, обнаруживаемых визуально.
При КНК ставятся следующие задачи: обнаружение дефекта, определение направления дефекта относительно конфигурации детали, определение размеров и формы дефекта.
Основными объектами КНК являются неферромагнитные материалы: детали приборов и аппаратов нефтяной и химической промышленности (например, для выявления поверхностных дефектов корпусов вертлюгов, щек талевых блоков, буровых крюков и др. ), лопатки турбин из никелевых сплавов, в том числе авиационных турбин; титановый крепеж для летательных и космических аппаратов; литые детали из цветных металлов для электроники и систем автоматического управления.
), лопатки турбин из никелевых сплавов, в том числе авиационных турбин; титановый крепеж для летательных и космических аппаратов; литые детали из цветных металлов для электроники и систем автоматического управления.
35
Капиллярные методы контроля предназначены для обнаружения невидимых или слабовидимых невооруженным глазом дефектов, выходящих на поверхность, и позволяют контролировать изделия любых форм и размеров, изготовленных как из металлических, так и неметаллических материалов. Имеют ограниченное применение для сварных швов, так как требуют предварительной механической обработки их поверхности с целью удаления чешуйчатости, брызг, окалины и обеспечения плавных переходов между основным и наплавленным металлом.
Рис. 3.1. Трещина на образце, обнаруженная КНК в процессе испытаний на усталость
Капиллярный контроль осуществляется путем нанесения жидких проникающих веществ, называемых пенетрантами, их проникновения в полости поверхностных и сквозных дефектов и регистрации образующихся на поверхности объекта контроля индикаторных следов [1]. Глубина дефектов, обнаруживаемых КНК, должна значительно превышать их ширину. Если ширина поверхностного повреждения больше его глубины (риска, царапина), то оно легко заполняется пенетрантом и так же легко удаляется из повреждений. Такие дефекты, как правило, КНК не выявляются. Важнейшим свойством пенетрантов является их способность к смачиванию материала объекта контроля. Явление смачивания вызывается силами взаимного притяжения атомов или молекул жидкости либо твердого тела.
Глубина дефектов, обнаруживаемых КНК, должна значительно превышать их ширину. Если ширина поверхностного повреждения больше его глубины (риска, царапина), то оно легко заполняется пенетрантом и так же легко удаляется из повреждений. Такие дефекты, как правило, КНК не выявляются. Важнейшим свойством пенетрантов является их способность к смачиванию материала объекта контроля. Явление смачивания вызывается силами взаимного притяжения атомов или молекул жидкости либо твердого тела.
При контакте жидкости с твердым телом возможны два случая: смачивание и несмачивание поверхности (рис. 3.2). При смачивании жидкость растекается по поверхности, а при несмачивании собирается в каплеобразную форму. При погружении капиллярной трубки в
36
смачиваемую или несмачиваемую жидкость в трубке соответственно образуется вогнутый или выпуклый мениск (рис. 3.3).
а б
Рис. 3.2. Смачивание (а) и несмачивание (б) поверхности твёрдого тела жидкостью
Рассмотрим каплю жидкости, лежащую на поверхности твёрдого тела. В точке А соприкасаются три фазы – твёрдая, жидкая и газообразная. Соответственно возникают три поверхностные силы: твёрдое тело–газ – Fтг, твёрдое тело–жидкость – Fтж и жидкость–газ – Fжг. Когда капля находится в состоянии покоя, равнодействующая проекций этих сил на поверхность равна нулю:
В точке А соприкасаются три фазы – твёрдая, жидкая и газообразная. Соответственно возникают три поверхностные силы: твёрдое тело–газ – Fтг, твёрдое тело–жидкость – Fтж и жидкость–газ – Fжг. Когда капля находится в состоянии покоя, равнодействующая проекций этих сил на поверхность равна нулю:
Fжг cos – Fтг+ Fтж=0, | (3.1) | |||
cos | FТГ FТЖ | , | (3.2) | |
FЖГ | ||||
|
|
| ||
где – краевой угол смачивания.
Если Fтг>Fтж, то угол 900 . Это значит, что жидкость смачивает твёрдое тело (рис. 3.3, а) – чем меньше , тем сильнее смачивание. Предельный случай будет соответствовать полному смачиванию, т.е. растеканию жидкости по всей поверхности твёрдого тела.
Если Fтж>Fтг, то угол cos <0, следовательно, угол 900 (рис. 3.3, б). Это означает, что жидкость не смачивает твёрдое тело.
Для большинства хорошо смачивающих веществ cos близок к единице. Например, для границы стекла с водой cos =0,685, с керо-
сином cos =0,90, с этиловым спиртом cos =0,955.
Большое влияние на смачивание поверхности оказывает наличие загрязнений. Например, слой масла на поверхности стали или стекла резко ухудшает смачивание ее водой, и cos G при этом становится отрицательным. Разница сил Fтг и Fтж называется силой смачивания, действующей на единицу длины поверхности:
Fтг– Fтж= Fжг cos . | (3.3) |
37
а б
Рис. 3.3. Образование вогнутого (а) и выпуклого менисков (б) в капиллярной трубке, наполненной соответственно смачивающей и несмачивающей жидкостями
При попадании смачивающей жидкости в полости дефектов малых размеров жидкость под действием силы смачивания проникает внутрь этих полостей. В качестве примера рассмотрим капиллярную трубку диаметром 2·r, погруженную в смачивающую жидкость (рис. 3.4). Под действием сил смачивания жидкость в трубке образует вогнутый мениск и поднимается на некоторую высоту h над поверхностью. Суммарная сила смачивания, действующая на длине окружности мениска, в состоянии равновесия уравновешивается весом столба жидкости:
В качестве примера рассмотрим капиллярную трубку диаметром 2·r, погруженную в смачивающую жидкость (рис. 3.4). Под действием сил смачивания жидкость в трубке образует вогнутый мениск и поднимается на некоторую высоту h над поверхностью. Суммарная сила смачивания, действующая на длине окружности мениска, в состоянии равновесия уравновешивается весом столба жидкости:
Fжг cos 2 r= g r2h, | (3.4) |
где – плотность жидкости; g – ускорение свободного падения. Оценим давление Р, создаваемое силой смачивания. Для этого
разделим обе части равенства на площадь трубки:
P | 2FЖГcos | gh | (3.5) | |||
| r | |||||
отсюда |
|
|
|
| ||
| 2FЖГcos |
|
| |||
h | . | (3.6) | ||||
r g |
| |||||
|
|
|
|
| ||
Таким образом, чем меньше радиус капилляра, тем больше капиллярное давление Р и высота подъема h.
Рассмотрим процесс проникновения смачивающей жидкости (пенетранта) вглубь тупиковой трещины [5, 8]. После пропитки объекта контроля и удаления излишков пенетранта с его поверхности в тупиковой трещине образуются два мениска (рис. 3.5): в устье радиусом r1 и вблизи вершины трещины – радиусом r2, при этом Р2 > Р1. Разность давлений, вызванных различием r2, и r1 составляет
P P2 P1 . | (3.7) |
38
Рис. 3.4. Схема к расчету капиллярного давления
Дальнейшему продвижению пенетранта вглубь трещины под действием P препятствует давление сжатого воздуха в замкнутом объеме вблизи вершины трещины, уравновешивающее P. Величина P определяет чувствительность метода и возрастает с увеличением различия радиусов менисков r1 и r2. Отсюда следует, что глубокие, расширяющиеся к устью дефекты будут выявляться лучше.
Величина P определяет чувствительность метода и возрастает с увеличением различия радиусов менисков r1 и r2. Отсюда следует, что глубокие, расширяющиеся к устью дефекты будут выявляться лучше.
Смачивающие жидкости (пенетранты) заполняют узкие
полости дефектов любой формы. Необходимым условием заполнения является то, что размеры этих полостей должны быть настолько малы, чтобы жидкость могла образовать мениск сплошной кривизны без плоских участков.
аб
Рис. 3.5. Схемы проникновения жидкости вглубь тупиковой трещины (а) и проявления индикаторных следов дефектов (б)
Если на мениск, распложенный в устье трещины, наложить ка- кое-нибудь пористое вещество, то он исчезнет, и вместо него образуется система малых менисков различной формы и большой кривизны с малыми радиусами ri, каждый из которых создает свое капиллярное
39
давление Pi . Равнодействующая сил P Pi , созданных менисками капиллярных давлений, существенно превышает давление P2 и действует в противоположном ему направлении.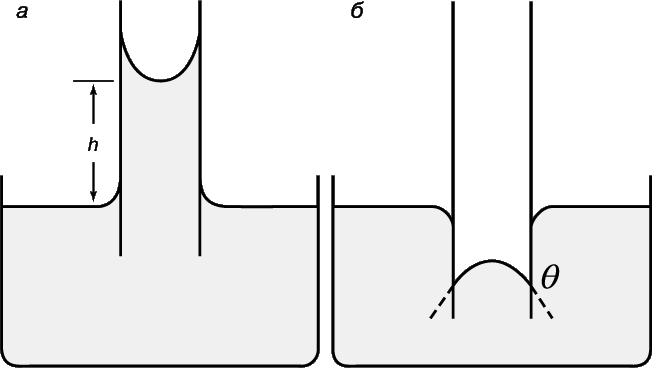 Под действием суммы давлений Pi пенетрант из полости трещины поднимается на
Под действием суммы давлений Pi пенетрант из полости трещины поднимается на
поверхность контролируемого объекта, несколько расплываясь над дефектным участком и образуя так называемый индикаторный след. Угол зрения на трещину при этом увеличивается, и индикаторный след можно наблюдать невооруженным глазом или в лупу с небольшим увеличением (рис. 3.5, б). Вещества, вытягивающие пенетранты из полостей дефектов, называют проявителями.
Индикаторные следы на контролируемой поверхности, образующиеся в результате взаимодействия пенетранта и проявителя, определяют положение соответствующих дефектов. Для повышения визуального восприятия в пенетрант вводят люминофоры, обладающие способностью люминесцировать при воздействии ультрафиолетового излучения, либо цветовые добавки, придающие индикаторному рисунку высокий яркостный и цветовой контраст по сравнению с фоном.
|
|
| У КНК есть верхний и | |||
| нижний | пределы чувствитель- | ||||
| ности. | |||||
| ляется | наибольшей | шириной | |||
| дефекта, при которой пенетрант | |||||
| полностью вытекает из него, | |||||
| образуя размытое облако. Ниж- | |||||
| ний предел определяется на- | |||||
| столько малым дефектом, что | |||||
| проникшего в него пенетранта | |||||
Рис. 3.6. К определению чувствитель- | недостаточно для обнаружения. | |||||
Чувствительность КНК опреде- | ||||||
ности КНК: 1 – контролируемое | ||||||
ляется геометрическим kг и оп- | ||||||
изделие; 2 – проявитель; 3 – дефект; | ||||||
В и Вп– интенсивности света, отражён- | тическим kо факторами. | |||||
ного от проявителя (фон) и от выде- |
|
| Геометрический | фактор | ||
лившегося из дефекта пенетранта | определяется как [3] |
| ||||
|
| |||||
kГ 1 y | b | , |
| (3.8) | ||
|
|
|
|
| ||
где у – ширина устья дефекта, a b – ширина выделившегося пенетранта, как показано на рис. 3.6.
40
Капиллярное действие — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1500
Капиллярное действие можно определить как подъем жидкости по тонкой трубке, цилиндру или проницаемому веществу за счет сил сцепления и сцепления, действующих между жидкостью и поверхностью. Когда межмолекулярная связь самой жидкости существенно уступает поверхности вещества, с которым она взаимодействует, возникает капиллярность . Кроме того, диаметр контейнера, а также гравитационные силы будут определять количество поднятой жидкости. В то время как вода обладает этим уникальным свойством, жидкость, такая как ртуть, не будет демонстрировать те же свойства из-за того, что она имеет более высокую силу сцепления, чем сила сцепления.
Когда межмолекулярная связь самой жидкости существенно уступает поверхности вещества, с которым она взаимодействует, возникает капиллярность . Кроме того, диаметр контейнера, а также гравитационные силы будут определять количество поднятой жидкости. В то время как вода обладает этим уникальным свойством, жидкость, такая как ртуть, не будет демонстрировать те же свойства из-за того, что она имеет более высокую силу сцепления, чем сила сцепления.
Силы капиллярного действия
Тремя основными переменными, определяющими, обладает ли жидкость капиллярным действием, являются:
- Сила сцепления : Это межмолекулярное связывание вещества, при котором его взаимное притяжение заставляет их поддерживать определенную форму жидкости. .
- Поверхностное натяжение : Это происходит в результате того, что одинаковые молекулы, когезионные силы объединяются вместе, образуя несколько непроницаемую поверхность на поверхности воды.
 Поверхностное натяжение измеряется в ньютонах на метр.
Поверхностное натяжение измеряется в ньютонах на метр. - Адгезионная сила : Когда возникают силы притяжения между разнородными молекулами, это называется адгезионной силой.
Капиллярное действие возникает только тогда, когда силы сцепления превышают силы сцепления, которые неизменно становятся поверхностным натяжением в жидкости.
Рисунок \(\PageIndex{1}\): Можно видеть, что в воде сила сил сцепления больше, чем сила сил сцепления. Это приводит к вогнутому образованию воды в капиллярной трубке; это известно как капиллярное притяжение. В качестве альтернативы для ртути силы сцепления сильнее, чем силы сцепления, что позволяет мениску отклоняться от стенок капиллярной трубки. Это известно как капиллярное отталкивание. commons.wikimedia.org/wiki/Fi…(PSF)(bjl).svg Хороший способ запомнить разницу между силами сцепления и силами сцепления заключается в том, что с и силами сцепления вы добавляете еще один набор молекул, молекул поверхности, с которыми жидкость связывается. При co силах сжатия молекулы жидкости будут действовать только co с себе подобными. Снижение поверхностного натяжения также увеличивает капиллярное действие. Это связано с тем, что снижение поверхностного натяжения означает, что межмолекулярные силы уменьшаются, что снижает силы сцепления. В результате капиллярное действие будет еще больше.
При co силах сжатия молекулы жидкости будут действовать только co с себе подобными. Снижение поверхностного натяжения также увеличивает капиллярное действие. Это связано с тем, что снижение поверхностного натяжения означает, что межмолекулярные силы уменьшаются, что снижает силы сцепления. В результате капиллярное действие будет еще больше.
Применение
Практическое использование капиллярного действия очевидно во всех формах нашей повседневной жизни. Это позволяет эффективно и результативно выполнять наши задачи. Вот некоторые области применения этого уникального свойства:
- Основные свойства используются для впитывания воды с помощью бумажных полотенец. Когезионные и адгезивные свойства втягивают жидкость в бумажное полотенце.
 Жидкость стекает в бумажное полотенце с определенной скоростью.
Жидкость стекает в бумажное полотенце с определенной скоростью. - Метод, называемый тонкослойной хроматографией, использует капиллярное действие, при котором слой жидкости используется для отделения смесей от веществ.
- Капиллярное действие естественным образом помогает нам откачивать слезную жидкость из глаза. Этот процесс очищает глаз и удаляет всю пыль и частицы, которые находятся вокруг протоков глаза.
- Для выработки энергии: возможное использование капиллярного действия в качестве источника возобновляемой энергии. Позволяя воде подниматься по капиллярам, испаряться, когда она достигает вершины, конденсат и падать обратно на дно, вращая турбину на своем пути для создания энергии, капиллярное действие может производить электричество! Хотя эта идея все еще находится в разработке, она показывает потенциал капиллярного действия и его важность.
 Вода начинается в корнях и поднимается вверх к самым высоким ветвям растения. commons.wikimedia.org/wiki/File:GemeineFichte.jpg
Вода начинается в корнях и поднимается вверх к самым высоким ветвям растения. commons.wikimedia.org/wiki/File:GemeineFichte.jpgПри измерении уровня жидкости в пробирке или бюретке обязательно проводить измерение на линии мениска для получения точных показаний. Высоту (обозначаемую буквой h) пробирки, бюретки или столба другой жидкости можно измерить по формуле:
\[ h = \dfrac{2\gamma \cos\theta}{\rho\;g\;r} \]
В этой формуле
- γ представляет поверхностное натяжение в жидкостно-воздушной среде,
- θ — угол контакта или степень контакта,
- ρ – плотность жидкости в репрезентативном столбе,
- g ускорение под действием силы тяжести и
- r – радиус трубки, в которой представлена жидкость. 9{-5}}{r}\]
Однако для того, чтобы эта формула работала, должны быть выполнены следующие условия.
- γ= 0,0728 Н/м (при температуре воды 20°C)
- θ= 20°
- ρis 1000 кг/м 3
- г= 9,8 м/с 2
Формула для определения объема жидкости, транспортируемой в среде:
Когда некоторые пористые объекты сталкиваются с жидкой средой, они начинают поглощать жидкость со скоростью, которая фактически уменьшается с течением времени.
 Эта формула записывается как:
Эта формула записывается как:\[ V = S*A\sqrt{t} \]
В этой конкретной формуле
- A – это влажная площадь (поперечное сечение),
- S – сорбционная способность (способность среды поглощать с использованием процесса капиллярного действия),
- V — объем жидкости, поглощенной во времени, т .
Вопросы
- Назовите один способ увеличить капиллярность и один способ уменьшить ее.
- Если когезия больше, чем адгезия, будет ли мениск выпуклым или вогнутым?
- Какова будет высота столба жидкости на земле при поверхностном натяжении жидкость-воздух 0f 0,0973 Н/м, краевом угле 30 градусов, плотности 1200 кг/м 3 ? Обратите внимание, что радиус трубы составляет 0,2 метра.
- Какова высота воды в стеклянной трубке радиусом 0,6 мм?
Растворы
- Увеличение капиллярного действия: повышение температуры, уменьшение диаметра капиллярной трубки, выполнение любого количества действий для уменьшения поверхностного натяжения и т.
 д.! Уменьшение капиллярного действия: Противоположное шагам, которые вы предпримете для увеличения, а также увеличению плотности жидкости, с которой вы работаете.
д.! Уменьшение капиллярного действия: Противоположное шагам, которые вы предпримете для увеличения, а также увеличению плотности жидкости, с которой вы работаете. - Мениск станет выпуклым.
- Используя приведенную выше формулу, высота жидкости будет равна 7,165* 10 -5 м.
- Используя приведенную выше формулу, высота воды в стеклянной трубке будет равна 0,014 м.
Ссылки
- Петруччи, Ральф и Уильям Харвуд. Ф. Джеффри Херринг. Джеффри Мадура. Общая химия: принципы и современные приложения. 9-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон, 2007.
- Циклический гравитационный парниковый генератор энергии капиллярного действия, Р. Смит, 9.11.2005 14:38,
- Капиллярное действие, Википедия
- Capillary Action, от USGS Water Science for Schools.
Авторы и ссылки
- Акилле Пейрис, Бекки Штайн
Capillary Action распространяется по незадекларированной лицензии, автором, ремиксом и/или куратором является LibreTexts.

- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Теги
- сила сцепления
- капиллярное действие
- сила сцепления
Капилляры »Патологические лаборатории» Медицинский колледж »Университет Флориды
Процедура прокола капилляров
Руководящая капиллярная пронтриная инструкция.
 взрослые где
взрослые где
венепункция затруднена. - Образцы у младенцев в возрасте до 6 месяцев обычно собирают пяточной палочкой.
У пациентов в возрасте старше 6 месяцев образцы капилляров должны собираться из пальца
. - Капиллярные образцы собирают в микротейнеры с цветными крышками, которые используются для
идентификации добавки в микротейнеры.
ПРИМЕЧАНИЕ
- Капиллярные пункции не подходят для исследования культуры крови и большинства тестов на коагуляцию.
- Капиллярные образцы могут быть собраны на фильтровальную бумагу и отправлены в лабораторию для тестирования только для специальных тестов
. Обратитесь к онлайн-каталогу тестов для получения информации о требованиях к каждой коллекции тестов. - Капиллярные образцы могут быть немедленно использованы для тестирования по месту оказания медицинской помощи.
МАТЕРИАЛЫ
1. Ланцеты
2. Пробирки для взятия крови с микротейнерами.
Пробирки для взятия крови с микротейнерами.
- Пробирки с различными добавками, используемые для сбора образцов крови на определенные виды
испытаний.
3. Рекомендуемый порядок сбора образцов в микротейнерах:
- Лавандовые микротейнеры с ЭДТА
- Зеленый – литий-гепарин
- Мятно-зеленый-гепарин лития PST
- Серый
- Золото – SST
- Красный-Без добавок
4. Бумага фильтровальная (при необходимости)
5. Перчатки безлатексные
6. Согревающее устройство
7. Антисептик. Индивидуально упакованные салфетки, содержащие 70% изопропилового спирта.
8. Марля 2×2
9. Контейнер для утилизации острых предметов. Приемлемый OSHA, защищенный от проколов контейнер с маркировкой
«Биологически опасный».
10. Бинты или ленты
БЕЗОПАСНОСТЬ
1. Соблюдайте универсальные (стандартные) меры предосторожности. Соблюдайте все применимые процедуры изоляции
.
2. Необходимо постоянно носить средства индивидуальной защиты.
3. Вымойте руки в теплой проточной воде с подходящим средством для мытья рук или, если нет видимых загрязнений, с помощью имеющегося в продаже пенящегося средства для мытья рук до и после
для каждого пациента.
4. Перчатки следует надевать во время всех процедур сбора крови и менять их между
забором крови у пациента.
5. Во время процедуры сбора крови необходимо надевать лабораторный халат или халат.
6. Ланцеты утилизируются в соответствующем контейнере для острых предметов как одна единица.
7. Перчатки следует выбрасывать в соответствующий контейнер сразу же после процедуры сбора крови
.
8. Все другие предметы, используемые для процедуры, должны быть утилизированы в соответствии с
Политика утилизации биологически опасных отходов.
9. Загрязненные поверхности необходимо очистить свежеприготовленным 10% раствором хлорной извести. Все поверхности
ежедневно очищаются отбеливателем.
10. В случае случайного укола немедленно промыть пораженное место антибактериальным мылом
, сцедить кровь из раны и обратиться к своему руководителю.
ПРОЦЕДУРА
1. Определите пациента. Требуются две формы активной идентификации. Спросите пациента или
опекуну сообщить имя и дату рождения пациента. Эта информация должна соответствовать запросу
.
2. Заверьте пациента, что будет взято минимальное количество крови, необходимое для анализа.
3. Выберите соответствующие контейнеры для микротейнеров для образцов, которые необходимо собрать. Любые микроконтейнеры
, содержащие добавки, следует постучать, чтобы удалить добавки со стенок и верхней части.
4. Вымойте руки и наденьте перчатки.
5. Расположите пациента с вытянутой рукой, образуя прямую линию от плеча до запястья.
6. Не пытайтесь проколоть капилляр более двух раз. Сообщите своему руководителю или врачу пациента по номеру
в случае неудачи.
СТУПКА ДЛЯ ПЯТКИ
1. Расположите ребенка, слегка приподняв голову.
2. Согреть пятку, из которой нужно взять кровь. Можно использовать коммерческую грелку для пяток.
3. Очистите пятку спиртовым препаратом, затем высушите стерильной салфеткой 2×2, так как спирт может повлиять на результаты теста
.
4. Используя стерильный ланцет, проколите самую медиальную или латеральную часть подошвенной поверхности
пятка, медиальнее линии, проведенной сзади от середины большого пальца ноги до пятки.
5. Сделайте прокол не глубже 2,4 мм (примерно 0,1 дюйма).
6. Проколы задней кривизны пяточной кости вызывают повреждение костей.
7. Следует избегать мест предыдущих проколов. Избегайте ушиба пятки младенца при получении крови
.
8. Сотрите первую каплю крови стерильной марлей 2×2.
9. Дождитесь образования еще одной большой капли крови. Слегка прикоснитесь к набору капилляров микротейнера
(или фильтровальную бумагу) на БОЛЬШУЮ каплю крови. Соберите капли крови в устройство для сбора
Соберите капли крови в устройство для сбора
, аккуратно массируя пятку. Избегайте чрезмерного давления, которое может выдавить тканевую жидкость
в каплю крови. Заполните пробирку(и) микротейнера по мере необходимости, придерживаясь порядка розыгрыша.
10. Закройте, поверните и переверните микротейнер, чтобы смешать собранную кровь.
11. Когда закончите, очистите участок и прижмите чистой марлей, чтобы остановить кровотечение. Наложите лейкопластырную повязку.
12. Промаркируйте все образцы в соответствии с принятыми инструкциями.
13. Поместите промаркированные образцы в пакет с застежкой-молнией и доставьте в лабораторию как можно скорее.
ПАЛОЧКА
1. Расположите пациента так, чтобы рука была легко доступна.
2. Очистите кончик 3-го (среднего) или 4-го (безымянного) пальца спиртовым препаратом. Дайте пальцу
высохнуть или вытрите насухо стерильной марлей 2×2.
3. Стерильным ланцетом проколите кончик пальца в мясистой части пальца, немного в сторону
по центру и поперек (перпендикулярно) бороздкам кончика пальца. Это позволяет крови
Это позволяет крови
формироваться в виде капли на кончике пальца. Если прокол параллелен линиям отпечатка пальца, кровь
не сформируется в виде капли, а будет стекать по пальцу, что затруднит сбор.
4. Сотрите первую каплю крови стерильной марлевой салфеткой 2×2.
5. Дождитесь образования еще одной большой капли крови. Слегка прикоснитесь устройством для сбора капилляров микротейнера
(или фильтровальной бумагой) к БОЛЬШОЙ капле крови. Собрать капли крови в коллекцию
, осторожно массируя палец. Избегайте чрезмерного давления, которое может выдавить тканевую жидкость
в каплю крови. Заполните пробирку(и) микротейнера по мере необходимости.
6. Закройте, поверните и переверните микротейнер, чтобы смешать собранную кровь.
7. Когда закончите, очистите участок и прижмите чистой марлей, чтобы остановить кровотечение. Наложите
лейкопластырную повязку.
8. Промаркируйте все образцы в соответствии с принятыми инструкциями.
9. Поместите промаркированные образцы в пакет с застежкой-молнией и доставьте в лабораторию как можно скорее.
ФИЛЬТР-БУМАГА ДЛЯ СБОРА ОБРАЗЦОВ
1. Дайте крови впитаться и полностью заполнить предварительно напечатанный кружок на фильтровальной бумаге.
2. Фильтровальная бумага должна касаться только крови, но не пятки или пальца.
3. Нанесите только ОДНУ каплю крови на круг. Не добавляйте кровь в круг, уже заполненный или частично заполненный кровью
.
4. Нанесите кровь на печатную сторону фильтровальной бумаги.
5. Убедитесь, что кровь полностью пропитала все четыре (4) круга и была видна с обоих
стороны.
6. Если кровоток уменьшился, повторите капиллярную ПУНКТУ, чтобы завершить сбор.
7. Дайте фильтровальной бумаге высохнуть на воздухе в течение двух (2) часов при комнатной температуре. Избегайте размещения образца на
горячих поверхностях, таких как били-лайты или мониторы.
8. Как можно скорее отправьте готовые/сухие образцы в лабораторию.
Как можно скорее отправьте готовые/сухие образцы в лабораторию.
Капиллярное действие и вода | Геологическая служба США
Школа водных наук 5 июня 2018 г.
Капиллярное действие и вода
Свойства воды Вопросы и ответы
Свойства воды Фотогалерея
Узнайте о свойствах воды с помощью изображений
Дом школы водных наук
- Обзор
- Наука
- Мультимедиа
- Публикации
Растения и деревья не могли бы расти без капиллярного действия. Капиллярное действие помогает поднять воду к корням. Благодаря адгезии и когезии вода может дойти до ветвей и листьев. Читайте дальше, чтобы узнать больше о том, как происходит это движение воды.
• Школа наук о воде ДОМАШНЯЯ СТРАНИЦА • Темы о свойствах воды •
Капиллярное действие
Источники/Использование: Некоторое содержимое может иметь ограничения. Посетите СМИ, чтобы узнать подробности.
Капиллярное действие ….. в действии! Без капиллярного действия уровень воды во всех трубках был бы одинаковым. Трубки меньшего диаметра имеют большую относительную площадь поверхности внутри трубки, что позволяет капиллярному действию поднимать воду выше, чем в трубках большего диаметра.Авторы и права: доктор Кит Хейуорд
Даже если вы никогда не слышали о капиллярном действии, оно все равно играет важную роль в вашей жизни. Капиллярное действие важно для движения воды (и всего, что в ней растворено). Определяется как движение воды в пространствах пористого материала под действием сил адгезия, когезия и поверхностное натяжение .
Капиллярное действие возникает из-за того, что вода липкая благодаря силам сцепления (молекулы воды любят оставаться близко друг к другу) и адгезии (молекулы воды притягиваются и прилипают к другим веществам). Прилипание воды к стенкам сосуда вызовет направленную вверх силу на жидкость по краям и приведет к мениску , который повернется вверх. Поверхностное натяжение удерживает поверхность неповрежденной. Капиллярное действие возникает, когда сцепление со стенками сильнее сил сцепления между молекулами жидкости. Высота, на которую капиллярное действие поднимет воду в однородной круглой трубе (рисунок справа), ограничена поверхностным натяжением и, конечно же, силой тяжести.
Прилипание воды к стенкам сосуда вызовет направленную вверх силу на жидкость по краям и приведет к мениску , который повернется вверх. Поверхностное натяжение удерживает поверхность неповрежденной. Капиллярное действие возникает, когда сцепление со стенками сильнее сил сцепления между молекулами жидкости. Высота, на которую капиллярное действие поднимет воду в однородной круглой трубе (рисунок справа), ограничена поверхностным натяжением и, конечно же, силой тяжести.
Мало того, что вода слипается в капле, она прилипает к стеклу, ткани, органическим тканям, почве и, к счастью, к волокнам бумажного полотенца. Окуните бумажное полотенце в стакан с водой, и вода «поднимется» на бумажное полотенце. На самом деле, он будет продолжать подниматься вверх по полотенцу до тех пор, пока притяжение не станет слишком сильным, чтобы его можно было преодолеть.
Капиллярное действие окружает нас каждый день
Источники/использование: общественное достояние.
- Если окунуть бумажное полотенце в воду, вы увидите, как оно «волшебным образом» поднимается вверх по полотенцу, как будто игнорируя гравитацию. Вы видите капиллярное действие в действии, и «подниматься вверх» почти правильно: молекулы воды взбираются вверх по полотенцу и увлекают за собой другие молекулы воды. (Очевидно, что Мона Лиза — большая поклонница капиллярного действия!)
- Растения и деревья не могли бы расти без капиллярного действия. Растения пускают в почву корни, которые способны переносить воду из почвы в растение. Вода, содержащая растворенные питательные вещества, попадает внутрь корней и начинает подниматься по тканям растения. Капиллярное действие помогает поднять воду к корням. Но капиллярное действие может лишь «подтянуть» воду вверх на небольшое расстояние, после чего она уже не может преодолеть гравитацию.
 Чтобы доставить воду ко всем ветвям и листьям, в ксилеме растения работают силы сцепления и сцепления, чтобы доставить воду к самому дальнему листу.
Чтобы доставить воду ко всем ветвям и листьям, в ксилеме растения работают силы сцепления и сцепления, чтобы доставить воду к самому дальнему листу.
- Капиллярное действие также важно для дренажа постоянно вырабатываемой слезной жидкости из глаза. Две трубки крошечного диаметра, слезные протоки, находятся во внутреннем углу века; эти протоки выделяют слезы в глаза. (Источник: Википедия)
- Может быть, вы пользовались перьевой ручкой… или ваши родители, бабушки и дедушки. Чернила перемещаются из резервуара в корпусе ручки вниз к кончику и в бумагу (которая состоит из крошечных бумажных волокон и воздушных промежутков между ними), а не просто превращаясь в каплю. Конечно, сила тяжести отвечает за то, что чернила движутся «вниз» к кончику пера, но капиллярное действие необходимо, чтобы чернила текли на бумагу.
Доказательство в пудинге
… То есть в сельдерее Источники/Использование: Некоторое содержимое может иметь ограничения. Посетите СМИ, чтобы узнать подробности.
Посетите СМИ, чтобы узнать подробности.
. Вы можете увидеть капиллярное действие в действии (хотя и медленно), проведя эксперимент, в котором вы помещаете нижнюю часть стебля сельдерея в стакан с водой с пищевым красителем и наблюдаете за движением цвета к верхним листьям. сельдерей. Возможно, вы захотите использовать кусочек сельдерея, который начал шататься, так как его нужно быстро выпить. На это может уйти несколько дней, но, как видно из этих снимков, окрашенная вода «тянется» вверх против силы тяжести. Этот эффект возникает из-за того, что в растениях молекулы воды движутся по узким трубкам, которые называются капиллярами (или ксилемой).
Источники/Использование: Некоторое содержимое может иметь ограничения. Посетите СМИ, чтобы узнать подробности.
Как вы думаете, много ли вы знаете о свойствах воды?
Пройдите наш интерактивный тест о свойствах воды, верно/неверно, и проверьте свои знания о воде.
Источники и дополнительная информация
- Свойства воды: окружающая среда и изменение климата Канада
Узнайте больше о капиллярном действии и связанных с ним свойствах воды.
Ниже представлены мультимедийные элементы, связанные с капиллярным действием и соответствующими свойствами воды.
Ниже приведены публикации, посвященные капиллярному действию и связанным с ним свойствам воды.
- Обзор
Растения и деревья не могли бы расти без капиллярного действия. Капиллярное действие помогает поднять воду к корням. Благодаря адгезии и когезии вода может дойти до ветвей и листьев. Читайте дальше, чтобы узнать больше о том, как происходит это движение воды.
• Школа наук о воде ДОМАШНЯЯ СТРАНИЦА • Темы о свойствах воды •
Капиллярное действие
Источники/Использование: Некоторое содержимое может иметь ограничения.
Капиллярное действие ….. в действии! Без капиллярного действия уровень воды во всех трубках был бы одинаковым. Трубки меньшего диаметра имеют большую относительную площадь поверхности внутри трубки, что позволяет капиллярному действию поднимать воду выше, чем в трубках большего диаметра. Посетите СМИ, чтобы узнать подробности.
Посетите СМИ, чтобы узнать подробности.Авторы и права: доктор Кит Хейуорд
Даже если вы никогда не слышали о капиллярном действии, оно все равно играет важную роль в вашей жизни. Капиллярное действие важно для движения воды (и всего, что в ней растворено). Он определяется как движение воды в пространстве пористого материала за счет сил сцепления, сцепления и поверхностного натяжения .
Капиллярное действие возникает из-за того, что вода липкая благодаря силам сцепления (молекулы воды любят оставаться близко друг к другу) и адгезии (молекулы воды притягиваются и прилипают к другим веществам). Прилипание воды к стенкам сосуда вызовет восходящую силу на жидкость по краям и приведет к мениск , обращенный вверх.
 Поверхностное натяжение удерживает поверхность неповрежденной. Капиллярное действие возникает, когда сцепление со стенками сильнее сил сцепления между молекулами жидкости. Высота, на которую капиллярное действие поднимет воду в однородной круглой трубе (рисунок справа), ограничена поверхностным натяжением и, конечно же, силой тяжести.
Поверхностное натяжение удерживает поверхность неповрежденной. Капиллярное действие возникает, когда сцепление со стенками сильнее сил сцепления между молекулами жидкости. Высота, на которую капиллярное действие поднимет воду в однородной круглой трубе (рисунок справа), ограничена поверхностным натяжением и, конечно же, силой тяжести.Мало того, что вода слипается в капле, она прилипает к стеклу, ткани, органическим тканям, почве и, к счастью, к волокнам бумажного полотенца. Окуните бумажное полотенце в стакан с водой, и вода «поднимется» на бумажное полотенце. На самом деле, он будет продолжать подниматься вверх по полотенцу до тех пор, пока притяжение не станет слишком сильным, чтобы его можно было преодолеть.
Капиллярное действие окружает нас каждый день
Источники/использование: общественное достояние.
Мы знаем, что никто никогда не прольет бутылку напитка Cherry Berry Go на Мону Лизу, но если бы это случилось, капиллярное действие и бумажные полотенца помогли бы убрать беспорядок.
- Если окунуть бумажное полотенце в воду, вы увидите, как оно «волшебным образом» поднимается вверх по полотенцу, как будто игнорируя гравитацию. Вы видите капиллярное действие в действии, и «подниматься вверх» почти правильно: молекулы воды взбираются вверх по полотенцу и увлекают за собой другие молекулы воды. (Очевидно, что Мона Лиза — большая поклонница капиллярного действия!)
- Растения и деревья не могли бы расти без капиллярного действия. Растения пускают в почву корни, которые способны переносить воду из почвы в растение. Вода, содержащая растворенные питательные вещества, попадает внутрь корней и начинает подниматься по тканям растения. Капиллярное действие помогает поднять воду к корням. Но капиллярное действие может лишь «подтянуть» воду вверх на небольшое расстояние, после чего она уже не может преодолеть гравитацию. Чтобы доставить воду ко всем ветвям и листьям, в ксилеме растения работают силы сцепления и сцепления, чтобы доставить воду к самому дальнему листу.

- Капиллярное действие также важно для дренажа постоянно вырабатываемой слезной жидкости из глаза. Две трубки крошечного диаметра, слезные протоки, находятся во внутреннем углу века; эти протоки выделяют слезы в глаза. (Источник: Википедия)
- Может быть, вы пользовались перьевой ручкой… или ваши родители, бабушки и дедушки. Чернила перемещаются из резервуара в корпусе ручки вниз к кончику и в бумагу (которая состоит из крошечных бумажных волокон и воздушных промежутков между ними), а не просто превращаясь в каплю. Конечно, сила тяжести отвечает за то, что чернила движутся «вниз» к кончику пера, но капиллярное действие необходимо, чтобы чернила текли на бумагу.
Доказательство в пудинге
… То есть в сельдерееИсточники/Использование: Некоторое содержимое может иметь ограничения. Посетите СМИ, чтобы узнать подробности.
Авторы и права: Кристин Дойл.. Вы можете увидеть капиллярное действие в действии (хотя и медленно), проведя эксперимент, в котором вы помещаете нижнюю часть стебля сельдерея в стакан с водой с пищевым красителем и наблюдаете за движением цвета к верхним листьям.
 сельдерей. Возможно, вы захотите использовать кусочек сельдерея, который начал шататься, так как его нужно быстро выпить. На это может уйти несколько дней, но, как видно из этих снимков, окрашенная вода «тянется» вверх против силы тяжести. Этот эффект возникает из-за того, что в растениях молекулы воды движутся по узким трубкам, которые называются капиллярами (или ксилемой).
сельдерей. Возможно, вы захотите использовать кусочек сельдерея, который начал шататься, так как его нужно быстро выпить. На это может уйти несколько дней, но, как видно из этих снимков, окрашенная вода «тянется» вверх против силы тяжести. Этот эффект возникает из-за того, что в растениях молекулы воды движутся по узким трубкам, которые называются капиллярами (или ксилемой).Источники/Использование: Некоторое содержимое может иметь ограничения. Посетите СМИ, чтобы узнать подробности.
Как вы думаете, много ли вы знаете о свойствах воды?
Пройдите наш интерактивный тест о свойствах воды, верно/неверно, и проверьте свои знания о воде.Источники и дополнительная информация
- Свойства воды: окружающая среда и изменение климата Канада
- Наука
Узнайте больше о капиллярном действии и связанных с ним свойствах воды.

- Мультимедиа
Ниже представлены мультимедийные элементы, связанные с капиллярным действием и соответствующими свойствами воды.
- Публикации
Ниже приведены публикации, связанные с капиллярным действием и связанными с ним свойствами воды.
Метод «капиллярной дорожки» для выделения магнитотактических бактерий | FEMS Микробиология Экология
Фильтр поиска панели навигации FEMS Microbiology EcologyЭтот выпуск FEMS JournalsMicrobiologyBooksJournalsOxford Academic Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации FEMS Microbiology EcologyЭтот выпуск FEMS JournalsMicrobiologyBooksJournalsOxford Academic Термин поиска на микросайте
Расширенный поиск
Журнальная статья
Р. С. Вульф,
С. Вульф,
Р.С. Вулф
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
Р.К. Тауэр,
Р.К. Тауэр
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
Н. Пфенниг
Н. Пфенниг
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
FEMS Microbiology Ecology , том 3, выпуск 1, февраль 1987 г., страницы 31–35, https://doi.org/10.1111/j.1574-6968.1987.tb02335.x
Опубликовано: февраль
3История статьи
Получено:
30 октября 1986 г.
Принято:
12 ноября 1986 г.
Опубликовано:
01 февраля 1987 г.
Фильтр поиска панели навигации FEMS Microbiology EcologyЭтот выпуск FEMS JournalsMicrobiologyBooksJournalsOxford Academic Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации FEMS Microbiology EcologyЭтот выпуск FEMS JournalsMicrobiologyBooksJournalsOxford Academic Термин поиска на микросайте
Advanced Search
Abstract
Была разработана капиллярная трубка, в которой инокулят магнитотактических бактерий, содержащих лишь небольшое количество загрязняющих веществ, можно было отделить от неочищенного осадка за несколько минут. На одну сторону смоченного ватного тампона помещали стерильную жидкость, а на другую — осадок. Магнитотактические бактерии быстро мигрировали через хлопок к южному полюсу магнита-мешалки, расположенного на закрытом конце капилляра. Простейшие и хемотаксические бактерии значительно задерживались при прохождении через хлопок.
На одну сторону смоченного ватного тампона помещали стерильную жидкость, а на другую — осадок. Магнитотактические бактерии быстро мигрировали через хлопок к южному полюсу магнита-мешалки, расположенного на закрытом конце капилляра. Простейшие и хемотаксические бактерии значительно задерживались при прохождении через хлопок.
Магнитотактическая бактерия, Магнитное поле, Подвижность, (Метод выделения)
Ссылки
[1]
Blakemore
R.
(
1975
)
Магнитотаксические бактерии
Science
,
190
,
377
—
379
11.
[2]
Blakemore
RP
Maratea
D.
Вулф
Р. С.
С.
(
1979
)
Выделение и чистая культура пресноводной магнитной спириллы в среде с определенным химическим составом
J. Bacteriol.
,
140
,
720
–
729
.
[3]
Блейкмор
Р.
(
1982
)
Магнитотактические бактерии
год. Преподобный Микробиолог.
,
36
,
217
–
238
.
[4]
Moench
T.T.
Конецка
W. A.
(
A.
(
1978
)
Новый метод выделения и изучения магнитотактической бактерии
Arch. микробиол.
,
119
,
203
–
212
.
[5]
Блейкмор
RP
Frankel
RB
(
1981
)
Магнитная навигация у бактерий
Sci. Являюсь.
,
245
,
58
–
65
.
[6]
Spormann
А.М.
Вулф
Р.С.
(
1984
)
Хемотактическое, магнитотактическое и тактильное поведение магнитной спириллы
FEMS Microbiol. лат.
лат.
,
22
,
171
–
177
.
Этот контент доступен только в формате PDF.
© 1987 Федерация Европейского микробиологического общества
© 1987 Федерация Европейского микробиологического общества
Раздел выпуска:
Статьи
Скачать все слайды
Реклама
Цитаты
Альтметрика
Дополнительная информация о метриках
Оповещения по электронной почте
Оповещение об активности статьи
Предварительные уведомления о статьях
Оповещение о новой проблеме
Оповещение о текущей проблеме
Получайте эксклюзивные предложения и обновления от Oxford Academic
Ссылки на статьи по телефону
Последний
Самые читаемые
Самые цитируемые
Отслеживание порчи бактерий в микробиоме тунца
Пространственно-временная динамика, формирование сообщества и функциональные возможности осадочных архей в водохранилищах: взаимодействие стохастичности и биогенной нагрузки
Соотношение азота и фосфора формирует бактериальное сообщество, участвующее в разложении целлюлозы, а загрязнение медью изменяет их стехиометрическую потребность
Сообщества филлосферных бактерий в городских зеленых зонах по всей Европе относятся к городской интенсивности
Микробные сообщества стратифицированных водных экосистем Кандалакшского залива (Белое море) проливают свет на эволюционную историю зеленых и коричневых морфотипов хлоробиоты.
Реклама
Капиллярный метод измерения пропускания воды через полиуретановые мембраны
. 1997 ноябрь-декабрь; 43(6):890-6.
doi: 10.1097/00002480-199711000-00008.
М Ян 1 , X Deng, G Laroche, C Hahn, M W King, RG Guidoin
принадлежность
- 1 Кафедра хирургии, Университет Лаваля, Квебек, Канада.
- PMID: 9386838
- DOI: 10.1097/00002480-199711000-00008
М Ян и др.
АСАИО Дж. 1997 ноябрь-декабрь.
1997 ноябрь-декабрь.
. 1997 ноябрь-декабрь; 43(6):890-6.
doi: 10.1097/00002480-199711000-00008.
Авторы
М Ян 1 , С. Дэн, Г. Ларош, С. Хан, М. В. Кинг, Р. Г. Гвидоин
принадлежность
- 1 Кафедра хирургии, Университет Лаваля, Квебек, Канада.
- PMID: 9386838
- DOI: 10.1097/00002480-199711000-00008
Абстрактный
Разработан капиллярный метод измерения скорости пропускания воды через полиуретановые мембраны, подготовленные для использования в качестве желудочков в искусственных сердцах. Система состояла в основном из герметичной камеры для проб, содержащей воду, стеклянного капиллярного расходомера и приемного отсека с непрерывной вентиляцией сухим воздухом. Капиллярный расходомер контролировал объем потери воды в камере для проб. Было обнаружено, что скорость пропускания воды через испытуемую мембрану пропорциональна потерям воды в камере для образца и зависит от толщины мембраны. Для толщин от 0,09мм до 0,34 мм, скорости пропускания паров воды варьировались от 7,53 х 10(-8) до 2,76 х 10(-8) моль/с см2 соответственно. Хотя концентрация водяного пара в ресиверном отсеке и влияла на скорость пропускания водяного пара через мембрану, в диапазоне давлений 50-200 мм рт. ст. влияние было очень незначительным. Эти данные свидетельствуют о том, что при прохождении воды через полиуретановую мембрану преобладает процесс диффузии, а не объемная конвекция.
Система состояла в основном из герметичной камеры для проб, содержащей воду, стеклянного капиллярного расходомера и приемного отсека с непрерывной вентиляцией сухим воздухом. Капиллярный расходомер контролировал объем потери воды в камере для проб. Было обнаружено, что скорость пропускания воды через испытуемую мембрану пропорциональна потерям воды в камере для образца и зависит от толщины мембраны. Для толщин от 0,09мм до 0,34 мм, скорости пропускания паров воды варьировались от 7,53 х 10(-8) до 2,76 х 10(-8) моль/с см2 соответственно. Хотя концентрация водяного пара в ресиверном отсеке и влияла на скорость пропускания водяного пара через мембрану, в диапазоне давлений 50-200 мм рт. ст. влияние было очень незначительным. Эти данные свидетельствуют о том, что при прохождении воды через полиуретановую мембрану преобладает процесс диффузии, а не объемная конвекция.
Похожие статьи
Полностью имплантируемые искусственные сердца и вспомогательные устройства для левого желудочка: выбор непроницаемого поликарбонат-уретана для изготовления желудочков.

Ян М., Чжан З., Хан С., Ларош Г., Кинг М.В., Гвидоин Р. Ян М. и др. J Biomed Mater Res. Весна 1999 г .; 48 (1): 13–23. doi: 10.1002/(sici)1097-4636(1999)48:13.0.co;2-4. J Biomed Mater Res. 1999. PMID: 10029144
Передача воды через биосовместимый полиуретан: применение в устройствах помощи кровообращению.
Рейд Дж.С., Розенберг Г., Пирс В.С. Рейд Дж.С. и др. J Biomed Mater Res. 1985 ноябрь-декабрь; 19(9):1181-202. doi: 10.1002/jbm.8201
. J Biomed Mater Res. 1985. PMID: 4086496Исследования влияния свойств поверхности на биосовместимость полиуретановых мембран.
Линь Д.Т., Янг Т.Х., Фан Ю. Лин Д.Т. и соавт. Биоматериалы. 2001 июнь; 22 (12): 1521-9. doi: 10.1016/s0142-9612(00)00308-2.
 Биоматериалы. 2001.
PMID: 11374451
Биоматериалы. 2001.
PMID: 11374451Мембранная инженерия в биотехнологии: quo vamus?
Rios GM, Belleville MP, Paolucci-Jeanjean D. Риос Г.М. и соавт. Тенденции биотехнологии. 2007 июнь; 25 (6): 242-6. doi: 10.1016/j.tibtech.2007.04.003. Epub 2007, 12 апреля. Тенденции биотехнологии. 2007. PMID: 17433844 Обзор.
Достижения в области биоматериалов на основе полиуретана на водной основе для биомедицинских применений.
Шин Э.Дж., Чой С.М. Шин Э.Дж. и др. Adv Exp Med Biol. 2018;1077:251-283. дои: 10.1007/978-981-13-0947-2_14. Adv Exp Med Biol. 2018. PMID: 30357693 Обзор.
Посмотреть все похожие статьи
Цитируется
Влияние схемы ЭКМО на концентрацию пищевых добавок.

Линдберг Б.Р., Видем В., Даль Т., Соренсен Г., Фиан А.Е., Тиара А.С. Линдберг Б.Р. и соавт. Научный представитель 2020 6 ноября; 10 (1): 19275. doi: 10.1038/s41598-020-76299-5. Научный представитель 2020. PMID: 33159150 Бесплатная статья ЧВК. Клиническое испытание.
Влияние на мембранный газообмен легких прерывистого маневра рекрутмента с высоким потоком газа: предварительные данные у пациентов с вено-венозной ЭКМО.
Castagna L, Zanella A, Scaravilli V, Magni F, Deab SA, Introna M, Mojoli F, Grasselli G, Pesenti A, Patroniti N. Кастанья Л. и др. Джей Артиф Органс. 2015 сен; 18 (3): 213-9. doi: 10.1007/s10047-015-0831-3. Epub 2015 26 марта. Джей Артиф Органс. 2015. PMID: 25809452
Типы публикаций
термины MeSH
вещества
Сбор слюны капиллярным методом может занижать передачу арбовирусов комарами | Паразиты и переносчики
- Исследования
- Открытый доступ
- Опубликовано:
- А. Глория-Сория ORCID: orcid.org/0000-0002-5401-3988 1 ,
- Д. Э. Брэкни 1 и
- П. М. Армстронг 1
Паразиты и переносчики том 15 , номер статьи: 103 (2022) Процитировать эту статью
1404 доступа
2 Цитаты
19 Альтметрический
Сведения о показателях
Abstract
Исходная информация
Вирусы, переносимые членистоногими (арбовирусы), ложатся тяжелым бременем на здоровье и экономику населения во всем мире, а комары служат важными переносчиками. Измерение способности популяции комаров передавать арбовирус важно с точки зрения оценки его риска для здоровья населения. В лаборатории для оценки передачи арбовирусов комарами используются различные методы, в том числе непрямые методы, включающие обнаружение вируса в слюне комаров, собранной путем принудительного слюноотделения. Точность непрямых методов оценки передачи арбовирусов живым животным-хозяевам еще не была полностью оценена.
Измерение способности популяции комаров передавать арбовирус важно с точки зрения оценки его риска для здоровья населения. В лаборатории для оценки передачи арбовирусов комарами используются различные методы, в том числе непрямые методы, включающие обнаружение вируса в слюне комаров, собранной путем принудительного слюноотделения. Точность непрямых методов оценки передачи арбовирусов живым животным-хозяевам еще не была полностью оценена.
Методы
Мы сравнили три часто используемых косвенных показателя передачи арбовирусов, а именно наличие вируса в лапках комаров, в слюнных железах (СГ) и в слюне, собранной в капиллярные трубки с помощью форсированного слюноотделения, с прямыми оценками передачи от комаров грудным мышей. Мы проанализировали пять комбинаций вектор-вирус, включая Aedes aegypti , инфицированных вирусом чикунгунья, вирусом Западного Нила и вирусом Зика; Culex quinquefasciatus , инфицированный вирусом Западного Нила; и Aedes triseriatus , зараженный вирусом Ла-Кросс.
Результаты
Для сравнения, методы обнаружения вирусной инфекции в лапках комаров и в SG были одинаково точными в прогнозировании передачи. В целом наличие вируса в лапках комаров было более точным предиктором передачи, чем широко применяемый метод обнаружения вируса с использованием принудительного слюноотделения в капиллярную трубку, и подвергался меньшим техническим вариациям.
Выводы
Эти результаты свидетельствуют о том, что в целом методы искусственного слюноотделения, как правило, недооценивают передачу вируса, и они обеспечивают уверенность в использовании сеток для ног комаров для оценки потенциала передачи популяции комаров.
Graphical Abstract
Исходная информация
Вирусы, переносимые членистоногими (арбовирусы), создают серьезное бремя для здоровья населения, и их число растет как в тропических, так и в умеренных регионах мира. В последние десятилетия вирус чикунгунья (CHIKV), вирус Западного Нила (WNV) и вирус Зика (ZIKV) распространились на новые географические регионы, что привело к исследованиям способности местных популяций комаров к переносу этих и других инвазивных арбовирусов. Компетентность вектора определяется как способность членистоногого приобретать, поддерживать и передавать патоген позвоночному хозяину в процессе кровоснабжения. В лаборатории для оценки передачи арбовирусов комарами-переносчиками используются различные методы. Прямые методы in vivo включают воздействие инфицированных векторов на лабораторных животных, что позволяет комарам участвовать в естественном процессе кровоснабжения, необходимом для передачи арбовирусов. Однако в настоящее время методы in vivo используются редко из-за высокой стоимости, требований к обучению персонала, соответствующих условий содержания и содержания животных, а также разрешений на использование животных [1]. Кроме того, использование позвоночных хозяев для этих исследований ограничено наличием компетентных моделей животных для изучаемого арбовируса [1].
В последние десятилетия вирус чикунгунья (CHIKV), вирус Западного Нила (WNV) и вирус Зика (ZIKV) распространились на новые географические регионы, что привело к исследованиям способности местных популяций комаров к переносу этих и других инвазивных арбовирусов. Компетентность вектора определяется как способность членистоногого приобретать, поддерживать и передавать патоген позвоночному хозяину в процессе кровоснабжения. В лаборатории для оценки передачи арбовирусов комарами-переносчиками используются различные методы. Прямые методы in vivo включают воздействие инфицированных векторов на лабораторных животных, что позволяет комарам участвовать в естественном процессе кровоснабжения, необходимом для передачи арбовирусов. Однако в настоящее время методы in vivo используются редко из-за высокой стоимости, требований к обучению персонала, соответствующих условий содержания и содержания животных, а также разрешений на использование животных [1]. Кроме того, использование позвоночных хозяев для этих исследований ограничено наличием компетентных моделей животных для изучаемого арбовируса [1]. Чаще передачу оценивают косвенными методами in vitro, которые более доступны и экономичны, но могут быть трудоемкими. Среди используемых в настоящее время методов in vitro наиболее широко используется капиллярный метод форсированного слюноотделения, включающий иммобилизацию отдельных комаров и последующий сбор их слюны для тестирования на арбовирусы путем помещения их хоботка в тонко вытянутую капиллярную трубку или наконечник пипетки. Другой подход заключается в простом скрининге периферических тканей (ноги, слюнные железы [SG] и/или ткани головы) на наличие арбовирусной инфекции с исходным предположением, что эти показатели диссеминированной инфекции эквивалентны передаче вируса [2,3,4].
Чаще передачу оценивают косвенными методами in vitro, которые более доступны и экономичны, но могут быть трудоемкими. Среди используемых в настоящее время методов in vitro наиболее широко используется капиллярный метод форсированного слюноотделения, включающий иммобилизацию отдельных комаров и последующий сбор их слюны для тестирования на арбовирусы путем помещения их хоботка в тонко вытянутую капиллярную трубку или наконечник пипетки. Другой подход заключается в простом скрининге периферических тканей (ноги, слюнные железы [SG] и/или ткани головы) на наличие арбовирусной инфекции с исходным предположением, что эти показатели диссеминированной инфекции эквивалентны передаче вируса [2,3,4].
Сложность, связанная с экспериментальным дизайном испытаний векторной компетентности, усложняет сравнение между исследованиями [5]. Тем не менее, стоит отметить, что в этих исследованиях часто сообщается о резком снижении процента комаров, передающих вирус, после развития диссеминированной вирусной инфекции [6,7,8,9]. Это может означать либо сильную инфекцию SG, либо барьер ускользания в этих векторах [10], или, возможно, это артефакт методов, используемых для оценки передачи арбовирусов. Например, Aedes aegypti и Aedes albopictus часто демонстрируют слабую компетентность в отношении переносчиков CHIKV, DENV и ZIKV в лабораторных условиях, хотя известно, что они служат эффективными переносчиками этих арбовирусов в природе [5, 11, 12]. Эти исследования основывались на методах принудительного слюноотделения для демонстрации передачи вируса, что не позволяет комарам исследовать или питаться естественным путем.
Это может означать либо сильную инфекцию SG, либо барьер ускользания в этих векторах [10], или, возможно, это артефакт методов, используемых для оценки передачи арбовирусов. Например, Aedes aegypti и Aedes albopictus часто демонстрируют слабую компетентность в отношении переносчиков CHIKV, DENV и ZIKV в лабораторных условиях, хотя известно, что они служат эффективными переносчиками этих арбовирусов в природе [5, 11, 12]. Эти исследования основывались на методах принудительного слюноотделения для демонстрации передачи вируса, что не позволяет комарам исследовать или питаться естественным путем.
Косвенные методы, используемые для оценки передачи арбовирусов комарами, не прошли полной проверки, несмотря на их широкое использование в исследованиях компетентности переносчиков. В исследовании Styer et al. [13], было обнаружено, что комары доставляют примерно в 600 раз больше ВЗН после зондирования на мышах, чем высвобождаются методом принудительного слюноотделения (капиллярный метод), что позволяет предположить, что некоторые методы могут недооценивать передачу арбовируса живым животным-хозяевам. Соответственно, для дальнейшего изучения этой возможности мы сравнили три часто используемых косвенных показателя передачи арбовирусов (непрямые методы), а именно наличие вируса в ногах, SG и слюне, с прямыми оценками передачи от комаров мышам-сосункам («истинная скорость передачи» ) для определения наиболее информативного и эффективного прокси для передачи арбовируса в пяти комбинациях вектор-вирус.
Соответственно, для дальнейшего изучения этой возможности мы сравнили три часто используемых косвенных показателя передачи арбовирусов (непрямые методы), а именно наличие вируса в ногах, SG и слюне, с прямыми оценками передачи от комаров мышам-сосункам («истинная скорость передачи» ) для определения наиболее информативного и эффективного прокси для передачи арбовируса в пяти комбинациях вектор-вирус.
Методы
Виды комаров
Комаров выращивали из яиц в пластиковых лотках, а личинок кормили по мере необходимости либо тропическими хлопьями TetraMin® (Tetra GmbH, Мелле, Германия), либо 2% раствором порошка печени 3:2 и смесь пивных дрожжей. Взрослых особей содержали в клетках размером 30 × 30 × 30 см и снабжали 10% раствором сахарозы ad libidum на ватном тампоне. Ае. aegypti Колония Орландо (ORL) была получена от Службы сельскохозяйственных исследований Министерства сельского хозяйства США (USDA ARS, Гейнсвилл, Флорида, США) и первоначально получена от комаров, собранных в поле в Орландо, штат Флорида, в 1952 (Глория-Сориа и др. [14]). Колония Aedes triseriatus возникла из комаров, собранных в Уотерфорде, штат Коннектикут (США) в 1992 г. Колония Culex quinquefasciatus была создана из комаров, первоначально приобретенных у Benzon Research Inc. (Карлайл, Пенсильвания, США), и, как полагают, изначально был получен от комаров в северной Флориде.
[14]). Колония Aedes triseriatus возникла из комаров, собранных в Уотерфорде, штат Коннектикут (США) в 1992 г. Колония Culex quinquefasciatus была создана из комаров, первоначально приобретенных у Benzon Research Inc. (Карлайл, Пенсильвания, США), и, как полагают, изначально был получен от комаров в северной Флориде.
Вирусные штаммы
CHIKV LR2006-OPY1 (инвентарный номер GenBank KT449801.1) был получен из Всемирного справочного центра арбовирусов при Медицинском отделении Техасского университета, Галвестон, Техас (США). Первоначально этот штамм был выделен из сыворотки пациента, вернувшегося с острова Реюньон в 2006 г., и пять раз был пассирован на культуре клеток Vero, один раз на мышах-сосунках и один раз на клетках C6/36. ВНВ 2741-99 был выделен из Culex pipiens , собранных в Гринвиче, штат Коннектикут (США) в 1999 г., и был пассирован 4 раза на клетках Vero. ZIKV MR766 (номер доступа в GenBank MW143022.1) был получен из Справочной коллекции арбовирусов из Центров по контролю за заболеваниями (Форт-Коллинз, Колорадо, США). Этот штамм был первоначально выделен от сигнальной макаки-резуса в 1947 году в лесу Зика, Энтеббе, Уганда, и неоднократно переносился на мышей, дважды на культуре клеток Vero и один раз на культуре клеток C6/36. Штамм вируса Ла-Кросса (LACV) 78V-8853 был выделен в 1978 из Ae. triseriatus из Рочестера, штат Миннесота (США), и пассировали один раз на клетках Vero, два раза на мышах-сосунках и еще два раза на клетках Vero.
Этот штамм был первоначально выделен от сигнальной макаки-резуса в 1947 году в лесу Зика, Энтеббе, Уганда, и неоднократно переносился на мышей, дважды на культуре клеток Vero и один раз на культуре клеток C6/36. Штамм вируса Ла-Кросса (LACV) 78V-8853 был выделен в 1978 из Ae. triseriatus из Рочестера, штат Миннесота (США), и пассировали один раз на клетках Vero, два раза на мышах-сосунках и еще два раза на клетках Vero.
Экспериментальные инфекции
Внутригрудная инокуляция
Самкам комаров в возрасте от 6 до 10 дней внутригрудно инокулировали 69 нл вирусного раствора, приготовленного из замороженного вирусного запаса, содержащего приблизительно 17 бляшкообразующих единиц (БОЕ) вируса. Самок инкубировали при 28 °C и цикле 14:10 (свет:темнота) со свободным доступом к 10%-му раствору сахара из ватного тампона в течение внешнего инкубационного периода (EIP), описанного в таблице 1.
Таблица 1 Подробности эксперимента по внутригрудной инокуляцииПолноразмерная таблица
Инфекции полости рта
Самок комаров в возрасте от 6 до 10 дней рассортировали по литровым чашкам с сеткой и лишили сахара за 24 часа до начала эксперимента.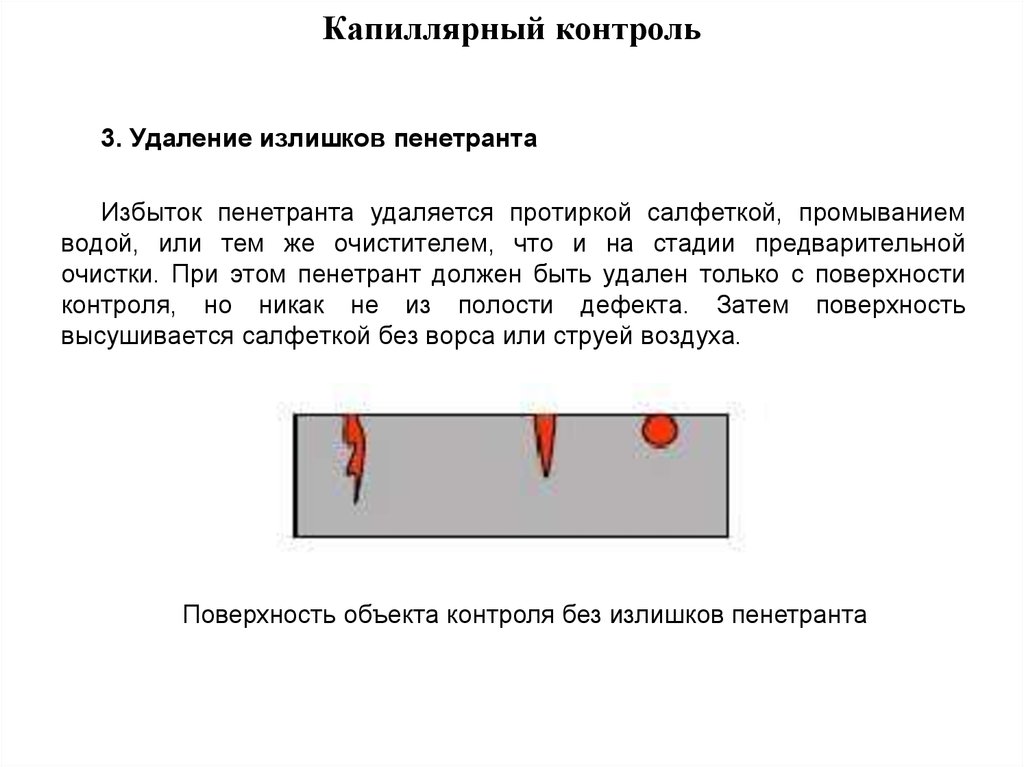 В день эксперимента комарам предлагали инфекционную кровяную муку, состоящую из смеси 1:1 свежевыращенной вирусной культуры и дефибринированной овечьей крови (HemoStat Labs, Диксон, Калифорния, США). Вирусную культуру получали путем инокуляции конфлюэнтного монослоя г. н.э. albopictus C6/36 в колбу Т25, содержащую 100 мкл исходного вируса CHIKV, с последующей 3-дневной инкубацией; культуру собирали в день эксперимента для приготовления смеси. Кровяную муку нагревали при 37 °C в течение 45 мин в системе с искусственными мембранами, выложенной оболочкой из свиной колбасы. Полностью напитавшихся комаров оставляли и инкубировали в течение 12 и 15 дней при 28 °C при цикле 14:10 (свет:темнота) со свободным доступом к 10%-ному раствору сахара, нанесенному на ватный тампон.
В день эксперимента комарам предлагали инфекционную кровяную муку, состоящую из смеси 1:1 свежевыращенной вирусной культуры и дефибринированной овечьей крови (HemoStat Labs, Диксон, Калифорния, США). Вирусную культуру получали путем инокуляции конфлюэнтного монослоя г. н.э. albopictus C6/36 в колбу Т25, содержащую 100 мкл исходного вируса CHIKV, с последующей 3-дневной инкубацией; культуру собирали в день эксперимента для приготовления смеси. Кровяную муку нагревали при 37 °C в течение 45 мин в системе с искусственными мембранами, выложенной оболочкой из свиной колбасы. Полностью напитавшихся комаров оставляли и инкубировали в течение 12 и 15 дней при 28 °C при цикле 14:10 (свет:темнота) со свободным доступом к 10%-ному раствору сахара, нанесенному на ватный тампон.
Оценки передачи
Было показано, что у иммунокомпетентных мышей-сосунков развивается системная инфекция и виремия при воздействии CHIKV [15], ZIKV [16, 17], LACV [18] и WNV [19]. В этом исследовании мы использовали инфекцию, развившуюся у мышей-сосунков после контакта, в качестве «истинной скорости передачи арбовируса» и сравнили эту скорость с оценками передачи, основанными на показателях тканей/слюны комаров. Пометы мышей-сосунков (смешанного пола) от беременных мышей CD-1 были получены из Charles River Laboratories (Уилмингтон, Массачусетс, США). Процедуры обращения с животными и ухода за ними были одобрены и проводились Комитетом по уходу и использованию животных Сельскохозяйственной экспериментальной станции штата Коннектикут (протокол № P28-17). Мышам-сосункам делали татуировки, чтобы отслеживать отдельных мышей из каждого помета. Отдельные комары были случайным образом распределены по отдельным мышам-сосункам по истечении соответствующего EIP (таблица 1). Каждому комару давали поесть зафиксированной мыши, помещенной на верхнюю часть экранированной клетки при 28 °C. После кормления у напитавшихся комаров удаляли ноги и крылья. Слюну собирали у комаров, вставляя их хоботок в микрокапиллярные гелевые наконечники P20, содержащие 5 мкл раствора 1:1 50% сахароза:фетальная бычья сыворотка, на 1 ч при комнатной температуре. Содержимое наконечника удаляли в пробирку с 50 мкл PBS-G (фосфатно-солевой буфер, 30% термоинактивированной кроличьей сыворотки, 0,5% желатина).
Пометы мышей-сосунков (смешанного пола) от беременных мышей CD-1 были получены из Charles River Laboratories (Уилмингтон, Массачусетс, США). Процедуры обращения с животными и ухода за ними были одобрены и проводились Комитетом по уходу и использованию животных Сельскохозяйственной экспериментальной станции штата Коннектикут (протокол № P28-17). Мышам-сосункам делали татуировки, чтобы отслеживать отдельных мышей из каждого помета. Отдельные комары были случайным образом распределены по отдельным мышам-сосункам по истечении соответствующего EIP (таблица 1). Каждому комару давали поесть зафиксированной мыши, помещенной на верхнюю часть экранированной клетки при 28 °C. После кормления у напитавшихся комаров удаляли ноги и крылья. Слюну собирали у комаров, вставляя их хоботок в микрокапиллярные гелевые наконечники P20, содержащие 5 мкл раствора 1:1 50% сахароза:фетальная бычья сыворотка, на 1 ч при комнатной температуре. Содержимое наконечника удаляли в пробирку с 50 мкл PBS-G (фосфатно-солевой буфер, 30% термоинактивированной кроличьей сыворотки, 0,5% желатина). Следует отметить, что Миллер и соавт. [20] недавно продемонстрировали, что кормление кровью непосредственно перед форсированным слюноотделением не влияет на отхаркивание арбовирусов. СГ были вскрыты. Брюшную полость, ноги и SG независимо гомогенизировали в 200 мкл PBS-G в 2-мл микроцентрифужной пробирке с использованием медных шариков Copperhead (Crosman Corp., Boomfield, NY, USA) и Mixer Mill 400 (Retsch GmbH, Haan, Germany). в течение 30–60 с при частоте 24 Гц. Все образцы хранили при температуре - 80 °C до выделения РНК.
Следует отметить, что Миллер и соавт. [20] недавно продемонстрировали, что кормление кровью непосредственно перед форсированным слюноотделением не влияет на отхаркивание арбовирусов. СГ были вскрыты. Брюшную полость, ноги и SG независимо гомогенизировали в 200 мкл PBS-G в 2-мл микроцентрифужной пробирке с использованием медных шариков Copperhead (Crosman Corp., Boomfield, NY, USA) и Mixer Mill 400 (Retsch GmbH, Haan, Germany). в течение 30–60 с при частоте 24 Гц. Все образцы хранили при температуре - 80 °C до выделения РНК.
Мышей содержали в стеллажной системе клеток Thoren (Thoren Caging Systems Inc., Хэзлтон, Пенсильвания, США) с НЕРА-фильтрацией при цикле 12:12 (свет:темнота) и наблюдали ежедневно, пока у них не проявились симптомы болезни или максимально количество дней после воздействия, соответствующее внутреннему инкубационному периоду (IIP), указанному в таблице 1. В этот момент мышей подвергали эвтаназии, а одну заднюю конечность и ткань мозга собирали, гомогенизировали в 500 мкл PBS-G (как описано выше). ) и хранили при температуре - 80 °C до выделения РНК.
) и хранили при температуре - 80 °C до выделения РНК.
Вирусная диссеминация комаров после ИТ инъекции была подтверждена тестированием ножек комаров с помощью ПЦР в реальном времени (ОТ-ПЦР). Инфицирование при оральном питании было подтверждено исследованием брюшка комара тем же методом. Способность комара к передаче вируса оценивалась по четырем параметрам: (i) обнаружение вируса в лапках комара; (ii) обнаружение вируса в SG комаров; (iii) обнаружение вируса в слюне комаров; и (iv) развитие системной инфекции у подвергшихся воздействию мышей-сосунков.
Обнаружение вирусов
Мы максимизировали нашу способность обнаруживать присутствие арбовирусов в образцах путем скрининга вирусных копий РНК с помощью ОТ-ПЦР. Этот метод обнаружения более чувствителен, чем количественная оценка инфекционных частиц с помощью анализа бляшек, потому что на каждую арбовирусную инфекционную частицу приходится как минимум на 10 2 –10 4 больше РНК-вирусных частиц [20,21,22].
РНК экстрагировали из 50 мкл гомогенизированного раствора ткани и слюны с использованием системы очистки KingFisher™ Flex (Thermo Fisher Scientific, Уолтем, Массачусетс, США) с набором Mag-Bind® Viral DNA/RNA Kit (Omega Bio-Tek, Норкросс, Джорджия, США) и элюировали в конечном объеме 50 мкл буфера 1/10X TE (трис-ЭДТА). Затем 2-мкл аликвоту этого элюата использовали в каждой 10-мкл реакции ОТ-ПЦР. Наличие вируса определяли в двух повторностях с помощью набора универсальных зондов I-Taq™ 1-Step-Kit (BioRad Laboratories, Геркулес, Калифорния, США) с использованием праймеров и зондов, описанных в дополнительном файле 1: Таблица S1. Образцы размораживали только один раз. Результаты были проанализированы с помощью программного обеспечения BioRad CFX Maestro™ для Mac 1.1. v.4.1.2 (BioRad Laboratories) с использованием базового уровня 100. Комар считался инфицированным, если вирусная РНК была обнаружена в брюшной полости, и считался диссеминированным, если ноги были положительными. Пороговое значение цикла (Ct) < 37 использовалось в анализах ОТ-ПЦР, чтобы считать образец положительным для WNV, LACV и ZIKV, а значение Ct < 35 использовалось для CHIKV; эти пороговые значения были основаны на пределе обнаружения нашего анализа, установленном из стандартных кривых (дополнительный файл 1: дополнительная информация; рис. S1; таблица S2).
S1; таблица S2).
Статистический анализ
Доля положительных образцов сравнивалась с использованием точного критерия Фишера [23] с применением поправки Холма для множественного тестирования [24], реализованной функцией prop.fisher.test() в fmsb v.0.7. 1 пакет [25] из R v. 4.0.3. [26]. Графики были сгенерированы в R v. 4.0.3. [26] и 95%-ные биномиальные доверительные интервалы для каждой пропорции были рассчитаны с помощью функции prop.test(), доступной в пакете статистики ядра программного обеспечения. Двухвыборочный t-критерий Уэлча использовался для сравнения точности ног и слюны для прогнозирования передачи.
Результаты
Оценка показателей передачи у комаров с диссеминированными инфекциями
Мы исследовали точность слюнных желез и слюны в качестве показателей передачи арбовирусов в множественных парах комаров-вирусов с использованием комаров, инфицированных внутригрудной (ИТ) инокуляцией. Этот подход был использован для обеспечения распространения вируса во время анализа передачи. По истечении соответствующего ЭИП (табл. 1) комарам давали поесть мышам-сосункам и определяли наличие арбовируса в ногах, слюнных железах и слюне. Наличие вируса в ногах использовалось для подтверждения диссеминации. «Истинная скорость передачи» была основана на проценте мышей-сосунков, у которых развилась инфекция в пределах IIP, а точность каждого показателя передачи определялась путем сравнения этого значения с долей положительных образцов, полученных из SG и слюны.
По истечении соответствующего ЭИП (табл. 1) комарам давали поесть мышам-сосункам и определяли наличие арбовируса в ногах, слюнных железах и слюне. Наличие вируса в ногах использовалось для подтверждения диссеминации. «Истинная скорость передачи» была основана на проценте мышей-сосунков, у которых развилась инфекция в пределах IIP, а точность каждого показателя передачи определялась путем сравнения этого значения с долей положительных образцов, полученных из SG и слюны.
Сначала мы оценили передачу трех арбовирусов (CHIKV, ZIKV и WNV) Ae. эгипт. Все протестированные лапки комаров дали положительный результат на соответствующий инъецированный вирус, что подтверждает диссеминацию (рис. 1). Мозг и/или задние конечности 82,4% (14/17) мышей-сосунков дали положительный результат на CHIKV после кормления инфицированными Ae. aegypti (рис. 1а). Исследование прокси выявило 100% (17/17) и 0% (0/17) положительных результатов для слюнных желез и слюны соответственно (рис. 1а). Статистический анализ не выявил существенной разницы в частоте инфицирования СГ и мышей (9).1301 P = 0,68), в то время как положительный результат слюны, собранной с помощью форсированного слюноотделения, значительно отличался от частоты заражения мышей ( P < 0,001).
Статистический анализ не выявил существенной разницы в частоте инфицирования СГ и мышей (9).1301 P = 0,68), в то время как положительный результат слюны, собранной с помощью форсированного слюноотделения, значительно отличался от частоты заражения мышей ( P < 0,001).
Расчетная скорость передачи для комаров Aedes aegypti , которым вводили три разных арбовируса, в зависимости от типа образца. а ЧИКВ ( N = 17), б ЗНВ ( N = 18/ # 17), в ЗИКВ ( N 7= 17 912). Столбики ошибок представляют 95% биномиальные доверительные интервалы. Звездочками (*) отмечены значимые сравнения на основе точного критерия Фишера [23] после поправки Холма для множественного тестирования [24]. Сокращения : CHIKV, вирус Чикунгунья; SG , слюнные железы; ВЗН, вирус Западного Нила; ZIKV, вирус Зика
Полноразмерное изображение
В то время как Ae. aegypti не считается переносчиком ВЗН, исследования продемонстрировали его компетентность в лаборатории, и, таким образом, он использовался для дальнейшей оценки точности прокси передачи. Зараженные г. н.э. aegypti передал ВЗН 61,1% подвергшихся воздействию мышей (11/17; рис. 1b). Как и в случае с CHIKV, все SG были положительными (100%, 18/18), однако доля комаров с ВЗН в выделениях слюны составила 27,8% (5/17) (рис. 1b). Основываясь на этих выводах, результаты для SG значительно переоценивают случаи передачи по сравнению с показателями заражения мышей ( P = 0,03). И наоборот, процент положительных образцов слюны был ниже, чем у мышей, положительных на ВЗН, но эта разница не отличалась статистически (9).1301 P = 0,17) (рис. 1б).
aegypti не считается переносчиком ВЗН, исследования продемонстрировали его компетентность в лаборатории, и, таким образом, он использовался для дальнейшей оценки точности прокси передачи. Зараженные г. н.э. aegypti передал ВЗН 61,1% подвергшихся воздействию мышей (11/17; рис. 1b). Как и в случае с CHIKV, все SG были положительными (100%, 18/18), однако доля комаров с ВЗН в выделениях слюны составила 27,8% (5/17) (рис. 1b). Основываясь на этих выводах, результаты для SG значительно переоценивают случаи передачи по сравнению с показателями заражения мышей ( P = 0,03). И наоборот, процент положительных образцов слюны был ниже, чем у мышей, положительных на ВЗН, но эта разница не отличалась статистически (9).1301 P = 0,17) (рис. 1б).
Aedes aegypti передал ZIKV 88,3% подвергшихся воздействию мышей (15/17) (рис. 1c), при этом все SG и ни один из выделений слюны дал положительный результат (рис. 1c). Статистически передача ZIKV лучше оценивалась по положительному результату SG ( P = 1,00), чем по положительному результату слюны ( P < 0,001).
С Ae. aegypti не является естественным переносчиком ВЗН, мы провели анализ передачи на Cx. пятифасциат комаров, основных переносчиков ВЗН в Северной Америке, были инокулированы внутригрудным путем. Все Сх. quinquefasciatus с диссеминированной инфекцией также имел положительный SG (100%; рис. 2) через 7 и 10 дней после заражения (dpi). Несмотря на наши усилия, мы зафиксировали только шесть из 16 комаров, которые либо прощупывали мышей, либо питались ими. Все мыши, подвергшиеся воздействию ВЗН, заразились (100%; рис. 2). ВЗН был обнаружен в 63,2% (24/38) и 72,7% (24/33) образцов слюны 7 и 10 dpi соответственно (рис. 2). Оценки скорости передачи с использованием слюны существенно не отличались от скорости передачи, наблюдаемой у мышей-сосунков при 10 днях на дюйм (9).1301 P = 1,00), равно как и оценки, основанные на SG ( P = 1,00). Однако из-за небольшого числа мышей, подвергшихся воздействию, эти результаты следует интерпретировать с осторожностью.
Расчетная скорость передачи для комаров Culex quinquefasciatus , инъецированных ВЗН, в зависимости от типа образца при 7 dpi (темно-серые столбцы; N = 38) и 10 dpi (светло-серые столбцы; N = 33 † ). † SG были выделены только у 15 из 33 комаров при 10 dpi, и только 6 мышей были успешно подвергнуты воздействию ВЗН. Столбики ошибок представляют 95% биномиальные доверительные интервалы. Звездочками (*) отмечены значимые сравнения при 10 dpi на основе точного критерия Фишера [23] после поправки Холма для множественного тестирования [24]. Аббревиатуры : dpi, Дни после заражения
Полноразмерное изображение
Далее мы оценили точность прокси-передачи с использованием члена семейства Peribunyaviridae (LACV) и Ae. triseriatus комаров. Высокая скорость передачи наблюдалась у мышей-сосунков, которых кормили инфицированными LACV 9.1301 г. н.э. triseriatus (16/17, 94,1%). Все SG рассеянных комаров были положительными (100%), в то время как 47,1% (8/17) образцов слюны были положительными на LACV (рис. 3). Положительный результат SG лучше отражал передачу LACV мышам-сосункам, чем через слюну ( P = 1,00 и P = 0,0264 соответственно) в этой системе.
Все SG рассеянных комаров были положительными (100%), в то время как 47,1% (8/17) образцов слюны были положительными на LACV (рис. 3). Положительный результат SG лучше отражал передачу LACV мышам-сосункам, чем через слюну ( P = 1,00 и P = 0,0264 соответственно) в этой системе.
Оценочная скорость передачи для комаров Aedes triseriatus , инъецированных LACV, на основе типа образца ( N = 17). Столбики ошибок представляют 95% биномиальные доверительные интервалы. Звездочками (*) отмечены значимые сравнения на основе точного критерия Фишера [23] после поправки Холма для множественного тестирования [24]. Аббревиатуры : LACV, вирус Ла-Кросс
Изображение полного размера
Влияние пути заражения на прокси-серверы передачи
маршрут повлиял на точность передачи прокси путем орального заражения г. н.э. aegypti с ЧИКВ. Инфекционный статус и способность передачи комаров, которых кормили зараженной CHIKV кровяной мукой, определяли через 12 и 15 дней на дюйм. Для анализа использовали только полностью сытых комаров. Уровень инфицирования, оцененный по наличию вируса в организме, составил 52,9% (9/17) при 12 dpi и достиг 100% к 15 dpi (18/18). Все комары с CHIKV-положительными ногами имели CHIKV-положительный SG. Среди инфицированных комаров (положительные тела) у 88,9% (8/9) развилась диссеминированная инфекция при 12 dpi и у 83,3% (15/18) при 15 dpi. Из мышей-сосунков, которых кормил комар с диссеминированной инфекцией, 62,5% (5/8) заразились от комаров с 12-дневным ЭИП и 80% (12/15) от комаров с 15-дневным ЭИП ( Рис. 4). Процент мышей-сосунков, заразившихся комаром, статистически не отличался от положительного результата на основе лапок или SG при 12 днях на дюйм (9).1301 P = 0,6) или 15 dpi ( P = 0,6724). При 12 днях на дюйм не было обнаружено положительной слюны, и только один образец был положительным на CHIKV при 15 днях на дюйм. Положительность слюны статистически не отличалась от таковой у мышей-сосунков на 12-й день EIP ( P = 0,1025), но значительно отличалась на 15-й день EIP ( P < 0,001).
Для анализа использовали только полностью сытых комаров. Уровень инфицирования, оцененный по наличию вируса в организме, составил 52,9% (9/17) при 12 dpi и достиг 100% к 15 dpi (18/18). Все комары с CHIKV-положительными ногами имели CHIKV-положительный SG. Среди инфицированных комаров (положительные тела) у 88,9% (8/9) развилась диссеминированная инфекция при 12 dpi и у 83,3% (15/18) при 15 dpi. Из мышей-сосунков, которых кормил комар с диссеминированной инфекцией, 62,5% (5/8) заразились от комаров с 12-дневным ЭИП и 80% (12/15) от комаров с 15-дневным ЭИП ( Рис. 4). Процент мышей-сосунков, заразившихся комаром, статистически не отличался от положительного результата на основе лапок или SG при 12 днях на дюйм (9).1301 P = 0,6) или 15 dpi ( P = 0,6724). При 12 днях на дюйм не было обнаружено положительной слюны, и только один образец был положительным на CHIKV при 15 днях на дюйм. Положительность слюны статистически не отличалась от таковой у мышей-сосунков на 12-й день EIP ( P = 0,1025), но значительно отличалась на 15-й день EIP ( P < 0,001).
Расчетная скорость передачи для перорально инфицированного Ae. aegypti комаров с CHIKV в зависимости от типа образца после 12 dpi ( N = 8) ( a ) и 15 точек на дюйм ( N = 15) ( b ). Столбики погрешностей представляют 95% биномиальные доверительные интервалы. Звездочки (*) указывают на значимые сравнения, основанные на точном критерии Фишера [23] после поправки Холма для множественного тестирования [24]
Полноразмерное изображение
Точность прокси передачи
Во всех проанализированных парах вектор-вирус статус инфекции SG был идентичен ногам, независимо от пути заражения (все попарные сравнения P = 1,00). Наличие вируса в ногах (и, следовательно, SG) более точно отражало значения прямой передачи мышам-сосункам, завышая передачу в среднем на 18,29 ± 14,09% (рис. 5). Для сравнения, передача, оцененная по положительному результату вируса в слюне, занижает передачу на 59,43 ± 23,55% (рис.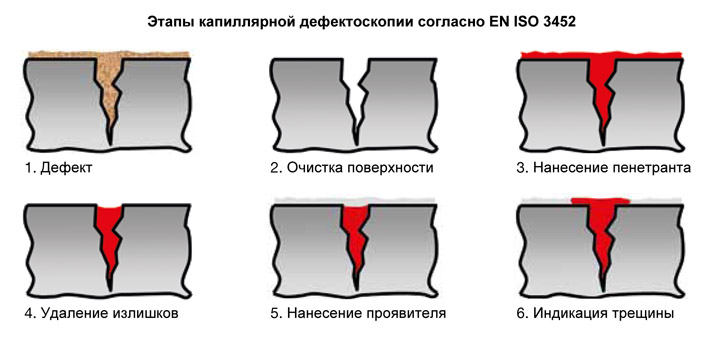 5). Разница в точности была значительной (t-критерий Велча, P < 0,001), и закономерность наблюдалась независимо от способа заражения (внутримышечная инокуляция по сравнению с пероральным кормлением).
5). Разница в точности была значительной (t-критерий Велча, P < 0,001), и закономерность наблюдалась независимо от способа заражения (внутримышечная инокуляция по сравнению с пероральным кормлением).
Точность косвенных показателей по сравнению с оценками прямой передачи вируса мышам-сосункам. Вертикальная ось показывает разницу в процентах передачи, оцененных между прокси-инфекцией и инфекцией мышей. Различные оттенки серого представляют разные вирусы. Эксперименты с внутригрудной инъекцией обозначены большими кружками, а оральные инфекции — треугольниками. Среднее значение и стандартное отклонение прокси показаны маленьким ромбом и прикрепленной вертикальной линией соответственно
Изображение в полный размер
Обсуждение
Точная оценка способности популяции комаров передавать возбудитель имеет решающее значение для определения его способности служить переносчиком болезни. В лаборатории это достигается путем форсированного слюноотделения отдельных комаров, кормления комаров восприимчивыми позвоночными хозяевами или анализа периферических тканей, таких как ноги, головы и/или SG, на вирусную инфекцию. В последние годы из-за стоимости и растущих ограничений на использование позвоночных принудительное слюноотделение стало общепринятым методом оценки потенциала передачи, несмотря на отсутствие эмпирических данных, демонстрирующих его точность в прогнозировании передачи.
В последние годы из-за стоимости и растущих ограничений на использование позвоночных принудительное слюноотделение стало общепринятым методом оценки потенциала передачи, несмотря на отсутствие эмпирических данных, демонстрирующих его точность в прогнозировании передачи.
Методы форсированного слюноотделения не стандартизированы, и наши данные показывают, что в нашей установке они искажают передачу арбовирусов позвоночным хозяевам. В этих методах комары могут быть анестезированы холодом, CO 2 или триэтиламином, после чего их хоботки погружаются в один из многих возможных разбавителей для сбора слюны (сахар, вирусная среда, FBS или иммерсионное масло). Смит и др. [27] не сообщили об отсутствии различий в титрах вируса венесуэльского лошадиного энцефалита между слюной, собранной в среде с минеральным маслом или фетальной бычьей сывороткой (FBS). Миллер и др. [20] постоянно обнаруживали, что то же самое верно для CHIKV и ZIKV, но отметили, что слюна, собранная в минеральном масле, чаще была положительной на вирус, чем слюна, собранная в среде FBS [20]. Каждая из этих переменных может по-разному влиять на физиологию комаров и процесс слюноотделения и может объяснять наблюдаемую изменчивость между исследованиями. Это было продемонстрировано в трех исследованиях, посвященных г. н.э. aegypti через форсированное слюноотделение, при котором от 0 до примерно 45 % комаров, подвергшихся воздействию ZIKV, обнаруживают вирус в слюне после 14-дневного EIP [28,29,30]. Такие расхождения могут быть связаны с различиями между штаммами комаров и вирусов или предполагают различия в методах принудительного слюноотделения. Хотя цель этого исследования не заключалась в том, чтобы различать различные методы принудительного слюноотделения, мы обнаружили, что принудительное слюноотделение в целом недооценивает потенциал передачи арбовируса по сравнению с кормлением живыми животными.
Каждая из этих переменных может по-разному влиять на физиологию комаров и процесс слюноотделения и может объяснять наблюдаемую изменчивость между исследованиями. Это было продемонстрировано в трех исследованиях, посвященных г. н.э. aegypti через форсированное слюноотделение, при котором от 0 до примерно 45 % комаров, подвергшихся воздействию ZIKV, обнаруживают вирус в слюне после 14-дневного EIP [28,29,30]. Такие расхождения могут быть связаны с различиями между штаммами комаров и вирусов или предполагают различия в методах принудительного слюноотделения. Хотя цель этого исследования не заключалась в том, чтобы различать различные методы принудительного слюноотделения, мы обнаружили, что принудительное слюноотделение в целом недооценивает потенциал передачи арбовируса по сравнению с кормлением живыми животными.
Прямое кормление лабораторных животных является золотым стандартом для оценки передачи арбовирусов, поскольку оно наиболее точно воспроизводит биологические и физиологические условия, связанные с естественными случаями передачи.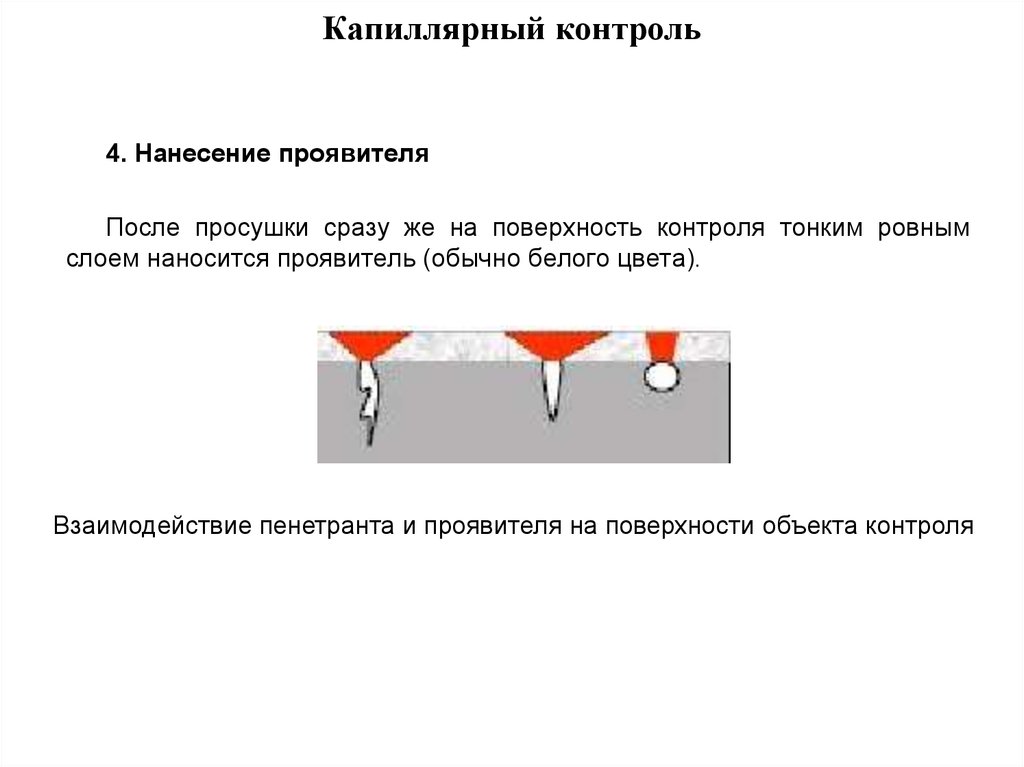 Предыдущие исследования показали, что беспородные мыши-сосуны являются надежной животной моделью для CHIKV, WNV, ZIKV и LACV [15,16,17,18,19], так как у них развивается виремия, а тяжелая болезнь и смертность часто сопровождают инфекцию [31]. Таким образом, мы уверены, что скорости прямой передачи, которые мы наблюдали для этих патогенов, точно отражают их потенциал передачи. Тем не менее, хотя прямое кормление комаров может быть очень чувствительным для оценки передачи арбовирусов, это зависит от наличия подходящей животной модели, что ограничивает применимость этого подхода для многих арбовирусов.
Предыдущие исследования показали, что беспородные мыши-сосуны являются надежной животной моделью для CHIKV, WNV, ZIKV и LACV [15,16,17,18,19], так как у них развивается виремия, а тяжелая болезнь и смертность часто сопровождают инфекцию [31]. Таким образом, мы уверены, что скорости прямой передачи, которые мы наблюдали для этих патогенов, точно отражают их потенциал передачи. Тем не менее, хотя прямое кормление комаров может быть очень чувствительным для оценки передачи арбовирусов, это зависит от наличия подходящей животной модели, что ограничивает применимость этого подхода для многих арбовирусов.
Альтернативные подходы к оценке передачи вируса комарами включают тестирование ткани головы/суговидной железы с помощью ПЦР, иммунофлуоресцентного анализа (ИФА) или титрования вируса. В этом исследовании мы исследовали ткань SG с помощью ПЦР-анализа в качестве еще одного показателя передачи и обнаружили, что он переоценил скорость прямой передачи мышам, но это было ближе к скорости прямой передачи, чем те, которые были оценены по принудительному слюноотделению. Положительный результат SG был идентичен таковому в ногах в этой системе, несмотря на наши попытки промыть SG после вскрытия. Возможное объяснение состоит в том, что контаминация СГ окружающей гемолимфой могла привести к завышению количества зарегистрированных положительных образцов СГ и что этот параметр может отражать не реальную инфекцию СГ, а скорее прикрепление вирусных частиц к внешней стороне этой ткани. Если бы мы выполнили IFA, уровень заражения от SG, возможно, был бы более близок к результатам прямого кормления. Тем не менее, эти результаты показывают, что скорость диссеминации (измеряемая по ногам) может быть хорошим показателем передачи без необходимости трудоемкого и технически сложного вскрытия SG.
Положительный результат SG был идентичен таковому в ногах в этой системе, несмотря на наши попытки промыть SG после вскрытия. Возможное объяснение состоит в том, что контаминация СГ окружающей гемолимфой могла привести к завышению количества зарегистрированных положительных образцов СГ и что этот параметр может отражать не реальную инфекцию СГ, а скорее прикрепление вирусных частиц к внешней стороне этой ткани. Если бы мы выполнили IFA, уровень заражения от SG, возможно, был бы более близок к результатам прямого кормления. Тем не менее, эти результаты показывают, что скорость диссеминации (измеряемая по ногам) может быть хорошим показателем передачи без необходимости трудоемкого и технически сложного вскрытия SG.
Плохая эффективность слюны, собранной через капиллярные трубки, в качестве показателя передачи наблюдалась независимо от способа заражения. Хотя мы знаем, что заражение через ИТ-инъекцию не отражает естественный путь заражения, основное внимание в этой работе уделялось измерению эффективности различных методов для оценки скорости передачи после установления инфекции.![]() Мы полагались на ИТ-прививки в большинстве исследований, чтобы увеличить размер выборки наших методов лечения и свести к минимуму использование позвоночных. С помощью ИТ-инъекций мы смогли обойти любую потенциальную инфекцию средней кишки и/или обойти барьеры, тем самым гарантируя, что у всех протестированных комаров была диссеминированная инфекция. Далее мы исследовали, зависели ли наши результаты от способа заражения, выполнив как ИТ, так и оральное инфицирование с помощью г. н.э. aegypti и ЧИКВ. Более длительный EIP рассматривался для оральной инфекции, поскольку известно, что ИТ-прививка снижает EIP [15, 27, 29, 30]. Данные об инфекциях полости рта подтверждают наши выводы о том, что методы форсированного слюноотделения значительно недооценивают передачу в этой системе. В этих экспериментах обнаружение вируса в слюне оказалось более трудным для Ae. aegypti , чем для двух других проверенных видов, независимо от вируса. Исследования показали низкий уровень передачи CHIKV и ZIKV в г.
Мы полагались на ИТ-прививки в большинстве исследований, чтобы увеличить размер выборки наших методов лечения и свести к минимуму использование позвоночных. С помощью ИТ-инъекций мы смогли обойти любую потенциальную инфекцию средней кишки и/или обойти барьеры, тем самым гарантируя, что у всех протестированных комаров была диссеминированная инфекция. Далее мы исследовали, зависели ли наши результаты от способа заражения, выполнив как ИТ, так и оральное инфицирование с помощью г. н.э. aegypti и ЧИКВ. Более длительный EIP рассматривался для оральной инфекции, поскольку известно, что ИТ-прививка снижает EIP [15, 27, 29, 30]. Данные об инфекциях полости рта подтверждают наши выводы о том, что методы форсированного слюноотделения значительно недооценивают передачу в этой системе. В этих экспериментах обнаружение вируса в слюне оказалось более трудным для Ae. aegypti , чем для двух других проверенных видов, независимо от вируса. Исследования показали низкий уровень передачи CHIKV и ZIKV в г. н.э. aegypti ORL по сравнению с другими штаммами [32, 33], и мы не можем исключить возможность того, что наши результаты могут частично отражать общий более низкий уровень компетентности этой конкретной колонии.
н.э. aegypti ORL по сравнению с другими штаммами [32, 33], и мы не можем исключить возможность того, что наши результаты могут частично отражать общий более низкий уровень компетентности этой конкретной колонии.
Недостаточная точность форсированного слюноотделения для отражения передачи арбовирусов, вероятно, связана с низкими титрами вируса в слюне на ранних стадиях передачи, ниже порогов обнаружения [20, 22], внутрипопуляционной изменчивостью вирусной мокроты [22], что также повлияло различиями в парах вектор-вирус [27] и/или возможностью того, что комары могут повторно заглатывать свою слюну во время форсированного слюноотделения, как они это делают во время искусственного вскармливания кровью [20]. Более того, есть доказательства того, что SG по-разному реагируют на употребление сахарной муки и кровяной муки [39].]. Следовательно, слюна, собранная во время форсированного слюноотделения, может не точно имитировать слюну, отхаркиваемую во время кормления кровью. Взаимодействие всех этих переменных, еще более усиленное отсутствием стандартизации методов форсированного слюноотделения в лабораториях, предостерегает от использования слюны в качестве показателя передачи без предварительного знания исследуемой системы.
Выводы
Наши результаты показывают, что наличие вируса в ногах или SG (скорость распространения) в целом являются более точными предикторами передачи арбовирусов, чем обнаружение вируса в слюне, собранной с использованием широко применяемого метода форсированного слюноотделения, и подвержены меньшим техническим вариациям. Однако подход, основанный только на ногах, для оценки скорости передачи может не подходить для всех исследований. При изучении компетентности новой пары вирус-вектор следует применять несколько подходов для оценки скорости передачи, чтобы изучить возможность существования инфекционного барьера SG или барьера ускользания. Более того, использование ветвей в качестве прокси-сервера передачи должно использоваться в судебном порядке при проверке EIP. Основываясь на кинетике инфекции, гемолимфа/ноги будут инфицированы до передачи инфекции; поэтому исследования, оценивающие передачу только через ноги, могут сообщать об укорочении EIP.
Доступность данных и материалов
Все данные, полученные или проанализированные в ходе этого исследования, включены в эту опубликованную статью и ее дополнительные информационные файлы.
Сокращения
- ЧИКВ:
Вирус Чикунгунья
- EIP:
Внешний инкубационный период
- ИИП:
Собственный инкубационный период
- ИТ:
Внутригрудная инокуляция
- ЛАКВ:
Вирус Ла-Кросс
- Орл:
Aedes aegypti Штамм Орландо
- БОЕ:
Налетообразующие агрегаты
- SG:
Слюнные железы
- ВНВ:
Вирус Западного Нила
- ЗИКВ:
Вирус Зика
Ссылки:
- «>
Armstrong PM, Rico-Hesse R. Эффективность штаммов вируса денге серотипа 2 для заражения и распространения в Aedes aegypti . Am J Trop Med Hyg. 2003; 68: 539–44.
ПабМед Статья Google ученый
Li MI, Wong PSJ, Ng LC, Tan CH. Оральная чувствительность Сингапура Aedes ( Stegomyia ) aegypti (Linnaeus) к вирусу Зика. PLOS Negl Trop Dis. 2012;6:e1792.
ПабМед ПабМед Центральный Статья Google ученый
Moncayo AC, Fernandez Z, Ortiz D, Diallo M, Sall A, Hartman S, et al. Возникновение денге и адаптация к околодомовым комарам.
 Эмердж Инфекция Дис. 2004; 10:1790–6.
Эмердж Инфекция Дис. 2004; 10:1790–6.ПабМед ПабМед Центральный Статья Google ученый
Азар SR, Уивер SC. Компетенция переносчика: чему нас научил вирус Зика? Вирусы. 2019;11:867.
КАС ПабМед Центральный Статья Google ученый
Циота А.Т., Белосукня С.М., Цинк С.Д., Брехер М., Эрбар Д.Дж., Моррисетт М.Н. и др. Воздействие штамма вируса Зика и видов комаров Aedes на компетентность переносчиков. Эмердж Инфекция Дис. 2017;23:1110–7.
КАС пабмед ПабМед Центральный Статья Google ученый
Гарсия-Луна С.М., Вегер-Лукарелли Дж., Рюкерт С., Мурриета Р.А., Янг М.С., Байас А.Д. и др. Различия в компетенции по передаче ZIKV между Aedes aegypti и Aedes albopictus в Мексике. PLOS Negl Trop Dis.
 2018;12:e0006599.
2018;12:e0006599.ПабМед ПабМед Центральный Статья Google ученый
Глория-Сориа А., Пейн А.Ф., Бялосукня С.М., Стаут Дж., Матиас Н., Иствуд Г. и др. Векторная компетенция Aedes albopictus популяций с северо-востока США на вирусы Чикунгунья, Денге и Зика. Am J Trop Med Hyg. 2021; 104: 1123–30.
Google ученый
Ryckebusch F, Berthet M, Missé D, Choumet V. Заражение французской популяции Aedes albopictus и Aedes aegypti (штамм Paea) вирусом Зика показывает низкую скорость передачи через слюну этих переносчиков. Int J Mol Sci. 2017;18:2384.
Центральный пабмед Статья Google ученый
Санчес-Варгас I, Олсон К.Е., черный туалет. Генетическая основа барьеров слюнных желез для передачи арбовирусов. Насекомые.
 2021;12:73.
2021;12:73.ПабМед ПабМед Центральный Статья Google ученый
Азар С.Р., Раунди С.М., Росси С.Л., Хуанг Дж.Х., Леал Г., Юн Р. и др. Компетенция дифференциального вектора Aedes albopictus популяций из Америки на вирус Зика. Am J Trop Med Hyg. 2017;97:330–9.
КАС пабмед ПабМед Центральный Статья Google ученый
Roundy CM, Azar SR, Rossi SL, Huang JH, Leal G, Yun R, et al. Изменение компетентности комаров Aedes aegypti в отношении передачи вируса Зика. Эмердж Инфекция Дис. 2017;23:625–32.
ПабМед ПабМед Центральный Статья Google ученый
Стайер Л.М., Кент К.А., Олбрайт Р.Г., Беннет С.Дж., Крамер Л.Д., Бернард К.А. Комары прививают высокие дозы вируса Западного Нила, когда они исследуют и питаются живыми хозяевами.
 PLoS Патог. 2007; 3:132.
PLoS Патог. 2007; 3:132.Артикул Google ученый
Глория-Сориа А., Согигиан Дж., Келлнер Д., Пауэлл Дж.Р. Генетическое разнообразие лабораторных штаммов и значение для исследований: случай Aedes aegypti . PLoS Negl Trop Dis. 2019;13:0007930.
Артикул Google ученый
Couderc T, Chrétien F, Schilte C, Disson O, Brigitte M, Guivel-Benhassine F, et al. Мышиная модель чикунгуньи: молодой возраст и неэффективная передача сигналов интерферона типа I являются факторами риска тяжелого заболевания. PLoS Патог. 2008; 4:29.
Артикул Google ученый
Yu J, Liu X, Ke C, Wu Q, Lu W, Qin Z и др. Эффективные модели мышей-сосунков C57BL/6, Kunming и BALB/c с заметными неврологическими проявлениями инфекции, вызванной вирусом Зика. Вирусы. 2017;9:165.

Центральный пабмед Статья Google ученый
Ядав П.Д., Кумар В., Кумар С., Моте К.С., Маджумдар Т.Д., Гокхале М. и др. Патогенез вируса Зика у детенышей мышей после естественной передачи через укус инфицированных комаров. Интервирусология. 2017;60:227–34.
КАС пабмед Статья Google ученый
Полсон С.Л., Гримстад П.Р., Крейг ГБ. Средняя кишка и слюнные железы препятствуют распространению вируса Ла-Кросс у комаров 9-го века.1301 группа Aedes triseriatus . Мед Вет Энтомол. 1989; 3: 113–23.
КАС пабмед Статья Google ученый
Sudeep AB, Mandar P, Ghodke YK, George RP, Gokhale MD. Переносная компетенция двух индийских популяций комаров Culex quinquefasciatus (Diptera: Culicidae ) в отношении трех штаммов вируса Западного Нила.
 Дж. Вектор Борн Дис. 2015;52:185.
Дж. Вектор Борн Дис. 2015;52:185.КАС пабмед Google ученый
Миллер М.Р., Соренсен М.Р., Маркл Э.Д., Кларксон Т.С., Найт А.Л., Савран М.Дж. и др. Характеристика и количественная оценка передачи арбовирусов Aedes aegypti с использованием форсированного слюноотделения и анализа крови. Насекомые. 2021;12:304.
ПабМед ПабМед Центральный Статья Google ученый
Аасков Дж., Бузакотт К., Четверг Х.М., Лоури К., Холмс Э.К. Длительная передача дефектных РНК-вирусов людям и Aedes комаров. Наука. 2006; 311: 236–8.
КАС пабмед Статья Google ученый
Mayton EH, Hernandez HM, Vitek CJ, Christofferson RC. Метод повторного лонгитудинального отбора проб отдельных особей Aedes aegypti на потенциал передачи арбовирусов.
 Насекомые. 2021;12:292.
Насекомые. 2021;12:292.ПабМед ПабМед Центральный Статья Google ученый
Фишер Р.А. Статистические методы для научных работников. Логика индуктивного вывода. J Royal Stat Soc Ser A. 1935; 98: 39–54.
Артикул Google ученый
Холм С. Простая процедура многократного последовательного отбраковывания. Scand J Stat. 1979; 6: 65–70.
Google ученый
Наказава М. fmsb: Функции для книги медицинской статистики с некоторыми демографическими данными. Пакет R версии 0.7.1. https://CRAN.R-project.org/package=fmsb. По состоянию на 18 декабря 2021 г.
R Основная команда. R: Язык и среда для статистических вычислений. 2016. Вена: R Foundation для статистических вычислений. https://www.r-project.org. По состоянию на 18 декабря 2021 г.

Smith DR, Carrara AS, Aguilar PV, Weaver SC. Оценка методов оценки потенциала передачи вируса венесуэльского лошадиного энцефалита комарами и оценка титров слюны комаров. Am J Trop Med Hyg. 2005; 73:33–9.
ПабМед Статья Google ученый
Weger-Lucarelli J, Rückert C, Chotiwan N, Nguyen C, Garcia Luna SM, Fauver JR, et al. Переносная компетенция американских комаров по трем штаммам вируса Зика. PLoS Negl Trop Dis. 2016;10:e0005101.
ПабМед ПабМед Центральный Статья Google ученый
Гутьеррес-Бугалло Г., Буллис А., Мартинес Ю., Хери Л., Родригес М., Биссет Х.А. и др. Вектор компетентности Aedes aegypti из Гаваны, Куба, для вирусов денге типа 1, чикунгуньи и вирусов Зика. PLOS Negl Trop Dis. 2020;14:e0008941.
ПабМед ПабМед Центральный Статья Google ученый
«>Карабацос Н., редактор. Международный каталог арбовирусов, включая некоторые другие вирусы позвоночных. Сан-Антонио: Американское общество тропической медицины и гигиены для Подкомитета по обмену информацией Американского комитета по переносимым членистоногими вирусам. 1985.
Альто Б.В., Виггинс К., Истмонд Б., Велес Д., Лунибос Л.П., Лорд К.С. Риск передачи двух линий чикунгуньи инвазивными переносчиками комаров из Флориды и Доминиканской Республики. PLoS Negl Trop Dis. 2017;11:e0005724.
ПабМед ПабМед Центральный Статья Google ученый
Ураки Р., Гастингс А.
 К., Глория-Сориа А., Пауэлл Дж.Р., Фикриг Э. Компетенция измененных переносчиков в экспериментальной модели передачи инфекции Зика от комаров к мышам. PLoS Negl Trop Dis. 2018;12:e0006350.
К., Глория-Сориа А., Пауэлл Дж.Р., Фикриг Э. Компетенция измененных переносчиков в экспериментальной модели передачи инфекции Зика от комаров к мышам. PLoS Negl Trop Dis. 2018;12:e0006350.ПабМед ПабМед Центральный Статья Google ученый
Дюбрюлль М., Муссон Л., Мутайлер С., Вазей М., Фейлу АБ. Вирус чикунгунья и комары Aedes : слюна становится заразной уже через два дня после орального заражения. ПЛОС ОДИН. 2009;4:e5895.
ПабМед ПабМед Центральный Статья Google ученый
Ариас-Гета К., Муссон Л., Ружон Ф., Файу АБ. Распространение и передача варианта E1–226V вируса чикунгуньи в Aedes albopictus контролируются на уровне барьера средней кишки. ПЛОС ОДИН. 2013;8:e57548.
КАС пабмед ПабМед Центральный Статья Google ученый
«>Сарделис М.Р., Турелл М.Дж., Дом Д.Дж., О’Гуинн М.Л. Компетентность отдельных североамериканских комаров Culex и Coquillettidia в отношении вируса Западного Нила. Эмердж Инфекция Дис. 2001;7:1018.
КАС пабмед ПабМед Центральный Статья Google ученый
McGee CE, Шустов А.В., Цецаркин К., Фролов И.В., Mason PW, Vanlandingham DL, et al. Заражение, распространение и передача инфекционного клона зеленого флуоресцентного белка вируса Западного Нила Culex pipiens quinquefasciatus комаров. Трансмиссивные зоонозные болезни. 2010; 10: 267–74.

ПабМед ПабМед Центральный Статья Google ученый
Маринотти О., Джеймс А.А., Рибейро Дж.К. Питание и слюноотделение у самок Aedes aegypti комаров. Дж. Физиология насекомых. 1990; 36: 545–8.
КАС Статья Google ученый
Reynolds ES, Hart CE, Hermance ME, Brining DL, Thangamani S. Обзор животных моделей переносимых членистоногими вирусов. Комп Мед. 2017;67:232–41.
КАС пабмед ПабМед Центральный Google ученый
Чан К.К., Огюст А.Дж., Брюстер К.С., Полсон С.Л. Переносчик компетентности комаров Вирджинии в отношении вирусов Зика и Кэш-Вэлли. Векторы паразитов. 2020;13:188.
ПабМед ПабМед Центральный Статья Google ученый
Робисон А., Янг М.С., Бьяс А.Д., Рюкерт С., Эбель Г.Д. Сравнение динамики репликации и передачи вируса чикунгунья и вируса Зика у комаров Aedes aegypti . Am J Trop Med Hyg. 2020;103:869.
ПабМед ПабМед Центральный Статья Google ученый
Скачать ссылки
Благодарности
Мы хотели бы поблагодарить J.J. Шепард и Т. Петруфф за помощь в выращивании колоний комаров, а также А. Брансфилд и М. Дж. Мизенчик за поддержку в лаборатории BSL3.
Финансирование
Эта публикация была профинансирована Соглашением о сотрудничестве U01CK000509, финансируемым Центром по контролю и профилактике заболеваний. Его содержание является исключительной ответственностью авторов и не обязательно отражает официальную точку зрения Центра по контролю и профилактике заболеваний или Министерства здравоохранения и социальных служб. Финансирующее агентство не участвовало в разработке исследования, сборе, анализе или интерпретации данных.
Информация об авторе
Авторы и организации
Центр биологии переносчиков и зоонозных болезней, Департамент наук об окружающей среде, Коннектикутская сельскохозяйственная экспериментальная станция, 123 Huntington St., New Haven, CT, 06504, USA
A. Gloria -Soria, D.E. Brackney & P.M. Armstrong
Авторы
- A. Gloria-Soria
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- D. E. Brackney
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- P. M. Armstrong
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Contributions
AG-S участвовал в планировании эксперимента, проводил все эксперименты, собирал и анализировал данные и составлял рукопись. DEB внес свой вклад в экспериментальный дизайн и анализ данных, а также просмотрел черновики рукописей. PMA внесла свой вклад в разработку экспериментального дизайна, провела эксперименты и собрала данные, а также рассмотрела черновики рукописей. Все авторы прочитали и одобрили окончательный вариант рукописи.
DEB внес свой вклад в экспериментальный дизайн и анализ данных, а также просмотрел черновики рукописей. PMA внесла свой вклад в разработку экспериментального дизайна, провела эксперименты и собрала данные, а также рассмотрела черновики рукописей. Все авторы прочитали и одобрили окончательный вариант рукописи.
Автор, ответственный за переписку
А. Глория-Сория.
Декларации этики
Утверждение этических норм и согласие на участие
Процедуры обращения с животными и ухода за ними были одобрены и выполняются Комитетом по уходу и использованию животных Сельскохозяйственной экспериментальной станции штата Коннектикут (протокол № P28-17).
Согласие на публикацию
Неприменимо.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Дополнительный файл 1: Текст S1.Титрование исходных растворов вирусов. Таблица S1. Последовательность праймеров и зондов (от 5’ до 3’), используемых для обнаружения вируса в анализе ОТ-ПЦР. Таблица S2. Предел обнаружения анализа ОТ-ПЦР. Рисунок S1 . Стандартные кривые ОТ-ПЦР для вирусов чикунгунья (а), Зика (б), Ла-Кросс (в) и Западного Нила (г).
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы укажете соответствующую ссылку на оригинальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке материала.




 Таким образом, она быстрее проникает внутрь дефектов, вытесняя из них воздух.
Таким образом, она быстрее проникает внутрь дефектов, вытесняя из них воздух. Это можно проводить при помощи тряпки или губки.
Это можно проводить при помощи тряпки или губки.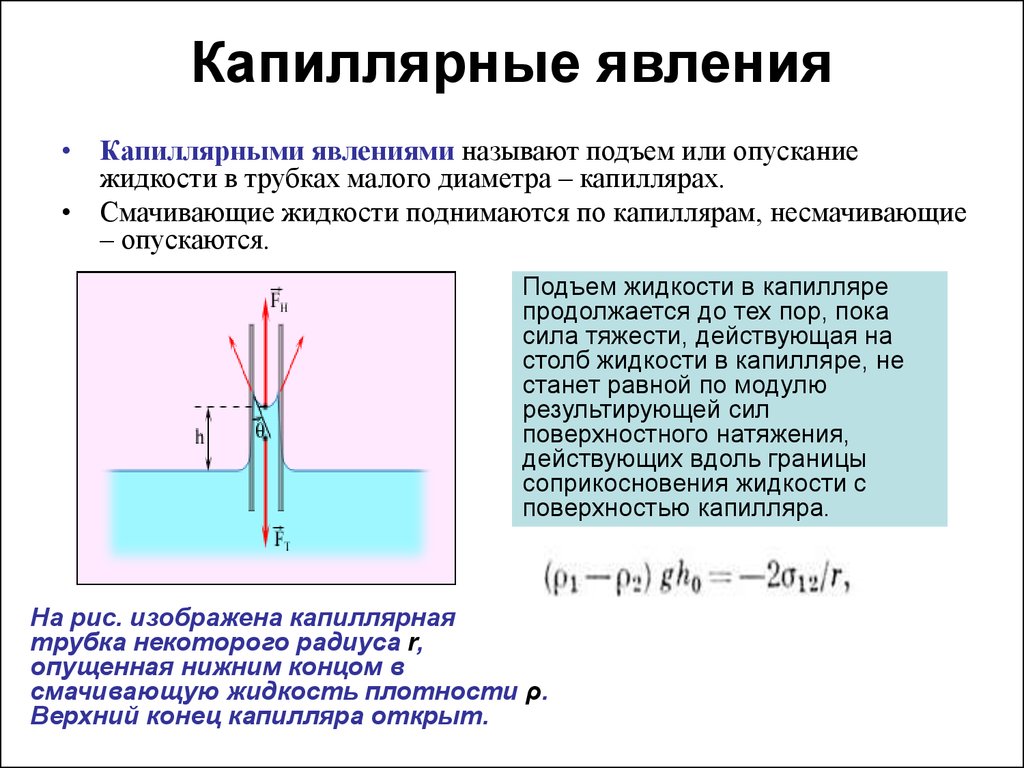
 Верхний предел опреде-
Верхний предел опреде-
 Поверхностное натяжение измеряется в ньютонах на метр.
Поверхностное натяжение измеряется в ньютонах на метр.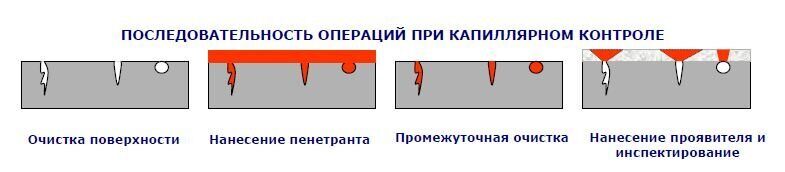 Жидкость стекает в бумажное полотенце с определенной скоростью.
Жидкость стекает в бумажное полотенце с определенной скоростью. Эта формула записывается как:
Эта формула записывается как: д.! Уменьшение капиллярного действия: Противоположное шагам, которые вы предпримете для увеличения, а также увеличению плотности жидкости, с которой вы работаете.
д.! Уменьшение капиллярного действия: Противоположное шагам, которые вы предпримете для увеличения, а также увеличению плотности жидкости, с которой вы работаете.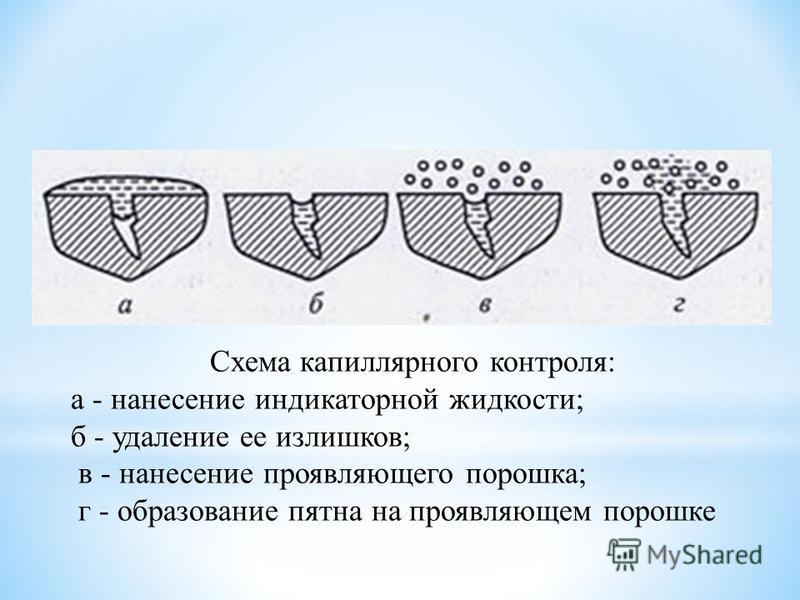
 взрослые где
взрослые где  Чтобы доставить воду ко всем ветвям и листьям, в ксилеме растения работают силы сцепления и сцепления, чтобы доставить воду к самому дальнему листу.
Чтобы доставить воду ко всем ветвям и листьям, в ксилеме растения работают силы сцепления и сцепления, чтобы доставить воду к самому дальнему листу. Посетите СМИ, чтобы узнать подробности.
Посетите СМИ, чтобы узнать подробности. Поверхностное натяжение удерживает поверхность неповрежденной. Капиллярное действие возникает, когда сцепление со стенками сильнее сил сцепления между молекулами жидкости. Высота, на которую капиллярное действие поднимет воду в однородной круглой трубе (рисунок справа), ограничена поверхностным натяжением и, конечно же, силой тяжести.
Поверхностное натяжение удерживает поверхность неповрежденной. Капиллярное действие возникает, когда сцепление со стенками сильнее сил сцепления между молекулами жидкости. Высота, на которую капиллярное действие поднимет воду в однородной круглой трубе (рисунок справа), ограничена поверхностным натяжением и, конечно же, силой тяжести.

 сельдерей. Возможно, вы захотите использовать кусочек сельдерея, который начал шататься, так как его нужно быстро выпить. На это может уйти несколько дней, но, как видно из этих снимков, окрашенная вода «тянется» вверх против силы тяжести. Этот эффект возникает из-за того, что в растениях молекулы воды движутся по узким трубкам, которые называются капиллярами (или ксилемой).
сельдерей. Возможно, вы захотите использовать кусочек сельдерея, который начал шататься, так как его нужно быстро выпить. На это может уйти несколько дней, но, как видно из этих снимков, окрашенная вода «тянется» вверх против силы тяжести. Этот эффект возникает из-за того, что в растениях молекулы воды движутся по узким трубкам, которые называются капиллярами (или ксилемой).
 С. Вулф, Р.К. Тауэр, Н. Пфенниг, Метод «капиллярной беговой дорожки» для выделения магнитотактических бактерий, FEMS Microbiology Ecology , Том 3, Выпуск 1, 19 февраля87, страницы 31–35, https://doi.org/10.1111/j.1574-6968.1987.tb02335.x
С. Вулф, Р.К. Тауэр, Н. Пфенниг, Метод «капиллярной беговой дорожки» для выделения магнитотактических бактерий, FEMS Microbiology Ecology , Том 3, Выпуск 1, 19 февраля87, страницы 31–35, https://doi.org/10.1111/j.1574-6968.1987.tb02335.x
 Биоматериалы. 2001.
PMID: 11374451
Биоматериалы. 2001.
PMID: 11374451
 Эмердж Инфекция Дис. 2004; 10:1790–6.
Эмердж Инфекция Дис. 2004; 10:1790–6. 2018;12:e0006599.
2018;12:e0006599. 2021;12:73.
2021;12:73. PLoS Патог. 2007; 3:132.
PLoS Патог. 2007; 3:132.
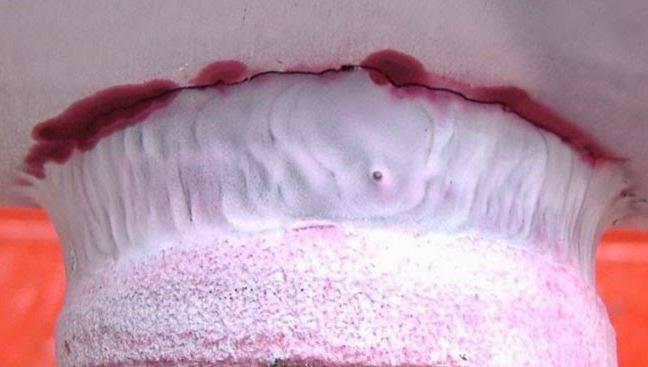 Дж. Вектор Борн Дис. 2015;52:185.
Дж. Вектор Борн Дис. 2015;52:185. Насекомые. 2021;12:292.
Насекомые. 2021;12:292.
 К., Глория-Сориа А., Пауэлл Дж.Р., Фикриг Э. Компетенция измененных переносчиков в экспериментальной модели передачи инфекции Зика от комаров к мышам. PLoS Negl Trop Dis. 2018;12:e0006350.
К., Глория-Сориа А., Пауэлл Дж.Р., Фикриг Э. Компетенция измененных переносчиков в экспериментальной модели передачи инфекции Зика от комаров к мышам. PLoS Negl Trop Dis. 2018;12:e0006350.