Свинец
| Свинец | |
|---|---|
| Атомный номер | 82 |
| Внешний вид простого вещества | |
| Свойства атома | |
|
Атомная масса (молярная масса) |
207,2 а. е. м. (г/моль) |
| Радиус атома | 175 пм |
|
Энергия ионизации (первый электрон) |
715,2 (7,41) кДж/моль (эВ) |
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 6p2 |
| Химические свойства | |
| Ковалентный радиус | 147 пм |
| Радиус иона | (+4e) 84 (+2e) 120 пм |
|
Электроотрицательность (по Полингу) |
1,8 |
| Электродный потенциал |
Pb←Pb2+ -0,126 В Pb←Pb4+ 0,80 В |
| Степени окисления | 4, 2 |
| Термодинамические свойства простого вещества | |
| Плотность | 11,3415 г/см³ |
| Молярная теплоёмкость | 26,65[1] Дж/(K·моль) |
| Теплопроводность | 35,3 Вт/(м·K) |
| Температура плавления | 600,65 K |
| Теплота плавления | 4,77 кДж/моль |
| Температура кипения | 2 013 K |
| Теплота испарения | 177,8 кДж/моль |
| Молярный объём | 18,3 см³/моль |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 4,950 Å |
| Отношение c/a | n/a |
| Температура Дебая | 88,00 K |
| Pb | 82 |
| 207,2 | |
| [Xe]4f145d106s26p2 | |
| Свинец | |
Свинец — элемент главной подгруппы четвёртой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82. Обозначается символом Pb (лат. Plumbum). Простое вещество свинец (CAS-номер: 7439-92-1) — ковкий, сравнительно легкоплавкий металл серого цвета.
Происхождение слова «свинец» неясно. В большинстве славянских языков (болгарском, сербско-хорватском, чешском, польском) свинец называется оловом. Слово с тем же значением, но похожее по произношению на «свинец», встречается только в языках балтийской группы: švinas (литовский), svins (латышский).
Латинское же plumbum (тоже неясного происхождения) дало английское слово plumber — водопроводчик (когда-то трубы зачеканивали мягким свинцом), и название венецианской тюрьмы со свинцовой крышей — Пьомбе, из которой по некоторым данным ухитрился бежать Казанова. Известен с глубокой древности. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы — в Древнем Риме. Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов. До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
Нахождение свинца в природе
Содержание в земной коре 1,6·10-3% по массе. Самородный свинец встречается редко, круг пород, в которых он установлен, достаточно широк: от осадочных пород до ультраосновных интрузивных пород. В основном встречается в виде сульфидов.
Получение свинца
Страны — крупнейшие производители свинца (включая вторичный свинец) на 2004 год (по данным ILZSG), в тыс. тонн:
| ЕС | 2200 |
| США | 1498 |
| Китай | 1256 |
| Корея | 219 |
Физические свойства свинца
Свинец имеет довольно низкую теплопроводность, она составляет 35,1 Вт/(м·К) при температуре 0°C. Металл мягкий, легко режется ножом. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет.
Плотность — 11,3415 г/см³ (при 20 °C)
Температура плавления — 327,4 °C
Температура кипения — 1740 °C
Химические свойства свинца
Электронная формула: KLMN5s25p65d106s26p
С кислородом образует ряд соединений Рb2О, РbО, РbО2, Рb2О3, Рb3О4. Без кислорода вода при комнатной температуре не реагирует со свинцом, но при большой температуре получают оксида свинца и водород при взаимодействии свинца и горячего водяного пара.
Оксидам РbО и РbО2 соответствуют амфотерные гидрооксиды Рb(ОН)2 и Рb(ОН)4.
При реакции Mg2Pb и разбавленной HCl получается небольшое количество РbН4. Pbh5 — газозообразное вещество без запаха, которое очень легко разлагается на свинец и и водород. При большой температуре галогены образовывают со свинцом соединения вида РbХ2 (X — соответствующий галоген). Все эти соединения мало растворяются в воде. Могут быть получены галогениды и типа РbХ4. Свинец с азотом прямо не реагирует. Азид свинца Pb(N3)2 получают косвенным путём: взаимодействием растворов солей Рb (II) и соли NaN3. Сульфиды свинца можно получить при нагревании серы со свинцом, образуется сульфид PbS. Сульфид получают также пропусканием сероводорода в растворы солей Pb (II). В ряду напряжений Pb стоит левее водорода, но свинец не вытесняет водород из разбавленных HCl и h3SO4, из-за перенапряжения Н2 на Pb, а также на поверхности металла образуются плёнки трудно-растворимых хлорида РbCl2 и сульфата PbSO4, защищающие металл от дальнейшего действия кислот. Концентрированные кислоты типа h3SO4 и НCl при нагревании действуют на Pb и образуют с ним растворимые комплексные соединения состава Pb(HSO4)2 и Н2[РbCl4]. Азотная, а также некоторые органических кислоты (например, лимонная) растворяют свинец с получением солей Рb(II). По растворимости в воде соли свинца делятся на нерастворимые (напрммер, сульфат, карбонат, хромат, фосфат, молибдат и сульфид), малорастворимые (вроде, хлорид и фторид) и растворимые (к примеру,ацетат, нитрат и хлорат свинца). Соли Pb (IV) могут быть получены электролизом сильно подкисленных серной кислотой растворов солей Рb (II). Соли Pb (IV) присоединяют отрицательные ионы с образованием комплексных анионов, например, плюмбатов (РbО3)2- и (РbО4)4-, хлороплюмбатов (РbCl6)2-, гидроксоплюмбатов [Рb(ОН)6]2- и других. Концентрированные растворы едких щелочей при нагревании реагируют с Pb с выделением водорода и гидроксоплюмбитов типа Х2[Рb(ОН)4]. Еион (Ме=>Ме++e)=7,42 эВ.
Основные соединения свинца
Оксиды свинца
Оксиды свинца имеют преимущественно основный или амфотерный характер. Многие из них окрашены в красные, жёлтые, чёрные, коричневые цвета. На фотографии в начале статьи, на поверхности свинцовой отливки, в её центре видны цвета побежалости — это тонкая плёнка оксидов свинца, образовавшаяся из-за окисления горячего металла на воздухе.
Галогениды свинца
Халькогениды свинца
Халькогениды свинца — сульфид свинца, селенид свинца и теллурид свинца — представляют собой кристаллы чёрного цвета, которые являются узкозонными полупроводниками.
Соли свинца
Сульфат свинца
Нитрат свинца
Ацетат свинца — свинцовый сахар, относится к очень ядовитым веществам. Ацетат свинца, или свинцовый сахар, Pb(CH3COO)2·3H2O существует в виде бесцветных кристаллов или белого порошка, медленно выветривающегося с потерей гидратной воды. Соединение хорошо растворимо в воде. Оно обладает вяжущим действием, но так как содержит ионы ядовитого свинца, то применяется как наружное в ветеринарии. Ацетат применяют также в аналитической химии, крашении, ситценабивном деле, как наполнитель шёлка и для получения других соединений свинца. Основной ацетат свинца Pb(CH3COO)2·Pb(OH)2 — менее растворимый в воде белый порошок — используется для обесцвечивания органических растворов и очистки растворов сахара перед анализом.
Применение свинца
Свинец в народном хозяйстве
Нитрат свинца применяется для производства мощных смесевых взрывчатых веществ. Азид свинца применяется как наиболее широкоупотребляемый детонатор (инициирующее взрывчатое вещество). Перхлорат свинца используется для приготовления тяжелой жидкости (плотность 2,6 г/см³), используемой во флотационном обогащении руд, он иногда применяется в мощных смесевых взрывчатых веществах как окислитель. Фторид свинца самостоятельно, а так же совместно с фторидом висмута, меди, серебра применяется в качестве катодного материала в химических источниках тока. Висмутат свинца, сульфид свинца PbS, иодид свинца применяются в качестве катодного материала в литиевых аккумуляторных батареях. Хлорид свинца PbCl2 в качестве катодного материала в резервных источниках тока. Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников. Двуокись свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но так же на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и др.
Свинцовые белила, основной карбонат Pb(OH)2•PbCO3, плотный белый порошок, — получается из свинца на воздухе под действием углекислого газа и уксусной кислоты. Использование свинцовых белил в качестве красящего пигмента теперь не так распространено, как ранее, из-за их разложения под действием сероводорода h3S. Свинцовые белила применяют также для производства шпатлевки, в технологии цемента и свинцовокарбонатной бумаги.
Арсенат и арсенит свинца применяют в технологии инсектицидов для уничтожения насекомых — вредителей сельского хозяйства (непарного шелкопряда и хлопкового долгоносика). Борат свинца Pb(BO2)2·h3O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора. Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония Nh5Cl. Его применяют для приготовления мазей при обработке опухолей.
Хромат свинца PbCrO4 известен как хромовый желтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В промышленности хромат применяют в основном в производстве желтых пигментов. Нитрат свинца Pb(NO3)2 — белое кристаллическое вещество, хорошо растворимое в воде. Это вяжущее ограниченного применения. В промышленности его используют в спичечном производстве, крашении и набивке текстиля, окраске рогов и гравировке. Сульфат свинца Pb(SO4)2, нерастворимый в воде белый порошок, применяют как пигмент в аккумуляторах, литографии, в технологии набивных тканей.
Сульфид свинца PbS, чёрный нерастворимый в воде порошок, используют при обжиге глиняной посуды и для обнаружения ионов свинца.
Поскольку свинец хорошо поглощает γ-излучение, он используется для радиационной защиты в рентгеновских установках и в ядерных реакторах. Кроме того, свинец рассматривается в качестве теплоносителя в проектах перспективных ядерных реакторов на быстрых нейтронах.
Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 85-90 % Sn и 15-10 % Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67 % Pb и 33 % Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников. Сплавы свинца с сурьмой обычно применяют для оболочек кабелей и пластин электрических аккумуляторов. Соединения свинца используются в производстве красителей, красок, инсектицидов, стеклянных изделий и как добавки к бензину в виде тетраэтилсвинца (C2H5)4Pb (умеренно летучая жидкость, пары к-рой в малых концентрациях имеют сладковатый фруктовый запах, в больших-неприятный запах; Тпл = 130 °C, Ткип = 80°С/13 мм рт.ст.; плотн. 1,650 г/см³; nD2v = 1,5198; не раств. в воде, смешивается с орг. растворителями; высокотоксичен, легко проникает через кожу; ПДК = 0,005 мг/м³; ЛД50 = 12,7 мг/кг (крысы, перорально)) для повышения октанового числа.
Свинец в медицине
Экономические показатели
Цены на свинец в слитках (марка С1) в 2006 году составили в среднем 1,3—1,5 долл/кг.
Страны, крупнейшие потребители свинца в 2004 году, в тыс. тонн (по данным ILZSG):
| Китай | 1770 |
| ЕС | 1553 |
| США | 1273 |
| Корея | 286 |
Физиологическое действие
Свинец и его соединения токсичны. Попадая в организм, свинец накапливается в костях, вызывая их разрушение. ПДК в атмосферном воздухе соединений свинца 0,003 мг/м³, в воде 0,03 мг/л, почве 20,0 мг/кг. Выброс свинца в Мировой океан 430—650 тысяч т/год.
Свойства атома Свинца | |
Название | Свинец / Plumbum |
Символ | Pb |
Номер | 82 |
Атомная масса (молярная масса) | 207,2 (1) а. е. м. (г/моль) |
Электронная конфигурация | [Xe] 4f14 5d10 6s2 6p2 |
Радиус атома | 175 пм |
Химические свойства Свинца | |
Ковалентный радиус | 147 пм |
Радиус иона | (+4e) 84 (+2e) 120 пм |
Электроотрицательность | 2,33 (шкала Полинга) |
Электродный потенциал | Pb←Pb2+ −0,126 В |
Pb←Pb4+ 0,80 В | |
Степени окисления | 4, 2, 0 |
Энергия ионизации (первый электрон) | 715,2 (7,41) кДж/моль (эВ) |
Термодинамические свойства простого вещества | |
Плотность (при н. у.) | 11,3415[2] г/см3 |
Температура плавления | 600,61 K (327,46 °C, 621,43 °F) |
Температура кипения | 2022 K (1749 °C, 3180 °F) |
Уд. теплота плавления | 4,77 кДж/моль |
Уд. теплота испарения | 177,8 кДж/моль |
Молярная теплоёмкость | 26,65 Дж/(K·моль) |
Молярный объём | 18,3 см3/моль |
Кристаллическая решётка простого вещества | |
Структура решётки | кубическая гранецентрированая |
Параметры решётки | 4,950 Å |
Температура Дебая | 88,00 K |
Прочие характеристики Свинца | |
Теплопроводность | (300 K) 35,3 Вт/(м·К) |
Номер CAS | 7439-92-1 |
Свинец — Знаешь как
Содержание статьи
(Plumbum), Pb — хим. элемент IV группы периодической системы элементов; ат. н. 82, ат. м. 207,2. Синевато-серый металл. В соединеиях проявляет степени окисления +2 и +4. Природный свинец состоит из стабильных изотопов 204Рb (1,4%), 206Рb (25,2%), 2о7Рb (21,7%) и 208Рb (51,7%). Есть также несколько радиоактивных изотопов. С. известен с давних времен. Египтяне выплавляли его за 5—7 тыс. лет до н. э. Римляне изготовляли из свинца водопроводные трубы. Содержание С. в земной коре 1,0-10 4%. Самородный свинец в природе не встречается. Важнейший минерал — галенит, Содержащийся преим, в сульфидных полиметаллических рудах. Кристаллическая решетка С. гранецентрированная кубическая с периодом а = 4,9495 А.
Плотность чистого металла 11,34 г/см3; tпл 327,4° С; tкип1740° С; скрытая теплота плавления 6,26 кал/г; скрытая теплота испарения 201 кал/г; температурный коэфф. линейного расширения (т-ра 20° С) 27,56 х 10-6 град ; удельная теплопроводность (т-ра 18° С) 0,083 кал/см х сек х град; теплоемкость (т-ра 0—100° С) 0,0306 кал/г х град; удельное электрическое сопротивление 20,68-10-6 ом-см. Вязкость при т-ре 340° С равна 0,0189 nз, при т-ре 470° С составляет 0,0144 пз. Т-ра перехода в сверхпроводящее состояние 7,17 К. С. мягок и пластичен. Модуль норм, упругости 1700 кгс/мм2; предел прочности на растяжение 1,2—1,3 кгс/мм2;
относительное удлинение 55%; НВ = 3—4.
На воздухе свинец покрывается окисной пленкой, предохраняющей металл от дальнейшего окисления. При нагревании расплавленного С. на воздухе образуется окись РbО. При медленном нагревании на воздухе РbО превращается в Рb304 красного цвета. Разбавленные соляная и серная к-ты почти не действуют на металл. Свинец легко растворяется в азотной к-те, образуя нитрат. При доступе воздуха свинец растворяется в уксусной к-те с образованием ацетата. Растворяется свинец в щелочах. Свинец сплавляется со многими металлами, образуя свинца сплавы и интерметаллические соединения. С железом не реагирует в жидком и твердом состоянии.
При нагревании непосредственно уединяется со многими неметаллами, в частности со всеми галогенами, с серой, селеном и теллуром. с. и его соединения ядовиты. Предельно допустимая концентрация в воздухе 0,01 мг/м3. Свинец получают из сульфидных концентратов, к-рые подвергают агломерирующему обжигу с последующей плавкой шихты в шахтной печи. Осн. продуктом плавки является черновой свинец (веркблей), содержащий 97—99% осн. металла и 3—1% примесей (меди, сурьмы, олова, серебра, висмута и др.). Распространены методы пирометаллургического и гидроэлектролитического рафинирования веркблея. Разработаны также способы рафинирования чернового свинца и разделения его сплавов электролизом ионных расплавов.
Для получения особо чистого металла применяют методы амальгамной металлургии, зонной перекристаллизации и др. Свинец весьма легко поддается ковке и прокатывается в листы любой толщины. Свинцовую стружку можно спрессовать в монолитную массу при давлении 2 тс/см2. Свинцовую проволоку получают, продавливая через фильеру твердый металл. Кислород, азот, сернистый газ, водород, окись углерода, углекислый газ и углеводороды не растворяются ни в жидком, ни в твердом металлическом свинце. Свинец применяют для облицовки (футеровки) хим. аппаратуры, в электролизных ваннах металлургических заводов. Он предохраняет от коррозии телеграфные и электр. провода, прокладываемые под землей или под водой (см. Коррозия металлов). Большое количество свинец расходуется на произ-во аккумуляторов. На его основе изготовляют легкоплавкие, типографские и антифрикционные сплавы.
Некоторое количество С. из-за способности поглощать радиоактивное излучение применяют в рентгенотехнике и ядерной технике. Свинец используют в огнестрельном оружии, в полупроводниковой технике. Особо чистый металл идет на изготовление термоэлектрогенераторов, в к-рых осуществляется прямое превращение тепловой энергии в электрическую. Эффективными материалами для изготовления термоэлектрогенераторов служат теллурид и селенид свинца. Сплав меди со свинцом используют в сверхпроводниковой технике Соединения свинец применяют в произ-ве красок, стекла, для очистки нефти. Оси. углекислую соль свинца 2PbCOs · Рb (0Н)2 используют для приготовления свинцовых белил; соединение Рb304 — для получения краски ярко-красного цвета; тетра-этилсвинец (С2Н5)4Рb — самый распространенный антидетонатор; азид свинца PbN6 — инициирующее вещество. Окись РbО применяют в произ-ве легкоплавких, сильно преломляющих свет стекол, эмалей.
Плюмбум или свинец
Свинец — голубовато серый , мягкий , пластичный металл , легко режется ножом , имеет плотность 11,34 г/см³ и температурой плавления 327,5.
Тепло — и электропроводность свинца низкая . На воздухе он покрывается защитной оксидной плёнкой и тускнеет образуя PbO :
Pb + O2 = PbO
Также оксид свинца образуется при накаливании его на воздухе , а при большом доступе воздуха и не очень высокой температуре переходит в Pb3O4 ( свинцовый сурик ) .
В присутствии влаги взаимодействует с кислородом воздуха по реакции:
2Pb+ O2 + 2h3O + 2Pb( OH)2
При повышенной температуре свинец преимущественно находится в соединении со степенью окисления 2+ .
Отрицательную степень окисления проявляет только в соединении с некоторыми более электро положительными металлами , например с магнием ( плюмбид Mg2Pb )
С водородом свинец непосредственно не взаимодействует , но его соединения получают косвенно :
Mg2Pb + 4HCl = 2MgCl2 + Pbh5
При этом образуется неустойчивый , ядовитый газ плюмбан Pbh5
Свинец практически не растворяется в соляной и разбавленной серной кислоте , так как покрывается нерастворимой плёнкой солей PbCl2 и PbSO4 :
Pb + 2HCl = PbCl2 + h3
Pb + h3SO4 = PbSO4 + h3
Только при действии концентрированной серной кислоты образуется растворимая кислая соль и свинец начинает растворятся Pb(HSO4)2 .
При взаимодействии с концентрированной и разбавленной азотной кислотой метал образует нитрат свинца Pb( NO3 )2 :
Pb + HNO3 = Pb( NO3 )2 + NO + h3O
Для свинца более характерны соединения со степенью окисления 2+ .Окисление соединения свинца ( II ) до соединения свинца ( IV ) происходит лишь при действии сильных кислот :
Pb(Ch4COO)2 + CaOCl2 + h3O = Pb2 + 2Ch4COOH + CaCl2
Соединения свинца ( IV )—сильные окислители , например , при кипячении с 30% серной кислотой диоксид свинца окисляет марганец с ( II ) до ( VII ) :
5PbO2 + 2MnSO4 + 3h3SO4 = 5PbSO4 + 2HMnO4 + 2h3O
Применение свинца
Свинец применяется для изготовления источников постоянного тока — аккумуляторов . В производстве взрывчатых веществ ( азид свинца Pb(N3)2 ) , входит в состав многих сплавов ( сплавы для производства подшипников ) . Из свинца изготовляют химическую аппаратуру , оболочки для кабелей , трубы . Он служит также для изготовления винтовочных и шрапнельных пуль и выделки дроби . Свинец сильно поглощает гамма — лучи и поэтому применяется для защиты от гамма — излучений при работе с радиоактивными веществами . Оксид свинца PbO используют при производстве стёкол ( в частности , хрусталя ) , оксид свинца PbO2 — в кислотных аккумуляторах . Ацетат свинца Pb(Ch4COO)2 применяют в качестве протравы при крашении тканей , ахромат свинца PbCrO4 — для изготовления красок ( жёлтый пигмент )
Физические свойства
Свинец — Pb,голубовато — серый металл ,горючее вещество . Ат. масса 207,2 ; температура плавления 327,4°C ;температура кипения 1745°C . При дисперсности образца 74 мкм тем. самовоспл.:аэрогеля 270°C , аэровзвеси 580 °C ; макс . давл . взрыва 20 кПа ; макс . скорость нарастания давл . 700 кПа /с ; МВСК 10% (об) .
Свинца сульфат , трудно горючее вещество , не склонен к самовозгоранию . Мол . масса 239,25; плотность 7100 кг /м3 ; температура плавления 1100°C . Дисперсность образца 250 мкм . Температура самовоспламенения аэрогеля 780 °C ;
Лит.; Основы металлургии, т. 2. М., Лоскутов Ф. М. Металлургия свинца. М., 1965; Некрасов Б. В. Курс общей химии.
Вы читаете, статья на тему свинец
Свинец кристаллическая структура — Справочник химика 21
Хорошо известно, что нафтенат свинца также является ингибитором коррозии в литиевых смазках. Соединения висмута и здесь превосходят свинец, так как кристаллическая структура сульфида висмута и висмуторганических соединений обеспечивает большую полярность по сравнению с сульфидом свинца это является и вторым объяснением его лучших противозадирных свойств. [c.278]Третий представитель этой подгруппы — свинец — в компактном состоянии представляет собой серебристо-серый металл с синеватым отливом. Свинец в отличие от Ge и Sn не имеет полиморфных модификаций и всегда кристаллизуется в плотноупакованной ГЦК структуре. Таким образом, сравнивая кристаллические структуры в ряду Ge—Sn—Pb, можно отметить, что общая тенденция к металлизации, отмеченная у элементов, прослеживается и в кристаллических структурах их гомоатомных соединений — от рыхлых алмазоподобных структур (Ge и a-Sn) к плотноупакованным ( -Sn и РЬ). В этом ряду олово все же ближе к германию, чем к своему [c.217]
Кристаллическая структура тетрафенилсилана была определена кристаллографическими методами при помощи рентгеновских лучей [1443, 1638, 051, 052]. Изучение изоморфизма [799] тетра-фенилзамещенных IV группы элементов (углерод, кремний, германий, олово, свинец) дало очень интересные сравнительные данные для этих элементов [807, 2270]. [c.231]
Листовой свинец шириной 2150 мм и более поставляется ролями (марок СО, С1С, С1, С2С, С2, СЗС и СЗ) или свернутым в рулон. Свинец первых пяти марок, содержащий до 0,05% примесей обладает наилучшей коррозионной стойкостью, высокой пластичностью, но низко механической прочностью, которая резко снижается при температуре свыше 150 °С [202]. Свинец, содержащий небольшое количество примесей, имеет грубую кристаллическую структуру и склонен к рекристаллизации при температурах О—20°С [203]. Особо чистый свинец, содержащий до 0,0001% примесей, имеет температуру рекристаллизации минус 50 °С. [c.183]
Получают этот раствор в колонне 1, куда предварительно гранулированный свинец подают с помощью электротельфера 2. Разбавленную до необходимой концентрации азотную кислоту непрерывно вводят через дозатор 3 в нижнюю часть колонны. Раствор нитрата свинца непрерывно сливают в приемную емкость 4, откуда перекачивают насосом 5 в напорную емкость 6. Предварительно приготовленную хромовую смесь собирают в напорной емкости 7. Осаждение пигмента проводят в реакторе непрерывного действия 8. Исходные растворы непрерывно вводят в него в заданных соотношениях с помощью дозаторов 9 п 10, образовавшуюся суспензию непрерывно сливают самотеком для вызревания в аппарат 11. Для стабилизации кристаллической структуры образовавшегося крона предназначен аппарат 12. В него вводят из мерника 13 предварительно приготовленные растворы стабилизаторов. Суспензию готового пигмента насосом 14 перекачивают в емкость 15, откуда она поступает для фильтрования на вакуум-фильтр 17. Отмывку пигмента от водорастворимых солей проводят репульпацией [c.244]
Весьма детальная классификация элементов по кристаллическим структурам была дана в 1942—1960 гг. Г. Б. Бокием [160]. Он различает шесть основных типов структур элементов 1) гексагональную плотную упаковку, 2) кубическую плотную, 3) кубическую объемноцентрированную упаковку (металлические структуры), 4) молекулярные структуры, 5) ковалентные структуры с координационным числом K—S—N, 6) прочие структуры. Г. Б. Бокий отметил принадлежность водорода по кристаллохимическим признакам к группе галогенов, разделение элементов III группы на две подгруппы (бора—таллия и скандия—актиния), указал на своеобразие структур марганца, урана, индия, цинка, кадмия и ртути, объяснил повышенные значения da для структур цинка и кадмия эллипсоидальной формой атомов и высказал предположение, что алюминий, а- и р-таллий, свинец и индий в металлическом состоянии не отщепляют всех валентных электронов [160]. В этом плане кристаллохимия элементов была рассмотрена и в ряде других работ [32, 111] и др. [c.190]
Природа вещества может играть важную роль в процедурах отбора, хранения, химической обработки перед анализом, правильного определения и оценки результатов (включая токсичность вещества или возможные поправки). Так, свинец может находиться в воздухе вблизи автострад в виде газа, аэрозоля и твердого вещества, в виде металла, оксида, хлорида, бромида, карбоната, сульфата, фосфата и др., а также в виде алкилсвинца и других металлорганических производных. Кадмий присутствует в воде в виде ионов, неорганических и органических соединений, металла, адсорбированного на твердых примесях или осажденного в виде покрытия, а также в виде включений в твердых биологических материалах или в кристаллических структурах. [c.582]
Олово существует в двух полиморфных модификациях, причем низкотемпературная (a-Sn — серое олово) обладает кристаллической решеткой типа алмаза и полупроводниковыми свойствами, а высокотемпературная ( -Sn — белое олово), хотя и представляет собой металл по физическим свойствам, тем не менее кристаллизуется в малохарактерной для металлов тетрагональной структуре. С химической точки зрения олово ближе примыкает к германию, чем к свинцу, но металлический характер этого элемента выражен более ярко, чем у германия. Единственным типичным металлом в этой подгруппе является свинец. В виде простого вещества он кристаллизуется в плотноупакованной ГЦК структуре с координационным числом 12. В своих соединениях он выступает в основном в качестве катионообразователя. [c.215]
В исходном состоянии [16] покрытия N1—В содержат до 10 % В, а также небольшие количества продуктов разложения стабилизаторов (сера, таллий, свинец и др.). От содержания бора зависит структура осадков при отсутствии бора (электро-осажденное покрытие) структура кристаллическая с очень сильно выраженной текстурой при 4 % В — кристаллическая с сильно выраженной текстурой при 7,5 % В — кристаллическая со слабой текстурой при 11,4 % В — аморфная. [c.61]
Это объясняется тем, что по своей структуре, т. е. по фактору, которым прежде всего определяется зависимость Ср от t для кристаллических веществ, алмаз не является исключением в подгруппе углерода. Другое дело— свинец. Нанеся на рис. 202 точки для РЬ [152, 156], можно было бы [c.241]
Металлы — хорошие проводники тепла и электричества. При прохождении электрического тока через металлические проводники не происходит переноса частиц металла (электронная проводимость, или проводимость первого рода). По способности проводить тепло и электричество металлы располагаются приблизительно в одном и том же порядке лучшие проводники — серебро и медь, затем золото, алюминий, железо и худшие — свинец и ртуть. Следовательно, между теплопроводностью металлов и их электропроводностью наблюдается почти постоянное соотношение. Металлы имеют кристаллическое строение. Представляют собой совокупность множества кристалликов микроскопических размеров (кристаллиты) в 1 см металла их содержится многие миллионы. Отдельно взятый кристаллит анизотропен (гл. 7, 1). В результате многочисленности кристаллитов в единице объема металла векторы анизотропии, направленные хаотично, взаимно компенсируются, и кусок металла в итоге проявляет свойство изотропности — равенство свойств в различных направлениях. Такие тела называют квазиизотропными. Следовательно, металлы по своей внутренней структуре квазиизотропны. [c.327]
При совместном использовании соединений серы и висмута, также как и в случае свинца, благодаря тепловой энергии трения образуются сульфиды железа и висмута. Более высокий противо-задирный эффект объясняется тем, что висмут обладает большей растворимостью в железе, чем свинец, образуя более прочную защитную пленку сплава на поверхности трущихся деталей. Кристаллическая структура такого сплава в достаточной степени отлична от таковой у чистых металлов. [c.278]
Все элементы, располагающиеся слева от границы Цинтля, ха рактеризуются дефицитом валентных электронов, в силу чего в плот поупакованпых кристаллических структурах соответствующих про стых веществ доминирует металлическая связь. При этом граница Цинтля не является границей между металлами и неметаллами а лишь разграничивает элементы с дефицитом и избытком валент ных элект
Кристаллическая решетка свинца. Свинец и его свойства
Свинец (Pb от лат. Plumbum) – химический элемент, который находится в IV группе Таблицы Менделеева. Свинец имеет множество изотопов, среди которых более 20 обладают радиоактивными свойствами. Изотопы свинца являются продуктами распада урана и тория, поэтому содержание свинца в литосфере постепенно увеличивалось в течение миллионов лет и сейчас составляет около 0,0016% по массе, но он более распространен, чем его ближайшие родственники, такие как золото и . Свинец легко выделяется из рудных месторождений. Основные источники свинца — галенит, англезит и церуссит. В руде со свинцом очень часто соседствуют другие металлы, например, цинк , кадмий и висмут. В самородном виде свинец встречается исключительно редко.
Свинец — интересные исторические факты
Этимология слова «свинец» до сих пор точно не выяснена и является предметом очень интересных исследований. Свинец очень похож на олово, очень часто их путали, поэтому в большинстве западнославянских языков свинец это олово. Зато слово «свинец» встречается в литовском (svinas) и латышском (svin) языках. Свинец в переводе на английский lead, на голландский lood. Видимо отсюда и пошло слово «лудить», т.е. покрывать изделие слоем олова (или свинца). Не до конца понятно также происхождение латинского слова Plumbum, от которого произошло английское слово plumber – водопроводчик. Дело в том, что когда-то водопроводные трубы «запечатывали» свинцом, «пломбировали» (франц. plomber «запечатывать свинцом»). Кстати, отсюда же всем известное слово «пломба». Но на этом путаница не заканчивается, греки всегда называли свинец «молибдос», отсюда и латинское «molibdaena», незнающему человеку легко спутать это название с наименованием химического элемента молибден . Так в древности называли блестящие минералы оставляющие тёмный след на светлой поверхности. Этот факт оставил свой след в немецком языке: «карандаш» по-немецки называется Bleistift, т.е. свинцовый стержень.
Человечество знакомо со свинцом с незапамятных времен. Археологами найдены свинцовые изделия выплавленные 8000 лет тому назад. В Древнем Египте из свинца даже отливали статуи. В Древнем Риме из свинца были изготовлены водопроводные трубы, именно он предопределил первую в истории экологическую катастрофу. Римляне не имели никакого представления о вреде свинца, им нравился податливый, прочный и простой в работе металл. Считалось даже, что свинец, добавленный в вино, улучшает его вкус. Поэтому почти каждый римлянин был отравлен свинцом. О симптомах отравления свинцом мы расскажем ниже, а пока лишь укажем, что одним из них является расстройство рассудка. Видимо отсюда и берут свое начало все эти безумные выходки знатных римлян и бесчисленные сумасшедшие оргии. Некоторые исследователи даже считают, что свинец явился чуть ли основной причиной падения Древнего Рима.
В древности гончары мололи свинцовую руду, разводили водой и обливали полученной смесью глиняные предметы. После обжига такие сосуды покрывались тонким слоем блестящего свинцового стекла.
Англичанин Джордж Равенскрофт в 1673 году усовершенствовал состав стекла, добавив к исходным компонентам оксид свинца и таким образом получил легкоплавкое блестящее стекло, которое было очень похоже на натуральный горный хрусталь. А в конце 18 века Георг Страсс при производстве стекла сплавил вместе белый песок, поташ и оксид свинца, получив такое чистое и блестящее стекло, что его сложно было отличить от алмаза. Отсюда и пошло название «стразы», по сути подделка под драгоценные камни. К сожалению, среди современников Страсс прослыл мошенником и его изобретение находилось в забвении до тех пор, пока в начале XX века Даниэль Сваровски не смог сделать из производства страз целую индустрию моды и направление искусства.
После появления и широкого распространения огнестрельного оружия, свинец начал использоваться для производства пуль и дроби. Из свинца изготавливали типографские литеры. Свинец ранее входил в состав белой и красной красок, ими писали почти все старинные художники.
Свинцовая дробь
Химические свойства свинца кратко
Свинец — металл матового серого цвета. Однако его свежий срез хорошо блестит, но к сожалению почти моментально покрывается грязноватой оксидной плёнкой. Свинец очень тяжелый металл, он тяжелее железа в полтора раза, а алюминия в четыре. Недаром в русском языке слово «свинцовый» является в некоторой мере синонимом тяжести. Свинец очень легкоплавкий металл, он плавится уже при 327 ° С. Ну, этот факт известен всем рыбакам, которые с легкостью выплавляют нужные по весу грузила. Также свинец очень мягок, его можно резать обычным стальным ножом. Свинец очень малоактивный металл, провести с ним реакцию или растворить его не составляет никакого труда даже при комнатной температуре.
Органические производные свинца являются очень ядовитыми веществами. К сожалению, одно из них, тетраэтилсвинец, широко использовалось как присадка к бензину, позволяющая повысить октановое число. Но зато к счастью, тетраэтилсвинец больше не применяется в такой ипостаси, химики и производственники научились повышать октановое число более безопасными способами.
Влияние свинца на организм человека и симптомы отравления
Любые соединения свинца очень ядовиты. Металл проникает в организм вместе с едой или со вдыхаемым воздухом и разносится кровью. Причем вдыхание паров свинцовых соединений и пыли намного более опасно, чем присутствие его в пище. Свинец имеет свойство накапливаться в костя
Цены и новости на рынке химии
Новости и события
Рязанцев беспокоит экологическая обстановка в городе. Постоянные жалобы на вонь, попытки добиться от властей внятного диалога или действий, растущее движение «Дышим чистым» — это все отлично хар…
Пестициды и антипирены снижают умственную активность сильнее, чем тяжелые металлы. Потеря IQ от токсичных химических веществ упала с 27 миллионов баллов в 2002 году до 9 миллионов баллов IQ в 20…
По результатам последних исследований уровня загрязнения почв 117 из 128 проб, взятых в восьми районах Санкт-Петербурга, выявили содержание «опасных» и даже «чрезвычайно опасных» для человека хи…
Кабинет министров Азербайджана на три месяца обнулил ставки таможенных пошлин на бензин с октановым числом 92 и 95, импортируемый в республику. «Решением Кабмина: с 1 сентября 2019…
Опубликовано итоговое решение ограничить оборот фосфорных удобрений с высоким содержанием тяжелых металлов (кадмия, мышьяка, свинца, ртути и никеля) на территории Европейского союза с 2022 г. Для удоб…
Концерн специальной химии LANXESS инвестирует в развитие производства ионообменных смол на своей площадке в Леверкузене, Германия. Компания оптимизирует технологические процессы и повышает эффективнос…
Информация
Рязанка рассказала, какими респираторами можно защититься от выбросов предприятий
Ученые назвали вещества, сильно снижающие IQ
Земля в Петербурге нашпигована химией
Рязанка рассказала, какими респираторами можно защититься от выбросов предприятий
Ученые назвали вещества, сильно снижающие IQ
Земля в Петербурге нашпигована химией
Каталог организаций и предприятий
ООО»НПП «Энергосплав» является производителем марочного свинца. (С2, ССуА). Предлагает к реализации свою продукцию. Закупаем на постоянной основе лом свинца.
Международная горнодобывающая компания, ведущая разведку, добычу и переработку основных цветных металлов. В 2006 году доход составил $82, 9 млн, чистая прибыль — $4, 838 млн. Переработано 1, 06 млн т руд…
Крупнейший индийский производитель свинца и цинка. В 2006 финансовом году производство цинка выросло до 505 тыс. тонн, свинца — 67, 36 тыс. т.
Производство порошков свинца, цинка, меди и их сплавов. Производство оксида цинка. Производство чернового свинца. Производство ферротитана ФТи70С1. Производство металлоконструкций для электромонтажа.
Отрасль: Трейдер УК: Направления: алюминиевый прокат; Контактное лицо: Попов Виталий Компания ООО «Драгон» является крупным производителем припоев свинцово-оловянных, сплавов на основе олова и свинца…
Покупка и переработка лома свинца. Производство свинца и свинцовых сплавов.
Предложения на покупку и продажу продукции
Производитель ООО «Гарант» (TM FLOVITAL) г. Дзержинск, предлагает сотрудничество по водорастворимым удобрениям, комплексным удобрениям, минеральным добавкам для КРС и комби-кормового производства, а т…
Высокооктановый компонент бензина –– прозрачная жидкость; рекомендуется для добавления к топливу в количестве 5-35% (по объёму) для достижения ОЧИ 92. После использования ВКБ-Д (окта-новое число смеше…
Высокооктановый компонент бензина –– прозрачная жидкость; рекомендуется для добавления к топливу в количестве 5-35% (по объёму) для достижения ОЧИ 92. После использования ВКБ-Д (окта-новое число смеше…
ЗАО «НТЗПИ» изготавливает изделия из пластмассы литьевым способом, предлагает услуги по изготовлению продукции из пластмасс на пресс-формах заказчика. Производит следующие изделия: — перемычки П…
Сочетание одного атома металла молибдена с двумя атомами серы составляет одну молекулу дисульфида молибдена Это серебристо-черное вещество, встречающееся в виде минерала молибденита — основная руда д…
получение и свойства. Полиморфные модификации олова. Химические свойства олова и свинца. — Студопедия
Герма́ний Ge — химический элемент 14-й группы 4 периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 32.
Германий встречается в виде примеси к полиметаллическим, никелевым, вольфрамовым рудам, а также в силикатах. В результате сложных и трудоёмких операций по обогащению руды и её концентрированию германий выделяют в виде оксида GeO2, который восстанавливают водородом при 600 °C до простого вещества:

Германий — хрупкий, серебристо-белый полуметалл. Кристаллическая решётка модификации — кубическая типа алмаза. Температура кипения 2850 °C, температура плавления 938,25 °C, плотность германия 5,33 г/см3. Германий является одним из немногих аномальных веществ, которые увеличивают плотность при плавлении. Германий по электрофизическим свойствам является не прямозонным полупроводником.
В химических соединениях германий обычно проявляет валентности 4 или 2.. При нормальных условиях устойчив к действию воздуха и воды, щелочей и кислот, растворим в царской водке и в щелочном растворе перекиси водорода.
О́лово (Sn) — элемент 14-й группы периодической таблицы химических элементов, пятого периода, с номером 50. Относится к группе лёгких металлов. Олово — пластичный, ковкий и легкоплавкий блестящий металл серебристо-белого цвета.
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем ~ 10 мм, в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационным методом на обогатительных столах. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановлении древесного угля, слои которого укладываются поочередно со слоями руды, или алюминием (цинком) в электропечах: SnO2 + C = Sn + CO2. Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
Простое вещество олово полиморфно. Олово существует в трех аллотропных модификациях. Серое олово (α-Sn) мелкокристаллический порошок, полупроводник, имеющий алмазоподобную кристаллическую решётку, существует при температуре ниже 13,2 °С. Белое олово (β-Sn) — пластичный серебристый металл, устойчивый в интервале температур 13,2—161 °С. Высокотемпературное гамма-олово (γ-Sn), имеющее ромбическую структуру, отличается высокой плотностью и хрупкостью, устойчиво между 161 и 232 °С (температура плавления чистого олова).
Химические свойства
При комнатной температуре олово устойчиво к воздействию воздуха или воды. При нагревании олово реагирует с большинством неметаллов. В разбавленной серной кислоте олово не растворяется, а с концентрированной — реагирует очень медленно.
В концентрированной азотной кислоте образуется оловянная кислота. При этом олово ведет себя как неметалл. При взаимодействии с разбавленной азотной кислотой олово проявляет свойства металла. При нагревании олово, подобно свинцу, может реагировать с водными растворами щелочей.
Гидрид олова — станнан SnH4 — можно получить по реакции:

Олову отвечают два оксида SnO2 и SnO.
При хранении на воздухе монооксид SnO постепенно окисляется.
Свине́ц (Pb) — элемент 14-й группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82 и, таким образом, содержит магическое число протонов. Простое вещество свинец — ковкий, сравнительно легкоплавкий металл серебристо-белого цвета с синеватым отливом.
Для получения свинца в основном используют руды, содержащие галенит. Сначала методом флотации получают концентрат, содержащий 40—70 процентов свинца. Затем метод шахтной восстановительной плавки или метод кислородно-взвешенной циклонной электротермической плавки свинцово-цинковых продуктов.
Свинец имеет довольно низкую теплопроводность. Металл мягкий, режется ножом, легко царапается ногтем. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет. Относится к группе тяжёлых металлов.
Химические свойства
На внешней электронной оболочке находятся 4 не спаренных электрона (2 на p- и 2 на d-подуровнях), поэтому основные степени окисления атома свинца — +2 и +4.
· Соли двухвалентного свинца реагируют с щелочами, образуя почти нерастворимый гидроксид свинца:

· При избытке щёлочи гидроксид растворяется:

· Реагирует со щелочами и кислотами:

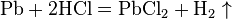
Свинец образует комплексные соединения с координационным числом 4, например, 
Кристаллическая решетка
Основная статья: Кристаллическая решетка .
Кристаллическая структура — бесконечная трехмерная периодическая решетка, составленная из частиц вещества (таких как молекулы, атомы и т.д.)
Кристаллическая решетка — элементарная трехмерная ячейка кристаллической структуры, которая полностью определяет его свойства. В общем случае это наклонный параллелепипед (иногда более одного) из частиц, находящихся в его узлах, ребрах и т. Д.
Классификация решеток
Существует множество классификаций кристаллических решеток — по типу частиц (химическая), по общей форме решетки (сингония), по типу симметрии решетки (кристаллическая система), по типу пространственных трансляций (решетка Браве) и т. Д. вы можете найти только основные классификации.
Химическая промышленность
В химической классификации решетки объединены в четыре вида по типу составляющих частиц.
| Тип решетки | Узлы решетки | Примеры | Модель |
|---|---|---|---|
| Атомный | Атомы неметаллических элементов | Алмаз, графит, селен |  |
| Молекулярный | Молекулы неионных соединений | Вода, диоксид углерода, сахароза |  |
| Ионный | Катионы и анионы солей, кислот, щелочей | Поваренная соль, лимонная кислота, сульфат меди (II) |  |
| Металлик | Атом-ионы металлических элементов и их общие электроны | Железо, медь, свинец, никель |  |
Кристаллическая система, сингония, система решеток
Главный атрикл: Кристаллическая система (википедия) .
Главный атриул: Кристаллическая система .
Классификация кристаллической системы фокусируется на наборах осей, решетку которых можно вращать менее чем на 360 °, и комбинировать с неподвижной осью.
Классификация syngony фокусируется на решетках с одинаковыми углами и определенными расстояниями между узлами.
Система классификации решеток фокусируется на типах симметрии решеток.
Несмотря на то, что определяемые параметры всех трех систем классификации совершенно разные, геометрические свойства форм кристаллов почти позволяют четко установить соответствие между ними.Они часто используются как синонимы друг друга, поскольку описывают конечные решетки примерно одинаково.
Обратите внимание, что на страницах проекта Crystal Growing все эти термины означают кристаллическую систему .
Форма кристалла
Основная статья: Форма .
Здесь вы можете найти все 47 существующих простых форм кристаллов в зависимости от кристаллической системы.
Стоит отметить, что кристаллы в простейшей форме вырастают редко, часто встречаются различные аналоги, можно встретить усечение, скошенные края и многие другие искажения.
Рекомендовано к просмотру
Навигация
.
Решетка Браве — 14 возможных кристаллических структур с иллюстрациями
- Классы
- Класс 1-3
- Класс 4-5
- Класс 6-10
- Класс 11-12
- КОНКУРСНЫЙ ЭКЗАМЕН
- BNAT 000 NC
- 000 NC Книги
- Книги NCERT для класса 5
- Книги NCERT для класса 6
- Книги NCERT для класса 7
- Книги NCERT для класса 8
- Книги NCERT для класса 9
- Книги NCERT для класса 10
- Книги NCERT для класса 11
- Книги NCERT для класса 12
- NCERT Exemplar
- NCERT Exemplar Class 8
- NCERT Exemplar Class 9
- NCERT Exemplar Class 10
- NCERT Exemplar Class 11
- NCERT 9000 9000
- NCERT Exemplar Class
- Решения RS Aggarwal, класс 12
- Решения RS Aggarwal, класс 11
- Решения RS Aggarwal, класс 10 90 003 Решения RS Aggarwal класса 9
- Решения RS Aggarwal класса 8
- Решения RS Aggarwal класса 7
- Решения RS Aggarwal класса 6
- Решения RD Sharma
- RD Sharma Class 6 Решения
- Решения RD Sharma Решения RD Sharma Class 8
- Решения RD Sharma Class 9
- Решения RD Sharma Class 10
- Решения RD Sharma Class 11
- Решения RD Sharma Class 12
- 000 NC Книги
- PHYSICS
- Механика
- Оптика
- Термодинамика Электромагнетизм
- ХИМИЯ
- Органическая химия
- Неорганическая химия
- Периодическая таблица
- MATHS
- Теорема Пифагора 0004
- 000300030004
- Простые числа
- Взаимосвязи и функции
- Последовательности и серии
- Таблицы умножения
- Детерминанты и матрицы
- Прибыль и убыток
- Полиномиальные уравнения
- Деление фракций
- BNAT 000 NC
- 000
- 000
- 000
- 000
- 000
- 000 Microology
- 000
- 000 Microology
- 000 BIOG3000
- FORMULAS
- Математические формулы
- Алгебраические формулы
- Тригонометрические формулы
- Геометрические формулы
- КАЛЬКУЛЯТОРЫ
- Математические калькуляторы
- 0003000 PBS4000
- 000300030002 Примеры калькуляторов химии Класс 6
- Образцы документов CBSE для класса 7
- Образцы документов CBSE для класса 8
- Образцы документов CBSE для класса 9
- Образцы документов CBSE для класса 10
- Образцы документов CBSE для класса 11
- Образцы документов CBSE чел для класса 12
- Классы
- CBSE Контрольный документ за предыдущий год
- CBSE Контрольный документ за предыдущий год Класс 10
- Контрольный документ за предыдущий год CBSE, класс 12
- HC Verma Solutions
- HC Verma Solutions Class 11 Physics
- Решения HC Verma, класс 12, физика
- Решения Лакмира Сингха
- Решения Лакмира Сингха, класс 9
- Решения Лакмира Сингха, класс 10
- Решения Лакмира Сингха, класс 8
- Заметки CBSE
- , класс
- CBSE Notes
- Примечания CBSE класса 7
- Примечания CBSE класса 8
- Примечания CBSE класса 9
- Примечания CBSE класса 10
- Примечания CBSE класса 11
- Примечания CBSE класса 12
- Примечания к редакции
- CBSE
- Примечания к редакции класса 10 CBSE
- Примечания к редакции класса 11 CBSE 9000 4
- Примечания к редакции класса 12 CBSE
- Дополнительные вопросы по математике класса 8 CBSE
- Дополнительные вопросы по науке 8 класса CBSE
- Дополнительные вопросы по математике класса 9 CBSE
- Дополнительные вопросы по науке класса 9 CBSE
- , класс 3
- , класс 4
- , класс 5
- , класс 6
- , класс 7
- , класс 8
- , класс 9 Класс 10
- Класс 11
- Класс 12
- Решения NCERT для класса 11
- Решения NCERT для класса 11 по физике
- Решения NCERT для класса 11 Химия Решения для биологии класса 11
- Решения NCERT для математики класса 11 9 0003 NCERT Solutions Class 11 Accountancy
- NCERT Solutions For Класс 12 по физике
- Решения NCERT для химии класса 12
- Решения NCERT для класса 12 по биологии
- Решения NCERT для класса 12 по математике
- Решения NCERT Класс 12 Бухгалтерия
- Решения NCERT, класс 12, бизнес-исследования
- Решения NCERT, класс 12 Экономика
- NCERT Solutions Class 12 Accountancy Part 1
- NCERT Solutions Class 12 Accountancy Part 2
- NCERT Solutions Class 12 Micro-Economics
- NCERT Solutions Class 12 Commerce
- NCERT Solutions Class 12 Macro-Economics
- Решения NCERT для математики класса 4
- Решения NCERT для класса 4 EVS
- Решения NCERT для математики класса 5
- Решения NCERT для класса 5 EVS
- Решения NCERT для математики класса 6
- Решения NCERT для науки класса 6
- Решения NCERT для социальных наук класса 6
- Решения NCERT для класса 6 Английский
- Решения NCERT для класса 7 Математика
- Решения NCERT для класса 7 Наука
- Решения NCERT для класса 7 по социальным наукам
- Решения NCERT для класса 7 Английский
- Решения NCERT для класса 8 Математика
- Решения NCERT для класса 8 Science
- Решения NCERT для социальных наук 8 класса
- Решение NCERT ns для класса 8 Английский
- Решения NCERT для социальных наук класса 9
- Решения NCERT для математики класса 9 Глава 1
- Решения NCERT для Математика класса 9 Глава 2
- Решения NCERT для математики класса 9 Глава 3
- Решения NCERT для математики класса 9 Глава 4 Решения
- NCERT для математики класса 9 Глава 5
Определение кристаллической решетки — Химический словарь
Что такое решетка?
Решетка — это упорядоченный массив точек, описывающий расположение частиц, образующих кристалл.
Элементарная ячейка кристалла определяется узлами решетки. Элементарная ячейка — это наименьшая часть кристалла, которая регулярно повторяется посредством трансляции в трех измерениях, что создает весь кристалл.
Например, показанное здесь изображение представляет собой элементарную ячейку примитивной кубической структуры.
В нарисованной структуре все частицы (желтые) одинаковы. В этом частном случае точки решетки, определяющие элементарную ячейку, совпадают с центрами частиц кристалла. Это не всегда так.
Ионная решетка
Если кристалл состоит из ионов, соединение можно описать как ионную решетку.
Хорошо известными примерами ионных решеток являются хлорид натрия, перманганат калия, бура (борат натрия) и сульфат меди (II).
Кристаллы перманганата калия. Изображение Бена Миллса.
Элементарная ячейка перманганата калия. Изображение Бена Миллса.
Ковалентная решетка
Если кристалл состоит из ковалентно связанных атомов, его можно описать как ковалентную решетку или бесконечную ковалентную решетку.
Хорошо известными примерами ковалентных решеток являются алмаз, кварц (диоксид кремния), кремний и серое олово.
Кристаллический кремний. Изображение Энрикорос.
Небольшая часть кристаллической структуры кремния.
Константы решетки
Постоянные решетки (или параметры решетки) — это длины и углы между краями элементарной ячейки.
На этой решетчатой диаграмме параллелепипеда постоянные решетки — это a, b и c (длина) и α, β и γ (углы).
Решетчатые конструкции
Решетки Браве. На основе изображения Napy1 Kenobi.
Кристаллические материалы вписываются в одну из четырнадцати известных структур решетки.Они известны как решетки Браве .
Названия систем кристаллической решетки, соответствующие номерам на диаграммах, следующие:
1. Примитивная кубическая
2. Тело центрированная кубическая
3. Гранецентрированная кубическая
4. Примитивная тетрагональная
5. Тело центрированная тетрагональная
6. Примитивная орторомбическая
7. Орторомбическая центрированная по основанию
8. Тело центрированная Орторомбическая
9. По центру лица Орторомбический
10. Примитивный моноклинический
11.Моноклиника по центру основания
12. Триклиническая модель
13. Ромбоэдрическая
14. Гексагональная
Дефекты решетки
Если предположить, что кристалл основан на математически совершенной ионной решетке, его расчетная прочность на растяжение была бы намного больше, чем наблюдается на самом деле.
Настоящие кристаллы имеют дефекты решетки, которые являются источниками слабости. Ионы, отсутствующие в ожидаемых местах, и ионы, занимающие необычные координационные узлы, являются примерами дефектов решетки.
Дефекты решетки также могут быть полезны, например, улучшая проводимость некоторых полупроводниковых материалов.
.
Кристаллическая решетка световозвращающая лента
Информация о продукте:
1, Материал: ПВХ
2, Размер: может быть изготовлен по разной ширине в соответствии с вашими требованиями,
3, Характеристики: Гибкий, глянцевый, устойчивый к загрязнениям и проникновение воды. доступны в различных цветах и моделях.
4, различные модели доступны в соответствии с требованиями клиентов.
Производственная выставка:
000
9000
9000
9000
Название | Zhejiang Caiyuan Reflecting Material Co., Ltd |
Основная продукция | Светоотражающая ткань, светоотражающая пленка / лента, светоотражающий жилет, световозвращающая пленка для автомобилей, световозвращающая пленка, предупреждающий треугольник, некоторые световозвращающие товары. |
Стандартный | E-MARK, EN471,3C, |
Адрес | Зона экономического развития (Шэнтан), Уи, Чжэцзян, Китай |
Compang | http: // www.zjcaiyuan.com |
Мы являемся профессиональным производителем с сильными производственными возможностями и хорошим качеством светоотражающего материала.
Наша сертификация
Ваше удовлетворение — наша первоочередная задача. Пожалуйста, не стесняйтесь обращаться к нам, если у вас есть какие-либо вопросы.
Спасибо за посещение и хорошего дня!
