Свинец кристаллическая структура — Справочник химика 21
Хорошо известно, что нафтенат свинца также является ингибитором коррозии в литиевых смазках. Соединения висмута и здесь превосходят свинец, так как кристаллическая структура сульфида висмута и висмуторганических соединений обеспечивает большую полярность по сравнению с сульфидом свинца это является и вторым объяснением его лучших противозадирных свойств. [c.278] Третий представитель этой подгруппы — свинец — в компактном состоянии представляет собой серебристо-серый металл с синеватым отливом. Свинец в отличие от Ge и Sn не имеет полиморфных модификаций и всегда кристаллизуется в плотноупакованной ГЦК структуре. Таким образом, сравнивая кристаллические структуры в ряду Ge—Sn—Pb, можно отметить, что общая тенденция к металлизации, отмеченная у элементов, прослеживается и в кристаллических структурах их гомоатомных соединений — от рыхлых алмазоподобных структур (Ge и a-Sn) к плотноупакованным ( -Sn и РЬ). В этом ряду олово все же ближе к германию, чем к своему
Кристаллическая структура тетрафенилсилана была определена кристаллографическими методами при помощи рентгеновских лучей [1443, 1638, 051, 052]. Изучение изоморфизма [799] тетра-фенилзамещенных IV группы элементов (углерод, кремний, германий, олово, свинец) дало очень интересные сравнительные данные для этих элементов [807, 2270]. [c.231]
Листовой свинец шириной 2150 мм и более поставляется ролями (марок СО, С1С, С1, С2С, С2, СЗС и СЗ) или свернутым в рулон. Свинец первых пяти марок, содержащий до 0,05% примесей обладает наилучшей коррозионной стойкостью, высокой пластичностью, но низко механической прочностью, которая резко снижается при температуре свыше 150 °С [202]. Свинец, содержащий небольшое количество примесей, имеет грубую кристаллическую структуру и склонен к рекристаллизации при температурах О—20°С [203].
Получают этот раствор в колонне 1, куда предварительно гранулированный свинец подают с помощью электротельфера 2. Разбавленную до необходимой концентрации азотную кислоту непрерывно вводят через дозатор 3 в нижнюю часть колонны. Раствор нитрата свинца непрерывно сливают в приемную емкость 4, откуда перекачивают насосом 5 в напорную емкость 6. Предварительно приготовленную хромовую смесь собирают в напорной емкости 7. Осаждение пигмента проводят в реакторе непрерывного действия 8. Исходные растворы непрерывно вводят в него в заданных соотношениях с помощью дозаторов 9 п 10, образовавшуюся суспензию непрерывно сливают самотеком для вызревания в аппарат 11. Для стабилизации кристаллической структуры образовавшегося крона предназначен аппарат 12. В него вводят из мерника 13 предварительно приготовленные растворы стабилизаторов. Суспензию готового пигмента насосом 14 перекачивают в емкость 15, откуда она поступает для фильтрования на вакуум-фильтр 17. Отмывку пигмента от водорастворимых солей проводят репульпацией
Весьма детальная классификация элементов по кристаллическим структурам была дана в 1942—1960 гг. Г. Б. Бокием [160]. Он различает шесть основных типов структур элементов 1) гексагональную плотную упаковку, 2) кубическую плотную, 3) кубическую объемноцентрированную упаковку (металлические структуры), 4) молекулярные структуры, 5) ковалентные структуры с координационным числом K—S—N, 6) прочие структуры. Г. Б. Бокий отметил принадлежность водорода по кристаллохимическим признакам к группе галогенов, разделение элементов III группы на две подгруппы (бора—таллия и скандия—актиния), указал на своеобразие структур марганца, урана, индия, цинка, кадмия и ртути, объяснил повышенные значения da для структур цинка и кадмия эллипсоидальной формой атомов и высказал предположение, что алюминий, а- и р-таллий, свинец и индий в металлическом состоянии не отщепляют всех валентных электронов [160].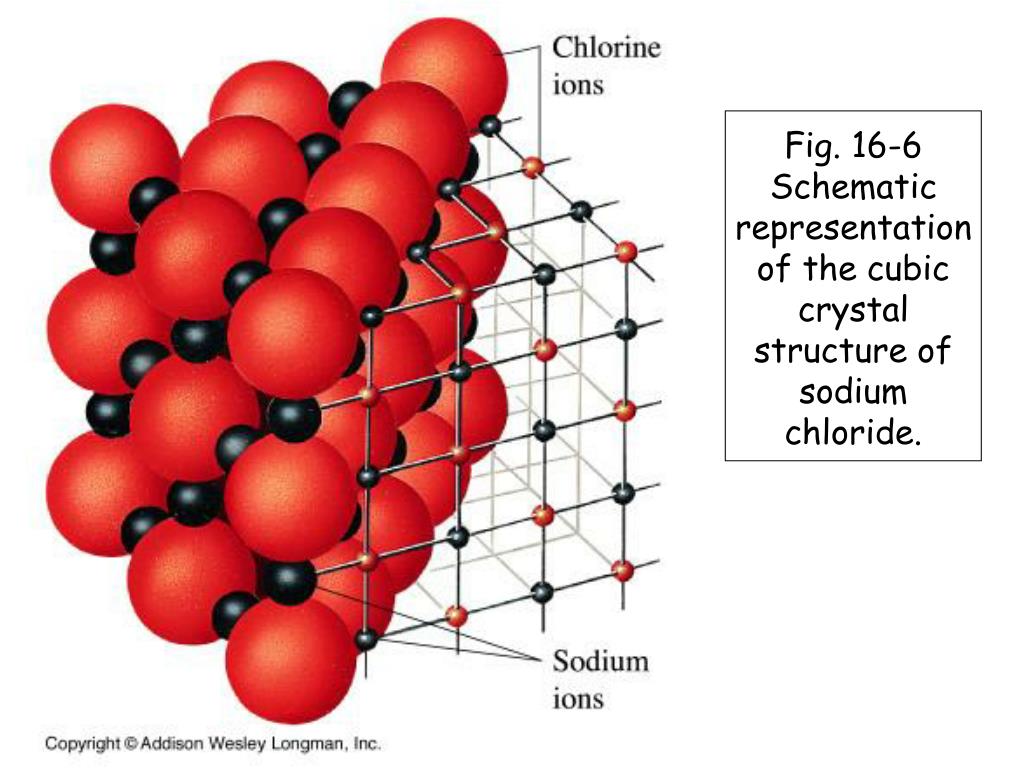
Природа вещества может играть важную роль в процедурах отбора, хранения, химической обработки перед анализом, правильного определения и оценки результатов (включая токсичность вещества или возможные поправки). Так, свинец может находиться в воздухе вблизи автострад в виде газа, аэрозоля и твердого вещества, в виде металла, оксида, хлорида, бромида, карбоната, сульфата, фосфата и др., а также в виде алкилсвинца и других металлорганических производных. Кадмий присутствует в воде в виде ионов, неорганических и органических соединений, металла, адсорбированного на твердых примесях или осажденного в виде покрытия, а также в виде включений в твердых биологических материалах или в кристаллических структурах.
Олово существует в двух полиморфных модификациях, причем низкотемпературная (a-Sn — серое олово) обладает кристаллической решеткой типа алмаза и полупроводниковыми свойствами, а высокотемпературная ( -Sn — белое олово), хотя и представляет собой металл по физическим свойствам, тем не менее кристаллизуется в малохарактерной для металлов тетрагональной структуре. С химической точки зрения олово ближе примыкает к германию, чем к свинцу, но металлический характер этого элемента выражен более ярко, чем у германия. Единственным типичным металлом в этой подгруппе является свинец. В виде простого вещества он кристаллизуется в плотноупакованной ГЦК структуре с координационным числом 12. В своих соединениях он выступает в основном в качестве катионообразователя. [c.215]
В исходном состоянии [16] покрытия N1—В содержат до 10 % В, а также небольшие количества продуктов разложения стабилизаторов (сера, таллий, свинец и др.). От содержания бора зависит структура осадков при отсутствии бора (электро-осажденное покрытие) структура кристаллическая с очень сильно выраженной текстурой при 4 % В — кристаллическая с сильно выраженной текстурой при 7,5 % В — кристаллическая со слабой текстурой при 11,4 % В — аморфная.
Это объясняется тем, что по своей структуре, т. е. по фактору, которым прежде всего определяется зависимость Ср от t для кристаллических веществ, алмаз не является исключением в подгруппе углерода. Другое дело— свинец. Нанеся на рис. 202 точки для РЬ [152, 156], можно было бы [c.241]
Металлы — хорошие проводники тепла и электричества. При прохождении электрического тока через металлические проводники не происходит переноса частиц металла (электронная проводимость, или проводимость первого рода). По способности проводить тепло и электричество металлы располагаются приблизительно в одном и том же порядке лучшие проводники — серебро и медь, затем золото, алюминий, железо и худшие — свинец и ртуть. Следовательно, между теплопроводностью металлов и их электропроводностью наблюдается почти постоянное соотношение. Металлы имеют кристаллическое строение. Представляют собой совокупность множества кристалликов микроскопических размеров (кристаллиты) в 1 см металла их содержится многие миллионы. Отдельно взятый кристаллит анизотропен (гл. 7, 1). В результате многочисленности кристаллитов в единице объема металла векторы анизотропии, направленные хаотично, взаимно компенсируются, и кусок металла в итоге проявляет свойство изотропности — равенство свойств в различных направлениях. Такие тела называют квазиизотропными. Следовательно, металлы по своей внутренней структуре квазиизотропны.
При совместном использовании соединений серы и висмута, также как и в случае свинца, благодаря тепловой энергии трения образуются сульфиды железа и висмута. Более высокий противо-задирный эффект объясняется тем, что висмут обладает большей растворимостью в железе, чем свинец, образуя более прочную защитную пленку сплава на поверхности трущихся деталей. Кристаллическая структура такого сплава в достаточной степени отлична от таковой у чистых металлов. [c.278]
Все элементы, располагающиеся слева от границы Цинтля, ха рактеризуются дефицитом валентных электронов, в силу чего в плот поупакованпых кристаллических структурах соответствующих про стых веществ доминирует металлическая связь. При этом граница Цинтля не является границей между металлами и неметаллами а лишь разграничивает элементы с дефицитом и избытком валент ных электронов, что определяет собенности кристаллохимического строения простых веществ. Обращает на себя внимание ряд исключений из правила 8—N. Так, свинец, расположенный справа от границы Цинтля, обладает плотноупакованной кристаллической решеткой с металлическим типом связи. Для последнего представителя УА-группы — висмута — характерно малое различие в межатомных расстояниях внутри слоя и между слоями 0,310 и 0,347 им, что фактически приводит к координационному числу 6. Ни одна из двух известных структур полония также не отвечает правилу К)м-Розери. Объясняется это тем, что с увеличением атомного номера элемента в пределах каждой группы возрастает количество элект-
При этом граница Цинтля не является границей между металлами и неметаллами а лишь разграничивает элементы с дефицитом и избытком валент ных электронов, что определяет собенности кристаллохимического строения простых веществ. Обращает на себя внимание ряд исключений из правила 8—N. Так, свинец, расположенный справа от границы Цинтля, обладает плотноупакованной кристаллической решеткой с металлическим типом связи. Для последнего представителя УА-группы — висмута — характерно малое различие в межатомных расстояниях внутри слоя и между слоями 0,310 и 0,347 им, что фактически приводит к координационному числу 6. Ни одна из двух известных структур полония также не отвечает правилу К)м-Розери. Объясняется это тем, что с увеличением атомного номера элемента в пределах каждой группы возрастает количество элект-
Все элементы, располагающиеся слева от границы Цинтля, характеризуются дефицитом валентных электронов, в силу чего в плотноупакованных кристаллических структурах соответствующих простых веществ доминирует металлическая связь. При этом граница Цинтля не является границей между металлами и неметаллами, а лишь разграничивает элементы с дефицитом и избытком валентных электронов, что определяет особенности кристаллохимического строения р 21. Икосаэдр — элемент простых веществ. Обращает на себя внимание ряд кристаллической структуры исключений из правила 8 — N. Так, свинец, располо- олиморфных модификаций женный на границе Цинтля, обладает плотноупакован-ной кристаллической структурой с металлическим [c.243]
Примеси других металлов (загрязнений) в свинцово-сурьмяных сплавах при застывании отливок собираются в межкристаллитных прослойках. Если эти примеси растворяются в серной кислоте легче, чем свинец, то их присутствие усиливает коррозию. Чем мельче кристаллическая структура сплава, тем легче закрыть межкрис-таллитные прослойки слоем РЬОг. Поэтому для уменьшения корро- [c.366]
Как показал Тамман (Tammann, 1932), полоний очень склонен к образованию смешанных кристаллов с такими металлами, как серебро, медь, цинк, кадмий, олово, свинец, сурьма, висмут, но не дает смешанных кристаллов с теллуром.
Свинец уксуснокислый, сахар-сатурн, (СНзС00)2РЬ-ЗН20— куски, в изломе, кристаллической структуры белого или кремового цвета. На воздухе выветривается. Получают растворением окиси свинца в уксусной кислоте. [c.1017]
По литературным данным, сернистый свинец представляет собой полупроводник, имеет кристаллическую структуру, аналогичную структуре хлористого натрия [1] с шириной запретной зоны 1,17 эе и подвижностью носителей тока 400— 700 см 1в.сек [2]. Отмечена возможность применения сернистого свинца в качестве материала для термоэлектрических устройств [2] вследствие сравнительно малой величины теплопроводности ( 7.10 кал1см.сек.град) и большой подвижностью носителей тока. [c.302]
Такое доказательство нельзя считать убедительным, так как на реакционной способности двойного соединения существенно отражается его прочность, возрастающая с убылью свободной энергии при образовании двойного соединения. Например, SO3 является значительно более сильным окислителем, чем SOs-HgO или SO -H l. Даже в случае образования соединений с комплексным анионом свойства катиона существеннейшим образом отражаются на устойчивости и окислительных свойствах всей соли. Достаточно сравнить резко различную устойчивость КСЮ4 и Ag lOj, обладающих одинаковой кристаллической структурой. Быстрое осаждение AgAuF4 также не является убедительным доказательством, потому что известны многочисленные случаи практически мгновенного разрушения комплексных ионов. Например, при прибавлении раствора Na.,S к раствору плюмбита наблюдается мгновенное выделение PbS, хотя в плюмбите свинец входит в состав комплексного аниона. [c.138]
Например, при прибавлении раствора Na.,S к раствору плюмбита наблюдается мгновенное выделение PbS, хотя в плюмбите свинец входит в состав комплексного аниона. [c.138]
Малорастворимый фтористый свинец PbFg легко получается действием плавиковой кислоты на гидроокись или карбонат свинца, или осаждением водных растворов солей свинца фтористым аммонием. Трудно, однако, получить вполне чистое вещество и, в особенности, непосредственно получить определенную модификацию вещества. Осаждение в обычных условиях приводит к получению ромбической модификации, кристаллическая структура которой аналогична структуре хлористого и бромистого свинца [130, 153]. [c.320]
Как показал Тамман (Ташшапп, 1932), полоний очень склонен к образованию смешанных кристаллов с такими металлами, как серебро, медь, цинк, кадмий, олово, свинец, сурьма, висмут, но не дает смешанных кристаллов с теллуром. Последнее объясняется тем, что структура кристаллической решетки полония сильно отличается от структуры решетки теллура. Кристаллическая структура полония была определена Ролье (RoIIier, [c.724]
Механизм коррозии свинца можно представить себе следующим образом кислород, выделяющийся из воды на поверхности РЬОг, при высоком потенциале частично входит в виде атомов в решетку (что придает перекиси свинца вследствие нарушения правильности кристаллической структуры черную окраску) и, пройдя через слой РЬОг, окисляет свинец. Повидимому, соединение кобальта, адсорбированное на поверхности, затрудняет этот процесс внедрения атомов кислорода в решетку двуокиси свинца. Это подтверждается тем, что в присутствии соединения кобальта двуокись свинца при анодной поляризации сохраняет светлокоричневый цвет, тогда как в отсутствии соли кобальта при близких потенциалах двуокись свинца становится черной и после прекращения поляризации длительное время из нее выделяется газообразный кислород. Свинец под слоем двуокиси свинца может, повидимому, корродировать также и в результате проникновения раствора электролита между кристаллами или аггломератами двуокиси свинца. Такое проникновение должно усиливаться при увеличении смачивания двуокиси свинца в результате увеличения заряда двойного слоя или специфической адсорбции веществ, делающих поверхность более гидрофильной. Кроме того, добавки могут влиять различно на перенапряжение выделения молекулярного кислорода, с одной стороны, и атомарного кислорода, внедряющегося в решетку, с другой стороны. [c.548]
Такое проникновение должно усиливаться при увеличении смачивания двуокиси свинца в результате увеличения заряда двойного слоя или специфической адсорбции веществ, делающих поверхность более гидрофильной. Кроме того, добавки могут влиять различно на перенапряжение выделения молекулярного кислорода, с одной стороны, и атомарного кислорода, внедряющегося в решетку, с другой стороны. [c.548]
Простые вещества. В ряду Ое—5п—РЬ отчетливо усиливаются металлические свойства простых веществ. Германий — серебристо-белый с желтоватым оттенком, внешне похож на металл, но имеет алмазоподобную решетку. Олово полиморфно. В обычных условиях оно существует в виде 8-модификацни (белое олово), устойчивой выше 13,2°С это — серебристо-белый металл, кристаллическая решетка его тетрагональной структуры с октаэдрической координацией атомов. При охлаждении белое олово переходит в -модификацию (серое олово) со структурой типа алмаза (пл. 5,85 г/см ). Переход (3-> -сопровождается увеличением удельного объема (на 25,6 %), в связи с чем олово рассыпается в пороиюк. Свинец — темно-серый металл с типичной для металлов структурой гранецентрированного куба. [c.422]
В ряду Ое—8п—РЬ отчетливо усиливаются металлические свойства простых веществ. Германий—серое металлоподобное вещество. Хотя германий внещне похож на металл, он имеет алмазоподобную структуру. Олово в обычных условиях существует в виде (3-модификации (белое олово). Это серебристо-белый металл, имеющий кристаллическую решетку с искаженно октаэдрической координацией атомов. При охлаждении ниже температуры 13,2 °С белое олово переходит в а-модификацию (серое олово) с алмазоподобной структурой. Этот переход сопровождается увеличением удельного объема (на 25,6%), в связи с чем олово рассыпается в порошок. Свинец — темно-серый металл с типичной для металлов структурой гранецентрированного куба (к.ч. = ]2). [c.188]
СИЛЬВЙН [от латинизированного имени (Sylvius) голл.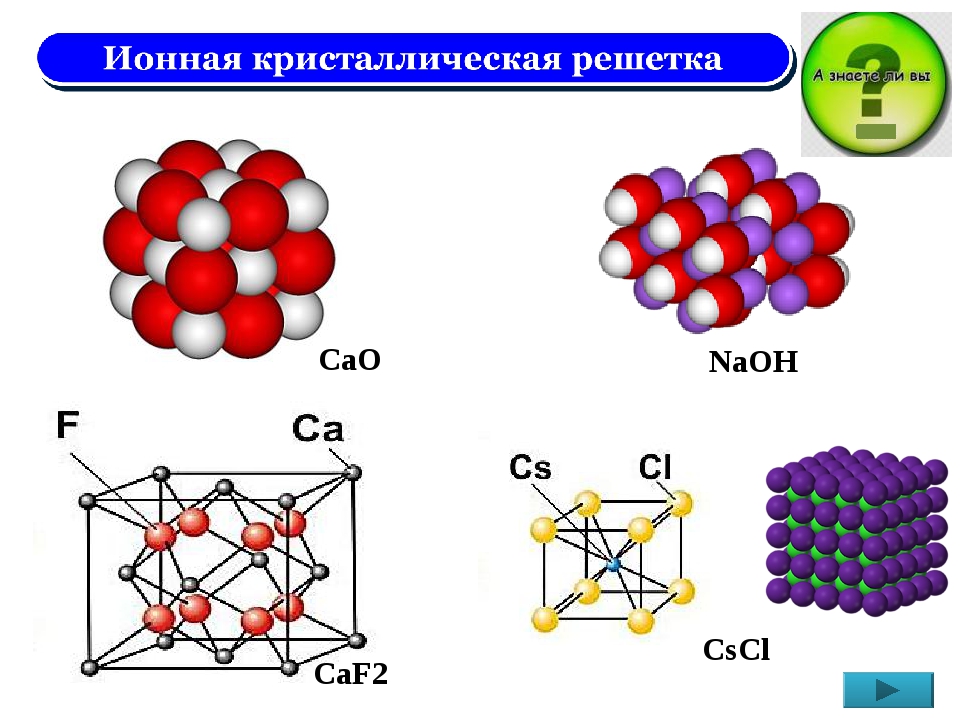 врача и химика Ф. Боэ], КС1 — минерал класса хлоридов. Хим. состав (%) К — 52,44 С1 — 47,56. Примеси бром, свинец, цезий, аммоний, уран, железо, барий, медь, таллий, марганец. Структура координационная, сингония кубическая, вид симметрии гексоктаэд-рический. Образует зернисто-кристаллические массы иногда встречается в гнездах и линзах в виде крупных кристаллов кубического, реже — октаэдрического габитуса. В прожилках обычно имеет волокнистое строение. Отмечаются выцветы С. на почве, стенках горных выработок и среди продуктов вулканических возгонов. Спайность совершенная по (100) (см. Спайность минералов). Плотность 1,99 г/см . Твердость 2,0. Хрупкий. Бесцветный и прозрачный в зависимости от количества микровключений газа, гематита или галита цвет становится молочно-белым, голубым, красным, желтым (см. Цвет минералов). Блеск стеклянный (см. Блеск минералов). Излом неровный (см. Излом минералов). Гигроскопичен, легко растворяется в воде. Изотропный, п = = 1,4904. Возникает в результате испарения природных вод, содержащих хлористый калий, в процессе перекристаллизации карналлита в соленосных отложениях и как продукт вулканической деятельности. Получают С. из водных растворов, [c.389]
врача и химика Ф. Боэ], КС1 — минерал класса хлоридов. Хим. состав (%) К — 52,44 С1 — 47,56. Примеси бром, свинец, цезий, аммоний, уран, железо, барий, медь, таллий, марганец. Структура координационная, сингония кубическая, вид симметрии гексоктаэд-рический. Образует зернисто-кристаллические массы иногда встречается в гнездах и линзах в виде крупных кристаллов кубического, реже — октаэдрического габитуса. В прожилках обычно имеет волокнистое строение. Отмечаются выцветы С. на почве, стенках горных выработок и среди продуктов вулканических возгонов. Спайность совершенная по (100) (см. Спайность минералов). Плотность 1,99 г/см . Твердость 2,0. Хрупкий. Бесцветный и прозрачный в зависимости от количества микровключений газа, гематита или галита цвет становится молочно-белым, голубым, красным, желтым (см. Цвет минералов). Блеск стеклянный (см. Блеск минералов). Излом неровный (см. Излом минералов). Гигроскопичен, легко растворяется в воде. Изотропный, п = = 1,4904. Возникает в результате испарения природных вод, содержащих хлористый калий, в процессе перекристаллизации карналлита в соленосных отложениях и как продукт вулканической деятельности. Получают С. из водных растворов, [c.389]
При атмосферном давлении свинец обладает г. ц. к. структурой с периодом (3 = 0,49502 нм при комнатной температуре. Энергия кристаллической рещетки 194 мкДж/кмоль. При приложении высокого давления (до 13 1 ГПа) при 25 °С в свинце протекает фазовое превращение, связанное с переходом г. ц. к. решетки (РЫ) в г. п. у. решетку (РЬ П). Периоды решетки РЬП а = 0,32б5 нм, с = 0.5387 им. Переход 1- П сопровождается резким изменением объема (0,868 0,289) -10- м кг. Работа выхода электрона ф = 4,0 эВ для грани монокристалла (111) Ф=3,85 эВ, для (100) ф = 3,95 эВ. [c.234]
Свойства простого вещества и соединений. В свободном виде галлий обладает металлическими признаками серебристо-белый цвет, высокая плотность (5,96 г/см ), хорошая ковкость (по твердости напоминает свинец), значительная электропроводность. Но температурой плавления он резко выделяется среди металлов — соседей по периоду и подгруппе. Его температура плавления 29,8 С, и он имеет самый большой интервал температур, при которых является жидкостью от 29,8 » С до /кип = 2247° С. Склонность к переохлаждению позволяет использовать галлий как жидкость в термометрах для измерения высоких температур. Аномально низкая температура плавления объясняется тем, что в конденсированном (твердом или жидком) состоянии кристаллическая решетка галлия образована молекулами Саг с межатомным расстоянием 2,48А. Атомы в молекуле Саг прочно связаны химическими связями, но молекулы между собой связаны только слабыми ван-дер-ваальсо-вымн силами, поэтому разорвать эти связи очень легко. У всех металлов в узлах кристаллической решетки расположены ионы металлов, а в решетке галлия находятся ионизированные молекулы Саг+. Ионизация молекулы доказывает, что связь между атомами в значительной мере ионная. Таким образом, галлий очень редкий для простых веществ пример кристаллической решетки, где существуют одновременно как металлическая, так и молекулярная структуры. Металлическая структура решетки галлия подтверждается его достаточно высокой электропроводностью. [c.318]
Но температурой плавления он резко выделяется среди металлов — соседей по периоду и подгруппе. Его температура плавления 29,8 С, и он имеет самый большой интервал температур, при которых является жидкостью от 29,8 » С до /кип = 2247° С. Склонность к переохлаждению позволяет использовать галлий как жидкость в термометрах для измерения высоких температур. Аномально низкая температура плавления объясняется тем, что в конденсированном (твердом или жидком) состоянии кристаллическая решетка галлия образована молекулами Саг с межатомным расстоянием 2,48А. Атомы в молекуле Саг прочно связаны химическими связями, но молекулы между собой связаны только слабыми ван-дер-ваальсо-вымн силами, поэтому разорвать эти связи очень легко. У всех металлов в узлах кристаллической решетки расположены ионы металлов, а в решетке галлия находятся ионизированные молекулы Саг+. Ионизация молекулы доказывает, что связь между атомами в значительной мере ионная. Таким образом, галлий очень редкий для простых веществ пример кристаллической решетки, где существуют одновременно как металлическая, так и молекулярная структуры. Металлическая структура решетки галлия подтверждается его достаточно высокой электропроводностью. [c.318]
Свойства простых веществ и соединений. Для олова известны две аллотропические формы обычное кристаллическое белое олово (р-модификация), устойчивое выше 13,2° С, и а морфное серое олово (а-модификация), устойчивое ниже 13,2° С. Кристаллическое олово обладает одной особенностью. При сгибании оловянной палочки слышится характерный звук — оловянный крик . Превра-шенке белого олова в серое называется оловянной чумой , так как при соприкосновении с улсе превращенным металлом белое олово резко меняет свои свойства и рассыпается в порошок. При нагревании выше 161° С (лучше при 200°С) оно снова становится хрупким и легко измельчается. Свинец —темно-серый металл со структурой гранецентрированного куба. Серое олово — полупроводник (Д = 0,08 эВ). Изменение типа связи с преимущественно ковалентной (у германия) на металлическую сопровождается повышением пластичности простого вещества и понижением твердости свинец и белое олово легко прокатываются до тонких листов.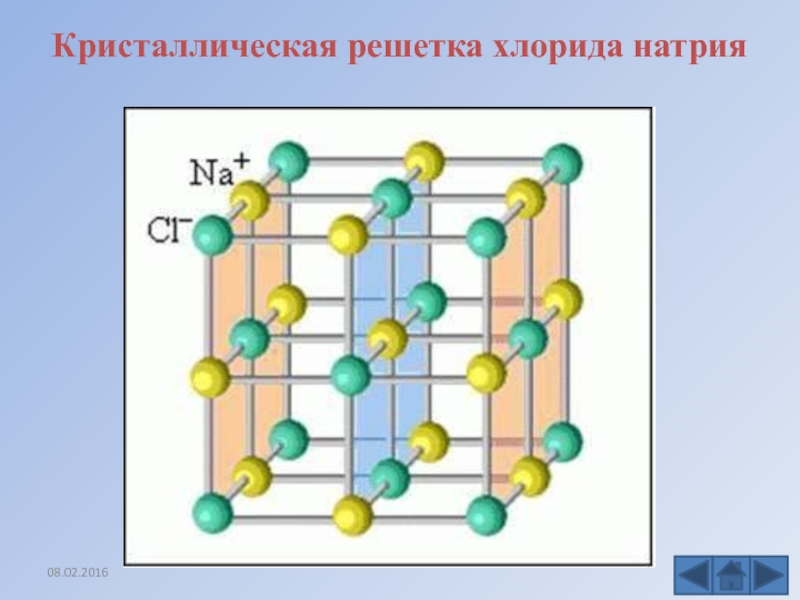 Близость нормального потенциала водорода, свинца и олова объясняет малую скорость взаимодействия этих металлов с разбавленными кислотами (особенно в отсутствие кислорода). Усиление металлических качеств проявляется по отношению к воздуху и воде. Свинец ведет себя в обоих случаях активно и при доступе воздуха медленно взаимодействует даже с водой [c.331]
Близость нормального потенциала водорода, свинца и олова объясняет малую скорость взаимодействия этих металлов с разбавленными кислотами (особенно в отсутствие кислорода). Усиление металлических качеств проявляется по отношению к воздуху и воде. Свинец ведет себя в обоих случаях активно и при доступе воздуха медленно взаимодействует даже с водой [c.331]
(PDF) Нестехиометрическое распределение атомов серы в структуре сульфида свинца
50
ДОКЛАДЫ АКАДЕМИИ НАУК том 428 № 1 2009
САДОВНИКОВ, РЕМПЕЛЬ
Райли [12]. Измерения показали, что сульфид
свинца имеет период
a
= 0.59395 нм при комнат
ной температуре и
a
= 0.59513 нм при 423 K. Из
менение периода решетки при нагреве приводит
к смещению максимума рентгеновских отраже
ний: на рис. 1 (вставка) показано изменение по
ложения рентгеновского отражения (220) пленки
нанокристаллического сульфида свинца при уве
личении температуры до 423 K.
Как видно из рис. 2, после нагрева до 423 K и
охлаждения до 293 K период решетки снизился до
a
= 0.59326 нм, что заметно меньше, чем период
a
= 0.59395 нм исходной пленки. Последующее
(после охлаждения до 293 K) повышение темпе
ратуры до 393 K приводит к увеличению периода
до 0.59492 нм, т.е. на
∆
a
= 1.7 пм. Такое большое
изменение периода решетки PbS при повышении
температуры в указанном интервале обнаружено
впервые. Заметим, что период решетки исходной
нанопленки сульфида свинца, измеренный спу
стя шесть месяцев после исследования, увеличил
ся с 0.59326 до 0.59395 нм (рис. 2), т.е. до значе
ния, равного периоду исходной (после синтеза)
нанокристаллической пленки. Это позволяет
считать, что исходное состояние пленки является
равновесным для температуры 293 K.
Принято считать структуру пленок PbS куби
ческой, но тип структуры однозначно не опреде
лен: известны данные, что пленки PbS могут
иметь структуру
B
1 [13],
B
3 или более сложную
кубическую [7]. В связи с этим следующим эта
В связи с этим следующим эта
пом в определении структуры был количествен
ный анализ измеренных рентгенограмм пленок
PbS с использованием разных моделей кубиче
ской структуры. Были рассмотрены следующие
модели кристаллической структуры нанопленок
PbS: кубическая (пр. гр. ) структура
B
1; ку
бическая (пр. гр. ) структура
B
3; двухфазная
модель пленки, в которой относительное содер
жание фазы со структурой
B
1 равно
y
, а фазы со
структурой
B
3 равно (1 –
y
). Распределение ато
мов свинца и серы для каждой из этих моделей
структуры следующее.
В базисе элементарной ячейки PbS со структу
рой
B
1 (пр. гр. ) находится восемь атомов,
из них четыре атома Pb в позициях 4(
a
) с коорди
натами (000), ( ), ( ), ( ) и четыре
атома серы S в позициях 4(
b
) с координатами
(), (), () и ().
В элементарной ячейке PbS со структурой
B
3
(пр. гр. ) четыре атома свинца занимают
позиции 4(
a
) с теми же координатами, что и в
структуре
B
1. Что касается четырех атомов се
ры, то они занимают позиции 4(
c
) с координа
тами (), (), () и ();
Если пленка двухфазная и относительное со
держание в ней фазы со структурой
B
1 равно
y
, а
фазы со структурой
B
3 равно (1 –
y
), то в такой
двухфазной пленке атомы S с вероятностью, рав
ной
y
, занимают неметаллические позиции струк
туры
B
1 и с вероятностью (1 –
y
) занимают неме
таллические позиции структуры
B
3.
Определение фазового состава, параметров
кристаллической решетки возможных кубиче
ских фаз и окончательное уточнение структуры
пленок PbS, соответствующей разным температу
рам от 293 до 423 K, выполняли с помощью про
граммного пакета X’Pert Plus [11]. Для оценки
Для оценки
справедливости структурных моделей использо
вали фактор достоверности Ритвелда [14]
где
I
exp,
i
и
I
calcd,
i
– экспериментальная и расчетная
интенсивности
i
го отражения соответственно.
Минимизация экспериментальных рентгено
грамм в приближении двухфазной пленки пока
зала
y
= 0.90
±
0.02 и лучшую сходимость (
R
I
(
B
1+
B
3)
=
= 0.04), чем минимизация в приближении того,
что пленка содержит одну фазу со структурой
B
1
или
B
3 (
R
I
(
B
1)
= 0.05 и
R
I
(
B
3)
= 0.12 соответственно).
Вместе с тем из минимизации следует, что перио
ды фаз со структурами
B
1 и
B
3 абсолютно одина
Fm3m
F43m
Fm3m
1
2
1
2
01
2
0 1
2
0 1
2
1
2
1
2
1
2
1
2
0 0 1
2
0 1
2
01
2
0 0
F43m
1
4
1
4
1
4
3
4
3
4
1
4
3
4
1
4
3
4
1
4
3
4
3
4
RIIexp i,Icalcd i,
–/Iexp i, ,
i1=
N
∑
i1=
N
∑
=
Рис. 2.
Влияние температуры на период
a
решетки на
нокристаллической пленки сульфида свинца:
1
– из
менение периода
a
при повышении температуры от
293 до 423 K;
2
– период решетки, измеренный при
293 K после охлаждения пленки и при температуре
контрольного нагрева, равной 393 K;
3
– период ре
шетки, измеренный при 293 K после охлаждения от
температуры контрольного нагрева;
4
– период ре
шетки, измеренный при 293 K спустя шесть месяцев
после проведения отжигов пленки.
Ученые измерили проводимость на атомном уровне
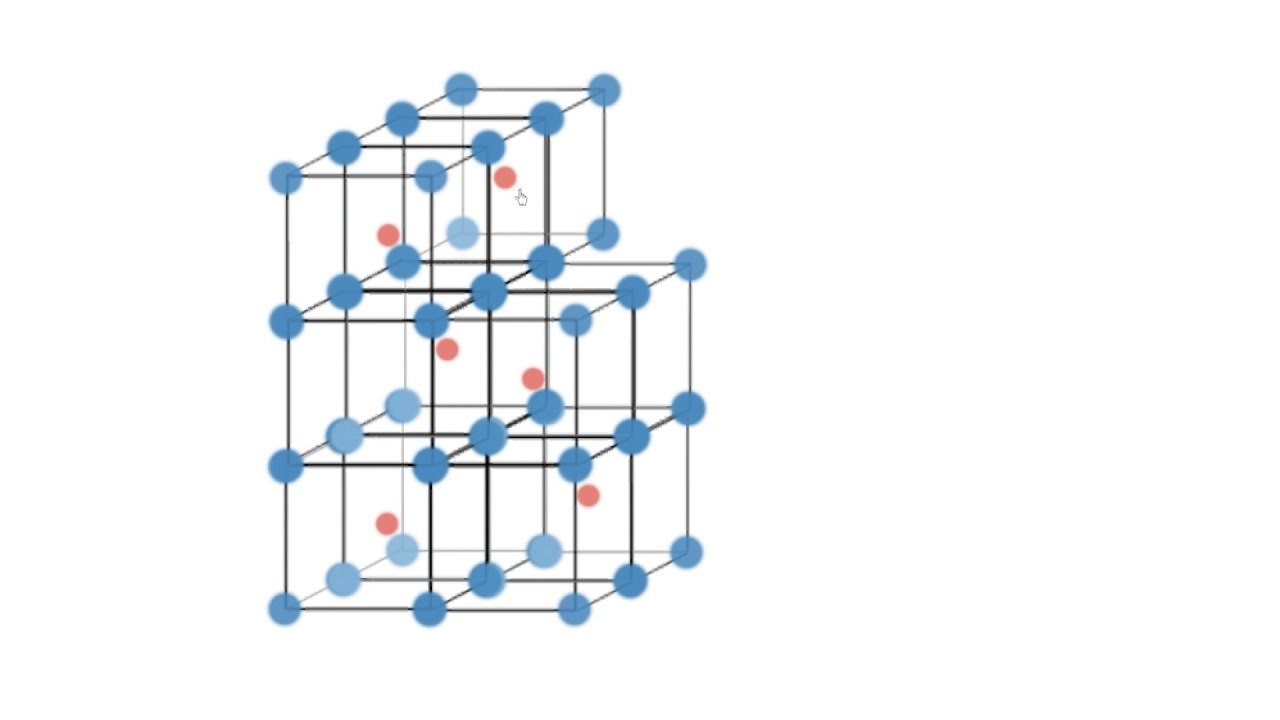
Кристаллическая решетка свинца
Изображение: Wikimedia Commons
Физикам Университета Токио удалось измерить электрическую проводимость в окрестностях одного атома свинца. Авторы впервые обнаружили, что ее характер может значительно меняться в зависимости от высоты измерительного зонда. Краткий ее обзор опубликован в журнале Physics, а препринт самой статьи, вышедшей в журнале Physical Review Letters, доступен на сайте arXiv.org.
Метод сканирующей туннельной микроскопии заключается в сканировании поверхности образца с помощью очень острой иглы. Между иглой и поверхностью экспериментаторы прикладывают напряжение и измеряют ток, наблюдающийся вследствие туннелирования электронов с образца на иглу. С помощью этого метода можно различить отдельные атомы на поверхности образца, а также совершать различные манипуляции ими (отрыв, перемещение), однако для изучения электропроводности на субатомном уровне необходимо чрезвычайно устойчивое оборудование, не допускающее даже малейших колебаний иглы. В противном случае, поверхность очень легко может быть нарушена, что приведет к искажению результатов измерения.
Авторы работы смогли создать такие условия для сканирования поверхности монокристалла свинца свинцовым же зондом. Атомы свинца формируют на атомном масштабе выпуклый периодический рисунок, который можно сравнить с пчелиными сотами. Когда зонд приближается к образцу очень близко, то атом, находящийся на самом его кончике, может оказаться либо напротив вершины поверхностного атома, либо в углублении, образованном тремя атомами. Ученые обнаружили, что в зависимости от высоты зонда над поверхностью значение проводимости в этих ситуациях может сильно меняться.
Ученые обнаружили, что в зависимости от высоты зонда над поверхностью значение проводимости в этих ситуациях может сильно меняться.
Карты проводимости поверхности свинца, полученные при разных высотах зонда (b, c)
Howon Kim and Yukio Hasegawa, arXiv.org, 2015
Когда зонд скользил над поверхностью на относительной высоте Δz = 100 пикометров (1 ангстрем), проводимость увеличивалась над «вершинами» и падала в «углублениях» и экспоненциально зависела от расстояния между зондом и ближайшим атомом. Это соответствует току, вызванному туннелированием электронов. Когда исследователи опустили зонд глубже, вплоть до значений Δz от 0 до -40 пикометров, зависимость приобрела более крутой характер, связанный с тем, что игла начала касаться поверхности. Но дальнейшее снижение высоты до -50 пикометров сильно изменило сам характер зависимости: проводимость над «вершинами» упала по сравнению с проводимостью в «углублениях».
Взаимное расположение поверхностных атомов и головки зонда
Howon Kim and Yukio Hasegawa, arXiv.org, 2015
Ученые связывают это изменение с тем, что при небольшой высоте иглы над образцом в «углублениях» образуются контакты одновременно с тремя атомами, в отличие от «вершин». По словам авторов, их работа доказывает, что в измерениях проводимости с помощью сканирующей туннельной микроскопии важным является даже взаимное расположение атомов.
Сульфид свинца(ii) — Вики
Ви́ки (англ. wiki) — веб-сайт, содержимое которого пользователи могут самостоятельно изменять с помощью инструментов, предоставляемых самим сайтом. Форматирование текста и вставка различных объектов в текст производится с использованием вики-разметки. В частности, на базе этих принципов построена Википедия и другие проекты Фонда Викимедиа[1].
wiki) — веб-сайт, содержимое которого пользователи могут самостоятельно изменять с помощью инструментов, предоставляемых самим сайтом. Форматирование текста и вставка различных объектов в текст производится с использованием вики-разметки. В частности, на базе этих принципов построена Википедия и другие проекты Фонда Викимедиа[1].
История
Впервые термин «вики» для описания веб-сайта был использован в 1995 году Уордом Каннингемом, разработчиком первой вики-системы WikiWikiWeb, «Портлендского хранилища образцов» программного кода[2], созданной 25 марта 1995 года, который заимствовал слово гавайского языка, означающее «быстрый»[3][4]. Каннингем объяснил выбор названия движка тем, что он вспомнил работника международного аэропорта Гонолулу, посоветовавшего ему воспользоваться вики-вики шаттлом — небольшим автобусом, курсировавшим между терминалами аэропорта. Каннингем же планировал сделать движок, позволявший пользователям максимально быстро редактировать и создавать статьи. Каннингем первоначально описал вики как «простейшую онлайн-базу данных, которая может функционировать»[5]. Позже этому слову был придуман английский бэкроним «What I Know Is…» («то, что я знаю, это…»)[6].
Сущность концепции вики
Уорд Каннингем и его соавтор Бо Леуф в их книге The Wiki Way: Quick Collaboration on the Web описали сущность концепции вики следующим образом:
- Вики предлагает всем пользователям редактировать любую страницу или создавать новые страницы на вики-сайте, используя обычный веб-браузер без каких-либо его расширений.
- Вики поддерживает связи между разными страницами за счёт почти интуитивно понятного создания ссылок на другие страницы и отображения того, существуют данные страницы или нет.
- Вики не является тщательно изготовленным сайтом для случайных посетителей. Напротив, Вики стремится привлечь посетителей к непрерывному процессу создания и сотрудничества, который постоянно меняет вид сайта.

Определяющие свойства
Вики характеризуется такими признаками:
- Возможность многократно править текст посредством самой вики-среды (сайта), без применения особых приспособлений на стороне редактора.
- Особый язык разметки — так называемая вики-разметка, которая позволяет легко и быстро размечать в тексте структурные элементы и гиперссылки; форматировать и оформлять отдельные элементы[7].
- Учёт изменений (версий) страниц: возможность сравнения редакций и восстановления ранних.
- Проявление изменений сразу после их внесения.
- Разделение содержимого на именованные страницы.
- Гипертекст: связь страниц и подразделов сайта через контекстные гиперссылки.
- Множество авторов. Некоторые вики могут править все посетители сайта.
Техническая основа
Редактирование вики-текста в «MediaWiki»Для создания вики-среды необходимо особое ПО — движок вики. Это частный вид систем управления сайтом, довольно простой в своём устройстве и функциональности, поскольку почти все действия по структурированию и обработке содержимого делаются пользователями вручную.
Работа Википедии и других сайтов Фонда Викимедиа основана на движке MediaWiki.
Особенности
Язык вики поддерживает гиперссылки для создания ссылок между вики-страницами и является более наглядным, чем HTML, и более безопасным, поскольку использование JavaScript и каскадных таблиц стилей ограничено.
Вандализм
Многие вики позволяют изменять своё содержимое всем желающим, а не только зарегистрированным пользователям. Подобно тому, как стены зданий и заборы исписывают непристойными надписями и украшают рисунками граффити, в таких вики иногда портят содержимое или добавляют что-то неуместное. Но, в отличие от стен и заборов, в вики легко вернуть содержимое к ранней версии: исправлять легче, чем портить. Если же кто-либо настойчиво и намеренно стремится навредить пользователям вики-сайта, можно закрыть ему возможность вносить правки.
См. также
Примечания
Ссылки
- WikiMatrix — сайт-энциклопедия о вики движках, на английском языке.
ЭВОЛЮЦИЯ СТРУКТУРНЫХ И ОПТИЧЕСКИХ СВОЙСТВ ПЛЕНОК PBS ПРИ ЛЕГИРОВАНИИ ЖЕЛЕЗОМ(II)
TY — JOUR
T1 — ЭВОЛЮЦИЯ СТРУКТУРНЫХ И ОПТИЧЕСКИХ СВОЙСТВ ПЛЕНОК PBS ПРИ ЛЕГИРОВАНИИ ЖЕЛЕЗОМ(II)
AU — Ваганова, Ирина Владимировна
AU — Мостовщикова, Е. В.
AU — Воронин, В. И.
AU — Чуфарова, Наталья Александровна
AU — Кутявина, Анастасия Дмитриевна
AU — Маскаева, Лариса Николаевна
PY — 2020
Y1 — 2020
N2 — Гидрохимическим осаждением из аммиачно-цитратной ванны, содержащей от 10–5 до 7 × 10–3 М легирующей примеси FeCl2, получены поликристаллические пленки PbS : Fe. Исследованы их морфология, структурные и оптические свойства. Рост периода кристаллической решетки сульфида свинца, легированного до 5 × 10–3 М включительно, свидетельствует о междоузельном положении ионов Fe2+, а дальнейшее уменьшение периода связано с замещением части ионов свинца в кристаллической решетке PbS на ионы железа меньшего радиуса. В спектрах оптического поглощения пленок PbS : Fe введение ионов железа приводит к появлению примесных полос поглощения. В пленке, полученной из раствора, содержащего 5 × 10–3 М FeCl2, обнаружена перестройка зонной структуры сульфида свинца вблизи края запрещенной зоны. Изменение зонной структуры связано с частичным замещением ионов свинца ионами железа в решетке PbS.
AB — Гидрохимическим осаждением из аммиачно-цитратной ванны, содержащей от 10–5 до 7 × 10–3 М легирующей примеси FeCl2, получены поликристаллические пленки PbS : Fe. Исследованы их морфология, структурные и оптические свойства. Рост периода кристаллической решетки сульфида свинца, легированного до 5 × 10–3 М включительно, свидетельствует о междоузельном положении ионов Fe2+, а дальнейшее уменьшение периода связано с замещением части ионов свинца в кристаллической решетке PbS на ионы железа меньшего радиуса. В спектрах оптического поглощения пленок PbS : Fe введение ионов железа приводит к появлению примесных полос поглощения. В пленке, полученной из раствора, содержащего 5 × 10–3 М FeCl2, обнаружена перестройка зонной структуры сульфида свинца вблизи края запрещенной зоны. Изменение зонной структуры связано с частичным замещением ионов свинца ионами железа в решетке PbS.
В спектрах оптического поглощения пленок PbS : Fe введение ионов железа приводит к появлению примесных полос поглощения. В пленке, полученной из раствора, содержащего 5 × 10–3 М FeCl2, обнаружена перестройка зонной структуры сульфида свинца вблизи края запрещенной зоны. Изменение зонной структуры связано с частичным замещением ионов свинца ионами железа в решетке PbS.
UR — https://www.elibrary.ru/item.asp?id=44137557
U2 — 10.31857/S0044453720120304
DO — 10.31857/S0044453720120304
M3 — Статья
VL — 94
SP — 1783
EP — 1789
JO — Журнал физической химии
JF — Журнал физической химии
SN — 0044-4537
IS — 12
ER —
Ученые СПбПУ сделали первый шаг к созданию безэлектролитных аккумуляторов
Ученым Санкт-Петербургского политехнического университета Петра Великого совместно с французскими, швейцарскими и польскими коллегами в ходе эксперимента удалось зафиксировать неожиданные явления в кристаллической решетке антисегнетоэлектрика цирконата свинца. Данное открытие – это первый шаг к созданию безэлектролитных аккумуляторов.
Статья исследователей «Несоразмерные фазы в функциональных материалах. Критическое рассеяние и несоразмерные фазовые переходы» опубликована в высокорейтинговом международном журнале “Scientific Reports” группы Nature.
В ходе эксперимента ученые стремились понять микроскопическую физику одного из наиболее сложных для теоретического описания антисегнетоэлектриков, модельного объекта данной группы – цирконата свинца. Свойства этого кристалла наиболее репрезентативны в данной группе, и, изучив их, полученные сведения можно расширить на свойства достаточно большого круга материалов. Это необходимо для создания функциональных «умных» материалов (smart materials), то есть материалов с заранее заданными свойствами.
Кристаллы PbZrO3 под воздействием внешних факторов могут иметь два типа упорядочения кристаллической решетки, для которых диполи, вызванные смещениями положительных ионов свинца, выстраиваются параллельно или антипараллельно друг другу. От того, какой тип упорядочения будет выбран, и зависят функциональные свойства материала.
От того, какой тип упорядочения будет выбран, и зависят функциональные свойства материала.
Для анализа возникающих свойств необходимо понимать, как структура материала откликается на изменение внешних параметров, например температуры, давления, поля. В ходе эксперимента научная группа проверяла, как на материал воздействует одновременное изменение температуры и давления. Для анализа кристаллической структуры использовали рассеяние синхротронного излучения на источнике ESRF (European Synchrotron Radiation Facility). Именно синхротронный источник необходим для обеспечения сильного потока фотонов, при помощи которого оказывается возможным изучение не только Брэгговского, но и диффузного рассеяния (рассеяния «между» Брэгговскими отражениями). Именно за счет диффузного рассеяния удалось обнаружить неизвестные процессы, происходящие в структуре кристалла.
Исследователи открыли две новые кристаллические фазы при высоких температурах и давлениях.
Подобные условия приближены к тем, что могут быть созданы в перспективных энергонакопителях (аккумуляторах), запасание и отдача энергии в которых происходит за счет переключения между кристаллическими фазами различной структуры. Такие структурные переключения позволят высвобождать значительные объемы энергии в очень короткие промежутки времени, а отсутствие электролитов имеет очевидные преимущества с точки зрения простоты интеграции и миниатюризации энергозапасающих элементов.
В ходе исследования ученым удалось зафиксировать весьма редко встречающееся явление в кристаллической структуре диэлектриков – образование несоразмерной фазы. Этот объект в науке достаточно сложно описать теоретически. Ученые СПбПУ совместно с коллегами выяснили, что цирконат свинца как раз является таким функциональным материалом, в котором реализуются несоразмерные фазы. «Исходя из макроскопических измерений, у исследователей были подозрения, что существующие теории, описывающие кристаллическую решетку, требуют пересмотра. Возникали противоречия при изменении температуры и давления, в связи с чем мы хотели выяснить, какие процессы происходят на микроуровнях. Так, в ходе эксперимента мы впервые идентифицировали несоразмерную фазу в беспримесном антисегнетоэлектрике», – пояснил Р.Г. Бурковский, доцент кафедры «Физическая электроника» Института физики, нанотехнологий и телекоммуникаций СПбПУ, первый автор статьи.
Возникали противоречия при изменении температуры и давления, в связи с чем мы хотели выяснить, какие процессы происходят на микроуровнях. Так, в ходе эксперимента мы впервые идентифицировали несоразмерную фазу в беспримесном антисегнетоэлектрике», – пояснил Р.Г. Бурковский, доцент кафедры «Физическая электроника» Института физики, нанотехнологий и телекоммуникаций СПбПУ, первый автор статьи.
Теперь перед научным сообществом встает задача построения теоретических моделей, непротиворечиво описывающих энергетические состояния в кристаллической решетке и их реакцию на внешние воздействия. «Мы доказали, что такие состояния в кристаллической решетке существуют, тем самым поставили задачу перед научным сообществом, решив которую, мы сделаем большой шаг в описании функциональных материалов», – уверен Роман Георгиевич.
Материал подготовлен Медиа-центром СПбПУ
Поделиться записью
Ученые пересмотрели главный метод датировки в геологии: Наука и техника: Lenta.ru
Методов радиоизотопного датирования существует совсем немного. Еще меньше этих методов позволяют определять возраст объектов в миллионы и миллиарды лет. Одним из самых популярных является уран-свинцовый метод, который примечателен тем, что в 1953 году Клэр Кэмерон Паттерсон, геолог из Чикагского университета, с его помощью впервые достаточно точно определил возраст Земли. Тем удивительнее стала новость о том, что геологи предложили поправить этот метод — изменение, которое повлечет передатировку большинства крупных геологических событий.
Немного истории
Радиометрические методы, несмотря на существенные различия, базируются на одной достаточно простой идее. Имеется некоторый образец. Нам известно содержание двух изотопов некоторых элементов — одного стабильного и одного не очень. Мы знаем, что стабильный получается из нестабильного в результате распада (или серии распадов) и даже знаем с высокой точностью время, которое занимает этот процесс. В самом первом, «наивном», приближении предполагается, что, начиная с некоторого момента, ядерные процессы внутри образца идут вне зависимости от окружающей среды.
В самом первом, «наивном», приближении предполагается, что, начиная с некоторого момента, ядерные процессы внутри образца идут вне зависимости от окружающей среды.
Закон ядерного распада, открытый Фредериком Содди и Эрнестом Резерфордом, утверждает, что интенсивность распада пропорциональна количеству атомов того или иного элемента. Взяв отношения начального количества атомов данного элемента к оставшимся и прологарифмировав обе части равенства, мы получаем довольно простую формулу, которая задает зависимость времени от количества атомов.
В эту формулу входят три параметра, два из которых определяются довольно точно — это период полураспада элемента и количество атомов (это вычисляется преимущественно спектрометрией). Третий же параметр — количество изотопа на момент консервации образца — необходимо определить независимыми методами. Например, при радиоуглеродном датировании органики (там, кстати, момент консервации — это момент смерти организма) для определения первоначального количества углерода 14C используют, среди прочего, дендрохронологическую шкалу, то есть определяют содержание этого вещества в атмосфере по образцам древесины известного возраста.
Метод уран-свинцового датирования, начавший активно развиваться в конце 50-х годов прошлого века, является одним из самых авторитетных на настоящий момент. Его используют преимущественно для датировки пород. В качестве образцов выступают кристаллы циркона — минерала ZrSiO4. Основой этого метода служит превращение урана после серии альфа- и бета-распадов в свинец.
У этого метода есть несколько очень важных плюсов по сравнению с конкурентами. Во-первых, на момент образования минерала он с большой вероятностью не содержал свинца вообще — это связано с тем, что уран встраивается в кристаллическую решетку минерала, замещая атомы циркония, а свинец для этого не подходит. Это означает, что снимается вопрос определения, какие из атомов свинца образовались в результате распада урана, а какие были в образце изначально. Ничего подобного, например, для радиоуглеродного метода нет.
Ничего подобного, например, для радиоуглеродного метода нет.
Вторым важным плюсом является наличие сразу двух радиоизотопных «часов» внутри образцов, связанных с ураном-238 и ураном-235. Эти элементы превращаются в разные изотопы свинца — 207 и 206 соответственно. Это является преимуществом вот почему: как уже говорилось выше, в теории, образец взаимодействовать с окружающей средой не должен. В действительности, однако, он взаимодействует и, как следствие, изотопы, получающиеся в результате распада, могут покидать образцы. Подобные утечки сказываются на часах по-разному, поэтому сравнение полученных датировок позволяет найти эти ошибки и достаточно часто устранить их — фактически, эти два процесса корректируют друг друга.
Метод уран-свинцового датирования используется очень широко. Например, с его помощью в 1953 году геолог из Чикагского университета Клэр Кэмерон Паттерсон сумел вычислить возраст Земли — он оказался равным 4,55 миллиарда лет. Примечательно, что со времени появления этой цифры прошло почти 60 лет, а единственное, что изменилось — геологи снизили погрешность в измерении с 70 до 20 миллионов лет. Это стало одним из ключевых достижений науки XX века.
Из последних достижений можно отметить статью, опубликованную в Science в ноябре 2011 года. Тогда международная группа ученых смогла построить наиболее полную датировку массового пермского вымирания — катастрофического события в истории планеты, когда погибло более 90 процентов видов живых организмов. В работе исследователи установили, что вымирание произошло 252,28 миллиона лет назад. Все погибшие виды вымирали одновременно в море и на суше, причем весь процесс занял около 200 тысяч лет (а мог, по словам ученых, уложиться и в 100 тысяч). Как следствие, ученые заключили, что причиной вымирания были так называемые сибирские траппы. Они возникают в результате особого вида магматизма и приводят к излиянию большого количества магмы на поверхность через трещины в земной коре без образования вулканов.
Новые результаты
Что же сделали ученые из США и Великобритании под руководством Джона Хайса в новой работе, опубликованной в Science? Они обратили внимание на то, что при сравнении работы двух изотопных часов внутри образца геологи используют соотношение изотопов урана 238U и 235U, которое считается постоянным и равным 137,88. При этом оказалось, что систематических исследований на эту тему не проводилось, а само число является результатом консенсуса между разными группами геологов.
В рамках работы ученые проанализировали содержание изотопов урана в 58 образцах циркона, собранных в разных регионах планеты. В результате они установили, что оно не является постоянным и лежит в пределах от 137,743 до 138,490. Как следствие, исследователи предлагают пересмотреть фундаментальное соотношение в пользу его небольшого уменьшения — они предлагают принять его равным 137,818 с погрешностью 0,045.
Новое предложение было принято многими специалистами положительно. Например, геохронолог из Калифорнийского университета Джеймс Мэттинсон заявил Nature News: «Люди, работающие в этой области, найдут много интересного в новой работе». Он также добавил, что результаты исследователей будут полезны для калибровки результатов различных измерений.
Сами ученые говорят, что из-за вносимой поправки возраст отдельных образцов может измениться на сотни тысяч, а иногда и миллионы лет. Это, в теории, приведет к пересмотру деталей существующей ныне геохронологической шкалы событий. Единственное, о чем ученые говорят с уверенностью — возраст Земли пересмотрен не будет. Это связано с тем, что данные по нему были подтверждены независимыми исследованиями.
Примечательно, что одновременно с работой Хайса появились данные о том, что другой радиометрический метод может потребовать пересмотра. Майкл Пол из Еврейского университета в Иерусалиме выяснил, что период полураспада самария-146, используемого в датировке по самарию-неодиму, может оказаться на 30 процентов короче, чем считалось до сих пор — «всего» 68 миллионов лет.
Все эти результаты показывают, что многие фундаментальные результаты в геологии могут потребовать пересмотра. Не кардинального, но все-таки довольно ощутимого. Это, в свою очередь, принесет науке множество новых результатов.
Разница между хрусталем и стеклом
Ключевое отличие: Стекло — это общее название, а хрусталь — это подкатегория стекла, изготовленная таким же образом, как и стекло, но из других материалов. Следовательно, весь кристалл — это стекло, но не все стекло — кристалл. Европейский Союз в 1969 году установил три основных критерия для кристаллов: содержание свинца более 24%, плотность более 2,90 и показатель отражения 1,545.
С научной точки зрения кристаллы — это чистые вещества, атомы, молекулы или ионы которых расположены в упорядоченном порядке, где они простираются во всех трех пространственных измерениях.Кристаллы чаще всего встречаются в природе на Земле, хотя процесс образования кристаллов с помощью механизмов роста кристаллов называется кристаллизацией или затвердеванием.
Хотя в том же контексте, что и стекло, кристалл относится к стеклу колодца. Термин кристалл часто используется для обозначения стеклянной посуды, которая имеет более элегантную форму, чем обычная или повседневная стеклянная посуда. Однако это не официальная разница между ними. На самом деле не существует официального определения кристалла с чистой огранкой.Тем не менее, действует общее правило: кристалл — это стекло, содержащее свинец.
По словам Джона Кеннеди, руководителя технической службы компании Waterford в Уотерфорде, Ирландия, существуют очень конкретные рекомендации относительно того, что представляет собой настоящий кристалл. Европейский Союз в 1969 году установил три основных критерия для кристаллов: содержание свинца более 24%, плотность более 2,90 и показатель отражения 1,545. Однако за пределами Европейского Союза это определение обычно не принимается во внимание.В Соединенных Штатах любое стекло с содержанием свинца более 1% называется кристаллом.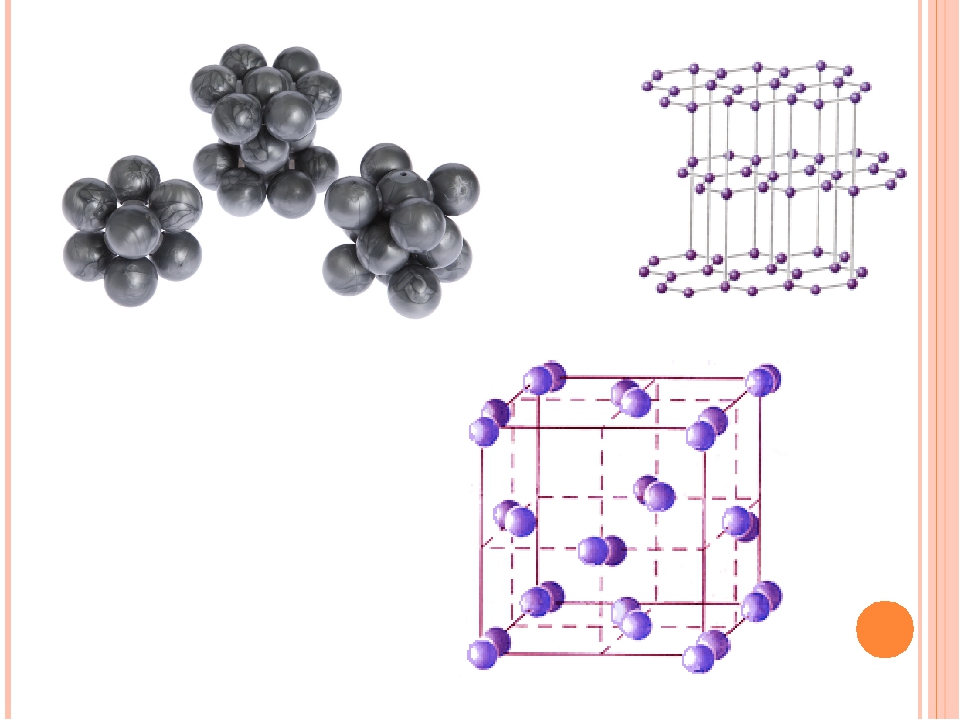
С технической точки зрения применение термина «кристалл» к стеклу само по себе неточно, поскольку стекло является аморфным твердым телом. Следовательно, по определению у него отсутствует кристаллическая структура, необходимая для кристалла. Тем не менее, этот термин, хотя и был ошибочно применен к стеклу, сохранился и остается популярным.
Стеклянная посуда может быть изготовлена из различных материалов: кремнезема, кальцинированной соды, натронной извести, поташа, цинка, свинца, бария и, в последнее время, титана.Технически, только продукты, содержащие не менее 24% свинца, следует называть «кристаллами свинца», в то время как продукты с меньшим содержанием оксида свинца или изделия из стекла с оксидами других металлов вместо оксида свинца следует называть «кристаллином» или «хрустальным стеклом». «. Тем не менее, их все часто называют кристаллами.
Цвет и блеск стекла часто меняются в зависимости от его содержимого. Стекло, изготовленное из железа, имеет зеленый оттенок, в то время как стекло, изготовленное из натронной извести, будет иметь морской оттенок.Хотя некоторые находят эти оттенки непривлекательными, очки с зеленоватым оттенком, как правило, намного сильнее. Кристаллы обычно светлые и в основном полупрозрачные. Некоторые прозрачные кристаллы обладают способностью отражать свет в разные цвета. При удерживании в правильном положении преломление и рассеивание света от кристалла создадут радугу оттенков.
Стекло также имеет тенденцию быть прочнее хрусталя, поэтому хрустальная посуда часто используется только для особых случаев, в то время как обычная стеклянная посуда используется в повседневной жизни.Использование свинца в кристалле сделало стекло мягким и податливым, что позволило создавать более детализированные узоры и узоры, чем обычное стекло.
Кроме того, из-за высокого содержания свинца хрусталь звенит при очень осторожном постукивании и тяжелее обычной стеклянной посуды. В зависимости от структуры и редкости кристаллов цены на кристаллы могут варьироваться, иногда очень сильно.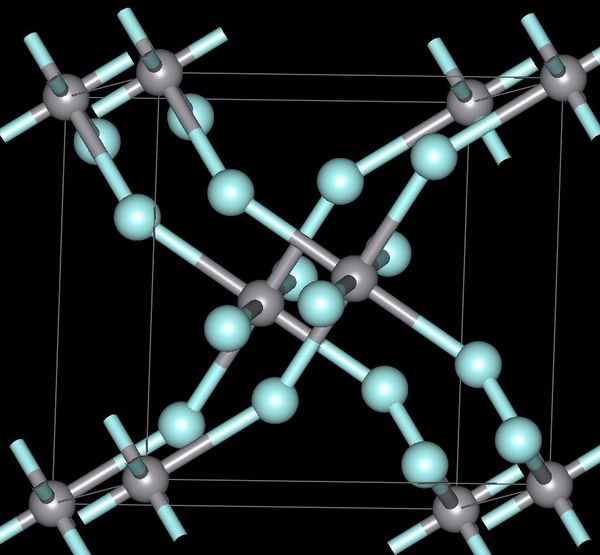
Итак, вкратце, стекло — это общее название, а хрусталь — это подкатегория стекла, изготовленная таким же образом, как стекло, но из других материалов.Следовательно, весь кристалл — это стекло, но не все стекло — кристалл.
кристалл | Определение, типы, структура и факты
Классификация
Определение твердого тела кажется очевидным; твердое тело обычно считается твердым и твердым. Однако при осмотре определение становится менее однозначным. Например, кубик масла становится твердым после хранения в холодильнике и явно твердый. После того, как этот кубик оставался на кухонном столе в течение дня, он становится довольно мягким, и неясно, следует ли считать масло твердым.Многие кристаллы ведут себя как масло в том смысле, что они твердые при низких температурах, но мягкие при более высоких. Их называют твердыми веществами при всех температурах ниже их точки плавления. Возможное определение твердого тела — это объект, который сохраняет свою форму, если его не трогать. Актуальный вопрос заключается в том, как долго объект сохраняет свою форму. Высоковязкая жидкость сохраняет форму в течение часа, но не года. Твердое тело должно дольше сохранять свою форму.
Основные единицы твердых тел
Основные единицы твердых тел — это атомы или атомы, которые объединились в молекулы.Электроны атома движутся по орбитам, которые образуют оболочку вокруг ядра. Оболочки заполняются в систематическом порядке, причем каждая оболочка вмещает только небольшое количество электронов. У разных атомов разное количество электронов, которые распределены в характерной электронной структуре заполненных и частично заполненных оболочек. Расположение электронов в атоме определяет его химические свойства. Свойства твердых тел обычно можно предсказать, исходя из свойств составляющих их атомов и молекул, и поэтому различные оболочечные структуры атомов ответственны за разнообразие твердых тел.
Все заполненные оболочки атома аргона (Ar), например, заполнены, что приводит к сферической форме атома. В твердом аргоне атомы расположены в соответствии с плотнейшей упаковкой этих сфер. Атом железа (Fe), напротив, имеет одну электронную оболочку, которая заполнена только частично, что придает атому чистый магнитный момент. Таким образом, кристаллическое железо — это магнит. Ковалентная связь между двумя атомами углерода (C) — самая прочная связь в природе. Эта прочная связь делает алмаз самым твердым.
В твердом аргоне атомы расположены в соответствии с плотнейшей упаковкой этих сфер. Атом железа (Fe), напротив, имеет одну электронную оболочку, которая заполнена только частично, что придает атому чистый магнитный момент. Таким образом, кристаллическое железо — это магнит. Ковалентная связь между двумя атомами углерода (C) — самая прочная связь в природе. Эта прочная связь делает алмаз самым твердым.
Твердое тело является кристаллическим, если оно имеет дальний порядок. Как только положение атома и его соседей известно в одной точке, положение каждого атома известно точно во всем кристалле. В большинстве жидкостей отсутствует дальний порядок, хотя во многих есть ближний порядок. Ближний радиус действия определяется как первые или вторые ближайшие соседи атома. Во многих жидкостях атомы первых соседей расположены в той же структуре, что и в соответствующей твердой фазе.Однако на расстояниях, которые находятся на расстоянии многих атомов, положения атомов становятся некоррелированными. Эти жидкости, такие как вода, имеют ближний порядок, но не имеют дальнего порядка. Некоторые жидкости могут иметь ближний порядок в одном направлении и дальний порядок в другом; эти особые вещества называются жидкими кристаллами. Твердые кристаллы имеют как ближний, так и дальний порядок.
Твердые тела, которые имеют ближний порядок, но не имеют дальнего порядка, называются аморфными. Практически любой материал можно сделать аморфным путем быстрого затвердевания из расплава (расплавленное состояние).Это состояние нестабильно, и твердое вещество со временем кристаллизуется. Если временной шкалой кристаллизации являются годы, то аморфное состояние кажется стабильным. Стекла — это пример аморфного твердого тела. В кристаллическом кремнии (Si) каждый атом тетраэдрически связан с четырьмя соседями. В аморфном кремнии (a-Si) такой же ближний порядок существует, но направления связей меняются на расстояниях дальше от любого атома. Аморфный кремний — это разновидность стекла. Квазикристаллы — это еще один тип твердых тел, в которых отсутствует дальний порядок.
Аморфный кремний — это разновидность стекла. Квазикристаллы — это еще один тип твердых тел, в которых отсутствует дальний порядок.
Большинство твердых материалов, встречающихся в природе, существуют в поликристаллической форме, а не в виде монокристалла. На самом деле они состоят из миллионов зерен (мелких кристаллов), упакованных вместе, чтобы заполнить все пространство. Каждое отдельное зерно имеет другую ориентацию, чем его соседи. Хотя дальний порядок существует внутри одного зерна, на границе между зернами он меняет направление. Типичный кусок железа или меди (Cu) поликристаллический. Монокристаллы металлов мягкие и податливые, а поликристаллические металлы тверже и прочнее и более полезны в промышленности.Большинство поликристаллических материалов можно превратить в крупные монокристаллы после продолжительной термообработки. Раньше кузнецы нагревали кусок металла, чтобы сделать его пластичным: тепло заставляет несколько крупинок увеличиваться в размерах за счет включения более мелких. Кузнецы сгибали размягченный металл, придавая ему форму, а затем некоторое время колотили по нему; удары сделают его снова поликристаллическим, увеличивая его прочность.
Категории кристаллов
Кристаллы классифицируются по общим категориям, таким как изоляторы, металлы, полупроводники и молекулярные твердые тела.Монокристалл изолятора обычно прозрачен и напоминает кусок стекла. Металлы блестят, если только они не заржавели. Полупроводники иногда блестят, а иногда прозрачны, но никогда не ржавеют. Многие кристаллы можно отнести к одному типу твердых тел, тогда как другие имеют промежуточное поведение. Сульфид кадмия (CdS) может быть получен в чистом виде и является отличным изолятором; когда в сульфид кадмия добавляются примеси, он становится интересным полупроводником. Висмут (Bi) кажется металлом, но количество электронов, доступных для электропроводности, аналогично количеству полупроводников.На самом деле висмут называют полуметаллом. Молекулярные твердые вещества обычно представляют собой кристаллы, образованные из молекул или полимеров. Они могут быть изолирующими, полупроводниковыми или металлическими, в зависимости от типа молекул в кристалле. Постоянно синтезируются новые молекулы, и многие из них превращаются в кристаллы. Количество разных кристаллов огромно.
Они могут быть изолирующими, полупроводниковыми или металлическими, в зависимости от типа молекул в кристалле. Постоянно синтезируются новые молекулы, и многие из них превращаются в кристаллы. Количество разных кристаллов огромно.
Структуры решеток в кристаллических твердых телах
Результаты обучения
- Опишите расположение атомов и ионов в кристаллических структурах
- Вычислить ионные радиусы, используя размеры элементарной ячейки
- Объяснить использование измерений дифракции рентгеновских лучей для определения кристаллических структур
Более 90% твердых веществ природного и антропогенного происхождения являются кристаллическими.Большинство твердых веществ образуются с регулярным расположением своих частиц, потому что общее притягивающее взаимодействие между частицами максимизируется, а общая межмолекулярная энергия сводится к минимуму, когда частицы упаковываются наиболее эффективным образом. Регулярное расположение на атомном уровне часто отражается на макроскопическом уровне. В этом модуле мы исследуем некоторые детали структур металлических и ионных кристаллических твердых тел и узнаем, как эти структуры определяются экспериментально.
Структуры металлов
Мы начнем обсуждение кристаллических твердых тел с рассмотрения элементарных металлов, которые относительно просты, поскольку каждый содержит только один тип атомов. Чистый металл — это кристаллическое твердое тело, атомы которого плотно упакованы в повторяющийся узор. Некоторые свойства металлов в целом, такие как их пластичность и пластичность, во многом обусловлены наличием одинаковых атомов, расположенных в правильном порядке. Различные свойства одного металла по сравнению с другим частично зависят от размеров их атомов и особенностей их пространственного расположения.В следующих разделах мы исследуем сходства и различия четырех наиболее распространенных геометрических форм металлических кристаллов.
Элементарные ячейки металлов
Структуру кристаллического твердого вещества, будь то металл или нет, лучше всего описать, рассматривая его простейшую повторяющуюся единицу, которая упоминается как ее элементарная ячейка . Элементарная ячейка состоит из узлов решетки, которые представляют расположение атомов или ионов. Вся структура состоит из этой элементарной ячейки, повторяющейся в трех измерениях, как показано на рисунке 1.
Элементарная ячейка состоит из узлов решетки, которые представляют расположение атомов или ионов. Вся структура состоит из этой элементарной ячейки, повторяющейся в трех измерениях, как показано на рисунке 1.
Рис. 1. Элементарная ячейка показывает расположение точек решетки, повторяющихся во всех направлениях.
Давайте начнем наше исследование структуры кристаллической решетки и элементарных ячеек с самой простой структуры и самой простой элементарной ячейки. Чтобы визуализировать это, представьте, что вы берете большое количество одинаковых сфер, таких как теннисные мячи, и равномерно размещаете их в контейнере. Самый простой способ сделать это — создать слои, в которых сферы в одном слое находятся прямо над сферами в слое ниже, как показано на рисунке 2.Такое расположение называется простой кубической структурой , а элементарная ячейка называется простой кубической элементарной ячейкой или примитивной кубической элементарной ячейкой.
Рис. 2. Когда атомы металла расположены сферами в одном слое непосредственно над или под сферами в другом слое, структура решетки называется простой кубической. Обратите внимание, что сферы соприкасаются.
В простой кубической структуре сферы не упакованы так плотно, как могли бы, и они «заполняют» только около 52% объема контейнера.Это относительно неэффективное устройство, и только один металл (полоний, Po) кристаллизуется в простой кубической структуре. Как показано на рисунке 3, твердое тело с таким расположением состоит из плоскостей (или слоев), в которых каждый атом контактирует только с четырьмя ближайшими соседями в своем слое; один атом прямо над ним в верхнем слое; и один атом прямо под ним в слое ниже. Число других частиц, с которыми контактирует каждая частица в кристаллическом твердом теле, известно как его координационное число .Следовательно, для атома полония в простом кубическом массиве координационное число равно шести.
Рис. 3. Атом в структуре простой кубической решетки контактирует с шестью другими атомами, поэтому его координационное число равно шести.
3. Атом в структуре простой кубической решетки контактирует с шестью другими атомами, поэтому его координационное число равно шести.
В простой кубической решетке элементарная ячейка, повторяющаяся во всех направлениях, представляет собой куб, определяемый центрами восьми атомов, как показано на рисунке 4. Атомы в соседних углах этой элементарной ячейки контактируют друг с другом, поэтому длина ребра этой ячейки ячейка равна двум атомным радиусам или одному атомному диаметру.Кубическая элементарная ячейка содержит только те части этих атомов, которые находятся в ней. Поскольку атом в углу простой кубической элементарной ячейки состоит в общей сложности из восьми элементарных ячеек, только одна восьмая этого атома находится в конкретной элементарной ячейке. А поскольку каждая простая кубическая элементарная ячейка имеет по одному атому в каждом из восьми «углов», в одной простой кубической элементарной ячейке находится [латекс] 8 \ times \ frac {1} {8} = 1 [/ latex] атом.
Рис. 4. Элементарная ячейка простой кубической решетки содержит по одной восьмой атома в каждом из восьми углов, так что всего она содержит один атом.
Пример 1:
Расчет атомного радиуса и плотности металлов, часть 1Длина ребра элементарной ячейки альфа-полония составляет 336 мкм.
- Определите радиус атома полония.
- Определите плотность альфа-полония.
Альфа-полоний кристаллизуется в простой кубической элементарной ячейке:
- Два соседних атома По контактируют друг с другом, поэтому длина края этой ячейки равна двум атомным радиусам По: [латекс] l = 2r [/ латекс].Следовательно, радиус Po равен [latex] r = \ dfrac {\ text {l}} {2} = \ dfrac {\ text {336 pm}} {2} = \ text {168 pm} [/ latex].
- Плотность задается как [латекс] \ text {density} = \ dfrac {\ text {mass}} {\ text {volume}} [/ latex]. Плотность полония можно определить, определив плотность его элементарной ячейки (масса, содержащаяся в элементарной ячейке, деленная на объем элементарной ячейки).
 Поскольку элементарная ячейка По содержит одну восьмую атома По в каждом из восьми углов, элементарная ячейка содержит один атом По.
Поскольку элементарная ячейка По содержит одну восьмую атома По в каждом из восьми углов, элементарная ячейка содержит один атом По.
Массу элементарной ячейки По можно найти по формуле:
[латекс] \ text {1 элементарная ячейка Po} \ times \ dfrac {\ text {1 атом Po}} {\ text {1 элементарная ячейка Po}} \ times \ dfrac {\ text {1 моль Po}} {6 .{3} [/ латекс]
Поскольку фактическая плотность Ni не близка к этой, Ni не образует простой кубической структуры.
Большинство металлических кристаллов являются одним из четырех основных типов элементарных ячеек. А пока мы сосредоточимся на трех кубических элементарных ячейках: простой кубической (которые мы уже видели), объемноцентрированной кубической элементарной ячейке и гранецентрированной кубической элементарной ячейке , все из которых показаны на рисунке 5. (Обратите внимание, что на самом деле существует семь различных систем решеток, некоторые из которых имеют более одного типа решетки, всего 14 различных типов элементарных ячеек.Мы оставляем более сложные геометрические формы на потом в этом модуле.)
Рис. 5. Кубические элементарные ячейки металлов показывают (на верхних рисунках) расположение узлов решетки и (на нижних рисунках) атомов металлов, расположенных в элементарной ячейке.
Некоторые металлы кристаллизуются в структуре, которая имеет кубическую элементарную ячейку с атомами во всех углах и атомом в центре, как показано на рисунке 6. Это называется объемно-центрированным кубическим (ОЦК) твердым телом . Атомы в углах элементарной ячейки ОЦК не контактируют друг с другом, а контактируют с атомом в центре.Элементарная ячейка BCC содержит два атома: по одной восьмой атома в каждом из восьми углов ([latex] 8 \ times \ frac {1} {8} = 1 [/ latex] атом от углов) плюс один атом от центр. Любой атом в этой структуре касается четырех атомов в слое над ним и четырех атомов в слое под ним. Таким образом, атом в структуре ОЦК имеет координационное число восемь.
Рис. 6. В объемно-центрированной кубической структуре атомы в определенном слое не касаются друг друга. Каждый атом касается четырех атомов в слое выше и четырех атомов в слое ниже.
Атомы в структурах BCC упакованы намного эффективнее, чем в простой кубической структуре, занимая около 68% от общего объема. Изоморфные металлы со структурой BCC включают K, Ba, Cr, Mo, W и Fe при комнатной температуре. (Элементы или соединения, которые кристаллизуются с одинаковой структурой, считаются изоморфными .)
Многие другие металлы, такие как алюминий, медь и свинец, кристаллизуются в структуре, которая имеет кубическую элементарную ячейку с атомами во всех углах и в центре каждой грани, как показано на рисунке 7.Такое расположение называется гранецентрированным кубическим (FCC) твердым телом . Элементарная ячейка FCC содержит четыре атома: по одной восьмой атома в каждом из восьми углов ([латекс] 8 \ times \ frac {1} {8} = 1 [/ latex] атом от углов) и половина атома на каждой из шести граней ([латекс] 6 \ times \ frac {1} {2} = 3 [/ латекс] атома от граней). Атомы в углах касаются атомов в центрах соседних граней по диагоналям граней куба. Поскольку атомы находятся в идентичных узлах решетки, они имеют идентичное окружение.
Рис. 7. Гранецентрированное кубическое твердое тело имеет атомы в углах и, как следует из названия, в центрах граней его элементарных ячеек.
Атомы в системе ГЦК упакованы как можно ближе друг к другу, причем атомы занимают 74% объема. Эта структура также называется кубической плотнейшей упаковки (CCP) . В CCP есть три повторяющихся слоя гексагонально расположенных атомов. Каждый атом контактирует с шестью атомами в своем собственном слое, с тремя в слое выше и с тремя в слое ниже.В этом расположении каждый атом касается 12 ближайших соседей и, следовательно, имеет координационное число 12. Тот факт, что устройства FCC и CCP эквивалентны, может быть не сразу очевиден, но почему они на самом деле являются одной и той же структурой, показано на рисунке 8.
Рис. 8. Схема CCP состоит из трех повторяющихся слоев (ABCABC…) гексагонально расположенных атомов. Атомы в структуре CCP имеют координационное число 12, потому что они контактируют с шестью атомами в своем слое, плюс три атома в слое выше и три атома в слое ниже.Поворачивая перспективу, мы видим, что структура CCP имеет элементарную ячейку с гранью, содержащей атом из слоя A в одном углу, атомы из слоя B по диагонали (в двух углах и в середине лица) и атом из слоя C в оставшемся углу. Это то же самое, что и гранецентрированное кубическое расположение.
Поскольку более тесная упаковка максимизирует общее притяжение между атомами и минимизирует общую межмолекулярную энергию, атомы в большинстве металлов упаковываются таким образом.Мы находим два типа плотнейшей упаковки в простых металлических кристаллических структурах: CCP, с которой мы уже сталкивались, и гексагональной плотнейшей упаковки (HCP) , показанной на рисунке 9. Оба типа состоят из повторяющихся слоев гексагонально расположенных атомов. В обоих типах второй слой (B) помещается на первый слой (A), так что каждый атом во втором слое контактирует с тремя атомами в первом слое. Третий слой размещается одним из двух способов. В HCP атомы в третьем слое находятся непосредственно над атомами в первом слое (т.е.е., третий слой также относится к типу A), и стопка состоит из чередующихся плотно упакованных слоев типа A и типа B (то есть ABABAB). В CCP атомы в третьем слое не находятся над атомами в любом из первых двух слоев (т. Е. Третий слой относится к типу C), а наложение состоит из чередующихся плотноупакованных слоев типа A, типа B и типа C ( т.е. ABCABCABC ⋯). Около двух третей всех металлов кристаллизуются в плотноупакованных массивах с координационным числом 12. Металлы, которые кристаллизуются в структуре HCP, включают Cd, Co, Li, Mg, Na и Zn, а металлы, которые кристаллизуются в структуре CCP, включают Ag , Al, Ca, Cu, Ni, Pb и Pt.
Рис. 9. В обоих типах плотнейшей упаковки атомы упакованы максимально компактно. Гексагональная плотнейшая упаковка состоит из двух чередующихся слоев (ABABAB…). Плотнейшая кубическая упаковка состоит из трех чередующихся слоев (ABCABCABC…).
Гексагональная плотнейшая упаковка состоит из двух чередующихся слоев (ABABAB…). Плотнейшая кубическая упаковка состоит из трех чередующихся слоев (ABCABCABC…).
Пример 2:
Расчет атомного радиуса и плотности металлов, часть 2Кальций кристаллизуется в гранецентрированной кубической структуре. Длина ребра его элементарной ячейки составляет 558,8 мкм.
- Каков атомный радиус Ca в этой структуре?
- Рассчитайте плотность Ca.{2}} {16}} = \ text {197,6 pmg для радиуса Ca} [/ latex].
Часть 2
Плотность задается как [латекс] \ text {density} = \ dfrac {\ text {mass}} {\ text {volume}} [/ latex]. Плотность кальция можно определить, определив плотность его элементарной ячейки: например, массу, содержащуюся в элементарной ячейке, деленную на объем элементарной ячейки. Гранецентрированная элементарная ячейка Ca имеет одну восьмую атома в каждом из восьми углов [латекс] \ left (8 \ times \ dfrac {1} {8} = 1 \ text {atom} \ right) [/ latex ] и по половине атома на каждой из шести граней [латекс] \ left (6 \ times \ dfrac {1} {2} = 3 \ text {atom} \ right) [/ latex], всего четыре атома в элементарной ячейке.{3} [/ латекс]
Проверьте свои знанияСеребро кристаллизуется в структуре FCC. Длина ребра его элементарной ячейки 409 мкм.
- Каков атомный радиус Ag в этой структуре?
- Рассчитайте плотность Ag.
В общем, элементарная ячейка определяется длиной трех осей ( a , b и c ) и углами (α, β и γ) между ними, как показано на рисунке 10.. оси определяются как длины между точками пространственной решетки.Следовательно, оси элементарной ячейки соединяют точки с идентичной средой.
Рис. 10. Элементарная ячейка определяется длиной трех ее осей (a, b и c) и углами (α, β и γ) между осями.
Существует семь различных систем решеток, некоторые из которых имеют более одного типа решетки, всего четырнадцать различных элементарных ячеек, которые имеют форму, показанную на рисунке 11.

Рис. 11. Существует семь различных систем решеток и 14 различных элементарных ячеек.
Структура ионных кристаллов
Ионные кристаллы состоят из двух или более различных типов ионов, которые обычно имеют разные размеры. Упаковка этих ионов в кристаллическую структуру более сложна, чем упаковка атомов металла того же размера.
Большинство одноатомных ионов ведут себя как заряженные сферы, и их притяжение для ионов противоположного заряда одинаково во всех направлениях. Следовательно, стабильные структуры для ионных соединений возникают (1), когда ионы одного заряда окружены как можно большим количеством ионов противоположного заряда, и (2) когда катионы и анионы контактируют друг с другом.Структуры определяются двумя основными факторами: относительными размерами ионов и соотношением количества положительных и отрицательных ионов в соединении.
Рис. 12. Катионы могут занимать два типа дырок между анионами: октаэдрические дырки или тетраэдрические дырки.
В простых ионных структурах мы обычно находим анионы, которые обычно больше, чем катионы, расположенные в виде плотноупакованного массива. (Как было замечено ранее, дополнительные электроны, притянутые к одному и тому же ядру, делают анионы больше, а меньшее количество электронов, притягиваемых к тому же ядру, делает катионы меньше по сравнению с атомами, из которых они образованы.Катионы меньшего размера обычно занимают один из двух типов: дырок (или пустот), оставшихся между анионами. Меньшее из отверстий находится между тремя анионами в одной плоскости и одним анионом в соседней плоскости. Четыре аниона, окружающие это отверстие, расположены по углам тетраэдра, поэтому отверстие называется тетраэдрическим отверстием . Дыра большего размера находится в центре шести анионов (три в одном слое и три в соседнем слое), расположенных в углах октаэдра; это называется октаэдрическим отверстием .На рисунке 12 показаны оба этих типа отверстий.

В зависимости от относительных размеров катионов и анионов, катионы ионного соединения могут занимать тетраэдрические или октаэдрические отверстия, как показано на рисунке 13. Относительно небольшие катионы занимают тетраэдрические отверстия, а более крупные катионы занимают октаэдрические отверстия. Если катионы слишком велики, чтобы поместиться в октаэдрические отверстия, анионы могут принять более открытую структуру, такую как простой кубический массив. Тогда более крупные катионы могут занять большие кубические отверстия, что стало возможным благодаря более открытому пространству.
Рис. 13. Размер катиона и форма отверстия, занимаемого соединением, напрямую связаны.
Есть две тетраэдрические дырки для каждого аниона в массиве анионов HCP или CCP. Соединение, которое кристаллизуется в виде плотноупакованного массива анионов с катионами в тетраэдрических отверстиях, может иметь максимальное соотношение катион: анион 2: 1; все тетраэдрические отверстия заполнены при этом соотношении. Примеры включают Li 2 O, Na 2 O, Li 2 S и Na 2 S.Соединения с соотношением менее 2: 1 могут также кристаллизоваться в виде плотноупакованного массива анионов с катионами в тетраэдрических отверстиях, если их размер соответствует. Однако в этих соединениях часть тетраэдрических дырок остается вакантной.
Пример 3:
Заполнение четырехгранных отверстийСульфид цинка является важным промышленным источником цинка, а также используется в качестве белого пигмента в красках. Сульфид цинка кристаллизуется с ионами цинка, занимающими половину тетраэдрических отверстий в плотноупакованном массиве сульфид-ионов.Какая формула сульфида цинка?
Показать решениеПоскольку на каждый анион (сульфид-ион) приходится две тетраэдрических дырки и половина этих дырок занята ионами цинка, должно быть [latex] \ frac {1} {2} \ times 2 [/ latex], или 1 , ион цинка на сульфид-ион. Таким образом, формула ZnS.
Проверьте свои знания
Селенид лития можно описать как плотнейшую упаковку селенид-ионов с ионами лития во всех тетраэдрических дырках. Какая у него формула селенида лития?
Отношение октаэдрических дырок к анионам в структуре HCP или CCP составляет 1: 1.Таким образом, соединения с катионами в октаэдрических дырках в плотноупакованном массиве анионов могут иметь максимальное соотношение катион: анион 1: 1. Например, в NiO, MnS, NaCl и KH все октаэдрические отверстия заполнены. Отношения менее 1: 1 наблюдаются, когда некоторые из октаэдрических отверстий остаются пустыми.
Пример 4:
Стехиометрия ионных соединенийСапфир — оксид алюминия. Оксид алюминия кристаллизуется с ионами алюминия в двух третях октаэдрических отверстий в плотноупакованном массиве оксидных ионов.Какая формула у оксида алюминия?
Показать решениеПоскольку на каждый анион (оксидный ион) приходится одна октаэдрическая дырка и только две трети этих дырок заняты, отношение алюминия к кислороду должно быть [латекс] \ frac {2} {3} [/ латекс]: 1, что даст [латекс] {\ text {Al}} _ {2 \ text {/} 3} \ text {O} [/ latex]. Простейшее целочисленное соотношение 2: 3, поэтому формула Al 2 O 3 .
Проверьте свои знанияБелый пигмент оксида титана кристаллизуется с ионами титана в половине октаэдрических отверстий в плотноупакованном массиве оксидных ионов.Какая формула оксида титана?
В простом кубическом массиве анионов есть одно кубическое отверстие, которое может быть занято катионом для каждого аниона в массиве. В CsCl и других соединениях с такой же структурой все кубические дырки заняты. Половина кубических дырок занята в SrH 2 , UO 2 , SrCl 2 и CaF 2 .
Различные типы ионных соединений часто кристаллизуются в одной и той же структуре, если относительные размеры их ионов и их стехиометрия (две основные характеристики, определяющие структуру) схожи.

Элементарные ячейки ионных соединений
Многие ионные соединения кристаллизуются с кубическими элементарными ячейками, и мы будем использовать эти соединения, чтобы описать общие особенности ионных структур.
Когда ионное соединение состоит из катионов и анионов одинакового размера в соотношении 1: 1, оно обычно образует простую кубическую структуру. Примером этого является хлорид цезия, CsCl (проиллюстрированный на Фигуре 14), причем Cs + и Cl — имеют радиусы 174 мкм и 181 мкм соответственно.Мы можем представить это как ионы хлорида, образующие простую кубическую элементарную ячейку с ионом цезия в центре; или в виде ионов цезия, образующих элементарную ячейку с ионом хлорида в центре; или в виде простых кубических элементарных ячеек, образованных ионами Cs + , перекрывающими элементарные ячейки, образованные ионами Cl — . Ионы цезия и ионы хлора соприкасаются по диагоналям тела элементарных ячеек. Один ион цезия и один ион хлорида присутствуют в элементарной ячейке, что дает стехиометрию 1: 1, требуемую формулой для хлорида цезия.Обратите внимание, что в центре ячейки нет точки решетки, и CsCl не является структурой BCC, потому что ион цезия не идентичен иону хлорида.
Рис. 14. Ионные соединения с катионами и анионами аналогичного размера, такие как CsCl, обычно образуют простую кубическую структуру. Их можно описать элементарными ячейками с катионами по углам или анионами по углам.
Мы сказали, что расположение точек решетки произвольно. Это иллюстрируется альтернативным описанием структуры CsCl, в которой узлы решетки расположены в центрах ионов цезия.В этом описании ионы цезия расположены в точках решетки в углах ячейки, а ион хлорида расположен в центре ячейки. Две элементарные ячейки разные, но они описывают идентичные структуры.
Когда ионное соединение состоит из катионов и анионов в соотношении 1: 1, которые значительно различаются по размеру, оно обычно кристаллизуется с помощью элементарной ячейки FCC, как показано на рисунке 15.
 Хлорид натрия, NaCl, является примером этого. с Na + и Cl —, имеющими радиусы 102 и 181 мкм, соответственно.Мы можем представить это как ионы хлора, образующие ячейку FCC, причем ионы натрия расположены в октаэдрических отверстиях в середине краев ячейки и в центре ячейки. Ионы натрия и хлора соприкасаются друг с другом по краям ячейки. Элементарная ячейка содержит четыре иона натрия и четыре иона хлорида, что дает стехиометрию 1: 1, требуемую формулой NaCl.
Хлорид натрия, NaCl, является примером этого. с Na + и Cl —, имеющими радиусы 102 и 181 мкм, соответственно.Мы можем представить это как ионы хлора, образующие ячейку FCC, причем ионы натрия расположены в октаэдрических отверстиях в середине краев ячейки и в центре ячейки. Ионы натрия и хлора соприкасаются друг с другом по краям ячейки. Элементарная ячейка содержит четыре иона натрия и четыре иона хлорида, что дает стехиометрию 1: 1, требуемую формулой NaCl.Рис. 15. Ионные соединения с анионами, которые намного крупнее катионов, например NaCl, обычно образуют структуру FCC. Их можно описать ГЦК элементарными ячейками с катионами в октаэдрических дырках.
Кубическая форма сульфида цинка, цинковая обманка, также кристаллизуется в элементарной ячейке FCC, как показано на рисунке 16. Эта структура содержит ионы сульфида в узлах решетки FCC-решетки. (Расположение сульфид-ионов идентично расположению хлорид-ионов в хлориде натрия.) Радиус иона цинка составляет всего около 40% от радиуса сульфид-иона, поэтому эти маленькие ионы Zn 2+ расположены в чередование четырехгранных отверстий, то есть в одной половине четырехгранных отверстий.В элементарной ячейке четыре иона цинка и четыре иона сульфида, что дает эмпирическую формулу ZnS.
Рис. 16. ZnS, сульфид цинка (или цинковая обманка) образуют элементарную ячейку ГЦК с ионами сульфида в узлах решетки и гораздо меньшими ионами цинка, занимающими половину тетраэдрических отверстий в структуре.
Элементарная ячейка с фторидом кальция, подобная той, что показана на рисунке 17, также является элементарной ячейкой FCC, но в этом случае катионы расположены в точках решетки; эквивалентные ионы кальция расположены в узлах решетки ГЦК-решетки.Все тетраэдрические позиции в массиве ГЦК ионов кальция заняты ионами фтора. В элементарной ячейке четыре иона кальция и восемь ионов фтора, что дает соотношение кальций: фтор 1: 2 в соответствии с химической формулой CaF 2 .
 Внимательное изучение рисунка 17 покажет простой кубический массив ионов фтора с ионами кальция в одной половине кубических дырок. Структура не может быть описана в терминах пространственной решетки из точек на фторид-ионах, поскольку не все фторид-ионы имеют одинаковое окружение.Ориентация четырех ионов кальция относительно ионов фтора различается.
Внимательное изучение рисунка 17 покажет простой кубический массив ионов фтора с ионами кальция в одной половине кубических дырок. Структура не может быть описана в терминах пространственной решетки из точек на фторид-ионах, поскольку не все фторид-ионы имеют одинаковое окружение.Ориентация четырех ионов кальция относительно ионов фтора различается.Рис. 17. Фторид кальция, CaF 2 , образует элементарную ячейку FCC с ионами кальция (зеленый) в узлах решетки и ионами фтора (красный), занимающими все тетраэдрические узлы между ними.
Расчет ионных радиусов
Если мы знаем длину края элементарной ячейки ионного соединения и положение ионов в ячейке, мы можем вычислить ионные радиусы для ионов в соединении, если мы сделаем предположения об индивидуальных формах ионов и контактах.
Пример 5:
Расчет ионных радиусовДлина края элементарной ячейки LiCl (NaCl-подобная структура, FCC) составляет 0,514 нм или 5,14 Å. Предполагая, что ион лития достаточно мал, чтобы ионы хлора контактировали, как на рисунке 15, рассчитайте ионный радиус для иона хлорида.
Примечание: Единица измерения длины, ангстрема, Å, часто используется для представления размеров в атомном масштабе и эквивалентна 10 −10 м.
Показать решениеНа лицевой стороне элементарной ячейки LiCl ионы хлора контактируют друг с другом по диагонали грани:
Нарисовав прямоугольный треугольник на поверхности элементарной ячейки, мы видим, что длина диагонали равна четырем радиусам хлорида (один радиус от каждого углового хлорида и один диаметр, равный двум радиусам, от иона хлорида в центре). грани), поэтому d = 4 r .{2}} {16}} = \ text {0,182 нм} [/ latex] (1,82 Å) для Cl — , радиус
Проверьте свои знанияДлина ребра элементарной ячейки KCl (NaCl-подобная структура, ГЦК) составляет 6,28 Å. Предполагая, что анион-катионный контакт проходит по краю ячейки, рассчитайте радиус иона калия.
Показать решение Радиус хлорид-иона составляет 1,82 Å.
Радиус хлорид-иона составляет 1,82 Å.Радиус иона калия 1,33 Å.
Важно понимать, что значения ионных радиусов, рассчитанные на основе длин краев элементарных ячеек, зависят от множества предположений, таких как идеальная сферическая форма для ионов, которые в лучшем случае являются приблизительными.Следовательно, такие расчетные значения сами по себе являются приблизительными, и сравнения нельзя зайти слишком далеко. Тем не менее, этот метод оказался полезным для расчета ионных радиусов на основе экспериментальных измерений, таких как рентгеновские кристаллографические определения.
Рентгеновская кристаллография
Размер элементарной ячейки и расположение атомов в кристалле можно определить из измерений дифракции рентгеновских лучей на кристалле, называемой рентгеновской кристаллографией . Дифракция — это изменение направления движения электромагнитной волны, когда она встречает физический барьер, размеры которого сопоставимы с размерами длины волны света. Рентгеновские лучи — это электромагнитное излучение с длиной волны, равной расстоянию между соседними атомами в кристаллах (порядка нескольких Å).
Когда пучок монохроматических рентгеновских лучей попадает на кристалл, его лучи рассеиваются во всех направлениях атомами внутри кристалла.Когда рассеянные волны, распространяющиеся в одном направлении, сталкиваются друг с другом, они подвергаются интерференции , процессу, посредством которого волны объединяются, приводя к увеличению или уменьшению амплитуды (интенсивности) в зависимости от степени, в которой максимумы объединяющихся волн находятся разделены (см. рисунок 18).
Рис. 18. Световые волны, занимающие одно и то же пространство, испытывают интерференцию, объединяясь, давая волны большей (а) или меньшей (б) интенсивности, в зависимости от разделения их максимумов и минимумов.
Когда рентгеновские лучи определенной длины волны λ рассеиваются атомами в соседних кристаллических плоскостях, разделенных расстоянием, d , они могут претерпевать конструктивную интерференцию, когда разница между расстояниями, пройденными двумя волнами до их объединения, составляет целочисленный коэффициент длины волны n .
 Это условие выполняется, когда угол дифрагированного луча, θ , связан с длиной волны и межатомным расстоянием уравнением:
Это условие выполняется, когда угол дифрагированного луча, θ , связан с длиной волны и межатомным расстоянием уравнением:[латекс] n {\ lambda} = 2d \ text {sin} \ theta [/ latex]
Это соотношение известно как уравнение Брэгга в честь У.Х. Брэгг, английский физик, первым объяснивший это явление. На рисунке 19 показаны два примера дифрагированных волн от одних и тех же двух плоскостей кристалла. На рисунке слева изображены волны, дифрагированные под углом Брэгга, приводящие к конструктивной интерференции, а на рисунке справа показаны дифракция и другой угол, который не удовлетворяет условию Брэгга, что приводит к деструктивной интерференции.
Рис. 19. Дифракция рентгеновских лучей, рассеянных атомами внутри кристалла, позволяет определить расстояние между атомами.Верхнее изображение показывает конструктивную интерференцию между двумя рассеянными волнами и результирующей дифрагированной волной высокой интенсивности. На нижнем изображении показаны деструктивная интерференция и дифрагированная волна низкой интенсивности.
Посетите раздел «Что такое закон Брэгга и почему он важен?» для получения дополнительных сведений об уравнении Брэгга и симуляторе, который позволяет исследовать влияние каждой переменной на интенсивность дифрагированной волны.Рентгеновский дифрактометр, такой как тот, что показан на рисунке 20, может использоваться для измерения углов, под которыми рентгеновские лучи дифрагируют при взаимодействии с кристаллом, как описано выше.Из таких измерений можно использовать уравнение Брэгга для вычисления расстояний между атомами, как показано в следующем примере упражнения.
Рис. 20. В дифрактометре (а) пучок рентгеновских лучей попадает на кристаллический материал, создавая картину дифракции рентгеновских лучей (b), которую можно проанализировать для определения кристаллической структуры.
Вы можете просмотреть стенограмму «Празднование кристаллографии — анимационное приключение» здесь (открывается в новом окне).

Пример 6:
Использование уравнения БрэггаВ дифрактометре рентгеновские лучи с длиной волны 0.1315 нм были использованы для получения дифракционной картины для меди. Дифракция первого порядка ( n = 1) произошла под углом θ = 25,25 °. Определите расстояние между дифрагирующими плоскостями в меди.
Показать решениеРасстояние между плоскостями находится путем решения уравнения Брэгга: n λ = 2 d sin θ для d .
Это дает: [латекс] d = \ dfrac {n \ lambda} {2 \ sin \ theta} = \ dfrac {1 \ left (0,1315 \ text {nm} \ right)} {2 \ sin \ left (25.{\ circ} \ right)} = 0,154 \ text {nm} [/ latex]
Проверьте свои знанияКристалл с расстоянием между плоскостями 0,394 нм дифрагирует рентгеновские лучи с длиной волны 0,147 нм. Каков угол дифракции первого порядка?
Портрет химика: рентгеновский кристаллограф Розалинд Франклин
Рис. 21. На этой иллюстрации показано изображение дифракции рентгеновских лучей, подобное тому, которое Франклин нашла в своем исследовании. (кредит: Национальный институт здоровья)
Открытие структуры ДНК в 1953 году Фрэнсисом Криком и Джеймсом Уотсоном — одно из величайших достижений в истории науки.Они были удостоены Нобелевской премии по физиологии и медицине 1962 года вместе с Морисом Уилкинсом, который предоставил экспериментальное доказательство структуры ДНК. Британский химик Розалинд Франклин внесла неоценимый вклад в это грандиозное достижение своей работой по измерению рентгеновских дифракционных изображений ДНК. В начале своей карьеры исследования Франклин структуры углей оказались полезными для британских военных действий. В начале 1950-х годов Франклин и докторант Реймонд Гослинг переключили свое внимание на биологические системы и обнаружили, что ДНК состоит из двух форм: длинного тонкого волокна, образующегося при намокании (тип «B»), и короткого широкого волокна, образующегося при сушке ( введите»).
 Ее рентгеновские дифракционные изображения ДНК (рис. 21) предоставили важную информацию, которая позволила Уотсону и Крику подтвердить, что ДНК образует двойную спираль, и определить детали ее размера и структуры.
Ее рентгеновские дифракционные изображения ДНК (рис. 21) предоставили важную информацию, которая позволила Уотсону и Крику подтвердить, что ДНК образует двойную спираль, и определить детали ее размера и структуры.Франклин также провел новаторское исследование вирусов и РНК, содержащей их генетическую информацию, обнаружив новую информацию, которая радикально изменила совокупность знаний в этой области. После развития рака яичников Франклин продолжала работать до своей смерти в 1958 году в возрасте 37 лет.Среди множества посмертных признаний ее работы, Чикагская медицинская школа Финчского университета медицинских наук изменила свое название на Медицинский и научный университет Розалинды Франклин в 2004 году и приняла изображение ее знаменитого рентгеновского дифракционного изображения ДНК в качестве официального документа. логотип университета.
Основные понятия и краткое изложение
Структуры кристаллических металлов и простых ионных соединений можно описать в терминах упаковки сфер. Атомы металла могут упаковываться в гексагональные структуры с плотнейшей упаковкой, кубические структуры с плотнейшей упаковкой, объемно-центрированные структуры и простые кубические структуры.Анионы в простых ионных структурах обычно принимают одну из этих структур, а катионы занимают пространства, оставшиеся между анионами. Маленькие катионы обычно занимают тетраэдрические дырки в плотноупакованном массиве анионов. Катионы большего размера обычно занимают октаэдрические отверстия. Катионы еще большего размера могут занимать кубические дырки в простом кубическом массиве анионов. Структуру твердого тела можно описать, указав размер и форму элементарной ячейки и ее содержимое. Тип структуры и размеры элементарной ячейки могут быть определены путем измерения дифракции рентгеновских лучей.
Ключевые уравнения
- [латекс] n {\ lambda} = 2d \ text {sin} \ theta [/ latex]
Попробуйте
- Опишите кристаллическую структуру железа, которое кристаллизуется с двумя эквивалентными атомами металла в кубической элементарной ячейке.

- Опишите кристаллическую структуру Pt, которая кристаллизуется с четырьмя эквивалентными атомами металла в кубической элементарной ячейке.
- Каково координационное число атома хрома в объемноцентрированной кубической структуре хрома?
- Каково координационное число атома алюминия в гранецентрированной кубической структуре алюминия?
- Металлический кобальт кристаллизуется в гексагональной плотноупакованной структуре.Какое координационное число атома кобальта?
- Металлический никель кристаллизуется в кубической плотноупакованной структуре. Какое координационное число атома никеля?
- Вольфрам кристаллизуется в объемно-центрированной кубической элементарной ячейке с длиной ребра 3,165 Å.
- Каков атомный радиус вольфрама в этой структуре?
- Рассчитайте плотность вольфрама.
- Платина (атомный радиус = 1,38 Å) кристаллизуется в кубической плотноупакованной структуре.Рассчитайте длину кромки гранецентрированной кубической элементарной ячейки и плотность платины.
- Барий кристаллизуется в объемноцентрированной кубической элементарной ячейке с длиной ребра 5,025 Å.
- Каков атомный радиус бария в этой структуре?
- Рассчитайте плотность бария.
- Алюминий (атомный радиус 1,43 Å) кристаллизуется в кубической плотноупакованной структуре. Рассчитайте длину ребра гранецентрированной кубической элементарной ячейки и плотность алюминия.
- Плотность алюминия 2,7 г / см 3 ; кремния 2,3 г / см 3 . Объясните, почему Si имеет более низкую плотность, хотя в нем более тяжелые атомы.
- Свободное пространство в металле может быть найдено путем вычитания объема атомов в элементарной ячейке из объема ячейки. Вычислите процент свободного пространства в каждой из трех кубических решеток, если все атомы в каждой имеют одинаковый размер и касаются своих ближайших соседей. Какая из этих структур представляет собой наиболее эффективную упаковку? То есть в каких упаковках меньше всего неиспользуемого места?
- Сульфид кадмия, иногда используемый художниками в качестве желтого пигмента, кристаллизуется с кадмием, занимая половину тетраэдрических отверстий в плотно упакованном массиве сульфид-ионов.Какая формула сульфида кадмия? Поясните свой ответ.
- Соединение кадмия, олова и фосфора используется в производстве некоторых полупроводников. Он кристаллизуется с кадмием, занимающим одну четверть тетраэдрических дырок, и оловом, занимающим одну четверть тетраэдрических дырок в плотно упакованном массиве фосфид-ионов. Какая формула соединения? Поясните свой ответ.
- Какова формула магнитного оксида кобальта, используемого в записывающих лентах, который кристаллизуется с атомами кобальта, занимающими одну восьмую тетраэдрических дырок и половину октаэдрических дырок в плотно упакованном массиве оксидных ионов?
- Соединение, содержащее цинк, алюминий и серу, кристаллизуется с плотной упаковкой сульфид-ионов.Ионы цинка находятся в одной восьмой тетраэдрических дырок, а ионы алюминия — в половине октаэдрических дырок. Какова эмпирическая формула соединения?
- Соединение таллия и йода кристаллизуется в виде простого кубического массива иодид-ионов с ионами таллия во всех кубических дырках. Какая формула этого йодида? Поясните свой ответ.
- Какой из следующих элементов реагирует с серой с образованием твердого тела, в котором атомы серы образуют плотноупакованный массив со всеми занятыми октаэдрическими отверстиями: Li, Na, Be, Ca или Al?
- Каков массовый процент титана в рутиле, минерале, содержащем титан и кислород, если его структуру можно описать как плотно упакованный массив оксидных ионов с ионами титана в половине октаэдрических отверстий? Какова степень окисления титана?
- Объясните, почему химически подобные хлориды щелочных металлов NaCl и CsCl имеют разную структуру, тогда как химически разные NaCl и MnS имеют одинаковую структуру.
- Поскольку минералы образовались из расплавленной магмы, разные ионы занимали одни и те же участки в кристаллах. Литий часто встречается вместе с магнием в минералах, несмотря на разницу в заряде их ионов. Предложите объяснение.
- Иодид рубидия кристаллизуется с кубической элементарной ячейкой, содержащей иодид-ионы по углам и ион рубидия в центре. Какая формула соединения?
- Один из различных оксидов марганца кристаллизуется с кубической элементарной ячейкой, содержащей ионы марганца по углам и в центре.Ионы оксида расположены в центре каждого края элементарной ячейки. Какая формула соединения?
- NaH кристаллизуется с той же кристаллической структурой, что и NaCl. Длина ребра кубической элементарной ячейки NaH составляет 4,880 Å.
- Рассчитайте ионный радиус H — . (Ионный радиус Li + составляет 0,0,95 Å.)
- Рассчитайте плотность NaH.
- Иодид таллия (I) кристаллизуется с той же структурой, что и CsCl. Длина ребра элементарной ячейки TlI равна 4.20 Å.
- Рассчитайте ионный радиус TI + . (Ионный радиус I — составляет 2,16 Å.)
- Рассчитайте плотность TlI.
- Кубическая элементарная ячейка содержит ионы марганца по углам и ионы фтора в центре каждого края.
- Какова эмпирическая формула этого соединения? Поясните свой ответ.
- Каково координационное число иона Mn 3+ ?
- Рассчитайте длину края элементарной ячейки, если радиус иона Mn 3+ равен 0.65 А.
- Рассчитайте плотность смеси.
- Каково расстояние между плоскостями кристалла, которые дифрагируют рентгеновские лучи с длиной волны 1,541 нм под углом θ 15,55 ° (отражение первого порядка)?
- Дифрактометр, использующий рентгеновские лучи с длиной волны 0,2287 нм, дает пик дифракции первого порядка для угла кристалла θ = 16,21 °. Определите расстояние между дифрагирующими плоскостями в этом кристалле.
- Металл с расстоянием между плоскостями 0.4164 нм дифрагирует рентгеновские лучи с длиной волны 0,2879 нм. Каков угол дифракции для дифракционного пика первого порядка?
- Золото кристаллизуется в кубической гранецентрированной элементарной ячейке. Отражение второго порядка (n = 2) рентгеновских лучей для плоскостей, составляющих вершину и основание элементарных ячеек, находится при θ = 22,20 °. Длина волны рентгеновского излучения составляет 1,54 Å. Какова плотность металлического золота?
- Когда электрон в возбужденном атоме молибдена падает с L на K-оболочку, испускается рентгеновское излучение.Эти рентгеновские лучи дифрагируют под углом 7,75 ° на плоскостях с разделением 2,64 Å. Какова разница в энергии между K-оболочкой и L-оболочкой в молибдене в предположении дифракции первого порядка?
1. Структура этой низкотемпературной формы железа (ниже 910 ° C) является объемно-центрированной кубической. В каждом из восьми углов куба находится по одной восьмой атома, а в центре куба — по одному атому.
3. Координационное число относится к числу ближайших соседей.Атом хрома находится в центре объемно-центрированного куба и имеет восемь ближайших соседей (в углах куба): четыре в одной плоскости вверху и четыре в одной плоскости внизу. Таким образом, координационное число — восемь.
5. Гексагональная плотнейшая упаковка происходит таким образом, что каждый атом касается 12 ближайших соседей: 6 в своем собственном слое и 3 в каждом соседнем слое. Таким образом, координационный номер 12.
7. (a) В объемно-центрированной кубической элементарной ячейке атомы металла контактируют по внутренней диагонали куба.Внутренняя диагональ образует прямоугольный треугольник с ребром элементарной ячейки и диагональю грани. Воспользуйтесь теоремой Пифагора, чтобы определить длину диагонали d на грани куба через ребро e .
d 2 = e 2 + e 2 = 2e 2
d = [латекс] \ sqrt {2} [/ латекс] e
Внутренняя диагональ куба равна длине четырех атомных радиусов и может быть снова вычислена с помощью теоремы Пифагора, диагонали грани и ребра.2 \\ \ text {диагональ} & = & \ sqrt {3} e = 4r \ end {array} [/ latex]
радиус вольфрама = [латекс] \ frac {\ text {diagonal}} {4} = \ frac {\ sqrt {3} e} {4} = \ frac {\ sqrt {3}} {4} \ left ( 3.165 \ mathring {\ text {A}} \ right) = 1.370 \ mathring {\ text {A}} [/ latex];
(b) Учитывая объемно-центрированную кубическую структуру, каждая элементарная ячейка содержит два атома. Используйте длину края элементарной ячейки, чтобы рассчитать объем элементарной ячейки и объем, занимаемый каждым атомом. Умножьте, чтобы получить молярный объем, и разделите атомную массу на это значение, чтобы получить плотность (e = длина края):
V (ячейка) = e 3 = (3.{-1}} [/ latex] = 19,26 г / см
9. (a) В объемно-центрированной кубической элементарной ячейке атомы металла контактируют по диагонали куба. Диагональ куба образует прямоугольный треугольник с ребром элементарной ячейки и диагональю грани. Используйте теорему Пифагора, чтобы определить длину диагонали d на грани куба через e.
d 2 = e 2 + e 2 = 2e 2
d = [латекс] \ sqrt {2} [/ латекс] e
Диагональ куба равна длине четырех атомных радиусов и может быть вычислена снова, используя теорему Пифагора:
(диагональ) 2 = (4 r ) 2 = (2e) 2 + e 2 = 16r 2 = 3e 2
по диагонали = 4 r = [латекс] \ sqrt {3 \ text {e}} [/ latex]
r = [латекс] \ frac {\ sqrt {3}} {4} \ text {e} = \ frac {\ sqrt {3}} {4} [/ latex] (5.025 Å) = 2,176 Å;
(b) Учитывая объемно-центрированную кубическую структуру, каждая элементарная ячейка содержит два атома. Используйте длину края элементарной ячейки, чтобы рассчитать объем элементарной ячейки и объем, занимаемый каждым атомом. Умножьте, чтобы получить молярный объем, и разделите атомный вес в граммах на это значение, чтобы получить плотность (e = длина края):
V (ячейка) = e 3 = (5,025 [латекс] \ раз [/ латекс] 10 −8 см) 3 = 1,26884 [латекс] \ раз [/ латекс] 10 −22 см 3
V (атом) = 1.{3} [/ latex] = 3,595 г / см 3
11. Кристаллическая структура Si показывает, что он менее плотно упакован (координационное число 4) в твердом теле, чем Al (координационное число 12).
13. В массиве с плотнейшей упаковкой для каждого аниона существуют две тетраэдрические дырки. Если занята только половина тетраэдрических дырок, количество анионов и катионов равно. Формула сульфида кадмия — CdS.
15. В плотноупакованном массиве оксидных ионов одна октаэдрическая дырка и две тетраэдрические дырки существуют для каждого оксидного иона.Если половина октаэдрических дырок заполнена, на каждые два оксидных иона приходится один ион Co. Если заполнена одна восьмая тетраэдрических дырок, на каждые четыре оксидных иона приходится один ион Co. На каждые четыре оксидных иона приходится два иона Co в октаэдрических дырках и один Co в тетраэдрической дырке; Таким образом, формула имеет вид Co 3 O 4 .
17. В простом кубическом массиве только одно кубическое отверстие может быть занято катионом для каждого аниона в массиве. Соотношение таллия и йодида должно быть 1: 1; следовательно, формула таллия — TlI.
19. Отношение октаэдрических дырок к анионам кислорода составляет 1: 1 в массиве плотнейшей упаковки. Только половина октаэдрических отверстий занята. Таким образом, отношение титана к кислороду составляет 1: 2, а формула — TiO 2 . Массовое процентное содержание Ti в структуре:
процентов Ti = [латекс] \ frac {47.90} {47.90+ \ text {2 (15.9994)}} \ times \ text {100%} = \ text {59.95%} [/ latex]
Степень окисления титана +4, потому что на каждый ион Ti приходится два иона O 2-.
21. Оба иона близки по размеру: Mg 0,65; Ли 0,60. Это сходство позволяет им довольно легко поменяться местами. Разница в заряде обычно компенсируется переключателем Si 4+ на Al 3+ .
23. Общее количество ионов Mn определяется сложением вкладов углов и центра. Mn (углы): 8 [латекс] \ times [/ latex] [латекс] \ frac {1} {8} [/ latex]; Mn (в центре) = 1. Суммарный вклад Mn в элементарную ячейку = 2.
Для O всего в кубе 12 ребер, и каждый ион на ребре дает одну четвертую часть элементарной ячейки.{4} \ text {eV} [/ latex]
Глоссарий
объемно-центрированное кубическое (ОЦК) твердое тело: кристаллическая структура, которая имеет кубическую элементарную ячейку с точками решетки по углам и в центре ячейки
объемно-центрированная кубическая элементарная ячейка: простейшая повторяющаяся единица объемно-центрированного кубического кристалла; это куб, содержащий точки решетки в каждом углу и в центре куба
Уравнение Брэгга: уравнение, которое связывает углы, под которыми рентгеновские лучи дифрагируют атомами внутри кристалла
Координационное число : число атомов, ближайших к любому данному атому в кристалле или к центральному атому металла в комплексе
кубическая плотнейшая упаковка (CCP): кристаллическая структура, в которой плоскости плотно упакованных атомов или ионов уложены в виде серии из трех чередующихся слоев с различной относительной ориентацией (ABC)
дифракция: перенаправление электромагнитного излучения, которое возникает, когда оно сталкивается с физическим барьером соответствующих размеров
гранецентрированное кубическое (ГЦК) твердое тело: кристаллическая структура, состоящая из кубической элементарной ячейки с точками решетки по углам и в центре каждой грани
кубическая гранецентрированная элементарная ячейка: простейшая повторяющаяся единица гранецентрированного кубического кристалла; это куб, содержащий точки решетки в каждом углу и в центре каждой грани
гексагональная плотнейшая упаковка (HCP): кристаллическая структура, в которой плотноупакованные слои атомов или ионов уложены в виде серии из двух чередующихся слоев с различной относительной ориентацией (AB)
отверстие: (также промежуток) пространство между атомами внутри кристалла
изоморфные: с такой же кристаллической структурой
октаэдрическое отверстие: открытое пространство в кристалле в центре из шести частиц, расположенных по углам октаэдра
простая кубическая элементарная ячейка: (также примитивная кубическая элементарная ячейка) элементарная ячейка в простой кубической структуре
простая кубическая структура: кристаллическая структура с кубической элементарной ячейкой с узлами решетки только по углам
пространственная решетка: все точки в кристалле, которые имеют идентичную среду
тетраэдрическая дыра: тетраэдрическое пространство, образованное четырьмя атомами или ионами в кристалле
элементарная ячейка: наименьшая часть пространственной решетки, которая повторяется в трех измерениях для формирования всей решетки
Рентгеновская кристаллография: экспериментальный метод определения расстояний между атомами в кристалле путем измерения углов, под которыми рентгеновские лучи дифрагируют при прохождении через кристалл
(PDF) Кристаллическая структура индия и свинца в условиях ограниченной геометрии
ТЕХНИЧЕСКАЯ ФИЗИКА
Vol.5 6
№ 5
2011
КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА ИНДИА И СВИНЦА 641
составляют приблизительную оценку. Как видно на рис. 3б, пики
,[101] и [202] наноструктурированного индия являются
самыми узкими и такими же узкими, как аномально узкие пики
[111] и [222] наноструктурированного свинца.
Обратите внимание, что пики [101] и [202] решетки
I
4/
мм
(см. Рис. 4a) эквивалентны (соответствуют)
[111] и [222] пики решетки
Fm
3
м
соответственно,
и что ширина и положение этих пиков
не изменяются в предложенной модели эволюции решетки.
Таким образом, можно предположить, что форма и размер
наночастиц индия близки к форме и размеру наночастиц свинца ì
; то есть нанокластеры индия также слегка анизотропны на
и их «дифракционные» размеры по каналам и
по каналам составляют ~ 11 и ~ 15 нм соответственно.
ВЫВОДЫ
Методом рентгеновской дифракции исследована структура наночастиц свинца и индия
, введенных в пористые стекла
со средним диаметром пор 7 нм при комнатной температуре
.Обнаружено, что наноструктурированный свинец
не демонстрирует искажения в виде упругой линии отражения
и сохраняет свою кубическую симметрию, тогда как некоторые
пиков упругого отражения нанокластеров индия демонстрируют
аномальную угловую зависимость линии асим
метры и ширины. Эти аномалии можно объяснить
наличием двух фаз индия с различными структурами
в условиях искусственно ограниченной геометрии
, а именно «ядром» частицы, которое сохраняет тет
рагон
I
4/
ммм
структура массивного индия и развитый поверхностный слой
, в котором тетрагональная симметрия
постепенно переходит в кубическую
Fm
3
м
симметрия
попытка (характеристика сверхмалых частиц).Размеры кластеров nano
оценены методом рентгеновской дифракции.
БЛАГОДАРНОСТИ
Благодарим И.В. Голосовский, Ю.П. Черненкову
за полезные обсуждения, В.В. Федорову за поощрение интереса к работе
, Е.В. Фомину за помощь.
Работа частично поддержана Российским фондом фундаментальных исследований
, проект №
. 090200329.
СПИСОК ЛИТЕРАТУРЫ
1. Голосовский И., Миребо И., Г.Андре, Д.А. Курь
дюков, Ю.А. Кумзеров, С.Б. Вахрушев, Phys.
Rev. Lett.
86
, 5783 (2001).
2. Голосовский И.В., Товар М., Хоффман У., Миребо И.,
Фаут Ф., Курдюков Д. А. Кумзеров,
Письма Ж. Эксп. Теор. Физ.
83
, 356 (2006) [Письма в ЖЭТФ.
83
, 298 (2006)].
3. Голосовский И.В., Миребо И., Андре Г., М. Товар,
Д.М. Тоббенс, Д. А. Курдюков, Ю. А. Кумзень
ров, Физ. Тверь. Тела (Санкт-Петербург)
48
, 2010 (2006)
[Phys. Твердотельный
48
, 2130 (2006)].
4. Панькова С.В., Поборчий В.В., Соловьев В.Г.,
J. Phys .: Condens. Иметь значение.
8
, L203 (1996).
5. Колла Э.В., Колла Э.Ю. Королева, Ю. Кумзеров А.А.,
Савенко Б.Н., Сегнетоэлектр. Lett.
20
, 143 (1996).
6. А. Набережнов, А. Фокин, Ю. Кумзеров, А. Сотников,
С. Вахрушев, Б. Дорнер, Eur. Phys. J. E
12
, S21
(2003).
7. Кутняк З., Водопивец Б., Блинц Р., Фокин А.В.,
Ю. Кумзеров А., Вахрушев С. Б., J. Chem. Phys.
123
, 084708 (2005).
8. Колла Е.В., Фокин А.В., Королева Ю. А. Куму
зеров, С. Б. Вахрушев, Б. Н. Савенко, Нано
struct.Матер.
12
, 963 (1999).
9. R. Poprawski, E. RysiakiewiczPasek, A. Sieradzki,
A.
‘
Cizman, and J.
‘
Polanska, J. NonCryst. Твердые вещества
353
,
4457 (2007).
10. Борисов Б.Ф., Гартвик А.В., Чарная Е.В.,
Ю.А. Кумзеров, Акуст. Журн. Phys.
55
, 816 (2009).
11. Дж. М. Дереппе, Б. Ф. Борисов, Э. В.Чарная, А.В. Ше
ляпин, М.М. Нассар, Ю. Кумзеров, Физ. Тверь.
Тела (Санкт-Петербург)
42
, 184 (2000) [Phys. Твердотельный
42
, 193 (2000)].
12. Ю. Кумзеров, А.А. Набережнов, Б.Н. Савенко,
, С.Б. Вахрушев, Phys. Ред. B
52
, 4772 (1995).
13. Е. В. Чарная, К. Тиен, К. Дж. Лин, К. С. Вур, и
Ю. Кумзеров, Phys. Ред. B
58
, 467 (1998).
14. В. Н. Богомолов, Э. В. Колла, Ю. А. Кумзеров,
Н. М. Окунева, В. Н. Пригодин, Solid State Com
мун.
35
, 363 (1980).
15. Г. Х. Панова, А.А. Набережнов, А.В. Фокин,
Физ. Тверь. Тела (Санкт-Петербург)
50
, 1317 (2008) [Phys.
Твердотельный
50
, 1370 (2008)].
16. Б. Донер, И. Голосовский, Ю. Кумзеров, Д. Курдуков,
А.Набережнов, А. Сотников, С. Вахрушев, Ferro
электрика
286
, 213 (2003).
17. Сорина И.Г., Тянь Ч., Чарная Е.В. Кумзеров А.,
, Смирнов Л. А., Физ. Тверь. Тела (Санкт-Петербург)
40
,
1552 (1998) [Phys. Твердотельный
40
, 1407 (1998)].
18. П. П. Чаттопадхьяй, П. М. Г. Намбиссан, С. К. Паби,
и И. Манна, Phys. Ред. B
63
, 054107 (2001).
19. ChinMing Lin, TsuLien Hung, Yen Heng Huang,
Kung Te Wu, MauTsu Tang, ChihHao Lee, C. T. Chen,
и Y. Y. Chen, Phys. Ред. B
75
, 125426 (2007).
20. Б. Баламуруган, Ф. Э. Круис, С. М. Шивапрасад,
О. Дмитриева, Х. Захрес, Appl. Phys. Lett.
86
,
083102 (2005).
21. K. Soulantica, L. Frades, M. Sauvan, F. Senocq,
A. Maisonnat, и B.Chaudret, Adv. Функц. Матер.
13
,
553 (2003).
22. Голосовский И.В., Делаплан Р.Г., Набережнов А.А.,
, Ю.А. Кумзеров, Phys. Ред. B
69
, 132301 (2004).
23. Дж. Родригес-Карвахал, Программа FULLPROF, версия
2000, LLB CEA (Saclay).
24. Янбао Чжао, Чжицзюнь Чжан и Хунсинь Данг,
J. Nanoparticle Res.
6
, 47 (2004).
25.C. Rottman, M. Wortis, J. C. Heyraud, J. J. Metois,
Phys. Rev. Lett.
52
, 1009 (1984).
26. B.E. Warren, Phys. Ред.
59
, 693 (1941).
27. М. Танака, М. Такегучи и К. Фуруя, Surf. Sci.
435
, 491 (1999).
Перевод К. Шахлевича
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
7.8: Кубические решетки и плотная упаковка
Цели обучения
Убедитесь, что вы полностью понимаете следующие важные идеи:
- Разница между квадратной и шестиугольной упаковкой в двух измерениях.
- Определение и значение элементарной ячейки.
- Нарисуйте три решетки Браве кубической системы и вычислите количество атомов, содержащихся в каждой из этих элементарных ячеек.
- Покажите, как альтернативные способы наложения трех плотноупакованных слоев могут привести к гексагональной или кубической плотноупакованной структуре.
- Объясните происхождение и значение октаэдрических и тетраэдрических дырок в плотно упакованных слоях и покажите, как они могут возникать.
Плотная упаковка одинаковых сфер
Кристаллы, конечно, трехмерные объекты, но мы начнем с изучения свойств массивов в двухмерном пространстве. Это упростит разработку некоторых основных идей без дополнительных сложностей, связанных с визуализацией в трехмерном пространстве — что часто требует некоторой практики. Предположим, у вас есть дюжина или около того шариков. Как их сложить одним компактным слоем на столешнице? Очевидно, они должны контактировать друг с другом, чтобы минимизировать площадь, которую они покрывают.Оказывается, есть два эффективных способа добиться этого:
Существенное отличие здесь состоит в том, что любой шарик внутри массива с квадратной упаковкой находится в контакте с четырьмя другими шариками, в то время как это число возрастает до шести в структуре с гексагональной упаковкой. Также должно быть очевидно, что последняя схема покрывает меньшую площадь (содержит меньше пустого пространства) и, следовательно, является более эффективным устройством упаковки. Если вы хорошо разбираетесь в геометрии, вы можете показать, что квадратная упаковка покрывает 78 процентов площади, а шестиугольная упаковка дает 91 процент покрытия.
Если мы перейдем от мира мрамора к миру атомов, какую упаковку предпочтут атомы данного элемента?
Если атомы идентичны и связаны друг с другом в основном дисперсионными силами, которые являются полностью ненаправленными, они предпочтут структуру, в которой как можно больше атомов могут находиться в прямом контакте. Это, конечно, будет шестиугольное расположение.
Направленные химические связи между атомами имеют большое влияние на упаковку.Версия гексагональной упаковки, показанная справа, представляет собой углерод, известный как , графит , который образует двумерные листы. Каждый атом углерода внутри листа связан с тремя другими атомами углерода. В результате получается просто основная гексагональная структура с отсутствием некоторых атомов.
Координационное число 3 отражает sp 2 -гибридизацию углерода в графите, приводящую к плоско-тригональной связи и, следовательно, к структуре листа. Соседние листы связаны слабыми дисперсионными силами, позволяя листам скользить друг по другу и приводя к смазывающим и отслаивающимся свойствам графита.
Решетки
Порядок, лежащий в основе кристаллического твердого тела, может быть представлен массивом регулярно расположенных точек, указывающих на расположение основных структурных единиц кристалла. Этот массив называется кристаллической решеткой. Кристаллические решетки можно рассматривать как построенные из повторяющихся единиц, содержащих всего несколько атомов. Эти повторяющиеся единицы действуют как резиновый штамп: прижмите его к бумаге, переместите («переместите») на величину, равную шагу решетки, и снова проштампуйте бумагу.
Серые кружки представляют собой квадратный массив точек решетки.
Оранжевый квадрат — это простейшая элементарная ячейка, которую можно использовать для определения двумерной решетки.
Построение решетки путем перемещения («перевода») элементарной ячейки в серию шагов,
Хотя настоящие кристаллы на самом деле не растут таким образом, этот процесс концептуально важен, потому что он позволяет нам классифицировать тип решетки с точки зрения простой повторяющейся единицы, которая используется для ее «построения».Мы называем эту форму элементарной ячейкой . Для определения элементарной ячейки данной кристаллической решетки можно использовать любое количество примитивных форм. Тот, который на самом деле используется, в значительной степени является вопросом удобства, и он может содержать точку решетки в своем центре, как вы видите на двух из показанных здесь элементарных ячеек. В общем, лучшая элементарная ячейка — это самая простая ячейка, способная построить решетку.
Выше показаны элементарные ячейки для плотноупакованных квадратных и гексагональных решеток, которые мы обсуждали в начале этого урока.Хотя мы могли бы использовать шестиугольник для второй из этих решеток, ромб предпочтительнее, потому что он проще.
Обратите внимание, что в обеих этих решетках углы элементарных ячеек центрированы в точке решетки. Это означает, что атом или молекула, расположенная в этой точке реальной кристаллической решетки, используется совместно с соседними ячейками. Как здесь более ясно показано для двумерной решетки с квадратной упаковкой, одна элементарная ячейка может претендовать на «владение» только четвертью каждой молекулы и, таким образом, «содержит» 4 × ¼ = 1 молекулу.
Элементарная ячейка графитовой формы углерода также представляет собой ромб в соответствии с гексагональной симметрией этого расположения. Обратите внимание, что для создания этой структуры из элементарной ячейки нам необходимо сместить ячейку в обоих направлениях: x и y , чтобы оставить пустые места в нужных местах. В качестве альтернативы мы могли бы использовать правильные шестиугольники в качестве элементарных ячеек, но сдвиги x + y все равно потребуются, поэтому обычно предпочтительнее более простой ромб.Как вы увидите в следующем разделе, пустые пространства внутри этих элементарных ячеек играют важную роль при переходе от двухмерной решетки к трехмерной.
Кубические кристаллы
Чтобы удержать этот урок в разумных рамках, мы ограничиваем его в основном кристаллами, принадлежащими так называемой кубической системе . Поступая таким образом, мы можем развить основные концепции, полезные для понимания более сложных структур (как будто в одних кубиках недостаточно усложнений!) Но, кроме того, кубические кристаллы встречаются очень часто; большинство металлических элементов имеют кубическую структуру, как и обычная соль, хлорид натрия.
Обычно мы думаем о кубической форме с точки зрения равенства длин ее ребер и углов 90 ° между ее сторонами, но есть еще один способ классификации форм, который химики считают очень полезным. Это нужно для того, чтобы посмотреть, какие геометрические преобразования (например, вращения вокруг оси) мы можем выполнить, чтобы внешний вид остался неизменным. Например, вы можете повернуть куб на 90 ° вокруг оси, перпендикулярной любой паре из шести его граней, не внося в него никаких видимых изменений.Мы говорим, что куб имеет три взаимно перпендикулярных оси четырехкратного вращения , сокращенно C 4 осей. Но если задуматься, куб также можно вращать вокруг осей, проходящих между противоположными углами; в этом случае требуется три поворота на 120 °, чтобы пройти полный круг, поэтому эти оси (также четыре) являются тройными или осями C 3 .
Кубические кристаллы относятся к одной из семи кристаллических систем, узлы решетки которых можно неограниченно расширять, чтобы заполнить трехмерное пространство, и которые могут быть построены путем последовательных перемещений (перемещений) примитивной элементарной ячейки в трех измерениях.Как мы увидим ниже, кубическая система, как и некоторые другие, может иметь варианты, в которых дополнительные точки решетки могут быть размещены в центре блока или в центре каждой грани.
Три типа кубических решеток
Здесь показаны три решетки Браве, которые образуют кубическую кристаллическую систему.
Структурные примеры всех трех известны, причем гораздо более распространены тела и лицо (BCC и FCC); большинство металлических элементов кристаллизуются в одной из этих последних форм.Но хотя простая кубическая структура сама по себе необычна, оказывается, что многие структуры ОЦК и ГЦК, состоящие из ионов, можно рассматривать как взаимопроникающие комбинации двух простых кубических решеток, одна из которых состоит из положительных ионов, а другая — из отрицательных. Обратите внимание, что только структура ГЦК, которую мы опишем ниже, представляет собой решетку с плотной упаковкой внутри кубической системы.
Плотно упакованные решетки в трех измерениях
Плотноупакованные решетки обеспечивают максимальное взаимодействие между атомами.Если эти взаимодействия в основном являются привлекательными, то плотная упаковка обычно приводит к более энергетически стабильным структурам. Эти геометрические формы решетки широко используются в металлических, атомных и простых ионных кристаллах.
Как мы указывали выше, гексагональная упаковка одного слоя более эффективна, чем квадратная, поэтому мы начнем с этого. Представьте, что мы начинаем с одного слоя зеленых атомов, показанного ниже. Мы назовем это слоем A. Если мы поместим второй слой атомов (оранжевый) поверх A-слоя, мы ожидаем, что атомы нового слоя будут располагаться в полостях в первом слое.Но если все атомы идентичны, будут доступны только некоторые из этих пустот.
Обратите внимание на диаграмму слева, что есть два класса пустот между атомами A; один набор (окрашен в синий цвет) имеет вершину, направленную вверх, а другой набор (не окрашенный) имеет вершины, направленные вниз. Каждое пустое пространство представляет собой углубление, в котором могут гнездиться атомы второго слоя (B-слоя). Два набора пустот полностью эквивалентны, но только один из этих наборов может быть занят вторым слоем атомов, размер которого аналогичен размерам нижнего слоя.На иллюстрации справа выше мы произвольно разместили атомы B-слоя в синих пустотах, но с таким же успехом могли бы выбрать и белые.
Два варианта третьего слоя приводят к двум различным типам плотноупакованной решетки
Теперь посмотрим, что происходит, когда мы кладем третий слой атомов. Они впишутся в пустоты в B-слое. Как и прежде, есть два набора этих позиций, но, в отличие от случая, описанного выше, они не эквивалентны.
Атомы в третьем слое представлены открытыми синими кружками, чтобы не закрывать слои под ними. На иллюстрации слева этот третий слой размещен на B-слое в местах, которые находятся непосредственно над атомами A-слоя, поэтому наш третий слой — это просто еще один слой A. Если мы добавим еще несколько слоев, вертикальная последовательность A-B-A-B-A-B-A … будет повторяться бесконечно.
На диаграмме справа вверху синие атомы размещены над белыми (незанятыми) пустотами в слое A.Поскольку этот третий слой смещен по горизонтали (на наш взгляд) от слоя A, мы назовем его слоем C. По мере добавления новых слоев атомов последовательность слоев будет A-B-C-A-B-C-A-B-C …, поэтому мы называем это упаковкой ABC.
Для наглядности на этих диаграммах показаны только три атома слоев A и C. Но на самом деле каждый слой состоит из расширенного гексагонального массива; два слоя просто смещены друг от друга.
Эти две диаграммы, которые показывают покомпонентные изображения вертикальной укладки, дополнительно иллюстрируют довольно небольшое фундаментальное различие между этими двумя схемами, но, как вы увидите ниже, они имеют сильно расходящиеся структурные последствия.Обратите внимание на противоположную ориентацию слоев A и C
.Гексагональная закрытоупакованная структура
Укладка ГПУ, показанная слева чуть выше, выводит нас из кубической кристаллической системы в гексагональную, поэтому мы не будем здесь много говорить об этом, за исключением того, что укажем, что у каждого атома есть 12 ближайших соседей: шесть в собственном слое, и по три в каждом слое над и под ним.
Кубическая плотноупакованная структура
Ниже мы воспроизводим структуру FCC, показанную выше.
Вы заметите, что атомы B-слоя образуют шестиугольник, но это кубическая структура . Как это может быть? Ответ заключается в том, что стек FCC наклонен по отношению к граням куба и фактически совпадает с одной из трех осей, проходящих через противоположные углы. Чтобы увидеть взаимосвязь, необходимо немного изучить, и мы предоставили вам два представления, чтобы помочь вам. Слева показан куб в нормальной изометрической проекции; тот, что справа, смотрит вниз на вершину куба под слегка наклонным углом.
И CCP, и HCP структуры заполняют 74 процента доступного пространства, когда атомы имеют одинаковый размер. Вы должны увидеть, что две заштрихованные плоскости, пересекающие диагонали внутри куба, содержат атомы разных цветов, что означает, что они принадлежат разным слоям стека CCP. Каждая плоскость содержит три атома из слоя B и три из слоя C, что снижает симметрию до C 3 , которая должна быть у кубической решетки.
Элементарная ячейка FCC
На рисунке ниже показана гранецентрированная кубическая элементарная ячейка плотноупакованной кубической решетки.
Сколько атомов содержится в элементарной ячейке? Каждый угловой атом используется совместно с восемью соседними элементарными ячейками, поэтому одна элементарная ячейка может занимать только 1/8 каждого из восьми угловых атомов. Точно так же каждый из шести атомов с центром на грани принадлежит ячейке только наполовину. В итоге получается (8 × 1/8) + (6 × ½) = 4 атома на элементарную ячейку.
Промежуточные пустоты
Атомы в каждом слое этих плотноупакованных стопок находятся в углублении в слое под ним.Как мы объяснили выше, эти пустые пространства не заполнены полностью. (Геометрически невозможно, чтобы более двух одинаковых сфер находились в контакте в одной точке.) Мы увидим позже, что эти межузельные пустые пространства иногда могут вмещать дополнительные (но обычно меньшего размера) атомы или ионы.
Если мы посмотрим сверху двух слоев плотно упакованных сфер, мы можем выделить два класса пустотных пространств, которые мы называем тетраэдрическими и октаэдрическими дырками .
Тетраэдрические отверстия
Если мы обратим наше внимание на область на приведенной выше диаграмме, где один атом находится в контакте с тремя атомами в слоях непосредственно под ним, пустое пространство известно как тетраэдрическая дыра . Аналогичное пространство будет находиться между этим единственным атомом и тремя атомами (не показаны), которые будут лежать на нем в расширенной решетке. Любой межузельный атом, который может занимать это место, будет взаимодействовать с четырьмя окружающими его атомами, поэтому это также называется четырехкоординатным межузельным пространством .
Не обманывайтесь этим именем; границами пустотного пространства являются сферические сечения, а не тетраэдры. Тетраэдр — это просто воображаемая конструкция, четыре угла которой указывают на центры четырех атомов, находящихся в контакте.
Восьмигранные отверстия
Точно так же, когда два набора из трех тригонально ориентированных сфер находятся в плотно упакованном контакте, они будут ориентированы на 60 ° друг от друга, и центры сфер будут определять шесть углов воображаемого октаэдра с центром в пустоте между двумя слоями. , поэтому мы называем эти октаэдрические отверстия или шестикоординатными интерстициальными узлами .Октаэдрические сайты больше тетраэдрических.
Октаэдр имеет шесть углов и восемь сторон. Обычно мы рисуем октаэдры в виде двойной квадратной пирамиды, стоящей на одном углу (слева), но для того, чтобы визуализировать форму октаэдра в плотно упакованной решетке, лучше представить октаэдр как лежащий на одной из его граней (справа). .
Каждая сфера в решетке с плотной упаковкой связана с одним октаэдрическим узлом, тогда как тетраэдрических узлов всего вдвое меньше.Это можно увидеть на этой диаграмме, которая показывает центральный атом в слое B, выровненный с полостями в слоях C и A выше и ниже.
Гранецентрированная кубическая элементарная ячейка содержит одно октаэдрическое отверстие внутри себя, но октаэдрические отверстия, общие с соседними ячейками, существуют в центрах каждого края. Каждый из этих двенадцати расположенных на краях узлов является общим с четырьмя соседними ячейками и, таким образом, вносит (12 ×) = 3 атома в ячейку. При добавлении к единственному отверстию, содержащемуся в середине ячейки, получается в общей сложности 4 октаэдрических узла на элементарную ячейку.Это то же самое, что мы вычислили выше для числа атомов в ячейке.
Обычные кубические плотноупакованные структуры
Из элементарной тригонометрии можно показать, что атом точно помещается в октаэдрическую позицию, если его радиус на 0,414 больше, чем радиус основных атомов. Соответствующий показатель для меньших тетраэдрических отверстий составляет 0,225.
Многие чистые металлы и соединения образуют гранецентрированные кубические (кубические плотноупакованные) структуры. Существование тетраэдрических и октаэдрических дырок в этих решетках дает возможность «чужеродным» атомам занять некоторые или все эти междоузлия.Чтобы сохранить плотную упаковку, межузельные атомы должны быть достаточно маленькими, чтобы поместиться в эти отверстия без нарушения решетки основной КПК. Когда эти атомы слишком большие, что обычно имеет место в ионных соединениях, атомы в интерстициальных узлах будут раздвигать основные атомы, так что гранецентрированная кубическая решетка в некоторой степени открывается и теряет свой характер плотной упаковки.
Строение каменной соли
Галогениды щелочных металлов, которые кристаллизуются со структурой «каменной соли», примером которой является хлорид натрия, можно рассматривать либо как структуру ГЦК одного типа ионов, в которой октаэдрические отверстия заняты ионами противоположного заряда, либо как две взаимопроникающие решетки ГЦК, образованные вверх двух видов ионов.Два заштрихованных октаэдра иллюстрируют идентичную координацию двух типов ионов; каждый атом или ион данного типа окружен шестью атомами противоположного типа, в результате чего координация выражается как (6: 6).
Сколько единиц NaCl содержится в элементарной ячейке? Если мы проигнорируем атомы, которые были размещены за пределами ячейки, чтобы построить октаэдры, вы сможете насчитать четырнадцать «оранжевых» атомов и тринадцать «синих». Но многие из них используются совместно с соседними элементарными ячейками.
Атом в углу куба является общим для восьми соседних кубов и, таким образом, вносит 1/8 вклад в любую одну ячейку. Точно так же центр ребра является общим для четырех других ячеек, а атом с центром на грани является общим для двух ячеек. Принимая все это во внимание, вы сможете подтвердить следующий результат, показывающий, что в элементарной ячейке такого типа есть четыре единицы AB.
Оранжевый Синий 8 углов: 8 x 1/8 = 1 12 в центрах кромок: 12 x ¼ = 3 6 в центрах граней: 6 x ½ = 3 1 в центре корпуса = 1 всего: 4 всего: 4 Если мы примем во внимание фактические размеры ионов (Na + = 116 мкм, Cl — = 167 мкм), очевидно, что ни один ион не поместится в октаэдрические отверстия с решеткой КПК, состоящей из другого иона, поэтому реальная структура NaCl несколько выходит за рамки модели плотной упаковки.
Модель, заполняющая пространство справа, изображает гранецентрированную кубическую элементарную ячейку из хлорид-ионов (фиолетовый) с ионами натрия (зеленый), занимающими октаэдрические позиции.
Структура цинковой обманки: с использованием некоторых тетраэдрических отверстий
Поскольку существует два тетраэдрических узла для каждого атома в плотноупакованной решетке, мы можем иметь бинарные соединения со стехиометрией 1: 1 или 1: 2 в зависимости от того, заняты ли половина или все тетраэдрические дырки. Цинковая обманка — это минералогическое название сульфида цинка, ZnS.Неочищенная форма, известная как сфалерит , является основной рудой, из которой получают цинк.
Эта структура состоит по существу из решетки FCC (CCP) атомов серы (оранжевый цвет) (эквивалентен решетке хлорид-ионов в NaCl), в которой ионы цинка (зеленый цвет) занимают половину тетраэдрических узлов. Как и в любой решетке ГЦК, на элементарную ячейку приходится четыре атома серы, и все четыре атома цинка полностью содержатся в элементарной ячейке. Каждый атом в этой структуре имеет четырех ближайших соседей и, таким образом, имеет тетраэдрическую координацию.
Интересно отметить, что если все атомы заменить углеродом, это будет соответствовать структуре алмаза .
Структура флюорита: все тетраэдрические позиции заняты
Флюорит, CaF 2 , содержащий в два раза больше ионов фторида, чем кальция, использует все восемь тетраэдрических отверстий в решетке CPP ионов кальция (оранжевый), изображенной здесь. Чтобы помочь вам понять эту структуру, мы показали некоторые из октаэдрических узлов в следующей ячейке справа; вы можете видеть, что ион кальция в A окружен восемью ионами фтора, и это, конечно, относится ко всем сайтам кальция.Поскольку каждый ион фтора имеет четыре ближайших иона кальция, координация в этой структуре описывается как (8: 4).
Хотя радиусы двух ионов (F — = 117 пм, Ca 2 + = 126 пм не допускают истинной плотной упаковки, они достаточно похожи, чтобы можно было описать структуру с таким же успехом, как и ГЦК. решетка из фторид-ионов с ионами кальция в октаэдрических дырках.
Простые и объемно-центрированные кубические конструкции
В разделе 4 мы видели, что единственная кубическая решетка, допускающая плотную упаковку, — это гранецентрированная кубическая структура.В простейшей из трех типов кубической решетки, в простой кубической решетке , отсутствуют гексагонально расположенные слои, необходимые для плотной упаковки. Но, как показано на этом изображении в разобранном виде, пустое пространство между двумя квадратными слоями этой ячейки представляет собой октаэдрическое отверстие, которое может вместить другой атом, давая упаковку, которая в благоприятных случаях может приближаться к истинной плотной упаковке. Каждый атом B второго слоя (синий) находится в элементарной ячейке, определяемой слоями A выше и ниже нее.
Атомы A и B могут быть одного или разных типов. Если они одинаковы, у нас есть объемно-центрированная кубическая решетка . Если они разные, и особенно если это ионы с противоположным зарядом (как в структуре CsCl), существуют ограничения по размеру: если атом B слишком велик, чтобы поместиться в межузельное пространство, или если он настолько мал, что атом A слои (которые все несут одинаковый электрический заряд) вступают в контакт без достаточного кулоновского притяжения AB, это структурное устройство может быть нестабильным.
Структура хлорида цезия
CsCl — это общая модель структуры ОЦК. Как и в случае со многими другими структурами, включающими два разных атома или иона, мы можем рассматривать одну и ту же базовую структуру по-разному. Таким образом, если мы посмотрим за пределы одной элементарной ячейки, мы увидим, что CsCl можно представить как две взаимопроникающие простые кубические решетки, в которых каждый атом занимает октаэдрическую дырку внутри кубов другой решетки.
Авторы и авторство
Бокалы для коньяка из свинцового стекла с ананасовой решеткой, набор из 6 — Традиционные — Бокалы для ликера — от Crystal Julia
- Все продукты
- Пиво и вино
- Бокалы для бара
- Бокалы для ликера
- MPN: 19692
- Описание продукта
- Характеристики продукта
- Доставка и возврат

 Поскольку элементарная ячейка По содержит одну восьмую атома По в каждом из восьми углов, элементарная ячейка содержит один атом По.
Поскольку элементарная ячейка По содержит одну восьмую атома По в каждом из восьми углов, элементарная ячейка содержит один атом По.


 Хлорид натрия, NaCl, является примером этого. с Na + и Cl —, имеющими радиусы 102 и 181 мкм, соответственно.Мы можем представить это как ионы хлора, образующие ячейку FCC, причем ионы натрия расположены в октаэдрических отверстиях в середине краев ячейки и в центре ячейки. Ионы натрия и хлора соприкасаются друг с другом по краям ячейки. Элементарная ячейка содержит четыре иона натрия и четыре иона хлорида, что дает стехиометрию 1: 1, требуемую формулой NaCl.
Хлорид натрия, NaCl, является примером этого. с Na + и Cl —, имеющими радиусы 102 и 181 мкм, соответственно.Мы можем представить это как ионы хлора, образующие ячейку FCC, причем ионы натрия расположены в октаэдрических отверстиях в середине краев ячейки и в центре ячейки. Ионы натрия и хлора соприкасаются друг с другом по краям ячейки. Элементарная ячейка содержит четыре иона натрия и четыре иона хлорида, что дает стехиометрию 1: 1, требуемую формулой NaCl. Внимательное изучение рисунка 17 покажет простой кубический массив ионов фтора с ионами кальция в одной половине кубических дырок. Структура не может быть описана в терминах пространственной решетки из точек на фторид-ионах, поскольку не все фторид-ионы имеют одинаковое окружение.Ориентация четырех ионов кальция относительно ионов фтора различается.
Внимательное изучение рисунка 17 покажет простой кубический массив ионов фтора с ионами кальция в одной половине кубических дырок. Структура не может быть описана в терминах пространственной решетки из точек на фторид-ионах, поскольку не все фторид-ионы имеют одинаковое окружение.Ориентация четырех ионов кальция относительно ионов фтора различается. Радиус хлорид-иона составляет 1,82 Å.
Радиус хлорид-иона составляет 1,82 Å. Это условие выполняется, когда угол дифрагированного луча, θ , связан с длиной волны и межатомным расстоянием уравнением:
Это условие выполняется, когда угол дифрагированного луча, θ , связан с длиной волны и межатомным расстоянием уравнением:
 Ее рентгеновские дифракционные изображения ДНК (рис. 21) предоставили важную информацию, которая позволила Уотсону и Крику подтвердить, что ДНК образует двойную спираль, и определить детали ее размера и структуры.
Ее рентгеновские дифракционные изображения ДНК (рис. 21) предоставили важную информацию, которая позволила Уотсону и Крику подтвердить, что ДНК образует двойную спираль, и определить детали ее размера и структуры.