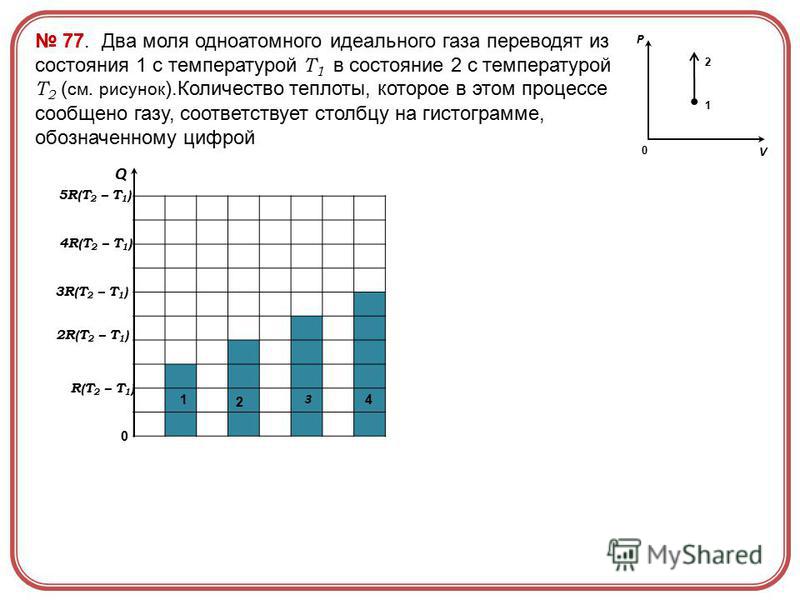
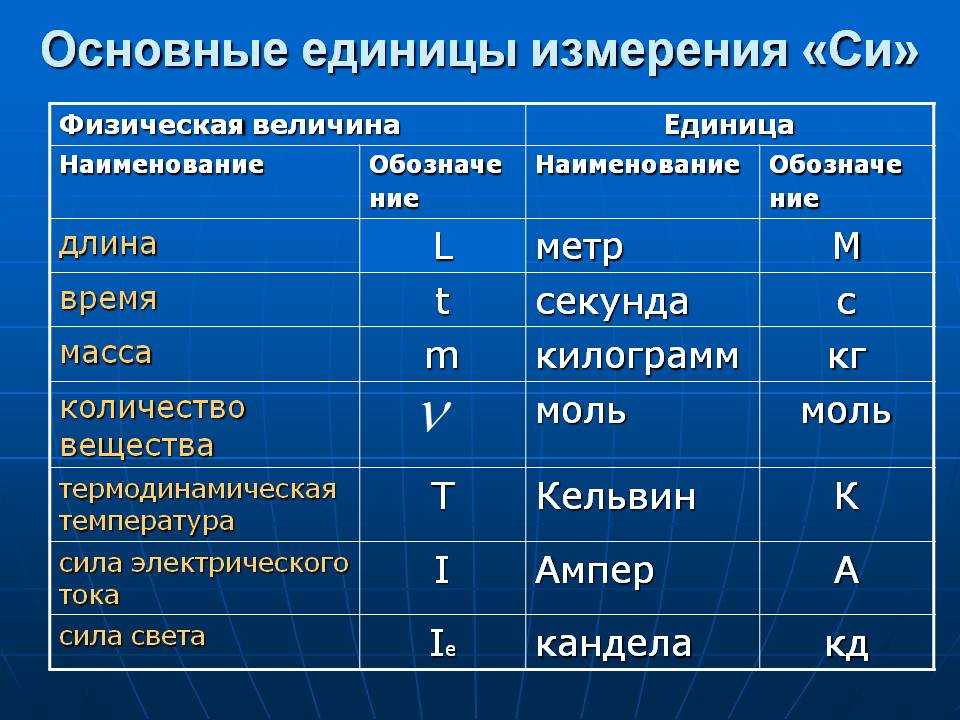
Индивидуальное домашнее задание «Плавление и отвердевание» 10 вариантов
Вариант№1
Обязательная часть
1. Что называется плавлением?
2. Построить график зависимости температуры от времени для следующего процесса: ртуть при температуре кристаллизации отвердевает и охлаждается до -50 °С.
3. Сколько энергии необходимо для превращения в жидкое состояние 400 г меди, взятой при 83 °С?
4. Какая энергия выделится при кристаллизации ртути массой 2 кг, если начальная температура ртути была равна 11 °С?
На дополнительную оценку
1. Воду объёмом 750 см3 с начальной температурой 12 °С переводят в твёрдое состояние. Конечная температура -5 °С. На сколько при этом изменилась внутренняя энергия?
2. В железной коробке массой 300 г расплавлено 100 г олова. Какое количество теплоты затрачено на этот процесс, если начальная температура была равна 32 °С?
3. В
банке находится 1 л горячей воды при температуре 80 °С. Какой станет
температура воды, если в неё бросить 100 г льда, имеющего температуру 0 °С?
В
банке находится 1 л горячей воды при температуре 80 °С. Какой станет
температура воды, если в неё бросить 100 г льда, имеющего температуру 0 °С?
№ 1: 2 балла № 2: 3 балла № 3-4: 4 балла
5–7 баллов: оценка «3» 8–10 баллов: оценка «4» 11–13 баллов: оценка «5»
Вариант№2
Обязательная часть
1. Что называется удельной теплотой плавления?
2. Постройте график зависимости температуры от времени для процесса: железо нагревают от 100 °С и расплавляют.
3. Какая энергия потребуется для расплавления льда массой 2 кг, взятого при 0 °С, и нагревания полученной воды до 40 °С?
4. Медь массой 300 г отвердевает при температуре кристаллизации и охлаждается до 83 °С. Какая энергия выделяется при этом?
На дополнительную оценку
1. Воду объёмом 750 см3
с начальной температурой 12 °С переводят в твёрдое состояние. Конечная температура -5 °С. На сколько при
этом изменилась внутренняя энергия?
Конечная температура -5 °С. На сколько при
этом изменилась внутренняя энергия?2. В железной коробке массой 300 г расплавлено 100 г олова. Какое количество теплоты затрачено на этот процесс, если начальная температура была равна 32 °С?
3. В банке находится 1 л горячей воды при температуре 80 °С. Какой станет температура воды, если в неё бросить 100 г льда, имеющего температуру 0 °С?
№ 1: 2 балла № 2: 3 балла № 3-4: 4 балла
5–7 баллов: оценка «3» 8–10 баллов: оценка «4» 11–13 баллов: оценка «5»
Вариант№3
Обязательная часть
1. Температура меди равна 1083,1°С. В каком состоянии находится медь?
2. Постройте график зависимости температуры от времени для процесса: лёд при 0 °С расплавляют и нагревают полученную воду до кипения.
3. Сколько энергии приобретёт при плавлении брусок из цинка массой 0,2 кг, взятый при температуре 20 °С?
4. Вода
массой 500 г охлаждается от 20 °С и замерзает. На сколько при этом уменьшилась
внутренняя энергия?
Вода
массой 500 г охлаждается от 20 °С и замерзает. На сколько при этом уменьшилась
внутренняя энергия?
На дополнительную оценку
1. Воду объёмом 750 см3 с начальной температурой 12 °С переводят в твёрдое состояние. Конечная температура -5 °С. На сколько при этом изменилась внутренняя энергия?
2. В железной коробке массой 300 г расплавлено 100 г олова. Какое количество теплоты затрачено на этот процесс, если начальная температура была равна 32 °С?
3. В банке находится 1 л горячей воды при температуре 80 °С. Какой станет температура воды, если в неё бросить 100 г льда, имеющего температуру 0 °С?
№ 1: 2 балла № 2: 3 балла № 3-4: 4 балла
5–7 баллов: оценка «3» 8–10 баллов: оценка «4» 11–13 баллов: оценка «5»
Вариант№4
Обязательная часть
1. Можно
ли утверждать, что при температуре 1539 °С железо будет жидким?
Можно
ли утверждать, что при температуре 1539 °С железо будет жидким?
2. Построить график зависимости температуры от времени для процесса: спирт охлаждается от 20°С и кристаллизуется.
3. На сколько увеличилась внутренняя энергия расплавленного железа массой 2 т, начальная температура которого была равна 39 °С?
4. Какая теплота выделится при отвердевании и последующем охлаждении до 400 °С стали массой 100 кг, взятой при температуре кристаллизации
На дополнительную оценку
1. Воду объёмом 750 см3 с начальной температурой 12 °С переводят в твёрдое состояние. Конечная температура -5 °С. На сколько при этом изменилась внутренняя энергия?
2. В железной коробке массой 300 г расплавлено 100 г олова. Какое количество теплоты затрачено на этот процесс, если начальная температура была равна 32 °С?
3. В банке находится 1 л горячей воды при температуре 80 °С. Какой станет температура воды, если в неё бросить 100 г льда, имеющего температуру 0 °С?
№ 1: 2 балла № 2: 3 балла № 3-4: 4 балла
5–7 баллов: оценка «3» 8–10 баллов: оценка «4» 11–13 баллов: оценка «5»
Вариант№5
Обязательная часть
1.
2. Постройте график зависимости температуры от времени для процесса: свинец расплавляют при температуре плавления и нагревают до 500 °С.
3. Какая энергия понадобится для превращения в воду льда массой 3 кг, взятого при -20 °С?
4. Вода массой 100 г замерзает при 0 °С и далее охлаждается до -10 °С. Сколько энергии при этом выделится?
На дополнительную оценку
1. Воду объёмом 750 см3 с начальной температурой 12 °С переводят в твёрдое состояние. Конечная температура -5 °С. На сколько при этом изменилась внутренняя энергия?
2. В железной коробке массой 300 г расплавлено 100 г олова. Какое количество теплоты затрачено на этот процесс, если начальная температура была равна 32 °С?
3. В банке находится 1 л горячей воды при температуре 80 °С. Какой станет температура воды, если в неё бросить 100 г льда, имеющего температуру 0 °С?
№ 1: 2 балла № 2: 3 балла № 3-4: 4 балла
5–7 баллов: оценка «3» 8–10 баллов: оценка «4» 11–13 баллов: оценка «5»
Вариант№6
Обязательная часть
1. Какой
из двух металлов – алюминий или медь – надо выбрать, чтобы изготовить посуду
для расплавления в ней второго металла?
Какой
из двух металлов – алюминий или медь – надо выбрать, чтобы изготовить посуду
для расплавления в ней второго металла?
2. Постройте график зависимости температуры от времени для процесса: вольфрам охлаждается от 3500 °С и кристаллизуется
3. Стальную деталь массой 200 г нагрели от 400 °С и расплавили. Какую энергию для этого затратили?
4. Свинец массой 3 кг отвердевает при температуре кристаллизации и охлаждается до 27 °С. Какая энергия при этом выделяется?
На дополнительную оценку
1. Воду объёмом 750 см 3 с начальной температурой 12 °С переводят в твёрдое состояние. Конечная температура -5 °С. На сколько при этом изменилась внутренняя энергия?
2. В железной коробке массой 300 г расплавлено 100 г олова. Какое количество теплоты затрачено на этот процесс, если начальная температура была равна 32 °С?
3. В банке находится 1 л горячей воды при температуре 80 °С. Какой станет температура воды, если в неё бросить 100 г льда, имеющего температуру 0 °С?
№ 1: 2 балла № 2: 3 балла № 3-4: 4 балла
5–7 баллов: оценка «3» 8–10 баллов: оценка «4» 11–13 баллов: оценка «5»
Вариант№7
Обязательная часть
1. Какое
тело обладает большей внутренней энергией – лёд при 0 °С или вода при 0 °С?
Какое
тело обладает большей внутренней энергией – лёд при 0 °С или вода при 0 °С?
2. Постройте график зависимости температуры от времени для процесса: лед нагревают от -10 °С и расплавляют.
3. Серебряный брусок массой 3 кг нагрели от 60 °С и расплавили. На сколько при этом увеличилась внутренняя энергия бруска
4. Воду массой 600 г охлаждают от 70 °С и замораживают. На сколько при этом уменьшилась внутренняя энергия?
На дополнительную оценку
1. Воду объёмом 750 см3 с начальной температурой 12 °С переводят в твёрдое состояние. Конечная температура -5 °С. На сколько при этом изменилась внутренняя энергия?
2. В железной коробке массой 300 г расплавлено 100 г олова. Какое количество теплоты затрачено на этот процесс, если начальная температура была равна 32 °С?
3. В банке находится 1 л горячей воды при температуре 80 °С. Какой станет температура воды, если в неё бросить 100 г льда, имеющего температуру 0 °С?
№ 1: 2 балла № 2: 3 балла № 3-4: 4 балла5–7 баллов: оценка «3» 8–10 баллов: оценка «4» 11–13 баллов: оценка «5»
Вариант№8
Обязательная часть
1. При
каком условии тело плавится? Отвердевает?
При
каком условии тело плавится? Отвердевает?
2. Постройте график зависимости температуры от времени для процесса: вода охлаждается от 50 °С и замерзает.
3. Сколько энергии приобретёт кусок свинца массой 300 г, взятый при 27 °С, при нагревании и плавлении?
4. Олово массой 5 кг отвердевает при температуре кристаллизации и охлаждается до 32°С. Какая теплота при этом выделяется?
На дополнительную оценку
4. Воду объёмом 750 см3 с начальной температурой 12 °С переводят в твёрдое состояние. Конечная температура -5 °С. На сколько при этом изменилась внутренняя энергия?
5. В железной коробке массой 300 г расплавлено 100 г олова. Какое количество теплоты затрачено на этот процесс, если начальная температура была равна 32 °С?
6. В банке находится 1 л горячей воды при температуре 80 °С. Какой станет температура воды, если в неё бросить 100 г льда, имеющего температуру 0 °С?
№ 1: 2 балла № 2: 3 балла № 3-4: 4 балла
5–7 баллов: оценка «3» 8–10 баллов: оценка «4» 11–13 баллов: оценка «5»
Вариант№9
Обязательная часть
1. В
стакане находятся вода и кусочки льда при 0 °С. Какой процесс
будет происходить – плавление или кристаллизация?
В
стакане находятся вода и кусочки льда при 0 °С. Какой процесс
будет происходить – плавление или кристаллизация?
2. Постройте график зависимости температуры от времени для процесса: медь нагревают от 0 °С и расплавляют
3. Алюминий массой 2 т нагревают от 58 °С и расплавляют. Какое при этом количество теплоты было сообщено алюминию?
4. Вода массой 4 кг замерзает при 0 °С и далее охлаждается до -20 °С. Сколько энергии при этом выделится?
На дополнительную оценку
1. Воду объёмом 750 см3 с начальной температурой 12 °С переводят в твёрдое состояние. Конечная температура -5 °С. На сколько при этом изменилась внутренняя энергия?
2. В железной коробке массой 300 г расплавлено 100 г олова. Какое количество теплоты затрачено на этот процесс, если начальная температура была равна 32 °С?
3. В банке находится 1 л горячей воды при температуре 80 °С. Какой станет температура воды, если в неё бросить 100 г льда, имеющего температуру 0 °С?
№ 1: 2 балла № 2: 3 балла № 3-4: 4 балла
5–7 баллов: оценка «3» 8–10 баллов: оценка «4» 11–13 баллов: оценка «5»
Вариант№10
Обязательная часть
1. Можно
ли ртутным термометром измерить температуру спирта, находящегося в твёрдом
состоянии?
Можно
ли ртутным термометром измерить температуру спирта, находящегося в твёрдом
состоянии?
2. Постройте график зависимости температуры от времени для процесса: ртуть охлаждается от 20 °С и кристаллизуется.
3. Какую энергию надо затратить для расплавления льда массой 5 кг при 0°С и последующего нагревания полученной воды до 70°С?
4. Цинк массой 2 т отвердевает при температуре кристаллизации и охлаждается до 20 °С. Какая теплота при этом выделится?
На дополнительную оценку
1. Воду объёмом 750 см3 с начальной температурой 12 °С переводят в твёрдое состояние. Конечная температура -5 °С. На сколько при этом изменилась внутренняя энергия?
2. В железной коробке массой 300 г расплавлено 100 г олова. Какое количество теплоты затрачено на этот процесс, если начальная температура была равна 32 °С?
3. В банке находится 1 л горячей воды при температуре 80 °С. Какой станет температура воды, если в неё бросить 100 г льда, имеющего температуру 0 °С?
№ 1: 2 балла № 2: 3 балла № 3-4: 4 балла
5–7 баллов: оценка «3» 8–10 баллов: оценка «4» 11–13 баллов: оценка «5»
Температура плавления меди и ее сплавов, график, характеристики.
 Как расплавить в домашних условиях
Как расплавить в домашних условияхБлагодаря тому, что температура плавления меди достаточно невысокая, этот металл стал одним из первых, которые древние люди начали использовать для изготовления различных инструментов, посуды, украшений и оружия. Самородки меди или медную руду можно было расплавить на костре, что, собственно, и делали наши далекие предки.
Этап плавления меди
Несмотря на активное применение человечеством с древних времен, медь не является самым распространенным природным металлом. В этом отношении она значительно уступает остальным элементам и занимает в их ряду только 23-е место.
Нахождение в природе
Самородная медь
Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде. Самый большой самородок был найден в Северной Америке, а его вес составлял 420 тонн [2]. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Читинской области, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии.
Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Читинской области, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии.
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,4 до 1,0 %.
Описание элемента и распространение его в природе
Медь на Кипре добывали и плавили еще в середине третьего тысячелетия до нашей эры. Поэтому свое название элемент носит в честь упомянутого острова. Добыча и производство элемента подействовали на историю развития острова и его экономическое положение.
В периодической системе Менделеева медь получила 29 атомный номер. Элемент расположен в одиннадцатой группе четвертого периода. Элемент имеет золотисто-розовый цвет и принадлежит к пластичным переходным металлам. В природе встречается продукт в виде сульфидных руд, по распространению в литосфере металл занимает 23-е место.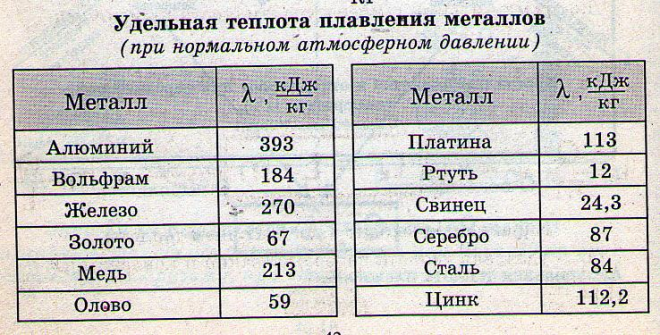 Медный блеск и колчедан являются самыми распространенными видами элемента.
Медный блеск и колчедан являются самыми распространенными видами элемента.
В природных условиях элемент медь находят в руде и в виде самородков. Самые лучшие месторождения находятся на территории государства Чили. Медные месторождения встречаются там в осадочных породах. Медные песчаники и сланцы находятся в Казахстане и Читинской области России.
Медные сланцы в Казахстане
Медь наделена высокой электро и теплопроводностью. Ее удельная теплоемкость при температуре +20ºС равна 390 Дж/кг. Температура кипения металла – 2595ºС.
В момент плавления металл меняет свое агрегатное состояние, т. е. из кристаллической твердой фазы он переходит в жидкую форму. Меди присуще своя температура плавления, она имеет определенную зависимость от находящихся в металле примесей. Плавка меди чаще всего проходит при температуре +1083ºС. Если в медном сплаве присутствует олово, то процесс плавления способен произойти при +950–1140ºС. В составе с цинком теплота плавления меди равна от +900 до +1050ºС.
Процесс плавки проходит следующим образом: в начале нагрева рушится кристаллическая решетка металла, постепенно температура увеличивается, но в определенный период она удерживается в некотором значении. Именно в этот промежуток медь начинает плавиться. После окончания выплавки температура вновь повышается. Далее, металл постепенно охлаждается и принимает твердую форму.
Кипение металла очень похоже на бурление жидкости при активном нагреве. В это время выделяется газ. На поверхности расплавленного продукта появляются пузырьки. При максимальном нагреве из жидкого металла выделяется углерод, он формируется в результате окисления элемента.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра). Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два варианта распада с различными продуктами.
Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два варианта распада с различными продуктами.
Существует ряд сплавов меди: латунь — сплав меди с цинком, бронза — сплав меди с оловом, мельхиор — сплав меди и никеля, и некоторые другие.
Купрум: характеристика элемента
Научное наименование меди Cuprum (Купрум) происходит от названия греческого острова Кипр, где медь начали добывать ещё в середине третьего тысячелетия до нашей эры. В периодической таблице Менделеева химический элемент медь имеет 29 атомный (порядковый) номер, находится в 11 группе четвёртого периода. Принадлежит к пластичным переходным металлам. В чистом виде имеет характерный золотисто-розовый цвет. Чистую медь легко окислить, поэтому в естественных условиях она всегда образует на своей поверхности тонкую оксидную плёнку, которая придаёт ей красноватый оттенок.
Физические свойства
Это второй металл после серебра по уровню электропроводности, что делает её крайне востребованной в современной электронике. Второе ценное качество — высокая теплопроводность, это позволяет её широко применять во всевозможных теплообменниках и в холодильной аппаратуре.
Второе ценное качество — высокая теплопроводность, это позволяет её широко применять во всевозможных теплообменниках и в холодильной аппаратуре.
- Температура плавления 1083 градуса.
- Температура кипения 2567 градусов.
- Удельное сопротивление при 20 градусах составляет 1,68·10 -3 Ом·м.
- Плотность 8,92 г/см.
Сплавы меди
Сплавы, повышающие прочность и другие свойства меди, получают введением в нее добавок, таких, как цинк, олово, кремний, свинец, алюминий, марганец, никель. На сплавы идет более 30% меди.
Латуни – сплавы меди с цинком ( меди от 60 до 90% и цинка от 40 до 10%) – прочнее меди и менее подвержены окислению. При присадке к латуни кремния и свинца повышаются ее антифрикционные качества, при присадке олова, алюминия, марганца и никеля возрастает антикоррозийная стойкость. Листы, литые изделия используются в машиностроении, особенно в химическом, в оптике и приборостроении, в производстве сеток для целлюлознобумажной промышленности.
Бронзы. Раньше бронзами называли сплавы меди (80-94%) и олова (20-6%). В настоящее время производят безоловянные бронзы, именуемые по главному вслед за медью компоненту.
- Алюминиевые бронзы содержат 5-11% алюминия, обладают высокими механическими свойствами в сочетании с антикоррозийной стойкостью.
- Свинцовые бронзы, содержащие 25-33% свинца, используют главным образом для изготовления подшипников, работающих при высоких давлениях и больших скоростях скольжения.
- Кремниевые бронзы, содержащие 4-5% кремния, применяют как дешевые заменители оловянных бронз.
- Бериллиевые бронзы, содержащие 1,8-2,3% бериллия, отличаются твердостью после закалки и высокой упругостью. Их применяют для изготовления пружин и пружинящих изделий.
- Кадмиевые бронзы – сплавы меди с небольшим количества кадмия (до1%) – используют при производстве троллейных проводов, для изготовления арматуры водопроводных и газовых линий и в машиностроении.
Припои – сплавы цветных металлов, применяемые при пайке для получения монолитного паяного шва.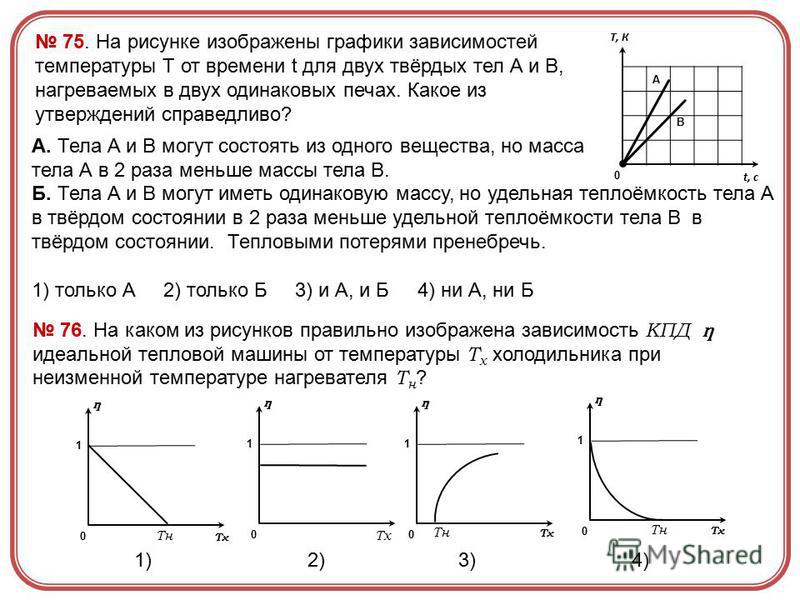 Среди твердых припоев известен медносеребряный сплав (44,5-45,5% Ag; 29-31% Cu; остальное – цинк).
Среди твердых припоев известен медносеребряный сплав (44,5-45,5% Ag; 29-31% Cu; остальное – цинк).
Бронза
Бронза
Цветной металл для изготовки изделий разных типов начали использовать с древних времен. Данный факт подтверждается найденными материалами при археологических раскопках. Состав бронзы изначально был богат оловом.
Промышленностью выпускается различное количество разновидностей бронзы. Опытный мастер способен по цвету металла определить его предназначение. Однако не каждому под силу определить точную марку бронзы, для этого используется маркировка. Способы производства бронзы подразделяются на литейные, когда происходит плавление и отлив и деформируемые.
Состав металла зависит от предназначения к использованию. Основным показателем является наличие бериллия. Повышенная концентрация элемента в сплаве, подвергнутая процедуре закаливания, может соперничать с высокопрочными сталями. Наличие в составе олова отнимает у металла гибкость и пластичность.
Производство бронзовых сплавов изменилось с древних времен фактически внедрением современного оборудования. Технология с использованием в качестве флюса в виде древесного угля используется до сих пор. Последовательность получения бронзы:
- печь разогревается для требуемой температуры, после этого в нее устанавливается тигель;
- после плавки металл может окислится, во избежание этого добавляют флюс в качестве древесного угля;
- кислотным катализатором служит фосфорная медь, добавление происходит после полного прогрева сплава.
Плавка бронзы
Старинные изделия из бронзы подвержены естественным процессам – патинирование. Зеленоватый цвет с белым оттенком проявляется из-за образования пленки, обволакивающей изделие. Искусственные методы патинирования включают в себя методы с использованием серы и параллельным нагреванием до определенной температуры.
Латунь
Латунь
Сплав на основе меди с добавлением цинка называется латунь. В некоторых ситуациях добавляется олово в меньших пропорциях. Джеймс Эмерсон в 1781 году решил запатентовать комбинацию. Содержание цинка в сплаве может варьироваться от 5 до 45%. Латуни различают в зависимости от предназначения и спецификации:
В некоторых ситуациях добавляется олово в меньших пропорциях. Джеймс Эмерсон в 1781 году решил запатентовать комбинацию. Содержание цинка в сплаве может варьироваться от 5 до 45%. Латуни различают в зависимости от предназначения и спецификации:
- простые, состоящие из двух компонентов – меди и цинка. Маркировка таких сплавов обозначается буквой «Л», напрямую значащая содержание меди в сплаве в процентах;
- многокомпонентные латуни – содержат множество других металлов в зависимости от назначения к использованию. Такие сплавы повышают эксплуатационные свойства изделий, обозначаются также буквой «Л», но с прибавлением цифр.
Физические свойства латуни относительно высокие, коррозийная стойкость на среднем уровне. Большинство сплавов не критично к пониженным температурам, возможно эксплуатировать металл в различных условиях. Технологии получения латуни взаимодействует с процессами медной и цинковой промышленности, обработке вторичного сырья. Эффективным способом плавки является использование электропечи индукционного типа с магнитным отводом и регулировкой температуры. После получения однородной массы, она разливается в формы и подвергается процессам деформации.
После получения однородной массы, она разливается в формы и подвергается процессам деформации.
Плавка латуни
Применение материала в различных отраслях, повышает на него спрос с каждым годом. Сплав применяется в суд строительстве и производстве боеприпасов, различных втулок, переходников, болтов, гаек и сантехнических материалов.
Каким образом наши предки плавили медь
Это древнейший металл, который освоили люди. Удивительная пластичность стала ее главным достоинством. Именно благодаря ему даже при наличии примитивных орудий труда можно обрабатывать металл, изготавливая из него предметы обихода и разнообразные орудия труда.
Обрабатывать первый металл наши предки научились примерно в 4 тысячелетии до нашей эры. Находя необычные по цвету булыжники, люди пытались обрабатывать их, привычно ударяя тяжелыми камнями. Однако самородки не раскалывались, а лишь деформировались. Таким образом первобытные мастера получили возможность изготовить первые орудия труда.
Этим и был обусловлен переход от каменного века к медному. На изготовление металлического оружия уходило не больше сил, чем на каменное. Зато оно служило значительно дольше, а при повреждении медный топор или нож можно было отремонтировать – каменные аналоги приходилось делать заново.
При скольких градусах плавится медь? На сегодняшний день эта температура не кажется специалистам большой – всего 1083 градуса по Цельсию.
Однако для древних металлургов она была недостижимой, так что плавить материал для полноценной обработки научились значительно позже – только в 3 тысячелетии до нашей эры, когда появились необходимые технологии. Однако и до этого во многих поселениях мастера нагревали медные самородки на кострах, замечая, что горячий металл поддается обработке значительно легче.
Соединения меди
Оксид меди (I) Cu2O3 и закись меди (I) Cu2O, как и другие соединения меди (I) менее устойчивы, чем соединения меди (II). Оксид меди (I), или закись меди Cu2O в природе встречается в виде минерала куприта. Кроме того, она может быть получена в виде осадка красного оксида меди (I) в результате нагревания раствора соли меди (II) и щелочи в присутствии сильного восстановителя.
Оксид меди (I), или закись меди Cu2O в природе встречается в виде минерала куприта. Кроме того, она может быть получена в виде осадка красного оксида меди (I) в результате нагревания раствора соли меди (II) и щелочи в присутствии сильного восстановителя.
Оксид меди (II), или окись меди, CuO – черное вещество, встречающееся в природе (например в виде минерала тенерита). Его получают прокаливанием гидроксокарбоната меди (II) (CuOH)2CO3 или нитрата меди (II) Cu(NO2)2. Оксид меди (II) хороший осислитель.
Гидроксид меди (II) Cu(OH)2 осаждается из растворов солей меди (II) при действии щелочей в виде голубой студенистой массы. Уже при слабом нагревании даже под водой он разлагается, превращаясь в черный оксид меди (II). Гидроксид меди (II) – очень слабое основание. Поэтому растворы солей меди (II) в большинстве случаев имеют кислую реакцию, а со слабыми кислотами медь образует основные соли.
Сульфат меди (II) CuSO4 в безводном состоянии представляет собой белый порошок, который при поглощении воды синеет. Поэтому он применяется для обнаружения следов влаги в органических жидкостях. Водный раствор сульфата меди имеет характерный сине-голубой цвет. Эта окраска свойственна гидратированным ионам [Cu(h3O)4]2+, поэтому такую же окраску имеют все разбавленные растворы солей меди (II), если только они не содердат каких-либо окрашенных анионов. Из водных растворов сульфат меди кристаллизуется с пятью молекулами воды, образуя прозрачные синие кристаллы медного купороса. Медный купорос применяется для электролитического покрытия металлов медью, для приготовления минеральных красок, а также в качестве исходного вещества при получении других соединений меди. В сельском хозяйстве разбавленный раствор медного купороса применяется для опрыскивания растений и протравливания зерна перед посевом, чтобы уничтожить споры вредных грибков.
Поэтому он применяется для обнаружения следов влаги в органических жидкостях. Водный раствор сульфата меди имеет характерный сине-голубой цвет. Эта окраска свойственна гидратированным ионам [Cu(h3O)4]2+, поэтому такую же окраску имеют все разбавленные растворы солей меди (II), если только они не содердат каких-либо окрашенных анионов. Из водных растворов сульфат меди кристаллизуется с пятью молекулами воды, образуя прозрачные синие кристаллы медного купороса. Медный купорос применяется для электролитического покрытия металлов медью, для приготовления минеральных красок, а также в качестве исходного вещества при получении других соединений меди. В сельском хозяйстве разбавленный раствор медного купороса применяется для опрыскивания растений и протравливания зерна перед посевом, чтобы уничтожить споры вредных грибков.
Хлорид меди (II) CuCl2. 2h3O. Образует темно-зеленые кристаллы, легко растворимые в воде. Очень концентрированные растворы хлорида меди (II) имеют зеленый цвет, разбавленные – сине-голубой. Применяется для получения хлорида меди (II), для приготовления синих и зеленых минеральных красок, а также в пиротехнике.
Применяется для получения хлорида меди (II), для приготовления синих и зеленых минеральных красок, а также в пиротехнике.
Ацетат меди (II) Cu (Ch4COO)2.h3O. Получается обработкой металлической меди или оксида меди (II) уксусной кислотой. Обычно представляет собой смесь основных солей различного состава и цвета (зеленого и сине-зеленого). Под названием ярь-медянка применяется для приготовления масляной краски.
Комплексные соединения меди образуются в результате соединения двухзарядных ионов меди с молекулами аммиака. Из солей меди получают разноообразные минеральные краски. Все соли меди ядовиты. Поэтому, чтобы избежать образования медных солей, медную посуду покрывают изнутри слоем олова (лудят).
Соединения
Медный купорос
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu+ и намного более стабильную Cu2+, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11h21)23-, полученных в 1994 году.
Последняя встречается в солях купраборанового аниона Cu(B11h21)23-, полученных в 1994 году.
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5h3O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Способы получения меди
В природе медь существует в соединениях и в виде самородков. Соединения представлены оксидами, гидрокарбонатами, сернистыми и углекислыми комплексами, а также сульфидными рудами. Самые распространённые руды – это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
Самые распространённые руды – это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
1. Пирометаллургический способ включает в себя такие процессы: обогащение и обжиг, плавка на штейн, продувка в конвертере, электролитическое рафинирование. Обогащают медные руды методом флотации и окислительного обжига. Сущность метода флотации заключается в следующем: частицы меди, взвешенные в водной среде, прилипают к поверхности пузырьков воздуха и поднимаются на поверхность. Метод позволяет получить медный порошкообразный концентрат, который содержит 10-35% меди.
Окислительному обжигу подлежат медные руды и концентраты со значительным содержанием серы. При нагреве в присутствии кислорода происходит окисление сульфидов, и количество серы снижается почти в два раза. Обжигу подвергаются бедные концентраты, в которых содержится 8-25% меди. Богатые концентраты, содержащие 25-35% меди, плавят, не прибегая к обжигу.
Следующий этап пирометаллургического способа получения меди – это плавка на штейн. Если в качестве сырья используется кусковая медная руда с большим количеством серы, то плавку проводят в шахтных печах. А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.
В горизонтальных конвертерах с боковым дутьём медный штейн продувается сжатым воздухом для того, чтобы произошли процессы окисления сульфидов и феррума. Далее образовавшиеся окислы переводят в шлак, а серу в оксид. В конвертере образуется черновая медь, которая содержит 98,4-99,4% меди, железо, серу, а также незначительное количество никеля, олова, серебра и золота.
Черновая медь подлежит огневому, а далее электролитическому рафинированию. Примеси удаляют с газами и переводят в шлак. В результате огневого рафинирования образуется медь с чистотой до 99,5%. А после электролитического рафинирования чистота составляет 99,95%.
2. Гидрометаллургический способ заключается в выщелачивании меди слабым раствором серной кислоты, а затем выделении металлической меди непосредственно из раствора. Такой способ применяется для переработки бедных руд и не допускает попутного извлечения драгоценных металлов вместе с медью.
Такой способ применяется для переработки бедных руд и не допускает попутного извлечения драгоценных металлов вместе с медью.
Методы добычи
Медь добывают открытым и закрытым способом. Первый актуален, если руда находится в толще до 500 метров. Для более глубоких залежей строят специальные подземные шахты. Чистую медь получают в основном пирометаллургическим способом, реже – гидрометаллургическим.
Пирометаллургическая методика условно подразделяется на два этапа, и в качестве исходного сырья использует халькопирит (медный купорос). Первая стадия – флотация или окислительный обжиг. Целью этой технологии является обогащение медной руды, в которой повышена концентрация серы. В процессе обработки, сера удаляется до 1%, другие содержащиеся в руде металлы переводятся в оксидные соединения.
Химические формулы процесса:
- ZnS + 1.5O2 = ZnO + SO2 + Q – реакция протекает при температуре, превышающей +800 градусов;
- ZnS + 2O2 = ZnSO2 + Q – оптимальная температура варьируется в пределах +600/+700 градусов.

После этого, обогащённая руда плавится в шахтных печах при температуре + 14 500 градусов, преобразуясь в сплав, состоящий из сульфидов железа и меди (штейн). Чтобы повысить качество, проводится конвертерный обдув без подачи топлива. Содержание меди в таком сплаве составляет примерно 91%. Вторая стадия – рафинирование, после чего медная составляющая увеличивается до 99.9%.
Гидрометаллургический способ основывается на выщелачивании. Для этого руду дробят на небольшие куски, и заливают растворителями:
- Nh5OH;
- h3SO4;
- Fe (SO4).
В результате получается раствор, в котором выделяется медь и другие металлы. Формулы процесса:
- CuO+h3SO4>CuSO4+h3O – выщелачивание серной кислотой;
- CuSO4+2Fe2SO4>4FeSO4+2CuSO+S – применение сульфата железа;
- Cu2S + 2 Fe2 (SО4)3>2 СuSO4 + 4 FeSO4 + S – выщелачивание сернокислым железом.
Полученный раствор проходит последующую обработку для извлечения металла. Например, может использоваться методика цементации: CuSО4 + Fe>FeSО4 + Cu.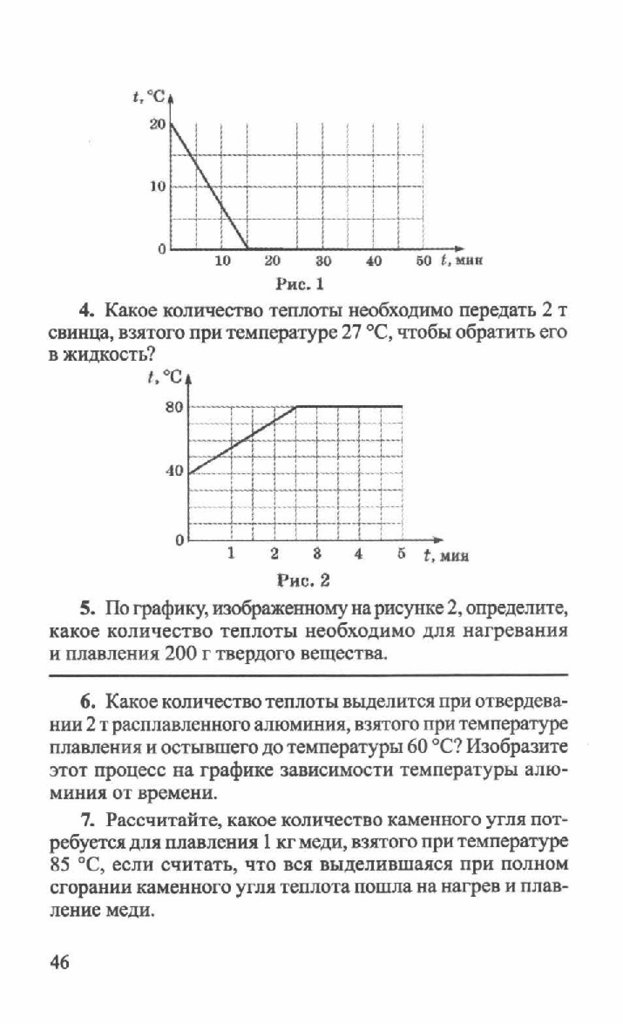 Здесь в состав добавляются куски железа, заменяющие медную составляющую в сернокислых солях.
Здесь в состав добавляются куски железа, заменяющие медную составляющую в сернокислых солях.
Применение меди
Благодаря ценным качествам медь и медные сплавы используются в электротехнической и электромашиностроительной отрасли, в радиоэлектронике и приборостроении. Существуют сплавы меди с такими металлами, как цинк, олово, алюминий, никель, титан, серебро, золото. Реже применяются сплавы с неметаллами: фосфором, серой, кислородом. Выделяют две группы медных сплавов: латуни (сплавы с цинком) и бронзы (сплавы с другими элементами).
Медь обладает высокой экологичностью, что допускает её использование в строительстве жилых домов. К примеру, медная кровля за счёт антикоррозионных свойств, может прослужить больше ста лет без специального ухода и покраски.
Медь в сплавах с золотом используется в ювелирном деле. Такой сплав увеличивает прочность изделия, повышает стойкость к деформированию и истиранию.
Для соединений меди характерна высокая биологическая активность. В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В медицине медь используют, как антисептическое и вяжущее средство. Она является компонентом глазных капель от конъюнктивита и растворов от ожогов.
Температура плавления меди
При нормальных условиях температура плавления меди составляет 1083 градусов по шкале Цельсия. А во время нагрева происходит ряд превращений на молекулярном уровне, что приводит к изменению свойств вещества. Чтобы разобраться во всех этих изменениях, нужно рассмотреть основные этапы нагрева и расплавления медного слитка. Примерный график плавления меди выглядит так:
Примерный график плавления меди выглядит так:
- В нормальном состоянии при температуре от 0 до 100 градусов внутри меди образуется прочная кристаллическая решетка, которая обеспечивает материалу большую устойчивость, упругость, химическую инертность. Решетка является достаточно прочной, однако в случае сильной деформации может происходить пространственное изменение положения атомов в решетке. Этим объясняется ковкость и пластичность медных изделий, которые могут сгибаться и деформироваться (скажем, при кузнечной обработке или в случае пресса).
- В нормальном состоянии при температуре от 0 до 100 градусов на поверхности медного изделия также образуется тонкая оксидная пленка. Наличие такой пленки является большим плюсом для изделия, поскольку она выполняет множество важных функций — минимизирует контакт с внешними веществами, защищает материал от коррозии, немного увеличивает прочность. В случае охлаждения материала ниже температуры 0 градусов сама медь сохраняет все свои физические свойства.
 Однако оксидная пленка при охлаждении становится менее упругой и плотной, изделие становится менее твердым (хотя с практической точки зрения это снижение прочности практически незаметно).
Однако оксидная пленка при охлаждении становится менее упругой и плотной, изделие становится менее твердым (хотя с практической точки зрения это снижение прочности практически незаметно). - При нагреве материала выше температуры 100 градусов происходит постепенная деструкция оксидной пленки на поверхности металла. Это повышает химическую активность материала, что делает его восприимчивым к воздействию веществ во внешней среде. Одновременно с этим при нагреве происходит насыщение энергией атомов меди, что делает материал более пластичным. По этой причине ковку медных изделий выполняют именно после нагрева, поскольку без нагрева для изменения формы изделия понадобится большое количество физических усилий (это может быть мускульная сила кузнеца, расходы электроэнергии для запуска электрического пресса и так далее).
- При достижении температуры 1083 градусов кристаллическая медная решетка начинается постепенно разрушаться, что превращает твердую медь в жидкую. На физическом уровне происходит следующее — из-за избытка энергии атомы начинают двигаться в кристаллической решетке более интенсивно и хаотично, что приводит к частому столкновению атомов между собой.
 В конечном счете это разрушает решетку, хотя за счет взаимного столкновения и притяжения атомы не разлетаются в разные стороны. На физическом уровне такая структура материала соответствует жидкости (то есть такому состоянию вещества, при котором атомы находятся в относительно свободном движении, но не разлетаются в разные стороны подобно газу).
В конечном счете это разрушает решетку, хотя за счет взаимного столкновения и притяжения атомы не разлетаются в разные стороны. На физическом уровне такая структура материала соответствует жидкости (то есть такому состоянию вещества, при котором атомы находятся в относительно свободном движении, но не разлетаются в разные стороны подобно газу). - При остывании медной жидкости ниже температуры 1083 градусов происходит постепенная кристаллизация вещества. Медь вновь обретает твердую форму (чем ниже температура, тем интенсивней происходит затвердение вещества). Однако при необходимости жидкую медь можно и дальше нагревать (на химическом уровне будет происходить дальнейшее насыщение атомов энергией). При достижении температуры 2595 градусов по Цельсию жидкость начнет закипать, а медь начнет принимать газообразную форму. На практике длительное удержание вещества в газообразной форме проблематично — при контакте с атмосферным воздухом вещество будет быстро остывать, обратно превращаясь в жидкость.
 Чтобы обойти это ограничение, используются разные технологии. Оптимальная — нагрев вещества в тугоплавкой камере с поддержанием стабильной температуры выше критической точки (то есть выше температуры 2595 градусов). В таком случае температура среды будет высокой, а остывание вещества происходить не будет.
Чтобы обойти это ограничение, используются разные технологии. Оптимальная — нагрев вещества в тугоплавкой камере с поддержанием стабильной температуры выше критической точки (то есть выше температуры 2595 градусов). В таком случае температура среды будет высокой, а остывание вещества происходить не будет.
Чтобы расплавить/испарить медное изделие с помощью высокоточного нагревательного прибора, нагревать рекомендуется до чуть более высокой температуры. Скажем, в случае расплавления нагревать изделие следует до температуры 1100-1200 градусов (а не 1083 градусов). С практической точки зрения объясняется это просто — нагрев вещества происходит неравномерно, поэтому некоторые фрагменты медного изделия будут долго держать свою форму, тогда как другие — быстро расплавятся. К тому же вещество будет постоянно остывать, что может привести к кристаллизации отдельных фрагментов расплава.
вторник, 1 ноября 2021 г.
Начертите график плавления меди
Начертите график плавления меди. По ветикали отложите температуру (1 клетка 20 градусов цельсия), по горизонтали – время ( 1 клетка 10 мин ). Начальная температура меди равна 1000 градусов, время нагревания до температуры плавления 20 мин, время перехода меди в жидкое состояние 30 мин.
По ветикали отложите температуру (1 клетка 20 градусов цельсия), по горизонтали – время ( 1 клетка 10 мин ). Начальная температура меди равна 1000 градусов, время нагревания до температуры плавления 20 мин, время перехода меди в жидкое состояние 30 мин.
Температура плавления меди 1085 градусов Цельсия. Сначала в течение 20 минут температура меди будет расти от 1000 градусов до 1085 градусов, потом температура будет оставаться постоянной до окончания плавления, потом снова будет расти. Чтобы определиться со скоростью нарастания температуры во время нагрева, надо разделить разность температуры плавления и начальной температуры на время разогрева до температуры плавления. Таким образом, первый участок графика буде представлять собой линию графика T =1000+4,25t, где T – температура, t – время.
Плавление сплавов на основе меди
На практике медь используют не только в качестве чистого вещества, но и в виде различных сплавов. Примеры таких сплавов — бронза, латунь, мельхиор и другие. Так как сплавы являются многокомпонентными веществами, то их плавление происходит по другому принципу. Рассмотрим примерный алгоритм плавления медных сплавов на примере латуни:
Так как сплавы являются многокомпонентными веществами, то их плавление происходит по другому принципу. Рассмотрим примерный алгоритм плавления медных сплавов на примере латуни:
- При температуре до 100 градусов Цельсия кристаллическая решетка является устойчивой и однородной. В случае удара происходит деформация материала. На поверхности материала имеется тонкая оксидная пленка, которая защищает изделие от воздействия воды, атмосферного воздуха, химически активных веществ.
- При нагреве латуни до 100 градусов внешняя пленка постепенно плавится, что делает вещество менее прочным. Также из-за повреждения защитной пленки увеличивается химическая активность материала (то есть он начинает более активно вступать в реакцию с водой, воздухом, химическими веществами). Кристаллическая решетка устойчива к небольшому нагреву, поэтому материал сохраняет свою форму.
- Температура 880 градусов — это точка солидуса. При достижении этой температуры начинается расплавление самых легкоплавких элементов, входящих в состав сплава.
 Это приводит к частичному переходу твердого вещества в жидкость. На химическом уровне при достижении точки солидуса происходит частичное разрушение кристаллической решетки вещества, однако у более тугоплавких фракций решетка сохраняется.
Это приводит к частичному переходу твердого вещества в жидкость. На химическом уровне при достижении точки солидуса происходит частичное разрушение кристаллической решетки вещества, однако у более тугоплавких фракций решетка сохраняется. - Температура 950 градусов — это точка ликвидуса. При достижении этой отметки плавятся самые тугоплавкие фракции, которые сохраняют свою твердость при более низких температурах. В результате на химическом уровне материал полностью становится жидким, поскольку полностью разрушается кристаллическая решетка у всех компонентов, входящих в состав латуни.
График температуры плавления металла в зависимости от давления
При какой температуре плавится медь
Плавления происходит, когда из твердого состояния металл переходит в жидкое. Каждый элемент имеет собственную температуру плавления. Многое зависит от примесей в металле. Обычная температура плавления меди — 1083 ° C. Когда добавляется олово, температура снижается до 930- 1140 ° C. Температура плавления зависит здесь от содержания в сплаве олова. В сплаве купрума с цинком плавление происходит при 900- 1050 ° C .
Температура плавления зависит здесь от содержания в сплаве олова. В сплаве купрума с цинком плавление происходит при 900- 1050 ° C .
При нагреве любого металла разрушается его кристаллическая решетка. По мере нагревания повышается температура плавления, но затем выравнивается по достижении определенного предела температуры. В этот момент и плавится металла. Полностью расплавляется, и температура повышается снова.
Когда металл охлаждается, температура снижается, в определенный момент остается на прежнем уровне, пока металл не затвердеет полностью. После полного затвердевания температура снижается опять. Это демонстрирует фазовая диаграмма, где отображен температурный процесс с начала плавления до затвердения. При нагревании разогретая медь при 2560 ° C начинает закипать. Кипение подобно кипению жидких веществ, когда выделяется газ и появляются пузырьки на поверхности. В момент кипения при максимально больших температурах начинается выделение углерода, образующегося при окислении.
Как расплавить медь в домашних условиях?
Обычно медь и сплавы на ее основе плавят в специальных печах, где происходит не только расплавление материала, но и формовка новых деталей. Однако при желании медные изделия можно расплавить и в домашних условиях. Температура плавления меди в домашних условиях будет стандартной — 1083 градусов. Опытные металлурги рекомендуют нагревать вещество с небольшим запасом, чтобы минимизировать теплопотери и не допустить повторной кристаллизации вещества при его охлаждении. Во время домашнего расплавления необходимо соблюдать правила техники безопасности. Ниже мы рассмотрим эти правила, а потом узнаем, как именно нужно проводить домашнюю расплавку медных изделий.
Муфельная печь
Лабораторный муфель – самое удобное устройство для расплавления металла.
Несколько советов, как расплавить медный сплав в лабораторных условиях:
- у муфельной печи есть ручка температурного регулятора, ее нужно поставить на отметку, незначительно превышающую температуру расплавления сплава;
- графитовый или керамический тигель перед загрузкой шихты хорошо прогревают;
- после отливки с горячего тигля проволочным крюком снимают окалину.

Литье в муфеле прогревается равномерно, плавильщик изолирован от летучих вредных компонентов, Через огнеупорное стекло дверцы удобно наблюдать за ходом расплавления меди.
Газовая горелка
Плавка меди в небольших объемах осуществляется ручной газовой горелкой. Мощность портативного устройства большого значения не имеет. Горелку располагают под тиглем, в котором будут плавить медный лом, направляют пламя на донце, языки должны охватывать его полностью. Процесс трудоемкий, длительный. Для защиты от кислорода цветной лом присыпают угольной крошкой.
Горн
Плавят медь в домашних условиях, используя тигельную печь или горн. Он представляет собой ограниченное пространство, куда на подставке помещается тигель. Снизу поджигаются угли или подводится горелка. Необходимо организовать воздухоподдув, чтобы повысить температуру горения топлива. Для ускорения процесса расплавления сверху горн прикрывают плотной крышкой. Хорошо раскаленный древесный уголь разогревают, засыпают в тигель с ломом. Метод используют специалисты, часто занимающиеся литьем в небольших объемах.
Метод используют специалисты, часто занимающиеся литьем в небольших объемах.
Паяльная лампа
Сплав с цинком, оловом плавится при невысокой температуре. В качестве источника энергии для расплавления используют обычную паяльную лампу, ее располагают вертикально под тиглем так, чтобы пламя охватывало поверхность дна и нижнюю часть боковой стенки. Для снижения объема окалины лом присыпают древесным углем. Процесс окисления при расплавлении под слоем угольной крошки будет протекать не так интенсивно.
Микроволновая печь
Плавить медь в домашних условиях можно в микроволновке, из нее достают поворотный механизм. Под размер тигля делают огнеупорный контейнер с крышкой из шамотного кирпича. Сначала в течение 15 минут на максимальном режиме нагревают керамический тигель, он разогревается до желтоватого свечения. Затем в него засыпают подготовленный лом, снова убирают шамотный контейнер в печь, плавить медный лом необходимо 20-30 минут на максимальном режиме, создается температура порядка +1200°С. Затем сплав выливают в заранее подготовленную изложницу или форму.
Затем сплав выливают в заранее подготовленную изложницу или форму.
Для изготовления мелких деталей лучше выбирать многокомпонентные сплавы: латуни, бронзы, они не такие текучие, их проще плавить, не нужны слишком высокие температуры. Когда плавят медь в домашних условиях, соблюдают технику безопасности, предусматривают противопожарные меры.
- Главная
- Технологии
График плавления меди
Расплавление любого металла заключается в том, что под воздействием высоких температур разрушается кристаллическая решётка и металл переходит из твёрдого состояния в жидкое. Можно выделить некоторые закономерности, свойственные любому металлу в процессе расплавления:
- Во время нагревания температура внутри металла повышается, но кристаллическая решётка не подвергается разрушению. Металл сохраняет своё твёрдое состояние.
- При достижении температуры плавления, для меди это 1083 градуса, температура внутри металла перестаёт повышаться, несмотря на то что общий нагрев и передача тепла продолжаются.

- После того как вся масса метала переходит в расплавленное состояние, температура внутри металла снова начинает резко повышаться.
В случае процесса охлаждения расплавленного металла происходит всё то же самое, но в обратной последовательности. Сначала происходит резкое снижение температуры внутри металла, затем на значении 1080 градусов падение температуры прекращается до тех пор, пока вся масса метала не перейдёт в твёрдое состояние. После этого температура снова начинает резко падать, пока не сравняется с температурой окружающего воздуха и кристаллизация не завершится окончательно.
Температура кипения
Медь начинает активно выделять углерод в виде пузырьков газа при температуре 2560 градусов. Внешне это очень напоминает кипение воды. На самом деле это процесс активного окисления меди, в результате которого металл теряет практически все свои уникальные свойства. Детали, отлитые из кипящей меди, имеют в своей структуре большое количество пор, которые будут уменьшать механическую прочность материала и ухудшать его декоративные свойства. Потому в процессе плавки необходимо внимательно следить за температурой и не допускать закипания меди.
Потому в процессе плавки необходимо внимательно следить за температурой и не допускать закипания меди.
Таблицы плавления металлов и сплавов
Ниже, представлены таблицы, для наглядного знакомства с температурами плавления тех или иных металлов и их сплавов.
Таблица температуры плавления легкоплавких металлов и сплавов
Таблица с температурами плавления легкоплавких металлов
| Название | Обозначение | Плавление | Кипение |
| Олово | Sn | 232°C | 2600°C |
| Свинец | Pb | 327°C | 1750°C |
| Цинк | Zn | 420°C | 907°C |
| Калий | K | 63,6°C | 759°C |
| Натрий | Na | 97,8°C | 883°C |
| Ртуть | Hg | -38,9°C | 356.73°C |
| Цезий | Cs | 28,4°C | 667.5°C |
| Висмут | Bi | 271,4°C | 1564°C |
| Полоний | Po | 254°C | 962°C |
| Кадмий | Cd | 321,07°C | 767°C |
| Рубидий | Rb | 39,3°C | 688°C |
| Галлий | Ga | 29,76°C | 2204°C |
| Индий | In | 156,6°C | 2072°C |
| Таллий | Tl | 304°C | 1473°C |
| Литий | Li | 18,05°C | 1342°C |
Powered by Inline
Начертите график плавления меди.
 По вертикали отложите те… -reshimne.ru
По вертикали отложите те… -reshimne.ruНовые вопросы
Ответы
Похожие вопросы
Мельхиоровую и серебрянную вилки одинаковой массы опустили в горячую воду. одинаковое ли количество теплоты они получают от воды?…
ПОМОГИИИТЕ!!! СРООЧНООО!!!Катер плывет против течения реки. Какова скорость катера относительно берега если скорость катера относительно воды 4м/с, а скорость течения реки 3м/с
…
Какую массу должны иметь железные тормоза, чтобы при остановке его при скорости 36км/ч, тормоза нагрелись на 100 градусов. Масса поезда 100 тонн. Пожалуйста, подробно: с Дано, и решением….
Чому горобці узимку виглядають набагато товстушими ніж літом? хоча корму мають набагато меньше. ..
..
Какую горизонтальную скорость необходимо сообщить мячу, чтобы его дальность полета была равна 40 м если высота на которой находится мяч равна 20 м?…
Помогите прошу!! Даю 70 баллов…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Как определить удельную теплоемкость
ChemTeam: как определить удельную теплоемкостьКак определить удельную теплоемкость вещества
Перейти к конкретным проблемам нагрева 1–10
Вернуться в меню термохимии
Пример #1: Мы собираемся определить удельную теплоемкость металлической меди. Сейчас это уже делалось много раз, поэтому значение доступно в справочниках. Мы сделаем вид, что это не так.
Сейчас это уже делалось много раз, поэтому значение доступно в справочниках. Мы сделаем вид, что это не так.
Очевидно, нам нужна чистая медь, поэтому мы берем ее небольшой кусочек. Допустим, мы используем 15,0 грамм. Форма не имеет значения.
Мы помещаем металлическую медь в открытый стакан с кипящей водой и оставляем. Оставляем до тех пор, пока вся медь не станет той же температуры, что и кипящая вода. Мы знаем, что такое температура, не так ли?
Это 100,00 °C.
Теперь неважно, как долго он простоял в кипящей воде, потому что мы предполагаем, что он простоял достаточно долго.
Теперь наступает настоящий ключевой шаг. Как можно быстрее мы вытаскиваем металл из кипящей воды и переносим его в химический стакан, вмещающий 100,0 мл воды гораздо более холодной, скажем, 25,00 °C. Мы знаем это, потому что измеряли температуру термометром.
Горячая медь остывает, а вода нагревается, пока они не достигнут одинаковой конечной температуры. Мы записываем это с помощью термометра и находим, что это 26,02 ° C.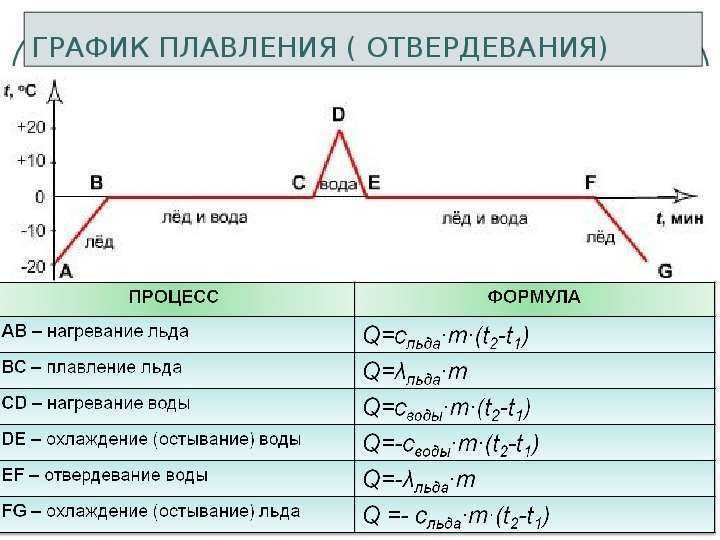 Теперь мы знаем два разных значения Δt. Один из них равен 100,00 минус конечная температура (медь), а другой — конечная температура минус 25,00 (вода).
Теперь мы знаем два разных значения Δt. Один из них равен 100,00 минус конечная температура (медь), а другой — конечная температура минус 25,00 (вода).
На этом этапе мы сделаем ключевое предположение, которое облегчит нашу задачу. То есть предположить, что все тепло, потерянное медью, уходит в воду. На самом деле это не так. В реальном эксперименте теплопередача не будет 100%, и вам придется предпринять шаги, чтобы компенсировать эти потери. Мы будем игнорировать их.
Приведенный выше абзац, сформулированный как термохимическое уравнение, выглядит следующим образом:
q медь = q вода
Подстановкой имеем (значения меди слева, значения воды справа):
(масса) (Δt) (C p ) = (масса) (Δt) (C p )
Расстановка чисел дает нам:
(15,0 г) (73,98 °C) (x) = (100,0 г) (1,02 °C) (4,184 Дж г¯ 1 °C¯ 1 )
Решение дает 0,384 Дж г¯ 1 °C¯ 1
Обратите внимание на довольно небольшой прирост температуры воды (от 25,00 до 26,02) и большое (для сравнения) изменение температуры (от 100 до 26,02) меди. Это типично для проблем такого рода.
Это типично для проблем такого рода.
Обратите внимание, что в приведенном выше расчете используется 100,0 г воды, а выше в тексте указано 100,0 мл воды. Масса присутствующей воды определяется произведением объема на плотность. Поскольку плотность воды составляет 1,00 г мл¯ 1 , расчет будет следующим:
100,0 мл x 1,00 г мл¯ 1
с ответом 100,0 г.
Пример #2: Тот же текст, что и выше, только медь заменена свинцом и использованы другие числа.
Определим удельную теплоемкость металлического свинца. Сейчас это уже делалось много раз, поэтому значение доступно в справочниках. Мы сделаем вид, что это не так.
Очевидно, нам нужен чистый свинец, поэтому мы берем его небольшой кусочек. Допустим, мы используем 490,51 грамма. Форма не имеет значения.
Мы помещаем свинец в открытый стакан с кипящей водой и оставляем его стоять. Мы позволяем ему сидеть, пока весь свинец не станет той же температуры, что и кипящая вода. Мы знаем, что такое температура, не так ли?
Мы знаем, что такое температура, не так ли?
Это 100,00 °C.
Теперь неважно, как долго он простоял в кипящей воде, потому что мы предполагаем, что он простоял достаточно долго.
Теперь наступает настоящий ключевой шаг. Как можно быстрее мы вытаскиваем металл из кипящей воды и переносим его в химический стакан, вмещающий 50,0 мл воды гораздо более холодной, скажем, 24,40 °C. Мы знаем это, потому что измеряли температуру термометром.
Горячий провод остывает, а вода нагревается, пока они не достигнут одинаковой конечной температуры. Мы записываем это с помощью термометра и находим, что это 27,20 ° C. Теперь мы знаем два разных значения Δt. Один из них равен 100,00 минус конечная температура (свинца), а другой — конечная температура минус 24,40 (воды).
На этом этапе мы сделаем ключевое предположение, которое облегчит нашу задачу. То есть предположить, что все тепло, теряемое свинцом, попадает в воду. На самом деле это не так. В реальном эксперименте теплопередача не будет 100%, и вам придется предпринять шаги, чтобы компенсировать эти потери. Мы будем игнорировать их.
Мы будем игнорировать их.
Приведенный выше абзац, сформулированный как термохимическое уравнение, выглядит следующим образом:
q свинец = q вода
Подстановкой имеем (значения свинца слева, значения воды справа):
(масса) (Δt) (C p ) = (масса) (Δt) (C p )
Расстановка чисел дает нам:
(49,51 г) (72,8 °C) (x) = (50,0 г) (2,8 °C) (4,184 Дж г¯ 1 °C¯ 1 )
Решение дает 0,1625 Дж г¯ 1 °С¯ 1 . Следуя правилу округления до пяти, окончательный ответ равен 0,162 Дж г¯ 1 °C¯ 1 .
Обратите внимание на небольшой прирост температуры воды (от 24.40 до 27.20) и очень большое изменение температуры (от 100 до 27.20) свинца. Это типично для проблем такого рода.
Обратите внимание, что в приведенном выше расчете используется 50,0 г воды, а выше в тексте указано 50,0 мл воды.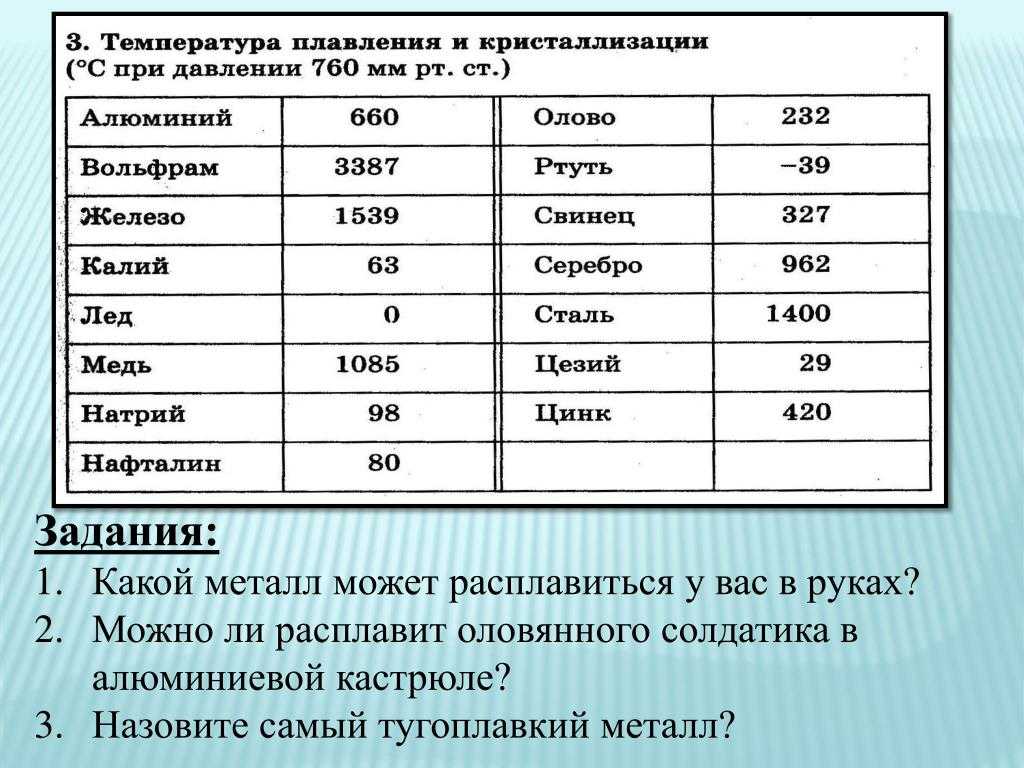 Масса присутствующей воды определяется произведением объема на плотность. Так как плотность воды 1,00 г мл¯ 1 , расчет:
Масса присутствующей воды определяется произведением объема на плотность. Так как плотность воды 1,00 г мл¯ 1 , расчет:
50,0 мл x 1,00 г мл¯ 1
с ответом 50,0 г.
Пример №3: Определим удельную теплоемкость металла по экспериментальным данным. В этом эксперименте мы использовали калориметр «кофейная чашка» и собрали следующие данные:
Масса пустой чашки 2,31 г Масса чашки + вода 180,89 г Масса чашки + вода + металл 780,89 г Начальная температура воды 17,0 °С Начальная температура металла 52,0 °С Конечная температура системы 27,0 °С
Ключевое термохимическое уравнение для решения этой задачи:
q металл = q вода
Тогда путем подстановки имеем (значения металла слева, значения воды справа):
(масса) (Δt) (C p ) = (масса) (Δt) (C p )
Нам нужно работать со значениями из таблицы данных, чтобы получить то, что нам нужно подставить в приведенное выше уравнение.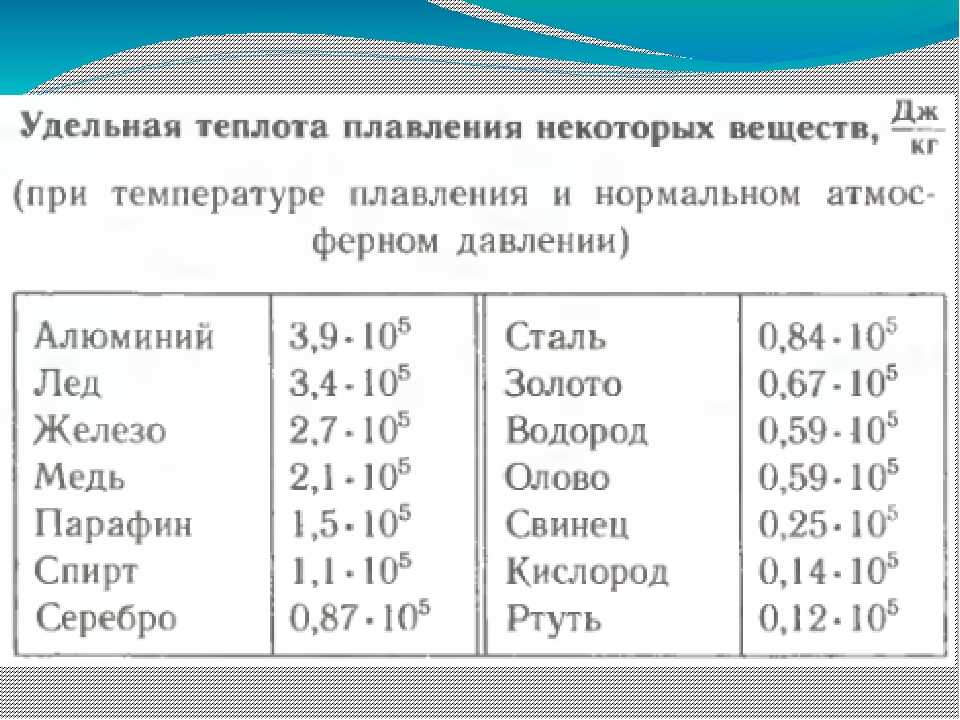
массы воды: 180,98 — 2,31 = 178,58 г.
масса металла: 780,89 — 180,89 = 600,0 г
изменение температуры воды: 27,0 − 17,0 = 10,0 °C
изменение температуры металла: 52,0 − 17,0 = 25,0 °C
Расстановка чисел дает нам:
(600,0 г) (25,0 °С) (х) = (178,58 г) (10,0 °С) (4,184 Дж г¯ 1 °С¯ 1 )
Решение дает 0,498 Дж г¯ 1 °C¯ 1
Обратите внимание на начальную температуру металла (52,0 °C). Это необычное значение, поскольку образец металла обычно нагревают путем погружения в кипящую воду, в результате чего обычная начальная температура металла составляет около 100,0 °C.
Часто в задачах такого рода указывают мл воды, а не граммы. Масса присутствующей воды определяется произведением объема на плотность. Так как плотность воды 1,00 г мл¯ 1 , расчет:
Ваш мл x 1,00 г мл¯ 1
с тем же числовым значением, но с единицей измерения в граммах, а не в миллилитрах.
Пример №4: Кусок металла массой 59,047 г нагрели до 100,0 °С, а затем поместили в 100,0 мл воды (первоначально при 23,7 °С). Металлу и воде давали достичь равновесной температуры, определенной как 27,8°С. Предполагая отсутствие потерь тепла в окружающую среду, вычислить удельную теплоемкость металла.
q металл = q вода(масса) (Δt) (C p ) = (масса) (Δt) (C p )
(59,047 г) (72,2 °C) (x) = (100,0 г) (4,1 °C) (4,184 Дж г¯ 1 °C¯ 1 )
x = 0,402 Дж г¯ 1 °C¯ 1
Пример № 5: Кусок металла весом 25,6 г был взят из стакана с кипящей водой при 100,0 °C и помещен непосредственно в калориметр, содержащий 100,0 мл воды при 25,0 °C. Теплоемкость калориметра 1,23 Дж/К. Учитывая, что конечная температура при тепловом равновесии равна 26,2 °С, определите удельную теплоемкость металла.
Решение:
1) Мы знаем это:
q потеряно, металл = q получено
2) Однако энергию получают два разных объекта (вода и сам калориметр).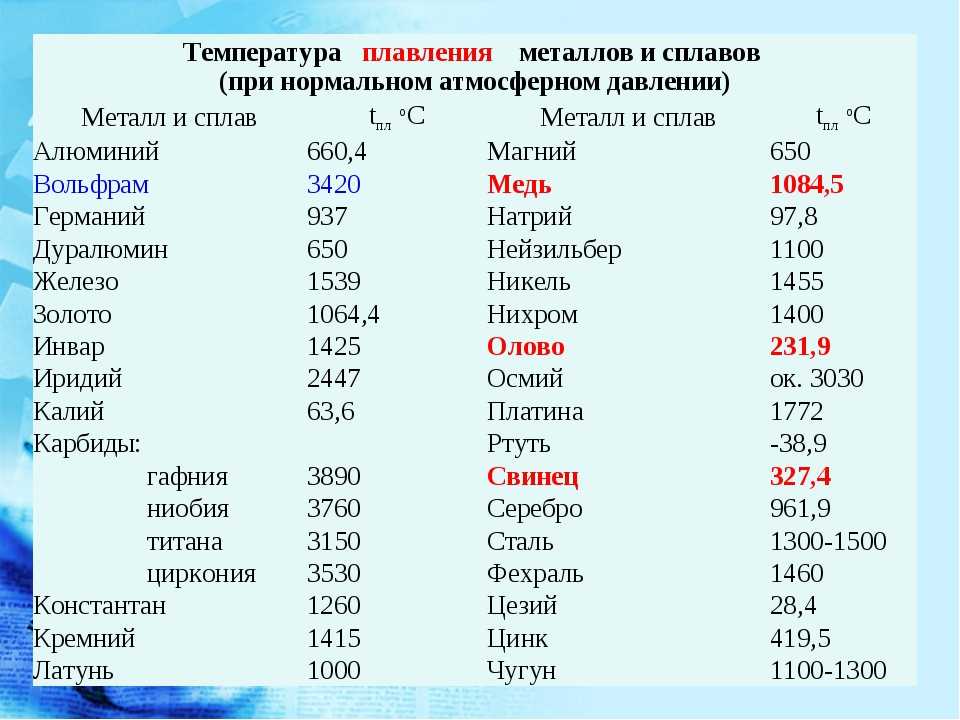 Следовательно:
Следовательно:
q потеряно, металл = q получено, вода + q получено, калориметр
3) Подставляя, имеем:
(масса) (Δt) (C p, металл ) = (масса) (Δt) (C p, вода ) + (Δt воды) (калориметрическая постоянная)
4) Расставить ценности по местам и решить:
(25,6 г) (73,8 °C) (x) = (100,0 г) (1,2 °C) (4,184 Дж/г °C) + (1,2 °C) (1,23 Дж/K)х = 0,266 Дж/г °С
Комментарий № 1: °C и K в этом случае взаимно исключаются, потому что (1) один °C имеет тот же размер, что и один K, и (2) 1,2 °C — это разница температур, а не температура 1,2 °C.
Комментарий № 2: мы можем сделать предварительную идентификацию металла как ниобия на основании его удельной теплоемкости. Глянь сюда.
Пример #6: Когда 12,29 г мелкодисперсной латуни при 95,0 °C быстро перемешивают в 40,00 г воды при 22,0 °C в калориметре, температура воды повышается до 24,0 °C. Найдите удельную теплоемкость латуни.
Найдите удельную теплоемкость латуни.
Решение:
1) Возьмем следующую удельную теплоемкость воды:
4186 Дж кг¯ 1 К¯ 1
2) Определить энергию для нагрева воды:
q = (масса) (изменение температуры) (удельная теплоемкость)q = (0,04000 кг) (2,0 К) (4186 Дж кг¯ 1 К¯ 1 ) = 334,88 Дж
3) Энергия, теряемая латунью при охлаждении, равна количеству энергии, поглощаемой водой:
q = (масса) (изменение температуры) (удельная теплоемкость)334,88 Дж = (0,01229 кг) (71,0 К) (х)
x = 384 Дж кг¯ 1 К¯ 1
или, если хотите, 0,384 Дж г¯ 1 °C¯ 1
Пример #7: Когда 450 г металлической дроби при 100,0 °C быстро высыпают в отверстие в глыбе льда при 0,00 °C, 25,0 г льда плавится. Какова удельная теплоемкость металла?
Решение:
Поскольку лед остается, жидкая вода остается при 0,00 °C.(25,0 г) (334,166 Дж/г) = 8354,15 Дж (количество тепла, теряемое металлической дробью)
q = (масса) (Δt) (удельная теплоёмкость)
8354,15 Дж = (450, г) (100,0 °C) (C p )
C p = 0,186 Дж/г¯ 1 °C¯ 1 (до трех знаков фиг.)
Перейти к конкретным проблемам нагрева 1–10
Вернуться в меню термохимии
В этом 20-минутном задании учащиеся исследуют, какой металл будет лучше сделать дно кастрюли. При проектировании и При проведении своих исследований учащиеся используют имитацию калориметра для проверить удельную теплоемкость двух металлов, которые могут быть использованы для дно кастрюли. Ниже приведены вопросы, ваши ответы и критерии оценки для каждого из вопросов в этом задании. Используйте навигацию слева, чтобы вернуться к просмотру сайта или выполнить другую задачу. Слева приведен график, показывающий результаты, когда 250-граммовый блок меди при температуре 60,0 градусов Цельсия был помещен в 250 г воды при температуре 20,0 градусов Цельсия. Судя по данным, что случилось с температурой материалов? Выбрать все, что подходит. А. Температура воды повысилась. Ваш ответ: Объясните, почему произошли эти изменения температуры. В своем ответе опишите, что произошло с молекулами воды и атомами меди во время этих изменений. Ваш ответ: Образец полного ответа учащегося: С течением времени медь отдавала небольшую часть своего тепла воде, обеспечивая повышение температуры воды и понижение температуры меди. Молекулы воды будут ускоряться при повышении температуры. Атомы в меди будут замедляться при понижении температуры. В комплекте:
Основной: ИЛИ Ответ учащегося выбирает (A) и (D) и относится к одной части правильного объяснения. Частично: ИЛИ Ответ учащегося выбирает (A) и (D) и не содержит объяснений или общего объяснения, относящегося к удельной теплоемкости или температуре материалов, которое не содержит неверной информации. Неудовлетворительно/Неверно:
Верх Теперь вы можете регулировать температуру и массу меди и воды. Запустите симуляцию с 250 г меди при температуре 20,0 градусов Цельсия и 250 г воды при температуре 60,0 градусов Цельсия. Основываясь на ваших данных, какое утверждение верно? A. Медь имела большее изменение температуры, чем вода. Ваш ответ: Правильный ответ: А
Верх Используйте моделирование, чтобы выяснить, какая теплоемкость выше: медь или вода. По вашим данным, какое вещество имеет более высокую удельную теплоемкость? А. Медь Ваш ответ: Объясни, откуда ты знаешь. Используйте свои данные, чтобы подтвердить свое объяснение. Ваш ответ: Образец полного ответа учащегося: Вода имеет более высокую удельную теплоемкость, потому что она менее склонна к изменению температуры. Это означает, что для повышения температуры воды требуется больше энергии. Медь с температурой 60 градусов по Цельсию и такой же массой, как и масса воды, в которую она была помещена, остыла до 23,4 градусов по Цельсию. С другой стороны, вода, начавшая с температуры 20 градусов по Цельсию, поднялась только до 23,4 градусов по Цельсию. Оценка и описание: Пример данных моделирования: В комплекте: Основной: Частично: ИЛИ Ответ учащегося выбирает (A) Медь, но дает объяснение, указывающее, что температура воды изменилась меньше, чем температура меди, и дает достоверные данные, подтверждающие правильный выбор (B). Неудовлетворительно/Неверно:
Верх Опишите процедуру, которую вы использовали для сравнения удельной теплоемкости металлов с помощью моделируемого калориметра. Ваш ответ: Опишите, как вы решили, какие комбинации температуры и массы установить для каждого металла в проведенных вами испытаниях. Ваш ответ: Образец полного ответа учащегося: Процедура, используемая для сравнения удельных теплоемкостей металлов, заключалась в том, что я установил начальную температуру воды на уровне 60 градусов Цельсия и массу на уровне 250 г. Затем я установил массу обоих металлов на 250 г и температуру для обоих на 20 градусов по Цельсию. Это позволило мне провести эксперимент и сравнить оба металла в одинаковых условиях. Я решил использовать по 250 граммов как для металлов, так и для воды, чтобы использовать наибольшее количество металла и минимальное количество воды. Установка температуры обоих металлов на 20 градусов Цельсия позволила мне увидеть, на сколько градусов увеличилась температура каждого металла. Руководство по подсчету очков В комплекте:
Основной: Частично: Неудовлетворительно/Неверно:
Верх По данным ваших исследований, какой металл имеет более высокую удельную теплоемкость? А. Медь Ваш ответ: Объясни, откуда ты знаешь. Используйте свои данные, чтобы подтвердить свое объяснение. Ваш ответ: Образец полного ответа учащегося: Температура алюминия изменилась меньше, чем температура меди при тех же условиях. Таким образом, для изменения температуры алюминию требуется больше энергии. Следовательно, алюминий имеет более высокую удельную теплоемкость. Руководство по подсчету очковДействительные данные моделирования: В комплекте: Основной: ИЛИ Ответ учащегося выбирает (B) и предоставляет действительные данные для поддержки без объяснения причин. Частично: Неудовлетворительно/Неверно:
Верхняя часть Помните, что лучший металл для дна кастрюли будет иметь большее повышение температуры, когда ему будет передано заданное количество тепловой энергии. Какой металл лучше всего использовать для дна кастрюли? А. Медь Ваш ответ: Объясни, откуда ты знаешь. Используйте свои данные, чтобы подтвердить свое объяснение. Ваш ответ: Образец полного ответа учащегося: При нагревании воды температура меди увеличивается больше из-за более низкой удельной теплоемкости. Руководство по подсчету очков В комплекте:
Объяснение может быть дано для алюминия. Основной: ИЛИ Ответ учащегося выбирает (B) алюминий и касается двух частей правильного объяснения. Объяснение согласуется с более низкой удельной теплоемкостью меди, но актуально для поддержки выбора алюминия как лучшего выбора для кастрюли. Частично: ИЛИ Ответ учащегося выбирает (B) алюминий и включает достоверные данные или ссылается на теплопередачу или удельную теплоемкость в поддержку правильного выбора (A). Неудовлетворительно/Неверно:
ИСТОЧНИК: Министерство образования США, Институт педагогических наук, Национальный центр статистики образования, Национальная оценка прогресса в образовании (NAEP), 2009 г.Оценка науки. Топ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
термодинамика.
 Конечная температура смеси воды и льда в медном сосуде
Конечная температура смеси воды и льда в медном сосудеЗаданный вопрос
Изменено 3 месяца назад
Просмотрено 625 раз
$\begingroup$
Допустим, у меня есть лед массой $m_i$, начальной температурой $T_i$ и удельной теплоемкостью $s_i$ . И у меня есть вода массой $m_w$ и начальной температурой $T_w$ и удельной теплоёмкостью $s_w$ . Я поместил эту воду и лед в медный сосуд с массой $m_{cu}$ , удельной теплоемкостью $s_{cu}$ и начальной температурой $T_w$ . Какой будет конечная температура $T$ системы? (Скрытая теплота замерзания воды $L_f$ )
Здесь ,
$$Q_1 = m_is_i(T-T_i) + m_iL_f$$
$$Q_2 = m_ws_w(T-T_w) + m_wL_f + m_{cu}s_{cu}(T-T_w)$$
Согласно калориметрии, $$Q_1 = Q_2$$ $$m_is_i(T-T_i) + m_iL_f = Q_2 = m_ws_w(T-T_w) + m_wL_f + m_{cu}s_{cu}(T-T_w)$$
Я могу использовать это уравнение для вычисления $T$, Но потом я столкнулся с проблемой.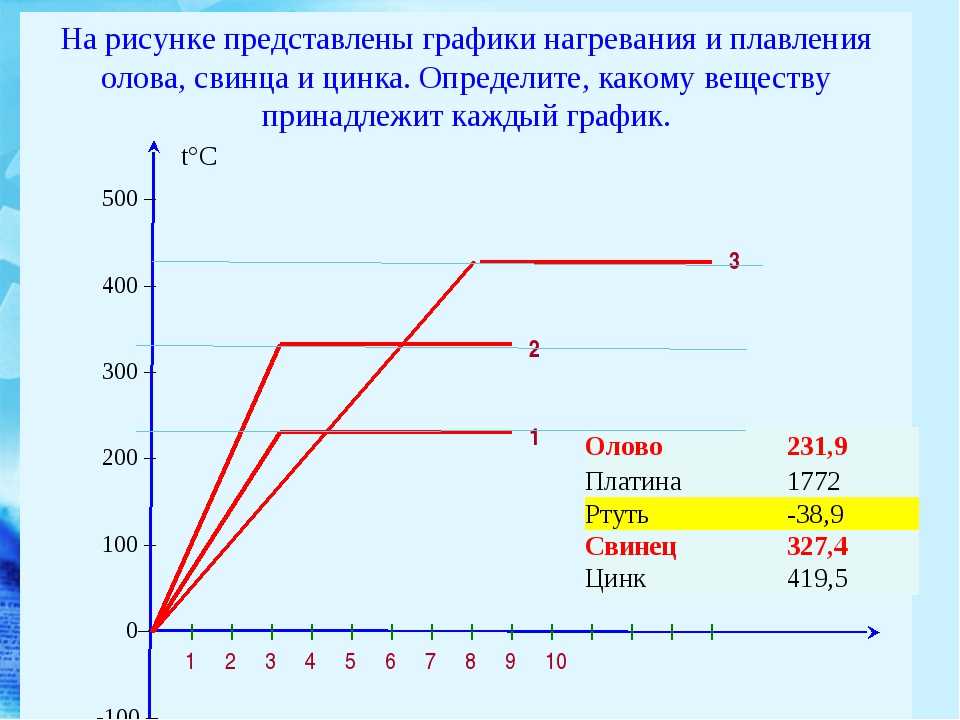 В этом случае я не знаю, что происходит, замерзание воды или таяние льда, поэтому я не могу просто добавить в уравнение $m_wL_f$ и $m_iL_f$ и считать, что это сделано. Возможно, мне придется удалить один из них в зависимости от того, что не происходит (замораживание или таяние). Что еще хуже, вода или лед могут просто замерзнуть или растаять частично . Есть ли другое уравнение, которое может решить конечную температуру, принимая все это во внимание?
В этом случае я не знаю, что происходит, замерзание воды или таяние льда, поэтому я не могу просто добавить в уравнение $m_wL_f$ и $m_iL_f$ и считать, что это сделано. Возможно, мне придется удалить один из них в зависимости от того, что не происходит (замораживание или таяние). Что еще хуже, вода или лед могут просто замерзнуть или растаять частично . Есть ли другое уравнение, которое может решить конечную температуру, принимая все это во внимание?
- термодинамика
- температура
- фазовый переход
$\endgroup$
2
$\begingroup$
На самом деле вам нужно рассмотреть все 3 случая: весь лед растает, вся вода замерзнет или вы получите смесь льда и воды. Кроме того, при решении этой задачи гораздо удобнее работать с первым законом термодинамики. Поскольку мы предполагаем, что эта система изолирована, это говорит нам, что изменение внутренней энергии системы равно нулю.
Пусть $m_{wi}$ и $m_{ii}$ — массы воды и льда изначально, а $m_{wf}$ и $m_{if}$ — массы воды и льда в конце. Кроме того, пусть эталонным состоянием для внутренней энергии является вода при 0 C. Тогда удельная внутренняя энергия воды и льда изначально равна $$u_{wi}=s_w(T_w-0)$$ $$u_{ii}=-L_f-s_i(0-T_i)$$ и, наконец, удельная внутренняя энергия воды и льда $$u_{wf}=s_w(T-0)$$ $$u_{if}=-L_f-s_i(0-T)$$ Таким образом, установка общей внутренней энергии системы первоначально на общую внутреннюю энергию системы в конечном итоге дает: $$m_{wi}s_wT_{w}+m_{ii}(-L_f+s_iT_i)+m_{cu}s_{cu}T_w=m_{wf}s_wT+m_{if}(-L_f+s_iT)+m_ {cu}s_{cu}T$$ На это уравнение действует ограничение, согласно которому общая масса воды и льда постоянна: $$m_{wi}+m_{ii}=m_{wf}+m_{if}$$
Возможны следующие три случая:
- Если в конечном итоге присутствуют и вода, и лед, то T = 0
- Если в итоге присутствует только вода, то $m_{if}=0$
- Если в итоге присутствует только лед, то $m_{wf}=0$
$\endgroup$
2
$\begingroup$
Предположим, что конечная температура равна $T$.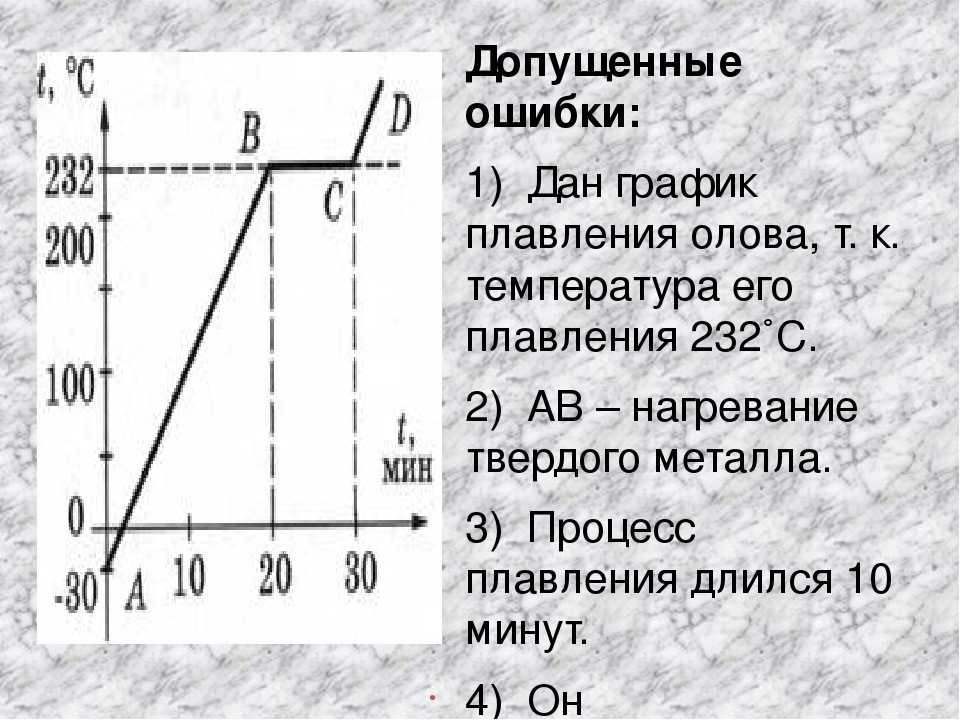 Тогда ваше выражение для $Q_1$ неверно.
Тогда ваше выражение для $Q_1$ неверно.
Лед нагреется от $T_i$ до $0$, затем поглотит скрытую теплоту таяния, после чего талая вода нагреется до $T$, поэтому имеем:
$$Q_1=m_1s_i(T_i-0)+m_1L_f+m_ws_w(0-T)$$
$\endgroup$
2
$\begingroup$
Как правильно ответили другие, существует ряд различных математически возможных решений.
Это приводит к возможности пробовать и отбрасывать несколько решений, прежде чем найти правильное.
Полезный метод (я думаю) для избежания напрасных усилий следующий:
- Выберите произвольную 9°С. Все это можно рассчитать.
- Теперь объедините эти различные потоки энергии, чтобы найти чистый поток энергии в/из системы.
Если поток энергии уже равен нулю, значит, ваша первоначальная догадка была верна. Работа выполнена.
если у вас есть чистая выходная энергия, то вам нужно вернуть эту сумму, чтобы добиться нулевой чистой энергии.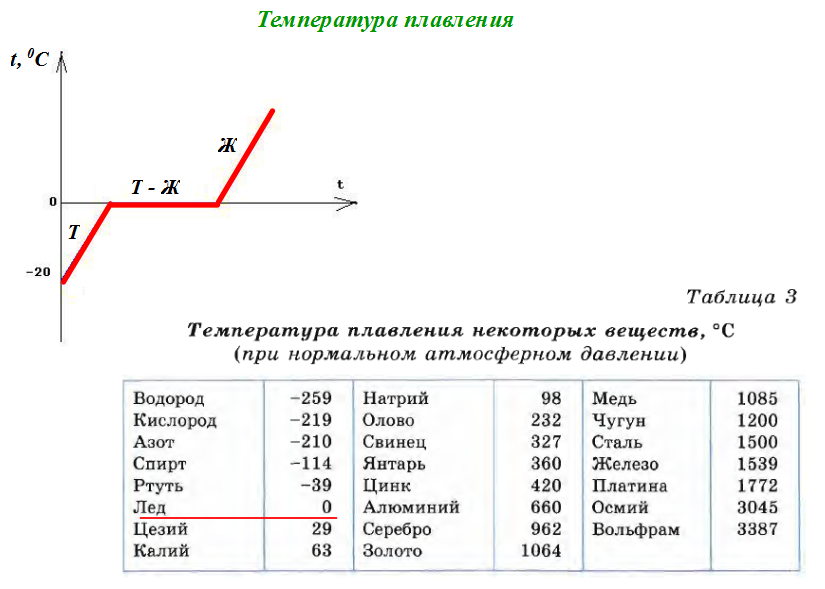



 Однако оксидная пленка при охлаждении становится менее упругой и плотной, изделие становится менее твердым (хотя с практической точки зрения это снижение прочности практически незаметно).
Однако оксидная пленка при охлаждении становится менее упругой и плотной, изделие становится менее твердым (хотя с практической точки зрения это снижение прочности практически незаметно).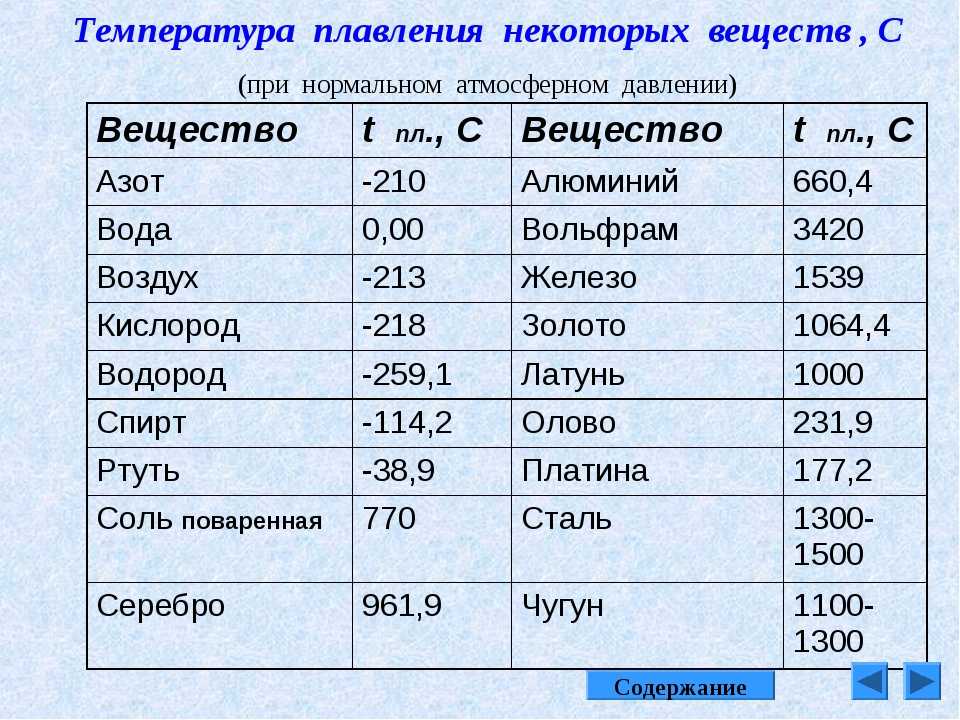 В конечном счете это разрушает решетку, хотя за счет взаимного столкновения и притяжения атомы не разлетаются в разные стороны. На физическом уровне такая структура материала соответствует жидкости (то есть такому состоянию вещества, при котором атомы находятся в относительно свободном движении, но не разлетаются в разные стороны подобно газу).
В конечном счете это разрушает решетку, хотя за счет взаимного столкновения и притяжения атомы не разлетаются в разные стороны. На физическом уровне такая структура материала соответствует жидкости (то есть такому состоянию вещества, при котором атомы находятся в относительно свободном движении, но не разлетаются в разные стороны подобно газу). Чтобы обойти это ограничение, используются разные технологии. Оптимальная — нагрев вещества в тугоплавкой камере с поддержанием стабильной температуры выше критической точки (то есть выше температуры 2595 градусов). В таком случае температура среды будет высокой, а остывание вещества происходить не будет.
Чтобы обойти это ограничение, используются разные технологии. Оптимальная — нагрев вещества в тугоплавкой камере с поддержанием стабильной температуры выше критической точки (то есть выше температуры 2595 градусов). В таком случае температура среды будет высокой, а остывание вещества происходить не будет. Это приводит к частичному переходу твердого вещества в жидкость. На химическом уровне при достижении точки солидуса происходит частичное разрушение кристаллической решетки вещества, однако у более тугоплавких фракций решетка сохраняется.
Это приводит к частичному переходу твердого вещества в жидкость. На химическом уровне при достижении точки солидуса происходит частичное разрушение кристаллической решетки вещества, однако у более тугоплавких фракций решетка сохраняется.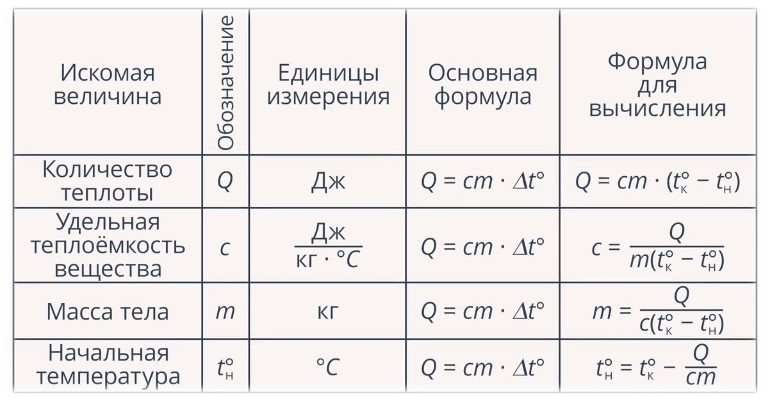






 Объяснение указывает на то, что температура воды изменилась меньше, чем температура меди (при соприкосновении равных масс меди и воды разной температуры), что показывает, что на градус изменения температуры воды передается больше тепловой энергии (тепла). чем медь.
Объяснение указывает на то, что температура воды изменилась меньше, чем температура меди (при соприкосновении равных масс меди и воды разной температуры), что показывает, что на градус изменения температуры воды передается больше тепловой энергии (тепла). чем медь.
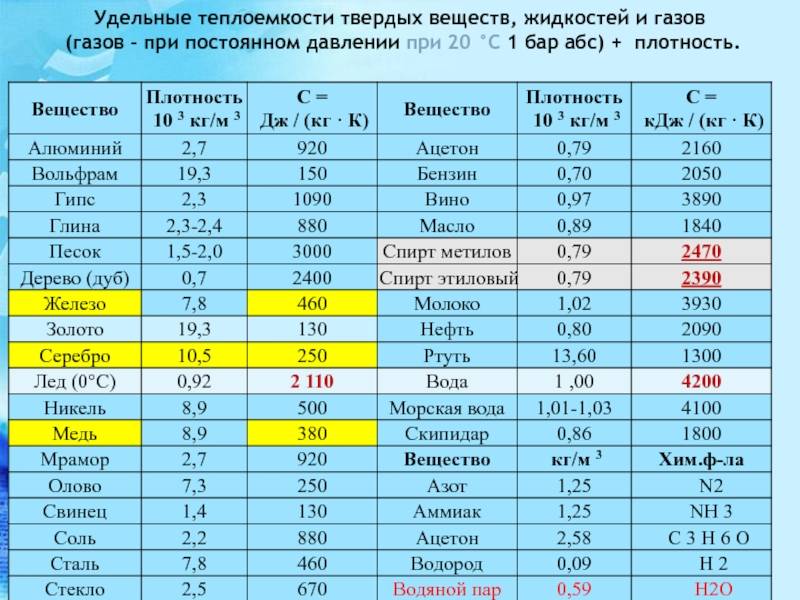

 Детали могут не суммироваться с итоговыми значениями из-за округления.
Детали могут не суммироваться с итоговыми значениями из-за округления. Данные показывают, что температура алюминия менялась меньше (медленнее), чем температура меди (или температура воды менялась больше с алюминием, чем с медью).
Данные показывают, что температура алюминия менялась меньше (медленнее), чем температура меди (или температура воды менялась больше с алюминием, чем с медью). Детали могут не суммироваться с итоговыми значениями из-за округления.
Детали могут не суммироваться с итоговыми значениями из-за округления.
 Ответ не может содержать неправильную или противоречивую информацию.
Ответ не может содержать неправильную или противоречивую информацию.