Коррозия алюминия
Коррозия алюминия – разрушение металла под влиянием окружающей среды.
Для реакции Al3+ +3e → Al стандартный электродный потенциал алюминия составляет -1,66 В.
Температура плавления алюминия — 660 °C.
Плотность алюминия — 2,6989 г/см3 (при нормальных условиях).
Алюминий, хоть и является активным металлом, отличается достаточно хорошими коррозионными свойствами. Это можно объяснить способностью пассивироваться во многих агрессивных средах.
Коррозионная стойкость алюминия зависит от многих факторов: чистоты металла, коррозионной среды, концентрации агрессивных примесей в среде, температуры и т.д. Сильное влияние оказывает рН растворов. Оксид алюминия на поверхности металла образуется только в интервале рН от 3 до 9!
Очень сильно влияет на коррозионную стойкость Al его чистота. Для изготовления химических агрегатов, оборудования используют только металл высокой чистоты (без примесей), например алюминий марки АВ1 и АВ2.
Коррозия алюминия не наблюдается только в тех средах, где на поверхности металла образуется защитная оксидная пленка.
При нагревании алюминий может реагировать с некоторыми неметаллами:
2Al + N2 → 2AlN – взаимодействие алюминия и азота с образованием нитрида алюминия;
4Al + 3С → Al4С3 – реакция взаимодействия алюминия с углеродом с образованием карбида алюминия;
2Al + 3S → Al2S3 – взаимодействие алюминия и серы с образованием сульфида алюминия.
Коррозия алюминия на воздухе (атмосферная коррозия алюминия)
Алюминий при взаимодействии с воздухом переходит в пассивное состояние. При соприкосновении чистого металла с воздухом на поверхности алюминия мгновенно появляется тонкая защитная пленка оксида алюминия. Далее рост пленки замедляется. Формула оксида алюминия – Al2O3 либо Al2
O3•H2O.Реакция взаимодействия алюминия с кислородом:
4Al + 3O2 → 2Al2O3.
Толщина этой оксидной пленки составляет от 5 до 100 нм (в зависимости от условий эксплуатации). Оксид алюминия обладает хорошим сцеплением с поверхностью, удовлетворяет условию сплошности оксидных пленок. При хранении на складе, толщина оксида алюминия на поверхности металла составляет около 0,01 – 0,02 мкм. При взаимодействии с сухим кислородом – 0,02 – 0,04 мкм. При термической обработке алюминия толщина оксидной пленки может достигать 0,1 мкм.
Алюминий достаточно стоек как на чистом сельском воздухе, так и находясь в промышленной атмосфере (содержащей пары серы, сероводород, газообразный аммиак, сухой хлороводород и т.п.). Т.к. на коррозию алюминия в газовых средах не оказывают никакого влияния сернистые соединения – его применяют для изготовления установок переработки сернистой нефти, аппаратов вулканизации каучука.
Коррозия алюминия в воде
Коррозия алюминия почти не наблюдается при взаимодействии с чистой пресной, дистиллированной водой. Повышение температуры до 180 °С особого воздействия не оказывает. Горячий водяной пар на коррозию алюминия влияния также не оказывает. Если в воду, даже при комнатной температуре, добавить немного щелочи – скорость коррозии алюминия в такой среде немного увеличится.
Горячий водяной пар на коррозию алюминия влияния также не оказывает. Если в воду, даже при комнатной температуре, добавить немного щелочи – скорость коррозии алюминия в такой среде немного увеличится.
Взаимодействие чистого алюминия (не покрытого оксидной пленкой) с водой можно описать при помощи уравнения реакции:
2Al + 6H2O = 2Al(OH)3 + 3H2↑.
При взаимодействии с морской водой чистый алюминий начинает корродировать, т.к. чувствителен к растворенным солям. Для эксплуатации алюминия в морской воде в его состав вводят небольшое количество магния и кремния. Коррозионная стойкость алюминия и его сплавов, при воздействии морской воды, значительно снижается, если в состав метала будет входить медь.
Коррозия алюминия в кислотах
С повышением чистоты алюминия его стойкость в кислотах увеличивается.
Коррозия алюминия в серной кислоте
Для алюминия и его сплавов очень опасна серная кислота (обладает окислительными свойствами) средних концентраций. Реакция с разбавленной серной кислотой описывается уравнением:
Реакция с разбавленной серной кислотой описывается уравнением:
2Al + 3H2SO4(разб) → Al2(SO4)3 + 3H2↑.
Концентрированная холодная серная кислота не оказывает никакого влияния. А при нагревании алюминий корродирует:
2Al + 6H2SO4(конц) → Al2(SO4)3 + 3SO2↑ + 6H2O.
При этом образуется растворимая соль – сульфат алюминия.
Al стоек в олеуме (дымящая серная кислота) при температурах до 200 °С. Благодаря этому его используют для производства хлорсульфоновой кислоты (HSO
Коррозия алюминия в соляной кислоте
В соляной кислоте алюминий или его сплавы быстро растворяются (особенно при повышении температуры). Уравнение коррозии:
2Al + 6HCl → 2AlCl3 + 3H2↑.
Аналогично действуют растворы бромистоводородной (HBr), плавиковой (HF) кислот.
Коррозия алюминия в азотной кислоте
Концентрированный раствор азотной кислоты отличается высокими окислительными свойствами. Алюминий в азотной кислоте при нормальной температуре исключительно стоек (стойкость выше, чем у нержавеющей стали 12Х18Н9). Его даже используют для производства концентрированной азотной кислоты методом прямого синтеза
Алюминий в азотной кислоте при нормальной температуре исключительно стоек (стойкость выше, чем у нержавеющей стали 12Х18Н9). Его даже используют для производства концентрированной азотной кислоты методом прямого синтеза
При нагревании коррозия алюминия в азотной кислоте проходит по реакции:
Al + 6HNO3(конц) → Al(NO3)3 + 3NO2↑ + 3H2O.
Коррозия алюминия в уксусной кислоте
Алюминий обладает достаточно высокой стойкостью к воздействию уксусной кислоты любых концентраций, но только если температура не превышает 65 °С. Его используют для производства формальдегида и уксусной к-ты. При более высоких температурах алюминий растворяется (исключение составляют концентрации кислоты 98 – 99,8%).В бромовой, слабых растворах хромовой (до10%), фосфорной (до 1%) кислотах при комнатной температуре алюминий устойчив.
Слабое влияние на алюминий и его сплавы оказывают лимонная, масляная, яблочная, винная, пропионовая кислоты, вино, фруктовые соки.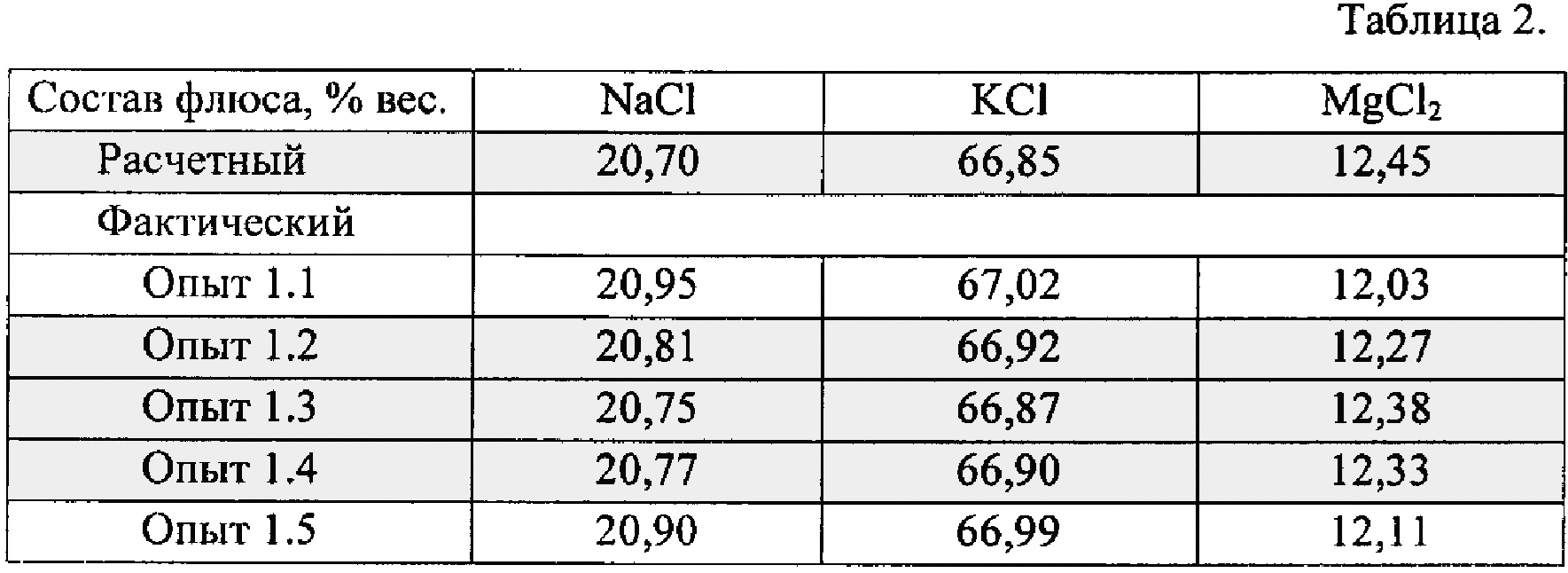
Щавелевая, муравьиная, хлорорганические кислоты разрушают металл.
На коррозионную стойкость алюминия очень сильно влияет парообразная и капельножидкая ртуть. После недолгого контакта металл и его сплавы интенсивно корродируют, образуя амальгамы.
Коррозия алюминия в щелочах
Щелочи легко растворяют защитную оксидную пленку на поверхности алюминия, он начинает реагировать с водой, в результате чего металл растворяется с выделением водорода (коррозия алюминия с водородной деполяризацией).
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑;
2(NaOH•H2O) + 2Al → 2NaAlO2 + 3H2↑.
Образуются алюминаты.
Также оксидную пленку разрушают соли ртути, меди и ионы хлора.
Руководство по материалам электротехники для всех. Часть 1 / Хабр
Привет гиктаймс! Я решил опубликовать по частям свое руководство по материалам, используемым не только в электротехнике, но и вообще в технике, в том числе самодельщиками. С описанием, примерами применения, заметками по работе. Руководство написано максимально просто, и будет понятно всем, от школьника до пенсионера.
С описанием, примерами применения, заметками по работе. Руководство написано максимально просто, и будет понятно всем, от школьника до пенсионера.
В этой части начинаем разбирать проводники — Серебро, Медь, Алюминий.
Добро пожаловать под кат (ТРАФИК)
Ковыряясь в поисках ответов на свои вопросы в разных учебниках по материаловедению, методичках, научпоп книгах я ужасался, насколько академический стиль изложения возводит стену между желающим узнать и знаниями. Насколько стремление авторов обойти острые грани, тёмные места превращает учебники в однородную бескрайнюю пустыню скуки и отчаяния. При этом запредельный уровень абстракции делает крайне сложным для неофита использование полученных знаний в практике. Поэтому я решил сделать свое руководство, с блекджеком и блудными девицами.
Это руководство — живое, по мере получения новых материалов, уточнений, комментариев от вас, дорогие читатели оно будет дополняться, изменяться, становиться лучше. Всегда самая свежая версия руководства лежит у меня на сайте в бложике Я обеими руками поддерживаю движение Open Source и Open Hardware, считаю, что обмен знаниями должен быть свободным, это принесет пользу для всех, поэтому пособие распространяется под лицензией Creative Commons 3.
- Ссылка на меня обязательна (в.т.ч. производных работах).
- Зарабатывать на моем пособии без договоренности со мной нельзя (запрет на использование в коммерческих целях).
- Все производные работы должны распространяться на тех же условиях.
Плюшки данного пособия:
- Весь текст написан мной, и дополнен замечательными людьми, упомянутыми в разделе Благодарности. Я не включал информацию, в достоверности или актуальности которой я бы сомневался. Поэтому доля брехни по тексту в среднем ниже, чем в маркетинговых текстах перепродавцов-поставщиков, но выше, чем в хорошем советском учебнике.
- Большую часть материалов я хотя бы щупал, использовал в своих конструкциях, а не видел только на картинке.
- Пособие полностью (Чтобы быть до конца честным — за исключением одной картинки, которую пришлось рисовать в чем умел.
 ) подготовлено с использованием OpenSource продуктов (Linux, GIMP, LibreOffice, context). Просто из спортивного интереса.
) подготовлено с использованием OpenSource продуктов (Linux, GIMP, LibreOffice, context). Просто из спортивного интереса. - Некоторые разделы имеют пункт «Источники» — советы по поиску материалов — где купить, под какими названиями искать. Конечно, всё можно купить на Алиэкспресс и на Ebay, поэтому такой вариант не указывается. Пункт может быть полезен если материал нужен «здесь и сейчас».
Публикуя руководство здесь я очень надеюсь на обилие конструктивной критики и дополнений от вас, дорогие читатели.
Содержание руководстваПроводники:
*Серебро
*Медь
*Алюминий
*Железо
*Золото
*Никель
*Вольфрам
*Ртуть
Так себе проводники:
*Углерод
*Нихромы
*Сплавы для изготовления термостабильных сопротивлений
*Припои
*Олово
*Легкоплавкие припои
Прочие проводники
*Термопарные сплавы
*Оксид Индия-Олова
Диэлектрики (Совсем не проводники):
*Неорганические диэлектрики
**Фарфор
**Стекло
**Слюда
**Алюмооксидные керамики
**Асбест
**Вода
*Органические диэлектрики полусинтетические
**Бумага, картон
**Шёлк
**Воск, парафин
**Трансформаторное масло
**Фанера, ДСП
*Органические диэлектрики синтетические
**Материалы на базе фенол-формальдегидных смол
**Карболит (бакелит)
**Гетинакс
**Текстолит
**Стеклотекстолит
**Лакоткань
**Резина
**Эбонит
**Полиэтилен
**Полипропилен
**Полистирол, АБС-пластик
**Фторопласт-4 (политетрафторэтилен PTFE)
**Поливинилхлорид — ПВХ
**Полиэтилентерефталат (ПЭТФ)
**Силиконы
**Полиимид
**Полиамиды
**Полиметилметакрилат — ПММА
**Поликарбонат
*График истории промышленного применения полимеров
*Изоленты
**Прорезиненная тканевая изолента
**Тканевые изоленты
**Резиновые самовулканизирующиеся изоленты
**Силиконовые самослипающиеся ленты
**Полиимидная лента
**ПВХ изоленты
**Канцелярская липкая лента «скотч»
*Изоляционные трубки
**Трубка из ПВХ — «кембрик»
**Фторопластовая трубка
**Стеклотканевая с силиконом
**Термоусадочная трубка
*Дополнительные сведения о полимерах
Поехали!
Двадцатый век — век пластмасс. До появления широкого спектра синтетических полимерных материалов, человек использовал в конструировании металлы и материалы природного происхождения — дерево, кожу и т.д. Сегодня мы завалены пластмассовыми изделиями, начиная от одноразовой посуды, заканчивая тяжелонагруженными деталями двигателей автомобилей. Пластмассы во многом превосходят металлы, но никогда не вытеснят их полностью, поэтому рассказ начнется с металлов. Металлам посвящены сотни книг, дисциплина, посвященная им, называется «металловедение».
До появления широкого спектра синтетических полимерных материалов, человек использовал в конструировании металлы и материалы природного происхождения — дерево, кожу и т.д. Сегодня мы завалены пластмассовыми изделиями, начиная от одноразовой посуды, заканчивая тяжелонагруженными деталями двигателей автомобилей. Пластмассы во многом превосходят металлы, но никогда не вытеснят их полностью, поэтому рассказ начнется с металлов. Металлам посвящены сотни книг, дисциплина, посвященная им, называется «металловедение».
Нас интересуют металлы с точки зрения электронной техники. Как проводники, как часть электронных приборов. Все остальные применения — например такие, как конструкционные материалы, в данное пособие пока не вошли.
Главное для электронной техники свойство металлов — это способность хорошо проводить электрический ток. Посмотрим на таблицу удельного сопротивления различных металлов:
| Металл | Удельное сопротивление Ом*мм2/м |
|---|---|
| Серебро | 0,015. ..0,0162 ..0,0162 |
| Медь | 0,01724…0,018 |
| Золото | 0,023 |
| Алюминий | 0,0262…0,0295 |
| Иридий | 0,0474 |
| Вольфрам | 0,053…0,055 |
| Молибден | 0,054 |
| Цинк | 0,059 |
| Никель | 0,087 |
| Железо | 0,098 |
| Платина | 0,107 |
| Олово | 0,12 |
| Свинец | 0,217…0,227 |
| Титан | 0,5562…0,7837 |
| Висмут | 1,2 |
Видим лидеров нашего списка: Ag, Cu, Au, Al.
Серебро
Ag — Серебро.
Драгоценный металл. Серебро — самый дешевый из драгоценных металлов, но, тем не менее, слишком дорог, чтобы делать из него провода. На 5% лучшая электропроводность по сравнению с медью, при разнице в цене почти в 100 раз.
На 5% лучшая электропроводность по сравнению с медью, при разнице в цене почти в 100 раз.
Примеры применения
В виде покрытий проводников в СВЧ технике.
Ток высокой частоты, из-за
скинэффектатечет по поверхности проводника, а не в его толще, поэтому тонкое покрытие волновода серебром дает бОльший прирост проводимости, чем покрытие серебром проводника для постоянного тока.
В сплавах контактных групп. Контакты силовых, сигнальных реле, рубильников, выключателей чаще всего изготовлены из сплава с содержанием серебра. Переходное сопротивление такого контакта получается ниже медного, он меньше подвержен окислению. Так как контакт обычно миниатюрен, стоимость этой малой добавки серебра к стоимости изделия незначительно. Хотя при утилизации большого количества реле, стоимость серебра делает целесообразным работу бокорезами по отделению контактов в кучку для последующего аффинажа.
Контакты силового реле на 16 Ампер. Согласно документации производителя
контакты содержат серебро и кадмий.
Различные реле. Верхнее реле имеет даже посеребренный корпус с характерной патиной. Содержание драгметаллов в изделиях, выпущенных в СССР было указано в паспортах на изделия.
В качестве присадки в припоях. Качественные припои (как твёрдые так и мягкие) часто содержат серебро.
Проводящие покрытия на диэлектриках. Например, для получения контактной площадки на керамике, на неё наносится суспензия из серебряных частиц с последующим запеканием в печи (метод «вжигания»).
Компонент электропроводящих клеев и красок. Электропроводящие чернила часто
содержат суспензию серебряных частиц. По мере высыхания таких чернил, растворитель
испаряется, частицы в растворе оказываются всё ближе, слипаясь и создавая проводящие
мостики, по которым может протекать ток. Хорошее видео с рецептом по созданию таких
чернил.
Недостатки
Несмотря на то, что серебро — благородный металл, он окисляется в среде с содержанием
серы:
4Ag + 2H
2S + O
2→ 2Ag
2S + 2H
2O
Образуется темный налет — «патина». Также источником серы может служить резина, по-
Также источником серы может служить резина, по-
этому провод в резиновой изоляции и посеребренные контакты — плохое сочетание.
Потемневшее серебро можно очистить химически. В отличии от чистки абразивными пастами (в том числе зубной пастой) это самый нежный способ чистки, не оставляющий царапин.
Медь
Cu — медь.
Основной металл проводников тока. Обмотки электродвигателей, провода в изоляции, шины, гибкие проводники — чаще всего это именно медь. Медь нетрудно узнать по характерному красноватому цвету. Медь достаточно устойчива к коррозии.
Примеры применения
Провода.
Основное применение меди в чистом виде. Любые добавки снижают электропроводность, поэтому сердцевина проводов обычно — чистейшая медь.
Гибкие многожильные провода различного сечения.
Гибкие тоководы. Если проводники для стационарных устройств можно в принципе изготовить из любого металла, то гибкие проводники делают почти всегда только из меди, алюминий для этих целей слишком ломкий. Содержат множество тоненьких медных жилок.
Содержат множество тоненьких медных жилок.
Теплоотводы. Медь не только на 56% лучше алюминия проводит ток, но ещё имеет почти вдвое лучшую теплопроводность. Из меди изготавливают тепловые трубки, радиаторы, теплораспределяющие пластины. Так как медь дороже алюминия, часто радиаторы делают составными, сердцевина из меди, а остальная часть из более дешевого алюминия.
Радиаторы охлаждения процессора. Центральный стержень изготовлен из меди, он хорошо отводит тепло от кристалла процессора, а алюминиевый радиатор с развитым оребрением уже охлаждает сам стержень.
При изготовлении фольгированных печатных плат. Печатные платы, в любом электронном устройстве изготовлены из пластины диэлектрика, на который наклеена медная фольга. Все соединения между элементами печатной платы выполнены дорожками из медной фольги.
Техника сверхвысокого вакуума. Из металлов и сплавов только нержавеющая сталь и медь пригодны для камер сверхвысокого вакуума в таких приборах, как ускорители элементарных частиц или рентгеновские спектрометры. Все остальные металлы в вакууме слегка испаряются и портят вакуум.
Все остальные металлы в вакууме слегка испаряются и портят вакуум.
Аноды рентгеновских трубок. В рентгеноструктурном анализе требуется монохроматическое рентгеновское излучение. Его источником зачастую является облучаемая электронами медь (спектральная линия Cu Kα), которая к тому же прекрасно отводит тепло. Если же требуется другое излучение (Co или Fe), его получают от маленького кусочка соответствующего металла на массивном медном теплоотводе. Такие аноды всегда охлаждаются проточной водой.
Интересные факты о меди
- Медь — достаточно дорогой металл, поэтому недобросовестные производители стараются экономить на нем. Занижают сечение проводов (когда написано 0,75 мм2, а фактически 0,11 мм2). Окрашивают алюминий «под медь» в обмотках, внешне обмотка выглядит как медная, а стоит соскрести изоляцию — оказывается, что она сделана из алюминия. Этим грешат и китайские, и отечественные производители, кабель сечением 2,5 мм2 вполне может оказаться сечением 2,3 мм2, поэтому запас прочности и входной контроль не будут лишними.
 Разумеется, надежность контакта в электроарматуре жилы сечением 2,3 мм2, рассчитанной на жилу 2,5 мм2, будет невысокой.
Разумеется, надежность контакта в электроарматуре жилы сечением 2,3 мм2, рассчитанной на жилу 2,5 мм2, будет невысокой. - Медь окрашивает пламя в зелёный цвет, это свойство использовали для обнаружения меди в руде, когда не был доступен химический анализ. Зеленый след в пламени — показатель наличия меди. (но не всегда, зеленую окраску пламени могут давать ионы бора)
- Медь — мягкий металл, но если добавить к меди хотя бы 10% олова, получается твёрдый, упругий сплав — бронза. Именно освоение получения бронзы послужило названием к исторической эпохе — бронзовому веку. Добавка к меди бериллия дает бериллиевую бронзу — прочный упругий сплав, из которого изготавливают пружинящие контакты.
- Медь — один из немногих мягких металлов с высокой температурой плавления, поэтому из меди изготавливают уплотнительные прокладки, например для высокотемпературной или вакуумной техники. Например, уплотнительная прокладка пробки картера двигателя автомобиля.
- При механической обработке (например волочении) медь уплотняется и становится жёсткой.
 Для восстановления исходной мягкости и пластичности медь «отжигают» в защитной атмосфере, нагревая до 500-700 °C и выдерживая некоторое время. Поэтому некоторые медные изделия твёрдые, а некоторые мягкие, например медные трубы.
Для восстановления исходной мягкости и пластичности медь «отжигают» в защитной атмосфере, нагревая до 500-700 °C и выдерживая некоторое время. Поэтому некоторые медные изделия твёрдые, а некоторые мягкие, например медные трубы. - Медь не даёт искр. Для работы во взрывоопасных местах, например на газопроводе, используют искробезопасный инструмент, стальной инструмент покрытый слоем меди или инструмент изготовленный из сплавов меди — бронз. Если таким инструментом случайно чиркнуть по стальной поверхности он не даст опасных искр.
- Так как температурный коэффициент сопротивления для чистой меди известен, из меди изготавливают термометры сопротивления (тип ТСМ — Термометр Сопротивления Медный, есть еще ТСП — Термометр Сопротивления Платиновый). Термометр сопротивления — это точно изготовленный резистор, навитый из медной проволоки. Измерив его сопротивление, можно по таблице или по формуле определить его температуру достаточно точно.
Алюминий
Al — Алюминий.

«Крылатый металл» четвертый по проводимости после серебра, золота и меди.
Алюминий хоть и проводит ток почти в полтора раза хуже меди, но он легче в 3,4 раза и в три
раза дешевле. А если посчитать проводимость, то эквивалентный медному проводник из
алюминия будет дешевле в 6,5 раз! Алюминий бы вытеснил медь, как проводник везде, если
бы не пара его противных свойств, но об этом в недостатках.
Чистый алюминий, как и чистое железо, в технике практически не применяется (исключения
— провода и фольга). Любой «алюминиевый» предмет состоит из какого-нибудь сплава алюминия. Сплавы могут содержать кремний, магний, медь, цинк и другие металлы. Их свойства отличаются очень сильно, и это необходимо учитывать при обработке. Ниже перечислены несколько самых распространенных марок алюминия:
- 1199. Чистый 99,99% алюминий. Бывает почти исключительно в виде фольги.
- 1050 и 1060. Чистый 99,5% и 99,6% соответственно. Из-за высокой теплопроводности иногда используется как материал для радиаторов.
 Мягок, легко гнется. Провода, пищевая фольга, посуда.
Мягок, легко гнется. Провода, пищевая фольга, посуда. - 6061 и 6082. Сплавы: 6061 — Si 0,6%, Mg 1,0%, Cu 0,28%, 6082 — Si, Mg, Mn. Первый более распространен в США, второй — в Европе. Легко точить, фрезеровать. Наилучший материал для самоделок. Прочен. Легко поддается сварке, паяется твердыми припоями. Легко анодируется. Плохо гнется. Не годится для литья.
- 6060. Состав: Mg, Si. Более мягок, чем 6061 и 6082, при обработке резанием слегка «пластилиновый», за что его не любят токари. Распространен и дешев, других особых преимуществ не имеет. Дешевый алюминиевый профиль из непонятного сплава имеет хорошиешансы оказаться им.
- 5083. Сплав с магнием (>4% Mg). Отличная коррозионная стойкость, устойчив в морской воде. Один из лучших вариантов для деталей, работающих под дождем. Тоже может встретиться в магазине стройматериалов, наряду с другими подобными марками.
- 44400, он же «силумин». Сплав с большим процентом кремния (Si >8%). Литейный.
 Низкая температура плавления, при пайке твердыми припоями риск расплавить саму деталь. Хрупок, при изгибе ломается. На изломе видны характерные кристаллы.
Низкая температура плавления, при пайке твердыми припоями риск расплавить саму деталь. Хрупок, при изгибе ломается. На изломе видны характерные кристаллы. - 7075. 2,1-2,9% Mg, 5,1-6,1% Zn, 1,2-1,6% Cu. Очень своеобразный сплав, отличается даже цветом (пленка окислов слегка золотистая). Неожиданно твердый для алюминия, по твердости сравним с мягкой сталью. Плохо анодируется. Не паяется вообще. Не сваривается вообще. Не гнется и не куется вообще. Не годится для литья. Резанием обрабатывает ся отлично, прекрасно полируется. Хорош для ответственных деталей. Используется для винтов в велосипедах, в оружии (материал многих деталей винтовки M16).
Относительно невысокая температура плавления (660 °C у чистого, меньше 600 °C у литейных сплавов) алюминия делает возможным отливку деталей в песочные формы в условиях
гаража/мастерской. Однако многие марки алюминия не годятся для литья.
Примеры применения
Провода.
Алюминий дешев, поэтому толстые силовые кабели,
СИП, ЛЭП выгодно делать из алюминия. В старых домах квартирная проводка сделана алюминиевым проводом (с 2001 года ПУЭ запрещает в квартирах использовать алюминиевый провод, только медный, см ПУЭ 7 издание п. 7.1.34) Также алюминий не используется как проводник в ответственных применениях.
В старых домах квартирная проводка сделана алюминиевым проводом (с 2001 года ПУЭ запрещает в квартирах использовать алюминиевый провод, только медный, см ПУЭ 7 издание п. 7.1.34) Также алюминий не используется как проводник в ответственных применениях.
Слева старый алюминиевый провод. Справа алюминиевые кабели различного сечения,
пригодные для укладки в грунт. В частности кабелем справа был подключен к электроэнергии целый этаж здания. Кабель помимо наружной резиновой оболочки имеет бронирующую стальную ленту, для защиты нижележащей изоляции от повреждений, к примеру лопатой при раскопке.
Теплоотводы. Не только домашние батареи делают из алюминия, но и радиаторы у
микросхем, процессоров, делают из алюминия.
Различные алюминиевые радиаторы.
Корпуса приборов. Корпус жёсткого диска в вашем компьютере отлит из алюминиевого сплава. Небольшая добавка кремния улучшает прочностные качества алюминия, сплав силумин — это корпуса жёстких дисков, бытовых приборов, редукторов и т. д.
д.
Анодированный алюминий (алюминий, у которого электрохимическим путем окисная пленка
на поверхности сделана потолще и прочнее) хорошо окрашивается и просто красив. Окисная
пленка (Al2O3 — из того же вещества состоят драгоценные камни рубины и сапфиры) достаточно твёрдая и износостойкая, но к сожалению алюминий под ней мягок, и при сильном воздействии ломается как лёд на воде.
Экраны. Электромагнитное экранирование часто делается из алюминиевой фольги или тонкой алюминиевой жести. Можете провести простой эксперимент, мобильный телефон
завернутый в фольгу потеряет сеть — он будет заэкранирован.
Отражающее покрытие у зеркал. Тонкая пленка алюминия на стекле отражает 89% падающего света (примерное значение, зависит от условий) (Серебро 98%, но на воздухе темнеет из-за сернистых соединений). Любой лазерный принтер содержит вращающееся зеркало, покрытое тонким слоем алюминия.
Зеркала от оптической системы планшетного сканера. Обратите внимание, оптические зеркала имеют металлизацию стекла снаружи, в отличии от привычных бытовых зеркал, где отражающее покрытие для защиты за стеклом. Бытовые зеркала дают двойное отражение — от поверхности стекла и от отражающего покрытия, что не так критично в быту, как защищенность отражающего покрытия.
Обратите внимание, оптические зеркала имеют металлизацию стекла снаружи, в отличии от привычных бытовых зеркал, где отражающее покрытие для защиты за стеклом. Бытовые зеркала дают двойное отражение — от поверхности стекла и от отражающего покрытия, что не так критично в быту, как защищенность отражающего покрытия.
Электроды обкладок конденсаторов. Алюминиевая фольга, разделенная слоем диэлектрика и туго свернутая в цилиндр — часть электрических конденсаторов (впрочем, для уменьшения габаритов конденсаторов фольгу заменяют алюминиевым напылением). Тот факт, что пленка оксида алюминия тонкая, прочная и не проводит ток, используется в электролитических конденсаторах, обладающими огромными для своих габаритов электрическими емкостями.
Недостатки
Алюминий — металл активный
, но на воздухе покрывается оксидной пленкой, которая предохраняет металл от разрушения и скрывает его активную натуру. Если не дать алюминию формировать стабильную защитную пленку, например капелькой ртути, алюминий активно
реагирует с водой. В щелочной среде алюминий растворяется, попробуйте залить алюминиевую фольгу средством для прочистки труб — реакция будет бурная, с выделением взрывоопасного водорода. Химическая активность алюминия, в паре с большой разницей в электрооотрицательности с медью делает невозможным прямое соединение проводов из этих двух металлов. В присутствии влаги (а она в воздухе есть почти всегда) начинает протекать гальваническая коррозия с разрушением алюминия.
В щелочной среде алюминий растворяется, попробуйте залить алюминиевую фольгу средством для прочистки труб — реакция будет бурная, с выделением взрывоопасного водорода. Химическая активность алюминия, в паре с большой разницей в электрооотрицательности с медью делает невозможным прямое соединение проводов из этих двух металлов. В присутствии влаги (а она в воздухе есть почти всегда) начинает протекать гальваническая коррозия с разрушением алюминия.
Два идентичных трансформатора от микроволновых печей. Левый вышел из строя по причине алюминиевых обмоток — отгорел провод от контакта — алюминий плохо паяется мягкими припоями, попытка обеспечить контакт также как и у медного провода привела к поломке.
Алюминий ползуч. Если алюминиевый провод очень сильно сжать, он деформируется
и сохранит новую форму — это называется «пластическая деформация». Если сжать его не
так сильно, чтобы он не деформировался, но оставить под нагрузкой надолго — алюминий
начнет «ползти» меняя форму постепенно. Это пакостное свойство ведет к тому, что хорошо
Это пакостное свойство ведет к тому, что хорошо
затянутая клемма с алюминиевым проводом спустя 5-10-20 лет постепенно ослабнет и будет
болтаться, не обеспечивая былого электрического контакта. Это одна из причин, почему ПУЭ
запрещает тонкий алюминиевый провод для разводки электроэнергии по потребителям в
зданиях. В промышленности не сложно обеспечить регламент — так называемая «протяжка»
щитка, когда электрик периодически проверяет затяжку всех клемм в щитке. В домашних же условиях, обычно пока розетка с дымом не сгорит — никто и не озаботится качеством контакта. А плохой контакт — причина пожаров.
Алюминий, по сравнению с медью, менее пластичный, риска от ножа на жиле, при сьёме изоляции с провода быстрее приведет к сломавшейся жиле, чем у меди, поэтому изоляцию с алюминиевых проводов надо счищать как с карандаша, под углом, а не в торец.
Интересные факты об алюминии
- Алюминий — хороший восстановитель, что используется для восстановления других металлов, например титана из состояния диоксида.
 Теодор Грей (Настоятельно рекомендую книги Теодора Грея «Элементы. Путеводитель по периодической таблице», «Научные опыты с периодической таблицей», «Эксперименты. Опыты с периодической таблицей». Они очень хорошо сделаны визуально, и опыты в них не приторно безопасные, как в большинстве современных пособий, могут и бабахнуть.) в домашних условиях проводил такой опыт. В смеси с окислом железа алюминиевая пудра образует термит— адская смесь, которая горит разогреваясь до 2400°С при этом восстанавливается железо и весело стекает вниз, что используется для сварки рельсов, иным способом такой кусок железа качественно и быстро не прогреть. Термитные карандаши позволяют в полевых условиях сваривать провода, а бравый спецназовец термитной горелкой пережжет дужку самого крепкого замка.
Теодор Грей (Настоятельно рекомендую книги Теодора Грея «Элементы. Путеводитель по периодической таблице», «Научные опыты с периодической таблицей», «Эксперименты. Опыты с периодической таблицей». Они очень хорошо сделаны визуально, и опыты в них не приторно безопасные, как в большинстве современных пособий, могут и бабахнуть.) в домашних условиях проводил такой опыт. В смеси с окислом железа алюминиевая пудра образует термит— адская смесь, которая горит разогреваясь до 2400°С при этом восстанавливается железо и весело стекает вниз, что используется для сварки рельсов, иным способом такой кусок железа качественно и быстро не прогреть. Термитные карандаши позволяют в полевых условиях сваривать провода, а бравый спецназовец термитной горелкой пережжет дужку самого крепкого замка. - Чтобы сделать бисквит нежным и воздушным используется пекарский порошок. Такой же порошок есть для того, что бы сделать пористым бетон — Алюминий + щелочь.
- Алюминий — активный металл, но он быстро покрывается окисной пленкой, которая защищает его от разрушения.
 Рубин, сапфир, корунд — это всё названия одного и того же вещества — оксида алюминия Al2O3 Белые точильные круги и бруски состоят из электрокорунда — оксида алюминия.
Рубин, сапфир, корунд — это всё названия одного и того же вещества — оксида алюминия Al2O3 Белые точильные круги и бруски состоят из электрокорунда — оксида алюминия.Можно убедиться в активности алюминия простым опытом. Нарежьте алюминиевую фольгу в стакан, добавьте медный купорос и поваренную соль, залейте холодной водой. Спустя некоторое время смесь закипит, алюминий будет окисляться, восстанавливая медь, с выделением тепла.
- Алюминий неплохо поддается экструзии. Корпуса приборов из нарезанного и обработанного экструдированного профиля значительно дешевле литых.
Алюминиевый корпус внешнего аккумулятора для телефона. Экструдированный анодированный окрашенный профиль. - Алюминий весьма посредственно паяется мягкими (оловянно-свинцовыми) припоями, неплохо паяется цинковыми припоями. При конструировании приборов это стоит помнить, соединить провод с алюминиевым шасси проще прикрутив винтом к запрессованной стойке, чем припаять.
 В твердых марках алюминия (6061, 6082, 7075) можно нарезать резьбу для винта непосредственно.
В твердых марках алюминия (6061, 6082, 7075) можно нарезать резьбу для винта непосредственно. - Алюминий можно сваривать аргоновой сваркой, но качественный шов получается только при TIG-сварке на переменном токе. Непрерывная смена полярности измельчает пленку окислов, которая в противном случае может попасть в шов. Учитывайте это при выборе сварочного аппарата для мастерской, если вам может потребоваться варить и алюминий.
Еще раз важное замечание. Алюминиевые и медные проводники напрямую соединять нельзя! Для соединения проводников из меди и алюминия используйте промежуточный металл, например, стальную клемму.
Источники
В крупных строительных магазинах (OBI, Leroy Merlin, Castorama) обычно есть в наличии алюминиевый профиль разных размеров и форм. Неплохим источником может послужить штампованная алюминиевая посуда — она очень дешева и существует разных форм. Но обратите внимание на марки. Если нужен 6061 и тем более 7075, придется покупать его у фирмы, специализирующейся по металлам.
Ссылки на части руководства:
1
: Проводники: Серебро, Медь, Алюминий.
2
: Проводники: Железо, Золото, Никель, Вольфрам, Ртуть.
3
: Проводники: Углерод, нихромы, термостабильные сплавы, припои, прозрачные проводники.
4
: Неорганические диэлектрики: Фарфор, стекло, слюда, керамики, асбест, элегаз и вода.
5
: Органические полусинтетические диэлектрики: Бумага, щелк, парафин, масло и дерево.
6
: Синтетические диэлектрики на базе фенолформальдегидных смол: карболит (бакелит), гетинакс, текстолит.
7
: Диэлектрики: Стеклотекстолит (FR-4), лакоткань, резина и эбонит.
8
: Пластики: полиэтилен, полипропилен и полистирол.
9
: Пластики: политетрафторэтилен, поливинилхлорид, полиэтилентерефталат и силиконы.
10
: Пластики: полиамиды, полиимиды, полиметилметакрилат и поликарбонат. История использования пластиков.
11
: Изоляционные ленты и трубки.
12
: Финальная
Свойства алюминия
Свойства алюминия
Отличительные особенности алюминия — высокая электропроводимость, теплопроводность, коррозионная стойкость, малая плотность и отличная обрабатываемость давлением в холодном состоянии. **Физические свойства алюминия [2-6]**
**Физические свойства алюминия [2-6]**Плотность (99,996% А1), г/см3, при температуре: |
|
| 20 °С | 2,6989 |
| 1000 °С | 2,289 |
Температура, °С: |
|
| плавления | 660 |
| кипения | ~2452 |
Теплота кДж/моль: |
|
| плавления | 10,55 |
| испарения | 291,4 |
Давление пара, Па, при температуре: |
|
| 660 °С | 0,266 |
| 1123 °С | 13 3 |
| 1279 °С | 133 |
Удельная теплоемкость, Дж/(кг*К), при температуре: |
|
| 20 °С | 929,46 |
| 100 °С | 931,98 |
| Коэффициент линейного расширения при температуре 20-100 °С, К-1 | 24,58*10-6 |
Теплопроводность, Вт/( м*К), при температуре: |
|
| 20 °С | 217 |
| 190 °С | 343 |
| Электропроводность по отношению к меди при температуре 20 °С | 65,5% |
| Удельное электросопротивление, мк*Ом*м | 0. 0265 0265 |
| Температурный коэффициент электросопротивления | 0,042 |
Динамическая вязкость (99,85% А1), Н*с/м2, при температуре: |
|
| 800 °С | 2*10-3 |
| 1123 °С | 1,540-3 |
| 1279 °С | 1,3*10-3 |
Модуль нормальной упругости Е, МПа, при температуре: |
|
| 180 °С | 7,8*104 |
| 20 °С | 7,1*104 |
| 100 °С | 7,0*104 |
| 200 °С | 6,6*104 |
| 400 °С | 5,6*104 |
| 500 °С | 5,0*104 |
| 600 °С | 4,4*104 |
| Модуль сдвига при температуре 20 °С | 2,7*104 МПа |
| Магнитная характеристика алюминия | Слабо парамагнитен |
Временное сопротивление разрыву σв,МПА: |
|
| в отожженном состоянии | 50 |
| в деформированном (холоднокатаном) состоянии | 115 |
Предел текучести s 0,2 : |
|
| в отожженном состоянии | 50-80 |
| в деформированном состоянии | 120 |
Предел усталости (500*10 6 циклов),σ -1: |
|
| в отожженном состоянии | 40 |
| в деформированном состоянии | 50 |
Предел ползучести, при температуре: |
|
| 15 °С | 50 |
| 100 °С | 27 |
| 200 °С | 7 |
Предел прочности при срезе,σ ср: |
|
| в отожженном состоянии | 60 |
| в деформированном состоянии | 100 |
Относительное удлинение,δ: |
|
| в отожженном состоянии | 30-40% |
| в деформированном состоянии | 5-10% |
Относительное сужение, ψ: |
|
| в отожженном состоянии | 70-90% |
| в деформированном состоянии | 50-60% |
| Ударная вязкость при температуре 20 °С aм | 140 |
Твердость по Бринеллю, НВ: |
|
| в отожженном состоянии | 25 |
| в литом состоянии | 20 |
| в деформированном состоянии | 30-35 |
 1.7). Таблица 1.7.
**Механические свойства алюминия различной чистоты**
1.7). Таблица 1.7.
**Механические свойства алюминия различной чистоты**| Состояние | Содержание Аl, % | Предел прочности при растяжении σв2МПа | Предел текучести при растяжении σ.00,2, МПа | Относительное удлинение δ, % | Твердость по Бринеллю, НВ |
| Литой в землю | 99,996 | 50 | — | 45 | 13-15 |
| Литой в землю | 99,5 | 75 | — | 29 | 20 |
| Литой в землю | 99. 0 0 |
85 | — | 20 | 25 |
| Литой в кокиль | 99,0 | 90 | — | 25 | 25 |
| Деформированный и отожженный | 99.0 | 90 | 30 | 30 | 25 |
| Деформированный | 99,0 | 140 | 100 | 12 | 32 |
| Литой в землю | 98,0 | 90 | 35 | 12,5 | 28 |
| Температура | °С |
| литья горячей обработки отжига отпуска Линейная усадка, % Допускаемая деформация (холодная и горячая), % Начало рекристаллизации, °С Жидкотекучесть, мм.  |
690-710 350-450 370-400 150 2,7 75-90 150 317 |
 Алюминий и его сплавы, не содержащие меди, достаточно стойки в естественной (не загрязненной) морской воде. Сернокислые соли магния, натрия, алюминия, а также гипосульфит практически не действуют на технический алюминий. Скорость коррозии алюминия возрастает в присутствии в воде солей ртути, меди или ионов хлора, разрушающих защитную оксидную пленку на алюминии. В концентрированной азотной кислоте при комнатной температуре алюминий и его сплавы устойчивы, но быстро разрушаются в разбавленных кислотах. Слабые растворы серной кислоты, концентрацией до 10%, при комнатной температуре незначительно влияют на технический алюминий, но с повышением концентрации и температуры скорость коррозии резко возрастает. В концентрированной серной кислоте алюминий практически устойчив. Соляная кислота быстро разрушает алюминий и его сплавы, особенно с повышением температуры. Такое же действие на алюминий оказывают растворы плавиковой и бромистоводородной кислот. Слабые растворы фосфорной (менее 1%), хромовой (до 10%) и борной (при всех концентрациях) кислот на алюминий и его сплавы действуют незначительно.
Алюминий и его сплавы, не содержащие меди, достаточно стойки в естественной (не загрязненной) морской воде. Сернокислые соли магния, натрия, алюминия, а также гипосульфит практически не действуют на технический алюминий. Скорость коррозии алюминия возрастает в присутствии в воде солей ртути, меди или ионов хлора, разрушающих защитную оксидную пленку на алюминии. В концентрированной азотной кислоте при комнатной температуре алюминий и его сплавы устойчивы, но быстро разрушаются в разбавленных кислотах. Слабые растворы серной кислоты, концентрацией до 10%, при комнатной температуре незначительно влияют на технический алюминий, но с повышением концентрации и температуры скорость коррозии резко возрастает. В концентрированной серной кислоте алюминий практически устойчив. Соляная кислота быстро разрушает алюминий и его сплавы, особенно с повышением температуры. Такое же действие на алюминий оказывают растворы плавиковой и бромистоводородной кислот. Слабые растворы фосфорной (менее 1%), хромовой (до 10%) и борной (при всех концентрациях) кислот на алюминий и его сплавы действуют незначительно. Органические кислоты — уксусная, масляная, лимонная, винная, а также кислые (незагрязненные) фруктовые соки, вино оказывают слабое действие на алюминий и его сплавы, за исключением щавелевой и муравьиной кислот. Алюминий и его сплавы быстро разрушаются в растворах едких щелочей, однако в растворах аммиака они довольно стойки, особенно сплавы, содержащие магний. Амины на них действуют также незначительно. Следует отметить, что алюминий и однофазные сплавы на алюминиевой основе более стойки в коррозионном отношении, чем сплавы двухфазные и многофазные. **Влияние примесей на свойства алюминия.** На коррозионные, физические, механические и технологические свойства алюминия оказывают значительное влияние примеси различных элементов. Так, например, большинство примесей снижают электропроводность алюминия (рис. 1.1). Основные примеси в алюминии — железо и кремний. Железо снижает коррозионную стойкость, электропроводность и пластичность алюминия, но несколько повышает его прочность. Диаграмма состояния системы Al-Fe, приведенная на рис.
Органические кислоты — уксусная, масляная, лимонная, винная, а также кислые (незагрязненные) фруктовые соки, вино оказывают слабое действие на алюминий и его сплавы, за исключением щавелевой и муравьиной кислот. Алюминий и его сплавы быстро разрушаются в растворах едких щелочей, однако в растворах аммиака они довольно стойки, особенно сплавы, содержащие магний. Амины на них действуют также незначительно. Следует отметить, что алюминий и однофазные сплавы на алюминиевой основе более стойки в коррозионном отношении, чем сплавы двухфазные и многофазные. **Влияние примесей на свойства алюминия.** На коррозионные, физические, механические и технологические свойства алюминия оказывают значительное влияние примеси различных элементов. Так, например, большинство примесей снижают электропроводность алюминия (рис. 1.1). Основные примеси в алюминии — железо и кремний. Железо снижает коррозионную стойкость, электропроводность и пластичность алюминия, но несколько повышает его прочность. Диаграмма состояния системы Al-Fe, приведенная на рис. 1.2, показывает, что железо незначительно растворяется в алюминии в твердом состоянии. При температуре эвтектики (655°С) растворимость железа достигает 0,052% и с понижением температуры граница твердого раствора а резко сдвигается в сторону алюминия. Железо в алюминии присутствует в виде самостоятельной фазы Al3Fe. Железо — вредная примесь не только в алюминии, но и в сплавах алюминия с кремнием и магнием. Однако в жаропрочных алюминиевых сплавах железо (в сочетании с никелм) является полезной примесью. Обычная примесь в алюминии — кремний. В сплавах на алюминиевой основе кремний наряду с медью, магнием, цинком, а также марганцем, никелем и хромом вводится в качестве основного компонента. Образующиеся при этом соединения CuAl2, Mg2Si, CuMgAl2 и др. являются эффективными упрочнителями алюминиевых сплавов. Из диаграммы состояния алюминий-кремний (рис. 1.3) видно, что при температуре эвтектики 577°С в алюминии растворяется до 1,65% кремния. С понижением температуры область твердого раствора α резко уменьшается.
1.2, показывает, что железо незначительно растворяется в алюминии в твердом состоянии. При температуре эвтектики (655°С) растворимость железа достигает 0,052% и с понижением температуры граница твердого раствора а резко сдвигается в сторону алюминия. Железо в алюминии присутствует в виде самостоятельной фазы Al3Fe. Железо — вредная примесь не только в алюминии, но и в сплавах алюминия с кремнием и магнием. Однако в жаропрочных алюминиевых сплавах железо (в сочетании с никелм) является полезной примесью. Обычная примесь в алюминии — кремний. В сплавах на алюминиевой основе кремний наряду с медью, магнием, цинком, а также марганцем, никелем и хромом вводится в качестве основного компонента. Образующиеся при этом соединения CuAl2, Mg2Si, CuMgAl2 и др. являются эффективными упрочнителями алюминиевых сплавов. Из диаграммы состояния алюминий-кремний (рис. 1.3) видно, что при температуре эвтектики 577°С в алюминии растворяется до 1,65% кремния. С понижением температуры область твердого раствора α резко уменьшается. Примеси кальция и других элементов, присутствующих в стандартных марках алюминия в незначительном количестве, не имеют практического значения. Небольшие добавки церия, натрия и титана оказывают существенное влияние на структуру и свойства определенных алюминиевых сплавов. Водород хорошо растворяется в алюминии и оказывает отрицательное влияние на его свойства, вызывая при литье пористость. Азот при высоких температурах вступает в реакцию с алюминием с образованием тугоплавкого соединения. **Токсикологические свойства алюминия [7]**. В соответствии с ГОСТом по степени воздействия на организм человека алюминиевую пыль относят к III классу опасности. Предельно-допустимая концентрация (ПДК) в воздухе пыли металлического алюминия и его оксидов составляет 2 мг/м3. При постоянном вдыхании пыли металлического алюминия и его оксида может возникнуть алюминоз легких. Рабочие, подвергшиеся воздействию пыли, должны проходить периодически флюорографическое обследование. У рабочих, занятых в производстве алюминия, часты катары верхних дыхательных путей (рипиты, фарингиты).
Примеси кальция и других элементов, присутствующих в стандартных марках алюминия в незначительном количестве, не имеют практического значения. Небольшие добавки церия, натрия и титана оказывают существенное влияние на структуру и свойства определенных алюминиевых сплавов. Водород хорошо растворяется в алюминии и оказывает отрицательное влияние на его свойства, вызывая при литье пористость. Азот при высоких температурах вступает в реакцию с алюминием с образованием тугоплавкого соединения. **Токсикологические свойства алюминия [7]**. В соответствии с ГОСТом по степени воздействия на организм человека алюминиевую пыль относят к III классу опасности. Предельно-допустимая концентрация (ПДК) в воздухе пыли металлического алюминия и его оксидов составляет 2 мг/м3. При постоянном вдыхании пыли металлического алюминия и его оксида может возникнуть алюминоз легких. Рабочие, подвергшиеся воздействию пыли, должны проходить периодически флюорографическое обследование. У рабочих, занятых в производстве алюминия, часты катары верхних дыхательных путей (рипиты, фарингиты). Наибольшую опасность для здоровья представляет процесс электролиза глинозема, протекающий в расплавленном криолите (Na3AlF6) при температуре 950 °С. Электролиз расплавленных солей может сопровождаться выбросами большого количества фторидной пыли, фторсодержащих газов, а также паров и частиц битума-компонента анодной массы. Рабочим, занятым на этой операции, также грозят ожоги кожи и глаз при попадании на них расплавленного металла. Во избежании несчастных случаев электролизные ванны необходимо надежно изолировать, рабочие должны иметь средства индивидуальной защиты:, противопылевые маски, очки,,, перчатки, фартуки, сапоги и т.д. В электролизных цехах должен регулярно проводиться контроль за содержанием пыли в воздухе.
Наибольшую опасность для здоровья представляет процесс электролиза глинозема, протекающий в расплавленном криолите (Na3AlF6) при температуре 950 °С. Электролиз расплавленных солей может сопровождаться выбросами большого количества фторидной пыли, фторсодержащих газов, а также паров и частиц битума-компонента анодной массы. Рабочим, занятым на этой операции, также грозят ожоги кожи и глаз при попадании на них расплавленного металла. Во избежании несчастных случаев электролизные ванны необходимо надежно изолировать, рабочие должны иметь средства индивидуальной защиты:, противопылевые маски, очки,,, перчатки, фартуки, сапоги и т.д. В электролизных цехах должен регулярно проводиться контроль за содержанием пыли в воздухе.Способ приготовления галогенидсодержащего флюса для обработки алюминия и его сплавов
Область техники
Изобретение относится к цветной металлургии, в частности к литейному производству алюминия и его сплавов, к переработке вторичного алюминиевого сырья, и касается технологии приготовления галогенидсодержащих флюсов.
Уровень техники
В алюминиевой промышленности используют большое количество различных флюсов, предназначенных для повышения качества алюминия и его сплавов, снижения потерь металла. Как правило, большинство флюсов состоит из хлоридов и фторидов металлов, что обусловлено требованиями к их физико-химическим свойствам, в частности к температурам плавления галогенидов, их термической стойкости, вязкости расплавов и стоимости компонентов флюсов.
В научной и патентной литературе описано множество составов флюсов различного назначения, но относительно мало информации по технологии приготовления флюсов. Известно, что флюсы готовят по двум вариантам:
— механическое смешивание порошков хлоридов металлов или хлоридов и фторидов металлов в определенном соотношении;
— плавление хлоридов металлов или хлоридов и фторидов металлов с последующей кристаллизацией расплава и получением кусковых флюсов.
Заявляемое техническое решение относится к технологии получения плавленых галогенидсодержащих флюсов на основе хлоридов и фторидов металлов для обработки алюминия и его сплавов.
Известен флюс для рафинирования алюминиевых сплавов (А.с. СССР №1196400, C22B 9/10, C22C 1/06. Опубл. 1985 г.), содержащий хлорид натрия и хлорид калия, отличающийся тем, что, с целью обеспечения более полного удаления неметаллических включений из сплава и одновременного снижения выбросов в атмосферу, он дополнительно содержит базальт при следующем соотношении компонентов, масс. %:
|
Технология приготовления этого флюса включает загрузку в смеситель требуемого количества ингредиентов, перемешивание и измельчение до дисперсности 0,03-0,5 мм.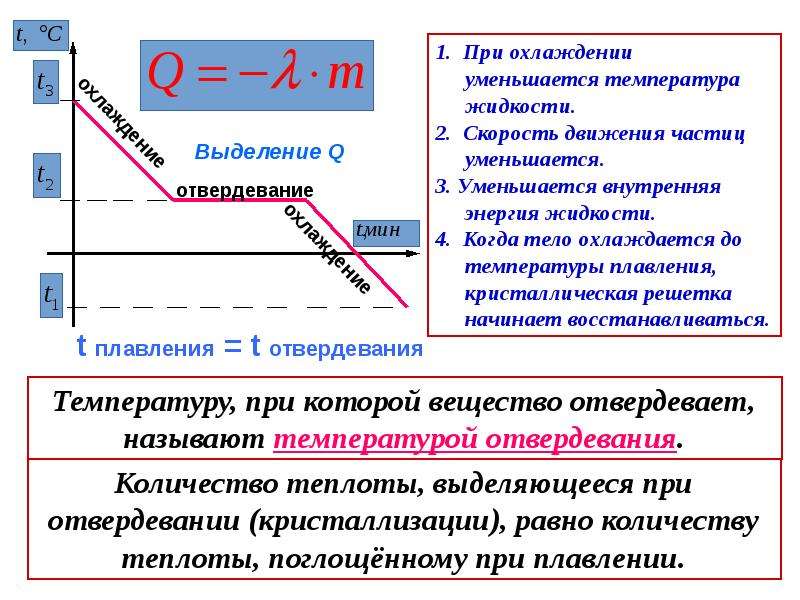 Полученную смесь термообрабатывают при 473-573 К. Для изготовления флюса используют технический хлорид натрия, хлорид калия и базальт Ровенского месторождения. Флюс в количестве 10-15% от массы расплава рафинируемого металла помещают на днище металлургической емкости, затем флюс расплавляют и в жидкий флюс подают расплав рафинируемого металла струей, перемешивающей жидкий металл с расплавленным флюсам. При этом флюс, имеющий меньшую плотность, чем расплав металла, всплывает на поверхность, проходя через всю толщу расплава металла, и взаимодействует с неметаллическими примесями, содержащимися в металле.
Полученную смесь термообрабатывают при 473-573 К. Для изготовления флюса используют технический хлорид натрия, хлорид калия и базальт Ровенского месторождения. Флюс в количестве 10-15% от массы расплава рафинируемого металла помещают на днище металлургической емкости, затем флюс расплавляют и в жидкий флюс подают расплав рафинируемого металла струей, перемешивающей жидкий металл с расплавленным флюсам. При этом флюс, имеющий меньшую плотность, чем расплав металла, всплывает на поверхность, проходя через всю толщу расплава металла, и взаимодействует с неметаллическими примесями, содержащимися в металле.
Заявленный флюс не содержит кристаллогидраты, поэтому предварительная обработка смеси хлорида натрия, хлорида калия и базальта при 473-573 К нецелесообразна, так как приведет к непроизводительному расходу энергоносителей, тем более, что после обработки при 473-573 К весь объем смеси плавят в металлургической емкости при более высокой температуре. При этом не регламентируются условия плавки флюса, в частности скорость плавления флюса и температура перегрева флюса над температурой плавления.
Наиболее близкой по технической сущности к заявляемому решению является технология приготовления плавленых флюсов (монография: Напалков В.И., Махов С.В., Бобрышев Б.Л., Моисеев B.C. Физико-химические процессы рафинирования алюминия и его сплавов. — М.: Теплотехник, 2011. С. 342).
Согласно ближайшему аналогу, исходные компоненты флюса измельчают и взвешивают в соответствии с расчетным составом флюса. Первоначально расплавляют соли, составляющие основу флюса, после чего в расплав вводят остальные компоненты. Расплав флюса тщательно перемешивают и анализируют химический состав. Готовый флюс разливают в сухие изложницы или металлические контейнеры. Затем готовый флюс измельчают и затаривают.
К недостаткам известной технологии приготовления флюсов относятся:
— неизбирательный подход к плавлению компонентов флюса, особенно обладающих повышенной упругостью паров (летучестью), склонностью к пирогидролизу (взаимодействию с парами воды) при высокой температуре или содержащих кристаллогидраты галогенидов;
— отсутствие контроля над скоростью плавления флюса и температурой перегрева флюса выше температуры плавления.
Раскрытие изобретения
Задачей изобретения является повышение эффективности производства галогенидсодержащих флюсов за счет контроля и регулирования последовательности и температурно-временных условий плавления компонентов флюса; улучшение экологической обстановки за счет применения данного флюса.
Техническими результатами предлагаемого способа являются:
— уменьшение потерь компонентов флюса за счет испарения и пирогидролиза (высокотемпературного взаимодействия галогенидов с парами воды) галогенидов и, как следствие, повышение выхода годного флюса;
— максимальное соответствие расчетного состава флюса фактически полученному при переплавке;
— снижение удельного расхода сырья и энергозатрат на получение плавленых флюсов;
— уменьшение выбросов газообразных хлоридов и фторидов.
Технический результат достигается тем, что в способе приготовления галогенидсодержащего флюса для обработки алюминия и его сплавов, включающем взвешивание компонентов флюса, порционную загрузку в печь и плавление галогенидов, составляющих основу флюса, с последующим введением в расплав остальных галогенидов металлов, перемешивание расплава флюса, грануляцию жидкого флюса или кристаллизацию расплава и дробление флюса, согласно изобретению 20÷40% вес. бинарных галогенидов металлов с равновесной упругостью пара при 827°C менее 1330 Па плавят со скоростью нагрева 15÷40°C/мин, после чего в расплав флюса порциями вводят оставшиеся 60÷80% вес. бинарных галогенидов металлов с равновесной упругостью пара при 827°C менее 1330 Па, затем в расплав флюса загружают комплексные галогениды металлов и/или бинарные галогениды металлов, равновесная упругость пара которых при 827°C более 1330 Па.
бинарных галогенидов металлов с равновесной упругостью пара при 827°C менее 1330 Па плавят со скоростью нагрева 15÷40°C/мин, после чего в расплав флюса порциями вводят оставшиеся 60÷80% вес. бинарных галогенидов металлов с равновесной упругостью пара при 827°C менее 1330 Па, затем в расплав флюса загружают комплексные галогениды металлов и/или бинарные галогениды металлов, равновесная упругость пара которых при 827°C более 1330 Па.
Кроме того, в заявляемом способе предусмотрены следующие дополнительные действия.
При загрузке в расплав флюса комплексных галогенидов металлов и/или бинарных галогенидов металлов, равновесная упругость пара которых при 827°C более 1330 Па, температуру перегрева флюса над ликвидусом поддерживают не выше 80°C.
Комплексные галогениды металлов и бинарные галогениды металлов, равновесная упругость пара которых при 827°C более 1330 Па, загружают в расплав с избытком 2÷6% вес. от расчетного содержания в готовом флюсе.
Также бинарные и комплексные галогениды металлов, содержащие кристаллогидраты, предварительно обезвоживают при 220÷300°C, при этом отношение площади поверхности расплавленного флюса в печи к полному объему флюса в печи поддерживают не более 0,8.
Равновесные упругости пара галогенидов можно найти в справочной литературе, например «Напалков В.И., Махов С.В., Бобрышев Б.Л., Моисеев B.C. Физико-химические процессы рафинирования алюминия и его сплавов. — М.: Теплотехник, 2011. С. 342.» или «http://chemanalytica.com/book/novyy_spravochnik_khimika_i_tekhnologa/12_obshchie_svedeniya/6054».
Техническая сущность заявляемого решения заключается в следующем.
В качестве исходных компонентов для получения галогенидсодержащего флюса предусматривается использование хлоридов и фторидов бинарных и комплексных металлов.
К бинарным хлоридам и фторидам металлов относят соли соляной (HCl) и фтористоводородной (HF) кислот, состоящие из одного вида ионов металла и соответствующего галогена (например, NaCl, CaCl2, AlF3).
Комплексные галогениды металлов — это твердые соединения, содержащие два или более вида ионов металлов и один тип атомов галогена (например, Na3AlF6, KMgCl3).
В заявляемом техническом решении предусматривается раздельное плавление хлоридов и фторидов металлов, в зависимости от их термической стойкости. В качестве параметра термической стойкости выбрана упругость пара галогенида. Термически более стойкие галогениды, равновесная упругость пара которых при 827°C менее 1330 Па, плавят в первую очередь. Это связано с тем, что на начальной стадии плавления флюса порошковая смесь галогенидов имеет большую удельную поверхность и, соответственно, повышенную степень испарения и пирогидролиза. Поэтому для снижения потерь флюса предусмотрено его порционное плавление. На первой стадии 20÷40% вес. бинарных галогенидов металлов с равновесной упругостью пара при 827°C менее 1330 Па плавят со скоростью нагрева 15÷40°C/мин. Заявленная высокая скорость нагрева компонентов флюса (15÷40°C/мин) на первой стадии плавления уменьшит его потери за счет испарения. Нижний и верхний пределы по скорости нагрева компонентов флюса зависят от количества переплавляемого флюса. Чем больше количество флюса, наплавляемого за одну плавку, тем объем первой партии ближе к 20% вес., а скорость нагрева компонентов флюса — к нижнему пределу: 15°C/мин.
Чем больше количество флюса, наплавляемого за одну плавку, тем объем первой партии ближе к 20% вес., а скорость нагрева компонентов флюса — к нижнему пределу: 15°C/мин.
Плавление 20÷40% вес. бинарных галогенидов металлов с низкой упругостью пара при высокой скорости нагрева (15÷40°C/мин) позволит быстро получить расплав флюса с минимальными потерями. Последующее плавление оставшихся 60÷80% вес. бинарных галогенидов металлов с низкой упругостью пара проводят загружая порции галогенидов в расплав флюса. Такая загрузка уменьшает потери флюса за счет испарения и пирогидролиза.
После расплавления термически стойких галогенидов в расплав флюса загружают комплексные галогениды металлов и/или бинарные галогениды металлов, равновесная упругость пара которых при 827°C более 1330 Па. Предусматриваются следующие варианты использования флюсов:
— загружают комплексные галогениды металлов;
— загружают бинарные галогениды металлов, равновесная упругость пара которых при 827°C более 1330 Па;
— загружают комплексные галогениды металлов и бинарные галогениды металлов, равновесная упругость пара которых при 827°C более 1330 Па.
Загрузка указанных галогенидов непосредственно в расплав снизит потери легколетучих компонентов флюса. При этом необходимо поддерживать температуру перегрева расплава флюса над ликвидусом не выше 80°C, чтобы минимизировать потери галогенидов за счет испарения и пирогидролиза. Заявленная температура перегрева (не более 80°C) обеспечит достаточную жидкотекучесть флюса. Перегрев расплава флюса до более высокой температуры приведет, кроме того, к непроизводительному расходу энергоносителей.
Учитывая склонность термически нестойких комплексных галогенидов металлов и бинарных галогенидов металлов, равновесная упругость пара которых при 827°C более 1330 Па к потерям при плавлении, их загружают в расплав с избытком 2÷6% вес. от расчетного содержания в готовом флюсе. Это обеспечит более точное соответствие расчетного состава флюса фактическому составу, полученному после переплавки порошковых галогенидов. Величина избытка термически нестойких галогенидов в интервале 2÷6% от расчетного зависит от свойств галогенидов и определяется экспериментальным путем.
Бинарные и комплексные галогениды металлов, содержащие кристаллогидраты, рекомендуется предварительно обезвоживать при 220÷300°C. Из кристаллогидратов, наиболее часто используемых для приготовления флюсов, используются карналлит KMgCl3⋅6H2O и бишофит MgCl2⋅6H2O.
Обезвоживание карналлита KMgCl3⋅6H2O при атмосферном давлении на воздухе протекает в две стадии. Первая — дегидратация шестиводного карналлита до двухводного (схема 1). Это превращение начинается при 85°C и заканчивается при 145°C. Вторая стадия — обезвоживание двухводного карналлита до безводного KMgCl3 — завершается при 190÷200°C (Ветюков М.М., Цыплаков A.M., Школьников С.Н. Электрометаллургия алюминия и магния. Учебник для вузов. — М.: Металлургия, 1987. — 320 с.: ил.).
Дегидратация бишофита MgCl2⋅6H2O протекает в три стадии и заканчивается образованием моногидрата хлорида магния MgCl2⋅H2O (схема 2) (Ветюков М. М., Цыплаков A.M., Школьников С.Н. Электрометаллургия алюминия и магния. Учебник для вузов. — М.: Металлургия, 1987. — 320 с.: ил.).
М., Цыплаков A.M., Школьников С.Н. Электрометаллургия алюминия и магния. Учебник для вузов. — М.: Металлургия, 1987. — 320 с.: ил.).
Более глубокое обезвоживание моногидрата хлорида магния MgCl2⋅H2O, то есть удаление последней молекулы кристаллизационной воды путем его дальнейшего нагревания на воздухе, сопровождается гидролизом хлорида магния с выделением в газовую фазу хлористого водорода HCl.
Поэтому дальнейшее удаление влаги из MgCl2⋅H2O на стадии предварительной дегидратации в воздушной атмосфере нецелесообразно.
В результате предварительного обезвоживания кристаллогидратов бинарных и комплексных галогенидов металлов при низких температурах (220÷300°C) минимизируются потери хлоридов и фторидов металлов вследствие пирогидролиза (высокотемпературного взаимодействия галогенидов с парами воды). В случае загрузки кристаллогидратов бинарных и комплексных галогенидов металлов без предварительного обезвоживания в расплав флюса неизбежен пирогидролиз хлоридов и фторидов металлов с участием в процессе практически всей влаги, содержащейся в кристаллогидратах. В результате увеличиваются потери хлоридов и фторидов, ухудшается экологическая обстановка.
В результате увеличиваются потери хлоридов и фторидов, ухудшается экологическая обстановка.
Еще ограничение, направленное на уменьшение потерь флюса при его приготовлении, заключается в том, что отношение площади поверхности расплавленного флюса в печи к полному объему флюса в печи поддерживают не более 0,8. Экспериментальным путем установлено, что при отношении площади поверхности расплавленного флюса в печи к полному объему флюса в печи более 0,8 возрастают потери флюса благодаря испарению и пирогидролизу хлоридов и фторидов с увеличенной поверхности флюса. Для снижения потерь с поверхности расплавленного флюса желательно иметь минимальную площадь поверхности флюса при максимальном объеме расплава. Иными словами желательно, чтобы печь для плавления флюса была глубокой и с узкой горловиной. Как пример для тигельной газовой печи это отношение составляет 0,67.
Сравнение предлагаемого решения с ближайшим аналогом показывает следующее. Предлагаемое решение и ближайший аналог характеризуются сходными признаками:
— оба решения распространяются на технологию приготовления плавленых флюсов на основе галогенидов металлов;
— включают предварительное взвешивание компонентов флюса;
— порционную и последовательную загрузку в печь галогенидов металлов, перемешивание расплава флюса;
— кристаллизацию расплава и дробление флюса.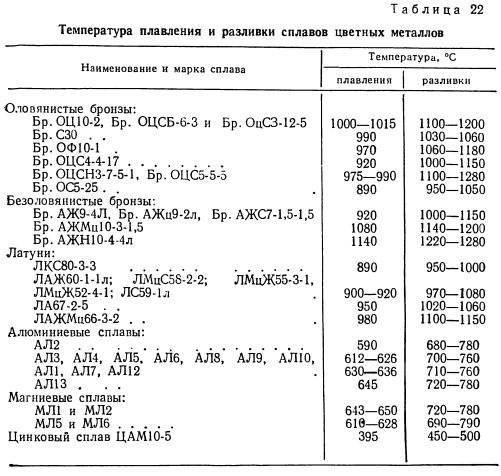
Предлагаемое решение отличается от ближайшего аналога следующими признаками:
— при приготовлении флюса первоначально, со скоростью нагрева 15÷40°C/мин, плавят 20÷40% вес. бинарных галогенидов металлов с равновесной упругостью пара при 827°C менее 1330 Па, после чего в расплав флюса порциями вводят оставшиеся 60÷80% вес. бинарных галогенидов металлов с равновесной упругостью пара при 827°C менее 1330 Па;
— после плавления термически стойких галогенидов в расплав флюса загружают комплексные галогениды металлов и/или бинарные галогениды металлов, равновесная упругость пара которых при 827°C более 1330 Па;
— при загрузке в расплав флюса комплексных галогенидов металлов и/или бинарных галогенидов металлов, равновесная упругость пара которых при 827°C более 1330 Па, температуру перегрева флюса над ликвидусом поддерживают не выше 80°C;
— комплексные галогениды металлов и бинарные галогениды металлов, равновесная упругость пара которых при 827°C более 1330 Па, загружают в расплав с избытком 2÷6% вес. от расчетного содержания в готовом флюсе;
от расчетного содержания в готовом флюсе;
— бинарные и комплексные галогениды металлов, содержащие кристаллогидраты, предварительно обезвоживают при 220÷300°C;
— отношение площади поверхности расплавленного флюса в печи к полному объему флюса в печи поддерживают не более 0,8.
Предлагаемое техническое решение характеризуется признаками как сходными с признаками ближайшего аналога, так и отличительными признаками, что позволяет сделать вывод о его соответствии условию патентоспособности «новизна».
Сравнительный анализ предлагаемого технического решения с известными решениями в данной области техники, проведенный по результатам поиска в патентной и научно-технической литературе, выявил следующее:
Известна технология плавки покровно-рафинирующего флюса, включающая:
— загрузку в печь части смеси хлористых солей и расплавление загруженной смеси;
— загрузку в жидкий флюс и расплавление оставшейся части хлористых солей;
— введение в готовый расплав фтористых солей — NaF и AlF3 при температуре 700-740°C с периодическим перемешиванием расплава до гомогенного состава;
— разливку готового флюса и его дробление.
Источник информации: Библиофонд. Электронная библиотека студента. Дипломная работа по химии: «Разработка нового состава флюса для рафинирования алюминиевых сплавов от магния» Подраздел. 3.6.2 Технология плавки покровно-рафинирующего флюса С. 48.
В процессе анализа, проведенного с целью определения «уровня техники» по отобранному массиву, частично приведенному в разделе описания — «аналоги», выявлено, что отдельные признаки объекта защиты известны:
— известна порционная загрузка и плавление компонентов флюса с последующей догрузкой оставшейся части солей;
— известна последовательность приготовления флюса, при которой первоначально расплавляют соли, составляющие основу флюса, после чего в расплав вводят остальные компоненты;
— известны ограничения по температуре в процессе плавления флюсов.
В результате поиска и сравнительного анализа не выявлено технических решений, характеризующихся идентичными или эквивалентными признаками предлагаемому решению, а именно:
— не выявлено, что при приготовлении флюса первоначально, со скоростью нагрева 15÷40°C/мин, плавят 20÷40% вес. бинарных галогенидов металлов с равновесной упругостью пара при 827°C менее 1330 Па, после чего в расплав флюса порциями вводят оставшиеся 60÷80% вес. бинарных галогенидов металлов с равновесной упругостью пара при 827°C менее 1330 Па;
бинарных галогенидов металлов с равновесной упругостью пара при 827°C менее 1330 Па, после чего в расплав флюса порциями вводят оставшиеся 60÷80% вес. бинарных галогенидов металлов с равновесной упругостью пара при 827°C менее 1330 Па;
— не установлено, что после плавления термически стойких галогенидов в расплав флюса загружают комплексные галогениды металлов и/или бинарные галогениды металлов, равновесная упругость пара которых при 827°C более 1330 Па;
— не найдено, что при загрузке в расплав флюса комплексных галогенидов металлов и/или бинарных галогенидов металлов, равновесная упругость пара которых при 827°C более 1330 Па, температуру перегрева флюса над ликвидусом поддерживают не выше 80°C;
— не выявлен факт загрузки в расплав комплексных галогенидов металлов и бинарных галогенидов металлов, равновесная упругость пара которых при 827°C более 1330 Па, с избытком 2÷6% вес. от расчетного содержания в готовом флюсе;
— не выявлено ограничения отношения площади поверхности расплавленного флюса в печи к полному объему флюса в печи на уровне не более 0,8.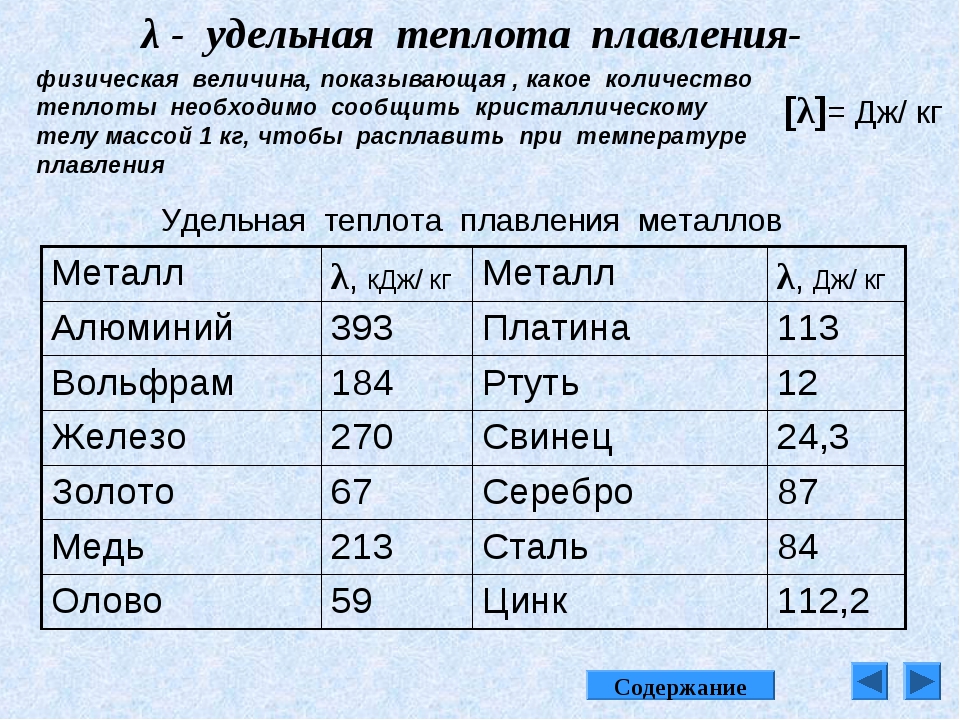
Учитывая вышеизложенное и принимая во внимание то, что использование совокупности известных и неизвестных признаков, характеризующих предлагаемое техническое решение в объеме, представленном в формуле изобретения, позволило выйти на новый уровень в разработке перспективной технологии приготовления галогенидсодержащего флюса для обработки алюминия и его сплавов, можно сделать вывод о соответствии предлагаемого решения условию патентоспособности «изобретательский уровень».
Соответствие заявляемого решения условию патентоспособности «промышленная применимость» доказывается экспериментальными данными, полученными в ходе лабораторных опытов.
Пример 1. Обоснование количества бинарных галогенидов металлов (от 20 до 40% вес.) с равновесной упругостью пара при 827°C менее 1330 Па, которые плавят на первой стадии приготовления флюсов.
Готовят пять плавленых покровных флюсов на основе химически чистых порошков хлоридов натрия, калия и карналлита. Состав исходных хлоридов, % вес.: бинарные хлориды: NaCl=20,7; KCl=66,85; комплексный хлорид: KMgCl2=12,82 — взят с избытком в 3% вес. (избыток = 0,037 кг) от расчетного содержания во флюсе. Вес исходных хлоридов 10,037 кг. Готовят пять одинаковых смесей указанного веса и состава. Причем каждая смесь состоит из двух составляющих: первая — бинарные хлориды NaCl+KCl весом 8,755 кг, вторая — комплексный хлорид KMgCl3 весом 1,282 кг. Плавление проводят в тиглях из нержавеющей стали в шахтной печи сопротивления, нагретой до 730±10°C. Предварительно пустой тигель нагревают до тех пор, пока его температура не сравняется с температурой печи. Затем в нагретый тигель загружают 0,8755 кг смеси бинарных хлоридов NaCl+KCl (10% вес. от общего веса NaCl+KCl) и фиксируют время до полного плавления флюса и нагрева до 730±10°C. Равновесная упругость пара при 827°C составляет: для NaCl ~ 107 Па, KCl ~ 199 Па, что существенно ниже 1330 Па. Исходя из времени плавления смеси NaCl+KCl, рассчитывают скорость нагрева смеси до 730±10°C.
Состав исходных хлоридов, % вес.: бинарные хлориды: NaCl=20,7; KCl=66,85; комплексный хлорид: KMgCl2=12,82 — взят с избытком в 3% вес. (избыток = 0,037 кг) от расчетного содержания во флюсе. Вес исходных хлоридов 10,037 кг. Готовят пять одинаковых смесей указанного веса и состава. Причем каждая смесь состоит из двух составляющих: первая — бинарные хлориды NaCl+KCl весом 8,755 кг, вторая — комплексный хлорид KMgCl3 весом 1,282 кг. Плавление проводят в тиглях из нержавеющей стали в шахтной печи сопротивления, нагретой до 730±10°C. Предварительно пустой тигель нагревают до тех пор, пока его температура не сравняется с температурой печи. Затем в нагретый тигель загружают 0,8755 кг смеси бинарных хлоридов NaCl+KCl (10% вес. от общего веса NaCl+KCl) и фиксируют время до полного плавления флюса и нагрева до 730±10°C. Равновесная упругость пара при 827°C составляет: для NaCl ~ 107 Па, KCl ~ 199 Па, что существенно ниже 1330 Па. Исходя из времени плавления смеси NaCl+KCl, рассчитывают скорость нагрева смеси до 730±10°C. Далее в расплав флюса небольшими порциями загружают остальные 7,8795 кг смеси NaCl+KCl. Каждую порцию доводят до полного плавления, при этом фиксируют время. После полного плавления бинарных хлоридов NaCl+KCl расплав нагревают до 730±10°C и загружают в него 1,282 кг комплексного хлорида KMgCl3, полученного в результате предварительной дегидратации карналлита KMgCl3⋅6H2O при 230±10°C. Температура плавления полученного покровного флюса, в соответствии с диаграммой состояния системы NaCl — KCl — MgCl2 (Лебедев В.А., Седых В.И. Металлургия магния: учебное пособие. Екатеринбург: УГТУ-УПИ, 2010. 174 с.), равна ~680°C. Температура перегрева флюса над ликвидусом составляет 50±10°C. Готовый флюс разливают в железную изложницу, охлаждают и взвешивают. Отбирают представительную пробу готового флюса и анализируют его химический состав. По результатам анализа рассчитывают фактический состав полученного флюса и сравнивают с расчетным (исходным) составом.
Далее в расплав флюса небольшими порциями загружают остальные 7,8795 кг смеси NaCl+KCl. Каждую порцию доводят до полного плавления, при этом фиксируют время. После полного плавления бинарных хлоридов NaCl+KCl расплав нагревают до 730±10°C и загружают в него 1,282 кг комплексного хлорида KMgCl3, полученного в результате предварительной дегидратации карналлита KMgCl3⋅6H2O при 230±10°C. Температура плавления полученного покровного флюса, в соответствии с диаграммой состояния системы NaCl — KCl — MgCl2 (Лебедев В.А., Седых В.И. Металлургия магния: учебное пособие. Екатеринбург: УГТУ-УПИ, 2010. 174 с.), равна ~680°C. Температура перегрева флюса над ликвидусом составляет 50±10°C. Готовый флюс разливают в железную изложницу, охлаждают и взвешивают. Отбирают представительную пробу готового флюса и анализируют его химический состав. По результатам анализа рассчитывают фактический состав полученного флюса и сравнивают с расчетным (исходным) составом.
По аналогичной методике плавят оставшиеся четыре смеси хлоридов, изменяя при этом от 20% до 50% вес.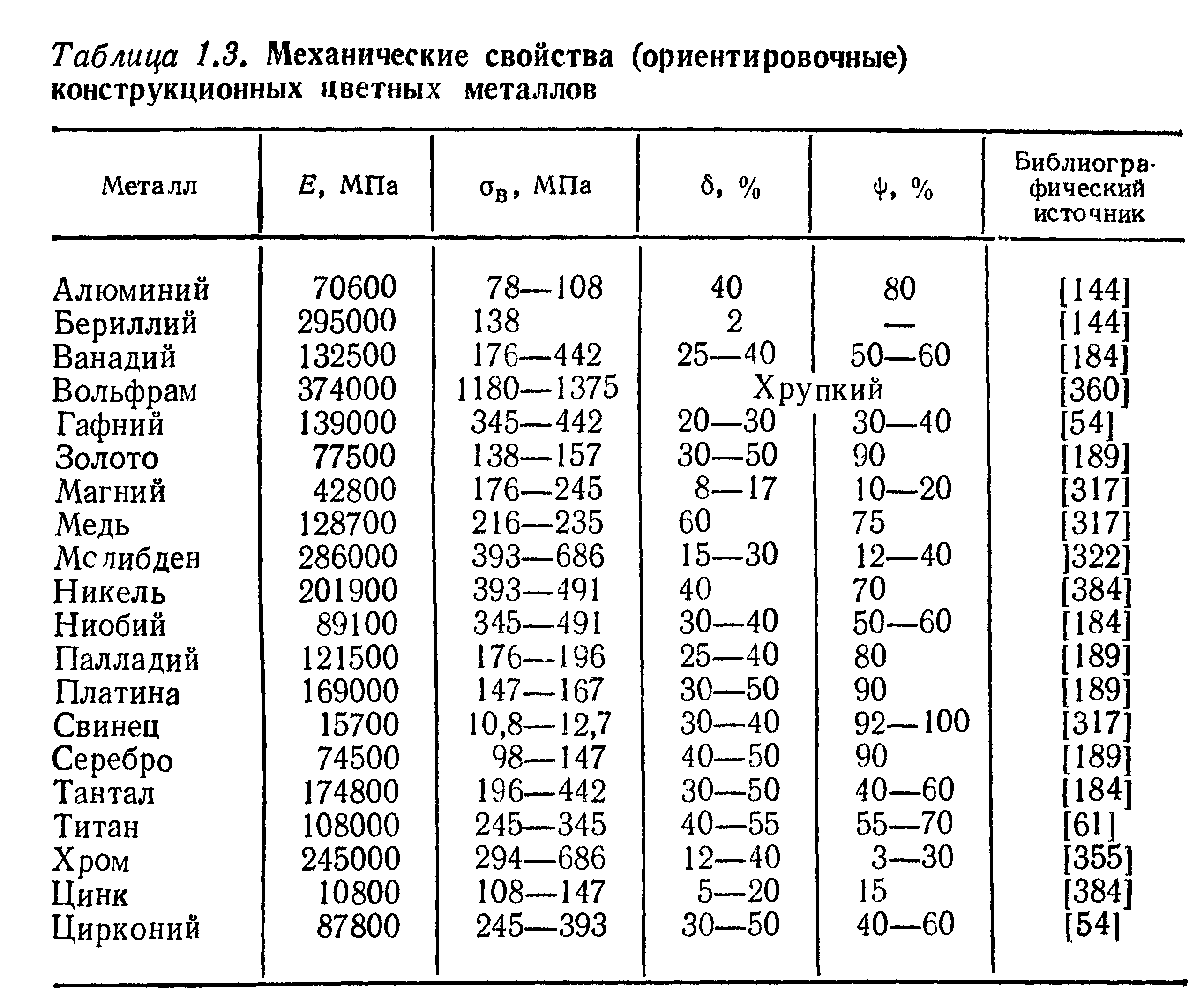 количество бинарных хлоридов NaCl+KCl с равновесной упругостью пара при 827°C менее 1330 Па, первоначально загружаемых в нагретый тигель.
количество бинарных хлоридов NaCl+KCl с равновесной упругостью пара при 827°C менее 1330 Па, первоначально загружаемых в нагретый тигель.
Результаты опытов приведены в таблицах 1, 2.
Из полученных результатов лабораторных опытов следует:
1. При первоначальном плавлении смеси бинарных хлоридов (NaCl+KCl) в количестве менее 20% вес. (опыт 1.1) увеличивается общее время приготовления флюса за счет большого количества порций при загрузке и плавлении оставшейся части бинарных хлоридов. Увеличенное время приготовления флюса приводит к дополнительным потерям компонентов флюса за счет испарения и пирогидролиза. В результате увеличивается расхождение фактического состава готового флюса от расчетного состава.
2. При первоначальном плавлении смеси бинарных хлоридов (NaCl+KCl) в количестве более 40% вес. (опыт 1.5) время приготовления флюса уменьшается. Но за счет плавления на начальной стадии 50% порошковой смеси (NaCl+KCl) с большой удельной поверхностью возрастают потери хлоридов, что приводит к снижению количества готового флюса и отклонению его состава от расчетного.
3. Флюсы, полученные в опытах 1.2, 1.3, 1.4, в которых количество бинарных галогенидов металлов с равновесной упругостью пара при 827°C менее 1330 Па составляло от 20% до 40% вес., наиболее близки к расчетному (исходному) составу.
Пример 2. Обоснование скорости нагрева бинарных галогенидов металлов в пределах 15÷40°C/мин.
Готовят пять плавленых покровных флюсов состава, приведенного в примере 1, из пяти одинаковых смесей, состоящих из двух частей: первая — смесь NaCl+KCl весом 8,755 кг, вторая — KMgCl3 весом 1,282 кг. Во всех пяти опытах в нагретый тигель первоначально загружают 2,6265 кг порошковой смеси NaCl+KCl (30% вес. от общего веса NaCl+KCl) и нагревают до 730±10°C с различными скоростями: от 10 до 50°C/мин. Скорость нагрева смеси NaCl+KCl в этом опыте регулируют изменением мощности печи сопротивления. При этом фиксируют время до полного плавления флюса и нагрева его до 730±10°C. По времени нагрева до заданной температуры рассчитывают скорость нагрева. Также фиксируют общий расход электроэнергии на приготовление флюса. Далее, также как в примере 1, в расплаве NaCl+KCl плавят оставшиеся 70% вес. бинарных хлоридов NaCl+KCl и загружают в расплав 1,282 кг комплексного хлорида KMgCl3, полученного в результате предварительной дегидратации карналлита KMgCl3⋅6H2O при 230±10°C. Разливку и анализ готовых флюсов проводят аналогично описанному в примере 1.
Также фиксируют общий расход электроэнергии на приготовление флюса. Далее, также как в примере 1, в расплаве NaCl+KCl плавят оставшиеся 70% вес. бинарных хлоридов NaCl+KCl и загружают в расплав 1,282 кг комплексного хлорида KMgCl3, полученного в результате предварительной дегидратации карналлита KMgCl3⋅6H2O при 230±10°C. Разливку и анализ готовых флюсов проводят аналогично описанному в примере 1.
Результаты опытов приведены в таблице 3.
При скорости нагрева смеси NaCl+KCl в первой загрузке 10°C/мин (опыт 2.1) увеличивается общее время приготовления флюса до 126 мин. В интервале скоростей нагрева 15÷40°C/мин (опыты 2.2-2.4) общее время приготовления флюса составляет от 73 до 99 мин. При скорости нагрева 50°C/мин (опыт 2.5) возрастают энергозатраты на плавление флюса вследствие увеличенной мощности печи для обеспечения заданной скорости нагрева. При высоких скоростях нагрева снижается коэффициент полезного действия печи сопротивления за счет дополнительных теплопотерь.
Кроме того, при приготовлении больших объемов плавленых флюсов (сотни кг) практически очень сложно обеспечить скорость нагрева более 40°C/мин вследствие низкой теплопроводности порошковых смесей галогенидов. При этом существенно возрастают энергозатраты на плавление флюса.
Пример 3. Обоснование последовательного плавления сначала бинарных галогенидов с равновесной упругостью пара при 827°C менее 1330 Па, затем комплексных галогенидов металлов.
Готовят два плавленых покровных флюса на основе химически чистых порошков хлоридов натрия, калия и хиолита. Плавление проводят в тиглях из нержавеющей стали в шахтной печи сопротивления, нагретой до 710±10°C. Состав исходных хлоридов, % вес.: бинарные хлориды: NaCl=39,6; KCl=50,4; комплексный фторид — хиолит: Na5Al3F14=10,3 — взят с избытком в 3% вес. от расчетного содержания во флюсе, равного 10% вес. Вес исходных галогенидов для каждого флюса 5,015 кг, в т.ч. NaCl=1,98 кг; KCl=2,52 кг, Na5Al3F14=0,515 кг.
Опыт 3.1. Первый состав флюса плавят согласно заявляемой последовательности: сначала 30% вес. смеси NaCl+KCl со скоростью нагрева 25°C/мин с последующей порционной загрузкой в расплав оставшихся 70% вес. смеси NaCl+KCl. Затем расплав нагревают до 710±10°C и загружают в него 0,515 кг хиолита. Температура плавления флюса NaCl+KCl+Na5Al3F14 указанного состава равна 640±5°C. Температура перегрева флюса над ликвидусом составляет 70±10°C. Разливка, взвешивание и анализ готового флюса — аналогично описанному в примере 1.
Опыт 3.2. Второй флюс плавят, нагревая со скоростью 25°C/мин. 30% вес. смеси NaCl+KCl+Na5Al3F14 с последующей порционной загрузкой в расплав оставшихся 70% вес. смеси NaCl+KCl+Na5Al3F14 при 710±10°C. Разливка, взвешивание и анализ готового флюса — аналогично описанному в примере 1. Результаты опытов приведены в таблице 4.
Из экспериментальных данных следует:
1.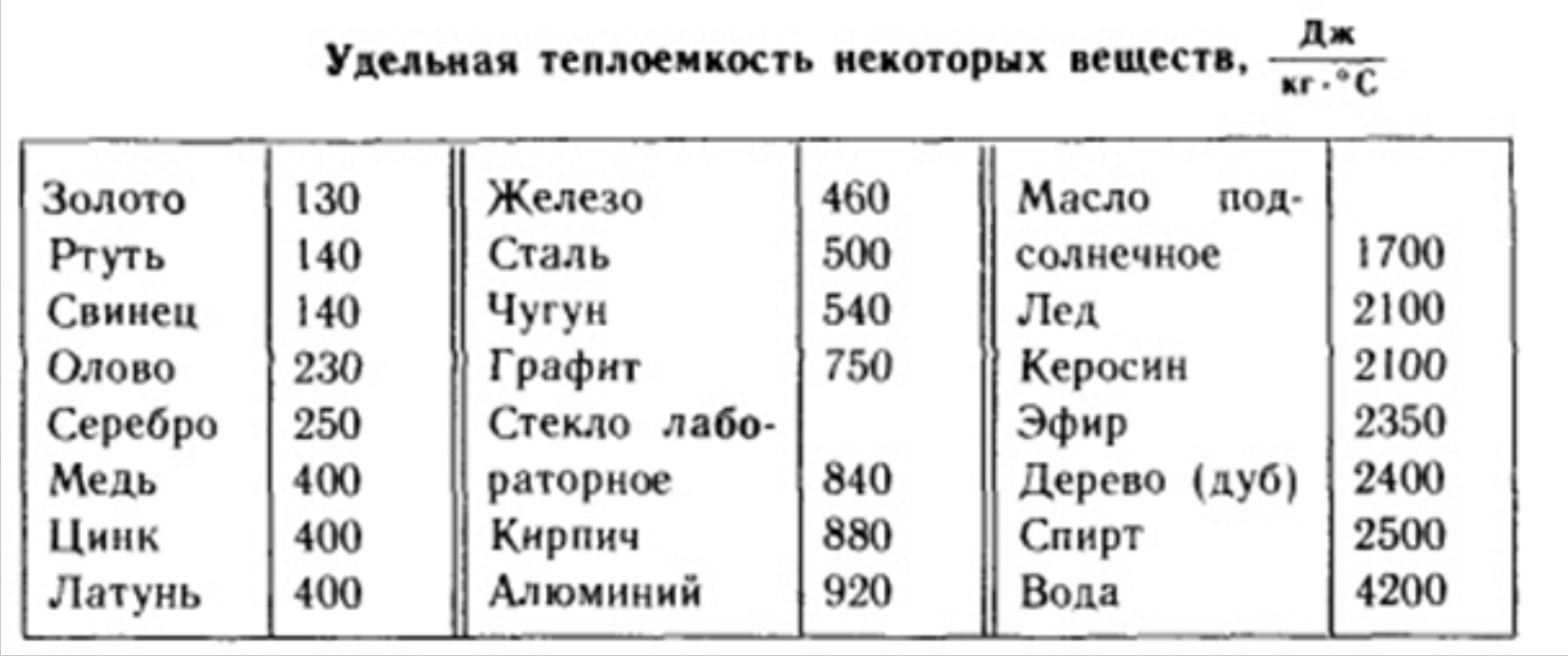 При введении комплексного галогенида (Na5Al3F14) в расплав бинарных галогенидов (опыт 3.1), по сравнению с плавлением комплексного галогенида в смеси с бинарными галогенидами (опыт 3.2), состав плавленого флюса более точно соответствует расчетному (исходному) составу.
При введении комплексного галогенида (Na5Al3F14) в расплав бинарных галогенидов (опыт 3.1), по сравнению с плавлением комплексного галогенида в смеси с бинарными галогенидами (опыт 3.2), состав плавленого флюса более точно соответствует расчетному (исходному) составу.
2. Вес плавленого флюса в опыте 3.1 (4,965 кг) превышает вес флюса, полученного в опыте 3.2 (4,940 кг), что связано с меньшими потерями комплексного галогенида (Na5Al3F14) в газовую фазу за счет испарения и пирогидролиза. Это связано с тем, что в опыте 3.1 порошок хиолита загружали непосредственно в расплав с минимальным временем контакта порошка с воздухом. В опыте 3.2 порошок хиолита с большой удельной поверхностью плавили в смеси с бинарными галогенидами, что привело к увеличению потерь фторидов.
Пример 4. Обоснование последовательного плавления сначала бинарных галогенидов с равновесной упругостью пара при 827°C менее 1330 Па, затем комплексных галогенидов металлов и бинарных галогенидов металлов с равновесной упругостью пара при 827°C более 1330 Па.
Готовят два плавленых флюса на основе химически чистых порошков хлорида калия, хлорида натрия, хлорида цинка и карналлита. Расчетный состав исходного флюса, % вес.: бинарные хлориды: NaCl=33,0; KCl=42,0; ZnCl2=15,0; комплексный хлорид — KMgCl3=10,0%. Равновесная упругость пара хлорида цинка ZnCl2 достигает 1330 Па при 611°C, т.е. хлорид цинка — термически нестойкий бинарный хлорид. Хлорид цинка — взят с избытком в 4% вес. от расчетного содержания во флюсе. Количество обезвоженного карналлита KMgCl3 взято строго по стехиометрии. Вес исходных хлоридов для приготовления каждого флюса равен 5,03 кг, в т.ч.: NaCl=1,65 кг; KCl=2,10 кг; ZnCl2=0,78 кг; KMgCl3=0,50 кг.
Опыт 4.1. Первый состав флюса готовят согласно заявляемой последовательности: сначала 35% вес. смеси NaCl+KCl плавят со скоростью нагрева 20°C/мин с последующей порционной загрузкой в расплав оставшихся 65% вес. смеси NaCl+KCl. Затем расплав нагревают до 710±10°C и загружают в него 0,78 кг хлорида цинка и 0,515 кг обезвоженного карналлита. При этом температуру расплава снижают до 670±10°C. Температура плавления флюса NaCl+KCl+ZnCl2+KMgCl3 указанного состава составляет около 605±5°C (Коршунов Б.Г., Сафонов В.В., Дробот Д.В. Диаграммы плавкости галогенидных систем переходных элементов: справочник / М.: Металлургия, 1977. 248 с., Chao-Jen Li, Peiwen Li, Kai Wang, Edgar Emir Molina. Survey of Properties of Key Single and Mixture Halide Salts for Potential Application as High Temperature Heat Transfer Fluids for Concentrated Solar Thermal Power Systems. AIMS Energy. Volume 2, Issue 2, 133-157. Published date 23 April 2014). Температура перегрева флюса над ликвидусом равна 65±10°C. Разливка, взвешивание и анализ готового флюса — аналогично описанному в примере 1.
При этом температуру расплава снижают до 670±10°C. Температура плавления флюса NaCl+KCl+ZnCl2+KMgCl3 указанного состава составляет около 605±5°C (Коршунов Б.Г., Сафонов В.В., Дробот Д.В. Диаграммы плавкости галогенидных систем переходных элементов: справочник / М.: Металлургия, 1977. 248 с., Chao-Jen Li, Peiwen Li, Kai Wang, Edgar Emir Molina. Survey of Properties of Key Single and Mixture Halide Salts for Potential Application as High Temperature Heat Transfer Fluids for Concentrated Solar Thermal Power Systems. AIMS Energy. Volume 2, Issue 2, 133-157. Published date 23 April 2014). Температура перегрева флюса над ликвидусом равна 65±10°C. Разливка, взвешивание и анализ готового флюса — аналогично описанному в примере 1.
Опыт 4.2. Второй флюс готовят плавлением 35% вес. смеси NaCl+KCl+ZnCl2+KMgCl3, нагревая со скоростью 20°C/мин, с последующей порционной загрузкой в расплав оставшихся 65% вес. смеси NaCl+KCl+ZnCl2+KMgCl3 при 710±10°C. Температурно-временной режим приготовления флюса полностью соответствует параметрам опыта 4.1. Разливка, взвешивание и анализ готового флюса — аналогично описанному в примере 1. Результаты опытов приведены в таблице 5.
Температурно-временной режим приготовления флюса полностью соответствует параметрам опыта 4.1. Разливка, взвешивание и анализ готового флюса — аналогично описанному в примере 1. Результаты опытов приведены в таблице 5.
Из экспериментальных данных следует:
1. В опыте 4.1, при введении комплексного галогенида — обезвоженного карналлита KMgCl3 и термически нестойкого бинарного хлорида цинка ZnCl2 в расплав бинарных хлоридов натрия и калия, вес и состав плавленого флюса более точно соответствует расчетному (исходному) весу и составу, по сравнению с опытом 4.2, где обезвоженный карналлит и хлорид цинка плавили вместе с хлоридом калия и хлоридом натрия.
2. В опыте 4.1 зафиксированы меньшие потери комплексного галогенида — обезвоженного карналлита и хлорида цинка в газовую фазу за счет испарения и пирогидролиза. Это связано с тем, что в опыте 4.1 порошки карналлита и хлорида цинка загружали непосредственно в расплав флюса с минимальным временем контакта порошка с воздухом. В опыте 4.2 порошки обезвоженного карналлита и хлорида цинка с большой удельной поверхностью плавили в смеси с бинарными галогенидами, что привело к увеличению потерь хлоридов.
В опыте 4.2 порошки обезвоженного карналлита и хлорида цинка с большой удельной поверхностью плавили в смеси с бинарными галогенидами, что привело к увеличению потерь хлоридов.
Пример 5. Обоснование последовательного плавления сначала бинарных галогенидов с равновесной упругостью пара при 827°C менее 1330 Па, затем бинарных галогенидов металлов с равновесной упругостью пара при 827°C более 1330 Па. Готовят два плавленых флюса на основе химически чистых порошков хлорида калия, хлорида натрия и хлорида цинка. Расчетный состав исходного флюса, % вес.: бинарные хлориды: NaCl=25,0; KCl=41,0; ZnCl2=34,0. Равновесная упругость пара хлорида цинка ZnCl2 достигает 1330 Па при 611°C, т.е. хлорид цинка — термически нестойкий бинарный хлорид. Хлорид цинка взят строго по стехиометрии (без избытка). Вес исходных хлоридов для приготовления каждого флюса равен 5,00 кг, в т.ч.: NaCl=1,25 кг; KCl=2,05 кг; ZnCl2=1,70 кг. Температура плавления флюса NaCl+KCl+ZnCl2 указанного состава составляет 580±5°C (Коршунов Б. Г., Сафонов В.В., Дробот Д.В. Диаграммы плавкости галогенидных систем переходных элементов: справочник / М.: Металлургия, 1977. 248 с., Chao-Jen Li, Peiwen Li, Kai Wang, Edgar Emir Molina. Survey of Properties of Key Single and Mixture Halide Salts for Potential Application as High Temperature Heat Transfer Fluids for Concentrated Solar Thermal Power Systems. AIMS Energy. Volume 2, Issue 2, 133-157. Published date 23 April 2014).
Г., Сафонов В.В., Дробот Д.В. Диаграммы плавкости галогенидных систем переходных элементов: справочник / М.: Металлургия, 1977. 248 с., Chao-Jen Li, Peiwen Li, Kai Wang, Edgar Emir Molina. Survey of Properties of Key Single and Mixture Halide Salts for Potential Application as High Temperature Heat Transfer Fluids for Concentrated Solar Thermal Power Systems. AIMS Energy. Volume 2, Issue 2, 133-157. Published date 23 April 2014).
Опыт 5.1. Первый состав флюса готовят согласно заявляемой последовательности: сначала плавят 35% вес. смеси NaCl+KCl со скоростью нагрева 20°C/мин с последующей порционной загрузкой в расплав оставшихся 65% вес. смеси NaCl+KCl. Затем расплав нагревают до 710±10°C и загружают в него 1,70 кг термически менее стойкого хлорида цинка. При этом температуру расплава снижают до 650±10°C. Температура перегрева флюса над ликвидусом составляет 70±10°C. Разливка, взвешивание и анализ готового флюса — аналогично описанному в примере 1.
Опыт 5. 2. Второй флюс готовят плавлением 35% вес. смеси NaCl+KCl+ZnCl2, нагревая со скоростью 20°C/мин с последующей порционной загрузкой в расплав оставшихся 65% вес. смеси NaCl+KCl+ZnCl2 при 710±10°C. Температурно-временной режим приготовления флюса полностью соответствует параметрам опыта 5.1. Разливка, взвешивание и анализ готового флюса — аналогично описанному в примере 1.
2. Второй флюс готовят плавлением 35% вес. смеси NaCl+KCl+ZnCl2, нагревая со скоростью 20°C/мин с последующей порционной загрузкой в расплав оставшихся 65% вес. смеси NaCl+KCl+ZnCl2 при 710±10°C. Температурно-временной режим приготовления флюса полностью соответствует параметрам опыта 5.1. Разливка, взвешивание и анализ готового флюса — аналогично описанному в примере 1.
Результаты опытов приведены в таблице 6.
Из экспериментальных данных следует:
1. В опыте 5.1, при введении термически нестойкого бинарного хлорида цинка в расплав бинарных хлоридов натрия и калия, вес и состав плавленого флюса более точно соответствует расчетному (исходному) весу и составу, по сравнению с опытом 5.2, где хлорид цинка плавили вместе с хлоридом калия и хлоридом натрия.
2. В опыте 5.1 зафиксированы меньшие потери в газовую фазу за счет испарения и пирогидролиза преимущественно хлорида цинка. Это связано с тем, что в опыте 5.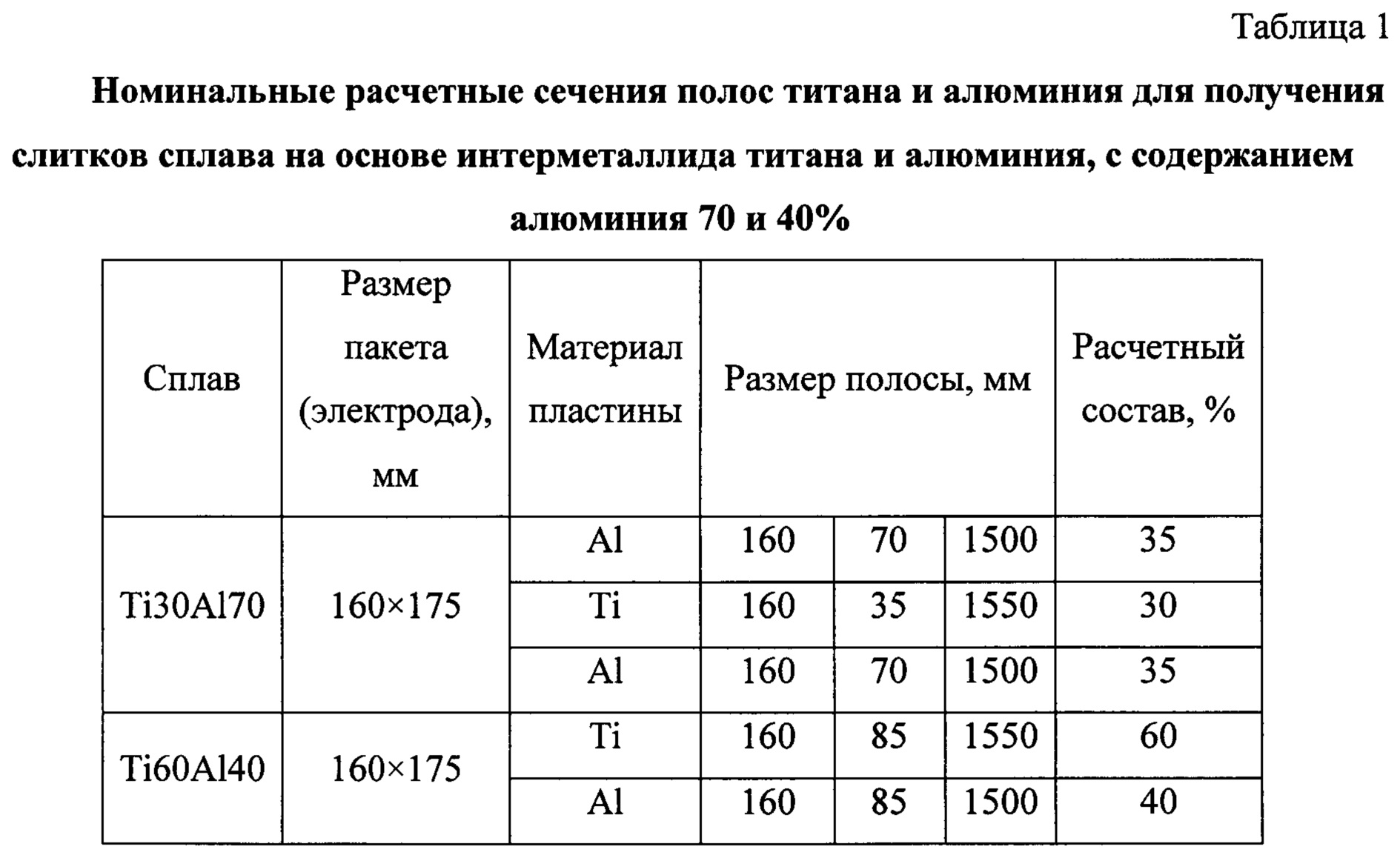 1 порошок хлорида цинка загружали непосредственно в расплав флюса. В опыте 5.2 порошок хлорида цинка с большой удельной поверхностью плавили в смеси с бинарными галогенидами, что привело к увеличению потерь хлоридов.
1 порошок хлорида цинка загружали непосредственно в расплав флюса. В опыте 5.2 порошок хлорида цинка с большой удельной поверхностью плавили в смеси с бинарными галогенидами, что привело к увеличению потерь хлоридов.
Пример 6. Обоснование необходимости поддержания температуры перегрева флюса над ликвидусом не выше 80°C при загрузке в расплав флюса комплексных галогенидов металлов и/или бинарных галогенидов металлов, равновесная упругость пара которых при 827°C более 1330 Па.
Готовят два плавленых флюса на основе химически чистых порошков бинарных галогенидов: хлорида меди (II), фторида натрия и фторида магния. Расчетный состав исходного флюса, % вес.: CuCl2=34,0; NaF=44,0; MgF2=22,0. Вес исходных бинарных фторидов для приготовления каждого флюса равен 5,00 кг, в т.ч.: CuCl2=1,700 кг; NaF=2,200 кг; MgF2=1,100 кг. Температура плавления флюса указанного состава по данным термогравиметрического анализа равна 720±10°C. Фториды, входящие в состав флюса, имеют низкие значения упругости пара. Равновесная упругость пара фторидов достигает 1330 Па при следующих температурах, °C: NaF=1452; MgF2=1917. Для хлорида меди равновесная упругость пара достигает 1330 Па при 435°C. В ходе приготовления флюсов фиксируют расход электроэнергии.
Фториды, входящие в состав флюса, имеют низкие значения упругости пара. Равновесная упругость пара фторидов достигает 1330 Па при следующих температурах, °C: NaF=1452; MgF2=1917. Для хлорида меди равновесная упругость пара достигает 1330 Па при 435°C. В ходе приготовления флюсов фиксируют расход электроэнергии.
Опыт 6.1. Первый флюс готовят согласно заявляемой последовательности: сначала плавят 25% вес. смеси NaF+MgF2 со скоростью нагрева 25°C/мин с последующей порционной загрузкой в расплав оставшихся 75% вес. смеси NaF+MgF2. При этом температуру расплава поддерживают 850±10°C. Затем в расплав порциями вводят хлорид меди и при этом температуру флюса снижают до 770±10°C. Температура перегрева флюса над ликвидусом составляет 50±10°C. Разливка, взвешивание и анализ готового флюса — аналогично описанному в примере 1.
Опыт 6.2. Второй флюс готовят аналогично первому, но температуру расплава при введении хлорида меди поддерживают 820±10°C. Температура перегрева флюса над ликвидусом составляет 100±10°C. Разливка, взвешивание и анализ готового флюса — аналогично описанному в примере 1.
Температура перегрева флюса над ликвидусом составляет 100±10°C. Разливка, взвешивание и анализ готового флюса — аналогично описанному в примере 1.
Результаты опытов приведены в таблице 7.
Из экспериментальных данных следует, что при температуре перегрева флюса над ликвидусом 100±10°C (опыт 6.2), по сравнению с перегревом в 50±10°C (опыт 6.1), снижается выход готового флюса, в большей степени изменяется фактический состав флюса относительно расчетного, а также увеличиваются энергозатраты на приготовление флюса.
Таким образом, при внедрении предлагаемого решения обеспечивается:
— уменьшение потерь компонентов флюса за счет испарения и пирогидролиза галогенидов и, как следствие, повышение выхода годного флюса;
— максимальное соответствие расчетного состава флюса фактически полученному при переплавке;
— снижение удельного расхода сырья и энергозатрат на получение плавленых флюсов;
— уменьшение выбросов газообразных хлоридов и фторидов.
Разница между стальной и алюминиевой системой
Разница между стальной и алюминиевой системойНавесные вентилируемые фасады
проектирование | производство | монтаж
Партнеры
- Сталь материал хорошо известный. Алюминий – материал современный, легкий, но в то же время прихотливый. При использовании фасадных подсистем из алюминиевого сплава, необходимо четко выполнять ряд требований, выдвигаемых алюминием. В условиях суровых российских реалий строительства, которые с кризисом стали еще более суровыми, когда монтажники подешевле, крепеж попроще, а строить надо побыстрее — выполнить эти требования сложно. Рассмотрим то, о чем умалчивают продавцы алюминиевых подсистем, но то, о чем описано в их каталогах технических решений.

1. Сталь имеет более низкий коэффициент термического расширения по сравнению с алюминием. При перепаде температур от –20 до +50 градусов нержавеющая 3х метровая направляющая удлиняется на 2мм, в то время как алюминиевая на 5-6мм. Поэтому в алюминиевых системах предусмотрен целый ряд подвижных соединений и термических швов. В стальных системах все соединения – фиксированные, более простые и надежные. Элементы системы работают в зоне упругих деформаций.
2. В стальной системе все кронштейны являются несущими. Поэтому вес облицовки равномерно распределяется по всем кронштейнам на направляющей (в двухконтурной системе – по массиву кронштейнов). Все точки крепления – жесткие, с помощью вытяжных заклепок или саморезов.
Напомним, что в алюминиевых фасадных системах кронштейны обязательно разделяются на несущие и ветровые. Причем весь вес 3х метровой направляющей с облицовкой должен нести один несущий кронштейн.3. Остальные – работают только на ветровые нагрузки. Для подвижного крепления направляющей к ветровому кронштейну в последнем предназначены продолговатые отверстия.
 Для создания подвижного соединения положено использовать вытяжные заклепки (не саморезы!). Кроме этого, точка крепления заклепки должна меняться в зависимости от температуры окружающего воздуха, при которой происходит монтаж.
Для создания подвижного соединения положено использовать вытяжные заклепки (не саморезы!). Кроме этого, точка крепления заклепки должна меняться в зависимости от температуры окружающего воздуха, при которой происходит монтаж.В условиях реальной стройки много ли монтажников изучают каталоги технических решений? А сколько выполняют предписания? (рисунки- ветровые-несущие кронштейны, точка крепления, температура).
- В стальных системах вентилируемых фасадов используется недорогой, однородный с фасадной системой крепеж. Это оцинкованные стальные заклепки и саморезы для систем из оцинкованной стали и нержавеющие заклепки для систем из нержавеющей стали. Кляймер всегда крепится нержавеющими заклепками.
В алюминиевых подсистемах теоретически положено использовать крепеж из нержавеющей стали или алюминиевые вытяжные заклепки. У нержавеющих заклепок есть, с точки зрения монтажника, три больших недостатка. Нержавеющая заклепка стоит в четыре раза дороже самореза, установка заклепки занимает в три раза больше времени, чем самореза, для установки нержавеющей заклепки надо иметь дорогой инструмент (800евро). Поэтому очень часто вытяжные заклепки заменяются на… оцинкованные саморезы. Электролитическая пара металл-алюминий говорит сама за себя.
Поэтому очень часто вытяжные заклепки заменяются на… оцинкованные саморезы. Электролитическая пара металл-алюминий говорит сама за себя. - Предел прочности алюминиевого сплава АД31 20кг/мм.кв, против 54кг/мм.кв. у стали. Сталь имеет в 2,5 раза большую несущую способность, чем алюминий. Поэтому в стальных системах применяются детали в 2 раза тоньше, чем в алюминиевых. Это позволяет сэкономить вес.
- Стальные фасады пожароустойчивые. Температура плавления стали 1800 градусов. Прессованного алюминия 600-700 градусов. Как показывают испытания, температура во время пожара может достигать 900 градусов на отдельных участках фасада, что может привести к расплавлению алюминия. Для противодействия этому в алюминиевых системах положено устраивать противопожарные отсечки. Это ведет к удорожанию алюминиевого вентилируемого фасада.
- Сталь имеет теплопроводность в 4 раза меньшую, чем алюминий. Теплопроводность алюминия 220 Вт/(мºС), нержавеющей и оцинкованной стали 40 и 45 Вт/(мºС) соответственно.
 Таким образом, кронштейны в алюминиевых системах вентилируемых фасадов являются большими мостиками холода. Российские коллеги подсчитали, что для равного утепления фасад, при использовании алюминиевой подсистемы необходимо закладывать на 20мм толще утеплитель.
Таким образом, кронштейны в алюминиевых системах вентилируемых фасадов являются большими мостиками холода. Российские коллеги подсчитали, что для равного утепления фасад, при использовании алюминиевой подсистемы необходимо закладывать на 20мм толще утеплитель.
- Теплопроводность алюминиевых сплавов в 5,5 раз выше, чем у нержавеющей стали. Поэтому для исключения возможности образования мостиков холода в местах крепления кронштейнов к стене, в алюминиевых подсистемах используется терморазрывы толщиной 10 мм (в стальных 2мм), что негативно сказывается на надёжность узла крепления кронштейн-стена, так как головка анкера работает в знакопеременных температурах, что приводит к коррозии самого нагруженного элемента НВФ — анкера. Также наличие в таком ответственном узле пластикового элемента большой толщины не повышает общей надёжности системы.
- Стоимость стальной фасадной системы – немаловажный для заказчика фактор. Фасадные системы из оцинкованной стали – хороший компромисс между ценой и качеством.
 Стальная двухконтурная система навески вентилируемого фасада дешевле алюминиевой одноконтурной уже изначально, при расчете на глухую стену. Учитывая преимущества, которые дает двухконтурность разница в цене может быть двойная.
Стальная двухконтурная система навески вентилируемого фасада дешевле алюминиевой одноконтурной уже изначально, при расчете на глухую стену. Учитывая преимущества, которые дает двухконтурность разница в цене может быть двойная.
Для улучшения работы сайта и его взаимодействия с пользователями мы используем файлы cookie. Продолжая работу с сайтом, Вы разрешаете использование cookie-файлов. Вы всегда можете отключить файлы cookie в настройках Вашего браузера.
ПринятьСвойства алюминия — Электроэнергетическая группа
Характерными свойствами чистого алюминия являются его малый удельный вес, низкая температура плавления, высокая тепловая и электрическая проводимость, высокая пластичность, очень большая скрытая теплота плавления и прочная, хотя и очень тонкая пленка окиси, покрывающая поверхности металла и защищающая его от проникновения кислорода внутрь.
Малая плотность делает алюминий основой легких конструкционных материалов; большая пластичность позволяет применять к алюминию все виды обработки давлением и получать из него листы, прутки, проволоку, трубы, тончайшую фольгу, штампованные детали с глубокой вытяжкой и др. Хорошая электрическая проводимость обеспечивает широкое применение алюминия в электротехнике. Так как плотность алюминия в 3,3 раза ниже, чем у меди, а удельное сопротивление лишь в 1,7 раза выше, чем у меди, то алюминий, на единицу массы имеет вдвое более высокую проводимость, чем медь. Прочная пленка окиси быстро покрывает свежий разрез металла уже при комнатной температуре, обеспечивая алюминию высокую устойчивость против коррозии в атмосферных условиях.
Хорошая электрическая проводимость обеспечивает широкое применение алюминия в электротехнике. Так как плотность алюминия в 3,3 раза ниже, чем у меди, а удельное сопротивление лишь в 1,7 раза выше, чем у меди, то алюминий, на единицу массы имеет вдвое более высокую проводимость, чем медь. Прочная пленка окиси быстро покрывает свежий разрез металла уже при комнатной температуре, обеспечивая алюминию высокую устойчивость против коррозии в атмосферных условиях.
Сернистый газ, сероводород, аммиак и другие газы, находящиеся в воздухе промышленных районов, не оказывают заметного влияния на скорость коррозии алюминия. Действие пара на алюминий также не-значительно. Алюминий, не содержащий меди, достаточно стоек (в отсутствие электрического тока) в естественной морской воде. В концентрированных азотной и серной кислотах алюминий также практически устойчив. В разбавленных кислотах и растворах едких щелочей алюминий быстро разрушается. Однако в растворах аммиака он достаточно стоек. В контакте с большинством металлов и сплавов, являющихся благородными по электрохимическому ряду потенциалов, алюминий служит анодом и, следовательно, коррозия его в электролитах будет прогрессировать.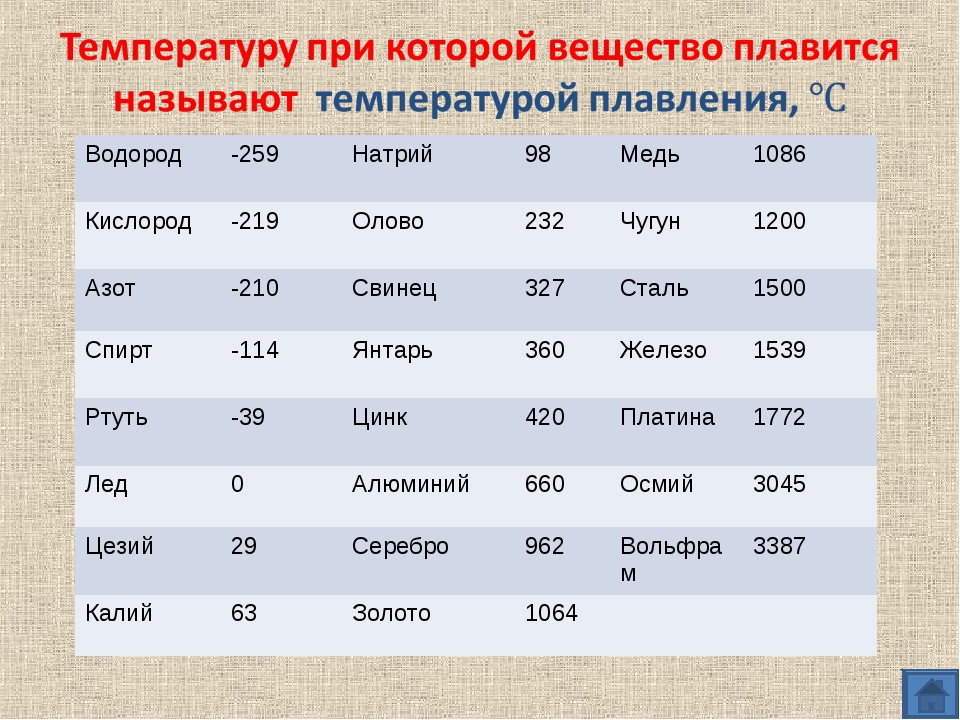 Чтобы избежать образования гальванопар во влажной атмосфере, место соединения алюминия, с другими металлами герметизируется лакировкой или другим путем.
Чтобы избежать образования гальванопар во влажной атмосфере, место соединения алюминия, с другими металлами герметизируется лакировкой или другим путем.
Длительные испытания проводов из алюминия показали, что они в отношении устойчивости против коррозии не уступают медным.
В табл. 8-16 приведены классификация и химический состав алюминия.
Влияние примесей на электрическую проводимость алюминия различно. Примеси, образующие с алюминием твердые растворы, сильно снижают электропроводность; примеси, не входящие в твердые растворы, почти не оказывают влияния на снижение проводимости. На рис. 8-4 показано изменение проводимости алюминия в зависимости от содержания примесей.
Физические свойства алюминия марок А5; А6 и АЕ, предназначенного для изготовления шин и проводов, приведены ниже:
Плотность при 20 °С, кг/м3 …………………….9700
Удельное электрическое сопротивление при 20 °С (не более), мкОм м:
проволока твердая и полутвердая …………. 0,0283
мягкая ………………………………………………. 0,0280
0,0280
шины …………………………………………………0,0290
Температурный коэффициент сопротивления в интервале 0-150 °С, …… 0,004
Температурный коэффициент линейного расширения (20-100 °С), ……….
Теплопроводность, Вт/(м °С)……………………………………………………………….2,05
Температура плавления, °С …………………………………………………………………..660-647
Теплота плавления, Дж/кг ………………………………………………………………..
Температура отжига, °С ………………………………………………………………………350-400
Средняя теплоемкость (0-100 °С), Дж/(кг °С)…………………………………………….240
В табл. 8-17 приведена ориентировочная зависимость механических свойств алюминия от температуры.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Свойства низкотемпературных плавящихся электролитов для процесса электролиза алюминия: обзор
%PDF-1.4 % 1 0 объект > эндообъект 7 0 объект /Заголовок /Предмет /Автор /Режиссер /Ключевые слова /CreationDate (D:20220115185437-00’00’) /ModDate (D:20120604115757+02’00’) >> эндообъект 2 0 объект > эндообъект 3 0 объект > эндообъект 4 0 объект > эндообъект 5 0 объект > эндообъект 6 0 объект > ручей GPL Ghostscript 8.70Электролиз алюминия — Электролитический процесс — Температура — Электролит2012-06-04T11:57:57+02:002012-06-04T11:53:24+02:00PDFCreator Версия 0.9.
 Электролитический процесс. Температура. Электролит
Электролитический процесс. Температура. Электролит pMeyyv.|ro|9’zFMu7n_z}
M0&L~IE`3knE@FGE NN7,,֏wwkuՋP!5s7?fE[zX-Qy㹇Y=XRDˆ (5V$y:Y4)W—د] J([A7[azf[rĝM0DCqdPH{xLBt9l»t ,
pMeyyv.|ro|9’zFMu7n_z}
M0&L~IE`3knE@FGE NN7,,֏wwkuՋP!5s7?fE[zX-Qy㹇Y=XRDˆ (5V$y:Y4)W—د] J([A7[azf[rĝM0DCqdPH{xLBt9l»t ,%PDF-1.5 % 24 0 объект> эндообъект внешняя ссылка 24 855 0000000016 00000 н 0000018691 00000 н 0000018828 00000 н 0000017745 00000 н 0000018908 00000 н 0000019087 00000 н 0000038006 00000 н 0000038082 00000 н 0000038116 00000 н 0000038158 00000 н 0000051585 00000 н 0000067297 00000 н 0000082685 00000 н 0000097322 00000 н 0000110729 00000 н 0000123975 00000 н 0000124230 00000 н 0000124490 00000 н 0000124752 00000 н 0000125009 00000 н 0000125254 00000 н 0000125493 00000 н 0000125929 00000 н 0000126306 00000 н 0000126702 00000 н 0000127242 00000 н 0000127723 00000 н 0000128204 00000 н 0000139718 00000 н 0000154279 00000 н 0000178199 00000 н 00001
00000 н 00002
Изменение состояния — плавление | Глава 2: Состояние вещества
Предложите учащимся посмотреть, как тает небольшой кусочек льда.

Покажите учащимся видеоролик «Таяние льда на разных поверхностях».
В этом видео лед кладут на две похожие черные поверхности — алюминиевую и пластиковую. Лед тает быстрее на алюминии, потому что он лучше проводит тепло, чем пластик.
Обсудите наблюдения учащихся.
Спросите студентов:
- Как вы думаете, откуда взялась энергия, чтобы растопить лед?
- Энергия исходит от воздуха и от поверхности, на которой находится лед, оба имеют комнатную температуру.Поскольку комнатная температура теплее температуры льда, энергия передается от поверхности и воздуха ко льду.
- Как вы думаете, что произошло со скоростью молекул льда при его нагревании?
- Молекулы воды двигались быстрее.
Дайте каждому учащемуся рабочий лист.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания. Разделы «Объясните это с помощью атомов и молекул» и «Возьми это» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Дайте учащимся время ответить на первые два вопроса в листе заданий.
Предложите учащимся изучить, как заставить лед таять быстрее.
Введите вопрос для исследования:
- Как заставить лед таять быстрее?
Помогите учащимся спланировать и провести эксперимент, спросив:
- Как бы вы поставили эксперимент для проверки вашего метода?
- Студенты могут предложить подышать на лед, подержать его в руке или поместить лед в теплую или комнатную воду.Любой из этих методов хорош, но постарайтесь, чтобы учащиеся подумали о включении элемента управления в эксперимент. В каждом случае им понадобятся два куска льда одинакового размера — один, который они каким-то образом согревают, а другой — нет.
Вот один из методов, который могут попробовать учащиеся:
Вопрос для расследования
Если положить лед в воду, лед растает быстрее?
Материалы
- 2 маленьких кусочка льда
- 2 маленьких прозрачных пластиковых стаканчика
- Вода
Процедура
- Налейте воду комнатной температуры в чашку, пока она не наполнится примерно на ½.

Поместите небольшой кусочек льда в воду и другой маленький кусочек льда в чашку без воды.
Ожидаемые результаты
Лед, помещенный в воду, растает быстрее, чем лед в воздухе. Поскольку вода и воздух имеют комнатную температуру, может быть непонятно, почему лед тает быстрее в воде. В воде так много молекул, которые могут контактировать со льдом, что передача тепла льду происходит намного эффективнее и быстрее в воде, чем в воздухе.
Дайте учащимся время написать свою процедуру и ответить на вопрос в листе заданий.
Показать анимацию таяния льда.
Показать анимацию «Тающий лед».
Укажите, что молекулы воды во льду вибрируют, но не движутся мимо друг друга. При повышении температуры они начинают сильнее вибрировать. В конце концов их движение преодолевает их привлекательность, и они больше не могут оставаться в своей упорядоченной кристаллической структуре.Когда лед тает, упорядоченное расположение разрушается, и молекулы воды движутся мимо друг друга и фактически сближаются как жидкая вода.
Проецирование изображения Лед и Вода
Спросите студентов
- Как изменилось движение и расположение молекул воды при таянии льда?
- Когда энергия передается молекулам воды во льду, движение молекул увеличивается. Движение молекул увеличивается настолько, что преодолевает притяжение молекул воды друг к другу, вызывая таяние льда.
Сравните движение и расположение молекул вещества (не воды) для каждого состояния вещества.
Спроецируйте изображение Состояния Материи.
Объясните, что на схеме показано движение и расположение атомов или молекул в одном веществе (не в воде), когда оно переходит из твердого состояния в жидкое и газообразное.
Предложите учащимся сравнить изменения состояния большинства веществ с изменениями состояния воды.
Спроецируйте изображение Состояния Воды.
Скажите учащимся, что движение молекул воды в каждом состоянии вещества подобно тому, что происходит с большинством веществ. Добавление энергии увеличивает движение молекул и заставляет их двигаться дальше друг от друга. Удаление энергии уменьшает движение молекул и заставляет их двигаться ближе друг к другу. Но вода делает что-то очень необычное, когда замерзает и становится льдом. Молекулы, которые двигались все ближе и ближе друг к другу, удаляются все дальше друг от друга по мере того, как они организуются в незамкнутую кольцевую структуру, показанную ниже для льда.Вот почему лед расширяется при замерзании.
Добавление энергии увеличивает движение молекул и заставляет их двигаться дальше друг от друга. Удаление энергии уменьшает движение молекул и заставляет их двигаться ближе друг к другу. Но вода делает что-то очень необычное, когда замерзает и становится льдом. Молекулы, которые двигались все ближе и ближе друг к другу, удаляются все дальше друг от друга по мере того, как они организуются в незамкнутую кольцевую структуру, показанную ниже для льда.Вот почему лед расширяется при замерзании.
Спросите студентов:
Узнайте больше об изменениях энергии и состояния в разделе биографии учителя.
- Чем изменения состояния воды сходны с изменениями состояния большинства других веществ и отличаются от них?
- Для воды или любого другого вещества молекулярное движение увеличивается при добавлении энергии и уменьшается при удалении энергии. Основное отличие воды от других веществ заключается в расположении молекул твердого тела и жидкости.В воде молекулы льда находятся дальше друг от друга, чем в жидкой воде.
 Это необычно, потому что молекулы твердых тел в большинстве других веществ расположены ближе друг к другу, чем в жидкости.
Это необычно, потому что молекулы твердых тел в большинстве других веществ расположены ближе друг к другу, чем в жидкости.
Предложите группам использовать свои молекулы воды для моделирования процессов замерзания, таяния, испарения и конденсации.
Процедура
- Спроецировать изображение Лед.
- Попросите каждую группу расположить свои молекулы воды в виде шестигранного ледяного кольца.Попросите учащихся осторожно обращаться со своими моделями, потому что они понадобятся им для других уроков.
- Лед тает
- Предложите учащимся представить на своих моделях, что происходит, когда лед тает. Укажите, что молекулы воды расположены ближе друг к другу, чем когда они были льдом. Учащиеся могут показать, как молекулы воды движутся мимо друг друга.
- Вода испаряется
- Предложите учащимся с помощью своих молекул смоделировать, что произойдет, если воду нагреть и молекулы испарятся.Учащиеся должны показать, как молекулы воды движутся быстрее, отрываются от других молекул и попадают в воздух.

- Конденсат водяного пара
- Предложите учащимся с помощью своих молекул смоделировать, что произойдет, если водяной пар охладить настолько, чтобы вызвать его конденсацию. Учащиеся должны показать, как молекулы воды в воздухе замедляются и соединяются вместе, но все еще движутся мимо друг друга, как жидкая вода.
Соберите молекулы воды.Эти модели будут использоваться снова в главе 5, уроке 1.
Проведите демонстрацию, чтобы сравнить таяние обычного льда и сухого льда.
Сообщите учащимся, что сухой лед представляет собой замороженный углекислый газ. Углекислый газ должен быть очень холодным, чтобы стать твердым (около -78 ° C или -109 ° F).
Подготовка
Для этой демонстрации вам понадобится сухой лед.Если у вас нет сухого льда, покажите видео «Сухой лед».
Вопрос для расследования
Сухой лед тает так же, как обычный лед?
Материалы
- Лед
- Сухой лед
- Коричневое бумажное полотенце
- Холодная вода
- Горячая вода (около 50 °С)
Процедура
- Положите кусочек сухого льда и кусочек обычного льда на коричневое бумажное полотенце.

Ожидаемые результаты
Вскоре лед начнет таять, а бумажное полотенце вокруг льда станет влажным и темным. Бумажное полотенце вокруг сухого льда останется сухим и не потемнеет. Если вы заметили небольшое темное пятно на бумажном полотенце рядом с сухим льдом, возможно, водяной пар из воздуха конденсировался на сухом льду и растаял на бумажном полотенце.
Если учащиеся увидят туманный белый туман, исходящий от сухого льда, сообщите им, что это не сам углекислый газ.Углекислый газ бесцветен, не имеет запаха и невидим. Туманный дым или туман на самом деле представляют собой водяной пар в воздухе, который становится достаточно холодным, чтобы конденсироваться. Водяной пар охлаждается сухим льдом и холодным углекислым газом. Туман имеет тенденцию дрейфовать вниз, потому что он переносится углекислым газом, который более плотный, чем окружающий его воздух.
Обсудите наблюдения учащихся и познакомьте их с идеей о том, что некоторые вещества могут напрямую переходить из твердого состояния в газообразное.

Спросите студентов:
- Тают ли обычный и сухой лед одинаково?
- Нет. Обычный лед превращается в жидкость, которую вы видите на коричневом бумажном полотенце. Сухой лед не превращается в жидкость.
Объясните учащимся, что причина того, что сухой лед не делает бумажное полотенце влажным, заключается в том, что он не тает. Когда энергия передается сухому льду, твердая двуокись углерода не превращается в жидкую двуокись углерода.Вместо этого твердое тело сразу превращается в газ. Этот процесс называется сублимацией. Сублимация происходит, когда молекулы твердого тела движутся достаточно быстро, чтобы преодолеть притяжение других молекул и стать газом. Поскольку замороженный углекислый газ никогда не становится жидкостью при нормальном давлении, его называют сухим льдом.
Покажите учащимся, что происходит, когда сухой лед помещают в воду.
Поместите кусок сухого льда в воду, а затем добавьте немного средства для мытья посуды или покажите видео «Сухой лед в воде».
Ожидаемые результаты
Образуются пузыри и туманный белый туман. Поскольку вода намного теплее сухого льда, энергия передается от воды к сухому льду, заставляя его переходить из твердого состояния в газообразное и пузыриться в воде. После добавления моющего средства образуется кучка пузырьков.
Ученикам будет любопытно узнать, какой туман выходит из чашки. Скажите им, что часть воды превращается в водяной пар в пузырьках углекислого газа, а затем конденсируется.Это вызывает туман внутри пузырьков, который выходит, когда пузырь лопается.
Спросите студентов:
- Вы видели, что сухой лед очень быстро сублимирует в воде. Что бы вы могли сделать, чтобы сухой лед сублимировался еще быстрее?
- Есть несколько способов ускорить сублимацию сухого льда. Один из вариантов — положить сухой лед в горячую воду.
Поместите кусок сухого льда в ¼ стакана холодной воды, а другой кусок — в ¼ стакана горячей воды.Или покажите видео Сухой лед в горячей и холодной воде.
Ожидаемые результаты:
Из чашки с горячей водой будет образовываться гораздо больше тумана.
Скажите учащимся, что при помещении сухого льда в горячую воду образуется больше тумана, потому что передача энергии и сублимация происходят быстрее. Это приводит к тому, что туман образуется с большей скоростью.
10.10: Энтальпия плавления и энтальпия испарения
Когда тепло подается к твердому телу (например, льду) с постоянной скоростью с помощью электрического нагревательного змеевика, мы обнаруживаем, что температура неуклонно растет, пока не будет достигнута точка плавления и становятся очевидными первые признаки образования жидкости, что видно на графике ниже.После этого, даже несмотря на то, что мы по-прежнему подводим тепло к системе, температура остается постоянной, пока присутствуют как жидкость, так и твердое тело. На приведенном ниже графике это представлено плоской линией, где энергия добавляется ко льду, но температура не меняется.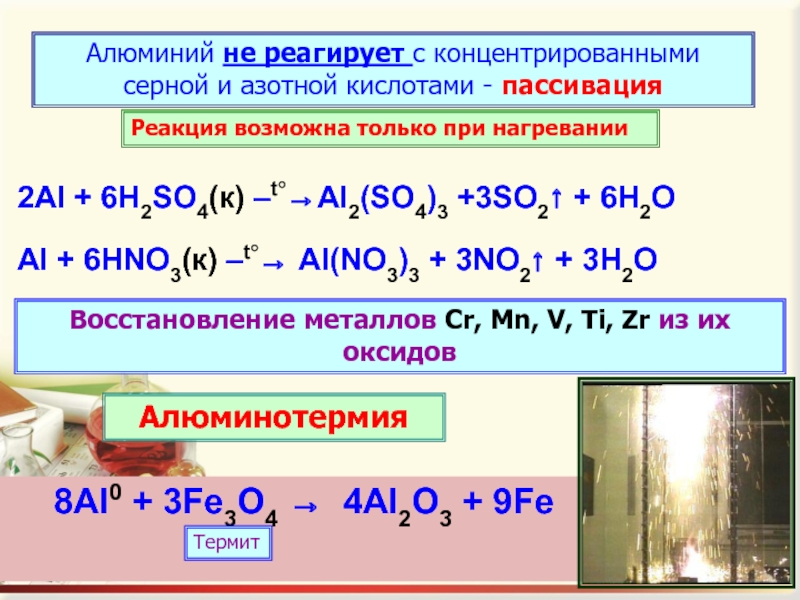 Вся энергия, добавляемая в систему на этом этапе, используется для преобразования твердого льда в жидкую воду.
Вся энергия, добавляемая в систему на этом этапе, используется для преобразования твердого льда в жидкую воду.
Изображение предоставлено Кавангом через Wikimedia Commons
Это макроскопическое поведение совершенно ясно демонстрирует, что к твердому телу должна быть подведена энергия, чтобы расплавить его.На микроскопическом уровне плавление включает в себя разделение молекул, которые притягиваются друг к другу. Это требует увеличения потенциальной энергии молекул, а необходимую энергию обеспечивает нагревательный змеевик. Кинетическая энергия молекул (вращение, вибрация и ограниченный перенос) остается постоянной во время фазовых переходов, потому что температура не меняется.
Теплота, которую твердое тело поглощает при плавлении, называется энтальпией плавления или теплотой плавления и обычно выражается в молярной основе.{о} \текст{С}] h3O(l)}\]
\[\треугольник H_m = 6,01 \frac {\text{кДж}}{\text{моль}}\]
Выбранные молярные энтальпии плавления сведены в таблицу \(\PageIndex{1}\). {o} \text{C}] h3O(g)}\]
{o} \text{C}] h3O(g)}\]
\[\треугольник H_m = 40.67 \ гидроразрыва {\ текст {кДж}} {\ текст {моль}} \]
тепла поглощается при кипении жидкости, потому что молекулы, удерживаемые вместе за счет взаимного притяжения в жидкости, отталкиваются друг от друга при образовании газа. Такое разделение требует энергии. В общем, необходимая энергия отличается от одной жидкости к другой в зависимости от величины межмолекулярных сил. Таким образом, мы можем ожидать, что жидкости с сильными межмолекулярными силами будут иметь более высокие энтальпии испарения. Список энтальпий парообразования, приведенный в таблице, подтверждает это.
| Вещество | Формула | ΔH(плавление) / кДж моль -1 | Температура плавления / K | ΔH(испарение) / кДж моль -1 | Точка кипения/К | (ΔH v /T b ) / JK -1 моль -1 |
|---|---|---|---|---|---|---|
| Неон | Не | 0. 33 33 | 24 | 1,80 | 27 | 67 |
| Кислород | О 2 | 0,44 | 54 | 6,82 | 90,2 | 76 |
| Метан | СН 4 | 0,94 | 90.7 | 8.18 | 112 | 73 |
| Этан | С 2 Н 6 | 2,85 | 90,0 | 14,72 | 184 | 80 |
| Хлор | Класс 2 | 6,40 | 172,2 | 20. 41 41 | 239 | 85 |
| Четыреххлористый углерод | ССl 4 | 2,67 | 250,0 | 30.00 | 350 | 86 |
| Вода* | Н 2 О | 6.00678 при 0°C, 101 кПа 6.354 при 81,6°C, 2,50 МПа | 273.1 | 40,657 при 100 °C, 45,051 при 0 °C, 46,567 при -33 °C | 373,1 | 109 |
| n -Нонан | С 9 Н 20 | 19,3 | 353 | 40,5 | 491 | 82 |
| Меркурий | рт.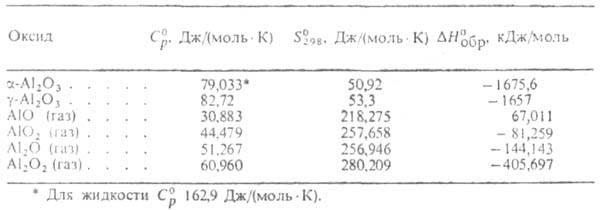 ст. ст. | 2.30 | 234 | 58,6 | 630 | 91 |
| Натрий | На | 2,60 | 371 | 98 | 1158 | 85 |
| Алюминий | Ал | 10,9 | 933 | 284 | 2600 | 109 |
| Свинец | Пб | 4. 77 77 | 601 | 178 | 2022 | 88 |
*www1.lsbu.ac.uk/water/data.html
Еще две особенности стола заслуживают упоминания. Одна из них заключается в том, что энтальпия испарения вещества всегда выше энтальпии его плавления. Когда твердое тело плавится, молекулы не отделяются друг от друга почти так же, как при кипении жидкости. Во-вторых, существует тесная корреляция между энтальпией парообразования и температурой кипения, измеряемой по термодинамической шкале температур.Периодические тренды температуры кипения точно следуют периодическим трендам теплоты парообразования. Если мы разделим одно на другое, мы обнаружим, что результат часто находится в диапазоне от 75 до 90 Дж К –1 моль –1 . Поэтому в первом приближении энтальпия испарения жидкости пропорциональна термодинамической температуре кипения жидкости . Этот интересный результат называется правилом Трутона . Эквивалентное правило не выполняется для слияния. Энергия, необходимая для плавления твердого тела, и температура, при которой это происходит, зависят от структуры кристалла, а также от величины межмолекулярных сил.{о}\текст{С}) \)
Этот интересный результат называется правилом Трутона . Эквивалентное правило не выполняется для слияния. Энергия, необходимая для плавления твердого тела, и температура, при которой это происходит, зависят от структуры кристалла, а также от величины межмолекулярных сил.{о}\текст{С}) \)
\[\треугольник H_m = 4,77 \frac {\text{кДж}}{\text{моль}}\]
\[100 \text{g} ~\times~ \frac {1 \text{mol Pb}}{207.2 ~\text{g}~ \text{Pb}} ~\times ~\frac{4.77~ \text {кДж}}{\текст{моль}} = 2,30~ \текст{кДж}\]
(2) Чтобы растопить 100 г воды:
\[100 \text{g} ~\times~ \frac {1 \text{mol}}{18.0 ~\text{g}}~ \times~ \frac{6.01~ \text{kJ}}{\text {моль}} = 33,4~ \text{кДж}\]
(3) Для испарения 100 г воды:
\[100 \text{g} ~\times ~\frac {1 \text{mol}}{18.0~ \text{g}} ~\times ~\frac{40,657~ \text{кДж}}{\text{моль}} = 226~ \text{кДж}\]
Может показаться удивительным, что для плавления или испарения 100 г свинца требуется гораздо меньше тепла, чем для плавления или испарения воды. Во-первых, температура, при которой плавится вещество, не имеет ничего общего с энтальпией плавления, хотя на практике нам пришлось бы добавлять больше тепла, чтобы получить свинец до температуры плавления. Молярная энтальпия плавления на самом деле меньше для свинца из-за меньшей энергии связи между частицами.Молярная энтальпия испарения свинца больше, чем у воды, но эта проблема напоминает нам, что в некоторых случаях результат, основанный на массе, может иметь практическое значение, показывая, что для испарения равной массы свинца требуется меньше тепла.
Во-первых, температура, при которой плавится вещество, не имеет ничего общего с энтальпией плавления, хотя на практике нам пришлось бы добавлять больше тепла, чтобы получить свинец до температуры плавления. Молярная энтальпия плавления на самом деле меньше для свинца из-за меньшей энергии связи между частицами.Молярная энтальпия испарения свинца больше, чем у воды, но эта проблема напоминает нам, что в некоторых случаях результат, основанный на массе, может иметь практическое значение, показывая, что для испарения равной массы свинца требуется меньше тепла.
Теория частиц — изменения состояния
Теория частиц — изменения состоянияВы SCIcentre / Self Учебные ресурсы / Теория частиц — Введение
Затронутые темы
Плавление
Испаряющийся
Кипячение
Изменения состояния
Кинетическая теория материи может быть использована для объяснения того, как твердые, жидкие и
газы взаимозаменяемы в результате увеличения или уменьшения тепловой энергии. Когда объект нагревается, движение частиц увеличивается по мере того, как частицы
стать более энергичным. При охлаждении движение частиц уменьшается
по мере того, как они теряют энергию.
Когда объект нагревается, движение частиц увеличивается по мере того, как частицы
стать более энергичным. При охлаждении движение частиц уменьшается
по мере того, как они теряют энергию.
Плавка
В твердом теле сильное притяжение между частицами крепко удерживает их
упакованы вместе. Даже если они вибрируют, этого недостаточно, чтобы нарушить
структура. При нагревании твердого тела частицы получают энергию и начинают
вибрировать все быстрее и быстрее.Первоначально структура постепенно ослабевает, что
имеет эффект расширения твердого тела. Дальнейший нагрев дает больше энергии
пока частицы не начнут отрываться от структуры. Хотя частицы
все еще слабо связаны, они могут передвигаться. В этот момент
твердое тело плавится, превращаясь в жидкость. Частицы в жидкости одинаковые
как в твердом теле, но они имеют больше энергии. Для плавления твердого тела требуется энергия
преодолеть притяжение между частицами и позволить им притянуть их
отдельно. Энергия выделяется при нагревании твердого тела. Температура при
что-то плавится, называется его «температурой плавления» или температурой плавления.
При комнатной температуре вещество находится в твердом, жидком или газообразном состоянии в зависимости от степени его плавления.
температура. Все, что имеет температуру плавления выше 20°C, вероятно,
быть твердым при нормальных условиях. Материалы имеют сильно различающиеся плавления
температура напр. ртуть -39°С, лед 0°С, соль 1081°С, алюминий 660°С и сталь
1535°С. Бытовые материалы, такие как лед, масло и воск, плавятся по-разному.
температуры и могут быть использованы в качестве примера с детьми.
Энергия выделяется при нагревании твердого тела. Температура при
что-то плавится, называется его «температурой плавления» или температурой плавления.
При комнатной температуре вещество находится в твердом, жидком или газообразном состоянии в зависимости от степени его плавления.
температура. Все, что имеет температуру плавления выше 20°C, вероятно,
быть твердым при нормальных условиях. Материалы имеют сильно различающиеся плавления
температура напр. ртуть -39°С, лед 0°С, соль 1081°С, алюминий 660°С и сталь
1535°С. Бытовые материалы, такие как лед, масло и воск, плавятся по-разному.
температуры и могут быть использованы в качестве примера с детьми.
Лед, вероятно, является плавящимся веществом, с которым знакомо большинство детей. Оно может
быть проблематичным при попытке развить понимание плавления, как это происходит
им часто кажется, что они тают без какого-либо источника тепла. Лед тает при комнатной температуре
потому что окружающий воздух теплее льда и имеет температуру выше
температура плавления. Тепловая энергия, необходимая для таяния льда, поступает от
окружающий воздух, который, следовательно, станет немного прохладнее.
Тепловая энергия, необходимая для таяния льда, поступает от
окружающий воздух, который, следовательно, станет немного прохладнее.
Не все твердые тела плавятся при нагревании.Некоторые из них могут подвергаться химическим изменениям.
в результате нагрева. Например, бумага горит, а не плавится.
Испаряющийся
Внутри жидкости одни частицы обладают большей энергией, чем другие. Эти «более
энергичные частицы» могут иметь достаточную энергию, чтобы покинуть поверхность
жидкости в виде газа или пара. Этот процесс называется испарением, а результат
испарения обычно наблюдается, когда лужи или одежда высыхают. Испарение
происходит при комнатной температуре, которая часто значительно ниже точки кипения
жидкости.Испарение происходит с поверхности жидкости. Как температура
увеличивается скорость испарения увеличивается. Испарению также способствует
ветреные условия, которые помогают удалить частицы пара из жидкости, поэтому
тем более побег.
Испарение — сложная идея для детей по ряду причин. Процесс
включает кажущееся исчезновение жидкости, что затрудняет процесс
чтобы они поняли. Нелегко увидеть частицы воды в воздухе.Кроме того, испарение происходит в ряде весьма различных ситуаций, таких как
из лужи или миски с водой, где количество жидкости явно меняется,
к ситуациям, когда жидкость менее заметна, например, при сушке одежды или даже
те, где для начала вообще нет очевидной жидкости — например, хлеб
Высыхать. Еще одна сложность заключается в том, что испарение растворителя может происходить из
решение напр. вода, испаряющаяся из соленой воды, чтобы оставить соль. Эти ситуации
совершенно разные, но все они связаны с испарением.
Процесс
включает кажущееся исчезновение жидкости, что затрудняет процесс
чтобы они поняли. Нелегко увидеть частицы воды в воздухе.Кроме того, испарение происходит в ряде весьма различных ситуаций, таких как
из лужи или миски с водой, где количество жидкости явно меняется,
к ситуациям, когда жидкость менее заметна, например, при сушке одежды или даже
те, где для начала вообще нет очевидной жидкости — например, хлеб
Высыхать. Еще одна сложность заключается в том, что испарение растворителя может происходить из
решение напр. вода, испаряющаяся из соленой воды, чтобы оставить соль. Эти ситуации
совершенно разные, но все они связаны с испарением.
Испарение может также происходить с другими жидкостями, кроме воды, т.е. духи, бензин,
освежитель воздуха. Модель частиц может быть использована для объяснения того, как это возможно.
обнаруживать запахи на некотором расстоянии от источника.
Вернуться к началу страницы
Кипячение
Если жидкость нагревается, частицы получают больше энергии и движутся быстрее. и быстрее расширяет жидкость. Самые энергичные частицы на поверхности
улетучиваются с поверхности жидкости в виде пара по мере ее нагревания.жидкости
испаряются быстрее, поскольку они нагреваются, и у большего количества частиц есть достаточно энергии, чтобы разрушиться.
прочь. Частицам нужна энергия, чтобы преодолеть притяжение между ними. В виде
жидкость становится теплее, больше частиц имеют достаточную энергию, чтобы вырваться из
жидкость. В конце концов, даже частицы в середине жидкости образуют пузырьки.
газа в жидкости. В этот момент жидкость кипит и превращается в газ.
Частицы в газе такие же, как и в жидкости.
больше энергии.При нормальном атмосферном давлении все материалы имеют определенную температуру
при котором происходит кипение. Это называется «точкой кипения» или точкой кипения
температура. Как и в случае с температурой плавления, температура кипения материалов сильно различается.
например азот -210°С, спирт 78°С, алюминий 459°С.
и быстрее расширяет жидкость. Самые энергичные частицы на поверхности
улетучиваются с поверхности жидкости в виде пара по мере ее нагревания.жидкости
испаряются быстрее, поскольку они нагреваются, и у большего количества частиц есть достаточно энергии, чтобы разрушиться.
прочь. Частицам нужна энергия, чтобы преодолеть притяжение между ними. В виде
жидкость становится теплее, больше частиц имеют достаточную энергию, чтобы вырваться из
жидкость. В конце концов, даже частицы в середине жидкости образуют пузырьки.
газа в жидкости. В этот момент жидкость кипит и превращается в газ.
Частицы в газе такие же, как и в жидкости.
больше энергии.При нормальном атмосферном давлении все материалы имеют определенную температуру
при котором происходит кипение. Это называется «точкой кипения» или точкой кипения
температура. Как и в случае с температурой плавления, температура кипения материалов сильно различается.
например азот -210°С, спирт 78°С, алюминий 459°С.
Любой материал с температурой кипения ниже 20oC, вероятно, будет газом при
комнатная температура. При кипении жидкости частицы должны иметь достаточную энергию
отрываться от жидкости и диффундировать через частицы окружающего воздуха.Когда эти частицы остывают и теряют энергию, они конденсируются и возвращаются обратно.
к жидкости. Когда пар образуется при кипении воды при 100°С, частицы быстро
конденсироваться, так как температура окружающего воздуха, вероятно, будет намного ниже 100°C.
поэтому частицы быстро остывают. На самом деле «пар», выходящий из
кипящий чайник можно увидеть только потому, что некоторые частицы газа сконденсировались
для образования мелких капель воды.
При кипении жидкости частицы должны иметь достаточную энергию
отрываться от жидкости и диффундировать через частицы окружающего воздуха.Когда эти частицы остывают и теряют энергию, они конденсируются и возвращаются обратно.
к жидкости. Когда пар образуется при кипении воды при 100°С, частицы быстро
конденсироваться, так как температура окружающего воздуха, вероятно, будет намного ниже 100°C.
поэтому частицы быстро остывают. На самом деле «пар», выходящий из
кипящий чайник можно увидеть только потому, что некоторые частицы газа сконденсировались
для образования мелких капель воды.
Когда газ превращается в жидкость (конденсируется) или жидкость превращается в твердое вещество (затвердевает)
частицы отдают энергию окружающей среде.
Вернуться к началу страницы
Сопровождающий веб-сайт: Р. Джонс Обновлено: 13 ноября 2000 г.
Скрытая теплота — Гиперучебник по физике
Скрытая теплота — Гиперучебник по физикеОбсуждение
обсуждение
Назовите 6 основных фазовых изменений (включая синонимы).
Теплота, поглощаемая или выделяемая в результате фазового перехода, называется скрытой теплотой. Во время фазового перехода нет изменения температуры, поэтому нет изменения кинетической энергии частиц в материале.Высвобождаемая энергия исходит из потенциальной энергии, запасенной в связях между частицами.
- экзотермические (процессы нагревания)
- конденсат
- грелка для душа
- паровые радиаторы
- замораживание
- производители апельсинов используют лед, чтобы предотвратить замерзание апельсинов
- показания
- снежные дни теплее ясных зимой
- конденсат
- эндотермические (процессы охлаждения)
- испарение/кипение
- плавление
- сублимация
Q = мл
Разрозненные мысли…
- Ожоги паром намного хуже, чем ожоги кипятком для воды или пара при температуре 100 °C (или любой другой температуре кипения воды в вашем регионе).

- В экстремальных условиях жары и физических упражнений человек может выделять более литра жидкости в час с потом.
- Внутренняя часть жареного мяса никогда не может достичь температуры выше точки кипения воды, пока из него не будет приготовлена вся вода, после чего оно будет напоминать обувную кожу. Однако внешняя сторона быстро высыхает и может достичь температуры окружающей среды для приготовления пищи.
- Какао-масло является уникальным среди жиров тем, что оно очень регулярно по составу; тогда как большинство других жиров на самом деле являются смесями.Это дает ему определенную температуру плавления; в отличие от сливочного масла, которое постепенно размягчается. Когда он тает во рту, он поглощает скрытую теплоту. Это делает вкус шоколадных батончиков «прохладным». Какао-масло удивительно однородно по составу и структуре: только три жирные кислоты образуют большинство его триглицеридов, причем одна из них занимает среднее положение. Чистое какао-масло довольно хрупкое при температуре примерно до 34 °C (93 °F), после чего оно довольно быстро плавится.

- Конденсационные печи извлекают энергию из водяного пара, образующегося при сгорании.Когда вы сжигаете такое топливо, как природный газ или пропан, одним из побочных продуктов является водяной пар, а другими являются углекислый газ и (надеюсь, немного) окись углерода. Стандартная печь выбрасывает все это во внешний мир, но этот водяной пар горячий и, что более важно, является источником скрытого тепла. Когда он конденсируется в жидкость, что неизбежно, поскольку температура наружного воздуха значительно ниже точки кипения воды, он выделяет это тепло. Конденсационная печь заставляет этот процесс происходить внутри дома, а не снаружи.Зачем тратить эту энергию на окружающую среду? Используйте это в своих интересах. Конденсационная печь поставляется со вторым теплообменником после первого. (Первый используется для непосредственного извлечения тепла сгорания.) Он охлаждает выхлопные газы, но, что более важно, он конденсирует водяной пар для извлечения его драгоценной скрытой теплоты.
 Это позволяет печам, которые обычно извлекают от 80 до 85% тепла сгорания, достигать КПД от 90 до 95%.
Это позволяет печам, которые обычно извлекают от 80 до 85% тепла сгорания, достигать КПД от 90 до 95%.
| элементы | Т м (°С) | Т б (°С) | л f (кДж/кг) | л v (кДж/кг) |
|---|---|---|---|---|
| алюминий | 660 | 2519 | 397 | 10 900 |
| аргон | −189 | −186 | 29.5 | 161 |
| висмут | 271 | 1564 | 54,0 | 723 |
| бром (Br 2 ) | −7 | 59 | 132 | 375 |
| хлор (Cl 2 ) | −102 | −34 | 181 | 576 |
| медь | 1084 | 2562 | 209 | 4730 |
| золото | 1064 | 2856 | 63. 7 7 | 1645 |
| гелий | н/д | −269 | 3,45 | 20,7 |
| водород (H 2 ) | −259 | −253 | 59,5 | 445 |
| железо | 1538 | 2861 | 247 | 6090 |
| криптон | -157 | -153 | 16,3 | 108 |
| свинец | 327 | 1749 | 23.0 | 866 |
| литий | 181 | 1342 | 432 | 21 200 |
| ртуть | −39 | 357 | 11,4 | 295 |
| неон | −249 | −246 | 16,8 | 84,8 |
| никель | 1455 | 2913 | 298 | 6430 |
| азот (N 2 ) | −210 | −196 | 25. 3 3 | 199 |
| кислород (O 2 ) | −219 | −183 | 13,7 | 213 |
| плутоний (ε) | 640 | 3228 | 11,6 | 1370 |
| кремний | 1414 | 3265 | 1790 | 12 800 |
| серебро | 962 | 2162 | 105 | 2390 |
| натрий | 98 | 883 | 113 | 4240 |
| сера | 115 | 445 | 53.6 | 1400 |
| банка | 231 | 2602 | 59,2 | 2490 |
| титан | 1668 | 3287 | 296 | 8880 |
| вольфрам | 3422 | 5555 | 285 | 4390 |
| уран | 1135 | 4131 | 38,4 | 1750 |
| цинк | 420 | 907 | 112 | 1890 |
| соединения | Т м (°С) | Т б (°С) | л f (кДж/кг) | л v (кДж/кг) |
|---|---|---|---|---|
| спирт этиловый | −130 | 78 | ||
| спирт метиловый | −97 | 64. 7 7 | ||
| аммиак | −77,7 | −33,3 | ||
| бутан | −138,4 | −0,5 | 80,2 | |
| двуокись углерода | н/д | н/д | 571 | 205 |
| этан | −172 | −89 | 95,1 | |
| фреон 12, −30 °C | −158 | −29.8 | 166,2 | |
| фреон 12, 0 °С | −158 | −29,8 | 152,8 | |
| фреон 12, +30°С | −158 | −29,8 | 136,3 | |
| метан | −182 | −164 | 58,4 | 112 |
| пропан | −188 | −44,5 | 80,1 | |
| вода, 0 °C | 0 | 100 | 334 | 2501 |
| вода, 25 °C | 0 | 100 | 2441 | |
| вода, 100 °C | 0 | 100 | 2258 | |
| воск, пчелиный воск | 62 |
| продукты питания | Т м (°С) | Т б (°С) | л f (кДж/кг) | л v (кДж/кг) |
|---|---|---|---|---|
| сливочное масло | 32~35 | |||
| сало | 41 | |||
| маргарин столовый | 34~37 | |||
| маргарин хлебопекарный | 38~43 | |||
| масло, масло какао | 34 | |||
| масло кокосовое | 24 | |||
| масло кукурузное | −20? −15? | |||
| масло оливковое | −6 | |||
| масло пальмовое | ~35 | |||
| масло, арахис | 3 | |||
| масло соевое | −16? −13? | |||
| растительное масло | 44~50 | |||
| сахар, фруктоза | 104 | |||
| сахар, глюкоза | 146 | |||
| сахар, сахароза | 186 |
Ни одно состояние не является постоянным.
- Механика
- Кинематика
- Движение
- Расстояние и перемещение
- Скорость и Скорость
- Ускорение
- Уравнения движения
- Свободное падение
- Графики движения
- Кинематика и исчисление
- Кинематика в двух измерениях
- Снаряды
- Параметрические уравнения
- Динамика I: Сила
- Силы
- Сила и масса
- Действие-реакция
- Вес
- Динамика
- Статика
- Трение
- Силы в двух измерениях
- Центростремительная сила
- Системы отсчета
- Энергия
- Рабочий
- Энергия
- Кинетическая энергия
- Потенциальная энергия
- Сохранение энергии
- Мощность
- Простые машины
- Динамика II: Импульс
- Импульс и импульс
- Сохранение импульса
- Импульс и энергия
- Импульс в двух измерениях
- Вращательное движение
- Вращательная кинематика
- Инерция вращения
- Вращательная динамика
- Вращательная статика
- Угловой момент
- Энергия вращения
- Роллинг
- Вращение в двух измерениях
- сила Кориолиса
- Планетарное движение
- Геоцентризм
- Гелиоцентризм
- Всемирная гравитация
- Орбитальная механика I
- Гравитационная потенциальная энергия
- Орбитальная механика II
- Гравитация вытянутых тел
- Периодическое движение
- Пружины
- Простой гармонический осциллятор
- Маятники
- Резонанс
- Эластичность
- Жидкости
- Плотность
- Давление
- Плавучесть
- Поток жидкости
- Вязкость
- Аэродинамическое сопротивление
- Режимы течения
- Кинематика
- Теплофизика
- Тепло и температура
- Температура
- Тепловое расширение
- Атомная природа материи
- Газовые законы
- Кинетико-молекулярная теория
- Фазы
- Калориметрия
- Явное тепло
- Скрытая теплота
- Химическая потенциальная энергия
- Теплопередача
- Проводка
- Конвекция
- Радиация
- Термодинамика
- Тепло и работа
- Диаграммы давление-объем
- Двигатели
- Холодильники
- Энергия и энтропия
- Абсолютный ноль
- Тепло и температура
- Волны и оптика
- Волновые явления
- Природа волн
- Периодические волны
- Интерференция и наложение
- Интерфейсы и барьеры
- Звук
- Природа звука
- Интенсивность
- Эффект Доплера (звук)
- Ударные волны
- Дифракция и интерференция (звук)
- Стоячие волны
- бьет
- Музыка и шум
- Физическая оптика
- Природа света
- Поляризация
- Эффект Доплера (свет)
- Черенковское излучение
- Дифракция и интерференция (свет)
- Тонкопленочная интерференция
- Цвет
- Геометрическая оптика
- Отражение
- Преломление
- Сферические зеркала
- Сферические линзы
- Аберрация
- Волновые явления
- Электричество и магнетизм
- Электростатика
- Электрический заряд
- Закон Кулона
- Электрическое поле
- Электрический потенциал
- Закон Гаусса
- Проводники
- Электростатические приложения
- Конденсаторы
- Диэлектрики
- Батареи
- Электрический ток
- Электрический ток
- Электрическое сопротивление
- Электроэнергия
- Цепи постоянного тока
- Резисторы в цепях
- Батареи в цепях
- Конденсаторы в цепях
- Правила Кирхгофа
- Магнитостатика
- Магнетизм
- Электромагнетизм
- Закон Ампера
- Электромагнитная сила
- Магнитодинамика
- Электромагнитная индукция
- Закон Фарадея
- Закон Ленца
- Индуктивность
- Цепи переменного тока
- Переменный ток
- RC цепи
- Цепи РЛ
- LC-цепи
- Электромагнитные волны
- Уравнения Максвелла
- Электромагнитные волны
- Электромагнитный спектр
- Электростатика
- Современная физика
- Относительность
- Пространство-время
- Масса-энергия
- Общая теория относительности
- кванта
- Излучение черного тела
- Фотоэлектрический эффект
- Рентген
- Антивещество
- Волновая механика
- Волны материи
- Атомные модели
- Полупроводники
- Конденсированные вещества
- Ядерная физика
- Изотопы
- Радиоактивный распад
- Период полураспада
- Энергия связи
- Деление
- Фьюжн
- Нуклеосинтез
- Ядерное оружие
- Радиобиология
- Физика элементарных частиц
- Квантовая электродинамика
- Квантовая хромодинамика
- Квантовая динамика вкуса
- Стандартная модель
- Помимо стандартной модели
- Относительность
- Фонды
- шт.

- Международная система единиц
- Гауссова система единиц
- Британско-американская система единиц
- Разные единицы
- Время
- Преобразование единиц измерения
- Измерение
- Значащие цифры
- Порядок величины
- Графики
- Графическое представление данных
- Линейная регрессия
- Изогнутый фитинг
- Исчисление
- Векторов
- Тригонометрия
- Сложение и вычитание векторов
- Векторное разрешение и компоненты
- Умножение на вектор
- Ссылка
- Специальные символы
- Часто используемые уравнения
- Физические константы
- Астрономические данные
- Периодическая таблица элементов
- Люди в физике
- шт.
- Задняя часть

 ) подготовлено с использованием OpenSource продуктов (Linux, GIMP, LibreOffice, context). Просто из спортивного интереса.
) подготовлено с использованием OpenSource продуктов (Linux, GIMP, LibreOffice, context). Просто из спортивного интереса. Разумеется, надежность контакта в электроарматуре жилы сечением 2,3 мм2, рассчитанной на жилу 2,5 мм2, будет невысокой.
Разумеется, надежность контакта в электроарматуре жилы сечением 2,3 мм2, рассчитанной на жилу 2,5 мм2, будет невысокой. Для восстановления исходной мягкости и пластичности медь «отжигают» в защитной атмосфере, нагревая до 500-700 °C и выдерживая некоторое время. Поэтому некоторые медные изделия твёрдые, а некоторые мягкие, например медные трубы.
Для восстановления исходной мягкости и пластичности медь «отжигают» в защитной атмосфере, нагревая до 500-700 °C и выдерживая некоторое время. Поэтому некоторые медные изделия твёрдые, а некоторые мягкие, например медные трубы. Мягок, легко гнется. Провода, пищевая фольга, посуда.
Мягок, легко гнется. Провода, пищевая фольга, посуда. Низкая температура плавления, при пайке твердыми припоями риск расплавить саму деталь. Хрупок, при изгибе ломается. На изломе видны характерные кристаллы.
Низкая температура плавления, при пайке твердыми припоями риск расплавить саму деталь. Хрупок, при изгибе ломается. На изломе видны характерные кристаллы. Теодор Грей (Настоятельно рекомендую книги Теодора Грея «Элементы. Путеводитель по периодической таблице», «Научные опыты с периодической таблицей», «Эксперименты. Опыты с периодической таблицей». Они очень хорошо сделаны визуально, и опыты в них не приторно безопасные, как в большинстве современных пособий, могут и бабахнуть.) в домашних условиях проводил такой опыт. В смеси с окислом железа алюминиевая пудра образует термит— адская смесь, которая горит разогреваясь до 2400°С при этом восстанавливается железо и весело стекает вниз, что используется для сварки рельсов, иным способом такой кусок железа качественно и быстро не прогреть. Термитные карандаши позволяют в полевых условиях сваривать провода, а бравый спецназовец термитной горелкой пережжет дужку самого крепкого замка.
Теодор Грей (Настоятельно рекомендую книги Теодора Грея «Элементы. Путеводитель по периодической таблице», «Научные опыты с периодической таблицей», «Эксперименты. Опыты с периодической таблицей». Они очень хорошо сделаны визуально, и опыты в них не приторно безопасные, как в большинстве современных пособий, могут и бабахнуть.) в домашних условиях проводил такой опыт. В смеси с окислом железа алюминиевая пудра образует термит— адская смесь, которая горит разогреваясь до 2400°С при этом восстанавливается железо и весело стекает вниз, что используется для сварки рельсов, иным способом такой кусок железа качественно и быстро не прогреть. Термитные карандаши позволяют в полевых условиях сваривать провода, а бравый спецназовец термитной горелкой пережжет дужку самого крепкого замка.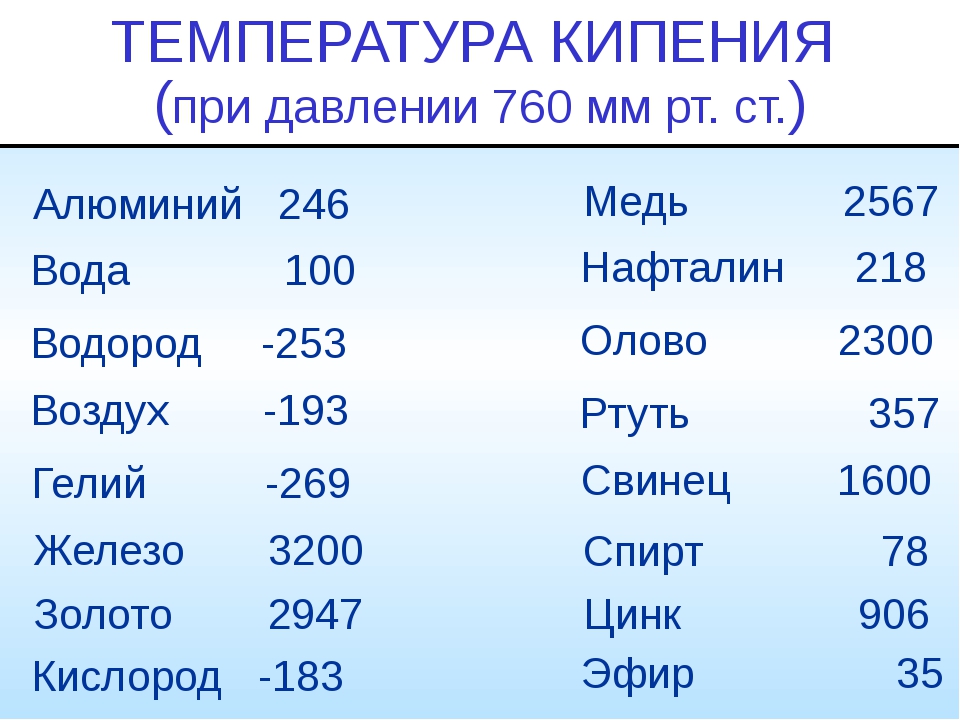 Рубин, сапфир, корунд — это всё названия одного и того же вещества — оксида алюминия Al2O3 Белые точильные круги и бруски состоят из электрокорунда — оксида алюминия.
Рубин, сапфир, корунд — это всё названия одного и того же вещества — оксида алюминия Al2O3 Белые точильные круги и бруски состоят из электрокорунда — оксида алюминия. В твердых марках алюминия (6061, 6082, 7075) можно нарезать резьбу для винта непосредственно.
В твердых марках алюминия (6061, 6082, 7075) можно нарезать резьбу для винта непосредственно.
 Для создания подвижного соединения положено использовать вытяжные заклепки (не саморезы!). Кроме этого, точка крепления заклепки должна меняться в зависимости от температуры окружающего воздуха, при которой происходит монтаж.
Для создания подвижного соединения положено использовать вытяжные заклепки (не саморезы!). Кроме этого, точка крепления заклепки должна меняться в зависимости от температуры окружающего воздуха, при которой происходит монтаж. Поэтому очень часто вытяжные заклепки заменяются на… оцинкованные саморезы. Электролитическая пара металл-алюминий говорит сама за себя.
Поэтому очень часто вытяжные заклепки заменяются на… оцинкованные саморезы. Электролитическая пара металл-алюминий говорит сама за себя.  Таким образом, кронштейны в алюминиевых системах вентилируемых фасадов являются большими мостиками холода. Российские коллеги подсчитали, что для равного утепления фасад, при использовании алюминиевой подсистемы необходимо закладывать на 20мм толще утеплитель.
Таким образом, кронштейны в алюминиевых системах вентилируемых фасадов являются большими мостиками холода. Российские коллеги подсчитали, что для равного утепления фасад, при использовании алюминиевой подсистемы необходимо закладывать на 20мм толще утеплитель. Стальная двухконтурная система навески вентилируемого фасада дешевле алюминиевой одноконтурной уже изначально, при расчете на глухую стену. Учитывая преимущества, которые дает двухконтурность разница в цене может быть двойная.
Стальная двухконтурная система навески вентилируемого фасада дешевле алюминиевой одноконтурной уже изначально, при расчете на глухую стену. Учитывая преимущества, которые дает двухконтурность разница в цене может быть двойная.
 Это необычно, потому что молекулы твердых тел в большинстве других веществ расположены ближе друг к другу, чем в жидкости.
Это необычно, потому что молекулы твердых тел в большинстве других веществ расположены ближе друг к другу, чем в жидкости.



 Это позволяет печам, которые обычно извлекают от 80 до 85% тепла сгорания, достигать КПД от 90 до 95%.
Это позволяет печам, которые обычно извлекают от 80 до 85% тепла сгорания, достигать КПД от 90 до 95%.
