Свинец
| Свинец | |
|---|---|
| Атомный номер | 82 |
| Внешний вид простого вещества | |
| Свойства атома | |
|
Атомная масса (молярная масса) |
207,2 а. е. м. (г/моль) |
| Радиус атома | 175 пм |
|
Энергия ионизации (первый электрон) |
715,2 (7,41) кДж/моль (эВ) |
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 6p2 |
| Ковалентный радиус | 147 пм |
| Радиус иона | (+4e) 84 (+2e) 120 пм |
|
Электроотрицательность (по Полингу) |
1,8 |
| Электродный потенциал |
Pb←Pb2+ -0,126 В Pb←Pb4+ 0,80 В |
| Степени окисления | 4, 2 |
| Термодинамические свойства простого вещества | |
| Плотность | 11,3415 г/см³ |
| Молярная теплоёмкость | 26,65[1]Дж/(K·моль) |
| Теплопроводность | 35,3 Вт/(м·K) |
| Температура плавления | 600,65 K |
| Теплота плавления | 4,77 кДж/моль |
| Температура кипения | 2 013 K |
| Теплота испарения | 177,8 кДж/моль |
| Молярный объём | 18,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 4,950 Å |
| Отношение c/a | n/a |
| Температура Дебая | 88,00 K |
| Pb | 82 |
| 207,2 | |
| [Xe]4f145d106s26p2 | |
| Свинец | |
Свинец — элемент главной подгруппы четвёртой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82. Обозначается символом Pb (лат. Plumbum). Простое вещество свинец (CAS-номер: 7439-92-1) — ковкий, сравнительно легкоплавкий металл серого цвета.
Происхождение слова «свинец» неясно. В большинстве славянских языков (болгарском, сербско-хорватском, чешском, польском) свинец называется оловом. Слово с тем же значением, но похожее по произношению на «свинец», встречается только в языках балтийской группы: švinas (литовский), svins (латышский).
Латинское же plumbum (тоже неясного происхождения) дало английское слово plumber — водопроводчик (когда-то трубы зачеканивали мягким свинцом), и название венецианской тюрьмы со свинцовой крышей — Пьомбе, из которой по некоторым данным ухитрился бежать Казанова. Известен с глубокой древности. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы — в Древнем Риме. Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов. До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
Нахождение свинца в природе
Содержание в земной коре 1,6·10-3% по массе. Самородный свинец встречается редко, круг пород, в которых он установлен, достаточно широк: от осадочных пород до ультраосновных интрузивных пород. В основном встречается в виде сульфидов.
Получение свинца
Страны — крупнейшие производители свинца (включая вторичный свинец) на 2004 год (по данным ILZSG), в тыс. тонн:
| ЕС | 2200 |
| США | 1498 |
| Китай | 1256 |
| Корея | 219 |
Физические свойства свинца
Свинец имеет довольно низкую теплопроводность, она составляет 35,1 Вт/(м·К) при температуре 0°C. Металл мягкий, легко режется ножом. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет.
Плотность — 11,3415 г/см³ (при 20 °C)
Температура плавления — 327,4 °C
Температура кипения — 1740 °C
Химические свойства свинца
Электронная формула: KLMN5s25p65d106s26p2, в соответствии с чем он имеет степени окисления +2 и +4. Свинец не очень активен химически. На металлическом разрезе свинца виден металлический блеск, постепенно исчезающий из-за образования тонкой плёнки РbО.
С кислородом образует ряд соединений Рb2О, РbО, РbО2, Рb2О3, Рb3О4. Без кислорода вода при комнатной температуре не реагирует со свинцом, но при большой температуре получают оксида свинца и водород при взаимодействии свинца и горячего водяного пара.
Оксидам РbО и РbО2 соответствуют амфотерные гидрооксиды Рb(ОН)2 и Рb(ОН)4.
При реакции Mg2Pb и разбавленной HCl получается небольшое количество РbН4. Pbh5 — газозообразное вещество без запаха, которое очень легко разлагается на свинец и и водород. При большой температуре галогены образовывают со свинцом соединения вида РbХ2 (X — соответствующий галоген). Все эти соединения мало растворяются в воде. Могут быть получены галогениды и типа РbХ4. Свинец с азотом прямо не реагирует. Азид свинца Pb(N3)2 получают косвенным путём: взаимодействием растворов солей Рb (II) и соли NaN3. Сульфиды свинца можно получить при нагревании серы со свинцом, образуется сульфид PbS. Сульфид получают также пропусканием сероводорода в растворы солей Pb (II). В ряду напряжений Pb стоит левее водорода, но свинец не вытесняет водород из разбавленных HCl и h3SO4, из-за перенапряжения Н2 на Pb, а также на поверхности металла образуются плёнки трудно-растворимых хлорида РbCl2 и сульфата PbSO4, защищающие металл от дальнейшего действия кислот. Концентрированные кислоты типа h3SO4 и НCl при нагревании действуют на Pb и образуют с ним растворимые комплексные соединения состава Pb(HSO4)2 и Н2[РbCl4]. Азотная, а также некоторые органических кислоты (например, лимонная) растворяют свинец с получением солей Рb(II). По растворимости в воде соли свинца делятся на нерастворимые (напрммер, сульфат, карбонат, хромат, фосфат, молибдат и сульфид), малорастворимые (вроде, хлорид и фторид) и растворимые (к примеру,ацетат, нитрат и хлорат свинца). Соли Pb (IV) могут быть получены электролизом сильно подкисленных серной кислотой растворов солей Рb (II). Соли Pb (IV) присоединяют отрицательные ионы с образованием комплексных анионов, например, плюмбатов (РbО3)2- и (РbО4)4-, хлороплюмбатов (РbCl6)2-, гидроксоплюмбатов [Рb(ОН)6]2- и других. Концентрированные растворы едких щелочей при нагревании реагируют с Pb с выделением водорода и гидроксоплюмбитов типа Х2[Рb(ОН)4]. Еион (Ме=>Ме++e)=7,42 эВ.
Основные соединения свинца
Оксиды свинца
Оксиды свинца имеют преимущественно основный или амфотерный характер. Многие из них окрашены в красные, жёлтые, чёрные, коричневые цвета. На фотографии в начале статьи, на поверхности свинцовой отливки, в её центре видны цвета побежалости — это тонкая плёнка оксидов свинца, образовавшаяся из-за окисления горячего металла на воздухе.
Галогениды свинца
Халькогениды свинца
Халькогениды свинца — сульфид свинца, селенид свинца и теллурид свинца — представляют собой кристаллы чёрного цвета, которые являются узкозонными полупроводниками.
Соли свинца
Сульфат свинца
Нитрат свинца
Ацетат свинца — свинцовый сахар, относится к очень ядовитым веществам. Ацетат свинца, или свинцовый сахар, Pb(CH3COO)2·3H2O существует в виде бесцветных кристаллов или белого порошка, медленно выветривающегося с потерей гидратной воды. Соединение хорошо растворимо в воде. Оно обладает вяжущим действием, но так как содержит ионы ядовитого свинца, то применяется как наружное в ветеринарии. Ацетат применяют также в аналитической химии, крашении, ситценабивном деле, как наполнитель шёлка и для получения других соединений свинца. Основной ацетат свинца Pb(CH 3COO)2·Pb(OH)2 — менее растворимый в воде белый порошок — используется для обесцвечивания органических растворов и очистки растворов сахара перед анализом.
Применение свинца
Свинец в народном хозяйстве
Нитрат свинца применяется для производства мощных смесевых взрывчатых веществ. Азид свинца применяется как наиболее широкоупотребляемый детонатор (инициирующее взрывчатое вещество). Перхлорат свинца используется для приготовления тяжелой жидкости (плотность 2,6 г/см³), используемой во флотационном обогащении руд, он иногда применяется в мощных смесевых взрывчатых веществах как окислитель. Фторид свинца самостоятельно, а так же совместно с фторидом висмута, меди, серебра применяется в качестве катодного материала в химических источниках тока. Висмутат свинца, сульфид свинца PbS, иодид свинца применяются в качестве катодного материала в литиевых аккумуляторных батареях. Хлорид свинца PbCl2 в качестве катодного материала в резервных источниках тока. Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников. Двуокись свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но так же на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и др.
Свинцовые белила, основной карбонат Pb(OH)2•PbCO3, плотный белый порошок, — получается из свинца на воздухе под действием углекислого газа и уксусной кислоты. Использование свинцовых белил в качестве красящего пигмента теперь не так распространено, как ранее, из-за их разложения под действием сероводорода h3S. Свинцовые белила применяют также для производства шпатлевки, в технологии цемента и свинцовокарбонатной бумаги.
Арсенат и арсенит свинца применяют в технологии инсектицидов для уничтожения насекомых — вредителей сельского хозяйства (непарного шелкопряда и хлопкового долгоносика). Борат свинца Pb(BO2)2·h3O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора. Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония Nh5Cl. Его применяют для приготовления мазей при обработке опухолей.
Хромат свинца PbCrO4 известен как хромовый желтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В промышленности хромат применяют в основном в производстве желтых пигментов. Нитрат свинца Pb(NO3)2 — белое кристаллическое вещество, хорошо растворимое в воде. Это вяжущее ограниченного применения. В промышленности его используют в спичечном производстве, крашении и набивке текстиля, окраске рогов и гравировке. Сульфат свинца Pb(SO4)2, нерастворимый в воде белый порошок, применяют как пигмент в аккумуляторах, литографии, в технологии набивных тканей.
Сульфид свинца PbS, чёрный нерастворимый в воде порошок, используют при обжиге глиняной посуды и для обнаружения ионов свинца.
Поскольку свинец хорошо поглощает γ-излучение, он используется для радиационной защиты в рентгеновских установках и в ядерных реакторах. Кроме того, свинец рассматривается в качестве теплоносителя в проектах перспективных ядерных реакторов на быстрых нейтронах.
Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 85-90 % Sn и 15-10 % Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67 % Pb и 33 % Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников. Сплавы свинца с сурьмой обычно применяют для оболочек кабелей и пластин электрических аккумуляторов. Соединения свинца используются в производстве красителей, красок, инсектицидов, стеклянных изделий и как добавки к бензину в виде тетраэтилсвинца (C2H5)4Pb (умеренно летучая жидкость, пары к-рой в малых концентрациях имеют сладковатый фруктовый запах, в больших-неприятный запах; Тпл = 130 °C, Ткип = 80°С/13 мм рт.ст.; плотн. 1,650 г/см³; nD2v = 1,5198; не раств. в воде, смешивается с орг. растворителями; высокотоксичен, легко проникает через кожу; ПДК = 0,005 мг/м³; ЛД50 = 12,7 мг/кг (крысы, перорально)) для повышения октанового числа.
Свинец в медицине
Экономические показатели
Цены на свинец в слитках (марка С1) в 2006 году составили в среднем 1,3—1,5 долл/кг.
Страны, крупнейшие потребители свинца в 2004 году, в тыс. тонн (по данным ILZSG):
| Китай | 1770 |
| ЕС | 1553 |
| США | 1273 |
| Корея | 286 |
Физиологическое действие
Свинец и его соединения токсичны. Попадая в организм, свинец накапливается в костях, вызывая их разрушение. ПДК в атмосферном воздухе соединений свинца 0,003 мг/м³, в воде 0,03 мг/л, почве 20,0 мг/кг. Выброс свинца в Мировой океан 430—650 тысяч т/год.
СВИНЕЦ | Энциклопедия Кругосвет
Содержание статьиСВИНЕЦ – химический элемент IV группы периодической таблицы. Относительная атомная масса (Ar = 207,2) является усредненной из масс нескольких изотопов: 204Pb (1,4%), 206Pb (24,1%), 207Pb (22,1%) и 208Pb (52,4%). Последние три нуклида – конечные продукты естественных радиоактивных превращений урана, актиния и тория. Известно также более 20 радиоактивных изотопов свинца, из которых наиболее долгоживущие – 202Pb и 205Pb (с периодами полураспада 300 тысяч и 15 млн. лет). В природе образуются также и короткоживущие изотопы свинца с массовыми числами 209, 210, 212 и 214 с периодами полураспада соответственно 3,25 ч, 27,1 года, 10,64 ч и 26,8 мин. Соотношение различных изотопов в разных образцах свинцовых руд может несколько различаться, что не дает возможности определить для свинца значение Ar с большей точностью.
В земной коре свинца немного – 0,0016% по массе, но этот один из самых тяжелых металлов распространен гораздо больше, чем его ближайшие соседи – золото, ртуть и висмут. Это связано с тем, что разные изотопы свинца являются конечными продуктами распада урана и тория, так что содержание свинца в земной коре медленно увеличивалось в течение миллиардов лет.
Известно много рудных месторождений, богатых свинцом, причем металл легко выделяется из минералов. Всего известно более ста свинцовых минералов. Из них основные – галенит (свинцовый блеск) PbS и продукты его химических превращений – англезит (свинцовый купорос) PbSO4 и церуссит («белая свинцовая руда») PbCO3. Реже встречаются пироморфит («зеленая свинцовая руда») PbCl2·3Pb3(PO4)2, миметит PbCl2·3Pb3(AsO4)2, крокоит («красная свинцовая руда») PbCrO4, вульфенит («желтая свинцовая руда») PbMoO4, штольцит PbWO4. В свинцовых рудах часто находятся также другие металлы – медь, цинк, кадмий, серебро, золото, висмут и др. В месте залегания свинцовых руд этим элементом обогащена почва (до 1% Pb), растения и воды.
В сильноокислительной щелочной среде степей и пустынь возможно образование диоксида свинца – минерала платтнерита. И исключительно редко встречается самородный металлический свинец. См. также СВИНЦОВАЯ ПРОМЫШЛЕННОСТЬ.
История.
Происхождение слова «свинец» неясно. В старину свинец не всегда четко отличали от олова. В большинстве славянских языков (болгарском, сербскохорватском, чешском, польском) свинец и называется оловом. Наш же «свинец» встречается только в языках балтийской группы: svinas (литовский), svin (латышский). У некоторых горе-переводчиков это приводило к забавным недоразумениям, например, к «оловянным аккумуляторам» в автомобилях. Английское название свинца lead и голландское lood, возможно, связаны с нашим «лудить». Латинское же plumbum (тоже неясного происхождения) дало английское слово plumber – водопроводчик (когда-то трубы зачеканивали мягким свинцом. И еще одна путаница, связанная со свинцом. Древние греки называли свинец «молибдос» (название сохранилось и в новогреческом языке). Отсюда – латинское molibdaena: так в средние века называли и свинцовый блеск PbS, и более редкий молибденовый блеск (MoS2), и другие похожие минералы, оставлявшие черный след на светлой поверхности. Такой же след оставляли графит и сам свинец. Тонкими свинцовыми стержнями можно было писать на пергаменте; недаром по-немецки карандаш – Bleistift, т.е. свинцовый стержень.
Свинец вместе с золотом, серебром, медью, оловом, железом и ртутью входит в семерку металлов, известных с глубокой древности. Эти металлы сопоставлялись с известными тогда планетами (свинцу соответствовал Сатурн). Считается, что впервые люди выплавили свинец из руд 8 тысяч лет назад. Раскопки в Древнем Египте обнаружили изделия из серебра и свинца в захоронениях до династического периода. К этому же времени относятся аналогичные находки, сделанные в Месопотамии. Совместные находки серебряных и свинцовых изделий не удивительны. Еще в доисторические времена внимание людей привлекли красивые тяжелые кристаллы свинцового блеска. Залежи этого минерала находили в горах Армении, в центральных районах Малой Азии. А минерал галенит часто содержит значительные примеси серебра. Если положить куски этого минерала в костер, то сера выгорит и потечет расплавленный свинец (древесный уголь препятствует окислению свинца). Уже за много тысячелетий до новой эры в Месопотамии, Египте из него отливали статуи.
В VI в. до н.э. богатые залежи галенита были обнаружены в Лаврионе – гористой местности недалеко от Афин. Во времена пунических войн (264–146 до н.э.) на территории современной Испании работали многочисленные свинцовые шахты, которые были заложены греками и финикийцами. Позднее они разрабатывались римлянами; римские инженеры использовали свинец для изготовления труб древнего водопровода. Древнегреческий историк Геродот (V в. до н.э.) писал о методе укрепления железных и бронзовых скоб в каменных плитах путем заливки отверстий легкоплавким свинцом. Позднее при раскопках Микен нашли свинцовые скобы в каменных стенах.
При получении свинца античные металлурги сначала прокаливали руду, при этом шли реакции
2PbS + 3O2 ® 2PbO + 2SO2 и PbS + 2O2 ® PbSO4. Затем температуру повышали, что приводило к выплавке свинца:
PbS + 2PbO ® 3Pb + SO2; PbS + PbSO4 ® 2Pb + 2SO2. Первые плавильные печи, сделанные из глины и камней, были весьма примитивны. Их старались установить на склонах холмов, где дуют ветры, помогающие обжигу. Выплавленный свинец, как правило, содержал серебро – иногда до 0,5% и более. При медленном охлаждении такого расплава сначала кристаллизуется чистый свинец, а жидкость обогащается серебром – примерно до 2%. Для выделения серебра использовали метод купелирования: окисляли расплавленный свинец в пористом глиняном сосуде – купели, а его оксид затем снова восстанавливали до металла. Механизм этого процесса был изучен только в 1833.
Использовали свинец и для очистки золота и серебра методом купелирования. Для этого подлежащий очистке драгоценный металл сплавляли со свинцом. Свинец и другие примеси легко окислялись при высокой температуре; образующиеся оксиды сдувались струей воздуха, а частично впитывались в поры купели, а на дне оставался слиток чистого серебра или золота. Оксид свинца затем снова могли превратить в металл, нагревая его с древесным углем. Археологические находки в Уре и Трое свидетельствуют, что купелирование было известно на северо-западе Малой Азии уже в первой половине III тыс. до н.э. А греческим умельцам из добытого в Лаврионе свинца удавалось извлечь почти все серебро: по современным анализам его оставалось в свинце всего 0,02%! Искусство древних металлургов достойно удивления: ведь у них не было ни возможности контролировать температуру на разных стадиях процесса, ни проводить химических анализов. И все же в отвалах рудников оставалось много неизвлеченного свинца. Еще лучших результатов добились римские металлурги, вдвое снизив остаточное количество серебра. Конечно, их беспокоила не чистота свинца, а полнота извлечения из него драгоценного металла. Более того, как свидетельствует греческий историк Страбон, перерабатывая старые отвалы в Лаврионе, римляне смогли извлечь довольно много и свинца, и серебра, оставив около двух миллионов тонн отработанной руды в отвалах. После этого рудники были заброшены почти на два тысячелетия, но в 1864 отвалы снова начали перерабатывать – теперь уже ради только серебра (его в них оставалось около 0,01%). На современных металлургических предприятиях в свинце оставляют еще в сотни раз меньше серебра.
Древние гончары, размалывая свинцовый блеск с глиной и водой, обливали этой смесью подлежащие обжигу глиняные сосуды. При высокой температуре поверхность сосуда покрывалась легкоплавким свинцовым стеклом. В 1673 английский стекольный мастер Джордж Равенскрофт, добавив в состав стекла оксид свинца, изобрел хрустальное стекло, которое легко плавится, прекрасно поддается обработке и обладает особым блеском, приближающим его к настоящему горному хрусталю. Позднее, сплавив чистый белый песок, поташ и оксид свинца, получили страз (от имени жившего в конце 18 в. ювелира Страсса) – сорт стекла с таким сильным блеском, что оно хорошо имитировало алмаз, а с примесью разных пигментов – другие драгоценные камни.
Тонкими свинцовыми пластинами обшивали деревянные корпуса древних кораблей. Один такой греческий корабль, построенный в III в. до н.э., был найден в 1954 на дне Средиземного моря недалеко от Марселя. Римляне изготовляли также из свинца трубы длиной 3 метра и разного, но строго определенного диаметра (всего было 15 вариантов). Это первый в истории пример стандартизированного промышленного производства. Сначала из свинца отливали пластину, оборачивали ее вокруг деревянного стержня и запаивали шов оловянно-свинцовым припоем (его состав с тех пор практически не изменился). В трубах нередко обнаруживались течи, и их надо было ремонтировать. До сих пор во время раскопок в Италии и в Англии находят такие трубы в очень хорошем состоянии. Римский зодчий и инженер Марк Витрувий Поллион рекомендовал заменить свинцовые трубы керамическими – из обожженной глины. Он обратил внимание на болезненность рабочих, занятых выплавкой свинца и считал, что свинец «лишает кровь ее силы». Однако не все разделяли это мнение. Так, римский государственный деятель, ученый и писатель Плиний, автор знаменитой «Естественной истории», писал о пользе свинцовых препаратов, о том, что свинцовая мазь помогает выводить шрамы, излечивать язвы и глазные болезни.
В средние века крыши церквей и дворцов нередко покрывали свинцовыми пластинами, устойчивыми к атмосферным влияниям. Еще в 669 свинцом покрыли крышу монастырской церкви в Йорке, а в 688 епископ в Нортумберленде приказал обшить свинцовыми пластинами крышу и стены церкви. Знаменитые витражи в соборах собирали с помощью свинцовых рамок с желобками, в которых укрепляли пластинки цветного стекла. Делали из свинца, по примеру римлян, и водопроводные, а также дренажные трубы. Так, в 1532 в Вестминстерском дворце установили свинцовые водосточные трубы квадратного сечения. Все эти изделия в те времена не прокатывали, а отливали в формах, на дно которых насыпали тонко просеянный песок. Со временем на свинцовых изделиях появлялся прочный защитный слой – патина. Некоторые облицованные свинцом средневековые шпили сохранились в течение почти семисот лет. К сожалению, пожар 1561 в Лондоне уничтожил такой шпиль величайшего собора святого Петра.
Когда появилось огнестрельное оружие, большие количества свинца пошли для изготовления пуль и дроби, и свинец начал ассоциироваться также со смертельной опасностью: «Засвищет вокруг меня губительный свинец» (А.Пушкин), «За твой окоп другой боец подставил грудь под злой свинец» (К.Симонов). Сначала дробь отливали в разъемных формах. В 1650 английский принц Руперт изобрел более быстрый и удобный способ. Он обнаружил, что если к свинцу добавить немного мышьяка и лить этот сплав через своего рода большой дуршлаг в бак с водой, то получаются шарики дроби правильной сферической формы. А после того, как в 1436 Иоганн Гутенберг изобрел способ печатать книги с использованием подвижных металлических литер, печатники в течение сотен лет отливали буквы из так называемого типографского сплава на основе свинца (с примесью олова и сурьмы).
Из соединений свинца с древних времен использовали свинцовый сурик Pb3O4 и основной карбонат свинца (свинцовые белила) в качестве красной и белой краски. Почти все картины старых мастеров писаны красками, приготовленными на основе свинцовых белил. Оригинальным был старинный способ их получения: горшки с крепким уксусом ставили в навоз, а над ними подвешивали скрученные в спираль тонкие свинцовые пластины. Разлагаясь, навоз давал тепло (оно необходимо для усиленного испарения уксусной кислоты) и углекислый газ. Совместное действие на свинец этих веществ, а также кислорода воздуха и давало белила. Помимо ядовитости, эти белила темнеют со временем, так как реагируют со следами сероводорода, который всегда присутствует в воздухе: 2PbCO3·Pb(OH)2 + 3H2S ® 3PbS + 2CO2 + 4H2O. При реставрации таких картин потемневшие участки осторожно обрабатывают раствором Н2О2, что переводит черный сульфид в белый сульфат: PbS + 4H2O2 ® PbSO4 + 4H2O. В настоящее время ядовитые свинцовые белила заменены более дорогими, но безвредными титановыми. Ограниченное применение (например, в качестве пигментов для художественных масляных красок) имеют пигменты, содержащих свинец: свинцовый крон лимонный 2PbCrO4·PbSO4, свинцовый крон желтый 13PbCrO4·PbSO4, красного цвета свинцово-молибдатный крон 7PbCrO4·PbSO4·PbMoO4.
Свойства свинца.
Свинец обычно имеет грязно-серый цвет, хотя свежий его разрез имеет синеватый отлив и блестит. Однако блестящий металл быстро покрывается тускло-серой защитной пленкой оксида. Плотность свинца (11,34 г/см3) в полтора раза больше, чем у железа, вчетверо больше, чем у алюминия; даже серебро легче свинца. Недаром в русском языке «свинцовый» – синоним тяжелого: «Ненастной ночи мгла по небу стелется одеждою свинцовой»; «И как свинец пошел ко дну» – эти пушкинские строки напоминают, что со свинцом неразрывно связано понятие гнета, тяжести.
Свинец очень легко плавится – при 327,5° С, кипит при 1751° С и заметно летуч уже при 700° С. Этот факт очень важен для работающих на комбинатах по добыче и переработке свинца. Свинец – один из самых мягких металлов. Он легко царапается ногтем и прокатывается в очень тонкие листы. Свинец сплавляется со многими металлами. С ртутью он дает амальгаму, которая при небольшом содержании свинца жидкая.
По химическим свойствам свинец – малоактивный металл: в электрохимическом ряду напряжений он стоит непосредственно перед водородом. Поэтому свинец легко вытесняется другими металлами из растворов его солей. Если опустить в подкисленный раствор ацетата свинца цинковую палочку, свинец выделяется на ней в виде пушистого налета из мелких кристалликов, имеющего старинного название «сатурнова дерева». Если затормозить реакцию, обернув цинк фильтровальной бумагой, вырастают более крупные кристаллы свинца.
Наиболее типична для свинца степень окисления +2; соединения свинца(IV) значительно менее устойчивы. В разбавленных соляной и серной кислотах свинец практически не растворяется, в том числе из-за образования на поверхности нерастворимой пленки хлорида или сульфата. С крепкой серной кислотой (при концентрации более 80%) свинец реагирует с образованием растворимого гидросульфата Pb(HSO4)2, а в горячей концентрированной соляной кислоте растворение сопровождается образованием комплексного хлорида H4PbCl6. Разбавленной азотной кислотой свинец легко окисляется:
Pb + 4HNO3 ® Pb(NO3)2 + 2NO2 + H2O. Разложение нитрата свинца(II) при нагревании – удобный лабораторный метод получения диоксида азота:
2Pb(NO3)2 ® 2PbO + 4NO2 + O2.
В присутствии кислорода свинец растворяется также в ряде органических кислот. При действии уксусной кислоты образуется легкорастворимый ацетат Pb(CH2COO)2 (старинное название – «свинцовый сахар»). Свинец заметно растворим также в муравьиной, лимонной и винной кислотах. Растворимость свинца в органических кислотах могло раньше приводить к отравлениям, если пищу готовили в посуде, луженной или паянной свинцовым припоем. Растворимые соли свинца (нитрат и ацетат) в воде гидролизуются:
Pb(NO3)2 + H2O 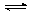 Pb(OH)NO3 + HNO3. Взвесь основного ацетата свинца («свинцовая примочка») имеет ограниченное медицинское применение в качестве наружного вяжущего средства.
Pb(OH)NO3 + HNO3. Взвесь основного ацетата свинца («свинцовая примочка») имеет ограниченное медицинское применение в качестве наружного вяжущего средства.
Свинец медленно растворяется и в концентрированных щелочах с выделением водорода: Pb + 2NaOH + 2H2O ® Na2Pb(OH)4 + H2, что указывает на амфотерные свойства соединений свинца. Белый гидроксид свинца(II), легко осаждаемый из растворов его солей, также растворяется как в кислотах, так и в сильных щелочах:
Pb(OH)2 + 2HNO3 ® Pb(NO3)2 + 2H2O; Pb(OH)2 + 2NaOH ® Na2Pb(OH)4. При стоянии или нагревании Pb(OH)2 разлагается с выделением PbO. При сплавлении PbO со щелочью образуется плюмбит состава Na2PbO2.
Из щелочного раствора тетрагидроксоплюмбата натрия Na2Pb(OH)4 тоже можно вытеснить свинец более активным металлом. Если в такой нагретый раствор положить маленькую гранулу алюминия, быстро образуется серый пушистый шарик, который насыщен мелкими пузырьками выделяющегося водорода и потому всплывает. Если алюминий взять в виде проволоки, выделяющийся на ней свинец превращает ее в серую «змею».
При нагревании свинец реагирует с кислородом, серой и галогенами. Так, в реакции с хлором образуется тетрахлорид PbCl4 – желтая жидкость, дымящая на воздухе из-за гидролиза, а при нагревании разлагающаяся на PbCl2 и Cl2. (Галогениды PbBr4 и PbI4 не существуют, так как Pb(IV) – сильный окислитель, который окислил бы бромид- и иодид-анионы.) Тонкоизмельченный свинец обладает пирофорными свойствами – вспыхивает на воздухе. При продолжительном нагревании расплавленного свинца он постепенно переходит сначала в желтый оксид PbO (свинцовый глет), а затем (при хорошем доступе воздуха) – в красный сурик Pb3O4 или 2PbO·PbO2. Это соединение можно рассматривать также как свинцовую соль ортосвинцовой кислоты Pb2[PbO4]. С помощью сильных окислителей, например, хлорной извести, соединения свинца(II) можно окислить до диоксида:
Pb(CH3COO)2 + Ca(ClO)Cl + H2O ® PbO2 + CaCl2 + 2CH3COOH. Диоксид образуется также при обработке сурика азотной кислотой:
Pb3O4 + 4HNO3 ® PbO2 + 2Pb(NO3)2 + 2H2O. Если сильно нагревать коричневый диоксид, то при температуре около 300° С он превратится в оранжевый Pb2O3 (PbO·PbO2), при 400°С – в красный Pb3O4, а выше 530° С – в желтый PbO (разложение сопровождается выделением кислорода). В смеси с безводным глицерином свинцовый глет медленно, в течение 30–40 минут реагирует с образованием водоупорной и термостойкой твердой замазки, которой можно склеивать металл, стекло и камень.
Диоксид свинца – сильный окислитель. Струя сероводорода, направленная на сухой диоксид, загорается; концентрированная соляная кислота окисляется им до хлора:
PbO2 + 4HCl ® PbCl2 + Cl2 + H2O, сернистый газ – до сульфата: PbO2 + SO2 ® PbSO4, а соли Mn2+ – до перманганат-ионов: 5PbO2 + 2MnSO4 + H2SO4 ® 5PbSO4 + 2HMnO4 + 2H2O. Диоксид свинца образуется, а затем расходуется при зарядке и последующем разряде самых распространенных кислотных аккумуляторов. Соединения свинца(IV) обладают еще более типичными амфотерными свойствами. Так, нерастворимый гидроксид Pb(OH)4 бурого цвета легко растворяется в кислотах и щелочах: Pb(OH)4 + 6HCl ® H2PbCl6; Pb(OH)4 + 2NaOH ® Na2Pb(OH)6. Диоксид свинца, реагируя с щелочью, также образует комплексный плюмбат(IV):
PbO2 + 2NaOH + 2H2O ® Na2[Pb(OH)6]. Если же PbO2 сплавить с твердой щелочью, образуется плюмбат состава Na2PbO3. Из соединений, в которых свинец(IV) входит в состав катиона, наиболее важен тетраацетат. Его можно получить кипячением сурика с безводной уксусной кислотой:
Pb3O4 + 8CH3COOH ® Pb(CH3COO)4 + 2Pb(CH3COO)2 + 4H2O. При охлаждении из раствора выделяются бесцветные кристаллы тетраацетата свинца. Другой способ – окисление ацетата свинца(II) хлором: 2Pb(CH3COO)2 + Cl2 ® Pb(CH3COO)4 + PbCl2. Водой тетраацетат мгновенно гидролизуется до PbO2 и CH3COOH. Тетраацетат свинца находит применение в органической химии в качестве селективного окислителя. Например, он весьма избирательно окисляет только некоторые гидроксильные группы в молекулах целлюлозы, а 5-фенил-1-пентанол под действием тетраацетата свинца окисляется с одновременной циклизацией и образованием 2-бензилфурана.
Органические производные свинца – бесцветные очень ядовитые жидкости. Один из методов их синтеза – действие алкилгалогенидов на сплав свинца с натрием:
4C2H5Cl + 4PbNa ® (C2H5)4Pb + 4NaCl + 3Pb. Действием газообразного HCl можно отщеплять от тетразамещенных свинца один алкильный радикал за другим, заменяя их на хлор. Соединения R4Pb разлагаются при нагревании с образованием тонкой пленки чистого металла. Такое разложение тетраметилсвинца было использовано для определения времени жизни свободных радикалов. Тетраэтилсвинец – антидетонатор моторного топлива.
Получение свинца.
Количество добываемого свинца непрерывно возрастает. Если в 1800 во всем мире его было получено около 30 000 тонн, то в 1850 – 130 000 т, в 1875 – 320 000 т, в 1900 – 850 000 т, 1950 – почти 2 млн. т, а в настоящее время в год добывают около 5 млн. т. По объему производства свинец занимает четвертое место среди цветных металлов – после алюминия, меди и цинка.
Основной источник свинца – сульфидные полиметаллические руды, содержащие от 1 до 5% свинца. Руду концентрируют до содержания свинца 40 – 75%, затем подвергают обжигу: 2PbS + 3O2 ® 2PbO + 2SO2 и восстанавливают свинец коксом и оксидом углерода(II). Более экономичный, так называемый автогенный, способ заключается в проведении реакции PbS + 2PbO ® 3Pb + SO2 (PbO образуется при частичном обжиге PbS). Получаемый из руды свинец содержит от 3 до 7% примесей в виде меди, сурьмы, мышьяка, олова, алюминия, висмута а также золота и серебра. Их удаление (или выделение, если это экономически рентабельно), требует сложных и длительных операций. Очистку свинца можно проводить также методом электрохимического рафинирования. Электролитом служит водный раствор фторосиликата свинца PbSiF6. На катоде оседает чистый свинец, а примеси концентрируются в анодном шламе, содержащем много ценных компонентов, которые затем выделяют.
Свинец в организме человека.
Соединения свинца ядовиты. Но очевидным это стало далеко не сразу. В прошлом покрытия гончарных изделий свинцовой глазурью, изготовление свинцовых водопроводных труб, использование свинцовых белил (особенно в косметических целях), применение свинцовых трубок в конденсаторах паров на винокуренных заводах – все это приводило к накоплению свинца в организме. Древние греки знали, что вино и кислые соки нельзя держать в глазурованных глиняных сосудах (глазурь содержала свинец), а вот римляне этим правилом пренебрегали. Джемс Линд, рекомендовавший в 1753 английскому адмиралтейству лимонный сок как средство против цинги для моряков в дальнем плавании, предостерегал от хранения сока в гончарных глазурованных изделиях. Тем не менее случаи отравления, в том числе и смертельные, наблюдались по той же причине и двести лет спустя.
Свинец проникает в организм через желудочно-кишечный тракт или дыхательную систему и разносится затем кровью по всему организму. Причем вдыхание свинцовой пыли значительно опаснее присутствия свинца в пище. В воздухе городов содержание свинца составляет в среднем от 0,15 до 0,5 мкг/м3. В районах, где расположены предприятия по переработке полиметаллических руд, эта концентрация выше.
Свинец накапливается в костях, частично замещая кальций в фосфате Са3(РО4)2. Попадая в мягкие ткани – мышцы, печень, почки, головной мозг, лимфатические узлы, свинец вызывает заболевание – плюмбизм. Как и многие другие тяжелые металлы, свинец (в виде ионов) блокирует деятельность некоторых ферментов. Было установлено, что их активность снижается в 100 раз при увеличении концентрации свинца в крови в 10 раз – с 10 до 100 микрограммов на 100 мл крови. При этом развивается анемия, поражаются кроветворная система, почки и мозг, снижается интеллект. Признак хронического отравления – серая кайма на деснах, расстройство нервной системы. Особенно опасен свинец для детей, так как он вызывает задержку в развитии. В то же время десятки миллионов детей во всем мире в возрасте до 6 лет имеют свинцовое отравление; основная причина – попадание в рот краски, содержащей свинец. Антидотом при отравлении может служить кальциевая соль этилендиаминтетрауксусной кислоты. В отравленном организме происходит замещение кальция на ионы свинца, которые удерживаются в этой соли очень прочно и в таком виде выводятся.
Свинец легко может попасть в организм с питьевой водой, если она соприкасалась с металлом: в присутствии углекислого газа в раствор медленно переходит растворимый гидрокарбонат Pb(HCO3)2. В Древнем Риме, где для подачи воды использовали свинцовые трубы, такое отравление было весьма распространенным, на что указывают анализы останков римлян. Причем отравлялись, в основном, богатые римляне, пользовавшиеся водопроводом, хранившие вино, оливковое масло и другие продукты в освинцованных сосудах, использовавшие содержащие свинец косметические средства. Достаточно, чтобы в литре воды был всего один миллиграмм свинца – и питье такой воды становится очень опасным. Это количество свинца так малó, что не изменяет ни запаха, ни вкуса воды, и только точные современные приборы могут его обнаружить.
Свинцовым отравлением некоторые историки объясняют и болезненность ряда русских царей. В 1633 в московском Кремле закончили строительство водопровода. Вода в него поступала из колодца в нижнем этаже Свибловой башни, стоявшей на слиянии Неглинной и Москвы-реки. Воду из колодца качали при помощи подъемной машины – взвода (с тех пор эта кремлевская башня называется Водовзводной). Машину приводили в движение лошади. Воду закачивали в большой бак, а оттуда вода сама по трубам текла на царскую кухню, в сады, другие места. Трубы были изготовлены из свинца; бак для воды изнутри тоже был выложен свинцовыми листами, чтобы вода из него не просачивалась в щели. Особенно много свинца накапливалось в воде за ночь, после ее неподвижного стояния в свинцовом баке и трубах.
Кремлевский «свинцовый водопровод» работал чуть больше 100 лет – его уничтожил пожар 1737. И в период действия этого водопровода русские цари жили меньше обычного. Так, царь и великий князь Иван V Алексеевич, сын царя Алексея Михайловича и первой жены его, Милославской, прожил всего 29 лет. Незадолго до смерти он выглядел дряхлым стариком. С детства он был, как писали тогда, «слабый и болезненный, немощен телом и рассудком, заикался, скорбен головою, страдал цингою и глазною болезнью». Из шести братьев царя пятеро не дожили до 20 лет. Некоторые ученые считают, что это последствия свинцового отравления. А вот шестой брат, Петр Алексеевич, будущий Петр I, избежал отравления – детство и отрочество он провел не в Кремле, а в подмосковных селах. Да и позднее он мало бывал в Кремле – много воевал, путешествовал по Европе, а потом и вовсе перенес столицу на берега Невы. Кстати, первый водопровод в Петербурге, который давал воду для дворцов и фонтанов Летнего сада, был деревянным. Его трубы были сделаны из бревен с просверленными в них отверстиями. Свинец же Петр использовал в военных целях – для отливки пуль.
А вот как пишут о свинцовом отравлении современные медицинские справочники: вялость, апатия, потеря памяти, раннее слабоумие, ослабление зрения, больные выглядят старше своих лет. Удивительно напоминает старинное описание царя Ивана Алексеевича!
Травились когда-то не только «свинцовой водой». Свинец широко использовали при изготовлении посуды (свинцовая глазурь), свинцовых белил, которыми окрашивали стены домов. Сейчас такое применение свинца строжайше запрещено. Белила, например, делают цинковые или титановые. Тем не менее у жителей промышленно развитых стран свинца в организме больше, чем у жителей отсталых и развивающихся стран, а у городских жителей больше, чем у сельских. Разница может быть огромной – в сотни раз.
Свинцовое загрязнение приобрело в 20 в. глобальный характер. Даже в снегах Гренландии его содержание за сто лет увеличилось в пять раз, а в центрах крупных городов в почве и растениях свинца в 25 раз больше, чем на окраинах! Загрязнение свинцом наблюдается в районах его добычи, а также в местах переработки и автострад, особенно если еще используется этилированный бензин. Немало свинца оседает на дне озер в виде охотничьей дроби. Каждый год в Мировой океан со сточными водами попадает более полумиллиона тонн этого ядовитого металла. А кто не видел выброшенные в мусорные ящики, а то и просто в канавы отработанные аккумуляторы! Пока свинец дешев, собирание и переработка его отходов невыгодна. Малая растворимость большинства соединений свинца, к счастью, не позволяет ему накапливаться в значительных количествах в воде. В водах Мирового океана его содержится в среднем 0,03 мкг/л (3·10–9%). Мало в среднем свинца и в живом веществе – 10–4%.
Применение свинца.
Несмотря на ядовитость свинца, отказаться от него невозможно. Свинец дешев – вдвое дешевле алюминия, в 11 раз дешевле олова. После того как в 1859 французский физик Гастон Планте изобрел свинцовый аккумулятор, для изготовления аккумуляторных пластин с тех пор израсходовали миллионы тонн свинца; в настоящее время на эти цели уходит в ряде стран до 75% всего добываемого свинца! Постепенно снижается применение свинца для изготовления очень ядовитого антидетонатора – тетраэтилсвинца. Способность тетраэтилсвинца улучшать качество бензина было открыто группой молодых американских инженеров в 1922; в своих поисках они руководствовались периодической таблицей элементов, планомерно приближаясь к наиболее эффективному средству. С тех пор производство тетраэтилсвинца непрерывно росло; максимум приходится на конец 1960-х, когда только в США ежегодно с выхлопами выбрасывались сотни тысяч тонн свинца – по килограмму на каждого жителя! В последние годы применение этилированного бензина запрещено во многих регионах, и его производство снижается.
Мягкий и пластичный свинец, не ржавеющий в присутствии влаги, – незаменимый материал для изготовления оболочек электрических кабелей; на эти цели в мире расходуется до 20% свинца. Малоактивный свинец используют для изготовления кислотоупорной аппаратуры для химической промышленности, например, для облицовки реакторов, в которых получают соляную и серную кислоты. Тяжелый свинец хорошо задерживает губительные для человека излучения и потому свинцовые экраны используются для защиты работников рентгеновских кабинетов, в свинцовых контейнерах хранят и перевозят радиоактивные препараты. Свинец содержат также подшипниковые сплавы баббиты, «мягкие» припои (самый известный – «третник» – сплав свинца с оловом).
В строительстве свинец используют для уплотнения швов и создания сейсмостойких фундаментов. В военной технике – для изготовления шрапнели и сердечников пуль.
Илья Леенсон
Cвинец химический элемент, плотность, температура плавления, удельный вес, формула плюмбума, молярная масса, степень окисления, свойства, применение

Свинец — это один из редких самородных металлов, имеющий бело-серебристый цвет. Он мягкий, легкоплавкий, пластичный.
Этот металл был известен уже в древние времена. В данной статье мы поговорим об использовании, производстве, физических и химических свойствах плюмбума Pb химического элемента таблицы Менделеева.
Что такое свинец
Это элемент в химической таблице под атомным номером 82, он же Pb (Plumbum).

В классическом виде он обычно имеет серебряный цвет. Удельный вес 11,35 г/см3.
История открытия химического элемента Pb
На ближнем Востоке свинец стал известен ещё с 3 тысячелетия до нашей эры, где он участвовал в создании кирпичей, статуй и разных бытовых предметов. Его сопоставляли Сатурну.

Археологические раскопки, которые проводились на территории Древнего царства Египта, помогли найти свинцовые изделия. Подобные открытия сделаны и на территории бывшей Месопотамии и Армении.
Его использовали не только в качестве самостоятельного металла для изделия, но также для очищения серебра и золота. Затем металлу нашли новую задачу – им обшивали корпуса кораблей и применяли в медицинских целях.
В конце 17 века появилось хрустальное стекло за счет добавления в стекло свинца. После, из него стали изготавливать пули.
Характеристика свинца
Если вас интересует, какого цвета свинец, то ответ следующий — плюмбум имеет голубовато-серый оттенок. Он плотный и тяжелый. Достаточно несложно добывается.

Как и любой из существующих металлов, свинец отличается своими физическими и химическими особенностями, которые и отличают его от других металлов.
Физические свойства
Металл не отличает высокая твердость. Это довольно мягкий металл, легко режущийся лезвием. Плавится при невысокой температуре плавления (327 градусов).

Температура кристаллизации 327 градусов, а температура кипения 2022 К. Плюмбум подлежит достаточно быстрому окислению на открытом воздухе.
Полезно знать: неприятным критерием свинца является его токсичность: в хроническом течении он собирается во внутренних органах и костной ткани, чем вызывает нарушения в организме живых существ.
Теплопроводность в два раза меньше железа.
Молярная масса 207,2 а. е. м. ± 0,1 а. е. м.
Формула простых оксидов — оксид свинца (II) PbO и оксид свинца (IV) PbO2 и смешанный Pb3O4 (свинцовый сурик).
Химические свойства
Является металлом малоактивным, стоящим в электрохимическом ряду перед водородом, что делает его легко вытесняемым иными металлами из растворов его солей. Степень окисления +2.

Заметно растворим в лимонной, уксусной и винной кислотах. Бесцветные ядовитые жидкости производные свинца. Его пары ядовиты.
Некоторые школьники и студенты спрашивают свинец магнитится или нет? Нет, такие качества отсутствуют.
Помимо токсичности, хочется знать, свинец радиоактивен или нет? Искусственные изотопы металла радиоактивны.
Основные соединения свинца
Галогениды образуются, взаимодействуя с фтором, хлором, бромом, йодом, и астатом. Халькогениды с кислородом, серой, селеном, теллуром, и полонием. Пниктиды с азотом и фосфором.
Области применения
Элемент получил широкое применение:
- В электротехнической системе, благодаря своей сопротивляемости коррозии, применяется в целях защиты кабелей, сверхпроводников, применяются свинцовые аккумуляторы.
- В военной промышленности делают пули и снаряды, взрывчатки и детонаторы.
- В медицине является защитником от радиации (пример: обследование рентгеном).
- В производстве — свинец входит в состав цемента, используется для защитных барьеров керамики и стекла.

Люди, боящиеся отравления свинцом, спрашивают где можно найти свинец? В домашних условиях его можно обнаружить в аккумуляторах, в кабелях.
Производство свинца
Около половины металла производится из руд. Годовая добыча составляет 5 млн. тонн. Переработка крайне выгодна в плане экономии.
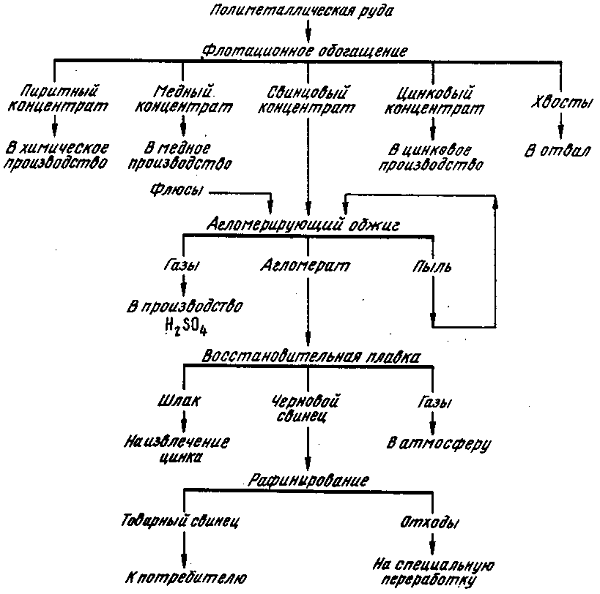
Приемы получения свинца это:
- пирометаллургический,
- гидрометаллургический.
В пирометаллургическом способе имеющиеся компоненты переплавляются, а во втором наблюдается разложение существующих концентратов.

Наибольшими объёмами добычи свинцовой руды могут быть отмечены такие страны, как:
- Китай,
- Мексика,
- Австралия,
- США,
- Перу.
Добыча свинца в России
Седьмое место по производству этого металла занимает Россия. Доля РФ в запасах этого метала чуть более 2% из-за его низкой концентрации в местных месторождениях. Причем свинец отправляется на экспорт.

Было высчитано, что на территории России находится около 70 месторождений свинца, производящих 93% процента этого металла в таких регионах, как: Красноярский край, Республика Бурятия, Читинская область, Алтайский край и Приморский край.
Можно это выявить в процентном соотношении:
- Сибирь – приблизительно 75%,
- Урал – около 15%,
- Дальний Восток – немногим меньше 10%.
Нахождение в природе
Обычно металл перемешан с каким-либо другим металлом, например, с оловом, а не встречается в чистом виде.

Галенит
Свинец – является стадией распада урана, поэтому может находиться в урановых рудах. Свинец получается из такого сырья, как галенит.
Заключение
Свинец — это металл, который уже известен людям многие тысячи лет. Такая наука, как химия, сейчас помогает разобраться в его свойствах, чтобы правильно и экономно употребить. Его месторождения располагаются во многих частях Земли.
На мировом рынке его цена достаточно стабильна. Благодаря уникальности своих физико-химических свойств, Pb применяется во многих сферах и отраслях, подлежит импорту и экспорту.
Свинец и его свойства
СВИНЕЦ (лат. Plumbum), Pb, химический элемент IV группы периодической системы Менделеева, атомный номер 82, атомная масса 207,2.
1.Свойства
Свинец обычно имеет грязно-серый цвет, хотя свежий его разрез имеет синеватый отлив и блестит. Однако блестящий металл быстро покрывается тускло-серой защитной пленкой оксида. Плотность свинца (11,34 г/см3) в полтора раза больше, чем у железа, вчетверо больше, чем у алюминия; даже серебро легче свинца. Недаром в русском языке «свинцовый» – синоним тяжелого: «Ненастной ночи мгла по небу стелется одеждою свинцовой»; «И как свинец пошел ко дну» – эти пушкинские строки напоминают, что со свинцом неразрывно связано понятие гнета, тяжести.
Свинец очень легко плавится – при 327,5° С, кипит при 1751° С и заметно летуч уже при 700° С. Этот факт очень важен для работающих на комбинатах по добыче и переработке свинца. Свинец – один из самых мягких металлов. Он легко царапается ногтем и прокатывается в очень тонкие листы. Свинец сплавляется со многими металлами. С ртутью он дает амальгаму, которая при небольшом содержании свинца жидкая.
2.Химические свойства
По химическим свойствам свинец – малоактивный металл: в электрохимическом ряду напряжений он стоит непосредственно перед водородом. Поэтому свинец легко вытесняется другими металлами из растворов его солей. Если опустить в подкисленный раствор ацетата свинца цинковую палочку, свинец выделяется на ней в виде пушистого налета из мелких кристалликов, имеющего старинного название «сатурнова дерева». Если затормозить реакцию, обернув цинк фильтровальной бумагой, вырастают более крупные кристаллы свинца. Наиболее типична для свинца степень окисления +2; соединения свинца(IV) значительно менее устойчивы. В разбавленных соляной и серной кислотах свинец практически не растворяется, в том числе из-за образования на поверхности нерастворимой пленки хлорида или сульфата. С крепкой серной кислотой (при концентрации более 80%) свинец реагирует с образованием растворимого гидросульфата Pb(HSO4)2, а в горячей концентрированной соляной кислоте растворение сопровождается образованием комплексного хлорида h5PbCl6. Разбавленной азотной кислотой свинец легко окисляется:
Pb + 4HNO3 = Pb(NO3)2 + 2NO2 + h3O.
Разложение нитрата свинца(II) при нагревании – удобный лабораторный метод получения диоксида азота:
2Pb(NO3)2 = 2PbO + 4NO2 + O2.
В присутствии кислорода свинец растворяется также в ряде органических кислот. При действии уксусной кислоты образуется легкорастворимый ацетат Pb(Ch4COO)2 (старинное название – «свинцовый сахар»). Свинец заметно растворим также в муравьиной, лимонной и винной кислотах. Растворимость свинца в органических кислотах могло раньше приводить к отравлениям, если пищу готовили в посуде, луженной или паянной свинцовым припоем. Растворимые соли свинца (нитрат и ацетат) в воде гидролизуются:
Pb(NO3)2 + h3O = Pb(OH)NO3 + HNO3.
Взвесь основного ацетата свинца («свинцовая примочка») имеет ограниченное медицинское применение в качестве наружного вяжущего средства. Свинец медленно растворяется и в концентрированных щелочах с выделением водорода:
Pb + 2NaOH + 2h3O = Na2Pb(OH)4 + h3
что указывает на амфотерные свойства соединений свинца. Белый гидроксид свинца(II), легко осаждаемый из растворов его солей, также растворяется как в кислотах, так и в сильных щелочах:
Pb(OH)2 + 2HNO3 = Pb(NO3)2 + 2h3O;
Pb(OH)2 + 2NaOH = Na2Pb(OH)4
При стоянии или нагревании Pb(OH)2 разлагается с выделением PbO. При сплавлении PbO со щелочью образуется плюмбит состава Na2PbO2. Из щелочного раствора тетрагидроксоплюмбата натрия Na2Pb(OH)4 тоже можно вытеснить свинец более активным металлом. Если в такой нагретый раствор положить маленькую гранулу алюминия, быстро образуется серый пушистый шарик, который насыщен мелкими пузырьками выделяющегося водорода и потому всплывает. Если алюминий взять в виде проволоки, выделяющийся на ней свинец превращает ее в серую «змею». При нагревании свинец реагирует с кислородом, серой и галогенами. Так, в реакции с хлором образуется тетрахлорид PbCl4 – желтая жидкость, дымящая на воздухе из-за гидролиза, а при нагревании разлагающаяся на PbCl2 и Cl2. (Галогениды PbBr4 и PbI4 не существуют, так как Pb(IV) – сильный окислитель, который окислил бы бромид- и иодид-анионы.) Тонкоизмельченный свинец обладает пирофорными свойствами – вспыхивает на воздухе. При продолжительном нагревании расплавленного свинца он постепенно переходит сначала в желтый оксид PbO (свинцовый глет), а затем (при хорошем доступе воздуха) – в красный сурик Pb3O4 или 2PbO·PbO2. Это соединение можно рассматривать также как свинцовую соль ортосвинцовой кислоты Pb2[PbO4]. С помощью сильных окислителей, например, хлорной извести, соединения свинца(II) можно окислить до диоксида:
Pb(Ch4COO)2 + Ca(ClO)Cl + h3O = PbO2 + CaCl2 + 2Ch4COOH
Диоксид образуется также при обработке сурика азотной кислотой:
Pb3O4 + 4HNO3 = PbO2 + 2Pb(NO3)2 + 2h3O.
Если сильно нагревать коричневый диоксид, то при температуре около 300° С он превратится в оранжевый Pb2O3 (PbO·PbO2), при 400° С – в красный Pb3O4, а выше 530° С – в желтый PbO (разложение сопровождается выделением кислорода). В смеси с безводным глицерином свинцовый глет медленно, в течение 30–40 минут реагирует с образованием водоупорной и термостойкой твердой замазки, которой можно склеивать металл, стекло и камень. Диоксид свинца – сильный окислитель. Струя сероводорода, направленная на сухой диоксид, загорается; концентрированная соляная кислота окисляется им до хлора:
PbO2 + 4HCl = PbCl2 + Cl2 + h3O,
сернистый газ – до сульфата:
PbO2 + SO2 = PbSO4,
а соли Mn2+ – до перманганат-ионов:
5PbO2 + 2MnSO4 + h3SO4 = 5PbSO4 + 2HMnO4 + 2h3O.
Диоксид свинца образуется, а затем расходуется при зарядке и последующем разряде самых распространенных кислотных аккумуляторов. Соединения свинца(IV) обладают еще более типичными амфотерными свойствами. Так, нерастворимый гидроксид Pb(OH)4 бурого цвета легко растворяется в кислотах и щелочах:
Pb(OH)4 + 6HCl = h3PbCl6;
Pb(OH)4 + 2NaOH = Na2Pb(OH)6.
Диоксид свинца, реагируя со щелочью, также образует комплексный плюмбат(IV):
PbO2 + 2NaOH + 2h3O = Na2[Pb(OH)6].
Если же PbO2 сплавить с твердой щелочью, образуется плюмбат состава Na2PbO3. Из соединений, в которых свинец(IV) входит в состав катиона, наиболее важен тетраацетат. Его можно получить кипячением сурика с безводной уксусной кислотой:
Pb3O4 + 8Ch4COOH = Pb(Ch4COO)4 + 2Pb(Ch4COO)2 + 4h3O.
При охлаждении из раствора выделяются бесцветные кристаллы тетраацетата свинца. Другой способ – окисление ацетата свинца(II) хлором:
2Pb(Ch4COO)2 + Cl2 = Pb(Ch4COO)4 + PbCl2.
Водой тетраацетат мгновенно гидролизуется до PbO2 и Ch4COOH. Тетраацетат свинца находит применение в органической химии в качестве селективного окислителя. Например, он весьма избирательно окисляет только некоторые гидроксильные группы в молекулах целлюлозы, а 5-фенил-1-пентанол под действием тетраацетата свинца окисляется с одновременной циклизацией и образованием 2-бензилфурана. Органические производные свинца – бесцветные очень ядовитые жидкости. Один из методов их синтеза – действие алкилгалогенидов на сплав свинца с натрием:
4C2H5Cl + 4PbNa = (C2H5)4Pb + 4NaCl + 3Pb
Действием газообразного HCl можно отщеплять от тетразамещенных свинца один алкильный радикал за другим, заменяя их на хлор. Соединения R4Pb разлагаются при нагревании с образованием тонкой пленки чистого металла. Такое разложение тетраметилсвинца было использовано для определения времени жизни свободных радикалов. Тетраэтилсвинец – антидетонатор моторного топлива.
3.Применение
Используют для изготовления пластин для аккумуляторов (около 30% выплавляемого свинца), оболочек электрических кабелей, защиты от гамма-излучения (стенки из свинцовых кирпичей), как компонент типографских и антифрикционных сплавов, полупроводниковых материалов
Источник: Компания ЛИК
Свинец — Мегаэнциклопедия Кирилла и Мефодия — статья
Свине́ц (лат. plumbum), Pb (читается «плюмбум»), химический элемент с атомным номером 82, атомная масса 207, 2. Природный свинец состоит из пяти стабильных изотопов: 202Pb (следы), 204Pb (1, 48%), 206Pb(23, 6%), 207Pb (22, 6%) и 208Pb (52, 3%). Последние три изотопа — конечные продукты радиоактивного распада Ac, U и Th. В природе образуются радиоактивные изотопы: 209Pb, 210Pb (историческое название радий Д, RaD, Т1/2 = 22 года), 211Pb (актиний Б, АсВ, Т1/2 = 36, 1 мин), 212Pb (торий Б, ThB, Т1/2 = 10, 6 часа), 214Pb (радий Б, RaB, Т1/2 = 26, 8 мин).
Конфигурация внешнего электронного слоя 6s2p2. Степени окисления +2, реже +4 (валентность II, IV). Расположен в группе IVA, в 6 периоде периодической системы элементов. Радиус атома 0, 175 нм, радиус иона Pb2+ 0, 112 нм (координационное число 4) и 0, 133 (6), иона Pb4+— 0, 133 нм (8). Энергии последовательной ионизации 7, 417, 15, 032, 31, 98, 42, 32 и 68, 8 эВ. Работа выхода электрона 4, 05 эВ. Электроотрицательность по Полингу 1, 55.Свинец был известен жителям Месопотамии и Древнего Египта за 7 тысяч лет до нашей эры, свинец и его соединения использовались в Древней Греции и Древнем Риме. Из свинцовых руд на острове Родос три тысячи лет тому назад получали свинцовые белила и свинцовый сурик. Из металлического свинца были изготовлены трубы древнего римского водопровода.
Содержание в земной коре 1, 6·10-3% по массе. Самородный свинец встречается редко. Входит в состав 80 различных минералов. Важнейшие из них галенит PbS, церуссит PbCO3,англезит PbSO4и крокоит PbCrO4. Всегда содержится в рудах урана и тория.Основной источник получения свинца — сульфидные полиметаллические руды. На первом этапе руду обогащают. Полученный концентрат подвергают окислительному обжигу:
2PbS + 3O2 = 2PbO + 2SO2
При обжиге добавляют флюсы (CaCO3, Fe2O3, SiO2). Они образуют жидкую фазу, цементирующую шихту. Полученный агломерат содержит 35-45% Pb. Далее содержащиеся в агломерате свинец(II) и оксид меди восстанавливают коксом:
PbO + C = Pb + CO и PbO + CO = Pb + CO2
Черновой свинец получают взаимодействием исходной сульфидной руды с кислородом (автогенный способ). Процесс протекает в два этапа:
2PbS + 3O2 = 2PbO + 2SO2,
PbS + 2PbO = 3Pb + SO2
Для последующей очистки чернового свинца от примеси Cu, Sb, Sn, Al, Bi, Au, и Ag его очищают пирометаллургическим методом или электролизом.Свинец — металл синевато-серого цвета с кубической гранецентрированной решеткой, а = 0, 49389 нм. Плотность 11, 3415 кг/дм3, температура плавления 327, 50°C кипения 1715°C. Свинец мягок, легко прокатывается в тончайшие листы, свинцовую фольгу. Хорошо поглощает рентгеновские и бета-лучи. Химически свинец довольно инертен. Во влажном воздухе поверхность свинца тускнеет, покрываясь сначала оксидной пленкой, которая постепенно переходит в основной карбонат 2PbCO3·Pb(OH)2.
С кислородом свинец образует оксиды: PbO, PbO2, Pb3O4, Pb2O3, Pb12O17, Pb12O19, из которых первые три существуют в низкотемпературной α-форме и высокотемпературной β-форме. Если гидроксид свинца Pb(OH)2 кипятить в большом количестве щелочи, образуется красный α-PbO. При недостатке щелочи образуется желтый β-PbO (см. оксиды свинца). Если суспензию α-PbO длительное время кипятить, она переходит в β-PbO. Переход α-PbO в β-PbO при комнатной температуре протекает очень медленно. β-PbO получают термическим разложением PbCO3 и Pb(NO3)2:PbCO3 = PbO + CO2; 2Pb(NO3)2 = 2PbО + 4NO2 + О2
В природе встречаются обе формы: α-PbO — минерал глет, β-PbO — минерал массикот. Если мелкий порошок α-PbO прокалить при 500°C в токе воздуха, то образуется высокотемпературная красная модификация α-Pb3О4. Ниже температуры -90°C α-Pb3О4 переходит в β-форму этого оксида. Электрохимическим окислением солей свинца (II) можно получить α-форму диоксида свинца PbO2. Осторожным нагреванием α-PbO2 на воздухе до 200-570°C получают Pb12O19 (температура разложения 200°C), Pb12O17 (350°C), Pb3О4 (380°C) и PbО (570°C). Оксид PbО обладает амфотерными свойствами. Реагирует с кислотами:PbО + 2СН3СООН = Pb(СН3СОО)2 + Н2О
и с растворами щелочей:
PbО + КОН = К2PbО2 + Н2О
Плюмбат калия К2PbО2 образуется также при взаимодействии свинца с раствором щелочи:
Pb + 2КОН = К2PbО2 + Н2
У PbО2, преобладают кислотные свойства, он является сильным окислителем. Оксид Pb3О4 можно рассматривать как свинцовую соль ортосвинцовой кислоты Pb2[PbO4]. При комнатной температуре свинец не реагирует с серной и соляной кислотами, так как на его поверхности при этом образуются плохо растворимые сульфат свинца PbSO4 и хлорид свинца PbCl2. Но с органическими кислотами (уксусной и муравьиной), а также с разбавленной азотной свинец реагирует, образуя соли свинца(II):3Pb + 8HNO3 = 3Pb(NO3)2 + 2NO + 4H2O
При взаимодействии свинца с уксусной кислотой, с продувкой кислорода, образуется ацетат свинца Pb(CH3COO)2, «свинцовый сахар», имеющий сладкий вкус.
До 45% свинца идет на изготовление пластин кислотных аккумуляторов. 20% — на изготовление проводов, кабелей и покрытий к ним. Экраны из свинца служат для защиты от радиоактивного и рентгеновского излучения. Из свинца и его сплавов изготавливают контейнеры для хранения радиоактивных веществ. Сплавы свинца с Sb, Sn и Cu используют для изготовления типографских шрифтов, из сплавов свинца с Sb и As изготавливают сердечники пуль, шрапнель, дробь. 5-20% свинца идет на изготовление тетраэтилсвинца (ТЭС) Pb(C2H5)4, который добавляют к бензину для повышения октанового числа. Свинец используется в производстве пигментов, для строительства сейсмостойких фундаментов.Свинец и его соединения — токсичны. Попадая в организм, свинец накапливается в костях, вызывая их разрушение. ПДК в атмосферном воздухе соединений свинца 0, 003 мг/м3, в воде 0, 03 мг/л, почве 20, 0 мг/кг. Выброс свинца в Мировой океан 430-650 тысяч т/год.
- Зайцев В. Я., Маргулис Е. В. Металлургия свинца и цинка. М., 1985.
- Козин Л. Ф., Морачевский А. Г. Физикохимия и металлургия высокочистого свинца. М., 1991.
- Зайцев В. Я., Маргулис Е. В. Металлургия свинца и цинка. М., 1985.
- Козин Л. Ф., Морачевский А. Г. Физико-химия и металлургия высокочистого свинца. М., 1991.
- Павловская Н. А. Свинец, ртуть, никель: ранняя диагностика токсического действия на организм. — Липецк: ГУП ИГ Инфол, 2002.
- Давыдова С. Л. Ртуть, олово, свинец и их органические производные в окружающей среде. — Астрахань, 2001.
- Свинец в окружающей среде. — М.: Наука, 1987.
- Полянский Н. Г. Свинец. — М.: Наука, 1986.
Тетраоксид трисвинца — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 декабря 2019; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 декабря 2019; проверки требует 1 правка.Тетраокси́д трисвинца́ — неорганическое соединение свинца и кислорода с формулой Pb3O4, красный порошок, не растворяется в воде. Свинец входит в соединение в двух степенях окисления, II и IV, поэтому оно может рассматриваться как оксид свинца(II,IV), а также как свинцовая соль ортосвинцовой кислоты H4PbO4, ортоплюмбат(IV) свинца(IlI).
- 6PbO+O2 →500oC 2Pb3O4{\displaystyle {\mathsf {6PbO+O_{2}\ {\xrightarrow {500^{o}C}}\ 2Pb_{3}O_{4}}}}
- 2K2[Pb(OH)4]+K2[Pb(OH)6] → Pb3O4↓+6KOH+4h3O{\displaystyle {\mathsf {2K_{2}[Pb(OH)_{4}]+K_{2}[Pb(OH)_{6}]\ {\xrightarrow {}}\ Pb_{3}O_{4}\downarrow +6KOH+4H_{2}O}}}
Тетраоксид трисвинца (β-фаза, существующая при температурах выше −90°C) образует красные кристаллы тетрагональной сингонии, пространственная группа P 42/mbc, параметры ячейки a = 0,88129 нм, c = 0,65661 нм, Z = 4 [2][3].
При температуре −90°С происходит переход в низкотемпературную α-фазу ромбической сингонии, пространственная группа P bam, параметры ячейки a = 0,91152 нм, b = 0,84696 нм, c = 0,65646 нм, Z = 4 [3][4].
Плохо растворяется в воде. Растворяется в расплаве нитрита натрия, в растворе хлорной кислоты.
β-Фаза является полупроводником. Ширина запрещённой зоны 2,1 эВ, подвижность электронов 0,6—3,0 см2/(В·с)
- Разлагается при нагревании:
- 2Pb3O4 →550oC 6PbO+O2↑{\displaystyle {\mathsf {2Pb_{3}O_{4}\ {\xrightarrow {550^{o}C}}\ 6PbO+O_{2}\uparrow }}}
- Реагирует с азотной кислотой с образованием диоксида свинца и других соединений.
- Pb3O4+4HNO3→PbO2+2Pb(NO3)2+2h3O{\displaystyle {\mathsf {Pb_{3}O_{4}+4HNO_{3}\rightarrow PbO_{2}+2Pb(NO_{3})_{2}+2H_{2}O}}}
Встречается в природе как относительно редкий минерал сурик.
- Пигмент для антикоррозионных красок (свинцовый сурик).
- Замазка в свинцовых аккумуляторах.
Как и многие другие соединения свинца, Pb3O4 (ортоплюмбат свинца) очень токсичен при попадании в организм орально (или же при ингаляции). Передозировка ионов свинца в живых организмах очень опасна.
- ↑ Руководство по неорганическому синтезу: В 6-ти т. / Ред. Брауэр Г.. — М.: Мир, 1985. — Т. 3. — 392 с.
- ↑ Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- ↑ 1 2 Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-85270-092-4.
- ↑ Диаграммы состояния двойных металлических систем / Под ред. Н. П. Лякишева. — М.: Машиностроение, 2001. — Т. 3 Книга 1. — 972 с. — ISBN 5-217-02843-2.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- CRC Handbook of Chemistry and Physics. — 89th Edition. — Taylor and Francis Group, LLC, 2008-2009.
- Краткая химическая энциклопедия / Под. ред. Кнунянц И. Л.. — М: Советская Энциклопедия, 1965. — Т. 4. — 1182 с.
Свинец химический элемент — свойства и применение

Свинец — это один из редких самородных металлов, имеющий бело-серебристый цвет. Он мягкий, легкоплавкий, пластичный.
Этот металл был известен уже в древние времена. В данной статье мы поговорим об использовании, производстве, физических и химических свойствах плюмбума Pb — химического элемента таблицы Менделеева.
Что такое свинец
Это элемент в химической таблице под атомным номером 82, он же Pb (Plumbum).

В классическом виде он обычно имеет серебряный цвет. Удельный вес — 11,35 г/см3.
История открытия химического элемента Pb
На ближнем Востоке свинец стал известен ещё с 3 тысячелетия до нашей эры, где он участвовал в создании кирпичей, статуй и разных бытовых предметов. Его сопоставляли Сатурну.

Археологические раскопки, которые проводились на территории Древнего царства Египта, помогли найти свинцовые изделия. Подобные открытия сделаны и на территории бывшей Месопотамии и Армении.
Его использовали не только в качестве самостоятельного металла для изделия, но также для очищения серебра и золота. Затем металлу нашли новую задачу – им обшивали корпуса кораблей и применяли в медицинских целях.

В конце 17 века появилось хрустальное стекло за счет добавления в стекло свинца. После, из него стали изготавливать пули.
Характеристика свинца
Если вас интересует, какого цвета свинец, то ответ следующий — плюмбум имеет голубовато-серый оттенок. Он плотный и тяжелый. Достаточно несложно добывается.

Как и любой из существующих металлов, свинец отличается своими физическими и химическими особенностями, которые и отличают его от других металлов.
Физические свойства
Металл не отличает высокая твердость. Это довольно мягкий металл, легко режущийся лезвием. Плавится при невысокой температуре плавления (327 градусов).

Температура кристаллизации — 327 градусов, а температура кипения — 2022 К. Плюмбум подлежит достаточно быстрому окислению на открытом воздухе.
Полезно знать: неприятным критерием свинца является его токсичность: в хроническом течении он собирается во внутренних органах и костной ткани, чем вызывает нарушения в организме живых существ.
Теплопроводность в два раза меньше железа.
Молярная масса 207,2 а. е. м. ± 0,1 а. е. м.
Формула простых оксидов — оксид свинца (II) PbO и оксид свинца (IV) PbO2 и смешанный Pb3O4 (свинцовый сурик).
Химические свойства
Является металлом малоактивным, стоящим в электрохимическом ряду перед водородом, что делает его легко вытесняемым иными металлами из растворов его солей. Степень окисления +2.

Заметно растворим в лимонной, уксусной и винной кислотах. Бесцветные ядовитые жидкости — производные свинца. Его пары ядовиты.
Некоторые школьники и студенты спрашивают — свинец магнитится или нет? Нет, такие качества отсутствуют.
Помимо токсичности, хочется знать, свинец радиоактивен или нет? Искусственные изотопы металла радиоактивны.
Основные соединения свинца
Галогениды образуются, взаимодействуя с фтором, хлором, бромом, йодом, и астатом. Халькогениды — с кислородом, серой, селеном, теллуром, и полонием. Пниктиды — с азотом и фосфором.
Области применения
Элемент получил широкое применение:
- В электротехнической системе, благодаря своей сопротивляемости коррозии, применяется в целях защиты кабелей, сверхпроводников, применяются свинцовые аккумуляторы.
- В военной промышленности — делают пули и снаряды, взрывчатки и детонаторы.
- В медицине — является защитником от радиации (пример: обследование рентгеном).
- В производстве — свинец входит в состав цемента, используется для защитных барьеров керамики и стекла.

Люди, боящиеся отравления свинцом, спрашивают — где можно найти свинец? В домашних условиях его можно обнаружить в аккумуляторах, в кабелях.
Производство свинца
Около половины металла производится из руд. Годовая добыча составляет 5 млн. тонн. Переработка крайне выгодна в плане экономии.

Приемы получения свинца это:
- пирометаллургический;
- гидрометаллургический.
В пирометаллургическом способе имеющиеся компоненты переплавляются, а во втором — наблюдается разложение существующих концентратов.

Наибольшими объёмами добычи свинцовой руды могут быть отмечены такие страны, как:
- Китай;
- Мексика;
- Австралия;
- США;
- Перу.
Добыча свинца в России
Седьмое место по производству этого металла занимает Россия. Доля РФ в запасах этого метала чуть более 2% из-за его низкой концентрации в местных месторождениях. Причем свинец отправляется на экспорт.

Было высчитано, что на территории России находится около 70 месторождений свинца, производящих 93% процента этого металла в таких регионах, как: Красноярский край, Республика Бурятия, Читинская область, Алтайский край и Приморский край.
Можно это выявить в процентном соотношении:
- Сибирь – приблизительно 75%;
- Урал – около 15%;
- Дальний Восток – немногим меньше 10%.
Нахождение в природе
Обычно металл перемешан с каким-либо другим металлом, например, с оловом, а не встречается в чистом виде.

Галенит
Свинец – является стадией распада урана, поэтому может находиться в урановых рудах. Свинец получается из такого сырья, как галенит.
Заключение
Свинец — это металл, который уже известен людям многие тысячи лет. Такая наука, как химия, сейчас помогает разобраться в его свойствах, чтобы правильно и экономно употребить. Его месторождения располагаются во многих частях Земли.
На мировом рынке его цена достаточно стабильна. Благодаря уникальности своих физико-химических свойств, Pb применяется во многих сферах и отраслях, подлежит импорту и экспорту.
