Температура плавления — это… Что такое Температура плавления?
Температу́ра плавле́ния и отвердева́ния — температура, при которой твёрдое кристаллическое тело совершает переход в жидкое состояние и наоборот. При температуре плавления вещество может находиться как в жидком, так и в твёрдом состоянии. При подведении дополнительного тепла вещество перейдёт в жидкое состояние, а температура не будет меняться, пока всё вещество в рассматриваемой системе не расплавится. При отведении лишнего тепла (охлаждении) вещество будет переходить в твёрдое состояние (застывать) и, пока оно не застынет полностью, температура не изменится.
Температура плавления/отвердевания и температура кипения/конденсации считаются важными физическими свойствами вещества. Температура отвердевания совпадает с температурой плавления только для чистого вещества.
На этом свойстве основаны специальные калибраторы термометров для высоких температур. Так как температура застывания чистого вещества, например, олова, стабильна, достаточно расплавить и ждать, пока расплав не начнёт кристаллизоваться.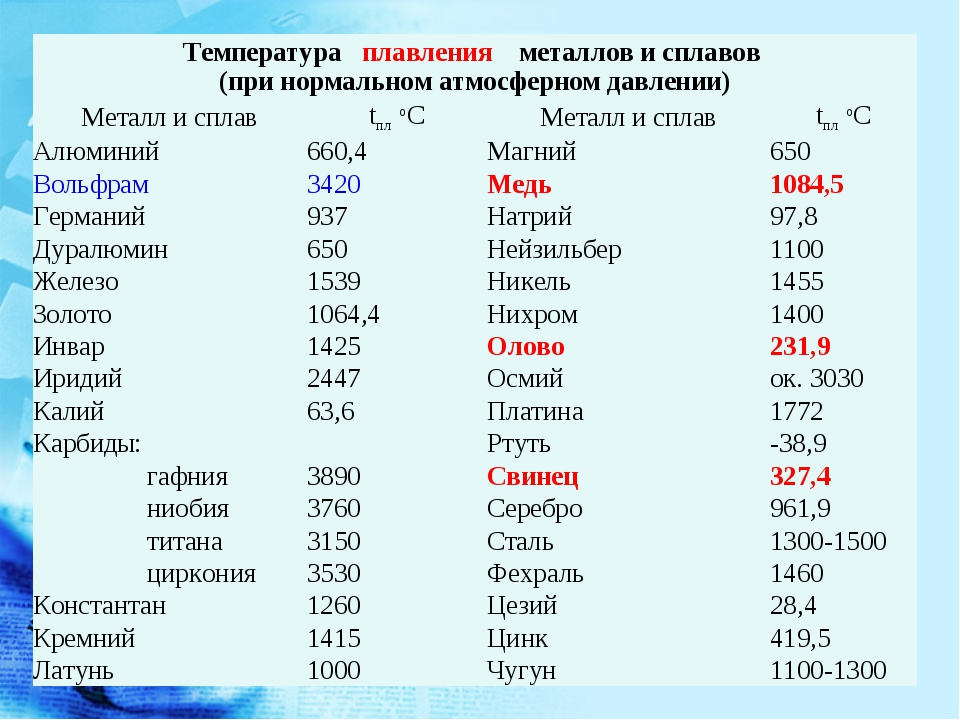
Смеси веществ не имеют температуры плавления/отвердевания вовсе, и совершают переход в некотором диапазоне температур (температура появления жидкой фазы называется точкой солидуса, температура полного плавления — точкой ликвидуса). Поскольку точно измерить температуру плавления такого рода веществ нельзя, применяют специальные методы (ГОСТ 20287 и ASTM D 97). Но некоторые смеси (эвтектического состава) обладают определенной температурой плавления, как чистые вещества.
Аморфные (некристаллические) вещества, как правило, не обладают чёткой температурой плавления, с ростом температуры снижается вязкость таких веществ, и чем ниже вязкость, тем более жидким становится материал.
К примеру, обычное оконное стекло — это переохлаждённая жидкость. За несколько столетий становится видно, что при комнатной температуре стекло на окне сползает вниз под действием гравитации и становится внизу толще. При температуре 500—600 этот же эффект можно наблюдать уже в течение нескольких суток.
При температуре 500—600 этот же эффект можно наблюдать уже в течение нескольких суток.
Поскольку при плавлении объём тела меняется незначительно, давление мало влияет на температуру плавления. Зависимость температуры фазового перехода (в том числе и плавления, и кипения) от давления для однокомпонентной системы даётся уравнением Клапейрона-Клаузиуса. Температуру плавления при нормальном атмосферном давлении (101 325 Па, или 760 мм ртутного столба) называют точкой плавления.
Температуры плавления некоторых важных веществ[1]:
| вещество | температура плавления (°C) |
|---|---|
| гелий (при 2,5 МПа) | −272,2 |
| водород | −259,2 |
| кислород | −218,8 |
| азот | −210,0 |
| метан | −182,5 |
| этиловый спирт | −114,5 |
| хлор | −101 |
| аммиак | −77,7 |
| ртуть | −38,87 |
| водяной лёд | 0 |
| бензол | +5,53 |
| цезий | +28,64 |
| сахароза | +185 |
| сахарин | +225 |
| олово | +231,93 |
| свинец | +327,5 |
| алюминий | +660,1 |
| серебро | +960,8 |
| золото | +1063 |
| кремний | +1415 |
| железо | +1539 |
| титан | +1668 |
| платина | +1772 |
| цирконий | +1852 |
| корунд | +2050 |
| рутений | +2334 |
| молибден | +2622 |
| карбид кремния | +2730 |
| осмий | +3054 |
| оксид тория | +3350 |
| вольфрам | +3410 |
| углерод | +3547 |
| карбид гафния | +3960 |
| карбид тантала-гафния | +4216 |
Примечания
- ↑ Дрица М.
 Е., Будберг П. Б., Бурханов Г. С., Дриц А. М., Пановко В. М. Свойства элементов. — Металлургия, 1985. — С. 672 с.
Е., Будберг П. Б., Бурханов Г. С., Дриц А. М., Пановко В. М. Свойства элементов. — Металлургия, 1985. — С. 672 с.
Температура плавления и кипения различных веществ
Вещество | Температуры плавления и кипения, °С |
Ag | пл. 962, кип. 2170 |
Ag2O | разл. > 160 |
Al | пл. 660, кип. 2500 |
Al2O3 | пл. 2053, кип. > 3000 |
As | возг. 615, пл. 817 |
AsH3 | пл.- 117, кип.- 62 |
At | пл. |
Au | пл. 1064, кип. 2947 |
B | пл. 2075, кип. 3700 |
B2O3 | пл. 450, кип. ок. 2000 |
Ba | пл. 727, кип. ок. 1860 |
BaO | пл. ок. 2020 |
Be | пл. 1287, кип. 2507 |
BeO | пл. 2580, кип. 4260 |
Bi | пл. 271, кип. 1564 |
Bi2O3 | пл. 825, кип. 1890 |
C (графит) | пл. 4800 [см. |
C (алмаз) | 1800 ® C (графит) |
CH4 | пл.- 182, кип.- 162 |
CO | пл.- 205, кип.- 192 |
CO2 | возг. — 78 |
Ca | пл. 842, кип. 1495 |
CaO | пл. ок. 2614, кип. 2850 |
Cd | пл. 321, кип. 767 |
CdO | возг. ок. 900, разл. |
Cl2 | пл.- 101, кип.- 34 |
ClO2 | пл.- 60, кип. +11 |
Cl2O | пл. |
| Cl2O6 | пл. 4, разл. > 20 |
Cl2O7 | пл.- 90, кип. +83 |
Сo | пл. 1494, кип. 2960 |
Cr | пл. 1890, кип. 2680 |
Cr2O3 | пл. 2340, кип. 3000 |
Cs | пл. 29, кип. 668 |
Cu | пл. 1085, кип. 2540 |
CuO | разл. 1026 |
Cu2O | пл. 1240, кип. 1800 |
F2 | пл. |
Fe | пл. 1539, кип. ок. 3200 |
FeO | пл. 1368 |
Fe2O3 | разл. 1390 |
Fr | пл. 21, кип. 660 |
Ga | пл. 30, кип. 2403 |
Ga2O3 | пл. ок. 1725 |
Ge | пл. 937, кип. ок. 2850 |
GeH4 | пл.- 166, кип.- 89 |
H2 | пл.- 259, кип.- 253 |
HBr | пл.- 87, кип.- 67 |
HCl | пл. |
HF | пл.- 84, кип. +20 |
HI | пл.- 51, кип.- 35 |
HN3 | пл.- 80, кип. +36 |
HNO3 | пл.- 42, кип. +83, разл. |
H2O | пл. 0, кип. 100 |
H2O2 | пл.- 0,4, разл. +150 |
H(PH2O2) | |
H2(PHO3) | пл. 74, разл. 200 |
H3PO4 | пл. 42, разл. 150 |
H4P2O7 | пл. |
H2S | пл.- 86, кип.- 60 |
H2SO4 | пл. 10, кип. 296, разл. |
H2Se | пл.- 66, кип.- 42 |
H2SeO3 | пл. и разл. 70 |
H2SeO4 | пл. 62 |
H2Te | пл.- 51, кип.- 2, разл. |
H2TeO3 | 40 ® TeO2 |
H6TeO6 | пл. 136, 220 ® TeO3 |
Hg | пл. |
HgO | разл. > 400 |
I2 | пл. 114, кип. 184 |
I2O5 | разл. 275-350 |
In | пл. 157, кип. 2024 |
In2O3 | пл. 1910, кип. ок. 3300 |
K | пл. 64, кип. 760 |
Li | пл. 180, кип. 1337 |
Mg | пл. 648, кип. 1095 |
MgO | пл. 2825, кип. 3600 |
Mn | пл. 1245, кип. |
MnO | пл. 1780 |
MnO2 | разл. > 535 |
Mn2O3 | 940 ® (MnIIMn2III)O4 |
Mn2O7 | пл. 6, разл. > 55 |
Mo | пл. 2620, кип. 4630 |
N2 | пл.- 210, кип.- 196 |
NH3 | пл.- 78, кип.- 33 |
N2H4 | пл. 2, кип. 114 |
NH2OH | пл. 32, разл. > 100 |
NO | пл. |
NO2 | < 21 ® N2O4 |
N2O | пл.- 91, кип.- 89 |
N2O3 | кип.- 40, разл. > +5 |
N2O4 | пл.- 11, кип. 21, разл. |
N2O5 | пл. 41, разл. |
Na | пл. 98, кип. 886 |
Ni | пл. 1455, кип. ок. 2900 |
NiO | пл. 1955 |
O2 | пл. |
O3 | пл.- 193, кип.- 112 |
OF2 | пл.- 224, кип.- 145 |
P (красный) | возг. 416 |
P4 (белый) | пл. 44, кип. 287 |
PH3 | пл.- 134, кип.- 87 |
P4O6 | пл. 24, кип. 175 |
P4O10 | возг. 359, пл. 422 |
Pb | пл. 328, кип. 1745 |
PbO | пл. 886, кип. 1535 |
PbO2 | разл. |
(Pb2IIPbIV)O4 | 550 ® PbO |
Ra | пл. 969, кип. 1536 |
Rb | пл. 39, кип. 696 |
Re | пл. 3190, кип. ок. 5900 |
S8 (монокл.) | пл. 119, кип. 445 |
S8 (ромб.) | 96 ® S8 (монокл.) |
SO2 | пл.- 75, кип.- 10 |
SO3 | пл. 17, кип. 45 |
Sb | пл. 631, кип. |
SbH3 | пл. — 94, кип. — 18 |
Sb2O3 | пл. 655, кип. 1456 |
Se | пл. 217, кип. 685 |
SeO2 | возг. 315, пл. 340 |
SeO3 | пл. 118, разл. > 185 |
Si | пл. 1415, кип. ок. 3250 |
SiH4 | пл.- 185, кип.- 112 |
SiO2 (кварц) | пл. 1550, кип. 2950 |
Sn | пл. 232, кип. 2620 |
SnO | пл. |
SnO2 | пл. 1630, кип. 2500 |
Sr | пл. 768, кип. 1390 |
Tc | пл. 2250, кип.ок. 4600 |
Te | пл. 450, кип. 990 |
TeO2 | пл. 733, кип. 1257 |
TeO3 | разл. > 400 |
Ti | пл. 1668, кип. 3260 |
TiO2 | пл. 1870, кип. ок. 3000 |
Tl | пл. 304, кип. 1457 |
Tl2O | пл. |
V | пл. 1920, кип. 3450 |
W | пл. 3387, кип. ок. 5680 |
Zn | пл. 420, кип. 906 |
ZnO | возг. 1725, разл. |
Сокращения:
возг. — возгонка; кип. — кипение; ок. — около;
пл. — плавление; разл. — разложение; ® — переход одного вещества в другое
Примечание: определение температуры плавления графита является очень важной, но очень сложной научной проблемой, которой занимаются во всем мире. В данном справочнике мы приводим значение, которое, исходя из обзора Савватимского Александра Ивановича, зав. лаб. электровзрывных процессов ОИВТ РАН, является в настоящее время наиболее обоснованным и полученным с помощью самых современных методов.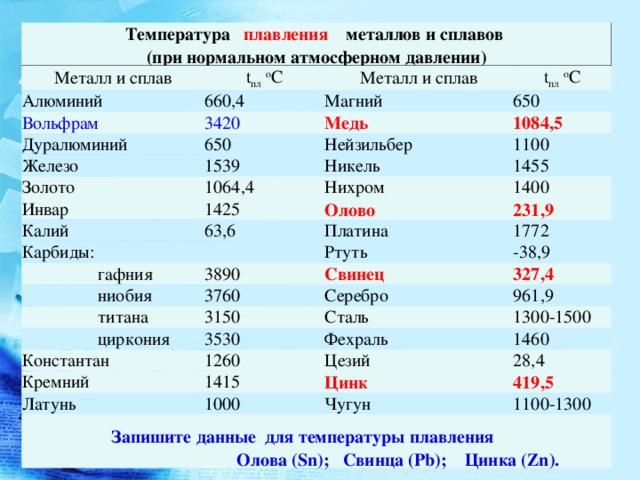 Обзор и описание методов см. в работах:
Обзор и описание методов см. в работах:
Савватимский А.И.»Плавление графита и жидкий углерод» УФН том 173 №12 стр.1371
A. I. Savvatimskiy. «Liquid carbon density and resistivity» J. Phys.: Condens. Matter 20 (2008) 114112
Korobenko V.N., Savvatimskiy A.I. «Graphite melting temperature» Electronic journal “INVESTIGATED IN RUSSIA” 2161
Примечание ко всем таблицам свойств: источниками справочных данных являются публикации в Интернете, поэтому они не могут считаться «официальными» и «абсолютно точными». Как правило, в Интернет справочниках не приводятся ссылки на научные работы, являющиеся основой опубликованных данных. Мы стараемся брать информацию из наиболее надежных научных сайтов. Однако если кого-то интересуют ссылки на эксперименты, советуем произвести самостоятельно углубленный поиск в Интернете. Будем признательны за любые комментарии к нашим справочным таблицам, а особенно за уточнения существующей информации или дополнение справочных данных.
АНАЛИЗ C ПОЗИЦИИ КЛАССИЧЕСКОЙ ТЕРМОДИНАМИКИ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ ПО ИЗМЕНЕНИЮ ТЕМПЕРАТУРЫ И ЭНТАЛЬПИИ ПЛАВЛЕНИЯ ЭВТЕКТИЧЕСКИХ СПЛАВОВ ПРИ ИЗМЕНЕНИИ ВЗАИМНОЙ ОРИЕНТИРОВКИ ФАЗ
ФИЗИКА МЕТАЛЛОВ И МЕТАЛЛОВЕДЕНИЕ
СТРУКТУРА, ФАЗОВЫЕ ПРЕВРАЩЕНИЯ И
ДИФФУЗИЯ
УДК 669. 017
017
АНАЛИЗ C ПОЗИЦИИ КЛАССИЧЕСКОЙ ТЕРМОДИНАМИКИ
ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ ПО ИЗМЕНЕНИЮ
ТЕМПЕРАТУРЫ И ЭНТАЛЬПИИ ПЛАВЛЕНИЯ
ЭВТЕКТИЧЕСКИХ СПЛАВОВ ПРИ ИЗМЕНЕНИИ ВЗАИМНОЙ
ОРИЕНТИРОВКИ ФАЗ
А.М. Савченко, Ю.В. Коновалов, А.В. Лаушкин
ОАО «Высокотехнологический научно-исследовательский институт неорганических материалов имени
академика А.А. Бочвара» (ОАО «ВНИИНМ»), 123060, г. Москва, ул. Рогова, 5А
e-mail: [email protected]
Поступила в редакцию
Проведены эксперименты по изменению температуры и энтальпии плавления эвтектических
сплавов. Было получено увеличение температуры плавления до 22 ºС, а также уменьшение
энтальпии плавления на 7-14 %. Впервые удалось перегреть сплав выше температуры плавления на
столь большую температуру без прохождения фазового превращения при низких скоростях нагрева
(80 град/мин). Предложено объяснение указанного эффекта с позиций классической
термодинамики.
Ключевые слова: плавление, затвердевание, фазы, термодинамика, температура плавления.
ВВЕДЕНИЕ
Известно, что сплавы, особенно эвтектические,
легко можно переохладить ниже температуры
плавления без прохождения фазового
превращения на десятки и сотни градусов, но пока
не удавалось перегреть их хотя бы на градус выше
температуры плавления даже при больших
скоростях нагрева [1].
В настоящее время более низкие температуры
плавления эвтектических сплавов (по сравнению с
температурами плавления компонентов), согласно
термодинамике сплавов, объясняются
увеличением энтропии смешения в жидком
состоянии, тем самым уменьшается свободная
энергия расплава и жидкое состояние
стабилизируется. Таким образом, в процессе
кристаллизации даже при низких температурах
сохраняется более высокоэнергетическое жидкое
состояние исходных компонентов эвтектики,
имеющих более высокую температуру плавления
[2-3].
Однако не совсем ясно, каким образом происходит
обратный процесс – плавление эвтектического
сплава при более низкой температуре. Известно,
что при эвтектической кристаллизации из
расплава с перемешанными атомами А и В и
преимущественно межатомными связями А-В
образуются кристаллы АА и ВВ со связями А-А и
В-В, соответственно. Каким образом, при
последующем нагреве из твердого состояния эти
фазы плавятся при более низкой эвтектической
температуре, если нет смешения атомов, то есть,
нет связей А-В и отсутствует энтропия смешения?
Каким образом смесь отдельных фаз уже знает,
что ей пора плавиться и плавление происходит
одновременно при одной температуре по всему
объему? На этот вопрос термодинамика сплавов
внятного объяснения не дает.
Сейчас считается, что эвтектический сплав
представляет собой механическую смесь фаз АА и
ВВ и плавление начинается по границам фаз, где
атомы А и B непосредственно соприкасаются.
Затем эта межграничная область должна
мгновенно распространиться по всему объему
сплава. Однако экспериментально установлено,
что эвтектики как мелкозернистые, так и
крупнозернистые, отличающиеся площадью
межфазной поверхности в сотни раз, плавятся без
перегрева по всему объему при одной и той же
более низкой эвтектической температуре, даже
при скорости нагрева 106 град/сек.
Подход к фазовой смеси как к механической смеси
фаз противоречит не только экспериментальным
данным, но и классической термодинамике,
которая всегда рассматривает любую
многокомпонентную систему, в том числе и
сплавы, как единую термодинамическую систему.
Это в свое время отмечал академик А.А. Бочвар в
своих работах по изучению особенностей
Волокна температура плавления — Справочник химика 21
Волокно Температура плавления, °С [c. 276]
276]Полимеризация протекает в присутствии катализаторов. В зависимости от условий полимеризации получают полипропилен, различающийся по структуре макромолекул, а следовательно, и па свойствам. По внешнему виду это каучукоподобная масса, более или менее твердая и упругая. Отличается от полиэтилена более высокой температурой плавления. Например, полипропилен с молекулярной массой выше 80 000 плавится прн 174—175 °С. Используют полипропилен для электроизоляции, для изготовления защитных пленок, труб, шлангов, шестерен, деталей приборов, а также высокопрочного и химически стойкого волокна. Последнее прим е-няют в производстве канатов, рыболовных сетей и др. Пленки нз полипропилена значительно прозрачнее и прочнее полиэтиленовых, пищевые продукты в упаковке из полипропилена можно подвергать стерилизации, варке и разогреванию. [c.501]
Из данных таблицы 104 следует, что наилучшим комплексом физико-механических свойств обладают полипропиленовые волокна.
 Полипропиленовые волокна имеют более высокую температуру плавления, чем полиэтиленовые, не уступая последним, волокнам по другим свойствам. [c.344]
Полипропиленовые волокна имеют более высокую температуру плавления, чем полиэтиленовые, не уступая последним, волокнам по другим свойствам. [c.344]Лавсан, известный также под названием терилен и дакрон, обладает высокой прочностью, и его температура плавления (255° С) наиболее высокая по сравнению с описанными выше полимерами, идущими на изготовление синтетического волокна. Получаемые из лавсана волокна обладают высокими качествами. Будучи весьма прочными, они являются основой для изготовления различных тканей и вязаных изделий. По внешнему виду эти изделия похожи на шерстяные, они не выгорают на солнце, не линяют и так же, как и другие полимеры, не портятся молью. [c.351]
Нитроновое волокно по своей прочности уступает нейлону, капрону и лавсану, но оно превосходит их по химической стойкости. Температура плавления нитрона также высокая и составляет 250° С. Нитроновое волокно очень похоже на шерсть и служит великолепным материалом для изготовления тепловых пушистых свитеров и кофточек, различных обивочных тканей, занавесей и т.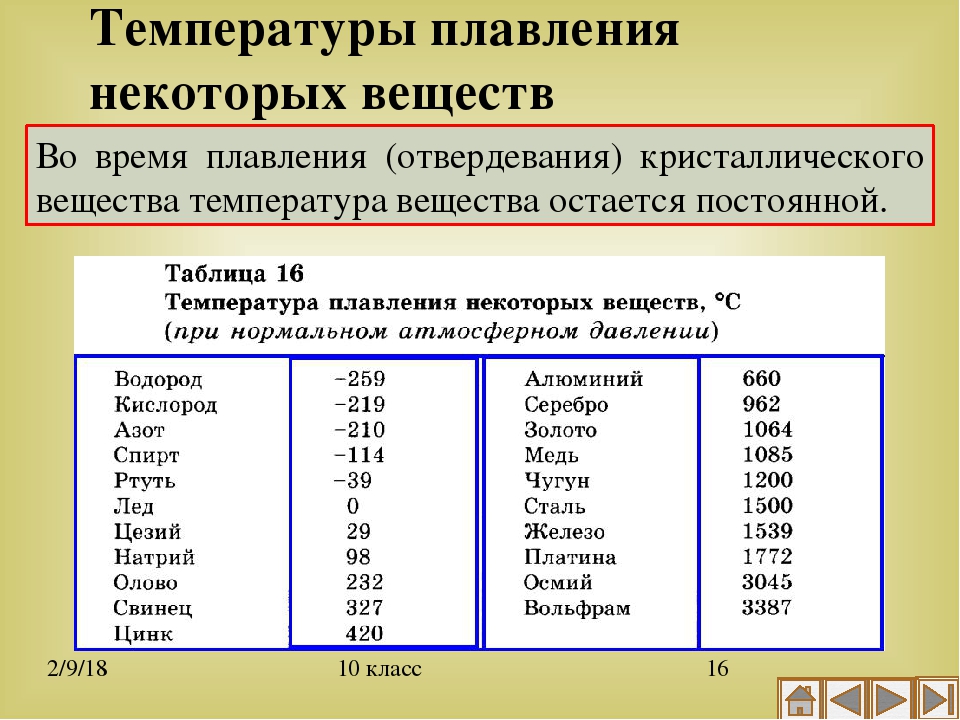 п. Ткани из нитронового волокна очень легко стираются. Как и лавсан, нитрон не выгорает на солнце и не портится молью. [c.351]
п. Ткани из нитронового волокна очень легко стираются. Как и лавсан, нитрон не выгорает на солнце и не портится молью. [c.351]
В других исследованиях по улавливанию летучей золы при температурах до 980 °С использовали волокно кремнекислого алюминия с температурой плавления 1750°С [422]. Эффективность улавливания достигала 90%. Более тонкие волокна при высокой плотности набивки обеспечивали повыщение эффективности улавливания. Скорость газов составила от 750 до 3500 мм/с, причем повышение скорости газов способствовало снижению эффективности улавливания, что позволило предположить унос уже уловленных частиц при высоких скоростях газов. [c.373]
Полипропилен имеет температуру плавления 170°, вместо. 125° для полиэтилена, и получаемые из него волокна более прочны. Это определяет его дальнейшее применение. [c.591]
На рис. 8.20 также видно расширение головки одиночного волокна. Это расширение соответствует сокращению ориентированного материала, вызванного нагревом волокна в процессе пластического деформирования. Если скорость деформирования возрастает до 50 с-, то тепло, выделяющееся при пластическом деформировании не затронутого трещиной поперечного сечения волокна, не может рассеиваться достаточно быстро. Происходит локальное превышение температуры плавления, и головка волокна расширяется почти до диаметра невытянутого материала (рис. 8.21). [c.264]
Если скорость деформирования возрастает до 50 с-, то тепло, выделяющееся при пластическом деформировании не затронутого трещиной поперечного сечения волокна, не может рассеиваться достаточно быстро. Происходит локальное превышение температуры плавления, и головка волокна расширяется почти до диаметра невытянутого материала (рис. 8.21). [c.264]
Волокна, используемые в качестве армирующих наполнителей, должны иметь следующие свойства высокую температуру плавления, малую плотность, высокую прочность во всем интервале рабочих температур, отсутствие токсичности при изготовлении и эксплуатации. [c.69]
Сушка твердых веществ может проводиться на воздухе при комнатной температуре и при нагревании в сушильном шкафу. При комнатной температуре твердые вещества чаще всего сушат на необожженных пористых фарфоровых и глиняных тарелках или на фильтровальной бумаге. В сушильном шкафу сушка твердых веществ производится на часовых стеклах, фарфоровых противнях, в фарфоровых чашках или бюксах. При этом температура в сушильном шкафу должна быть значительно ниже температуры плавления вещества, подвергаемого сушке. Категорически запрещается сушить в сушильном шкафу на бумаге, так как при этом продукт загрязняется бумажными волокнами, хлопьями подгоревшей и истлевшей бумаги и, кроме того, возможны значительные потери продукта, если в процессе сушки он пропитывает бумагу. Скорость сушки тем больше, чем выше температура. Многие органические соединения при высокой температуре разлагаются и подвергаются окислению кислородом воздуха. Такие соединения сушат при разрежении в лабораторных вакуум-сушильных шкафах. [c.41]
При этом температура в сушильном шкафу должна быть значительно ниже температуры плавления вещества, подвергаемого сушке. Категорически запрещается сушить в сушильном шкафу на бумаге, так как при этом продукт загрязняется бумажными волокнами, хлопьями подгоревшей и истлевшей бумаги и, кроме того, возможны значительные потери продукта, если в процессе сушки он пропитывает бумагу. Скорость сушки тем больше, чем выше температура. Многие органические соединения при высокой температуре разлагаются и подвергаются окислению кислородом воздуха. Такие соединения сушат при разрежении в лабораторных вакуум-сушильных шкафах. [c.41]
Практически вытяжкой повысить прочность волокон на разрыв сверх 9,81-10 Па (100 кгс/мм ) не представляется возможным. Поэтому предлагались различные обходные пути наиболее эффективен использованный Савицким и Левиным [см. 16, с. 484], при котором закристаллизованное волокно подвергается кратковременному очень сильному обогреву (при температуре, существенно превышающей температуру плавления) с одновременной сильной вытяжкой. Вытяжке в этом случае, по существу, подвергается уже расплав удается получить, по крайней мере частично, кристаллиты с развернутыми цепями типа игольчатых кристаллов или усов (ср. стр. 227) как показывают опыты и ориентировочные расчеты, 10% таких кристаллитов по отношению к общему объему кристаллической фазы оказывается достаточно для получения прочности, превосходящей 20-10 Па. [c.217]
Вытяжке в этом случае, по существу, подвергается уже расплав удается получить, по крайней мере частично, кристаллиты с развернутыми цепями типа игольчатых кристаллов или усов (ср. стр. 227) как показывают опыты и ориентировочные расчеты, 10% таких кристаллитов по отношению к общему объему кристаллической фазы оказывается достаточно для получения прочности, превосходящей 20-10 Па. [c.217]
Полимерные волокна отличаются тем, что исходные полимеры в них находятся в ориентированном состоянии в результате сильной вытяжки. Большинство волокнообразующих полимеров находится в кристаллическом состоянии и характеризуется сильными межмолекулярными взаимодействиями. Температуры плавления этих полимеров 100—300° С. Природные и синтетические волокна являются основой для создания текстильных материалов и изделий. [c.11]
Стереорегулярный полипропилен (стр. 454) — кристаллически полимер с очень высокими физико-механическими показателями и хорошими диэлектрическими свойствами. Температура плавления полипропилена значительно выше, чем у полиэтилена 164—170° С, а молекулярная масса 60000—200 000. Полипропилен кислото-и маслостоек даже при повышенных температурах. При обычной температуре он не растворяется ни в одном растворителе, при 80° С растворяется в ароматических углеводородах и хлорированных парафинах. Благодаря исключительным свойствам полипропилен — весьма перспективный полимер. Имеются указания о том, что синтетическое волокно из полипропилена по прочности превосходит все известные природные и синтетические волокна. [c.469]
Температура плавления полипропилена значительно выше, чем у полиэтилена 164—170° С, а молекулярная масса 60000—200 000. Полипропилен кислото-и маслостоек даже при повышенных температурах. При обычной температуре он не растворяется ни в одном растворителе, при 80° С растворяется в ароматических углеводородах и хлорированных парафинах. Благодаря исключительным свойствам полипропилен — весьма перспективный полимер. Имеются указания о том, что синтетическое волокно из полипропилена по прочности превосходит все известные природные и синтетические волокна. [c.469]
Полиолефиновые (полипропиленовые и полиэтиленовые) волокна. Такие волокна очень перспективны вследствие доступности и дешевизны исходного сырья. Обладают высокой химической стойкостью, влагостойкостью, устойчивостью к гнилостным бактериям. Недостатком их является низкая температура плавления. Ткани из полипропилена и полиэтилена могут применяться для изготовления изделий технического назначения (рыбе- [c. 420]
420]
Формование волокна из полиэфира аналогично формованию полиамидного волокна. Полиэтилентерефталат, применяемый для формования волокна, имеет молекулярный вес 15 ООО—-20 ООО и температуру плавления 250—265 С. [c.207]
Технологическая схема процесса производства минеральной ваты представлена на рнс. 11.2. Шихту, состоящую нз раздробленных горных пород осадочного или вулканического происхождения, например диабаза, а также известняк и кокс, сплавляют в вагранке при температуре приблизительно 1500 С. Повышение содержания диоксида кремния приводит к получению более длинного расплава. Однако этот эффект сопровождается повышением температур плавления и прядения, что накладывает ограничение иа содержание ЗЮг в расплаве [8]. Из вагранки волокнообразующую композицию подают на четыре прядильных валка (3000— 5000 об/мин) и с помощью центробежной сплы получают тонкие волокна диаметром 3—7 мкм. Затем в продувочной камере волокна орошают связующим (фенольная смола) и маслом (около 0,2%) [c. 169]
169]
Пластические массы и волокна эксплуатируются в твердом состоянии— кристаллическом или стеклообразном (аморфном). Выше температур плавления стеклования они размягчаются. Поэтому температуры их плавления или стеклования определяют верхний температурный предел эксплуатационных свойств, их теплостойкость. [c.151]
Области применения полиэтилена высокой плотности, как правило, совпадают с областями, потребляющими материал малой плотности, но измененные свойства первых, несомненно, улучшают качество вырабатываемых продуктов. Так, пленка из полиэтилена высокой плотности будет прочнее и прозрачнее, формованные детали могут иметь меньшее сечение, а трубы и волокна будут обладать большей прочностью. Повышение температуры плавления новых полиэтиленов позволяет проводить стерилизацию водяным паром. Эти факторы в сочетании с возможностью регулировать свойства продуктов будут способствовать росту применения полиэтиленов, вырабатываемых на поверхностных катализаторах.
 Следует отметить, что в ряде случаев применение полиэтиленов высокой плотности может лимитироваться растрескиванием при длительном приложении нагрузки. [c.306]
Следует отметить, что в ряде случаев применение полиэтиленов высокой плотности может лимитироваться растрескиванием при длительном приложении нагрузки. [c.306]Полиамид эфтрелон имеет ряд преимуществ перед полиамидом типа найлон 6,6. Он более стоек к действию кислорода воздуха нри новышенпых температурах, что облегчает формование пз него волокна. Температура плавления эфтрелона на 15—20″ С нпже, чем полиамида пайлон 6,6. [c.105]
Капроновое волокно является полиамидным волокном. Путем конденсации аминокарбоновой или дикарбоновой кислот получают суперполиамид, служащий сырьем для полиамидного волокна. Температура плавления суперполиамида около 246°, молекулярный вес колеблется от 7000 до 20 ООО. [c.50]
Кристаллические стереорегулярпые полимеры имеют более высокую температуру плавления и меньшую ползучесть, чем кристаллические атактические полимеры, а механическая прочность их много выше. На основе стереорегулярных полимеров получены высокопрочные теплостойкие волокна и пленки.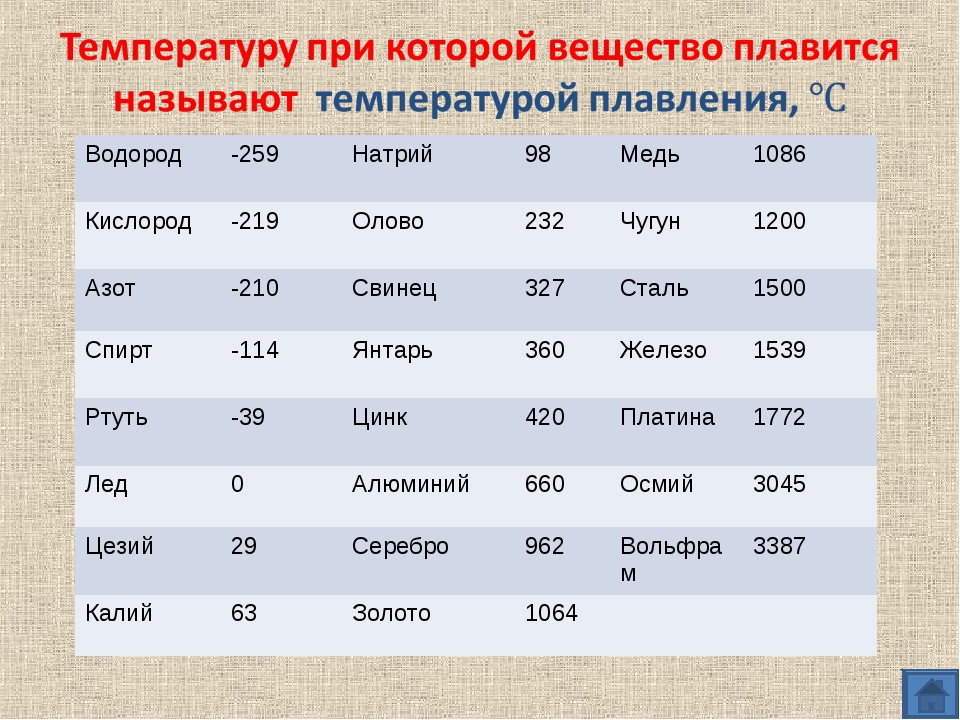 [c.59]
[c.59]
Гетерополитиоэфиры, в отличие от карбополитиоэфиров, имеют более низкую степень полимеризации, но отличаются высокой кристалличностью. Поэтому они образуют прочные пленки и волокна, аналогично кислородсодержащим полиэфирам. Прочность и эластичность этих изделий возрастает с повышением степени ориентации полимеров. Гетеротиополиэфиры отличаются от кислородсодержащих аналогов полиэфиров более высокой температурой плавления и большей стойкостью к гидролитическому воздействию. [c.464]
Если эти ответвления расположены редко, пе создается пятствий для кристаллизации отдельных сегментов макромолекул, и кристаллические образования имеют такие же размеры и форму, как и в гомополимерах полиамида. Поэтому температура плавления привитого сополимера мало отличается от температуры плавления соответствующего гомополиамида. Полиоксиэтиленовые боков1.1е ответвления выполняют функцию пластификатора, способствуя увеличению текучести расплава, повышению упругости полимера, придавая волокну большую гибкость и лучшую морозостойкость. Волокна и пленки из привитого полиамида сохраняют упругость и при —7Сг (полиамид 6 и полиамид 6-6 начинают утрачивать упругость при температуре н(i кoJ[ькo ниже О ). [c.543]
Волокна и пленки из привитого полиамида сохраняют упругость и при —7Сг (полиамид 6 и полиамид 6-6 начинают утрачивать упругость при температуре н(i кoJ[ькo ниже О ). [c.543]
Образование КВЦ сопряжено с выделением теплоты кристаллизации и система возвращается из состояния, соответствующего верхней линии для кристаллической фазы в состояние, соответствующее нижней впрочем, для гйбкоцепных полимеров фазовая линия КВЦ на О — Г-диаграмме может и не вполне совпадать с линией для складчатых кристаллов. Важно, однако, что такое волокно (или пленка) с КВЦ вполне устойчиво и обладает такими же прочностными показателями, что и жесткоцепные аналоги, уступая им только по температуре плавления, которая имеет обычные [c.219]
Полимеризация протекает в присутствии катализаторов (R3AI + Т1С1з) в растворителе. В зависимости от условий полимеризации получают полипропилен, различающийся по структуре макромолекул, а следовательно, и по свойствам. По внешнему виду это каучукоподобная масса, более или менее твердая и упругая. Отличс1ется от полиэтилена более высокой температурой плавления и более высокой прочностью на растяжение. Например, полипропилен с молекулярной массой выше 80000 размягчается при 174—175 °С. Его теплостойкость, стойкость к истиранию и поверхностная прочность значительно выше, чем у полиэтилена. Используют полипропилен для электроизоляции, для изготовления защитных пленок, труб, шлангов, шестерен, деталей приборов, а также высокопрочного и химически стойкого волокна. Последнее применяют в производстве канатов, рыболовных сетей и др. Пленки из полипропилена значительно прозрачнее и прочнее полиэтиленовых, пищевые продукты в упаковке из полипропилена можно подвергать стерилизации, варке и разогреванию. [c.605]
Отличс1ется от полиэтилена более высокой температурой плавления и более высокой прочностью на растяжение. Например, полипропилен с молекулярной массой выше 80000 размягчается при 174—175 °С. Его теплостойкость, стойкость к истиранию и поверхностная прочность значительно выше, чем у полиэтилена. Используют полипропилен для электроизоляции, для изготовления защитных пленок, труб, шлангов, шестерен, деталей приборов, а также высокопрочного и химически стойкого волокна. Последнее применяют в производстве канатов, рыболовных сетей и др. Пленки из полипропилена значительно прозрачнее и прочнее полиэтиленовых, пищевые продукты в упаковке из полипропилена можно подвергать стерилизации, варке и разогреванию. [c.605]
Фенол (карболовая кислота) СвНьОН. Бесцветное кристаллическое вещество со специфическим запахом. Температура плавления 42,3° С, температура кипения 181,1° С. Довольно трудно растворяется в воде. На воздухе краснеет (окисляется) и кристаллы его расплываются. Применяется в огромных количествах для производства синтетических феноло-формальдегидных смол, красителей, синтетического волокна (капрона и анида, стр. 298, 299, 479, 480) для синтеза лекарственных веществ. Сильный антисептик. Вызывает ожоги кожи ядовит. [c.366]
Применяется в огромных количествах для производства синтетических феноло-формальдегидных смол, красителей, синтетического волокна (капрона и анида, стр. 298, 299, 479, 480) для синтеза лекарственных веществ. Сильный антисептик. Вызывает ожоги кожи ядовит. [c.366]
Температура плавления политетраметилентерефталамида 436 °С, полиэтилентерефталамида 455°С. Полимеры растворимы в серной и трифторуксусной кислотах. Из растворов полиалкилентерефталамидов в трифторуксусной кислоте можно формовать волокно. Использование для синтеза Ы-замещенных диаминов приводит к получению полиамидов с более высокой температурой плавления. [c.386]
Поликонденсация в растворе (в пиридине) протекает с большей скоростью, чем поликондеисация соли в твердой фазе. Полифенилеп-сульфид плавится при температуре около 295 С, стоек до 400°С па воздухе. Его применение при высоких температурах лимитируется температурой плавления, поэтому из него сначала формуют изделия (пленки, волокна), а затем прогревают их в атмосфере азота при 400 В результате образования межмолекулярных сульфидных связей образуется неплавкий нерастворимый термостойкий полимер пространственного строения. Полифениленсульфиды обладают исключительно высокой адгезией к стеклу. [c.401]
Полифениленсульфиды обладают исключительно высокой адгезией к стеклу. [c.401]
Из полиэфиров ценными техническими свойствами обладает нолиэти-ленторефталат, высокие механические свойства которого обусловлены теми же причинами, что и полиамидов. Полиэфиры алифатических дикарбоновых кислот не обладают такими свойствами. В частности, низкая температура их плавления (ниже 100°) препятствует использованию их в качестве волокнообразующих материалов. В отличие от них полиэтилентерефталат обладает высокой кристалличностью, высокой температурой плавления (265°) и образует прочные волокна, что объясняется большей жесткостью цепи благодаря наличию симметричных п, и -фениленовых группировок и полярностью эфирных групп [75]. [c.671]
Твердость по Мосу Прочность при растяжении, Н/мм2 Модуль упругости, Н/мм Температура плавления, °С Плотность, кг/м pH (в воде без СО2) Диаметр волокна, мкм [c.151]
В колбу 4 помещают около 250 г очищенной серы, собирают установку, как показано на схеме (см. рис. 64), пропускают из баллона ток высушенного азота (высушивание плавленым хлоридом кальция, или едким кали и пятиокисью фосфора) для вытеснения воздуха из установки обычно пропускают 7—10-кратный объем азота ло отношению к объему установки. Затем п )опускают приблизительно такой же объем водорода для вытеснения азота и, не ярегсращая пропускание водорода, нагревают трубку 5 до 600 °С. Как только е трубке будет достигнута эта температура, нагревают колбу 4 с серой приблизительно до 250°С, для чего колбу помещают на песчаную баню. Одновременно конденсатор 16 охлаждают жидким воздухом. Скорость потока водорода должна составлять 8—9 л ч. Для того чтобы предотвратить оседание серы на холодной части отводной трубки колбы 4 и забивку трубки, последнюю изолируют асбестовым волокном. Температуру и-образных трубок 12, 13, 14. 15 поддерживают соответственно около —20 —40 —55 —55 °С для охлаждения трубок ишоль-зуют смесь твердой углекислоты и ацетона. [c.153]
рис. 64), пропускают из баллона ток высушенного азота (высушивание плавленым хлоридом кальция, или едким кали и пятиокисью фосфора) для вытеснения воздуха из установки обычно пропускают 7—10-кратный объем азота ло отношению к объему установки. Затем п )опускают приблизительно такой же объем водорода для вытеснения азота и, не ярегсращая пропускание водорода, нагревают трубку 5 до 600 °С. Как только е трубке будет достигнута эта температура, нагревают колбу 4 с серой приблизительно до 250°С, для чего колбу помещают на песчаную баню. Одновременно конденсатор 16 охлаждают жидким воздухом. Скорость потока водорода должна составлять 8—9 л ч. Для того чтобы предотвратить оседание серы на холодной части отводной трубки колбы 4 и забивку трубки, последнюю изолируют асбестовым волокном. Температуру и-образных трубок 12, 13, 14. 15 поддерживают соответственно около —20 —40 —55 —55 °С для охлаждения трубок ишоль-зуют смесь твердой углекислоты и ацетона. [c.153]
Иногда полимер имеет очень высокую вязкость расплава или он несколько нестабнлен при температуре плавления. В таком с 1учяе часто смешивают полимер с пластификатором — высококнпяш,ен жидкостью, совместимой с полимером. Пластифицированный полимер плавится при более низкой температуре. Таким образом в промышленности получают волокно из ря а вииило-в Х полимеров (например, волокно саран ). [c.35]
В таком с 1учяе часто смешивают полимер с пластификатором — высококнпяш,ен жидкостью, совместимой с полимером. Пластифицированный полимер плавится при более низкой температуре. Таким образом в промышленности получают волокно из ря а вииило-в Х полимеров (например, волокно саран ). [c.35]
Если полимер нельзя расплавлять или он нестабнлен выше температуры плавления, изделие получают нз его вязких растворов в летучем растворителе. Из таких растворов могут быть отлиты пленки или вытянуты волокна и нитн. Массивные предметы (аналогичные штампованным образцам) нельзя получить из раствора, так как удаление растворителя становится очень трудным, а сохранение формы — почти невозможным. [c.36]
Политиоэфиры были количественно окислены до соответствующих полисульфонов в смеси муравьиная кислота — перекись водорода [56, 57] Температуры плавления полисульфонов значительно выше, чем исходного полимера. Когда углеводородное звено состоит из шести метиленовых групп, полнсульфон плавится при температуре 212°, по сравнению с 75° для тиоэфира. Температура плавления линейно увеличивается с уменьшением длины углеводородного звена цепи. Был приготовлен ряд полисульфонов и прядением из расплава были получены волокна, способные к холодной вытяжке и обладающие достаточной прочностью. При этом углеводородная часть цепи имела не менее 4 атомов углерода. Поли-сульфон из пропилена н двуокиси серы (см. гл. 4), имеющий только 2 атома углерода в структурной единице, разлагается ниже температуры плавления. [c.160]
Температура плавления линейно увеличивается с уменьшением длины углеводородного звена цепи. Был приготовлен ряд полисульфонов и прядением из расплава были получены волокна, способные к холодной вытяжке и обладающие достаточной прочностью. При этом углеводородная часть цепи имела не менее 4 атомов углерода. Поли-сульфон из пропилена н двуокиси серы (см. гл. 4), имеющий только 2 атома углерода в структурной единице, разлагается ниже температуры плавления. [c.160]
Кристаллические стереорегулярные полимеры, вырабатываемые из пропилена и других а-олефинов и но своим механическим свойствам занимающие промежуточное положение между полиэтиленом и полистиролом, найдут широкое применение в производстве формованных изделий. Стереорегулярные полимеры, вследствие их прозрачности и высокого сопротивления разрыву особенно пригодны для производства пленки. Вследствие высокого сопротивления разрыву и сравнительно низкой стоимости они представляют также ценное сырье для производства текстильных волокон. Волокна из кристаллического полипропилена но сопротивлению разрыву равноценны полиэтилен-терефталатным, прочность которых достигает 7 г/денъе. Единственным серьезным недостатком полипропиленового волокна является более низкая температура плавления по сравнению с другими волокнами одинаковой прочности как найлон и дакрон. [c.306]
Волокна из кристаллического полипропилена но сопротивлению разрыву равноценны полиэтилен-терефталатным, прочность которых достигает 7 г/денъе. Единственным серьезным недостатком полипропиленового волокна является более низкая температура плавления по сравнению с другими волокнами одинаковой прочности как найлон и дакрон. [c.306]
Температура плавления полиэтилена и полипропилена.
Температура плавления полиэтилена и полипропилена.
- Создано: 02.02.2018 16:12
Полиэтилен и полипропилен, являющиеся наиболее важными и востребованными представителями термопластов,
то есть, полимеров, способных при нагревании обратимо переходить в высокоэластичное/вязкотекучее состояние, относятся к классу полиолефинов. Именно, это их свойство, позволяющее формировать из них различные изделия, отличающиеся долговечностью, маленьким весом и невысокой стоимостью, а также многократно перерабатывать, и обусловило особую популярность полиэтилена и полипропилена. Естественно, решая задачи эффективного и оптимального использования этих полиолефинов в промышленности, других отраслях жизнедеятельности, очень важно учитывать такой параметр, как температуру их плавления, начала размягчения, диапазон рабочих температур.
Естественно, решая задачи эффективного и оптимального использования этих полиолефинов в промышленности, других отраслях жизнедеятельности, очень важно учитывать такой параметр, как температуру их плавления, начала размягчения, диапазон рабочих температур.
Полиэтилен – полимер с широким температурным диапазоном эксплуатации
Полиэтилен, зависимо от его плотности, плавится при температурах в диапазоне 105-135 градусов, а этот материал высокого давления подвержен плавлению и вовсе лишь при 137 градусах. Этот его параметр, а также устойчивость при низких температурах, позволяют эффективно и безопасно использовать полиэтилен/изделия из него в диапазоне -60 – +100 градусов.
Более высокими техническими параметрами (температура плавления – 200 градусов, большие плотность и прочность, устойчивость к агрессивному воздействию химических веществ, наличие «памяти формы») от обычного отличается, так называемый, «сшитый» полиэтилен. Он производится полимеризацией этилена под высоким давлением.
Зависимо от условий эксплуатации полиэтилен различной плотности, его «сшитая» модификация могут быть использованы для изготовления:
- канализационных, дренажных и труб водо-, газоснабжения;
- различных пленок;
- пластиковой тары;
- корпусов для вездеходов, лодок, различных деталей, предметов быта и пр.;
- электроизоляционных материалов;
- бронежилетов;
- теплоизоляционных материалов и т.д.
Полипропилен активно доминирует в различных отраслях
Благодаря своим параметрам (температура плавления 164-175 градусов, 140 градусов – размягчения, менее плотный, но более твердый, чем полиэтилен), полипропилен, получа емый из пропилена путем его полимеризации, уверенно конкурирует с другими пластмассами, последовательно вытесняя их из различных отраслей промышленности. Этому способствуют также его большая стойкость к истиранию, неподверженность коррозионному растрескиванию, устойчивость к температурным перепадам, отличные теплоизоляционные характеристики.
Зависимо от химической структуры полипропилен может быть:
- изотактическим, отличающимся от других видов этого вещества большей степенью кристалличности, более высоким показателями прочности и твердости, теплостойкости, что позволяет его эффективно использовать при производстве труб, трубопроводной арматуры, изделий/деталей в электротехнике, автомобилестроении с повышенными требованиями к механическим свойствам материала;
- синдиотактическим, менее прочным, чем изотактическим, но вполне приемлемым при изготовлении медицинских изделий, това ров народного потребления, игрушек;
- атактическим, отличающимся химической нестабильностью, но пригодным для производства различного вида полимерных волокон и строительных добавок (модификаторов и пр.)
Ныне, являясь и так очень востребованными различными отраслями полимерами, полиэтилен и полипропилен, благодаря возможности совершенствования их параметров за счет изменения давления, температуры, подбора катализатора, расширяют сферу своего эффективного использования.
Ждем вас в офисе ООО НПП Симплекс в Самаре:
Заводское шоссе д. 111
8 800 775 90 06 (код 846)
8 (846) 379-59-65
Алмазы выдерживают пятикратное давление в ядре Земли. Как это использовать? | Технологии
Алмаз выдерживает давление, в пять раз превышающее давление в ядре Земли. Ученые считают, что эти данные могут помочь исследователям понять внутреннее устройство богатых углеродом планет. Но как?
Что такое алмаз?
Алмаз — минерал, кубическая аллотропная форма углерода. При нормальных условиях метастабилен, то есть может существовать неограниченно долго. В вакууме или в инертном газе при повышенных температурах постепенно переходит в графит. Самый твердый по шкале эталонных минералов твердости Мооса.
Алмаз является широкозонным полупроводником. У него очень низкий коэффициент трения по металлу на воздухе — всего 0,1, что связано с образованием на поверхности кристалла тонких пленок адсорбированного газа, играющих роль своеобразной смазки.
Одним из важных свойств алмазов является люминесценция. Под действием солнечного света и особенно катодных, ультрафиолетовых и рентгеновских лучей камни начинают люминесцировать — светиться различными цветами.
Под действием катодного и рентгеновского излучения светятся все разновидности алмазов, а под действием ультрафиолетового — только некоторые. Рентгенолюминесценция широко применяется на практике для извлечения камней из породы.
Алмаз в материнской породеАлмаз сходен со многими бесцветными минералами — кварцем, топазом, цирконом, которые часто используются в качестве его имитаций. Отличается твердостью — это самый твердый из природных материалов (по шкале Мооса — 10), оптическими свойствами, прозрачностью для рентгеновских лучей, светимостью в рентгеновских, катодных, ультрафиолетовых лучах.
Алмаз — редкий, но вместе с тем довольно широко распространенный минерал. Промышленные месторождения известны на всех континентах, кроме Антарктиды. Известно несколько видов месторождений камня.
Уже несколько тысяч лет назад алмазы в промышленных масштабах добывались из россыпных месторождений. Только к концу XIX века, когда впервые были открыты алмазоносные кимберлитовые трубки, стало ясно, что они не образуются в речных отложениях.
О происхождении и возрасте алмазов до сих пор нет точных научных данных. Ученые придерживаются разных гипотез — магматической, мантийной, метеоритной, флюидной, есть даже несколько экзотических теорий.
Большинство склоняется к магматической и мантийной теориям, к тому, что атомы углерода под большим давлением (как правило, 50 000 атмосфер) и на большой (примерно 200 км) глубине формируют кубическую кристаллическую решетку — собственно алмаз. Камни выносятся на поверхность вулканической магмой во время формирования так называемых трубок взрыва.
Схематическое изображение кристаллической решётки алмазаИсключительная твердость находит свое применение в промышленности: драгоценный камень используют для изготовления ножей, сверл, резцов и тому подобных изделий.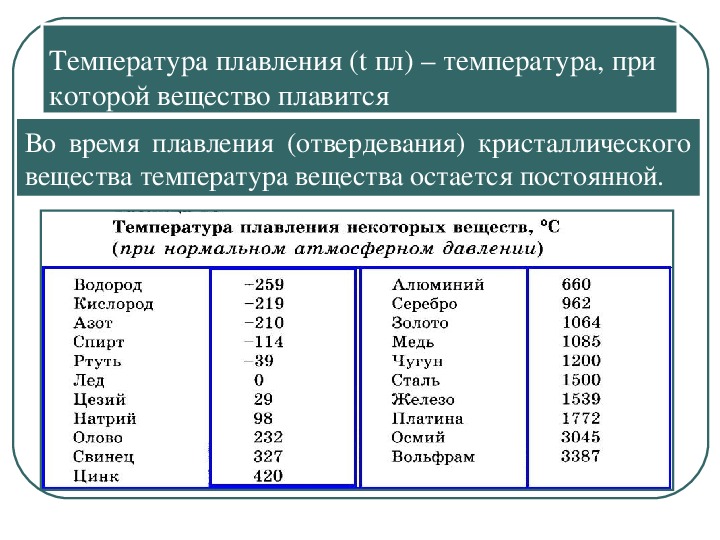
Потребность для промышленного применения вынуждает расширять производство искусственных алмазов. В последнее время проблема решается за счет кластерного и ионно-плазменного напыления алмазных пленок на режущие поверхности.
Алмазный порошок (как отход при обработке природного алмаза, так и полученный искусственно) используется как абразив для изготовления режущих и точильных дисков, кругов и т. д.
В чем особенность алмазов?
Главные отличительные черты алмаза — высочайшая среди минералов твердость (и в то же время хрупкость), наиболее высокая теплопроводность среди всех твердых тел 900–2300 Вт/(м·К), большой показатель преломления и дисперсия.
Алмаз является широкозонным полупроводником. У него очень низкий коэффициент трения по металлу на воздухе — всего 0,1, что связано с образованием на поверхности кристалла тонких пленок адсорбированного газа, играющих роль своеобразной смазки. Когда такие пленки не образуются, коэффициент трения возрастает и достигает 0,6–1,0.
Высокая твердость обуславливает исключительную износостойкость алмаза на истирание. Для него также характерны самый высокий (по сравнению с другими известными материалами) модуль упругости и самый низкий коэффициент сжатия.
Температура плавления составляет примерно 3 700–4 000 °C при давлении ~11 ГПа. На воздухе алмаз сгорает при 850–1 000 °C, а в струе чистого кислорода горит слабо-голубым пламенем при 720–800 °C, полностью превращаясь в углекислый газ.
Алмаз может выдержать пятикратное давление в ядре Земли
В конце января 2021 года ученые выяснили, что алмаз выдерживает давление, в пять раз превышающее давление в ядре Земли: структура материала сохраняется даже при сжатии до 2 трлн паскалей.
Исследование предполагает, что камень является метастабильным при высоких давлениях: он сохраняет свою структуру, несмотря на то, что в таких условиях ожидается доминирование других, более стабильных структур. Изучение причуд алмаза при экстремальном давлении может помочь выявить внутреннюю работу богатых углеродом экзопланет.
Богатые углеродом планеты могут состоять из алмазов
За пределами нашей Солнечной системы может существовать множество планет, состоящих из алмазов. Так считают ученые из Университета штата Аризона и Чикагского университета.
Они выдвинули предположение, что богатые углеродом экзопланеты могут состоять из алмазов и двуокиси кремния. На Земле диоксид кремния встречается в основном в виде песка и кварца.
Звезды и планеты образуются из газовых облаков и космической пыли. И именно состав газов определяет то, как выглядит та или иная звезда и планета.
Планета с низким отношением углерода к кислороду, как Земля, будет состоять из силикатов (солей и сложных эфиров) и оксидов и будет содержать мало алмазов. Доля алмазов на Земле составляет всего 0,001% от ее состава.
В отличие от нашего Солнца, у других звезд может быть более высокое соотношение углерода и кислорода. И в сочетании с водой в этой среде могут образовываться планеты, богатые углеродом.
Чтобы проверить эту гипотезу, исследовательская группа провела эксперимент, сымитировав химическое зарождение этих углеродистых экзопланет с помощью высоких температур и давления.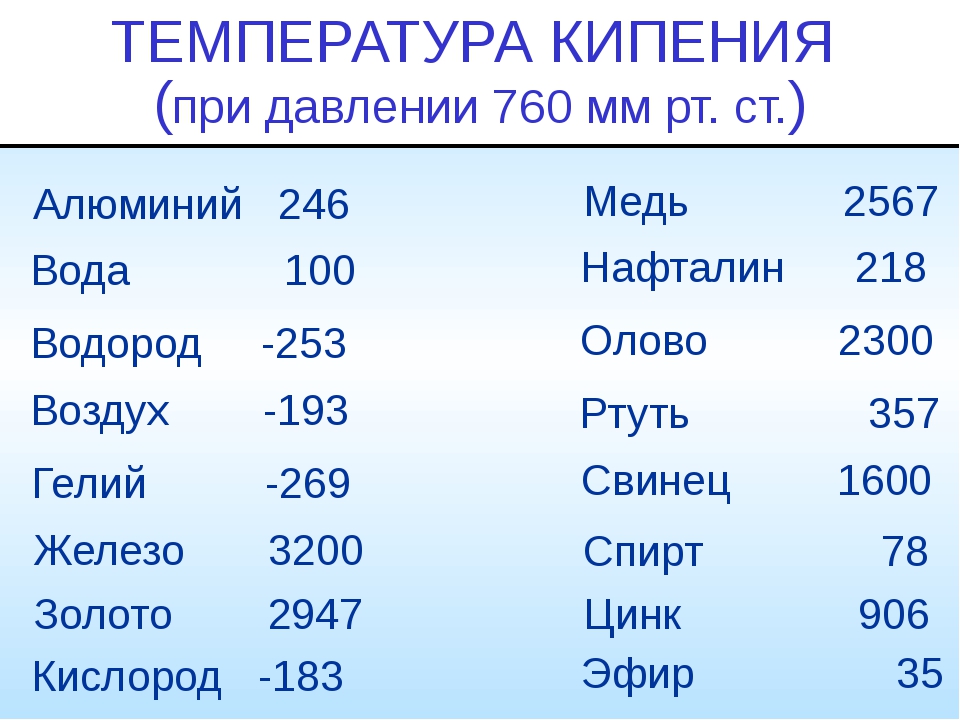 Результаты работы в лаборатории показали, что при высокой температуре и давлении карбид кремния вступал в реакцию с водой и превращался в алмазы и кремнезем.
Результаты работы в лаборатории показали, что при высокой температуре и давлении карбид кремния вступал в реакцию с водой и превращался в алмазы и кремнезем.
Что мы знаем об углеродных планетах?
Углеродная планета — теоретическая разновидность экзопланет земного типа, которая была предсказана американским астрофизиком Марком Кюхнером.
Условием для формирования планет такого типа является большое содержание углерода в протопланетном диске и малое содержание кислорода. По химическому свойству такая планета будет довольно сильно отличаться от планет земного типа, таких как Земля, Марс и Венера, которые построены преимущественно на базе кремния и кислорода, и углерода в их составе содержится не так много.
Планета, предположительно, будет иметь железосодержащее ядро, подобно другим планетам земной группы. Основу поверхности будут составлять преимущественно карбиды кремния и титана, а также чистый углерод.
Также возможно наличие областей, сплошь покрытых километрами алмазов. Атмосфера будет состоять из углеводородов и диоксида углерода. Жизнь на планете этого класса потенциально возможна, если на планете есть вода, однако формы жизни будут резко отличаться от земной в связи с малым количеством кислорода, которого будет недостаточно для формирования органических веществ земного типа.
Атмосфера будет состоять из углеводородов и диоксида углерода. Жизнь на планете этого класса потенциально возможна, если на планете есть вода, однако формы жизни будут резко отличаться от земной в связи с малым количеством кислорода, которого будет недостаточно для формирования органических веществ земного типа.
Пульсар PSR 1257+12, возможно, имеет углеродные планеты, которые сформировались после взрыва сверхновой из углеродного слоя бывшей звезды. Планеты этого типа могут находиться возле галактического ядра, где звезды содержат много углерода.
Диаметр и масса углеродных планет не отличаются от обычных планет, содержащих преимущественно воду и соединения кремния, поэтому разделить их пока в случае обнаружения не представляется возможным.
В 2014 году астрономы из Йельского университета под руководством Джона Мориарти (John Moriarty) разработали модель, позволяющую оценивать состав экзопланет, основанную на изменениях с годами в составе газообразных дисков, в которых формируются планеты.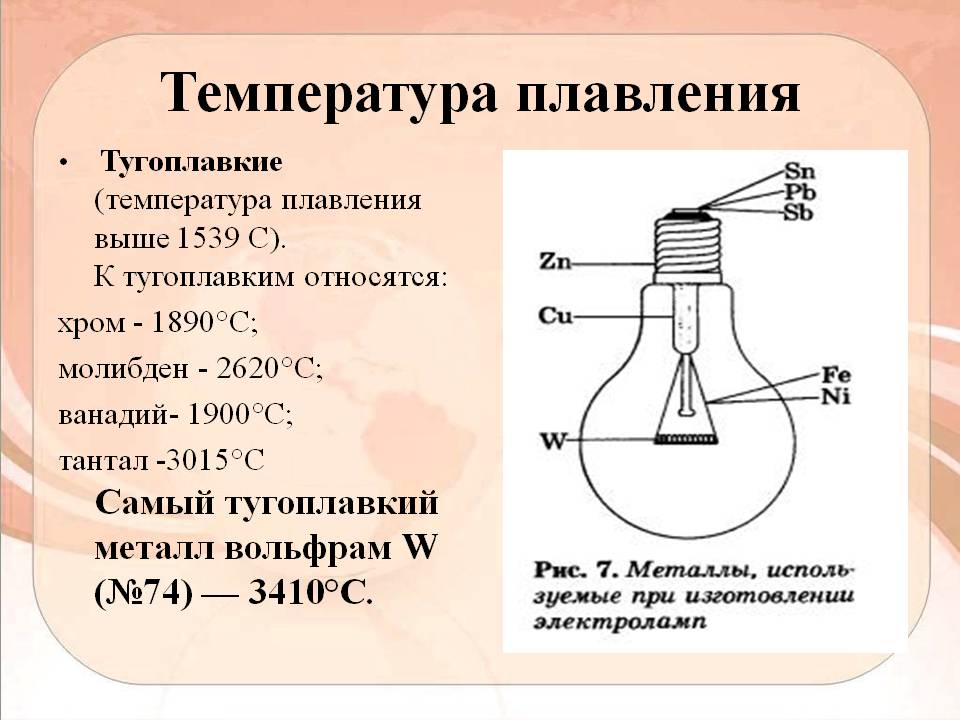
Согласно их выводам, в дисках, где соотношение углерода и кислорода превышает 0,8, богатые углеродом планеты могут образовываться дальше от центра диска. Кроме того, ученые считают, что углеродные планеты могут формироваться в дисках, где соотношение углерода и кислорода достаточно низкое (0,65), но в этом случае такие планеты образуются близко к своей звезде.
Соответственно, богатые углеродом планеты могут оказаться гораздо более распространенным явлением, чем считалось ранее.
Художественное изображение углеродной планеты. Цвет планеты тёмный и красноватый вследствие наличия углеводородов.Читать далее
Аборты и наука: что будет с детьми, которых родят
Радары обнаружили последний форт тлинкитов на Аляске. Его искали более 100 лет
Треть переболевших COVID-19 возвращаются в больницу. Каждый восьмой — умирает
Ученые выяснили, что происходит с графеном при плавлении
Несмотря на широкое применение графита в самых различных сферах, где имеют место сверхвысокие температуры, детали процесса его плавления до последнего времени оставались неясными.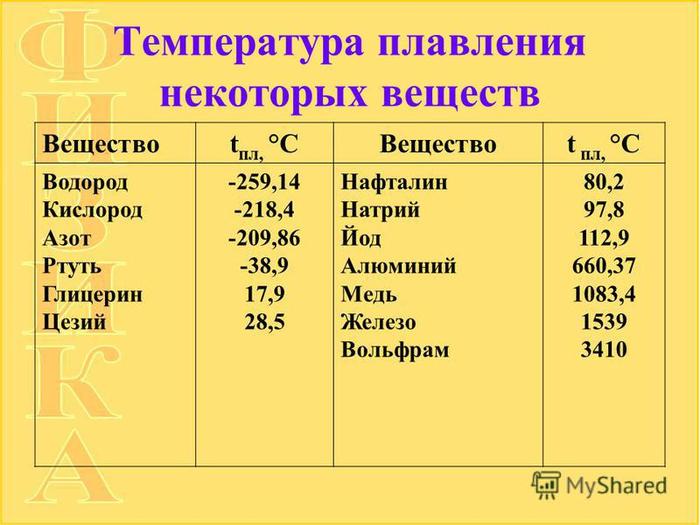 Практически неисследованным был и процесс плавления графена.
Практически неисследованным был и процесс плавления графена.
Ученые из Московского физико-технического института и Института физики высоких давлений им. Л.Ф. Верещагина РАН с помощью компьютерного моделирования построили кривые плавления этих важных для промышленности и инновационных технологий материалов.
Графит — минерал, активно используемый в различных видах производств, в том числе в металлургии и для тепловой защиты космических аппаратов, поэтому точные сведения о его поведении при сверхвысоких температурах очень важны. Плавление графита начали изучать еще в начале ХХ века. Около сотни экспериментальных работ в качестве температуры плавления называли цифры в диапазоне от 3000 до 7000 градусов Кельвина. Понятно, что при таком огромном разбросе результаты экспериментов не вызывали доверия. Самые разные значения температур плавления давали и компьютерные модели.
Идея авторов исследования, Юрия Фомина и Вадима Бражкина заключалась в том, чтобы сравнить результаты нескольких компьютерных моделей, построенных с помощью двух различных методов: классической молекулярной динамики и первопринципных расчетов, учитывающих квантово-механические эффекты.
Дело в том, что первый метод дает неточности из-за неучета квантовой механики, а второй — из-за того, что учитывает взаимодействие только небольшого количества атомов и на коротком промежутке времени. Сравнение результатов, полученных из разных теоретических моделей, позволило авторам найти объяснение экспериментальным результатам.
Еще в 1960-е годы было предсказано, что на кривой плавления графита должен существовать максимум — структурный переход, в котором происходит плавное изменение структуры. Потом существование этого структурного перехода то подтверждали, то опровергали. Результаты Фомина и Бражкина показывают, что структура жидкого углерода над кривой плавления графита претерпевает изменения, а значит, максимум существует.
Вторая часть работы была посвящена исследованию процесса плавления графена. Экспериментов по плавлению графена нет. Компьютерные модели дают температуру плавления от 4500 до 4900 градусов Кельвина.
Расчеты авторов исследования показывают, что температура плавления графена в атмосфере аргона близка к температуре плавления графита, но сам процесс имеет одну особенность.
«В нашей работе мы обратили внимание на то, что «плавление» графена происходит неким странным образом — посредством образования линейных цепочек. Мы показали, что на самом деле там наблюдается не плавление, а переход сразу в газообразное состояние — возгонка», — приводятся в пресс-релизе института слова Юрия Фомина, доцента кафедры общей физики МФТИ.
Результаты исследования позволяют лучше понять природу фазовых переходов в углеродных наноматериалах, которые рассматриваются как важные составные части многих разрабатываемых технологий — от электроники до медицины.
Работа выполнена при поддержке Российского научного фонда с использованием вычислительных ресурсов федерального центра коллективного пользования «Комплекс моделирования и обработки данных исследовательских установок мега-класса» в НИЦ «Курчатовский институт».
Точка плавления, точка замерзания, точка кипения
Точка плавления, точка замерзания, Температура кипения
Температура плавления и замерзания Путевая точка
Чистые кристаллические твердые вещества имеют характеристическую температуру плавления , температура, при которой твердое вещество плавится и превращается в жидкость. Переход между твердым телом а жидкость настолько острая для небольших образцов чистого вещества, что точки плавления могут быть измеренным до 0.1 o C. Температура плавления, например, твердого кислорода составляет -218,4 o С.
Жидкости имеют характерную температуру, при которой они превращаются в твердые тела, известную как
их точка замерзания . Теоретически температура плавления твердого тела должна быть
то же, что и точка замерзания жидкости. На практике небольшие различия между этими
количества можно наблюдать.
На практике небольшие различия между этими
количества можно наблюдать.
Трудно, если не невозможно, нагреть твердое тело выше его точки плавления, потому что тепло, которое входит в твердое тело при его температуре плавления, используется для преобразования твердого вещества в жидкость.Однако возможно охлаждение некоторых жидкостей до температур ниже их точки замерзания. точки, не образуя твердого тела. Когда это сделано, жидкость называется переохлажденной .
Пример переохлажденной жидкости может быть получен путем нагревания твердого ацетата натрия.
тригидрат (NaCH 3 CO 2 3 H 2 O). Когда это твердое вещество тает,
ацетат натрия растворяется в воде, которая была захвачена кристаллом, с образованием раствора.
Когда раствор остынет до комнатной температуры, он должен затвердеть.Но часто этого не происходит. Если
в жидкость добавляется небольшой кристалл тригидрата ацетата натрия, однако содержимое
колбы затвердевают в течение нескольких секунд.
Жидкость может стать переохлажденной, поскольку частицы твердого тела упакованы в регулярная структура, характерная для данного вещества. Что-нибудь из этого твердые вещества образуются очень легко; другие нет. Некоторым нужна частица пыли или затравочный кристалл, действовать как место, на котором кристалл может расти. Для образования кристаллов натрия тригидрат ацетата, ионы Na + , ионы CH 3 CO 2 — , и молекулы воды должны собраться вместе в правильной ориентации.Это сложно для эти частицы организуются, но затравочный кристалл может обеспечить основу для что правильное расположение ионов и молекул воды может расти.
Потому что трудно нагреть твердые тела до температур выше их точек плавления, и
поскольку чистые твердые вещества имеют тенденцию плавиться в очень небольшом диапазоне температур, точки плавления
часто используется для идентификации соединений. Мы можем различать три известных сахара
как глюкоза ( MP = 150 o C), фруктоза ( MP =
103-105 o C) и сахарозы ( MP = 185-186 o C), для
например, путем определения точки плавления небольшого образца.
Измерения температуры плавления твердого тела также могут предоставить информацию о чистота вещества. Чистые кристаллические твердые вещества плавятся в очень узком диапазоне температуры, тогда как смеси плавятся в широком диапазоне температур. Смеси также склонны к плавятся при температурах ниже точек плавления чистых твердых веществ.
Точка кипения
Когда жидкость нагревается, она в конечном итоге достигает температуры, при которой пар давление достаточно велико, чтобы внутри тела жидкости образовывались пузырьки.Эта температура называется точкой кипения . Как только жидкость закипит, температура остается постоянной, пока вся жидкость не превратится в газ.
Нормальная температура кипения воды составляет 100 o C. Но если вы попытаетесь приготовить яйцо в
кипящей воды во время кемпинга в Скалистых горах на высоте 10 000 футов, вы
обнаружит, что яйцо готовится дольше, потому что вода кипит только при температуре 90 o C
на этой высоте.
Теоретически нельзя нагревать жидкость до температуры выше нормальной. точка кипения. Однако до того, как микроволновые печи стали популярными, использовались скороварки. чтобы сократить время приготовления пищи. В обычной скороварке вода может оставаться жидкостью при температурах до 120 o C, а пища готовится в меньше одной трети обычного времени.
Чтобы объяснить, почему вода закипает при температуре 90 o C в горах и 120 o C в скороварку, даже если нормальная температура кипения воды составляет 100 o C, мы надо понимать, почему закипает жидкость.По определению жидкость закипает, когда пар давление газа, выходящего из жидкости, равно давлению, оказываемому на жидкость в окружающей среде, как показано на рисунке ниже.
| Жидкости кипят, когда давление их паров равно давлению, оказываемому на жидкость своим окружением. |
Нормальная температура кипения воды составляет 100 o C, потому что это температура
при котором давление пара воды составляет 760 мм рт. ст., или 1 атм.В нормальных условиях, когда
давление атмосферы примерно 760 мм рт. ст., вода закипает при температуре 100 o C.
На высоте 10 000 футов над уровнем моря атмосферное давление составляет всего 526 мм рт. На этих
над уровнем моря вода закипает, когда давление ее паров составляет 526 мм рт. ст., что происходит при температуре
из 90 o C.
ст., или 1 атм.В нормальных условиях, когда
давление атмосферы примерно 760 мм рт. ст., вода закипает при температуре 100 o C.
На высоте 10 000 футов над уровнем моря атмосферное давление составляет всего 526 мм рт. На этих
над уровнем моря вода закипает, когда давление ее паров составляет 526 мм рт. ст., что происходит при температуре
из 90 o C.
Скороварки оснащены клапаном, который позволяет выходить газу при повышении давления. внутри банка превышает некоторую фиксированную стоимость. Этот клапан часто устанавливается на 15 фунтов на квадратный дюйм, что означает что водяной пар внутри горшка должен достичь давления 2 атм, прежде чем он сможет уйти.Поскольку вода не достигает давления пара 2 атм, пока температура не достигнет 120 o C, он кипит в этом контейнере при 120 o C.
Жидкости часто закипают неравномерно, или поднимает . Они имеют тенденцию натыкаться, когда есть
нет ли царапин на стенках емкости, где могут образоваться пузыри. Натыкаясь
легко предотвратить, добавив в жидкость несколько кипящих стружек, которые обеспечивают грубую
поверхность, на которой могут образовываться пузырьки. При варке чипсов практически все
на поверхности этих стружек образуются пузыри, которые поднимаются сквозь раствор.
Натыкаясь
легко предотвратить, добавив в жидкость несколько кипящих стружек, которые обеспечивают грубую
поверхность, на которой могут образовываться пузырьки. При варке чипсов практически все
на поверхности этих стружек образуются пузыри, которые поднимаются сквозь раствор.
Почему вещи тают, когда нагреваются?
Жаркий летний день. Вы расслабляетесь у бассейна, и у вас внезапно возникает желание побаловать себя прохладным удовольствием. После быстрого похода в снек-бар вы расслабляетесь, чтобы понежиться в солнечных лучах с большим стаканом холодного чая и мороженым.
Вдруг друг через бассейн выкрикивает ваше имя. Вы подбегаете, чтобы поприветствовать друга, которого не видели с тех пор, как окончили школу.Через несколько минут вы вернетесь на свое место и обнаружите, что произошла катастрофа.
Когда вы уходили, у вас был высокий стакан холодного чая и плитка мороженого. По возвращении у вас есть стакан прохладного водянистого чая и лужа мороженого. Что тут происходит? Они, конечно, растаяли!
По возвращении у вас есть стакан прохладного водянистого чая и лужа мороженого. Что тут происходит? Они, конечно, растаяли!
Не рекомендуется оставлять кубики льда и мороженое под палящими лучами солнца, если вы хотите, чтобы они оставались прохладными. Почему нет? Всем известен ответ: они тают. Но задумывались ли вы когда-нибудь о том, почему вещи тают, когда нагреваются? Что именно здесь происходит?
Плавление — это естественный научный процесс, который ученые называют фазовым переходом.Это происходит на молекулярном уровне. Все, что вы видите вокруг себя, состоит из молекул. Молекулы — это крошечные частицы, которые обычно нельзя увидеть невооруженным глазом.
Молекулы состоят из основных строительных блоков, называемых элементами. Например, молекула воды (h3O) состоит из двух элементов: водорода и кислорода. В частности, каждая молекула воды содержит два атома водорода и один атом кислорода.
Когда вода находится в твердом состоянии, которое мы называем льдом, ее отдельные молекулы плотно упакованы вместе. На самом деле они упакованы так плотно, что едва могут двигаться. Это то, что придает льду твердую природу.
На самом деле они упакованы так плотно, что едва могут двигаться. Это то, что придает льду твердую природу.
Когда энергия добавляется в виде тепла, молекулы воды начинают возбуждаться и двигаться. По мере того, как добавляется все больше и больше тепла, молекулы движутся все быстрее и быстрее, вызывая расшатывание структуры молекул. По мере ослабления конструкции допускается большее движение. Вы видите это в форме превращения твердого льда в жидкую воду или в том, что мы называем таянием.
В жидкости молекулы воды все еще могут держаться вместе, но они легко перемещаются.Если добавить дополнительное тепло, они будут так возбуждены, что больше не смогут держаться вместе. Когда это происходит, жидкость превращается в газ, а молекулы распадаются и уходят в воздух.
Температура, при которой вещество превращается в жидкость, называется его точкой плавления. У каждого вещества есть точка плавления. Например, температура плавления воды в форме льда составляет 32 ° F. Когда температура поднимется выше отметки 32 ° F, лед начнет таять в жидкую воду.
Многие другие вещества имеют температуру плавления намного выше, чем у льда.Специфические свойства атомов в твердом теле и способ их связи друг с другом определяют температуру плавления вещества.
Например, химические элементы с наивысшими температурами плавления — это вольфрам и углерод, которые плавятся при температуре 6192 ° F и более 7000 ° F соответственно. Ученые также смогли смешать различные металлы вместе, чтобы сделать сплавы с чрезвычайно высокими температурами плавления. Один из таких сплавов, карбид тантала и гафния, плавится при поразительной температуре 7619 ° F!
Температура расплава — обзор
3.7.2 Температура расплава
Контроль температуры расплава полимера является критическим параметром для воспроизведения процесса экструзии. Термопары расплава должны быть правильно расположены и спроектированы так, чтобы давать точные показания. Измерение температуры расплава внутри цилиндра экструдера нецелесообразно, поскольку вращающийся шнек может срезать зонд расплава в потоке расплава. Измерения температуры расплава проводились в цилиндрах с инфракрасными датчиками, которые либо являются частью датчика давления, либо имеют размер, соответствующий отверстию датчика давления в цилиндре.Точность ИК-измерения зависит от регистрируемой температуры и коэффициента излучения источника. Утверждается, что ИК-излучение проникает в полимер и измеряет температуру расплава на определенной глубине. Эта глубина по отношению к имеющемуся материалу несколько сомнительна.
Измерения температуры расплава проводились в цилиндрах с инфракрасными датчиками, которые либо являются частью датчика давления, либо имеют размер, соответствующий отверстию датчика давления в цилиндре.Точность ИК-измерения зависит от регистрируемой температуры и коэффициента излучения источника. Утверждается, что ИК-излучение проникает в полимер и измеряет температуру расплава на определенной глубине. Эта глубина по отношению к имеющемуся материалу несколько сомнительна.
Для измерения температуры расплава в адаптере, переходной трубе или матрице требуется проникновение в поток расплава. Профиль скорости полимера имеет более высокий поток в середине потока расплава, чем вдоль стенок.В результате возникает профиль температуры плавления от стенки к центру. Теплопроводность термопары также может привести к ошибочным показаниям температуры расплава. Еще один фактор, который следует учитывать, — это рассеяние энергии на зонде из-за сдвигового нагрева полимера, когда полимер течет вокруг зонда.
Некоторые доступные конструкции датчиков температуры расплава показаны на рис. 3.36. Термопара A заподлицо не нарушает поток смолы в канале; однако он больше измеряет температуру металла, чем температуру плавления.При использовании зонда, устанавливаемого заподлицо, температура плавления аналогична температуре переходника, перехода или матрицы, даже если эти температуры значительно выше или ниже температуры цилиндра экструдера. Вероятно, что измеренная температура относится к металлу, а не к расплаву. Температура полимера у стены всегда соответствует температуре металла. Термопары B и C на рисунке 3.36 представляют собой прямые зонды, выступающие в поток расплава. Это простые и прочные термопары, обеспечивающие хорошую температуру плавления в канале.Погрешность измерения возникает из-за сдвигового нагрева, вызванного течением полимера вокруг термопары и проводимости вдоль зонда. Термопара D на рис. 3.36 может регулироваться в радиальном направлении в потоке расплава. Эта регулируемая термопара позволяет измерять однородность расплава по каналу расплава, где температура может варьироваться до 20 ° F (11 ° C).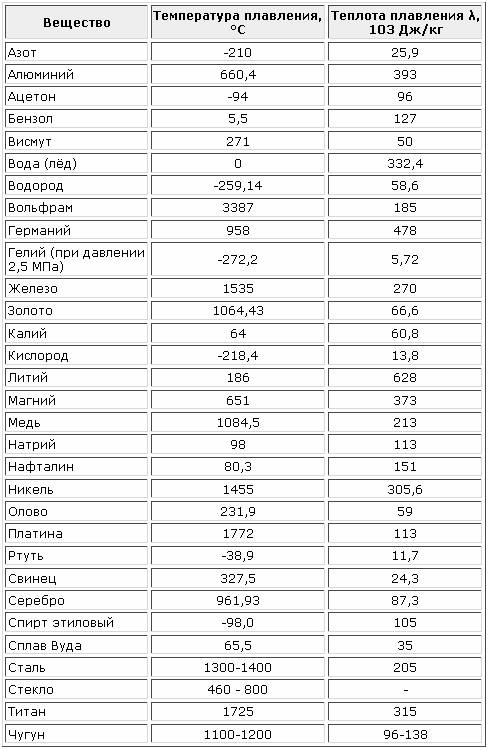 При сравнении данных обработки от цикла к запуску с радиально регулируемыми термопарами, положение зонда термопары в потоке расплава должно быть постоянным.Во время запуска процесса эти датчики следует убрать из потока расплава, чтобы предотвратить поломку. В настоящее время радиально регулируемые зонды более распространены в научно-исследовательских лабораториях и на линиях разработки технологических процессов, чем в производственной среде. Наконец, мосты для термопар, обозначенные буквой E на рис. 3.36, позволяют проводить одновременные измерения в разных точках потока расплава, обеспечивая мгновенный поперечный температурный профиль. На рис. 3.37 показана регулируемая термопара расплава К-типа, которая выступает в поток расплава.
При сравнении данных обработки от цикла к запуску с радиально регулируемыми термопарами, положение зонда термопары в потоке расплава должно быть постоянным.Во время запуска процесса эти датчики следует убрать из потока расплава, чтобы предотвратить поломку. В настоящее время радиально регулируемые зонды более распространены в научно-исследовательских лабораториях и на линиях разработки технологических процессов, чем в производственной среде. Наконец, мосты для термопар, обозначенные буквой E на рис. 3.36, позволяют проводить одновременные измерения в разных точках потока расплава, обеспечивая мгновенный поперечный температурный профиль. На рис. 3.37 показана регулируемая термопара расплава К-типа, которая выступает в поток расплава.
Рисунок 3.36. Расплавьте термопары.
Рисунок 3.37. Термопара расплава типа К.
Температура расплава имеет решающее значение для управления процессом и является параметром, который необходимо тщательно контролировать при настройке, оценке или устранении неисправностей процесса.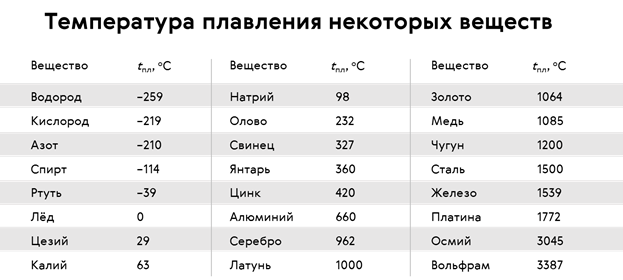 Вязкость и текучесть полимера напрямую связаны с температурой плавления. Более высокая температура плавления приводит к более низкой вязкости, что приводит к более низкому сопротивлению потоку в плавильной трубе и фильере, а также к более высокому потоку противодавления в экструдере.Эта комбинация обычно приводит к более низкому результату. Более низкая температура плавления приводит к более высокой вязкости и более высокому сопротивлению потоку в плавильной трубе и фильере, а также к более низкому потоку противодавления в экструдере. Эта комбинация обычно приводит к более высокой производительности.
Вязкость и текучесть полимера напрямую связаны с температурой плавления. Более высокая температура плавления приводит к более низкой вязкости, что приводит к более низкому сопротивлению потоку в плавильной трубе и фильере, а также к более высокому потоку противодавления в экструдере.Эта комбинация обычно приводит к более низкому результату. Более низкая температура плавления приводит к более высокой вязкости и более высокому сопротивлению потоку в плавильной трубе и фильере, а также к более низкому потоку противодавления в экструдере. Эта комбинация обычно приводит к более высокой производительности.
Термопары состоят из двух разнородных металлических проводов, соединенных на обоих концах, причем один конец имеет температуру, отличную от температуры другого конца. Возникает электродвижущая сила (термо-ЭДС), в результате чего в замкнутом контуре протекает электрический ток.При предсказуемом протекании тока и поддержании известной температуры одного соединения или перехода можно определить температуру другого. Длина или размер провода не влияют на измерение температуры. Любые две разные проволоки можно использовать для изготовления термопары; однако для получения воспроизводимых результатов каждый раз необходимо использовать одну и ту же комбинацию проводов. Термопара J-типа показана на рисунке 3.38. Технология термопар возможна благодаря законам однородных цепей и промежуточных металлов.Закон однородных цепей гласит, что на однородные проводники термопар не влияют промежуточные температуры или перепады температур вдоль проводов. Это позволяет использовать длинные выводы термопары во всех температурных средах. Закон промежуточных металлов гласит, что третий металл может быть введен в цепь, не влияя на измеряемую температуру, при условии, что соединения с третьим металлом имеют одинаковую температуру. Это позволяет прибору, производящему измерения, быть из металла, отличного от металла проводов термопары.
Длина или размер провода не влияют на измерение температуры. Любые две разные проволоки можно использовать для изготовления термопары; однако для получения воспроизводимых результатов каждый раз необходимо использовать одну и ту же комбинацию проводов. Термопара J-типа показана на рисунке 3.38. Технология термопар возможна благодаря законам однородных цепей и промежуточных металлов.Закон однородных цепей гласит, что на однородные проводники термопар не влияют промежуточные температуры или перепады температур вдоль проводов. Это позволяет использовать длинные выводы термопары во всех температурных средах. Закон промежуточных металлов гласит, что третий металл может быть введен в цепь, не влияя на измеряемую температуру, при условии, что соединения с третьим металлом имеют одинаковую температуру. Это позволяет прибору, производящему измерения, быть из металла, отличного от металла проводов термопары.
Рисунок 3.38. Стандартная термопара.
Со временем некоторые металлы были выбраны для производства стандартных термопар; некоторые из них показаны в таблице 3. 4. Самая распространенная термопара, используемая в экструдерах, — это термопара K. Переносные пирометры, используемые при переработке пластмасс, обычно представляют собой термопары типа J или K. Каждый тип термопары имеет уникальный цвет разъема и провод термопары. При заказе провода для термопары убедитесь, что приобретен правильный провод и размер, соответствующий типу термопары и ее применению.Важно, чтобы термопара соответствовала области применения.
4. Самая распространенная термопара, используемая в экструдерах, — это термопара K. Переносные пирометры, используемые при переработке пластмасс, обычно представляют собой термопары типа J или K. Каждый тип термопары имеет уникальный цвет разъема и провод термопары. При заказе провода для термопары убедитесь, что приобретен правильный провод и размер, соответствующий типу термопары и ее применению.Важно, чтобы термопара соответствовала области применения.
Таблица 3.4. Доступны некоторые типы термопар
| Тип / цвет | Проводники | 1/4 дюйма Зонд диаметра Провод 18 AWG | 3/16 дюйма Зонд диаметра Провод 24 AWG | 1/8 дюйма Зонд диаметра Провод 24 AWG | 1/16 дюйма Диаметр Зонд 30 AWF Провод |
|---|---|---|---|---|---|
| J / Черный | Fe / CuNi | 482 ° C (900 ° F) | 482 ° C (900 ° F) | 371 ° C (700 ° F) | 315 ° C (600 ° F) |
| K / Желтый | NiCr / NiAl | 982 ° C (1800 ° F) | 982 ° C (1800 ° F) | 871 ° C (1600 ° F) | 760 ° C (1400 ° F) |
| T / Синий | Cu / CuNi | 287 ° C (550 ° F) | 260 ° C (500 ° F) | 204 ° C ( 400 ° F) | 148 ° C (300 ° F) |
| E / Purple | NiCr / CuNi | 537 ° C (1000 ° F) | 537 ° C (1000 ° F) | 426 ° C (800 ° F) | 371 ° C (700 ° F) |
Три спая термопары, показанные на рисунке 3. 39, имеются в продаже. Заземленные переходы используются там, где присутствует электромагнитная индукция или радиочастотные помехи, которые могут мешать сигналу термопары или измерениям. У них более быстрое время отклика, чем у изолированных переходов. Второй переход — это изолированная незаземленная модель с более медленным временем отклика из-за изоляции. Обычно они используются в экструдерах и портативных пирометрах. Термопары с открытым спаем имеют самое быстрое время отклика; однако при открытых переходах они легко повреждаются и подвержены окислению и температурному ухудшению.
39, имеются в продаже. Заземленные переходы используются там, где присутствует электромагнитная индукция или радиочастотные помехи, которые могут мешать сигналу термопары или измерениям. У них более быстрое время отклика, чем у изолированных переходов. Второй переход — это изолированная незаземленная модель с более медленным временем отклика из-за изоляции. Обычно они используются в экструдерах и портативных пирометрах. Термопары с открытым спаем имеют самое быстрое время отклика; однако при открытых переходах они легко повреждаются и подвержены окислению и температурному ухудшению.
Рисунок 3.39. Переходы термопар.
Время срабатывания термопары зависит от диаметра оболочки и типа перехода. Меньшие диаметры дают более быстрый отклик. Преимуществами термопар являются их прочность, дешевизна, высокая чувствительность, широкий диапазон температур и чувствительность наконечника. Недостатки заключаются в том, что их выходы нелинейны, а точность зависит от чистоты используемых металлических проводов.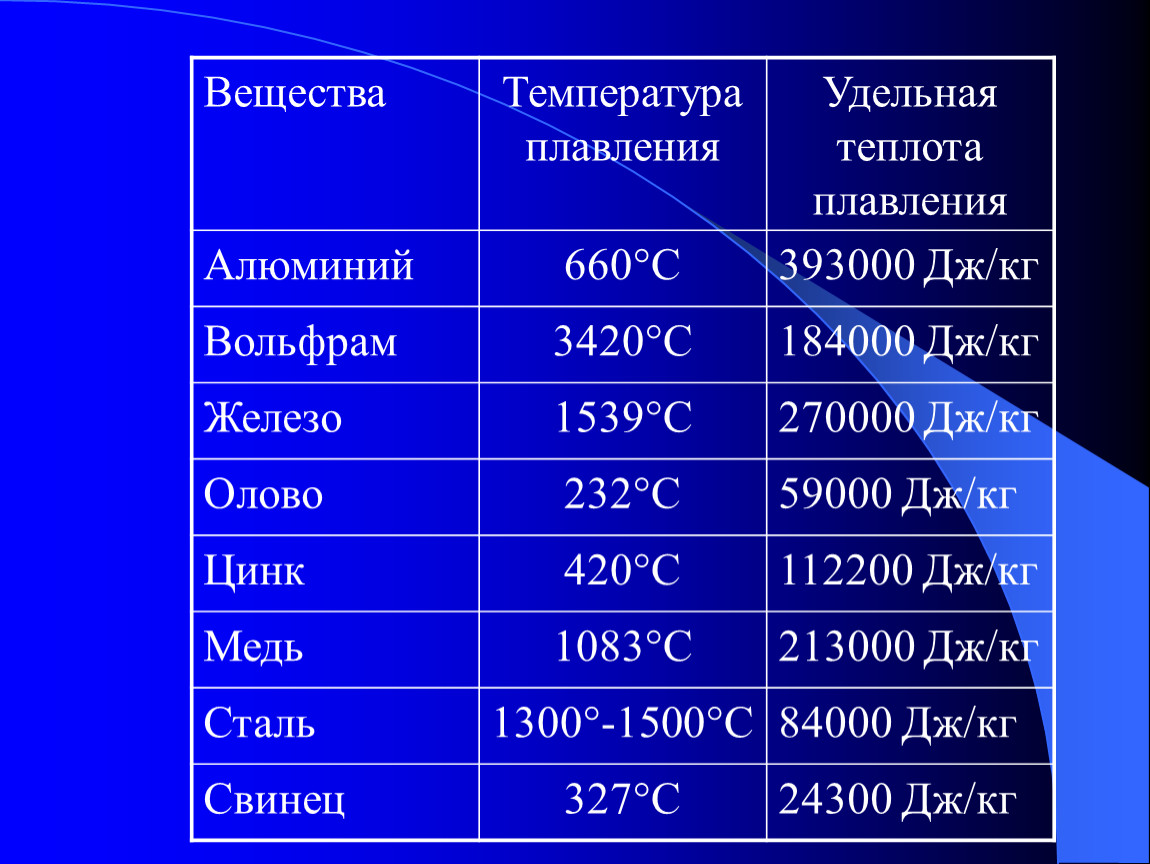 Нелинейность выходного сигнала не является серьезным ограничением, поскольку измерительное оборудование обычно учитывает это при преобразовании ЭДС в температуру.
Нелинейность выходного сигнала не является серьезным ограничением, поскольку измерительное оборудование обычно учитывает это при преобразовании ЭДС в температуру.
Еще одно устройство для измерения температуры — резистивный датчик температуры (RTD). Работа RTD основана на предсказуемом увеличении или уменьшении электрического сопротивления с температурой. Зонд, показанный на рис. 3.40, представляет собой сборку, содержащую элемент, оболочку, подводящие провода и соединения. Элемент, который измеряет температуру, представляет собой платиновую, медную или никелевую проволоку, намотанную на керамический или стеклянный сердечник. Чтобы указать RTD, необходимо знать длину элемента, диаметр элемента и сопротивление в омах при 0 ° C.Преимущества RTD по сравнению с термопарами заключаются в том, что отклик более линейный и стабильность сигнала лучше. Главный недостаток — меньшее время отклика по сравнению с термопарой.
Рисунок 3.40. Датчик RTD.
Температура плавления — обзор
5.
 6 Точка плавления
6 Точка плавленияТочка плавления твердого тела — это температура, при которой давление пара твердого тела и жидкости одинаково. В точке плавления твердая и жидкая фазы находятся в равновесии.Точка плавления (иногда называемая точкой разжижения) — это точка, в которой химическое вещество переходит из твердого состояния в жидкое, а в точке плавления твердая и жидкая фазы находятся в равновесии. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении, например 1 атм (14,7 фунта на квадратный дюйм). Когда фазовое изменение обращено (то есть из жидкой фазы в твердую), температура, при которой происходит это фазовое изменение, называется точкой замерзания или точкой кристаллизации.Из-за способности некоторых веществ к переохлаждению точка замерзания не всегда считается характерным свойством вещества.
Температуры плавления производных алканов следуют той же тенденции, что и температуры кипения производных алканов (таблица 9. 2, рис. 9.1) по той же причине, что указана выше. То есть (при прочих равных), чем больше молекула, тем выше температура плавления. Есть одно существенное различие между температурами кипения и плавления.Твердые тела имеют более жесткую и фиксированную структуру, чем жидкости. Эта жесткая конструкция требует энергии для разрушения. Таким образом, для разрушения более прочных, лучше собранных твердых конструкций потребуется больше энергии. Для производных алканов нечетные производные алканов имеют более низкую тенденцию к температуре плавления, чем производные алканов с четными номерами (рис. 9.1). Производные алканов с четными номерами хорошо упаковываются в твердой фазе, образуя хорошо организованную структуру, для разрушения которой требуется больше энергии. Алкановые производные с нечетным числом упаковываются хуже, и поэтому более рыхлая организованная твердая структура упаковки требует меньше энергии для разрушения.
2, рис. 9.1) по той же причине, что указана выше. То есть (при прочих равных), чем больше молекула, тем выше температура плавления. Есть одно существенное различие между температурами кипения и плавления.Твердые тела имеют более жесткую и фиксированную структуру, чем жидкости. Эта жесткая конструкция требует энергии для разрушения. Таким образом, для разрушения более прочных, лучше собранных твердых конструкций потребуется больше энергии. Для производных алканов нечетные производные алканов имеют более низкую тенденцию к температуре плавления, чем производные алканов с четными номерами (рис. 9.1). Производные алканов с четными номерами хорошо упаковываются в твердой фазе, образуя хорошо организованную структуру, для разрушения которой требуется больше энергии. Алкановые производные с нечетным числом упаковываются хуже, и поэтому более рыхлая организованная твердая структура упаковки требует меньше энергии для разрушения.
Точки плавления производных алканов с разветвленной цепью могут быть как выше, так и ниже, чем у соответствующих производных алканов с прямой цепью, опять же в зависимости от способности рассматриваемого алкана хорошо упаковываться в твердой фазе. Это особенно верно для производных изоалкана (2-метилизомеры), которые часто имеют температуры плавления выше, чем у линейных аналогов.
Это особенно верно для производных изоалкана (2-метилизомеры), которые часто имеют температуры плавления выше, чем у линейных аналогов.
Производные углеводородов, которые являются жидкими при температуре окружающей среды, и проблемы, которые могут возникнуть в результате затвердевания при нормальном использовании, встречаются нечасто.Тем не менее, точка плавления — это тест (ASTM D87 и ASTM D127), который широко используется поставщиками воска и потребителями воска; он особенно применяется к парафиновым или кристаллическим парафинам. Количественное предсказание точки плавления чистых производных углеводородов затруднено, но точка плавления имеет тенденцию качественно повышаться с увеличением молекулярной массы и симметрии молекулы.
Незамещенные и симметрично замещенные соединения (например, бензол, циклогексан, p, -ксилол и нафталин) плавятся при более высоких температурах по сравнению с парафиновыми соединениями аналогичной молекулярной массы: несимметричные изомеры обычно плавятся при более низких температурах, чем производные алифатических углеводородов такой же молекулярной массы.
Ненасыщенность влияет на температуру плавления в основном за счет изменения симметрии; таким образом, этан (-172 ° C, -278 ° F) и этилен (-169,5 ° C, -273 ° F) различаются незначительно, но точки плавления циклогексана (6,2 ° C, 21 ° F) и циклогексена (-104 ° C, −155 ° F) сильно контрастируют. Все типы сильно несимметричных производных углеводородов трудно кристаллизовать; асимметрично разветвленные алифатические углеводородные производные с таким низким октановым числом и большинство замещенных циклических углеводородных производных составляют большую часть смазывающих фракций сырой нефти, кристаллизуются медленно, если вообще кристаллизуются, а при охлаждении просто принимают форму стекловидных твердых частиц.
Хотя точки плавления сырой нефти и нефтепродуктов имеют ограниченную полезность, за исключением оценки чистоты или, возможно, состава парафинов, обратный процесс, отверждение , привлек внимание в химии сырой нефти. Фактически, отверждение сырой нефти и сырых нефтепродуктов подразделяется на четыре категории, а именно: точка замерзания , точка застывания , точка помутнения и точка застывания .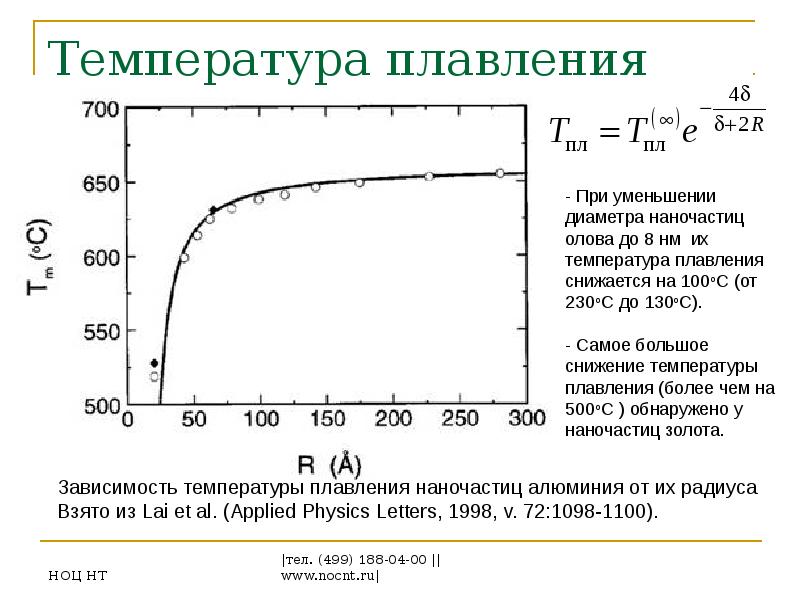
Сырая нефть становится более или менее пластичной при охлаждении до достаточно низких температур. Это происходит из-за застывания различных углеводородных производных, составляющих нефть. Температура помутнения сырой нефти или неочищенного нефтепродукта — это температура, при которой парафиновый воск или другие затвердевающие соединения, присутствующие в масле, выглядят как помутнение, когда масло охлаждается в строго заданных условиях (ASTM D2500; ASTM D6751). По мере продолжения охлаждения вся сырая нефть и сырые нефтепродукты становятся все более и более вязкими, и поток становится все медленнее и медленнее.Температура потери текучести сырой нефти или сырого нефтепродукта — это самая низкая температура, при которой нефть льется или течет в строго заданных условиях, когда она охлаждается без нарушений со стандартной скоростью (ASTM D97).
Характеристики отверждения углеводородного или углеводородного топлива зависят от его марки или вида. Для пластичной смазки интерес представляет собой температура, при которой возникает текучесть, обычно известная как точка каплепадения . Точка каплепадения консистентной смазки — это температура, при которой консистентная смазка переходит из твердого пластичного состояния в жидкое состояние и начинает течь в условиях испытания (ASTM D56 и ASTM D2650).Для другого типа твердого пластика, включая вазелин и микрокристаллический воск, интерес представляют как точка плавления , так и точка застывания .
Точка каплепадения консистентной смазки — это температура, при которой консистентная смазка переходит из твердого пластичного состояния в жидкое состояние и начинает течь в условиях испытания (ASTM D56 и ASTM D2650).Для другого типа твердого пластика, включая вазелин и микрокристаллический воск, интерес представляют как точка плавления , так и точка застывания .
Температура плавления парафина — это температура, при которой воск становится достаточно жидким, чтобы упасть с термометра; точка застывания . — это температура, при которой расплавленный вазелин перестает течь, когда ему дают остыть в строго заданных условиях (ASTM D93). Для парафина представляет интерес температура застывания .Для таких целей точка плавления — это температура, при которой расплавленный парафиновый воск начинает затвердевать, о чем свидетельствует минимальная скорость изменения температуры при охлаждении в заданных условиях. Для чистых или по существу чистых производных углеводородов температура затвердевания — это точка замерзания, температура, при которой углеводород переходит из жидкого в твердое состояние.
При какой температуре соль плавит лед?
8 января 2017 г.
При температуре 30 градусов (F) один фунт соли (хлорида натрия) растопит 46 фунтов льда.Но по мере того, как температура падает, эффективность соли снижается до такой степени, что при понижении температуры около 10 градусов (F) и ниже соль почти не работает. 1
Коммерчески доступные материалы для плавления льда включают соль (хлорид натрия), хлорид кальция и хлорид магния. Каждый ингредиент имеет свои преимущества и недостатки, но соль остается лучшим выбором для использования при температуре выше 15 градусов по Фаренгейту (-9,4 градуса по Цельсию). 2
Устойчивые крайне низкие температуры довольно редки для большей части страны, поэтому, если это произойдет с вами, и все, что у вас есть, — это соль, чтобы растопить лед, что вы можете сделать?
Хлорид магния и хлорид кальция остаются эффективными при таянии льда даже при очень низких температурах.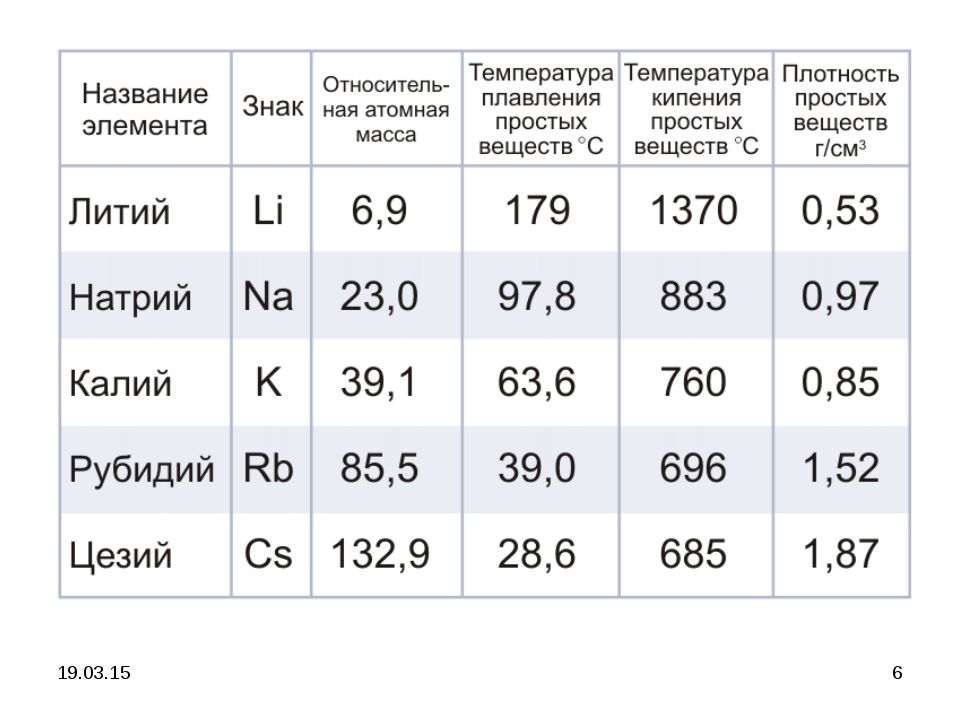 Например, хлорид магния работает при температурах от -20 до -25 градусов.
Например, хлорид магния работает при температурах от -20 до -25 градусов.
Линия продуктов Diamond Crystal® предлагает несколько продуктов для плавления льда, эффективных при очень низких температурах. Jiffy Melt® Ice Melt Salt содержит специально разработанную смесь хлорида магния и хлорида натрия для быстрого плавления при температурах -10 ° F / -23 ° C. Flash Melt® Ice and Snow Melt — это простой выбор при температурах до -25 ° F / -31 ° C, поскольку он содержит хлорид кальция, который выделяет тепло при растворении и разжижении льда.
1 http://www.southcoasttoday.com/article/20140112/news/401120325
2 http://www.saltinstitute.org/news-articles/homeowners-liable-for-snow-ice-control/
1 http: // травма.findlaw.com/torts-and-personal-injuries/conditions-leading-to-outdoor-slip-and-fall-accidents. html
html
При какой температуре соль тает лед?
На самом деле соль не тает лед! На самом деле происходит то, что когда соль посыпается на снег, температура замерзания воды (льда) понижается, поэтому снег или лед тают.
Это объясняет, почему, при прочих равных, температура замерзания льда составляет 0 градусов по Цельсию, а температура замерзания морской воды (которая является соленой из-за наличия в ней соли) ниже (-2.2 градуса Цельсия).
Так как соль попадает на наши дороги, точка замерзания льда (в снегу) понижается, поэтому снег или лед тают.
Песок: битва за соль против льда
При понижении температуры вам нужно больше соли на каждый фунт льда, который вы хотите растопить.
При температуре -1 o C один фунт соли растопит 46 фунтов льда.
А в «эвтектической» точке соль вообще не тает лед (-21 o C).
Что общего у мороженого с солью?
Интересный факт: для приготовления мороженого нужно добавить соль. Почему?
Почему?
Лед тает и нагревается еще до завершения приготовления мороженого.
Итак, в этот летний день стоит выделить минутку, чтобы поблагодарить за соль, которая защищает дороги и тропинки зимой и сохраняет прохладу летом.
Виды соли
Есть два основных типа соли, которые используются для таяния льда, каменная соль и морская соль.
Каменная соль имеет тенденцию быть коричневой, а морская соль — чисто белой.
Каменная соль является наиболее распространенной из этих двух и широко используется муниципалитетами Великобритании.
Морская соль, как правило, используется профессиональными операторами, поскольку она имеет более высокий процент NaCl, а также не оставляет никаких остатков, которые необходимо удалить.
Сколько соли используется в Великобритании?
Ежегодно на дороги Великобритании разбрасывается более двух миллионов тонн соли, что обходится более чем в 150 миллионов фунтов стерлингов в год.
Большая часть из них приходится на автомагистрали, магистральные дороги и основные дороги, и менее трети приходится на небольшие проселочные дороги.
Исследования показали, что на каждый 1 фунт стерлингов, израсходованный на содержание дорог в зимнее время, экономится около 8 фунтов стерлингов в экономике в целом.
И это даже без учета потенциальной человеческой трагедии.
Стоимость аварии или смертельного исхода на дорогах огромна, если в нее включены такие статьи, как расходы на здравоохранение и юридические услуги.
Исследование материалов с самой высокой температурой плавления: исследование лазерного плавления системы TaC-HfC
Термический анализ лазерного плавления
Эксперимент по лазерному нагреву состоял из четырех последовательных лазерных импульсов, начиная с импульса малой мощности, удерживаемого в течение длительного времени время (обычно 1000 мс), а затем мощность последующих импульсов увеличивалась, но сокращалось время удержания (обычно несколько сотен мс). Этап предварительного нагрева и последовательные импульсы были задуманы так, чтобы минимизировать термические напряжения и риск механического разрушения образцов.Выходные сигналы лазерного эксперимента для TaC 1.00 показаны на рис. 2а, термограмма (черная линия) показывает температуру образца во время цикла лазерного нагрева и охлаждения, профиль выходной мощности лазера представляет собой красный сигнал, а Сигнал RLS (синий) показывает, что плавление происходило в течение первых трех лазерных импульсов, в то время как для последнего импульса фазовых превращений не наблюдалось. Для того, чтобы вызвать выраженную остановку замерзания, было недостаточно кратковременного превышения температуры плавления.Пришлось расплавить достаточно большую массу, например, с помощью более длинного лазерного импульса. Колебания RLS и термическая остановка на участке охлаждения термограммы подтвердили, что образец расплавился и повторно затвердел. Трудно идентифицировать плавление образца, используя только термограмму, поскольку, как предсказано численным моделированием экспериментов 11 , из-за сильно неоднородного (поверхностного) характера лазерного нагрева во время быстрого нагрева не наблюдается тепловой остановки.
Этап предварительного нагрева и последовательные импульсы были задуманы так, чтобы минимизировать термические напряжения и риск механического разрушения образцов.Выходные сигналы лазерного эксперимента для TaC 1.00 показаны на рис. 2а, термограмма (черная линия) показывает температуру образца во время цикла лазерного нагрева и охлаждения, профиль выходной мощности лазера представляет собой красный сигнал, а Сигнал RLS (синий) показывает, что плавление происходило в течение первых трех лазерных импульсов, в то время как для последнего импульса фазовых превращений не наблюдалось. Для того, чтобы вызвать выраженную остановку замерзания, было недостаточно кратковременного превышения температуры плавления.Пришлось расплавить достаточно большую массу, например, с помощью более длинного лазерного импульса. Колебания RLS и термическая остановка на участке охлаждения термограммы подтвердили, что образец расплавился и повторно затвердел. Трудно идентифицировать плавление образца, используя только термограмму, поскольку, как предсказано численным моделированием экспериментов 11 , из-за сильно неоднородного (поверхностного) характера лазерного нагрева во время быстрого нагрева не наблюдается тепловой остановки.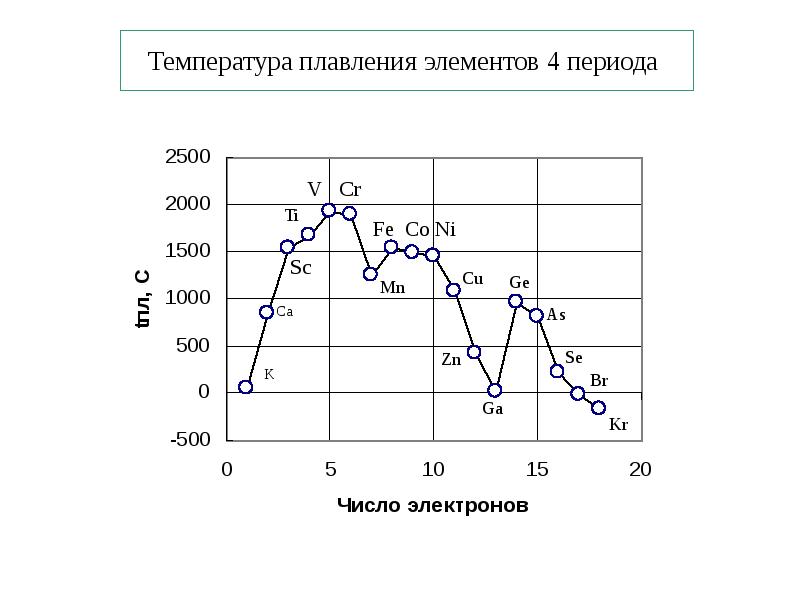 .В этих случаях может быть видно только слабое изменение скорости нагрева поверхности, вызванное продвижением фронта плавления в образец, который потребляет часть переданной лазерной энергии по мере плавления большего количества материала. Следовательно, начало плавления часто легче идентифицировать с помощью сигнала RLS. Шум, наблюдаемый после плавления при самых высоких температурах, в некоторых случаях может быть вызван кипением поверхности образца 10 . Поскольку никаких дальнейших перегибов во время нагревания или охлаждения не наблюдалось, можно сделать вывод, что в пределах текущих экспериментальных неопределенностей TaC плавится конгруэнтно и не показывает дальнейших фазовых изменений ниже температуры плавления.Дальнейший анализ явной термической остановки затвердевания показал, что T m TaC 1,00 был (4041 ± 77) K с использованием значения Deadmore NSE 0,52 с относительной погрешностью 10%. Здесь и в остальной части этой работы диапазоны неопределенности вычисляются с использованием закона распространения ошибок [11], считая независимыми неопределенности, связанные с NSE, разбросом данных и калибровкой пирометра.
.В этих случаях может быть видно только слабое изменение скорости нагрева поверхности, вызванное продвижением фронта плавления в образец, который потребляет часть переданной лазерной энергии по мере плавления большего количества материала. Следовательно, начало плавления часто легче идентифицировать с помощью сигнала RLS. Шум, наблюдаемый после плавления при самых высоких температурах, в некоторых случаях может быть вызван кипением поверхности образца 10 . Поскольку никаких дальнейших перегибов во время нагревания или охлаждения не наблюдалось, можно сделать вывод, что в пределах текущих экспериментальных неопределенностей TaC плавится конгруэнтно и не показывает дальнейших фазовых изменений ниже температуры плавления.Дальнейший анализ явной термической остановки затвердевания показал, что T m TaC 1,00 был (4041 ± 77) K с использованием значения Deadmore NSE 0,52 с относительной погрешностью 10%. Здесь и в остальной части этой работы диапазоны неопределенности вычисляются с использованием закона распространения ошибок [11], считая независимыми неопределенности, связанные с NSE, разбросом данных и калибровкой пирометра. Во время плавления визуально наблюдался значительный объем пара, что связано с нарушением формы термограммы при самых высоких температурах 14 .Однако испарение не было проблемой для наблюдаемых температур плавления / замерзания, поскольку они показали удовлетворительную воспроизводимость с 12 лазерными выстрелами, выполненными на каждом образце с разным пиковым импульсом и длительностью. Геометрия эксперимента была задумана таким образом, чтобы паровой шлейф, развивающийся параллельно поверхности к верхней и более холодной частям диска, не мешал оптическому измерению температуры, выполняемому в самой горячей зоне и перпендикулярно ей.Были выполнены последовательности из четырех последовательных импульсов. Между импульсами образец никогда не охлаждали до температуры ниже 1500 К. Это помогло снизить термические напряжения и сохранить механическую целостность материала на протяжении испытаний. В текущих испытаниях длительность последовательных лазерных импульсов варьировалась до десяти раз, а их мощность — до двух раз.
Во время плавления визуально наблюдался значительный объем пара, что связано с нарушением формы термограммы при самых высоких температурах 14 .Однако испарение не было проблемой для наблюдаемых температур плавления / замерзания, поскольку они показали удовлетворительную воспроизводимость с 12 лазерными выстрелами, выполненными на каждом образце с разным пиковым импульсом и длительностью. Геометрия эксперимента была задумана таким образом, чтобы паровой шлейф, развивающийся параллельно поверхности к верхней и более холодной частям диска, не мешал оптическому измерению температуры, выполняемому в самой горячей зоне и перпендикулярно ей.Были выполнены последовательности из четырех последовательных импульсов. Между импульсами образец никогда не охлаждали до температуры ниже 1500 К. Это помогло снизить термические напряжения и сохранить механическую целостность материала на протяжении испытаний. В текущих испытаниях длительность последовательных лазерных импульсов варьировалась до десяти раз, а их мощность — до двух раз.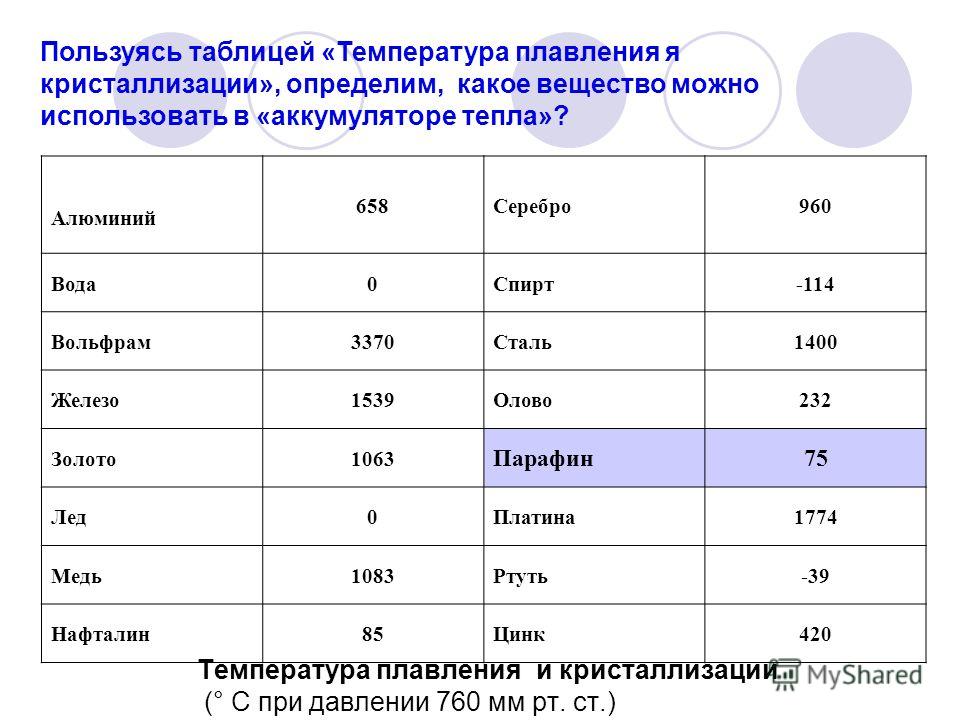 Использование лазерных импульсов с различной пиковой мощностью и длительностью было хорошим способом проверить, что переходы твердое тело / жидкость происходили при термодинамическом равновесии и что образование пара оказало незначительное влияние на зарегистрированные температуры плавления / затвердевания.Наблюдаемые температуры фазового перехода действительно не зависели, в пределах экспериментальной неопределенности, от мощности и длительности лазерного импульса, тогда как, конечно, более длинные и более мощные лазерные импульсы подразумевали более высокую пиковую температуру, более длительное время пребывания после плавления, большее образование пара и т. Д. Для проведения дополнительных испытаний возможной интерференции парового факела с пирометрическими измерениями температуры было выполнено больше лазерных импульсов с более высокой пиковой мощностью. В этих испытаниях (результаты не показаны в этой статье) максимальные температуры, превышающие 6000 К, были достигнуты в течение нескольких десятков мс, что, как следствие, привело к большому образованию пара.
Использование лазерных импульсов с различной пиковой мощностью и длительностью было хорошим способом проверить, что переходы твердое тело / жидкость происходили при термодинамическом равновесии и что образование пара оказало незначительное влияние на зарегистрированные температуры плавления / затвердевания.Наблюдаемые температуры фазового перехода действительно не зависели, в пределах экспериментальной неопределенности, от мощности и длительности лазерного импульса, тогда как, конечно, более длинные и более мощные лазерные импульсы подразумевали более высокую пиковую температуру, более длительное время пребывания после плавления, большее образование пара и т. Д. Для проведения дополнительных испытаний возможной интерференции парового факела с пирометрическими измерениями температуры было выполнено больше лазерных импульсов с более высокой пиковой мощностью. В этих испытаниях (результаты не показаны в этой статье) максимальные температуры, превышающие 6000 К, были достигнуты в течение нескольких десятков мс, что, как следствие, привело к большому образованию пара. Тем не менее, даже в этих крайних случаях остановки затвердевания наблюдались при тех же температурах, что и зарегистрированные в более стандартных экспериментах, в пределах неопределенности.
Тем не менее, даже в этих крайних случаях остановки затвердевания наблюдались при тех же температурах, что и зарегистрированные в более стандартных экспериментах, в пределах неопределенности.
Термограмма, профиль лазерного импульса и производная RLS расплавленного лазера.
( a ) TaC 1,00 ; ( b ) Ta 0,8 Hf 0,2 C; и (c ) HfC 0,98 . Термограмма (черная линия) показывает температуру образца, синий сигнал — производная RLS, в которой фазовые переходы обнаруживаются по колебаниям / колебаниям в сигнале.Красный сигнал — это профиль выходной мощности лазера.
Аналогичным образом образцы Ta 0,8 Hf 0,2 C были испытаны при тех же профилях лазера, что и TaC 1,00 (рис. 2b). Сравнивая профили TaC 1,00 и Ta 0,8 Hf 0,2 C, было обнаружено, что при одинаковых тепловых условиях Ta 0,8 Hf 0,2 C плавится быстрее, чем TaC 1,00 (на ~ 300 мс раньше) при (4178 ± 82) К с использованием значения Deadmore NSE 0.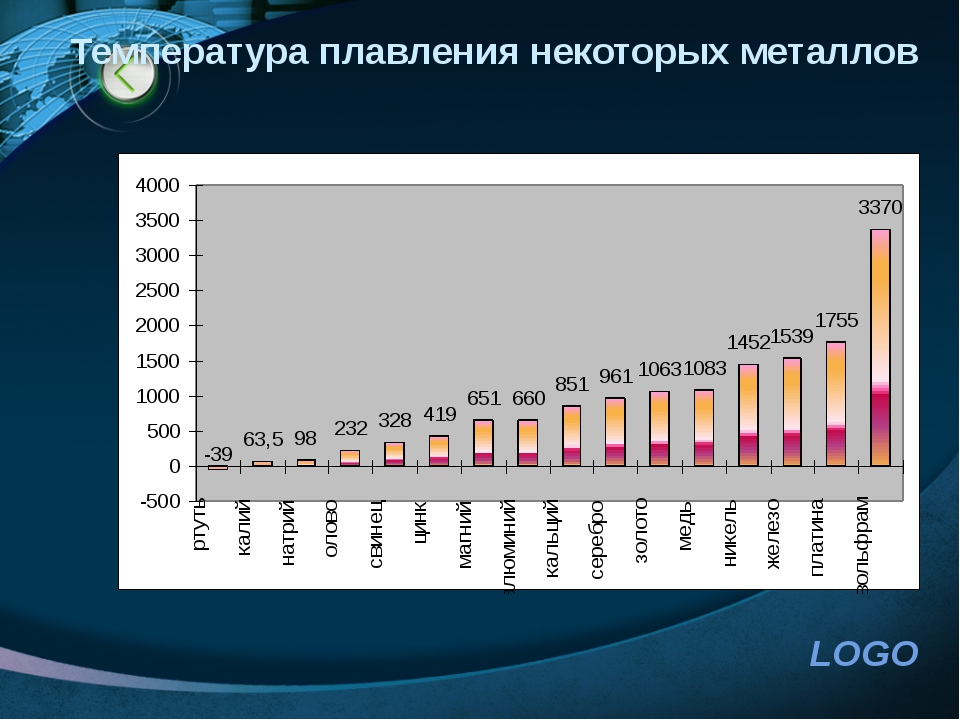 47 с относительной погрешностью 10%. При более высоких температурах сигнал RLS был меньше нарушен по сравнению с сигналом TaC, и, следовательно, меньше испарение во время плавления. После окончания лазерного импульса образец охладился естественным образом, и при термической остановке возник небольшой эффект переохлаждения. Этот эффект является обычным в условиях быстрого замораживания и связан с кинетикой затвердевания (зародышеобразование и рост) 14 . Здесь следует отметить, что наблюдаемые термические остановки соответствуют температуре солидуса, которая наиболее актуальна для технологических приложений, поскольку отмечает начало плавления и предел термической стабильности этих материалов.К сожалению, при нынешних условиях и неопределенности невозможно различить переход ликвидуса на настоящих термограммах. Аналогичные эксперименты были проведены на образцах Ta 0,5 Hf 0,5 C и Ta 0,2 Hf 0,8 C, и зарегистрированные температуры плавления составили (4077 ± 78) К и (4120 ± 80) К на основе значений Deadmore NSE.
47 с относительной погрешностью 10%. При более высоких температурах сигнал RLS был меньше нарушен по сравнению с сигналом TaC, и, следовательно, меньше испарение во время плавления. После окончания лазерного импульса образец охладился естественным образом, и при термической остановке возник небольшой эффект переохлаждения. Этот эффект является обычным в условиях быстрого замораживания и связан с кинетикой затвердевания (зародышеобразование и рост) 14 . Здесь следует отметить, что наблюдаемые термические остановки соответствуют температуре солидуса, которая наиболее актуальна для технологических приложений, поскольку отмечает начало плавления и предел термической стабильности этих материалов.К сожалению, при нынешних условиях и неопределенности невозможно различить переход ликвидуса на настоящих термограммах. Аналогичные эксперименты были проведены на образцах Ta 0,5 Hf 0,5 C и Ta 0,2 Hf 0,8 C, и зарегистрированные температуры плавления составили (4077 ± 78) К и (4120 ± 80) К на основе значений Deadmore NSE.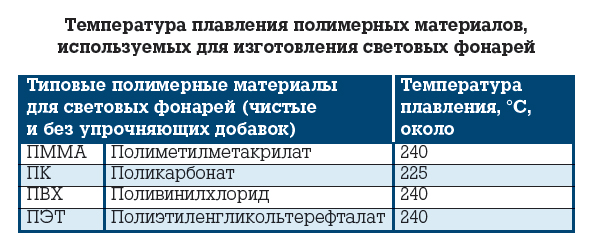 0,55 и 0,56 соответственно, и такая же предполагаемая относительная погрешность NSE 10%.
0,55 и 0,56 соответственно, и такая же предполагаемая относительная погрешность NSE 10%.
Во время начального импульса HfC 0.98 экспериментов по плавлению было обнаружено, что для плавления карбида гафния требуется меньшая мощность лазера по сравнению с образцами аналогичной формы и объема всех предыдущих составов (рис. 2c). Первоначальный лазерный импульс с выходной плотностью мощности 256 МВт · м -2 (1810 Вт в круглом фокусном пятне диаметром 3 мм) требовался для расплавления образца, по сравнению с 350 МВт · м -2 , необходимыми для расплав TaC 1,00 . Плавление образцов HfC 0,98 достигалось также при промежуточных и коротких импульсах.Более низкий коэффициент температуропроводности 24 HfC по сравнению с TaC вызывает более высокую концентрацию тепла на поверхности образца, что приводит к более высоким температурам при более низкой приложенной мощности. Кроме того, в чистом карбиде гафния наблюдалось гораздо меньшее испарение по сравнению со всеми другими композициями, судя по размеру следов пара, видимых на держателе образца над образцом после экспериментов по плавлению. Скорее всего, избыточная мощность, необходимая для нагрева других композиций, в значительной степени рассеивалась при испарении образца.Однако для плавления образцов HfC требовались более высокие температуры. Изменение наклона термограммы наблюдалось по мере того, как образец начинал плавиться (рис. 3а), с меньшим испарением, наблюдаемым на стадии плавления, и с четкой термической остановкой во время стадии охлаждения. При значении Deadmore NSE 0,5 и относительной погрешности 10% температура плавления, измеренная для HfC 0,98 , составила (4232 ± 84) К, самое высокое значение, измеренное в системе Ta-Hf-C. Сравнение термограмм первого лазерного выстрела на HfC, TaC и Ta 0.8 Hf 0,2 C показано на рис. 3б.
Скорее всего, избыточная мощность, необходимая для нагрева других композиций, в значительной степени рассеивалась при испарении образца.Однако для плавления образцов HfC требовались более высокие температуры. Изменение наклона термограммы наблюдалось по мере того, как образец начинал плавиться (рис. 3а), с меньшим испарением, наблюдаемым на стадии плавления, и с четкой термической остановкой во время стадии охлаждения. При значении Deadmore NSE 0,5 и относительной погрешности 10% температура плавления, измеренная для HfC 0,98 , составила (4232 ± 84) К, самое высокое значение, измеренное в системе Ta-Hf-C. Сравнение термограмм первого лазерного выстрела на HfC, TaC и Ta 0.8 Hf 0,2 C показано на рис. 3б.
( a ) Термограмма и RLS расплавленного лазером HfC 0,98 и ( b ) сравнение термограмм, записанных в ходе экспериментов, проведенных на TaC 1,00 , HfC 0,98 и Ta 0,8 Hf 0,2 C.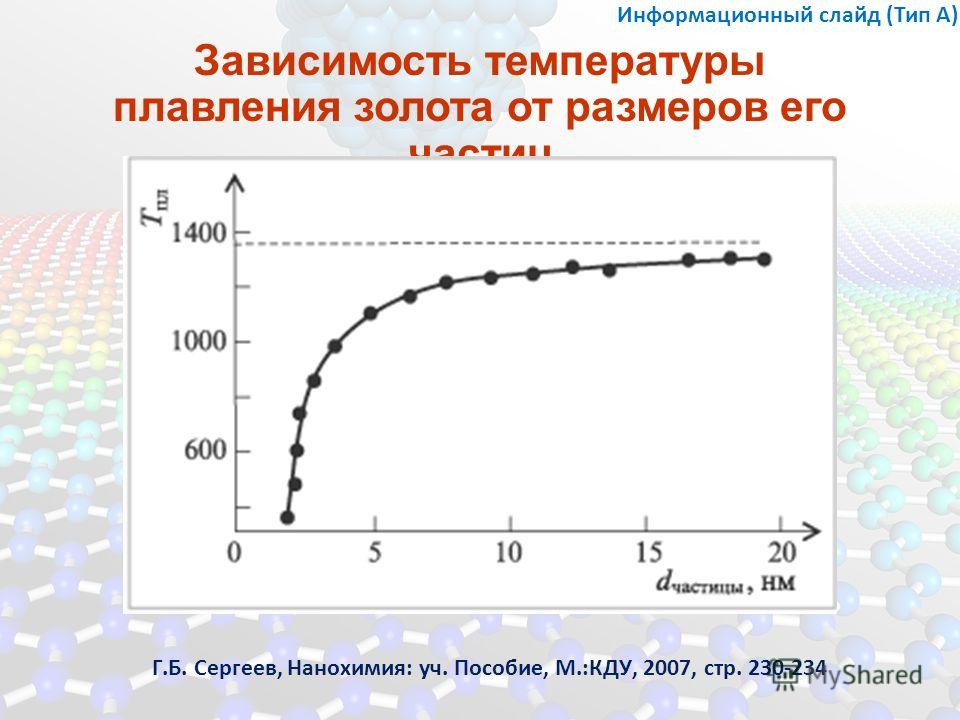 Образцы.
Образцы.
Результаты представлены на рис. 4a. Они показывают, что в пределах неопределенности значений NSE Дэдмора действительно может существовать локальная максимальная температура плавления твердых растворов вблизи Ta 0.8 Hf 0,2 Состав C, при 4178 К, что хорошо согласуется со значением, указанным Agte и Alterthum 4 . Однако эта максимальная температура плавления является только локальной, поскольку максимальная наблюдаемая температура плавления в системе Ta-Hf-C составляет для HfC 0,98 , при 4232 К. Кроме того, в отличие от предыдущих экспериментальных отчетов, T m Содержание TaC, измеренное в этом исследовании, было самым низким в системе Ta-Hf-C при 4041 К. Промежуточные составы между Ta 0,8 Hf 0.2 C и HfC 0,98 имеют более высокие температуры перехода твердое тело / жидкость, чем чистый TaC. Наивысшая температура плавления, о которой ранее сообщалось для HfC 0,94 , составляет 4201 К, а самая высокая температура плавления для любого соединения составляет 4256 К для TaC 0,88 , обе температуры определены Руди 5 . Гусев и др. . 8 сообщил о тенденции, аналогичной результатам Руди 5 , но с немного более высокими значениями (таблица 1), однако их значения были получены из термодинамических расчетов.Тенденция, полученная в нашей работе, аналогична тенденции, предсказанной Хонгом и ван де Валлем 9 с HfC 0,81 , имеющим самую высокую температуру плавления, TaC 0,88 , самую низкую, и с локальным максимумом для Ta 0,8 Hf 0,2 C.
Гусев и др. . 8 сообщил о тенденции, аналогичной результатам Руди 5 , но с немного более высокими значениями (таблица 1), однако их значения были получены из термодинамических расчетов.Тенденция, полученная в нашей работе, аналогична тенденции, предсказанной Хонгом и ван де Валлем 9 с HfC 0,81 , имеющим самую высокую температуру плавления, TaC 0,88 , самую низкую, и с локальным максимумом для Ta 0,8 Hf 0,2 C.
( a ) Экспериментальные температуры плавления ( T m ), полученные путем корректировки текущих температур яркости с данными по излучательной способности Дэдмора в системе TaC-HfC в зависимости от содержания HfC, и ( b ) нормированное тепловое излучение, измеренное многоканальным спектропирометром при температурах замерзания пяти составов, исследованных в данной работе.
На рис. 4b представлены спектры яркости, зарегистрированные между 515 и 900 нм при остановке затвердевания для исследуемых композиций. Они охватывают большую часть видимого диапазона, где, согласно уравнению 1 Планка, максимальное значение и значительная часть общего теплового излучения излучаются 25 при текущих температурах плавления / затвердевания, и они включают длину волны максимальной тепловой яркости при этих температурах. температуры. Интересно, что спектры яркости при температуре затвердевания лишь частично следуют тенденции, представленной на рис.4а для температур плавления / замерзания, рассчитанных на основе измеренных температур яркости на длине волны 650 нм и значений NSE, сообщенных Дэдмором. В соответствующих точках плавления / затвердевания чистый карбид гафния действительно излучает самую высокую яркость, а чистый карбид тантала — самую низкую, что согласуется с температурными данными, представленными на рис. 4a. Однако с точки зрения яркости затвердевания ниже 700 нм смешанные композиции демонстрируют довольно монотонный рост при переходе от композиций с более высоким содержанием Ta к композициям с более высоким содержанием Hf.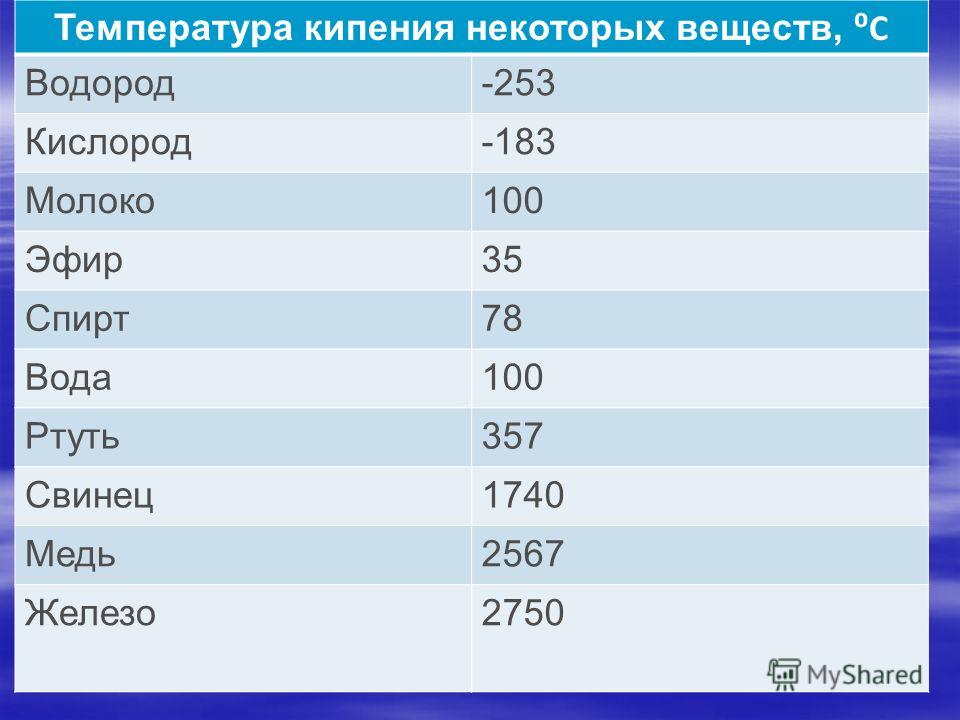 Следовательно, существование локальной максимальной температуры плавления для Ta 0,8 Hf 0,2 C не очевидно из спектров яркости. Кроме того, монотонный тренд спектральной яркости в зависимости от состава, по-видимому, нарушается на более длинных волнах спектром яркости Ta 0,5 Hf 0,5 C при остановке затвердевания, который сначала превышает таковой для Ta 0,8 Hf 0,2 C, а затем HfC на длинах волн более 700 и 850 нм соответственно.Причина должна заключаться в зависимости NSE от состава и длины волны, и нельзя сделать определенные выводы об абсолютных температурах плавления / затвердевания без прямого измерения NSE на месте , что является чрезвычайно сложной задачей, если учесть экстремальные температуры. вовлеченный. С другой стороны, наблюдаемая связь между излучательной способностью образца и существованием локальной максимальной температуры плавления / затвердевания может быть воспринята как дополнительный экспериментальный намек в пользу гипотезы Хонга и ван де Валле 9 о том, что положение Уровень Ферми в композициях Ta-Hf-C напрямую влияет на их температуру плавления.
Следовательно, существование локальной максимальной температуры плавления для Ta 0,8 Hf 0,2 C не очевидно из спектров яркости. Кроме того, монотонный тренд спектральной яркости в зависимости от состава, по-видимому, нарушается на более длинных волнах спектром яркости Ta 0,5 Hf 0,5 C при остановке затвердевания, который сначала превышает таковой для Ta 0,8 Hf 0,2 C, а затем HfC на длинах волн более 700 и 850 нм соответственно.Причина должна заключаться в зависимости NSE от состава и длины волны, и нельзя сделать определенные выводы об абсолютных температурах плавления / затвердевания без прямого измерения NSE на месте , что является чрезвычайно сложной задачей, если учесть экстремальные температуры. вовлеченный. С другой стороны, наблюдаемая связь между излучательной способностью образца и существованием локальной максимальной температуры плавления / затвердевания может быть воспринята как дополнительный экспериментальный намек в пользу гипотезы Хонга и ван де Валле 9 о том, что положение Уровень Ферми в композициях Ta-Hf-C напрямую влияет на их температуру плавления.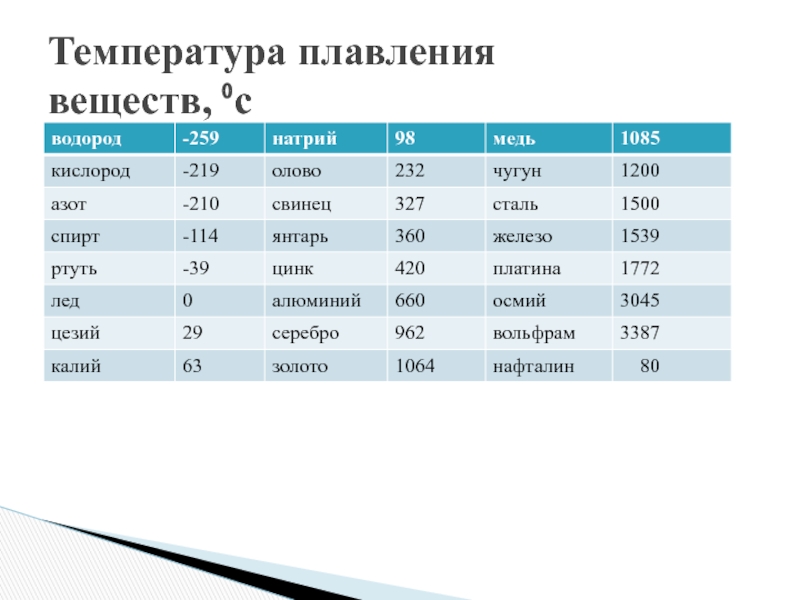 Это, безусловно, должно стимулировать дальнейшие экспериментальные исследования в соответствии с теоретическим предсказанием Хонга и Ван де Валле, основанным также на соображениях энтропии жидкой фазы, что смешанные составы Ta-Hf-CN могут иметь даже более высокие температуры плавления, чем те, которые были оценены для тройного Ta- Система Hf-C.
Это, безусловно, должно стимулировать дальнейшие экспериментальные исследования в соответствии с теоретическим предсказанием Хонга и Ван де Валле, основанным также на соображениях энтропии жидкой фазы, что смешанные составы Ta-Hf-CN могут иметь даже более высокие температуры плавления, чем те, которые были оценены для тройного Ta- Система Hf-C.
Наконец, текущие результаты, показанные на рис. 4a и b, гарантируют, что чистый карбид гафния может удерживать соединение, излучающее наивысшую интенсивность излучения при его температуре плавления, по крайней мере, в исследуемом здесь спектральном диапазоне.Это, безусловно, самая полезная информация, учитывая его использование в качестве огнеупорного материала.
Характеристики после плавления
Образцы были охарактеризованы после экспериментов по плавлению. Фотография образцов после плавления показана на рис. 5. После 8 лазерных импульсов образец TaC 1,00 (рис. 5а) показал отделение материала от основного материала вокруг ванны расплава, яркую ванну расплавленного и повторно замороженного материала на центр образца наблюдался. Кроме того, Ta 0.Таблетка 8 Hf 0,2 C (рис. 5b) показала лучшую механическую стойкость к лазерным импульсам, чем другие составы, образец сохранял свою форму даже после 12 последовательных циклов лазерного выстрела. Округленная область ванны расплава ок. 3 мм с вздутым участком в центре образца. Кроме того, образовывались радиальные трещины, возникающие в фокусном пятне лазера и распространяющиеся к краю образца. В ходе экспериментов по лазерному плавлению на образце HfC 0,98 были нанесены серьезные повреждения.Ванна расплава, покрывающая всю поверхность и имеющая кратерообразную форму, показана на рис. 5c. Во время лазерного нагрева части образца отделились и отвалились от образца из-за высокой пористости (около 15%). В некоторых экспериментах термограмма показывала сбои из-за падения объемного материала с поверхности образца. Это стабилизировалось после нескольких лазерных выстрелов, когда после плавления и замораживания материала была получена более плотная поверхность.
Кроме того, Ta 0.Таблетка 8 Hf 0,2 C (рис. 5b) показала лучшую механическую стойкость к лазерным импульсам, чем другие составы, образец сохранял свою форму даже после 12 последовательных циклов лазерного выстрела. Округленная область ванны расплава ок. 3 мм с вздутым участком в центре образца. Кроме того, образовывались радиальные трещины, возникающие в фокусном пятне лазера и распространяющиеся к краю образца. В ходе экспериментов по лазерному плавлению на образце HfC 0,98 были нанесены серьезные повреждения.Ванна расплава, покрывающая всю поверхность и имеющая кратерообразную форму, показана на рис. 5c. Во время лазерного нагрева части образца отделились и отвалились от образца из-за высокой пористости (около 15%). В некоторых экспериментах термограмма показывала сбои из-за падения объемного материала с поверхности образца. Это стабилизировалось после нескольких лазерных выстрелов, когда после плавления и замораживания материала была получена более плотная поверхность.
Фотографии образцов, наплавленных лазером.
( a ) TaC 1,00 ; ( b ) Ta 0,8 Hf 0,2 C; и (c ) HfC 0,98 .
Кроме того, SEM-анализ был проведен на образцах после плавления. На изображении BSE на рис. 6а показан расплавленный образец TaC 1.00 после экспериментов по лазерному нагреву. Центр образца представляет собой ванну расплава, окруженную нерасплавленным сыпучим материалом. В центре ванны расплава можно наблюдать кратер в том месте, где был наведен фокус лазера.Область, окружающая пустоту или кратер (рис. 6б), показывает рекристаллизованные зерна после замораживания. Морфология зерен после замораживания имеет волнистую поверхность. Эта морфология однородна по всей ванне расплава, и одно зерно можно наблюдать при большем увеличении на рис. 6с.
Рис. 6 Изображение BSE TaC 1,00 после лазерно-индуцированного плавления.
( a ) ванна расплава; ( b ) морфология зерен после плавления; и ( c ) большее увеличение зерна после плавления.
Расплавленная область образца Ta 0,8 Hf 0,2 C показана на рис. 7а, на котором видна круглая область расплавленного материала с набухшей областью в центре. Трещины наблюдались начиная с фокуса лазера и распространялись радиально к внешним областям образца. После последовательного плавления одного и того же пятна образовалась дендритная структура. На рис. 7б рядом с дендритной структурой образовались трещины. Когда материал, окружающий дендриты, замерз, на поверхности рекристаллизованных зерен образовывалась рябь (рис.7в). Также обнаружено изменение морфологии зерна от набухшей до зоны термического влияния (т.е. не расплавленной) с тремя различными участками; удлиненные зерна с рифленой поверхностью, затем переходная зона с равноосными зернами и, наконец, область с зернами с комками или пиками на каждом зерне (рис.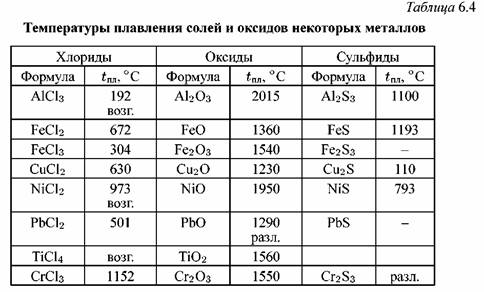 7d).
7d).
Изображение BSE затвердевшей ванны расплава Ta 0,8 Hf 0,2 C; ( a ) опухшая область около центра лазерной фокальной точки с трещинами на поверхности; ( b ) дендритная микроструктура после многократного плавления; ( c ) рябь на поверхности вблизи точки фокусировки лазера; и ( d ) изменение морфологии зерна от набухшей области до зоны термического влияния.
BSE изображение расплавленного HfC 0,98 показывает на рис. 8a ванну расплава образца, которая составляет всю верхнюю поверхность образца после серьезного повреждения, вызванного повторными экспериментами по плавлению. Область, обозначенная белым овалом (рис. 8а), показывает точку фокусировки луча, в которой была сосредоточена наибольшая тепловая нагрузка. Он имеет дендритную структуру, образовавшуюся после последовательного плавления и замораживания одного и того же пятна. На увеличенном изображении (рис. 8б) показаны сформированные дендритные структуры с междендритными пустотами, показанными черным контрастом.Квадрат, показанный на фиг. 8a и увеличенный на фиг. 8c, показывает расплавленную поверхность за пределами дендритной области, в которой рекристаллизованные равноосные зерна образовались после замерзания расплавленной поверхности. Эта морфология однородна по всей ванне расплава, окружающей дендритную область.
8б) показаны сформированные дендритные структуры с междендритными пустотами, показанными черным контрастом.Квадрат, показанный на фиг. 8a и увеличенный на фиг. 8c, показывает расплавленную поверхность за пределами дендритной области, в которой рекристаллизованные равноосные зерна образовались после замерзания расплавленной поверхности. Эта морфология однородна по всей ванне расплава, окружающей дендритную область.
Изображение BSE ванны расплава HfC 0,98 : ( a ) ванна расплава; ( b ) образовали дендриты после многократного плавления; и ( c ) морфология зерен вокруг дендритной структуры.
Важной проблемой в экспериментах по плавлению является возникновение фазовых превращений, отличных от твердо-жидких. Из-за испарения углеродных продуктов и возможного снижения содержания углерода возможно образование гексагональной фазы Ta 2 C или других фаз Ta-C. Эта ситуация не вызывает беспокойства в HfC, где карбид имеет широкий диапазон нестехиометрии при высоких температурах и не образует карбиды низшего порядка 5 .

 Е., Будберг П. Б., Бурханов Г. С., Дриц А. М., Пановко В. М. Свойства элементов. — Металлургия, 1985. — С. 672 с.
Е., Будберг П. Б., Бурханов Г. С., Дриц А. М., Пановко В. М. Свойства элементов. — Металлургия, 1985. — С. 672 с. 244, кип. 309
244, кип. 309 примечание]
примечание] — 116, кип. +2
— 116, кип. +2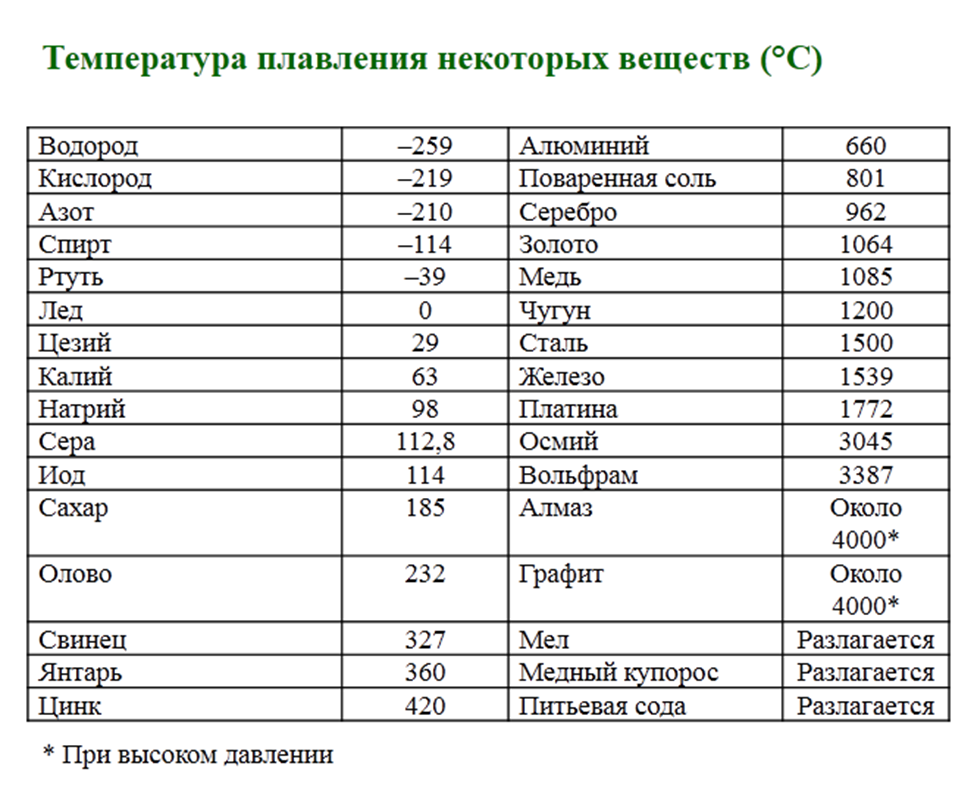
 — 114, кип.- 85
— 114, кип.- 85 61, разл. 300
61, разл. 300 — 39, кип. +357
— 39, кип. +357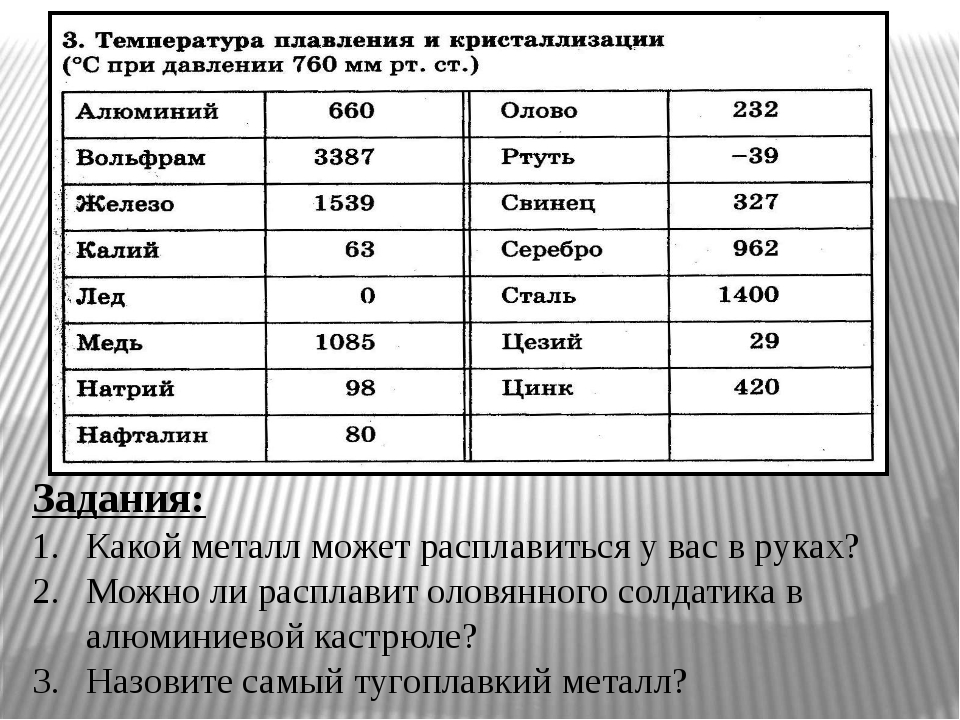 2080
2080 — 164, кип.- 152
— 164, кип.- 152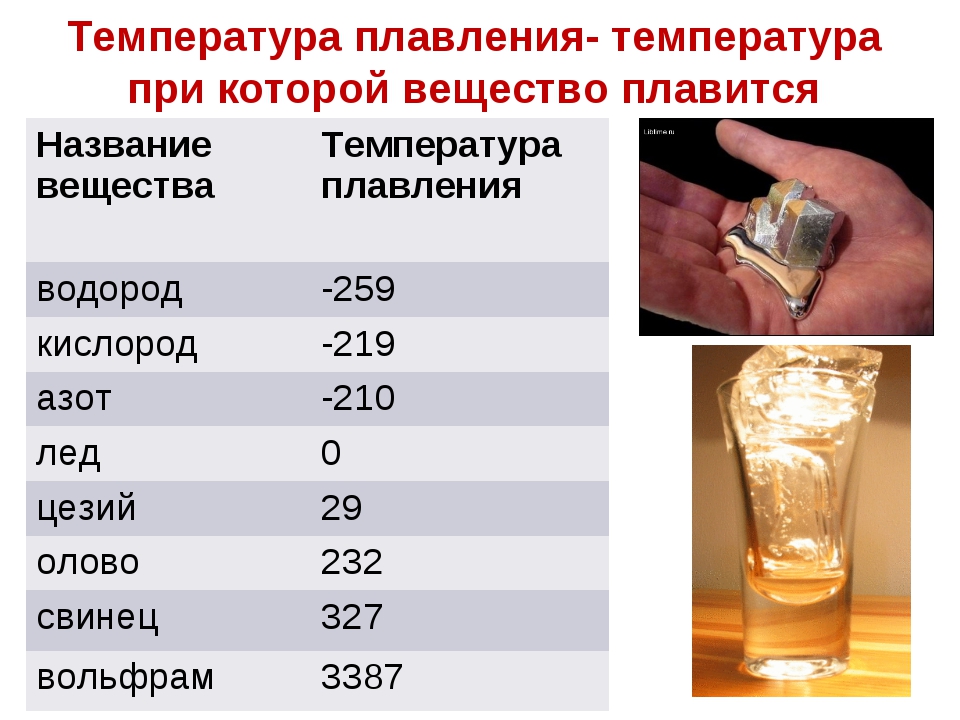 — 219, кип.- 183
— 219, кип.- 183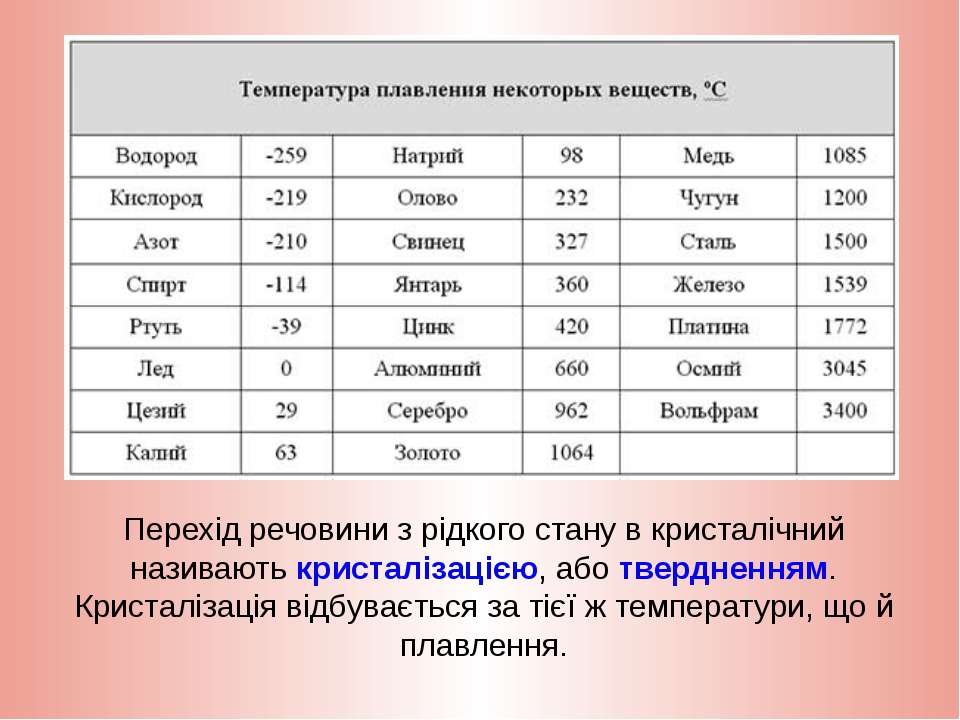 > 344
> 344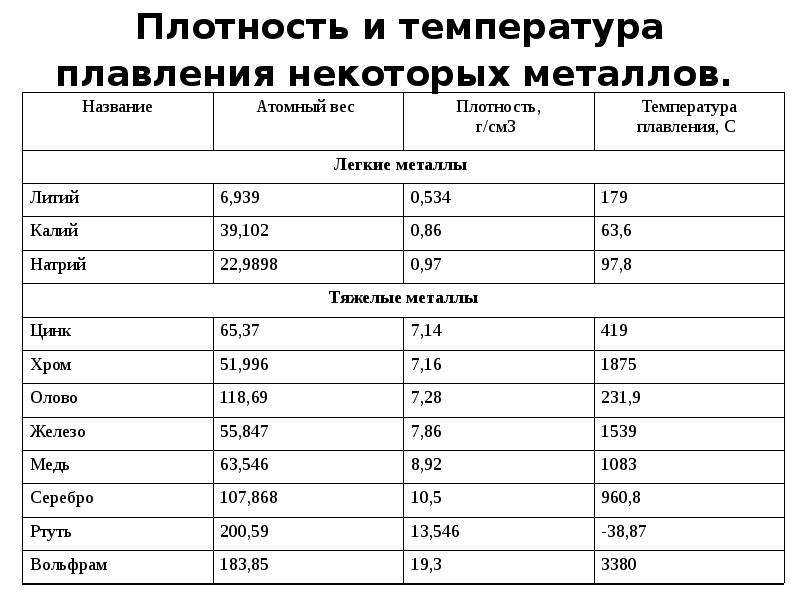 1634
1634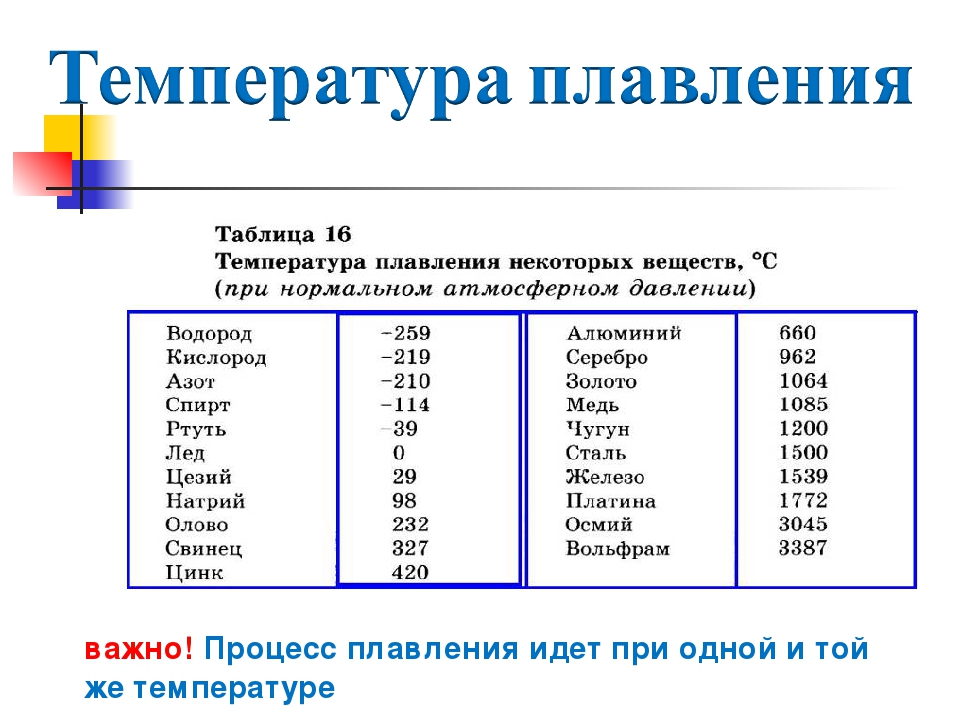 1040, кип. 1425
1040, кип. 1425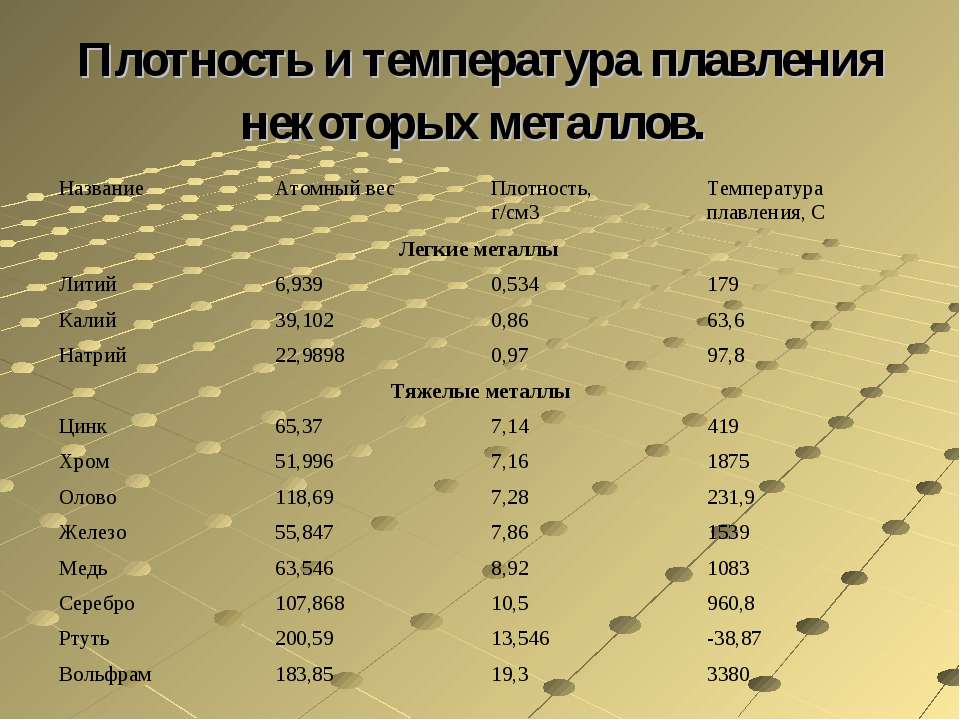 303, кип. ок. 1100
303, кип. ок. 1100