Кельвина плавления — Справочник химика 21
Для измерения температуры предусматривается применение Международной стоградусной температурной шкалы, единицей которой является градус Цельсия (°С) [0° стоградусной шкалы соответствует температуре плавления чистой воды]. Если обозначить температуру тела, измеренную в °С, через а в °К (Кельвина) — [c.8]Термодинамическую температуру выражают в градусах Кельвина (К). Градус Цельсия (°С) является специальной единицей для выражения температуры по шкале Цельсия. Температура по этой шкале равна Т —Т , где То — температура таяния льда (плавления) при нормальном давлении равная 273,15 °С. Для разности температур обозначение град больше не применяется. [c.33]
Для тепловых измерений вводится четвертая основная величина — температура единицей температуры является градус, В зависимости от начальной точки отсчета различают абсолютную температуру (отсчет от абсолютного нуля), выражаемую в градусах Кельвина (°К), и температуру по стоградусной шкале (отсчет от точки плавления льда), выражаемую в градусах Цельсия ( С).
Температурная шкала Фаренгейта. В этой шкале температур точка таяния льда = 0°С) соответствует 32°Р, а точка кипения воды (( — 100°С) — 212°Р. В шкале Цельсия или Кельвина 100 градусов, лежащие в интервале между точкой плавления льда и точкой кипения воды, соответствуют 180 градусам Фаренгейта. [c.258]
Решением десятой генеральной конференции по мерам и весам (1954 г.) и согласно ГОСТ 8550—57, международная термодинамическая шкала определяется при помощи тройной точки воды ( 90) в качестве основной реперной точки, причем ей приписывается температура 273,16 К. Это значит, что величина градуса этой шкалы равна 1/273,16 интервала между абсолютным нулем и темпера-, турой тройной точки. Температура по термодинамической шкале при отсчете от абсолютного нуля называется абсолютной температурой или температурой, выраженной в К (градус Кельвина), и обозначается буквой Т. При отсчете от температуры плавления льда, равной 273,15 К, согласно решениям XI генеральной конференции (1960 г.
Еще в 1854 г. Томсоном было отмечено, что если значение точки плавления льда известно с достаточной точностью, то с теоретической точки зрения предпочтительнее определять шкалу температур с помощью абсолютного значения точки плавления льда, чем путем отнесения 100° к разнице между значениями точки плавления льда и точки кипения воды. В 1954 г. десятая Генеральная конференция по мерам и весам [1424] пересмотрела определение шкалы температур по Кельвину, приписав значение 273,16° К тройной точке воды в этом случае точка плавления льда соответствует 273,15° К. Для практических целей пересчет между двумя шкалами температур выражается формулой
К тройной точке воды, а 273,15° К — к точке плавления льда [124]. Таким образом, было принято предложение Кельвина, сделанное в 1854 г. Он высказал тогда мысль о том, что если бы точка плавления льда была известна с достаточной точностью, то величина одного градуса могла бы быть окончательно определена по абсолютному значению температуры этой точки, а не как сотая часть интервала между точками плавления льда и кипения воды, как это обычно делается при определении стоградусной температурной шкалы. При таком определении температуры соотношение между градусами Кельвина и градусами Цельсия будет следующим [c.21]
При таком определении температуры соотношение между градусами Кельвина и градусами Цельсия будет следующим [c.21]
Обычно указывают теплоту плавления для температуры плавления, теплоту испарения — для температуры кипения. Для уточненных расчетов теплот сублимации обе эти величины перед сложением необходимо пересчитать на температуру, при которой производится определение теплоты сублимации (чаще всего в градусах Кельвина). [c.359]
Тройная точка воды играет важную роль в определении температурной шкалы. Согласно решению десятой генеральной конференции по мерам и весам (1954 г.) и согласно ГОСТ 8550—57 международная термодинамическая шкала температур определяется при помощи тройной точки воды, причем ей приписывается температура 273,16° К. Это значит, что величина градуса этой шкалы равна интервала между абсолютным нулем и температурой тройной точки. Определяемая таким путем величина градуса практически равна 1/100 интервала между температурами кипения и кристаллизации воды при нормальном атмосферном давлении.
Температуры приведены в градусах Кельвина. Первая цифра соответствует температуре плавления, вторая — температуре кипения. [c.191]
Один градус шкалы Кельвина принят равным 1/100 температурного интервала между точками плавления льда и кипения воды при нормальном давлении. Точка плавления льда по шкале Кельвина соответствует 273,16° К, точка кипения воды—373,16° К. Следовательно нуль по шкале Кельвина ниже точки таяния льда на 273,16° С. [c.9]
Все термодинамические величины выражены в калориях или килокалориях (1 кал = 4,1840 дж) температура Т указана в градусах Кельвина (°К).
Точка плавления указана в скобках в градусах Кельвина. [c.118]
В этом выражении АНт,х и А8т,х — изменения соответственно энтальпии и энтропии нри плавлении, отнесенные к 1 молю, а Г — температура (в градусах Кельвина). С помощью соотношения для температуры плавления [c.24]
Мы выяснили смысл термина температура . Согласно кинетической теории, если два газа находятся при одинаковой температуре, то молекулы этих газов обладают одинаковой средней кинетической энергией. При изменении температуры газа при постоянном давлении объем прямо пропорционален температуре, если температура выражена в градусах абсолютной шкалы.
Ниже приведены температуры кипения и температуры плавления некоторых жидкостей в градусах Цельсия. Выразите эти значения по абсолютной шкале температуры (в градусах Кельвина). [c.95]
В настояшее время применяют две температурные шкалы термодинамическую и международную практическую, введенную как обязательную с 1 января 1971 г. В термодинамической шкале Кельвина начальная точка отсчета — точка абсолютного нуля (точка, лежаш,ая на 273,16° ниже точки плавления льда — 0,01 °С). [c.177]
До 1954 г. стоградусная термодинамическая шкала (шкала Цельсия) и абсолютная термодинамическая шкала (шкала Кельвина) по Положению, принятому международным соглашением, строились именно таким образом. Однако в 1954 г. X Генеральная конференция по мерам и весам приняла решение, согласно которому построение абсолютной и стоградусной термодинамической шкалы должно производиться иным методом. В отличие от рассмотренного выше метода, основным температурным интервалом при построении абсолютной шкалы является теперь не интервал между точкой плавления льда и точкой кипения водЫ а интервал между абсолютным нулем температур и тройной точкой воды. Шкала Цельсия по-прежнему получается при сдвиге нулевой точки на 273,15°, Следует заметить, что введенные изменения касаются скорее принципа построения шкалы и способа определения градуса. Значения термодинамических температур при этом почти не изменяются (некоторое изменение возможно, но оно настолько мало, что в настоящее время не может быть надежно установлено). Подробнее об этом см. 11.
Однако в 1954 г. X Генеральная конференция по мерам и весам приняла решение, согласно которому построение абсолютной и стоградусной термодинамической шкалы должно производиться иным методом. В отличие от рассмотренного выше метода, основным температурным интервалом при построении абсолютной шкалы является теперь не интервал между точкой плавления льда и точкой кипения водЫ а интервал между абсолютным нулем температур и тройной точкой воды. Шкала Цельсия по-прежнему получается при сдвиге нулевой точки на 273,15°, Следует заметить, что введенные изменения касаются скорее принципа построения шкалы и способа определения градуса. Значения термодинамических температур при этом почти не изменяются (некоторое изменение возможно, но оно настолько мало, что в настоящее время не может быть надежно установлено). Подробнее об этом см. 11.
О численном значении точки кипения кислорода необходимо сказать следующее.
 Как известно, по Положению о Международной практической температурной шкале этой точке приписано значение —182,97° С. Температура кислородной точки по шкале Кельвина еще сравнительно недавно считалась 90,19° К, так как температура плавления льда (0° С) была принята равной 273,16° К. Поскольку в настоящее время нулевой точке Международной шкалы приписано другое значение, а именно 273,15 К (см. гл. 1), температура, принятая для кислородной точки по шкале Кельвина, также должна измениться ее следует считать равной 90,18° К. [c.122]
Как известно, по Положению о Международной практической температурной шкале этой точке приписано значение —182,97° С. Температура кислородной точки по шкале Кельвина еще сравнительно недавно считалась 90,19° К, так как температура плавления льда (0° С) была принята равной 273,16° К. Поскольку в настоящее время нулевой точке Международной шкалы приписано другое значение, а именно 273,15 К (см. гл. 1), температура, принятая для кислородной точки по шкале Кельвина, также должна измениться ее следует считать равной 90,18° К. [c.122]Температура 273,16К принята в качестве единственной реперной точки (точка отсчета) для абсолютной термодинамической температурной шкалы Кельвина. При атмосферном давлении (Р = 1,0133 10 Па) температура плавления льда лежит на 0,01 К ниже тройной точки (Т = = 273, 15 К = 0°С). При плавлении система становитвя двухфазной и ее состояние на диаграмме изображается фигуративной точкой, находящейся на линии плавления ЬО. [c.334]
Когда необходимо получение сопоставимых данных по свойствам разных материалов, соблюдение физическ010 подобия усложняется. Например, сравнение механических свойств разш.1х металлов и сплавов при одной температуре может быть при решении 0 тределенных задач лишено физического смысла. Механические свойства, в частности,прочностные, связаны с температурой начала плавления металла или сплава при прочих равных условиях, чем вьппе эта температура, тем вьпие прочностные характеристики при заданной температуре испьггания. Поэтому сопоставление свойств разных металлических материалов более правильно проводить г1ри одинаковых гомологических температурах, т. е. одинаковых отношениях абсолютных температур испьггания и плавления (в градусах Кельвина).
Например, сравнение механических свойств разш.1х металлов и сплавов при одной температуре может быть при решении 0 тределенных задач лишено физического смысла. Механические свойства, в частности,прочностные, связаны с температурой начала плавления металла или сплава при прочих равных условиях, чем вьппе эта температура, тем вьпие прочностные характеристики при заданной температуре испьггания. Поэтому сопоставление свойств разных металлических материалов более правильно проводить г1ри одинаковых гомологических температурах, т. е. одинаковых отношениях абсолютных температур испьггания и плавления (в градусах Кельвина).
Если температуру плавления льда, находящегося в равновесии с жидкой водой при атмосферном дапленип, условно принять за нуль, а температуру кипящей воды при том же давлении столь же произвольно принять за 100, то при таком выборе шкалы величина а для всех газов оказывается равной ,00366086 град . Нельзя представить себе газ, занимающий отрицательный объем, п поэтому наименьшее значение V равно пулю. Это могло бы иметь место при а = —1,т.е. при = —1/а= —273,16°. Так можно ввести понятие абсолютной шкалы температур. Это сделал Кельвин, прибавив 273,16° к температуре, измеренной но стоградусной шкале [c.13]
Это могло бы иметь место при а = —1,т.е. при = —1/а= —273,16°. Так можно ввести понятие абсолютной шкалы температур. Это сделал Кельвин, прибавив 273,16° к температуре, измеренной но стоградусной шкале [c.13]
Ниже определенной температуры аморфный полимер может рассматриваться как твердое стекло. Если его нагреть выше этой температуры, то отдельные сегменты макромолекулы приобретают большую подвижность, полимер становится мягким и, наконец, переходит в высокоэластическое состояние. Температуру, при которой происходит это изменение, называют температурой стеклования Tg. Эта температура зависит от химической природы полимера, стереохимического строения его цепи, от степени разветвленности макромолекул. Для одного и того же образца Tg может быть различной в зависимости от метода ее определения [90 . Температуру стеклования можно определить путем исследования некоторых физических характеристик полимерного образца, таких, как показатель преломления, модуль упругости, диэлектрическая проницаемость, теплоемкость, коэффициент набухания, удельный объем, в зависимости от температуры. При достижении температуры стеклования эти величины или их температурный ход резко меняются. У аморфных полимеров температура размягчения часто совпадает с температурой стеклования у кристаллических полимеров точка плавления существенно выше, чем ТТемпературу стеклования кристаллических полимеров можно оценить по эмпирическому правилу Бойера — Бимана составляет примерно две трети температуры плавления (в градусах Кельвина) . [c.87]
При достижении температуры стеклования эти величины или их температурный ход резко меняются. У аморфных полимеров температура размягчения часто совпадает с температурой стеклования у кристаллических полимеров точка плавления существенно выше, чем ТТемпературу стеклования кристаллических полимеров можно оценить по эмпирическому правилу Бойера — Бимана составляет примерно две трети температуры плавления (в градусах Кельвина) . [c.87]
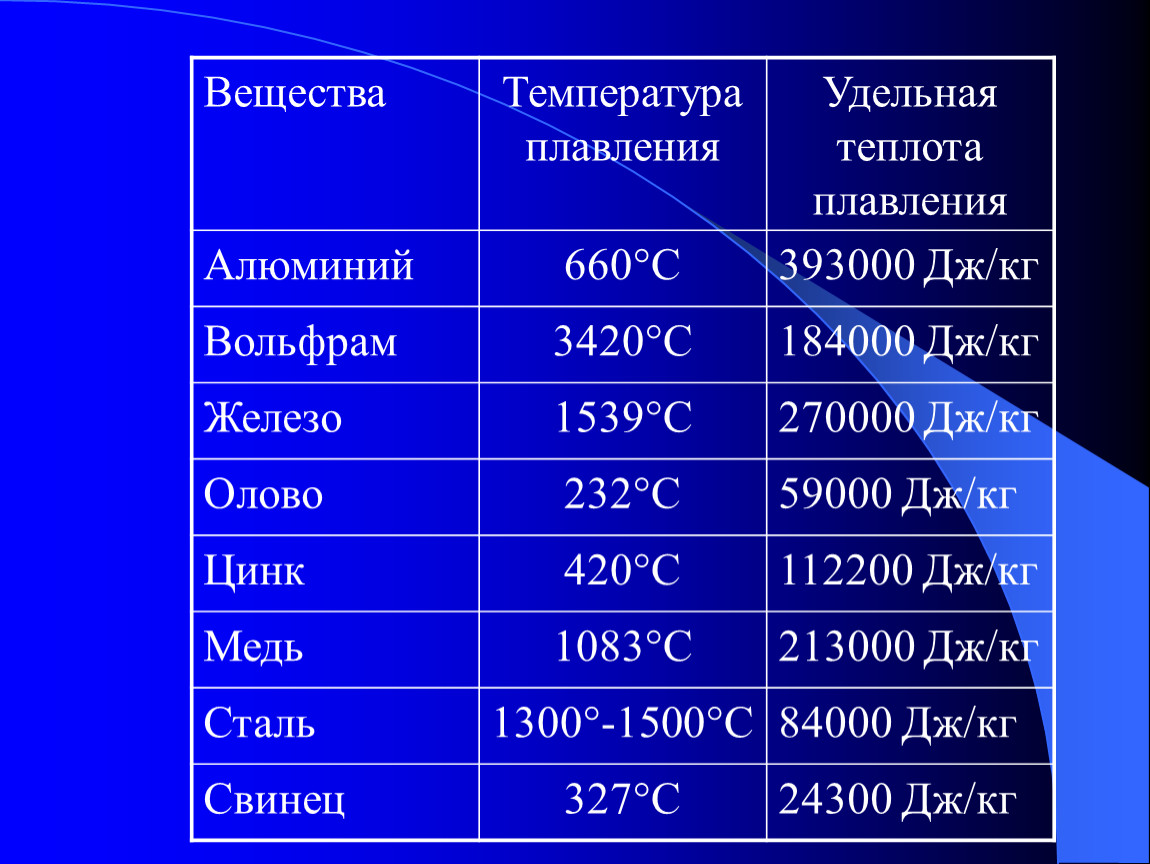
Для удобства сравнения АНм различных полимеров эта величина во всех случаях поделена на молекулярный вес мономерного звена Ма. Полученная при этом удельная теплота, отнесенная к 1 г кристаллического полимера приведена в табл. 4. Энтропия плавления А5м на мономерное звено находится из отношения AHJT iл (Гпл выражается в этом случае в градусах Кельвина). Для сравнения на какой-то рациональной основе энтропий плавления полимеров, различающихся по величине мономерных звеньев, Д5м было разделено на число единичных связей в главной цепи мономерного звена. Полученный таким образом параметр приведен в последней колонке табл. 4. Калориметрически можно определить некоторую условную теплоту плавления А/У. различных полимеров, однако, зная степень кристалличности системы до плавления, можно затем по А//м оценить энтальпию фазового перехода АЯ . Результаты для полимеров, в отношении которых отсутствуют данные, полученные более точными методами, приведены также в табл. 4. [c.124]
Полученный таким образом параметр приведен в последней колонке табл. 4. Калориметрически можно определить некоторую условную теплоту плавления А/У. различных полимеров, однако, зная степень кристалличности системы до плавления, можно затем по А//м оценить энтальпию фазового перехода АЯ . Результаты для полимеров, в отношении которых отсутствуют данные, полученные более точными методами, приведены также в табл. 4. [c.124]
Тепловая обработка зернистых (порошкообразных) материалов может приводить к агломерации частиц и монолитизации материала. Этот процесс называется спеканием. Он является основным процессом в керамическом производстве и применяется также для металлов, стекол, а в последнее время для полимерных материалов [78]. Кроме тех изменений, которыми сопровождается отжиг, изменения, связанные со спеканием, обычно наблюдаются при температурах, составляюших от 2/з до V5 температуры плавления, выраженной в градусах Кельвина. [c.444]
Киршенбаум [130] использовал строгое соотношение между энтропией плавления и температурой плавления для расчета теплоты плавления полимеров. Энтропию плавления (в джоулях на кельвин и моль повторяющегося звена) он рассчитывал с учетом изменения объ. М3 (А8 0,75 Д пп) и конформационных изменений = 7,5п [c.58]
Энтропию плавления (в джоулях на кельвин и моль повторяющегося звена) он рассчитывал с учетом изменения объ. М3 (А8 0,75 Д пп) и конформационных изменений = 7,5п [c.58]
Исторически Т. возникла как учение о взаимопревращениях теплоты и механич. работы (механич. теория тепла). Толчком к созданию Т. послужило развитие теплотехники и, в частности, изобретенне паровой машины в конце 18 в. Однако значительную роль в создании Т. сыграли многие более ранние открытия в естествознании, в т. ч. изобретение термометра (Галилей, 1592), создание первых температурных шкал (Бойль, 1695, Цельсий, 1742), введение понятий о теплоемкости и так наз. скрытых теплотах — теплоте плавления и теплоте испарения (Блек, 1760—62), и, наконец, установление газовых законов. Непосредственно к открытию первого закона Т. привели опыты Румфорда (1798), к-рый наблюдал выделение большого количества теплоты нри сверлении пушечного ствола, и гл. обр. исследования Майера (1841—42) и Джоуля (1843) по установлению принципа эквивалентности между работой и теплотой и измерению механич. эквивалента теплоты. Основой второго закона Т., сформулированного Клаузиусом (1850) и Томсоном (Кельвином) (1851), послужил труд Карно (1823) Размышления о движущей силе огия и о машинах, способных развивать эту силу , в к-ром впервые был дан анализ работы идеальной тепловой машины (см. Карно цикл). Т. обр., Т. как наука сформировалась в середине 19 в. В последующем важнейшими этапами в развитии Т. явились создание общей теории термодинамич. равновесия (Гиббс, 1875—78) и открытие третьего закона Т. (Нернст, 1906). Параллельно расширялись области применения термоди-намич. законов в различных областях науки и техники. [c.47]
эквивалента теплоты. Основой второго закона Т., сформулированного Клаузиусом (1850) и Томсоном (Кельвином) (1851), послужил труд Карно (1823) Размышления о движущей силе огия и о машинах, способных развивать эту силу , в к-ром впервые был дан анализ работы идеальной тепловой машины (см. Карно цикл). Т. обр., Т. как наука сформировалась в середине 19 в. В последующем важнейшими этапами в развитии Т. явились создание общей теории термодинамич. равновесия (Гиббс, 1875—78) и открытие третьего закона Т. (Нернст, 1906). Параллельно расширялись области применения термоди-намич. законов в различных областях науки и техники. [c.47]
Бакл [Bu kle, 1960] также обратил внимание на эти результаты. Он построил график зависимости температуры (в градусах Кельвина) зародышеобразования (по вертикальной оси) от температуры плавления Тм (также в градусах Кельвина по горизонтальной оси) для металлов, галогепидов щелочей и молекулярных соединений. Этот график дан на рис. III.8. Все точки хорошо ложатся на линию с наклоном 82%, что соответствует величине 100 ДГ .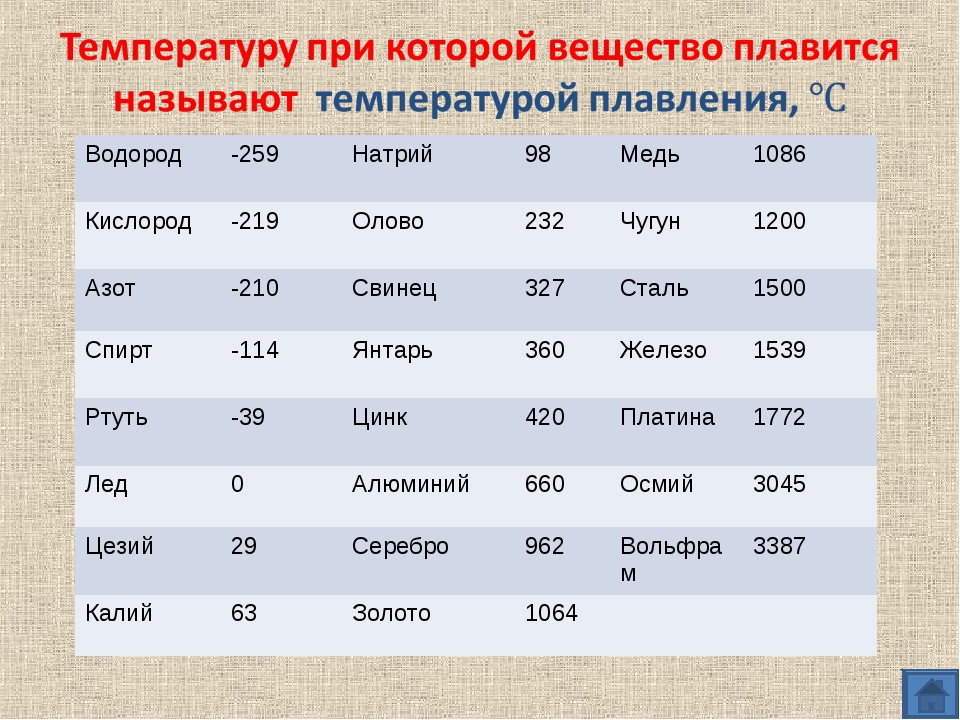 /Т м = 18%. Результат поразительный, причем он получен на 38 веществах. [c.94]
/Т м = 18%. Результат поразительный, причем он получен на 38 веществах. [c.94]
Точка плавления — Энциклопедия по машиностроению XXL
Скрытая теплота плавления при точке плавления 933 °К равна 2550 кал моль. [c.291]В атмосфере углекислоты медь неустойчива. Хлор, бром и йод при температурах ниже точек плавления их соединений с медью разрушают ее, а с повышением температуры скорость коррозии сильно возрастает. Медь можно применять в газообразных НС1 и lo при температурах ниже 225 и 260° С соответственно. Азот не действует на медь п ее сплавы, а окислы азота разрушают медные сплавы. Аммиак также вызывает окисление меди и ее сплавов. В условиях диссоциации аммиака наблюдается водородная коррозия меди. [c.255]
Цель данной книги — изложение основных принципов термометрии в интервале от 0,5 до приблизительно 3000 К. В течение последних 25 лет по этому вопросу накоплен весьма богатый опыт, и настало время объединить полученные результаты и обсудить достигнутые успехи.
 Большая часть работ последних лет относилась к низкотемпературной термометрии ниже приблизительно 30 К и их результаты послужили основой Предварительной температурной шкалы 1976 г. от 0,5 до 30 К. Таким образом, температура 0,5 К оказалась удобной нижней границей интервала температур, обсуждаемого в книге. Верхняя граница не обладает такой же определенностью, поскольку термометрия по излучению, рассматриваемая в гл. 7, может быть в принципе распространена на сколь угодно высокие температуры и достаточно лишь теплового равновесия в системе, температура которой измеряется. При всем разнообразии условий в термометрии, охватывающей интервал от температур жидкого гелия до точки плавления платины, общими являются требования теплового равновесия и теплового контакта с термометром. Эти требования неизменно присутствуют при всех термометрических работах и всех температурах на протяжении данной книги. Ясное понимание физических основ каждого из различных методов термометрии представляется обязательным для детального обсуждения их принципов, точности, интервала применения и ограничений.
Большая часть работ последних лет относилась к низкотемпературной термометрии ниже приблизительно 30 К и их результаты послужили основой Предварительной температурной шкалы 1976 г. от 0,5 до 30 К. Таким образом, температура 0,5 К оказалась удобной нижней границей интервала температур, обсуждаемого в книге. Верхняя граница не обладает такой же определенностью, поскольку термометрия по излучению, рассматриваемая в гл. 7, может быть в принципе распространена на сколь угодно высокие температуры и достаточно лишь теплового равновесия в системе, температура которой измеряется. При всем разнообразии условий в термометрии, охватывающей интервал от температур жидкого гелия до точки плавления платины, общими являются требования теплового равновесия и теплового контакта с термометром. Эти требования неизменно присутствуют при всех термометрических работах и всех температурах на протяжении данной книги. Ясное понимание физических основ каждого из различных методов термометрии представляется обязательным для детального обсуждения их принципов, точности, интервала применения и ограничений. По этой причине каждой из основных глав предпослано краткое изложение физических основ метода в той мере, в какой это требуется для теории и практики термометрии.
[c.9]
По этой причине каждой из основных глав предпослано краткое изложение физических основ метода в той мере, в какой это требуется для теории и практики термометрии.
[c.9]ТОЙ нержавеющей сталью, никеля или даже серебра в зависимости от особых требований и температурного интервала. Покрытая нержавеющей сталью медь особенно удобна до температур порядка 1050 °С (точка плавления меди 1084 °С). Покры- [c.143]
В отличие от фазовых переходов первого рода, таких, как точки плавления или кипения, при фазовых переходах второго рода отсутствует скрытая теплота перехода. Поэтому такие переходы используются лишь как индикатор определенной температуры, а не способ ее поддержания. При затвердевании чистых металлов, которое обсуждается ниже, образец металла будет оставаться при температуре затвердевания, хотя его окружение охлаждается. В случае сверхпроводящих переходов отсутствие скрытой теплоты перехода не создает серьезных проблем. Это объясняется тем, что при низких температурах легко обеспечить необходимую точность терморегулирования, а теплоемкости и теплопроводности материалов таковы, что неоднородности температуры в криостате и инерционность объектов регулирования не создают никаких затруднений. [c.168]
[c.168]
Интенсивное изучение методов и техники точной реализации точек плавления и затвердевания металлов было проведено авторами работ [47—50] и [52—56]. Предел воспроизводимости, достигнутый при реализации точек затвердевания металлов, определяется скорее совершенством термометров, используемых для фиксации переходов, чем самими металлами. Необходимость обеспечить достаточную глубину погружения термометра в среду с измеряемой температурой является сложной проблемой (см. гл. 5). В зависимости от конструкции термометра требуется его погружение в зону однородных температур в пределах от 10 до 20 см, чтобы чувствительный элемент в пределах 0,5 мК соответствовал температуре окружения. Поскольку разница АТ между температурой чувствительного элемента и температурой окружения экспоненциально уменьшается с глубиной погружения, нет больших различий в глубине погружения для точки таяния льда, точки затвердевания олова и даже золота.
 Увеличение глубины погружения для разных конструкций термометров на 1,5—3 см приводит к уменьшению АТ примерно в 10 раз. В точках затвердевания металлов обычно можно обеспечить достаточную глубину погружения, однако при измерении платиновым термометром сопротивления температур других объектов всегда важным ограничением является однородность их температур. Поэтому выше 500 °С платиновым термометром трудно измерить температуру тела с точностью лучше 50 мК. Отметим в этой связи эффективность применения тепловых трубок для увеличения области очень однородной температуры.
[c.169]
Увеличение глубины погружения для разных конструкций термометров на 1,5—3 см приводит к уменьшению АТ примерно в 10 раз. В точках затвердевания металлов обычно можно обеспечить достаточную глубину погружения, однако при измерении платиновым термометром сопротивления температур других объектов всегда важным ограничением является однородность их температур. Поэтому выше 500 °С платиновым термометром трудно измерить температуру тела с точностью лучше 50 мК. Отметим в этой связи эффективность применения тепловых трубок для увеличения области очень однородной температуры.
[c.169]Практическая реализация точек плавления и затвердевания металлов [c.173]
Платиновый термометр сопротивления является прибором, которому отдают предпочтение для наиболее точного измерения температуры в диапазоне от тройной точки водорода (13,81 К) до точки плавления сурьмы (903,89 К). К достоинствам платины как материала для термометров можно отнести ее химическую инертность вплоть до высоких температур, высокую температуру плавления, высокое удельное сопротивление ( 10 мкОм-см при комнатной температуре), а также легкость изготовления из платины высокочистой тонкой проволоки. Од-
[c.200]
Од-
[c.200]
Максимальная температура, до которой могут применяться термопары типов S я R, ограничена точкой плавления платинового электрода 1769°С. Однако верхняя граница использования лежит, как правило, значительно ниже, поскольку платиновый электрод становится чрезвычайно мягким выше 1600°С- Как и [c.280]
Эти термопары имеют более высокую термо-э.д.с. по сравнению с термопарами, описанными выше. Однако ими нельзя пользоваться при столь же высоких температурах в связи с более низкой точкой плавления электродов и быстрой порчей при окислении. В промышленности чаще всего применяются стандартизованные термопары типов Е, I, К п Т, которые изготавливаются во множестве вариантов в зависимости от условий их применения. Подробные сведения о рекомендуемых диаметрах проволок, материалах изоляции и чехлов и других требованиях, связанных с особенностями эксплуатации, содержатся в национальных стандартах (см., например, [2]) приведенное ниже краткое описание свойств термопар из неблагородных металлов может быть дополнено, например, сведениями из работы [40] и других источников.
[c.287]
Подробные сведения о рекомендуемых диаметрах проволок, материалах изоляции и чехлов и других требованиях, связанных с особенностями эксплуатации, содержатся в национальных стандартах (см., например, [2]) приведенное ниже краткое описание свойств термопар из неблагородных металлов может быть дополнено, например, сведениями из работы [40] и других источников.
[c.287]
Для градуировки термопар типов 8, R и В в температурном интервале выше 1100°С удобен, а при соблюдении ряда предосторожностей и надежен метод плавящейся проволоки. Принцип метода состоит в том, что небольшой кусочек проволоки из зо.лота, палладия или платины вставляется между двумя электродами термопары, как показано на рис. 6.17. Когда температура печи проходит через точку плавления проволоки, э.д. с. термопары перестает меняться, а затем исчезает в результате разрыва цепи. Одновременно измеряется э.д.с. конт- [c.
 302]
302]Средняя температура капель электродного металла, поступающих в ванну, увеличивается с увеличением плотности тока и составляет при сварке сталей от 2200 до 2700 С, т. е. характеризуется значительным перегревом. Температура сварочной ванны при дуговой сварке также характеризуется значительным превышением над точкой плавления, перегрев составляет 100—500° С. Высокая температура способствует высокой скорости протекания реакций, однако из-за больших скоростей охлаждения реакции при сварке обычно не успевают завершиться полностью. [c.26]
Ферритные стали названы так по ферритной фазе — относительно чистому железу, которое является компонентом углеродистых сталей, медленно охлаждаемых из аустенитной области температур. Феррит или так называемая а-фаза чистого железа устойчив при температуре ниже 910 °С. В малоуглеродистых сплавах Сг—Fe высокотемпературный аустенит (или v-фаза) существует только, если он содержит до 12 % Сг. При увеличении содержания хрома выше 12 % сплавы представляют собой ферритную фазу во всем интервале температур вплоть до точки плавления. Они умеренно упрочняются при холодной обработке
[c.296]
Они умеренно упрочняются при холодной обработке
[c.296]
Легкость скольжения коньков по льду. Известно, что точка плавления льда с повышением давления понижается. Основываясь на этой закономерности, скользкость льда, т. е. легкость скольжения коньков по льду, объясняют следующим образом под давлением острого конька лед плавится при температуре ниже 0° С, образуя жидкую смазку, которая и обеспечивает легкость катания по льду зимой. [c.167]
Поскольку при переходе жидкости в пар теплота сообщается (Х>0) и объем всегда увеличивается v >v ), то, следовательно, dT/dp>(), т. е, температура кипения при увеличении давления всегда повышается. Точка же плавления при увеличении давления или повышается, или понижается, смотря по тому, увеличивается или уменьшается объем при плавлении. У большинства тел при плавлении v»>v, поэтому у таких тел, как и в случае кипения, dT/dp>0. Однако у воды, чугуна, висмута, германия и таллия объем при плавлении твердой фазы уменьшается (жидкая фаза в этих случаях тяжелее твердой), поэтому для них dT/dp[c. 236]
236]
Точка плавления йода I2 равна 114 °С. Возрастание упругости пара вблизи температуры плавления при увеличении температуры плавления на Г С равно 578,6 Па/К. Найти теплоту возгонки йода при температуре плавления упругость пара твердого иода при этой температуре равна 11821 Па. [c.254]
Существенный прогресс последних лет в эталонной термометрии связан с созданием герметичных ячеек с чистыми газами для воспроизведения температур их тройных точек. Осуществленное по разработанной ККТ программе международное сличение транспортируемых герметичных ячеек разных лабораторий, в том числе ВНИИФТРИ, показало, что их воспроизводимость по крайней мере в несколько раз лучше, чем на традиционной стационарной аппаратуре. Поэтому естественна современная тенденция положить в основу будущей МПТШ в качестве реперных температур только тройные точки в ее низкотемпературной части и точки затвердевания металлов при температурах выше 0° С. Отметим в этой связи превосходные метрологические характеристики точки галлия. В низкотемпературной части МПТШ эта программа, обеспечивающая повышение воспроизводимости будущей шкалы в несколько раз, может быть, без сомнения, реализована вплоть до 24 К, особенно при добавлении к традиционным тройным точкам МПТШ-68 тройной точки вблизи 150 К и точки плавления галлия.
[c.7]
Отметим в этой связи превосходные метрологические характеристики точки галлия. В низкотемпературной части МПТШ эта программа, обеспечивающая повышение воспроизводимости будущей шкалы в несколько раз, может быть, без сомнения, реализована вплоть до 24 К, особенно при добавлении к традиционным тройным точкам МПТШ-68 тройной точки вблизи 150 К и точки плавления галлия.
[c.7]В 1889 г. 1-я ГКМВ утвердила принятую МКМВ в 1887 г. шкалу водородного газового термометра постоянного объема, основанную на реперных точках плавления льда (О °С) и кипения воды (100 °С) и получившую название нормальной водородной шкалы в качестве международной практической шкалы. В описании шкалы указывалось начальное давление заполнения (1 м рт. ст. при о °С) и никаких поправок на отклонение свойств водорода от идеального газа не вводилось. По этой. причине шкала была названа практической . Она, очевидно, и не была термодинамической, поскольку наблюдалась зависимость результатов измерений от свойств рабочего газа. В гл. 3 будет подробно рассмотрено, каким образом отклонения от свойств идеального газа учитываются в газовой термометрии. Здесь же следует подчеркнуть, что для газового термометра постоянного объема, калиброванного в двух точках и примененного для интерполяции между ними, как это сделал Шаппюи, погрешности, вызванные неидеальностью газа, скажутся лишь в меру изменения самой неидеальности между реперными точками. Для водорода эти изменения от О до 100 °С неве-
[c.39]
В гл. 3 будет подробно рассмотрено, каким образом отклонения от свойств идеального газа учитываются в газовой термометрии. Здесь же следует подчеркнуть, что для газового термометра постоянного объема, калиброванного в двух точках и примененного для интерполяции между ними, как это сделал Шаппюи, погрешности, вызванные неидеальностью газа, скажутся лишь в меру изменения самой неидеальности между реперными точками. Для водорода эти изменения от О до 100 °С неве-
[c.39]
Это затруднение было преодолено в ревизии температурной шкалы 1968 г., когда единица температуры по практической и термодинамической шкалам была одинаково определена равной 1/273,16 части термодинамической температуры тройной точки воды. Единица получила название кельвин вместо градус Кельвина и обозначение К вместо °К. При таком определении единицы интервал температур между точкой плавления льда и точкой кипения воды может изменять свое значение по результатам более совершенных измерений термодинамической температуры точки кипения. В температурной шкале 1968 г. значение температуры кипения воды было принято точно 100 °С, поскольку не имелось никаких указаний на ошибочность этого значения. Однако новые измерения с газовым термометром и оптическим пирометром, выполненные после 1968 г., показали, что следует предпочесть значение 99,975 °С (см. гл. 3). Тот факт, что новые первичные измерения, опираюшиеся на значение температуры 273,16 К для тройной точки воды, дают значение 99,975 °С для точки кипения воды, означает, что ранние работы с газовым термометром, градуированным в интервале 0°С и 100°С между точкой плавления льда и точкой кипения воды, дали ошибочное значение —273,15 °С для абсолютного нуля температуры. Исправленное значение составляет —273,22 °С.
[c.50]
В температурной шкале 1968 г. значение температуры кипения воды было принято точно 100 °С, поскольку не имелось никаких указаний на ошибочность этого значения. Однако новые измерения с газовым термометром и оптическим пирометром, выполненные после 1968 г., показали, что следует предпочесть значение 99,975 °С (см. гл. 3). Тот факт, что новые первичные измерения, опираюшиеся на значение температуры 273,16 К для тройной точки воды, дают значение 99,975 °С для точки кипения воды, означает, что ранние работы с газовым термометром, градуированным в интервале 0°С и 100°С между точкой плавления льда и точкой кипения воды, дали ошибочное значение —273,15 °С для абсолютного нуля температуры. Исправленное значение составляет —273,22 °С.
[c.50]
Влияние примесей на точку плавления и на давление паро было изучено и оказалось небольшим. Частично это связано с тем, что немногие из часто встречающихся примесей попадаюг в камеру с образцом.
 Например газы, имеющие точки кипения выще азотных температур, конденсируются в области, далекой от области жидкого водорода. Наиболее вероятные примеси —
[c.155]
Например газы, имеющие точки кипения выще азотных температур, конденсируются в области, далекой от области жидкого водорода. Наиболее вероятные примеси —
[c.155]| Рис. 4.14. Влияние на точку плавления водорода различных количеств катализатора, расположенного различным образом А — катализатор отсутствует В — 0,78 г катализатора в камере-конверсии С — 0,072 г катализатора в камере конверсии Д],. >2 — 0,147 г катализатора в паровой фазе Е — 0,147 г катализатора в паровой фазе на границе с конденсированным образцом Е—-1 г катализатора на дне камеры с образцом означает повторное замораживание образца, — испарение и затем замораживание [4]. |
 Диаграмма на рис. 4.23, а составлена для растворенного вещества В, которое понижает точку плавления вещества А. Заметим, что обе температуры Ту н Тз лежат ниже точки плавления чистого металла А. При охлаждении сплава состава Ву из области жидкости и при условии, что переохлаждение отсутствует, зарождение твердой фазы начинается при температуре Гь Твердая фаза, появившаяся при этой температуре, имеет состав б] и оставляет жидкость состава Ьу. При дальнейшем охлаждении осаждается большее количество твердой фазы, имеющей состав, который изменяется вдоль линии солидуса. Состав оставшейся жидкости изменяется по линии ликвидуса. При температуре Т твердая фаза имеет состав бз, жидкая — Ьз, а при температуре Тз твердая фаза состава бз находится в равновесии с жидкостью состава бз. До сих пор считалось, что скорость охлаждения бесконечно мала, так что всегда поддерживается равновесный состав. Другими словами, твердая фаза состава б], появившаяся первой, успела диффузионно перейти в состав бз, пока температура падала до Тз.
Диаграмма на рис. 4.23, а составлена для растворенного вещества В, которое понижает точку плавления вещества А. Заметим, что обе температуры Ту н Тз лежат ниже точки плавления чистого металла А. При охлаждении сплава состава Ву из области жидкости и при условии, что переохлаждение отсутствует, зарождение твердой фазы начинается при температуре Гь Твердая фаза, появившаяся при этой температуре, имеет состав б] и оставляет жидкость состава Ьу. При дальнейшем охлаждении осаждается большее количество твердой фазы, имеющей состав, который изменяется вдоль линии солидуса. Состав оставшейся жидкости изменяется по линии ликвидуса. При температуре Т твердая фаза имеет состав бз, жидкая — Ьз, а при температуре Тз твердая фаза состава бз находится в равновесии с жидкостью состава бз. До сих пор считалось, что скорость охлаждения бесконечно мала, так что всегда поддерживается равновесный состав. Другими словами, твердая фаза состава б], появившаяся первой, успела диффузионно перейти в состав бз, пока температура падала до Тз. Поскольку диффузия в твердом состоянии всегда медленна, а скорость охлаждения не может быть бесконечно мала, концентрационное равновесие никогда не достигается, в результате чего при температуре ниже Тз состав твердой фазы оказывается между 61 и 63, а жидкость с избытком В не затвердеет окончательно, пока температура не достигнет Т .
[c.170]
Поскольку диффузия в твердом состоянии всегда медленна, а скорость охлаждения не может быть бесконечно мала, концентрационное равновесие никогда не достигается, в результате чего при температуре ниже Тз состав твердой фазы оказывается между 61 и 63, а жидкость с избытком В не затвердеет окончательно, пока температура не достигнет Т .
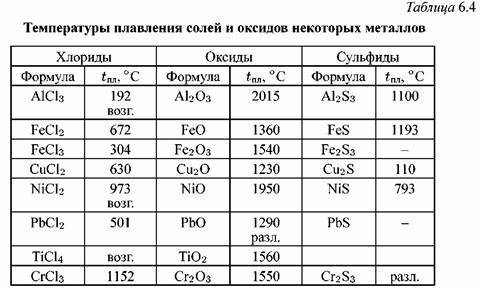
[c.170]Сведения о влиянии различных примесей на точки плавления и затвердевания упоминавщихся выше металлов можно найти в работах по фазовым диаграммам бинарных сплавов [32, 71]. Этими фазовыми диаграммами для очень малых концентраций следует пользоваться с осторожностью, поскольку экспериментальные сведения для сильно разбавленных твердых растворов ненадежны [26]. Солидус и ликвидус обычно просто экстраполируются до пересечения в точке плавления основного компонента. Этот наклон может оказаться ошибочным, если ближайшие экспериментальные точки получены при концентрации дополнительного компонента, равной, например, 5%-
[c. 173]
173]
При измерении высоких температур термометрами сопротивления существенными становятся также радиационные тепловые потери вдоль термометра. Для термометров, имеющих кварцевый кожух, световодный эффект (многократное отражение внутри стенок кожуха) приводит к погрешности до 80 мК при 600 °С [22]. К счастью, тепловые потери за счет внутренних отражений легко ослабить, обработав пескоструйным аппаратом внешнюю поверхность кожуха или зачернив ее, например, аквадагом на длину в несколько сантиметров сразу за чувствительным элементом (см. рис. 5.13). Этот прием теперь используется при изготовлении всех стержневых термометров, включая и термометры в стеклянном кожухе, предназначенные для использования выше точки плавления олова (-230 С). [c.213]
Взаимодействие кислорода с чистой поверхностью металла протекает в три этапа I) адсорбция кислорода, 2) иуклеация, т. е. образование зародышей, 3) рост сплошной оксидной пленки. На первых стадиях адсорбции пленка состоит из атомов кислорода, так как свободная энергия адсорбции атомов кислорода превышает свободную энергию диссоциации его молекул. Методом дифракции медленных электронов удалось установить, что атомы некоторых металлов входят в состав адсорбционной пленки и образуют относительно стабильную двухмерную структуру из ионов кислорода (отрицательно заряженных) и металла (положительно заряженных). Как уже говорилось в отношении пассивирующей пленки (разд. 5.5), адсорбционная пленка, составляющая доли монослоя, термодинамически более стабильна, чем оксид металла. На никеле, например, она сохраняется вплоть до точки плавления никеля [1 ], тогда как NiO разрушается вследствие растворения кислорода в металле . Дальнейшая выдержка при низком давлении кислорода ведет к адсорбции на металле молекул Оа, проникающих сквозь первичный адсорбционный слой. Так как второй слой кислорода связан менее прочно, чем первый, он адсорбируется не диссоциируя. Возникающая в результате структура более стабильна на переходных, чем на непереходных металлах [2]. Любые дополнительные слои адсорбированного кислорода связаны еще слабее, и наружные слои становятся подвижными при повышенных температурах, о чем свидетельствуют рентгенограммы, отвечающие аморфной структуре.
Методом дифракции медленных электронов удалось установить, что атомы некоторых металлов входят в состав адсорбционной пленки и образуют относительно стабильную двухмерную структуру из ионов кислорода (отрицательно заряженных) и металла (положительно заряженных). Как уже говорилось в отношении пассивирующей пленки (разд. 5.5), адсорбционная пленка, составляющая доли монослоя, термодинамически более стабильна, чем оксид металла. На никеле, например, она сохраняется вплоть до точки плавления никеля [1 ], тогда как NiO разрушается вследствие растворения кислорода в металле . Дальнейшая выдержка при низком давлении кислорода ведет к адсорбции на металле молекул Оа, проникающих сквозь первичный адсорбционный слой. Так как второй слой кислорода связан менее прочно, чем первый, он адсорбируется не диссоциируя. Возникающая в результате структура более стабильна на переходных, чем на непереходных металлах [2]. Любые дополнительные слои адсорбированного кислорода связаны еще слабее, и наружные слои становятся подвижными при повышенных температурах, о чем свидетельствуют рентгенограммы, отвечающие аморфной структуре. Вероятно, ионы металла входят в многослойную адсорбционную пленку в нестехиометрических количествах и к тому же относительно подвижны. Например, обнаружено, что скорость поверхностной диффузии атомов серебра и меди выше в присутствии адсорбированного кислорода, чем в его отсутствие [3].
[c.189]
Вероятно, ионы металла входят в многослойную адсорбционную пленку в нестехиометрических количествах и к тому же относительно подвижны. Например, обнаружено, что скорость поверхностной диффузии атомов серебра и меди выше в присутствии адсорбированного кислорода, чем в его отсутствие [3].
[c.189]
Эвтектическая смесь оксидов еще больше снижает температуру плавления. Если в нефти, содержащей ванадий, присутствуют соединения серы или натрия, то благодаря катализирующему влиянию V2O5 на реакцию окисления SO в SO3 образуется содержащая N82804 и различные оксиды окалина, температура плавления которой всего 500 °С. Положительное действие оказывает добавление в нефть кальциевых и магниевых мыл, порошкообразного доломита или магния — они повышают температуру плавления золы вследствие образования СаО (Катастрофического окисления можно также избежать, работая при температурах ниже точки плавления оксидов. Сплавы, содержащие большое количество никеля, устойчивее вследствие высокой температуры плавления NiO (1990 °С). [c.201]
[c.201]
Циркон имеет повышенную огнеупорность точка плавления промышленных сортов циркона составляет 2200°С. Это намного выше, чем встречающиеся на практике температуры в самых напряженных горячих узлах отливок. Это свойство важно для производства точных отливок с гладкой поверхностью (Ra = 1,6 -80 мкм), т.е. отсутствует шероховатость поверхности iyiy6oKHx карманов отливок. Дисперсность составляет 7000 — 8000 см 7г. [c.208]
Так, например, следует учитывать тепловое расширение металла [83, 84] ). Вызывающая его ангармоничность колебаний решетки должна приводить к нелинейности температурной зависимости удельного сопротивления [85]. Кроме того, полагают, что, начиная с температуры, лежаш ей на 50—100° ниже точки плавления металла, концентрация дефектов решетки, вызванных тепловым движением, быстро растет последнее также должно оказывать существенное влияние на температурный ход сопротивления [86, 87].
 Наконец, у переходных металлов рассеяние, обусловленное переходами между s-и б -зонами, тоже может вносить свой вклад в сопротивление [88—91]. Чтобы учесть отклонения температурно зависимости сопротивления от линейности, появляющиеся по той или иной причине при высоких температурах, Грюнейзен ввел в теоретическую формулу эмпирический множитель -fb, Г ), вследствие которого достоверность данных, приведенных в табл. 4, несколько уменьшается.
[c.192]
Наконец, у переходных металлов рассеяние, обусловленное переходами между s-и б -зонами, тоже может вносить свой вклад в сопротивление [88—91]. Чтобы учесть отклонения температурно зависимости сопротивления от линейности, появляющиеся по той или иной причине при высоких температурах, Грюнейзен ввел в теоретическую формулу эмпирический множитель -fb, Г ), вследствие которого достоверность данных, приведенных в табл. 4, несколько уменьшается.
[c.192]Выясним, почему в качестве реперной точки выбрана тройная точка воды, а не точка кипения воды, как это, например, сделано при построении шкалы Цельсия, или не точка плавления льда, как это сделано в темнератур1юй шкале Реомюра. [c.89]
Стекло представляет собой типичный пример так называемого аморфного состояния вещества, которое в отличие от кристаллического характеризуется двумя признаками — изотропностью свойств и отсутствием точки плавления. Аморфные тела встречаются обычно в виде двух форм — компактной и дисперсной. Представителем компактной формы является стеклообразное состояние, дисперсной — сажа, аморфные-бор и кремний. Для аморфного состояния характерен только ближний порядок расположения структурных единиц. Дальний порядок, свойственный кристаллам, отсутствует. Компактное аморфное состояние представляет собой сильно перео.хлажденную жидкость и отличается от последней только отсутствием подвижного обмена местами между отдельными структурными ассоциатами, что обусловлено высокой вязкостью. В дисперсном аморфном состоянии (тонкий порошок, состоящий из агрегатов, не имеющих упорядоченного строения) химическое взаимодействие отсутствует. Обе формы аморфного состояния вещества в термодинамическом отношении метастабильны и при благоприятных условиях способны кристаллизоваться с выделением тепла.
[c.13]
Представителем компактной формы является стеклообразное состояние, дисперсной — сажа, аморфные-бор и кремний. Для аморфного состояния характерен только ближний порядок расположения структурных единиц. Дальний порядок, свойственный кристаллам, отсутствует. Компактное аморфное состояние представляет собой сильно перео.хлажденную жидкость и отличается от последней только отсутствием подвижного обмена местами между отдельными структурными ассоциатами, что обусловлено высокой вязкостью. В дисперсном аморфном состоянии (тонкий порошок, состоящий из агрегатов, не имеющих упорядоченного строения) химическое взаимодействие отсутствует. Обе формы аморфного состояния вещества в термодинамическом отношении метастабильны и при благоприятных условиях способны кристаллизоваться с выделением тепла.
[c.13]
Способ получения прессованных изделий и порошок на основе железа, содержащий смазочное вещество
Область техники
Данное изобретение касается смазочных веществ для композиций из металлургических порошков (ПМ). Конкретно, данное изобретение касается композиций из порошка железа или на основе железа, включающих жидкие смазочные вещества.
Конкретно, данное изобретение касается композиций из порошка железа или на основе железа, включающих жидкие смазочные вещества.
Уровень техники
В промышленности использование металлических изделий, получаемых путем прессования и спекания композиций из металлических порошков, находит все более широкое применение. Изготавливают ряд различных изделий, имеющих разнообразные формы и толщину, при этом предъявляются различные требования к качеству получаемых изделий в зависимости от их конечного использования. С целью удовлетворения различных требований в области порошковой металлургии был разработан широкий спектр композиций из порошка железа или на основе железа.
Один из способов обработки для получения деталей из таких порошковых композиций включает загрузку порошковой композиции в полость матрицы и ее прессование под высоким давлением. Полученную неспеченную деталь затем удаляют из полости матрицы. Во избежание излишнего износа полости матрицы во время процесса прессования обычно используют смазочные вещества. Смазывание обычно осуществляют, смешивая твердые частицы смазочного порошка с порошком на основе железа (внутренняя смазка) либо распыляя жидкую дисперсию или раствор смазочного вещества на поверхность полости матрицы (внешняя смазка). В некоторых случаях используют оба способа смазывания.
Смазывание обычно осуществляют, смешивая твердые частицы смазочного порошка с порошком на основе железа (внутренняя смазка) либо распыляя жидкую дисперсию или раствор смазочного вещества на поверхность полости матрицы (внешняя смазка). В некоторых случаях используют оба способа смазывания.
Смазывание путем подмешивания твердого смазочного вещества в порошковую композицию на основе железа широко используется, поэтому постоянно разрабатываются новые твердые смазочные вещества. Такие твердые смазочные вещества обычно имеют плотность около 1-2 г/см3, которая является очень низкой по сравнению с плотностью порошка на основе железа, составляющей около 7-8 г/см3. Кроме того, на практике твердые смазывающие вещества должны быть использованы в количествах, составляющих по меньшей мере 0,6 мас.% от порошковой композиции. В результате включение таких менее плотных смазочных веществ в композицию понижает плотность до спекания прессованной детали.
Жидкие смазочные вещества в сочетании с порошками железа для получения прессованных деталей описаны в патенте США 3728110. Согласно данному патенту смазочное вещество должно быть использовано в сочетании с гелем из пористых частиц оксида. Более того, примеры данного патента также иллюстрируют использование известного твердого смазывающего вещества (стеарата цинка). Подвергнутый испытанию порошок железа представляет собой электролитический порошок размером менее 80 меш (номер сита согласно стандарту США). Патент США 4002474 также касается жидких смазочных веществ. Согласно данному патенту используются дискретные, разрушающиеся под давлением микрокапсулы. Микрокапсулы включают ядро и твердую оболочку, окружающую ядро и включающую органическое жидкое смазывающее вещество. Согласно системе для смазывания, описанной в патенте США 6679935, смазывающее вещество, которое является твердым в условиях окружающей среды, плавится под давлением во время прессования металлических деталей, при этом система для смазывания образует жидкую фазу вдоль стенок полости, в которой прессуется порошок. Однако в современной технологии ПМ жидкие смазывающие вещества per se не имели успеха.
Согласно данному патенту смазочное вещество должно быть использовано в сочетании с гелем из пористых частиц оксида. Более того, примеры данного патента также иллюстрируют использование известного твердого смазывающего вещества (стеарата цинка). Подвергнутый испытанию порошок железа представляет собой электролитический порошок размером менее 80 меш (номер сита согласно стандарту США). Патент США 4002474 также касается жидких смазочных веществ. Согласно данному патенту используются дискретные, разрушающиеся под давлением микрокапсулы. Микрокапсулы включают ядро и твердую оболочку, окружающую ядро и включающую органическое жидкое смазывающее вещество. Согласно системе для смазывания, описанной в патенте США 6679935, смазывающее вещество, которое является твердым в условиях окружающей среды, плавится под давлением во время прессования металлических деталей, при этом система для смазывания образует жидкую фазу вдоль стенок полости, в которой прессуется порошок. Однако в современной технологии ПМ жидкие смазывающие вещества per se не имели успеха.
Было неожиданно обнаружено, что в результате соединения определенного вида порошков железа или порошков на основе железа с конкретным видом жидких органических веществ в качестве смазочных материалов могут быть получены прессованные изделия, имеющие не только высокую плотность, но и, как было установлено, такие прессованные изделия могут быть вытолкнуты из матриц со сравнительно небольшими усилиями. Более того, оказалось, что такие смазывающие вещества эффективно предотвращают износ стенок матрицы, при этом поверхности прессованных деталей не имеют недостатков. В отличие от патента США 3728110 отсутствует необходимость использования геля из пористых частиц оксида.
Сущность изобретения
Вкратце данное изобретение касается способа получения прессованных и спеченных деталей с использованием жидкого смазочного вещества. Данное изобретение также касается порошковой композиции, включающей железо или порошок на основе железа, необязательные легирующие элементы и жидкое органическое смазочное вещество.
Подробное описание изобретения
Виды порошков
Подходящие металлические порошки, которые могут быть использованы в качестве исходных материалов для процесса прессования, представляют собой порошки, полученные из металлов, таких как железо. Легирующие элементы, такие как углерод, хром, марганец, молибден, медь, никель, фосфор, сера и т.д., могут быть добавлены в виде частиц, подвергнутых предварительному или диффузионному легированию с целью модификации свойств продукта окончательного спекания. Порошки на основе железа могут быть выбраны из группы, состоящей из по существу чистых порошков из железа, подвергнутых диффузному легированию частиц на основе железа, а также смеси частиц железа или частиц на основе железа и легирующих элементов. Что касается формы частиц, она предпочтительно является неправильной, получаемой путем распыления воды. Интерес могут также представлять губчатые железные порошки с частицами неправильной формы.
Что касается деталей ПМ для имеющих высокий спрос видов применения, особенно многообещающие результаты были получены при использовании предварительно легированных, полученных распылением воды порошком, включающих небольшое количество одного или более таких легирующих элементов, как Мо и Cr.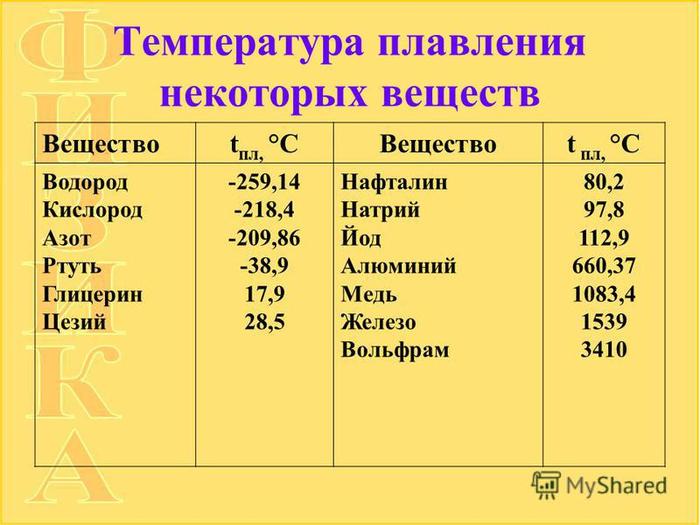 Примерами таких порошков служат порошки, имеющие химический состав, соответствующий химическому составу Astaloy Мо (1,5% Мо) и Astaloy 85 Мо (0,85% Мо), а также Astaloy CrM (3 Cr, 0,5 Мо) и Astaloy CrL (1,5 Cr, 0,2 Мо) от Нäganäs AB, Sweden.
Примерами таких порошков служат порошки, имеющие химический состав, соответствующий химическому составу Astaloy Мо (1,5% Мо) и Astaloy 85 Мо (0,85% Мо), а также Astaloy CrM (3 Cr, 0,5 Мо) и Astaloy CrL (1,5 Cr, 0,2 Мо) от Нäganäs AB, Sweden.
Критическим признаком данного изобретения является то, что порошок состоит из крупных частиц, т.е. порошок по существу не имеет мелких частиц. Фраза «по существу не имеет мелких частиц» означает, что менее приблизительно 10%, предпочтительно — менее приблизительно 5% частиц порошка имеют размер менее 45 мкм, измеряемый способом, описанным в SS-EN 24497. Средний диаметр частиц обычно составляет от 75 до 300 мкм, а количество частиц, имеющих размер более 212 мкм, обычно составляет более 20%. Максимальный размер частиц может составлять около 2 мм.
Размер частиц на основе железа, обычно используемых в области ПМ, распределен согласно кривой гауссова распределения со средним диаметром частиц в районе до 100 мкм, при этом около 10-30% частиц имеют размер менее 45 мкм.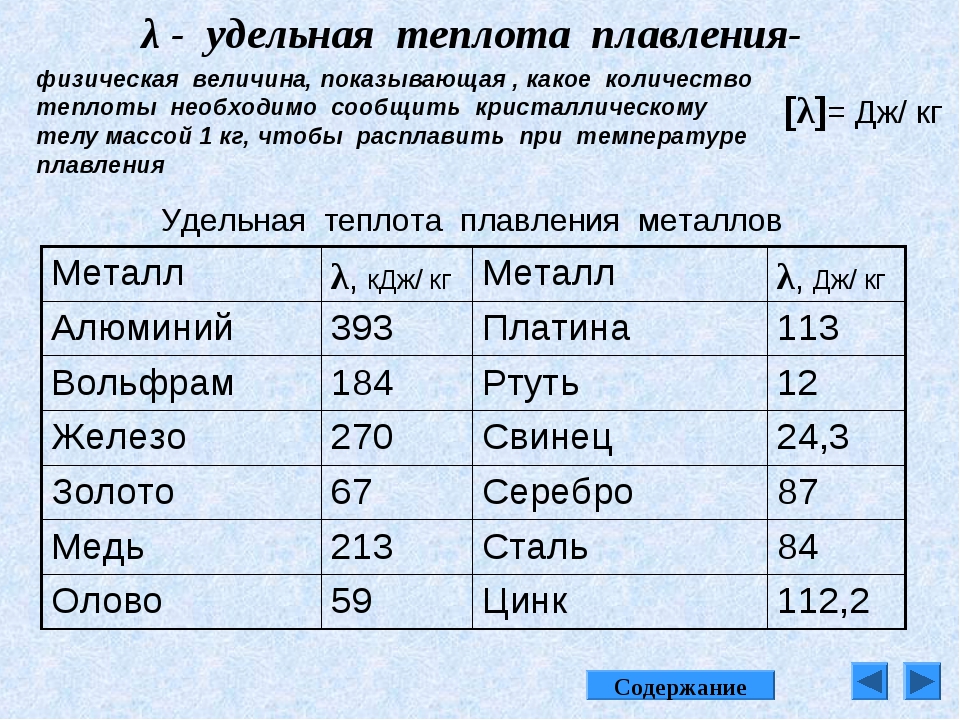 Таким образом, порошки, используемые согласно настоящему изобретению, имеют гранулометрический состав, отличный от обычно используемого состава. Такие порошки могут быть получены путем удаления более мелких фракций порошка либо путем получения порошка, имеющего желаемый гранулометрический состав.
Таким образом, порошки, используемые согласно настоящему изобретению, имеют гранулометрический состав, отличный от обычно используемого состава. Такие порошки могут быть получены путем удаления более мелких фракций порошка либо путем получения порошка, имеющего желаемый гранулометрический состав.
Таким образом, подходящий гранулометрический состав вышеупомянутых порошков, имеющих химический состав, соответствующий химическому составу Astaloy 85, может быть таким, при котором максимально 5% частиц имеют размер менее 45 мкм, а средний диаметр частиц обычно составляет от 106 до 300 мкм. Соответствующие подходящие величины для порошка, имеющего химический состав, соответствующий Astaloy CrL, являются такими, при которых менее 5% частиц имеют размер менее 45 мкм, а средний диаметр частиц обычно составляет от 106 до 212 мкм.
Смазывающее вещество
Смазывающее вещество согласно настоящему изобретению отличается тем, что оно является жидким при температуре окружающей среды, т. е. температура плавления кристаллов должна составлять менее 25°С.
е. температура плавления кристаллов должна составлять менее 25°С.
Кроме того, вязкость (η) при 40°С должна составлять более 15 мПА·с в зависимости от температуры согласно следующей формуле:
10 log η=k/T+С,
где угловой коэффициент k предпочтительно более 800;
Т означает температуру по шкале Кельвина;
С является постоянной.
Виды веществ, удовлетворяющие вышеперечисленным критериям, представляют собой невысыхающие масла, такие как различные минеральные масла, жирные кислоты растительного или животного происхождения, такие как олеиновая кислота, а также жидкие вещества, такие как полиалкиленгликоли, например, ПЭГ 400. Такие смазочные масла могут быть использованы в сочетании с определенными добавками, такими как реологические модификаторы, противозадирные добавки, добавки против холодной сварки, ингибиторы окисления и ингибиторы коррозии.
Подходящее для смазывания количество силанового соединения описанного в WO 2004/037467 типа также может быть включено в порошковую смесь. Конкретно силановое соединение может представлять собой алкилалкокси- или полиэфиралкоксисилан, в котором алкилгруппа алкилалкоксисилана и полиэфирная цепь полиэфиралкоксисилана содержат от 8 до 30 атомов углерода, а алкоксигруппа содержит 1-3 атома углерода. Примерами таких соединений являются октил-три-метоксисилан, гексадецил-три-метоксисилан и полиэтиленэфир-триметоксисилан с 10 этиленэфирными группами.
Конкретно силановое соединение может представлять собой алкилалкокси- или полиэфиралкоксисилан, в котором алкилгруппа алкилалкоксисилана и полиэфирная цепь полиэфиралкоксисилана содержат от 8 до 30 атомов углерода, а алкоксигруппа содержит 1-3 атома углерода. Примерами таких соединений являются октил-три-метоксисилан, гексадецил-три-метоксисилан и полиэтиленэфир-триметоксисилан с 10 этиленэфирными группами.
Смазывающее вещество может составлять от 0,04 до 0,4 мас.% металлопорошковой композиции согласно данному изобретению. Количество смазывающего вещества предпочтительно составляет от 0,1 до 0,3 мас.%, а наиболее предпочтительно — от 0,1 до 0,25 мас.%. Возможность использования очень небольших количеств смазочного вещества согласно настоящему изобретению является особенно выгодной, поскольку она позволяет получать прессовки и спеченные изделия с высокой плотностью, особенно при отсутствии необходимости соединения таких смазочных веществ с твердым смазочным веществом.
Химически жидкое смазочное вещество, используемое согласно настоящему изобретению, может быть более или менее идентично органическим веществам или предложено в качестве связующих в композициях из железа или на основе железа. Однако в таких случаях композиции включают твердое смазочное вещество.
Однако в таких случаях композиции включают твердое смазочное вещество.
Для получения спеченных металлических деталей, имеющих удовлетворительные механические свойства после спекания, согласно настоящему изобретению может возникнуть необходимость добавления графита к прессуемой порошковой смеси. Таким образом, графит в количествах 0,1-1, предпочтительно 0,2-1,0, более предпочтительно 0,2-0,7 и наиболее предпочтительно 0,2-0,5 мас.% от общей массы прессуемой смеси может быть добавлен перед прессованием. Однако при некоторых видах использования добавление графита является необязательным.
Прессование
Общепринятое прессование при высоком давлении, т.е. свыше приблизительно 600 МПа, обычно используемых порошков, включающих более мелкие частицы, в смеси с небольшим количеством смазывающих веществ (менее 0,6 мас.%) обычно считается неподходящим из-за слишком больших усилий, необходимых для выталкивания прессовок из матрицы, сопутствующего сильного износа матрицы и того, что поверхности деталей становятся менее блестящими или ухудшаются. При использовании порошков и жидких смазывающих веществ согласно настоящему изобретению было неожиданно обнаружено, что усилие выталкивания снижается при высоком давлении, выше приблизительно 800 МПа, и что детали, имеющие приемлемые или даже безупречные поверхности могут быть также получены при отсутствии смазывания стенок матрицы. Прессование может быть осуществлено при помощи стандартного оборудования, что означает, что новый способ может быть осуществлен без высоких затрат. Прессование осуществляют одноосно, за одну стадию при температуре окружающей среды или повышенной температуре. Для реализации преимуществ настоящего изобретения прессование должно предпочтительно продолжаться до получения плотности свыше 7,45 г/см3.
При использовании порошков и жидких смазывающих веществ согласно настоящему изобретению было неожиданно обнаружено, что усилие выталкивания снижается при высоком давлении, выше приблизительно 800 МПа, и что детали, имеющие приемлемые или даже безупречные поверхности могут быть также получены при отсутствии смазывания стенок матрицы. Прессование может быть осуществлено при помощи стандартного оборудования, что означает, что новый способ может быть осуществлен без высоких затрат. Прессование осуществляют одноосно, за одну стадию при температуре окружающей среды или повышенной температуре. Для реализации преимуществ настоящего изобретения прессование должно предпочтительно продолжаться до получения плотности свыше 7,45 г/см3.
Далее данное изобретение проиллюстрировано следующими неограничивающими примерами.
В качестве жидких смазывающих веществ были использованы вещества, перечисленные в таблице 1.
|
В таблице 2 представлена вязкость при различных температурах жидких используемых смазочных веществ.
|
В таблице 3 показана зависимость температуры от вязкости.
|
Невысыхающие смазочные масла или иные жидкие смазочные вещества согласно данному изобретению имеют вязкость, рассчитанную согласно приведенной формуле, удовлетворяющей следующим требованиям: k>800, при этом вязкость при 40°С составляет >15 мПА·с.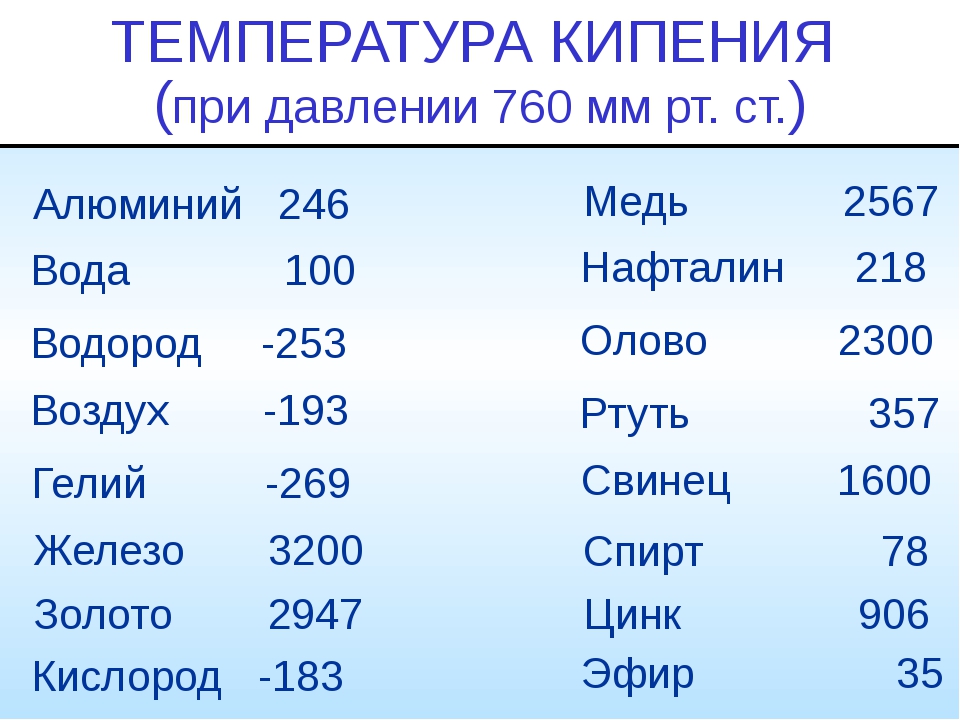
Пример 1
Были приготовлены различные смеси общей массой 3 кг. В качестве порошка на основе железа был использован порошок, имеющий химический состав, соответствующий Astaloy 85 Мо, и гранулометрический состав согласно нижеприведенной таблице 4.
|
180 г порошка на основе железа интенсивно перемешивают с 7,5 г жидких смазочных веществ в отдельном смесителе, получая в результате так называемую «маточную смесь».
К оставшемуся порошку на основе железа в смесителе Ludiger добавляют 9 г графита и интенсивно перемешивают в течение 2 минут. Затем добавляют маточную смесь и готовую смесь перемешивают в течение еще 3 минут.
Результаты измерения потока Carney и насыпной плотности полученных смесей представлены ниже в таблице 5.
|
Полученные смеси переносят в матрицу и прессуют в виде цилиндрических образцов для испытаний диаметром 25 мм при одноосном движении пресса и давлении прессования, составляющем 1100 МПа. Во время выталкивания спрессованных образцов измеряют статические и динамические усилия выталкивания, а также общую энергию выталкивания, необходимую для выталкивания образцов из матрицы. В таблице 6 представлены результаты измерений усилий выталкивания, энергии выталкивания, плотность до спекания, внешний вид поверхности и общие свойства различных образцов.
Во время выталкивания спрессованных образцов измеряют статические и динамические усилия выталкивания, а также общую энергию выталкивания, необходимую для выталкивания образцов из матрицы. В таблице 6 представлены результаты измерений усилий выталкивания, энергии выталкивания, плотность до спекания, внешний вид поверхности и общие свойства различных образцов.
|
Пример 2
Были получены три различные смеси согласно примеру 1, содержащие смазочные вещества А, С, F и G, при этом образцы согласно примеру 1 были спрессованы при различных температурах прессования.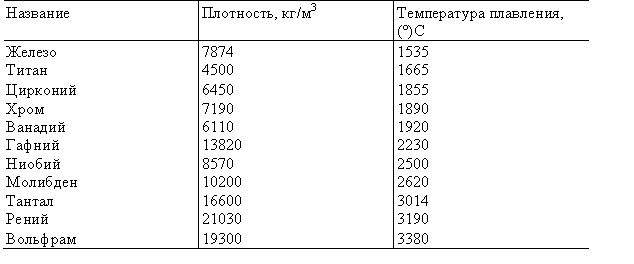 В таблице 7 представлены результаты измерений усилий выталкивания и энергии, необходимой для выталкивания образцов из матрицы, внешний вид поверхности вытолкнутых образцов и плотность образцов до спекания.
В таблице 7 представлены результаты измерений усилий выталкивания и энергии, необходимой для выталкивания образцов из матрицы, внешний вид поверхности вытолкнутых образцов и плотность образцов до спекания.
|
Пример 3
Данный пример иллюстрирует влияние добавляемого количества смазывающего вещества А и смазывающего вещества С на усилие выталкивания и энергию, необходимую для выталкивания спрессованного образца из матрицы, а также внешний вид поверхности вытолкнутых образцов. Были получены смеси согласно примеру 1, за исключением того, что количество добавляемого смазочного вещества составило 0,20 и 0,15%. Образцы согласно примеру 1 были спрессованы при комнатной температуре (RT). В таблице 8 представлены результаты измерений усилий выталкивания и энергии, необходимой для выталкивания образцов из матрицы, а также внешний вид поверхностей вытолкнутого образца.
Были получены смеси согласно примеру 1, за исключением того, что количество добавляемого смазочного вещества составило 0,20 и 0,15%. Образцы согласно примеру 1 были спрессованы при комнатной температуре (RT). В таблице 8 представлены результаты измерений усилий выталкивания и энергии, необходимой для выталкивания образцов из матрицы, а также внешний вид поверхностей вытолкнутого образца.
|
Пример 4
Данный пример иллюстрирует влияние гранулометрического состава на усилие выталкивания и энергию, необходимую для выталкивания спрессованного образца из матрицы, а также влияние гранулометрического состава на внешний вид поверхностей вытолкнутого образца при использовании жидких смазочных веществ согласно данному изобретению.
Пример 1 повторяют, за исключением того, что в качестве «тонкодисперсного порошка» был использован Astaloy 85 Мо. Количество частиц Astaloy 85 Мо размером менее 45 мкм составляет 20%, а количество частиц размером более 150 мкм обычно составляет 15%.
В таблице 9 представлены результаты измерений усилий выталкивания и энергии, необходимой для выталкивания образцов из матрицы, а также внешний вид поверхностей вытолкнутого образца.
|
Из вышеприведенных таблиц очевидно, что композиции, включающие крупнодисперсный порошок и вид вышеописанных жидких смазочных веществ, могут быть спрессованы до высокой степени плотности до спекания с получением прессовок, имеющих безупречную отделку поверхности.
Пример 5
Были приготовлены три пятикилограммовые порошковые смеси на основе железа. В качестве порошка на основе железа был использован предварительно легированный порошок, содержащий около 1,5% Cr и около 0,2% Мо, в котором около 3% крупных частиц имеют размер менее 45 мкм, а около 30% — более 212 мкм.
Были приготовлены две смеси для испытаний; смесь для испытаний 1 содержит, помимо порошка на основе железа 0,25% графита, 0,15% гексадецил-три-метоксисилана и 0,15% смазочного вещества С.
Смесь для испытаний 2 содержит такой же материал, за исключением того, что было использовано 0,255% гексадецил-три-метоксисилана и 0,045% смазочного вещества С.
В сравнительной смеси в качестве смазочного вещества было использовано 0,30% гексадецил-три-метоксисилана.
Полученные порошковые металлургические смеси были спрессованы при трех различных давлениях прессования в виде цилиндров, имеющих высоту 25 мм и диаметр также 25 мм. Во время выталкивания деталей были измерены усилия выталкивания и общая энергия, необходимая для их выталкивания из матрицы. В таблице 10 указаны давления прессования и полученные результаты.
Во время выталкивания деталей были измерены усилия выталкивания и общая энергия, необходимая для их выталкивания из матрицы. В таблице 10 указаны давления прессования и полученные результаты.
|
Как следует из результатов, представленных в таблице 10, добавление смазочных веществ согласно данному изобретению позволяет снизить энергию выталкивания и обеспечивает выталкивание без каких-либо задиров по сравнению с результатами, полученными при использовании сравнительных образцов.
Пример 6
Пример 5 повторяют, за исключением того, что прессование осуществляют при повышенной температуре, составляющей 60°С. Результаты представлены в таблице 11.
|
Положительное влияние повышенной температуры во время выталкивания показано в таблице 11 как для испытуемого, так и сравнительного образцов.
 45.Способпоп.4,вкотороморганосиланвыбранизгруппы,состоящейизоктил-три-метоксисилана,гексадецил-три-метоксисиланаиполиэтиленэфир-три-метоксисиланас10группамипростогоэтиленэфира.56.Способпоп.1,вкоторомсмазочноевеществовводятвколичестве0,1-0,3мас.%.67.Способпоп.1,вкоторомсмазочноевеществовводятвколичестве0,1-0,25мас.%.78.Способпоп.1,вкоторомкомпозициясвободнаотсмазочноговещества(смазочныхвеществ),котороеявляетсятвердым(твердыми)притемпературеокружающейсреды.89.Способпоп.1,вкоторомпрессованиеосуществляютприповышеннойтемпературе.910.Порошковаякомпозиция,содержащаякрупнодисперсныйпорошокжелезаилипорошокнаосновежелезаи,смазочноевеществовколичествеот0,04до0,4мас.%композиции,представляющеесобойпоменьшеймереодновеществоизгруппы,включающейневысыхающеемаслоилижирнуюкислотурастительногоилиживотногопроисхождения,имеющиетемпературуплавлениякристалловниже25°С;вязкость(η)при40°Сболее15мПа·с,приэтомупомянутаявязкостьзависитоттемпературысогласноследующейформуле1011.Порошковаякомпозицияпоп.10,вкоторойсмазочноевеществовыбраноизгруппы,включающейминеральныемасла,жирныекислотырастительногоилиживотногопроисхождения.
45.Способпоп.4,вкотороморганосиланвыбранизгруппы,состоящейизоктил-три-метоксисилана,гексадецил-три-метоксисиланаиполиэтиленэфир-три-метоксисиланас10группамипростогоэтиленэфира.56.Способпоп.1,вкоторомсмазочноевеществовводятвколичестве0,1-0,3мас.%.67.Способпоп.1,вкоторомсмазочноевеществовводятвколичестве0,1-0,25мас.%.78.Способпоп.1,вкоторомкомпозициясвободнаотсмазочноговещества(смазочныхвеществ),котороеявляетсятвердым(твердыми)притемпературеокружающейсреды.89.Способпоп.1,вкоторомпрессованиеосуществляютприповышеннойтемпературе.910.Порошковаякомпозиция,содержащаякрупнодисперсныйпорошокжелезаилипорошокнаосновежелезаи,смазочноевеществовколичествеот0,04до0,4мас.%композиции,представляющеесобойпоменьшеймереодновеществоизгруппы,включающейневысыхающеемаслоилижирнуюкислотурастительногоилиживотногопроисхождения,имеющиетемпературуплавлениякристалловниже25°С;вязкость(η)при40°Сболее15мПа·с,приэтомупомянутаявязкостьзависитоттемпературысогласноследующейформуле1011.Порошковаякомпозицияпоп.10,вкоторойсмазочноевеществовыбраноизгруппы,включающейминеральныемасла,жирныекислотырастительногоилиживотногопроисхождения. 1112.Порошковаякомпозицияпоп.10,всочетанииспоменьшеймереоднойдобавкой,выбраннойизгруппы,включающейреологическиемодификаторы,противозадирныедобавки,добавкипротивхолоднойсварки,ингибиторыокисленияиингибиторыкоррозии.1213.Порошковаякомпозицияпоп.10,свободнаяотсмазочноговещества(смазочныхвеществ),котороеявляетсятвердым(твердыми)притемпературеокружающейсреды.1314.Порошковаякомпозицияпоп.10,дополнительновключающаяоднуилиболеедобавок,выбранныхизгруппы,включающейтехнологическиедобавки,легирующиеэлементыитвердыефазы.14
1112.Порошковаякомпозицияпоп.10,всочетанииспоменьшеймереоднойдобавкой,выбраннойизгруппы,включающейреологическиемодификаторы,противозадирныедобавки,добавкипротивхолоднойсварки,ингибиторыокисленияиингибиторыкоррозии.1213.Порошковаякомпозицияпоп.10,свободнаяотсмазочноговещества(смазочныхвеществ),котороеявляетсятвердым(твердыми)притемпературеокружающейсреды.1314.Порошковаякомпозицияпоп.10,дополнительновключающаяоднуилиболеедобавок,выбранныхизгруппы,включающейтехнологическиедобавки,легирующиеэлементыитвердыефазы.14pick_fizika_10_gelfgat Flipbook PDF | DOKUMENT.PUB
ББК 22.2 я 72.3 Г32
Рецензенты: К. О. Чишко — доктор ({лзико-математичних наук ТВ. Лободюк — заслужен™ учитель Украши
Гельфгат 1.М., Ненашев 1.Ю. Г32
N
II о Ё
1. ОСНОВЫ М ОЛЕКУЛЯРНО -КИНЕТИЧЕСКО Й ТЕОРИИ. ПОСТОЯННАЯ АВОГАДРО
При изготовлении астрономического зеркала на поверхность площадью 8 = I м2 напылили т = 0,1 г серебра. Оцените размер с1 атомов серебра, если в зеркальном покрытии N = 100 атомных слоев.
Дано:
Решение .
8 = 1 м2 т = 0,1 г = 1СГ4 кг
Толщина напыленного слоя серебра к = N 6 .
ЛГ= 100 р = 10500 кг/м3
т = рУ = Ыр8с1.
Объем этого слоя V = 8 к = ВЫЛ, а его масса
т
Отсюда получаем (I =
ДГрЗ
кг
м
= м.
сI =
10-4 100.10500 • 1
* 10“ 10 (м).
м
Ответ . Приблизительно 10″10 м.
1.1. Какова толщина керосиновой пленки на поверхности воды, если керосин массой 1,6 г образовал пятно площадью 200 м ? Какой вывод можно отсюда сделать о размерах молекул? л
1.2 . © Чем объясняется явление диффузии? Почему диффузия в газах происходит намного быстрее, чем в жидкостях? 1 .3 . © П о ч е м у водород и гелий способны «улетучиваться» даже из герметично закрытых емкостей4? 1 .4 . © Если не работает вентиляция, мельчайшая древесная пыль в столярном цеху часами «висит» в воздухе даже после выключения деревообрабатывающих станков. Почему?
5
1 . 5 . 0 Две стеклянные пластинки трудно оторвать друг от друга, если между ними есть немного воды. Если же стекла сухие, то они отделяются друг от друга без труда. Почему? 1 . 6 . 0 Почему полировка трущихся поверхностей может привести не к уменьшению трения, а, наоборот, к увеличению? 1.7. Каковы молярные массы гелия, меди, ртути, урана? 1.8. Каковы молярные массы поваренной соли ЫаС1, сульфата меди С и 3 0 4, аммиака ЫН3? 1.9. Какова масса 25 моль кислорода? 1.10. Какова масса атома лития? Атома золота? 1.11. Чему равна масса молекулы метана (СН4)?
Если же стекла сухие, то они отделяются друг от друга без труда. Почему? 1 . 6 . 0 Почему полировка трущихся поверхностей может привести не к уменьшению трения, а, наоборот, к увеличению? 1.7. Каковы молярные массы гелия, меди, ртути, урана? 1.8. Каковы молярные массы поваренной соли ЫаС1, сульфата меди С и 3 0 4, аммиака ЫН3? 1.9. Какова масса 25 моль кислорода? 1.10. Какова масса атома лития? Атома золота? 1.11. Чему равна масса молекулы метана (СН4)?
1 . 1 2 . 0 При диффузионной сварке детали прижимают друг к другу, нагревают до определенной температуры и выдерживают некоторое время (диффузионная сварка позволяет прочно соединять детали из разных металлов и даже металлические детали с керамическими). Какую (примерно) температуру следует поддерживать при сварке? 1.13. Во сколько раз изменилось бы количество вещества в баллоне, если бы в результате электрического разряда находящийся в бал лоне кислород (Оз) превратился в озон ( 0 3)? 1.14. Сколько молекул содержится в 1 г углекислого газа (С 0 2)? 1. 15. Сколько молекул содержится в 5 г водорода (Н 2)? 1.16. Через микроскопические щели из баллона со сжатым воздухом** ежесекундно «уходят» 5 миллиардов молекул. За какое время мас са баллона с воздухом уменьшится на 1 мг? 1.17. Сколько ионов натрия содержится в пачке поваренной соли (ЫаС1) массой 500 г? 1.18. Какое количество вещества содержится в 39 г железа? 1.19. Каково количество вещества (ЗЮ 2) в песчинке массой 20 мг? 1.20. Где больше атомов кислорода: в 10 моль воды или 5 моль кис лорода? Во сколько раз? 1.21. Где больше молекул: в 5 г водорода или 10 г воды? Во сколько раз больше? ** Здесь и далее считайте воздух газом с молярной массой 0,029 кг/моль.
15. Сколько молекул содержится в 5 г водорода (Н 2)? 1.16. Через микроскопические щели из баллона со сжатым воздухом** ежесекундно «уходят» 5 миллиардов молекул. За какое время мас са баллона с воздухом уменьшится на 1 мг? 1.17. Сколько ионов натрия содержится в пачке поваренной соли (ЫаС1) массой 500 г? 1.18. Какое количество вещества содержится в 39 г железа? 1.19. Каково количество вещества (ЗЮ 2) в песчинке массой 20 мг? 1.20. Где больше атомов кислорода: в 10 моль воды или 5 моль кис лорода? Во сколько раз? 1.21. Где больше молекул: в 5 г водорода или 10 г воды? Во сколько раз больше? ** Здесь и далее считайте воздух газом с молярной массой 0,029 кг/моль.
6
1 .2 2 .0 3 Какой объем занимают 4 моль алюминия? 1.23. Поместятся ли в трехлитровой банке 50 моль ртути? 1.24. В каком объеме воды содержится 1018 молекул (вода находится в жидком состоянии)? 1.25. Где больше молекул: в стакане воды или в воздухе внутри пус той бочки? Объем стакана 200 см3, объем бочки 0,4 м3, воздух находится при нормальных условиях. 1.26. При каком объеме спортивного зала количество молекул воздуха в этом зале в 100 раз превышает количество атомов в железной штанге массой 100 кг? 1.27. Сравните количество вещества в двух кубиках одинакового объ ема: железном и алюминиевом. 1.28. В гальванической ванне корпуса часов покрывают слоем золота толщиной 24 мкм. Сколько атомов золота в покрытии, если площадь поверхности корпуса часов равна 10 см2? 1.29. Какова была бы относительная атомная масса фтора, если бы за атомную единицу массы приняли массу молекулы водорода? 1.30. В какой из капель — воды или ртути — количество вещества больше? Во сколько раз? Рассмотрите случаи, когда капли имеют: а) одинаковые массы; б) одинаковые объемы. 1.31. Оцените размеры молекулы воды, воспользовавшись приведен ными в Приложении данными. 1.32. При изготовлении интегральной микросхемы в кристалл сверх чистого кремния массой 1 мг вводят галлий массой КГ6 г. Сколько атомов кремния приходится на один атом галлия? 1.33. В цилиндрическом стакане диаметром 7 см находится вода мас сой 200 г.
1.26. При каком объеме спортивного зала количество молекул воздуха в этом зале в 100 раз превышает количество атомов в железной штанге массой 100 кг? 1.27. Сравните количество вещества в двух кубиках одинакового объ ема: железном и алюминиевом. 1.28. В гальванической ванне корпуса часов покрывают слоем золота толщиной 24 мкм. Сколько атомов золота в покрытии, если площадь поверхности корпуса часов равна 10 см2? 1.29. Какова была бы относительная атомная масса фтора, если бы за атомную единицу массы приняли массу молекулы водорода? 1.30. В какой из капель — воды или ртути — количество вещества больше? Во сколько раз? Рассмотрите случаи, когда капли имеют: а) одинаковые массы; б) одинаковые объемы. 1.31. Оцените размеры молекулы воды, воспользовавшись приведен ными в Приложении данными. 1.32. При изготовлении интегральной микросхемы в кристалл сверх чистого кремния массой 1 мг вводят галлий массой КГ6 г. Сколько атомов кремния приходится на один атом галлия? 1.33. В цилиндрическом стакане диаметром 7 см находится вода мас сой 200 г. Оцените количество молекулярных слоев, «уходящих» с поверхности воды ежесекундно, если вся вода испаряется за 10 суток. Считайте, что скорость испарения постоянна, а толщина молекулярного слоя равна 1,5 • Ю»10 м. 1.34. В научно-фантастических произведениях встречается упомина ние о сверхпрочной и сверхтонкой нити толщиной в один атом. Какой была бы длина такой нити массой 20 г, изготовленной из углерода? Сравните эту длину с расстоянием от Земли до Солнца. Считайте атом углерода шариком радиусом 7,7 • Ю~10 м.
Оцените количество молекулярных слоев, «уходящих» с поверхности воды ежесекундно, если вся вода испаряется за 10 суток. Считайте, что скорость испарения постоянна, а толщина молекулярного слоя равна 1,5 • Ю»10 м. 1.34. В научно-фантастических произведениях встречается упомина ние о сверхпрочной и сверхтонкой нити толщиной в один атом. Какой была бы длина такой нити массой 20 г, изготовленной из углерода? Сравните эту длину с расстоянием от Земли до Солнца. Считайте атом углерода шариком радиусом 7,7 • Ю~10 м.
7
1.35. В закрытом баллоне с кислородом находится уголь массой 12 г. Во сколько раз изменится количество вещества в баллоне после сгорания угля? Рассмотрите два случая: а) масса кислорода рав на 32 г; б) масса кислорода равна 64 г. 1 .3 6 . И Й В герметично закрытой лаборатории площадью 5 = 80 м и высотой к = 3 м капельку ртути радиусом г = 0,2 мм подвергли силь ному нагреву, в результате чего она быстро испарилась. Была ли при этом превышена предельно допустимая концентрация (ПДК) паров ртути в помещении? ПДК паров ртути п тлх = 3 • 1016 м~3. 1.37. В озеро со средней глубиной 7,5 м и площадью 16 км бросили кристаллик поваренной соли ЫаС1 массой 20 мг. Спустя очень длительное время из озера зачерпнули стакан воды объемом 200 см3. Сколько ионов натрия из брошенного кристаллика оказа лось в этом стакане? 1 .3 8 . Е Я Какова плотность р кристалла с так называемой простой кубической решеткой (см. рисунок), если масса каждого атома то, а длина ребра кубической ячейки а?
1.37. В озеро со средней глубиной 7,5 м и площадью 16 км бросили кристаллик поваренной соли ЫаС1 массой 20 мг. Спустя очень длительное время из озера зачерпнули стакан воды объемом 200 см3. Сколько ионов натрия из брошенного кристаллика оказа лось в этом стакане? 1 .3 8 . Е Я Какова плотность р кристалла с так называемой простой кубической решеткой (см. рисунок), если масса каждого атома то, а длина ребра кубической ячейки а?
ллл
ЛЛП К задаче 1.39
К задаче 1.38
1.39. Кристаллы поваренной соли ЫаС1 имеют кубическую решетку, состоящую из чередующихся ионов Ыа и С1 (см. рисунок). Найдите расстояние а между центрами ближайших ионов. Плотность соли р = 2200 кг/м3.
8
2. ГАЗОВЫ Е ЗАКОНЫ . УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА*»
2.1. Выразите в кельвинах значения температуры: 27 °С, -2 3 °С, 370 °С. 2.2. Выразите в градусах Цельсия значения температуры: 23 К, 93 К, 753 К. 2.3. При какой температуре по шкале Кельвина плавится свинец? 2.4. Температура в комнате увеличилась на 10 °С. На сколько увеличилась температура по шкале Кельвина? 2.5. При температуре -2 3 °С газ занимает объем 60 л. Каков будет объем газа при 127 °С? Давление газа не изменилось. 2 . 6 . 0 При изготовлении ламп накаливания их баллоны заполняют азотом под давлением, значительно меньшим атмосферного. Почему это давление не делают равным атмосферном}7? 2.7. На сколько процентов увеличилось давление газа в закрытом баллоне, который внесли с улицы в комнату? Температура наружного воздуха равна -2 3 °С, температу ра в комнате 17 °С. 2.8. Давление газа в баллоне при 27 °С равно 240 кПа. Каким станет давление после нагрева газа на 100 °С? Охлаждения на 50 °С? 2.9. В баллоне объемом 10 л находится воздух при давлении 1,5 МПа. Каким станет давление газа, если открыть кран, соединяющий этот баллон с другим, имеющим объем 40 л, из которого воздух откачан? Температура газа не изменяется. 2.10. Газ при температуре 37 °С и давлении 1,5 МПа имеет объем 10 л. Каков объем этой массы газа при нормальных условиях? 2.
На сколько увеличилась температура по шкале Кельвина? 2.5. При температуре -2 3 °С газ занимает объем 60 л. Каков будет объем газа при 127 °С? Давление газа не изменилось. 2 . 6 . 0 При изготовлении ламп накаливания их баллоны заполняют азотом под давлением, значительно меньшим атмосферного. Почему это давление не делают равным атмосферном}7? 2.7. На сколько процентов увеличилось давление газа в закрытом баллоне, который внесли с улицы в комнату? Температура наружного воздуха равна -2 3 °С, температу ра в комнате 17 °С. 2.8. Давление газа в баллоне при 27 °С равно 240 кПа. Каким станет давление после нагрева газа на 100 °С? Охлаждения на 50 °С? 2.9. В баллоне объемом 10 л находится воздух при давлении 1,5 МПа. Каким станет давление газа, если открыть кран, соединяющий этот баллон с другим, имеющим объем 40 л, из которого воздух откачан? Температура газа не изменяется. 2.10. Газ при температуре 37 °С и давлении 1,5 МПа имеет объем 10 л. Каков объем этой массы газа при нормальных условиях? 2. 11. При сжатии воздуха в цилиндре дизельного двигателя объем воздуха уменьшается в 15 раз, а температура повышается от 47 °С до 620 °С. Каково давление воздуха в конце сжатия, если в начале сжатия давление воздуха равнялось 100 кПа? 2.12. Каково количество вещества в газе, если при температуре -1 3 °С и давлении 500 кПа объем газа равен 30 л? 2.13. Какое давление должен выдерживать газовый баллон объемом 50 л, чтобы ‘при температуре 25 °С в нем можно было хранить 2 кг метана (СН4)?
11. При сжатии воздуха в цилиндре дизельного двигателя объем воздуха уменьшается в 15 раз, а температура повышается от 47 °С до 620 °С. Каково давление воздуха в конце сжатия, если в начале сжатия давление воздуха равнялось 100 кПа? 2.12. Каково количество вещества в газе, если при температуре -1 3 °С и давлении 500 кПа объем газа равен 30 л? 2.13. Какое давление должен выдерживать газовый баллон объемом 50 л, чтобы ‘при температуре 25 °С в нем можно было хранить 2 кг метана (СН4)?
} Здесь и далее, если атмосферное давление не задано, считайте его равным 100 кПа.
9
2.14.Евй2 Перевернутую открытую колбу нагрели, закрыли пробкой и опустили в ведро с водой. Когда пробку вынули, вода заполнила 25% объема колбы. До какой температуры была нагрета колба, если температура воды в ведре 20 °С? 2.15. После увеличения абсолютной температуры в 1,2 раза объем газа увеличился на 0,6 л при постоянном давлении. Найдите первоначальный объем газа. 2.16. Изменялось ли давление газа, заключенного в непроницаемую эластичную оболочку, если при нагревании газа от 250 К до 500 К его объем возрос в 1,5 раза? 2 . 1 7 .0 Космический корабль, стартовав с Земли, вышел на около земную орбиту’. Как изменилось давление воздуха в герметично закрытом отсеке? Температура в отсеке нс изменилась. 2 .1 8 .0 Почему баллон с любым сжатым газом представляет большую опасность при пожаре? 2.19. После повышения температу ры на 9 К давление газа в закрытом баллоне увеличилось на 3%. Какой была начальная температура? 2.20. После увеличения абсолютной температуры в 1,3 раза давление газа в закрытом баллоне увеличилось на 150 кПа. Каким было начальное давление в баллоне? 2.21. Когда летнее солнце нагрело баллон с газом на 15 К, показание манометра* ** на баллоне увеличилось от 19атм до 20 атм. Какой была начальная температура баллона? 2.22. Манометр на баллоне с газом при температуре 27 °С показывал 5 атм. Когда баллон вынесли на улицу, где температура равна -2 3 °С, манометр показал 3,6 атм. Не произошла ли при переноске утечка газа из баллона? 2.23. Газ находится в стальном баллоне. Есть ли трещины в баллоне, если при нагревании от 100 К до 300 К давление в баллоне изменяется от 120 кПа до 340 кПа? 2.
1 7 .0 Космический корабль, стартовав с Земли, вышел на около земную орбиту’. Как изменилось давление воздуха в герметично закрытом отсеке? Температура в отсеке нс изменилась. 2 .1 8 .0 Почему баллон с любым сжатым газом представляет большую опасность при пожаре? 2.19. После повышения температу ры на 9 К давление газа в закрытом баллоне увеличилось на 3%. Какой была начальная температура? 2.20. После увеличения абсолютной температуры в 1,3 раза давление газа в закрытом баллоне увеличилось на 150 кПа. Каким было начальное давление в баллоне? 2.21. Когда летнее солнце нагрело баллон с газом на 15 К, показание манометра* ** на баллоне увеличилось от 19атм до 20 атм. Какой была начальная температура баллона? 2.22. Манометр на баллоне с газом при температуре 27 °С показывал 5 атм. Когда баллон вынесли на улицу, где температура равна -2 3 °С, манометр показал 3,6 атм. Не произошла ли при переноске утечка газа из баллона? 2.23. Газ находится в стальном баллоне. Есть ли трещины в баллоне, если при нагревании от 100 К до 300 К давление в баллоне изменяется от 120 кПа до 340 кПа? 2. 24. Бутылку’ закрыли пробкой, площадь сечения которой равна 2 см2. Чтобы вытащить пробку, нужно приложить силу 10 Н. До какой температуры нужно нагреть бутылку’, чтобы пробка вылетела? Начальная температура воздуха в бутылке равна 20 °С. 2 .2 5 .0 При надувании щек и давление, и объем воздуха во рту воз растают, а температура остается неизменной. Не противоречит ли это закону’ Бойля-Мариотта? *Ч
24. Бутылку’ закрыли пробкой, площадь сечения которой равна 2 см2. Чтобы вытащить пробку, нужно приложить силу 10 Н. До какой температуры нужно нагреть бутылку’, чтобы пробка вылетела? Начальная температура воздуха в бутылке равна 20 °С. 2 .2 5 .0 При надувании щек и давление, и объем воздуха во рту воз растают, а температура остается неизменной. Не противоречит ли это закону’ Бойля-Мариотта? *Ч
Следует учитывать, что манометр показывает давление, избыточное над атмосферным (разность давлений внутри и снаружи баллона).
10
2.26. При изотермическом сжатии объем газа уменьшился на 5 л, а давление увеличилось в 3 раза. Каким был начальный объем газа? 2.27. [ $ 2 Всплывающий со дна озера пузырек воздуха вблизи поверх ности воды имеет диаметр I) = 2 мм. На какой глубине Л диаметр пузырька с1 был равен 1,5 мм? Изменение температуры воды с глубиной не учитывайте. 2.28. Чтобы подводная лодка всплыла, нужно с помощью сжатого воздуха вытеснить из балластных цистерн 1 т морской воды. С какой наибольшей глубины может всплыть лодка, имея в запасе шесть баллонов сжатого воздуха объемом по 30 л? Давление сжатого воздуха 7 МПа. 2.29. Изменялась ли температура газа при сжатии, если при уменьше нии объема в 2 раза давление возросло от 120 кПа до 260 кПа? 2.30. Объем газа уменьшили в 1,5 раза, в результате чего абсолютная температура увеличилась на 20%, а давление — на 320 кПа. Каким было начальное давление газа? 2.31. Б2В Два баллона, имеющие объемы 6 л и 14 л, содержат газы при давлениях соответственно 8 МПа и 5 Мпа и при одинаковой температурое. Баллоны соединены трубкой с краном. Какое давление установится в баллонах, если открыть кран? Температура не изме няется, газы в химическую реакцию не вступают. 2.32. Компрессор нагнетает воздух в резервуар емкостью 50 л, захватывая при каждом качании объем воздуха 2 л. Первоначально давление в резервуаре равно атмосферному. Какое давление установится в резервуаре после 100 качаний компрессора? Считайте, что температура воздуха при сжатии не изменяется.
С какой наибольшей глубины может всплыть лодка, имея в запасе шесть баллонов сжатого воздуха объемом по 30 л? Давление сжатого воздуха 7 МПа. 2.29. Изменялась ли температура газа при сжатии, если при уменьше нии объема в 2 раза давление возросло от 120 кПа до 260 кПа? 2.30. Объем газа уменьшили в 1,5 раза, в результате чего абсолютная температура увеличилась на 20%, а давление — на 320 кПа. Каким было начальное давление газа? 2.31. Б2В Два баллона, имеющие объемы 6 л и 14 л, содержат газы при давлениях соответственно 8 МПа и 5 Мпа и при одинаковой температурое. Баллоны соединены трубкой с краном. Какое давление установится в баллонах, если открыть кран? Температура не изме няется, газы в химическую реакцию не вступают. 2.32. Компрессор нагнетает воздух в резервуар емкостью 50 л, захватывая при каждом качании объем воздуха 2 л. Первоначально давление в резервуаре равно атмосферному. Какое давление установится в резервуаре после 100 качаний компрессора? Считайте, что температура воздуха при сжатии не изменяется.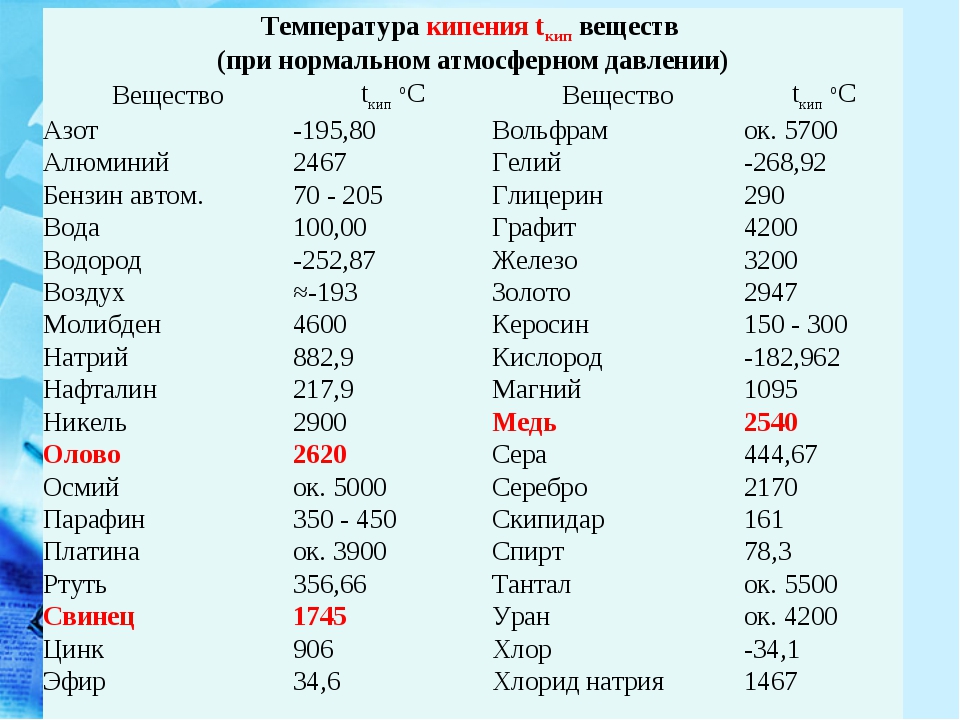 2.33. В З Поршневым воздушным насосом объемом V = 2 л откачи вают воздух из баллона объемом У0 = 50 л. Каково давление в сосуде после 7/ = 100 качаний насоса, если начальное давление равно атмосферному? Температуру можно считать неизменной.
2.33. В З Поршневым воздушным насосом объемом V = 2 л откачи вают воздух из баллона объемом У0 = 50 л. Каково давление в сосуде после 7/ = 100 качаний насоса, если начальное давление равно атмосферному? Температуру можно считать неизменной.
2.34. При температуре -2 3 °С давление газа в баллоне равно 1,8 МПа. Если давление в баллоне превышает 2 МПа, автоматический клапан открывается и выпускает часть газа. Сколько процентов газа выйдет из баллона, если температура в помещении поднимется до 27 °С? 2.35. Из автомобильной шины через небольшое отверстие вытекает воздух. На сколько повысилась температура шины во время движения автомобиля, если после вытекания 10% воздуха
11
давление в шине не изменилось? Начальная температура равна 10 °С. 2 .3 6 .Е Н Постройте графики процесса, происходящего с идеальным газом (см. рисунок), в координатах V, Т и р, V. Масса газа постоянна.
К задаче 2.36
К задаче 2.37
К задаче 2.38
2 .3 7 . Постройте графики процесса, происходящего с идеальным газом (см. рисунок), в координатах р, У и р, Т. Масса газа постоянна. 2.38. Постройте графики процесса, происходящего с идеальным газом (см. рисунок), в координатах р, Т и V, Т. Масса газа постоянна. Участок графика 3-4 соответствуют изотермическому процессу. 2 .3 9 . Сравните объем данной массы идеального газа в состояниях I и 2 (см. рисунок).
рисунок), в координатах р, У и р, Т. Масса газа постоянна. 2.38. Постройте графики процесса, происходящего с идеальным газом (см. рисунок), в координатах р, Т и V, Т. Масса газа постоянна. Участок графика 3-4 соответствуют изотермическому процессу. 2 .3 9 . Сравните объем данной массы идеального газа в состояниях I и 2 (см. рисунок).
2.40. о-* Как изменялось давление идеального газа в ходе процесса, график которого изображен на рисунке? Укажите точки на гра фике, соответствующие наибольшему и наименьшем}’ давлению. 2.41. В каких состояниях температура газа при циклическом процессе (см. рисунок) максимальна? Минимальна? Во сколько раз отлича ется максимальная температура от минимальной? 2.42. На сколько изменится масса воздуха в комнате, если в результате неисправности отопительной системы температура в комнате по низится от 20 °С до 7 °С? Объем комнаты равен 60 м3.
12
2.43. Во сколько раз отличается плотность углекислого газа (С 0 2) от плотности азота (N 2 ).. если газы находятся при одинаковых условиях? 2.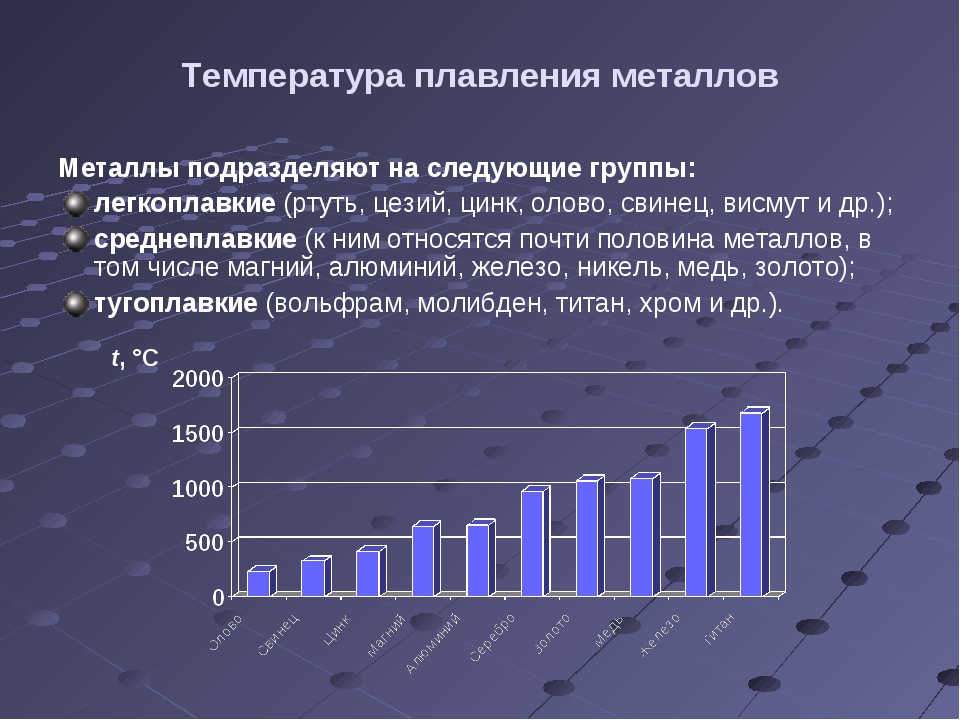 о = 1 °С? Давление воздуха внутри шара считайте равным атмосферному; массой оболочки воздушного шара можно пренебречь. 2.48. Во сколько раз изменится подъемная сила воздушного шара, если наполняющий его гелий заменить водородом? Весом оболочки шара можно пренебречь. 2.49. При каком давлении пара в паро ,г а____н1 ь вом котле клапан А (см. рисунок) |’1 откроется? Площадь отверстия кла Ь Ш • ш пана 8 = 2 см2, масса подвешенной к шт рычагу клапана гири т = 2 кг, штщ | Ц ‘■•у.’у’у. указанные на рисунке отрезки рычага 5\-‘: ::•*::•*:*: Н 1 а = 15 см и Ъ = 3 см. ………■
о = 1 °С? Давление воздуха внутри шара считайте равным атмосферному; массой оболочки воздушного шара можно пренебречь. 2.48. Во сколько раз изменится подъемная сила воздушного шара, если наполняющий его гелий заменить водородом? Весом оболочки шара можно пренебречь. 2.49. При каком давлении пара в паро ,г а____н1 ь вом котле клапан А (см. рисунок) |’1 откроется? Площадь отверстия кла Ь Ш • ш пана 8 = 2 см2, масса подвешенной к шт рычагу клапана гири т = 2 кг, штщ | Ц ‘■•у.’у’у. указанные на рисунке отрезки рычага 5\-‘: ::•*::•*:*: Н 1 а = 15 см и Ъ = 3 см. ………■
•-… —
• …………………. ………………………………..
2.50. Горизонтальный цилиндр длиной 20 см разделен закрепленным тонким поршнем пополам. Слева от поршня давление газа равно 400 кПа, справа — 100 кПа. Куда и на сколько передвинется поршень, если его отпустить? 2.51 -БЕЗ Открытую с двух концов вертикальную стеклянную трубку длиной Ь = 50 см наполовину погружают в ртуть. Затем трубку за крывают сверху и вынимают. Какова дтина I оставшегося в трубке столбика ртути? Атмосферное давление равно 750 мм рт. ст.
Какова дтина I оставшегося в трубке столбика ртути? Атмосферное давление равно 750 мм рт. ст.
13
2.52. В баллон объемом 8 л налили 10 г воды. Затем баллон герметично закрыли и нагрели от 20 °С до 180 °С. Вся вода испарилась. Какое давление установилось внутри баллона? 2.53. Какую плотность имеет при давлении 200 кПа и температуре 17 °С смесь, 10% массы которой составляет кислород, а 90% — гелий? 2.5 4 .6 2 Как изменялась температура идеального газа в процессе, график которого изображен на рисунке? Укажите точку графика, соответствующую максимальной температуре. Во сколько раз максимальная температура превышает минимальную?
К задаче 2.54
К задаче 2.55
2.5 5 .6 2 С помощью показанной на рисунке установки можно измерить атмосферное давление. Для этого поршень размещают посередине цилиндра, отверстие в дне цилиндра закрывают пальцем и измеряют с помощью динамометра силу которую нужно приложить к поршню для его медленного перемещения на четверть длины цилиндра. Утром эта сила была равна 20 Н, а вечером 19,4 Н. Каким было атмосферное давление утром и вечером? Площадь поршня 8 = 6 см2. 2.56. Посередине открытой горизонтальной трубки помещают пор шень, который может перемещаться без трения. Трубку закрыва ют с обоих концов и располагают вертикально. После установле ния равновесия поршень делит трубку в отношении 2 : 1 . Затем опыт повторяют, увеличив массу поршня вдвое. В каком отноше нии поршень теперь делит трубку? 2.57. Посередине открытой с обоих концов горизонтальной стеклян ной трубки длиной 87 см находится столбик ртути длиной 15 см. Закрыв одно из отверстий трубки, ее располагают вертикально, закрытым концом вниз. Найдите атмосферное давление, если столбик ртути переместился относительно трубки на 6 см. 2.58. На сколько переместился бы столбик ртути относительно трубки (см. предыдущую задачу), если бы трубку- расположили вертика льно: а) закрытым концом вверх; б) предварительно закрыв оба ■ отверстия трубки?
Утром эта сила была равна 20 Н, а вечером 19,4 Н. Каким было атмосферное давление утром и вечером? Площадь поршня 8 = 6 см2. 2.56. Посередине открытой горизонтальной трубки помещают пор шень, который может перемещаться без трения. Трубку закрыва ют с обоих концов и располагают вертикально. После установле ния равновесия поршень делит трубку в отношении 2 : 1 . Затем опыт повторяют, увеличив массу поршня вдвое. В каком отноше нии поршень теперь делит трубку? 2.57. Посередине открытой с обоих концов горизонтальной стеклян ной трубки длиной 87 см находится столбик ртути длиной 15 см. Закрыв одно из отверстий трубки, ее располагают вертикально, закрытым концом вниз. Найдите атмосферное давление, если столбик ртути переместился относительно трубки на 6 см. 2.58. На сколько переместился бы столбик ртути относительно трубки (см. предыдущую задачу), если бы трубку- расположили вертика льно: а) закрытым концом вверх; б) предварительно закрыв оба ■ отверстия трубки?
14
3. СВЯЗЬ МЕЖ ДУ ТЕМ ПЕРАТУРО Й И СРЕДНЕЙ КИНЕТИЧЕСКОЙ ЭНЕРГИЕЙ МОЛЕКУЛ
р = ^ — п т 0о2, р — п к Т , Е К= ^- кТ
3 . 1 . В Н Каково давление углекислого газа, если в баллоне объемом V — 40 л содержится N = 5 • 1024 молекул, а средняя квадратичная скорость молекул V = 400 м/с? 3 .2 . Найдите среднюю квадратичную скорость молекул кислорода при нормальных условиях. 3.3. При какой температуре средняя квадратичная скорость атомов гелия равна 1,3 км/с? 3.4. Во сколько раз изменилось бы давление в баллоне, если бы в ре зультате электрического разряда находившийся в баллоне кисло род ( 0 2) превратился в озон ( 0 3)? Считайте, что температура газа не изменилась. 3 . 5 . 0 Воздух состоит в основном из кислорода и азота. Молекулы какого из этих газов имеют: а) большую среднюю кинетическую энергию; б) большую среднюю квадратичную скорость? 3.6. Найдите среднюю кинетическую энергию поступательного движе ния молекул при температуре 27 °С. 3.7. Температура воздуха равна -1 3 °С. До какой температуры надо его нагреть, чтобы средняя кинетическая энергия поступательного движения молекул увеличилась на 15%? В полтора раза? 3.
1 . В Н Каково давление углекислого газа, если в баллоне объемом V — 40 л содержится N = 5 • 1024 молекул, а средняя квадратичная скорость молекул V = 400 м/с? 3 .2 . Найдите среднюю квадратичную скорость молекул кислорода при нормальных условиях. 3.3. При какой температуре средняя квадратичная скорость атомов гелия равна 1,3 км/с? 3.4. Во сколько раз изменилось бы давление в баллоне, если бы в ре зультате электрического разряда находившийся в баллоне кисло род ( 0 2) превратился в озон ( 0 3)? Считайте, что температура газа не изменилась. 3 . 5 . 0 Воздух состоит в основном из кислорода и азота. Молекулы какого из этих газов имеют: а) большую среднюю кинетическую энергию; б) большую среднюю квадратичную скорость? 3.6. Найдите среднюю кинетическую энергию поступательного движе ния молекул при температуре 27 °С. 3.7. Температура воздуха равна -1 3 °С. До какой температуры надо его нагреть, чтобы средняя кинетическая энергия поступательного движения молекул увеличилась на 15%? В полтора раза? 3. 8. Какова концентрация молекул в воздухе при нормальных условиях?
8. Какова концентрация молекул в воздухе при нормальных условиях?
3 .9 . © Е Д Один из двух одинаковых сосудов заполнен сухим воздухом, а другой — влажным, содержащим водяной пар. Температуры и давления в обоих сосудах одинаковы. Какой из сосудов легче? 3.10. Каково давление газа, если его плотность равна 2 кг/м3, а средняя квадратичная скорость его молекул 600 м/с? 3.11. Молекулы какого газа при 20 °С имеют среднюю квадратичную скорость 510 м/с? 3.12. В баллон объемом 20 л, находящийся на весах, накачали газ. Какова средняя квадратичная скорость молекул газа, если мано метр показал 4,9 МПа, а показания весов увеличились на 1 кг? 3.13. Во сколько раз отличаются средние квадратичные скорости молекул кислорода и азота в вашей комнате?
15
3.14. Е Я В баллоне А находится кислород массой 8 г, а в таком же баллоне Б — водород массой 0,5 г. Сравните давления в баллонах, если у молекул кислорода и водорода одинаковы: а) средние квадратичные скорости; б) средние кинетические энергии.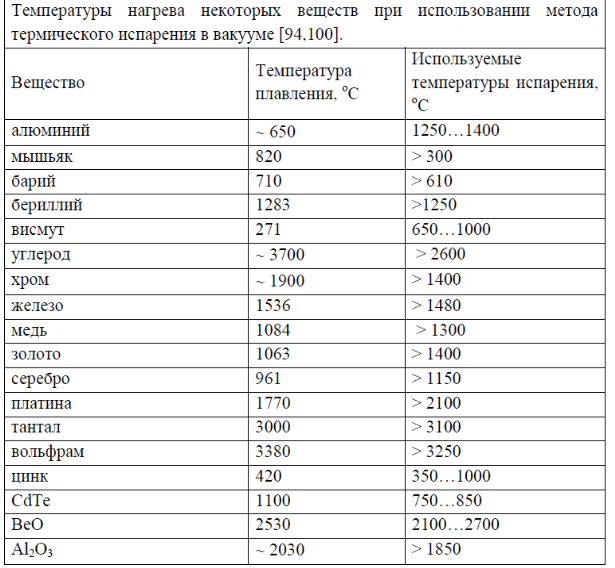 3.15. Оцените среднее расстояние между молекулами воздуха в ясный летний день (при температуре 27 °С и давлении 100 кПа). Во сколько раз это расстояние превышает размеры молекул (приблизительно 3 • 10″10 м)? 3.16. Е Я При повышении абсолютной температуры азота в 2 раза каждая вторая молекула диссоциировала на атомы. Во сколько раз изменилось давление газа? 3.17. В опыте Штерна прибор вращается с частотой 40 с ‘1, радиусы внутреннего и внешнего цилиндров равны соответственно 2 см и 20 см. На каком расстоянии друг от друга осядут на внешнем цилиндре атомы серебра, имеющие скорости 200 м/с и 300 м/с? 3.18. В опыте Штерна (см. предыдущую задачу) смещение середины полоски сереора составило 17 мм. Какова температура платиновой нити накала?
3.15. Оцените среднее расстояние между молекулами воздуха в ясный летний день (при температуре 27 °С и давлении 100 кПа). Во сколько раз это расстояние превышает размеры молекул (приблизительно 3 • 10″10 м)? 3.16. Е Я При повышении абсолютной температуры азота в 2 раза каждая вторая молекула диссоциировала на атомы. Во сколько раз изменилось давление газа? 3.17. В опыте Штерна прибор вращается с частотой 40 с ‘1, радиусы внутреннего и внешнего цилиндров равны соответственно 2 см и 20 см. На каком расстоянии друг от друга осядут на внешнем цилиндре атомы серебра, имеющие скорости 200 м/с и 300 м/с? 3.18. В опыте Штерна (см. предыдущую задачу) смещение середины полоски сереора составило 17 мм. Какова температура платиновой нити накала?
3.19. О В закрытом сосуде происходит полное сгорание кусочка угля с образованием углекислого газа. После этого сосуд охлаждают до начальной температуры. Сравните конечное давление в сосуде с начальным. Объем угля мал по сравнению с объемом сосуда. 3. 20. В закрытом сосуде при давлении р 0 находится смесь из 1 моль кислорода и 2 моль водорода. Между газами происходит реакция с образованием водяного пара. Какое давление установится в сосуде после охлаждения до первоначальной температуры? Кон денсации пара нс происходит.
20. В закрытом сосуде при давлении р 0 находится смесь из 1 моль кислорода и 2 моль водорода. Между газами происходит реакция с образованием водяного пара. Какое давление установится в сосуде после охлаждения до первоначальной температуры? Кон денсации пара нс происходит.
3.21 .ц23 В герметично закрытом баллоне находится смесь из =2г водорода и т 2 = 64 г кислорода при давлении р 0 = 120 кПа. Между газами происходит реакция с образованием водяного пара. Какое давление установится в баллоне после охлаждения до первона чальной температуры? Пар нс конденсируется. 3 .2 2 .0 Как изменился бы вид основного уравнения молекулярнокинетической теории идеального газа, если бы молекулам было «разрешено» двигаться только вдоль прямой, перпендикулярной стенке сосуда?
3 . 2 3 Найдите среднюю квадратичную скорость броуновской час тицы при температуре 20 °С; броуновскую частицу рассматри вайте как шарик радиусом 3 мкм, плотность которого равна плот ности воды.
16
4. ЗАКОНЫ ТЕРМОДИНАМИКИ. и отрицательный заряд -д . Найдите напряженность электрического поля в центре квадрата. 7 . 3 5 . 0 Двум шарикам, подвешенным на нитях одинаковой длины, сообщают положительные заряды. Нити отклоняются от
и отрицательный заряд -д . Найдите напряженность электрического поля в центре квадрата. 7 . 3 5 . 0 Двум шарикам, подвешенным на нитях одинаковой длины, сообщают положительные заряды. Нити отклоняются от
36
вертикали (см. рис. а , б). Какой из шариков имеет бблыную массу и ббльший заряд в случаях а, 61
7.36. Некий «ученый» поставил цель получить такие «атомные ядра», чтобы кулоновское отталкивание между ними в точности компен сировало гравитационное притяжение. Какой должна быть доля протонов в этих «ядрах»? Какова минимально возможная масса такого «ядра»? 7.37. Расстояние между’ двумя одинаковыми дробинками с разно именными зарядами равно 2 см. Сила притяжения между ними 40 мкН. Дробинки приводят в соприкосновение и опять разводят на расстояние 2 см. Теперь дробинки отталкиваются с силой 22,5 мкН. Найдите первоначальные заряды дробинок. 7.38. Двум соприкасающимся металлическим шарам сообщают заряд (2. После этого шары удаляют на расстояние, намного пре вышающее их радиусы. Докажите, что возникающая между шарами сила отталкивания будет наибольшей в том случае, когда радиусы шаров одинаковы. 7 .3 9 .0 Бусинка может без трения скользить по непроводящей гори зонтальной спице. На концах спицы закреплены шарики с одина ковыми положительными зарядами. Положительный или отрица тельный заряд надо сообщить бусинке, чтобы посередине спицы она находилась в устойчивом равновесии? 7.40.0 Правильно ли утверждение: свободные заряженные частицы движутся в электростатическом поле вдоль силовых линий этого поля? 7.41 .ц Я На нитях длиной I — 3 м, закрепленных в одной точке, висят два одинаковых металлических шарика. Шарикам сообщили равные заряды, в результате чего они разошлись на расстояние а = 19 см. Затем один из шариков разрядили. Каким будет расстояние Ь между шариками после установления равновесия? 7.42. В простейшей модели атбма водорода считается, что электрон движется вокруг неподвижного протона по окружности радиусом 5- Ю» 10 м. Каковы в этой модели скорость электрона и частота его обращения?
Докажите, что возникающая между шарами сила отталкивания будет наибольшей в том случае, когда радиусы шаров одинаковы. 7 .3 9 .0 Бусинка может без трения скользить по непроводящей гори зонтальной спице. На концах спицы закреплены шарики с одина ковыми положительными зарядами. Положительный или отрица тельный заряд надо сообщить бусинке, чтобы посередине спицы она находилась в устойчивом равновесии? 7.40.0 Правильно ли утверждение: свободные заряженные частицы движутся в электростатическом поле вдоль силовых линий этого поля? 7.41 .ц Я На нитях длиной I — 3 м, закрепленных в одной точке, висят два одинаковых металлических шарика. Шарикам сообщили равные заряды, в результате чего они разошлись на расстояние а = 19 см. Затем один из шариков разрядили. Каким будет расстояние Ь между шариками после установления равновесия? 7.42. В простейшей модели атбма водорода считается, что электрон движется вокруг неподвижного протона по окружности радиусом 5- Ю» 10 м. Каковы в этой модели скорость электрона и частота его обращения?
37
8. ПОТЕНЦИАЛ. ПРОВОДНИКИ И Д И Э Л ЕКТРИ КИ В ЭЛЕКТРИЧЕСКО М ПОЛЕ Ж
ПОТЕНЦИАЛ. ПРОВОДНИКИ И Д И Э Л ЕКТРИ КИ В ЭЛЕКТРИЧЕСКО М ПОЛЕ Ж
.
Ф=
,
А
=
?(ф, — ф2) =
Я
д Ц ‘,
Е
=
Ц — ,
а
Е
=
—
е
8.1. Потенциальная энергия заряда 1 нКл в электрическом поле равна 5 мкДж. Чему равен потенциал поля в этой точке? 8.2. В точке поля с потенциалом 300 В заряженное тело имеет потенциальную энергию -0 ,6 мкДж. Каков его заряд? 8.3. Какую работу совершает поле при перемещении заряда 2 нКл из точки с потенциалом 200 В в точку- с потенциалом 50 В? 8.4. Какую работу совершает поле при перемещении заряда 4 нКл из точки с потенциалом 20 В в точку с потенциалом 220 В? 8.5. При переносе из точки А в точку В заряда 5 нКл электрическое поле совершило работу 10 мкДж. Какова разность потенциалов между точками А и В? 8 . 6 . При переносе из точки А в точку- В заряда 4 мкКл потребовалось совершить работу 40 мДж против кулоновских сил. Какова разность потенциалов между точками А и В? 8. 7. Заряд-2 0 нКл переместили в однородном электрическом поле с напряженностью 10 кВ/м на 5 см в направлении силовой линии. Какую работу совершило поле? На сколько изменилась потенци альная энергия заряда? 8 . 8 . В однородном электрическом поле две точки лежат на одной сило вой линии. Расстояние между точками равно 10 см. Каково напря жение между ними, если напряженность поля 150 кВ/м? 8 .9 . Для измерения энергии микрочастиц применяют внесистемную единицу— электронвольт (эВ). Такую энергию приобретает электрон, пройдя разность потенциалов 1 В. При какой скорости электрона его кинетическая энергия равна 1 эВ? 1 кэВ? 8.10. Какую кинетическую энергию приобрел электрон, пройдя уско ряющую разность потенциалов 2 кВ? Выразите ответ в электронвольтах и джоулях. 8.11 О Заряженный прямоугольный лист фольги свернули в цилиндр. Как изменилась поверхностная плотность заряда? 8.12. Точечный заряд 2 нКл находится в керосине. Какова напряжен ность поля этого заряда на расстоянии 1 см от него?
7. Заряд-2 0 нКл переместили в однородном электрическом поле с напряженностью 10 кВ/м на 5 см в направлении силовой линии. Какую работу совершило поле? На сколько изменилась потенци альная энергия заряда? 8 . 8 . В однородном электрическом поле две точки лежат на одной сило вой линии. Расстояние между точками равно 10 см. Каково напря жение между ними, если напряженность поля 150 кВ/м? 8 .9 . Для измерения энергии микрочастиц применяют внесистемную единицу— электронвольт (эВ). Такую энергию приобретает электрон, пройдя разность потенциалов 1 В. При какой скорости электрона его кинетическая энергия равна 1 эВ? 1 кэВ? 8.10. Какую кинетическую энергию приобрел электрон, пройдя уско ряющую разность потенциалов 2 кВ? Выразите ответ в электронвольтах и джоулях. 8.11 О Заряженный прямоугольный лист фольги свернули в цилиндр. Как изменилась поверхностная плотность заряда? 8.12. Точечный заряд 2 нКл находится в керосине. Какова напряжен ность поля этого заряда на расстоянии 1 см от него?
38
8.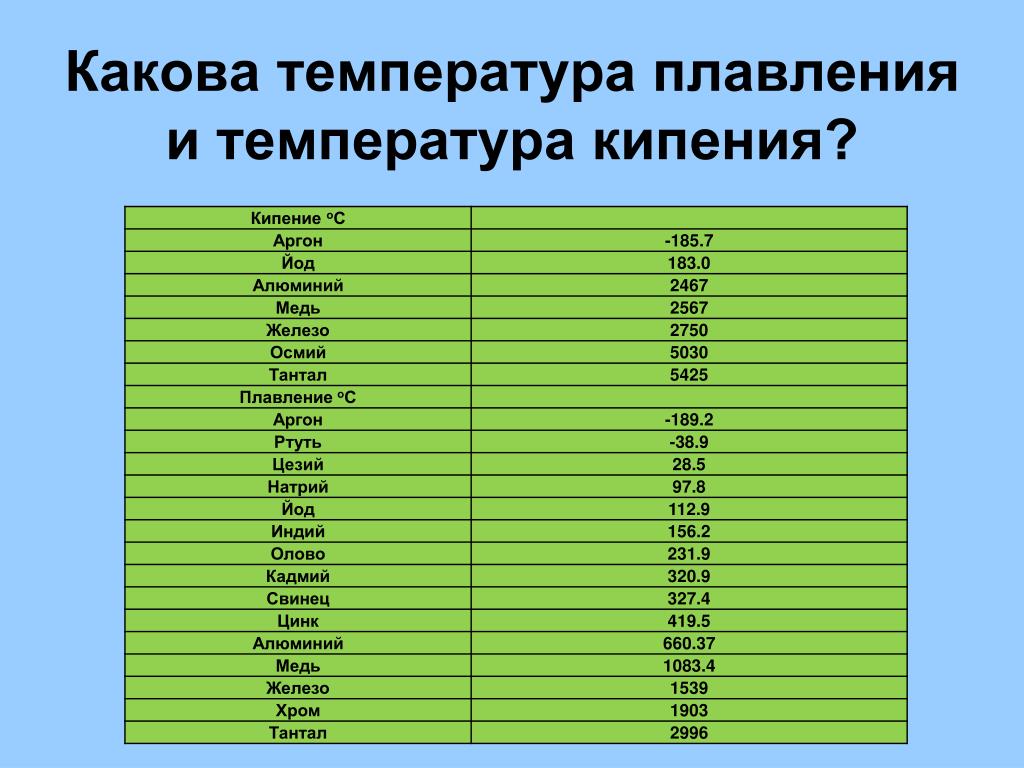 13. На каком расстоянии от заряда 10 нКл в машинном масле напря женность поля равна 10 кВ/м? 8.14. Два маленьких шарика с одинаковыми зарядами, находящиеся в воде на расстоянии 10 см один от другого, отталкиваются с силой 4 мкН. Найдите заряд каждого из шариков.
13. На каком расстоянии от заряда 10 нКл в машинном масле напря женность поля равна 10 кВ/м? 8.14. Два маленьких шарика с одинаковыми зарядами, находящиеся в воде на расстоянии 10 см один от другого, отталкиваются с силой 4 мкН. Найдите заряд каждого из шариков.
8 .1 5 .0 Как можно изменить потенциал проводящего шара, не касаясь его и не меняя его заряда? 8 .1 6 .0 Сравните потенциал и напряженность электрического поля в точках Л и В, С и В (см. рисунок).
А
К задаче 8.17
К задаче 8.16
К задаче 8.18
8 .1 7 .0 На рисунке изображены эквипотенциальные поверхности электрического поля. Нарисуйте силовые линии этого поля. Рассмотрите два случая: а) ср1 > Ф2 > Фз; б) Ф1
39
8 .2 4 .© Е Н На Рисбу
сверхпроводников — шкала Кельвина
Поскольку пользоваться отрицательными значениями при измерении низких температур как по шкале Фаренгейта, так и по шкале Цельсия неудобно, в девятнадцатом веке англичанин лорд Кельвин изобрел новую температурную шкалу, пригодную для измерения низких температур.
Когда материал охлаждается, он теряет тепло, и его температура снижается до тех пор, пока не будет достигнута точка, при которой у него больше не останется тепла, которое можно было бы отдать. В этот момент дальнейшее снижение температуры невозможно.Эта низкая температура называется абсолютным нулем. Лорд Кельвин предложил, чтобы эта абсолютная нулевая температура стала основой новой шкалы, которая начинается с нулевого значения при абсолютном нуле. На уровне моря в этом масштабе вода замерзает при 273 градусах, а кипит при 373 градусах. Итак, как и по шкале Цельсия, разница между точками замерзания и кипения воды составляет 100 градусов. Эта новая шкала называется шкалой Кельвина в честь лорда Кельвина и имеет единицу измерения «Кельвин». Чтобы перевести градусы Цельсия в градусы Кельвина, используйте формулу:
.Кельвин = градусы Цельсия + 273
Эта шкала очень удобна для регистрации очень низких температур жидкого азота и жидкого гелия.В этой шкале азот конденсируется в жидкость при температуре 77 Кельвинов, а гелий — в холодную жидкость при температуре 4,2 Кельвина. YBa2Cu3O7 имеет критическую температуру около 90 кельвинов, а BiSrCaCu2O9 — критическую температуру 110 кельвинов. Таким образом, когда их погружают в жидкий азот при температуре 77 Кельвинов, они становятся сверхпроводящими.
YBa2Cu3O7 имеет критическую температуру около 90 кельвинов, а BiSrCaCu2O9 — критическую температуру 110 кельвинов. Таким образом, когда их погружают в жидкий азот при температуре 77 Кельвинов, они становятся сверхпроводящими.
ИЗМЕРЕНИЕ ТЕМПЕРАТУРЫ
Температуру можно точно измерить с помощью термометров, разработанных и откалиброванных для использования в интересующем диапазоне температур. Для всех экспериментов в этом руководстве с использованием Colorado Superconductor Inc.семейство наборов сверхпроводников, представляет интерес в диапазоне от комнатной температуры до температуры жидкого азота. Сложные термометры обычно не работают в таком широком диапазоне. Однако термопарные термометры довольно точны в этом большом диапазоне температурных изменений.
Термопара состоит из механического соединения двух разнородных металлов. Этот переход генерирует небольшой электрический потенциал (напряжение), значение которого зависит от температуры перехода.Таким образом, при калибровке и соответствующем выборе металлов можно получить термометр для желаемого диапазона температур. Для нашего диапазона (от 300 до 77 Кельвинов) используется термопара типа Т или медно-константановая термопара.
Для нашего диапазона (от 300 до 77 Кельвинов) используется термопара типа Т или медно-константановая термопара.
Спай термопары был тщательно присоединен к сверхпроводникам в наших наборах, термически сбалансирован и откалиброван. Для определения напряжения этого перехода можно использовать простой цифровой милливольтметр, прикрепленный к проводам. Обратите внимание, что выводы термопары должны быть подключены к вольтметру проводами из того же материала, а соединение с выводами термопары должно иметь комнатную температуру.Это напряжение можно преобразовать в эквивалентную температуру с помощью таблицы преобразования, прилагаемой к каждому комплекту.
Информация предоставлена CSI Superconductors
Периодическая таблица элементов
Периодическая таблица элементов| Наименование | Вес | Номер | Температура кипения | Температура плавления |
|---|---|---|---|---|
| Водород | 1. 00794 00794 | 1 | 20.28 Кельвин | 13,81 Кельвин |
| Гелий | 4,0026 | 2 | 4,216 Кельвин | 0,95 Кельвин |
| Литий | 6,941 | 3 | 1615 Кельвин | 453,7 Кельвин |
| Бериллий | 9.01218 | 4 | 3243 Кельвин | 1560 Кельвин |
| Бор | 10,811 | 5 | 4275 Кельвин | 2365 Кельвин |
| Углерод | 12.011 | 6 | 5100 Кельвин | 3825 Кельвин |
| Азот | 14,0067 | 7 | 77,344 Кельвин | 63,15 Кельвин |
| Кислород | 15,9994 | 8 | 90,188 Кельвин | 54,8 Кельвин |
| Фтор | 18,9984 | 9 | 85 Кельвин | 53,55 Кельвин |
| Неон | 20. 1797 1797 | 10 | 27,1 Кельвина | 24,55 Кельвина |
| Натрий | 22,98977 | 11 | 1156 Кельвин | 371 Кельвин |
| Магний | 24,305 | 12 | 1380 Кельвин | 922 Кельвин |
| Алюминий | 26,98154 | 13 | 2740 Кельвин | 933,5 Кельвин |
| Силикон | 28.0855 | 14 | 2630 Кельвин | 1683 Кельвин |
| Фосфор | 30,97376 | 15 | 553 Кельвин | 317,3 Кельвин |
| Сера | 32,066 | 16 | 717,82 Кельвин | 392,2 Кельвин |
| Хлор | 35,4527 | 17 | 239,18 Кельвин | 172,17 Кельвин |
| Аргон | 39.948 | 18 | 87,45 Кельвина | 83,95 Кельвина |
| Калий | 39,0983 | 19 | 1033 Кельвин | 336,8 Кельвин |
| Кальций | 40,078 | 20 | 1757 Кельвин | 1112 Кельвин |
| Скандий | 44,9559 | 21 | 3109 Кельвин | 1814 Кельвин |
| Титан | 47.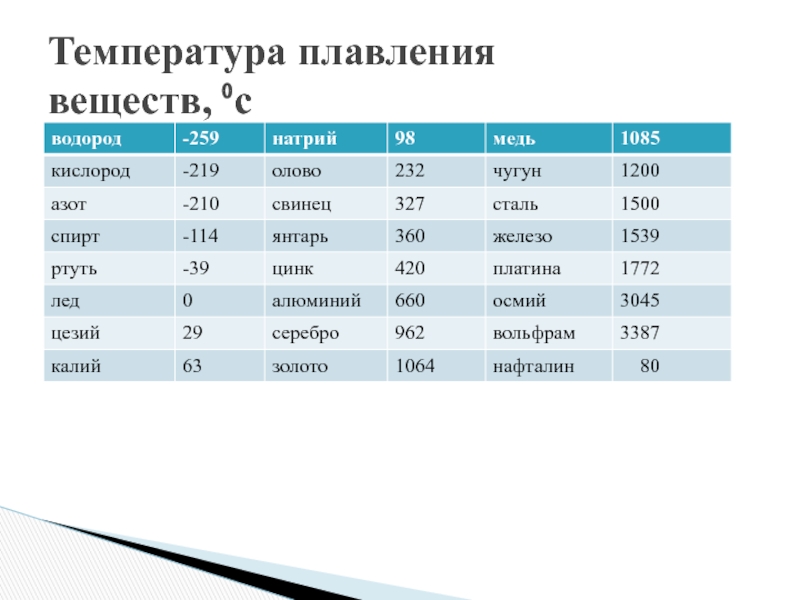 88 88 | 22 | 3560 Кельвин | 1945 Кельвин |
| Ванадий | 50,9415 | 23 | 3650 Кельвин | 2163 Кельвин |
| Хром | 51,996 | 24 | 2945 Кельвин | 2130 Кельвин |
| Марганец | 54,938 | 25 | 2335 Кельвин | 1518 Кельвин |
| Железо | 55.847 | 26 | 3023 Кельвин | 1808 Кельвин |
| Кобальт | 58,9332 | 27 | 3143 Кельвин | 1768 Кельвин |
| Никель | 58,6934 | 28 | 3005 Кельвин | 1726 Кельвин |
| Медь | 63,546 | 29 | 2840 Кельвин | 1356,6 Кельвин |
| Цинк | 65.39 | 30 | 1180 Кельвин | 692,73 Кельвин |
| Галлий | 69,723 | 31 | 2478 Кельвин | 302,92 Кельвин |
| Германий | 72,61 | 32 | 3107 Кельвин | 1211,5 Кельвин |
| Мышьяк | 74,9216 | 33 | 876 Кельвин | 1090 Кельвин |
| Селен | 78. 96 96 | 34 | 958 Кельвин | 494 Кельвин |
| Бром | 79,904 | 35 | 331,85 Кельвин | 265,95 Кельвин |
| Криптон | 83,8 | 36 | 120,85 Кельвин | 116 Кельвин |
| Рубидий | 85,4678 | 37 | 961 Кельвин | 312,63 Кельвин |
| Стронций | 87.62 | 38 | 1655 Кельвин | 1042 Кельвин |
| Иттрий | 88,9059 | 39 | 3611 Кельвин | 1795 Кельвин |
| Цирконий | 91,224 | 40 | 4682 Кельвин | 2128 Кельвин |
| Ниобий | 92,9064 | 41 | 5015 Кельвин | 2742 Кельвин |
| Молибден | 95.94 | 42 | 4912 Кельвин | 2896 Кельвин |
| Технеций | 98 | 43 | 4538 Кельвин | 2477 Кельвин |
| Рутений | 101,07 | 44 | 4425 Кельвин | 2610 Кельвин |
| Родий | 102,9055 | 45 | 3970 Кельвин | 2236 Кельвин |
| Палладий | 106. 42 42 | 46 | 3240 Кельвин | 1825 Кельвин |
| Серебро | 107,868 | 47 | 2436 Кельвин | 1235,08 Кельвин |
| Кадмий | 112,41 | 48 | 1040 Кельвин | 594,26 Кельвин |
| Индий | 114,82 | 49 | 2350 Кельвин | 429,78 Кельвин |
| Олово | 118.71 | 50 | 2876 Кельвин | 505,12 Кельвин |
| Сурьма | 121,757 | 51 | 1860 Кельвин | 903,91 Кельвин |
| Теллур | 127,6 | 52 | 1261 Кельвин | 722,72 Кельвин |
| Йод | 126,9045 | 53 | 457,5 Кельвин | 386,7 Кельвин |
| Ксенон | 131.29 | 54 | 165,1 Кельвина | 161,39 Кельвина |
| Цезий | 132,9054 | 55 | 944 Кельвин | 301,54 Кельвин |
| Барий | 137,33 | 56 | 2078 Кельвин | 1002 Кельвин |
| Лантан | 138,9055 | 57 | 3737 Кельвин | 1191 Кельвин |
| Церий | 140. 12 12 | 58 | 3715 Кельвин | 1071 Кельвин |
| Празеодим | 140,9077 | 59 | 3785 Кельвин | 1204 Кельвин |
| Неодим | 144,24 | 60 | 3347 Кельвин | 1294 Кельвин |
| Прометий | 145 | 61 | 3273 Кельвин | 1315 Кельвин |
| Самарий | 150.36 | 62 | 2067 Кельвин | 1347 Кельвин |
| Европий | 151,965 | 63 | 1800 Кельвин | 1095 Кельвин |
| Гадолиний | 157,25 | 64 | 3545 Кельвин | 1585 Кельвин |
| Тербий | 158,9253 | 65 | 3500 Кельвин | 1629 Кельвин |
| Диспрозий | 162.5 | 66 | 2840 Кельвин | 1685 Кельвин |
| Гольмий | 164,9303 | 67 | 2968 Кельвин | 1747 Кельвин |
| Эрбий | 167,26 | 68 | 3140 Кельвин | 1802 Кельвин |
| Тулий | 168,9342 | 69 | 2223 Кельвин | 1818 Кельвин |
| Иттербий | 173. 04 04 | 70 | 1469 Кельвин | 1092 Кельвин |
| Лютеций | 174,967 | 71 | 3668 Кельвин | 1936 Кельвин |
| Гафний | 178,49 | 72 | 4875 Кельвин | 2504 Кельвин |
| Тантал | 180,9479 | 73 | 5730 Кельвин | 3293 Кельвин |
| Вольфрам | 183.85 | 74 | 5825 Кельвин | 3695 Кельвин |
| Рений | 186,207 | 75 | 5870 Кельвин | 3455 Кельвин |
| Осмий | 190,2 | 76 | 5300 Кельвин | 3300 Кельвин |
| Иридий | 192,22 | 77 | 4700 Кельвин | 2720 Кельвин |
| Платина | 195.08 | 78 | 4100 Кельвин | 2042,1 Кельвин |
| Золото | 196,9665 | 79 | 3130 Кельвин | 1337,58 Кельвин |
| Меркурий | 200,59 | 80 | 629,88 Кельвин | 234,31 Кельвин |
| Таллий | 204,383 | 81 | 1746 Кельвин | 577 Кельвин |
| Свинец | 207. 2 2 | 82 | 2023 Кельвина | 600,65 Кельвина |
| Висмут | 208,9804 | 83 | 1837 Кельвин | 544,59 Кельвин |
| Астат | 210 | 85 | 610 Кельвин | 575 Кельвин |
| Радон | 222 | 86 | 211,4 Кельвин | 202 Кельвин |
| Франций | 223 | 87 | 950 Кельвин | 300 Кельвин |
| Радий | 226.0254 | 88 | 1413 Кельвин | 973 Кельвин |
| Торий | 232.0381 | 90 | 5060 Кельвин | 2028 Кельвин |
| Протактиний | 231.0359 | 91 | 4300 Кельвин | 1845 Кельвин |
| Уран | 238,029 | 92 | 4407 Кельвин | 1408 Кельвин |
| Нептуний | 237.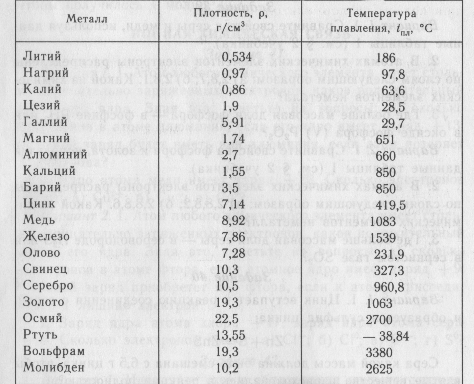 0482 0482 | 93 | 4175 Кельвин | 912 Кельвин |
| Плутоний | 244 | 94 | 3505 Кельвин | 913 Кельвин |
| Америций | 243 | 95 | 2880 Кельвин | 1449 Кельвин |
7.2: Тепло и температура — Химия LibreTexts
Температурные весы
Температура является мерой среднего количества энергии движения или кинетической энергии , содержащейся в системе.Температуры выражаются с помощью шкал, в которых используются единицы измерения, называемые градусами. Для измерения температуры используются три шкалы. На рисунке \(\PageIndex{1}\) сравниваются три температурные шкалы: градусы Фаренгейта (выражается в °F), градусы Цельсия (°C) и кельвины (K). Термометры измеряют температуру с помощью материалов, которые расширяются или сжимаются при нагревании или охлаждении. Ртутные или спиртовые термометры, например, имеют резервуар с жидкостью, который расширяется при нагревании и сжимается при охлаждении, поэтому столбик жидкости удлиняется или укорачивается при изменении температуры жидкости.
В Соединенных Штатах широко используемой температурной шкалой является шкала по Фаренгейту (обозначается как °F и произносится как «градусы по Фаренгейту»). По этой шкале точка замерзания жидкой воды (температура, при которой жидкая вода превращается в твердый лед) составляет 32 ° F, а точка кипения воды (температура, при которой жидкая вода превращается в пар) составляет 212 ° F.{\ circ} C \ times \ dfrac {9} {5} \ right) +32 \ label {C2F} \]
Обратите внимание, что наука использует почти исключительно шкалы Цельсия и Кельвина; практически ни один практикующий химик не выражает температуры, измеренные в лаборатории, по шкале Фаренгейта. (На самом деле Соединенные Штаты — одна из немногих стран в мире, которые до сих пор ежедневно используют шкалу Фаренгейта.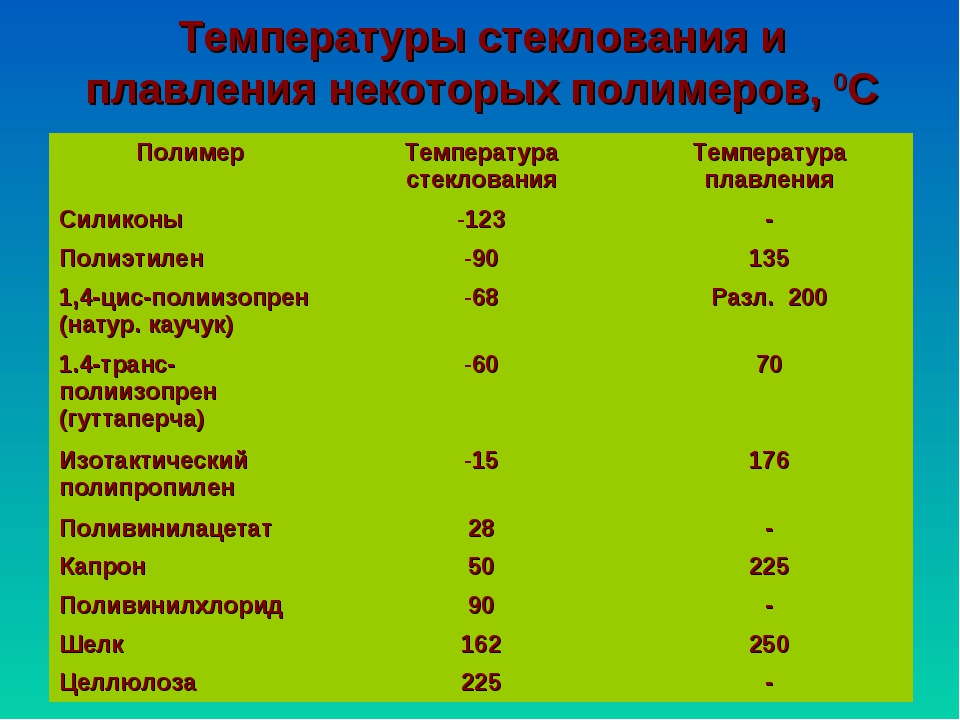 Люди, проезжающие мимо границ Канады или Мексики, могут ловить местные радиостанции по другую сторону границы, которые выражайте ежедневную погоду в градусах Цельсия, чтобы не запутаться в их прогнозах погоды.{\circ}F \end{align*}\]
Люди, проезжающие мимо границ Канады или Мексики, могут ловить местные радиостанции по другую сторону границы, которые выражайте ежедневную погоду в градусах Цельсия, чтобы не запутаться в их прогнозах погоды.{\circ}F \end{align*}\]
Для получения дополнительных примеров того, как решать эти типы задач, щелкните это видео, чтобы увидеть своего профессора в действии.
Упражнение \(\PageIndex{1}\)
- Преобразование 0°F в градусы Цельсия.
- Преобразование 212°C в градусы Фаренгейта.
- Ответить на
−17,8°С
- Ответ б
414°F
Фундаментальной единицей измерения температуры в системе СИ является кельвин (К).{\ circ} C + 273,15 \ метка {C2K} \]
Для большинства целей допустимо использовать 273 вместо 273,15 в уравнении \ref{C2K}.
Обратите внимание, что шкала Кельвина не использует слово градусов ; о температуре 295 К говорят как о «двести девяноста пяти градусах Кельвина», а не о «двести девяноста пяти градусах Кельвина».
Причина, по которой шкала Кельвина определяется таким образом, заключается в том, что существует минимально возможная температура, называемая абсолютным нулем (ноль Кельвина). Температурная шкала Кельвина настроена так, что 0 К является абсолютным нулем, и от этого значения температура отсчитывается вверх.{\circ}C+273,15 \\[5pt] &= 295,4K \end{align*}\]
Итак, комнатная температура около 295 К.
Здоровье Применение: Температура тела
Нормальная температура тела определяется как 98,6°F (+/- 1,0°F). Для определения температуры тела термометры могут быть помещены внутрь или на поверхность тела. Два лучших метода измерения температуры тела — это помещение термометра либо под язык, либо в прямую кишку. Как правило, дети способны держать градусник во рту примерно в возрасте четырех лет (развлекаются до этого возраста).
Лихорадка определяется как температура тела выше 100°F (у взрослых). Статус высокой лихорадки возникает при температуре 104°F и выше. Что касается взрослых, этим взрослым следует немедленно обратиться за медицинской помощью, если температура превышает 104 ° F. У детей эти значения значительно ниже.
Что касается взрослых, этим взрослым следует немедленно обратиться за медицинской помощью, если температура превышает 104 ° F. У детей эти значения значительно ниже.
Гипертермия (неспособность организма регулировать тепло) возникает при превышении нормальной температуры тела. Состояниями, которые могут вызвать гипертермию, являются лихорадка (инфекция), тепловой удар, заболевания щитовидной железы, сердечный приступ или травматическое повреждение.Лекарства для больных раком, артритом и щитовидной железой могут вызвать повышение температуры тела. Симптомы гипертермии включают потливость, спутанность сознания, тошноту и головокружение.
Гипотермия (воздействие холода) возникает, когда нормальная температура тела падает ниже 95,0°F. Когда это происходит, пострадавшее лицо (лица) должны немедленно обратиться за медицинской помощью. Во время гипотермии у организма возникают проблемы с выработкой тепла. Медицинские состояния, такие как диабет, инфекция и дисфункция щитовидной железы, могут вызывать гипотермию. Посмотрите это видео о том, как американские морские пехотинцы пытаются выжить в экстремальных условиях. Симптомы этого состояния включают дрожь, спутанность сознания и вялое поведение.
Посмотрите это видео о том, как американские морские пехотинцы пытаются выжить в экстремальных условиях. Симптомы этого состояния включают дрожь, спутанность сознания и вялое поведение.
Лечение гипертермии может включать гидратацию пациента. Если лихорадка вызвана инфекцией, анальгетики (такие как тайленол, адвил, аспирин или алив) могут помочь облегчить лихорадку. Помещение человека в прохладную ванну также может облегчить симптомы.
Для борьбы с переохлаждением необходимо снимать мокрую одежду, одеваться в теплые вещи и участвовать в физических движениях.
Теплообмен
Тепло — привычное проявление энергии. Когда мы прикасаемся к горячему предмету, энергия течет от горячего предмета к нашим пальцам, и мы воспринимаем эту поступающую энергию как «горячий» предмет. И наоборот, когда мы держим кубик льда в ладонях, энергия течет из нашей руки в кубик льда, и мы воспринимаем эту потерю энергии как «холод». В обоих случаях температура объекта отличается от температуры нашей руки, поэтому можно сделать вывод, что разность температур является конечной причиной теплопередачи.
Предположим, мы рассматриваем перенос тепла с противоположной точки зрения, а именно, что происходит с системой, которая получает или теряет тепло? Как правило, температура системы меняется. (Мы обратимся к нескольким исключениям позже.) Чем больше первоначальная разность температур, тем больше передача тепла и тем больше конечное изменение температуры. Отношение между количеством переданного тепла и изменением температуры можно записать как
.\[\text{тепло} \propto ΔT \label{Eq1}\]
, где ∝ означает «пропорционально», а Δ T — изменение температуры системы .Любое изменение переменной всегда определяется как «конечное значение минус начальное значение» переменной, поэтому Δ T равно T окончательное − T начальное . Кроме того, чем больше масса объекта, тем больше тепла необходимо для изменения его температуры. Мы можем включить переменную, представляющую массу ( m ) в пропорциональность следующим образом:
\[\text{тепло} \propto mΔT \label{Eq2}\]
Чтобы преобразовать эту пропорциональность в равенство, мы включаем константу пропорциональности. Константа пропорциональности называется удельной теплоемкостью и обычно обозначается как \(c\):
Константа пропорциональности называется удельной теплоемкостью и обычно обозначается как \(c\):
\[\text{тепло} = mcΔT \label{Eq3}\]
Каждое вещество имеет характеристическую удельную теплоемкость , которая выражается в единицах кал/г•°C или кал/г•K, в зависимости от единиц, используемых для выражения Δ T . Удельной теплоемкостью вещества называется количество энергии, которое необходимо передать 1 г этого вещества или от него, чтобы изменить его температуру на 1°. В таблице \(\PageIndex{1}\) указана удельная теплоемкость для различных материалов.
| Вещество | с (кал/г•°С) |
|---|---|
| алюминий (Al) | 0,215 |
| оксид алюминия (Al 2 O 3 ) | 0,305 |
| бензол (C 6 H 6 ) | 0.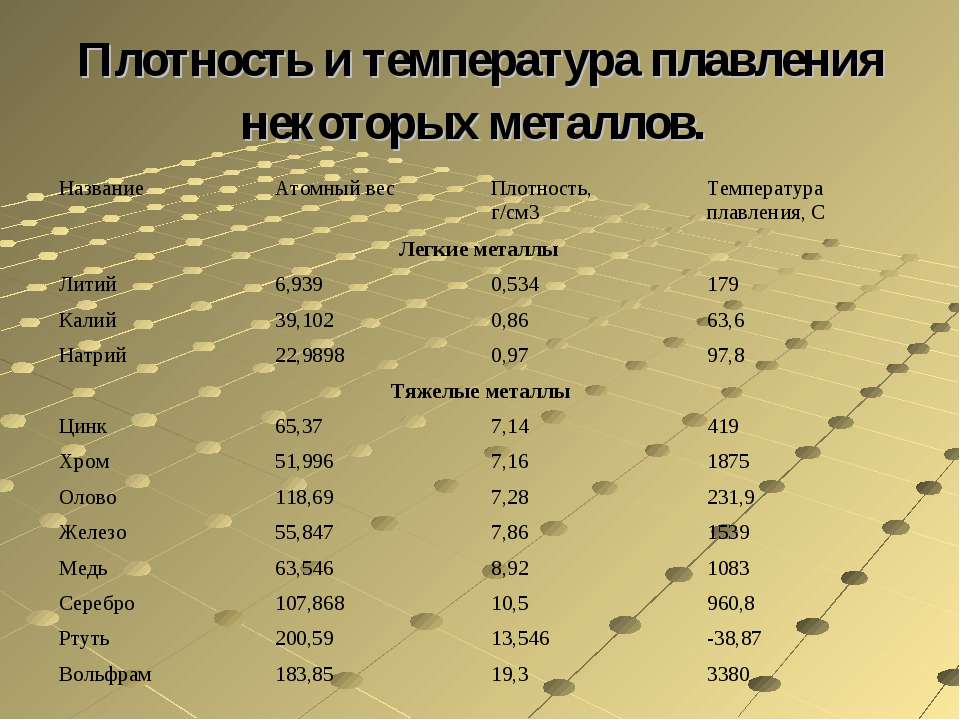 251 251 |
| медь (Cu) | 0,092 |
| этанол (C 2 H 6 O) | 0,578 |
| гексан (C 6 H 14 ) | 0,394 |
| водород (H 2 ) | 3.419 |
| лед [H 2 O(s)] | 0,492 |
| железо (Fe) | 0.108 |
| оксид железа(III) (Fe 2 O 3 ) | 0,156 |
| ртуть (Hg) | 0,033 |
| кислород (O 2 ) | 0,219 |
| хлорид натрия (NaCl) | 0,207 |
| пар [H 2 O(г)] | 0,488 |
| вода [H 2 O(ℓ)] | 1. 00 00 |
Константу пропорциональности c иногда называют удельной теплоемкостью или (ошибочно) теплоемкостью.
направление теплового потока не показано в тепле = mc Δ T . Если энергия уходит в объект, полная энергия объекта увеличивается, а значения теплоты Δ T положительны. Если энергия исходит от объекта, полная энергия объекта уменьшается, а значения теплоты и Δ T отрицательны.
Пример \(\PageIndex{3}\)
Какое количество теплоты передается при нагревании бруска металлического железа массой 150,0 г с 25,0°С до 73,3°С? Каково направление теплового потока?
Раствор
Мы можем использовать heat = mc Δ T для определения количества теплоты, но сначала нам нужно определить Δ T . Поскольку конечная температура железа составляет 73,3°C, а начальная температура составляет 25,0°C, Δ T будет следующим:
\[\begin{align*} ΔT = T_{final} − T_{initial} \\[4pt] &= 73. \circ C) = 782\: кал}\)
\circ C) = 782\: кал}\)
Обратите внимание, что единицы грамм и °C сокращаются алгебраически, остается только единица калорий, которая является единицей тепла. Поскольку температура железа увеличивается, энергия (в виде тепла) должна течь в металл.
Упражнение \(\PageIndex{3}\)
Какое количество теплоты передается при охлаждении бруска металлического алюминия массой 295,5 г со 128,0°С до 22,5°С? Каково направление теплового потока?
- Ответить
6700 кал.
Пример \(\PageIndex{4}\)
А 10.Образец красновато-коричневого металла массой 3 г выделил 71,7 кал теплоты при понижении его температуры с 97,5°С до 22,0°С. Чему равна удельная теплоемкость металла? Можете ли вы определить металл по данным в таблице \(\PageIndex{1}\)?
Раствор
Вопрос дает нам теплоту, конечную и начальную температуры и массу образца. Значение Δ T следующее:
Δ T = T конечное − T начальное = 22. \circ C)}}\)
\circ C)}}\)
c = 0,0923 кал/г•°C
Это значение удельной теплоемкости очень близко к значению, указанному для меди в таблице \(\PageIndex{1}\).
Упражнение \(\PageIndex{4}\)
Кристалл хлорида натрия (NaCl) массой 10,7 г имел начальную температуру 37,0°C. Какова конечная температура кристалла, если к нему подведено 147 кал теплоты?
- Ответить
103,4°С
Обратите внимание, что вода имеет очень высокую удельную теплоемкость по сравнению с большинством других веществ.Вода обычно используется в качестве охлаждающей жидкости для машин, поскольку она способна поглощать большое количество тепла (см. таблицу выше). Прибрежный климат гораздо более умеренный, чем внутренний, из-за присутствия океана. Вода в озерах или океанах поглощает тепло из воздуха в жаркие дни и отдает его обратно в воздух в прохладные дни.
Рисунок\(\PageIndex{2}\): Эта электростанция в Западной Вирджинии, как и многие другие, расположена рядом с большим озером, так что воду из озера можно использовать в качестве охлаждающей жидкости. Прохладная вода из озера закачивается на завод, а более теплая вода откачивается из завода и возвращается в озеро.
Прохладная вода из озера закачивается на завод, а более теплая вода откачивается из завода и возвращается в озеро.Упражнения
1. Температура плавления ртути составляет −38,84 o C. Переведите это значение в градусы Фаренгейта и Кельвина.
2. Горшок с водой ставится на горячую конфорку плиты. Каково направление теплового потока?
3. В кастрюлю с кипящей водой добавляют несколько сырых макарон. Каково направление теплового потока?
4.Сколько энергии в калориях требуется, чтобы нагреть 150 г H 2 O от 0°C до 100°C?
5. Сколько энергии в калориях требуется, чтобы нагреть 125 г Fe с 25°C до 150°C?
6. Если к 43,8 г Al при температуре 22,5 °C добавить 250 кал тепла, какова будет конечная температура алюминия?
7. Если к 33,2 г Hg при температуре 56,2 °C добавить 195 кал тепла, какова будет конечная температура ртути?
8. Образец меди поглощает 145 кал энергии, а его температура повышается с 37.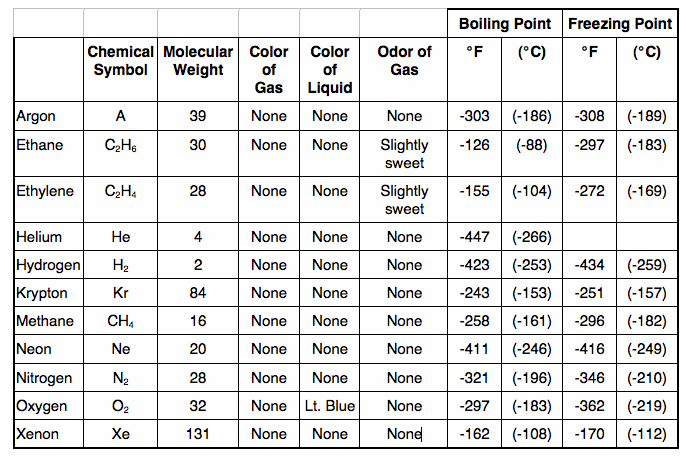 от 8°С до 41,7°С. Какова масса меди?
от 8°С до 41,7°С. Какова масса меди?
9. Большой монокристалл хлорида натрия поглощает 98,0 кал тепла. Если его температура повысится с 22,0°С до 29,7°С, какова масса кристалла NaCl?
10. Если бы 1,00 г каждого вещества из Таблицы 7.3 поглотил бы 100 кал тепла, какое вещество подверглось бы наибольшему изменению температуры?
11. Если 1,00 г каждого вещества из таблицы 7.3 поглотит 100 кал тепла, какое вещество испытает наименьшее изменение температуры?
12.Определить теплоемкость вещества, если 23,6 г вещества выделяют 199 кал теплоты при изменении его температуры от 37,9°С до 20,9°С.
13. Какова теплоемкость золота, если для повышения температуры образца массой 250 г требуется 133 кал энергии для повышения его температуры с 23,0°С до 40,1°С?
Кельвинов: Введение | НИСТ
Кредит: НИСТ
Температура является одним из самых важных и распространенных измерений в жизни человека.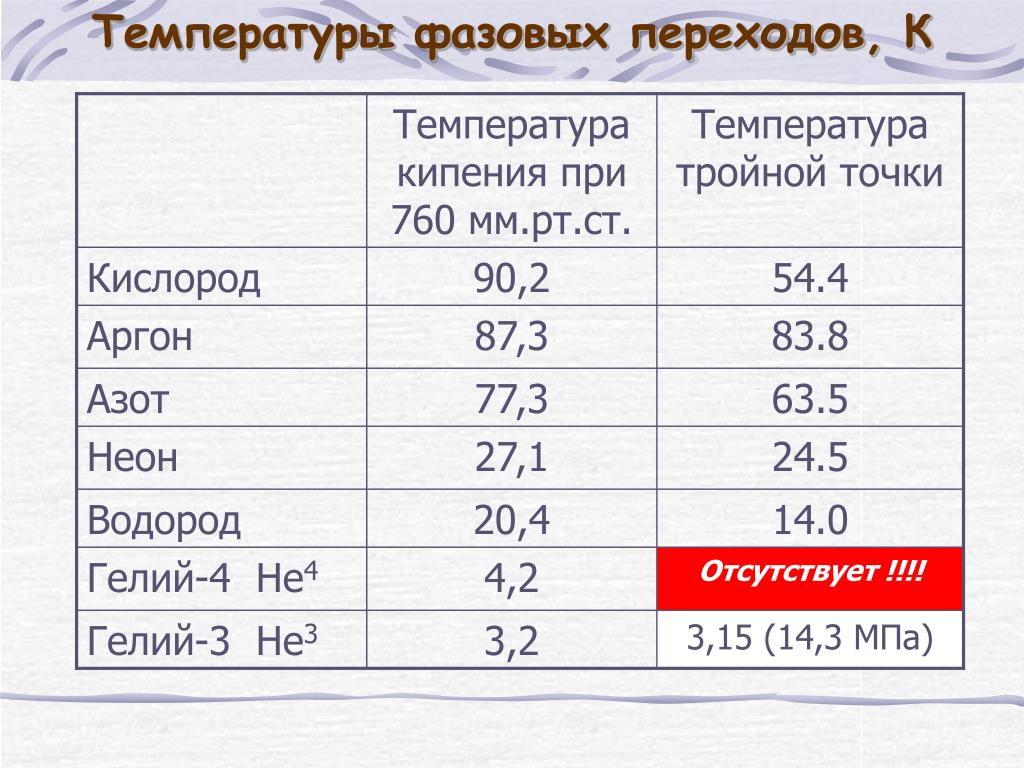 На протяжении веков мы постоянно совершенствовали системы, технологии, методы и единицы, используемые для количественной оценки и выражения. Теперь произошел следующий этап этого процесса. Кельвин (К) — единица измерения температуры в СИ — теперь имеет радикально новое определение.
На протяжении веков мы постоянно совершенствовали системы, технологии, методы и единицы, используемые для количественной оценки и выражения. Теперь произошел следующий этап этого процесса. Кельвин (К) — единица измерения температуры в СИ — теперь имеет радикально новое определение.
В повседневной жизни температурная шкала Кельвина, названная в честь знаменитого британского физика лорда Кельвина (1824–1907), встречается редко. Люди больше знакомы со шкалами Фаренгейта и Цельсия, которые используются для большинства практических измерений температуры, таких как прогнозы погоды, приготовление пищи, производство и т. д.Исторически сложилось так, что обе шкалы сосредоточены вокруг определенных точек, таких как точка таяния льда, температура человеческого тела или точка кипения воды.
Единица измерения Кельвина не выражается в градусах, как в градусах Цельсия или Фаренгейта. Он используется сам по себе для описания температуры. Например, «ртуть теряет все электрическое сопротивление при температуре 4,2 Кельвина».
Изменение на один кельвин равносильно изменению температуры на один градус Цельсия, но шкала Кельвина является «абсолютной» в том смысле, что она начинается с абсолютного нуля, или того, что Кельвин и другие ученые называли «бесконечным холодом».(0 K = -273,15 градуса C = -459,67 градуса F. Температура в помещении составляет около 70 градусов F, 21 градус C или 294 K.)
Концепция абсолютной температурной шкалы мощна; это отличается от простой относительной температуры, когда говорят, что объекты горячее или холоднее, чем что-то еще. Абсолютная, термодинамическая температура объекта дает информацию о том, какой средней энергией движения (кинетической энергией) обладают его атомы и молекулы.
Важное отступление: согласно классической физике 19-го века, движение полностью прекращается при абсолютном нуле.Но согласно квантовой теории, введенной в 20-м веке, материя действительно имеет случайное движение при абсолютном нуле, называемое «движением в нулевой точке», благодаря квантовой концепции, известной как принцип неопределенности Гейзенберга, который диктует, что положение и импульс объект не может быть известен с полной уверенностью в то же время. Движение в нулевой точке не считается тепловым (тепловым) движением и, следовательно, не является частью определения термодинамической или абсолютной температуры. При абсолютном нуле существует только квантово-механическое движение нулевой точки.
Движение в нулевой точке не считается тепловым (тепловым) движением и, следовательно, не является частью определения термодинамической или абсолютной температуры. При абсолютном нуле существует только квантово-механическое движение нулевой точки.
Шкала Кельвина широко используется в науке, особенно в физических науках. В быту чаще всего встречается как «цветовая температура» лампы. Старомодная лампа накаливания, излучающая желтоватый свет, имеет цветовую температуру около 3000 К. Иными словами, это означает, что ее желтоватый спектр очень похож на естественное излучение горячего объекта при температуре 3000 К. Лампа с цветовой температурой от 5000 до 5600 К, которая содержит больше синего света, обычно обозначается как «дневной свет» или «полный спектр», поскольку температура поверхности солнца составляет около 5800 К.Многие новые светодиодные светильники попадают в этот диапазон или идут еще выше.
В 1954 году кельвин был определен как доля 1/273,16 термодинамической температуры тройной точки воды — точки, в которой вода, лед и водяной пар сосуществуют в равновесии. Это ценная общая ссылка, потому что для точной формулы воды при определенном давлении тройная точка всегда возникает при одной и той же температуре: 273,16 К.
Это ценная общая ссылка, потому что для точной формулы воды при определенном давлении тройная точка всегда возникает при одной и той же температуре: 273,16 К.
Экстраполяция температуры тройной точки воды на очень высокие или очень низкие температуры проблематична; так, по международному соглашению указана 21 другая определяющая точка, начиная от точки замерзания гелия и заканчивая точкой замерзания меди.
Однако кельвин был переопределен с точки зрения постоянной Больцмана, которая связывает количество термодинамической энергии в веществе с его температурой. Когда пересмотренный SI был утвержден в ноябре 2018 года, новое определение стало следующим:
.Кельвин, символ K, является единицей термодинамической температуры в системе СИ; его величина устанавливается путем фиксирования числового значения постоянной Больцмана, равного точно 1,380649 × 10 -23 …J K -1 [джоулей на кельвин].
Если это кажется пустяком, вы не ошибетесь! Чтобы лучше понять контекст и значение этого исторического переопределения, полезно узнать больше о прошлом, настоящем и будущем измерения температуры.
Программа преобразования температуры (градусы Фаренгейта-Цельсия-Кельвина)
С помощью этой программы можно преобразовать единицы измерения температуры (градусы Цельсия, Кельвина и градусы Фаренгейта).
Расчет охлаждения ветром
Определение температуры:Тенденция вещества или объекта передавать тепло окружающей среде.
Определение термодинамической температуры:
Кельвин, единица измерения термодинамической температуры, представляет собой долю 1/273,16 термодинамической температуры тройной точки воды (13de CGPM (1967), рез. 4)
Ссылка: http: //www.nmi.nl/english/about_metrology/quantities_and_units/definition_of_the_basic_units.htm
Ссылка: http://physics.nist.gov/cuu/Units/current.html
На 13-й ГКМВ в 1967 г. было решено, что единица температуры будет кельвин, а не «градусы Кельвина».Тройная точка воды равна 273,16 К, что составляет 0,01 o С (градусы Цельсия).
Определение градусов Цельсия:Шкала Цельсия определяется следующими двумя точками:
- Тройная точка воды определяется как 0,01 o C.

- Один градус Цельсия равен изменению температуры с один градус по шкале идеального газа.
Тройная точка — это теоретическая точка, в которой сходятся вместе три фазы вещества (например, воды).Это означает, что жидкая, твердая и газообразная фазы из вещества возникают одновременно. Это практически невозможно.
История измерения температуры: Идея измерения температуры существует давно. Одним из первых, кто захотел сделать температурную шкалу, был Гален (ок. 170 г.). У него была шкала из 4 градусов тепла и 4 градусов холода. Более ранние приборы для измерения температуры назывались термоскопами. В 1610 году Галилей ввел в термоскопы вместо воздуха вино.В 1724 году Габриэль Фаренгейт ввел ртуть в термоскопы. Причина использования ртути заключается в том, что тепловое расширение ртути велико, в основном однородно, и она не прилипает к стеклу. Ртуть также остается в жидкой фазе в широком диапазоне температур. Это также легко читать.
Существующие температурные шкалы имеют две основные точки: с момента, когда вода начинает замерзать и когда она начинает кипеть.Между этими двумя температурами составляется шкала. Двумя самыми популярными шкалами являются шкала Цельсия (изготовленная Андерсом Цельсиусом) и шкала Фаренгейта (изготовленная Габриэлем Фаренгейтом). Шкала Фаренгейта определяется таким образом, что точка плавления воды составляет 32 градуса по Фаренгейту, а точка кипения — 212 градусов по Фаренгейту. Это означает, что между точкой замерзания и точкой кипения 180 делений. Фаренгейт представил свою шкалу в 1724 году.
Еще одна шкала — шкала Цельсия. По шкале Цельсия точка замерзания воды установлена на уровне 0 градусов (по Цельсию), а точка кипения равна 100 градусам (по Цельсию).Эта шкала существует на 100 делений, также известная как сантишкала. В 1948 году сантиградусы (шкала стоградусов) были заменены градусами Цельсия ( o C). Шкала Цельсия определяется следующими двумя точками:
Шкала Цельсия определяется следующими двумя точками:
- Тройная точка воды определяется как 0,01 o C.
- Один градус Цельсия равен изменению температуры на один градус по шкале идеального газа.
По шкале Цельсия температура кипения воды при давлении 1 атмосфера равна 99.975 o C. В сантишках это было 100.
Температурная шкала СИ:Температура связана с кинетической энергией молекул. Кинетическая энергия изменяется при изменении температуры. Температура определяется как перенос тепла между двумя объектами. Фундаментальной температурной шкалой является шкала Кельвина. Температурная шкала Кельвина зависит от точки абсолютного нуля. Это точка, в которой молекулы больше не двигаются, поэтому они не дают тепла.Это для всех молекул. Точка абсолютного нуля находится на 0 К, это -273,15 o С. Шкала такая же, как и у шкалы Цельсия.
Lenntech BV не несет ответственности за ошибки программирования или расчетов на этом листе. Не стесняйтесь обращаться к нам для получения любой обратной связи.
Не стесняйтесь обращаться к нам для получения любой обратной связи.
Рекомендуемая литература по теме: Меркурий
Тепловые свойства вещества
Тепловые свойства веществаТепловые свойства вещества
Удельная теплоемкость:
(ккал/(кг o C))
| Вода | 1.0 |
|---|---|
| Лед | 0,49 |
| Пар | 0,48 |
| Стекло | 0,20 |
| Сталь | 0,11 |
| Медь | 0,092 |
| Алюминий | 0,215 |
Единица ккал (килокалория) является единицей энергии.
1 ккал = 4186 Дж
В единицах ккал/(кг o С) удельная теплоемкость воды равна 1.
При переходе тепла от одного материала к другому температура контакта
слой более холодного материала увеличивается. От тепловой энергии контактного слоя
должен распространяться по холодному материалу путем проводимости или конвекции. Как
Эффективность передачи тепла зависит от удельная теплоемкость материал. Удельная теплоемкость с – это количество энергии, необходимое для
повысить температуру одного кг материала на 1 градус Кельвина или Цельсия.
Как
Эффективность передачи тепла зависит от удельная теплоемкость материал. Удельная теплоемкость с – это количество энергии, необходимое для
повысить температуру одного кг материала на 1 градус Кельвина или Цельсия.
с = ΔQ/(мΔТ).
Удельная теплоемкость: (ккал/(кг o C))
Удельная теплоемкость воды примерно в 4 раза выше, чем у воздуха. Точная удельная теплоемкость вещества зависит от условие, при котором он измеряется. Для газов удельная теплоемкость измеренная при постоянном объеме, отличается от удельной теплоемкости измеряется при постоянном давлении.
Чем меньше удельная теплоемкость материала, соприкасающегося с кожей,
тем меньше тепла требуется для доведения температуры пограничного слоя до
температура вашей кожи.Как быстро тепло уносится от этой границы
слой теперь зависит от теплопроводности материала и от того,
нет конвекционных токов. Чтобы свести к минимуму потерю тепла кожей,
окружить его материалом с низкой удельной теплоемкостью и низкой проводимостью, и
предотвратить конвекцию. Кроме того, вы должны свести к минимуму потери тепла через излучение.
Кроме того, вы должны свести к минимуму потери тепла через излучение.
Проблема:
Образец меди массой 50 г находится при 25 o С.Если 1200 Дж тепловой энергии добавляется к нему, какова конечная температура меди?
Решение:
- Обоснование:
Мы знаем удельную теплоемкость меди, поэтому знаем, какую энергию она требуется, чтобы поднять температуру одного кг меди на 1 градус Кельвина или Цельсия. - Детали расчета:
ΔT = ΔQ/(см·м). Для меди с = 9,2*10 -2 ккал/( кг o С).
ΔT = 1200 Дж*(1 ккал/4186 Дж)/(0.05 кг*9,2*10 -2 ккал/(кг o C)) = 62,3 o С.
T = 87,3 o С.
Проблема:
Алюминиевый калориметр массой 100 г содержит 250 г воды. То
калориметр и вода находятся в тепловом равновесии при 10 o С.
Два металлических блока помещаются в воду. Один кусок 50 г.
медь при 80 o C. Другой имеет массу 70 г и
исходно при температуре 100 o С.Вся система
стабилизируется при конечной температуре 20 o C.
Другой имеет массу 70 г и
исходно при температуре 100 o С.Вся система
стабилизируется при конечной температуре 20 o C.
(a) Определите удельную теплоемкость неизвестного образца.
(b) Угадайте материал неизвестного образца.
Решение:
- Обоснование:
Калориметр минимизирует обмен энергией с окружающая обстановка. Таким образом, полная энергия системы равна (приблизительно) постоянный.
ΔQ всего = ΔQ вода + ΔQ алюминий + ΔQ медь + ΔQ неизвестный объект = 0. - Детали расчета:
Температура алюминиевого калориметра и температура воды повышаются на 10 o C. Количество энергии, полученное объектом, температура которого повышается на ΔT, равно ΔQ = мкΔТ.
Приток воды ΔQ воды = 0,25 кг*1 ккал/(кг o Кл)*10 o Кл = 2,5 ккал.
Прирост алюминия ΔQ алюминия = 0,1 кг*0,215 ккал/(кг o Кл)*10 o Кл = 0. 215 ккал.
215 ккал.
Температура меди падает 60 o С.
Потери меди ΔQ меди = -0,05 кг*0,092 ккал/(кг o Кл)*60 o Кл = -0,276 ккал.
Таким образом, неизвестный объект теряет ΔQ unknown объект = (-2,5 + -0,215 + 0,276) ккал = -2,439 ккал.
Его удельная теплоемкость c = ΔQ/(m ΔT) = 2,439/(0,07*80) ккал/(кг o С) = 0,436 ккал/(кг o Кл) = 1,82 Дж/(г К).
Неизвестный материал, вероятно, бериллий.
Вопрос:
Почему температура в прибрежных городах достаточно стабильна, но в пустыне оно может значительно различаться между днем и ночью?
Ответ:
Ключевым фактором здесь является вода. Вода имеет высокую удельную теплоемкость, поэтому она способна
сохранять, поглощать и высвобождать много энергии. У побережья вода поглощает тепло
в течение дня и хранит его, высвобождая ночью, действуя как теплоотвод.
В пустыне мало воды, чтобы запасать энергию и высвобождать ее в таком количестве. цикла, поэтому температура гораздо более чувствительна к тому, светит солнце или нет.
цикла, поэтому температура гораздо более чувствительна к тому, светит солнце или нет.
Материя существует в разных состояниях. Может, для например, быть в твердом, жидком или газообразном состоянии. Эти состояния называются фазами . Атомы и молекулы, составляющие материю, движутся по-разному в разные фазы.
- В твердом теле атомы колеблются около равновесия позиции, но не могут течь или распространяться. Межмолекулярный силы очень сильны, а импульсивные силы от столкновений атомы с тепловой энергией в среднем значительно слабее.
- В жидкостях атомы или молекулы могут протекать мимо друг друга, но поддерживают тесный контакт. Некоторый порядок сохраняется в диапазоне нескольких молекулярных диаметров. То межмолекулярные силы не пренебрежимо малы по сравнению с импульсивные силы от столкновений с атомами тепловой энергии и молекулы.
- В газах атомы или молекулы движутся свободно.
Их среднее расстояние намного больше атомного или
диаметр молекулы и межмолекулярная сила становятся
пренебрежимо малы по сравнению с импульсивными силами от столкновений с
теплоэнергетические атомы и молекулы.
 Поведение большинства газов
хорошо описывается законом идеального газа, PV = Nk B T.
Поведение большинства газов
хорошо описывается законом идеального газа, PV = Nk B T.
Как правило, тепло передается от объекта с более высокой температурой к
объект более низкой температуры. Температура – это величина, которая
указывает, будет ли течь теплота и в каком направлении она
будет течь. При переходе тепла от более горячего к более холодному объекту
температура более горячего объекта уменьшается, а температура
более холодный объект поднимается.Средняя кинетическая энергия
молекул в более горячем объекте уменьшается, а среднее кинетическое
энергия молекул в более холодном объекте увеличивается. Но когда
объект меняет фазу, его температура не меняется, хотя
добавляется или отводится тепло. плавится льда и кипящей воды
являются знакомыми примерами. Во время смены фаза температура не меняется, но внутренняя
энергия делает.Внутренняя энергия равна сумме кинетической энергии
молекул и химической потенциальной энергии
молекулы. При фазовом переходе средняя кинетическая энергия
молекулы остаются прежними, но средняя потенциальная энергия
изменения.
При фазовом переходе средняя кинетическая энергия
молекулы остаются прежними, но средняя потенциальная энергия
изменения.
Процессы, обозначенные красными стрелками, требуют
энерговклад.
Процессы, представленные черными стрелками, высвобождают энергию.
Плавление это фазовый переход .
Лед и вода — разные фазы одного и того же вещества. При атмосферном
сжатый лед существует при температурах ниже 0 o C. Если мы хотим
повысить температуру 1 кг льда на 1 градус Цельсия, скажем, с -5 до С
до — 4 o С, нам потребуется 0,49 ккал тепла. Но если мы хотим расплавиться
1 кг льда при 0 o С нам нужно 80 ккал тепла. Это тепло
используется для разрыва химических связей и преобразуется в потенциальную энергию. это
называется скрытой теплотой плавления или скрытой теплотой плавления
сплав (L f ).Скрытая теплота – это теплота, изменяющая фазу
вещество без изменения его температуры. Когда мы нагреваем смесь
вода и лед, тепло будет перетекать из воды в лед при 0 o C
пока весь лед не растает. Если бы мы могли термически изолировать смесь, она
достигло бы теплового равновесия при 0 o C, и лед больше не таял бы.
Если теплота отводится от воды при температуре 0 o C, она замерзает в лед, а не превращается в лёд.
становится холоднее. Замораживание выпускает
скрытая теплота плавления.
Когда мы нагреваем смесь
вода и лед, тепло будет перетекать из воды в лед при 0 o C
пока весь лед не растает. Если бы мы могли термически изолировать смесь, она
достигло бы теплового равновесия при 0 o C, и лед больше не таял бы.
Если теплота отводится от воды при температуре 0 o C, она замерзает в лед, а не превращается в лёд.
становится холоднее. Замораживание выпускает
скрытая теплота плавления.
При замораживании выделяется большое количество тепла. То поэтому температура большого водоема очень стабильна вблизи точки замерзания. Зимняя погода умеренная до большой степени этим фактором. Зимние температуры останутся около 0 o C, пока вся местная вода не замерзнет. Но также требуется много энергии, чтобы растопить лед, и поэтому Местные температуры не сильно повышаются до тех пор, пока лед не растаял.
Кипение является фазовым переходом . Вода и
пар – это разные фазы одного и того же вещества. При атмосферном давлении
вода существует при температуре от 0 o C до 100 o C. Если
мы хотим поднять температуру 1 кг воды на 1 градус Цельсия, скажем, от
50 o C до 51 o C нам потребуется 1 ккал тепла. Но если мы
хотим вскипятить 1 кг воды при температуре 100 o С и превратить ее в пар, который нам нужен
540 ккал тепла.Это называется скрытым теплота парообразования (L V ). Он используется для разрыва
связи, удерживающие молекулы воды в жидкости. Кипение
температура воды зависит от давления. Чем ниже давление, тем ниже
это температура кипения. При более низком давлении молекулам требуется меньше кинетических
энергии для выхода из жидкости.
При атмосферном давлении
вода существует при температуре от 0 o C до 100 o C. Если
мы хотим поднять температуру 1 кг воды на 1 градус Цельсия, скажем, от
50 o C до 51 o C нам потребуется 1 ккал тепла. Но если мы
хотим вскипятить 1 кг воды при температуре 100 o С и превратить ее в пар, который нам нужен
540 ккал тепла.Это называется скрытым теплота парообразования (L V ). Он используется для разрыва
связи, удерживающие молекулы воды в жидкости. Кипение
температура воды зависит от давления. Чем ниже давление, тем ниже
это температура кипения. При более низком давлении молекулам требуется меньше кинетических
энергии для выхода из жидкости.
Кипящая вода не повышает температуру
выше 100 o C, пока вся вода не испарится.Пар, который мы видим,
не водяной пар, который невидим, а скопление мелкой воды
капли, которые образуются при охлаждении газообразного водяного пара.
Фазы материи
Добавление тепла в заданную фазу изменяет температуру.
Удельная теплоемкость c: ΔQ = c*m*ΔT
Добавление тепла во время фазового перехода преобразует одну фазу в другую фазу.
без изменения температуры.
Скрытая теплота L: ΔQ = m*L
Проблема:
Сколько тепловой энергии требуется, чтобы превратить кубик льда массой 40 г из твердого тела при -10 o C в пар при 110 o C?
Решение:
- Обоснование:
Тепловой энергии требуется на
поднять температуру льда до 0 o С,
растопить лед,
поднять температуру воды до 100 o C,
кипятить воду,
и поднять температуру пара до 110 o С, - Детали расчета:
Поднять температуру льда до 0 o C нам нужно
ΔQ = 0.04 кг*(0,49 ккал/(кг o С))*10 o С = 0,196 ккал.
Чтобы растопить лед, нам нужно
ΔQ = 0,04 кг * 80 ккал/кг = 3,2 ккал.
Для повышения температуры воды до 100 o C нам нужно
ΔQ = 0,04 кг*(1 ккал/(кг o C))*100 o С = 4 ккал.
Для кипячения воды нужно
ΔQ = 0,04 кг*540 ккал/кг = 21,6 ккал.
Для повышения температуры пара до 110 o С нужно
ΔQ = 0,04 кг*(0,48 ккал/(кг o С))*10 или С = 0.192 ккал.
Общая необходимая тепловая энергия составляет
(0,196 + 3,2 + 4 + 21,6 + 0,192) ккал = 29,188 ккал.
Проблема:
Если 90 г расплавленного свинца при его температуре плавления
327,3 o С заливают в отливку массой 300 г
форме из железа и первоначально при 20 o С, что является конечным
температура системы? Предположим, что энергия не теряется
к окружающей среде.
Свинец: скрытая теплота L f = 2,45*10 4 Дж/кг, удельная теплоемкость с = 128 Дж/(кг o С).
Железо: удельная теплоемкость с = 448
Дж/(кг o Кл).
Решение:
- Обоснование:
Энергосбережение: Энергия, выделяемая свинцом, поглощается железо.
Температура плавления свинца 327,3 o C. Свинец будет выделять энергию по мере затвердевания и охлаждения до температуры T.
Железо будет поглощать энергию по мере нагревания до температуры T. - Детали расчета:
Предположим, что конечная температура системы равна T.
Тогда количество энергии, выделяемой свинца при затвердевании составляет
ΔQ = 0,09 кг*(2,45*10 4 Дж/кг) = 2205 Дж,
, а количество энергии, выделяемой при его охлаждении, равно
ΔQ = 0,09 кг*(128 Дж/(кг o Кл))*(327,3 o Кл — Т) = (11,52 Дж/ o Кл)*(327,3 или С-Т).
Эта энергия поглощается железом. Таким образом, для железа мы имеем
2205 Дж + (11,52 Дж/ o Кл) * (327,3 o Кл — Т) = 0.3 кг*448 Дж/(кг o Кл))*(Т — 20 o Кл).
5975,5 Дж — (11,52 Дж/ o Кл)*T = (134 Дж/ o Кл)*T — 2688 Дж.
8663,5 Дж = (145,52 Дж/ o Кл)*T.
Т = 59,5 o С.
Выпаривание и сублимация
Температура вещества является мерой средней кинетической энергии атомов или молекулы, из которых состоит вещество. Но не все частицы имеют одинаковую кинетическую энергии, они имеют распределение энергий.Некоторые частицы в жидкости или твердое тело может иметь достаточную кинетическую энергию, чтобы разорвать химические связи и оставить вещество. Жидкость испаряется а твердое тело сублимация . Когда частицы с наибольшей кинетической энергией покидают вещество, средняя кинетическая энергия оставшихся частиц уменьшается. Поэтому температура вещества уменьшается. Испарение охлаждает вещество.
Игрушка, демонстрирующая процесс охлаждения
Испарение — это диппи-птица.Диппи-птица изготавливается путем выдувания
стеклянная трубка, впадающая в колбу, как горловина воронки. Этот
верхняя луковица становится головой птицы. Вторая лампочка становится
тело. Трубка доходит почти до дна этого нижнего
луковица, как соломинка в безалкогольный напиток.
Этот
верхняя луковица становится головой птицы. Вторая лампочка становится
тело. Трубка доходит почти до дна этого нижнего
луковица, как соломинка в безалкогольный напиток.
Птица наполнена жидкостью с высоким давлением паров. Голова птицы покрыта пухом, что дает большую площадь для испарение. Когда голова мокрая, испарение вызывает охлаждение и конденсация газа внутри фары, и давление капли.Это заставляет жидкость ползти вверх по шее в область более низкого давления. Центр тяжести смещается к голове конец птицы. Птица падает в стакан с водой, где пух снова становится влажным. Но когда птица достигает своего максимальная обедненность, нижний конец трубки торчит из жидкости, и жидкость может вытекать из трубки обратно в нижнюю колбу. Это смещает центр тяжести назад и смешивает газ. Процесс продолжается пока в стакане есть вода.
Ссылка: инженерия пьющей птицы (Youtube)
Терминология для различных фазовых переходов:
| Из жидкости в газ: | Испарение |
|---|---|
| Из газа в жидкость: | Конденсат |
| Твердое вещество в газообразное: | Сублимация |
| Из газа в твердое: | Депонирование |
Относительная влажность
Молекулы могут покидать жидкую воду в результате испарения, но молекулы также могут
повторно войти в жидкую воду, если в окружающем воздухе есть водяной пар. Мы
назовем это явление конденсацией . Относительная влажность – отношение скорости
конденсации к скорости испарения. Если уйдет в два раза больше молекул
жидкости, чем возвращаются в жидкость, то относительная влажность равна 0,5
или 50%. Относительная влажность зависит от температуры и от
плотность водяного пара в воздухе. Чем выше температура, тем
выше средняя кинетическая энергия молекул и, следовательно, скорость при
которые они уходят.Чем выше плотность водяного пара в воздухе,
тем выше скорость возвращения молекул.
Мы
назовем это явление конденсацией . Относительная влажность – отношение скорости
конденсации к скорости испарения. Если уйдет в два раза больше молекул
жидкости, чем возвращаются в жидкость, то относительная влажность равна 0,5
или 50%. Относительная влажность зависит от температуры и от
плотность водяного пара в воздухе. Чем выше температура, тем
выше средняя кинетическая энергия молекул и, следовательно, скорость при
которые они уходят.Чем выше плотность водяного пара в воздухе,
тем выше скорость возвращения молекул.
В закрытом контейнере при заданной температуре равновесие будет
достигнут, и количество молекул воды, покинувших поверхность воды, будет
равно числу, возвращаемому в единицу времени. Давление водяного пара при
равновесие называется давлением насыщенных паров . В
более высокая температура, больше молекул может покинуть поверхность и насыщенный пар
давление выше. Температура, при которой давление пара равно
к атмосферному давлению называется температурой кипения. Если жидкость
открытым для воздуха, то давление пара рассматривается как парциальное давление вдоль
с другими составляющими воздуха.
Температура, при которой давление пара равно
к атмосферному давлению называется температурой кипения. Если жидкость
открытым для воздуха, то давление пара рассматривается как парциальное давление вдоль
с другими составляющими воздуха.
При температуре ниже 100 o C вода, оставленная открытой для
воздуха, медленно испаряется с его поверхности. Давление его паров намного ниже, чем
атмосферное давление. Внутри также образуются микроскопические пузырьки.
но эти крошечные пузырьки водяного пара с низким давлением, равным
давление, немедленно подавляются гораздо более высоким давлением
атмосфера давит на поверхность жидкости.Когда вода нагревается и
его температура достигает 100 o C, его давление пара достигает
давление окружающего воздуха. Теперь пузырьки, которые образуются при испарении в
внутренности жидкости больше не подавляются. Они вырастают до больших размеров, поднимаются
на поверхность и выпускают пары в воздух. Это иногда взрывоопасно
испарение, которое начинается внутри жидкости, называется кипением.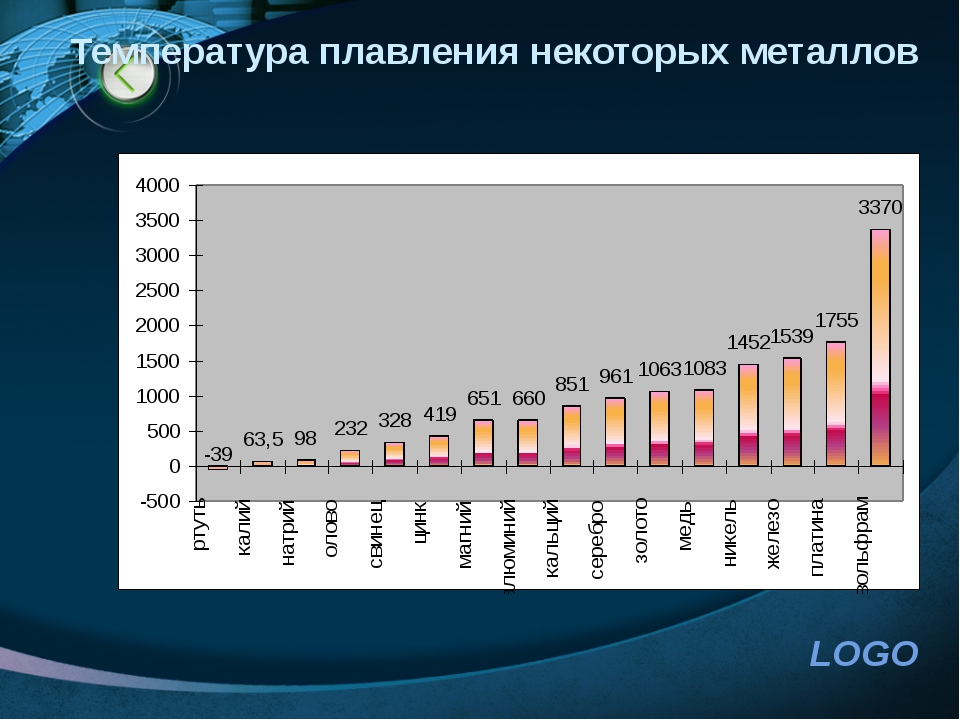 Пузыри
представляют собой водяной пар, возможно смешанный с небольшим количеством воздуха, который раньше
растворил воду.Ранее растворенный воздух также производит крошечные пузырьки.
которые появляются в начале процесса нагрева.
Пузыри
представляют собой водяной пар, возможно смешанный с небольшим количеством воздуха, который раньше
растворил воду.Ранее растворенный воздух также производит крошечные пузырьки.
которые появляются в начале процесса нагрева.
Вопрос:
Погода в Ноксвилле летом часто жаркая и влажная. Под теми условиях, почему время после восхода солнца самое комфортное время суток? Почему это не время сразу после захода солнца, когда температура начинает падать? немного опуститься?
Ответ:
Сразу после восхода солнца, когда температура повышается, скорость испарения
увеличивается.Однако количество водяного пара в воздухе все еще невелико.
Поэтому скорость конденсации и относительная влажность довольно низкие.
Таким образом, пот на коже испаряется. Испарение охлаждает оставшуюся
пот и, посредством проводимости, кожу. Так как плотность водяного пара в
воздух увеличивается, чистая скорость испарения уменьшается, потому что больше и
больше молекул попадает в жидкость. Пот больше не охлаждает
кожу эффективно. Сразу после захода солнца, когда температура падает,
влажность увеличивается еще больше, потому что скорость испарения падает, но
плотность водяного пара в воздухе по-прежнему высока.
Пот больше не охлаждает
кожу эффективно. Сразу после захода солнца, когда температура падает,
влажность увеличивается еще больше, потому что скорость испарения падает, но
плотность водяного пара в воздухе по-прежнему высока.
Вопрос:
Работала бы «Dippy Bird», если бы влажность была 100%?
Фазовые диаграммы
Каждое вещество может существовать в твердом, жидком или газообразном состоянии. Фазовая диаграмма представляет собой график всех кривых равновесия между любые две фазы на диаграмме давление-температура. Точная форма фазовая диаграмма зависит от вещества. Там только одна точка диаграмма, на которой все три фазы чистого вещества находятся в равновесие.Это называется тройной точкой .
Модуль 9: Вопрос 2
Какая связь между теплом и температурой? Объяснять!
Обсудите это со своими однокурсниками на форуме!
Интерметаллиды и пустоты Киркендалла продолжают расти при комнатной температуре | Доктор Рон Ласки | Блоги Indium Corporation
Народ,
В моем последнем посте я обсуждал интерметаллические соединения (IMC) и то, что я назвал «чудом пайки».Я также упомянул, что исследования, посвященные хрупкому характеру IMC, показывают, что сбои в стресс-тестах более вероятны из-за отказов между интерфейсами IMC и припоем, IMC и медью или IMC (Cu 6 Sn). 5 с Cu 3 Sn) сами по себе и не связаны с каким-либо предполагаемым хрупким характером IMC.
Другим механизмом ослабления при пайке и термическом старении паяных соединений являются пустоты Киркендалла .Пустоты Киркендалла образуются, когда один металл диффундирует в другой металл быстрее, чем наоборот. Интерфейс медь-олово отображает такой механизм. Медь диффундирует в олово быстрее, чем олово в медь. Этот механизм может привести к фактическим пустотам в меди на границе раздела металлов. См. изображение ниже. В дополнение к возможной слабости на границе раздела избыточная медь, которая диффундирует в олово, создает сжимающие напряжения, которые могут привести к образованию усов олова .
Пустоты Киркендалла.Источник: http://www.jfe-tec.co.jp/en/electronic-component/case/img/case_solder_02.png
IMCи пустоты Киркендалла образуются довольно быстро при температурах пайки. Однако даже при комнатной температуре IMC и пустоты Киркендалла продолжают расти, хотя и со значительно меньшей скоростью. Причина этого продолжающегося роста заключается в том, что по абсолютной температуре или по шкале Кельвина комнатная температура составляет значительную часть температуры плавления припоев. Например, температура плавления SAC составляет около 219°C, эта температура равна 492K (219+273), тогда как комнатная температура составляет 295°K, поэтому комнатная температура составляет 60% от температуры плавления SAC припоя ( 295/492 = 0.60). Сравните эту ситуацию со сталью, которая плавится при температуре около 1480°С. Сталь будет раскалена докрасна при 60 % (780 °C) ее температуры плавления по абсолютной шкале. Таким образом, поскольку комнатная температура составляет 60% пути к плавлению, процессы формирования IMC и Киркендалла не останавливаются при комнатной температуре.

 усилия выталкивания kN
усилия выталкивания kN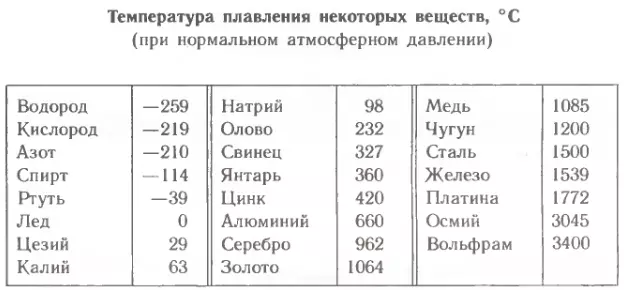 усилия выталкивания kN
усилия выталкивания kN
 215 ккал.
215 ккал.  Поведение большинства газов
хорошо описывается законом идеального газа, PV = Nk B T.
Поведение большинства газов
хорошо описывается законом идеального газа, PV = Nk B T.
