описание и свойства металла, 2 способа получения, сферы применения и месторождения
Этот металл – один из самых распространенных на планете. Его значение для человека неоценимо: титан стал «дублером» поврежденных зубов и суставов. У него есть фанаты, стремящиеся заменить все свои кости титановыми.
Содержание
- Что представляет собой
- История открытия
- Физико-химические характеристики
- Технология получения
- Месторождения, добыча
- Присутствие в природе
- Где используется
- Промышленность
- Медицина
- Другие сферы
- Марки и сплавы
- Предостережение
Что представляет собой
Титан – элемент периодической системы Менделеева №22. Международное обозначение – Titanium (Ti).
Это блестящий серебристый металл. Легок, прочен, устойчив к коррозии.
По составу представляет собой конгломерат пяти стабильных изотопов.
История открытия
История открытия металла связана с именами нескольких ученых:
- В конце 18 века немец Мартин Клапрот и англичанин Уильям Грегор одновременно открыли диоксид вещества.

- Через десять лет их компанию пополнил француз Луи-Николя Воклен.
- К середине 19 века Иенс Берцелиус получил металлический титан.
- Еще через сто лет материал повышенной чистоты выделили голландцы.
Название нового вещества предложил Клапрот: по учрежденной им традиции химик назвал открытый элемент именем персонажа греческой мифологии.
Титаны – это дети главных богов греческого пантеона Зевса и Геи. То есть второе поколение богов.
Физико-химические характеристики
Свойства металла хорошо изучены:
- Легко реагирует с кислотами даже малой концентрации.
- Это тугоплавкий металл: температура плавления – 1670°C. Для вскипания требуется вдвое больше.
- Пластичен, хрупкость обретает на морозе (-80°C).
- На прочность влияет степень очистки, но не температура.
- При комнатной температуре покрывается оксидной пленкой, что делает его устойчивым к коррозии (исключая щелочи).

- При обычном давлении существует два вида титана с разными типами решеток: высоко- и низкотемпературный.
Легкость, почти невесомость – главное свойство, по которому титан легко отличить от других металлов.
| Свойства атома | |
|---|---|
| Название, символ, номер | Тита́н / Titanium (Ti), 22 |
| Атомная масса (молярная масса) | 47,867(1) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d2 4s2 |
| Радиус атома | 147 пм |
| Химические свойства | |
| Ковалентный радиус | 132 пм |
| Радиус иона | (+4e)68 (+2e)94 пм |
| Электроотрицательность | 1,54 (шкала Полинга) |
| Электродный потенциал | −1,63 |
| Степени окисления | 2, 3, 4 |
| Энергия ионизации (первый электрон) | 657,8 (6,8281) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
Плотность (при н. у.) у.) | 4,54 г/см³ |
| Температура плавления | 1670 °C 1943 K |
| Температура кипения | 3560 K |
| Уд. теплота плавления | 18,8 кДж/моль |
| Уд. теплота испарения | 422,6 кДж/моль |
| Молярная теплоёмкость | 25,1 Дж/(K·моль) |
| Молярный объём | 10,6 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная плотноупакованная (α-Ti) |
| Параметры решётки | a=2,951 с=4,697 (α-Ti) |
| Отношение c/a | 1,587 |
| Температура Дебая | 380 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 21,9 Вт/(м·К) |
| Номер CAS | 7440-32-6 |
Из-за повышенной вязкости механическая обработка металла затруднена. Этот недостаток устраняют, смазывая инструмент специальными составами.
Этот недостаток устраняют, смазывая инструмент специальными составами.
Технология получения
Технический прогресс частично отразился на способе получения металла.
Сегодня титан получают двумя методами:
- Процесс Кролла. Один из основных, предложен в 1940 году ученым из Люксембурга Гийомом Кроллом. Заключается в восстановлении металлического титана магнием при высоких температурах. Комбинаты, вырабатывающее такое сырье, именуются титано-магниевыми.
- FFC Cambridge. Новацией является электрохимическая технология. Она предполагает прямое восстановление металла из оксида в расплавленной смеси хлорида и оксида кальция. Процесс назван по именам разработчиков, сотрудников Кембриджского университета Фрэя, Фартинга, Чена.
Цена продукта доступна: титан разной степени очистки на мировых биржах торгуют по $5,7 – 6,1 за кг.
Месторождения, добыча
Месторождения равномерно распределены по планете. Российские залежи рассредоточены по всей территории страны (20 рудников). Крупнейшее – на севере, в Республике Коми.
Российские залежи рассредоточены по всей территории страны (20 рудников). Крупнейшее – на севере, в Республике Коми.
Добыча ведется традиционным способом, но предполагает использование средств защиты от пыли.
Мировые резервы руды оцениваются триллионом тонн. При нынешних темпах добычи титанового сырья хватит на полтора столетия.
Присутствие в природе
В природе титан представлен оксидами разных химических элементов (более ста). В свободном виде не встречается.
Не считается редким металлом: содержание в породах исчисляется килограммами на тонну (от 2,3 до 9).
Это девятый по распространенности элемент земной коры – более полупроцента по массе.
Больше всего его в бокситах и морской осадочной глине.
Породы плохо выветриваются, образуя крупные россыпи.
Где используется
Титан так же прочен, как сталь, но вполовину легче. Он вдвое превосходит по прочности алюминий, но тяжелее всего на 60%. Этими достоинствами обусловлено использование человеком титана как металла.
Этими достоинствами обусловлено использование человеком титана как металла.
Промышленность
Титановые сплавы – конструкционный материал номер один для строителей ракет, самолетов, океанских лайнеров. Чаще их выполняют из сплавов с другими металлами (особенно никелем и алюминием).
Титан легче других металлов, но способен работать при высоких температурах.
Есть и другие области применения металла:
- Трубы, насосы, другое оборудование для работы с агрессивными жидкостями.
- Военно-промышленный комплекс – бронированные жилеты, корпусы субмарин, детали ракет, самолетов.
- Установки для опреснения воды, очистки воздуха.
- Исходник при производстве целлюлозы, бумаги.
- Детали автомобилей, сельхозтехники, оборудование пищепрома.
- Спортивный инвентарь.
Более половины соединений вещества забирают производители лаков и красок.
Все больше продукции из титана припадает на IT-сферу: корпус, начинка мобильных телефонов, других гаджетов.
Медицина
Прочный металл дружелюбен к процессам, протекающим в организме человека. Поэтому его активно задействуют как материал протезов конечностей, зубных имплантов. Медицина ценит его свойство безболезненно сращиваться с костной тканью. Поэтому титан относится к металлам будущего.
Безопасность для тканей организма человека сделала возможным применение металла для пирсинга.
Другие сферы
Из титана изготавливают корпусы часов класса люкс. Это материал ювелирных изделий.
Часы из титанового сплаваНитридом вещества «золотят» купола храмов, предметы декора. Четырехвалентный хлорид «создает» дымовую завесу и дымчатость стекла.
Пищевая добавка Е171 – это белый диоксид титана (TiO2), пищевой краситель.
Марки и сплавы
Номенклатура титановых сплавов насчитывает десятки позиций.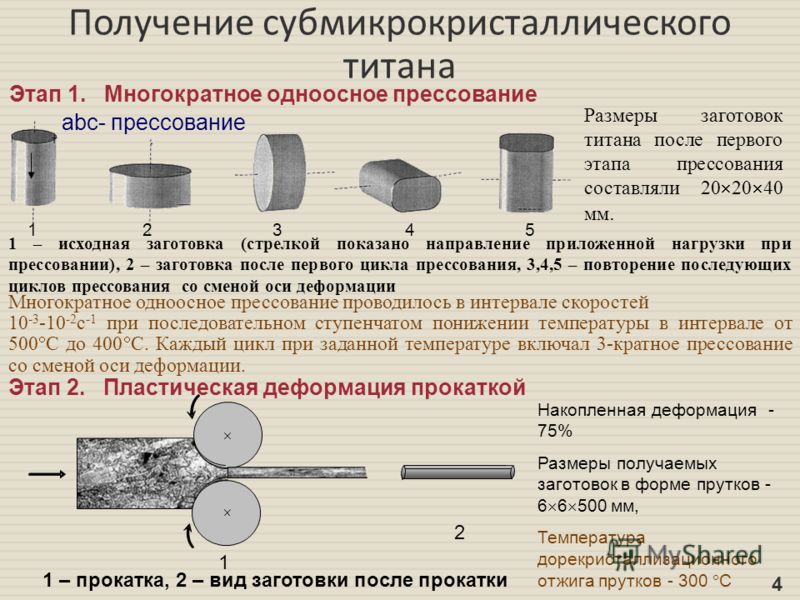
Самый востребованный – с алюминием и ванадием, 6% и 4% соответственно. На его производство тратится половина добываемого сырья.
Второй по популярности – ферротитан (соотношение титан-железо – 1:3). В черной металлургии это средство для очистки стали от примесей.
Чаще всего выплавляются следующие марки титана:
- ВТ1-0;
- ВТ1-00;
- ВТ1-00 св.
Это технический материал, без легирующих присадок. В нем минимум примесей: содержание Ti (%) – 99,24+.
Предостережение
Металлическое вещество безопасно. Опасность исходит от титановой пыли: она провоцирует онкологию. Это проблема людей, работающих на добыче руды, и металлургов.
Кроме того, титановая пыль – потенциальное взрывчатое вещество.
Пожар может сотворить и стружка металла.
Металлургия титана- Реферат | Металлургический портал MetalSpace.ru
В последние годы, в связи с разработкой способов получения технически чистого ковкого титана, положение резко изменилось. Началось усиленное развитие исследования титана и сплавов на его основе. В настоящее время проводиться большая экспериментальная работа по разработке и испытанию сплавов титана, о чем свидетельствует большое количество публикаций по этому вопросу за последние годы в мировой литературе. Большие природные ресурсы и замечательные свойства титана дают основания утверждать, что он станет одним из важнейших конструкционных материалов.
Началось усиленное развитие исследования титана и сплавов на его основе. В настоящее время проводиться большая экспериментальная работа по разработке и испытанию сплавов титана, о чем свидетельствует большое количество публикаций по этому вопросу за последние годы в мировой литературе. Большие природные ресурсы и замечательные свойства титана дают основания утверждать, что он станет одним из важнейших конструкционных материалов.
В данной работе рассматриваются вопросы истории открытия и изучения титана, его распространенности в космосе и на Земле, рассказывается о технологии получения титана и его соединений, о свойствах и об использовании человеком, о перспективах его применения в будущем.
В книге Зубкова Л.Б. «Космический металл. Все о титане» освещаются история открытия и изучения титана, его месторождения и добыча.
В работе Еременко В.Н. Титан и его сплавы приведены исчерпывающие данные о строении т свойствах двойных сплавов титана всех систем, исследованных до настоящего времени, а также сообщаются сведения о распространении титана в природе, объеме его производства, о способах получения, уплотнения и обработки металлического титана и его сплавов.
Истории открытия и изучения титана
В учебнике Б.А.Колачева, В.И.Елагина, В.А.Ливанова «Металловедение и термическая обработка цветных металлов и сплавов» изложены основные положения металловедения и термической обработки цветных металлов: алюминия, магния, бериллия, титана, меди, никеля, тугоплавких металлов и сплавов на их основе. Описаны свойства чистых металлов, принципы легирования сплавов, промышленные сплавы и их термическая обработка, области применения цветных металлов и сплавов на их основе.
Первооткрывателем титана считается 28-летний английский монах Уильям Грегор. Для своего времени, а это был конец XVIII в., он был весьма образованным человеком. Окончив Оксфордский университет, он стал бакалавром искусств и магистром наук, увлекался научными исследованиями, в том числе и минералогией. В 1790 г., проводя минералогические изыскания в своем приходе, он обратил внимание на распространенность и необычные свойства черного песка в долине Менакэна на юго-западе Англии и принялся его исследовать. В песке священник обнаружил большое количество мелких зерен черного блестящего минерала, притягивающегося обыкновенным магнитом. Грегор произвел с этим магнитным минералом несколько опытов: растворил его сначала в соляной, затем в серной кислоте, упарил раствор и получил белый порошок, который при прокалке желтел, а при спекании с углем приобретал голубой цвет. Исследованное природное образование черного цвета Грегор принял за новый, неизвестный ранее минерал, а выделенный из него белый порошок за новый элемент. Минералу и элементу дали название по местности, где они были найдены: минерал «менакэнит» и элемент «менакин». Сведения о них были впервые опубликованы через год после открытия, в 1791 г., в «Физическом журнале». По сегодняшним представлениям открытый в 1790 г. «менакэпит» был титаномагнетитом – смесью твердых растворов ильменита и магнетита, а белый порошок «менакин» – диоксидом титана[1, С.6-7].
В песке священник обнаружил большое количество мелких зерен черного блестящего минерала, притягивающегося обыкновенным магнитом. Грегор произвел с этим магнитным минералом несколько опытов: растворил его сначала в соляной, затем в серной кислоте, упарил раствор и получил белый порошок, который при прокалке желтел, а при спекании с углем приобретал голубой цвет. Исследованное природное образование черного цвета Грегор принял за новый, неизвестный ранее минерал, а выделенный из него белый порошок за новый элемент. Минералу и элементу дали название по местности, где они были найдены: минерал «менакэнит» и элемент «менакин». Сведения о них были впервые опубликованы через год после открытия, в 1791 г., в «Физическом журнале». По сегодняшним представлениям открытый в 1790 г. «менакэпит» был титаномагнетитом – смесью твердых растворов ильменита и магнетита, а белый порошок «менакин» – диоксидом титана[1, С.6-7].
В том же 1791 г. немецкий исследователь-химик Мартин Генрих Клапрот (1743-1817), академик Берлинской академии наук, а впоследствии почетный академик Российской Академии наук, первооткрыватель многих редких и цветных металлов – урана, циркония, теллура, молибдена, вольфрама, бария, марганца, ознакомился со статьей Грегора, но не заинтересовался этим открытием. Однако через несколько лет, в 1795 г., изучая рутил, именовавшийся тогда красным венгерским шерлом, он выделил из него диоксид нового металла – белый порошок, похожий на описанный ранее Грегором. И хотя до получения чистого металла было еще очень далеко – почти полтора столетия, Клапрот, обладая могучей научной интуицией, опираясь на исследования Грегора и на результаты собственных опытов, известил мир об открытии нового металла, которому дал название «титан». Вопреки распространенному в те времена правилу французских химиков во главе с известным Лавуазье – присваивать новым элементам и соединениям имена, отражающие их свойства, у Клапрота был свой принцип. Он считал, что при открытии и первых исследованиях элемента его свойства трудно определить точно. Часто случалось, что элементы, названные по их первоначальным свойствам, впоследствии, при углубленном изучении, не отвечали своим названиям. Многие из них пришлось переименовать. Поэтому Клапрот, открывший многие элементы, предпочитал давать им имена планет, героев легенд и мифов.
Однако через несколько лет, в 1795 г., изучая рутил, именовавшийся тогда красным венгерским шерлом, он выделил из него диоксид нового металла – белый порошок, похожий на описанный ранее Грегором. И хотя до получения чистого металла было еще очень далеко – почти полтора столетия, Клапрот, обладая могучей научной интуицией, опираясь на исследования Грегора и на результаты собственных опытов, известил мир об открытии нового металла, которому дал название «титан». Вопреки распространенному в те времена правилу французских химиков во главе с известным Лавуазье – присваивать новым элементам и соединениям имена, отражающие их свойства, у Клапрота был свой принцип. Он считал, что при открытии и первых исследованиях элемента его свойства трудно определить точно. Часто случалось, что элементы, названные по их первоначальным свойствам, впоследствии, при углубленном изучении, не отвечали своим названиям. Многие из них пришлось переименовать. Поэтому Клапрот, открывший многие элементы, предпочитал давать им имена планет, героев легенд и мифов.
В 1795 г. по поводу присвоения новому элементу названия «титан» Клапрот писал: «Для вновь открываемого элемента трудно подобрать название, указывающее на его свойства, и я нахожу, что лучше всего подбирать такие названия, которые ничего не говорили бы о свойствах и не давали бы таким образом повода для превратных толкований. В связи с этим мне захотелось для данной металлической субстанции подобрать, так же как и для урана, имя из мифологии: поэтому я называю новый металлический осадок титаном, в честь древних обитателей Земли». Это название стало поистине пророческим. Мифические жители – титаны, сыновья богини Земли Ген и бога неба Урана, были огромными, сильными, стойкими, добрыми, бессмертными существами, покорителями огня, земных просторов и недр, морей, рек и гор. И открытый ме¬талл оказался одним из самых твердых, крепких, стойких. Но чтобы познать нес замечательные свойства нового металла и использовать их для своего блага, человечеству потребовалось еще более 150 лет[1, C. 7-9].
7-9].
Титан был получен в чистом виде (всего лишь несколько килограммов) только в 40-х гг. XX в., а промышленное производство его началось в 1957 г. После Грегора и Клапрота, исследовавших минералы и двуокись титана в 1791 – 1795 гг., соединениями титана, выделяемыми, из титаномагнетитовых руд, занимался русский химик-металлург Товий Егорович Лониц. В 1821 г. немецкий химик Генрих Розе синтетическим путем в лабораторных условиях получил двуокись титана, а еще через год, в 1822 – 1823 гг., английский химик Волластон, исследуя черные кристаллики, выделенные им из металлургических шлаков сталеплавильного завода «Мертир-Гидвиль», открыл в них, как он уверял, «металлический титан». В этом его поддержал знаменитый шведский химик Йене Якоб Берцелиус, который в 1825 г. также выделил титан, по его мнению, в чистом виде, восстановив фтортитанат калия. Но образцы титана Волластона и Берцелиуса были еще очень далеки от чистого металла. Они содержали большое количество различных примесей (более 5%), были хрупкими, нековкими, непластичными; по существу, как было установлено позднее, представляли собой нитриды и карбиды титана. Поэтому после исследований Волластона и Берцелиуса почти полвека существовало мнение, что титан – элемент бесполезный, так как сделать из него «что-либо» практически невозможно.
Поэтому после исследований Волластона и Берцелиуса почти полвека существовало мнение, что титан – элемент бесполезный, так как сделать из него «что-либо» практически невозможно.
Тем не менее, несмотря на такое ошибочное мнение, работы над получением чистого титана продолжались в течение всего XIX – начала XX вв. Во Франции этим занимались ученые Фридрих Веллер, Шарль Девиль, Леви, Мусман, в Швеции – Нильсон, Петерсои и др. Последние выделили титан натрие-термическим восстановлением четыреххлористого титана в автоклаве (стальном термососуде). Но и этот титан содержал более 5% примесей и не мог раскрыть все свои уникальные свойства.
Наиболее чистый, практически свободный от примесей металл сумел получить впервые русский ученый, профессор Московского университета Дмитрий Кириллович Кириллов. В 1875 г. он опубликовал работу «Исследования над титаном», в которой освещались результаты его опытов по выделению чистого титана. К сожалению, тяжелобольной Кириллов не смог продолжить свои работы и вынужден был прекратить опыты. Образцы наиболее чистого титана удалось получить французскому химику Анри Муассану в 1885 г., который, восстанавливая диоксид титана древесным углем при высокой температуре и последующей перечисткой, сумел довести титан до 98%-ной чистоты. Более поздние исследования этих образцов показали, что в них загрязненный титан (с примесью железа и углерода) образовывал внешнюю оболочку, а внутри металл был очень чистым.
Образцы наиболее чистого титана удалось получить французскому химику Анри Муассану в 1885 г., который, восстанавливая диоксид титана древесным углем при высокой температуре и последующей перечисткой, сумел довести титан до 98%-ной чистоты. Более поздние исследования этих образцов показали, что в них загрязненный титан (с примесью железа и углерода) образовывал внешнюю оболочку, а внутри металл был очень чистым.
В 1910 г. американскому инженеру Хантеру и его коллегам удалось получить титан, как они определили, чистотой 99,9%. Но и этот образец, выделенный по сложной технологии, с опасностями для жизни самих исследователей (взорвалась стальная бомба), был хрупким, не поддавался ковке и механической обработке. Вероятно, он был загрязнен карбидами и нитридами титана в большей степени, чем считали авторы. Изученные Хантером свойства металла, загрязненного различными примесями не в количестве 0,1%, как он предполагал, а гораздо больше, опять отнесли титан в разряд бесполезных металлов: ведь ни ковать, ни обрабатывать его было практически невозможно.
В 1925 г. голландские химики Ван Аркель и Де Бур получили действительно очень чистый металл, с незначительным (менее 0,1%) количеством примесей. Их образцы титана проявили все замечательные свойства этого металла – низкую плотность, высокую твердость и прочность, не теряемые при высоких температурах (до 500°С и выше), хорошую пластичность, позволяющую деформировать металл в холодном состоянии, прокатывать в листы и даже в тонкую фольгу, вытягивать в тонкую проволоку. Технология голландцев основывалась на разложении йодидного титана. Нагревание йодида до температуры примерно 1300-1500°С приводит к его разложению на титан и йод. Причем парообразный йод соединяется снова с черновым металлом, а титан осаждается на раскаленной поверхности затравки из титана же. Примеси, находящиеся в черновом металле, взаимодействуют с йодом и не попадают на раскаленный чистый титан.
Инженерная мысль пошла по другому пути – по пути восстановления четыреххлористого титана металлическим магнием. Данный способ был разработан в 30-х гг. XX в., Кроллем, и поныне как за рубежом, так и в СССР титан в промышленных условиях получают именно по этой принципиальной технологии.
Данный способ был разработан в 30-х гг. XX в., Кроллем, и поныне как за рубежом, так и в СССР титан в промышленных условиях получают именно по этой принципиальной технологии.
Промышленной организации производства технически чистого титана предшествовало тщательное технологическое и экономическое исследование всех известных к тому времени способов и методов его получения. Этим занялась горно-геологическая организация США («Горное бюро»), которая, собственно, и определила широчайшие возможности использования титана в новой и новейшей технике, главным образом в авиационной, космической, морской. В городке Боддер-Сити на юге штата Невада в 1942 г. была построена небольшая промышленная установка но получению технического титана. На ней испытывались различные способы его производства. Остановились на способе Кролля – магниетермическом. Ученый был приглашен работать на этой установке и в течение нескольких лет отрабатывал во всех деталях технологию получения технически чистого титана. В 1946 г. эта технология была опробована в промышленных условиях.
эта технология была опробована в промышленных условиях.
В 1947 г. были выпущены первые 45 кг технически чистого титана. Стоимость его, конечно, была баснословно высокой – 10 тыс. долл. за 1 т, т.е. этот новый конструкционный материал был во много раз дороже железа, алюминия, магния. Тем не менее выпуск металлического титана осуществлялся такими гигантскими темпами, каких не знало никакое другое металлургическое производство, в том числе и главных конструкционных металлов – железа, алюминия, магния. В 1951 г., т е. всего через три года, выпуск титановой губки увеличился почти в 300 раз и составил уже 700 т/год.
Титановая губка представляет собой пористый бесформенный хрупкий металл с содержанием примесей до 0,2-0,3%, небольшой плотности – всего около 1 т/м3. Именно титановая губка является исходным сырьем для получения и чистого, титана, и его сплавов. Чтобы металл был плотным и компактным, губку плавят, реже используют методы порошковой металлургии. В основном же применяется метод вакуумной дуговой плавки в печах с расходуемым электродом. Чистый титан вместе с легирующими элементами спрессовывается с расходуемым электродом на гидравлических пpeccax, затем для очистки он дважды переплавляется. Tехнология была разработана английским химиком Л.Росси в 1908 – 1918 гг. и базировалась на методе разложения титановых концентратов серной кислотой. Усовершенствованная и модернизированная сернокислотная технология получения белой двуокиси титана из титановых концентратов существует и по сей день. Мировое производство (без СССР) несоизмеримо выше, чем металлического титана, и сегодня держится на уровне 2 – 2,5 млн т/год. В России впервые был получен наиболее чистый титан. В начале века много усилий было приложено для изыскания, разведок титановых руд и их переработки на диоксид, четыреххлористый титан, ферротитан. Проблемами титанового сырья много занимался русский химик Г.В.Вдовишенский, который, будучи знаком с трудами Кириллова и других ученых и понимая важную практическую роль титана в научно-техническом прогрессе, организовал в самом начале 90-х гг.
Чистый титан вместе с легирующими элементами спрессовывается с расходуемым электродом на гидравлических пpeccax, затем для очистки он дважды переплавляется. Tехнология была разработана английским химиком Л.Росси в 1908 – 1918 гг. и базировалась на методе разложения титановых концентратов серной кислотой. Усовершенствованная и модернизированная сернокислотная технология получения белой двуокиси титана из титановых концентратов существует и по сей день. Мировое производство (без СССР) несоизмеримо выше, чем металлического титана, и сегодня держится на уровне 2 – 2,5 млн т/год. В России впервые был получен наиболее чистый титан. В начале века много усилий было приложено для изыскания, разведок титановых руд и их переработки на диоксид, четыреххлористый титан, ферротитан. Проблемами титанового сырья много занимался русский химик Г.В.Вдовишенский, который, будучи знаком с трудами Кириллова и других ученых и понимая важную практическую роль титана в научно-техническом прогрессе, организовал в самом начале 90-х гг. XIX в. поиски и разведку титановых руд. В те годы в России появился интерес не столько к самому титану, сколько к его соединениям, а объяснялось это следующим. Как оказалось, диоксид титана является самым стойким белым пигментом для окраски военно-морских судов и других сооружений. Кроме того, стало известно, что четыреххлористый титан может применяться как дымовая завеса и для улучшения сортов стали.
XIX в. поиски и разведку титановых руд. В те годы в России появился интерес не столько к самому титану, сколько к его соединениям, а объяснялось это следующим. Как оказалось, диоксид титана является самым стойким белым пигментом для окраски военно-морских судов и других сооружений. Кроме того, стало известно, что четыреххлористый титан может применяться как дымовая завеса и для улучшения сортов стали.
В 1916 г. уже были предприняты первые попытки производства четыреххлористого титана. По инициативе и под руководством советского геохимика и минералога А.Е.Ферсмана (1883-1945) была создана специальная подкомиссия по титану при Комиссии военно-технической помощи. А.Е.Ферсман провел большую работу по выявлению сырьевых источников титана. Правда, большого размаха эти исследования не приобрели, по первый шаг был сделан: на Урале были открыты и обследованы пегматитовые месторождения Вишневых и Ильменских гор. По имени последних был, назван новый титановый минерал, основной минерально-сырьевой источник получения титана и его соединений – ильменит.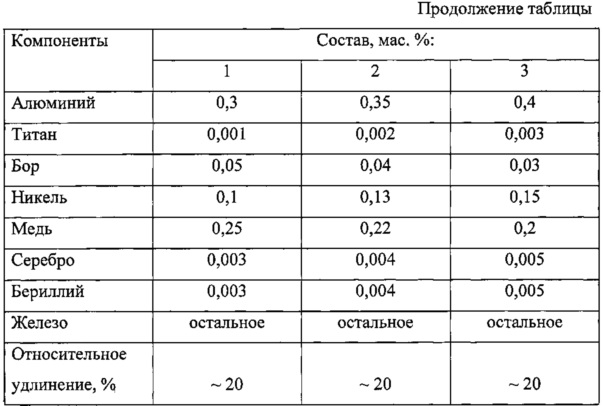
В конце 20-х гг. XX в. Институт прикладной минералогии, позднее переименованный во Всесоюзный институт минерального сырья (ВИМС), приступил к созданию сырьевой базы титана на Урале, а также к разработке технологии производства титановых белил и получения спецсталей с использованием ферротитана. Развернулись исследования и промышленные испытания различных методов получения ферротитана. Благодаря работам советских ученых С.С.Штейнберга, Н.С.Кусакина, В.П.Елютина, Н.П.Шипулина и др. промышленное производство ферротитана было освоено к концу 30-х гг. XX в. Первые опытные заводы по производству пигментного диоксида титана из ильменитовых концентратов сернокислотным способом были пущены в 1935 – 1939 гг. В конце 40-х гг. XX в., в СССР начались исследования по получению металлического титана, а к 1952 г. окончательно оформилась промышленная технология получения титана хлорированием титановых шлаков[1, C.34-41].
Титан — тугоплавкий металл
Долгое время считалось, что он плавится при 1800 °С, однако в середине 50-х гг.
Важнейшей особенностью титана как металла являются его уникальные физико-химические свойства:
- низкая плотность,
- высокая прочность,
- твердость и др.
Эти свойства не меняются существенно при высоких температурах.
Титан обладает незаменимыми свойства, которые позволяют широко использовать титан как конструкционный материал. Прежде этот всего прочность металла, т.е. его способность сопротивляться разрушению, а также необратимому изменению формы (пластические деформации). В зависимости от вида напряженного состояния – растяжения, сжатия, изгиба и других условий испытания (температура, время) для характеристики прочности металла используются различные показатели: предел текучести, временное сопротивление, предел усталости и др.
Удельная прочность сплавов титана может быть повышена в 1,5-2 раза. Его высокие механические свойства хорошо сохраняются при температурах вплоть до нескольких сот градусов. Другие же металлы либо просто не выдерживают таких температур, либо сильно разупрочняются.
Чистый титан – высокопластичный металл, что обусловлено благоприятным соотношением осей «с» и «а» в его гексагональной решетке и наличием в ней множества систем плоскостей скольжения и двойникования. Хотя и считается, что металлы с гексагональной кристаллической решеткой очень пластичны, титан в силу указанных особенностей его кристаллов стоит в одном ряду с высокопластичными металлами, имеющими иной, тип кристаллической решетки. В результате чистый титан пригоден для любых видов обработки в горячем и холодном состоянии: его можно ковать, как железо, вытягивать и даже делать из него проволоку, прокатывать в листы, ленты, в фольгу толщиной до 0,01 мм.
Титан имеет высокий предел текучести – примерно 250 мн/м2. Это выше в 2,5 раза, чем у железа, в 3 раза, чем у меди, и почти в 20 раз, чем у алюминия. Следовательно, титан лучше этих металлов сопротивляется сминающим ударам и другим нагрузкам, способным деформировать титановые детали.
Высока и вязкость титана. Он отлично противостоит воздействию сколовых и сдвиговых ударов и нагрузок. Этой выносливостью объясняется еще одно замечательное свойство титана – исключительная стойкость его в условиях кавитации, т.е. при усиленной «бомбардировке» металла в жидкой среде пузырьками воздуха, которые образуются при быстром движении или вращении металлической детали в жидкой среде. Эти пузырьки воздуха, лопаясь на поверхности металла, вызывают очень сильные микроудары жидкости о поверхность движущегося тела. Они быстро разрушают многие материалы, и металлы в том числе, а титан прекрасно противостоит кавитации.
Титан обладает еще одним удивительным свойством – «памятью». В сплаве с некоторыми металлами (например, с никелем) он «запоминает» форму изделия, которую из него сделали при определенной температуре. Если такое изделие потом деформировать, например свернуть в пружину, изогнуть, то оно останется в таком положении на долгое время. После нагревания до той температуры, при которой это изделие было сделано, оно принимает первоначальную форму.
В сплаве с некоторыми металлами (например, с никелем) он «запоминает» форму изделия, которую из него сделали при определенной температуре. Если такое изделие потом деформировать, например свернуть в пружину, изогнуть, то оно останется в таком положении на долгое время. После нагревания до той температуры, при которой это изделие было сделано, оно принимает первоначальную форму.
Титан реагирует со многими металлами
При трении с деталями из более мягкого металла титан может срывать с них металлические частицы и прилеплять к себе металл, а из более твердого, наоборот, частицы титана будут срываться с титановой детали и покрывать другую деталь. Причем никакая жировая или масляная смазка не помогает исключить взаимоналипание частиц. В течение небольшого времени это явление можно ослабить, лишь применив в качестве смазки чешуйчатые молибденит или графит. А вот сваривается титан с другими металлами очень плохо. Практически полностью эта проблема пока не решена, хотя сварка титановых изделий проходит отлично.
Рассмотренные химические и физические свойства титана в целом благоприятствуют широкому использованию этого металла. Однако у титана есть немало и отрицательных качеств. Например, он может самовозгораться, а в некоторых случаях даже и взрываться.
Еще одним недостатком титана является его способность сохранять высокие физико-механические свойства лишь до температуры 400-450°С, а с добавками некоторых легирующих металлов до 600° С, и здесь у него есть серьезные конкуренты – жаропрочные спецстали. Однако в минусовом диапазоне температур титану равных нет. Железо становится хрупким уже при температуре 40°С, специальные низкотемпературные стали ниже -100°С. А вот титан и его сплавы не разрушаются при температурах до 253°С (в жидком водороде) и даже до 269°С (в жидком гелии). Это очень важное свойство титана открывает ему большие перспективы для использования в криогенной технике и для работы в космическом пространстве.
По своей же распространенности во Вселенной титан редким элементом назвать никак нельзя. Он обнаружен в спектре Солнца и в его атмосфере, в атмосфере звезд различных типов. Автоматические космические аппараты зафиксировали наличие титана на Марсе и на Венере, в очень больших количествах в лунных породах, а на нашей планете титан находят во всех типах пород земной коры, в морях и океанах, в атмосфере и даже в растениях и тканях живых организмов.
Он обнаружен в спектре Солнца и в его атмосфере, в атмосфере звезд различных типов. Автоматические космические аппараты зафиксировали наличие титана на Марсе и на Венере, в очень больших количествах в лунных породах, а на нашей планете титан находят во всех типах пород земной коры, в морях и океанах, в атмосфере и даже в растениях и тканях живых организмов.
Цена – вот что сегодня ещё тормозит производство и потребление титана. Собственно, высокая стоимость – не врожденный порок титана. В земной коре его много – 0,63%. Дорогая цена – следствие чрезвычайной сложности извлечение титана из руд. Если принять стоимость титана в концентрате за единицу, то стоимость готовой продукции – титанового листа в сотни раз больше. Объясняется это высоким сродством титана многим элементам и прочностью химических связей в его природных соединениях. Отсюда – сложности технологии. Вот как выглядит магниетермический способ производства титана, разработанный в 1940 г. американским учёным У.Кролем.
Двуокись титана с помощью хлора (в присутствии углерода) переводят в четырёххлористый титан: TiO2+C+2Cl2=TiCl4+CO2
Кажется, ещё недавно титан называли редким металлом – сейчас он важнейший конструкционный материал. Объясняется это только одним: редким в шахтных электропечах при 800-1250°С. Другой вариант – хлорирование в расплаве солей щелочных металлов NaCl и KCl.
Объясняется это только одним: редким в шахтных электропечах при 800-1250°С. Другой вариант – хлорирование в расплаве солей щелочных металлов NaCl и KCl.
Следующая операция (в одинаковой мере важная и трудоёмкая) – очистка TiCl4 от примесей – проводится разными способами и веществами. Четырёххлористый титан в обычных условиях представляет собой жидкость с температурой кипения 136°С. Разорвать связь титана с хлором легче, чем с кислородом. Это можно сделать с помощью магния по реакции: TiCl4+2Mg = Ti+2MgCl2. Эта реакция идёт в стальных реакторах при 900°С. В результате образуется так называемая титановая губка, магнием и хлоридом магния. Их испаряют в герметичном вакуумном аппарате при 950°С, а титановую губку затем спекают или переплавляют в компактный металл.
Натриетермический метод получения металлического титана в принципе мало чем отличается от магниетермического. Эти два метода наиболее широко применяются в промышленности.
Для получения более чистого титана и поныне используется иодидный метод, предложенный нидерландскими химиками ван Аркелем (1893-1976) и де Буром. Металлотермический губчатый титан превращают в иодид TiI4, который затем возгоняют в вакууме. На своём пути пары иодида титана встречают раскалённую до 1400°С титановую проволоку. При этом иодид разлагается, и на проволоке нарастает слой чистого титана. Этот метод производства титана малопроизводителен и дорог, поэтому в промышленности он применяется крайне ограниченно[4].
Металлотермический губчатый титан превращают в иодид TiI4, который затем возгоняют в вакууме. На своём пути пары иодида титана встречают раскалённую до 1400°С титановую проволоку. При этом иодид разлагается, и на проволоке нарастает слой чистого титана. Этот метод производства титана малопроизводителен и дорог, поэтому в промышленности он применяется крайне ограниченно[4].
Полученные в промышленных условиях слитки титана называют техническим титаном. Он имеет практически все те свойства, которыми обладает химически чистый титан. Технический титан в отличие от химически чистого содержит повышенное количество некоторых элементов-примесей. В разных странах в зависимости от технологических особенностей процесса технический титан содержит примеси (в %): железа 0,15-0,3; углерода 0,05-0,1; водорода 0,006-0,013; азота 0,04-0,07; кислорода 0,1-0,4.
Сплавы титана с алюминием
Они наиболее важны в техническом и промышленном отношении. Введение алюминия в технический титан даже в небольших количествах (до 13%) позволяет резко повышать жаропрочность сплава при снижении его плотности и стоимости. Этот сплав — отличный конструкционный материал. Добавка 3-8% алюминия повышает температуру превращения α-титана в β-титан. Алюминий является практически единственным легирующим стабилизатором α-титана, увеличивающим его прочность при постоянстве свойств пластичности и вязкости титанового сплава и повышении его жаропрочности, сопротивления ползучести и модуля упругости. Этим устраняется существенный недостаток титана.
Этот сплав — отличный конструкционный материал. Добавка 3-8% алюминия повышает температуру превращения α-титана в β-титан. Алюминий является практически единственным легирующим стабилизатором α-титана, увеличивающим его прочность при постоянстве свойств пластичности и вязкости титанового сплава и повышении его жаропрочности, сопротивления ползучести и модуля упругости. Этим устраняется существенный недостаток титана.
Помимо улучшения механических свойств сплавов при различных температурах, увеличивается их коррозионная стойкость и взрывоопасность при работе деталей из титановых сплавов в азотной кислоте.
Алюминий-титановые сплавы выпускаются нескольких марок и содержат 3-8% алюминия, 0,4-0,9% хрома, 0,25-0,6% железа, 0,25-0,6% кремния, 0,01% бора. Все они коррозионно-стойкие, высокопрочные и жаропрочные сплавы на основе титана. С увеличением содержания алюминия в сплавах температура их плавления несколько снижается, однако механические свойства значительно улучшаются и температура разупрочнения повышается.
Эти сплавы сохраняют высокую прочность до 600°С.
Сплавы титана с железом
Своеобразным сплавом является соединение титана с железом, так называемый ферротитан, представляющий собой твердый раствор TiFe3 в α-железе.
Ферротитан облагораживающе действует на сталь, так как он, активно поглощая кислород, является одним из лучших раскислителей стали. Ферротитан так же активно поглощает из расплавленной стали азот, образуя нитрид титана, другие примеси, способствует равномерному распределению прочих примесей и образованию мелкозернистых структур стали.
Кроме ферротитана, на основе железа и титана производятся и другие сплавы, широко используемые в черной металлургии. Феррокарботитан – железотитановый сплав, содержащий 7-9% углерода, 74-75% железа, 16-17% титана. Ферросиликотитан – сплав, состоящий из железа (около 50%), титана (30%) и кремния (20%). Оба эти сплава также применяются для раскисления сталей.
Сплавы титана с медью
Даже небольшие присадки меди к титану и другим его сплавам повышают их стабильность в процессе эксплуатации, увеличивается и их жаропрочность. Кроме того, 5-12% титана добавляют в медь для получения так называемого купротитана; им пользуются, чтобы очистить расплавленную медь и бронзу от кислорода и азота. Легирование меди титаном производится только очень небольшими его добавками, уже при 5% титана медь становится нековкой.
Кроме того, 5-12% титана добавляют в медь для получения так называемого купротитана; им пользуются, чтобы очистить расплавленную медь и бронзу от кислорода и азота. Легирование меди титаном производится только очень небольшими его добавками, уже при 5% титана медь становится нековкой.
Сплавы титана с марганцем
Марганец, введенный в технический титан или в его сплавы, делает их прочнее, они сохраняют пластичность и легко обрабатываются при прокатке. Марганец – недорогой и недефицитный металл, поэтому он широко применяется (до 1,5%) при легировании титановых сплавов, предназначенных для листовой прокатки. Богатый марганцем (70%) сплав называется мангантитаном. Оба металла являются энергетическими раскислителями. Этот сплав, как и купротитан, хорошо очищает от кислорода, азота и других примесей медь и бронзу при отливках.
Сплавы титана с молибденом, хромом и другими металлами. Основная цель добавки этих металлов — повысить прочность и жаропрочность титана и его сплавов при сохранении высокой пластичности. Оба металла легируют их в комбинации: молибден предотвращает нестабильность титан-хромовых сплавов, делающихся хрупкими при высоких температурах. Сплавы титана с молибденом по стойкости против коррозии в кипящих неорганических кислотах превосходят технический титан в 1000 раз. Для повышения коррозионной стойкости в титан добавляют некоторые тугоплавкие редкие и благородные металлы: тантал, ниобии, палладий[1, C.94-103].
Оба металла легируют их в комбинации: молибден предотвращает нестабильность титан-хромовых сплавов, делающихся хрупкими при высоких температурах. Сплавы титана с молибденом по стойкости против коррозии в кипящих неорганических кислотах превосходят технический титан в 1000 раз. Для повышения коррозионной стойкости в титан добавляют некоторые тугоплавкие редкие и благородные металлы: тантал, ниобии, палладий[1, C.94-103].
Значительное количество весьма ценных в научно-техническом отношении композиционных материалов можно производить на основе карбида титана. Это главным образом жаростойкие изделия из металлокерамики, в основе которых лежит карбид титана. В них совмещается твердость, тугоплавкость и химическая стойкость карбида титана с пластичностью и сопротивлением тепловому удару цементирующих металлов – никеля и кобальта. В них можно вводить ниобий, тантал, молибден и тем самым еще больше повышать стойкость и жаропрочность этих композиций па основе карбида титана.
Сейчас известно более 30 различных сплавов титана с другими металлами, удовлетворяющих практически любым техническим требованиям. Это пластичные сплавы с низкой прочностью (300-600 МПа) и рабочей температурой 100-200°С, со средней прочностью (600-900 МПа) и рабочей температурой 200-300°С, конструкционные сплавы с повышенной прочностью (800-1100 МПа) и рабочей температурой 300-450°С, высокопрочные (100-1400 МПа) термомеханически обрабатываемые сплавы с нестабильной структурой и рабочей температурой 300-400°С, высокопрочные (1000-1300 МПа) коррозионно-стойкие и жаропрочные сплавы с рабочей температурой 600-700° С, особо коррозионно-стойкие сплавы со средней прочностью (400-900 МПа) и рабочей температурой 300-500°С.
Это пластичные сплавы с низкой прочностью (300-600 МПа) и рабочей температурой 100-200°С, со средней прочностью (600-900 МПа) и рабочей температурой 200-300°С, конструкционные сплавы с повышенной прочностью (800-1100 МПа) и рабочей температурой 300-450°С, высокопрочные (100-1400 МПа) термомеханически обрабатываемые сплавы с нестабильной структурой и рабочей температурой 300-400°С, высокопрочные (1000-1300 МПа) коррозионно-стойкие и жаропрочные сплавы с рабочей температурой 600-700° С, особо коррозионно-стойкие сплавы со средней прочностью (400-900 МПа) и рабочей температурой 300-500°С.
Технический титан и его сплавы выпускаются в виде листов, плит, полос, лент, фольги, прутков, проволоки, труб, поковок и штамповок. Эти полуфабрикаты являются исходным материалом для изготовления из титана и его сплавов различных изделий. Для этого полуфабрикаты надо обработать ковкой, штамповкой, фасонным литьем, резанием, сваркой и т.п.[5, C.180-193].
Авиационная промышленность была первым потребителем титана. Создание летательных аппаратов со скоростями близкими к скорости звука и превосходящими ее, определило ряд технических и экономических требований к конструкционным материалам, идущим на изготовление корпуса самолета и его обшивки, а также двигателей, которые невозможно было удовлетворить без применения материалов на основе титана.
Создание летательных аппаратов со скоростями близкими к скорости звука и превосходящими ее, определило ряд технических и экономических требований к конструкционным материалам, идущим на изготовление корпуса самолета и его обшивки, а также двигателей, которые невозможно было удовлетворить без применения материалов на основе титана.
Малый удельный вес и высокая прочность (особенно при повышенных температурах) титана и его сплавов делают их весьма ценными авиационными материалами. В области самолетостроения и производства авиационных двигателей титан все больше вытесняет алюминий и нержавеющую сталь. С повышением температуры алюминий быстро утрачивает свою прочность. С другой стороны, титан обладает явным преимуществом в отношении прочности при температуре до 430°С, а повышенные температуры такого порядка возникают при больших скоростях благодаря аэродинамическому нагреванию. Преимущество замены стали титаном в авиации заключается в снижении веса без потери прочности. Общее снижение веса с повышением показателей при повышенных температурах позволяет увеличить полезную нагрузку, дальность действия и маневренность самолетов. Этим объясняются усилия, направленные на расширение применения титана в самолетостроении при производстве двигателей, постройке фюзеляжей, изготовлении обшивки и даже крепежных деталей.
Этим объясняются усилия, направленные на расширение применения титана в самолетостроении при производстве двигателей, постройке фюзеляжей, изготовлении обшивки и даже крепежных деталей.
При постройке реактивных двигателей титан применяется преимущественно для изготовления лопаток компрессора, дисков турбины и многих других штампованных деталей. Здесь титан вытесняет нержавеющую и термически обрабатываемую легированную стали. Экономия в весе двигателя в один килограмм позволяет сберегать до 10 кг в общем весе самолета благодаря облегчению фюзеляжа. В дальнейшем намечено применять листовой титан для изготовления кожухов камер сгорания двигателя.
В конструкции самолета титан находит широкое применение для деталей фюзеляжа, работающих при повышенных температурах. Листовой титан применяется для изготовления всевозможных кожухов, защитных оболочек кабелей и направляющих для снарядов. Из листов легированного титана изготовляются различные элементы жесткости, шпангоуты фюзеляжа, нервюры и т. д.
д.
Кожухи, закрылки, защитные оболочки для кабелей и направляющие для снарядов изготовляются из нелегированного титана. Легированный титан применяется для изготовления каркаса фюзеляжа, шпангоутов, трубопроводов и противопожарных перегородок.
Вращающиеся детали роторов авиадвигателей испытывают в полете колоссальную нагрузку. Им приходится работать в условиях высоких температур и динамических воздействий. От их надежности зависят безопасность самолета и жизни людей, что находятся на борту воздушного судна. Следовательно, титан, используемый в этих ответственных узлах, должен быть не просто прочным, а суперпрочным.
В будущем из титана будут делать створки шасси, трубопроводы гидросистем, выхлопные патрубки и сопла, лонжероны, закрылки, откидные стойки и т. д.
Титан можно применять для изготовления броневых плит, лопастей пропеллера и снарядных ящиков.
Растет потребление титана в гражданском самолетостроении. И понятно почему: титан сочетает в себе основные параметры эффективности самолета – веса, надежности, стоимости обслуживания и прибыли от эксплуатации. Это главные критерии для авиаперевозчиков.
Это главные критерии для авиаперевозчиков.
В настоящее время разработчики авиатехники перестраивают всю материаловедческую концепцию строительства самолетов, активно привлекая и используя композиционные материалы на основе углеволокна и титановые сплавы. Первые заменяют алюминий и сталь, вторые коррозийноустойчивы и исключительно прочны.
Переход на композиционные материалы
Причин перехода на композиционные материалы несколько. Во-первых, наметился быстрый рост пассажирских и грузовых перевозок, объем которых, по прогнозам специализированной аналитической группы Airline Monitor, в период с 2008 по 2026 гг. увеличится втрое, что потребует в два раза увеличить парк магистральных авиалайнеров. Во-вторых, в условиях высоких цен на топливо cамолетостроительным компаниям приходится разрабатывать и готовить серийный выпуск экономичных моделей авиалайнеров. Поскольку с композитами «уживается» только титан, спрос гражданского самолетостроения на титановые полуфабрикаты возрастет к 2015 г. примерно в два раза.
примерно в два раза.
Коррозионная стойкость титана и его сплавов делает их весьма ценным материалом на море. Малый удельный вес металла в сочетании с коррозионной стойкостью повышает маневренность и дальность действия кораблей, а также снижает расходы по уходу за материальной частью и ее ремонту.
Применение титана
Применение титана в военно-морском деле включает изготовление выхлопных глушителей для дизельных двигателей подводных лодок, дисков измерительных приборов, тонкостенных труб для конденсаторов и теплообменников. По мнению специалистов, титан, как никакой другой металл, способен увеличить срок службы выхлопных глушителей на подводных лодках. Применительно к дискам измерительных приборов, работающих в условиях соприкосновения с соленой водой, бензином или маслом, титан обеспечит лучшую стойкость. Исследуется возможность применения титана для изготовления труб теплообменников, которые должны обладать коррозионной стойкостью в морской воде, омывающей трубы снаружи, и одновременно противостоять воздействию выхлопного конденсата, протекающего внутри них.
Специалисты научно-исследовательского института конструкционных материалов «Прометей» при государственной поддержке Федерального агентства по науке и инновациям (Роснаука) начали в 2009 г. разработку усовершенствованных технологий производства из титановых сплавов так называемых крупногабаритных полуфабрикатов (заготовок крупных узлов и деталей) для морских судов и «оффшорной техники», предназначенной для работ на шельфах. Такие заготовки из титановых сплавов могут применяться для изготовления сверхлёгких, прочных и стойких к коррозии деталей самых разных типов судов, например, исследующих морские глубины, или связанные с добычей углеводородного сырья.
Существенный недостаток титановых сплавов только один – высокий коэффициент трения «металл по металлу», титан попросту «задирается» при трении из-за повышенной вязкости. Поэтому для деталей из титановых сплавов (в первую очередь, для различных т. н. «узлов трения») необходимо напыление специальных покрытий, придающих необходимые антифрикционные свойства. В качестве «кандидатов» на создание таких покрытий ученые намерены всесторонне исследовать различные высокопрочные материалы на основе оксидов алюминия, циркония и хрома.
Поэтому для деталей из титановых сплавов (в первую очередь, для различных т. н. «узлов трения») необходимо напыление специальных покрытий, придающих необходимые антифрикционные свойства. В качестве «кандидатов» на создание таких покрытий ученые намерены всесторонне исследовать различные высокопрочные материалы на основе оксидов алюминия, циркония и хрома.
Металл потребляет артиллерия, где в настоящее время ведутся интенсивные исследования различных опытных образцов. Были исследованы различные детали артиллерийского оборудования с точки зрения возможности замены титаном обычных материалов при условии снижения цен на титан. Главное внимание уделялось деталям, для которых существенно снижение веса (детали, переносимые вручную и перевозимые по воздуху).
Опорная плита миномета, изготовленная из титана вместо стали. Путем такой замены и после некоторой переделки вместо стальной плиты из двух половинок общим весом 22 кг удалось создать одну деталь весом 11 кг. Благодаря такой замене можно уменьшить число обслуживающего персонала с трех человек до двух. Рассматривается возможность применения титана для изготовления орудийных пламегасителей.
Рассматривается возможность применения титана для изготовления орудийных пламегасителей.
Проходят испытания изготовленные из титана орудийные станки, крестовины лафетов и цилиндры противооткатных приспособлений. Широкое применение титан может получить при производстве управляемых снарядов и ракет.
Сплавы титана повышенного качества позволяют надеяться на возможность замены стальных плит титановыми равной толщины, что дает экономию в весе до 44%. Промышленное применение титана позволит обеспечить большую маневренность, увеличит дальность перевозки и долговечность орудия. Современный уровень развития воздушного транспорта делает очевидными преимущества легких броневиков и других машин из титана. Артиллерийское ведомство намерено снарядить в будущем пехоту касками, штыками, гранатометами и ручными огнеметами, сделанными из титана. Первое применение в артиллерии титановый сплав получил для изготовления поршня некоторых автоматических орудий.
Титан и его сплавы используются медицинской промышленностью для изготовления не только хирургических инструментов, но и наркозно-дыхательных аппаратов, «искусственных» сердца, легких, почек, защитных устройств радиологической аппаратуры.
Биологическая инертность титана превосходит все известные марки нержавеющей стали и даже специальный кобальтовый сплав «виталлиум». Технически чистый титан и его сплавы содержат гораздо меньше примесей, чем другие, применяющиеся в медицине сплавы, он хорошо переносится человеческим организмом, обрастает костной и мышечной тканью, не корродирует и агрессивных средах человеческого тела (в лимфе, крови, желудочном соке), структура окружающей титановый элемент ткани не изменяется на протяжении десятилетий. Эти свойства титана в сочетании с его высокими механическими качествами позволяют широко использовать его для металлического остеосинтеза – распространенного способа лечения переломов костей. Из него изготавливают для наружных и внутренних протезов стержни, спицы, гвозди, болты, скобы, внутрикостные фиксаторы, а также протезы бедренных костей, тазобедренных суставов и челюстно-лицевых костей. Как известно, детали для остеосинтеза даже из самых высококачественных сортов нержавеющей стали приводят со временем к самым различным осложнениям, связанным с коррозией и разрушением этих деталей, повреждением костных и мышечных тканей продуктами коррозии. Из-за реакции их с физиологическими солями организма происходят воспаления тканей, возникают болевые ощущения. Костные фиксаторы и любые протезы из титана осложнений и воспалений не дают, они могут находиться я человеческом организме сколь угодно долго, практически вечно. Титан, обладая высокой усталостной прочностью при знакопеременных нагрузках, как нельзя лучше служит в качестве протезов костей, постоянно подвергающихся переменным нагрузкам. Кроме того, его немагнитность и слабая электропроводность позволяют проводить физиотерапевтическое лечение больных с титановыми протезами без осложнений. Малая плотность и высокие прочностные свойства титана позволяют почти вдвое уменьшать вес и объем протезов. Эти качества делают титан практически незаменимым материалом в костной хирургии. Он может использоваться в стоматологии (искусственные зубы) и офтальмологии (имплантат глазного яблока). Имеются попытки изготовления из титана миниатюрного, массой 300 г, искусственного сердца. Наряду с нейлоновыми для вживания в сердце используются и титановые клапаны.
Из-за реакции их с физиологическими солями организма происходят воспаления тканей, возникают болевые ощущения. Костные фиксаторы и любые протезы из титана осложнений и воспалений не дают, они могут находиться я человеческом организме сколь угодно долго, практически вечно. Титан, обладая высокой усталостной прочностью при знакопеременных нагрузках, как нельзя лучше служит в качестве протезов костей, постоянно подвергающихся переменным нагрузкам. Кроме того, его немагнитность и слабая электропроводность позволяют проводить физиотерапевтическое лечение больных с титановыми протезами без осложнений. Малая плотность и высокие прочностные свойства титана позволяют почти вдвое уменьшать вес и объем протезов. Эти качества делают титан практически незаменимым материалом в костной хирургии. Он может использоваться в стоматологии (искусственные зубы) и офтальмологии (имплантат глазного яблока). Имеются попытки изготовления из титана миниатюрного, массой 300 г, искусственного сердца. Наряду с нейлоновыми для вживания в сердце используются и титановые клапаны. Детали и конструкции из титана сравнительно несложны в изготовлении и сравнительно недороги, во всяком случае проще и дешевле, чем применяемые ныне сплавы типа «виталан» или «комохром»[7].
Детали и конструкции из титана сравнительно несложны в изготовлении и сравнительно недороги, во всяком случае проще и дешевле, чем применяемые ныне сплавы типа «виталан» или «комохром»[7].
Остановимся еще на нескольких областях применения титана.
Атомная энергетика: оболочки реакторов на быстрых нейтронах, конструктивные детали ядерных реакторов с водяным охлаждением, футеровка реакторов тонкими пористыми или перфорированными листами титана, титановые электроды в плазменных установках.
Приборостроение: зеркала телескопов, затворы кино- и фотокамер, мембраны телефонов, гибкие трубки для бронирования кабелей.
Электроника: создание высокого вакуума в электронно-лучевых трубках (используется свойство расплавленного титана энергично поглощать газы), аноды высоковольтных кенотронов и катоды поляризационных электролитических конденсаторов, сетки электронных ламп с минимальной эмиссией, тонкопленочные интегральные схемы и тонкопленочные конденсаторы; электронные трубки микроскопических размеров.
Военная техника: опорные плиты минометов, лафеты, кронштейны, станки орудий, пламегасители, атомные орудия малой мощности, облегченная броня, равная по снарядостойкости стальной броне, детали танкостроения; многие виды оружия и снаряжения для десантных войск.
Экспедиционное и спортивное снаряжение: инвентарь для антарктических и других экспедиций, снаряжение для альпинистов и пожарных, ружья для подводной охоты, мачты гоночных яхт, лыжные палки, теннисные ракетки, шары и клюшки для гольфа и др.
Бытовая техника и приборы: кухонные приборы, садовые инструменты, шариковые и перьевые авторучки.
Монументальное искусство: из титана созданы памятник Ю.А.Гагарину и монумент покорителям космоса в Москве, обелиск в честь успехов в освоении Вселенной в Женеве.
Есть еще один, совершенно необычный аспект применения титана – колокольный звон. Колокола, отлитые из этого металла, обладают необычным, очень красивым звучанием. Применяется титан в колокольчиках для электрозвонков.
Главными потребителями двуокиси титана являются лакокрасочная промышленность, использующая 60-65% всей производимой двуокиси титана, бумажная промышленность (12-16%) и производство пластмассы (10-14%). Остальное потребляется химической промышленностью для производства химволокна, искусственной кожи.
Помимо надежности и долговечности, титановые краски дают еще и чисто экономические выгоды: сокращается расход лакокрасочных материалов на единицу окрашиваемой поверхности и уменьшаются затраты труда на окраску в связи с сокращением числа наносимых слоев[1, C.103-128].
Титан – это металл будущего, благодаря обширным запасам он имеет перспективу стать основным металлом грядущих лет, поскольку его характеристики выигрывают по сравнению с характеристиками железа и алюминия во всех областях применения. Титан изначально предназначался для использования в военной и оборонной промышленности, но с течением времени он получает все большее распространение в мирных областях – народном хозяйстве, гражданской авиации, медицине и морских исследованиях, спорте и автомобилестроении. Своими свойствами и качеством изделий титан доказал целесообразность своего применения вместо привычных нам железа и алюминия – с практической, экономической и экологической точек зрения.
Своими свойствами и качеством изделий титан доказал целесообразность своего применения вместо привычных нам железа и алюминия – с практической, экономической и экологической точек зрения.
- Авторы
- Аннотация
- Ключевые слова
- Литература
- Студент: Попова М.А.
- Руководитель: Бармин А.В.
Природные ресурсы титана превышают в несколько раз общее количество хорошо известных и широко применяемых металлов – меди, никеля, олова, свинца, цинка и других. Среди конструкционных металлов титан занимает по распространенности четвертое место, уступая только алюминию, железу и магнию. Однако еще недавно использование металлического титана и сплавов на его основе не имело перспектив, так как не было промышленных способов получения ковкого материала. Рассматриваются вопросы истории открытия и изучения титана, его распространенности в космосе и на Земле, рассказывается о технологии получения титана и его соединений, о свойствах и об использовании человеком, о перспективах его применения в будущем.
- титан;
- чистый титан;
- титановая губка;
- свойства титана
- сплавы титана;
- применение титана.
- Зубков Л.Б. Космический металл. Все о титане. / М.: Наука, 1987. 128 с.
- http://ru.wikipedia.org/wiki/%CC%E0%F0%F2%E8%ED_%CA%EB%E0%EF
- Еременко В.Н. Титан и его сплавы./ Издательство академии наук Украинской ССР: Киев, 1960. 499с.
- http://www.argonik.ru/articles/18
- Б.А. Колачев, В.И. Елагин, В.А. Ливанов. Металловедение и термическая обработка цветных металлов и сплавов. Учебник для вузов. М.: «МИСИС», 1999.–416 с.
- http://www.protown.ru/information/hide/5615.html 7. «Металлургический бюллетень»(№ 8) http://www.metalbulletin.ru/
ПОДЕЛИСЬ ИНТЕРЕСНОЙ ИНФОРМАЦИЕЙ
Космический металл: (Все о титане) :: Книги по металлургии
Сплавы титана
Полученные в промышленных условиях слитки титана называют техническим титаном. Он имеют практически все те свойства, которыми обладает химически чистый титан. Технический титан в отличие от химически чистого содержит повышенное количество некоторых элементов-примесей. В разных странах в зависимости от технологических особенностей процесса технический титан содержит примеси (в %): железа 0,15—0,3; углерода 0,05-0,1; водорода 0,006-0,013; азота 0,04-0,07; кислорода 0,1 —0,4. Наилучшие качественные показатели по содержанию вышеперечисленных примесей имеет технический титан, выпускаемый в СССР. В целом эти примеси практически не ухудшают физические, механические, технологические свойства технического титана по сравнению с химически чистым металлом.
Он имеют практически все те свойства, которыми обладает химически чистый титан. Технический титан в отличие от химически чистого содержит повышенное количество некоторых элементов-примесей. В разных странах в зависимости от технологических особенностей процесса технический титан содержит примеси (в %): железа 0,15—0,3; углерода 0,05-0,1; водорода 0,006-0,013; азота 0,04-0,07; кислорода 0,1 —0,4. Наилучшие качественные показатели по содержанию вышеперечисленных примесей имеет технический титан, выпускаемый в СССР. В целом эти примеси практически не ухудшают физические, механические, технологические свойства технического титана по сравнению с химически чистым металлом.
Технический титан — это металл серебристо-серого цвета с едва заметным светло-золотистым оттенком. Он легок, почти в 2 раза легче железа, но все же тяжелее алюминия: 1 см3 титана весит 4,5 г, железа 7,8 г, а алюминия 2,7 г. Плавится технический титан почти при 1700° С, сталь — при 1500°С, алюминий — при 600° С. Он в 1,5 раза прочнее стали и в несколько раз прочнее алюминия, очень пластичный: технический титан легко прокатывать в листы и даже в очень топкую фольгу, толщиной в доли миллиметра, его можно вытягивать в прутки, проволоку, делать из него лепты, трубы. Технический титан обладает высокой прочностью, т. о. хорошо противостоит воздействию ударом и поддастся ковке, при этом он имеет высокую упругость и отличную выносливость. У технического титана довольно высокий продел текучести, он сопротивляется любым усилиям и нагрузкам, стремящимся смять, изменить форму и размеры изготовленной детали. Это его свойство выше в 2,5 раза, чем у железа, в 3 раза, чем у меди, и в 18 раз, чем у алюминия. У титана гораздо более высокая твердость, чем у алюминия, магния, меди, железа и некоторых сортов стали, однако ниже, чем у инструментальных сталей.
Технический титан обладает высокой прочностью, т. о. хорошо противостоит воздействию ударом и поддастся ковке, при этом он имеет высокую упругость и отличную выносливость. У технического титана довольно высокий продел текучести, он сопротивляется любым усилиям и нагрузкам, стремящимся смять, изменить форму и размеры изготовленной детали. Это его свойство выше в 2,5 раза, чем у железа, в 3 раза, чем у меди, и в 18 раз, чем у алюминия. У титана гораздо более высокая твердость, чем у алюминия, магния, меди, железа и некоторых сортов стали, однако ниже, чем у инструментальных сталей.
Технический титан — металл очень большой коррозионной стойкости. Он практически не изменяется и не разрушается на воздухе, в воде, исключительно стоек при обычной температуре во многих кислотах, даже в «царской водке», во многих агрессивных средах.
У титана имеется еще множество уникальных качеств. Например, стойкость к кавитации, слабые магнитные свойства, низкие электропроводность и теплопроводность и т. н. Но есть у титана и недостатки. Главный — его большая дороговизна, он в 3 раза дороже стали, в 3—5 раз дороже алюминия. титан не универсальный коррозионно-стойкий конструкционный материал, у него несколько более низкие по сравнению с лучшими сортами легированных сталей значения модулей упругости и ползучести, он может разупрочняться при высоких температурах, склонен к абразивному износу, плохо работает па резьбовых соединениях. Все эти недостатки снижают эффективность применения технического титана в чистом виде, что в общем-то характерно и для других конструкционных металлов; железа, алюминия, магния. Многие, почти все, недостатки чистого титана устраняются при легировании ого различными металлами и создании сплавов на его основе. В качестве наилучших конструкционных и коррозионно-стойких материалов сплавы титана имеют огромное преимущество.
н. Но есть у титана и недостатки. Главный — его большая дороговизна, он в 3 раза дороже стали, в 3—5 раз дороже алюминия. титан не универсальный коррозионно-стойкий конструкционный материал, у него несколько более низкие по сравнению с лучшими сортами легированных сталей значения модулей упругости и ползучести, он может разупрочняться при высоких температурах, склонен к абразивному износу, плохо работает па резьбовых соединениях. Все эти недостатки снижают эффективность применения технического титана в чистом виде, что в общем-то характерно и для других конструкционных металлов; железа, алюминия, магния. Многие, почти все, недостатки чистого титана устраняются при легировании ого различными металлами и создании сплавов на его основе. В качестве наилучших конструкционных и коррозионно-стойких материалов сплавы титана имеют огромное преимущество.
Титан, будучи весьма химически активным металлом, имеет благоприятные металлохимические свойства для образования прочных соединений — типа непрерывных и ограниченных твердых растворов ковалентных и ионных соединений.
В целом насчитывается более 50 элементов, дающих с титаном твердые растворы, на основе которых можно производить титановые сплавы и их соединения.
Сплавы титана с алюминием.
Они наиболее важны и техническом и промышленном отношении. Введение алюминия в технический титан даже в небольших количествах (до 13%) позволяет резко повышать жаропрочность сплава при снижении его плотности и стоимости. Этот сплав — отличный конструкционный материал. Добавка 3—8% алюминия повышают температуру превращения а-титана в b-титан. алюминий является практически единственным легирующим стабилизатором титана, увеличивающим его прочность при постоянстве свойств пластичности и вязкости титанового сплава и повышении его жаропрочности, сопротивления ползучести и модуля упругости. Этим устраняется существенный недостаток титана.
Помимо улучшения механических свойств сплавов при различных температурах, увеличивается их коррозионная стойкость и взрывоопасность ври работе деталей из титановых сплавов в азотной кислоте.
Алюминий-титановые сплавы выпускаются нескольких марок и содержат 3—8% алюминия. 0,4 — 0,5% хрома, 0,25-0,6% железа, 0,25-0,6% кремния, 0,01% бора. Все они коррозионно-стойкие, высокопрочные и жаропрочные сплавы па основе титана. С увеличением содержания алюминия и сплавах температура плавления несколько снижается, однако магнитные свойства значительно улучшаются и температура разупрочнения повышается.
Эти сплавы сохраняют высокую прочность до 600° С.
Сплавы титана с железом.
Своеобразным сплавом является соединение титана с железом, так называемый ферротитан, представляющий собой твердый раствор TiFe2 в a-жслезе.
Ферротитан облагораживающе действует на сталь, так как он, активно поглощая кислород, является одним из лучших раскислителей стали. Ферротитан так жt активно поглощает из расплавленной стали азот, образуя нитрид титана, другие примеси, способствует равномерному распределению прочих примесей и образованию мелкозернистых структур стали.
Кроме ферротитана, на основе железа и титана производятся и другие сплавы, широко используемые в черной металлургии. Феррокарботитан — железотитановый, содержащий 7—9% углерода, 74—75% железа, 10—17% титана. Ферросиликотитан — сплав, состоящий из железа (около 50%), титана (30%) и кремния (20%)- Оба эти сплава также применяются для раскисления сталей.
Сплавы титана с медью.
Даже небольшие присадки, меди к титану и другим его сплавам повышают их стабильность в процессе эксплуатации, увеличивается и их жаропрочность. Кроме того 5—12% титана добавляют в медь для получения так называемого купро-титана; им пользуются, чтобы очистить расплавленную медь и бронзу от кислорода и азота. Легирование меди титаном производится только очень небольшими ого добавками, уже при 5% титана медь становится нековкой.
Сплавы титана с марганцем.
Марганец, введенный в технический титан или в его сплавы, делает их прочнее, они сохраняют пластичность и легко обрабатываются при прокатке. Марганец — недорогой и не дефицитный металл, поэтому он широко применяется (до 1,5%) при легировании титановых сплавов, предназначенных для листовой прокатки. Богатый марганцем (70%) сплав называется мангантитаном. Оба металла являются энергетическими раскислителями. Этот сплав, как и купротитан, хорошо очищает от кислорода, азота и других примесей медь и бронзу при отливках.
Марганец — недорогой и не дефицитный металл, поэтому он широко применяется (до 1,5%) при легировании титановых сплавов, предназначенных для листовой прокатки. Богатый марганцем (70%) сплав называется мангантитаном. Оба металла являются энергетическими раскислителями. Этот сплав, как и купротитан, хорошо очищает от кислорода, азота и других примесей медь и бронзу при отливках.
Сплавы титана с молибденом, хромом и другими металлами.
Основная цель добавки этих металлов — повысить прочность и жаропрочность титана и его сплавов при сохранении высокой пластичности. Оба металла легируют их в комбинации: молибден предотвращает нестабильность титан-хромовых сплавов, делающихся хрупкими при высоких температурах. сплавы титана с молибденом по стойкости против коррозии в кипящих неорганических кислотах превосходят технический титан в 1000 раз. Для повышения коррозионной стойкости в титан добавляют некоторою тугоплавкие редкие и благородные металлы: тантал, ниобий, палладий.
Значительное количество весьма ценных в научно-техническом отношении композиционных материалов можно производить на основе карбида титана. Это главным образом жаростойкие изделия из металлокерамики, в основе которых лежит карбид титана. В них совмещается твердость, тугоплавкость и химическая стойкость карбида титана с пластичностью и сопротивлением тепловому удару цементирующих металлов — никеля и кобальта. В них можно вводить ниобий, тантал, молибден и тем самым еще больше повышать стойкость и жаропрочность этих композиций па основе карбида титана.
Сейчас известно более 30 различных сплавов титана с другими металлами, удовлетворяющих практически любым техническим требованиям. Это пластичные сплавы с низкой прочностью (300—600 МПа) и рабочей температурой 100—200° С, со средней прочностью (700— 1000 МПа) и рабочей температурой 200—300° С, конструкционные сплавы с повышенной прочностью (800— 1100 МПа) и рабочей температурой 300—450° С, высокопрочные (1000—1400 МПа) термомеханически обрабатываемые сплавы с нестабильной структурой и рабочей температурой 300—400° С, высокопрочные (1000— 1300 МПа) коррозионно-стойкие и жаропрочные сплавы с рабочей температурой 600—700° С, особо коррозионно-стойкие сплавы со средней прочностью (400— 900 МПа) и рабочей температурой 300-500° С.
Технический титан и его сплавы выпускаются в виде листов, плит, полос, лент, фольги, прутков, проволоки, труб, поковок и штамповок. Эти полуфабрикаты являются исходным материалом для изготовления из титана и: его сплавов различных изделий. Для этого полуфабрикаты надо обработать ковкой, штамповкой, фасонным литьем, резанием, сваркой и т д.
Как же ведет себя этот прочный, стойкой металл и его сплавы в обрабатывающих процессах? Многие полуфабрикаты используются непосредственно, например, трубы и листы. Вес они проходят предварительную термическую обработку. Затем для очистки поверхности подвергаются обработке гидропескоструйной или корундовым песком. Листовые изделия еще травит и шлифуют. Так были подготовлены титановые листы для монумента покорителям космоса на ВДНХ и для памятника Ю. А. Гагарину на площади его имени в Москве. Монументы из листового титана будут стоять вечно.
Слитки титана и его сплавов могут подвергаться ковке и штамповке, но только в горячем состоянии. Поверхности слитков, ночей и штампов должны быть тщательно очищены от примесей, так как титан и ого сплавы могут быстро с ними прореагировать и загрязниться. Рекомендуется даже перед ковкой и штамповкой покрывать заготовки специальной эмалью. Нагрев не должен превышать температур полного полиморфного превращения. Ковка производится но специальной технологии — сначала слабыми, а лотом более сильными и частыми ударами. Дефекты неправильно проведенной горячей деформации, приведшие к нарушению структуры и свойств полуфабрикатов последующей обработкой, в том числе и термической, исправить нельзя.
Поверхности слитков, ночей и штампов должны быть тщательно очищены от примесей, так как титан и ого сплавы могут быстро с ними прореагировать и загрязниться. Рекомендуется даже перед ковкой и штамповкой покрывать заготовки специальной эмалью. Нагрев не должен превышать температур полного полиморфного превращения. Ковка производится но специальной технологии — сначала слабыми, а лотом более сильными и частыми ударами. Дефекты неправильно проведенной горячей деформации, приведшие к нарушению структуры и свойств полуфабрикатов последующей обработкой, в том числе и термической, исправить нельзя.
Листовой штамповке в холодном виде может подвергаться только технический титан и его сплав с алюминием и марганцем. Все остальные листовые титановые сплавы, как менее пластичные, требуют нагрева опять же с соблюдением строгого контроля температур, очистки Поверхности от «охрупченного» слоя.
Резка и рубка листов толщиной до 3 мм могут производиться в холодном состоянии, свыше 3 мм — при нагреве по специальным режимам. титан и его сплавы обладают высокой чувствительностью к надрезу и поверхностным дефектам, что требует специальных зачисток кромок в местах, подвергающихся деформации. Обычно в связи с этим предусматриваются припуски па размеры вырубаемых заготовок деталей и пробиваемых отверстий,
титан и его сплавы обладают высокой чувствительностью к надрезу и поверхностным дефектам, что требует специальных зачисток кромок в местах, подвергающихся деформации. Обычно в связи с этим предусматриваются припуски па размеры вырубаемых заготовок деталей и пробиваемых отверстий,
Резание, токарная, фрезерная и другие виды обработки деталей из титана и ого сплавов затрудняются их низкими антифрикционными свойствами, вызывающими налипание металла на рабочие Поверхности инструмента. С чем это связано. Между титановой стружкой и инструментом имеется очень небольшая контактная поверхность, в этой зоне возникают большие удельные давления и температуры. Отвод тепла из этой зоны затруднителен, так как титан обладает низкой теплопроводностью и может как бы «растворять» в себе металл инструмента. В результате титан налипает на инструмент и он быстро изнашивается. Приваривание и налипание титана на контактируемые Поверхности режущего инструмента приводят к изменению геометрических параметров инструмента. При механической обработке титановых изделий для уменьшения налипания и задирании титана, отвода тепла применяют сильно охлажденные жидкости. Для фрезерования они должны быть очень вязкими. Пользуются резцами из сверхтвердых сплавов, обработку ведут на очень небольших скоростях. В целом механическая обработка титана во много раз более трудоемкая операция, чем обработка стальных изделий.
При механической обработке титановых изделий для уменьшения налипания и задирании титана, отвода тепла применяют сильно охлажденные жидкости. Для фрезерования они должны быть очень вязкими. Пользуются резцами из сверхтвердых сплавов, обработку ведут на очень небольших скоростях. В целом механическая обработка титана во много раз более трудоемкая операция, чем обработка стальных изделий.
Сверление отверстий в титановых изделиях тоже является сложной проблемой, связанной в основном с отводом стружки. Налипая на рабочие Поверхности сверла, она скапливается в отводящих канавках ого, пакетируется. Вновь образующаяся стружка движется уже по прилипшей. Все это снижает скорость сверления и повышает износ сверла.
Целый ряд титановых изделий изготавливать методами конки и штамповки нецелесообразно из-за технологических трудностей производства и большого количества отходов. Многие детали сложной формы гораздо выгоднее изготавливать фасонным литьем. Это весьма перспективное направление в производстве изделий из титана и его сплавов. Но на пути его развития есть ряд осложнений: расплавленный титан реагирует и с атмосферными газами, и практически со всеми известными огнеупорами, и с формовочными материалами. В связи с этим плавка титана и его сплавов производится в вакууме, а формовочный материал должен быть химически нейтральным по отношению к расплаву. Обычно формы, в которые он отливается, это графитовые кокиля, реже керамические и металлические
Но на пути его развития есть ряд осложнений: расплавленный титан реагирует и с атмосферными газами, и практически со всеми известными огнеупорами, и с формовочными материалами. В связи с этим плавка титана и его сплавов производится в вакууме, а формовочный материал должен быть химически нейтральным по отношению к расплаву. Обычно формы, в которые он отливается, это графитовые кокиля, реже керамические и металлические
Несмотря на трудности этой технологии, фасонные отливки сложных деталей из титана и ого сплавов получаются при строгом соблюдении технологии и очень качественными. Ведь расплавы титана и его сплавов обладают отличными литейными свойствами: у них высокая жидкотекучесть, сравнительно небольшая (всего 2—3%) линейная усадка при затвердевании, они даже в условиях затрудненной усадки не дают горячих трещин, но образуют рассеянную пористость. Литье в вакууме имеет массу преимуществ: во-первых, исключается образование окисных пленок, шлаковых включений, газовой пористости; во-вторых, повышается жидкотекучесть расплава, что влияет на заполнение всех полостей литейной формы. Кроме того, на жидкотекучесть и полноценную заполняемость полостей литейных форм существенно влияют, например, центробежные силы. Поэтому, как правило, фасонные отливки из титана производятся центробежной заливкой.
Кроме того, на жидкотекучесть и полноценную заполняемость полостей литейных форм существенно влияют, например, центробежные силы. Поэтому, как правило, фасонные отливки из титана производятся центробежной заливкой.
Еще одним чрезвычайно перспективным методом изготовления деталей и изделий из титана это порошковая металлургия. Сначала получают очень мелкозернистый, скорее даже тонкодисперсный, порошок титана. Затем он спрессовывается в холодном виде и металлических пресс-формах, Далее при температурах 900—1000° С, а для высокоплотных конструкционных изделий при 1200—1300° С пресс-изделия спекаются. Разработаны и методы горячего прессования при температурах, близких к температуре спекания, которые позволяют повысить конечную плотность изделий и снизить трудоемкость процесса их изготовления.
Разновидностью динамического горячего прессования является горячая штамповка и выдавливание (экструзия) из порошков титана. Главное преимущество порошкового метода изготовления деталей и изделий — почти безотходное производство. Если по обычной технологии (слиток—полуфабрикат—изделие) выход годного составляет всего 25—30%, то при порошковой металлургии коэффициент использования металла повышается в несколько раз, снижается трудоемкость изготовления изделий, уменьшаются трудозатраты на механическую обработку. Методами порошковой металлургии можно организовать производство из титана новых изделий, изготовление которых традиционными Методами невозможно: пористые фильтрующие элементы, газопоглотители, металлополимерные покрытия и т. п.
Если по обычной технологии (слиток—полуфабрикат—изделие) выход годного составляет всего 25—30%, то при порошковой металлургии коэффициент использования металла повышается в несколько раз, снижается трудоемкость изготовления изделий, уменьшаются трудозатраты на механическую обработку. Методами порошковой металлургии можно организовать производство из титана новых изделий, изготовление которых традиционными Методами невозможно: пористые фильтрующие элементы, газопоглотители, металлополимерные покрытия и т. п.
Еще один важнейший аспект рассматриваемой проблемы — соединение титана. Как соединить титановые изделия (листы, ленты, детали и др.) между собой и с другими изделиями? Мы знаем три основных метода соединения металлов — это сварка, пайка и клепка их. Как же ведет себя титан во всех этих операциях? Вспомним, что титан обладает, особенно при повышенных температурах, высокой химической активностью. При взаимодействии с кислородом, азотом, водородом воздуха зона расплавленного металла насыщается этими голами, изменяется микроструктура металла в месте разогрева, может происходить загрязнение посторонними примесями, и сваркой шов будет хрупким, пористым, непрочным. Поэтому обычно методы сварки титановых изделий неприемлемы. Сварка титана требует постоянного и неукоснительного предохранения сварного шва от загрязнения примесями и газами воздуха. Типология сварки титановых изделий предусматривает ее проведение с большой скоростью только в атмосфере инертных газов с применением специальных бескислородных флюсов. Наиболее качественная Сварка производится в специальных обитаемых или необитаемых камерах, зачастую автоматическими методами. Необходим постоянный контроль состава газа, флюсов, температуры, скорости сварки, а также качества шва визуальным, рентгеновским и другими методами. Сварной титановый шов хорошего качества должен иметь золотистый оттенок без всякой побежалости. Особо крупные изделия сваривают в специальных герметично закрытых помещениях, заполненных инертным газом. Работу производит сварщик высокой квалификации, оп работает в скафандре с индивидуальной системой жизнеобеспечения.
Поэтому обычно методы сварки титановых изделий неприемлемы. Сварка титана требует постоянного и неукоснительного предохранения сварного шва от загрязнения примесями и газами воздуха. Типология сварки титановых изделий предусматривает ее проведение с большой скоростью только в атмосфере инертных газов с применением специальных бескислородных флюсов. Наиболее качественная Сварка производится в специальных обитаемых или необитаемых камерах, зачастую автоматическими методами. Необходим постоянный контроль состава газа, флюсов, температуры, скорости сварки, а также качества шва визуальным, рентгеновским и другими методами. Сварной титановый шов хорошего качества должен иметь золотистый оттенок без всякой побежалости. Особо крупные изделия сваривают в специальных герметично закрытых помещениях, заполненных инертным газом. Работу производит сварщик высокой квалификации, оп работает в скафандре с индивидуальной системой жизнеобеспечения.
Небольшие титановые изделия можно соединять методами пайки. Здесь возникают те же проблемы предохранения разогретых спаиваемых чистой от загрязнения газами воздуха и примесями, делающими пайку ненадежной. Кроме того, обычно припои (олово, медь и другие металлы) не пригодны. Используются только серебро и алюминий высокой степени чистоты.
Здесь возникают те же проблемы предохранения разогретых спаиваемых чистой от загрязнения газами воздуха и примесями, делающими пайку ненадежной. Кроме того, обычно припои (олово, медь и другие металлы) не пригодны. Используются только серебро и алюминий высокой степени чистоты.
Соединения титановых изделий с помощью клейки пли болтов тоже имеют свои особенности. Титановая клепка очень трудоемкий процесс: на нее приходите» тратить вдвое больше времени, чем на алюминиевую. Резьбовое соединение титановых изделий ненадежны, так как титановые гайки и болты при завинчивании начинают налипать и задираться, и оно может не выдержать больших напряжений. Поэтому болты и гайки из титана обязательно покрывают топким слоем серебра или синтетической пленкой из тефлона, а уж потом используют для завинчивания.
Свойство титана к налипанию и задиранию, обусловленное высоким коэффициентом трения, не позволяет применять его без специальной предварительной обработки в трущихся изделиях; при скольжении по любому металлу титан, налипая на трущуюся деталь, быстро изнашивается, деталь буквально вязнет в липком титане. Для устранения этого явления приходится специальными Методами упрочнять поверхностный слой титана в изделиях, работающих на скольжение. Производится азотирование или оксидирование титановых изделий: их при высоких температурах (850—950° С) выдерживают в течение определенного времени в атмосфере чистого азота или кислорода. В результате на Поверхности образуется тонкая нитридная или окисная пленка высокой микротвердости. Такая обработка приближает износостойкость титана к специальным поверхностно обработанным сталям и позволяет применять его в трущихся и скользящих, изделиях.
Для устранения этого явления приходится специальными Методами упрочнять поверхностный слой титана в изделиях, работающих на скольжение. Производится азотирование или оксидирование титановых изделий: их при высоких температурах (850—950° С) выдерживают в течение определенного времени в атмосфере чистого азота или кислорода. В результате на Поверхности образуется тонкая нитридная или окисная пленка высокой микротвердости. Такая обработка приближает износостойкость титана к специальным поверхностно обработанным сталям и позволяет применять его в трущихся и скользящих, изделиях.
Титан — общая характеристика и свойства химического элемента
В периодической системе химический элемент титан обозначается, как Ti (Titanium) и располагается в побочной подгруппе IV группы, в 4 периоде под атомным номером 22. Это серебристо-белый твёрдый металл, который входит в состав большого количества минералов. Купить титан вы можете на нашем сайте.
Открыли титан в конце 18 века химики из Англии и Германии Ульям Грегор и Мартин Клапрот, причём независимо друг от друга с шестилетней разницей. Название элементу дал именно Мартин Клапрот в честь древнегреческих персонажей титанов (огромных, сильных, бессмертных существ). Как оказалось, название стало пророческим, но чтобы познакомиться со всеми свойствами титана, человечеству понадобилось ещё больше 150 лет. Только через три десятилетия удалось получить первый образец металла титана. На тот момент времени его практически не использовали из-за хрупкости. В 1925 году после ряда опытов, при помощи йодидного метода химики Ван Аркель и Де Бур добыли чистый титан.
Название элементу дал именно Мартин Клапрот в честь древнегреческих персонажей титанов (огромных, сильных, бессмертных существ). Как оказалось, название стало пророческим, но чтобы познакомиться со всеми свойствами титана, человечеству понадобилось ещё больше 150 лет. Только через три десятилетия удалось получить первый образец металла титана. На тот момент времени его практически не использовали из-за хрупкости. В 1925 году после ряда опытов, при помощи йодидного метода химики Ван Аркель и Де Бур добыли чистый титан.
Благодаря ценным свойствам металла, на него сразу же обратили внимание инженеры и конструкторы. Это был настоящий прорыв. В 1940 году Кролль разработал магниетермический способ получения титана из руды. Этот способ актуален и на сегодняшний день.
История открытия
Явление нового элемента связано с именами Грегора и Клапрота. Оба выделили его практически одновременно 1791 и 1795 гг. соответственно.
Мартин Генрих Клапрот
В 1805 г. был выделен вновь Вокленом из анатаза. При этом чистый титан был получен в Голландии более чем через век после выделения.
был выделен вновь Вокленом из анатаза. При этом чистый титан был получен в Голландии более чем через век после выделения.
Высокопрочные сплавы с нестабильной β-структурой
| Марка сплава | Процент легирующих добавок | Предел прочности кгс/мм2 | Рабочая температура |
| ВТ-14 | 3,5−6,3 Al, 2,5−3,5 Mo, 0,9−1,9 V | 110 — 160 | 300 — 400 |
| ВТ-15 | 2,5−3,5 Al, 6,8−8 Mo, 9,5−11 Cr | 110 — 160 | 300 — 400 |
| ВТ-16 | 1,6−3 Al, 4,5−5,5 Mo, 4−5 V | 110 — 160 | 300 — 400 |
| ВТ-22 | 4,4−5,9 Al, 4−5,5 Mo, 4−5,5 V, 0,5−2 Cr, 0,2−4 Si, 0,2−0,5 Fe | 110 — 160 | 300 — 400 |
| ТС-6 | 3 Al, 5 Mo, 6 V, 11 Cr | 110 — 160 | 300 — 400 |
Нахождение в природе
В природе титан представлен в виде соединений с кислородом. Чистые формы не встречаются.
Под влиянием метеорологических условий по строению приближается к корунду (соединению алюминия с кислородом).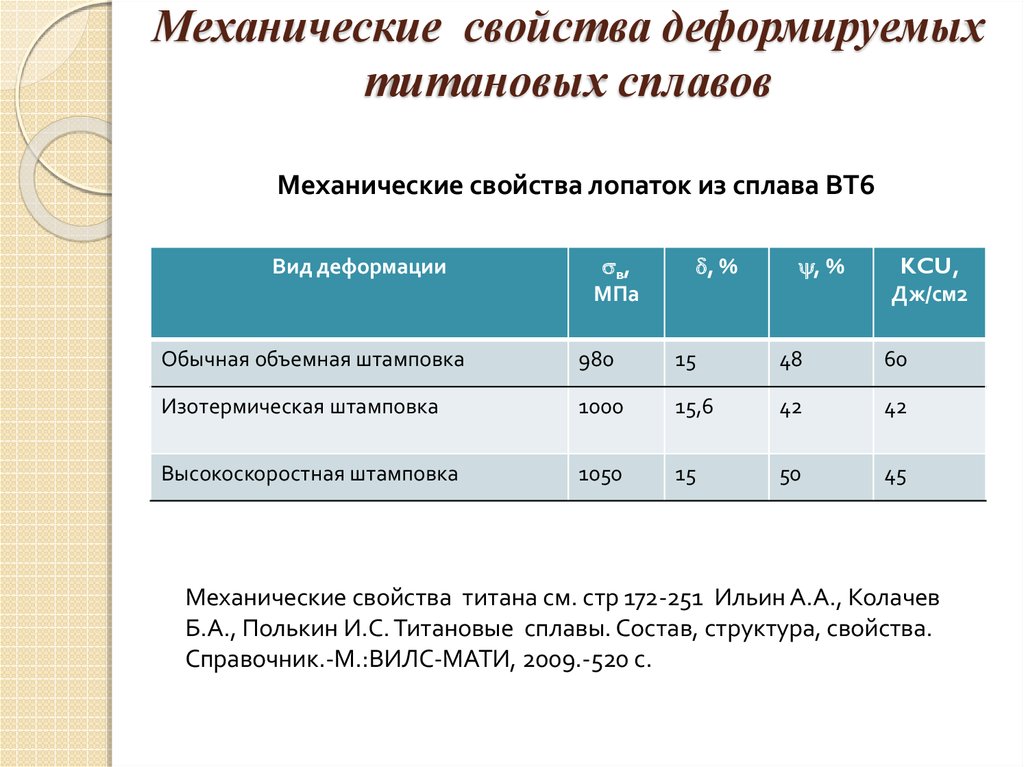 Его обнаруживают в морской глине, в алюминиевых рудах с железом и кремнием.
Его обнаруживают в морской глине, в алюминиевых рудах с железом и кремнием.
Титан представлен в минералах: титанит, титаномагнетит, рутил. Известны австралийские, бразильские, канадские месторождения последнего. Минерал представлен в виде букрита и анатаза.
Широко встречаемым минералом служит титанат железа (ильменит). Крупные месторождения представлены в России, Северной Америке.
Крупные месторождения
Лидирующее место занимает Китай, далее следует Российская Федерация, Северная Америка (Канада). Самое крупное месторождение, где добывают титан в РФ, расположено на территории республики Коми и называется Ярегское нефтяное месторождение.
В десятку стран лидеров по добыче титана входят:
- США;
- Индия;
- Австралия;
- ЮАР;
- Швеция;
- Норвегия;
- Южная Корея.
Происхождение названия
Менакин — первое название титана, которое применялось до 1795 года. Именно так, по территориальной принадлежности, назвал новый элемент У. Грегор. Мартин Клапрот присваивает элементу в 1797 году наименование «титан». В это время его французские коллеги во главе с достаточно авторитетным химиком А. Л. Лавуазье предлагают именовать вновь открытые вещества в соответствии с их основными свойствами. Немецкий ученый не был согласен с таким подходом, он вполне обоснованно считал, что на стадии открытия достаточно сложно определить все характеристики, свойственные веществу, и отразить их в названии. Однако следует признать, что интуитивно выбранный Клапротом термин в полной мере соответствует металлу — это неоднократно подчеркивали современные ученые. Существуют две основные теории возникновения названия титан. Металл мог быть обозначен так в честь эльфийской царицы Титании (персонаж германской мифологии). Такое название символизирует одновременно легкость и прочность вещества. Большинство ученых склоняются к версии использования древнегреческой мифологии, в которой титанами называли могучих сыновей богини земли Геи. В пользу этой версии говорит и название открытого ранее элемента — урана.
Грегор. Мартин Клапрот присваивает элементу в 1797 году наименование «титан». В это время его французские коллеги во главе с достаточно авторитетным химиком А. Л. Лавуазье предлагают именовать вновь открытые вещества в соответствии с их основными свойствами. Немецкий ученый не был согласен с таким подходом, он вполне обоснованно считал, что на стадии открытия достаточно сложно определить все характеристики, свойственные веществу, и отразить их в названии. Однако следует признать, что интуитивно выбранный Клапротом термин в полной мере соответствует металлу — это неоднократно подчеркивали современные ученые. Существуют две основные теории возникновения названия титан. Металл мог быть обозначен так в честь эльфийской царицы Титании (персонаж германской мифологии). Такое название символизирует одновременно легкость и прочность вещества. Большинство ученых склоняются к версии использования древнегреческой мифологии, в которой титанами называли могучих сыновей богини земли Геи. В пользу этой версии говорит и название открытого ранее элемента — урана.
Мировые запасы и производство титана
Представленные в Канаде около 1/5 мировой добычи приходится на ильменитовые руды. В Китае 1/10 часть выпуска обеспечивается месторождением Лак-Тико.
РФ производит меньше 1% титанового концентрата. Однако месторождение в Коми признано вторым по масштабу после Китая. Также лопаритовые руды экспортируются преимущественно Россией (Ловозерск). Последние используют в производстве редкоземельных металлов (в том числе титана).
Пластичные сплавы со средней прочностью
| Марка сплава | Процент легирующих добавок | Предел прочности кгс/мм2 | Рабочая температура |
| АТ-2 | 2,5 Zr, 1,5 Mo | 50 — 80 | 200 — 300 |
| ОТ4−1 | 1−2,5 Al, 0,7−2 Mn | 50 — 80 | 200 — 300 |
| ОТ4 | 3,5−5 Al, 0,8−2 Mn | 50 — 80 | 200 — 300 |
| АТ-3 | 3 Al, 1,5%(Cr+Fe+Si+B) | 50 — 80 | 200 — 300 |
| ВТ5−1 | 4−6 Al, 2−3 Sn | 50 — 80 | 200 — 300 |
Получение титана
Источник металла – диоксид титана.
Его образование происходит в процессе переработки ильменита. В результате образуется титановый шлак, который подвергается дальнейшей переработке. К концентрату добавляют серную кислоту, на выходе образуется двуокись титана.
Другой способ заключается в соединении с углеродом (кокс), хлором и дальнейшим нагреванием в присутствии магния.
Также применяют восстановление кальцием диоксида титана. Последний процесс заключается в проведении электрического тока, что ведет к разложению оксида кальция (кислород на аноде и собственно кальций).
Кислород выступает в роли окислителя, кальций, будучи металлом, переходит к катоду, попутно восстанавливая титан. Процесс происходит несколько раз. Исходом реакции служит титановая губка, требующая очищения.
К какой группе металлов относится титан
Ведущей отраслью в экономике нашей страны является металлургия. Для успешного ее развития нужно много металла. В данной статье речь пойдет о цветных тяжелых и легких металлах и их использовании.
Классификация цветных металлов
В зависимости от физических свойств и назначения, они подразделяются на такие группы:
- Легкие цветные металлы. Список этой группы большой: в ее состав входит кальций, стронций, цезий, калий, а также литий. Но в металлургической промышленности чаще всего используются алюминий, титан и магний.
- Тяжелые металлы пользуются большой популярностью. Это всем известные цинк и олово, медь и свинец, а также никель.
- Благородные металлы, такие как платина, рутений, палладий, осмий, родий. Золото и серебро широко применяются для изготовления украшений.
- Редкоземельные металлы — селен и цирконий, германий и лантан, неодим, тербий, самарий и другие.
- Тугоплавкие металлы — ванадий и вольфрам, тантал и молибден, хром и марганец.
- Малые металлы, такие как висмут, кобальт, мышьяк, кадмий, ртуть.
- Сплавы – латунь и бронза.
Легкие металлы
Они имеют широкое распространение в природе.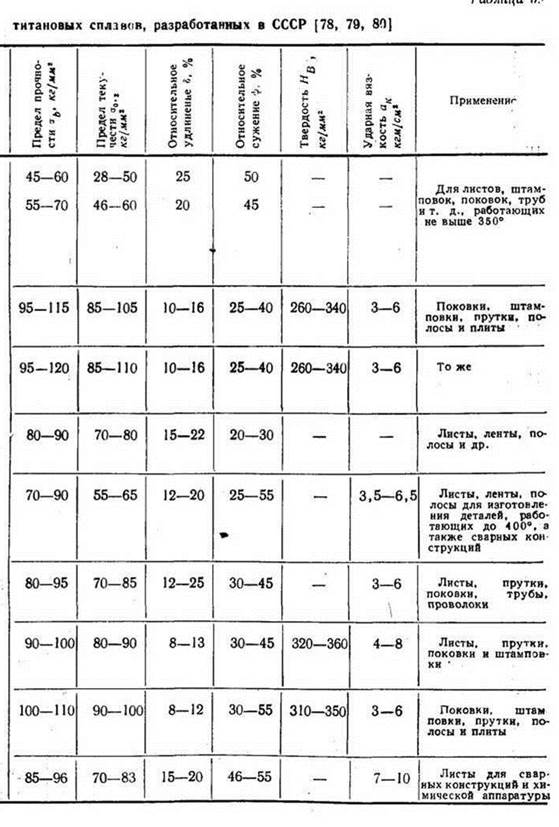 Эти металлы обладают маленькой плотностью. У них высокая химическая активность. Они представляют собой прочные соединения.
Эти металлы обладают маленькой плотностью. У них высокая химическая активность. Они представляют собой прочные соединения.
Металлургия этих металлов начала развиваться в девятнадцатом веке. Их получают путем электролиза солей в расплавленном виде, электротермии и металлотермии.
Легкие цветные металлы, списоккоторых имеет много пунктов, используются для производства сплавов.
Алюминий
Относится к легким металлам. Имеет серебристый цвет и точку плавления около семисот градусов. В промышленных условиях используется в сплавах. Он применяется везде, где нужен металл. У алюминия плотность низкая, а прочность – высокая. Этот металл легко режется, пилится, сваривается, сверлится, паяется и сгибается.
Сплавы образует с металлами различных свойств, такими как медь, никель, магний, кремний. Они обладают большой прочностью, не ржавеют при неблагоприятных погодных условиях. У алюминия высокая электро- и теплопроводность.
Магний
Он относится к группе легких цветных металлов. Имеет серебристо-белый цвет и пленочное окисное покрытие. Обладает маленькой плотностью, хорошо обрабатывается. Металл устойчив к воздействию горючими веществами: бензином, керосином, минеральными маслами, но подвержен растворению в кислотах. Магний не магнитен. Обладает низкими упругими и литейными свойствами, подвергается коррозии.
Имеет серебристо-белый цвет и пленочное окисное покрытие. Обладает маленькой плотностью, хорошо обрабатывается. Металл устойчив к воздействию горючими веществами: бензином, керосином, минеральными маслами, но подвержен растворению в кислотах. Магний не магнитен. Обладает низкими упругими и литейными свойствами, подвергается коррозии.
Титан
Это легкий металл. Он не магнитен. Имеет серебристый цвет с отливом голубоватого тона. Обладает высокой прочностью и устойчивостью к коррозии. Но у титана маленькая электропроводность и теплопроводность. Теряет механические свойства при температуре 400 градусов, приобретает хрупкость при 540 градусах.
Механические свойства титана повышаются в сплавах с молибденом, марганцем, алюминием, хромом и другими. В зависимости от легирующего металла, сплавы имеют разную прочность, среди них есть и высокопрочные. Такие сплавы применяются в самолетостроении, машиностроении, судостроении. Из них производят ракетную технику, бытовые приборы и многое другое.
Тяжелые металлы
Тяжелые цветные металлы, список которых весьма широк, получают из сульфидных и окисленных полиметаллических руд. В зависимости от их типов, методы получения металлов отличаются по способу и сложности производства, в процессе которого должны полностью извлекаться ценные составляющие сырья.
Металлы этой группы бывают гидрометаллургическими и пирометаллургическими. Полученные любым методом металлы называются черновыми. Они подвергаются процедуре рафинирования. Только после этого их можно использовать в промышленных целях.
Медь
Цветные металлы, список которых представлен выше, в промышленности используются не все. В данном случае речь идет о распространенном тяжелом металле – меди. У нее высокая теплопроводность, электропроводность и пластичность.
Сплавы меди нашли широкое применение в такой отрасли промышленности, как машиностроение, а все благодаря тому, что этот тяжелый металл хорошо сплавляется с другими.
Цинк
Он тоже представляет цветные металлы. Список названий большой. Однако далеко не все тяжелые цветные металлы, к которым относится цинк, используются в промышленности. Этот металл хрупкий.
Список названий большой. Однако далеко не все тяжелые цветные металлы, к которым относится цинк, используются в промышленности. Этот металл хрупкий.
Но если нагреть его до ста пятидесяти градусов, он будет без проблем коваться и с легкостью прокатываться.
У цинка высокие антикоррозионные свойства, но он поддается разрушению при воздействии щелочью и кислотой.
Свинец
Список цветных металлов будет неполным без свинца. Он серого цвета с проблеском голубого оттенка. Температура плавления составляет триста двадцать семь градусов. Он тяжелый и мягкий. Хорошо куется молотком, при этом не твердеет. Из него выливают различные формы. Устойчив к воздействию кислот: соляной, серной, уксусной, азотной.
Латуни
Это сплавы из меди и цинка с добавлением марганца, свинца, алюминия и других металлов. Стоимость латуни меньше, чем меди, а прочность, вязкость и коррозионная стойкость – выше. У латуни хорошие литейные свойства. Из нее производят детали путем штамповки, раскатки, вытяжки, вальцовки. Из этого металла делают гильзы для снарядов и многое другое.
Из этого металла делают гильзы для снарядов и многое другое.
Использование цветных металлов
Цветными называют не только сами металлы, но и их сплавы. Исключение составляет так называемый «чермет»: железо и, соответственно, его сплавы. В странах Европы цветные металлы носят название нежелезистых.
Цветные металлы, список которых немаленький, нашли широкое применение в разных отраслях во всем мире, в том числе и в России, где являются основной специализацией. Производятся и добываются на территориях всех регионов страны.
Легкие и тяжелые цветные металлы, список которых представлен большим разнообразием наименований, составляют отрасль промышленности под названием «Металлургия». Это понятие включает в себя добычу, обогащение руд, выплавку как металлов, так и их сплавов.
В настоящее время отрасль цветной металлургии получила широкое распространение. Качество цветных металлов очень высокое, они отличаются долговечностью и практичностью, применяются в строительной индустрии: ими отделывают здания и сооружения. Из них производят профильный металл, проволоку, ленты, полосы, фольгу, листы, прутки различной формы.
Из них производят профильный металл, проволоку, ленты, полосы, фольгу, листы, прутки различной формы.
Титан – описание и свойства
Земная кора, как известно, насыщенна многочисленным рядом химических элементов. Среди часто встречающихся среди них — титан. Можно сказать, что он находится на 10-м месте ТОПа самых распространенных хим элементов Земли.
Титан — металл серебристо-белого цвета, стоек ко многим агрессивным средам, не подвержен окислению в ряде мощнейших кислот, исключениями являются лишь плавиковая, ортофосфорная серная кислота в высокой концентрации.
Титан в чистом виде относительно молод, его получили лишь в 1925 году.
Пленка оксида, которая покрывает титан в чистом виде, служит весьма надежной защитой этого металла от коррозии.
Ценится титан и за его низкую теплопроводность, для сравнения — титан в 13 раз хуже проводит тепло чем алюминий, а вот с проводимостью электричества обратная картина — титан обладает гораздо большим сопротивлением.
Все же самой главная отличительная черта титана — его колоссальная прочность. Опять же если сравнить ее теперь с чистым железом, то титан в два раза превышает его прочность!
Сплавы титана
Сплавы из титана обладают так же выдающимися свойствами, среди которых на первом месте, как вы уже могли догадаться — прочность. Как конструкционный материал, титан уступает в прочности лишь бериллиевым сплавам. Однако неоспоримым преимуществом сплавов титана является их высокая стойкость к истиранию, износу и в то же время достаточная пластичность.
Титановые сплавы устойчивы к воздействию целого ряда активных кислот, солей, гидроксидов. Эти сплавы не боятся и высокотемпературных воздействий, именно поэтому из титана и его сплавов изготавливают турбины реактивных двигателей, да и вообще широко используются в ракетостроении и авиационной промышленности.
Где используется титан
Титан используется там, где необходим очень прочный материал, обладающий максимальной стойкостью к различным видам негативного воздействия. Например, в химической промышленности титановые сплавы применяются для производства насосов, емкостей и трубопроводов для транспортировки агрессивных жидкостей.
Например, в химической промышленности титановые сплавы применяются для производства насосов, емкостей и трубопроводов для транспортировки агрессивных жидкостей.
В медицине титан служит для протезирования и обладает отличной биологической совместимостью с организмом человека. Кроме того, сплав титана и никеля – нитинол – обладает “памятью”, что позволяет использовать его в ортопедической хирургии.
В металлургии титан служит легирующим элементом, который вводят в состав некоторых видов стали.
Благодаря сохранению пластичности и прочности под воздействием низких температур, металл используют в криогенной технике. В авиа- и ракетостроении титан ценится за свою жаропрочность, а наиболее широкое распространение здесь получил его сплав с алюминием и ванадием: именно из него изготавливают детали для корпусов летательных аппаратов и реактивных двигателей.
В свою очередь, в судостроении титановые сплавы применяют для изготовления металлических изделий с повышенной коррозийной устойчивостью.
Но, помимо промышленного использования, титан служит сырьем для создания украшений и аксессуаров, так как он хорошо поддается таким методам обработки, как полировка или анодирование.
В частности, из него отливают корпуса наручных часов и ювелирные украшения.
Титан получил широкое применение в составе различных соединений. Например, диоксид титана входит в состав красок, используется в процессе производства бумаги и пластика, а нитрид титана выступает в роли защитного покрытия инструментов. Несмотря на то, что титан называют металлом будущего, на данном этапе сфера его применения серьезно ограничена высокой стоимостью получения.
Таблица 1
| Химический состав промышленных титановых сплавов. | ||||||||
| Тип сплава | Марка сплава | Химический состав, % (остальное Ti) | ||||||
| Аl | V | Mo | Mn | Cr | Si | Другие элементы | ||
| a | ВТ5ВТ5-1 | 4,3—6,24,5—6,0 | —— | —— | —— | —— | —— | —2—3Sn |
| Псевдо-a | ОТ4-0ОТ4-1ОТ4ВТ20ВТ18 | 0,2—1,41,0—2,53,5—5,06,0—7,57,2—8,2 | ———0,8—1,8— | ———0,5—2,00,2—1,0 | 0,2—1,30,7—2,00,8—2,0—— | ————— | ————0,18—0,5 | ———1,5—2,5Zr0,5—1,5Nb10—12Zr |
| a + b | ВТ6СВТ6ВТ8ВТ9ВТ3-1ВТ14ВТ16ВТ22 | 5,0—6,55,5—7,06,0—7,35,8—7,05,5—7,04,5—6,31,6—3,04,0—5,7 | 3,5—4,54,2—6,0———0,9—1,94,0—5,04,0—5,5 | ——2,8—3,82,8—3,82,0—3,02,5—3,84,5—5,54,5—5,0 | ———————— | ————1,0—2,5——0,5—2,0 | ——0,20—0,400,20—0,360,15—0,40——— | ———0,8—2,5Zr0,2—0,7Fe——0,5—1,5Fe |
| b | ВТ15 | 2,3—3,6 | — | 6,8—8,0 | — | 9,5—11,0 | — | 1,0Zr |
Таблица 2. Механические свойства титановых сплавов (типичные).
Механические свойства титановых сплавов (типичные).
Двоякость свойств металла титан
Многих интересует немного загадочный и не до конца изученный титан — металл, свойства которого отличаются некоторой двоякостью. Металл и самый прочный, и самый хрупкий.
Самый прочный и самый хрупкий металл
Его открыли двое ученых с разницей в 6 лет — англичанин У. Грегор и немец М. Клапрот. Название титана связывают, с одной стороны, с мифическими титанами, сверхъестественными и бесстрашными, с другой стороны, с Титанией — королевой фей. Это один из самых распространенных в природе материалов, но процесс получения чистого металла отличается особой сложностью.
Связь с другими металлами
Титан занимает промежуточное положение между двумя другими известнейшими конструкционными материалами – алюминием и железом, вернее говоря, сплавами железа. По многим параметрам металл превосходит «конкурентов»:
- механическая прочность титана в 2 раза выше, чем у железа, и в 6 раз, чем у алюминия.
 При этом прочность при снижении температуры возрастает;
При этом прочность при снижении температуры возрастает; - коррозийная стойкость намного выше, чем у железа и даже алюминия;
- при нормальной температуре титан инертен. Однако при повышении до 250 С, начинает поглощать водород, что сказывается на свойствах. По химической активности он уступает магнию, но, увы, превосходит железо и алюминий;
- металл намного слабее проводит электричество: его удельное электросопротивление выше, чем у железа 5 раз, выше, чем у алюминия в 20 раз, и выше, чем у магния в 10 раз;
- теплопроводность также намного ниже: меньше, чем 1 железа в 3 раза, и меньше, чем у алюминия в 12 раз. Однако это свойство обуславливает очень низкий коэффициент температурного расширения.
Плюсы и минусы
На деле недостатков у титана множество. Но сочетание прочности и легкости настолько востребовано, что ни сложный способ изготовления, ни необходимость исключительной чистоты не останавливают потребителей металла.
К несомненным плюсам вещества относятся:
- низкая плотность, что означает очень небольшой вес;
- исключительная механическая прочность как самого металла титан, так и его сплавов.
 При повышении температуры титановые сплавы превосходят все сплавы алюминия и магния;
При повышении температуры титановые сплавы превосходят все сплавы алюминия и магния; - соотношение прочности и плотности – удельная прочность, достигает 30–35, что почти в 2 раза выше, чем у лучших конструкционных сталей;
- на воздухе титан подлежит покрытию тонким слоем оксида, который и обеспечивает превосходную коррозийную стойкость.
Недостатков у металла тоже хватает:
- стойкость к коррозии и инертность относится только к продукции с неактивной поверхностью. Титановая пыль или стружка, например, самовоспламеняются и сгорают с температурой в 400 С;
- очень сложный способ получения металла титан обеспечивает очень высокую стоимость. Материал намного дороже железа, алюминия или меди;
- способность впитывать атмосферные газы при повышении температуры требует применения при плавке и получении сплавов вакуумной аппаратуры, что тоже заметно увеличивает стоимость;
- титан отличается плохими антифрикционными свойствами – на трение он не работает;
- металл и его сплавы склонны к водородной коррозии, предотвратить которую сложно;
- титан плохо поддается обработке резанием.
 Сварка его тоже затруднена из-за фазового перехода во время нагревания.
Сварка его тоже затруднена из-за фазового перехода во время нагревания.
Далее рассмотрены состав и структура титана.
Лист титана
Свойства и характеристики
Физические качества вещества сильно зависят от чистоты. Справочные данные описывают, конечно, чистый металл, но характеристики технического титана могут заметно отличаться.
- Плотность металла уменьшается при нагревании от 4,41 до 4,25 г/куб см. Фазовый переход изменяет плотность лишь на 0,15%.
- Температура плавления металла – 1668 С. температуру кипения – 3227 С. Титан является тугоплавким веществом.
- В среднем предел прочности на растяжение составляет 300–450 МПа, однако это показатель можно увеличить до 2000 МПА, прибегнув к закалке и старению, а также введению дополнительных элементов.
- По шкале НВ твердость составляет 103 и это не предел.
- Теплоемкость титана невелика – 0,523 кдж/(кг·К).
- Удельное электросопротивление — 42,1·10-6 ом·см.
- Титан является парамагнитом.
 При снижении температуры его магнитная восприимчивость уменьшается.
При снижении температуры его магнитная восприимчивость уменьшается. - Металлу в целом свойственны пластичность и ковкость. Однако на эти свойства сильно влияют кислород и азот в сплаве. Оба элемента придают материалу хрупкость.
Вещество устойчиво ко многим кислотам, включая азотную, серную в низкой концентрации и практически все органические за исключением муравьиной. Это качество обеспечивает титану востребованность в химической, нефтехимической, бумажной промышленности и так далее.
Структура и состав
Титан – хоть и переходный металл, да и удельное электросопротивление имеет низкое, все же, является металлом и проводит электрический ток, а это означает упорядоченную структуру. При нагревании до определенной температуры структура изменяется:
- до 883 С устойчивой является α-фаза с плотностью в 4,55 г/куб. см. Она отличается плотной гексагональной решеткой. Кислород растворяется в этой фазе с образованием растворов внедрения и стабилизирует α-модификацию – отодвигает температурный предел;
- выше 883 С стабильна β-фаза с объемно-центрированной кубической решеткой.
 Плотность его несколько меньше – 4,22 г/куб. см. Эту структуру стабилизирует водород – при его растворении в титане также образуются растворы внедрения и гидриды.
Плотность его несколько меньше – 4,22 г/куб. см. Эту структуру стабилизирует водород – при его растворении в титане также образуются растворы внедрения и гидриды.
Эта особенность очень затрудняет работу металлурга. Растворимость водорода при охлаждении титана резко уменьшается, и в сплаве выпадает гидрид водорода – γ-фаза.
Он становится причиной появления холодных трещин при сварке, поэтому производителям приходится применять дополнительные усилия после плавки металла, чтобы очистить его от водорода.
О том, где можно найти и как сделать титан, расскажем ниже.
Данное видео посвящено описанию титана как металла:
Титан весьма распространен, так что с рудами, содержащими металл, причем в довольно больших количествах, затруднений не возникает. Исходным сырьем выступает рутил, анатаз и брукит – диоксиды титана в разной модификации, ильменит, пирофанит – соединения с железом, и так далее.
А вот технология плавки титана сложна и требует дорогостоящей аппаратуры. Способы получения несколько отличаются, поскольку состав руды различен. Например, схема получения металла из ильменитовых руд выглядит так:
Способы получения несколько отличаются, поскольку состав руды различен. Например, схема получения металла из ильменитовых руд выглядит так:
- получение титанового шлака – породу загружают в электродуговую печь вместе с восстановителем – антрацитом, древесным углем и прогревают до 1650 С. При этом отделяют железо, которое идет на получение чугуна и диоксида титана в шлаке;
- шлак хлорируют в шахтных или солевых хлораторах. Суть процесса сводится к тому, чтобы перевести твердый диоксид в газообразный тетрахлорид титана;
- в печах сопротивления в специальных колбах металл восстанавливают натрием или магнием из хлорида. В итоге получают простую массу – титановую губку. Это технический титан вполне пригодный для изготовления химической аппаратуры, например;
- если же требуется более чистый металл, прибегают к рафинированию – при этом металл реагирует с йодом с тем, чтобы получить газообразный йодид, а последний под действием температуры – 1300–1400 С, и электрического тока, разлагается, высвобождая чистый титан.
 Электрический ток подается через натянутую в реторте титановую проволоку, на которую и осаждается чистое вещество.
Электрический ток подается через натянутую в реторте титановую проволоку, на которую и осаждается чистое вещество.
Физические свойства
Элемент расположен в четвертой группе в системе Д. И. Менделеева, под номером 22. В соединении атом обладает валентностью (II). Электронная конфигурация представлена формулой: [Ar] 3d24s2.
Вес атома (масса) около 47,9 а.е.м. Переход альфа титана в бета титан происходит при температуре 8830С. Теплота плавления 18,8 кДж/моль. Подвергается кипению при 31800С. Обладает теплопроводностью, составляющей 22,09 Вт/(м*К).
Титан обладает высокой ковкостью, пластичностью, низкой твердостью. Однако сплавы, содержащие титан, относятся к высокотвердым, но хрупким соединениям.
Серебристое вещество, по строению относится к металлам, имеет голубоватый оттенок. Обладает низкой плотностью. Высокая температура плавления (16700С).
В соединениях Ti способен проявить степень окисления (+2) (Ti+2h3, Ti+2O, Ti+2(OH)2, Ti+2F2, Ti+2Cl2, Ti+2Br2), (+3) (Ti+32O3, Ti+3(OH)3, Ti+3F3, Ti+3Cl3, Ti+32S3) и (+4) (Ti+4F4, Ti+4h5, Ti+4Cl4, Ti+4Br4).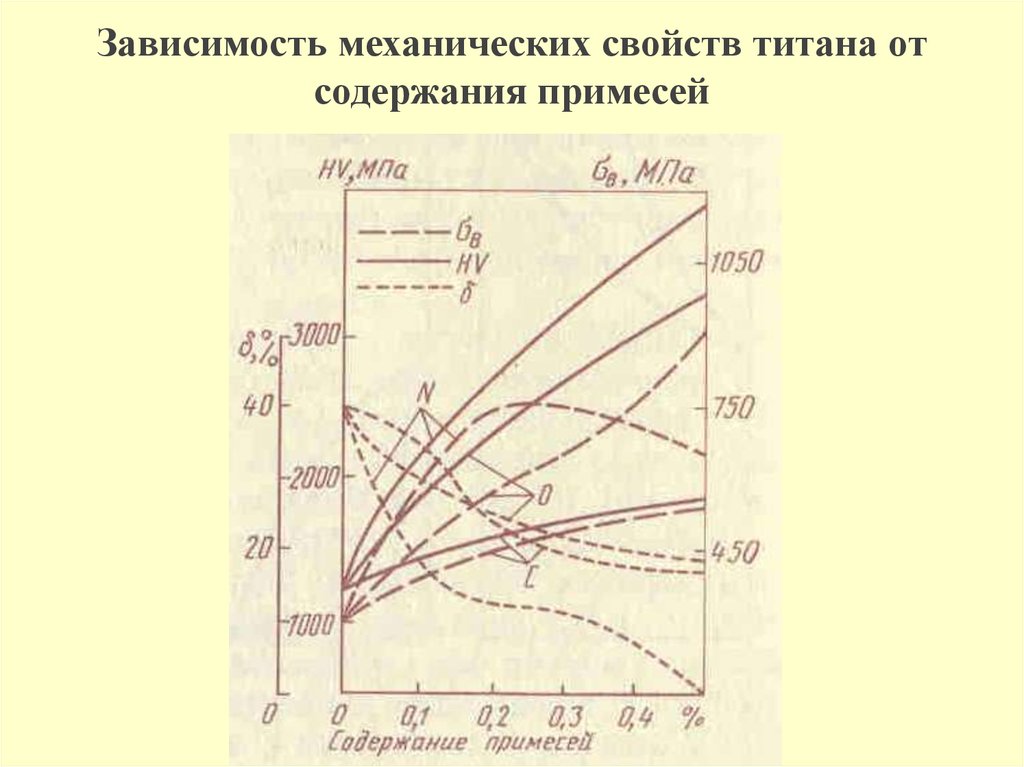
Конструкционные сплавы с повышенной прочностью
| Марка сплава | Процент легирующих добавок | Предел прочности кгс/мм2 | Рабочая температура |
| ВТ-4 | 3,5−4,5 Al, 0,8−2 Mn | 80 — 100 | 300 — 450 |
| ОТ4−2 | 5,5−7 Al, 0,2−1,8 Mn | 80 — 100 | 300 — 450 |
| ВТ5 | 4,3−6,2 Al | 80 — 100 | 300 — 450 |
| ВТ-6 | 5,5−7 Al, 4,2−6 V | 80 — 100 | 300 — 450 |
| ВТ-6с | 5−6,5 Al, 5,5−4,5 V | 80 — 100 | 300 — 450 |
| ВТ-20 | 5,5−7,5 Al, 1,-2,5 Zr, 0,5−2 Mo, 0,8−1,8 V | 80 — 100 | 300 — 450 |
| АТ-4 | 4,5 Al, 1,5%(Cr+Fe+Si+B) | 80 — 100 | 300 — 450 |
| АТ-6 | 6 Al, 1,5 (Cr+Fe+Si+B) | 80 — 100 | 300 — 450 |
Химические свойства
Устойчив к коррозии, по свойствам приближается хромоникелевой стали. Последнее обусловлено пленкой, образуемой на его поверхности. Воздух не меняет механических свойств.
Последнее обусловлено пленкой, образуемой на его поверхности. Воздух не меняет механических свойств.
При нагревании свыше 6000С металл становится хрупким, усиливается поглощение кислорода. При нагревании более 9100С взаимодействует с газообразными соединениями углерода, реабсорбирует азот.
При присоединении водорода, титан приобретает «водородную хрупкость». Данный эффект проявляется повышенной ломкостью при перепадах напряжения. Устойчив в кислотах.
Структура металла
По внешнему виду металл больше всего напоминает сталь, однако механические его качества выше. При этом титан отличается малым весом – молекулярная масса 22. Физические свойства элемента изучены довольно хорошо, однако сильно зависят от чистоты металла, что приводит к существенным отклонениям.
Кроме того, имеет значение его специфические химические свойства. Титан устойчив к щелочам, азотной кислоте, и в то же время бурно взаимодействует с сухими галогенами, а при более высокой температуре – с кислородом и азотом.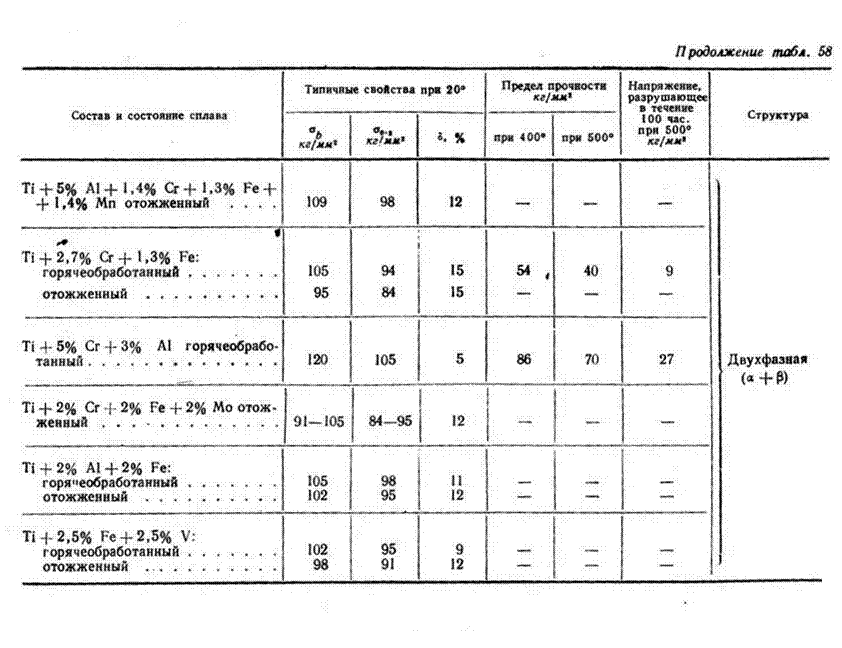 Хуже того, он начинает поглощать водород еще при комнатной температуре, если имеется активная поверхность. А в расплаве впитывает кислород и водород настолько интенсивно, что расплавление приходится проводить в вакууме.
Хуже того, он начинает поглощать водород еще при комнатной температуре, если имеется активная поверхность. А в расплаве впитывает кислород и водород настолько интенсивно, что расплавление приходится проводить в вакууме.
Еще одна важная особенность, определяющая физические характеристики – существование 2 фаз состояния.
- Низкотемпературная – α-Ti имеет гексагональную плотноупакованную решетку, плотность вещества – 4,55 г/куб. см (при 20 С).
- Высокотемпературная – β-Ti характеризуется объемно-центрированный кубической решеткой, плотность фазы, соответственно, меньше – 4, 32 г/куб. см. (при 900С).
Температура фазового перехода – 883 С.
В обычных условиях металл покрывается защитной оксидной пленкой. При ее отсутствии титан представляет большую опасность. Так, титановая пыль может взрываться, температура такой вспышки 400С. Титановая стружка является пожароопасным материалом и хранится в специальной среде.
Далее мы рассмотрим магнитные, механические, химические и физические свойства титана, его сплавов и их применение.
О структуре и свойствах титана рассказывает видео ниже:
Использование титана и его сплавов
Выделяют несколько технических сплавов с разной маркировкой ВТ1-00; ВТ1-0. В состав обоих входят:
- углерод;
- кислород;
- азот;
- водород;
- железо;
- кремний.
Однако в первом содержание представленных элементов выше, что обусловливает его преимущества перед ВТ1-0.
При легировании молибденом, ванадием, железом, повышается стабильность титана (или устойчивость) к температурным воздействиям. При добавлении алюминия, напротив, происходит снижение — это используют в промышленности, увеличивая диапазон химических превращений титана.
Используется в ракетном строительстве. На основе Ti изготавливают обшивку, различные агрегаты. Осуществляется производство компрессоров двигателей, цистерн для хранения. Титан нашел применение в самолетостроении, поскольку замедляет разрушение приборов.
Низкая теплопроводность позволила использовать его для изготовления противопожарных перегородок. В судостроении он предупреждает коррозию в морской воде.
В судостроении он предупреждает коррозию в морской воде.
В таблице представлены сведения о применении титана в зависимости от его свойств.
| Высокая коррозионная сопротивление | Трубы, теплообменники, реакторы |
| Низкий модуль упругости относительно стали | Пружины, тяги в машиностроении |
| Легкость, низкий иммунный ответ | Протезирование в медицине |
| Сохранение цвета | Бытовые предметы, оправы, рамки |
| Долговечность | Фасад, декор зданий, создание монументов, порошки, краски |
| Сплавы титана: превосходят по удельной прочности сталь | Создание стали для брони |
Повышенная коррозионная стойкость сплавов
| Марка сплава | Процент легирующих добавок | Предел прочности кгс/мм2 | Рабочая температура |
| 4200 | 0,2 Pd | 60 — 100 | 300 — 600 |
| 4201 | 31−35 Mo | 60 — 100 | 300 — 600 |
| 4204 | 5 Ta | 60 — 100 | 300 — 600 |
| НТ60 | 40−50 Nb | 60 — 100 | 300 — 600 |
| СТ! | Ti-Al-Zr-Sn | 60 — 100 | 300 — 600 |
| СТ4 | Ti-Al-Sn-Mo-Sr | 60 — 100 | 300 — 600 |
| СТ6 | Ti-Al-Zr-W | 60 — 100 | 300 — 600 |
Характеристики металла титан — свойства, особенности приминения металла, положительные и отрицательные качества.

Металл титан — распространенный в природе металл, в земной коре его больше, чем меди, свинца и цинка. При плотности 4,51 г/см3 титан имеет прочность 267…337 МПа, а его сплавы-до 1 250 МПа. Это тускло-серый металл с температурой плавления 1668 0С, коррозионно стоек при нормальной температуре даже в сильных агрессивных средах, но очень активен при нагреве выше 400 0С. В кислороде способен к самовозгоранию. Бурно реагирует с азотом. Окисляется водяным паром, углекислым газом, поглощает водород. Теплопроводность титана более чем в два раза ниже, чем у углеродистой стали. Поэтому при сварке титана, несмотря на его высокую температуру плавления, требуется меньше тепла.
Титановые сплавы — разбираемся в подробностях
Металл титан — распространенный в природе металл, в земной коре его больше, чем меди, свинца и цинка. При плотности 4,51 г/см3 титан имеет прочность 267…337 МПа, а его сплавы-до 1 250 МПа. Это тускло-серый металл с температурой плавления 1668 0С, коррозионно стоек при нормальной температуре даже в сильных агрессивных средах, но очень активен при нагреве выше 400 0С. В кислороде способен к самовозгоранию. Бурно реагирует с азотом. Окисляется водяным паром, углекислым газом, поглощает водород. Теплопроводность титана более чем в два раза ниже, чем у углеродистой стали. Поэтому при сварке титана, несмотря на его высокую температуру плавления, требуется меньше тепла.
В кислороде способен к самовозгоранию. Бурно реагирует с азотом. Окисляется водяным паром, углекислым газом, поглощает водород. Теплопроводность титана более чем в два раза ниже, чем у углеродистой стали. Поэтому при сварке титана, несмотря на его высокую температуру плавления, требуется меньше тепла.
Титан может находиться в виде двух основных стабильных фаз, отличающихся строением кристаллической решетки. При нормальной температуре он существует в виде α-фазы с мелкозернистой структурой, не чувствительной к скорости охлаждения. При температуре выше 882 0С образуется β-фаза с крупным зерном и высокой чувствительностью к скорости охлаждения. Легирующие элементы и примеси могут стабилизировать α-фазу (алюминий, кислород, азот) или β-фазу (хром, марганец, ванадий). Поэтому сплавы титана условно разделяют на три группы: α, α + β и β сплавы. Первые (ВТ1, ВТ5-1) термически не упрочняются, пластичны, обладают хорошей свариваемостью. Вторые (ОТ4, ВТЗ, ВТ4, ВТ6, ВТ8) при малых добавках β-стабилизаторов также свариваются хорошо.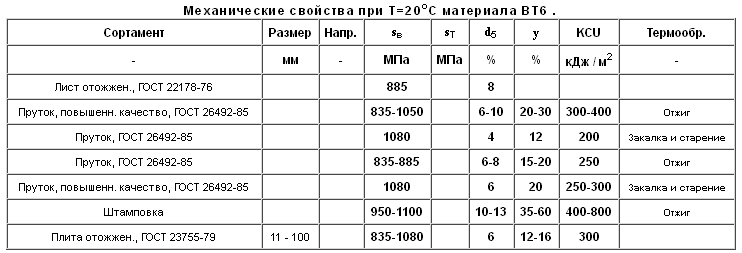 Они термически обрабатываются. Сплавы с β-структурой, например ВТ15, ВТ22, упрочняются термообработкой. Они свариваются хуже, склонны к росту зерен и к холодным трещинам.
Они термически обрабатываются. Сплавы с β-структурой, например ВТ15, ВТ22, упрочняются термообработкой. Они свариваются хуже, склонны к росту зерен и к холодным трещинам.
При комнатной температуре поверхность титана растворяет кислород, образуется его твердый раствор в α-титане. Возникает слой насыщенного раствора, который предохраняет титан от дальнейшего окисления. Этот слой называют алъфированным. При нагреве титан вступает в химическое соединение с кислородом, образуя ряд окислов от Ti6O до TiO2. По мере окисления изменяется окраска оксидной пленки от золотисто-желтой до темно-фиолетовой, переходящей в белую. По этим цветам в околошовной зоне можно судить о качестве защиты металла при сварке. С азотом титан, взаимодействуя активно при температуре более 500 0С, образует нитриды, повышающие прочность, но резко снижающие пластичность металла. Растворимость водорода в жидком титане больше, чем в стали, но с понижением температуры она резко падает, водород выделяется из раствора. При затвердевании металла это может вызвать пористость и замедленное разрушение сварных швов после сварки. Все титановые сплавы не склонны к образованию горячих трещин, но склонны к сильному укрупнению зерна в металле шва и околошовной зоны, что ухудшает свойства металла.
Все титановые сплавы не склонны к образованию горячих трещин, но склонны к сильному укрупнению зерна в металле шва и околошовной зоны, что ухудшает свойства металла.
Технология сварки титановых сплавов
Из-за высокой химической активности титановые сплавы удается сваривать дуговой сваркой в инертных газах неплавящимся и плавящимся электродом, дуговой сваркой под флюсом, электронным лучом, электрошлаковой и контактной сваркой. Расплавленный титан жидкотекуч, шов хорошо формируется при всех способах сварки.
Основная трудность сварки титана — это необходимость надежной защиты металла, нагреваемого выше температуры 400 0С, от воздуха.
Дуговую сварку ведут в среде аргона и в его смесях с гелием. Сварку с местной защитой производят, подавая газ через сопло горелки, иногда с насадками, увеличивающими зону защиты. С обратной стороны стыка деталей устанавливают медные подкладные планки с канавкой, по длине которой равномерно подают аргон. При сложной конструкции деталей, когда осуществить местную защиту трудно, сварку ведут с общей защитой в камерах с контролируемой атмосферой. Это могут быть камеры-насадки для защиты части свариваемого узла, жесткие камеры из металла или мягкие из ткани со смотровыми окнами и встроенными рукавицами для рук сварщика. В камеры помещают детали, сварочную оснастку и горелку. Для крупных ответственных узлов применяют обитаемые камеры объемом до 350 м 3, в которых устанавливают сварочные автоматы и манипуляторы. Камеры вакуумируются, затем заполняются аргоном, через шлюзы в них входят сварщики в скафандрах.
Это могут быть камеры-насадки для защиты части свариваемого узла, жесткие камеры из металла или мягкие из ткани со смотровыми окнами и встроенными рукавицами для рук сварщика. В камеры помещают детали, сварочную оснастку и горелку. Для крупных ответственных узлов применяют обитаемые камеры объемом до 350 м 3, в которых устанавливают сварочные автоматы и манипуляторы. Камеры вакуумируются, затем заполняются аргоном, через шлюзы в них входят сварщики в скафандрах.
Аргонодуговой сваркой вольфрамовым электродом детали толщиной 0,5… 1,5 мм сваривают встык без зазора и без присадки, а толщиной более 1,5 мм — с присадочной проволокой. Кромки свариваемых деталей и проволока должны зачищаться так, чтобы был снят насыщенный кислородом альфированный слой. Проволока должна пройти вакуумный отжиг при температуре 900… 1000 0С в течение 4 ч. Сварку ведут на постоянном токе прямой полярности. Детали толщиной более 10… 15 мм можно сваривать за один проход погруженной дугой. После образования сварочной ванны увеличивают расход аргона до 40. ..50 л/мин, что приводит к обжатию дуги. Затем электрод опускают в сварочную ванну. Давление дуги оттесняет жидкий металл, дуга горит внутри образовавшегося углубления, ее проплавляющая способность увеличивается.
..50 л/мин, что приводит к обжатию дуги. Затем электрод опускают в сварочную ванну. Давление дуги оттесняет жидкий металл, дуга горит внутри образовавшегося углубления, ее проплавляющая способность увеличивается.
Узкий шов с глубоким про-плавлением при сварке неплавя-щимся электродом в аргоне можно получать, применяя флюсы-пасты АН-ТА, АНТ17А на основе фтористого кальция с добавками. Они частично рафинируют и модифицируют металл шва, а также уменьшают пористость.
Дуговую сварку титановых сплавов плавящимся электродом (проволокой диаметром 1,2…2,0 мм) выполняют на постоянном токе обратной полярности на режимах, обеспечивающих мелкокапельный перенос электродного металла. В качестве защитной среды применяют смесь из 20 % аргона и 80 % гелия или чистый гелий. Это позволяет увеличить ширину шва и уменьшить пористость.
Титановые сплавы можно сваривать дуговой сваркой под бескислородными фтористыми флюсами сухой грануляции АНТ1, АНТЗ для толщины 2,5…8,0 мм и АНТ7 для более толстого металла. Сварку ведут электродной проволокой диаметром 2,0…5,0 мм с вылетом электрода 14…22 мм на медной или на флюсомедной подкладке, либо на флюсовой подушке. Структура металла в результате модифицирующего действия флюса получается более мелкозернистой, чем при сварке в инертных газах.
Сварку ведут электродной проволокой диаметром 2,0…5,0 мм с вылетом электрода 14…22 мм на медной или на флюсомедной подкладке, либо на флюсовой подушке. Структура металла в результате модифицирующего действия флюса получается более мелкозернистой, чем при сварке в инертных газах.
При электрошлаковой сварке используют пластинчатые электроды из того же титанового сплава, что и свариваемая деталь, толщиной 8…12 мм и шириной, равной толщине свариваемого металла. Используют тугоплавкие фторидные флюсы АНТ2, АНТ4, АНТ6. Чтобы через флюс не проникал кислород, шлаковую ванну дополнительно защищают аргоном. Металл зоны термического влияния защищают, увеличивая ширину формирующих водоохлаждаемых ползунов и продувая в зазор между ними и деталью аргон. Сварные соединения после электрошлаковой сварки имеют крупнокристаллическую структуру, но свойства их близки к основному металлу. Перед электрошлаковой сваркой, так же как и перед дуговой, флюсы должны быть прокалены при температуре 200.. .300 0С.
.300 0С.
Электронно-лучевая сварка титановых сплавов обеспечивает наилучшую защиту металла от газов и мелкозернистую структуру шва. Требования к сборке по сравнению с другими способами жестче.
При всех способах сварки титановых сплавов нельзя допускать перегрева металла. Нужно применять способы и приемы, позволяющие влиять на кристаллизацию металла: электромагнитное воздействие, колебания электрода или электронного луча поперек стыка, ультразвуковое воздействие на сварочную ванну, импульсный цикл дуговой сварки и т.п. Все это позволит получать более мелкую структуру шва и высокие свойства сварных соединений.
Характеристики металла титан и его применение
Металл титан является легким серебристо-белым металлом. Титановые сплавы обладают легкостью и прочностью, высокой коррозийной стойкостью и низким коэффициентом теплового расширения. Кроме того, титан — металл, который способен сохранять свои свойства в диапазоне температур от – 290 до +600 градусов Цельсия.
Оксид этого металла впервые обнаружил в 1789 У. Грегор. Во время исследования железистого песка ему удалось выделить окись неизвестного до селе металла, которой он дал название менакеновая. Один из первых образцов металлического титана был получен в 1825 Й. Я. Берцелиусом.
Грегор. Во время исследования железистого песка ему удалось выделить окись неизвестного до селе металла, которой он дал название менакеновая. Один из первых образцов металлического титана был получен в 1825 Й. Я. Берцелиусом.
Особенности
В периодической таблице Менделеева титан — элемент, находящийся в 4-ой группе 4-ого периода под номером 22. В наиболее устойчивых соединениях данный элемент четырехвалентен. Своим внешним видом он немного напоминает сталь и относится к переходным элементам. Температура плавления титана 1668±4°С, а кипит он при 3300 градусах Цельсия. Что касается скрытой теплоты плавления и испарения этого металла, то она почти в 2 раза больше, нежели у железа.
Титан — металл серебристого оттенка
Сегодня существуют две аллотропические модификации титана. Первая – низкотемпературная альфа-модификация. Вторая – высокотемпературная бетта-маодификация. По плотности, а также удельной теплоемкости этот металл занимает место между алюминием и железом.
Характеристика титана имеет ряд положительных особенностей. Механическая прочность его вдвое больше чистого железа и в шесть раз выше алюминия. Однако, титан способен поглощать кислород, водород и азот. Они могут резко снижать его пластические свойства. Если титан смешивается с углеродом, то образуются тугоплавкие карбиды, которые имеют высокую твердость.
Титану свойственна низкая теплопроводность, которая в 4 раза меньше, чем у алюминия, и в 13 раз, чем у железа. Также титан обладает довольно высоким удельным электросопротивлением.
Титан является парамагнитным металлом, а как известно, парамагнитные вещества обладают магнитной восприимчивостью, которая падает при нагревании. Однако, титан – исключение, так как его восприимчивость только увеличивается с температурой.
Достоинства:
Малая плотность, которая способствует уменьшению массы материала;
Высокая механическая прочность;
Высокая коррозийная стойкость;
Высокая удельная прочность.
Недостатки:
Высокая стоимость производства;
Активное взаимодействие со всеми газами, из-за чего плавят его только в вакууме либо среде инертных газов;
Плохие антифрикционные свойства;
Сложности вовлечения в производство титановых отходов;
Склонность к солевой коррозии, водородной хрупкости;
Довольно плохая обрабатываемость резанием;
Большая химическая активность.
Использование
Применение титана наиболее востребовано в производстве ракетной и авиационной техники, морском судостроении.
Кольца
Его используют в качестве легирующей примеси к качественным сталям. Технический титан расходуется на изготовление емкостей и химических реакторов, трубопроводов и арматуры, насосов и клапанов, плюс ко всему изделий, функционирующих в агрессивных средах. Компактный титан применяется для изготовления сеток и других деталей электровакуумных приборов, которые работают в высоких температурах.
Механическая прочность, коррозийная стойкость, удельная прочность, жаропрочность и другие свойства титана позволяют широко применять его в технике. Высокая стоимость этого металла и сплавов компенсируется большой работоспособностью. В некоторых ситуациях титановые сплавы являются единственными использующимися для изготовления того или иного оборудования либо конструкций, способных работать в конкретных условиях.
Добыча
Изначально добыча титана производилась для нужд производства красителей. Однако, использование этого металла в качестве конструкционного материала привело к расширению добычи титановой руды, а также поиску и освоению новых месторождений
Брусок чистого (99,995 %) титана
В прошлом титан был побочным продуктом, а во многих случаях препятствовал, к примеру, добыче железной руды. Сегодня же рудники эксплуатируются только для получения этого металла, как главного продукта.
Чтобы добывать титановую руду, не нужно обладать каким-либо специальным горным оборудованием и проводить сложные операции. Если титановые минералы находят в песчаных месторождениях, то собираются они с помощью землесосных снарядов, проходя через которые они попадают на баржи, а те в свою очередь доставляют их на обогатительную установку. Но, если же минералы титана находят в горных породах, то здесь уже не используют даже горное оборудование.
Если титановые минералы находят в песчаных месторождениях, то собираются они с помощью землесосных снарядов, проходя через которые они попадают на баржи, а те в свою очередь доставляют их на обогатительную установку. Но, если же минералы титана находят в горных породах, то здесь уже не используют даже горное оборудование.
Руда измельчается для обеспечения эффективного разделения минеральных компонентов. После, чтобы отделить ильменит от посторонних материалов применяется влажная магнитная сепарация малой интенсивности. Затем остаточный ильменит обогащается с помощью гидравлических классификаторов и столов. Потом обогащение производится методом сухой магнитной сепарации, обладающей высокой интенсивностью.
Свойство металла титан и его место в продуктах
Титан – химический элемент, довольно широко распространённый в природе. Это металл, серебристо-серый и твёрдый; он входит в состав многих минералов, и добывать его можно почти везде – Россия занимает второе место в мире по добыче титана.
Много титана в титанистом железняке – ильмените, относящемся к сложным оксидам, и золотисто-красном рутиле, являющемся полиморфной (многообразной и способной существовать в разных кристаллических структурах) модификацией двуокиси титана – химикам известно три таких природных соединения.
Титан часто встречается в горных породах, но в почвах, особенно песчаных, его ещё больше. Среди титаносодержащих горных пород можно назвать перовскит – он считается довольно распространённым; титанит – силикат титана и кальция, которому приписываются лечебные и даже магические свойства; анатаз – также полиморфное соединение – простой оксид; и брукит – красивый кристалл, часто встречающийся в Альпах, а у нас, в России – на Урале, Алтае и в Сибири.
Заслуга открытия титана принадлежит сразу двоим учёным – немцу и англичанину. Английский учёный Уильям Мак-Грегор не был химиком, но минералами очень интересовался, и однажды, в конце XVIII века, выделил из чёрного песка Корнуэлла неизвестный металл, и вскоре написал о нём статью.
Эту статью читал и известный немецкий учёный, химик М.Г. Клапрот, и он через 4 года после Мак-Грегора обнаружил оксид титана (так он назвал этот металл, а англичане называли его менаккином – по названию места, где он был найден) в красном песке, распространённом в Венгрии. Когда учёный сравнил соединения, найденные в чёрном и красном песке, они оказались оксидами титана – так что этот металл был открыт обоими учёными независимо.
Кстати, название металла не имеет никакого отношения к древнегреческим Богам Титанам (хотя есть и такая версия), а назвали его в честь Титании – царицы фей, о которой писал Шекспир. Это название связывается с лёгкостью титана – его необычно низкой плотностью.
После этих открытий многие учёные не раз пытались выделить чистый титан из его соединений, но в XIX веке это удавалось плохо — даже великий Менделеев считал этот металл редким, и потому интересным только для «чистой» науки, а не для применения в практических целях. Но учёные XX века поняли, что титана в природе много – около 70 минералов содержат его в своём составе, и сегодня известно множество таких месторождений. Если говорить о металлах, широко используемых человеком в технике, то можно найти только три, которых в природе больше, чем титана – это магний, железо и алюминий. Химики ещё говорят, что, если количественно объединить все запасы меди, серебра, золота, платины, свинца, цинка, хрома и ещё некоторых металлов, которыми богата Земля, то титана получится больше, чем их всех.
Если говорить о металлах, широко используемых человеком в технике, то можно найти только три, которых в природе больше, чем титана – это магний, железо и алюминий. Химики ещё говорят, что, если количественно объединить все запасы меди, серебра, золота, платины, свинца, цинка, хрома и ещё некоторых металлов, которыми богата Земля, то титана получится больше, чем их всех.
Выделять из соединений чистый титан химики научились только в 1940 году – это сделали американские учёные.
Многие свойства титана уже изучены, и он применяется в разных сферах науки и промышленности, но мы здесь не будем подробно рассматривать эту сторону его применения – нам интересно биологическое значение титана.
Использование титана в медицине и пищевой промышленности тоже нас интересует – в этих случаях титан поступает непосредственно в организм человека, или контактирует с ним. Одно из свойств этого металла очень радует: учёные, в том числе и медики, считают титан безопасным для человека, хотя при его избыточном поступлении в организм могут возникать хронические лёгочные заболевания.
Титан в продуктах
Титан есть в морской воде, тканях растений и животных, а значит, и в продуктах растительного и животного происхождения. Растения получают титан из почвы, на которой растут, а животные получают его, поедая эти растения, однако вначале – уже в XIX веке — химики открыли титан в организме животных, а уже потом в растениях. Эти открытия снова были сделаны англичанином и немцем – Г. Ризом и А. Адергольдом.
В организме человека титана около 20 мг, и поступает он обычно с продуктами питания и водой. Титан есть в яйцах и молоке, в мясе животных и растениях – их листьях, стеблях, плодах и семенах, но вообще в продуктах питания его немного. Растения, особенно водоросли, содержат больше титана, чем ткани животных; много его в кладофоре – кустистой ярко-зелёной водоросли, часто встречающейся в пресных водоёмах и морях.
Значение титана для организма человека
Зачем титан нужен организму человека? Учёные говорят, что его биологическая роль не выяснена, но он участвует в процессе образования эритроцитов в костном мозге, в синтезе гемоглобина и в процессе формирования иммунитета.
Титан есть в головном мозге человека, в слуховом и зрительном центрах; в женском молоке он есть всегда, причём в определённых количествах. Концентрации титана в организме активизируют обменные процессы, и улучшают общий состав крови, снижая в ней содержание холестерина и мочевины.
В сутки человек получает около 0,85 мг титана, с водой и продуктами питания, а также с воздухом, но в желудочно-кишечном тракте он всасывается слабо – от 1 до 3%.
Для человека титан нетоксичен или малотоксичен, и о летальной дозе у медиков тоже нет данных, но при регулярном вдыхании двуокиси титана он накапливается в лёгких, и тогда развиваются хронические заболевания, сопровождающиеся одышкой и кашлем с мокротой – трахеит, альвеолит и др. Накопление титана вместе с другими, более токсичными элементами, вызывает воспаления и даже гранулематоз – тяжёлое заболевание сосудов, опасное для жизни.
Избыток и недостаток титана
Чем может объясняться избыточное поступление титана в организм? Поскольку, как уже сказано, титан применяется во многих областях науки и промышленности, избыток титана и даже отравление им часто грозит рабочим разных производств: машиностроительных, металлургических, лакокрасочных и т. д. Наиболее токсичен хлорид титана: достаточно отработать на таком производстве около 3-х лет, не особенно соблюдая технику безопасности, и хронические заболевания не замедлят проявиться.
д. Наиболее токсичен хлорид титана: достаточно отработать на таком производстве около 3-х лет, не особенно соблюдая технику безопасности, и хронические заболевания не замедлят проявиться.
Лечат такие заболевания обычно антибиотиками, пеногасителями, кортикостероидами, витаминами; больные должны находиться в покое и получать обильное питьё.
Дефицит титана – как у человека, так и у животных, не выявлен и не описан, и в этом случае можно предположить, что его действительно не бывает.
В медицине титан необыкновенно популярен: из него делают превосходные инструменты, и при этом доступные и недорогие – титан стоит от 15 до 25 долларов за килограмм. Любят титан ортопеды, стоматологи и даже нейрохирурги – и неудивительно.
Оказывается, у титана есть ценное для медиков качество – биологическая инертность: это означает, что конструкции из него прекрасно себя ведут в организме человека, и абсолютно безопасны для мышечных и костных тканей, которыми они обрастают со временем. Структура тканей при этом не меняется: титан не подвержен коррозии, а его механические свойства очень высоки. Достаточно сказать, что в морской воде, которая по составу очень близка к лимфе человека, титан может разрушаться со скоростью 0,02 мм за 1000 лет, а в растворах щелочей и кислот он по устойчивости похож на платину.
Достаточно сказать, что в морской воде, которая по составу очень близка к лимфе человека, титан может разрушаться со скоростью 0,02 мм за 1000 лет, а в растворах щелочей и кислот он по устойчивости похож на платину.
Среди всех используемых в медицине сплавов титановые отличаются чистотой, и примесей в них почти нет, чего нельзя сказать о кобальтовых сплавах или нержавеющей стали.
Внутренние и наружные протезы, изготовленные из титановых сплавов, не разрушаются и не деформируются, хотя всё время выдерживают рабочие нагрузки: механическая прочность титана в 2-4 раза выше, чем у чистого железа, и в 6-12 раз выше, чем у алюминия.
Пластичность титана позволяет делать с ним всё, что угодно – резать, сверлить, шлифовать, ковать при низких температурах, прокатывать – из него получается даже тонкая фольга.
Температура его плавления, однако, довольно высока – около 1670°C.
Электропроводность у титана очень низкая, и он относится к немагнитным металлам, поэтому пациентам с титановыми конструкциями в организме можно назначать физиотерапевтические процедуры – это безопасно.
В пищевой промышленности используется диоксид титана – в качестве красителя, обозначающегося как Е171. Им окрашивают конфеты и жвачку, кондитерские изделия и порошковые продукты, лапшу, крабовые палочки, изделия из фарша; им же осветляют глазури и муку.
В фармакологии диоксидом титана окрашивают лекарства, а в косметологии – кремы, гели, шампуни и другие средства.
металл титан свойство металла титан характеристики металла титан
Строительство
|
|
Титан — лучший выбор для различных архитектурных сфер применения, он используется для наружной обшивки зданий, ненесущих стен, кровельных материалов, облицовки колонн, софитов, карнизов, навесов, внутренней обшивки, легких крепежных приспособлений; и кроме того, титан используется в искусстве, скульптуре и для изготовления памятников. Сочетание таких уникальных свойства архитектурного титана, как отличная устойчивость к коррозии, прочность, легкий вес и долговечность обеспечивают самый длительный срок службы при любых условиях и с минимальной необходимостью проведения ремонта. Его уникальная и неповторимая отражательная способность не сравнима с любым другим металлом. И новые конструкции, в которых проявляются свойства титана, делают его высоко практичным металлом, особенно когда затрагиваются вопросы срока службы. Отличная устойчивость к коррозии — защита от коррозии, возникающей в результате воздействия окружающей среды. Когда срок службы каких-либо других архитектурных металлов подходит к концу, титан выдерживает испытание временем. Он устойчив к загрязнениям городской атмосферы и морской среды, кислотным дождям, осадкам вулканической золы, промышленным выбросам и другим крайне неблагоприятным атмосферным условиям. Титан не подвергается атмосферным влияниям и не обесцвечивается от ультрафиолетовых лучей. Низкий коэффициент распространения тепловой энергии Титан обладает самым низким коэффициентом распространения тепловой энергии из всех архитектурных металлов. При 8.4 x 10-6, он практически равен показателям стекла, бетона, кирпича и камня, что обеспечивает титану отличную сочетаемость с данными материалами. Это расширяет возможности конструкций, в которых титан и стекло являются основными архитектурными элементами, а также дает титану преимущество над другими металлами при конструировании элементов архитектурных сооружений. Не оказывает негативного влияния на окружающую среду Вследствие относительной инертности титана считается, что он не оказывает отрицательного влияния на окружающую среду. 100% титана можно использовать повторно, он не разрушается, и как результат этого не загрязняет окружающую среду. Другие металлы, когда подвергаются действию загрязняющих веществ окружающей среды, разъедаются или разрушаются от коррозии и выделяют ионы металла в грунтовые воды, что является причиной возникновения проблем в окружающей среде. С учетом обязательств, связанных со «спецификацией по строительству без вреда окружающей среде», преимуществами титана считаются его наибольшая степень инертности и наибольший срок службы по сравнению со всеми остальными архитектурными металлами. Легкий вес и высокая прочность Специфическая сила тяжести составляет порядка 4.51 — 60% в сравнении со сталью, половину в сравнении с медью и 1.7 раз в сравнении с алюминием. Будучи таким легким металлом, титан оказывает меньше нагрузки на конструкцию и может быть изготовлен с использованием традиционных способов формования металлов. При использовании титана отпадает необходимость расходов по устранению коррозии и существует возможность дальнейшего снижения массы благодаря разработкам технологического проектирования. Наряду со своей отличной механической прочностью титан является очень прочным и ударостойким. Титан остается гибким при возникновении интенсивных колебаний (землетрясений) и выдерживает сильные штормы без повреждений. Срок службы — гарантия на 100 лет без сквозной коррозии Когда титан используется для отделки крыш или внешней облицовки стен, его первоначальная стоимость выше, чем у других металлов. Стоимость изготовления и стоимость строительных работ будут такими же, как и для других металлов, так что затраты на использование титана по сравнению с нержавеющей сталью возрастут в целом всего на 5-10%. Устойчивость к коррозии устраняет необходимость проведения капитального ремонта и не требует постоянных затрат на техническое обслуживание. Если говорить о затратах в течение всего срока службы, то титан, несомненно, обладает преимуществом по сравнению с остальными металлами. Это преимущество становится ещё более заметным в обстановке, в которой существует большая вероятность появления коррозии, — например, на побережье, в городской или промышленной зонах. Принимая во внимание долгий срок службы титана, он явно опережает все остальные архитектурные металлы в показателях долгосрочности и экономической эффективности. Многие титановые сплавы были разработаны для использования в аэрокосмической промышленности, в которой основное внимание уделяется механическим качествам. Для промышленности такой главной характеристикой является устойчивость к коррозии. Для современной архитектуры основными значимыми параметрами являются эстетика и устойчивость к коррозии. В архитектуре наиболее часто применяется продукция из промышленного чистого титана (Марка 1 и Марка 2). Материал, специально изготовленный и обработанный для последующего использования в архитектуре, разрабатывается так, чтобы соответствовать требованиям по эстетической части отделки. Хотя подобный «высокотехнологичный» металл считается относительно новым в западной архитектуре, в Японии за последние 25 лет он использовался для сотен зданий и прекрасно проявил себя в плане устойчивости к коррозии в наиболее загрязненных городских и прибрежных зонах. Начиная с октября 1997 года, с момента открытия музея Guggenheim Museum Bilbao (конструктор — Frank O. Монумент покорителям космоса в Москве |
«Я титан» | элемент | Периодическая таблица
В песне «Titanium» Дэвида Гетты при участии Sia есть слова «Ты стреляешь в меня, но я не упаду; Я титановый». Элементарный титан — один из самых прочных металлов — он такой же прочный, как сталь, но сравнительно менее плотный и гораздо более легкий. Кроме того, он очень устойчив к экстремальным температурам. Это делает элемент титана отличным легирующим агентом для самолетов и космических кораблей.
Этот элемент действительно так силен, как следует из песни.
Интересные факты о титане
- Название титана происходит от титанов из греческой мифологии.
- Первоначально титан назывался грегорит.
- В природе этот элемент почти всегда встречается в изверженных породах и их отложениях. Горняки ищут минералы рутил и ильменит.

- На Земле горные породы содержат около 1% титана. Однако на Луне есть скопления богатых титаном пород, содержащих около 10% титана.
- Как известно, при более высоких температурах титан вступает в реакцию с кислородом. При производстве титановых сплавов оксидная окалина титана удаляется, чтобы металл не стал хрупким.
- Титан — девятый по распространенности элемент на Земле; Земная кора содержит около 0,44% его. Растения, животные, природные воды и звезды также содержат этот элемент.
Титан в периодической таблице
Титан — переходный металл с символом Ti и атомным номером 22. Он находится в группе 4, справа от скандия, слева от ванадия и выше циркония. Его химический состав и свойства чем-то похожи на цирконий. Он имеет электроотрицательность 1,54, а атом титана имеет electron configuration of [Ar]3d 2 4s 2 or 1s 2 2s 2 2p 6 3s 2 3p 6 3d 2 4s 2
Where is Titanium Найденный?
Титан — девятый по распространенности элемент на Земле. Его можно найти в магматических породах и образовавшихся из них отложениях. Встречается в минералах рутила. ильменита и титанита и присутствует во многих железных рудах. Титан очень широко распространен, а крупнейшими производителями губчатого титана являются Китай, Россия, США, Япония.
Его можно найти в магматических породах и образовавшихся из них отложениях. Встречается в минералах рутила. ильменита и титанита и присутствует во многих железных рудах. Титан очень широко распространен, а крупнейшими производителями губчатого титана являются Китай, Россия, США, Япония.
Высокая удельная прочность титана и его устойчивость к коррозии делают его очень ценным элементом. Как уже говорилось, титан такой же прочный, как сталь, но при этом весит значительно меньше и может выдерживать экстремальные перепады температур. Его устойчивость к коррозии обусловлена его способностью образовывать пассивную оксидную пленку на поверхности, которая предотвращает перенос электронов в окружающую среду.
В чистом виде это блестящий, блестящий металл, прочный и пластичный. Он обладает низкой электро- и теплопроводностью и является парамагнитным.
Опасен ли титан?
Как уже говорилось, пищевые продукты обычно содержат TiO 2 . Хотя FDA заявляет, что пигмент можно использовать для окрашивания пищевых продуктов, оно строго регламентирует, сколько можно добавлять, поскольку существует ограничение в 1%.
Хотя FDA заявляет, что пигмент можно использовать для окрашивания пищевых продуктов, оно строго регламентирует, сколько можно добавлять, поскольку существует ограничение в 1%.
Вдыхание порошка титана может повлиять на легкие человека и вызвать заболевание плевры. Он канцерогенен и может вызвать рак.
В окружающей среде титан относительно безопасен. Тем не менее, он все еще имеет свои опасности. Порошок титана легко воспламеняется. При нагревании на воздухе и в контакте с кислородом представляет опасность взрыва. Если он реагирует с водой при высоких температурах, он выделяет водород и может вызвать взрыв.
В поисках слабости Титана: это слишком хорошо, чтобы быть правдой?
Титан кажется довольно нерушимым и почти невосприимчивым ко всему, так как он очень хорошо адаптируется к стрессу благодаря своей эластичности. Однако это неверно. Металл очень активно взаимодействует с кислородом и при смешивании двух элементов становится очень хрупким и ломким. Это делает его хрупким и более восприимчивым к растрескиванию. Кислород — главный враг титана.
Кислород — главный враг титана.
Применение титана в современном мире
Наиболее распространенная форма использования титана — диоксид титана (TiO 2 ) пигмент. Это нетоксичный порошок, очень непрозрачный и белого цвета. Лак, бумага, глазурь и даже продукты питания могут содержать этот пигмент. Почему это так популярно? TiO 2 имеет степень окисления +4 — наиболее стабильную степень окисления — и устойчив к ультрафиолетовым лучам и обесцвечиванию, что делает его широко используемым в красках, пластике и солнцезащитных кремах. Пищевые продукты, такие как зефир, жевательная резинка и глазурь для тортов, обычно содержат TiO 2 для придания эстетически приятного белого цвета. Кроме того, нетоксичный порошок добавляют к таким материалам, как графит, из-за его укрепляющих свойств. Высококачественные клюшки для гольфа обычно покрывают пигментом.
Сплавы титана содержат другие металлы, такие как алюминий и сталь. Эти сплавы обладают высокой стойкостью и могут выдерживать коррозию, растрескивание и экстремальные температуры. Его высокая прочность объясняет, почему этот металл так часто используется для изготовления самолетов, космических кораблей, военно-морских кораблей и шасси. Кроме того, этот прочный металл может противостоять коррозии от соленой воды. Поэтому корабли, аквариумы с морской водой, рыболовные лески и даже некоторые подводные лодки используют титановые сплавы. Их также используют для изготовления зубных имплантатов, поскольку они не разрушаются при контакте с жидкостями организма. Кроме того, титановые сплавы используются в протезах, поскольку они не вступают в реакцию с тканями и костями организма. Наконец, титан является остеокондуктивным, что означает, что он способствует росту кости на самом имплантате, обеспечивая плавную интеграцию в структуру скелета.
Его высокая прочность объясняет, почему этот металл так часто используется для изготовления самолетов, космических кораблей, военно-морских кораблей и шасси. Кроме того, этот прочный металл может противостоять коррозии от соленой воды. Поэтому корабли, аквариумы с морской водой, рыболовные лески и даже некоторые подводные лодки используют титановые сплавы. Их также используют для изготовления зубных имплантатов, поскольку они не разрушаются при контакте с жидкостями организма. Кроме того, титановые сплавы используются в протезах, поскольку они не вступают в реакцию с тканями и костями организма. Наконец, титан является остеокондуктивным, что означает, что он способствует росту кости на самом имплантате, обеспечивая плавную интеграцию в структуру скелета.
Помимо того, что титан является чрезвычайно прочным металлом, он также может быть анодирован в различные цвета. Анодирование – это направленное окисление поверхности металла; обычно это делается с помощью электролиза. Анодирование дает металлу более эластичное покрытие, которое тверже основного металла, что делает этот процесс очень популярным в аэрокосмической промышленности. Однако, в отличие от анодирования алюминия, анодирование окрашенного титана не требует использования красителя. Различные цвета могут быть получены путем изменения напряжения, используемого в процессе электролиза. Каждое напряжение приводит к образованию оксидного слоя разной толщины, что дает разный цвет.
Однако, в отличие от анодирования алюминия, анодирование окрашенного титана не требует использования красителя. Различные цвета могут быть получены путем изменения напряжения, используемого в процессе электролиза. Каждое напряжение приводит к образованию оксидного слоя разной толщины, что дает разный цвет.
История титана
Как был открыт титан и кто его открыл?
История титана уникальна. Два разных химика открыли титан в два разных раза — один раз в 1791 году и один раз в 1795 году. Британский химик преподобный Уильям Грегор первым открыл элементарный титан. Затем немецкий химик по имени Мартин Генрих Клапрот снова открыл этот элемент. Как это возможно? Грегор был минералогом и изучал черный песок в долине Манаккан. Он взял образец песка и смог идентифицировать оксид железа и неизвестный металл, который он назвал «менаханит». Этот оксид был идентифицирован как ильменит, одна из титановых руд. Хотя он сообщил о своих открытиях Королевскому геологическому обществу Корнуолла, о его вкладе забыли. Несколько лет спустя Клапрот заново открыл титан, изучая Шёрля, тип красной руды и форму рутила (TiO 2 ). Ученый назвал рутил «титан».
Несколько лет спустя Клапрот заново открыл титан, изучая Шёрля, тип красной руды и форму рутила (TiO 2 ). Ученый назвал рутил «титан».
Реакции с титаном
Соляная кислота не вступает в реакцию с титаном, если она не горячая, после чего она медленно растворяет титан, в результате чего образуется хлорид титана (III) темно-фиолетового цвета. Это противоположность висмуту, на который соляная кислота не действует. Со временем это соединение будет медленно окисляться до бесцветного титана (IV). Металлический титан всегда имеет пассивирующий слой оксида титана, как и алюминий, поэтому он может противостоять сильным кислотам.
При взаимодействии титана с горячей азотной кислотой он становится нерастворимым. При растворении металла предпочтительным растворителем является фтористоводородная кислота, поскольку она может как растворять металл, так и удерживать его в растворе.
Титан ведет себя по-разному при воздействии различных температур. При комнатной температуре металл хрупок, а при высоких температурах более пластичен и ковок. При повышенных температурах титан может реагировать с кислородом с образованием диоксида титана.
При повышенных температурах титан может реагировать с кислородом с образованием диоксида титана.
Эксперименты с титаном
Титан будет медленно реагировать с горячей соляной кислотой с образованием красивого фиолетового TiCl 3 . Добавление фторида натрия приводит к образованию зеленого фторокомплекса титана (III), добавление иона тиоцианата приводит к образованию тиоцианатного комплекса еще более темно-фиолетового цвета. Добавление гидроксида натрия приведет к осаждению гидроксида титана (III) красивого синего цвета. И последнее, но не менее важное: добавление 30% перекиси водорода к водному раствору TiCl 3 приведет к получению пероксисоединения титана (IV) красного цвета, Ti(O 2 )(OH) +
Соединения титана
Оксиды
Соединения оксида титана образуются, когда титан реагирует с кислородом при высоких температурах. Наиболее важным оксидом является диоксид титана, TiO 2 , потому что он дешев, нетоксичен и химически инертен, что делает его применение широко распространенным. Кроме того, это только природный оксид титана. TiO 2 представляет собой мелкий белый порошок, который образует белый пигмент. Вы когда-нибудь задумывались, почему сливки для кофе такие белые? Содержит TiO 2 пигмент. Кроме того, он образует разные формы с разными свойствами; TiO 2 существует в трех формах: анатаз , брукит и рутил .
Кроме того, это только природный оксид титана. TiO 2 представляет собой мелкий белый порошок, который образует белый пигмент. Вы когда-нибудь задумывались, почему сливки для кофе такие белые? Содержит TiO 2 пигмент. Кроме того, он образует разные формы с разными свойствами; TiO 2 существует в трех формах: анатаз , брукит и рутил .
Полиморфы анатаза и брукита являются метастабильными, что означает, что они стабильны только при определенных условиях. В противном случае они могут подвергнуться самопроизвольной трансформации; При нагревании анатаз и брукит необратимо переходят в более стабильную форму рутила. Анатаз — коричнево-черный минерал, прозрачный в светлом цвете и непрозрачный в насыщенном цвете. Брукит — темно-красный кристалл, который считается довольно редким. К сожалению, его неприятный запах выделяет его среди остальных. Рутиловые руды являются наиболее распространенной природной формой TiO 9 . 0059 2 . Они широко распространены в земной коре и содержат 98 % TiO 2 . Помимо производства металлического титана, они играют большую роль в производстве пигментов и огнеупорной керамики.
0059 2 . Они широко распространены в земной коре и содержат 98 % TiO 2 . Помимо производства металлического титана, они играют большую роль в производстве пигментов и огнеупорной керамики.
Диоксид титана очень инертен, устойчив к большинству кислот даже при нагревании, за исключением плавиковой кислоты.
Галогениды
Соединения галогенидов титана представляют собой продукты соединения титана с галогенами. Существуют различные типы галогенидных соединений, включая хлориды, йодиды и фториды.
Хлориды
Тетрахлорид титана, TiCl 4 , образуются, когда титан реагирует с сухим хлором при повышенной температуре. TiCl 4 представляет собой вонючую тяжелую бесцветную жидкость с ковалентными связями. Кроме того, он не присутствует в природе и получается при переработке других титаносодержащих минералов. Это может быть хорошо, так как это самое токсичное соединение титана. TiCl 4 представляет собой едкое, нестабильное соединение, которое вступает в различные реакции при контакте с другими веществами.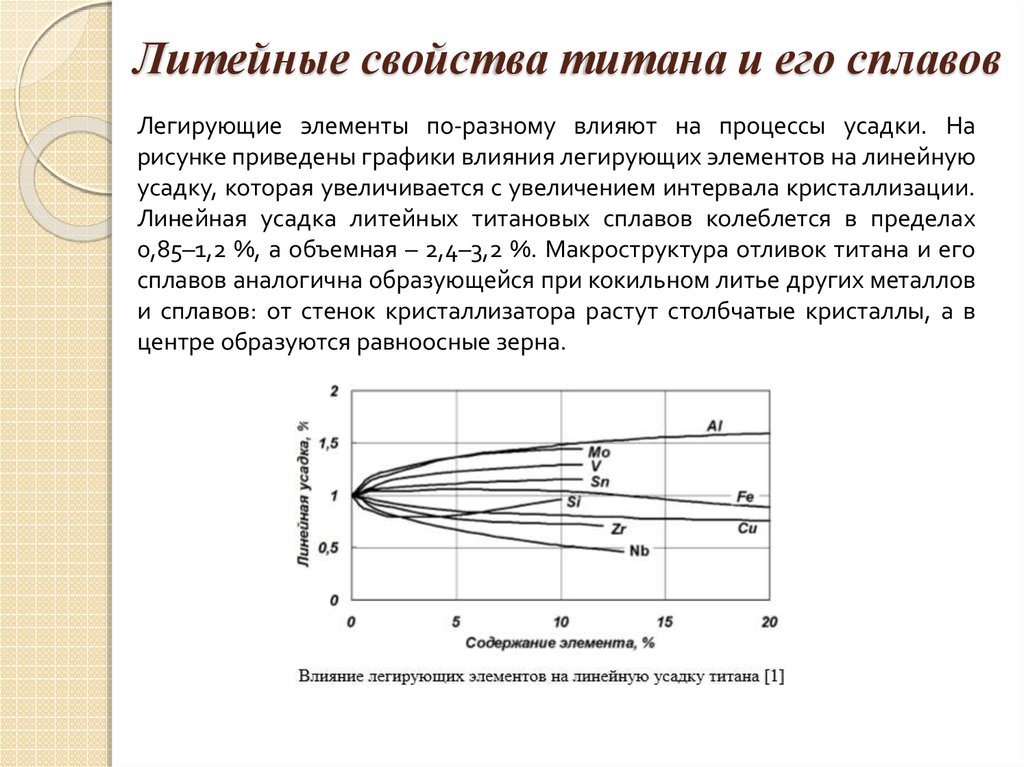 При контакте с воздухом дымит; при контакте с водой образует соляную кислоту; когда он реагирует со спиртом, он образует алкоксид. Несмотря на свою опасность, TiCl 4 является важным соединением, так как является промежуточным продуктом при коммерческом производстве титана. Кроме того, алкоксиды чрезвычайно важны для промышленной области. Когда алкоксиды реагируют с водой, они превращаются в твердый диоксид титана, который, как обсуждалось, обладает многими жизненно важными свойствами.
При контакте с воздухом дымит; при контакте с водой образует соляную кислоту; когда он реагирует со спиртом, он образует алкоксид. Несмотря на свою опасность, TiCl 4 является важным соединением, так как является промежуточным продуктом при коммерческом производстве титана. Кроме того, алкоксиды чрезвычайно важны для промышленной области. Когда алкоксиды реагируют с водой, они превращаются в твердый диоксид титана, который, как обсуждалось, обладает многими жизненно важными свойствами.
Трихлорид титана, TiCl 3 , является более низким и немного более нестабильным хлоридом. Атом титана TiCl 3 состоит из электрона d , и когда этот электрон возбуждается, он создает различимый фиолетовый цвет. Однако правило выбора Лапорта не позволяет этому красивому цвету быть очень непрозрачным. Правило выбора Лапорта запрещает переходы между двумя состояниями с одинаковой симметрией. Кроме того, TiCl 3 одновременно является восстановителем и катализатором для производства пропилена, из которого получают полипропилен. Это химическое вещество содержится во многих предметах домашнего обихода, таких как бутылки из-под кетчупа, пакеты с картофельными чипсами, соломинки и даже ковровые волокна.
Это химическое вещество содержится во многих предметах домашнего обихода, таких как бутылки из-под кетчупа, пакеты с картофельными чипсами, соломинки и даже ковровые волокна.
Дихлорид титана, TiCl 2 , обладает высокой реакционной способностью и при контакте с воздухом загорается. Подобно TiCl 3 , он является восстановителем и образует устойчивые хлориды.
Титан легко образует фторидные комплексы как в степени окисления +3, так и +4.
Иодиды
Тетрайодид титана, TiI 4 , также является важным тетрагалогенидом, поскольку он способен давать металлический титан высокой чистоты. Как? При обращении реакции Ti + 2 I 2 → TiI 4 выделяется чистый металл. Однако это соединение встречается относительно редко. Кроме того, он нерастворим и гидролизуется в воде.
Фториды
Ионы фтора играют роль в защитном оксидном слое титана и его сплавов; Они обладают коррозионным действием. Титан будет реагировать с фтором при более высоких температурах с образованием галогенида титана (IV), называемого тетрафторидом титана, TiF 4 . Это нерастворимое соединение, которое является источником титана для производства металлов. Это изученное соединение, которое может быть использовано в области стоматологии для лечения кариозных поражений. На данный момент результаты неубедительны из-за отсутствия исследований in vivo . Это соединение имеет уникальное взаимодействие с твердыми тканями зуба; Фторид может препятствовать разрушению зубов, но высокое воздействие может вызвать негативные проблемы со здоровьем из-за его разъедающего действия.
Это нерастворимое соединение, которое является источником титана для производства металлов. Это изученное соединение, которое может быть использовано в области стоматологии для лечения кариозных поражений. На данный момент результаты неубедительны из-за отсутствия исследований in vivo . Это соединение имеет уникальное взаимодействие с твердыми тканями зуба; Фторид может препятствовать разрушению зубов, но высокое воздействие может вызвать негативные проблемы со здоровьем из-за его разъедающего действия.
Металлоорганические соединения
Дихлорид титаноцена (C 5 H 5 ) 2 TiCl 2 представляет собой металлоцен. Это реагент и катализатор, используемый во многих реакциях синтеза в органической химии. Он ярко-красного цвета и образует из толуола игольчатые кристаллы. Кроме того, (C 5 H 5 ) 2 TiCl 2 является предшественником для синтеза производных титана (II). Это соединение важно, потому что оно обеспечивает источник титана для производства наноструктур диоксида титана. В будущем (C5H5)2TiCl2 может сыграть жизненно важную роль в области медицины, поскольку в настоящее время он изучается на предмет его использования в качестве противоракового препарата.
В будущем (C5H5)2TiCl2 может сыграть жизненно важную роль в области медицины, поскольку в настоящее время он изучается на предмет его использования в качестве противоракового препарата.
Сульфиды
Хотя существуют различные отклонения сульфидов титана, дисульфид титана, TiS2 является наиболее важным. Этот вонючий желто-серый порошок нестабилен и гидролизуется в воде с выделением сероводорода, который является токсичным и легковоспламеняющимся газом. Кроме того, это катод или отрицательно заряженный электрод для перезаряжаемых литиевых батарей.
Нитриды
Нитрид титана, TiN — тугоплавкий переходный металл. Обладает высокой микротвердостью, термодинамически стабилен, обладает электропроводными свойствами, снижает трение, имеет высокую температуру плавления. Он чрезвычайно полезен и действует как прекурсор для производства антикоррозионного покрытия. Многие режущие инструменты, в том числе хирургическое оборудование, покрыты TiN для повышения их прочности и остроты.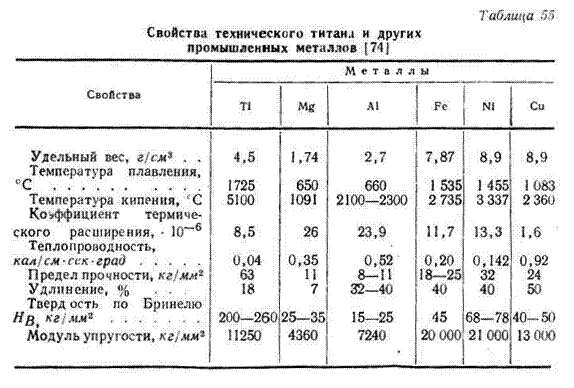 TiN также оставляет красивое покрытие цвета темного золота.
TiN также оставляет красивое покрытие цвета темного золота.
Изоляция элемента Титан
Титан не является легким для извлечения металлом. Чтобы решить эту проблему, Уильям Дж. Кролл представил процесс Кролла в 1930-х годах. Этот процесс работает для извлечения чистого титана из его руд, таких как рутил, в промышленных масштабах. Как уже говорилось, рутил представляет собой полиморф диоксида титана TiO 2 . Сначала рутил превращается в тетрахлорид титана TiCl 4 путем нагревания с хлором при опасно высокой температуре около 1000°C (1832°F). Один раз TiCl 4 пар, его помещают в сосуд с магнием или натрием и подвергают процессу восстановления при температуре около 1000°C. Эта реакция восстановления очень медленная и занимает около двух дней. После отделения чистого титанового элемента он должен остыть, что может занять еще несколько дней. Наконец, смесь измельчают и смешивают с соляной кислотой для удаления любых оставшихся восстановителей, после чего титан подвергается дальнейшей очистке. Важно отметить, что этот процесс должен происходить в атмосфере аргона, а не воздуха, чтобы предотвратить любые нежелательные реакции, которые могут привести к хрупкости металла.
Важно отметить, что этот процесс должен происходить в атмосфере аргона, а не воздуха, чтобы предотвратить любые нежелательные реакции, которые могут привести к хрупкости металла.
Степени окисления титана
Титан в основном находится в степени окисления +4, но может также проявлять степени окисления +3 и +2. Хотя сайт окисления +3 также распространен, он не так важен, как состояние +4. Когда соединение титана находится в степени окисления +4, оно наиболее стабильно, и дальнейшие реакции окисления протекать не могут; Считается, что это высокая степень окисления, поэтому соединения титана обычно образуют ковалентные связи. Примеры соединений в степенях окисления +3 и +2 включают триоксид дититана, Ti 2 O 3 и монооксид титана TiO соответственно.
Физические свойства титана
Температура плавления: 1943 К; 1670°С; 3038°F
Температура кипения: 3560 K; 3287°С; 5949 ° F
Плотность: 4,506 г/см сегодня
. : [Ар] 3d2 4s2
Изотопы: Ti-46, Ti-47, Ti-48, Ti-49, Ti-50
Встречается в природе в минералах: рутил, ильменит, (редко) анатаз
Токсичность: низкая токсичность
купить «Титан»?
iTunes! Я просто шучу. Титан — довольно дорогой металл. С 2003 по 2014 год цена за фунт металла увеличилась с 15 до 30 долларов. В 2018 году метрическая тонна металла стоила колоссальные 4800 долларов. Многие обычно инвестируют в ценный металл; Он используется для покупки и торговли акциями компаний, которые либо добывают титан, либо используют его для производства своей продукции. Однако титан можно легко купить на Amazon, а также на специализированных веб-сайтах и в магазинах.
Титан — довольно дорогой металл. С 2003 по 2014 год цена за фунт металла увеличилась с 15 до 30 долларов. В 2018 году метрическая тонна металла стоила колоссальные 4800 долларов. Многие обычно инвестируют в ценный металл; Он используется для покупки и торговли акциями компаний, которые либо добывают титан, либо используют его для производства своей продукции. Однако титан можно легко купить на Amazon, а также на специализированных веб-сайтах и в магазинах.
Титан Металл | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Металлический титан
Номер продукта: Все применимые коды продуктов American Elements, например ТИ-М-02 , ТИ-М-03 , ТИ-М-04 , ТИ-М-05 , ТИ-М-06 , TI-M-07
Номер CAS: 7440-32-6
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
10884 Weyburn Ave.
Los Angeles, CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи: +
Внутренний, Северная Америка 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси опасны для здоровья или окружающей среды в соответствии с правилами CLP.
Классификация в соответствии с Директивой 67/548/ЕЭС или Директивой 1999/45/ЕС
Н/Д
Информация об особых опасностях для человека и окружающей среды:
Нет данных
Опасности, не классифицированные иначе
Нет данных
Элементы маркировки
Маркировка в соответствии согласно Регламенту (ЕС) № 1272/2008
Н/Д
Пиктограммы опасности
Н/Д
Сигнальное слово
Н/Д
Указания на опасность
Н/Д
Классификация WHMIS
Не контролируется
Система классификации
Рейтинги HMIS (шкала 0-4)
(Система идентификации опасных материалов)
ЗДОРОВЬЕ
ПОЖАР
РЕАКЦИОННАЯ СПОСОБНОСТЬ
1
1
1
Здоровье (острые воздействия) = 1
Воспламеняемость = 1
Физическая опасность 9030 Результаты оценки PBT и vPvB
PBT:
N/A
vPvB:
N/A
РАЗДЕЛ 3.
 СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ
СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ Вещества
CAS No. номер(а):
Номер ЕС:
231-142-3
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
Описание мер первой помощи
При вдыхании:
Обеспечить пострадавшего свежим воздухом. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь к врачу.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь к врачу.
При попадании в глаза:
Промыть открытые глаза в течение нескольких минут под проточной водой. Проконсультируйтесь с врачом.
При проглатывании:
Обратиться за медицинской помощью.
Информация для врача
Наиболее важные симптомы и эффекты, как немедленные, так и замедленные
Нет данных
Указание на необходимость немедленной медицинской помощи и специального лечения
Нет данных
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
Средства пожаротушения
Подходящие огнетушащие вещества
Специальный порошок для сжигания металлов. Не используйте воду.
Не используйте воду.
Неподходящие огнетушащие вещества из соображений безопасности
Вода
Особые опасности, исходящие от вещества или смеси
В случае пожара могут выделяться следующие вещества:
Пары оксидов металлов
Рекомендации для пожарных
Защитное снаряжение:
Надеть автономный респиратор.
Носите полностью защитный непроницаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры предосторожности для персонала, защитное снаряжение и чрезвычайные меры
Использовать средства индивидуальной защиты. Держите незащищенных людей подальше.
Обеспечить достаточную вентиляцию
Меры предосторожности по охране окружающей среды:
Не допускать попадания материала в окружающую среду без официального разрешения.
Не допускайте попадания продукта в канализацию, канализационные системы или другие водотоки.
Не допускайте проникновения материала в землю или почву.
Методы и материалы для локализации и очистки:
Собрать механически.
Предотвращение вторичных опасностей:
Никаких специальных мер не требуется.
Ссылка на другие разделы
Информацию о безопасном обращении см. в разделе 7
Информацию о средствах индивидуальной защиты см. в разделе 8.
Информацию об утилизации см. в Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение с
Меры предосторожности для безопасного обращения
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Информация о защите от взрывов и пожаров:
Данные отсутствуют
Условия безопасного хранения, включая любые несовместимости
Требования, которым должны соответствовать складские помещения и емкости:
Особых требований нет.
Сведения о хранении в одном общем хранилище:
Хранить вдали от окислителей.
Хранить вдали от галогенов.
Хранить вдали от галогеноуглеродов.
Хранить вдали от минеральных кислот
Дополнительная информация об условиях хранения:
Хранить контейнер плотно закрытым.
Хранить в прохладном, сухом месте в хорошо закрытых контейнерах.
Особое конечное использование
Данные отсутствуют
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Дополнительная информация по конструкции технических систем:
Правильно работающий химический вытяжной шкаф, предназначенный для опасных химических веществ и имеющий среднюю скорость не менее 100 футов в минуту.
Контрольные параметры
Компоненты с предельными значениями, которые требуют контроля на рабочем месте:
Продукт не содержит каких-либо соответствующих количеств материалов с критическими значениями
, которые должны контролироваться на рабочем месте.
Дополнительная информация:
Нет данных
Средства контроля воздействия
Средства индивидуальной защиты
Соблюдайте стандартные меры защиты и гигиены при обращении с химическими веществами.
Хранить вдали от пищевых продуктов, напитков и кормов.
Немедленно снимите всю испачканную и зараженную одежду.
Мыть руки перед перерывами и по окончании работы.
Поддерживайте эргономически подходящую рабочую среду.
Дыхательное оборудование:
При наличии высоких концентраций используйте подходящий респиратор.
Защита рук:
Непроницаемые перчатки 903:00 Осмотрите перчатки перед использованием.
Пригодность перчаток должна определяться как материалом, так и качеством, последнее из которых может варьироваться в зависимости от производителя.
Время проницаемости материала перчаток (в минутах)
Данные отсутствуют
Защита глаз:
Защитные очки
Защита тела:
Защитная рабочая одежда
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физико-химических свойствах
Внешний вид :
Форма: твердая в различных формах
Цвет: Темно-серый
Запах: Без запаха
Порог восприятия запаха: Данные отсутствуют.
pH: неприменимо
Точка плавления/диапазон плавления: 1668 °C (3034 °F)
Точка кипения/диапазон кипения: 3277 °C (5931 °F)
Температура сублимации/начало: Данные отсутствуют газ)
Нет данных.
Температура воспламенения: Данные отсутствуют
Температура разложения: Данные отсутствуют
Самовоспламенение: Данные отсутствуют.
Опасность взрыва: Данные отсутствуют.
Пределы взрываемости:
Нижний: данные отсутствуют
Верхний: данные отсутствуют
Давление пара: неприменимо
Плотность при 20 °C (68 °F): 4,506 г/см 3 (37,603 фунта/гал)
Относительная плотность
Нет данных.
Плотность паров
Н/Д
Скорость испарения
Н/Д
Растворимость в воде (H 2 O): Нерастворим
Коэффициент распределения (н-октанол/вода): Данные отсутствуют.
Вязкость:
Динамическая: Н/Д
Кинематическая: Н/Д
Другая информация
Нет данных
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность
Нет данных
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать:
Разложение не происходит, если используется и хранится в соответствии со спецификациями.
Возможность опасных реакций
Опасные реакции не известны
Условия, которых следует избегать
Данные отсутствуют
Несовместимые материалы:
Окисляющие вещества
Галогены
Галогенуглероды
Минеральные кислоты
Опасные продукты разложения:
Пары оксидов металлов
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Информация о токсикологическом воздействии
Острая токсичность:
Воздействие не известно.
Значения LD/LC50, важные для классификации:
Нет данных
Раздражение или коррозия кожи:
Может вызывать раздражение
Раздражение или коррозия глаз:
Может вызывать раздражение
Повышение чувствительности:
Неизвестно о сенсибилизирующих эффектах.
Мутагенность зародышевых клеток:
Эффекты неизвестны.
Канцерогенность:
Нет классификационных данных о канцерогенных свойствах этого материала от EPA, IARC, NTP, OSHA или ACGIH.
Реестр токсических эффектов химических веществ (RTECS) содержит данные об онкогенности, и/или канцерогенности, и/или новообразованиях для этого вещества.
Репродуктивная токсичность:
Реестр токсического воздействия химических веществ (RTECS) содержит репродуктивные данные для этого вещества.
Специфическая токсичность системы органов-мишеней — многократное воздействие: 903:00 Эффекты неизвестны.
Специфическая системная токсичность на орган-мишень — однократное воздействие:
О влиянии не известно.
Опасность при вдыхании:
Воздействие неизвестно.
От подострой до хронической токсичности:
Эффекты неизвестны.
Дополнительная токсикологическая информация:
Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Акватоксичность:
Нет данных
Стойкость и способность к разложению
Нет данных
Биоаккумулятивный потенциал
Нет данных
Подвижность в почве
Нет данных
Дополнительная экологическая информация:
Не допускать попадания материала в окружающую среду без официальных разрешений.
Избегайте попадания в окружающую среду.
Результаты оценки PBT и vPvB
PBT:
Н/Д
vPvB:
Н/Д
Другие неблагоприятные воздействия
Нет данных
РАЗДЕЛ 13. СООБРАЖЕНИЯ ПО УТИЛИЗАЦИИ
Методы обработки отходов
Рекомендация
Обратитесь к официальным правилам, чтобы обеспечить надлежащую утилизацию.
Неочищенная упаковка:
Рекомендация:
Утилизация должна производиться в соответствии с официальными правилами.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, ADN, IMDG, IATA
N/A
Собственное отгрузочное наименование ООН
DOT, ADN, IMDG, IATA
N/A
Транспортный класс опасности 30 90 DOT, ADR, ADN, IMDG, IATA
Class
N/A
Группа упаковки
DOT, IMDG, IATA
н/д
Опасность для окружающей среды: н/д
Особые меры предосторожности для пользователя
н/д
Транспортировка навалом в соответствии с Приложением II MARPOL73/78 и Кодексом IBC
н/д
Транспортировка/Дополнительная информация: DOT
Загрязнитель морской среды (DOT): №
РАЗДЕЛ 15.
 НОРМАТИВНАЯ ИНФОРМАЦИЯ
НОРМАТИВНАЯ ИНФОРМАЦИЯ Правила/законодательные акты по безопасности, охране здоровья и окружающей среды, относящиеся к данному веществу или смеси
Национальные правила
Все компоненты этого продукта перечислены в Законе Агентства по охране окружающей среды США о контроле над токсичными веществами. Инвентаризация химических веществ.
Все компоненты этого продукта перечислены в Канадском перечне веществ для внутреннего потребления (DSL).
Раздел 313 SARA (списки конкретных токсичных химических веществ)
Вещество не указано в списке.
California Proposition 65
Proposition 65 — Химические вещества, вызывающие рак
Вещество не указано.
Prop 65 — Токсичность для развития
Вещество не указано.
Prop 65 — Токсичность для развития, женщины
Вещество не указано.
Prop 65 — Токсичность для развития, мужчины
Вещество не указано.
Информация об ограничении использования:
Только для использования технически квалифицированными лицами.
Другие правила, ограничения и запретительные положения
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (ЕС) № 1907/2006.
Вещество не указано.
Необходимо соблюдать условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке и использования.
Вещество не указано.
Приложение XIV Регламента REACH (требуется разрешение на использование)
Вещество не указано.
REACH — Предварительно зарегистрированные вещества
Вещество указано.
Оценка химической безопасности:
Оценка химической безопасности не проводилась.
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Краткий обзор титана и его основных свойств
Титан: все, что вам нужно знать
Титан — это химический элемент с символом Ti и атомным номером 22 [таблица Менделеева ниже]. Это блестящий переходный металл серебристого цвета, низкой плотности и высокой прочности. Титан устойчив к коррозии в морской воде, царской водке и хлоре. В то время как титан только на одном уровне со сталью с точки зрения прочности, он весит вдвое меньше, что делает его одним из самых прочных металлов на единицу массы. Плотность титана примерно вдвое меньше плотности стали. Пожалуйста, положение Ti в периодической таблице ниже.
Пожалуйста, положение Ti в периодической таблице ниже.
Титан является девятым по распространенности элементом в земной коре (0,63% по массе) и седьмым по распространенности металлом.
Уникальные свойства Ti:
Физически, высокое отношение прочности к весу. Это прочный металл с низкой плотностью, достаточно пластичный (особенно в бескислородной среде), блестящий и металлически-белого цвета. Он имеет довольно низкую электро- и теплопроводность по сравнению с другими металлами. Прочность на растяжение титана составляет около 434 МПа (63 000 фунтов на квадратный дюйм), что соответствует прочности обычных сплавов из низкосортной стали, но они менее плотные. Титан на 60% плотнее алюминия, но более чем в два раза прочнее наиболее часто используемого алюминиевого сплава 6061-T6. Модуль упругости, иногда называемый модулем Юнга, является мерой гибкости материала. Он описывает, насколько легко согнуть или деформировать материал без пластической деформации, и часто является хорошей мерой общей упругой реакции материала. Модуль упругости титана довольно низкий, что говорит о том, что он легко изгибается и деформируется. Отчасти поэтому титан трудно поддается механической обработке.
Модуль упругости титана довольно низкий, что говорит о том, что он легко изгибается и деформируется. Отчасти поэтому титан трудно поддается механической обработке.
Химически , подобно алюминию и магнию, металлический титан и его сплавы окисляются сразу же при контакте с воздухом. Атмосферная пассивация придает титану превосходную коррозионную стойкость, почти эквивалентную платине. Титан способен выдерживать воздействие разбавленной серной и соляной кислот, растворов хлоридов и большинства органических кислот. Однако титан разъедается концентрированными кислотами.
Подводя итоги, можно сказать, что титан обладает двумя уникальными свойствами
[1] Высокое отношение прочности к весу
[2] Высокая устойчивость к коррозии
Что придает прочность высокое отношение прочности к весу
Короче говоря, высокая прочность титана обусловлена его шестигранной Плотноупакованная кристаллическая структура с сильными металлическими связями. На изображении ниже структура Fe находится в крайнем левом углу, а Ti — в крайнем правом. Таким образом, атомы Ti гораздо более плотно упакованы в кристалле по сравнению с Fe. Чем плотнее упаковка, тем прочнее металлические связи.
На изображении ниже структура Fe находится в крайнем левом углу, а Ti — в крайнем правом. Таким образом, атомы Ti гораздо более плотно упакованы в кристалле по сравнению с Fe. Чем плотнее упаковка, тем прочнее металлические связи.
Низкая плотность обусловлена относительно большим атомным размером, как видно из приведенной выше таблицы. Пример: Атомный номер Ti = 22, Атомная масса Ti = 48, Атомный радиус Ti = 140 пм. Атомный номер железа = 26, атомная масса железа = 56, атомный радиус железа = 140 пм. Это говорит о том, что Ti с атомной массой 48 и железо с атомной массой 56 имеют одинаковый атомный радиус 140 пм. См. приведенную ниже таблицу зависимости атомной массы от размера атома
Коррозионная стойкость Ti
Когда титан вступает в контакт с кислородом, он образует на своей поверхности тонкий слой диоксида титана (TiO2). Этот оксидный слой защищает лежащий под ним титан от коррозии, вызванной большинством кислот, щелочей, загрязнений и соленой воды.
Несмотря на то, что титан устойчив к этим средам, он не застрахован и может быть восприимчив к точечной коррозии.
Хлориды: Титан обладает отличной устойчивостью к коррозии нейтральными растворами хлоридов даже при относительно высоких температурах. Ограничивающим фактором применения титана и его сплавов в водно-хлоридных средах является щелевая коррозия. При наличии щелей нелегированный титан иногда подвергается коррозии в условиях, не предсказуемых общей скоростью коррозии
Морская вода: Титан устойчив к коррозии в морской воде при температурах до 260°C. Отчеты предполагают следующее: Титановые трубки, которые в течение 16 лет подвергались воздействию загрязненной морской воды в поверхностном конденсаторе, слегка изменили цвет, но не имели признаков коррозии. Титан уже более тридцати лет безотказно служит морской воде для химической, нефтеперерабатывающей и опреснительной промышленности. Нахождение титана в течение многих лет на глубине более мили под поверхностью океана не привело к заметной коррозии. Наличие сульфидов в морской воде не влияет на стойкость титана к коррозии.
Наличие сульфидов в морской воде не влияет на стойкость титана к коррозии.
Тепловая и электрическая проводимость Ti
Диапазон проводимости металлов составляет примерно 100:1 (от 1 до 100 кСм/метр). Титан находится в нижней части этого диапазона, со скоростью 2,4 кСм/метр, но он все же является лучшим проводником, чем нержавеющая сталь, графит или вода. И это намного лучше, чем такие изоляторы, как стекло или резина. Титан образует в воздухе очень тонкий оксидный слой, который делает его устойчивым к коррозии, но также изолирует титан. Это может привести к тому, что титан окажется плохим проводником.
То, насколько хорошо элемент проводит, определяется тем, насколько «свободны» внешние электроны, то есть насколько легко они могут быть разделены между соседними молекулами в кристалле. Медь имеет один внешний электрон в частично заполненной оболочке, при этом все нижние оболочки полностью заполнены. Это облегчает совместное использование этого внешнего электрона и делает медь хорошим проводником. Другие хорошие проводники, такие как алюминий и серебро, также имеют этот характерный свободный внешний электрон. У титана внешняя оболочка полностью заполнена, а следующая снизу заполнена частично. Электроны в некоторой степени доступны для совместного использования, но они немного более тесно связаны с ядром. Это делает титан худшим проводником, чем медь или алюминий. Но это все же дирижер.
Другие хорошие проводники, такие как алюминий и серебро, также имеют этот характерный свободный внешний электрон. У титана внешняя оболочка полностью заполнена, а следующая снизу заполнена частично. Электроны в некоторой степени доступны для совместного использования, но они немного более тесно связаны с ядром. Это делает титан худшим проводником, чем медь или алюминий. Но это все же дирижер.
Титановые сплавы :
Механическая прочность Ti и сплавов
Титан сплавляют с железом, алюминием, ванадием и молибденом, среди прочих элементов, для производства прочных и легких сплавов для аэрокосмической промышленности (реактивные двигатели, ракеты, и космические аппараты), военные, промышленные процессы (химия и нефтехимия, опреснительные установки, целлюлоза и бумага).
Кредит: Google
Свойства титана — титановые трубы, листы, прутки
Главная › Титан
Титан — это химический элемент, обозначаемый символом Ti и имеющий атомный номер 22. Это переходный металл с низкой плотностью, но высокой прочностью и устойчивостью к коррозии, что делает его пригодным для использования в различных областях, таких как титановая трубка и титановый лист.
Это переходный металл с низкой плотностью, но высокой прочностью и устойчивостью к коррозии, что делает его пригодным для использования в различных областях, таких как титановая трубка и титановый лист.
Титан был впервые обнаружен английским химиком преподобным Уильямом Грегором в 1791 году, который назвал этот металл грегоритом. Металл также был обнаружен отдельно и позднее немецким ученым в М.Х. Клапрот в 179 г.3, который назвал металл Титан в честь греческого бога Титана, и название Титан сохранилось и по сей день. Изолировать металл удалось только столетие спустя, в 1910 году. Титан содержится в необработанном виде в минералах рутиле и ильмените, которые сами по себе составляют более 24% земной коры, что делает титан очень распространенным материалом. Однако титан не встречается в природе изолированно, вместо этого он встречается в комбинациях Fe и кислорода, при этом процесс выделения требует значительных усилий и, как таковой, влияет на доступность и стоимость металла.
Ключевыми свойствами титана, которые делают этот металл оптимальным материалом для различных применений, являются:
- Атомный вес 47,867 а.
 е.м.
е.м. - Плотность 4510 кг/³, что делает его более чем на 50% легче стали
- Нет -магнитный
- Высокая температура плавления (т.пл.) 1650 °C
- Высокая пассивность, поэтому он способен выдерживать высокие уровни хлоридов и кислот без коррозии.
- Биосовместимый и нетоксичный
Титановые маркиТерминологияСтандартыПримененияРынки
Титановые марки
Титановые марки обычно классифицируются как коммерчески чистые (CP) или титановые сплавы. В следующей таблице перечислены наиболее популярные марки. Марки различаются от страны к стране, при этом несколько стран с крупнейшим производством титана поддерживают разные спецификации и стандарты для титана.0781
| Modified CP Grades |
|---|
| Grade 7 – Ti-0.15Pd |
| Grade 11 – Ti -0,15PD |
| 16 класс-TI-0,05PD |
| 17-TI-0,05PD |
| 26-TI-0,1781778 |
. |
| Alpha and Near-Alpha Alloys |
|---|
| Grade 9 – 3Al-2.5V |
| Grade 12 |



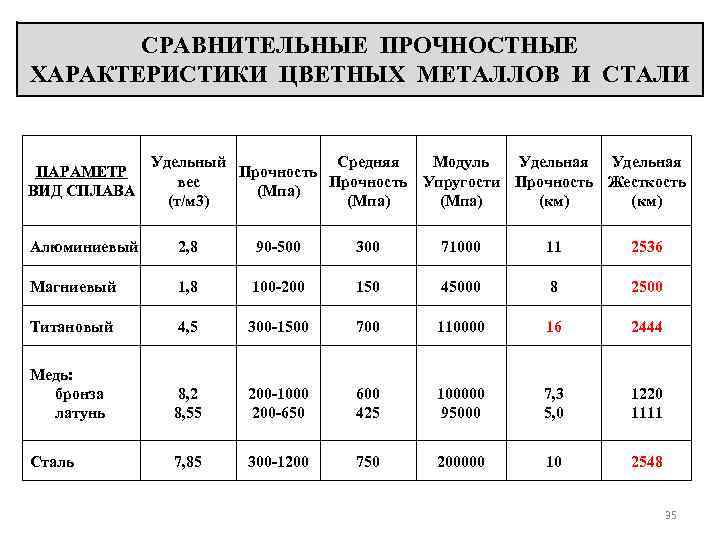
 При этом прочность при снижении температуры возрастает;
При этом прочность при снижении температуры возрастает; При повышении температуры титановые сплавы превосходят все сплавы алюминия и магния;
При повышении температуры титановые сплавы превосходят все сплавы алюминия и магния; Сварка его тоже затруднена из-за фазового перехода во время нагревания.
Сварка его тоже затруднена из-за фазового перехода во время нагревания. При снижении температуры его магнитная восприимчивость уменьшается.
При снижении температуры его магнитная восприимчивость уменьшается. Плотность его несколько меньше – 4,22 г/куб. см. Эту структуру стабилизирует водород – при его растворении в титане также образуются растворы внедрения и гидриды.
Плотность его несколько меньше – 4,22 г/куб. см. Эту структуру стабилизирует водород – при его растворении в титане также образуются растворы внедрения и гидриды. Электрический ток подается через натянутую в реторте титановую проволоку, на которую и осаждается чистое вещество.
Электрический ток подается через натянутую в реторте титановую проволоку, на которую и осаждается чистое вещество.
 Также он обладает отличной устойчивостью к коррозии, которая может появиться в результате кислотных дождей и действия агрессивных газов (газ сернистой кислоты, газ сероводорода и т.д.), что является плюсом при использовании титана для строительства в крупных городах и промышленных областях. Титан также устойчив к коррозии под напряжением, точечной, щелевой коррозии, а также другим видам коррозии или проблемам, связанным с другими металлами для лужения.
Также он обладает отличной устойчивостью к коррозии, которая может появиться в результате кислотных дождей и действия агрессивных газов (газ сернистой кислоты, газ сероводорода и т.д.), что является плюсом при использовании титана для строительства в крупных городах и промышленных областях. Титан также устойчив к коррозии под напряжением, точечной, щелевой коррозии, а также другим видам коррозии или проблемам, связанным с другими металлами для лужения. Для типичной крыши со стоячими фальцами требуются повторяющиеся поперечные фальцы. Для крыши, по всей длине покрытой сплошной титановой панелью, уже не требуется фальцев, что компенсирует распространение и сжатие. Соответственно, тепловое напряжение на титан очень низкое и составляет примерно половину напряжения на нержавеющую сталь и одну треть — на алюминий.
Для типичной крыши со стоячими фальцами требуются повторяющиеся поперечные фальцы. Для крыши, по всей длине покрытой сплошной титановой панелью, уже не требуется фальцев, что компенсирует распространение и сжатие. Соответственно, тепловое напряжение на титан очень низкое и составляет примерно половину напряжения на нержавеющую сталь и одну треть — на алюминий. Яркий пример — недавно выполненная титановая облицовка музея Scheepvaart Maritime Museum в Амстердаме. Архитекторы и правительство наложили на облицовочный материал проекта строгие ограничения в отношении причинения вреда окружающей среде.
Яркий пример — недавно выполненная титановая облицовка музея Scheepvaart Maritime Museum в Амстердаме. Архитекторы и правительство наложили на облицовочный материал проекта строгие ограничения в отношении причинения вреда окружающей среде. По прочности титан эквивалентен стали.
По прочности титан эквивалентен стали.
 Gehry), архитектурный титан продолжает все больше и больше использоваться в различных проектах коммерческих и жилых зданий во всем мире. Музей Guggenheim считается мировым образцом использования архитектурного титана, открывшим двери для будущих проектов. Новые применения титана в настоящее время отмечены в США, Канаде, Шотландии, Англии, Германии, Бельгии, Перу и др. Два крупных проекта международного класса с уникальным применением архитектурного титана были разработаны Aeroports de Paris (Аэропорты Парижа). Технологический директор ADP Paul Andreu выбрал титан для облицовки эллипсовидного купола театра Grand National Theater в городе Beijing, а также для аэропорта Abu Dhabi Airport. Впервые в мире титан был использован для строительства аэропорта. Порядка 700 тонн продукции из титана Grade 2 было использовано при
строительстве этого нового терминала Международного аэропорта в Абу Даби. Для данного
строительства были использованы листы, плиты, прутки и трубы. Благодаря физическим свойствам, титановые балки намного меньше, чем стальные, что позволило архитектору реализовать его архитектурную задумку.
Gehry), архитектурный титан продолжает все больше и больше использоваться в различных проектах коммерческих и жилых зданий во всем мире. Музей Guggenheim считается мировым образцом использования архитектурного титана, открывшим двери для будущих проектов. Новые применения титана в настоящее время отмечены в США, Канаде, Шотландии, Англии, Германии, Бельгии, Перу и др. Два крупных проекта международного класса с уникальным применением архитектурного титана были разработаны Aeroports de Paris (Аэропорты Парижа). Технологический директор ADP Paul Andreu выбрал титан для облицовки эллипсовидного купола театра Grand National Theater в городе Beijing, а также для аэропорта Abu Dhabi Airport. Впервые в мире титан был использован для строительства аэропорта. Порядка 700 тонн продукции из титана Grade 2 было использовано при
строительстве этого нового терминала Международного аэропорта в Абу Даби. Для данного
строительства были использованы листы, плиты, прутки и трубы. Благодаря физическим свойствам, титановые балки намного меньше, чем стальные, что позволило архитектору реализовать его архитектурную задумку. В дополнение, внешние стены аэропорта были отделаны титановыми панелями и стеклом.
В дополнение, внешние стены аэропорта были отделаны титановыми панелями и стеклом. 
 е.м.
е.м.

 Процесс отжига делает титан более мягким и легко поддается формовке, механической обработке и резке.
Процесс отжига делает титан более мягким и легко поддается формовке, механической обработке и резке.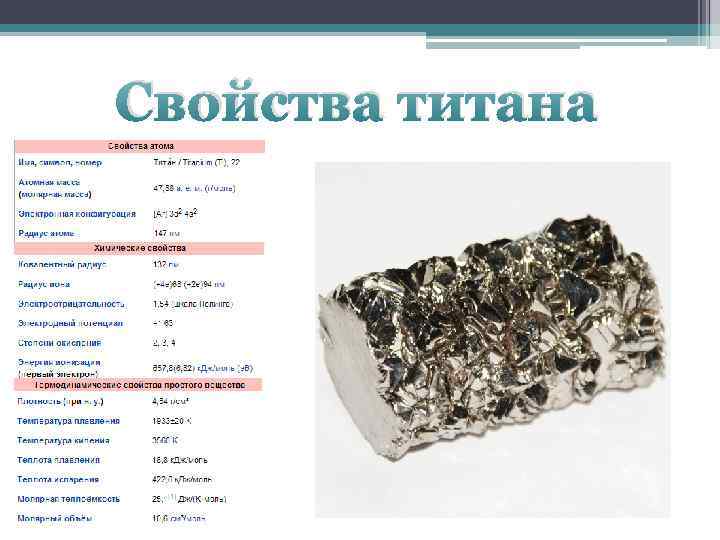 История его использования восходит к военному использованию в самолетах, и спрос на металл по-прежнему сильно зависит от военного сектора. В последние десятилетия его использование стало более разнообразным, поскольку материал все чаще используется в качестве улучшенной альтернативы для применения в стали.
История его использования восходит к военному использованию в самолетах, и спрос на металл по-прежнему сильно зависит от военного сектора. В последние десятилетия его использование стало более разнообразным, поскольку материал все чаще используется в качестве улучшенной альтернативы для применения в стали.
 Название подходит, так как многие его детали сделаны из титана. Изображение Центрального разведывательного управления.
Название подходит, так как многие его детали сделаны из титана. Изображение Центрального разведывательного управления. Нитинол 60 решил проблему коррозии без потери прочности и не вступал в реакцию со смазкой для подшипников. Изображение НАСА.
Нитинол 60 решил проблему коррозии без потери прочности и не вступал в реакцию со смазкой для подшипников. Изображение НАСА. Этот НАСА F-16XL имеет титановую перчатку для исследований ламинарного потока, покрывающую часть его левого крыла. Изображение НАСА Джима Росса.
Этот НАСА F-16XL имеет титановую перчатку для исследований ламинарного потока, покрывающую часть его левого крыла. Изображение НАСА Джима Росса. Это связано с тем, что диоксид титана является ингредиентом продуктов, а не основным материалом.
Это связано с тем, что диоксид титана является ингредиентом продуктов, а не основным материалом.


 Богатая титаном зона, соответствующая физико-географической провинции Вирджиния-Блю-Ридж, показывает значения более 3% по массе диоксида титана, Геологическая служба США.
Богатая титаном зона, соответствующая физико-географической провинции Вирджиния-Блю-Ридж, показывает значения более 3% по массе диоксида титана, Геологическая служба США. Эти отложения были извлечены и обработаны для удаления из них тяжелых минералов. Район, где ведется эта добыча, соответствует богатым титаном речным отложениям и почвам, отобранным, проанализированным и нанесенным на карту Национальной геохимической службой (см. Прилагаемую карту).
Эти отложения были извлечены и обработаны для удаления из них тяжелых минералов. Район, где ведется эта добыча, соответствует богатым титаном речным отложениям и почвам, отобранным, проанализированным и нанесенным на карту Национальной геохимической службой (см. Прилагаемую карту).