Виды электродов с покрытием и их применение
Главная |
Статьи |
Виды электродов с покрытием и их применение
Ассортимент плавящихся электродов с покрытием для ручной сварки довольно разнообразен. Все разновидности выпускаемой продукции имеют вид прутков. Все они обладают достоинствами и недостатками и подбираются в зависимости от условий работы и требуемого результата.
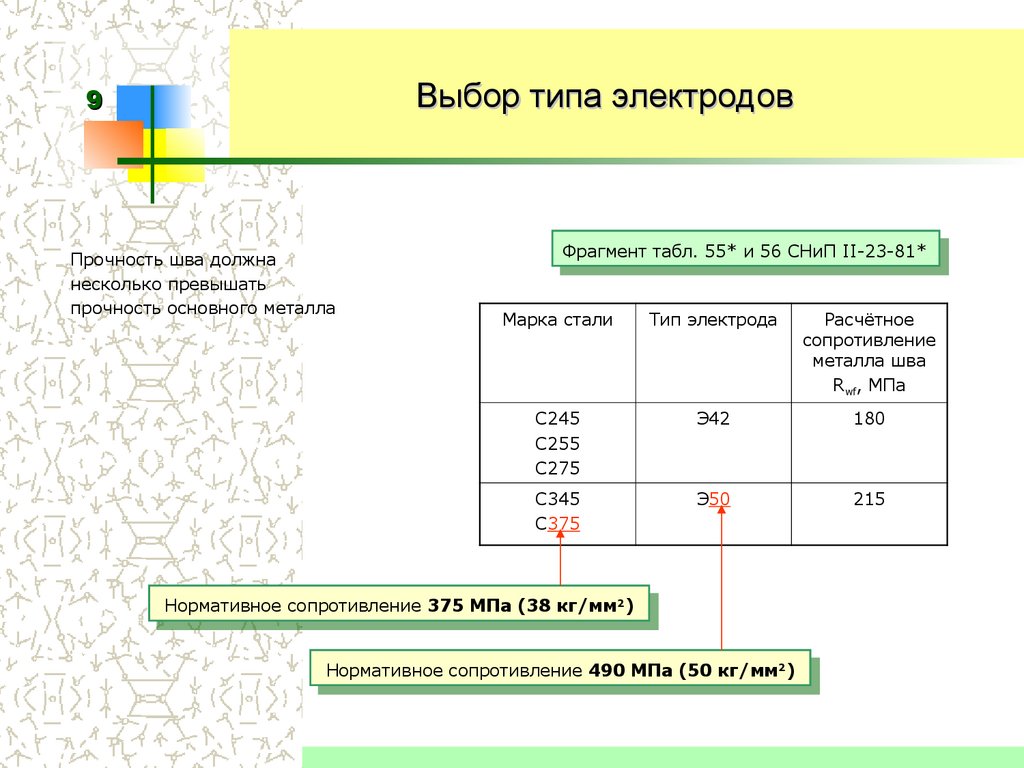
Согласно ГОСТу и ISO, электроды подразделяются по составу покрытия на несколько групп. По названию каждой группы можно определить, какие именно компоненты преобладают. Разбираясь в маркировке и обладая необходимыми знаниями, можно добиться высокого качества шва и прочности соединения.
ВИДЫ ПОКРЫТИЙ И ИХ МАРКИРОВКА
Кислые покрытия (А) состоят в основном из шлакообразующих оксидов железа, марганца, кремния, с небольшим включением оксида алюминия. Газообразующими добавками служат органические вещества, например, крахмал или целлюлоза, а связующим — жидкое стекло. Образующийся при плавлении шлак имеет характерные кислотные свойства, что и дало название этой группе.
Образующийся при плавлении шлак имеет характерные кислотные свойства, что и дало название этой группе.
Главными компонентами основных или щелочных покрытий (Б) являются мрамор и плавиковый шпат, в состав которых входят кальций и фтор. Для образования при сварке шлака вводятся рутил и кварцевый песок. При разложении мрамора выделяется углекислый газ, защищающий дугу и сварочную ванну от попадания воздуха. Для стабильности горения применяются добавки карбонатов и щелочных металлов. Этот вид покрытий называется основным, так как в результате плавления образуется шлак с ярко выраженными основными свойствами.
В составе целлюлозных покрытий (Ц) содержится более 50 % целлюлозы и других органических компонентов, служащих для газообразования. В процессе сварки выделяется окись углерода и водород.
Рутиловые покрытия (Р) на 50 % и более состоят из оксида титана — рутила, который является шлакообразующим веществом. В качестве добавок используются карбонаты, полевой шпат, каолин.
ПРЕИМУЩЕСТВА ЭЛЕКТРОДОВ С ПОКРЫТИЕМ И ИХ ПРИМЕНЕНИЕ
Электроды с кислым покрытием (А) не имеют в составе дорогостоящих компонентов. Они характеризуются стабильным горением дуги и подходят для сварки как постоянным, так и переменным током. Кислое покрытие обладает стойкостью к увлажнению и прочностью к механическому воздействию. К недостаткам продукции этого вида относят разбрызгивание металла и повышенное выделение токсинов, вызывающих силикоз. Образующийся шов имеет невысокую пластичность и склонность к старению. По механическим характеристикам он сопоставим с марками кипящей стали невысокой прочности. Этот вид электродов не подходит для сварки высоколегированной стали и стали с высоким содержанием углерода и серы. Они применяются для конструкций с невысокой нагрузкой.
Они применяются для конструкций с невысокой нагрузкой.
Электроды с щелочным покрытием (Б) позволяют получить шов, сопоставимый по свойствам со спокойной сталью с повышенными механическими характеристиками и пластичностью. При необходимости в покрытие можно добавлять легирующие компоненты для придания соединению особых свойств. Электродами удобно работать в любом пространственном положении. Лучше всего основные электроды подходят для сварки постоянным током. Для работы с аппаратами на переменном токе выпускается продукция с сильными стабилизирующими компонентами. Без них постоянной дуги добиться сложно. Основные покрытия гигроскопичны, поэтому эти электроды требуют соблюдения правил хранения. В их состав входят дорогостоящие компоненты, что отражается на цене. Электроды применяются при сварке ответственных конструкций, для получения жестких соединений. Они подходят для работы с углеродистой и легированной сталью.
Электроды с целлюлозным покрытием (Ц) характеризуются стабильностью дуги и подходят для работы на любом токе и во всех пространственных положениях.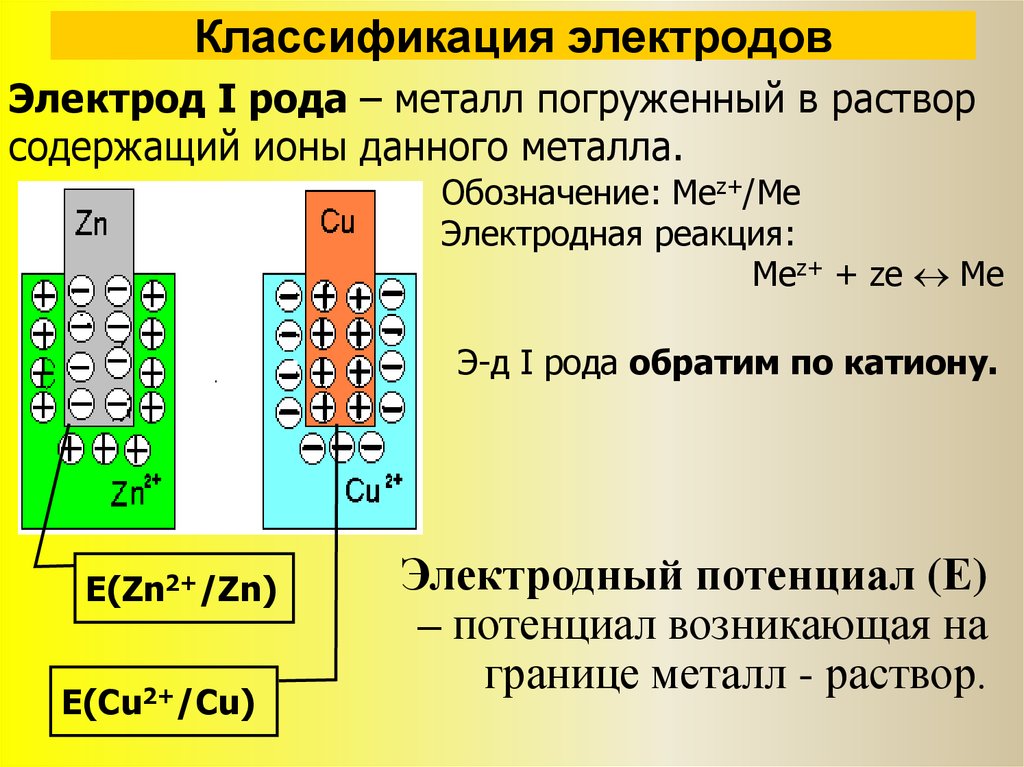 Этот вид продукции предпочтителен для сваривания тонколистовых деталей. При этом нужно учесть, что покрытие не обеспечивает достаточной защиты от воздуха и отличается высоким влагопоглощением. Металл при сварке сильно разбрызгивается. Электроды с целлюлозным покрытием востребованы для работ на газонефтепроводах.
Этот вид продукции предпочтителен для сваривания тонколистовых деталей. При этом нужно учесть, что покрытие не обеспечивает достаточной защиты от воздуха и отличается высоким влагопоглощением. Металл при сварке сильно разбрызгивается. Электроды с целлюлозным покрытием востребованы для работ на газонефтепроводах.
Рутиловое покрытие (Р) не выделяет токсичных веществ и поддерживает стабильную дугу при любом токе. Металл при сварке не разбрызгивается, а шов образует плавный переход к свариваемым деталям. Прочность соединения выше, чем при работе с кислым электродом, но и стоит рутиловая продукция дороже. Применяют ее для сварки низколегированной стали. Для повышения прочности шва без излишних затрат для работы используют электроды с кисло-рутиловым покрытием (АР).
Виды электродов для сварки
Дата публикации: 15.11.2018 12:53
Чтобы получить хороший результат в виде качественного сварного шва, перед началом сварных работ необходимо внимательно изучить необходимые для производства материалы. Нужно разобраться в видах электродов, ведь универсальных изделий для сварки пока не существует. Каждый вид применяется для конкретного материала и при определенных условиях.
Нужно разобраться в видах электродов, ведь универсальных изделий для сварки пока не существует. Каждый вид применяется для конкретного материала и при определенных условиях.
Электрод представляет собой стержень определенного размера, выполненный из металла или другого материала. Существуют разнообразные виды электродов для сварки:
- Неплавящиеся стержни изготовлены из графита, а также могут быть торированными, итрированными и угольными.
- Плавящиеся электроды производят из легированных, высоколегированных и углеродистых марок стали, бронзы, меди, чугуна и других металлов. Эти изделия обладают покрытием, которое выполняет сразу несколько функций при расплавлении металла. К его «обязанностям» относится защита от газовой фазы сварочной ванны и стабилизация электрической дуги.
Изделия с щелочным покрытием легко образуют и стабилизируют дугу.
Электроды делятся на несколько основных классов:
- — электроды для сварки теплоустойчивых легированных видов стали;
- — электроды для сварки высоколегированных видов стали с особенными свойствами;
- — электроды для сварки конструкционных сталей с применением дуговой сварки;
- — электроды для наплавки металла;
- — электроды для сварки цветных металлов;
- — электроды для сварки чугуна;
Также электроды делятся на четыре типа по допустимым положениям сваривания:
- – все возможные положения;
- – все возможные положения кроме вертикального сверху вниз;
- – нижнее, горизонтальное и вертикальное сверху вниз;
- – нижнее положение;
В промышленности используются различные типы электродов для соединения металлов, которые обладают разной температурой плавления.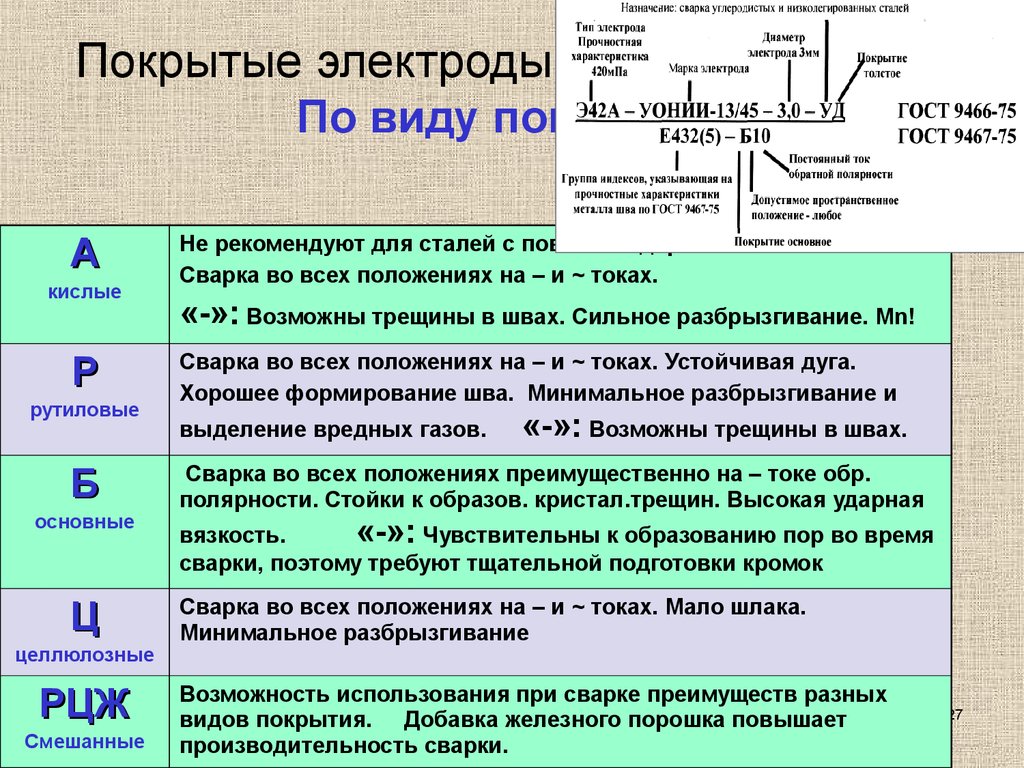 Для каждой задачи подбирается специальный тип сварочного электрода. Например, одна марка электродов для сварки используется для тонкой листовой стали толщиной 0,5 мм, другой тип соединяет металлопрофили толщиной 5 мм.
Для каждой задачи подбирается специальный тип сварочного электрода. Например, одна марка электродов для сварки используется для тонкой листовой стали толщиной 0,5 мм, другой тип соединяет металлопрофили толщиной 5 мм.
Есть много типов стержней, которые классифицировать сложно. Типы для сварки стали определяются по ГОСТу 9467-75. Например, в буквенно-числовых обозначениях марок Э42А, Э38 и Э50А:
- «Э» обозначает «электрод»,
- число указывает минимальное время сопротивления разрыву,
- буква «А» определяет возможность использовать наплавляемый пластичный металл повышенной вязкости.
- буквой «Н» обозначаются изделия для наплавления на разные поверхности,
- буквой «У» маркируются стержни для соединения изделий из углеродистой стали,
- буква «Т» – для изделий из легированных теплоустойчивых сталей.
Химические элементы, входящие в состав наплавки, тоже отражаются в маркировке электрода, например:
- «Х» – хром,
- «М» – молибден,
- «Б» – ниобий,
- «Ф» – ванадий.

К одному классу отечественных и зарубежных сварочных материалов относится большое количество марок сварочных электродов.
Проволока для производства электродов маркируется так:
- буквы Св означают сварочный тип,
- число после букв определяет проценты углерода в металле,
- буквенный код означает наличие легирующих веществ,
- следующее число означает процент этих элементов в составе стержня.
Также это очень важно помнить еще и потому что если Вы сварите изделие не подходящим видом электродов, то Вам никто не даст гарантию, что оно доживет до завтра. Правильно относиться к выбору электродов Вам помогут и прайс-листы наших заводов-изготовителей, найти которые Вы сможете только в разделе «Контакты». Помните: правильное отношение к выбору электродов является залогом успешно выполненной работы!
Сколько типов электродов у нас есть?
15 января 2021 г. 15 января 2021 г. | 10:06
Электрод является жизненно важным компонентом электрохимических элементов.
Газовые электроды:
Газовый электрод включает различные газы, такие как h3, Cl2 и O2, находящиеся в контакте с раствором, содержащим ионы, получаемые из газа, такие как H+, Cl-, OH-. Потенциал газового электрода зависит от интенсивности его ионов в растворе и силы газа. Газовый электрод барботирует газ вокруг инертной металлической проволоки, включенной в раствор, содержащий ионы, с которыми газ постоянен.
Электрод из малорастворимой соли металла:
Электрод из малорастворимой соли металла также известен как обратимый анионный электрод. В электроде этого типа металл и труднорастворимая соль металла находятся в равных пропорциях с раствором, содержащим тот же анион, что и труднорастворимая соль.
Электроды металл-металл-ион:
В этом случае металлическая деталь помещается в раствор водорастворимого катиона-носителя соли соответствующего металла. В электрохимической ячейке электрод с более высоким окислительным потенциалом подвергается окислению и служит анодом/отрицательным электродом. Электрод с более низким потенциалом окисления испытывает потери и действует как катод/положительный электрод.
В электрохимической ячейке электрод с более высоким окислительным потенциалом подвергается окислению и служит анодом/отрицательным электродом. Электрод с более низким потенциалом окисления испытывает потери и действует как катод/положительный электрод.
Каломельный электрод:
Электрод-источник, содержащий молекулы ртути и хлорида ртути. Он изготовлен из жидкой элементарной ртути и твердой пасты Hg2Cl2, соединенной со стержнем, покрытым насыщенным раствором KCl. Необходимо использовать насыщенный раствор, так как это обеспечивает действие хлорида калия и минимальное напряжение, более похожее на стандартный водородный электрод, т. е. СВЭ. Этот насыщенный раствор позволяет осуществить перенос ионов хлора.
Серебряно-хлоридный электрод:
Электрод этого типа прессует соль в растворе, который связывается с результатом электрода. Этот электрод содержит твердое серебро и осажденную соль AgCl. Это обычно используемый электрод сравнения, потому что он разумен и не очень токсичен. Электрод из хлорида серебра-серебра изготавливается с использованием нити из твердого серебра и путем кодирования его в AgCl. Затем его помещают в пробирку с раствором AgCl и KCl. Это позволяет ионам образовываться по мере движения электронов в систему электродов и из нее.
Электрод из хлорида серебра-серебра изготавливается с использованием нити из твердого серебра и путем кодирования его в AgCl. Затем его помещают в пробирку с раствором AgCl и KCl. Это позволяет ионам образовываться по мере движения электронов в систему электродов и из нее.
pH-электрод:
Пожалуй, самый полезный и надежный способ определения pH — использование стеклянного электрода. рН-электрод зависит от ионного обмена в гидратированных слоях, построенных снаружи стеклянного электрода. Стекло состоит из силикатной сетки, в которой ионы металла координированы с частицей кислорода, и именно ионы металла взаимодействуют с H+. Стеклянный электрод действует как батарея, напряжение которой зависит от движения H+ в растворе, в котором он находится.
Ионоселективные электроды:
Ионоселективный электрод реагирует на действие селективного иона. Предположим, что некоторые из атомов несвободны и сохраняются в виде компактной структуры или необъяснимого осадка. В этом случае эти электроды обеспечат гораздо более низкие показания, чем метод, который идентифицирует все присутствующие ионы. Обычно используются ионоселективные электроды K+, Ca2+ и NO-3. Возможно, что электрод является ионоселективным, но он не будет ионоселективным.
Обычно используются ионоселективные электроды K+, Ca2+ и NO-3. Возможно, что электрод является ионоселективным, но он не будет ионоселективным.
Газочувствительные электроды:
Они обычно используются для определения интенсивности газа путем его взаимодействия с тонким слоем, окружающим ион-чувствительный электрод, обычно pH-электрод. Диоксид серы, диоксид углерода и аммиак можно измерить по их растворению в тонком слое, окружающем pH-электрод и содержащем результирующий pH покрытия.
Кислородный электрод Кларка:
Этот электрод состоит из платинового катода и серебряного анода, включенных в один и тот же раствор насыщенного хлорида калия и изолированных от исследуемого раствора кислородно-пористой пленкой. Когда на электродах используется внутренняя разность -0,6 В, так что платиновый катод формируется отрицательно по отношению к серебряному аноду, и на аноде образуются электроны. Затем они используются для снижения содержания кислорода на катоде.
Piping Mart
Pipingmart — это портал B2B, специализирующийся на промышленных, металлических и трубопроводных изделиях. Кроме того, делитесь последней информацией и новостями, касающимися продуктов, материалов и различных типов марок, чтобы помочь бизнесу в этой отрасли.
Кроме того, делитесь последней информацией и новостями, касающимися продуктов, материалов и различных типов марок, чтобы помочь бизнесу в этой отрасли.
Газовый электрод, электрод из соли металла и т. д.
Наука > Химия > Электрохимия > Типы электродовВ этой статье мы изучим различные типы электродов, их представление, написание клеточных реакций и определение ЭДС. клетки.
Есть четыре типа электродов
- Газовые электроды
- Электроды на основе труднорастворимых солей металлов
- Металло-ионные электроды
- Редокс-электроды
Газовые электроды:
A Cl2, O2) в контакте с раствором, содержащим ионы, полученные из газа, например Н+, Cl-, ОН-. Потенциал газового электрода зависит от концентрации его ионов в растворе и давления газа. Газовый электрод состоит из газа, барботируемого вокруг инертной металлической проволоки (платинированный платиновый электрод), погруженной в раствор, содержащий ионы, с которыми газ необратим.
Примеры газовых электродов:
Стандартный водородный электрод (SHE):
SHE is представлен как
Pt| H 2(г) (1 атм.)| H + (водный) (1 М)
Половина клеточные реакции:
H 2(g) → 2H + (водн.) + 2e – (окисление) (L.H.S.)
2H + (водн.) + 2e – → H 2(g) (уменьшение) (R.H.S.)
Потенциалу электрода произвольно присваивается нуль. Этот электрод катионный электрод.
Электрод для газообразного хлора:
Этот электрод — анионный электрод. Хлоргазовый электрод представлен как,
Пт| Cl 2(г) (1 атм.)| Класс – (водный) (1 м)
Половинка клеточные реакции:
2Cl – (водн. ) → Cl 2(г) + 2e – (окисление) (L.H.S.)
) → Cl 2(г) + 2e – (окисление) (L.H.S.)
Cl 2(g) + 2e – → 2Cl – (водн.) (восстановление) (R.H.S.)
Кислородный электрод:
Кислородный газ электрод представлен как,
Pt | O 2(г) (1 атм)| ОН – (водный) (1M)
Половинка реакция клетки
4OH – → 2H 2 O+ O 2(g) + 4e – (окисление) (Л.В.С.)
2H 2 O + O 2(g) + 4e – → 4OH – (восстановление) (R.H.S.)
Металло-умеренно растворимый металлический солевой электрод:
Реверсивный
анионный электрод также называют металл-умеренно растворимой солью металла.
электрод. В этом электроде металл, малорастворимая соль металла в
равновесие с раствором, содержащим тот же анион, что и труднорастворимый
соль. например Каломельный электрод.
Металлоионные электроды:
В этом случае металлическая полоса находится в контакте с раствором водорастворимого солевого катиона того же металла.
напр. Zn (с) | Zn ++ (водный)
В в электрохимической ячейке электрод с более высоким потенциалом окисления подвергается окисления и действует как анод или отрицательный электрод и электрод, имеющий меньший потенциал окисления подвергается восстановлению и действует как катод или положительный электрод.
Zn (s) | Zn ++ (водн.)
Zn (тв.) → Zn ++ (водн.) + 2e – (Окисление)
Zn ++ (водн.) + 2e – → Zn (s) (Сокращение)
Cu (s) | Cu ++ (водн.)
Cu (тв. ) → Cu ++ (водный) +
2e – (Окисление)
) → Cu ++ (водный) +
2e – (Окисление)
Cu ++ (водн.) + 2e – → Cu (s) (Восстановление)
Окислительно-восстановительный электрод:
В этих электродов инертный металл типа Pt погружают в раствор, содержащий ионы активный металл в двух различных степенях окисления.
Пл | Fe 2+ , Fe 3+
Fe 2+ → Fe 3+ е – (Окисление)
Fe +++ + e – → Fe ++ (восстановление)
Pt | Sn 2+ , Sn 4+
Sn 2+ → Sn 4+ + 2e – (Окисление)
Sn 4+ + 2e – → Sn 2+ (Редукция)
Запись клеточной реакции и нахождение Э.Д.С. ячейки:
Окислительно-восстановительный потенциал:
Потенциал, возникающий из-за способности ионов терять или приобретать электроны, образуя более высокую или более низкую стабильную степень окисления, называется окислительно-восстановительным потенциалом.
Редокс потенциал зависит от соотношения концентраций двух типов ионов.
Пл | Fe 2+ (водн.) (1M), Fe 3+ (водн.) (1M) E 2 ox = – 0,771 В
Представление ячеек, содержащих стандарт и эталон электроды:
Ячейка состоит из контакта цинкового стержня с 1-молярным раствором иона цинка и насыщенного каломельный электрод.
Zn (с) | Zn 2+ (1M) || KCl (водный) (насыщенный) | Hg 2 Cl 2(s) |Hg (л) , Pt +
Ячейка состоит из SHE и насыщенного каломельного электрода
Pt | H 2(г) (1 атм)| H + (водный) (1М) || KCl (водн.) (насыщенный)|Hg 2 Cl 2(тв) | ртутного столба (л) ,Pt +
Реакции ячеек:
Шаги для записи реакции ячейки гальванического элемента:- Представьте данный гальванический элемент со стандартным соглашением.

- Электрод в левой части изображения показывает, что он является анодом и на этом электроде происходит окисление. Напишите для него реакцию полуклеточного окисления полуклеточную реакцию.
- Электрод в правой части изображения показывает, что он является катодом и на этом электроде происходит восстановление. Напишите для него полуклеточную реакцию восстановления полуклеточной реакции.
- Баланс вышеперечисленных двух реакций для электронов для реакции окисления и восстановления.
- Сложите две реакции и получите чистую (общую) клеточную реакцию.
Шаг – 1: Представьте ячейку условно:
Pb (s) | Pb 2+ (водн.) (1M) || Ag + (водн.) (1M)| Ag (s) +
Шаг – 2: Запишите реакцию полуэлемента слева: Pb(s) находится в левой части изображения. что это анод, и окисление происходит на Pb(s) электроде.
Pb (т) → Pb 2+ (водн. ) + 2e – (Окисление) … (1)
) + 2e – (Окисление) … (1)
Шаг – 3: Напишите реакцию правой половины ячейки: Ag (s) находится в правой части представления. показывает, что это катод и восстановление происходит при Ag (s) электрод.
Ag + (водный) + e – → Ag (s) (Сокращение) … (2)
Шаг – 4: Сбалансируйте электроны двух вышеуказанных полуэлементных реакций:
Умножьте уравнение (2) на 2, чтобы сбалансировать электроны.
2Ag + (водный) + 2e – → 2Ag (s) (Сокращение) … (2)
Шаг – 5: Складывая уравнения (1) и (3), получаем общая реакция.
Pb (т) + Ag + (водн.) → Pb 2+ (водн.) + Ag (s)
Действия по нахождению ЭДС. гальванического элемента:- Представление данного гальванического элемента в соответствии со стандартными условными обозначениями.

- Электрод в левой части изображения показывает, что он является анодом и на этом электроде происходит окисление.
- Электрод в правой части изображения показывает, что он является катодом и на этом электроде происходит восстановление.
- Получите стандартные значения потенциала окисления из электродвижущего ряда для материала катода и анода.
- Используйте следующую формулу для расчета Э.Д.С. клетки.
Е или Ячейка = E o (бык/катод) – E o (вол/анод)
ИЛИ
E o Ячейка = E o (вол/катод) + E o (красный/анод)
Для нахождения э.д.с. Daniel Cell:Шаг – 1: представить ячейку обычным образом
Шаг
– 2: Определите анод и катод: Pb(s) является
в левой части изображения видно, что это анод и окисление
происходит на Pb(s) электроде.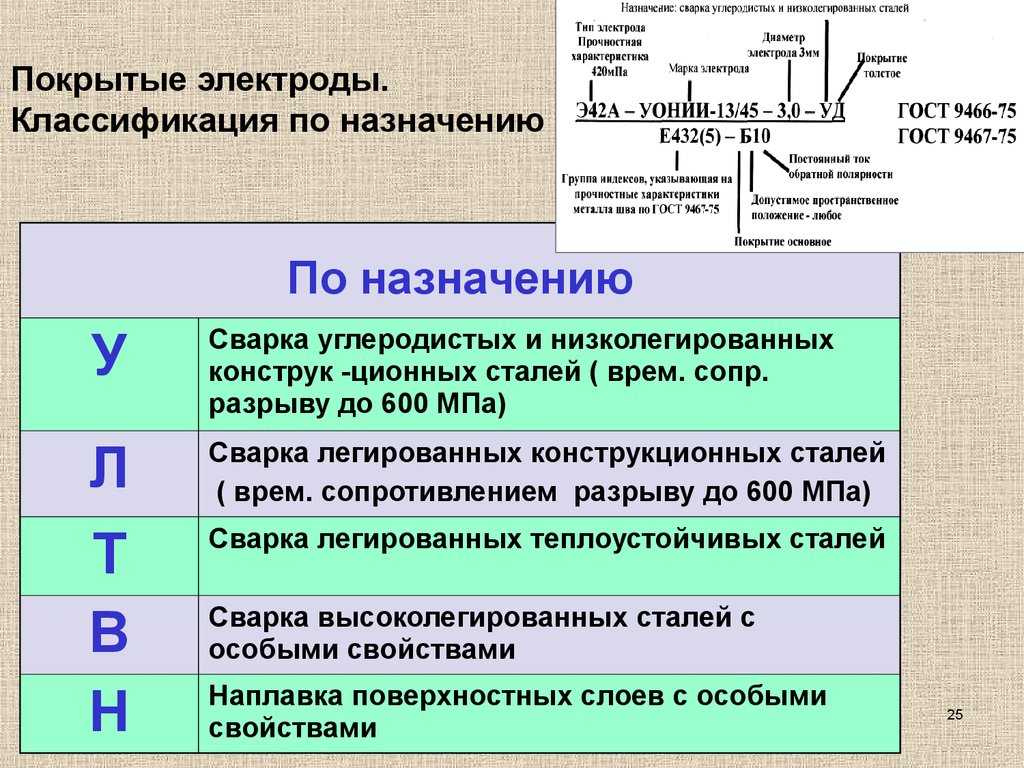 Ag(s) находится на правой стороне
изображении видно, что это катод и восстановление происходит при
Ag(s) электрод.
Ag(s) находится на правой стороне
изображении видно, что это катод и восстановление происходит при
Ag(s) электрод.
Шаг – 3: Получить значения потенциала окисления или потенциал восстановления для электродов Из электрохимической серии
E o (ox/Zn) = 0,76 В и EE o (ox/Cu) =-0,34 В
Шаг – 4: рассчитать ЭДС ячейки:
E o Cell = E o (вол/катод) – E (окс/анод)
E o Ячейка = E o (вол/цинк) – E o (ox/Cu)
E o Ячейка = 0,76 – (- 0,34)
E o Ячейка = 0,76 +0,34
E O Cell = 1,1 В
Предыдущая тема: Электроды справки
Следующая тема: Теория NERSNT потенциала электрода
.