Какой химический символ свинца? | Ответ на вопрос
Cвине́ц (лат. Plumbum; обозначается символом Pb) — элемент 14-й группы (по устаревшей классификации — главной подгруппы IV группы), шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82 и, таким образом, содержит магическое число протонов. Простое вещество свинец — ковкий, сравнительно легкоплавкий металл серебристо-белого цвета с синеватым отливом. Известен с глубокой древности. Содержание в земной коре — 1,6•10−3 % по массе. Самородный свинец встречается редко, круг пород, в которых он установлен, достаточно широк: от осадочных пород до ультраосновных интрузивных пород. Для получения свинца в основном используют руды, содержащие галенит. Свинец имеет довольно низкую теплопроводность, она составляет 35,1 Вт/(м•К), при температуре 0 °C. Металл мягкий, режется ножом, легко царапается ногтем. Свинец и его соединения токсичны. Особенно ядовиты водорастворимые, например, ацетат свинца и летучие, например, тетраэтилсвинец соединения.
Происхождение слова «свинец» неясно. Этот металл по-болгарски называется «оло́во», в большинстве других славянских языков (сербско-хорватском, чешском, польском) свинец называется словом, близким по звучанию к «олово»: волава, olovo, ołów и т. п. Слово с тем же значением, но похожее по произношению на «свинец», встречается в языках балтийской группы: švinas (литовский), svins (латышский), а также в нескольких славянских — русском, украинском (свинець) и словенском (svinec).
Латинское plumbum дало английское слово plumber — водопроводчик (в Древнем Риме трубы водопровода были именно из этого металла, как наиболее подходящего для отливки), и название венецианской тюрьмы со свинцовой крышей — Пьомби, из которой, по некоторым данным, ухитрился бежать Казанова.
Узнать больше:
en.wikipedia.org
<div> <img src=»https://cdn.quizzclub.com/social/was-it-interesting.png» alt=»Was it interesting?»> </div> Поделиться этим фактом
СВИНЕЦ — это… Что такое СВИНЕЦ?
СВИНЕЦ — обыкновенный (Plumbum), симв. Pb, смесь изотопов, атомный в. 207,22 (ат. в. уранового свинца 206,05, ториевого 207,9). Кроме этих изотопов имеется еще свинец с ат. в. 207. Отношение изотопов в обыкновенном свинце206: : 207 : 208 = 100 : 75 :175.… … Большая медицинская энциклопедия
СВИНЕЦ — муж. крушец, металл, один из самых мягких и веских, цветом посинее олова; встарь зывали его оловом, откуда и поговорка: слово олово, ·т.е. веско. В Васильев вечер лить олово, свинец, воск. Ружейные пули свинцовые. Свинцовая руда всегда… … Толковый словарь Даля
СВИНЕЦ — (символ Рb), металлический элемент IV группы периодической таблицы. Его основная руда ГАЛЕНИТ (сульфид свинца), из нее добывают свинец путем обжига. Воздействие на организм свинца, содержащегося в красках, трубах, бензине и др. может привести к… … Научно-технический энциклопедический словарь
СВИНЕЦ — (Plumbum), Pb, химический элемент IV группы периодической системы, атомный номер 82, атомная масса 207,2; мягкий, пластичный синевато серый металл, tпл 327,5шC, летуч. Из свинца изготовляют электроды аккумуляторов, провода, кабели, пули, трубы и… … Современная энциклопедия
СВИНЕЦ — СВИНЕЦ, свинца, мн. нет, муж. 1. Мягкий, очень тяжелый металл синевато серого цвета. Пломба из свинца. Расплавленный свинец. 2. перен. Пуля; собир. пули (поэт.). «Засвищет вкруг меня губительный свинец.» Пушкин. «С свинцом в груди, лежал недвижим … Толковый словарь Ушакова
Свинец — (Рb) хим. элемент IV гр. периодической системы, порядковый номер 82, ат. в. 207,19. Для С. характерны положительные валентности 4 и 2, наиболее типичными являются соединения, в которых он двухвалентен. Четырехвалентный С. в кислой среде является… … Геологическая энциклопедия
свинец — рейхблей, веркблей, церуссит, алтаит Словарь русских синонимов. свинец сущ., кол во синонимов: 11 • аабам (1) • абаам … Словарь синонимов
СВИНЕЦ — хим. элемент, символ Рb (лат. Plumbum), ат. н. 82, ат. м. 207,19; тяжёлый, мягкий, ковкий и пластичный металл синевато серого цвета, плотность 11340 кг/м3, tпл = 327,5°С. Самородный свинец в природе встречается крайне редко. Он входит в состав… … Большая политехническая энциклопедия
СВИНЕЦ — (лат. Plumbum) Pb, химический элемент IV группы периодической системы Менделеева, атомный номер 82, атомная масса 207,2. Синевато серый металл, тяжелый, мягкий, ковкий; плотность 11,34 г/см³, tпл 327,4 .С. На воздухе покрывается оксидной… … Большой Энциклопедический словарь
Свинец — металл, известный еще в древности. С. добывали в Египте и на Синайском полуо ве, а также привозили в Тир из Фарсиса (Иез 27:12). При перечислении захвач. у мадианитян трофеев С. среди металлов называется последним (Чис 31:22), т.к. он, очевидно,… … Библейская энциклопедия Брокгауза
СВИНЕЦ — СВИНЕЦ, нца, муж. Мягкий, ковкий, тяжёлый металл синевато серого цвета. Врагов встретили свинцом (перен.: стрельбой, пулями). Лечь свинцом на сердце (перен.: о чём н. тяжёлом, гнетущем). Голова как свинцом налита (об ощущении тяжести, боли в… … Толковый словарь Ожегова
Изотопы свинца — Википедия
Материал из Википедии — свободной энциклопедии
Изото́пы свинца́ — разновидности химического элемента свинца с разным количеством нейтронов в ядре. Известны изотопы свинца с массовыми числами от 178 до 220 (количество протонов 82, нейтронов от 96 до 138) и 48 ядерных изомеров.
Свинец — последний элемент в периодической таблице, у которого существуют стабильные изотопы. Элементы после свинца стабильных изотопов не имеют.
Природный свинец состоит из 4 стабильных изотопов:[1]
- 204Pb (изотопная распространённость 1,4 ± 0,6 %)
- 206Pb (изотопная распространённость 24,1 ± 3,0 %)
- 207Pb (изотопная распространённость 22,1 ± 5,0 %)
- 208Pb (изотопная распространённость 52,4 ± 7,0 %)
Большие разбросы изотопной распространённости вызваны не погрешностью измерений, а наблюдаемым разбросом в различных природных минералах ввиду разных цепочек радиогенного возникновения свинца. Изотопы 206Pb, 207Pb, 208Pb являются радиогенными, то есть образуются в результате радиоактивного распада соответственно 238U, 235U и 232Th. Поэтому многие минералы имеют иной изотопный состав свинца вследствие накопления продуктов распада урана и тория. Изотопный состав, который приведён выше, характерен преимущественно для галенитов, в которых урана и тория практически нет, и пород, преимущественно осадочных, в которых количество урана находится в кларковых пределах. В радиоактивных минералах этот состав существенно отличается и зависит от вида радиоактивного элемента, слагающего минерал. В урановых минералах, таких как уранинит UO
Помимо стабильных изотопов, в природе в следовых количествах наблюдаются другие радиоактивные изотопы свинца, входящие в состав радиоактивных рядов урана-238 (214Pb и 210Pb), урана-235 (211Pb) и тория-232 (212Pb). Эти изотопы имеют устаревшие, но ещё иногда встречающиеся исторические названия и обозначения: 210Pb — радий D (RaD), 214Pb — радий B (RaB), 211Pb — актиний B (AcB), 212Pb — торий B (ThB). Их природное содержание крайне мало, в равновесии оно соответствует содержанию родительского изотопа ряда, умноженному на отношение периодов полураспада дочернего изотопа и родоначальника ряда. Например, для свинца-212 из ряда тория это отношение равно (10,64 часа)/(1,405·10
Свинец-212[править | править код]
212Pb[3] является перспективным изотопом для терапии рака альфа-частицами (англ.)русск.. Период полураспада 10 часов, конечный изотоп 208Pb. Цепочка распада создает альфа- и бета-излучение. Изотоп вводится в состав фармацевтического препарата, который селективно поглощается поражёнными клетками. Альфа-частицы имеют очень небольшую длину свободного пробега в тканях, соизмеримую с размером клетки. Таким образом, разрушительное воздействие ионизирующего излучения концентрируется в поражённых тканях, а высокая разрушительная способность альфа-излучения эффективно убивает поражённые клетки.
212Pb входит в цепочку распада 232U, искусственного изотопа, получаемого путём облучения природного тория 232Th нейтронами в реакторе. Для медицинских целей создают мобильные генераторы 212Pb, из которых наработанный свинец вымывается химическим способом.
Свинец-208[править | править код]
208Pb обладает низким сечением захвата нейтронов, что делает этот изотоп пригодным в качестве теплоносителя для ядерных реакторов с жидкометаллическим теплоносителем.
| Символ нуклида | Z (p) | N (n) | Масса изотопа[4] (а. е. м.) | Период полураспада[5] (T1/2) | Спин и чётность ядра[5](J π) |
|---|---|---|---|---|---|
| Энергия возбуждения | |||||
| 178Pb | 82 | 96 | 178,003830 | 230 мкс | 0+ |
| 82 | 97 | 179,00215 | 3 мс | 5/2- | |
| 180Pb | 82 | 98 | 179,997918 | 4,5 мс | 0+ |
| 181Pb | 82 | 99 | 180,99662 | 45 мс | 5/2- |
| 182Pb | 82 | 100 | 181,992672 | 60 мс | 0+ |
| 183Pb | 82 | 101 | 182,99187 | 535 мс | 3/2- |
| 183mPb | 94 кэВ | 415 мс | 13/2+ | ||
| 184Pb | 82 | 102 | 183,988142 | 490 мс | 0+ |
| 185Pb | 82 | 103 | 184,987610 | 6,3 с | 3/2- |
| 185mPb | 60 кэВ | 4,07 с | 13/2+ | ||
| 186Pb | 82 | 104 | 185,984239 | 4,82 с | 0+ |
| 187Pb | 82 | 105 | 186,983918 | 15,2 с | 3/2- |
| 187mPb | 11 кэВ | 18,3 с | 13/2+ | ||
| 188Pb | 82 | 106 | 187,980874 | 25,5 с | 0+ |
| 188m1Pb | 2,5782 МэВ | 830 нс | 8- | ||
| 188m2Pb | 2,80 МэВ | 797 нс | |||
| 189Pb | 82 | 107 | 188,98081 | 51 с | 3/2- |
| 189mPb | 40 кэВ | 1 мин | 13/2+ | ||
| 190Pb | 82 | 108 | 189,978082 | 71 с | 0+ |
| 190m1Pb | 2,6148 МэВ | 150 нс | 10+ | ||
| 190m2Pb | 2,618 МэВ | 25 мкс | 12+ | ||
| 190m3Pb | 2,6582 МэВ | 7,2 мкс | 11- | ||
| 191Pb | 82 | 109 | 190,97827 | 1,33 мин | 3/2- |
| 191mPb | 20 кэВ | 2,18 мин | 13/2+ | ||
| 192Pb | 82 | 110 | 191,975785 | 3,5 мин | 0+ |
| 192m1Pb | 2,5811 МэВ | 164 нс | 10+ | ||
| 192m2Pb | 2,6251 МэВ | 1,1 мкс | 12+ | ||
| 192m3Pb | 2,7435 МэВ | 756 нс | 11- | ||
| 193Pb | 82 | 111 | 192,97617 | 5 мин | 3/2- |
| 193m1Pb | 130 кэВ | 5,8 мин | 13/2+ | ||
| 193m2Pb | 2,6125 МэВ | 135 нс | 33/2+ | ||
| 194Pb | 82 | 112 | 193,974012 | 12,0 мин | 0+ |
| 195Pb | 82 | 113 | 194,974542 | 15 мин | 3/2- |
| 195m1Pb | 202,9 кэВ | 15,0 мин | 13/2+ | ||
| 195m2Pb | 1,7590 МэВ | 10,0 мкс | 21/2- | ||
| 196Pb | 82 | 114 | 195,972774 | 37 мин | 0+ |
| 196m1Pb | 1,04920 МэВ | 100 нс | 2+ | ||
| 196m2Pb | 1,73827 МэВ | 1 мкс | 4+ | ||
| 196m3Pb | 1,79751 МэВ | 140 нс | 5- | ||
| 196m4Pb | 2,6935 МэВ | 270 нс | 12+ | ||
| 197Pb | 82 | 115 | 196,973431 | 8,1 мин | 3/2- |
| 197m1Pb | 319,31 кэВ | 42,9 мин | 13/2+ | ||
| 197m2Pb | 1,91410 МэВ | 1,15 мкс | 21/2- | ||
| 198Pb | 82 | 116 | 197,972034 | 2,4 ч | 0+ |
| 198m1Pb | 2,1414 МэВ | 4,19 мкс | 7- | ||
| 198m2Pb | 2,2314 МэВ | 137 нс | 9- | ||
| 198m3Pb | 2,8205 МэВ | 212 нс | 12+ | ||
| 199Pb | 82 | 117 | 198,972917 | 90 мин | 3/2- |
| 199m1Pb | 429,5 кэВ | 12,2 мин | 13/2+ | ||
| 199m2Pb | 2,5638 МэВ | 10,1 мкс | 29/2- | ||
| 200Pb | 82 | 118 | 199,971827 | 21,5 ч | 0+ |
| 201Pb | 82 | 119 | 200,972885 | 9,33 ч | 5/2- |
| 201m1Pb | 629,14 кэВ | 61 с | 13/2+ | ||
| 201m2Pb | 2,7185 МэВ | 508 нс | 29/2- | ||
| 202Pb | 82 | 120 | 201,972159 | 52,5 тыс. лет | 0+ |
| 202m1Pb | 2,16983 МэВ | 3,53 ч | 9- | ||
| 202m2Pb | 4,1429 МэВ | 110 нс | 16+ | ||
| 202m3Pb | 5,3459 МэВ | 107 нс | 19- | ||
| 203Pb | 82 | 121 | 202,973391 | 51,873 ч | 5/2- |
| 203m1Pb | 825,20 кэВ | 6,21 с | 13/2+ | ||
| 203m2Pb | 2,94947 МэВ | 480 мс | 29/2- | ||
| 203m3Pb | 2,9234 МэВ | 122 нс | 25/2- | ||
| 204Pb | 82 | 122 | 203,9730436 | стабилен | 0+ |
| 204m1Pb | 1,27400 МэВ | 265 нс | 4+ | ||
| 204m2Pb | 2,18579 МэВ | 67,2 мин | 9- | ||
| 204m3Pb | 2,26433 МэВ | 450 нс | 7- | ||
| 205Pb | 82 | 123 | 204,9744818 | 15,3 млн лет | 5/2- |
| 205m1Pb | 2,329 кэВ | 24,2 мкс | 1/2- | ||
| 205m2Pb | 1,013839 МэВ | 5,55 мс | 13/2+ | ||
| 205m3Pb | 3,1957 МэВ | 217 нс | 25/2- | ||
| 206Pb | 82 | 124 | 205,9744653 | стабилен | 0+ |
| 206m1Pb | 2,20014 МэВ | 125 мкс | 7- | ||
| 206m2Pb | 4,0273 МэВ | 202 нс | 12+ | ||
| 207Pb | 82 | 125 | 206,9758969 | стабилен | 1/2- |
| 207mPb | 1,633368 МэВ | 806 мс | 13/2+ | ||
| 208Pb | 82 | 126 | 207,9766521 | стабилен | 0+ |
| 208mPb | 4,895 МэВ | 500 нс | 10+ | ||
| 209Pb | 82 | 127 | 208,9810901 | 3,253 ч | 9/2+ |
| 210Pb | 82 | 128 | 209,9841885 | 22,20 года | 0+ |
| 210mPb | 1,278 МэВ | 201 нс | 8+ | ||
| 211Pb | 82 | 129 | 210,9887370 | 36,1 мин | 9/2+ |
| 212Pb | 82 | 130 | 211,9918975 | 10,64 ч | 0+ |
| 212mPb | 1,335 МэВ | 5 мкс | 8+ | ||
| 213Pb | 82 | 131 | 212,996581 | 10,2 мин | 9/2+ |
| 214Pb | 82 | 132 | 213,9998054 | 26,8 мин | 0+ |
| 215Pb | 82 | 133 | 215,00481 | 36 с | 5/2+ |
| 216Pb | 82 | 134 | > 300 нс | ||
| 217Pb | 82 | 135 | > 300 нс | ||
| 218Pb | 82 | 136 | > 300 нс | ||
| 219Pb | 82 | 137 | > 300 нс | ||
| 220Pb | 82 | 138 | > 300 нс | ||
- ↑ Meija J. et al. Isotopic compositions of the elements 2013 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2016. — Vol. 88, no. 3. — P. 293—306. — doi:10.1515/pac-2015-0503.
- ↑ 1 2 Войткевич Г. В., Мирошников А. Е., Поваренных А. С., Прохоров В. Г. Краткий справочник по геохимии. — М.: Недра, 1970.
- ↑ Способ получения радионуклида висмут-212
- ↑ Данные приведены по Audi G., Wapstra A. H., Thibault C. The AME2003 atomic mass evaluation (II). Tables, graphs, and references (англ.) // Nuclear Physics A. — 2003. — Vol. 729. — P. 337—676. — doi:10.1016/j.nuclphysa.2003.11.003. — Bibcode: 2003NuPhA.729..337A.
- ↑ 1 2 Данные приведены по Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — doi:10.1016/j.nuclphysa.2003.11.001. — Bibcode: 2003NuPhA.729….3A.
Свинецорганические соединения — Википедия
Материал из Википедии — свободной энциклопедии
Свинецорганические соединения — химические соединения, в которых имеется химическая связь между атомами углерода и свинца. Первым таким полученным веществом стал гексаэтилсвинец, синтезированный в 1858 году[1]. Свинец находится в одной подгруппе с углеродом и имеет валентность 4.
При движении вниз по подгруппе углерода, связь C–X (X = C, Si, Ge, Sn, Pb) становится слабее, а длина связи растет. Длина связи C–Pb в тетраметилсвинце составляет 222 пм, её энергия — 49 ккал/моль (204 кДж/моль). Для сравнения, связь С-Sn в тетраметилолове имеет длину 214 пм и энергию 71 ккал/моль (297 кДж/моль). Преобладание Pb(IV) в свинцовоорганической химии примечательно, имея в виду тот факт, что в неорганических соединениях свинец, как правило, имеет степень окисления +2.
Наиболее важным свинцовоорганическим соединением является тетраэтилсвинец, ранее использовавшийся в качестве антидетонатора. Наиболее важными реактивами свинца для его введения являются тетраацетат свинца и хлорид свинца.
Использование свинецорганических соединений ограничено частично из-за их токсичности, хотя токсичность составляет лишь 10% от уровня палладиевых соединений[1].
Свинецорганические соединения могут быть получены с помощью реактива Гриньяра и хлорида свинца. Например, продуктом реакции хлорида метилмагния и хлорида свинца является тетраметилсвинец, прозрачная жидкость с температурой кипения 110 °C и плотностью 1,995 г/см³. Реакция вещества с Pb(II) с циклопентадиенидом натрия дает свинцовый металлоцен — плюмбоцен.
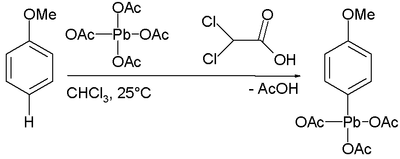
Некоторые ароматические соединения могут реагировать непосредственно с тетраацетатом свинца, образуя ароматические соединения свинца по механизму электрофильного ароматического замещения. К примеру, анизол при взаимодействии с тетраацетатом свинца образует р-methoxyphenyllead в хлороформе и дихлоруксусной кислоте:
Другие соединения свинца — свинецорганические галогениды типа RnPbX(4-n), свинецорганические сульфинаты (RnPb(OSOR)(4−n)) и свинецорганические гидроксиды (RnPb(OH)(4−n)). Типичные реакции:[2]
- R4Pb + HCl → R3PbCl + RH
- R4Pb + SO2 → R3PbO(SO)R
- R3PbCl + 1/2Ag2O (aq) → R3PbOH + AgCl
- R2PbCl2 + 2 OH− → R2Pb(OH)2 + 2 Cl−
Соединения типа R2Pb(OH)2амфотерны. При pH ниже 8 они образуют ионы R2Pb2+, а при pH выше 10 — ионы R2Pb(OH)3—.
Свинецорганические соединения образуют разнообразные интермедиаты, такие, как свободные радикалы свинца:
- Me3PbCl + Na (77 K) → Me3Pb.
и плюмбилены(?) (en:Plumbylene),
- Me3Pb-Pb-Me3 → [Me2Pb]
- [Me2Pb] + (Me3Pb)2 → Me3Pb-Pb(Me)2-PbMe3
- Me3Pb-Pb(Me)2-PbMe3 → Pb(0) + 2 Me4Pb
Эти интермедиаты распадаются в реакции диспропорционирования.
- ↑ 1 2 Main Group Metals in Organic Synthesis Yamamoto, Hisashi / Oshima, Koichiro (eds.) 2004 ISBN 3-527-30508-4
- ↑ Elschenbroich, C.; Salzer, A. ”Organometallics : A Concise Introduction” (2nd Ed) (1992) Wiley-VCH: Weinheim. ISBN 3-527-28165-7
Азид свинца — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 2 декабря 2019; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 2 декабря 2019; проверки требует 1 правка.Азид свинца — химическое соединение Pb(N3)2, соль азотистоводородной кислоты.
Кристаллическое вещество, имеет две основных кристаллических формы. Плотность α-формы 4,71 г/см³, плотность β-формы 4,93 г/см³. В воде плохо растворим, растворим в моноэтаноламине.
Как и многие другие азиды, неустойчив и склонен к взрывному разложению.
Азид свинца токсичен, как и многие другие азиды и соли свинца.
Применяется как инициирующее взрывчатое вещество, имеет высокую чувствительность и очень малый критический диаметр. Наиболее часто применяется в капсюлях-детонаторах.
Обращение требует особой осторожности и специальных технических приёмов.
- Взрывоопасен.
- Теплота взрыва: около 1,536 МДж/кг (7,572 МДж/дм³).
- Объем газов: 308 л/кг (1518 л/дм³)
- Скорость детонации: около 4800 м/сек.
- Очень ядовит.
Синтез азида свинца осуществляется в ходе обменной реакции между растворами солей свинца и растворимыми азидами щелочных металлов. Азид свинца в результате выпадает в виде белого кристаллического осадка:
- Pb(NO3)2+2NaN3→Pb(N3)2↓+2NaNO3{\displaystyle {\mathsf {Pb(NO_{3})_{2}+2NaN_{3}\rightarrow Pb(N_{3})_{2}\!\downarrow +2NaNO_{3}}}}
Реакцию рекомендуется проводить с добавлением декстрина, глицерина, желатина или подобных веществ, препятствующих формированию крупных кристаллов азида свинца и уменьшающих опасность детонации.
- М. А. Магочейников, Ф. М. Галаджий, Н. Л. Росинский. Мастер-взрывник. — Москва, 1962.
Отравление свинцом — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 апреля 2015; проверки требует 31 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 апреля 2015; проверки требует 31 правка.Отравление свинцом (сатурнизм, от лат. saturnus (по имени планеты) — свинец)[2] — наиболее распространённый вид отравлений тяжёлыми металлами. Обычно заболевание наблюдается у детей от года до пяти лет. Свинец, как правило, попадает в организм человека при вдыхании свинецсодержащей пыли, копоти и паров, что вызывает психотропное, нейротоксическое и гемолитическое действия. Попадая в организм, органические соединения металла превращаются в неорганические, что приводит к хронической интоксикации. Характеризуется отравление поражением всех отделов головного мозга[3].
При работе со свинцом его попадание в организм приводит к повышению концентрации этого вещества в крови. Поэтому уже в 1950-х предпринимались попытки разработать критерии, позволяющие с помощью биомониторинга распознать начало заболевания на его ранних стадиях[4]. Дальнейшее развитие науки позволило сформулировать требования, обязательные для выполнения работодателем, которые есть в стандарте США по охране труда при работе со свинцом[5]. Концентрация свинца и протопорфирина цинка в крови строго контролируется, см. раздел Медицинское обследование.
Значительное загрязнение окружающей среды свинцом происходило в результате выхлопов автомобильных двигателей, так как соединения свинца (тетраэтилсвинец) добавлялись в топливо с целью повышения его октанового числа. В России этилированный бензин был запрещён с 15 ноября 2002 года. ПДК соединений свинца в атмосферном воздухе — 0,003 мг/м³, в воде — 0,03 мг/л, почве — 20,0 мг/кг. Сброс свинца в Мировой океан — 430—650 тысяч т/год.
Установлена связь между отравлением свинцом и уровнем преступности[6].
Для защиты от ингаляционного поступления свинца в организм на рабочих местах следует использовать эффективные средства коллективной защиты — снижение запылённости воздуха, автоматизация технологических процессов и дистанционное управление, использование эффективной вентиляции и воздушных душей[7] и др. Необходимы предварительный (для поступающих на работу) и периодический (для работающих) медосмотры.
Изучение профессиональной заболеваемости работников разных отраслей в СССР и РФ показало, что при том, как сейчас выбираются и используются СИЗОД (в РФ), добиться эффективной профилактики профессиональных заболеваний с помощью этого «последнего средства защиты», удаётся исключительно редко[8].
- ↑ 1 2 Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ Книжников В.А., Бережной Р.В., Рубцов А.Ф., Григорян Э.А., Марченко Е.Н., Самойлов Д.Н., Соркина Н.С., Цивильно М.А. Свинец // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б.В. Петровский. — 3 изд. — Москва : Советская энциклопедия, 1984. — Т. 23. Сахароза — Сосудистый тонус. — С. 21-26. — 544 с. — 150 800 экз.
- ↑ Отравления свинцом и его соединениями (неопр.). http://www.health-news.ru.
- ↑ Frank A. Patty. Industrial Hygiene and Toxicology. — 2 ed. — New York, 1958.
- ↑ OSHA. 29 CFR 1910.1025 Lead (англ.). — Occupational Safety and Health Administration, 1972. — (Occupational Safety and Health Standards). Есть перевод: Стандарт по охране труда при работе со свинцом
- ↑ Может ли отравление свинцом влиять на преступность? (неопр.).
- ↑ Отчёт NIOSH о разработке и испытаниях воздушного душа для защиты шахтёров от пыли
- ↑ Капцов В.А., Чиркин А.В. Об эффективности средств индивидуальной защиты органов дыхания как средства профилактики заболеваний (обзор) // ФБУЗ «Российский регистр потенциально опасных химических и биологических веществ» Роспотребнадзора Токсикологический вестник. — Москва, 2018. — № 2 (149). — С. 2-6. — ISSN 0869-7922.
- ↑ Susan Aldridge. Archaeforensics. What Killed…? // BBC Focus. — 2008. — № за февраль. — P. 42 lang=en.
- ↑ Ulf Aasebø, Kjell G Kjær. Lead poisoning as possible cause of deaths at the Swedish House at Kapp Thordsen, Spitsbergen, winter 1872-3 (англ.) // BMJ. — London: BMJ Group, 2009. — ISSN 0959-8138.
- ↑ Первый искусственный подсластитель был на основе свинца и убивал древних римлян (неопр.). Фактрум. Дата обращения 31 октября 2015.
Обсуждение:Свинец — Википедия
Материал из Википедии — свободной энциклопедии
5—20 % свинца идет на изготовление тетраэтилсвинца (ТЭС) (Ch4Ch3)4Pb, который добавляют к бензину для повышения октанового числа (в наcтоящее время не используют, поскольку доказана его канцерогенность)
Это как? Куча свинца идёт на то, что не используют? Конст. Карасёв 22:29, 3 марта 2007 (UTC)
- Угу, Вы правы.—Medved’?!@ 15:52, 29 апреля 2007 (UTC)
- Вы все неправы. ТЭС постоянно производится, а в бензине он работает вместе с соединениями брома и хлора (выносителями) и при сгорании выбрасываются нерастворимые бромиды и хлориды свинца. — Эта реплика добавлена с IP 77.106.231.30 (о)
- То есть всё-таки используют? Конст. Карасёв 10:48, 30 апреля 2007 (UTC)
- Все заводы по производству ТЭС давно стоят — никто этим безобразием, приравниваемым в отравляющим веществам, давно не пользуется.—Cheops 23:57, 12
- Вы все неправы. ТЭС постоянно производится, а в бензине он работает вместе с соединениями брома и хлора (выносителями) и при сгорании выбрасываются нерастворимые бромиды и хлориды свинца. — Эта реплика добавлена с IP 77.106.231.30 (о)
декабря 2008 (UTC)
- Мне б Ваш оптимизм 🙁 Alexandrov 13:53, 13 декабря 2008 (UTC)
- [1], [2]… Годы идут и как-то так вот дела обстоят… Ural-66 (обс.) 03:37, 29 декабря 2017 (UTC)
- Мне б Ваш оптимизм 🙁 Alexandrov 13:53, 13 декабря 2008 (UTC)
Табличка с названием, символом, номером и пр. имеет цвет фона страницы. Прошу поправить. 93.120.130.208 17:55, 13 апреля 2008 (UTC)
Металл мягкий, легко режется ножом.
Металл достаточно твёрдый, чтобы резаться ножом. Если попытаться разрезать, то нож как минимум затупится. BLaDimir N. 20:02, 21 февраля 2012 (UTC)
- 194.44.181.161 07:11, 10 апреля 2012 (UTC) Звиняйте никак не выучи Вики разметку. Может стоит указать все величины в СИ?
- BLaDimir N. либо у вас нож был пластмассовый либо вы пытались резать не свинец, а его сплав с другими металлами, к примеру с сурьмой (в АКБ и боеприпасах (пулях) в таком виде, к примеру), хотя такой сплав стальным ножом тоже режется без проблем. А что касаемо «…нож затупится…», то от нарезания хлеба он тоже тупится и периодический приходится точить 😉 Ural-66 (обс.) 03:33, 29 декабря 2017 (UTC)
Поглощение гамма-излучения[править код]
В статье никак не объяснен механизм этого свойства. По-видимому, это из-за высокой устойчивости ядер благодаря магическим числам. И вообще, св-во упомянуто вскользь. — Ivan Pozdeev 13:32, 17 мая 2014 (UTC)
- Нет, никакого отношения к магическим числам это свойство не имеет. Просто чем выше заряд ядра, тем эффективнее элемент поглощает гамма-излучение. Например, уран является более эффективным поглотителем, чем свинец. Но свинец — самый дешёвый из тяжёлых элементов, поэтому именно он чаще всего используется как поглотитель гамма- и рентгеновского излучения. —V1adis1av 18:26, 17 мая 2014 (UTC)