AC/DC: что такое полярность тока
Вы знаете, что означают надписи AC (переменный ток) и DC (постоянный ток) на сварочных аппаратах и электродах? По сути эти термины описывают полярность электрического тока, который вырабатывается источником питания и направляется к рабочему изделию через электрод. Выбор правильной полярности для той или иной марки электродов оказывает существенное влияние на прочность и качество соединений – поэтому не забывайте проверить надпись на упаковке! Чтобы лишний раз убедиться, Вы можете сделать две пробные попытки с разной полярностью на краю рабочего изделия.В обиходе используются термины «прямая» и «обратная» полярность или «электрод-отрицательная» и «электрод-положительная» полярность. Последнее звучит более наглядно и поэтому здесь мы будем использовать именно эти обозначения.
Полярность обусловлена тем, что электрический контур имеет отрицательный и положительный полюсы. Постоянный ток (DC) все время движется в одном направлении, из-за чего его полярность всегда одинакова.
Сварщик должен хорошо понимать, что такое полярность и какое влияние она оказывает на процесс сварки. С некоторыми исключениями электрод-положительная (обратная) полярность обеспечивает более глубокое проплавление. Электрод-отрицательная (прямая) полярность имеет более высокую производительность расплавления электрода и, как следствие, производительность наплавки. На это могут влиять химические вещества в покрытии. Электроды из углеродистой стали с покрытием целлюлозного типа, например, Fleetweld 5P или Fleetweld 5P+, обычно рекомендуют использовать с положительной полярностью. Некоторые типы электродов для сварки в среде защитных газов пригодны для сварки с обоими типами полярности.
Применение сварочных аппаратов трансформаторного типа породило необходимость в электродах, пригодных для сварки с любой полярностью из-за постоянных смен направления переменного тока. Хотя переменный ток сам по себе не имеет полярности, если электроды для сварки на переменном токе использовать с постоянным, они покажут более низкие результаты. Поэтому производители электродов обычно указывают наиболее подходящую полярность на покрытии и упаковке электродов.
Хотя переменный ток сам по себе не имеет полярности, если электроды для сварки на переменном токе использовать с постоянным, они покажут более низкие результаты. Поэтому производители электродов обычно указывают наиболее подходящую полярность на покрытии и упаковке электродов.
Чтобы обеспечить необходимое проплавление, однородную форму шва и высокие сварочные характеристики, обязательно нужно использовать подходящую полярность. Неправильная полярность вызовет недостаточное проплавление, непостоянную форму шва, избыточное разбрызгивание, сложности с контролем дуги, перегрев и быстрое сгорание электрода.
На большинстве аппаратов четко обозначены контакты или подробно описано, как их настроить на определенную полярность. Например, некоторые аппараты имеют переключатель полярности, а на других для этого нужно сменить кабельные разъемы. Если Вы не уверены, какая в данный момент используется полярность, есть два несложных способа это выяснить. Первый – это сварка угольным электродом для постоянного тока, который будет нормально работать только при прямой полярности.
Проверка полярности:
А: Определение полярности с помощью угольного электрода
1. Проведите очистку основного металла и расположите его горизонтально.
2. Заострите кончики двух угольных электродов на шлифовальном диске, чтобы они имели одинаковую форму в плавным скосом, начинающимся в 5–7.5 см от кончика электрода.
3. Вставьте один электрод в электрододержатель возле начала скоса.
5. Выберите интересующую Вас полярность.
6. Подожгите дугу (не забывайте о маске) и некоторое время подождите. Увеличьте длину дуги, чтобы было удобнее наблюдать действие дуги.
7. Понаблюдайте за дугой. При электрод-отрицательной (прямой) полярности дуга имеет коническую форму и отличается высокой стабильностью, легкой управляемостью и однородностью.
При электрод-положительной (обратной) полярности дугой достаточно сложно управлять.
 Она будет оставлять черные отложения углерода на основном металле.
Она будет оставлять черные отложения углерода на основном металле.8. Смените полярность. Подожгите дугу вторым электродом и подождите такое же время. Понаблюдайте за дугой.
9. Сравните кончики двух электродов. При прямой полярностью электрод сгорает равномерно, сохраняя свою форму. При обратной полярности электрод быстро сгорает и принимает плоскую форму.
Б. Определение полярности с помощью металлического электрода (E6010)
1. Проведите очистку основного металла и расположите его горизонтально.
2. Настройте силу сварочного тока 130–145 А (для электродов диаметром 4 мм).
3. Выберите одну из полярностей.
4. Подожгите дугу. Начните сварку, соблюдая стандартную длину дуги и угол наклона электрода.
5. Прислушайтесь к звуку дуги. При подходящей полярности, нормальной длине дуги и силе тока, дуга будет издавать равномерный «треск».
Неправильная полярность при нормальной длине дуги и силе тока вызовет нерегулярный «хруст» и «хлопки» и нестабильность дуги.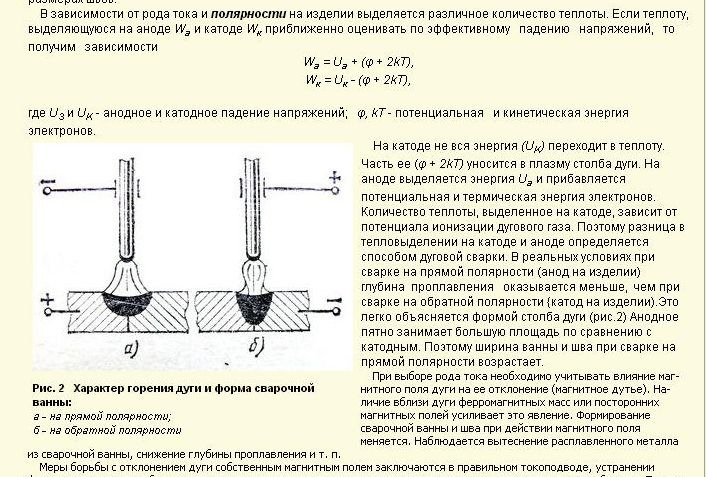 См. выше, как ведет себя дуга и как выглядит шов при использовании металлического электрода с правильной и неправильной полярностью.
См. выше, как ведет себя дуга и как выглядит шов при использовании металлического электрода с правильной и неправильной полярностью.
7. Смените полярность и создайте второй шов.
8. Проведите чистку швов и внимательно их осмотрите. При неправильной, прямой полярности шов будет иметь отрицательные характеристики, перечисленные в Уроке 1.6.
Сварка тонкой стали инвертором — плюс на электрод или минус
Сварка тонкой стали инвертором — плюс на электрод или минусИзобретение такого устройства как сварочный инвертор существенно упростило процесс создания неразъёмного соединения металлов. Теперь варить тонкую сталь стало гораздо проще, ведь можно использовать режим обратной полярности при сварке.
И если раньше тонкий металл то и дело прогорал, то сегодня практически полностью можно избавиться от данной проблемы. Кроме того, режим обратной полярности позволяет уменьшить развитие деформаций, ведь металл не так сильно нагревается в процессе соединения.
Технология сварки тонкой стали инвертором
Однако, как говорится, не одной единой полярностью. При сварке тонкого металла инвертором нужно придерживаться следующих рекомендаций, только в таком случае удастся избежать прожогов металла толщиной в несколько миллиметров.
Рекомендации по сварке тонкого металла заключаются в следующем:
- Нужно стараться как можно быстрее перемещать электрод, и только один раз. Для этого электрод проводится вдоль будущего соединения без каких-либо задержек, достаточно быстро, чтобы сварочная дуга не успела сильно проплавить тонкий металл и прожечь его тем самым.
- Сварочный ток нужно снизить до минимума. Если варить тонкую сталь слишком большим током, то прожоги будут появляться часто. Для примерного подсчёта сварочного тока, нужно знать, что на 1 мм электрода необходимо около 25-30 ампер сварочного тока. При необходимости данное значение следует уменьшить до предельно возможного, такого, чтобы электрод не прилипал к металлу.

- Варить нужно по возможности только аппаратом с плавной регулировкой силы тока. Важно чтобы аппарат для сварки имел бы напряжение холостого хода не менее чем 70 вольт.
- Если и после этого, тонкий металл все равно деформируется при сварке, то нужно предусмотреть все возможности его быстрого охлаждения. Нужно использовать подкладки или давать время на остывание металла. Чтобы избежать деформаций, следует ставить прихватки и только после этого наваривать основной шов.
- Для сварки тонкого металла необходимо применять электроды 1,6-2 мм диаметром. Сварочный ток для работы с такими электродами нужен небольшой, примерно 40-60 ампер.
Теперь что касается непосредственной работы с самим сварочным инвертором. Как было упомянуто выше, инвертор выдаёт постоянный ток, а значит, есть плюс и минус. Так вот, если подключать держак к плюсу или минусу, то мы получим обратную или же прямую полярность при сварке металлов.
Сварка тонкой стали инвертором — плюс на электрод или минус
Варить тонкую сталь инвертором рекомендуется на обратной полярности.
Что дает обратная полярность? Всё просто, поскольку основная концентрация температуры приходится не на свариваемый металл, а на кончик электрода. Сварка на обратной полярности дает возможность не прожигать тонкостенный металл, а также, не допустить появление деформаций при сваривании.
что это такое, как их определить и запомнить
Среди терминов в электрике встречаются такие понятия как анод и катод. Это касается источников питания, гальваники, химии и физики. Термин встречается также в вакуумной и полупроводниковой электронике. Им обозначают выводы или контакты устройств и каким электрическим знаком они обладают. В этой статье мы расскажем, что это такое анод и катод, а также как определить где они находятся в электролизере, диоде и у батарейки, что из них плюс, а что минус.
Электрохимия и гальваника
В электрохимии есть два основных раздела:
- Гальванические элементы – производство электричества за счет химической реакции. К таким элементам относятся батарейки и аккумуляторы. Их часто называют химическими источниками тока.
- Электролиз – воздействие на химическую реакцию электроэнергией, простыми словами – с помощью источника питания запускается какая-то реакция.
Рассмотрим окислительно-восстановительную реакцию в гальваническом элементе, тогда какие процессы протекают на его электродах?
- Анод – электрод на котором наблюдается окислительная реакция, то есть он отдаёт электроны. Электрод, на котором происходит окислительная реакция – называется
- Катод – электрод на котором протекает восстановительная реакция, то есть он принимает электроны. Электрод, на котором происходит восстановительная реакция – называется окислителем.

Отсюда возникает вопрос – где плюс, а где минус у батарейки? Исходя из определения, у гальванического элемента анод отдаёт электроны.
Важно! В ГОСТ 15596-82 дано официальное определение названий выводов химических источников тока, если кратко, то плюс на катоде, а минус на аноде.
В данном случае рассматривается протекание электрического тока по проводнику внешней цепи от окислителя (катода) к восстановителю (аноду). Так как электроны в цепи текут от минуса к плюсу, а электрический ток наоборот, тогда катод – это плюс, а анод – это минус.
Внимание: ток всегда втекает в анод!
Или то же самое на схеме:
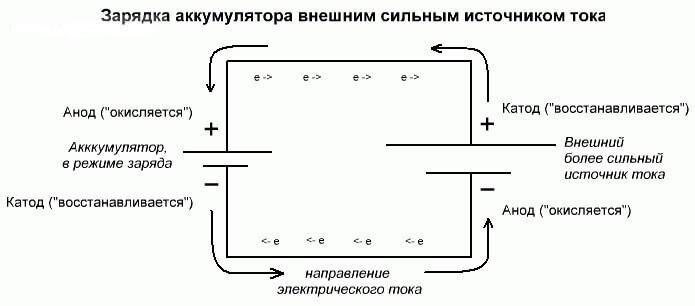
Процесс электролиза или зарядки аккумулятора
Эти процессы похожи и обратны гальваническому элементу, поскольку здесь не энергия поступает за счет химической реакции, а наоборот – химическая реакция происходит за счет внешнего источника электричества.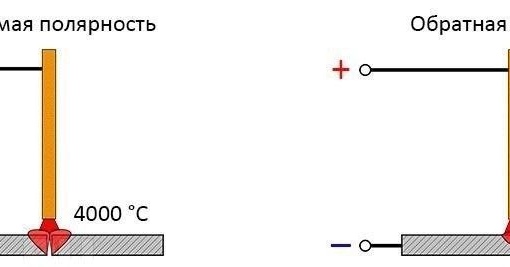
В этом случае плюс источника питания всё также называется катодом, а минус анодом. Зато контакты заряжаемого гальванического элемента или электроды электролизера уже будут носить противоположные названия, давайте разберемся почему!
Важно! При разряде гальванического элемента анод – минус, катод – плюс, при зарядке наоборот.
Так как ток от плюсового вывода источника питания поступает на плюсовой вывод аккумулятора – последний уже не может быть катодом. Ссылаясь на вышесказанное можно сделать вывод, что в этом случае электроды аккумулятора при зарядке условно меняются местами.
Тогда через электрод заряжаемого гальванического элемента, в который втекает электрический ток, называют анодом. Получается, что при зарядке у аккумулятора плюс становится анодом, а минус катодом.
Гальванотехника
Процессы осаждения металлов в результате химической реакции под воздействием электрического тока (при электролизе) называют гальванотехникой.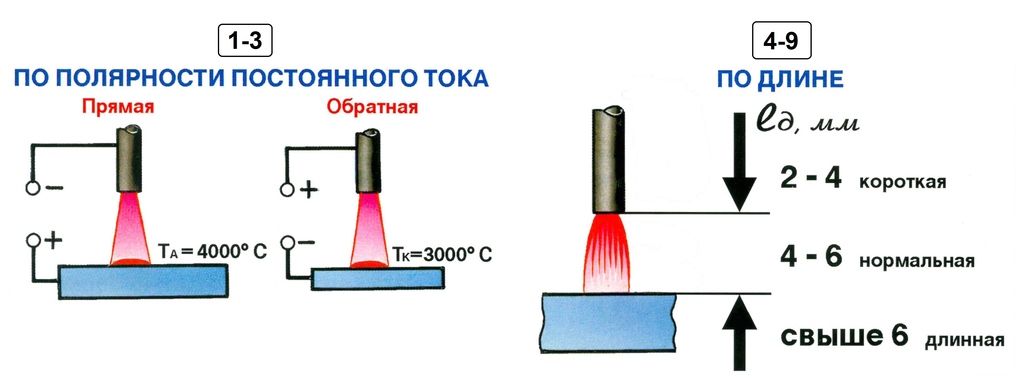 Таким образом мир получил посеребренные, золоченные, хромированные или покрытые другими металлами украшения и детали. Этот процесс используют как в декоративных, так и в прикладных целях – для улучшения стойкости к коррозии различных узлов и агрегатов механизмов.
Таким образом мир получил посеребренные, золоченные, хромированные или покрытые другими металлами украшения и детали. Этот процесс используют как в декоративных, так и в прикладных целях – для улучшения стойкости к коррозии различных узлов и агрегатов механизмов.
Принцип действия установок для нанесения гальванического покрытия лежит в использовании растворов солей элементов, которыми будут покрывать деталь, в качестве электролита.
В гальванике анод также является электродом, к которому подключаются плюсовой вывод источника питания, соответственно катод в этом случае – это минус. При этом металл осаждается (восстанавливается) на минусовом электроде (реакция восстановления). То есть если вы хотите сделать позолоченное кольцо своими руками – подключите к нему минусовой вывод блока питания и поместите в ёмкость с соответствующим раствором.
В электронике
Электроды или ножки полупроводниковых и вакуумных электронных приборов тоже часто называют анодом и катодом.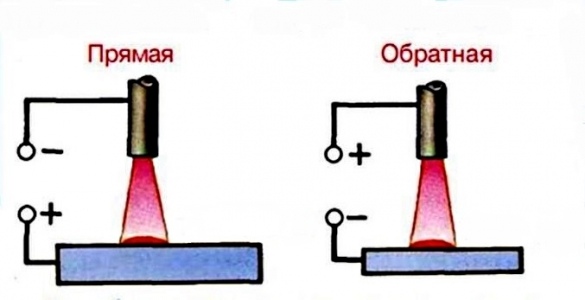 Рассмотрим условное графическое обозначение полупроводникового диода на схеме:
Рассмотрим условное графическое обозначение полупроводникового диода на схеме:
Как мы видим, анод у диода подключается к плюсу батареи. Он так называется по той же причине – в этот вывод у диода в любом случае втекает ток. На реальном элементе на катоде есть маркировка в виде полосы или точки.
У светодиода аналогично. На 5 мм светодиодах внутренности видны через колбу. Та половина, что больше — это катод.
Также обстоит ситуация и с тиристором, назначение выводов и «однополярное» применение этих трёхногих компонентов делают его управляемым диодом:
У вакуумного диода анод тоже подключается к плюсу, а катод к минусу, что изображено на схеме ниже. Хотя при приложении обратного напряжения – названия этих элементов не изменятся, несмотря на протекание электрического тока в обратном направлении, пусть и незначительного.
С пассивными элементами, такими как конденсаторы и резисторы дело обстоит иначе. У резистора не выделяют отдельно катод и анод, ток в нём может протекать в любом направлении.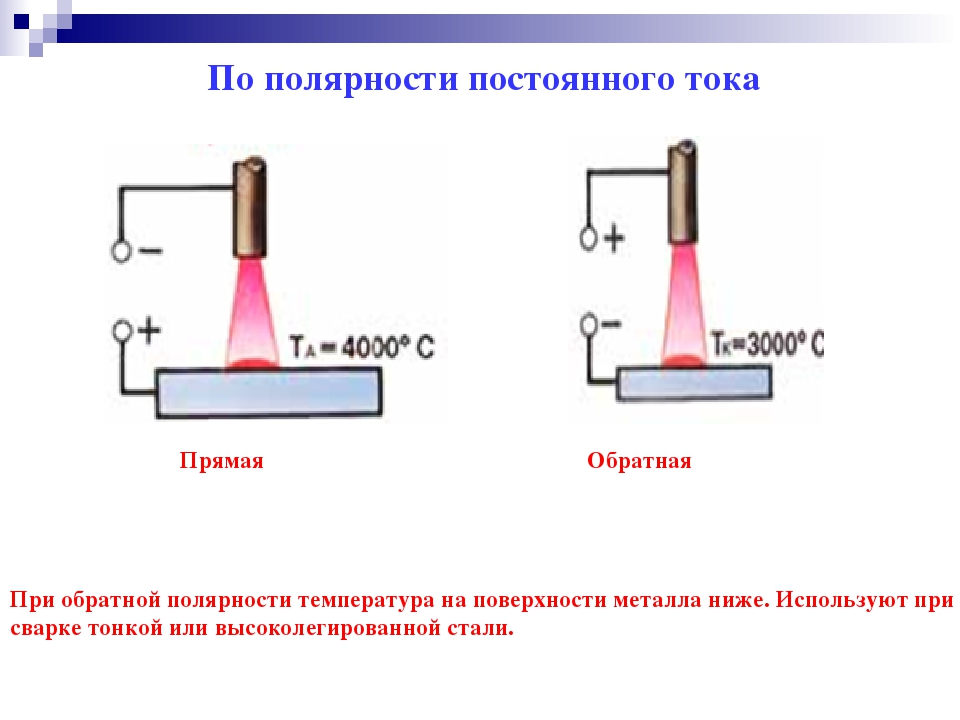 Вы можете дать любые названия его выводам, в зависимости от ситуации и рассматриваемой схемы. У обычных неполярных конденсаторов также. Реже такое разделение по названиям контактов наблюдается в электролитических конденсаторах.
Вы можете дать любые названия его выводам, в зависимости от ситуации и рассматриваемой схемы. У обычных неполярных конденсаторов также. Реже такое разделение по названиям контактов наблюдается в электролитических конденсаторах.
Заключение
Итак, подведем итоги, ответив на вопрос: как запомнить где плюс, где минус у катода с анодом? Есть удобное мнемоническое правило для электролиза, заряда аккумуляторов, гальваники и полупроводниковых приборов. У этих слов с аналогичными названиями одинаковое количество букв, что проиллюстрировано ниже:
Во всех перечисленных случаях ток вытекает из катода, а втекает в анод.
Пусть вас не собьёт с толку путаница: «почему у аккумулятора катод положительный, а когда его заряжают – он становится отрицательным?». Помните у всех элементов электроники, а также электролизеров и в гальванике – в общем у всех потребителей энергии анодом называют вывод, подключаемый к плюсу. На этом отличия заканчиваются, теперь вам проще разобраться что плюс, что минус между выводами элементов и устройств.
Напоследок рекомендуем просмотреть полезное видео по теме статьи:
Теперь вы знаете, что такое анод и катод, а также как запомнить их достаточно быстро. Надеемся, предоставленная информация была для вас полезной и интересной!
Материалы по теме:
Почему прилипают электроды при сварке инвертором
Содержание
Причины залипания электрода при сварке инвертором:
Существует несколько причин почему электрод может прилипать во время сварки. Рассмотрим основные из них.
1. Отсыревшие электроды
Сварочный электрод состоит из металлического стержня и обмазки, которая подвержена воздействию влаги. Соответственно, при хранении без должной упаковки или в местах с повышенной влажностью электроды отсыревают и теряют свои качественные характеристики, что в конечном итоге приводит к залипанию.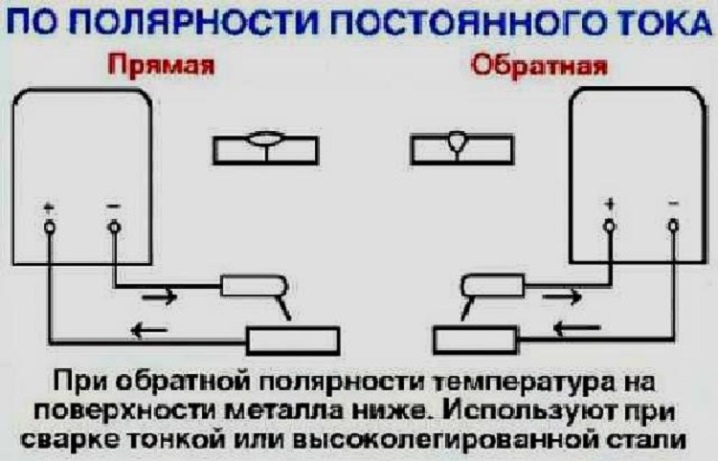
2. Неправильный выбор электрода
Неправильный выбор электрода также приводит к залипанию. Сварочные электроды разделяются по типу покрытий. У каждого типа своя область применения и преимущества. Некоторые электроды работают только на постоянном токе, другие работают как на переменном, так и на постоянном. Также обязательно проследите на какой полярности они сваривают и какая стоит на аппарате (электрод на «плюс» или на «минус»).
Выбор толстого стержня для сварки тонких листов также может вызвать проблемы с прилипанием электрода. В таких случаях как правило снижают силу тока, опасаясь прожечь тонкий металл и занижают минимальный предел силы тока для нормального горения данного электрода.
3. Некачественные электроды
Использование электродов низкого качества также приводит к залипанию. Данный дефект исправить невозможно, поэтому при покупке расходного материала уделите особое внимание выбору производителя.
Сейчас на рынке сварочных материалов представлен широкий ассортимент электродов различной ценовой категории от разных производителей. Но не стоит гнаться за дешевизной или громким брендом. Главный критерий при выборе сварочных материалов — наличие необходимой документации на эти материалы. Если вы покупаете электроды для сварки высокоответственных конструкций, то обязательно проверяйте их на соответствие ГОСТу и наличие сертификатов НАКС. К примеру, электроды GOODEL-ОК46 с рутилово-целлюлозным покрытием для сварки ответственных конструкций из низкоуглеродистых сталей, сертифицированы в системе ГОСТ Р, аттестованы в системе НАКС и имеют Одобрение Российского Речного Регистра, а УОНИ-13/55 с основным покрытием сертифицированы в ГОСТ Р, НАКС (КСМ), РРР и ИНТЕРГАЗСЕРТ.
4. Низкий сварочный ток
Настройка сварочного тока напрямую зависит от толщины свариваемого металла, диаметра электрода и положения сварки. То есть, если ток низкий, его силы достаточно, чтобы расплавить кончик электрода, но недостаточно для зажигания дуги. Следовательно, перед началом сварочных работ необходимо оценить толщину свариваемого металла, подобрать электроды соответствующего диаметра и выставить необходимые значения тока. Как правило, производители указывают диапазон рекомендуемых значений сварочного тока на упаковке с электродами.
Следовательно, перед началом сварочных работ необходимо оценить толщину свариваемого металла, подобрать электроды соответствующего диаметра и выставить необходимые значения тока. Как правило, производители указывают диапазон рекомендуемых значений сварочного тока на упаковке с электродами.
5. Неверный способ поджигания дуги
Неверная техника поджига дуги также приводит к залипанию. Начинающие сварщики во время работы зачастую постукивают кончиком электрода по свариваемой поверхности, что приводит к короткому замыканию с моментальным нагревом металла, в результате которого и происходит залипание.
6. Короткая дуга
Длина дуги — не что иное, как расстояние между кончиком электрода и поверхностью свариваемого металла. Если поднести электрод слишком близко к заготовке, то он приклеится к металлу. Точно так же, если вы отведете электрод слишком далеко, ваша дуга погаснет. Поэтому, чрезвычайно важно поддерживать оптимальную длину дуги.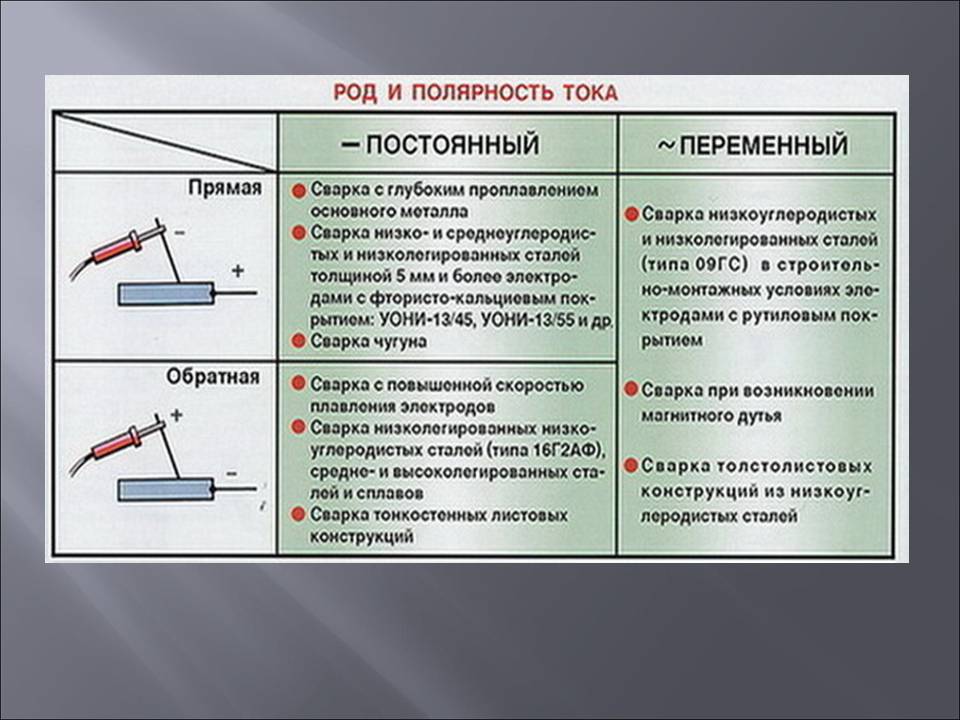
7. Плохо очищенная металлическая поверхность
Если поверхность свариваемого металла ржавая или грязная, зажигать дугу становится сложно. Во время работ дуга может начать гаснуть, а с электрода начнет отпадать обмазка. Дальнейшие действия приведут к залипанию кончика стержня.
Советы по предотвращению прилипания сварочного электрода к металлу:
Мы обсудили причины, по которым происходит залипание электрода при сварке. Теперь поговорим о том, как этого не допустить.
1. Выбирайте соответствующие настройки
Убедитесь, что параметры силы тока соответствуют используемым электродам и толщине металла. Если электрод толстый, для его плавления требуется более высокий ток. Поэтому идеальные настройки силы тока должны определяться типом электрода и характером сварного шва.
2. Держите электрод и поверхность в чистоте
Перед началом работ убедитесь, что электроды не повреждены и не заржавели. Попробуйте стереть обмазку со стержня пальцами. Если он легко падает на стержень, то качество электрода плохое, соответственно есть риск залипания.
Попробуйте стереть обмазку со стержня пальцами. Если он легко падает на стержень, то качество электрода плохое, соответственно есть риск залипания.
Не забудьте перед сваркой удалить с поверхности металла ржавчину, влагу, масло и другие загрязнения.
3. Следуйте правильной технике зажигания дуги
Оптимальным способом зажигания дуги принято считать метод «чирканья». Суть в том, чтобы вести электрод как спичку по коробку. При этом рабочий элемент старайтесь держать перпендикулярно заготовке. После того как дуга разгорелась, следует наклонить электрод назад под углом в 15 градусов и вести шов по намеченной линии.
4. Используйте соответствующую длину дуги
Как только удалось стабилизировать дугу, постарайтесь поддерживать соответствующее расстояние между концом стержня и основным металлом. Старайтесь держать электрод на небольшом расстоянии, но не касаться металла. Кроме того, не увеличивайте длину дуги слишком сильно, так как это приведет к разбрызгиванию металла.
Кроме того, не увеличивайте длину дуги слишком сильно, так как это приведет к разбрызгиванию металла.
5. Храните электроды в сухом месте
Как говорилось выше, на срок службы электродов влияет не только качество, но и грамотное их хранение. Для предотвращения загрязнения и отсыревания храните электроды в сухом, чистом месте с относительно постоянной температурой.
Если влага все-таки попала поверхность электрода, то необходима тщательная просушка или прокалка в соответствии с рекомендациями, указанными на упаковке.
Вывод
Правильно подбирайте диаметр электрода и силу тока в зависимости от толщины свариваемого металла. Зачищайте соединяемые поверхности. Соблюдайте условия хранения и прокалки. Используйте для поджига метод «чирканья» и держите оптимальную длину дуги.
Не экономьте при покупке сварочного аппарата. Идеальным вариантом станет оборудование с дополнительными функциями «Hot start» и «AntiStick». «Горячий старт» обеспечит увеличение сварочного тока в момент поджига дуги, а «Антизалипание» автоматически снижает ток при залипании. Но помните, инвертор с данными функциями позволит избежать большинства причин залипания, но не сможет полностью исключить его. А о том как выбрать электроды для сварки читайте здесь.
Идеальным вариантом станет оборудование с дополнительными функциями «Hot start» и «AntiStick». «Горячий старт» обеспечит увеличение сварочного тока в момент поджига дуги, а «Антизалипание» автоматически снижает ток при залипании. Но помните, инвертор с данными функциями позволит избежать большинства причин залипания, но не сможет полностью исключить его. А о том как выбрать электроды для сварки читайте здесь.
Плюс и минус на сварке. Прямая и обратная полярность. Сварка током обратной полярности.
Чтобы ответить на вопрос зачем менять полярность при сварке электродами , для начала нужно разобраться какие виды полярности бывают, как и в каких случаях их использовать.
Сварка электрической дугой может осуществляться на оборудовании которое вырабатывает или постоянный , или переменный ток .
Электрическая дуга зажигается искровым генератором между электродом и деталью. Электрод представляет собой только клемму одного из полюсов и не добавляется в плавильный пул. Следовательно, используются электроды с высокой температурой плавления и высокой эмиссией. Для пайки стали, меди, никеля, титана и т.д. постоянный ток с прямой полярностью используется при нагреве электрода за вычетом обратной полярности. Алюминий и его сплавы обычно свариваются с переменным током. Переменный ток дает дугу, которая очищает пластину в положительном цикле, что позволяет легко течь.
Следовательно, используются электроды с высокой температурой плавления и высокой эмиссией. Для пайки стали, меди, никеля, титана и т.д. постоянный ток с прямой полярностью используется при нагреве электрода за вычетом обратной полярности. Алюминий и его сплавы обычно свариваются с переменным током. Переменный ток дает дугу, которая очищает пластину в положительном цикле, что позволяет легко течь.
При работе на переменном токе не имеет значения куда подключать «плюс», «минус», так как при сварке на постоянном токе подключение имеет большое значение . Можно сказать, что полярность при сварке – это основа качества сварки. Полярность обеспечивает качество сварки материала. При сварке постоянным током, сварочная дуга бывает прямой или обратной полярности.
При всем этом управлении вы можете добиться чрезвычайно стойких сварных швов с наивысшим качеством отделки. Преимущества Отличная сварочная сварочная обработка Обработка сварных швов с меньшим количеством сварных швов Низкая чувствительность к межкристаллитной коррозии Без всплесков Может быть автоматизирована Стоимость оборудования очень разумная Расходные материалы и аксессуары, легко доступные на рынке.
Ограничения Трудность использования при наличии воздушного потока Недостаточная для сварки пластин более 6 мм, для которых мы имеем другие более эффективные процессы. Низкая производительность из-за низкой скорости осаждения материала Процесс зависит от способности сварщика, когда он не автоматизирован.
При прямой полярности «плюс» подключается к соединяемым заготовкам (массе), соответственно «минус» подключается на держатель электрода ; при обратной полярности «плюс» подключается на электрод, «минус» подключается на деталь. Менять полярность нужно в зависимости от того какую задачу сварки нужно выполнить. На «плюсе» тепла выделяется больше, чем на «минусе».
Если вы смотрите прямо на сварочную дугу, даже на короткое время, это может привести к ожогам вашей роговицы, которая чрезвычайно чувствительна к ярким светорам, например, непосредственно глядя на солнечный свет, снег, яркие отражения и т.д. технически излучение дуги вызывает воспаление в роговице, вызванное.
Избыток ультрафиолетовых лучей, генерируемых сваркой, который, как известно офтальмологам, называется «Излучение дуги». Один из наиболее распространенных симптомов, указывающих на то, что вы «сожгли» свою роговицу, — это ощущение, что кто-то «тыкает» ваши глаза ночью. Использование «сварочной маски» является обязательным и необязательным. Во время сварки с прохожими рекомендуется использовать занавеску и не забывайте предупреждать окружающих, особенно детей и даже мелких животных, таких как кошки и собаки, поскольку они также могут пострадать.
Прямая полярность используется при сварке цветных металлов (медь , латунь, алюминий), так как они имеют большую теплопроводность, в итоге получаем большую температуру в месте нагрева, что позволяет превысить температуру плавления цветного метала, особенно это важно для алюминия , так как сначала надо одолеть оксидную пленку. У нее температура плавления существенно выше в сравнении с самим металлом.
Пример защиты шторного типа в секции сварки. Выделенные пары связаны с типом свариваемого материала, силой тока, способностью сварщика, очисткой листа, сваркой, вентиляцией участка и т.д. существуют типы материалов, которые могут генерировать чрезвычайно ядовитые газы, например, при цинковой сварке, и очень важно, чтобы сварщик знал переменные объекта и предотвращал загрязнение. Все это кумулятивно, и сварочные отделы должны иметь хорошую вентиляцию или даже выхлопные газы. Никогда не сваривайте в помещении, как внутри гаража.
Выделенные пары связаны с типом свариваемого материала, силой тока, способностью сварщика, очисткой листа, сваркой, вентиляцией участка и т.д. существуют типы материалов, которые могут генерировать чрезвычайно ядовитые газы, например, при цинковой сварке, и очень важно, чтобы сварщик знал переменные объекта и предотвращал загрязнение. Все это кумулятивно, и сварочные отделы должны иметь хорошую вентиляцию или даже выхлопные газы. Никогда не сваривайте в помещении, как внутри гаража.
Сварочный свет производит большое количество ультрафиолетовых лучей и может вызвать ожоги, как если бы вы были подвержены воздействию солнца. Также важно защищать лицо, руки, руки, ноги. Поскольку сварка часто «размахивает» небольшими кусками раскаленного металла, наиболее заметными являются «царапины».
На прямой полярности так же лучше работать с большими, массивными деталями. При прямой полярности получается более сконцентрированная и узкая электрическая дуга, следовательно металл проплавляется глубже, шов получается более качественный, что происходит благодаря тому, что направление движение электронов постоянное и при сварке не происходит большого разбрызгивания расплавленного металла. Также при использовании прямой полярности можно производить резку металла независимо какой тип электрода используется.
Также при использовании прямой полярности можно производить резку металла независимо какой тип электрода используется.
Обычно встречаются в мастерских и отраслях. Не говоря уже о легковоспламеняющихся растворителях и красках. Поэтому перед началом сварки. Помните, что пенные или водные огнетушители не рекомендуются по понятным причинам: электричество сварочных машин и их установок. Это факт, что многое уже сожжено, пытаясь освободить тюлени огнетушителей.
Офисы и отрасли промышленности часто являются шумными местами, и использование демпферов в соответствии с состоянием местоположения имеет важное значение. Но если у вас более одного. Он используется для сварки стали. Только паяльная машина не может быть шумной. нержавеющая сталь.
Обратная полярность используется при сварке высоколегированых сталей , тонколистовых металлов, нержавейки , так как температура для их сварки нужна небольшая. Недостатком подключения обратной полярности есть то, что электрическая дуга «гуляет», соответственно шов получается менее герметичным и красивым, но при таком подключении почти полностью исключается возможность прожечь свариваемый материал.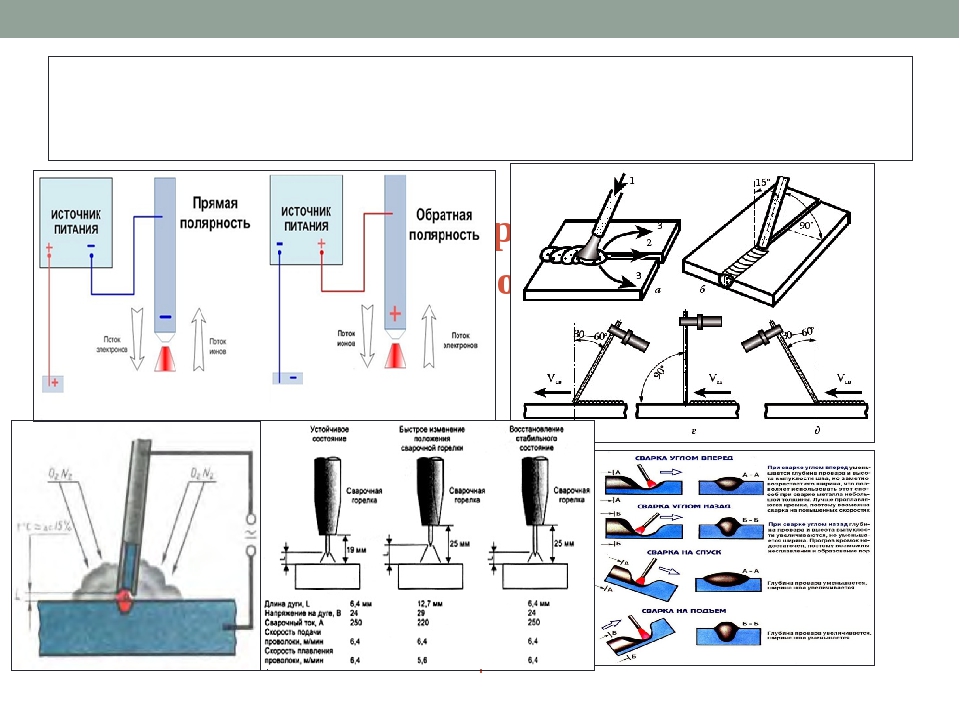
Этот вариант идеально подходит для сварки цветных материалов. При таком типе сварки электрод будет чередоваться между положительным и отрицательным. углеродистой стали. Элемент панели управления слева направо: разъем факела Газовый разъем Гнездовой разъем горелки Отрицательный зажимной разъем.
Это разъемы, которые соединяют факел с оборудованием. Один для газа и один для запуска триггера. На передней части устройства. Разъем триггера газового разъема. Где все соединения будут подключены. Мы имеем слева направо. Время для сборки электрода. Электрод. Мы первоначально разместим диффузор на факеле диффузора.
Следовательно менять полярность нужно в зависимости от того , какую задачу сварки необходимо выполнить и верно выбранный вид полярности подключения электродов способствует тому, что качество шва будет выше, а процесс сварки станет намного проще.
Качественное сварное соединение, при работе с аппаратами постоянного тока, во многом зависит от их настроек.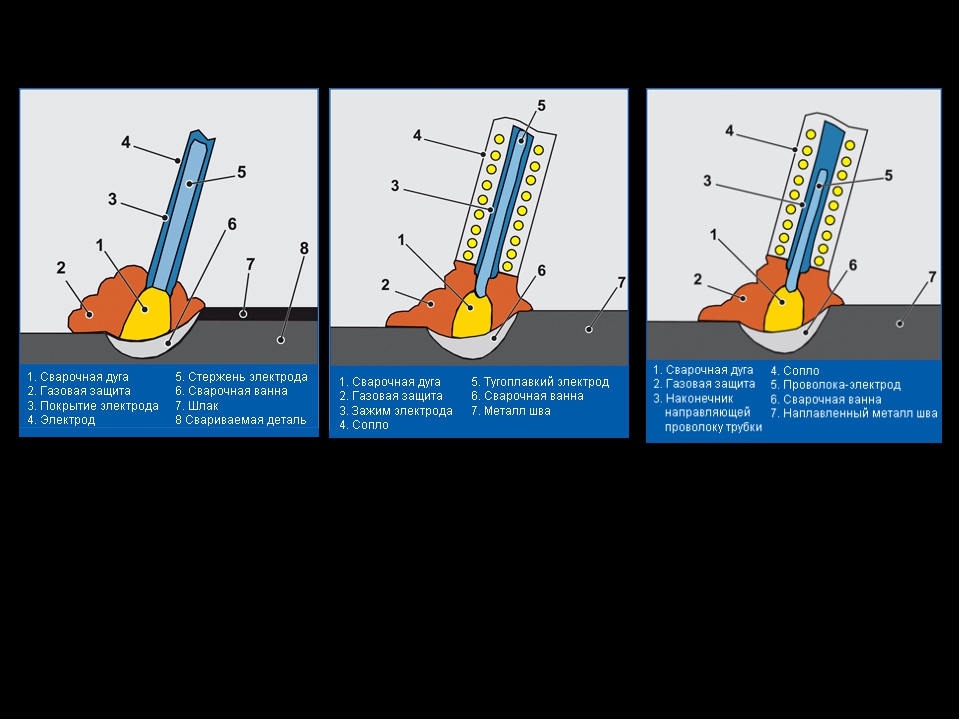 Даже самый простой инвертор имеет не только настройки силы тока, но и полярности. Чаще всего, по умолчанию установлена прямая полярность при сварке и вы можете годами работать со своим инвертором, не зная всех его возможностей. Если у вас возникла необходимость сварить высоколегированную сталь или не получается добиться качественного шва, то знание всех тонкостей настроек вам просто необходимы. О том, какая бывает полярность и как она влияет на сварочные работы мы и поговорим.
Даже самый простой инвертор имеет не только настройки силы тока, но и полярности. Чаще всего, по умолчанию установлена прямая полярность при сварке и вы можете годами работать со своим инвертором, не зная всех его возможностей. Если у вас возникла необходимость сварить высоколегированную сталь или не получается добиться качественного шва, то знание всех тонкостей настроек вам просто необходимы. О том, какая бывает полярность и как она влияет на сварочные работы мы и поговорим.
Он будет заправлен в факел. на дне его. Затяните плотно. Соблюдайте небольшой крутящий момент с помощью двух плоскогубцев. Но чтобы сломать меня, чтобы подтянуть, давайте поместим верх факела. Пропустите сопло сопла. Это должно быть хорошо утечка. Что может привести к загрязнению во время сварки. Который должен быть в хорошем состоянии. Чтобы предотвратить утечку в факеле.
Теперь пришло время установить вилку, чтобы наблюдать, что рядом с винтовой резьбой вилки. Таким образом, именно в этот момент мы регулируем «сколько» вольфрамового электрода.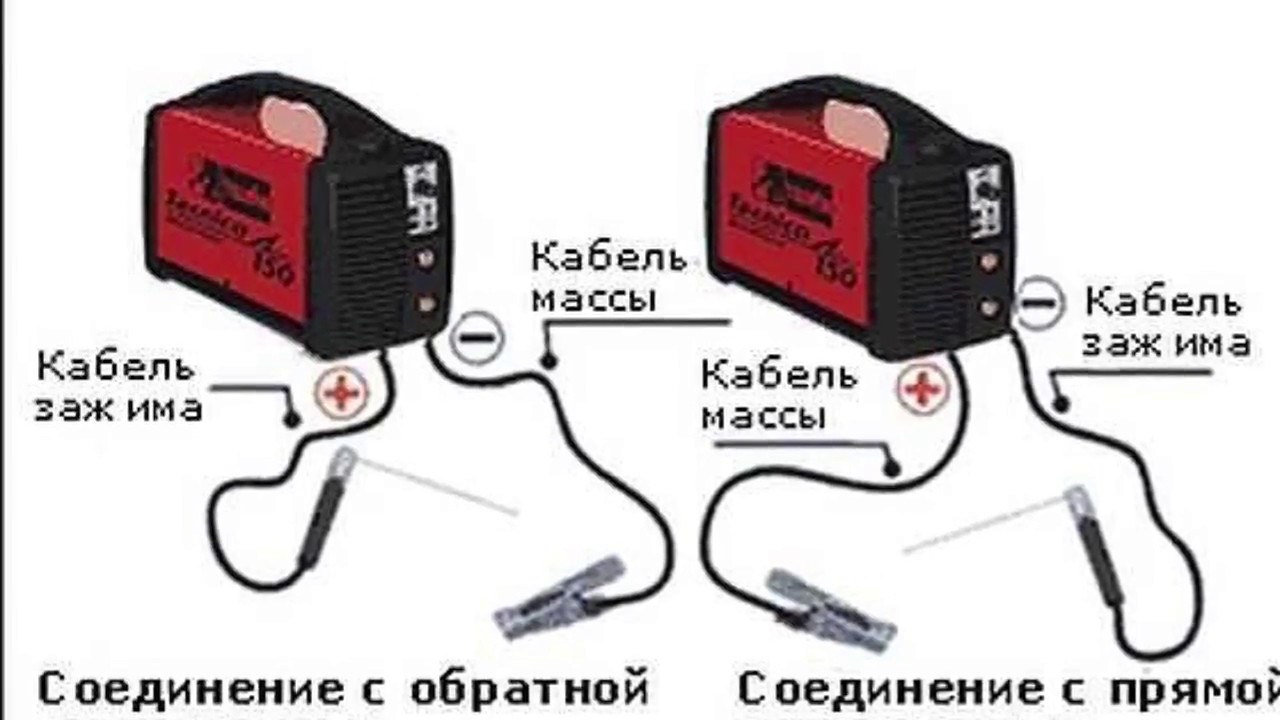 Теперь мы с факелом, смонтированным и готовым к использованию. Подсоединение отрицательного когтя теперь позволяет установить отрицательный коготь.
Теперь мы с факелом, смонтированным и готовым к использованию. Подсоединение отрицательного когтя теперь позволяет установить отрицательный коготь.
Сварка постоянным током подразумевает наличие гнезда, для подключения к «+» и «–» сварочного аппарата. В зависимости от того, куда подключена масса, а куда электрод и различают полярность.
- Прямая полярность – схема подключения, при которой к плюсовому гнезду присоединяется масса, а к минусу – электрод. При этом род и полярность тока обуславливает существование анодного и катодного пятен. При таком подключении анодное(более горячее) образуется на стороне заготовки.
- Обратная полярность – масса присоединена к минусу, а электрод к плюсу. На обратной полярности при сварке постоянным током анодное пятно с более высокой температурой, образуется на противоположной стороне, то есть — электроде.
Обратите внимание! Сварка переменным током подразумевает самостоятельное изменение полярности до сотни раз в секунду, поэтому в таких случаях соблюдать схему подключения не имеет смысла.
Разъем прост и функциональен, он остается подключенным к «положительному» выходу оборудования. Вставлен в разъем. Поверните по часовой стрелке, чтобы заблокировать его. Но он очень прост. Он имеет определенную позицию для соответствия. Установка аргонового регулятора на цилиндр.
И затяните зажим. Используется при этой сварке. Конечный результат близок к окончательному результату. Из 5 мм каждый на отопление. То есть: мы сделаем металлы собраны вместе без добавления материала, в котором мы используем 85 ампер мощности в этом сварном шве. Мы должны сварить две части стали.
Чем обусловлен выбор полярности
Изменяя тип подключения, можно сконцентрировать нагрев или на свариваемой детали или на электроде (перемещая анодное пятно). За нагрев отвечает плюсовое гнездо, поэтому при прямом подключении, когда плюс присоединен к металлу наблюдается больший нагрев сварного соединения, а при обратной полярности больше греется электрод.
Уже появляется нагретый сварной шов, завершающий результат.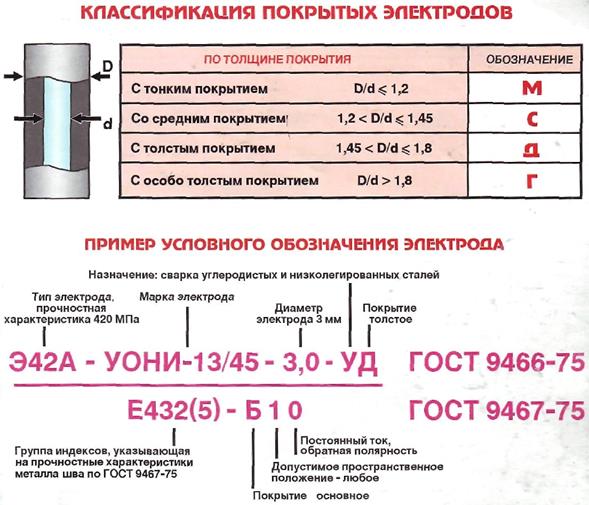 Давайте намотаем две части трубки из нержавеющей стали. Из 3 мм начальной стены. Завершая окончательный результат, мы сварим две части трубки из нержавеющей стали. стены 3 мм. Они защищены от атмосферного загрязнения инертным газом. Этот процесс в основном относится к производству ультрачистых металлов. С минимальным плавлением и электроэрозией. Обычно при сварке алюминия. Увеличьте срок службы электрода. Иридий и церий. Вольфрамовый электрод.
Давайте намотаем две части трубки из нержавеющей стали. Из 3 мм начальной стены. Завершая окончательный результат, мы сварим две части трубки из нержавеющей стали. стены 3 мм. Они защищены от атмосферного загрязнения инертным газом. Этот процесс в основном относится к производству ультрачистых металлов. С минимальным плавлением и электроэрозией. Обычно при сварке алюминия. Увеличьте срок службы электрода. Иридий и церий. Вольфрамовый электрод.
Лантан. сварочная дуга. торий. Добавление этих компонентов вольфрамовый электрод обычно осуществляется в пропорциях от 1% до 4%. Является стержнем из вольфрамового металла. Электрода и сварочной ванны. Обычно используются оксиды металлов: цирконий. И быть отличным проводником электронов. повышенная стабильность дуги. Они производятся металлургическим процессом самого высокого уровня. Называется «спекание». И признается за его эффективные преимущества. Его температура плавления. Обычно аргон. Все эти оксиды увеличивают простоту открытия дуги.
Благодаря этой особенности мы можем выбирать схему подключения исходя из:
- Толщины металла. Если мы свариваем толстые детали или средней толщины, то подойдет прямое подключение, при котором тепло, сконцентрированное на изделии поможет получить более глубокий шов и качественный провар. Также этот вид подключения подходит для отрезания металлов различной толщины. Тонкие металлы лучше всего сваривать при обратной полярности, концентрируя большую часть тепла на электроде. Таким образом деталь не будет поддаваться перегреву, а сам электрод будет плавиться быстрей.
- Типа металла. Возможность изменять локализацию теплового пятна помогает подобрать наиболее эффективные схемы работы для различных металлов. К примеру, если мы варим нержавеющие стали или чугун, то необходимо обратное подключение, помогающее избежать перегрева сплава и формирования тугоплавких соединений. Для алюминия необходимо прямое подключение иначе пробиться через окислы будет очень сложно.
 Перед началом работ внимательно изучите рекомендации по настройки аппарата к конкретному сплаву.
Перед началом работ внимательно изучите рекомендации по настройки аппарата к конкретному сплаву. - Типа электрода или проволоки. Как и металлы, электроды имеют свои особенности температурных режимов, в большей степени связанных с типом флюса. К примеру, для работы с угольными электродами нельзя использовать обратную полярность иначе флюс перегреется и электрод придет в негодность. Чтобы подобрать настройку, подходящую для вашего электрода смотрите на тип проволоки и флюса или воспользуйтесь рекомендациями производителя. Говоря о проволоках для полуавтоматов, то они тоже имеют рекомендации, относительно подключения минуса и плюса аппарата.
Теперь вы знаете, что может повлиять на настройки подключения. Бывают случаи, когда металл требует одних, а электрод совсем других настроек. В таких случаях следует искать компромиссы, подстраивая силу тока и рабочие циклы.
Ториум используется в течение многих лет. Цирконий используется с переменным током. Обычно содержит небольшое количество других оксидов металлов. Газ «Гелий» также является вариантом. а также возможность разумно обрабатывать подавляющее большинство сварочных работ. и для стоимости.
Газ «Гелий» также является вариантом. а также возможность разумно обрабатывать подавляющее большинство сварочных работ. и для стоимости.
В Бразилии. Тем самым позволяя вам рассчитать, сколько газа вы потратили или все еще имеете внутри цилиндра. Частичное или полное воспроизведение запрещено, за пределами Системы, без прямого разрешения вашего регионального отдела. Электрод и бассейн расплава защищены газообразной атмосферой, состоящей из инертного газа, то есть газа, который не реагирует с другими материалами, или смеси инертных газов, обычно аргона или гелия. В зависимости от применения припоя можно добавлять материал в расплав; В этом случае материал должен быть совместим с основным металлом. Это процесс, подходящий практически для всех металлов, в частности титановых, циркониевых, алюминиевых и магниевых сплавов, легированных сталей, нержавеющих сталей, никелевых сплавов и специальных сплавов. Это широко используемый процесс сварки труб в аэрокосмической и атомной промышленности и ремонтных работах из-за простоты в управлении процессом и возможности использования дополнительного материала. Преимущества Этот процесс имеет преимущество высококачественных сварных швов, отсутствие шлака и брызг и может использоваться во всех положениях и типах соединений. Кроме того, вольфрам называется термоэлектронным, поскольку легко излучать электроны, что значительно облегчает стабильность дуги; вольфрам может быть чистым или с циркониевыми или ториевыми сплавами. Чистые вольфрамовые электроды имеют преимущество в снижении стоимости и меньшем измельчении при использовании переменного тока. С другой стороны, недостатки — это трудность открытия арки и более низкая долговечность. Химический состав электрода. Химические элементы, добавленные к электроду, важны для обеспечения лучшей производительности процесса сварки. Электроды с добавлением диоксида циркония или титана обладают такими преимуществами, как повышенная долговечность, более высокая прочность с более высокими потенциями и лучшими свойствами воспламенения. С другой стороны, недостатками при использовании переменного тока являются более высокая стоимость, более высокий эффект шлифования и более низкая стабильность дуги.
Преимущества Этот процесс имеет преимущество высококачественных сварных швов, отсутствие шлака и брызг и может использоваться во всех положениях и типах соединений. Кроме того, вольфрам называется термоэлектронным, поскольку легко излучать электроны, что значительно облегчает стабильность дуги; вольфрам может быть чистым или с циркониевыми или ториевыми сплавами. Чистые вольфрамовые электроды имеют преимущество в снижении стоимости и меньшем измельчении при использовании переменного тока. С другой стороны, недостатки — это трудность открытия арки и более низкая долговечность. Химический состав электрода. Химические элементы, добавленные к электроду, важны для обеспечения лучшей производительности процесса сварки. Электроды с добавлением диоксида циркония или титана обладают такими преимуществами, как повышенная долговечность, более высокая прочность с более высокими потенциями и лучшими свойствами воспламенения. С другой стороны, недостатками при использовании переменного тока являются более высокая стоимость, более высокий эффект шлифования и более низкая стабильность дуги. Электрод с диоксидом циркония имеет хорошие характеристики при использовании с переменным током и обладает высокой устойчивостью к загрязнению. Этот препарат выполняется путем шлифования наконечника, всегда в продольном направлении, для облегчения направления электронов. В особых случаях шлифовальные метки удаляются полировкой. При сварке постоянным током кончик электрода должен быть заострен. Правильный наконечник конуса можно получить по практическому правилу: высота конуса должна быть в два раза больше диаметра электрода. В случае сварки переменного тока наконечник электрода должен быть слегка закруглен. Выбор электрода. Выбор типа и диаметра электрода должен учитывать толщину и тип материала, тип соединения, количество проходов и параметры сварки, такие как сила тока и напряжение, а также химический состав электрода, Диаграмма помогает выбрать электрод. Рассматриваются следующие параметры: длина дуги, скорость сварки, расход газа и сварочный ток. Длина дуги Длина дуги — это расстояние между наконечником электрода и основным металлом; Увеличение длины также увеличивает напряжение дуги под заданным сварочным током и данным защитным газом.
Электрод с диоксидом циркония имеет хорошие характеристики при использовании с переменным током и обладает высокой устойчивостью к загрязнению. Этот препарат выполняется путем шлифования наконечника, всегда в продольном направлении, для облегчения направления электронов. В особых случаях шлифовальные метки удаляются полировкой. При сварке постоянным током кончик электрода должен быть заострен. Правильный наконечник конуса можно получить по практическому правилу: высота конуса должна быть в два раза больше диаметра электрода. В случае сварки переменного тока наконечник электрода должен быть слегка закруглен. Выбор электрода. Выбор типа и диаметра электрода должен учитывать толщину и тип материала, тип соединения, количество проходов и параметры сварки, такие как сила тока и напряжение, а также химический состав электрода, Диаграмма помогает выбрать электрод. Рассматриваются следующие параметры: длина дуги, скорость сварки, расход газа и сварочный ток. Длина дуги Длина дуги — это расстояние между наконечником электрода и основным металлом; Увеличение длины также увеличивает напряжение дуги под заданным сварочным током и данным защитным газом. Длина дуги влияет на сварной шов, который будет тем больше, чем больше дуга. Очень короткая или очень длинная дуга становится неустойчивой, что способствует образованию пористости, укусов и отсутствия слияния. Скорость сварки Скорость сварки влияет на проникновение и ширину сварного шва; Таким образом, если скорость увеличивается, то проникновение и шнур уменьшаются, а также усиливается при сварке с добавлением металла. Повышенная скорость улучшает эффективность и производительность сварки, снижая издержки производства; Однако слишком высокие скорости могут вызывать разрывы, такие как отсутствие проникновения и укусов. Поток газа Для эффективной защиты от газа необходимо учитывать поток газа. Поток должен быть достаточно прочным, чтобы вывести воздух из зоны сварки и таким образом защитить бассейн расплава; Однако высокая скорость потока может вызвать турбулентность в потоке газа, что приводит к разрыву или дефектам шнура и нестабильности дуги, не говоря уже о более высокой стоимости сварки.
Длина дуги влияет на сварной шов, который будет тем больше, чем больше дуга. Очень короткая или очень длинная дуга становится неустойчивой, что способствует образованию пористости, укусов и отсутствия слияния. Скорость сварки Скорость сварки влияет на проникновение и ширину сварного шва; Таким образом, если скорость увеличивается, то проникновение и шнур уменьшаются, а также усиливается при сварке с добавлением металла. Повышенная скорость улучшает эффективность и производительность сварки, снижая издержки производства; Однако слишком высокие скорости могут вызывать разрывы, такие как отсутствие проникновения и укусов. Поток газа Для эффективной защиты от газа необходимо учитывать поток газа. Поток должен быть достаточно прочным, чтобы вывести воздух из зоны сварки и таким образом защитить бассейн расплава; Однако высокая скорость потока может вызвать турбулентность в потоке газа, что приводит к разрыву или дефектам шнура и нестабильности дуги, не говоря уже о более высокой стоимости сварки. На рынке доступны 10 адаптивных устройств с факелом, которые обеспечивают более плавный и эффективный поток газа. Правило для определения идеальной скорости потока состоит в том, чтобы провести испытание, начиная с высокого потока и постепенно уменьшаться до тех пор, пока не начнется поверхностное окисление шнура; идеальный расход будет самым близким и самым высоким. Низкий расход не обеспечивает адекватной защиты плавильной лужи, что также приводит к разрыву. 11 В случае механизированной сварки используются катушки проката. Диаметры нитей и нитей различны. Материалы и сплавы, используемые при изготовлении палочек, различны; Классифицируются по их химическому составу и по свойствам осажденного металла. Важно, чтобы аддитивный металл не содержал влаги, жира и окисления. Выбор добавочного металла. Выбор металла с добавлением учитывает такие факторы, как схожесть основного металла, химический состав, механические свойства и разумные затраты. Диаметр провода или измерительного щупа должен соответствовать толщине свариваемых деталей или количеству материала, подлежащего осаждению.
На рынке доступны 10 адаптивных устройств с факелом, которые обеспечивают более плавный и эффективный поток газа. Правило для определения идеальной скорости потока состоит в том, чтобы провести испытание, начиная с высокого потока и постепенно уменьшаться до тех пор, пока не начнется поверхностное окисление шнура; идеальный расход будет самым близким и самым высоким. Низкий расход не обеспечивает адекватной защиты плавильной лужи, что также приводит к разрыву. 11 В случае механизированной сварки используются катушки проката. Диаметры нитей и нитей различны. Материалы и сплавы, используемые при изготовлении палочек, различны; Классифицируются по их химическому составу и по свойствам осажденного металла. Важно, чтобы аддитивный металл не содержал влаги, жира и окисления. Выбор добавочного металла. Выбор металла с добавлением учитывает такие факторы, как схожесть основного металла, химический состав, механические свойства и разумные затраты. Диаметр провода или измерительного щупа должен соответствовать толщине свариваемых деталей или количеству материала, подлежащего осаждению. Эта информация доступна в каталогах производителей. Содержание влаги также является важным фактором, который необходимо контролировать. Выбор газа зависит от таких факторов, как тип свариваемого металла, толщина деталей и положение сварки. 70% и 30% и 30% и 70% смеси аргона и гелия представляют лучшие результаты при сварке цветных металлов, таких как алюминий, магний и сплавы. Выбор газа важен, поскольку он влияет на скорость сварки. Гелий требует высоких сварочных напряжений, что требует более высокой энергии при одинаковой длине тока и дуги; Обеспечивает большое проникновение сварного шва; Представляет высокую стоимость, но, в свою очередь, обеспечивает более высокую скорость в случае автоматической сварки алюминия и его сплавов. При автоматической сварке алюминия и его сплавов можно использовать чистый гелиевый газ с постоянным током и отрицательной полярностью. Состоит из источника электрической энергии, который может быть в то же время трансформатором, в случае переменного тока или выпрямителя или генератора, в случае постоянного тока; Факел с опорой для электрода; Проводящий кабель для защитного газа; Один кабель для системы охлаждения и один для питания; источник газа, который может быть цилиндром и регулятором давления, или набор цилиндров с каналами для подачи распределительной сети в случае сварки несколькими рабочими станциями; И регулятор потока газа.
Эта информация доступна в каталогах производителей. Содержание влаги также является важным фактором, который необходимо контролировать. Выбор газа зависит от таких факторов, как тип свариваемого металла, толщина деталей и положение сварки. 70% и 30% и 30% и 70% смеси аргона и гелия представляют лучшие результаты при сварке цветных металлов, таких как алюминий, магний и сплавы. Выбор газа важен, поскольку он влияет на скорость сварки. Гелий требует высоких сварочных напряжений, что требует более высокой энергии при одинаковой длине тока и дуги; Обеспечивает большое проникновение сварного шва; Представляет высокую стоимость, но, в свою очередь, обеспечивает более высокую скорость в случае автоматической сварки алюминия и его сплавов. При автоматической сварке алюминия и его сплавов можно использовать чистый гелиевый газ с постоянным током и отрицательной полярностью. Состоит из источника электрической энергии, который может быть в то же время трансформатором, в случае переменного тока или выпрямителя или генератора, в случае постоянного тока; Факел с опорой для электрода; Проводящий кабель для защитного газа; Один кабель для системы охлаждения и один для питания; источник газа, который может быть цилиндром и регулятором давления, или набор цилиндров с каналами для подачи распределительной сети в случае сварки несколькими рабочими станциями; И регулятор потока газа. 15 Факел служит опорой для вольфрамового электрода, а также обеспечивает защитный газ. Внутри факела есть зажим, который удерживает электрод, и его следует выбирать в соответствии с диаметром электрода. Широкий выбор факелов, доступных на рынке, позволяет адаптировать его к труднодоступным сварным швам. Сопло горелки, которое может быть керамическим или металлическим, имеет функцию направления защитного газа; Его также следует выбирать в зависимости от толщины и формы сварочного шва или используемого электрического тока. Диаметр газового сопла должен быть достаточно большим, чтобы адекватно защитить расплавленную лужу и нагретую зону. Практическое правило говорит, что внутренний диаметр сопла должен быть в четыре раза больше диаметра электрода. Система охлаждения факела Сильное дуговое дутье и большие токи требуют охлаждения факела и сварочного кабеля. Таким образом обеспечивается адекватная защита, и оборудование становится гибким и простым в обращении. Охлаждение факела может осуществляться водой или воздухом.
15 Факел служит опорой для вольфрамового электрода, а также обеспечивает защитный газ. Внутри факела есть зажим, который удерживает электрод, и его следует выбирать в соответствии с диаметром электрода. Широкий выбор факелов, доступных на рынке, позволяет адаптировать его к труднодоступным сварным швам. Сопло горелки, которое может быть керамическим или металлическим, имеет функцию направления защитного газа; Его также следует выбирать в зависимости от толщины и формы сварочного шва или используемого электрического тока. Диаметр газового сопла должен быть достаточно большим, чтобы адекватно защитить расплавленную лужу и нагретую зону. Практическое правило говорит, что внутренний диаметр сопла должен быть в четыре раза больше диаметра электрода. Система охлаждения факела Сильное дуговое дутье и большие токи требуют охлаждения факела и сварочного кабеля. Таким образом обеспечивается адекватная защита, и оборудование становится гибким и простым в обращении. Охлаждение факела может осуществляться водой или воздухом. Водяное охлаждение. Вода, используемая для охлаждения, должна быть очищена, чтобы не ограничивать или забивать проходы, из-за чего оборудование перегревается и не работает. В тех случаях, когда доступная вода не очищается, рекомендуется использовать фильтры. В большинстве мастерских есть питьевое водоснабжение; Однако иногда работа выполняется на больших мастерских или в полевых условиях, 17 Воздушное охлаждение Факел также может быть оснащен воздушным охлаждением; Эта система ограничена током около 200 А, согласно изготовителю, и используется при сварке тонких пластин с очень низким рабочим циклом. Горелка с воздушным охлаждением легче и имеет более низкую стоимость, чем система водоснабжения. Апертура выполнена с помощью устройств, которые образуют тип пилотной дуги. Наиболее часто используется высокочастотный воспламенитель, который обеспечивает высоковольтный и высокочастотный сигнал 5 кВ и 5 кГц и позволяет ионизировать газовый столбец между электродом и частью, вызывая открытие. За несколько секунд до открытия дуги рекомендуется запустить поток инертного газа; Этот временной интервал известен как предварительная утечка газа.
Водяное охлаждение. Вода, используемая для охлаждения, должна быть очищена, чтобы не ограничивать или забивать проходы, из-за чего оборудование перегревается и не работает. В тех случаях, когда доступная вода не очищается, рекомендуется использовать фильтры. В большинстве мастерских есть питьевое водоснабжение; Однако иногда работа выполняется на больших мастерских или в полевых условиях, 17 Воздушное охлаждение Факел также может быть оснащен воздушным охлаждением; Эта система ограничена током около 200 А, согласно изготовителю, и используется при сварке тонких пластин с очень низким рабочим циклом. Горелка с воздушным охлаждением легче и имеет более низкую стоимость, чем система водоснабжения. Апертура выполнена с помощью устройств, которые образуют тип пилотной дуги. Наиболее часто используется высокочастотный воспламенитель, который обеспечивает высоковольтный и высокочастотный сигнал 5 кВ и 5 кГц и позволяет ионизировать газовый столбец между электродом и частью, вызывая открытие. За несколько секунд до открытия дуги рекомендуется запустить поток инертного газа; Этот временной интервал известен как предварительная утечка газа. Затем дуга освещается с помощью высокочастотного воспламенителя, а факел направляется в конкретное место, чтобы обеспечить формирование плавильного пула; Когда лужа достигает требуемого размера, может начаться сварка. Высокочастотный сигнал имеет очень низкую мощность и не влияет на безопасность оператора. Газовый баллон. Защитный газ поставляется в стальных цилиндрах под давлением. Обычно устройства имеют устройство, которое препятствует воспламенению искр при открытии дуги. Этот тип цепи применяется при сварке стальных, медных, хромоникелевых аустенитных сталей и жаропрочных сплавов. 19 Концентрация тепла составляет около 30% в части и 70% в электроде. Полученный сварной шов широкий, с небольшим проникновением. Чистящий эффект возникает при воздействии электрической дуги: электроны, покидающие основной металл или ионы газа, бомбардируют оксидную пленку, вызывая ее разрушение. Однако, поскольку положительная полярность мало используется, обычно используется переменный ток, чтобы вызвать этот эффект, поскольку пробой оксида происходит в положительной половине цикла.
Затем дуга освещается с помощью высокочастотного воспламенителя, а факел направляется в конкретное место, чтобы обеспечить формирование плавильного пула; Когда лужа достигает требуемого размера, может начаться сварка. Высокочастотный сигнал имеет очень низкую мощность и не влияет на безопасность оператора. Газовый баллон. Защитный газ поставляется в стальных цилиндрах под давлением. Обычно устройства имеют устройство, которое препятствует воспламенению искр при открытии дуги. Этот тип цепи применяется при сварке стальных, медных, хромоникелевых аустенитных сталей и жаропрочных сплавов. 19 Концентрация тепла составляет около 30% в части и 70% в электроде. Полученный сварной шов широкий, с небольшим проникновением. Чистящий эффект возникает при воздействии электрической дуги: электроны, покидающие основной металл или ионы газа, бомбардируют оксидную пленку, вызывая ее разрушение. Однако, поскольку положительная полярность мало используется, обычно используется переменный ток, чтобы вызвать этот эффект, поскольку пробой оксида происходит в положительной половине цикла. Электроны и ионы идут от части к электроду и наоборот, вызывая сбалансированную концентрацию тепла 50% для каждого и средний проникающий шарик. Из-за эффекта выпрямления наблюдается дисбаланс в этом движении, что приводит к тому, что излучение электронов из пула слияния меньше, чем излучение электронов от электрода; это вызывает появление двух синусоид различной интенсивности. Выпрямляющий эффект является более разрушительным в случае сварки алюминия и магния, которые представляют собой тугоплавкий оксид, поскольку поток электронов, испускаемых лужей, недостаточен Чтобы полностью разрушить слой оксида, который существует во время сварки. Для ослабления эффекта выпрямления используется трансформатор конденсаторного фильтра, который уравновешивает синусоидальные волны, представляющие поток электронов. 21 Четыре основные цифры, идентификаторы электродов имеют следующее значение: сопротивление соответствует пределу прочности при сварке в килограммах на квадратный миллиметр. Третья цифра изменяется от 1 до 4 и указывает положение, в котором электрод может сваривать, где: 1 — все позиции; 2 — все, кроме нисходящих вертикальных положений; 3-квартирный и горизонтальный макет; 4-плоское положение.
Электроны и ионы идут от части к электроду и наоборот, вызывая сбалансированную концентрацию тепла 50% для каждого и средний проникающий шарик. Из-за эффекта выпрямления наблюдается дисбаланс в этом движении, что приводит к тому, что излучение электронов из пула слияния меньше, чем излучение электронов от электрода; это вызывает появление двух синусоид различной интенсивности. Выпрямляющий эффект является более разрушительным в случае сварки алюминия и магния, которые представляют собой тугоплавкий оксид, поскольку поток электронов, испускаемых лужей, недостаточен Чтобы полностью разрушить слой оксида, который существует во время сварки. Для ослабления эффекта выпрямления используется трансформатор конденсаторного фильтра, который уравновешивает синусоидальные волны, представляющие поток электронов. 21 Четыре основные цифры, идентификаторы электродов имеют следующее значение: сопротивление соответствует пределу прочности при сварке в килограммах на квадратный миллиметр. Третья цифра изменяется от 1 до 4 и указывает положение, в котором электрод может сваривать, где: 1 — все позиции; 2 — все, кроме нисходящих вертикальных положений; 3-квартирный и горизонтальный макет; 4-плоское положение. Когда расчет не требует точности, мы можем просто умножать константу 0. Существуют три основных типа машин для сварки с электродом с покрытием: трансформатор для сварки; Генератор для сварки; выпрямитель для сварки. Модели варьируются от производителя к производителю, но принцип работы каждого типа машины одинаковый. Трансформатор для сварки Это статическая электрическая машина, предназначенная для подачи электрической дуги переменного тока. Он может быть небольшим, средним и большим в зависимости от выполняемой работы. Трансформаторы, являющиеся станками для сварки переменным током, позволяют использовать только электроды, подходящие для этого типа тока. Примечание. Для долговременной работы и электродов с большим диаметром необходимо соблюдать осторожность, чтобы выбрать машину с достаточной мощностью. У машины обычно есть два контакта для подключения кабелей. Трансформатор, в большинстве случаев, имеет рулевое кривошипное устройство, в котором регулируется интенсивность тока. В небольших машинах регулировка интенсивности производится с помощью штырькового разъема, а заземляющий кабель — внутри.
Когда расчет не требует точности, мы можем просто умножать константу 0. Существуют три основных типа машин для сварки с электродом с покрытием: трансформатор для сварки; Генератор для сварки; выпрямитель для сварки. Модели варьируются от производителя к производителю, но принцип работы каждого типа машины одинаковый. Трансформатор для сварки Это статическая электрическая машина, предназначенная для подачи электрической дуги переменного тока. Он может быть небольшим, средним и большим в зависимости от выполняемой работы. Трансформаторы, являющиеся станками для сварки переменным током, позволяют использовать только электроды, подходящие для этого типа тока. Примечание. Для долговременной работы и электродов с большим диаметром необходимо соблюдать осторожность, чтобы выбрать машину с достаточной мощностью. У машины обычно есть два контакта для подключения кабелей. Трансформатор, в большинстве случаев, имеет рулевое кривошипное устройство, в котором регулируется интенсивность тока. В небольших машинах регулировка интенсивности производится с помощью штырькового разъема, а заземляющий кабель — внутри. 29 Он может быть небольшим, средним и большим, в зависимости от требований выполняемой работы. Для регулирования интенсивности тока используется рычаг, который смещается между двумя шкалами, градуированными в усилителях. Примечание: генератор содержит вращающиеся детали, подлежащие износу; По этой причине должен быть установлен план обслуживания и смазки в соответствии с инструкциями производителя. Сварочный выпрямитель Это статическая электрическая машина, предназначенная для питания электрической дуги с постоянным током. Выпрямитель поддерживает долговременную работу благодаря охлаждающему устройству, соединенному с его собственным корпусом. 31 Выпрямитель имеет два или три контакта для подключения кабелей, где указана полярность. Выпрямитель имеет устройство маховика или реостата, в котором регулируется интенсивность тока. 32 Регулировка тока Ток, подаваемый машиной, должен меняться в зависимости от диаметра электрода. Когда диаметр электрода указывается в дробном дюйме, для регулировки тока может быть установлено общее правило.
29 Он может быть небольшим, средним и большим, в зависимости от требований выполняемой работы. Для регулирования интенсивности тока используется рычаг, который смещается между двумя шкалами, градуированными в усилителях. Примечание: генератор содержит вращающиеся детали, подлежащие износу; По этой причине должен быть установлен план обслуживания и смазки в соответствии с инструкциями производителя. Сварочный выпрямитель Это статическая электрическая машина, предназначенная для питания электрической дуги с постоянным током. Выпрямитель поддерживает долговременную работу благодаря охлаждающему устройству, соединенному с его собственным корпусом. 31 Выпрямитель имеет два или три контакта для подключения кабелей, где указана полярность. Выпрямитель имеет устройство маховика или реостата, в котором регулируется интенсивность тока. 32 Регулировка тока Ток, подаваемый машиной, должен меняться в зависимости от диаметра электрода. Когда диаметр электрода указывается в дробном дюйме, для регулировки тока может быть установлено общее правило. Это правило: текущая интенсивность работы с электродом с покрытием должна примерно соответствовать диаметру сердечника электрода в миллисекундах. Пример. Решение. Если на каждые 1 мм мы используем 40 А, умножая 3, 2 мм на 40 А, мы найдем приблизительную силу тока для сварки с электродом диаметром 3, 2 мм. Длина дуги Чтобы определить это, применяется следующее правило: Длина дуги в сварных швах с покрытыми электродами должна быть равна или немного меньше диаметра используемого сердечника электрода. В следующей таблице мы можем наблюдать некоторые различия в сварке при работе с короткой или длинной дугой. Короткая дуга Длинная дуга Высокое проникновение Меньше сварного зеркала менее разбрызгивание Меньше проникновения Распылительная сварка Чрезмерное разбрызгивание Скорость продвижения Оно изменяется в зависимости от интенсивности тока с размером детали и желаемым типом шнура. 34 Вычислите и запишите интенсивность тока для работы с электродом диаметром 4 мм. 35 Типы электродов Электрод может быть двух типов: голый или с покрытием.
Это правило: текущая интенсивность работы с электродом с покрытием должна примерно соответствовать диаметру сердечника электрода в миллисекундах. Пример. Решение. Если на каждые 1 мм мы используем 40 А, умножая 3, 2 мм на 40 А, мы найдем приблизительную силу тока для сварки с электродом диаметром 3, 2 мм. Длина дуги Чтобы определить это, применяется следующее правило: Длина дуги в сварных швах с покрытыми электродами должна быть равна или немного меньше диаметра используемого сердечника электрода. В следующей таблице мы можем наблюдать некоторые различия в сварке при работе с короткой или длинной дугой. Короткая дуга Длинная дуга Высокое проникновение Меньше сварного зеркала менее разбрызгивание Меньше проникновения Распылительная сварка Чрезмерное разбрызгивание Скорость продвижения Оно изменяется в зависимости от интенсивности тока с размером детали и желаемым типом шнура. 34 Вычислите и запишите интенсивность тока для работы с электродом диаметром 4 мм. 35 Типы электродов Электрод может быть двух типов: голый или с покрытием.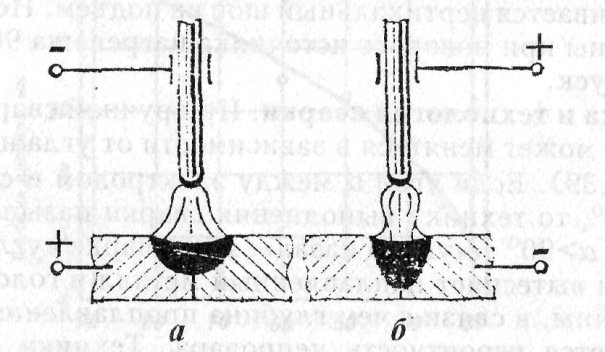 Покрыто Оно состоит из металлического сердечника, покрытого органическими и минеральными соединениями, сплавом железа и т.д. с определенными процентами. Электрод может быть покрыт экструзией или просто покрыт оболочкой и может быть тонким, средним или толстым. Материал сердечника может быть черным или цветным, и его выбор производится в соответствии с материалом детали, подлежащей сварке. Компоненты покрытия поставляются в виде порошка, соединенного «связующим» клеем, обычно с силикатом калия или натрия. Он используется с преимуществами на рабочих местах: мелким и средним покрытием. Который требует хорошего мастерства. Заказ отделки с металлическими рамами. Целлюлоза Содержит горючие органические материалы в покрытии. Он широко используется для сварки, где: проникновение очень важно; Шлаковые включения нежелательны. Два типа электродов, которые мы будем приводить ниже, менее используются, чем три упомянутых выше. Кислота Его покрытие состоит из оксида железа, оксида марганца и других раскислителей.
Покрыто Оно состоит из металлического сердечника, покрытого органическими и минеральными соединениями, сплавом железа и т.д. с определенными процентами. Электрод может быть покрыт экструзией или просто покрыт оболочкой и может быть тонким, средним или толстым. Материал сердечника может быть черным или цветным, и его выбор производится в соответствии с материалом детали, подлежащей сварке. Компоненты покрытия поставляются в виде порошка, соединенного «связующим» клеем, обычно с силикатом калия или натрия. Он используется с преимуществами на рабочих местах: мелким и средним покрытием. Который требует хорошего мастерства. Заказ отделки с металлическими рамами. Целлюлоза Содержит горючие органические материалы в покрытии. Он широко используется для сварки, где: проникновение очень важно; Шлаковые включения нежелательны. Два типа электродов, которые мы будем приводить ниже, менее используются, чем три упомянутых выше. Кислота Его покрытие состоит из оксида железа, оксида марганца и других раскислителей. Наиболее рекомендуемое рабочее положение для этого электрода является плоским. Его проникновение невелико, а его механические свойства очень плохие. Он используется на рабочих местах, где внешний вид шнура более важен, чем его сопротивление. Примечание: В некоторых типах покрытия добавляются металлические частицы, которые придают электроду другие характеристики, такие как: более высокая эффективность работы; определенные свойства. Функции покрытия Функции покрытия много. Затем мы разделим наиболее важные и разделим их на три группы. Электрическая функция Сделайте воздух между электродом и деталью более проводящим, облегчая прохождение электрического тока, что позволяет устанавливать и поддерживать стабильную дугу. Металлургические функции. Создавайте газовую завесу, которая окружает дугу и расплавленный металл, предотвращая вредное воздействие воздуха, а также добавляя легирующие элементы и дезоксиданты для уменьшения примесей. Физическая функция Направляйте металлические капельки к плавильному бассейну, облегчая сварку в различных положениях и задерживая охлаждение шарика через образование шлака, обеспечивая лучшие механические свойства сварного шва.
Наиболее рекомендуемое рабочее положение для этого электрода является плоским. Его проникновение невелико, а его механические свойства очень плохие. Он используется на рабочих местах, где внешний вид шнура более важен, чем его сопротивление. Примечание: В некоторых типах покрытия добавляются металлические частицы, которые придают электроду другие характеристики, такие как: более высокая эффективность работы; определенные свойства. Функции покрытия Функции покрытия много. Затем мы разделим наиболее важные и разделим их на три группы. Электрическая функция Сделайте воздух между электродом и деталью более проводящим, облегчая прохождение электрического тока, что позволяет устанавливать и поддерживать стабильную дугу. Металлургические функции. Создавайте газовую завесу, которая окружает дугу и расплавленный металл, предотвращая вредное воздействие воздуха, а также добавляя легирующие элементы и дезоксиданты для уменьшения примесей. Физическая функция Направляйте металлические капельки к плавильному бассейну, облегчая сварку в различных положениях и задерживая охлаждение шарика через образование шлака, обеспечивая лучшие механические свойства сварного шва. Толстый, содержащий карбонат кальция, другие основные карбонаты и фтор. Он должен быть сухим, чтобы избежать пористости в сварном шве. Тонкие, содержащие горючие органические материалы, которые при сжигании дают толстый слой защитного газа. Средние или толстые, содержащие оксид железа и марганец и другие дезоксиданты. Толстый, содержащий оксид железа без оксида магния. Скорость плавления Обычный Регулярный Высокий Высокий Высокий Проникновение Небольшой Средний Большой Средний Маленький шлак Плотный и вязкий, обычно самонарезающий. Компактный и толстый, легко снимаемый. Кислота, легко отделяемая; Пористой и рыхлой. Тяжелый, компактный и самозарядный. Тенденция к трещине Обычный Низкий Регулярный Высокий Обычный 41 Может быть в сварочных кабинах или в других местах, где необходимо выполнить сварку. Приведем меры предосторожности, которые необходимо соблюдать в некоторых из этих мест. Кабина должна быть окрашена в темное и матовое, чтобы избежать отражения света. Он должен быть достаточно вентилируемым, чтобы газы, выделяемые электродом во время сварки, не всасывались сварщиком; Хотя эти газы обычно не токсичны, они могут влиять на дыхательные пути.
Толстый, содержащий карбонат кальция, другие основные карбонаты и фтор. Он должен быть сухим, чтобы избежать пористости в сварном шве. Тонкие, содержащие горючие органические материалы, которые при сжигании дают толстый слой защитного газа. Средние или толстые, содержащие оксид железа и марганец и другие дезоксиданты. Толстый, содержащий оксид железа без оксида магния. Скорость плавления Обычный Регулярный Высокий Высокий Высокий Проникновение Небольшой Средний Большой Средний Маленький шлак Плотный и вязкий, обычно самонарезающий. Компактный и толстый, легко снимаемый. Кислота, легко отделяемая; Пористой и рыхлой. Тяжелый, компактный и самозарядный. Тенденция к трещине Обычный Низкий Регулярный Высокий Обычный 41 Может быть в сварочных кабинах или в других местах, где необходимо выполнить сварку. Приведем меры предосторожности, которые необходимо соблюдать в некоторых из этих мест. Кабина должна быть окрашена в темное и матовое, чтобы избежать отражения света. Он должен быть достаточно вентилируемым, чтобы газы, выделяемые электродом во время сварки, не всасывались сварщиком; Хотя эти газы обычно не токсичны, они могут влиять на дыхательные пути. Полевая сварка В этой ситуации, помимо обычных мер предосторожности, сварщик должен знать о повреждениях, вызванных электрическим током, избегать работы во влажных местах, под дождем, босиком или с обувью в плохих условиях. Техническое обслуживание при сварке Особое внимание следует уделять сварке вблизи легковоспламеняющихся или взрывоопасных материалов. 43 Из лучей, излучаемых наиболее вредными, являются ультрафиолетовые и инфракрасные. Ультрафиолетовые лучи Причины: сильные ожоги, разрушение клеток и при этом преждевременное разрушение кожи; Тяжелая атака на глазное яблоко и может привести к катаральному конъюнктивиту, язве роговицы и т.д. инфракрасный луч Он несет ответственность за повреждения, такие как: ожоги 1 и 2 степени; катаракта; частые головные боли; Взгляд устал. Инфракрасные и ультрафиолетовые лучи невидимы. Брызги Это небольшие капли расплавленного металла, которые прыгают в процессе сварки во всех направлениях. Они отвечают за ожоги на сварщике, а также за пожары, если они попадают на горючий материал.
Полевая сварка В этой ситуации, помимо обычных мер предосторожности, сварщик должен знать о повреждениях, вызванных электрическим током, избегать работы во влажных местах, под дождем, босиком или с обувью в плохих условиях. Техническое обслуживание при сварке Особое внимание следует уделять сварке вблизи легковоспламеняющихся или взрывоопасных материалов. 43 Из лучей, излучаемых наиболее вредными, являются ультрафиолетовые и инфракрасные. Ультрафиолетовые лучи Причины: сильные ожоги, разрушение клеток и при этом преждевременное разрушение кожи; Тяжелая атака на глазное яблоко и может привести к катаральному конъюнктивиту, язве роговицы и т.д. инфракрасный луч Он несет ответственность за повреждения, такие как: ожоги 1 и 2 степени; катаракта; частые головные боли; Взгляд устал. Инфракрасные и ультрафиолетовые лучи невидимы. Брызги Это небольшие капли расплавленного металла, которые прыгают в процессе сварки во всех направлениях. Они отвечают за ожоги на сварщике, а также за пожары, если они попадают на горючий материал. 44 Маски для индивидуального защитного оборудования Они изготовлены из негорючего материала, тепловой и электрической изоляции, легкие и устойчивые. Они служат для защиты сварщика от молнии, разбрызгивания и высокой температуры, возникающих во время сварки. Существует несколько моделей, и ваш выбор должен быть выполнен в соответствии с типом выполняемой работы. Световые фильтры Это защитные очки, которые должны поглощать не менее 99, 5% излучения, испускаемого при сварке. Сборка очков Сборка очков в маске должна выполняться, как показано на рисунке ниже. Фартук Защищает переднюю часть тела. Поножи или поножи Защитите ноги и ноги сварщика. Понятие электричества, применяемого для сварки. Безопасность и средства индивидуальной защиты. Переменные, которые влияют на сварку. Электроды для ручной дуговой сварки. Классификация и хранение электродов. Технология сварки — процесс тигров и электрод с покрытием.
. Это процесс сварки, который использует электрическую дугу в качестве источника тепла между деталью и расходным материалом в виде проволоки, обеспечиваемой непрерывным питателем, что делает соединение металлических материалов сплавлением.
44 Маски для индивидуального защитного оборудования Они изготовлены из негорючего материала, тепловой и электрической изоляции, легкие и устойчивые. Они служат для защиты сварщика от молнии, разбрызгивания и высокой температуры, возникающих во время сварки. Существует несколько моделей, и ваш выбор должен быть выполнен в соответствии с типом выполняемой работы. Световые фильтры Это защитные очки, которые должны поглощать не менее 99, 5% излучения, испускаемого при сварке. Сборка очков Сборка очков в маске должна выполняться, как показано на рисунке ниже. Фартук Защищает переднюю часть тела. Поножи или поножи Защитите ноги и ноги сварщика. Понятие электричества, применяемого для сварки. Безопасность и средства индивидуальной защиты. Переменные, которые влияют на сварку. Электроды для ручной дуговой сварки. Классификация и хранение электродов. Технология сварки — процесс тигров и электрод с покрытием.
. Это процесс сварки, который использует электрическую дугу в качестве источника тепла между деталью и расходным материалом в виде проволоки, обеспечиваемой непрерывным питателем, что делает соединение металлических материалов сплавлением.
Запомните! Тип подключения не зависит от пространственного положения.
Особенности сварки током прямой полярности
Прямая полярность при работе с постоянным током имеет ряд особенностей. Некоторые из них, мы уже перечислили, на остальные стоит обратить особое внимание:
- сварной шов получается глубоким, но достаточно узким.
- подходит для большинства сталей, толщиной от 3-х мм.
- цветные металлы с применением вольфрамового стержня варятся только прямой полярностью.
- характеризуется стабильной дугой и как следствие — более качественным швом.
- запрещено использовать электроды для сварочных аппаратов переменного тока.
- лучше подходит для резки металла.
Особенности сварки током обратной полярности
Как и прямая, обратная полярность при сварке инвертором имеет ряд особенностей, зная которые вы сможете избежать ряда ошибок, свойственных новичкам. Стоит выделить такие особенности:
- при сварке постоянным током на обратной полярности шов получается менее глубоким, но более широким
- отлично подходит для сваривания тонких металлов и средней толщины.
 При работе с толстыми заготовками качество шва резко снижается.
При работе с толстыми заготовками качество шва резко снижается. - запрещено работать обратной полярностью с электродами, чувствительными к перегреву.
- при низких токах наблюдается значительное снижение качества сварного шва из-за скачущей дуги.
- помимо обратного подключения, для работы с высоколегированными сталями следует строго придерживаться рекомендаций о рабочем цикле и остывании заготовки.
Заключение
Сварочные аппараты постоянного тока, такие как инверторы или полуавтоматы – достаточно просты, чтобы использовать в быту. Именно поэтому спрос и предложение этих устройств на рынке постоянно растет. Этому способствует их доступность, дешевизна и постоянным током варить проще, чем переменным. Однако чтобы получить качественное, красивое и долговечное сварное соединение нужно знать ряд технологических особенностей, в том числе предназначение и виды полярности. Благодаря знаниям из этой статьи и источнику постоянного тока своими руками вы сможете выполнить любые сварочные работы. Главное — тщательный подход к работе и соблюдение всех защитных мер.
Главное — тщательный подход к работе и соблюдение всех защитных мер.
Советы начинающему аргонщику, часть 3 — Страница 53 — Аргонодуговая сварка — TIG
Всем привет.
Видимо, вскоре стану начинающим аргонщиком.
Для начала затарился вот таким набором:
Wp-24gf сварочной горелки тело гибким, 80Amp с воздушным охлаждением
Wp-9fv SR-9FV сварочной горелки тело гибким и газовый вентиль, 125amp, Air — с водяным охлаждением
Две горелки, чисто тело.
WP-24 TIG Сварочные Горелки Расходные КИТ 53N14 Колле Тела Глинозема сопло, 13 шт. — цанги и сопла для 24 горелки.
TIG КИТ Удлиненная Глинозема Сопло 796F74 ~ 77 Fit TIG Факел SR PTA WP-9 20 25, 4PK удлиненные сопла от 3Xl до 6L
TIG газовой линзы цанги тело & #10 pyrex чашка комплект дБ SR WP 9 20 25 wig-сварочная горелка 26 шт. — 4 газовые линзы разного диаметра, прозрачные чашки, 4 цанги, 3 колпачка для 9 горелки разной длины.
Tig глинозема керамическая 13N11 7 # Fit TIG сварочные расходные SR пта DB WP 9 20 25 серии, 10PK — 10 сопл средней длины размер 7.
1.5% Lanthanated электрод WL15 золото 1.6 * 150 мм и 1/16 » x6 » x10PK
2% Lanthanated электрод WL20 голубой TIG сварки 6 » x3 / 32 » ( 2.4 мм ), 10PK — все говорят что WL самые универсальные, решил их прикупить.
Баллон, редуктор уже присмотрел.
Подскажите, что еще понадобится?
Горелки заказал только тело, решил что шланг-пакет сделаю сам.
Я так понимаю, для самодельного шланг-пакета удобнее всего отдельные каналы газ и ток? Трубка силикон или резина, какое сечение достаточно, если чисто для газа?
Кабель сложно доставаемый ПЩ или хватит акустического? Больших токов вроде не предполагается.
Штуцеры тоже пожалуй сам сделаю, спецификацию по резьбам уже нашел, все нужное есть.
Сообщение отредактировал Yuriy82: 09 Декабрь 2017 00:36
Анод, катод, положительный и отрицательный: основные сведения об аккумуляторах
Последнее обновление: 26 августа 2021 г.
Значительные разработки были сделаны в области аккумуляторных батарей (иногда называемых вторичными элементами), и большую часть этой работы можно отнести к разработке электромобилей. Эта работа привела к присуждению Нобелевской премии по химии 2019 года за разработку литий-ионных аккумуляторов.Следовательно, термины «анод», «катод», «положительный» и «отрицательный» получили все большее распространение.
В статьях о новых аккумуляторных электродах часто используются названия анод и катод без указания, разряжается аккумулятор или заряжается. Термины анод, катод, положительный и отрицательный не являются синонимами, иногда их можно перепутать, что может привести к ошибкам.
Цель этой статьи — прояснить и четко определить эти различные термины.
Реакции окисления и восстановления
- Реакция окисления — это электрохимическая реакция, в результате которой образуются электроны.- \к LiCoO_2}$
— реакция восстановления.
 Редукция — это приобретение электронов.
Редукция — это приобретение электронов.Анод, катод
- Анод – это электрод, на котором протекает реакция окисления. Потенциал анода, через который протекает ток, выше его равновесного потенциала: $E_\text a(I)>E_{I=0}$ (рис. 1).
- Катод – это электрод, на котором протекает реакция восстановления. Потенциал катода, через который протекает ток, ниже его равновесного потенциала: $E_\text c(I)
Рисунок 1: $(E_{I \neq 0}-E_{I= 0})\;I >0$
Положительный и отрицательный электроды
Два электрода батареи или аккумулятора имеют разные потенциалы. Электрод с более высоким потенциалом называется положительным, электрод с более низким потенциалом — отрицательным. Электродвижущая сила, ЭДС в В, батареи представляет собой разницу между потенциалами положительного и отрицательного электродов, когда батарея не работает.
 +$ → положительный электрод является анодом.-$ → отрицательный электрод является катодом.
+$ → положительный электрод является анодом.-$ → отрицательный электрод является катодом.
Рисунок 3: Разряд/заряд вторичной батареи, представленной в виде гальванического элемента, с электронами и направлением тока.
Заключение
При нормальном использовании перезаряжаемой батареи потенциал положительного электрода как при разрядке, так и при перезарядке остается выше, чем потенциал отрицательного электрода.С другой стороны, роль каждого электрода меняется во время цикла разрядки/зарядки.
- Во время разряда плюс — катод, минус — анод.
- Во время заряда положительный является анодом, отрицательный — катодом.
Тексты, описывающие аноды или катоды аккумуляторов, безусловно, имплицитно рассматривают случай разряда. Давайте без колебаний напишем, перефразируя Резерфорда, имплицитное есть не что иное, как плохое явное.
Узнайте больше о потенциостатах
Чтобы узнать больше о потенциостатах BioLogic, которые используются в исследованиях аккумуляторов и тестировании аккумуляторов, а также в других областях, представляющих интерес, перейдите на нашу страницу обзора потенциостатов и страницу обзора тестирования аккумуляторов/циклов аккумуляторов.
Узнайте больше о кривых цикла работы батареи
Может быть интересна следующая статья «Как читать кривые цикла работы батареи»
батарея анод катод положительный отрицательный электрод
Отрицательный электрод — обзор
7.5 Материалы реакции конверсии
В этом разделе описывается использование фаз, которые вступают в реакцию реакций конверсии и реакций замещения , в качестве материалов как положительного, так и отрицательного электрода в усовершенствованных батареях (Cabana et al., 2010; Bruce et al., 2008; Аматуччи и Перейра, 2007). Помимо классических реакций интеркаляции, различные недорогие соединения обещают удельную емкость, которая в два-пять раз выше, чем у используемых в настоящее время графита и LiCoO 2 . Концепция реакции конверсии была разработана в начале этого века. Однако необходимо добиться гораздо большего технического прогресса, особенно реорганизации частиц во время заряда и разряда.
Концепция реакции конверсии была разработана в начале этого века. Однако необходимо добиться гораздо большего технического прогресса, особенно реорганизации частиц во время заряда и разряда.
Аккумулирование энергии за пределами интеркаляции : В литий-ионных элементах гость Li + реверсивно помещается в основную решетку и извлекается из нее, которая остается более или менее неизменной во время зарядки и разрядки (рис. 7.5). Многие соединения переходных металлов не имеют вакантных мест для процессов интеркаляции и поэтому до сих пор не учитывались для аккумуляторов.
Рисунок 7.5. (а) Внедрение лития в отличие от структурной реорганизации конверсионных материалов. (b) Кривые расхода/заряда конверсионных материалов: фторида железа и сульфида кобальта (по Аматуччи).
Современные научно-исследовательские подходы к поиску оксидов, фторидов, нитридов, сульфидов, фосфидов или гидридов переходных металлов, которые используют более одного электрона на атом металла для накопления энергии.
MaXb+bxLi⇌aM+bLixX
M переходный металл, x формальная степень окисления аниона X.
Отрицательные электроды в основном изготавливаются на основе фосфидов, нитридов или оксидов; положительные электроды на основе фторидов. Фториды, оксиды и сульфиды меди, марганца, железа, кобальта и никеля достигают теоретических потенциалов до 3,5 В по сравнению с Li|Li + (Poizot et al., 2000):
| MnS+2e –+2Li+⇌Mn+Li2S | (< 1,1 В) |
| FeF2+2e–+2Li+⇌Fe+2LiF | (< 2,6 В) |
| CoF2+2+2 | (< 2.7 В) |
| NiF2 + 2e- + 2Li + ⇌NI + 2LIF | (<3,0 В) |
| CUF2 + 2E- + 2Li + ⇌CU + 2LIF | (<3,5 В) |
Данные о производительности : Потенциал в основном определяется электроотрицательностью анионов. Самые высокие потенциалы были измерены с CuF 2 (~ 3 В), CoF 2 (2,1 В) и FeF 2 (1,9 В). Лучшими экспериментальными сульфидами являются Cu 2 S (1,6 В), NiS (1,4 В), Co 0.9 S (1,3 В) и FeS (1,2 В). Диапазон потенциалов оксидов обычно ниже 1 В по сравнению с Li|Li + .
Лучшими экспериментальными сульфидами являются Cu 2 S (1,6 В), NiS (1,4 В), Co 0.9 S (1,3 В) и FeS (1,2 В). Диапазон потенциалов оксидов обычно ниже 1 В по сравнению с Li|Li + .
Теоретическая емкость конверсионных материалов превышает таковую у интеркаляционных материалов и компенсирует несколько более низкие потенциалы. Теоретическая емкость выше 1500 Ач кг − 1 обещает CoP 3 , MnP 4 , CrN и NiP 3 . Более 1000 ах кг — 1 были рассчитаны для Con, Nip 2 , FEP 2 , CR 2 O 3 , MOO 3 , MNO 2 , MN 2 O 3 , Fe 2 O 3 , RuO 2 , Co 3 O 4 и MnS.
Трехвалентные соединения FeF 3 и BiF 3 достигают 800 Втч·кг − 1 (материал) при 2,5 В. Такие фторидные фазы не содержат лития, поэтому смеси LiF и железа использовались в качестве положительный электрод в экспериментальных литий-ионных элементах.
Кинетика реакции : К сожалению, реорганизация структуры во время зарядки и разрядки этих материалов происходит медленно. Высокое внутреннее сопротивление вызывает сильный гистерезис зарядно-разрядных характеристик и приводит к низкой энергоэффективности (рис. 7.5б). Электроотрицательные анионы обеспечивают высокое напряжение ячейки, но, с другой стороны, сильные связи М-Х увеличивают внутреннее сопротивление (поляризационное сопротивление, перенапряжение) в порядке: фториды > оксиды > сульфиды > фосфиды.
Помимо изменения решетки кинетически подавляются диффузия ионов лития и перенос заряда электронов. Уменьшение путей диффузии в наноструктурах может улучшить кинетику реакций конверсии. Более того, реорганизация частиц при заряде и разряде приводит к постепенному измельчению материалов.
| 1. Улучшитель SEI a. Добавка восстановительного типа |
|
| |
| б.Добавка реакционного типа |
|
| |
| г.SEI модификаторов морфологии |
| 5
| |
| 2.Позитивный агент защиты электродов |
| ||
| 3.LiPF 6 солевой стабилизатор | LiF, трис(2,2,2-трифторэтил)фосфит, 1-метил-2-пирролидон, фторированный карбамат, гексаметилфосфорамид | Scavenge PF 5 (из LiPF 24 90) | |
4. Защита от перезарядки Защита от перезарядки |
|
| |
| 5. Огненадочная добавка |
|
| |
| 6 6. Улучшение осаждения лития |
|
| |
| 7. Усилитель ионного спасения |
| ||
| 80027 | |||
| 80 80229 | |||
| Libob, LioDFB | Passivace | , Уситающий агент | Циклогексан, трикхил фосфат, метил деканоата, додецилцетат | поверхностно-активные вещества влажные полиолефиновые сепараторы |
| 10. P 2 O 5 | Уменьшить вязкость липфа 5 Электролиты |
Как называется отрицательный электрод? – СидмартинБио
Как называется отрицательный электрод?
В электролизе отрицательно заряженный электрод называется катодом.А положительно заряженный электрод называется анодом.
Что такое отрицательно заряженный электрод?
Отрицательно заряженный электрод в электролизе называется катодом. Положительно заряженный электрод в электролизе называется анодом.
Является ли анод отрицательным электродом?
В батарее или другом источнике постоянного тока анодом является отрицательная клемма, а в пассивной нагрузке — положительная клемма. Например, в электронной трубке электроны от катода перемещаются по трубке к аноду, а в гальванической ячейке отрицательные ионы осаждаются на аноде.
Например, в электронной трубке электроны от катода перемещаются по трубке к аноду, а в гальванической ячейке отрицательные ионы осаждаются на аноде.
Черный электрод положительный или отрицательный?
Другими словами, красный и черный меняются с положительных на отрицательные. С другой стороны, гальванический или постоянный ток (DC) имеет истинное положительное и отрицательное значение. Чрезвычайно важно, где вы разместите красный (анод) и черный (катод) электроды.
Что происходит на отрицательном электроде?
Положительно заряженные ионы движутся к отрицательному электроду во время электролиза. Они получают электроны и восстанавливаются.Отрицательно заряженные ионы движутся к положительному электроду во время электролиза. Они теряют электроны и окисляются.
Что происходит на отрицательном электроде?
Почему анод отрицательный?
В гальваническом элементе электроны будут двигаться к аноду. Поскольку электроны несут отрицательный заряд, то и анод заряжен отрицательно. Это потому, что протоны притягиваются к катоду, поэтому он в основном положительный и, следовательно, положительно заряжен.
Это потому, что протоны притягиваются к катоду, поэтому он в основном положительный и, следовательно, положительно заряжен.
Светодиод анода положительный или отрицательный?
Для работы светодиода его необходимо подключить к источнику напряжения правильной стороной.Сторона подачи напряжения на диод — это положительная (+) сторона, она называется анодом. Отрицательная сторона называется катодом.
ДЕСЯТКИ переменного или постоянного тока?
1) ЧЭНС (чрескожная электрическая стимуляция нервов) Это группа распространенных токов, заменяющих стандартное применение диадинамических токов. Они маломощны и не имеют постоянной составляющей.
Могут ли электроды быть вредными?
Наиболее распространенным риском электронного стимулятора является раздражение кожи в месте размещения электродов.Однако существует гораздо более серьезный риск для здоровья сердца. Для людей с кардиостимулятором или другим имплантируемым сердечным устройством электростимулирование может быть опасным и не рекомендуется.
Что делает электрод положительным или отрицательным?
Положительные и отрицательные электроды Электрод с более высоким потенциалом называется положительным, электрод с более низким потенциалом — отрицательным.
Что является отрицательным электродом в клетке?
Анод — это отрицательный или восстановительный электрод, который отдает электроны во внешнюю цепь и окисляется во время электрохимической реакции.Электролит — это среда, которая обеспечивает механизм переноса ионов между катодом и анодом ячейки.
Катод в батарее положительный или отрицательный?
Аноды положительные или отрицательные? Электрод батареи, испускающий электроны во время разряда, называется анодом; электрод, который поглощает электроны, является катодом. Анод аккумулятора всегда отрицательный, а катод положительный. Это, по-видимому, нарушает соглашение, поскольку анод является клеммой, через которую протекает ток.
Как разрушаются отрицательно заряженные ионы при электролизе?
Отрицательно заряженные ионы перемещаются к положительному электроду во время электролиза. Они теряют электроны и окисляются. Вещество, которое разрушается, называется электролитом. Чтобы быть электролитом, вещество должно быть способно проводить электричество.
Они теряют электроны и окисляются. Вещество, которое разрушается, называется электролитом. Чтобы быть электролитом, вещество должно быть способно проводить электричество.
Кто изобретатель отрицательного электрода?
Пенсильванская компания Axion Power International Incorporated (Axion Power International) (OTC Bulletin Board: AXPW), занимающаяся разработкой усовершенствованных свинцово-углеродных батарей PbC (R), завершила последние приготовления к строительству автоматизированной производственной линии второго поколения для своей запатентованный отрицательный электрод PbC (R).
Укажите разницу между отрицательным электродом класса 11 химии CBSE
Подсказка: Катод — это отрицательный электрод, и здесь происходит восстановление элементов.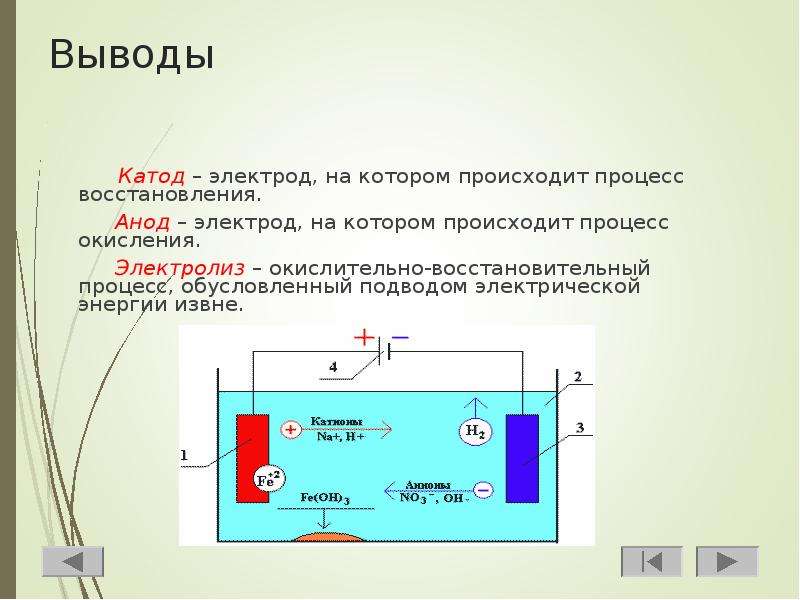 С другой стороны, анод является положительным электродом, и на аноде происходит реакция окисления.
С другой стороны, анод является положительным электродом, и на аноде происходит реакция окисления. Полный пошаговый ответ: Батарея — это устройство, которое накапливает энергию в форме химической энергии и преобразует ее в электрическую энергию. Для этого у батареи есть положительная и отрицательная клеммы, а электролит представляет собой химический раствор, который окружает анод и катод.Электрод состоит из металла, поскольку металлы являются хорошими проводниками тепла и электричества. Электрон переносится с отрицательной клеммы на положительную, но, с другой стороны, ток течет от положительной клеммы к отрицательной.
| Катод | Анод | ||
| 1 | Положительная клемма батареи называется катодом. | 1 | Отрицательная клемма батареи называется анодом. |
| 2 | Ток течет от катода к аноду. | 2 | Электроны перемещаются от анода к катоду. |
| 3 | Здесь происходит редукция элементов.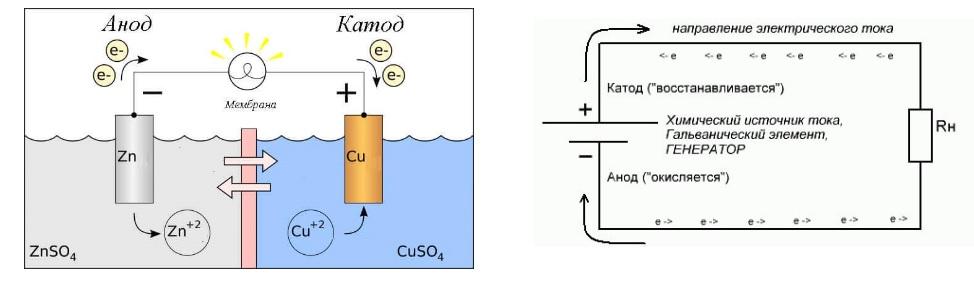 | 3 | Здесь происходит окисление элементов. |
| 4 | Поскольку катод притягивает положительно заряженные частицы и восстанавливает их, мы можем сказать, что он действует как источник электронов. | 4 | Анод притягивает к себе отрицательно заряженные ионы и отбирает у них лишний электрон, таким образом либо нейтрализуя, либо окисляя их до катионов. |
| 5 | В электрохимических элементах катод положительный, а в электролитических элементах катод отрицательный. | 5 | В электрохимических элементах анод отрицательный, а в электролитических элементах анод положительный. |
Примечание: Электрохимический элемент представляет собой устройство, которое может генерировать электрическую энергию из химической энергии. Примерами электрохимических элементов являются элементы, используемые в телевизионных пультах и бытовой технике. С другой стороны, электролитическая ячейка представляет собой устройство, которое может преобразовывать электрическую энергию в химическую энергию.
Границы | Снимок материалов отрицательного электрода для калийно-ионных аккумуляторов
Введение
Менее чем за полвека LIB превратились из ранних лабораторных открытий в массовое промышленное производство. Сегодня они оснащают большую часть нашей портативной электроники, а также рассматриваются в качестве источников энергии для электротранспорта следующего поколения. По мере того, как наши общества с каждым днем становятся все более связанными и электрифицированными, производство LIB продолжает стремительно расти (Tarascon, 2010).Кроме того, растущая часть производства возобновляемой энергии должна поддерживаться увеличением емкости хранения, и здесь снова важную роль играют ЛИА. Однако этот впечатляющий успех может столкнуться с практическими препятствиями в будущем. Как и в случае с другими интенсивными человеческими производствами, может возникнуть нехватка ресурсов или геополитическая напряженность. Вдобавок ко всему, после десятилетий улучшения производительности технология LIB, кажется, приближается к пределу плотности энергии (Van Noorden, 2014). По всем этим причинам важно исследовать альтернативные способы эффективного и устойчивого электрохимического накопления энергии.
По всем этим причинам важно исследовать альтернативные способы эффективного и устойчивого электрохимического накопления энергии.
Среди возможных альтернатив ЛИА представляют интерес аккумуляторы на основе поливалентных катионов, таких как Mg 2+ , Zn 2+ , Ca 2+ или Al 3+ . Действительно, эти элементы имеют высокое содержание в земной коре, подходящее для разработки «недорогих» батарей, а многовалентные катионы подразумевают перенос более одного электрона, что приводит к высокой емкости (Ponrouch et al., 2016; Fang et al., 2018; Ма и др., 2019; Ян Х и др., 2019). Однако разработка подходящих электролитов по-прежнему остается главной проблемой для всех этих систем, и необходимо приложить значительные усилия, чтобы реализовать их многообещающий потенциал.
Что касается одновалентных ионов, то после десятилетий неизвестности NIB теперь привлекает внимание исследовательского сообщества (Chen et al., 2018; Eftekhari and Kim, 2018). Вдохновленные обширной литературой по LIB, NIB быстро росли, используя сходство с точки зрения материала положительного/отрицательного электрода, электролита, и сегодня первые NIB поступили в продажу. Опускаясь в щелочной колонке, KIB идут ниже и также заслуживают внимания.
Вдохновленные обширной литературой по LIB, NIB быстро росли, используя сходство с точки зрения материала положительного/отрицательного электрода, электролита, и сегодня первые NIB поступили в продажу. Опускаясь в щелочной колонке, KIB идут ниже и также заслуживают внимания.
Безусловно, гораздо больший размер ионов K + по сравнению с ионами Li + и Na + напрямую повлияет на химический состав материалов внутри батареи.Тем не менее, KIB обладают рядом положительных характеристик: (i) высокое содержание калия в земной коре по сравнению с литием, что приводит к низкой стоимости прекурсоров и солей для производства аккумуляторов; (ii) алюминий не сплавляется с калием, что позволяет использовать дешевые алюминиевые токосъемники для отрицательных электродов; (iii) Низкий окислительно-восстановительный потенциал окислительно-восстановительной пары K + / K (-2,93 В по сравнению с SHE), очень близкий к Li + / Li (-3,04 В по сравнению с SHE), подходящий для разработки высоких энергий. батареи плотности; (iv) Более слабая кислотность по Льюису ионов K + по сравнению с Na + и Li + , что приводит к малому радиусу Стокса в обычных растворителях и, следовательно, обеспечивает высокую ионную диффузию и проводимость.Этот последний пункт хорошо описан Kubota et al. которые показали, что меньший радиус Стокса K + в ПК по сравнению с радиусами Li + и Na + приводит к более высокой проводимости соли KFSI в ПК по сравнению с NaFSI и LiFSI независимо от концентрации соли (Kubota et al. ., 2018).
батареи плотности; (iv) Более слабая кислотность по Льюису ионов K + по сравнению с Na + и Li + , что приводит к малому радиусу Стокса в обычных растворителях и, следовательно, обеспечивает высокую ионную диффузию и проводимость.Этот последний пункт хорошо описан Kubota et al. которые показали, что меньший радиус Стокса K + в ПК по сравнению с радиусами Li + и Na + приводит к более высокой проводимости соли KFSI в ПК по сравнению с NaFSI и LiFSI независимо от концентрации соли (Kubota et al. ., 2018).
Следовательно, в последние несколько лет были проведены интенсивные исследования по выявлению электродных материалов, которые могут электрохимически присоединять ионы калия.Что касается материалов положительного электрода, слоистые оксиды, полианионные соединения и аналоги берлинской лазури, по-видимому, демонстрируют наиболее многообещающие свойства (Zhu et al., 2018; Hosaka et al., 2019). Среди них интересно отметить, что оксиды на основе Mn или V также используются в качестве катодных материалов в первичных элементах Zn/MnO 2 , а также в перезаряжаемых ионно-цинковых батареях, которые могут работать с электролитами на водной основе. (Minakshi et al., 2008; Subbaiah et al., 2015; Zhang N. et al., 2017; Ян С и др., 2019). Сообщалось также об аналогах берлинской лазури в качестве возможного катодного материала для KIB с использованием водных электролитов (Wessells et al., 2011; Su et al., 2017). Сочетание богатых землей и экологически чистых электродных материалов с нетоксичными электролитами является многообещающим для разработки недорогих и безопасных аккумуляторных систем.
(Minakshi et al., 2008; Subbaiah et al., 2015; Zhang N. et al., 2017; Ян С и др., 2019). Сообщалось также об аналогах берлинской лазури в качестве возможного катодного материала для KIB с использованием водных электролитов (Wessells et al., 2011; Su et al., 2017). Сочетание богатых землей и экологически чистых электродных материалов с нетоксичными электролитами является многообещающим для разработки недорогих и безопасных аккумуляторных систем.
Возвращаясь к KIB, очень высокая чувствительность калия к воздуху и влаге исключает его прямое использование в качестве отрицательного электрода без надежной химической или физической защиты поверхности.К счастью, различные материалы электрохимически реагируют с ионами калия при низком потенциале и, следовательно, предлагают многообещающие альтернативы отрицательным электродам из металлического калия. Целью этого краткого обзора является сбор информации о последних достижениях в области материалов для отрицательных электродов для KIB с критическим сравнением характеристик элементов и уделением особого внимания электролитам и соответствующим электрохимическим механизмам.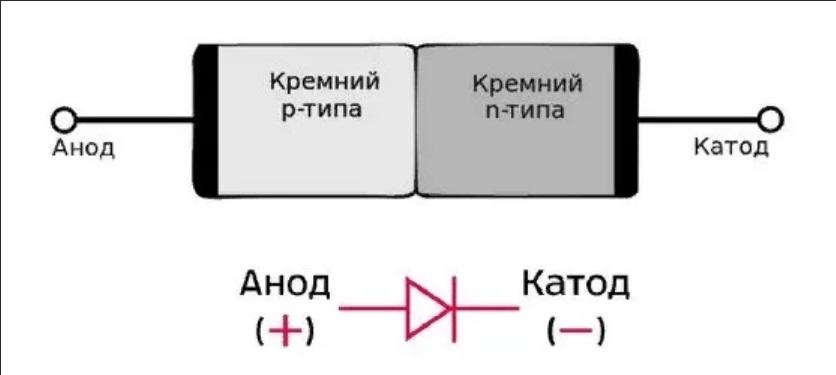
Электроды на основе графита и углерода
Сообщалось, что широкий спектр материалов на основе углерода, таких как графит и его производные, легированный углерод, углеродные волокна, углеродные нанотрубки, мезопористый углерод и твердый углерод, являются возможными кандидатами для отрицательного электрода в KIB.
Графит, наиболее распространенный отрицательный электрод в ЛИА, также способен интеркалировать ионы калия до образования KC 8 , что соответствует теоретической емкости 279 мАч/г. Это важное преимущество по сравнению с технологией NIB, поскольку в обычных карбонатных электролитах не наблюдается внедрения ионов натрия в графит. Эта характеристика была подтверждена теоретическими расчетами профилей потенциала для различных ИСГ и могла быть объяснена более высоким окислительно-восстановительным потенциалом Na + /Na при -2.71 В против SHE по сравнению с окислительно-восстановительным потенциалом Li + /Li и K + / K с -3,04 и -2,93 В соответственно (Okamoto, 2014). Процесс электрохимической интеркаляции ионов калия в графит был впервые описан Jian et al. (2015), с процессом стадирования и образованием промежуточных продуктов KC 36 и KC 24 , выявленных с помощью XRD ex situ (Jian et al., 2015) (рис. 1). Умеренные циклические характеристики графитового электрода, особенно при высоких плотностях тока, побудили авторов обратить внимание на поведение более мягких углей, полученных пиролизом органического ароматического соединения.Мягкий углерод показал более высокий рабочий потенциал, чем графит с наклонным профилем потенциала, менее подходящий для аккумуляторных батарей, но гораздо лучшие циклические характеристики и скорость. В то же время Luo et al. предложили несколько иной процесс стадирования. на основе расчетов ab initio с KC 24 , KC 16 и KC 8 соответственно, сформированными от стадии III до стадии I (Luo et al., 2015). Образование KC 8 в полностью разряженном состоянии, характеризующееся бронзовым цветом, было подтверждено ex situ XRD и рамановской спектроскопией (рис.
Процесс электрохимической интеркаляции ионов калия в графит был впервые описан Jian et al. (2015), с процессом стадирования и образованием промежуточных продуктов KC 36 и KC 24 , выявленных с помощью XRD ex situ (Jian et al., 2015) (рис. 1). Умеренные циклические характеристики графитового электрода, особенно при высоких плотностях тока, побудили авторов обратить внимание на поведение более мягких углей, полученных пиролизом органического ароматического соединения.Мягкий углерод показал более высокий рабочий потенциал, чем графит с наклонным профилем потенциала, менее подходящий для аккумуляторных батарей, но гораздо лучшие циклические характеристики и скорость. В то же время Luo et al. предложили несколько иной процесс стадирования. на основе расчетов ab initio с KC 24 , KC 16 и KC 8 соответственно, сформированными от стадии III до стадии I (Luo et al., 2015). Образование KC 8 в полностью разряженном состоянии, характеризующееся бронзовым цветом, было подтверждено ex situ XRD и рамановской спектроскопией (рис. 1).В последнее время несколько работ, посвященных экспериментам с РФА, скорее предполагали образование KC 36 на стадии III и KC 24 на стадии II (Beltrop et al., 2017; An et al., 2018; Kubota et al., 2018).
1).В последнее время несколько работ, посвященных экспериментам с РФА, скорее предполагали образование KC 36 на стадии III и KC 24 на стадии II (Beltrop et al., 2017; An et al., 2018; Kubota et al., 2018).
Рисунок 1 . Слева: рентгенограммы электродов, остановившиеся в разных точках во время первого цикла полуэлементов K/Graphite, циклированных со скоростью C/10, с соответствующими структурами (Jian et al., 2015). Справа: рентгенограммы и фотография как чистого, так и полностью разряженного графитового электрода *KC24.Справа внизу структуры K-GIC, предложенные расчетами DFT (Luo et al., 2015). Адаптировано с разрешения Jian et al. (2015) и Luo et al. (2015) Copyright (2018) Американское химическое общество.
Подробное исследование различий механизма введения ионов калия в графит с использованием электролита на основе карбоната (KPF 6 в EC/DEC) или электролита на основе эфира (KPF 6 в моноглиме или диглиме) было проведено группой Пинта (Кон и др. , 2016; Шаре и др., 2016а). Operando Спектроскопия комбинационного рассеяния света показала, что свободные ионы внедряются с использованием карбонатных растворителей, тогда как совместная интеркаляция ионов и растворителя происходит с электролитом на основе эфира, однако без повреждения первозданной структуры графита (рис. 2). Таким образом, многослойный графеновый электрод показал емкость 95 мА·ч/г при 2 А/г после 1000 циклов с высокой кулоновской эффективностью при использовании KPF 6 (1 M) в диглиме, в то время как плохое сохранение емкости было получено для нескольких слоев. графеновый электрод при 100 мА/г с KPF 6 (0.8 M) в электролите EC/DEC. Об аналогичной тенденции недавно сообщили Wang et al. которые показали, что электролит на основе КПФ 6 (1 М) в ДМЭ приводит к тонкому SEI и небольшому расширению графитовой плоскости (002), тогда как КПФ 6 (1 М) в ЭК/ДМК приводит к формирование KC 8 с 60% объемным расширением и более толстым SEI (Wang et al.
, 2016; Шаре и др., 2016а). Operando Спектроскопия комбинационного рассеяния света показала, что свободные ионы внедряются с использованием карбонатных растворителей, тогда как совместная интеркаляция ионов и растворителя происходит с электролитом на основе эфира, однако без повреждения первозданной структуры графита (рис. 2). Таким образом, многослойный графеновый электрод показал емкость 95 мА·ч/г при 2 А/г после 1000 циклов с высокой кулоновской эффективностью при использовании KPF 6 (1 M) в диглиме, в то время как плохое сохранение емкости было получено для нескольких слоев. графеновый электрод при 100 мА/г с KPF 6 (0.8 M) в электролите EC/DEC. Об аналогичной тенденции недавно сообщили Wang et al. которые показали, что электролит на основе КПФ 6 (1 М) в ДМЭ приводит к тонкому SEI и небольшому расширению графитовой плоскости (002), тогда как КПФ 6 (1 М) в ЭК/ДМК приводит к формирование KC 8 с 60% объемным расширением и более толстым SEI (Wang et al.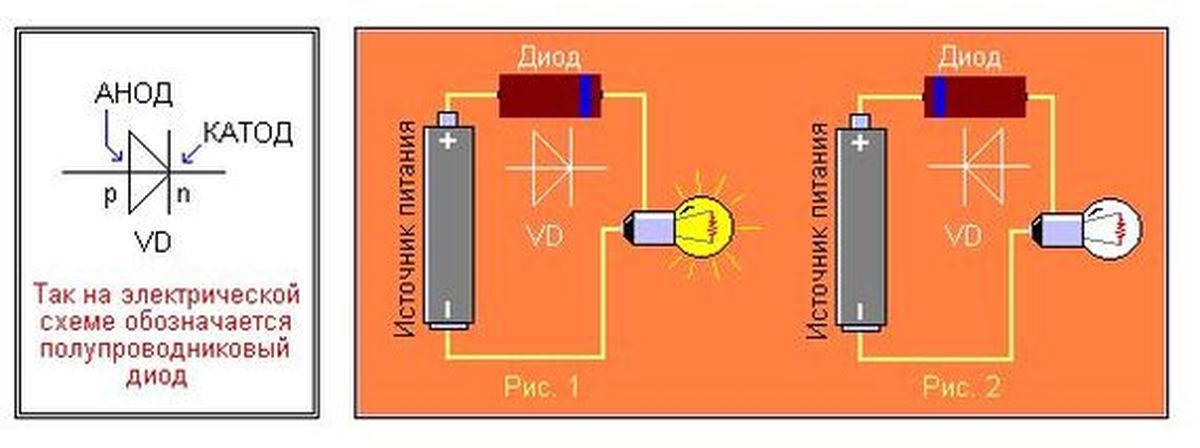 , 2019).
, 2019).
Рисунок 2 . Слева вверху: электрохимическое поведение и характеристики графенового электрода с несколькими слоями с электролитом на основе карбоната.Слева внизу: in situ эволюция спектров комбинационного рассеяния во время LSV при 0,5 мВ/с. Справа вверху электрохимическое поведение природного графита с электролитом на основе эфира. Справа внизу, in situ эволюция спектров комбинационного рассеяния во время измерения LSV. Воспроизведено из Cohn et al. (2016) и Share et al. (2016a) с разрешения Королевского химического общества.
Что касается результатов при езде на велосипеде, Komaba et al. подчеркнул влияние связующего на характеристики электродов на основе графита (Komaba et al., 2015). Более высокая кулоновская эффективность достигается при использовании связующих PA-Na и CMC-Na, чем при использовании PVdF. Растворитель электролита также оказывает сильное влияние, что согласуется с ранее обсуждавшимся сравнением между карбонатами и растворителями на основе эфира. Сосредоточившись на карбонатах, Zhao et al. показали, что улучшенное сохранение емкости 220 и 200 мАч/г может быть получено при 20 мА/г при использовании смеси ЭК/ПК и ЭК/ДЭК соответственно, в то время как при использовании смеси ЭК/ДМК емкость постоянно снижается (Zhao J. et al. ., 2016).Полинанокристаллический графит, синтезированный методом CVD, показал низкую кулоновскую эффективность 54% в течение первого цикла (по сравнению с 78% для графита), но лучшее сохранение емкости, связанное с наличием неупорядоченных нанодоменов, позволяющих сохранить структурную целостность материал при последовательной вставке/удалении K + (Xing et al., 2017). В недавнем исследовании Hui et al. предположили, что более быстрое внедрение K + в графитовые материалы может быть достигнуто с предварительным кондиционированием слоя SEI на основе Li + (Hui et al., 2018). Относительно низкоскоростная способность графита побудила к исследованию других углеродистых материалов.
Сосредоточившись на карбонатах, Zhao et al. показали, что улучшенное сохранение емкости 220 и 200 мАч/г может быть получено при 20 мА/г при использовании смеси ЭК/ПК и ЭК/ДЭК соответственно, в то время как при использовании смеси ЭК/ДМК емкость постоянно снижается (Zhao J. et al. ., 2016).Полинанокристаллический графит, синтезированный методом CVD, показал низкую кулоновскую эффективность 54% в течение первого цикла (по сравнению с 78% для графита), но лучшее сохранение емкости, связанное с наличием неупорядоченных нанодоменов, позволяющих сохранить структурную целостность материал при последовательной вставке/удалении K + (Xing et al., 2017). В недавнем исследовании Hui et al. предположили, что более быстрое внедрение K + в графитовые материалы может быть достигнуто с предварительным кондиционированием слоя SEI на основе Li + (Hui et al., 2018). Относительно низкоскоростная способность графита побудила к исследованию других углеродистых материалов.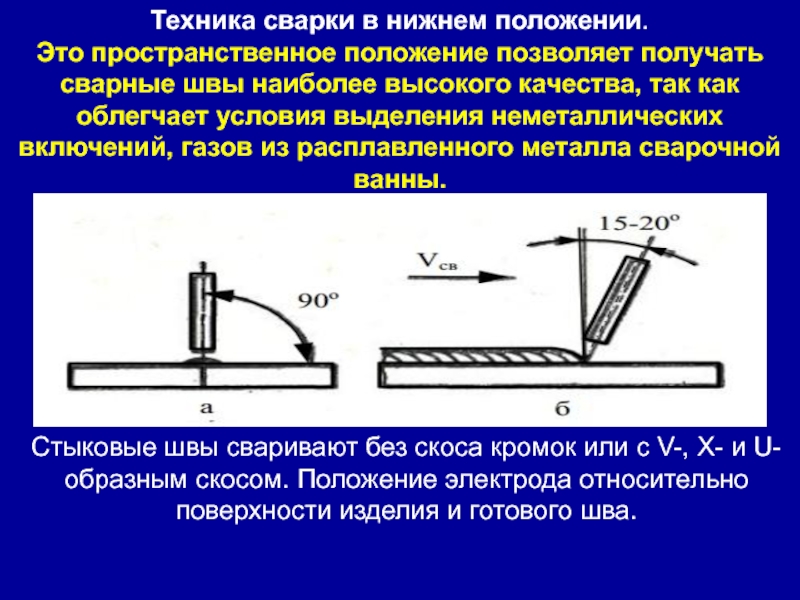 Среди них аморфный упорядоченный мезопористый углерод (OMC) представляет два интересных аспекта для хранения ионов K: большее межслоевое расстояние и большее количество краев и дефектов, чем графит, подходящий для интеркаляции и адсорбции ионов K + соответственно (Wang W. и др., 2018). Таким образом, этот углерод проявлял более высокую обратимую емкость, чем графит, в течение первых циклов, которая сохранялась на уровне 257 мАч/г после 100 циклов при плотности тока 50 мА/г.
Среди них аморфный упорядоченный мезопористый углерод (OMC) представляет два интересных аспекта для хранения ионов K: большее межслоевое расстояние и большее количество краев и дефектов, чем графит, подходящий для интеркаляции и адсорбции ионов K + соответственно (Wang W. и др., 2018). Таким образом, этот углерод проявлял более высокую обратимую емкость, чем графит, в течение первых циклов, которая сохранялась на уровне 257 мАч/г после 100 циклов при плотности тока 50 мА/г.
Среди других углеродистых материалов, исследованных в качестве возможных анодных материалов для KIB, УНТ кажутся многообещающими благодаря образуемой ими взаимосвязанной проводящей сети, которая также позволяет избежать добавления материалов мертвого объема, таких как связующее вещество и проводящая добавка. Легированные азотом маты УНТ, собранные в стопку, полученные с помощью CVD, демонстрируют обратимую емкость 236 мАч/г после 100 циклов при 20 мА/г, тогда как многослойные маты УНТ не интеркалируют ионы K + обратимо (Zhao et al. , 2018). Легированные азотом УНТ, полученные пиролизом металлоорганического каркаса, обеспечивают 255 мАч/г при 50 мА/г после 300 циклов и превосходную пропускную способность при 100 мАч/г при 2 А/г с KPF 6 (0,8 М) EC /DEC электролит (Xiong et al., 2018a). Ван и др. сообщили о подробном исследовании иерархической губки УНТ с модулированной объемной плотностью от 8 до 21 мг/см 3 и показали, что менее плотные УНТ, имеющие более высокий объем макропор и более высокую удельную емкость (Wang Y. et al., 2018).
, 2018). Легированные азотом УНТ, полученные пиролизом металлоорганического каркаса, обеспечивают 255 мАч/г при 50 мА/г после 300 циклов и превосходную пропускную способность при 100 мАч/г при 2 А/г с KPF 6 (0,8 М) EC /DEC электролит (Xiong et al., 2018a). Ван и др. сообщили о подробном исследовании иерархической губки УНТ с модулированной объемной плотностью от 8 до 21 мг/см 3 и показали, что менее плотные УНТ, имеющие более высокий объем макропор и более высокую удельную емкость (Wang Y. et al., 2018).
Изменяя морфологию, CNF также были тщательно исследованы. УНВ, приготовленный электроспиннингом, показал высокую стабильность при циклировании, поддерживая 210 мАч/г в течение 1200 циклов при 200 мА/г с KPF 6 (0,8 М) в электролите EC/DEC (Zhao et al., 2017). УНВ, легированные азотом, синтезированные путем карбонизации в атмосфере N 2 предшественника полипиррола, продемонстрировали аналогичные характеристики с хорошим сохранением емкости и высокой скоростью (Xu et al. , 2018). Количественный анализ свойств хранения N-УНВ, карбонизированных при различных температурах от 650 до 1100°C, показал, что низкие температуры индуцируют процесс адсорбции/десорбции K + , приписываемый емкостному поведению, тогда как более высокие температуры карбонизации приводят к внедрению K + Фарадея. /экстракционные процессы.Это было хорошо описано Lin et al. с использованием спектроскопии комбинационного рассеяния света operando на УНВ, карбонизированном при 650, 1250 и 2800°C (Lin et al., 2019). Они показали, что присутствие огромных N-индуцированных дефектов или оксигенированных функциональных групп с использованием низкотемпературной карбонизации приводит к емкостным накопительным характеристикам при потенциале выше 1 В. in situ Рамановские наблюдения выявили стадийный процесс на графеновых слоях с образованием KC 24 и KC 8 (рис. 3).Положительное влияние N-легирования на графеновые слои ранее было продемонстрировано Pint et al.
, 2018). Количественный анализ свойств хранения N-УНВ, карбонизированных при различных температурах от 650 до 1100°C, показал, что низкие температуры индуцируют процесс адсорбции/десорбции K + , приписываемый емкостному поведению, тогда как более высокие температуры карбонизации приводят к внедрению K + Фарадея. /экстракционные процессы.Это было хорошо описано Lin et al. с использованием спектроскопии комбинационного рассеяния света operando на УНВ, карбонизированном при 650, 1250 и 2800°C (Lin et al., 2019). Они показали, что присутствие огромных N-индуцированных дефектов или оксигенированных функциональных групп с использованием низкотемпературной карбонизации приводит к емкостным накопительным характеристикам при потенциале выше 1 В. in situ Рамановские наблюдения выявили стадийный процесс на графеновых слоях с образованием KC 24 и KC 8 (рис. 3).Положительное влияние N-легирования на графеновые слои ранее было продемонстрировано Pint et al. через исследование, посвященное множеству графенов (Share et al., 2016b). Для всех вышеупомянутых исследований низкий кулоновский КПД на первых циклах из-за высокой удельной площади, приводящей к сильному разложению электролита, а также форма профилей потенциала с прогрессивным наклоном остаются препятствием для промышленного применения.
через исследование, посвященное множеству графенов (Share et al., 2016b). Для всех вышеупомянутых исследований низкий кулоновский КПД на первых циклах из-за высокой удельной площади, приводящей к сильному разложению электролита, а также форма профилей потенциала с прогрессивным наклоном остаются препятствием для промышленного применения.
Рисунок 3 . Слева: потенциальный профиль при 25 мА/г и спектры комбинационного рассеяния in situ УНВ, отожженного при 1250°C (вверху), и УНВ, отожженного при 2800°C (внизу).Справа, номинальные возможности электродов УНВ. Адаптировано из Lin et al. (2019) с разрешения Elsevier.
Характеристики твердого углерода, известного отрицательного электрода в NIB (Irisarri et al., 2015), также были исследованы в KIB. В подробном исследовании Jian et al. сравнили электрохимическую реакцию Na + и K + с электродами из твердых углеродных микросфер, полученных пиролизом сахарозы (Jian et al. , 2016). Среднее потенциальное плато немного больше, а поляризация выше с калием, чем с натрием.Однако лучшая скорость и сохранение емкости были получены для калия с 216 мАч/г после 100 циклов при скорости C/10 с KPF 6 (0,8 М) в электролите EC/DEC. Сравнительная работа по твердости углерода была проведена Ji et al. использование твердых углеродов, мягких углеродов и их смешанных композитов для определения основных характеристик неграфитового углерода для хранения калия (Jian et al., 2017). Их электрохимическая оценка показала, что смешанный композит демонстрирует наилучшие характеристики, сочетая хорошую циклическую стабильность и высокую производительность мягкого и твердого углерода соответственно.Предварительная термическая обработка твердых углей, полученных из сахаридов, перед карбонизацией, по-видимому, является ключевым моментом для получения каркасной структуры, подобной молекулярному ситу, образованной сшитыми турбостратными нанодоменами, которая остается стабильной при калиевом и, следовательно, отвечает за хороший срок службы.
, 2016). Среднее потенциальное плато немного больше, а поляризация выше с калием, чем с натрием.Однако лучшая скорость и сохранение емкости были получены для калия с 216 мАч/г после 100 циклов при скорости C/10 с KPF 6 (0,8 М) в электролите EC/DEC. Сравнительная работа по твердости углерода была проведена Ji et al. использование твердых углеродов, мягких углеродов и их смешанных композитов для определения основных характеристик неграфитового углерода для хранения калия (Jian et al., 2017). Их электрохимическая оценка показала, что смешанный композит демонстрирует наилучшие характеристики, сочетая хорошую циклическую стабильность и высокую производительность мягкого и твердого углерода соответственно.Предварительная термическая обработка твердых углей, полученных из сахаридов, перед карбонизацией, по-видимому, является ключевым моментом для получения каркасной структуры, подобной молекулярному ситу, образованной сшитыми турбостратными нанодоменами, которая остается стабильной при калиевом и, следовательно, отвечает за хороший срок службы. композита. Используя оптимизированные параметры синтеза и связующее PA-Na, Yamamoto et al. получили обратимую емкость 290 мАч/г в течение 50 циклов при 25 мА/г с KFSI (1 M) в электролите EC/DEC (Yamamoto et al., 2018).
композита. Используя оптимизированные параметры синтеза и связующее PA-Na, Yamamoto et al. получили обратимую емкость 290 мАч/г в течение 50 циклов при 25 мА/г с KFSI (1 M) в электролите EC/DEC (Yamamoto et al., 2018).
В заключение следует отметить, что в качестве потенциальных отрицательных электродов для KIB был изучен широкий спектр углеродистых материалов. Графитовые соединения могут обратимо интеркалировать ионы калия при низком потенциале после поэтапного процесса до образования KC 8 с теоретической емкостью 279 мАч/г, но они обладают относительно низкой скоростью. Пористые угли с большой удельной площадью, такие как CNF или CNT, характеризуются емкостным поведением с адсорбцией/десорбцией K + внутри пористой структуры, демонстрируя более высокий рабочий потенциал и лучшее сохранение емкости и скорости, чем графит.Синтез материалов со специальной структурой, сочетающей преимущества графитовых соединений и пористого углерода, может позволить разработать более эффективные отрицательные электроды для KIB.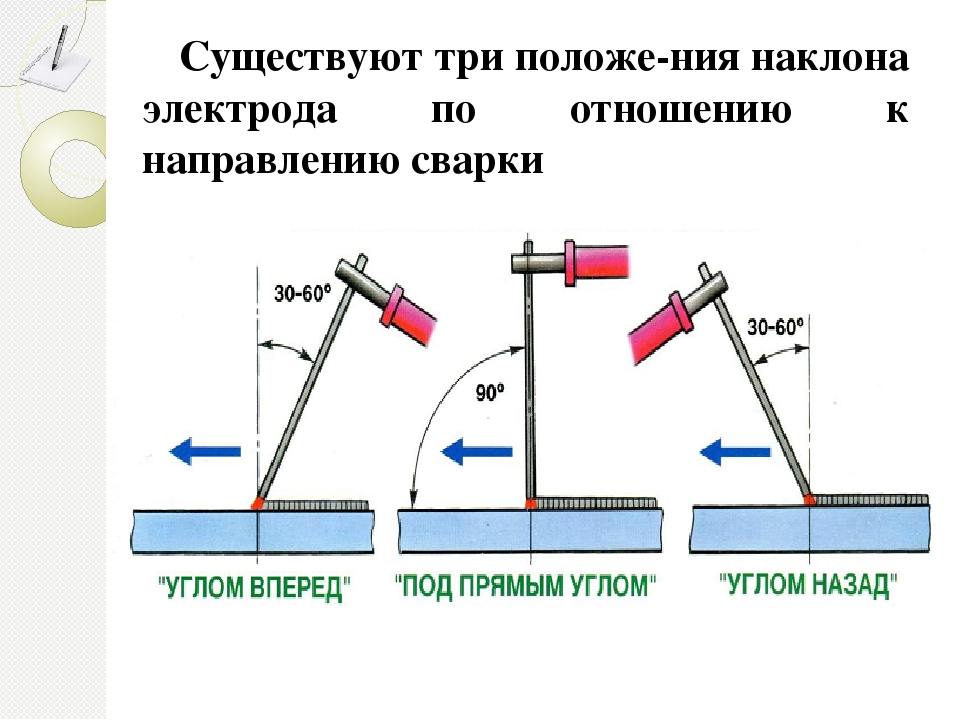
Электроды вставного типа
Соединения на основе титана
Помимо графита и углеродистых материалов, большинство неорганических материалов вставочного типа, исследованных на предмет их потенциального применения в качестве отрицательных электродов в KIB, основаны на окислительно-восстановительной паре Ti 3+ /Ti 4+ .Репрезентативные исследования электрохимических свойств оксидов, фосфатов и карбидов титана возобновляются в следующих параграфах.
Электрохимическое внедрение лития и натрия в полиморфные модификации диоксида титана в прошлом интенсивно изучалось, особенно в качестве модельных электродных материалов. Что еще более интересно с точки зрения способности к циклированию, щелочные оксиды титана, такие как шпинель Li 4 Ti 5 O 12 или моноклинная Na 2 Ti 3 O 7 , сочетают в себе недорогой синтез и нетоксичность, а Li 4 Ti 5 O 12 в настоящее время находится в центре внимания аккумуляторной промышленности. Чтобы обойти низкую электронную проводимость Na 2 Ti 3 O 7 , Li et al. произвели гидрогенизированные нанопроволоки, выращенные на углеродной губке, легированной азотом, и полученный композит демонстрирует емкость на ранней стадии 108 мАч/г при 100 мА/г и хорошее сохранение емкости с KPF 6 (1M) в электролите EC:DEC ( Ли и др., 2018).
Чтобы обойти низкую электронную проводимость Na 2 Ti 3 O 7 , Li et al. произвели гидрогенизированные нанопроволоки, выращенные на углеродной губке, легированной азотом, и полученный композит демонстрирует емкость на ранней стадии 108 мАч/г при 100 мА/г и хорошее сохранение емкости с KPF 6 (1M) в электролите EC:DEC ( Ли и др., 2018).
Аналоги калия (K 2 Ti 4 , K 9 , K 2 o 6 o 13 , а также K 2 Ti 8 o 17 ) также были недавно исследованы (Рисунок 4).В 2016 году Кишор и соавт. подготовили K 2 Ti 4 O 9 микрометрового размера твердотельным способом и сообщили о начальной емкости 97 мАч/г при 30 мАч/г с KPF 6 (1 M) в EC:PC ( Кишор и др., 2016). Хорошее сохранение емкости наблюдалось при низких скоростях, но быстрое затухание происходит при увеличении плотности тока. Что касается других материалов вставного типа, ожидается, что уменьшение размера частиц улучшит диффузию ионов и, таким образом, повысит производительность. Действительно, наноленты K 2 Ti 4 O 9 , изготовленные из выщелоченного кислотой Ti 3 C 2 (MXene), полученные гидротермальным путем, демонстрируют более высокую емкость даже при высоких скоростях тока, а также более длительный срок службы при циклировании. , используя KPF 6 (1M) в диглимовом электролите (Dong et al., 2017) (рис. 4). Получение нанокомпозитов C-K 2 Ti 4 O 9 путем конверсии Ti 2 AlC также является возможной альтернативой, однако полученный материал был исследован только в качестве электрода ЛИА (Liu et al., 2019). В том же направлении гидротермальными процессами были получены наноструктурированные K 2 Ti 8 O 17 или K 2 Ti 6 O 13 . Используя KPF 6 (0,8 М) в электролите EC:DEC, композитные электроды, изготовленные из акантосфероподобных наностержней K 2 Ti 8 O 17 , демонстрируют при 20 мА/г первую разрядную емкость, превышающую 180 мА·ч/г.
Действительно, наноленты K 2 Ti 4 O 9 , изготовленные из выщелоченного кислотой Ti 3 C 2 (MXene), полученные гидротермальным путем, демонстрируют более высокую емкость даже при высоких скоростях тока, а также более длительный срок службы при циклировании. , используя KPF 6 (1M) в диглимовом электролите (Dong et al., 2017) (рис. 4). Получение нанокомпозитов C-K 2 Ti 4 O 9 путем конверсии Ti 2 AlC также является возможной альтернативой, однако полученный материал был исследован только в качестве электрода ЛИА (Liu et al., 2019). В том же направлении гидротермальными процессами были получены наноструктурированные K 2 Ti 8 O 17 или K 2 Ti 6 O 13 . Используя KPF 6 (0,8 М) в электролите EC:DEC, композитные электроды, изготовленные из акантосфероподобных наностержней K 2 Ti 8 O 17 , демонстрируют при 20 мА/г первую разрядную емкость, превышающую 180 мА·ч/г.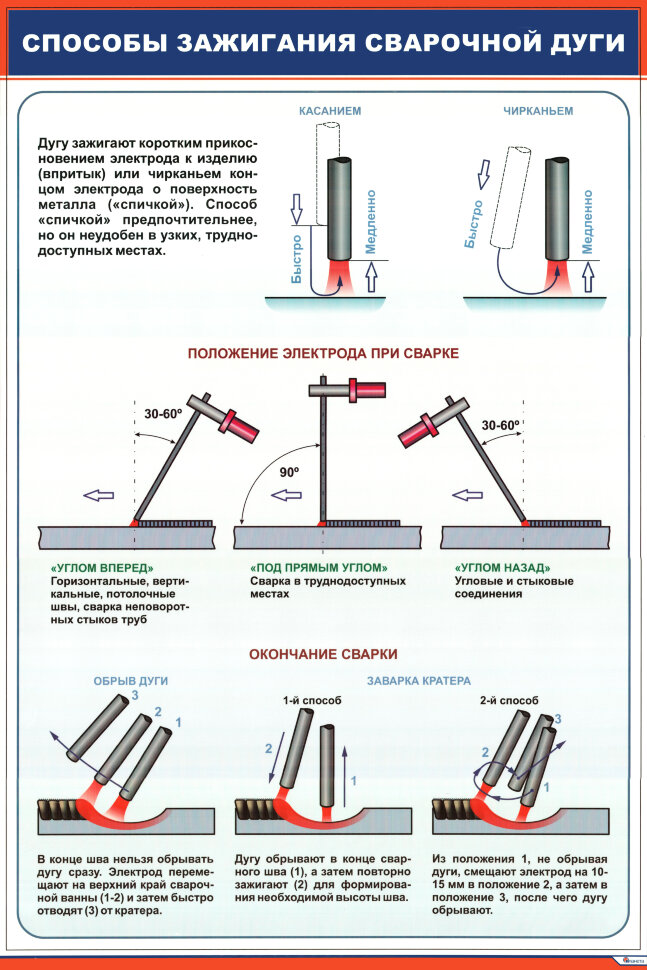 Несмотря на значительную необратимую емкость в первом цикле, эти материалы сохраняют стабильную емкость, превышающую 115 мАч/г, в течение 50 циклов при низких скоростях; это значение, однако, быстро исчезает при увеличении скорости (Han et al., 2016b). В аналогичном подходе наностержни K 2 Ti 6 O 13 , структурированные в микроскаффолдах, были получены с помощью гидротермального процесса в щелочных условиях. При 50 мА/г начальная разрядная емкость приближается к 300 мА·ч/г с KPF 6 (0.8 М) в ПК (с 5 об.% добавки ФЭК) электролите. После значительной необратимой потери при последующем заряде циклическая емкость остается стабильной около 90 мАч/г (Dong et al., 2018). Для всех этих оксидов наблюдается низкая кулоновская эффективность, связанная с возможным образованием SEI или значительным захватом ионов калия в слоистую структуру.
Несмотря на значительную необратимую емкость в первом цикле, эти материалы сохраняют стабильную емкость, превышающую 115 мАч/г, в течение 50 циклов при низких скоростях; это значение, однако, быстро исчезает при увеличении скорости (Han et al., 2016b). В аналогичном подходе наностержни K 2 Ti 6 O 13 , структурированные в микроскаффолдах, были получены с помощью гидротермального процесса в щелочных условиях. При 50 мА/г начальная разрядная емкость приближается к 300 мА·ч/г с KPF 6 (0.8 М) в ПК (с 5 об.% добавки ФЭК) электролите. После значительной необратимой потери при последующем заряде циклическая емкость остается стабильной около 90 мАч/г (Dong et al., 2018). Для всех этих оксидов наблюдается низкая кулоновская эффективность, связанная с возможным образованием SEI или значительным захватом ионов калия в слоистую структуру.
Рисунок 4 . Топ, кристаллические структуры K 2 Ti 4 , K 2 , K 2 Ti 6 O 13 , и K 2 Ti 8 O 17 o 17 (слева направо) демонстрируя слоистую организацию с триплетом октаэдрических цепей TiO 6 с общими ребрами и ионами калия в межслоевом пространстве. Нижняя часть, TEM и HRTEM нанолент Ti 3 C 2 -производного K 2 Ti 4 O 9 и соответствующие электрохимические характеристики. Адаптировано с разрешения Dong et al. (2017) Copyright (2017) Американское химическое общество.
Нижняя часть, TEM и HRTEM нанолент Ti 3 C 2 -производного K 2 Ti 4 O 9 и соответствующие электрохимические характеристики. Адаптировано с разрешения Dong et al. (2017) Copyright (2017) Американское химическое общество.
Полианионные соединения широко исследуются в качестве электродных материалов для LIB и NIB, поскольку они обычно имеют очень открытый каркас, который облегчает диффузию ионов. Кроме того, химическое замещение либо переходного элемента, либо лиганда позволяет настраивать, а иногда и улучшать электрохимические свойства (Messinger et al., 2015). Следовательно, K-содержащие полианионные соединения также могут быть интересными электродами для KIB. Хотя для стороны положительного электрода подходит множество композиций (Hosaka et al., 2019), до сих пор сообщалось, что только KTi 2 типа NASICON (PO 4 ) 3 может использоваться на стороне отрицательного электрода. Чтобы сбалансировать плохую проводимость и получить интересные электрохимические характеристики, необходима инженерия поверхности.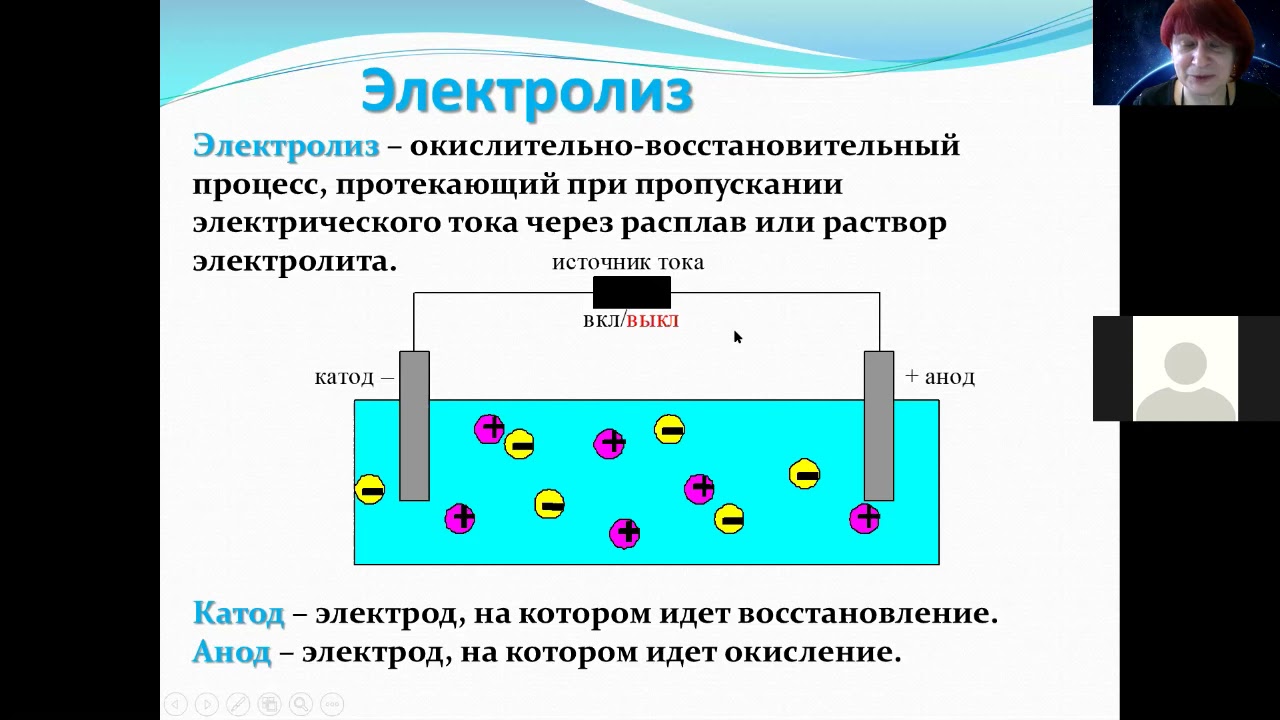 В 2016 году Хан и соавт. оцененный нанокубический KTi 2 (PO 4 ) 3 , полученный гидротермальным способом, и KTi с углеродным покрытием 2 (PO 4 ) 3 , полученный методом с использованием тростникового сахара (Han et al.), 2016а). В обоих случаях плато потенциала разряда при 1,7 В наблюдается после первого цикла, тогда как профиль заряда более пологий (рис. 5). Без углеродного покрытия емкость KTi 2 (PO 4 ) 3 при токе C/2 с KPF 6 (0,8 М) в электролите EC:DEC быстро снижается после начальной разрядной емкости около 75 мАч /g, Spheroidal KTi 2 (PO 4 ) 3 Нанокомпозиты @C, полученные с помощью электрораспыления, используют внутреннюю углеродную сетку и обладают достаточной пористостью для эффективной пропитки электролитом.Следовательно, улучшаются электрохимические характеристики с высокой обратимой емкостью 293 мАч/г при 20 мА/г и очень хорошей пропускной способностью (133 мАч/г при 1 А/г) (Wei et al.
В 2016 году Хан и соавт. оцененный нанокубический KTi 2 (PO 4 ) 3 , полученный гидротермальным способом, и KTi с углеродным покрытием 2 (PO 4 ) 3 , полученный методом с использованием тростникового сахара (Han et al.), 2016а). В обоих случаях плато потенциала разряда при 1,7 В наблюдается после первого цикла, тогда как профиль заряда более пологий (рис. 5). Без углеродного покрытия емкость KTi 2 (PO 4 ) 3 при токе C/2 с KPF 6 (0,8 М) в электролите EC:DEC быстро снижается после начальной разрядной емкости около 75 мАч /g, Spheroidal KTi 2 (PO 4 ) 3 Нанокомпозиты @C, полученные с помощью электрораспыления, используют внутреннюю углеродную сетку и обладают достаточной пористостью для эффективной пропитки электролитом.Следовательно, улучшаются электрохимические характеристики с высокой обратимой емкостью 293 мАч/г при 20 мА/г и очень хорошей пропускной способностью (133 мАч/г при 1 А/г) (Wei et al.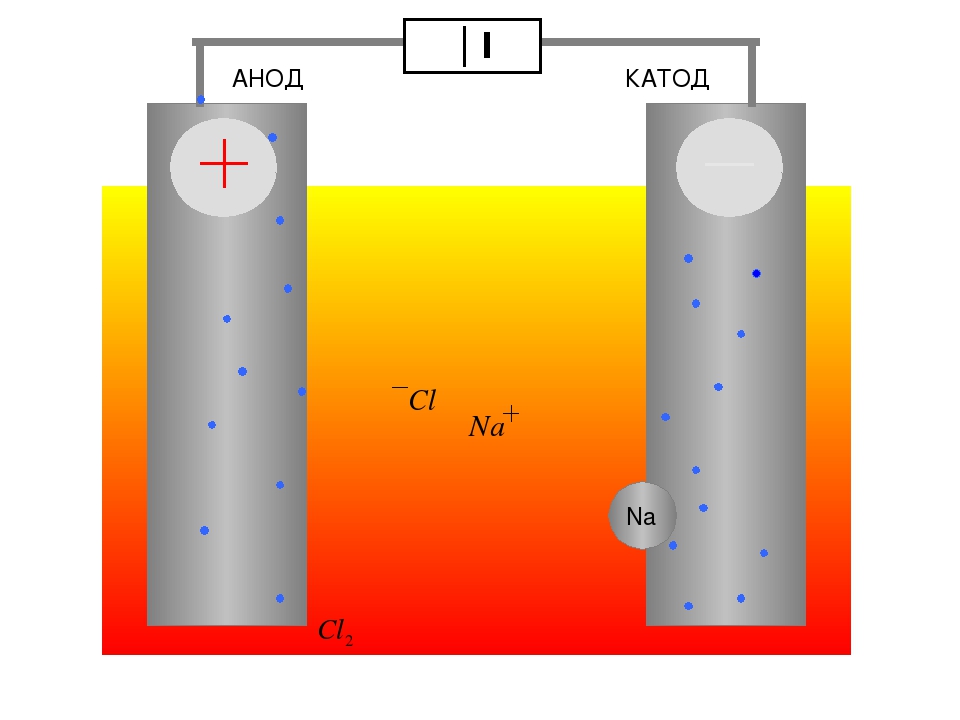 , 2018). Иерархические микросферы Ca 0,5 Ti 2 (PO 4 ) 3 @C также получали электрораспылением. В этом случае двухвалентные катионы кальция индуцируют вакансии в исходных материалах, которые могут усилить ионную диффузию (рис. 5). Интересны электрохимические характеристики со стабилизированной емкостью, близкой к 250 мАч/г при 50 мАч/г (Zhang Z.и др., 2018).
, 2018). Иерархические микросферы Ca 0,5 Ti 2 (PO 4 ) 3 @C также получали электрораспылением. В этом случае двухвалентные катионы кальция индуцируют вакансии в исходных материалах, которые могут усилить ионную диффузию (рис. 5). Интересны электрохимические характеристики со стабилизированной емкостью, близкой к 250 мАч/г при 50 мАч/г (Zhang Z.и др., 2018).
Рисунок 5 . Вверху электрохимические характеристики KTi 2 с покрытием C (PO 4 ) 3 ; ниже кристаллографическая структура Ca 0,5 Ti 2 (PO 4 ) 3 , показывающая катионные вакансии, которые способствуют диффузии ионов калия. Воспроизведено и адаптировано из Han et al. (2016a) с разрешения Королевского химического общества и с разрешения Zhang Z. et al. (2018). Авторское право (2018) WILEY-VCH Verlag GmbH & Co.КГаА, Вайнхайм.
Электрохимическое внедрение калия также было протестировано в соединениях MXene. Эти ранние карбиды или карбонитриды переходных металлов обеспечивают расстояние между пластинами в двумерной морфологии, обеспечивающее быструю ионную диффузию. MXenes обычно получают выщелачиванием слоев A в исходной фазе M n+1 AX n . Это приводит к химическому составу M n+1 X n или M n+1 X n Tx, если они включают анионные концевые группы, полученные на стадии выщелачивания.Теоретическое моделирование внедрения калия в Ti 3 C 2 или O-концевые Ti 2 CO 2 MXenes обеспечивает высокую емкость 192 и 264 мАч/г соответственно (Er et al., 2014; Xie et al. ., 2014). Ti 3 C 2 T x (T = O, F и/или OH) был оценен как электродный материал, обеспечивающий первую разрядную емкость 260 мАч/г (в KPF 6 (1 M) в электролите EC:PC), как и предполагалось. В то время как последующая зарядка все еще интересна (146 мАч/г), при циклировании наблюдается постоянное снижение емкости (до 45 мАч/г после 120 циклов).
Эти ранние карбиды или карбонитриды переходных металлов обеспечивают расстояние между пластинами в двумерной морфологии, обеспечивающее быструю ионную диффузию. MXenes обычно получают выщелачиванием слоев A в исходной фазе M n+1 AX n . Это приводит к химическому составу M n+1 X n или M n+1 X n Tx, если они включают анионные концевые группы, полученные на стадии выщелачивания.Теоретическое моделирование внедрения калия в Ti 3 C 2 или O-концевые Ti 2 CO 2 MXenes обеспечивает высокую емкость 192 и 264 мАч/г соответственно (Er et al., 2014; Xie et al. ., 2014). Ti 3 C 2 T x (T = O, F и/или OH) был оценен как электродный материал, обеспечивающий первую разрядную емкость 260 мАч/г (в KPF 6 (1 M) в электролите EC:PC), как и предполагалось. В то время как последующая зарядка все еще интересна (146 мАч/г), при циклировании наблюдается постоянное снижение емкости (до 45 мАч/г после 120 циклов).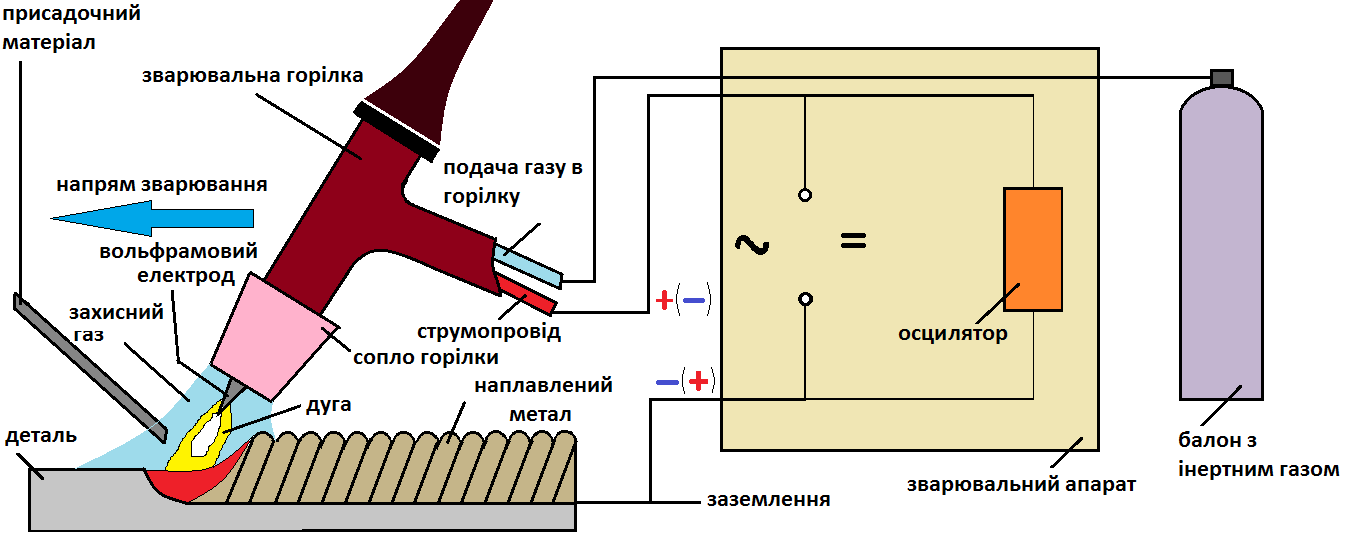 Трехмерные пористые алкализированные наноленты Ti 3 C 2 с расширенным межпластинчатым пространством были легко получены из Ti 3 C 2 в водном КОН Lian et al. Эти материалы сохраняют емкость 42 мАч/г при 200 мАч/г после 500 циклов (Lian et al., 2017).
Трехмерные пористые алкализированные наноленты Ti 3 C 2 с расширенным межпластинчатым пространством были легко получены из Ti 3 C 2 в водном КОН Lian et al. Эти материалы сохраняют емкость 42 мАч/г при 200 мАч/г после 500 циклов (Lian et al., 2017).
Таким образом, несмотря на то, что для материалов вставного анода на основе титана обычно наблюдаются хорошие разрядные емкости, последующее необратимое и быстрое затухание резко снижает общую производительность.Внедрение большого количества ионов калия в жесткие кристаллические структуры не кажется простым, и получаются лишь ограниченные возможности. Кроме того, при повышенных плотностях тока часто наблюдается снижение емкости, что, скорее всего, связано с важными кинетическими ограничениями. Интересно отметить некий консенсус в использовании электролита при изучении таких материалов вставочного типа. Действительно, во всех упомянутых выше работах упоминаются электролиты на основе КПФ 6 . Как показано в случае с другими материалами электродов, ожидается, что электролит будет влиять на характеристики циклирования.Следовательно, повторное использование этих материалов на основе титана с другими электролитными солями и составами может привести к улучшению электрохимических свойств.
Как показано в случае с другими материалами электродов, ожидается, что электролит будет влиять на характеристики циклирования.Следовательно, повторное использование этих материалов на основе титана с другими электролитными солями и составами может привести к улучшению электрохимических свойств.
Другие материалы электродов вставного типа
Электроды на основе ванадатов, таких как многие различные полиморфы V 2 O 5 , интенсивно исследовались на предмет их свойств внедрения щелочи. Оксиды калия-ванадия объединяют широкий спектр соединений, которые в основном предлагаются в качестве материалов положительных электродов для ЛИА.Интересно, что Лю и соавт. повторно посетили гидротермально полученные K 0,23 V 2 O 5 и показали очень низкий потенциал электрохимического внедрения калия (Liu et al., 2018). Очень высокая емкость первого разряда 800 мАч/г (вызванная значительными побочными реакциями) не сохраняется при циклировании, а стабильная емкость 100 мАч/г при 20 мА/г с KPF 6 (0,8 М) в ЭК :DEC в качестве электролита является весьма приемлемым.
Слоистые дихалькогениды переходных металлов имеют пластинчатую структуру с открытыми диффузионными плоскостями.Хотя химическое внедрение калия в слоистый MoS 2 изучалось в течение десятилетий для получения доступа к необычным физическим свойствам, таким как сверхпроводимость, об электрохимическом внедрении сообщалось только недавно. Начиная с коммерческого MoS 2 и используя простую рецептуру электрода, была получена стабильная емкость 65 мАч/г при плотности тока 20 мА/г (Ren et al., 2017). Несмотря на то, что соответствующий окислительно-восстановительный потенциал для материала отрицательного электрода довольно высок (1,2–1,5 В), распространенность MoS 2 может сделать его предпочтительным материалом для устойчивых крупномасштабных приложений.
Легирующие и конверсионные электроды
Свойства электродных материалов вставочного типа, представленные в предыдущих разделах, ясно демонстрируют, что открытые кристаллографические структуры могут оказаться неспособными стабилизировать обратимое внедрение ионов калия в течение длительных периодов времени. С конверсионными и легирующими материалами, наоборот, не возникает проблемы вялой диффузии ионов калия в кристаллическую структуру, поскольку электрохимический процесс полностью меняет форму исходного материала и образует новые калийсодержащие соединения посредством фазовых переходов.В этом разделе в качестве возможных материалов отрицательного электрода будут обсуждаться интерметаллические соединения и материалы конверсионного типа на основе блочных элементов p . Как и в случае с литием и натрием, также и с калием образование таких фаз соответствует высокой теоретической емкости с сопутствующим большим объемным расширением, которое необходимо устранить с помощью электродной техники (Sultana et al., 2018). В некоторых случаях для решения проблемы расширения используется комбинированный подход, объединяющий активные элементы с углеродом, что также может способствовать повышению емкости.
С конверсионными и легирующими материалами, наоборот, не возникает проблемы вялой диффузии ионов калия в кристаллическую структуру, поскольку электрохимический процесс полностью меняет форму исходного материала и образует новые калийсодержащие соединения посредством фазовых переходов.В этом разделе в качестве возможных материалов отрицательного электрода будут обсуждаться интерметаллические соединения и материалы конверсионного типа на основе блочных элементов p . Как и в случае с литием и натрием, также и с калием образование таких фаз соответствует высокой теоретической емкости с сопутствующим большим объемным расширением, которое необходимо устранить с помощью электродной техники (Sultana et al., 2018). В некоторых случаях для решения проблемы расширения используется комбинированный подход, объединяющий активные элементы с углеродом, что также может способствовать повышению емкости.
Среди легирующих элементов сурьма кажется очень интересной из-за ее низкого рабочего потенциала по сравнению с K + /K и ее высокой теоретической емкости 660 мАч/г, соответствующей образованию K 3 Sb. В 2015 году McCulloch et al. исследовал нанокомпозит Sb/C, полученный с помощью шаровой мельницы, и достиг 600 мАч/г при 35 мА/г с KPF 6 (1M) в электролите EC:PC (McCulloch et al., 2015). Образование кубической формы K 3 Sb было показано методом РФА. Общий электрохимический механизм позже был детализирован другими группами.Образование аморфных интермедиатов K x Sb было предположено операндо XRD, а аморфное состояние Sb после заряда было подтверждено спектроскопией комбинационного рассеяния, тогда как наша группа также указала на образование незначительных количеств гексагональных K 3 Sb (Цолов и Илиев, 1992; Габаудан и др., 2018а; Хан и др., 2018; Йи и др., 2018) (рис. 6). Здесь важно отметить, что в этих работах использовались различные типы первичных частиц, от объемного Sb до наночастиц, заключенных в пористую углеродную матрицу, что приводило к очень похожим электрохимическим механизмам.Кроме того, механизм реакции Sb с K еще полностью не изучен из-за значительной аморфизации материала во время циклирования, и в будущем необходимо предпринять ряд усилий для выявления структурных превращений, происходящих во время циклирования.
В 2015 году McCulloch et al. исследовал нанокомпозит Sb/C, полученный с помощью шаровой мельницы, и достиг 600 мАч/г при 35 мА/г с KPF 6 (1M) в электролите EC:PC (McCulloch et al., 2015). Образование кубической формы K 3 Sb было показано методом РФА. Общий электрохимический механизм позже был детализирован другими группами.Образование аморфных интермедиатов K x Sb было предположено операндо XRD, а аморфное состояние Sb после заряда было подтверждено спектроскопией комбинационного рассеяния, тогда как наша группа также указала на образование незначительных количеств гексагональных K 3 Sb (Цолов и Илиев, 1992; Габаудан и др., 2018а; Хан и др., 2018; Йи и др., 2018) (рис. 6). Здесь важно отметить, что в этих работах использовались различные типы первичных частиц, от объемного Sb до наночастиц, заключенных в пористую углеродную матрицу, что приводило к очень похожим электрохимическим механизмам.Кроме того, механизм реакции Sb с K еще полностью не изучен из-за значительной аморфизации материала во время циклирования, и в будущем необходимо предпринять ряд усилий для выявления структурных превращений, происходящих во время циклирования. Это невозможно сделать без использования мощных методов исследования локальной среды вокруг атомов Sb, таких как анализ XAS или PDF, путем сравнения образцов, полученных с помощью электрохимии, с эталонами, приготовленными с помощью химии твердого тела, как это было сделано в прошлом для Sb в NIB ( Аллан и др., 2016; Дарвич и др., 2018).
Это невозможно сделать без использования мощных методов исследования локальной среды вокруг атомов Sb, таких как анализ XAS или PDF, путем сравнения образцов, полученных с помощью электрохимии, с эталонами, приготовленными с помощью химии твердого тела, как это было сделано в прошлом для Sb в NIB ( Аллан и др., 2016; Дарвич и др., 2018).
Рисунок 6 . Слева: гальваностатические профили Sb (вверху) и Bi (внизу) электродов, циклически повторяющихся со скоростью C/5. Середина, операндо XRD картины, записанные во время первого цикла. Справа: изменение нормализованного объема при добавлении калия. Перепечатано с разрешения Gabaudan et al. (2018а). Авторское право (2018) Американское химическое общество.
Подобно сурьме, висмут может реагировать с калием с образованием K 3 Bi, что соответствует теоретической емкости 385 мАч/г.Какой бы ни была природа Bi-электрода и электролита, наблюдается одно плато потенциала около 0,35 В в гальваностатических условиях во время первого разряда, что свидетельствует о двухфазной реакции.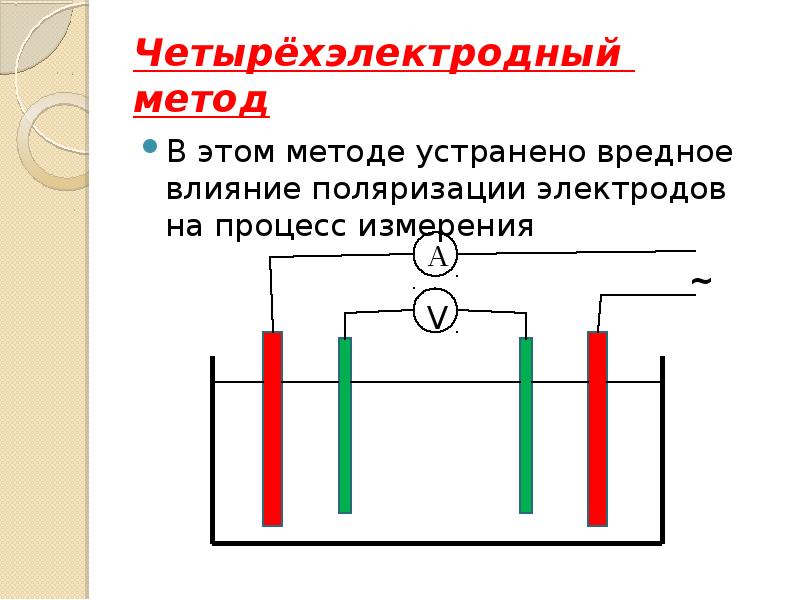 Однако во время следующих разверток можно обнаружить три плоских плато между 0,5 и 1,3 В, что соответствует трем независимым стадиям реакции. Очень рано Zhang et al. предложили обратимое калийование в два этапа от Bi до KBI, а затем от KBi до K 3 Bi, тогда как Guo et al. предположил образование твердого раствора Bi-K перед двухфазной реакцией между K 5 Bi 4 и K 3 Bi.Хуанг и др. подтвердили экспериментальные данные расчетами DFT и показали непрерывное образование K 3 Bi во время первого восстановления, а затем трехстадийный процесс при окислении, ведущий последовательно к K 3 Bi 2 и KiB 2 и Bi, отбрасывая K 5 Bi 4 и KBi. Тот же механизм был предложен Lei и др. . с уточнениями Ритвельда ex situ рентгенограмм и Gabaudan et al. в условиях операндо (рис. 6).Олово является хорошо известным анодным материалом в LIB и NIB, теоретически обеспечивающим удельную емкость 991 и 847 мАч/г, что соответствует образованию Li 22 Sn 5 и Na 15 Sn 4 соответственно.
Однако во время следующих разверток можно обнаружить три плоских плато между 0,5 и 1,3 В, что соответствует трем независимым стадиям реакции. Очень рано Zhang et al. предложили обратимое калийование в два этапа от Bi до KBI, а затем от KBi до K 3 Bi, тогда как Guo et al. предположил образование твердого раствора Bi-K перед двухфазной реакцией между K 5 Bi 4 и K 3 Bi.Хуанг и др. подтвердили экспериментальные данные расчетами DFT и показали непрерывное образование K 3 Bi во время первого восстановления, а затем трехстадийный процесс при окислении, ведущий последовательно к K 3 Bi 2 и KiB 2 и Bi, отбрасывая K 5 Bi 4 и KBi. Тот же механизм был предложен Lei и др. . с уточнениями Ритвельда ex situ рентгенограмм и Gabaudan et al. в условиях операндо (рис. 6).Олово является хорошо известным анодным материалом в LIB и NIB, теоретически обеспечивающим удельную емкость 991 и 847 мАч/г, что соответствует образованию Li 22 Sn 5 и Na 15 Sn 4 соответственно.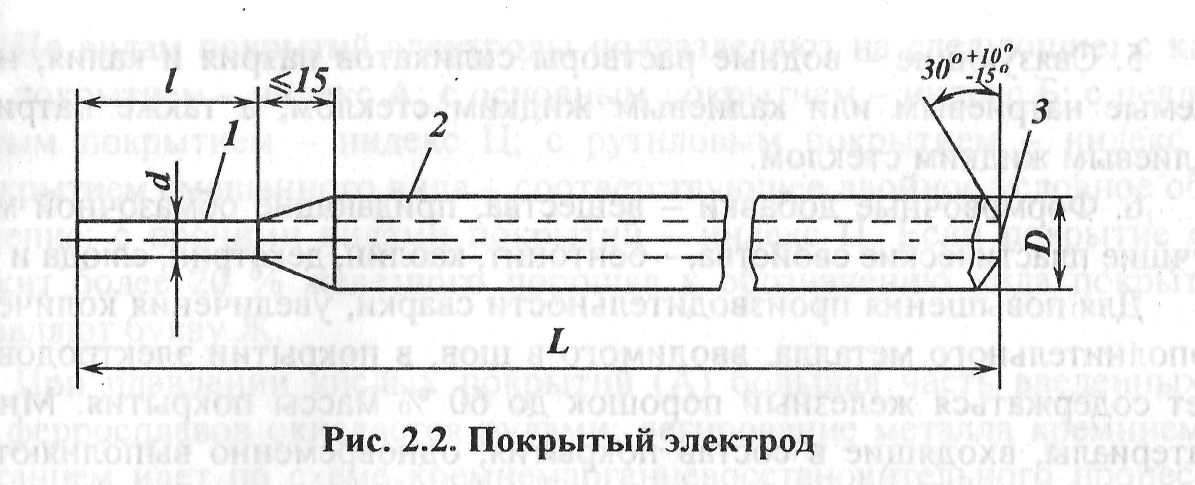 Кроме того, олово широко распространено, дешево и нетоксично. В KIB расчеты первого принципа DFT предполагали образование KSn как наиболее калиевой фазы при среднем потенциале 0,5 В, что приводит к емкости 226 мАч / г (Kim et al., 2018). В первом экспериментальном исследовании Sultana et al.композит Sn/C, полученный путем измельчения в шаровой мельнице, показал первую обратимую емкость 150 мАч/г (Sultana et al., 2016). Соответствующий гальваностатический профиль показывает одно плато во время разряда, тогда как при заряде наблюдаются (но не объясняются) несколько процессов. Ван и др. получили аналогичные характеристики с использованием наночастиц Sn и идентифицировали образование KSn как с помощью XRD ex situ , так и с помощью электронной дифракции (Wang et al., 2017). Глядя на эволюцию объемного расширения in situ TEM, они также предположили образование аморфного K 4 Sn 9 в качестве промежуточной фазы только во время разряда.Совсем недавно синхротронный рентгеновский анализ i n situ , выполненный на пленке CVD Sn, циклически повторяемой со скоростью 0,1 мВ/с, показал, что Sn также может быть непосредственно преобразован в KSn (Ramireddy et al.
Кроме того, олово широко распространено, дешево и нетоксично. В KIB расчеты первого принципа DFT предполагали образование KSn как наиболее калиевой фазы при среднем потенциале 0,5 В, что приводит к емкости 226 мАч / г (Kim et al., 2018). В первом экспериментальном исследовании Sultana et al.композит Sn/C, полученный путем измельчения в шаровой мельнице, показал первую обратимую емкость 150 мАч/г (Sultana et al., 2016). Соответствующий гальваностатический профиль показывает одно плато во время разряда, тогда как при заряде наблюдаются (но не объясняются) несколько процессов. Ван и др. получили аналогичные характеристики с использованием наночастиц Sn и идентифицировали образование KSn как с помощью XRD ex situ , так и с помощью электронной дифракции (Wang et al., 2017). Глядя на эволюцию объемного расширения in situ TEM, они также предположили образование аморфного K 4 Sn 9 в качестве промежуточной фазы только во время разряда.Совсем недавно синхротронный рентгеновский анализ i n situ , выполненный на пленке CVD Sn, циклически повторяемой со скоростью 0,1 мВ/с, показал, что Sn также может быть непосредственно преобразован в KSn (Ramireddy et al. , 2017). Объемное расширение в результате образования KSn составляет 180%, что относительно мало по сравнению с образованием Li 22 Sn 5 (257%) и Na 15 Sn 4 (410%) в LIB и NIB. Тем не менее, калиевое олово также сопровождается многочисленными трещинами, вызывающими распыление электрода и непрерывную деградацию электролита при воздействии электролита на поверхность свежего олова.
, 2017). Объемное расширение в результате образования KSn составляет 180%, что относительно мало по сравнению с образованием Li 22 Sn 5 (257%) и Na 15 Sn 4 (410%) в LIB и NIB. Тем не менее, калиевое олово также сопровождается многочисленными трещинами, вызывающими распыление электрода и непрерывную деградацию электролита при воздействии электролита на поверхность свежего олова.
Параллельно с пониманием механизма электрохимического сплавления было предложено несколько стратегий, направленных на улучшение характеристик циклирования. В своей основополагающей работе McCulloch et al. наблюдали быстрое снижение емкости после нескольких циклов с нанокомпозитом Sb/C. Уменьшив потенциальное окно, они ограничили объемное расширение и стабилизировали обратимую емкость на уровне 250 мАч/г в течение почти 50 циклов (McCulloch et al., 2015). Состав композиционного материала играет важную роль в характеристиках цикла, как сообщалось для шарового измельчения Sb/C (Sultana et al. , 2019). Большее количество углерода позволило улучшить стабильность при циклировании, но при расчете емкости с учетом массы композита получается уменьшенная емкость. Выбор электролита также является ключевым параметром для повышения производительности. С электродами на основе Sb использование соли KFSI вместо KPF 6 в смеси EC:DEC позволило получить лучшую стабильность SEI и, следовательно, более высокую кулоновскую эффективность и сохранение емкости (Madec et al., 2018; Zhang Q. et др., 2018). Повышение производительности также может быть достигнуто за счет использования концентрированных солей электролитов, как сообщалось Liu et al.с KFSI (3M) в DME, что дает для композитного электрода Sb / C емкость 200 мАч / г после 800 циклов при 1 А / г (Liu Q. et al., 2018). Переходя к электродам на основе висмута, также интересно отметить, что электролиты на основе карбоната кажутся неподходящими, поскольку они приводят к быстрому снижению емкости. Кроме того, непонятно, почему плато, соответствующие фазовым переходам KBi 2 -Bi и K 3 Bi 2 -KBi 2 , не сохраняются при циклировании с использованием карбонатных электролитов, а сохраняются использование эфиров в качестве растворителей электролитов.
, 2019). Большее количество углерода позволило улучшить стабильность при циклировании, но при расчете емкости с учетом массы композита получается уменьшенная емкость. Выбор электролита также является ключевым параметром для повышения производительности. С электродами на основе Sb использование соли KFSI вместо KPF 6 в смеси EC:DEC позволило получить лучшую стабильность SEI и, следовательно, более высокую кулоновскую эффективность и сохранение емкости (Madec et al., 2018; Zhang Q. et др., 2018). Повышение производительности также может быть достигнуто за счет использования концентрированных солей электролитов, как сообщалось Liu et al.с KFSI (3M) в DME, что дает для композитного электрода Sb / C емкость 200 мАч / г после 800 циклов при 1 А / г (Liu Q. et al., 2018). Переходя к электродам на основе висмута, также интересно отметить, что электролиты на основе карбоната кажутся неподходящими, поскольку они приводят к быстрому снижению емкости. Кроме того, непонятно, почему плато, соответствующие фазовым переходам KBi 2 -Bi и K 3 Bi 2 -KBi 2 , не сохраняются при циклировании с использованием карбонатных электролитов, а сохраняются использование эфиров в качестве растворителей электролитов. Выбор калиевой соли также имеет решающее значение: более высокая кулоновская эффективность сообщается как с солью KFSI вместо KPF 6 , так и с электролитами на основе эфира, включая моноглим или диглим, вместо электролитов на основе карбоната. Концентрация соли также играет важную роль в работе электрода, как было показано Zhang et al. с солью KTFSI в диглиме, обеспечивающей лучшие характеристики композитного электрода Bi@C с электролитом, концентрированным 5 М солями (Zhang R. et al., 2018). Недавно было достигнуто выдающееся сохранение емкости 550 мАч/г после 100 циклов для композита Sb/C, синтезированного с помощью стратегии с электрораспылением, подвергнутого циклированию с KTFSI (4 M) в смеси EC/DEC (Zheng et al., 2019). Что касается влияния растворителя, то об этом сообщили Chen et al. что молекулы моноглима подвергаются специфической химической адсорбции на поверхности Bi-электродов, что приводит к стабильному SEI и лучшей производительности по сравнению с электролитами на основе ПК (Lei et al.
Выбор калиевой соли также имеет решающее значение: более высокая кулоновская эффективность сообщается как с солью KFSI вместо KPF 6 , так и с электролитами на основе эфира, включая моноглим или диглим, вместо электролитов на основе карбоната. Концентрация соли также играет важную роль в работе электрода, как было показано Zhang et al. с солью KTFSI в диглиме, обеспечивающей лучшие характеристики композитного электрода Bi@C с электролитом, концентрированным 5 М солями (Zhang R. et al., 2018). Недавно было достигнуто выдающееся сохранение емкости 550 мАч/г после 100 циклов для композита Sb/C, синтезированного с помощью стратегии с электрораспылением, подвергнутого циклированию с KTFSI (4 M) в смеси EC/DEC (Zheng et al., 2019). Что касается влияния растворителя, то об этом сообщили Chen et al. что молекулы моноглима подвергаются специфической химической адсорбции на поверхности Bi-электродов, что приводит к стабильному SEI и лучшей производительности по сравнению с электролитами на основе ПК (Lei et al. , 2018). Таким образом, они получили емкость 320 мАч/г при 2°С (800 мА/г) после 300 циклов с электролитом на основе ДМЭ в конфигурации полуэлемента K/Bi.Нанокомпозит Bi/rGO, синтезированный в растворе при комнатной температуре, сохранял емкость 290 мАч/г после 50 циклов при 50 мА/г (Zhang Q. et al., 2018). Такие же тенденции наблюдались и для электродов на основе олова. Использование соли KFSI вместо KPF 6 в EC:DEC, а также ограниченное потенциальное окно между 0,01 и 1,2 В привело к улучшению циклических характеристик (Ramireddy et al., 2017; Zhang Q. et al., 2018).
, 2018). Таким образом, они получили емкость 320 мАч/г при 2°С (800 мА/г) после 300 циклов с электролитом на основе ДМЭ в конфигурации полуэлемента K/Bi.Нанокомпозит Bi/rGO, синтезированный в растворе при комнатной температуре, сохранял емкость 290 мАч/г после 50 циклов при 50 мА/г (Zhang Q. et al., 2018). Такие же тенденции наблюдались и для электродов на основе олова. Использование соли KFSI вместо KPF 6 в EC:DEC, а также ограниченное потенциальное окно между 0,01 и 1,2 В привело к улучшению циклических характеристик (Ramireddy et al., 2017; Zhang Q. et al., 2018).
Другие легирующие материалы, такие как Si, Ge и Pb, в настоящее время привлекают незначительное внимание.Эти элементы могут реагировать только с одним калием, что приводит к интересным теоретическим емкостям 954, 369 и 129 мАч/г соответственно. Что касается кремния, Sultana et al. не получили надежных доказательств электрохимического калиевого электрода Si/графена в отличие от предсказанного образования сплава KSi, предложенного Ceder (Kim et al.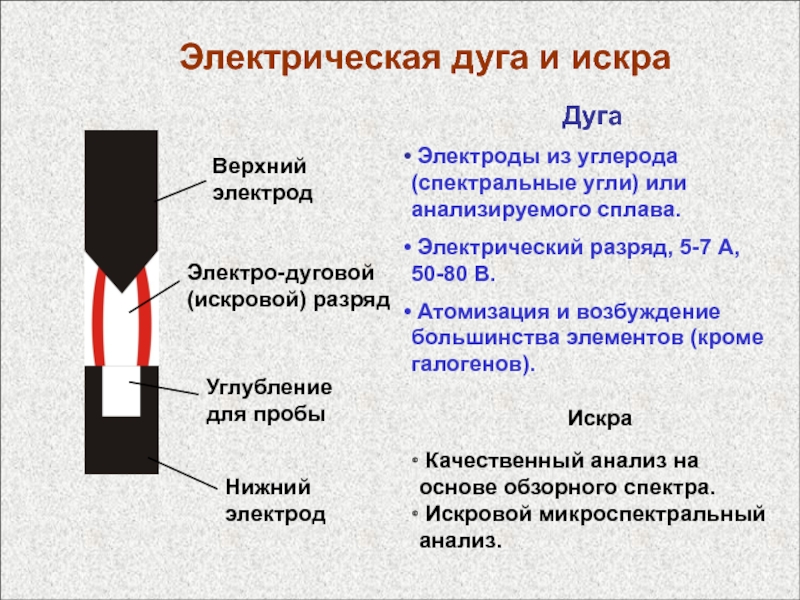 , 2018; Sultana et al., 2018). Единственное сообщение об электрохимической активности кремния можно найти в работе Komaba et al., которые использовали композит Si/графит, составленный с связующим PA-Na, который показал обратимую емкость 510 мАч/г (Kubota et al., 2018). С другой стороны, об активности Ge в KIB сообщили только Guo et al. с использованием GeP 5 , что приводит к образованию KGe (Zhang et al., 2018a). Свинец имеет относительно низкую теоретическую емкость (127 мАч/г). Путь электрохимического сплавления тщательно прослеживался в operando XRD, показывающем трехстадийный процесс во время разряда с K 10 Pb 48 и K 4 Pb 9 промежуточными продуктами и KPb в качестве конечного продукта, тогда как только K 4 Pb 9 обнаруживается во время загрузки перед извлечением металлического свинца (Gabaudan et al., 2018б).
, 2018; Sultana et al., 2018). Единственное сообщение об электрохимической активности кремния можно найти в работе Komaba et al., которые использовали композит Si/графит, составленный с связующим PA-Na, который показал обратимую емкость 510 мАч/г (Kubota et al., 2018). С другой стороны, об активности Ge в KIB сообщили только Guo et al. с использованием GeP 5 , что приводит к образованию KGe (Zhang et al., 2018a). Свинец имеет относительно низкую теоретическую емкость (127 мАч/г). Путь электрохимического сплавления тщательно прослеживался в operando XRD, показывающем трехстадийный процесс во время разряда с K 10 Pb 48 и K 4 Pb 9 промежуточными продуктами и KPb в качестве конечного продукта, тогда как только K 4 Pb 9 обнаруживается во время загрузки перед извлечением металлического свинца (Gabaudan et al., 2018б).
Среди p -блочных элементов фосфор представляется очень многообещающим электродным материалом благодаря его большому содержанию и очень высокой теоретической емкости: ожидается 2594 мАч/г для образования K 3 P.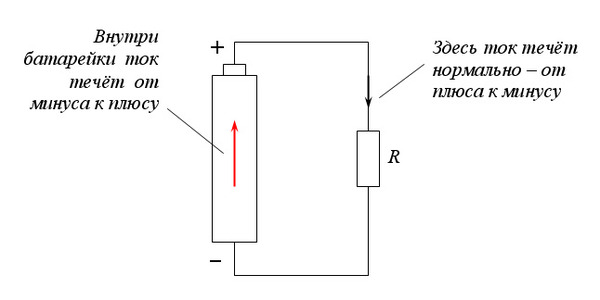 Фаза КП Диаграмма представляет следующий диапазон сплавов: K 3 P, K 4 P 3 , KP, K 4 P 6 , K 3 P 7 , K 3 P 11 и KP 15 могут наблюдаться при электрохимическом калиевании фосфора (Sangster, 2010).Расчеты по первому принципу, проведенные Ceder et al. показали, что фазы KP и K 4 P 3 могут образовываться при потенциале 0,8 и 0,2 В соответственно, тогда как K 3 P в их расчетах оказались нестабильными (Kim et al., 2018). Однако фосфор страдает как от низкой электропроводности, так и от значительного объемного расширения, как и все легирующие материалы. Использование интерметаллических соединений, а также наноструктурирование пористых углеродных каркасов являются возможными решениями для преодоления этих недостатков.Сочетание фосфора с другими активными элементами или поиск наноструктурированных архитектур в пористых проводящих каркасах является обязательным, чтобы сбалансировать его низкую электропроводность.
Фаза КП Диаграмма представляет следующий диапазон сплавов: K 3 P, K 4 P 3 , KP, K 4 P 6 , K 3 P 7 , K 3 P 11 и KP 15 могут наблюдаться при электрохимическом калиевании фосфора (Sangster, 2010).Расчеты по первому принципу, проведенные Ceder et al. показали, что фазы KP и K 4 P 3 могут образовываться при потенциале 0,8 и 0,2 В соответственно, тогда как K 3 P в их расчетах оказались нестабильными (Kim et al., 2018). Однако фосфор страдает как от низкой электропроводности, так и от значительного объемного расширения, как и все легирующие материалы. Использование интерметаллических соединений, а также наноструктурирование пористых углеродных каркасов являются возможными решениями для преодоления этих недостатков.Сочетание фосфора с другими активными элементами или поиск наноструктурированных архитектур в пористых проводящих каркасах является обязательным, чтобы сбалансировать его низкую электропроводность.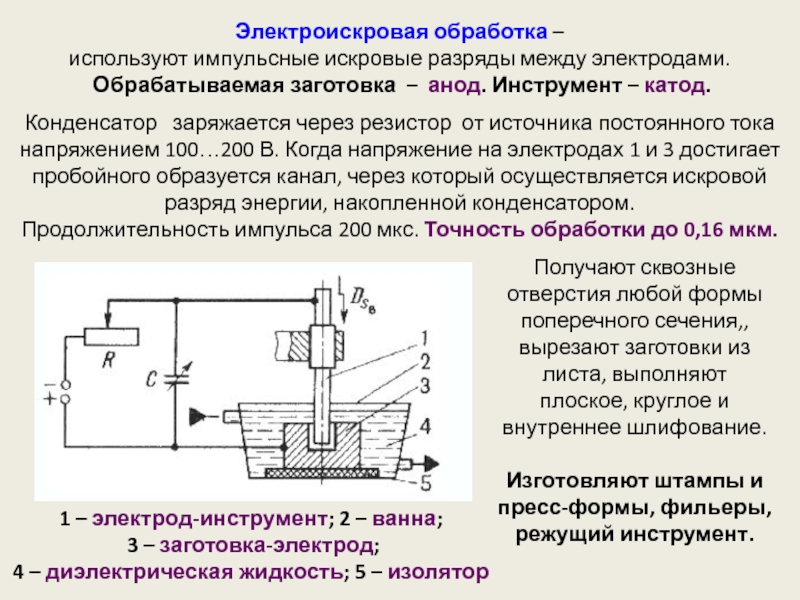 Первое исследование фосфорсодержащего соединения было проведено Guo et al. с использованием композита Sn 4 P 3 /C, который показал емкость 307 мАч/г после 50 циклов при 50 мА/г, что намного лучше. чем оба электрода P/C или Sn/C (Zhang W. et al., 2017) (рис. 7). Синтез наночастиц Sn 4 P 3 , встроенных в пористые углеродные волокна, в дополнение к замене соли KPF 6 на KFSI позволил значительно улучшить циклические характеристики (Zhang et al., 2018б). После исследования Sn 4 P 3 они изучили калий нанокристаллического GeP 5 , синтезированного с помощью шаровой мельницы, который показал обратимую емкость 495 мАч/г после 50 циклов при 50 мА/г (Zhang et al. , 2018а). Измерения FTIR, выполненные на электроде GeP 5 после одного цикла, показали образование однородного слоя SEI как с KFSI, так и с KPF 6 в EC/DEC, в то время как использование 5% FEC индуцировало неоднородный и толстый SEI.
Первое исследование фосфорсодержащего соединения было проведено Guo et al. с использованием композита Sn 4 P 3 /C, который показал емкость 307 мАч/г после 50 циклов при 50 мА/г, что намного лучше. чем оба электрода P/C или Sn/C (Zhang W. et al., 2017) (рис. 7). Синтез наночастиц Sn 4 P 3 , встроенных в пористые углеродные волокна, в дополнение к замене соли KPF 6 на KFSI позволил значительно улучшить циклические характеристики (Zhang et al., 2018б). После исследования Sn 4 P 3 они изучили калий нанокристаллического GeP 5 , синтезированного с помощью шаровой мельницы, который показал обратимую емкость 495 мАч/г после 50 циклов при 50 мА/г (Zhang et al. , 2018а). Измерения FTIR, выполненные на электроде GeP 5 после одного цикла, показали образование однородного слоя SEI как с KFSI, так и с KPF 6 в EC/DEC, в то время как использование 5% FEC индуцировало неоднородный и толстый SEI. Удержание фосфора в пористом углеродном субстрате интенсивно изучалось в LIB с целью повышения электропроводности и сдерживания изменения объема в процессе легирования.Та же методология была также применена в KIB с описанными композитами P/C, размолотыми в шаровой мельнице, и P@CN, P@TBMC или P@rGO, синтезированными методом испарения/конденсации (Sultana et al., 2017a,b; Liu D. et al., 2018; Wang H. et al., 2018; Wu et al., 2018b; Xiong et al., 2018b) (рис. 7). Глядя на электрохимическое поведение этих материалов, первая разрядная емкость никогда не достигала 2596 мАч/г, как ожидалось для образования K 3 P, а скорее емкости около 850 мАч/г, ожидаемой для образования КП.Несмотря на эту неожиданно низкую емкость, для фосфора наблюдаются многообещающие свойства при циклировании: емкость 427 мАч/г измерена после 40 циклов при 100 мА/г для красных наночастиц P, встроенных в трехмерный углеродный нанолистовой каркас, тогда как 366 мАч/г после 50 циклов при 100 мА/г получают для красного P, испаренного и диспергированного в восстановленный оксид графена (Wang H.
Удержание фосфора в пористом углеродном субстрате интенсивно изучалось в LIB с целью повышения электропроводности и сдерживания изменения объема в процессе легирования.Та же методология была также применена в KIB с описанными композитами P/C, размолотыми в шаровой мельнице, и P@CN, P@TBMC или P@rGO, синтезированными методом испарения/конденсации (Sultana et al., 2017a,b; Liu D. et al., 2018; Wang H. et al., 2018; Wu et al., 2018b; Xiong et al., 2018b) (рис. 7). Глядя на электрохимическое поведение этих материалов, первая разрядная емкость никогда не достигала 2596 мАч/г, как ожидалось для образования K 3 P, а скорее емкости около 850 мАч/г, ожидаемой для образования КП.Несмотря на эту неожиданно низкую емкость, для фосфора наблюдаются многообещающие свойства при циклировании: емкость 427 мАч/г измерена после 40 циклов при 100 мА/г для красных наночастиц P, встроенных в трехмерный углеродный нанолистовой каркас, тогда как 366 мАч/г после 50 циклов при 100 мА/г получают для красного P, испаренного и диспергированного в восстановленный оксид графена (Wang H.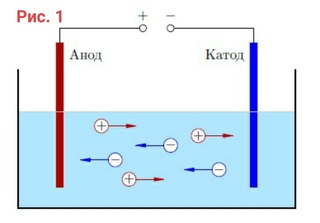 et al., 2018; Xiong et al., 2018b).
et al., 2018; Xiong et al., 2018b).
Рисунок 7 . Гальваностатические профили и сохранение емкости красного композита P@CN (слева), электрода Sn, полученного методом электронно-лучевого испарения (в центре), и Sn 4 P 3 /C, измельченного в шаровой мельнице (справа).Перепечатано с разрешения Zhang W. et al. (2017) Copyright (2018) Американское химическое общество, от Xiong et al. (2018б). Авторское право (2018) WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, и от J. Electrochem. Соц., 164, 12360 (2017). Copyright 2017, Электрохимическое общество.
Также сообщалось о некоторых конверсионных материалах в качестве возможных отрицательных электродов для KIB, таких как Co 3 O 4 -Fe 2 O 3 , оксиды олова или сурьма и сульфиды олова (Lakshmi et al., 2017; Султана и др., 2017b; Лю Ю. и др., 2018; Симидзу и др., 2018). Симидзу и др. сообщили об электрохимической активности SnO, который необратимо превращается в наночастицы олова, внедренные в стабильную матрицу K 2 O. Эта матрица препятствует агрегации наночастиц олова, которые затем вступают в реакцию сплавления с K (Shimizu et al., 2018). ). Интересно, что SnO демонстрирует разрядную емкость около 200 мАч/г в течение 30 циклов, тогда как SnO 2 оказывается неактивным.При исследовании сульфидных систем нанокристаллические частицы сульфидов сурьмы и олова диспергировали на графеновых каркасах, чтобы увеличить электропроводность и минимизировать изменение объема при циклировании. Как следствие, малослойные листы сульфида сурьмы/углерода показали многообещающие характеристики, последовательно комбинируя механизм интеркаляции K + между листами углерода с механизмом превращения серы с образованием K 2 S 3 и легированием реакция для Sb, преобразованного в K 3 Sb (Liu Y.и др., 2018).
Эта матрица препятствует агрегации наночастиц олова, которые затем вступают в реакцию сплавления с K (Shimizu et al., 2018). ). Интересно, что SnO демонстрирует разрядную емкость около 200 мАч/г в течение 30 циклов, тогда как SnO 2 оказывается неактивным.При исследовании сульфидных систем нанокристаллические частицы сульфидов сурьмы и олова диспергировали на графеновых каркасах, чтобы увеличить электропроводность и минимизировать изменение объема при циклировании. Как следствие, малослойные листы сульфида сурьмы/углерода показали многообещающие характеристики, последовательно комбинируя механизм интеркаляции K + между листами углерода с механизмом превращения серы с образованием K 2 S 3 и легированием реакция для Sb, преобразованного в K 3 Sb (Liu Y.и др., 2018).
Подводя итог результатам, полученным с легирующими материалами, можно сказать, что теоретические емкости композитных электродов легко достигаются в течение первых циклов, но затем быстро снижаются в течение первых десятков циклов.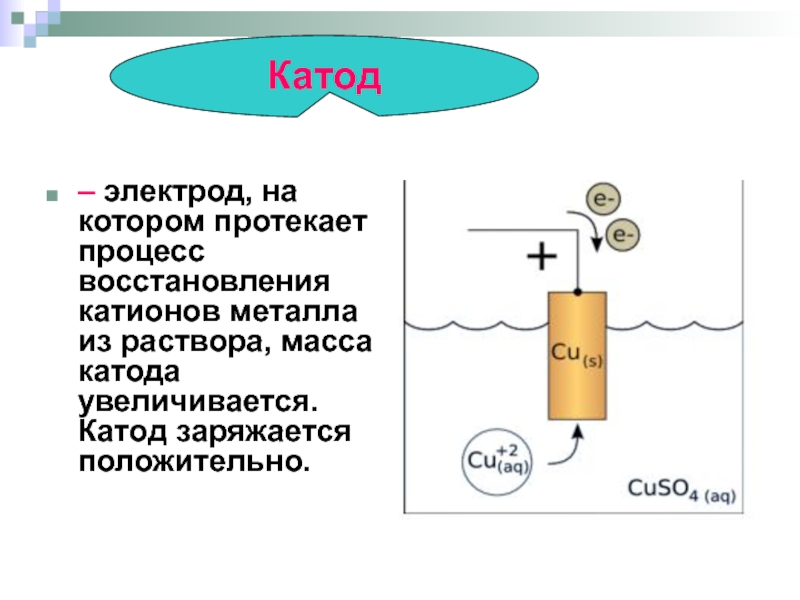 В настоящее время использование обычных добавок к электролиту, таких как FEC или VC, не доказало свою эффективность для улучшения циклической стабильности. Много усилий следует приложить к составу электролита (соли, растворители и добавки), а также к составу электродов с эффективными связующими для улучшения характеристик легирующих материалов.Понимание электрохимических механизмов также нуждается в дальнейшем углублении, учитывая, что в основном это не перевод наблюдаемых для тех же материалов в LIB- и NIB.
В настоящее время использование обычных добавок к электролиту, таких как FEC или VC, не доказало свою эффективность для улучшения циклической стабильности. Много усилий следует приложить к составу электролита (соли, растворители и добавки), а также к составу электродов с эффективными связующими для улучшения характеристик легирующих материалов.Понимание электрохимических механизмов также нуждается в дальнейшем углублении, учитывая, что в основном это не перевод наблюдаемых для тех же материалов в LIB- и NIB.
Органические соединения
Органические материалы все больше и больше используются в качестве эффективных электродных материалов в LIB и NIB, поскольку они недороги и безопасны для окружающей среды, а также благодаря своей хорошей циклируемости. Сосредоточившись на электрохимическом хранении калия, силы Ван-дер-Ваальса между органическими молекулами приводят к снижению энергии барьера и позволяют формировать больше свободного пространства для вставки больших ионов металлов. Большинство анодных материалов, о которых сообщалось до сих пор, имеют структуру терефталата.
Большинство анодных материалов, о которых сообщалось до сих пор, имеют структуру терефталата.
В 2009 году Арманд и его сотрудники выделили терефталатные соединения в качестве привлекательных устойчивых анодов для ЛИА, при этом большое поглощение лития происходит при 1 В и приводит к высокой начальной емкости 300 мАч/г (Armand et al., 2009). Две группы одновременно проверили преимущества электродов на основе терефталата перед новым KIB. На C/20 Денг и др. сообщили о стабильной емкости 180 мАч/г в течение 100 циклов для терафталата дикалия (K 2 C 8 H 4 O 4 , далее именуемого K 2 TP) с KFSI (1M) в EC: ДМЦ в качестве электролита (Deng et al., 2017). Несколько лучшие результаты были представлены Chen et al. с электролитами на основе KPF 6 (Lei et al., 2017) (рис. 8). Интересно, что K 2 TP получают при первом калиевом действии терафталевой кислоты. Затем на двух сопряженных карбоксилатных группах происходит окислительно-восстановительный процесс, чему способствует гибкая слоистая структура. Соответствующий рабочий потенциал очень низкий, 0,6 В, что делает материал K 2 TP пригодным для использования в качестве материала отрицательного электрода. За электрохимическим процессом тщательно следили с помощью FTIR и XPS, и была доказана решающая роль пленки SEI, образующейся при использовании DME в качестве растворителя.Фактически при замене последних растворителями на карбонатной основе наблюдались как ограниченная обратимая емкость, так и быстрое снижение емкости.
Соответствующий рабочий потенциал очень низкий, 0,6 В, что делает материал K 2 TP пригодным для использования в качестве материала отрицательного электрода. За электрохимическим процессом тщательно следили с помощью FTIR и XPS, и была доказана решающая роль пленки SEI, образующейся при использовании DME в качестве растворителя.Фактически при замене последних растворителями на карбонатной основе наблюдались как ограниченная обратимая емкость, так и быстрое снижение емкости.
Рисунок 8 . Слева двусторонняя вставка K + в K 2 TP и слоистая структура K 2 TP; справа – электрохимические характеристики электрода на основе ТП К 2 с КПФ 6 (1 М) в электролите ДМЭ. Адаптировано из Lei et al. (2017) с разрешения Королевского химического общества.
Позже нанокомпозиты из K 2 TP и углеродных нанотрубок были внедрены в полный KIB с гексацианоферратом железа, богатым калием, в качестве катодного материала и электролитом на основе KClO 4 (Liao et al. , 2017). Без металлического калия электрохимическая оценка в полной ячейке показывает отсутствие побочных реакций и улучшенную цикличность. Глядя на другие соединения на основе терафаталатов, средняя емкость 146 мАч/г для 200 циклов при 60 мА/г была получена для терафталата кобальта (CoTP) с KFSI (1 M) в EC:DMC (Fan C.и др., 2017). Проще говоря, прямое использование обычной и коммерчески доступной терефталевой кислоты позволило получить доступ к емкости до 240 мАч/г в течение 150 циклов при 500 мА/г (Wang C. et al., 2018).
, 2017). Без металлического калия электрохимическая оценка в полной ячейке показывает отсутствие побочных реакций и улучшенную цикличность. Глядя на другие соединения на основе терафаталатов, средняя емкость 146 мАч/г для 200 циклов при 60 мА/г была получена для терафталата кобальта (CoTP) с KFSI (1 M) в EC:DMC (Fan C.и др., 2017). Проще говоря, прямое использование обычной и коммерчески доступной терефталевой кислоты позволило получить доступ к емкости до 240 мАч/г в течение 150 циклов при 500 мА/г (Wang C. et al., 2018).
Другие органические молекулы на основе карбоксилатов с расширенным ароматическим скелетом были исследованы в надежде, что большее π-сопряжение может улучшить межмолекулярную перколяцию электронов. С 1,1′-бифенил-4,4′-дикарбоксилатом калия (K 2 BPDC) и 4,4′-E-стильбендикарбоксилатом калия (K 2 SBDC) низкий потенциал калия при 0.35 и 0,55 В соответственно. Хотя циклическая емкость логически ниже, чем у K 2 TP, они по-прежнему многообещающие, например, 143 мАч/г при 200 мА/г и 100 мАч/г при 1000 мА/г для K 2 BPDC (Li et al. , 2017). В том же духе группа Ванга разработала калиевые соли азобензол-4,4′-дикарбоновой кислоты с азогруппой в качестве окислительно-восстановительного центра (Liang et al., 2019).
, 2017). В том же духе группа Ванга разработала калиевые соли азобензол-4,4′-дикарбоновой кислоты с азогруппой в качестве окислительно-восстановительного центра (Liang et al., 2019).
Среди органических систем был приготовлен и исследован в качестве отрицательных электродов в LIB NIB и KIB (Zhao Q.и др., 2016). Неожиданно было обнаружено, что K 2 C 6 O 6 и K 2 C 5 O 5 обеспечивают сверхбыструю вставку/экстракцию K-ионов. Например, разрядная емкость K 2 C 6 O 6 составляет 212 мАч/г при 0,2 C, а 164 мАч/г поддерживается при 10 C при использовании KPF 6 (1,25M) в электролит ДМЭ. Более высокая электропроводность K 2 C 6 O 6 по сравнению с аналогами лития и натрия была предложена для объяснения таких удивительно высоких характеристик.Электрохимическое калийование K 2 C 6 O 6 протекает в две стадии, а плато с более высоким потенциалом при 2,4 В (реакция от K 2 C 6 O 6 до K до K C 6 O 6 ) слишком высок для применения в качестве анода. Благодаря важному отличию со вторым потенциальным плато при 1,3 В (реакция от K 3 C 6 O 6 к K 4 C 6 O 6 ) авторы обошли этот вопрос, предложив полный K 4 C 6 O 6 /K 2 C 6 O 6 KIB, демонстрирующий потенциал 1.1 В и ограниченная общая плотность энергии 35 Втч/кг (рис. 9).
Благодаря важному отличию со вторым потенциальным плато при 1,3 В (реакция от K 3 C 6 O 6 к K 4 C 6 O 6 ) авторы обошли этот вопрос, предложив полный K 4 C 6 O 6 /K 2 C 6 O 6 KIB, демонстрирующий потенциал 1.1 В и ограниченная общая плотность энергии 35 Втч/кг (рис. 9).
Рисунок 9 . Пример полного органического КИБ, подвергнутого циклу при плотности тока 25 мАч/г с оксоуглеродами K 4 C 6 O 6 и K 2 C 6 O 6 в качестве отрицательного и положительного электродов соответственно. Перепечатано с разрешения Zhao Q. et al. (2016). Авторское право (2016) WILEY-VCH Verlag GmbH & Co. KGaA, Вайнхайм.
Наконец, важно упомянуть недавний отчет об анодах на основе витамина К (Xue et al., 2018). Действительно, эта биомолекула обладает хиноновой структурой, которая делает их электрохимически активными. Используя коммерчески доступный витамин К, связанный с графеновыми нанотрубками, Xue et al. сообщают, что при 100 мА/г многообещающая начальная емкость составляет 300 мАч/г, которая остается достаточно высокой при циклировании (222 мАч/г после 100 циклов) или при высоких скоростях тока (165 мАч/г при 1000 мА/г).
Используя коммерчески доступный витамин К, связанный с графеновыми нанотрубками, Xue et al. сообщают, что при 100 мА/г многообещающая начальная емкость составляет 300 мАч/г, которая остается достаточно высокой при циклировании (222 мАч/г после 100 циклов) или при высоких скоростях тока (165 мАч/г при 1000 мА/г).
Органические электродные материалы являются интересными кандидатами, поскольку можно прогнозировать крупномасштабное низкозатратное производство.В отличие от материалов вставочного типа, размер иона калия не влияет на электрохимические характеристики, и самые последние работы, описанные выше, неожиданно подчеркивают, что быстрые реакции возможны для некоторых органических соединений. Рациональный состав электрода из органического материала с углеродными добавками должен еще больше повысить общую эффективность циклирования.
Общие выводы и перспективы
Усилия по поиску высокоэффективных материалов отрицательного электрода для KIB логично следуют путям, ранее выбранным при разработке LIB и NIB. Благодаря этому прошлому опыту, начиная с электродных материалов того же типа и следуя тем же методологиям, исследования материалов отрицательных электродов для KIB быстро продвигаются. Однако можно сожалеть об отсутствии новых концепций, посвященных только электрохимии калия. Таким образом, сравнение электрохимического поведения в KIB, NIB и LIB полезно для понимания механизма и прогнозирования ограничений с точки зрения производительности.
Благодаря этому прошлому опыту, начиная с электродных материалов того же типа и следуя тем же методологиям, исследования материалов отрицательных электродов для KIB быстро продвигаются. Однако можно сожалеть об отсутствии новых концепций, посвященных только электрохимии калия. Таким образом, сравнение электрохимического поведения в KIB, NIB и LIB полезно для понимания механизма и прогнозирования ограничений с точки зрения производительности.
Как и ионы лития, ионы калия могут быть электрохимически внедрены в графит.Следовательно, графит и материалы на основе углерода интенсивно исследуются. Тем не менее, конкретные возможности и возможности скорости, о которых сообщалось до сих пор, кажутся ограниченными. Другие материалы вставочного типа могут демонстрировать электрохимическую обратимую реакцию с ионами калия, но большой размер иона калия может не облегчить ионную диффузию в особо ограниченных структурах. Более того, после весьма многообещающей первой разрядной емкости часто наблюдается большая необратимая потеря емкости из-за высокой степени захвата ионов в структуре-хозяине.
Ожидается, что для электродных материалов легирующего и конверсионного типа, включающих фазовые переходы, размер K-иона не будет играть значительной роли. Однако он оказывает непосредственное влияние на объемное расширение, которое иногда в 4 раза превышает наблюдаемое при легировании литием. Это важное изменение объема представляет собой реальное ограничение для крупномасштабного применения. Тем не менее, его можно смягчить, используя специальные составы, включающие связующие и углеродные добавки, или наноструктурирование активного материала, как это было широко сделано для кремния в ЛИА (Franco Gonzalez et al., 2017).
В настоящее время растет интерес к разработке гибридных систем, сочетающих в себе поведение батареи и суперконденсатора, работающих на двойной реакции катионов и анионов с электродными материалами (Fan L. et al., 2017; Fan et al., 2018). В этом контексте нет сомнений в том, что игра с ионом калия в качестве электрохимического вектора может представлять интерес, например, с некоторыми электродными материалами, перечисленными выше.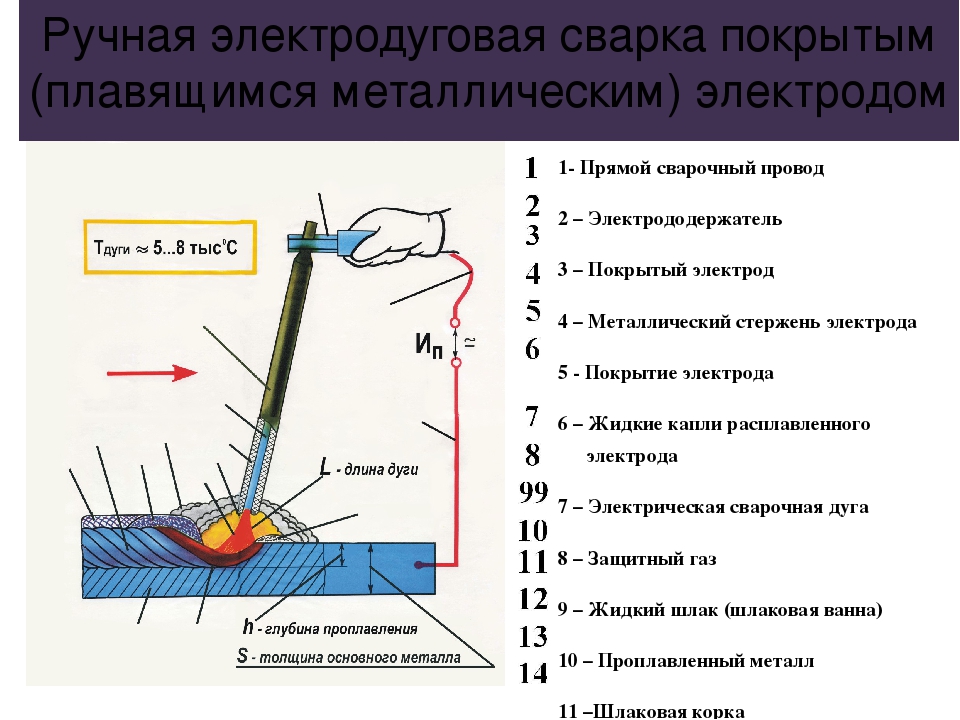
В ряде работ электролит указывался как ключевой фактор электрохимических характеристик материалов отрицательного электрода.Большинство электрохимических измерений было выполнено с солью KPF 6 (Hwang et al., 2018), но KFSI кажется более стабильным и позволил получить лучшее сохранение емкости и кулоновскую эффективность с большинством материалов отрицательного электрода. Что касается растворителя, в основном сообщалось о смеси ЭК/ДЭК, но также рассматривались ЭК/ДМЦ и ЭК/ПХ. Многие работы были посвящены сравнению электролитов на основе карбонатов и на основе эфиров. Сильное различие наблюдалось для графита, для которого карбонатные частицы в электролите привели к интеркаляции K + между графеновыми слоями, тогда как эфирные электролиты скорее демонстрируют механизмы коинтеркаляции.Хорошо известные добавки к электролиту LIB, такие как FEC или VC, по-видимому, не подходят для KIB. Поэтому в будущем необходимо приложить много усилий для разработки стабильных и эффективных электролитов с соответствующими добавками. При измерениях полуэлементов необходимо учитывать высокую реакционную способность металлического калия, поскольку его присутствие изменяет как электрохимические характеристики, так и образование SEI. Действительно, было показано, что металлический калий влияет на стабильность электролита и характер SEI на другом интерфейсе электрод/электролит через механизм перекрестных помех (Madec et al., 2018). Поэтому поиск эффективных электролитов для КИБ лучше проводить в полных конфигурациях элементов.
При измерениях полуэлементов необходимо учитывать высокую реакционную способность металлического калия, поскольку его присутствие изменяет как электрохимические характеристики, так и образование SEI. Действительно, было показано, что металлический калий влияет на стабильность электролита и характер SEI на другом интерфейсе электрод/электролит через механизм перекрестных помех (Madec et al., 2018). Поэтому поиск эффективных электролитов для КИБ лучше проводить в полных конфигурациях элементов.
В заключение следует отметить, что все категории материалов для отрицательных электродов, описанные выше, обладают интересными свойствами, но также и важными ограничениями. Электроды представляют собой композиты, образованные активным материалом, связующим и проводящей добавкой, соотношение которых необходимо оптимизировать для улучшения синергии между ними. Кажется очевидным, что ядром электрода мог быть графит или углеродсодержащие производные; добавление легирующих материалов может представлять интерес для увеличения удельной и/или объемной емкости, в то время как добавление материалов на основе титана или органических материалов может позволить контролировать и минимизировать электрохимические явления, происходящие на критической границе раздела электрод-электролит.
Вклад авторов
Все перечисленные авторы внесли существенный, непосредственный и интеллектуальный вклад в работу и одобрили ее для публикации.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарят Французское национальное исследовательское агентство за поддержку проекта Labex STORE-EX (ANR-10-LABX-76-01).
Сокращения
LIB, Литий-ионные аккумуляторы; NIB, натрий-ионные батареи; KIB, Калий-ионные аккумуляторы; ЭК, этиленкарбонат; ПК, пропиленкарбонат; ДЭК, диэтиленкарбонат; DMC, диметиленкарбонат; ФЭК, фторэтиленкарбонат; VC, виниленкарбонат; ДМЭ, диметоксиэтан; XRD, рентгеновская дифракция; XAS, рентгеновская абсорбционная спектроскопия; PDF, функция парного распределения; DFT, теория функционала плотности; SEI, межфазный слой твердого электролита; LSV, вольтамперометрия с линейной разверткой; PA-Na, полиакрилат натрия; CMC-Na, карбоксиметилцеллюлоза натрия; ПВДФ, поливинилдифторид; CVD, химическое осаждение из паровой фазы; УНТ, углеродные нанотрубки; УНВ, углеродные нановолокна; УВ, твердый углерод; СК, мягкий углерод; ПЭМ, просвечивающая электронная микроскопия; HRTEM, просвечивающая электронная микроскопия высокого разрешения; FTIR, инфракрасная спектроскопия пропускания Фурье; KFSI, бис(фторсульфонил)имид калия; NaFSI, бис(фторсульфонил)имид натрия; LiFSI, бис(фторсульфонил)имид лития; KTFSI, бис(трифторметансульфонил)имид калия; KPF6, гексафторфосфат калия; rGO, восстановленный оксид графена; GIC, интеркаляционное соединение графита; SHE, стандартный водородный электрод.
Каталожные номера
Аллан, П.К., Гриффин, Дж.М., Дарвич, А., Боркевич, О.Дж., Видерек, К.М., Чепмен, К.В., и соавт. (2016). Отслеживание фазовых превращений натрия и антимонида в анодах с ионами натрия: результаты анализа функции распределения пар операндо и ЯМР-спектроскопии твердого тела. Дж. Ам. хим. соц. 138, 2352–2365. doi: 10.1021/jacs.5b13273
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ан, Ю., Фей, Х., Цзэн, Г., Си, Л., Xi, B., Xiong, S., et al. (2018). Коммерческий расширенный графит в качестве недорогого анода с длительным сроком службы для калий-ионных аккумуляторов с обычным карбонатным электролитом. Дж. Источник питания. 378, 66–72. doi: 10.1016/j.jpowsour.2017.12.033
Полнотекстовая перекрестная ссылка | Академия Google
Арман, М., Гружон, С., Везин, Х., Ларуэль, С., Рибьер, П., Пуазо, П., и др. (2009). Сопряженные дикарбоксилатные аноды для литий-ионных аккумуляторов. Нац. Матер. 8, 120–125. дои: 10.1038/nmat2372
Матер. 8, 120–125. дои: 10.1038/nmat2372
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Белтроп, К., Бойкер, С., Хекманн, А., Винтер, М., и Плаке, Т. (2017). Альтернативный электрохимический накопитель энергии: двойные графитовые батареи на основе калия. Энергетика Окружающая среда. Наука . 10, 2090–2094 гг. дои: 10.1039/C7EE01535F
Полнотекстовая перекрестная ссылка | Академия Google
Чен, Л., Фиоре, М., Ван, Дж. Э., Руффо, Р., Ким, Д.-К., и Лонгони, Г. (2018). Уровень готовности технологии натрий-ионных аккумуляторов: обзор материалов. Доп. Поддерживать. Сист. 2:1700153. doi: 10.1002/adsu.201700153
Полнотекстовая перекрестная ссылка | Академия Google
Кон, А. П., Муралидхаран, Н., Картер, Р., Шаре, К., Оукс, Л., и Пинт, К. Л. (2016). Прочные электроды ионно-калиевых батарей из высокоскоростной коинтеркаляции в графитовый углерод. Дж. Матер. хим. А 4, 14954–14959. дои: 10.1039/C6TA06797B
Полнотекстовая перекрестная ссылка | Академия Google
Дарвич А. , Фехсе М., Махмуд А., Лафонтен К., Fraisse, B., Hermann, R., et al. (2018). Электрохимическое натрийирование Sb, исследованное методами рентгеновской абсорбции и мёссбауэровской спектроскопии 121Sb: чему на самом деле учат? Батарейки 4:25. doi: 10.3390/batteries4020025
, Фехсе М., Махмуд А., Лафонтен К., Fraisse, B., Hermann, R., et al. (2018). Электрохимическое натрийирование Sb, исследованное методами рентгеновской абсорбции и мёссбауэровской спектроскопии 121Sb: чему на самом деле учат? Батарейки 4:25. doi: 10.3390/batteries4020025
Полнотекстовая перекрестная ссылка | Академия Google
Дэн, К., Пей, Дж., Фан, К., Ма, Дж., Цао, Б., Ли, К., и др. (2017). Калиевые соли параароматических дикарбоксилатов как высокоэффективные органические аноды для недорогих K-ионных аккумуляторов. Nano Energy 33, 350–355.doi: 10.1016/j.nanoen.2017.01.016
Полнотекстовая перекрестная ссылка | Академия Google
Донг, С., Ли, З., Син, З., Ву, X., Цзи, X., и Чжан, X. (2018). Новый калий-ионный гибридный конденсатор на основе анода из микрокаркасов K 2 Ti 6 O 13 . Приложение ACS Матер. Интерфейсы 10, 15542–15547. дои: 10.1021/acsami.7b15314
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дун Ю. , Ву З., Чжэн С., Ван С., Цинь Дж., Ван С. и др. (2017). Наноленты титаната натрия/калия, полученные из Ti 3 C 2 MXene, для высокоэффективных натрий/калиевых ионных аккумуляторов повышенной емкости. ACS Nano 11, 4792–4800. doi: 10.1021/acsnano.7b01165
, Ву З., Чжэн С., Ван С., Цинь Дж., Ван С. и др. (2017). Наноленты титаната натрия/калия, полученные из Ti 3 C 2 MXene, для высокоэффективных натрий/калиевых ионных аккумуляторов повышенной емкости. ACS Nano 11, 4792–4800. doi: 10.1021/acsnano.7b01165
Полнотекстовая перекрестная ссылка | Академия Google
Эфтехари А. и Ким Д.-В. (2018). Натрий-ионные аккумуляторы: новые возможности помимо накопления энергии литием. Дж. Источник питания. 395, 336–348. doi: 10.1016/j.jpowsour.2018.05.089
Полнотекстовая перекрестная ссылка | Академия Google
Эр, Д., Ли Дж., Нагиб М., Гогоци Ю. и Шеной В.Б. (2014). Ti3C2 MXene в качестве электродного материала большой емкости для металлических (Li, Na, K, Ca) ионных аккумуляторов. Приложение ACS Матер. Интерфейсы 6, 11173–11179. дои: 10.1021/am501144q
Полнотекстовая перекрестная ссылка | Академия Google
Fan, C., Zhao, M., Li, C., Wang, C., Cao, B., Chen, X., et al. (2017). Исследование электрохимического поведения терефталата кобальта(II) (CoC8h5O4) в качестве органического анода в K-ионном аккумуляторе. Электрохим.Acta 253, 333–338. doi: 10.1016/j.electacta.2017.09.078
Исследование электрохимического поведения терефталата кобальта(II) (CoC8h5O4) в качестве органического анода в K-ионном аккумуляторе. Электрохим.Acta 253, 333–338. doi: 10.1016/j.electacta.2017.09.078
Полнотекстовая перекрестная ссылка | Академия Google
Фань Л., Лю К., Чен С., Линь К., Сюй З. и Лу Б. (2017). Двойная ионная батарея на основе калия с двойным графитовым электродом. Маленький 13:1701011. doi: 10.1002/smll.201701011
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фанг Г., Чжоу Дж., Пан А. и Лян С. (2018). Последние достижения в области водных цинк-ионных аккумуляторов. ACS Energy Письмо .3, 2480–2501. doi: 10.1021/acsenergylett.8b01426
Полнотекстовая перекрестная ссылка | Академия Google
Франко Гонсалес, А., Ян, Н. Х., и Лю, Р. С. (2017). Дизайн кремниевых анодов для литий-ионных аккумуляторов: прогресс и перспективы. J. Phys. хим. С 121, 27775–27787. doi: 10. 1021/acs.jpcc.7b07793
1021/acs.jpcc.7b07793
Полнотекстовая перекрестная ссылка | Академия Google
Габаудан, В., Бертелот, Р., Стеевано, Л., и Монкондуит, Л. (2018a). Внутри сплава Sb и Bi электродов для K-ионных аккумуляторов. J. Phys. хим. С 122, 18266–18273. doi: 10.1021/acs.jpcc.8b04575
Полнотекстовая перекрестная ссылка | Академия Google
Габаудан, В., Бертелот, Р., Стеевано, Л., и Монкондуит, Л. (2018b). Электрохимическое легирование свинца в калий-ионных аккумуляторах. АСУ Омега 3, 12195–12200. doi: 10.1021/acsomega.8b01369
Полнотекстовая перекрестная ссылка | Академия Google
Хан, К., Хан, К., Ван, X., Ван, К., Ли, К., Мэн, Дж., и др. (2018). Трехмерная углеродная сеть ограничивает аноды из наночастиц сурьмы для K-ионных аккумуляторов большой емкости. Наномасштаб 10, 6820–6826. DOI: 10.1039/C8NR00237A
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хан, Дж., Ню, Ю., Бао, С.Дж., Ю, Ю. Н., Лу, С.Ю., и Сюй, М. (2016a). Нанокубические электроды KTi 2 (PO 4) 3 для калий-ионных аккумуляторов. Хим. коммун. 52, 11661–11664. дои: 10.1039/C6CC06177J
Н., Лу, С.Ю., и Сюй, М. (2016a). Нанокубические электроды KTi 2 (PO 4) 3 для калий-ионных аккумуляторов. Хим. коммун. 52, 11661–11664. дои: 10.1039/C6CC06177J
Полнотекстовая перекрестная ссылка | Академия Google
Хань Дж., Сюй М., Ниу Ю., Ли Г.Н., Ван М., Чжан Ю. и др. (2016б). Исследование K2Ti8O17 в качестве анодного материала для калий-ионных аккумуляторов. Хим. коммун. 52, 11274–11276. дои: 10.1039/C6CC05102B
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хосака Т., Шимамура Т., Кубота К. и Комаба С. (2019). Полианионные соединения для калий-ионных аккумуляторов. Хим. Рек . 19, 735–745. doi: 10.1002/tcr.201800143
Полнотекстовая перекрестная ссылка | Академия Google
Хуэй, Дж., Шорр, Н.Б., Пахира, С., Ку, З., Мендоса-Кортес, Дж.Л., и Родригес-Лопес, Дж. (2018). Достижение быстрой и эффективной интеркаляции K+ на ультратонких графеновых электродах, модифицированных межфазной границей твердого электролита на основе Li+. Дж. Ам. хим. соц. 140, 13599–13603. doi: 10.1021/jacs.8b08907
Дж. Ам. хим. соц. 140, 13599–13603. doi: 10.1021/jacs.8b08907
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хван, Дж.-Ю., Мён, С.-Т., и Сун, Ю.-К. (2018). Недавний прогресс в перезаряжаемых калиевых батареях. Доп. Функц. Матер. 28:1802938. doi: 10.1002/adfm.201802938
Полнотекстовая перекрестная ссылка | Академия Google
Ирисарри, Э., Понроуч, А., и Паласин, М. Р. (2015). Обзор — твердые углеродные материалы отрицательного электрода для натрий-ионных аккумуляторов. Дж. Электрохим. соц. 162, А2476–А2482. дои: 10.1149/2.00jes
Полнотекстовая перекрестная ссылка | Академия Google
Jian, Z., Hwang, S., Li, Z., Hernandez, A.S., Wang, X., Xing, Z., et al. (2017). Жестко-мягкий композитный углерод в качестве анода с длительным циклом и высокой производительностью для калий-ионных аккумуляторов. Доп. Функц. Матер. 27:1700324. doi: 10.1002/adfm.201700324
Полнотекстовая перекрестная ссылка | Академия Google
Цзянь, З. , Син, З., Боммьер, К., Ли, З.и Джи, X. (2016). Твердые углеродные микросферы: анод с ионами калия по сравнению с анодом с ионами натрия. Доп. Энергия Матер. 6:1501874. doi: 10.1002/aenm.201501874
, Син, З., Боммьер, К., Ли, З.и Джи, X. (2016). Твердые углеродные микросферы: анод с ионами калия по сравнению с анодом с ионами натрия. Доп. Энергия Матер. 6:1501874. doi: 10.1002/aenm.201501874
Полнотекстовая перекрестная ссылка | Академия Google
Ким, Х., Ким, Дж. К., Бьянкини, М., Сео, Д.-Х., Родригес-Гарсия, Дж., и Седер, Г. (2018). Недавний прогресс и перспективы в электродных материалах для K-ионных аккумуляторов. Доп. Энергия Матер. 8:1702384. doi: 10.1002/aenm.201702384
Полнотекстовая перекрестная ссылка | Академия Google
Кишор, Б., Г. В. и Мюнхенандрайя Н. (2016). K 2 Ti 4 O 9 : многообещающий анодный материал для калий-ионных аккумуляторов. Дж. Электрохим. соц. 163, А2551–А2554. дои: 10.1149/2.0421613jes
Полнотекстовая перекрестная ссылка | Академия Google
Комаба С., Хасегава Т., Дахби М. и Кубота К. (2015). Интеркаляция калия в графит для создания высоковольтных/мощных калий-ионных аккумуляторов и калий-ионных конденсаторов. Электрохим. Коммуна .60, 172–175. doi: 10.1016/j.elecom.2015.09.002
Электрохим. Коммуна .60, 172–175. doi: 10.1016/j.elecom.2015.09.002
Полнотекстовая перекрестная ссылка | Академия Google
Кубота К., Дахби М., Хосака Т., Кумакура С. и Комаба С. (2018). Навстречу K-ion и Na-ion батареям как «за пределами Li-ion». Хим. Рек . 18, 459–479. doi: 10.1002/tcr.201700057
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лакшми В., Чен Ю., Михайлов А. А., Медведев А. Г., Султана И., Рахман М. М. и соавт. (2017). Нанокристаллический SnS 2, нанесенный на восстановленный оксид графена: демонстрация возможности создания неграфитового анода с сульфидной химией для калий-ионных аккумуляторов. Хим. коммун. 53, 8272–8275. дои: 10.1039/C7CC03998K
Полнотекстовая перекрестная ссылка | Академия Google
Лей, К., Ли, Ф., Му, К., Ван, Дж., Чжао, К., Чен, К., и др. (2017). Высокая производительность хранения калия благодаря синергии терефталата дикалия и электролитов на основе эфира.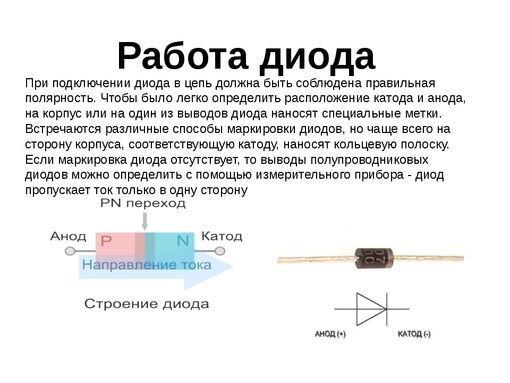 Энергетика Окружающая среда. науч. 10, 552–557. дои: 10.1039/C6EE03185D
Энергетика Окружающая среда. науч. 10, 552–557. дои: 10.1039/C6EE03185D
Полнотекстовая перекрестная ссылка | Академия Google
Лей, К., Ван, К., Лю, Л., Луо, Ю., Мю, К., Ли, Ф., и др.(2018). Пористая сеть висмута, используемая в качестве анодного материала для ионно-калиевых батарей с высокой плотностью энергии. Анжю. хим. Междунар. Эд. 57, 4687–4691. doi: 10.1002/anie.201801389
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Li, C., Deng, Q., Tan, H., Wang, C., Fan, C., Pei, J., et al. (2017). Пара-сопряженные дикарбоксилаты с расширенными ароматическими скелетами в качестве высокотехнологичных органических анодов для K-ионных аккумуляторов. Приложение ACS Матер. Интерфейсы 9, 27414–27420.дои: 10.1021/acsami.7b08974
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ли, П., Ван, В., Гонг, С., Лв, Ф., Хуанг, Х., Луо, М., и др. (2018). Гидрированный Na 2 Ti 3 O 7 эпитаксиально выращенный на гибкой углеродной губке, легированной N, для калий-ионных аккумуляторов.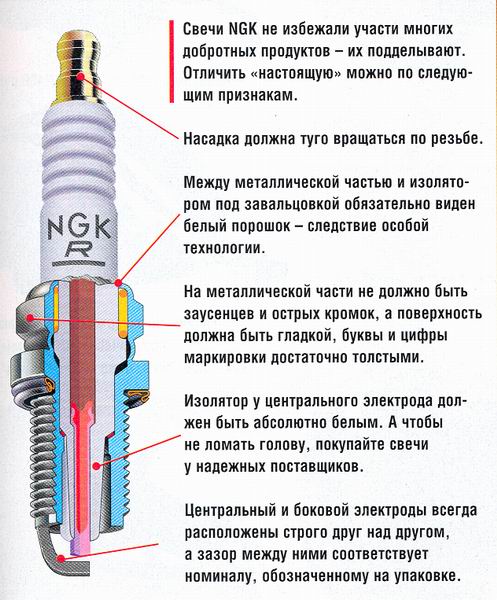 Приложение ACS Матер. Интерфейсы 10, 37974–37980. дои: 10.1021/acsami.8b11354
Приложение ACS Матер. Интерфейсы 10, 37974–37980. дои: 10.1021/acsami.8b11354
Полнотекстовая перекрестная ссылка | Академия Google
Лиан П., Донг Ю., Ву З.-С., Чжэн С., Ван Х., Ван С. и др. (2017). Alkalized Ti 3 C 2 Наноленты MXene с увеличенным межслойным расстоянием для натриевых и калиевых аккумуляторов большой емкости. Nano Energy 40, 1–8. doi: 10.1016/j.nanoen.2017.08.002
Полнотекстовая перекрестная ссылка | Академия Google
Лян, Ю., Луо, К., Ван, Ф., Хоу, С., Лиоу, С.-К., Цин, Т., и др. (2019). Органический анод для высокотемпературных калий-ионных аккумуляторов. Доп. Энергия Матер. 9:1802986.doi: 10.1002/aenm.201802986
Полнотекстовая перекрестная ссылка | Академия Google
Ляо, Дж., Ху, К., Ю, Ю., Ван, Х., Тан, З., Вен, З., и др. (2017). Богатый калием композит гексацианоферрата железа/терефталата дикалия и углеродных нанотрубок, используемый для полных элементов K-ion с оптимизированным электролитом.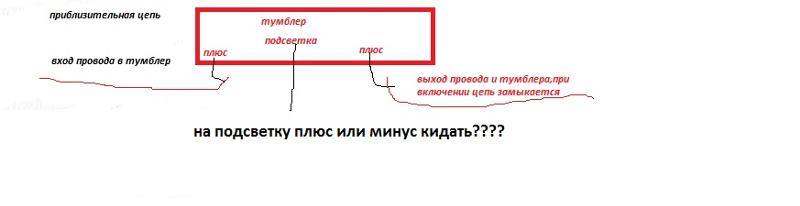 Дж. Матер. хим. А 5, 19017–19024 гг. дои: 10.1039/C7TA05460B
Дж. Матер. хим. А 5, 19017–19024 гг. дои: 10.1039/C7TA05460B
Полнотекстовая перекрестная ссылка | Академия Google
Линь, X., Хуанг, Дж., и Чжан, Б. (2019). Корреляция между микроструктурой углеродных материалов и их способностью накапливать ионы калия. Углерод N. Y . 143, 138–146. doi: 10.1016/j.carbon.2018.11.001
Полнотекстовая перекрестная ссылка | Академия Google
Лю, К., Луо, С., Хуан, Х., Ван, З., Ван, К., Чжан, Ю., и другие. (2018). Ванадат калия K 0,23 V 2 O 5 в качестве анодных материалов для литий-ионных и калий-ионных аккумуляторов. Дж. Источник питания. 389, 77–83. doi: 10.1016/j.jpowsour.2018.04.014
Полнотекстовая перекрестная ссылка | Академия Google
Лю, Д., Huang, X., Qu, D., Zheng, D., Wang, G., Harris, J., et al. (2018). Ограниченный фосфор в мезопористом углероде с основой из углеродных нанотрубок в качестве превосходного анодного материала для натриевых/калий-ионных батарей. Nano Energy 52, 1–10. doi: 10.1016/j.nanoen.2018.07.023
Nano Energy 52, 1–10. doi: 10.1016/j.nanoen.2018.07.023
Полнотекстовая перекрестная ссылка | Академия Google
Лю, К., Фан, Л., Ма, Р., Чен, С., Ю, С., Ян, Х., и другие. (2018). Сверхдолговечные калий-ионные аккумуляторы на основе композитного анода сурьма@углерод. Хим.коммун. 54, 11773–11776. дои: 10.1039/C8CC05257C
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Liu, Y., Li, Y., Li, F., Liu, Y., Yuan, X., Zhang, L., et al. (2019). Преобразование Ti 2 AlC в C-K 2 Ti 4 O 9 с помощью гидротермальной обработки с помощью KOH и его применение в анодах литий-ионных аккумуляторов. Электрохим. Acta 295, 599–604. doi: 10.1016/j.electacta.2018.11.003
Полнотекстовая перекрестная ссылка | Академия Google
Лю, Ю., Tai, Z., Zhang, J., Pang, W.K., Zhang, Q., Feng, H., et al. (2018). Усиление калий-ионных аккумуляторов с помощью малослойных композитных анодов, изготовленных с помощью одноэтапного сдвигового расслоения, запускаемого раствором. Нац. коммун. 9:3645. doi: 10.1038/s41467-018-05786-1
Нац. коммун. 9:3645. doi: 10.1038/s41467-018-05786-1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Луо В., Ван Дж., Оздемир Б., Бао В., Чен Ю., Дай Дж. и др. (2015). Калий-ионные аккумуляторы с графитовыми материалами. Нано Летт. 15, 7671–7677.doi: 10.1021/acs.nanolett.5b03667
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ма, З., Макфарлейн, Д. Р., и Кар, М. (2019). Mg-катодные материалы и электролиты для аккумуляторных MG-батарей: обзор. Тесто. Суперкапс 2, 115–127. doi: 10.1002/bat.201800102
Полнотекстовая перекрестная ссылка | Академия Google
Мадек, Л., Габаудан, В., Гашо, Г., Стеевано, Л., Монкондуит, Л., и Мартинес, Х. (2018). Прокладывая путь для K-ионных аккумуляторов: роль реактивности электролита на примере электродов на основе Sb. Приложение ACS Матер. Интерфейсы 10, 34116–34122. дои: 10.1021/acsami.8b08902
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
McCulloch, W. D., Ren, X., Yu, M., Huang, Z., and Wu, Y. (2015). Калийно-кислородный аккумулятор на основе сурьмяного анода большой емкости. Приложение ACS Матер. Интерфейсы 7, 26158–26166. doi: 10.1021/acsami.5b08037
D., Ren, X., Yu, M., Huang, Z., and Wu, Y. (2015). Калийно-кислородный аккумулятор на основе сурьмяного анода большой емкости. Приложение ACS Матер. Интерфейсы 7, 26158–26166. doi: 10.1021/acsami.5b08037
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мессингер, Р. Дж., Менетрие, М., Salager, E., Boulineau, A., Duttine, M., Carlier, D., et al. (2015). Выявление дефектов в электродах кристаллических литий-ионных аккумуляторов методом твердотельного ЯМР: приложения к LiVPO 4 F. Chem. Матер. 27, 5212–5221. doi: 10.1021/acs.chemmater.5b01234
Полнотекстовая перекрестная ссылка | Академия Google
Минакши М., Сингх П., Картер М. и Принс К. (2008). Аккумулятор Zn–MnO[sub 2]: влияние водных электролитов LiOH и KOH на механизм интеркаляции. Электрохим. Твердотельное письмо. 11:А145. дои: 10.1149/1.2932056
Полнотекстовая перекрестная ссылка | Академия Google
Окамото, Ю. (2014). Расчеты теории функционала плотности интеркаляционных соединений графита щелочных металлов (Li, Na и K). J. Phys. хим. С 118, 16–19. дои: 10.1021/jp4063753
J. Phys. хим. С 118, 16–19. дои: 10.1021/jp4063753
Полнотекстовая перекрестная ссылка | Академия Google
Рамиредди Т., Кали Р. М., Джангид К., Шрихари В., Посвал Х. К. и Мукхопадхьяй А. (2017). Понимание электрохимического поведения, фазовой эволюции и стабильности Sn при калиевом легировании/удалении сплавов с помощью исследований на месте. Дж. Электрохим. соц. 164, А2360–А2367. дои: 10.1149/2.0481712jes
Полнотекстовая перекрестная ссылка | Академия Google
Рен, X., Чжао, К., Маккалох, В. Д., и Ву, Ю. (2017). MoS 2 в качестве материала-основы с длительным сроком службы для интеркаляции ионов калия. Нанорез . 10, 1313–1321. doi: 10.1007/s12274-016-1419-9
Полнотекстовая перекрестная ссылка | Академия Google
Сангстер, Дж. М. (2010). K-P (калий-фосфорная) система. J. Рассеянное фазовое равновесие .31, 68–72. doi: 10.1007/s11669-009-9614-y
Полнотекстовая перекрестная ссылка | Академия Google
Шар, К.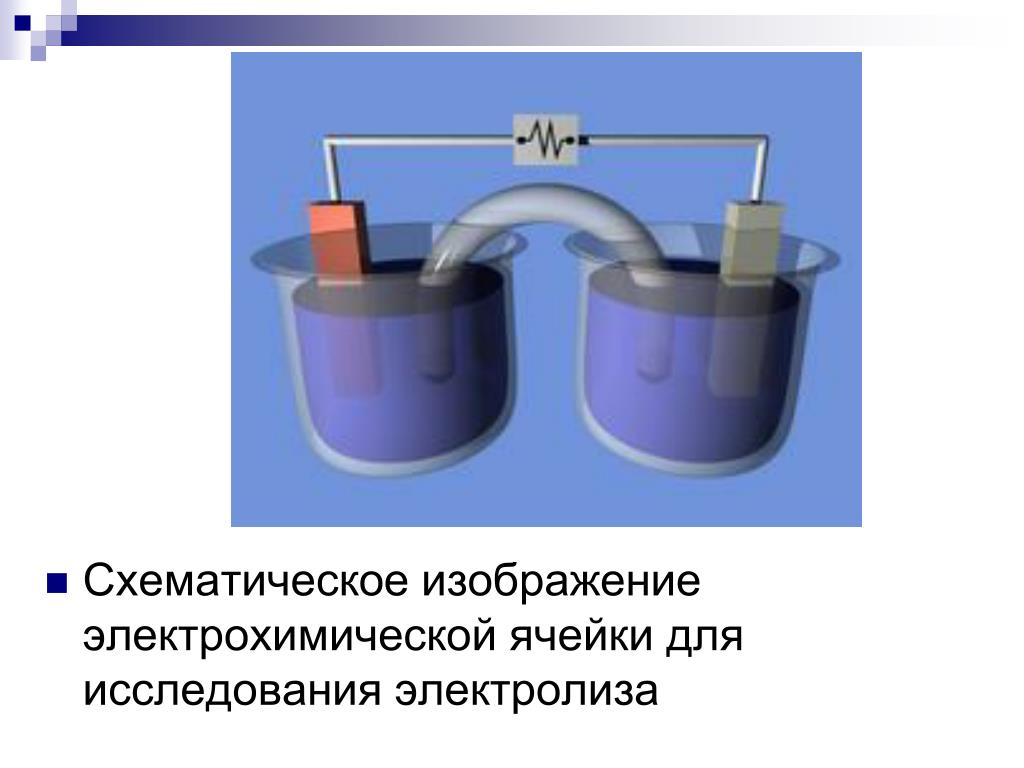 , Кон, А. П., Картер, Р., Роджерс, Б., и Пинт, К. Л. (2016b). Роль графена, легированного азотом, в улучшенных анодах ионно-калиевых батарей большой емкости. ACS Nano 10, 9738–9744. doi: 10.1021/acsnano.6b05998
, Кон, А. П., Картер, Р., Роджерс, Б., и Пинт, К. Л. (2016b). Роль графена, легированного азотом, в улучшенных анодах ионно-калиевых батарей большой емкости. ACS Nano 10, 9738–9744. doi: 10.1021/acsnano.6b05998
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шар, К., Кон, А. П., Картер, Р. Э., и Пинт, К. Л. (2016a). Механизм интеркаляции ионов калия в малослойном графене по данным рамановской спектроскопии in situ. Наномасштаб 8, 16435–16439. дои: 10.1039/C6NR04084E
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Симидзу М., Яцузука Р., Коя Т., Ямаками Т. и Араи С. (2018). Оксиды олова как материал отрицательного электрода для калий-ионных аккумуляторов. Приложение ACS Энергия Матер . 1, 6865–6870. doi: 10.1021/acsaem.8b01209
Полнотекстовая перекрестная ссылка | Академия Google
Су Д., МакДонах А., Цяо С. З. и Ван Г. (2017). Водные калий-ионные батареи большой емкости для крупномасштабного хранения энергии. Доп. Матер. 29:1604007. doi: 10.1002/adma.201604007
Доп. Матер. 29:1604007. doi: 10.1002/adma.201604007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Суббайя, Т., Санджай, К., Бисвал, А., Чандра Трипати, Б., и Минакши, М. (2015). Электролитический диоксид марганца (EMD): взгляд на мировое производство, запасы и его роль в электрохимии. RSC Adv . 5, 58255–58283. дои: 10.1039/C5RA05892A
Полнотекстовая перекрестная ссылка | Академия Google
Султана И., Рахман М.М., Чен Ю. и Глушенков А.М. (2018). Анодные материалы калий-ионных аккумуляторов работают по механизму реакции сплавления-разлегирования. Доп. Функц. Матер. 28:1703857. doi: 10.1002/adfm.201703857
Полнотекстовая перекрестная ссылка | Академия Google
Султана И., Рахман М.М., Лю Дж., Шарма Н., Эллис А.В., Чен Ю. и др. (2019). Нанокомпозиты сурьмы и углерода для калий-ионных аккумуляторов: понимание механизма разрушения электродов и возможные пути улучшения циклической стабильности. Дж. Источник питания. 413, 476–484. doi: 10.1016/j.jpowsour.2018.12.017
Дж. Источник питания. 413, 476–484. doi: 10.1016/j.jpowsour.2018.12.017
Полнотекстовая перекрестная ссылка | Академия Google
Султана И., Рахман М. М., Матети С., Ахмадабади В. Г., Глушенков А. М. и Чен Ю. (2017b). Показатели накопления ионов K и Na для Co 3 O 4 -Fe 2 O 3 супер-углеродной сажи P, украшенной наночастицами, полученной методом шаровой мельницы. Наномасштаб 9, 3646–3654. дои: 10.1039/C6NR09613A
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Султана, И., Рахман М.М., Рамиредди Т., Чен Ю. и Глушенков А.М. (2017a). Аноды калий-ионных аккумуляторов большой емкости на основе черного фосфора. Дж. Матер. хим. А 5, 23506–23512. дои: 10.1039/C7TA02483E
Полнотекстовая перекрестная ссылка | Академия Google
Султана И., Рамиредди Т., Рахман М. М., Чен Ю. и Глушенков А. М. (2016). Композитные аноды на основе олова для калий-ионных аккумуляторов.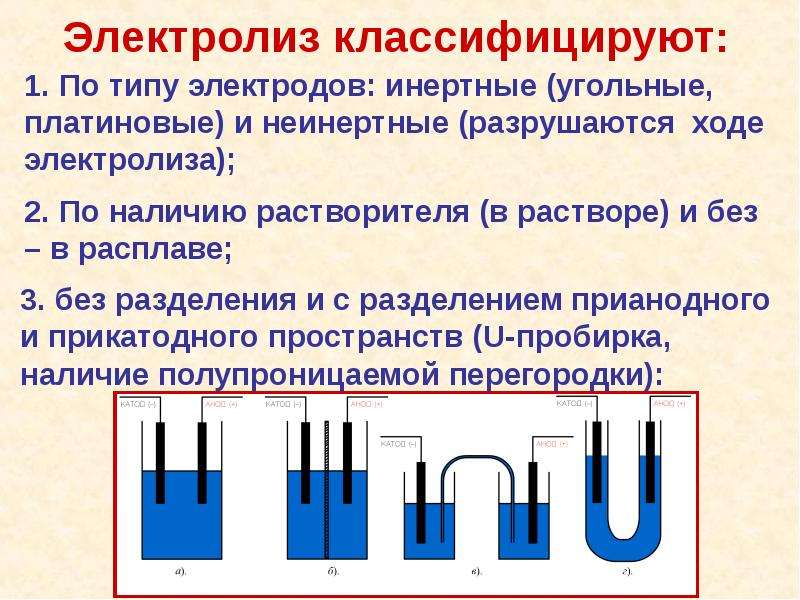 Хим. Коммуна . 52, 9279–9282. дои: 10.1039/C6CC03649J
Хим. Коммуна . 52, 9279–9282. дои: 10.1039/C6CC03649J
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Цолов, М.Б., Илиев М.Н. (1992). Рамановское рассеяние на монощелочных (Na-Sb и K-Sb), двухщелочных (Na-K-Sb) и многощелочных (Na-K-Sb-Cs) фотокатодах. Тонкие твердые пленки 213, 99–102. дои: 10.1016/0040-6090(92)
Полнотекстовая перекрестная ссылка | Академия Google
Ван К., Тан В., Яо З., Чен Ю., Пей Дж. и Фан К. (2018). Использование органической кислоты в качестве универсального анода для высокоэффективных Li-ion, Na-ion и K-ion аккумуляторов. Орг. Электрон. 62, 536–541. дои: 10.1016/ж.оргель.2018.06.027
Полнотекстовая перекрестная ссылка | Академия Google
Wang, H., Wang, L., Wang, L., Xing, Z., Wu, X., Zhao, W., et al. (2018). Частицы фосфора, встроенные в матрицу из восстановленного оксида графена, повышают емкость и скорость емкостного хранения ионов калия. Хим. Евро. Дж. 24, 13897–13902. doi: 10.1002/chem.201802753
Дж. 24, 13897–13902. doi: 10.1002/chem.201802753
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ван, Л., Ян, Дж., Ли, Дж., Чен, Т., Чен, С., Ву, З. и др. (2019). Графит в качестве анода калий-ионного аккумулятора в электролите на основе карбоната и на основе эфира. J. Источники питания 409, 24–30. doi: 10.1016/j.jpowsour.2018.10.092
Полнотекстовая перекрестная ссылка | Академия Google
Wang, Q., Zhao, X., Ni, C., Tian, H., Li, J., Zhang, Z., et al. (2017). Реакция и механизмы уменьшения емкости наночастиц олова в калий-ионных батареях. J. Phys. хим. С 121, 12652–12657. doi: 10.1021/acs.jpcc.7b03837
Полнотекстовая перекрестная ссылка | Академия Google
Wang, W., Zhou, J., Wang, Z., Zhao, L., Li, P., Yang, Y., et al. (2018). Ближний порядок в мезопористом углероде повышает производительность калий-ионной батареи. Доп. Энергия Матер. 8:1701648. doi: 10.1002/aenm.201701648
Полнотекстовая перекрестная ссылка | Академия Google
Ван Ю. , Ван З., Чен Ю., Чжан Х., Юсуф М., Ву Х. и др. (2018). Гиперпористая губка, соединенная между собой иерархическими углеродными нанотрубками в качестве высокопроизводительного анода калий-ионного аккумулятора. Доп. Матер. 30:1802074. doi: 10.1002/adma.201802074
, Ван З., Чен Ю., Чжан Х., Юсуф М., Ву Х. и др. (2018). Гиперпористая губка, соединенная между собой иерархическими углеродными нанотрубками в качестве высокопроизводительного анода калий-ионного аккумулятора. Доп. Матер. 30:1802074. doi: 10.1002/adma.201802074
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вэй, З., Ван, Д., Ли, М., Гао, Ю., Ван, К., Чен, Г., и соавт. (2018). Изготовление иерархических сфероидов фосфата титана калия: исходный материал для хранения ионов натрия и калия. Доп. Энергия Матер. 8:1801102. doi: 10.1002/aenm.201801102
Полнотекстовая перекрестная ссылка | Академия Google
Весселс, К.Д., Хаггинс, Р. А., и Цуй, Ю. (2011). Медные аккумуляторные электроды из гексацианоферрата с длительным сроком службы и высокой мощностью. Нац. Коммуна . 2, 550–555. doi: 10.1038/ncomms1563
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Wu, X., Zhao, W., Wang, H. , Qi, X., Xing, Z., Zhuang, Q., et al. (2018б). Повышенная емкость химически связанного фосфорно-углеродного композита в качестве анодного материала для калий-ионных аккумуляторов. Дж. Источник питания. 378, 460–467. дои: 10.1016/j.jpowsour.2017.12.077
, Qi, X., Xing, Z., Zhuang, Q., et al. (2018б). Повышенная емкость химически связанного фосфорно-углеродного композита в качестве анодного материала для калий-ионных аккумуляторов. Дж. Источник питания. 378, 460–467. дои: 10.1016/j.jpowsour.2017.12.077
Полнотекстовая перекрестная ссылка | Академия Google
Xie, Y., Dall’Agnese, Y., Naguib, M., Gogotsi, Y., Barsoum, M.W., Zhuang, H.L., et al. (2014). Прогнозирование и характеристика анодов из нанолистов MXene для нелитий-ионных аккумуляторов. ACS Nano 8, 9606–9615. дои: 10.1021/nn503921j
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Xing, Z., Qi, Y., Jian, Z., and Ji, X. (2017). Полинанокристаллический графит: новый углеродный анод с превосходными циклическими характеристиками для K-ion аккумуляторов. Приложение ACS Матер. Интерфейсы 9, 4343–4351. doi: 10.1021/acsami.6b06767
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Xiong, P. , Bai, P., Tu, S., Cheng, M., Zhang, J., Sun, J., et al. (2018б). Наночастицы красного фосфора @ 3D взаимосвязанный углеродный нанолистовой композитный каркас для анодов калий-ионных аккумуляторов. Малый 14, 1802140. doi: 10.1002/smll.201802140
, Bai, P., Tu, S., Cheng, M., Zhang, J., Sun, J., et al. (2018б). Наночастицы красного фосфора @ 3D взаимосвязанный углеродный нанолистовой композитный каркас для анодов калий-ионных аккумуляторов. Малый 14, 1802140. doi: 10.1002/smll.201802140
Полнотекстовая перекрестная ссылка | Академия Google
Сюн, П., Чжао, X.и Сюй Ю. (2018a). Легированные азотом углеродные нанотрубки на основе металлоорганических каркасов для анодов калий-ионных аккумуляторов. ChemSusChem 11, 202–208. doi: 10.1002/cssc.201701759
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Xu, Y., Zhang, C., Zhou, M., Fu, Q., Zhao, C., Wu, M., et al. (2018). Углеродные нановолокна с высоким содержанием азота с превосходной скоростью и возможностью повторного использования для калий-ионных аккумуляторов. Нац. коммун. 9:1720. дои: 10.1038/с41467-018-04190-з
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сюэ, К. , Ли, Д., Хуанг, Ю., Чжан, X., Йе, Ю., Фань, Э., и другие. (2018). Витамин К как высокоэффективный органический анодный материал для перезаряжаемых ионно-калиевых батарей. Дж. Матер. хим. А 6, 12559–12564. дои: 10.1039/C8TA03921F
, Ли, Д., Хуанг, Ю., Чжан, X., Йе, Ю., Фань, Э., и другие. (2018). Витамин К как высокоэффективный органический анодный материал для перезаряжаемых ионно-калиевых батарей. Дж. Матер. хим. А 6, 12559–12564. дои: 10.1039/C8TA03921F
Полнотекстовая перекрестная ссылка | Академия Google
Ямамото Х., Мурацубаки С., Кубота К., Фукуниси М., Ватанабэ Х., Ким Дж. и др.(2018). Синтез твердых углеродов повышенной емкости из целлюлозы для Na- и K-ионных аккумуляторов. Дж. Матер. хим. А 6, 16844–16848. дои: 10.1039/C8TA05203D
Полнотекстовая перекрестная ссылка | Академия Google
Yang, H., Li, H., Li, J., Sun, Z., He, K., Cheng, H.M., et al. (2019). Аккумуляторная алюминиевая батарея: возможности и проблемы. Анжю. Чеми Инт. Эд. doi: 10.1002/anie.201814031. [Epub перед печатью].
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ян, С., Zhang, M., Wu, X., Wu, X., Zeng, F., Li, Y., et al. (2019). Превосходные электрохимические характеристики ZnMn 2 O 4 /Mn 2 O 3 : композитный катодный материал для потенциальных водных цинк-ионных аккумуляторов. Дж. Электроанал. хим. 832, 69–74. doi: 10.1016/j.jelechem.2018.10.051
Дж. Электроанал. хим. 832, 69–74. doi: 10.1016/j.jelechem.2018.10.051
Полнотекстовая перекрестная ссылка | Академия Google
Йи, З., Линь, Н., Чжан, В., Ван, В., Чжу, Ю. и Цянь, Ю. (2018). Получение наночастиц Sb в расплавленной соли, их характеристики и механизм накопления калия. Наномасштаб 10, 13236–13241. дои: 10.1039/C8NR03829E
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Zhang, N., Cheng, F., Liu, J., Wang, L., Long, X., Liu, X., et al. (2017). Перезаряжаемые водные батареи на основе диоксида цинка и марганца с высокой плотностью энергии и мощности. Нац. коммун. 8, 1–9. doi: 10.1038/s41467-017-00467-x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжан, К., Мао, Дж., Панг, В.К., Чжэн, Т., Сенкадас В., Чен Ю. и соавт. (2018). Повышение эффективности накопления калия в анодных материалах на основе сплавов с помощью химии электролитных солей. Доп. Энергия Матер. 2018:1703288. doi: 10.1002/aenm.201703288
2018:1703288. doi: 10.1002/aenm.201703288
Полнотекстовая перекрестная ссылка | Академия Google
Чжан В., Мао Дж., Ли С., Чен З. и Го З. (2017). Материалы сплава на основе фосфора для анода усовершенствованной калий-ионной батареи. Дж. Ам. хим. Соц . 139, 3316–3319. doi: 10.1021/jacs.6b12185
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжан, В., Панг В.К., Сенкадас В. и Го З. (2018b). Понимание высокой плотности энергии Sn 4 P 3 анодов для калий-ионных аккумуляторов. Дж 2, 1534–1547. doi: 10.1016/j.joule.2018.04.022
Полнотекстовая перекрестная ссылка | Академия Google
Zhang, W., Wu, Z., Zhang, J., Liu, G., Yang, N.H., Liu, R.S., et al. (2018а). Раскрытие влияния химии солей на долговечный анод с высокой концентрацией фосфора для ионно-калиевых батарей. Nano Energy 53, 967–974.doi: 10.1016/j.nanoen.2018.09.058
Полнотекстовая перекрестная ссылка | Академия Google
Zhang, Z. , Li, M., Gao, Y., Wei, Z., Zhang, M., Wang, C., et al. (2018). Быстрое хранение калия в иерархических микросферах Ca 0,5 Ti 2 (PO 4 ) 3 @C позволяет создавать высокоэффективные калий-ионные конденсаторы. Доп. Функц. Матер. 28:1802684. doi: 10.1002/adfm.201802684
, Li, M., Gao, Y., Wei, Z., Zhang, M., Wang, C., et al. (2018). Быстрое хранение калия в иерархических микросферах Ca 0,5 Ti 2 (PO 4 ) 3 @C позволяет создавать высокоэффективные калий-ионные конденсаторы. Доп. Функц. Матер. 28:1802684. doi: 10.1002/adfm.201802684
Полнотекстовая перекрестная ссылка | Академия Google
Чжао, Дж., Цзоу, X., Чжу Ю., Сюй Ю. и Ван К. (2016). Электрохимическое внедрение калия в графит. Доп. Функц. Мать . 26, 8103–8110. doi: 10.1002/adfm.201602248
Полнотекстовая перекрестная ссылка | Академия Google
Чжао, К., Ван, Дж., Лу, Ю., Ли, Ю., Лян, Г., и Чен, Дж. (2016). Оксоуглеродные соли для быстрозаряжаемых аккумуляторов. Анжю. Чеми Инт. Эд. 55, 12528–12532. doi: 10.1002/anie.201607194
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжао, X., Tang, Y., Ni, C., Wang, J., Star, A., Xu, Y., et al. (2018). Отдельно стоящие маты из углеродных нанотрубок, легированные азотом, для анодов калий-ионных аккумуляторов.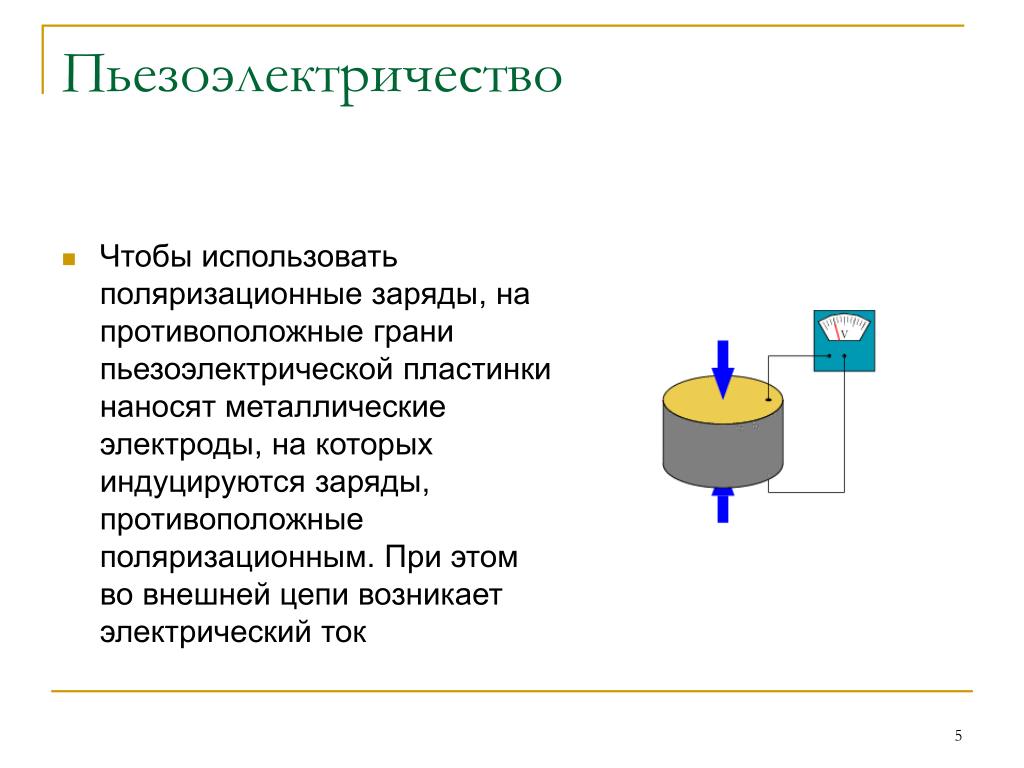 Приложение ACS Энергия Матер. 1, 1703–1707 гг. doi: 10.1021/acsaem.8b00182
Приложение ACS Энергия Матер. 1, 1703–1707 гг. doi: 10.1021/acsaem.8b00182
Полнотекстовая перекрестная ссылка | Академия Google
Чжао, X., Сюн, П., Мэн, Дж., Лян, Ю., Ван, Дж., и Сюй, Ю. (2017). Высокопроизводительные и долговечные пористые бумажные аноды из углеродных нановолокон для калий-ионных аккумуляторов. Дж. Матер. хим. А 5, 19237–19244.дои: 10.1039/C7TA04264G
Полнотекстовая перекрестная ссылка | Академия Google
Чжэн, Дж., Ян, Ю., Фань, X., Цзи, Г., Цзи, X., и Ван, К. (2019). Чрезвычайно стабильные композитные аноды из сурьмы и углерода для калий-ионных аккумуляторов. Энергетика Окружающая среда. науч. 12, 615–623. дои: 10.1039/C8EE02836B
Полнотекстовая перекрестная ссылка | Академия Google
Zhu, Y.-H., Yang, X., Sun, T., Wang, S., Zhao, Y.-L., Yan, J.-M., et al. (2018). Последние достижения и перспективы катодных материалов для неводных калий-ионных аккумуляторов. Электрохим. Energy Rev.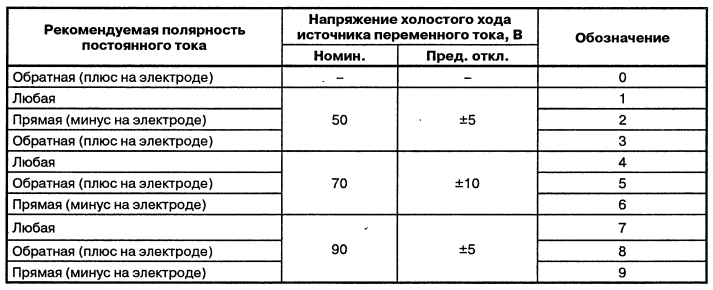 1, 548–566. doi: 10.1007/s41918-018-0019-7
1, 548–566. doi: 10.1007/s41918-018-0019-7
Полнотекстовая перекрестная ссылка | Академия Google
Электродные материалы для литий-ионных аккумуляторов
Аноды
В настоящее время существует только два типа промышленных анодных материалов: на основе углерода (в основном графита) и оксидной шпинели Li 4 Ti 5 O 12 ( Рисунок 3 ). Использование интеркаляционного электрода с низким потенциалом позволяет избежать проблем с цикличностью и безопасностью, связанных с образованием дендритов на литиевых анодах, подвергающихся перезарядке, которые препятствуют их использованию в перезаряжаемых батареях.В нормальных условиях эксплуатации и при большинстве неблагоприятных условий литиевые дендриты не растут на графитовых анодах, и эти электроды можно надежно циклировать. О химическом получении интеркаляционных соединений графита (GIC) Li x C 6 (x = 1), в которых ионы лития расположены между листами графена, впервые сообщил в 1955 году Герольд. 34 В то время как литированный графит был предложен для использования в батареях еще в 1977 году Арманом и Тузеном, 35 коинтеркаляция растворителя и необратимое восстановление электролитических растворов, обычно используемых в то время, предотвратили электрохимическое циклирование этого электрода.Только когда были разработаны электролитические растворы, содержащие этиленкарбонат (EC) (продукт № 676802), графитовые аноды можно было успешно использовать в конфигурации ионно-литиевых батарей. В этих растворах на поверхности частиц образуется граница твердого электролита (SEI), поскольку графит литируется в электрохимических элементах во время первых циклов. SEI является ионно-проводящим, но электронным изолятором, и после образования эффективно предотвращает дальнейшее необратимое восстановление электролитического раствора.Некоторое количество электролита обязательно расходуется во время начального цикла работы элемента для формирования SEI, что приводит к неэффективности заряда.
34 В то время как литированный графит был предложен для использования в батареях еще в 1977 году Арманом и Тузеном, 35 коинтеркаляция растворителя и необратимое восстановление электролитических растворов, обычно используемых в то время, предотвратили электрохимическое циклирование этого электрода.Только когда были разработаны электролитические растворы, содержащие этиленкарбонат (EC) (продукт № 676802), графитовые аноды можно было успешно использовать в конфигурации ионно-литиевых батарей. В этих растворах на поверхности частиц образуется граница твердого электролита (SEI), поскольку графит литируется в электрохимических элементах во время первых циклов. SEI является ионно-проводящим, но электронным изолятором, и после образования эффективно предотвращает дальнейшее необратимое восстановление электролитического раствора.Некоторое количество электролита обязательно расходуется во время начального цикла работы элемента для формирования SEI, что приводит к неэффективности заряда. Тщательная очистка, оптимизация морфологии частиц и использование добавок к электролиту значительно снизили неэффективность; в результате усовершенствованные ионно-литиевые батареи демонстрируют начальную необратимую емкость всего в несколько процентов. Осаждение растворенного металла с катода или высокие температуры во время работы могут разрушить SEI, тем самым потребовав его повторного формирования; это затем приводит к дальнейшей потере циклируемого лития.
Тщательная очистка, оптимизация морфологии частиц и использование добавок к электролиту значительно снизили неэффективность; в результате усовершенствованные ионно-литиевые батареи демонстрируют начальную необратимую емкость всего в несколько процентов. Осаждение растворенного металла с катода или высокие температуры во время работы могут разрушить SEI, тем самым потребовав его повторного формирования; это затем приводит к дальнейшей потере циклируемого лития.
Графит состоит из листов графена, уложенных в шахматном порядке либо по схеме AB (шестиугольная, наиболее распространенная форма), либо по схеме ABC (ромбоэдрическая) ( рис. 3 ). При введении ионов лития листы графена укладываются непосредственно друг на друга по схеме AA, и происходит стадирование; т. е. образуются соединения, в которых есть периодические массивы незанятых галерей, число которых зависит от значения x в Li x C 6 . (Например, в соединении стадии 2, где x=0.5, занятые галереи чередуются с незанятыми). Стадийность проявляется в профиле электрохимического напряжения литий-графитовых полуэлементов в виде серии плато примерно от 0,2 до 0,1 В, что указывает на несколько двухфазных областей.
Стадийность проявляется в профиле электрохимического напряжения литий-графитовых полуэлементов в виде серии плато примерно от 0,2 до 0,1 В, что указывает на несколько двухфазных областей.
Неграфитовый углерод, который содержит графеновые домены, но не имеет дальнего структурного порядка, также представляет интерес для литий-ионных аккумуляторов. Внедрение лития в эти материалы обычно происходит при более высоких потенциалах, чем в графите, и стадийность не возникает.Хотя необратимая емкость часто намного выше, чем у графита, SEI на некоторых типах неупорядоченного углерода (например, на твердом углероде) менее подвержены разрушению, что делает их подходящими для сопряжения с катодами из оксида марганца шпинели, в которых растворение металла может быть проблематичным. Структуры неупорядоченных углеродов очень сложны, а электрохимические свойства (форма профиля напряжения и емкости) значительно различаются. Для получения дополнительной информации об угольных анодах читатель может обратиться к ссылкам 36 и 37.
Шпинель литий-титаноксид, Li 4 Ti 5 O 12 , 38 (Арт. № 702277) является альтернативой угольным анодам, но ее использование ограничено приложениями, не требующими высокой энергии. плотности из-за высокого рабочего напряжения (1,5 В против Li/Li + ). Он обратимо вмещает литий с образованием фазы каменной соли Li 7 Ti 4 O 12 . В отличие от большинства других интеркаляционных электродов, этот материал не демонстрирует изменения объема во время двухфазных процессов введения/извлечения лития, что делает его материалом с нулевой деформацией, который чрезвычайно хорошо циклируется. 39 Кроме того, в окне термодинамической стабильности электролитических растворов на основе органических карбонатов возникает высокий рабочий потенциал, поэтому нет необходимости формировать слой SEI для правильного функционирования электрода. Поскольку Li 4 Ti 5 O 12 имеет низкую электронную проводимость, он часто имеет наноструктуру. Как и в случае с LiFePO 4 , низкая реакционная способность Li 4 Ti 5 O 12 позволяет этому подходу добиться успеха, хотя опасения по поводу влияния наноструктурирования на и без того низкую плотность энергии все еще оправданы.Наилучшие результаты достигаются, когда наночастицы однородны и имеют сферическую форму, поэтому они хорошо упаковываются. 40 Элементы, состоящие из наноструктурированного Li 4 Ti 5 O 12 и LiFePO 4 , могут подвергаться более 200 циклов со скоростью до 10 C (где C определяется как скорость, при которой общая емкость аккумулятор разряжается за 1 час) без снижения емкости.
Как и в случае с LiFePO 4 , низкая реакционная способность Li 4 Ti 5 O 12 позволяет этому подходу добиться успеха, хотя опасения по поводу влияния наноструктурирования на и без того низкую плотность энергии все еще оправданы.Наилучшие результаты достигаются, когда наночастицы однородны и имеют сферическую форму, поэтому они хорошо упаковываются. 40 Элементы, состоящие из наноструктурированного Li 4 Ti 5 O 12 и LiFePO 4 , могут подвергаться более 200 циклов со скоростью до 10 C (где C определяется как скорость, при которой общая емкость аккумулятор разряжается за 1 час) без снижения емкости.
На пути к лучшим батареям
Текущие исследования электродов для ионно-литиевых аккумуляторов направлены в первую очередь на материалы, которые могут обеспечить более высокую плотность энергии устройств.Для положительных электродов разрабатываются как высоковольтные материалы, такие как LiNi 0,5 Mn 1,5 O 4 (номер продукта 725110) ( рис. 2 ), так и материалы с повышенной емкостью. К последним относятся высокоемкие марганцево-богатые (HCMR) слоисто-слоистые композиты общей формулы xLi 2 MnO 3 •(1-x)LiNiyMnyCo 1-2y O 2 , 41 и соединения такие как Li 2 MSiO 4 (M=Fe, Mn, Co), из которых теоретически может быть удалено более одного Li на формульную единицу.Для многослойных композитов начальный заряд выше примерно 4,4 В относительно Li/Li + в электрохимических элементах активирует обычно инертный компонент Li 2 MnO 3 путем необратимого удаления ионов лития и кислорода. Слоистый фрагмент «MnO 2 », который образуется, может затем интеркалировать ионы лития, добавляя свою емкость к емкости компонента NMC. Хотя сообщалось об очень высокой емкости (иногда превышающей 250 мА·ч/г) для активированных композитов в электрохимических элементах, они имеют низкую скорость и падение напряжения из-за постепенного превращения слоистого компонента MnO 2 в шпинель при катание на велосипеде.
2 ), так и материалы с повышенной емкостью. К последним относятся высокоемкие марганцево-богатые (HCMR) слоисто-слоистые композиты общей формулы xLi 2 MnO 3 •(1-x)LiNiyMnyCo 1-2y O 2 , 41 и соединения такие как Li 2 MSiO 4 (M=Fe, Mn, Co), из которых теоретически может быть удалено более одного Li на формульную единицу.Для многослойных композитов начальный заряд выше примерно 4,4 В относительно Li/Li + в электрохимических элементах активирует обычно инертный компонент Li 2 MnO 3 путем необратимого удаления ионов лития и кислорода. Слоистый фрагмент «MnO 2 », который образуется, может затем интеркалировать ионы лития, добавляя свою емкость к емкости компонента NMC. Хотя сообщалось об очень высокой емкости (иногда превышающей 250 мА·ч/г) для активированных композитов в электрохимических элементах, они имеют низкую скорость и падение напряжения из-за постепенного превращения слоистого компонента MnO 2 в шпинель при катание на велосипеде.
Высокая теоретическая емкость около 330 мАч/г, рассчитанная для Li 2 MSiO 4 на основе извлечения двух ионов лития на формульную единицу, требует общего изменения окислительно-восстановительного состояния на +2 для первоначально двухвалентного металлического центра. Расчеты из первых принципов показывают, что окисление Fe 3+ в Fe 4+ происходит при непрактично высоком потенциале, 42 , а эксперименты подтвердили, что только первый ион лития может быть извлечен во время заряда Li 2 FeSiO 4 в электрохимических элементах. 43 Хотя ожидается, что окисление Mn 3+ в Mn 4+ в силикатах будет происходить при более низких потенциалах, чем окисление Fe 3+ в Fe 4+ , попытки использовать Li 2 Соединения MnSiO 4 или Li 2 (Mn,Fe)SiO 4 в качестве катодов не имели большого успеха. Даже наноструктурирование и добавление большого количества углерода к композитным электродам не компенсируют в достаточной мере плохие транспортные свойства и отрицательно сказываются на практической плотности энергии. Кроме того, нежелательным является широкий диапазон напряжений, в котором протекают интеркаляционные процессы, так как это приводит к падению энергоемкости по мере разряда электрода. Соединения, в которых металлические центры могут претерпевать более одного изменения степени окисления, по-прежнему представляют интерес из-за потенциальной очень высокой емкости, и исследователи продолжают поиск электроактивных материалов с такими характеристиками.
Кроме того, нежелательным является широкий диапазон напряжений, в котором протекают интеркаляционные процессы, так как это приводит к падению энергоемкости по мере разряда электрода. Соединения, в которых металлические центры могут претерпевать более одного изменения степени окисления, по-прежнему представляют интерес из-за потенциальной очень высокой емкости, и исследователи продолжают поиск электроактивных материалов с такими характеристиками.
Напротив, высоковольтный шпинельный катод LiNi 0,5 Mn 1.5 O 4 демонстрирует очень хорошую скорость и цикличность, не требуя наноструктурирования, 44 , хотя преимущество плотности энергии по сравнению с коммерчески используемыми материалами относительно скромное (всего примерно на 30% больше, чем у Li 1+x Mn 2- x O 4 , например). Высокий рабочий потенциал может потребовать использования специально разработанных электролитических растворов, покрытий на поверхности частиц и других стратегий для снижения кулоновской неэффективности и увеличения срока службы. Как и в случае изоструктурных вариантов LiMn 2 O 4 , растворение Mn потенциально является проблемой для срока службы. Это явление в обоих случаях связано с наличием электроактивного Mn 3+ . В идеализированной структуре LiNi 0,5 Mn 1,5 O 4 ионы Mn находятся в степени окисления +4 и электрохимически инертны, и только Ni претерпевает окислительно-восстановительные процессы. На практике образцы обычно демонстрируют некоторую степень нестехиометрии с избытком Mn, присутствующим в трехвалентном состоянии.Это проявляется в профиле потенциала как емкость около 4 В по сравнению с Li/Li + ( рис. 2 ).
Как и в случае изоструктурных вариантов LiMn 2 O 4 , растворение Mn потенциально является проблемой для срока службы. Это явление в обоих случаях связано с наличием электроактивного Mn 3+ . В идеализированной структуре LiNi 0,5 Mn 1,5 O 4 ионы Mn находятся в степени окисления +4 и электрохимически инертны, и только Ni претерпевает окислительно-восстановительные процессы. На практике образцы обычно демонстрируют некоторую степень нестехиометрии с избытком Mn, присутствующим в трехвалентном состоянии.Это проявляется в профиле потенциала как емкость около 4 В по сравнению с Li/Li + ( рис. 2 ).
Исследования новых анодных материалов были сосредоточены на сплавах лития, в первую очередь с Si, 45 (номер продукта 633097) и классе материалов, известных как конверсионные электроды, 46 , которые подвергаются реакции 1, а не простому интеркалированию.
nLi + + ne – + M n+ X m ↔ M + nLiX m/n (X=O, F, N, S) (1)
Исходные материалы для реакции 1, как правило, представляют собой наночастицы, что обеспечивает легкое восстановление до металлического элемента и соли лития во время включения лития. Удельная емкость может быть чрезвычайно высокой (700 мАч/г и более), но эти электроды страдают от высокой неэффективности первого цикла, наклонных профилей напряжения и большой поляризации заряда/разряда (гистерезиса), что приводит к низкой эффективности туда и обратно. Гистерезис, скорее всего, является присущей системе, а не просто вопросом кинетических ограничений, которые, по-видимому, можно улучшить с помощью наноструктурирования. Разрыв связи и повторное образование происходят во время электрохимических процессов, и пути реакции могут быть разными для заряда и разряда.
Удельная емкость может быть чрезвычайно высокой (700 мАч/г и более), но эти электроды страдают от высокой неэффективности первого цикла, наклонных профилей напряжения и большой поляризации заряда/разряда (гистерезиса), что приводит к низкой эффективности туда и обратно. Гистерезис, скорее всего, является присущей системе, а не просто вопросом кинетических ограничений, которые, по-видимому, можно улучшить с помощью наноструктурирования. Разрыв связи и повторное образование происходят во время электрохимических процессов, и пути реакции могут быть разными для заряда и разряда.
Система кремний/литий имеет самую высокую удельную емкость среди всех литиевых сплавов, 4200 мАч/г, что соответствует полному восстановлению до конечного состава Li 4,4 Si. Очень большие объемные изменения, связанные с легированием (до 400%), приводят к быстрой деградации и отсоединению композитных электродов, изготовленных из обычного кремния микронного размера, что приводит к снижению срока службы. 47 Изменения объема также приводят к большой кулоновской неэффективности, связанной с непрерывным образованием слоев SEI на недавно открытых поверхностях.Значительные усилия были предприняты для снижения объемного расширения за счет наноструктурирования Si для снижения механических напряжений во время процессов легирования/делегирования лития. 48 Другие стратегии, добившиеся определенного успеха, включают использование специальных связующих, придающих эластичность композитному электроду, 49 , а также проводящих полимеров, которые выполняют двойную функцию в качестве связующего и проводящей добавки. 50
47 Изменения объема также приводят к большой кулоновской неэффективности, связанной с непрерывным образованием слоев SEI на недавно открытых поверхностях.Значительные усилия были предприняты для снижения объемного расширения за счет наноструктурирования Si для снижения механических напряжений во время процессов легирования/делегирования лития. 48 Другие стратегии, добившиеся определенного успеха, включают использование специальных связующих, придающих эластичность композитному электроду, 49 , а также проводящих полимеров, которые выполняют двойную функцию в качестве связующего и проводящей добавки. 50
Небольшие количества кремния в настоящее время добавляются в коммерческие аноды для повышения емкости, и несколько производителей батарей объявили о своем намерении заменить графит кремнием.Несколько удивительно, но улучшение удельной энергии аккумуляторов, содержащих кремниевые аноды, ожидается всего на 30%, несмотря на то, что удельная емкость кремния более чем в десять раз превышает удельную емкость графита. Это связано с требованием согласования емкости анода и катода с гораздо меньшей плотностью энергии, который должен обеспечить весь пригодный для повторного использования литий в батарее. Таким образом, дальнейшее увеличение удельной энергии зависит от успешной разработки катода большей емкости.
Это связано с требованием согласования емкости анода и катода с гораздо меньшей плотностью энергии, который должен обеспечить весь пригодный для повторного использования литий в батарее. Таким образом, дальнейшее увеличение удельной энергии зависит от успешной разработки катода большей емкости.
Резюме и задачи
Потребность в усовершенствованных литий-ионных батареях для требовательных транспортных средств создает как проблемы, так и возможности для заинтересованных материаловедов. Хотя более высокая плотность энергии чрезвычайно желательна для этих приложений, а также для бытовой электроники, она не может быть достигнута за счет безопасности, срока службы или календарного срока службы (, рис. 5, ). По этой причине наноструктурирование лучше всего работает при использовании материалов с низкой реакционной способностью, таких как LiFePO 4 и Li 4 Ti 5 O 12 , которые в настоящее время поступили в продажу.Наноподход также имеет некоторые преимущества для кремниевых анодов, которые находятся на продвинутой стадии разработки. В дополнение к кремнию недавно появились новые электроды с высокой плотностью энергии, такие как многослойные оксидные композиты, высоковольтные шпинели, конверсионные материалы и многовалентные окислительно-восстановительные соединения, включая силикаты, но не ограничиваясь ими.
В дополнение к кремнию недавно появились новые электроды с высокой плотностью энергии, такие как многослойные оксидные композиты, высоковольтные шпинели, конверсионные материалы и многовалентные окислительно-восстановительные соединения, включая силикаты, но не ограничиваясь ими.
Подтверждение
Эта работа была поддержана помощником секретаря по энергоэффективности и возобновляемым источникам энергии, Управление транспортных технологий США.S. Министерство энергетики по контракту № DE-AC02-05Ch21231. Этот документ был подготовлен как отчет о работе, спонсируемой правительством Соединенных Штатов. Хотя считается, что этот документ содержит правильную информацию, ни правительство Соединенных Штатов, ни какое-либо его учреждение, ни регенты Калифорнийского университета, ни кто-либо из их сотрудников не дают никаких гарантий, явных или подразумеваемых, и не берут на себя никакой юридической ответственности за точности, полноты или полезности любой раскрытой информации, устройства, продукта или процесса, или свидетельствует о том, что их использование не будет нарушать права частной собственности.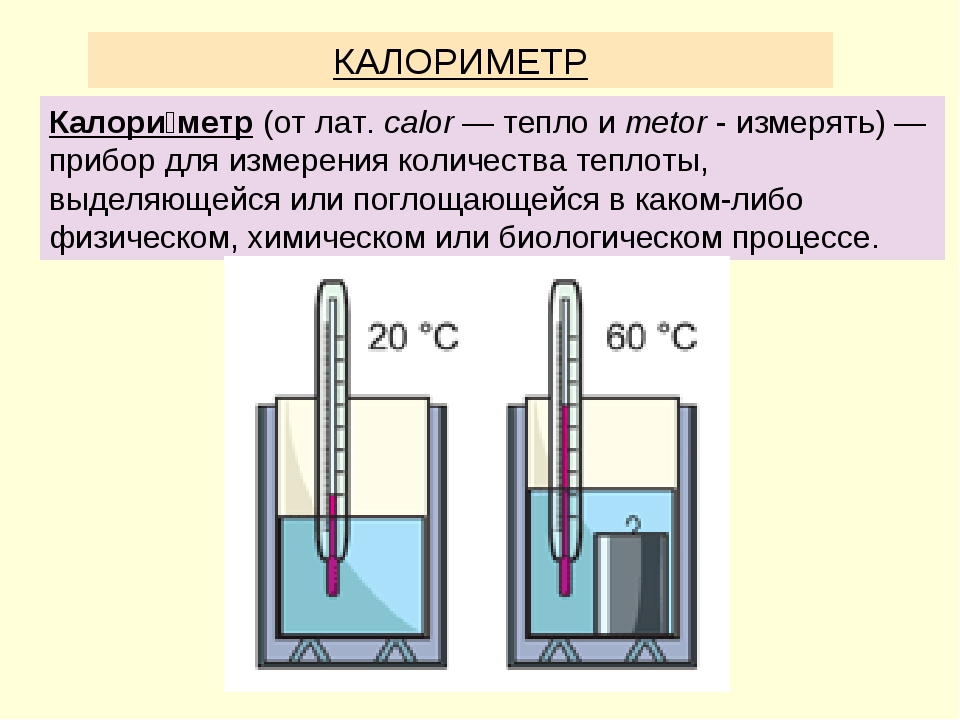 Ссылка в настоящем документе на любой конкретный коммерческий продукт, процесс или услугу под его торговым наименованием, товарным знаком, производителем или иным образом не обязательно означает или подразумевает его одобрение, рекомендацию или поддержку со стороны правительства Соединенных Штатов или любого его агентства или Регентов. Калифорнийского университета. Взгляды и мнения авторов, высказанные здесь, не обязательно отражают или отражают точку зрения правительства Соединенных Штатов или любого его агентства или регентов Калифорнийского университета.
Ссылка в настоящем документе на любой конкретный коммерческий продукт, процесс или услугу под его торговым наименованием, товарным знаком, производителем или иным образом не обязательно означает или подразумевает его одобрение, рекомендацию или поддержку со стороны правительства Соединенных Штатов или любого его агентства или Регентов. Калифорнийского университета. Взгляды и мнения авторов, высказанные здесь, не обязательно отражают или отражают точку зрения правительства Соединенных Штатов или любого его агентства или регентов Калифорнийского университета.


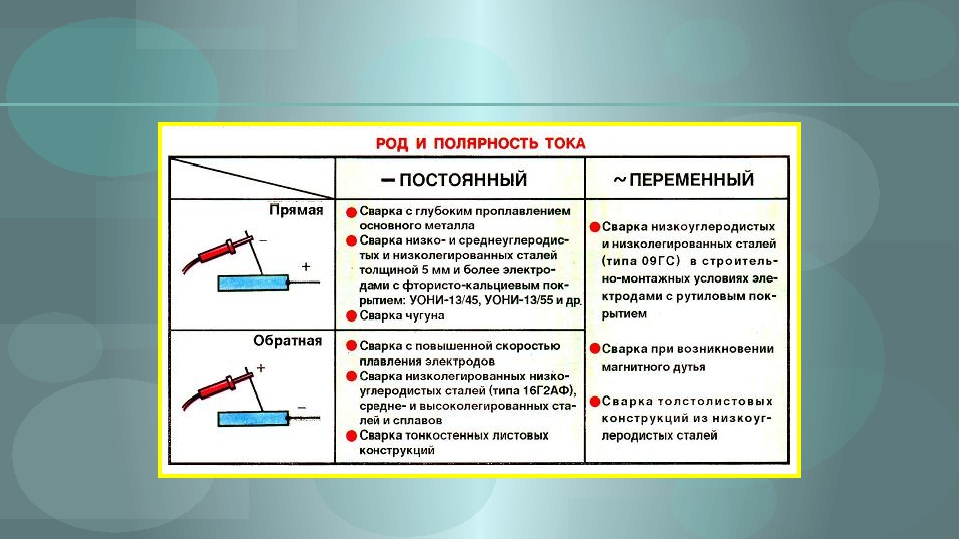
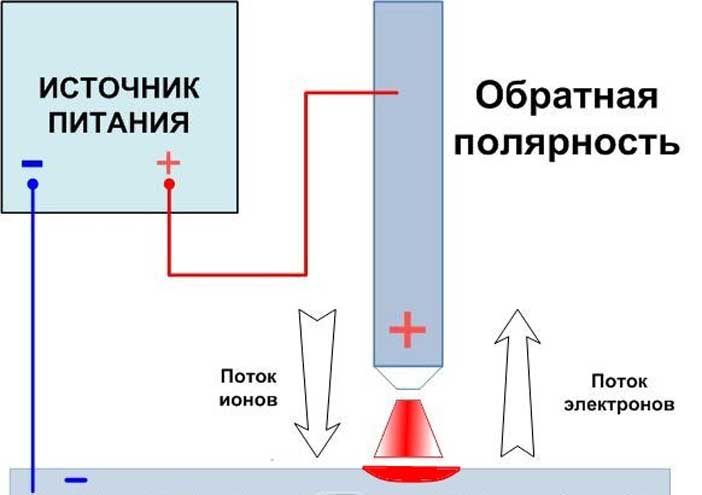

 Перед началом работ внимательно изучите рекомендации по настройки аппарата к конкретному сплаву.
Перед началом работ внимательно изучите рекомендации по настройки аппарата к конкретному сплаву. При работе с толстыми заготовками качество шва резко снижается.
При работе с толстыми заготовками качество шва резко снижается. Редукция — это приобретение электронов.
Редукция — это приобретение электронов.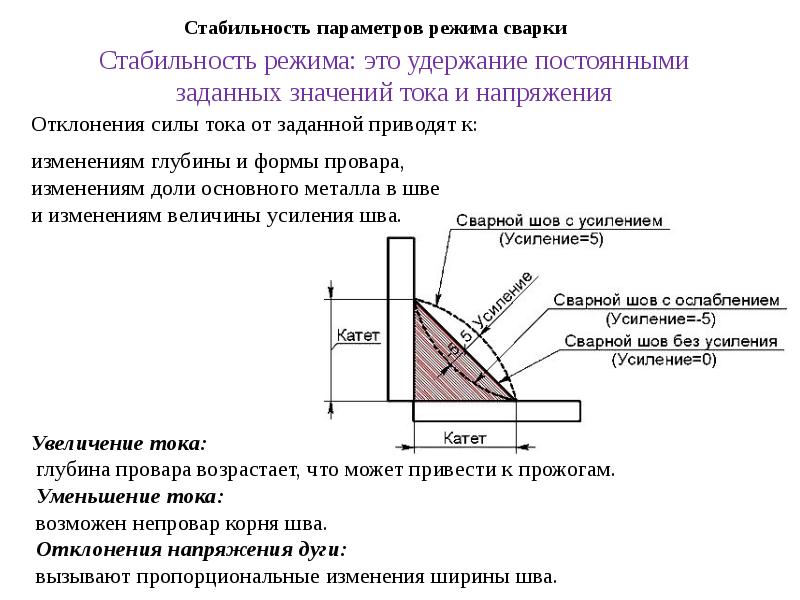 +$ → положительный электрод является анодом.-$ → отрицательный электрод является катодом.
+$ → положительный электрод является анодом.-$ → отрицательный электрод является катодом.