ICSC 0656 — ФТОРИД ХЛОРА (III)
ICSC 0656 — ФТОРИД ХЛОРА (III)| ФТОРИД ХЛОРА (III) | ICSC: 0656 (Сентябрь 1997) |
| CAS #: 7790-91-2 |
| UN #: 1749 |
| EINECS #: 232-230-4 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее, но способствует возгоранию других веществ. |
НЕ допускать контакта с легковоспламеняющимися веществами. НЕ допускать контакта с водой. | В случае возникновения пожара в рабочей зоне, использовать надлежащие средства пожаротушения. В случае пожара: охлаждать баллон распыляя воду. НЕ допускать прямого контакта с водой. Бороться с огнем из укрытия. |
| ИЗБЕГАТЬ ЛЮБЫХ КОНТАКТОВ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Ощущения жжения. Кашель. Боли в горле. Затрудненное дыхание. Сбивчивое дыхание. | Применять вентиляцию, местную вытяжку или средства защиты органов дыхания. |
Свежий воздух, покой. Полусидячее положение. Обратиться за медицинской помощью. |
| Кожа | Покраснение. Серьезные ожоги кожи. Боль. Волдыри. | Защитные перчатки. Защитная одежда. | Сначала промыть большим количеством воды в течение не менее 15 минут, затем удалить загрязненную одежду и снова промыть. обратиться за медицинской помощью . |
| Глаза | Покраснение. Боль. Сильные глубокие ожоги. Потеря зрения. | Использовать маску для лица или средства защиты глаз в комбинации со средствами защиты органов дыхания.. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | |||
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Покинуть опасную зону! Проконсультироваться со специалистом! Средства индивидуальной защиты: полный комплект защитной одежды СПЕЦИАЛЬНО РЕКОМЕНДОВАННЫЙ ДЛЯ ЭФФЕКТИВНОЙ ЗАЩИТЫ ОТ трифторида хлора, включая автономный дыхательный аппарат. Вентилировать. Выключите газ в источнике, если это возможно. НИКОГДА не направлять струю воды на жидкость. Вентилировать. Выключите газ в источнике, если это возможно. НИКОГДА не направлять струю воды на жидкость. |
Согласно критериям СГС ООН ТранспортировкаКлассификация ООН Класс опасности по ООН: 2.3; Дополнительные риски по ООН: 5.1 and 8 |
| ХРАНЕНИЕ | |
| Обеспечить огнестойкость. Отдельно от горючих веществ, восстановителей и пищевых продуктов и кормов. Прохладное место. Хранить сухим. | |
| УПАКОВКА | |
| Не перевозить с продуктами питания, кормами для животных и горючими материалами. |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| ФТОРИД ХЛОРА (III) | ICSC: 0656 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: ClF3 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
 Необходимо медицинское обследование. См Примечания Необходимо медицинское обследование. См Примечания
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| TLV: 0.1 ppm как STEL |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| Thorough flushing with an inert gas should precede any opening of apparatus that has contained chlorine trifluoride. Бурно реагирует с такими средствами пожаротушения, как вода.  Значение предельно-допустимой концентрации не должно превышаться во время любой части профессионального воздействия. Симптомы отека легких часто не проявляются, пока не пройдет несколько часов, и они усугубляются физическими усилиями. Поэтому крайне важны отдых и медицинское наблюдение. Следует рассмотреть возможность немедленного проведения соответствующей ингаляционной терапии врачом или уполномоченным на это лицом. В случае отравления этим веществом необходимо специфическое лечение; должны иметься в наличии соответствующие средства с инструкциями. Данные о влиянии этого вещества на здоровье человека являются недостаточными, поэтому необходимо соблюдать предельную осторожность. См. карту ICSC 0283. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
I. ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ / КонсультантПлюс
I. ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ
2801 Фтор, хлор, бром и йод:
2801 10 000 — хлор —
2801 20 000 — йод —
2801 30 — фтор; бром:
2801 30 100 — фтор —
2801 30 900 — бром —
2802 00 000 Сера сублимированная или осажденная; сера —
коллоидная
2803 00 Углерод (сажи и прочие формы углерода, в другом
месте не поименованные или не включенные):
2803 00 100 — метановая сажа —
2803 00 800 — прочий —
2804 Водород, газы инертные и прочие неметаллы:
2804 10 000 — водород м3
— газы инертные:
2804 21 000 — аргон м3
2804 29 — прочие:
2804 29 100 — гелий м3
2804 29 900 — прочие м3
2804 30 000 — азот м3
2804 40 000 — кислород м3
2804 50 — бор; теллур:
2804 50 100 — бор —
2804 50 900 — теллур —
— кремний:
2804 61 000 — содержащий не менее 99,99 мас. % кремния —
% кремния —
2804 69 000 — прочий —
2804 70 00 — фосфор:
2804 70 001 — фосфор желтый («белый») —
2804 70 002 — фосфор красный —
2804 80 000 — мышьяк —
2804 90 000 — селен —
2805 Металлы щелочные или щелочно-земельные; металлы
редкоземельные, скандий и иттрий в чистом виде,
в смесях или сплавах; ртуть:
— металлы щелочные или щелочно-земельные:
2805 11 000 — натрий —
2805 12 000 — кальций —
2805 19 — прочие:
2805 19 100 — стронций и барий —
2805 19 900 — прочие —
2805 30 — металлы редкоземельные, скандий и иттрий в
чистом виде, в смесях или сплавах:
2805 30 100 — смеси или сплавы —
2805 30 900 — прочие —
2805 40 — ртуть:
2805 40 100 — во флягах нетто-массой 34,5 кг (стандартная —
масса), ценой на условиях ФОБ за каждую
флягу не более 224 евро
2805 40 900 — прочая —
F/C — Анализатор фтора и хлора
Доступные модели
- 5E-FT2301 (фтор)
- 5E-CLT2311 (хлор)
Применение
Анализаторы фтора/хлора используются для определения содержания фтора и хлора в угле и других горючих материалах (видах топлива) сжиганием образца с последующим поглощением продуктов конверсии водой (ионоселективный электрод для фтора и потенциометрическое титрование для хлора).
Особенности
Высокая степень автоматизации
Процесс анализа полностью автоматический. Доступны быстрые результаты анализа после загрузки образца.
Высокая эффективность
Непрерывный анализ двух проб каждой партии.
Обеспечение безопасности
Работа в полностью автоматическом режиме с защитой от отсутствия или переполнения уровня воды.
Гибкая конфигурация
Не требуется проточной воды для прибора с резервуаром с водой.
Технические характеристики
| Диапазон измерений | Фтор: 10-2000 мкг/г |
| Хлор: 0,003-0,4% | |
| Масса образца | 0,5 г |
| Точность печи | 1050 ± 10ºС |
| Время анализа | Разложение: 35 мин |
| Калибровка электрода: во время разложения | |
| Титрование: 15 мин | |
| Одновременный анализ двух образцов: 65 мин | |
| Последовательный анализ: 17,5 мин/образец (в среднем) | |
| Чувствительность электродного потенциала | 0,1 мВ |
| Минимальное заполнение насоса впрыска | 0,05 мл |
| Воспроизводимость | 0,015 мг/г (Fad ≤150 мкг/г), 10% (Fad ≥150 мкг/г), 0,010% (Clad) |
| Питание | Одна фаза, 220 В, 50/60 Гц, до 3,5 кВт |
| Вес, кг | Анализатор: 130, Резервуар: 30 |
| Габариты (Д*Ш*В), мм | Анализатор: 1400*600*610, Резервуар: 900*500*510 |
фтор хлор — Справочник химика 21
Электрохимические методы получения простых веществ.
 Процессы электрохимического окисления и восстановления осуществляются на электродах при электролизе расплавов или растворов соединений. Электрохимическим (анодным) окислением получают фтор, хлор и кислород. Электрохимическим (катодным) восстановлением расплавов соответствующих соединений получают щелочные и щелочноземельные металлы, алюминий и некоторые другие. [c.245]
Процессы электрохимического окисления и восстановления осуществляются на электродах при электролизе расплавов или растворов соединений. Электрохимическим (анодным) окислением получают фтор, хлор и кислород. Электрохимическим (катодным) восстановлением расплавов соответствующих соединений получают щелочные и щелочноземельные металлы, алюминий и некоторые другие. [c.245] Электронные аналоги. Рассмотрение размещения электронов по уровням и подуровням оболочек атомов, выражаемого электронными формулами, показывает нам, что независимо от числа энергетических уровней размещение электронов по подуровням в наружных уровнях может быть аналогичным. Эта аналогия выражается одинаковыми электронными формулами наружных уровней. Так, например, размещение электронов на наружных уровнях атомов бора, алюминия, галлия, индия и таллия выражается соответственно электронными формулами 2s 2p 35 3p 4s 4p 5s 5,o и б5 6р а в атомах фтора, хлора, брома, иода и астата — формулами 25 2р 35ЧрЧзЧр» 58 5р и б5 6р Элементы, в атомах которых одинакова электронная конфигурация наружного уровня, называются электронными аналогами. У атомов ряда элементов понятие электронной аналогии распространяется и на преднаружный уровень. Так, например, электронная конфигурация атомов титана, циркония и гафния выражается формулами 4з 4р 4с1 5з и а атомов марганца, технеция и рения — 45 Чр 4 552 5s 5p 5d» 6s . Таким образом, электронные аналоги отличаются друг от друга числом энергетических уровней и сходны но конфигурации наружных уровней. [c.32]
У атомов ряда элементов понятие электронной аналогии распространяется и на преднаружный уровень. Так, например, электронная конфигурация атомов титана, циркония и гафния выражается формулами 4з 4р 4с1 5з и а атомов марганца, технеция и рения — 45 Чр 4 552 5s 5p 5d» 6s . Таким образом, электронные аналоги отличаются друг от друга числом энергетических уровней и сходны но конфигурации наружных уровней. [c.32]
Рассуждая таким образом, можно сказать, что щелочноземельные элементы (магний, кальций, стронций и барий) похожи друг на друга также по этой причине у каждого из них на внешней оболочке по два электрона. На внешних оболочках атомов галогенов (фтора, хлора, брома и иода) по семь электронов, а на внешних оболочках инертных газов (неона, аргона, криптона и ксенона)— по восемь. [c.158]
В химической промышленности методом электролиза получают различные продукты к числу их относятся фтор, хлор, едкий натр, водород высокой степени чистоты, многие окислители, в частности, пероксид водорода. [c.301]
[c.301]
Тип связи Фтор Хлор Бром Иод [c.201]
Начнем с группы элементов, которые называют галогенами. Четыре самых важных члена этой группы — фтор, хлор, бром и иод. Фтор — газ бледно-зеленого цвета, очень ядовитый и очень активный это самое активное из известных нам веществ. Он взаимодействует почти со всеми молекулами, с которыми приходит в соприкосновение, вытесняя из них те или иные атомы и занимая их место. Хлор — тоже газ, желто-зеленого цвета, тоже активный и ядовитый, но несколько меньше фтора. Бром — темно-красная жидкость, а иод — твердое вещество серого цвета. [c.67]
Чтобы определить стадии процесса, кинетику замещения водорода на галоген сравнивали с кинетикой взаимодействия галоидов с водородом. Энергия активации при образовании галоидоводородных кислот в результате взаимодействия галоидов с водородом была рассчитана с точки зрения бимолекулярного механизма и механизма образования через свободные радикалы.
 Сопоставление полученных результатов с экспериментальными показало, что в случае фтора, хлора и брома промежуточно образуются свободные радикалы, в то время как реакции иода с водородом протекают по бимолекулярному механизму. [c.264]
Сопоставление полученных результатов с экспериментальными показало, что в случае фтора, хлора и брома промежуточно образуются свободные радикалы, в то время как реакции иода с водородом протекают по бимолекулярному механизму. [c.264]При обычных температурах в основном стандартном состоянии водород, кислород, азот, фтор, хлор и элементы подгруппы гелия являются газообразными, бром и ртуть — жидкими, а остальные элементы — кристаллическими. [c.24]
Фторо, хлоро, бромо и иодо [c.218]
Предскажите, как изменяется константа ди социации уксусной кислоты при замене атома вод рода в группе СНз на атомы фтора, хлора или бром [c.74]
Hal (F, l) галогены -фтор, хлор. .. (галогениды) [c.102]
Набивка из стружки фторопласта-4 со смазкой (Ф4с) Кислотные и щелочные среды различной концентрации, органические жидкости, жидкое топливо, фтор, хлор, бром, хлористая сера, растворители Для сальников центробежных и поршневых насосов, аппаратов с перемешивающими устройствами, регулирующей аппаратуры и арматуры с прокладками между отформованными кольцами уплотнителя из листового фторопласта-4 или полиэтилена [c. 266]
266]
Сера Серебро Скандий Стронций Сурьма Таллий Тантал Теллур Тербий Технеций Титан Торий Тулий Углерод Уран Фосфор Фтор. Хлор Хром [c.649]
Реакции замещения атомов водорода на фтор, хлор п бром экзотермические и необратимые. То же относится и к присоединению этих галогенов по ненасыщенной связи при умеренных температурах (примерно до 400 °С). [c.390]
Следующие группы не считаются главными и не включаются в название соединения-основы азидо-, бром-, иод-, нитро-, нитрозо-, фтор-, хлор-. Все они рассматриваются как заместители. [c.9]
Мембранные компрессоры. В компрессорах этого типа газ сжимается в результате уменьшения объема камеры сжатия при колебательном движении мембраны, вызываемом возвратно-поступательным движением жидкости. Мембрана, прогибаясь, вызывает всасывание и нагнетание газа. Мембрана полностью изолирует газ, предотвращая попадание в него масла II воды, поэтому компрессоры данного типа используют в тех случаях, когда требуется газ высокой чистоты. Они нашли применение при сжатии кислорода, фтора, хлора и других газов, т. е. там, где необходима полная герметичность полости компрессора. [c.18]
Они нашли применение при сжатии кислорода, фтора, хлора и других газов, т. е. там, где необходима полная герметичность полости компрессора. [c.18]
Сероводород Серы диоксид Углерода оксид Углерода диоксид Фтор Хлор [c.50]
Промотор Хлор Фтор Хлор [c.67]
В табл. 22 даны константы диссоциации бензойной, фтор-, хлор- и бромбензойной кислот (25°С). Обсудите влияние атомов фтора, хлора и брома в бензойной кислоте на силу соответствующих кислот. Каково влияние положения атомов галогено1в в бензольном кольце а силу этих кислот [c.75]
Вода горит в струе фтора. Хлор при 100 °С или на свету разлагает воду с выделением атомного кислорода [c.101]
Алкилирование фтор-, хлор- и бромбензолов бутеном-2 нрово-дилось как описано выше. Фторбензол по индукционному периоду, по тепловому эффекту и интенсивности поглощения бутена-2 напоминает бензол, хотя алкилат образует с более низким выходом. Хлорбензол оказался наименее реакционноспособным в данной реакции, как это видно из данных табл. 93, по выходу основных продуктов реакции. [c.148]
Хлорбензол оказался наименее реакционноспособным в данной реакции, как это видно из данных табл. 93, по выходу основных продуктов реакции. [c.148]
Дороговизна платины предопределила её малое содержание в промышленных катализаторах риформинга и, следовательно, необходимость её эффективного использования. Этому способствовало применение в качестве носителя оксида алюминия, известного как лучший носитель для катализаторов ароматизации. Для придания катализатору необходимой бифункцио-нальности (нужной для всего комплекса реакций) носителю следовало придать кислотные свойства промотированием галоидами (фтором, хлором). [c.3]
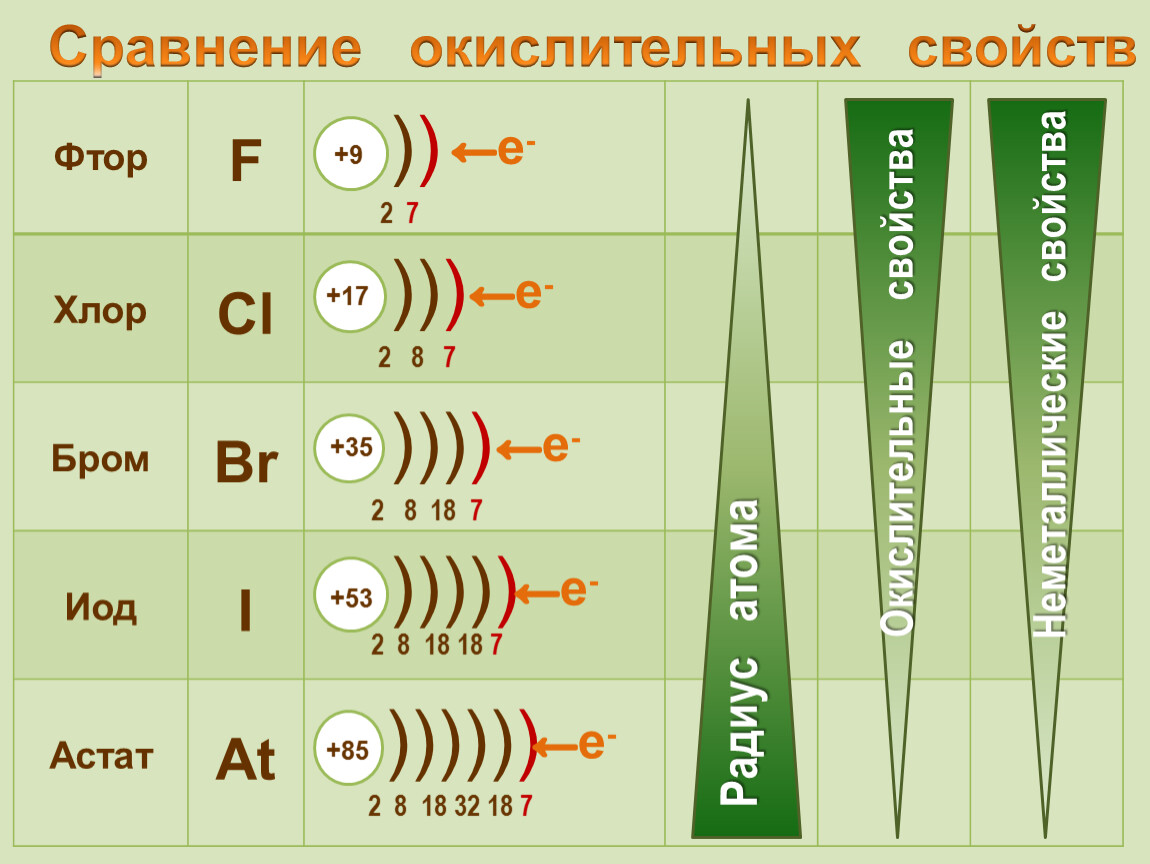
Исходя из строения атомов галогенов, ука-затг>, какие валентные состояния ха[)актерны для фтора, хлора, брома и иода. Какие степени окисленности проявляют галогены в своих соединениях [c.221]
Энергия дпссоци-ации молекул галогенов по схеме Г2[c.222]
Подгруппа VIIA (водород, фтор, хлор, бром, иод, астат) . 462 [c.4]
462 [c.4]
ПОДГРУППА VIIА (ВОДОРОД, ФТОР, ХЛОР, БРОМ, [c.462]
Предприятия химической промышленности выбрасывают в атмосферу в значительных количествах вредные газы и пыли. К их числу относятся сернистый ангидрид, окислы азота, туман серной кислоты, фтор, хлор, сероводород, окись углерода, пыли минеральных удобрений—фосфоритная и суперфосфатная, сажа и многие другие вещества. Большинство отходящих газов и пылей приносит ущерб народному хозяйству. Некоторые из них агрессивно действуют на строительные конструкции, разрушая бетон, железные крыши, фермы мостов, мачты линий электропередач. Пыль и сажа, осаж-даясь на изоляторах, могут вызвать аварии на высоковольтных линиях, попадаЯТ машины и механизмы, они ускоряют изяоС трущихся частей, понижают прозрач- [c.255]
Реакци I галогепировапия сильно различаются по своим энергетическим характеристикам, что предопределяет нх существенные особенности.
 Ниже сопоставлены тепловые эффекты реакций с участием фтора, хлора, брома и иода для идеального газообразного соотояния веществ [c.99]
Ниже сопоставлены тепловые эффекты реакций с участием фтора, хлора, брома и иода для идеального газообразного соотояния веществ [c.99] Как видно из приведенных данных, тепловой эффект уменьшается в ряду р2 > I2 > Вг2 > I2, причем особое место занимают реакци I фторирования и иодирования. Первые сопровождаются очень (ольшим выделением тепла, превышающим энергию разрыва связей С—С и С—Н. Если не принять особых мер, это приведет к глубокому разложению органического вещества, вследствие чего фторирование по технологии значительно отличается от хлорирования и поэтому рассмотрено в отдельном разделе главы. С другой стороны, иодирование протекает с очень небольшим или даже отрицательным тепловым эффектом и, в отличие от реакций с фтором, хлором и бромом, является обратимым. Это наряду с низкой активностью иода как реагента заставляет получать иод-пропзводные другими путями. Впрочем, они производятся в малых масштабах и не принадлежат к продуктам основного органического и нефтехимического синтеза. [c.99]
[c.99]
Галогены при обычной температуре практически иа медь не действуют. В присутствии паров воды фтор, хлор н бром окисляют медь с образованием дигалидов, ирн нагревании медь в комиакт-ком состоянни (фольга, проволока) сгорает в атмосфере фтора нли хлора. [c.319]
Вышли следующие тома т. 1, 1956 (общие сведения, воздух, вода, водород, дей-теряй, тритий, гелий и инертные газы, радон) т. 3, 1957 (главная подгруппа I группы, побочная подгруппа I группы) т. 4, 1958 (бериллий, магний, кальсий, стронций, барий) т. 7, 1959 (скандий — иттрий, редкие земли) т. 10. 1956 (азот, фосфор) т. И, 1958 (мышьяк, сурьма, висмут) т. 12, 1958 (ванадий, ниобий, тантал, протактиний) т. 14, 1959 (хром, молибден, вольфрам) т. 15, 1960 (уран и трансурановые элементы) т. 16. 19(Ю (фтор, хлор, бром, марганец) т. 18, 1959 (комплексные соединения железа, кобальта. никеля) т. 19, 1958 (рутений, осмнй, родий, иридий, палладий, платина). [c.127]
Кислотную функцию в алюмон/атиновом катализаторе выполняет окись алюминия. Она определяет активность катализатора в реакциях изомеризации и гидрокрекинга. Для усиления кислотности в окись алюминия вводят 0,3% фтора или 0,5—2% хлора. Более высокое содержание галогена значительно повышает крекирующие свойства катализатора и приводит к увеличению выхода газа. Применение хлора в качест]1о промотора имеет некоторое преимущество перед использованием фтора. Хлор в меньшей мере способствует реакциям крекинга и, кроме того, стабилизирует высокую дисперсность платины за сче» образования комплекса с платиной и окисью алюминия. [c.256]
Она определяет активность катализатора в реакциях изомеризации и гидрокрекинга. Для усиления кислотности в окись алюминия вводят 0,3% фтора или 0,5—2% хлора. Более высокое содержание галогена значительно повышает крекирующие свойства катализатора и приводит к увеличению выхода газа. Применение хлора в качест]1о промотора имеет некоторое преимущество перед использованием фтора. Хлор в меньшей мере способствует реакциям крекинга и, кроме того, стабилизирует высокую дисперсность платины за сче» образования комплекса с платиной и окисью алюминия. [c.256]
С. В. Завгородний и В. Г. Вахтин изучили алкилирование фтор-, хлор- и бромбензолов бутеном-2 [94] и фторбензола пропиленом и циклогексеном [95] в присутствии BF3 Н3РО4. Как показали исследования, моногалоидбензолы, как и алкилбензолы, алкилируются олефинами с образованием п-алкилгалоидбензолов. Выход их понижается от фторбензола к бромбензолу. [c.117]
Необходимо отметить, что наиболее полными являются технические условия ОШ52622 (ФРГ), поскольку они охватывают широкий круг различных показателей, обусловливающих применение СНГ в различных областях (в двигателях внутреннего сгорания, как котельно-печное топливо, в том числе городской газ, и как сырье для химической промышленности). В эти технические условия включены требования по ограничению большинства примесей (по элементарной сере, коррозионным свойствам, масляным остаткам, фтору, хлору, щелочи, аммиаку, кислороду, азоту и т.п.), которые практически во всех других технических условиях как потребителей, так и поставщиков не учитываются. Однако следует подчеркнуть, что даже при самых строгих технических условиях не будет достигнут положительный эффект, если неизвестно, какие специфические требования по некоторым показателям качества топлива предъявляет рассматриваемый процесс. [c.76]
В эти технические условия включены требования по ограничению большинства примесей (по элементарной сере, коррозионным свойствам, масляным остаткам, фтору, хлору, щелочи, аммиаку, кислороду, азоту и т.п.), которые практически во всех других технических условиях как потребителей, так и поставщиков не учитываются. Однако следует подчеркнуть, что даже при самых строгих технических условиях не будет достигнут положительный эффект, если неизвестно, какие специфические требования по некоторым показателям качества топлива предъявляет рассматриваемый процесс. [c.76]
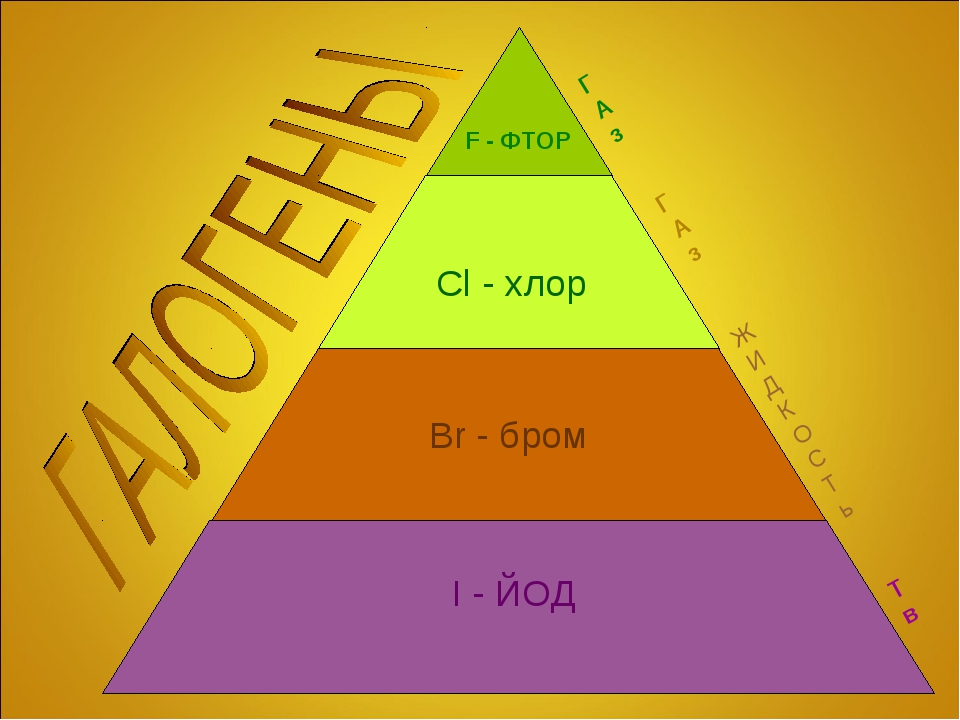
Химические свойства галогенов — урок. Химия, 8–9 класс.
Галогены относятся к химически активным веществам. В реакциях с металлами и большинством неметаллов, а также со сложными веществами галогены проявляют сильные окислительные свойства. Наиболее активен в химических реакциях фтор. С увеличением молекулярной массы активность галогенов снижается.
Взаимодействие с металлами
При взаимодействии галогенов с металлами образуются соли: фториды, хлориды, бромиды, иодиды.
Фтор реагирует со всеми металлами (даже с золотом и платиной), с большинством — при обычных условиях:
Ca+F2=CaF2,
2Au+3F2=t2AuF3.
Остальные галогены реагируют с металлами при нагревании:
2Fe+3Cl2=t2FeCl3,
Cu+Br2=tCuBr2,
2Al+3I2=t2AlI3.
Взаимодействие с водородом
В реакциях галогенов с водородом образуются газообразные галогеноводороды.
Фтор взаимодействует с водородом со взрывом с образованием фтороводорода:
h3+F2=2HF.
Смесь хлора с водородом взрывается только при поджигании или освещении. В результате реакции образуется хлороводород:
h3+Cl2=t2HCl.
Бром начинает реагировать с водородом только при нагревании, и реакция происходит без взрыва. Продукт реакции — бромоводород:
h3+Br2=t2HBr.
Реакция иода с водородом идёт медленно даже при нагревании. Иод с водородом образуют газ иодоводород:
Иод с водородом образуют газ иодоводород:
h3+I2=t2HI.
На примере этих реакций прослеживается снижение химической активности веществ в ряду: фтор — хлор — бром — иод.
Все галогеноводороды хорошо растворяются в воде. Их растворы представляют собой кислоты:
HF — плавиковая, HCl — соляная, HBr — бромоводородная, HI — иодоводородная.
Сила кислот в этом ряду увеличивается. Самая слабая из них — плавиковая кислота, самая сильная — иодоводородная.
Вытеснение галогенов друг другом из солей
В реакциях галогенов с галогенидами проявляется следующая закономерность: более активный галоген вытесняет менее активный из его солей. Так, хлор взаимодействует с водными растворами бромидов и иодидов, выступая в этих реакциях окислителем:
2KBr−1+Cl02=Br02+2KCl−1,
2NaI−1+Cl02=I02+2NaCl−1.
Бром способен вытеснить иод из иодидов, а с хлоридами не реагирует:
2KI−1+Br02=I02+2KBr−1.
У иода способность вытеснять другие галогены отсутствует, так как его окислительные свойства в ряду галогенов самые слабые.
Реакции фтора с водными растворами солей невозможны по причине его взаимодействия с водой.
Знакомимся с макро- и микроэлементами: фтор, хлор, хром
Знакомимся с очередной группой химических элементов, от присутствия и работы которых во многом зависит здоровье наших органов и систем, а следовательно, здоровье всего организма в целом. Сколько, когда и зачем они нужны. Фтор, хлор, хром.
ФТОР
99% фтора находится в костной ткани и зубах в составе фторапатита. Первое место по содержанию фтора занимает цемент зуба. За ним следуют кость, дентин и эмаль.
Суточная потребность
Взрослые: 2–4 мг; дети: новорожденные — 0,1 мг, 1 год — 1 мг, 2 года — 1,5 мг.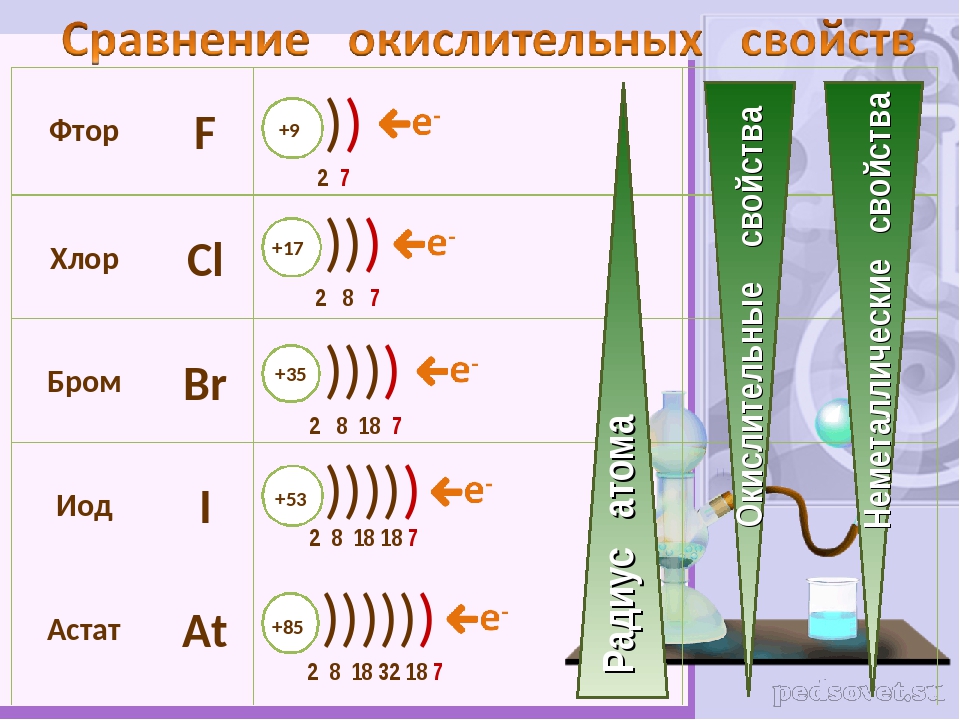 Поступает в организм животных и человека преимущественно с питьевой водой.
Поступает в организм животных и человека преимущественно с питьевой водой.
Значение в организме
Фтор способствует восстановлению эмали и уменьшает проникаемость в ткани зуба, замедляя действие микроорганизмов мягкого зубного налета, облегчает процессы реминерализации эмали, обладает антибактериальным действием.
Оказывает стимулирующее действие на все производные соединительной ткани, стимулирует иммунные реакции.
Следствия дефицита
Слабые, хрупкие кости и зубы. Типичное поражение зубов кариесом.
Для детей
Запаздывание прорезывания зубов и специфическое поражение зубов молочного прикуса кариесом; плохая осанка и близорукость. Существуют косвенные указания на связь гипофтороза с тонзиллопатиями, рахитом, неполноценностью иммунного статуса и нарушением обмена кальция.
Для пожилых
Прогрессирование типичного кариеса зубов; фторзависимый остеопороз скелета, склонность к переломам, особенно у женщин.
Источники
Фторированная вода и любая пища, приготовленная на ней. Продукты моря, консервы, желатин.
ХЛОР
Постоянный спутник натрия в организме.
Суточная потребность
Токсичность проявляется при дозе более 15 г в сутки.
Значение в организме
Регулирует поступление, расходование и распределение воды в организме. Способствует выведению шлаков, помогает пищеварению, улучшает функции печени.
Роль в обмене витаминов
Хлорированная вода разрушает витамин Е.
Связь с другими микроэлементами
Хлорированная вода нарушает обмен кальция.
Использование в медицине
Ионы хлора поваренной соли нейтрализуют успокаивающее действие препаратов брома.
Причины дефицита
Его потребность полностью удовлетворяет обычная пища, так как в ней всегда избыток поваренной соли.
Причины и следствия избытка
Обеззараживание хлором неизбежно вызывает образование в водопроводной воде хлорорганических соединений, наиболее опасных и вредных, способствующих возникновению многих заболеваний и обладающих канцерогенным действием.
ХРОМ
Присутствует в печени, железах внутренней секреции и кишечнике, содержится в легких, селезенке, мышцах и костях. Концентрация хрома с возрастом уменьшается.
Суточная потребность
Взрослые: 50–200 мкг; дети: до 1 года — 0,2 мкг/кг, 1–5 лет — 1–5 мкг, 5–10 лет — 5 мкг, 10–14 лет — 10–20 мкг. Потребность возрастает при острых инфекциях, во время беременности и родов.
Значение в организме
Регуляция сахара в крови. Предотвращает сахарный диабет, принимая участие в углеводном обмене. Является биохимическим партнером инсулина, осуществляет транспортировку сахара из крови в клетки для использования или депонирования, ускоряет окисление глюкозы, стимулирует синтез гликогена.
Профилактика заболеваний сердечно-сосудистой системы, особенно атеросклероза. Уменьшает концентрацию холестерина и частоту атероматозных бляшек. Предотвращает и уменьшает повышенное артериальное давление. Участвует в функциях нуклеиновых кислот. Способствует росту.
Следствия дефицита
Начальные признаки: чувство тревоги, утомление, непереносимость сахара («пограничный диабет»). Диабет (снижение толерантности к глюкозе, повышение концентрации инсулина в крови, глюкозурия, гипергликемия).
Болезни глаз. Заболевания сердечно-сосудистой системы (повышение триглицеридов и холестерина в сыворотке крови, увеличение атеросклеротических бляшек в аорте). Способствует атеросклерозу.
Периферические невропатии. Нарушение нервной деятельности. Снижение оплодотворяющей способности и количества сперматозоидов. Риск развития рака желудка.
Для детей
Задержка роста, утомляемость, угнетение деятельности поджелудочной железы (нарушение толерантности к глюкозе).
Для беременных
Быстрый набор веса, задержка жидкости, повышение артериального давления.
Источники
Пивные дрожжи, картофель с кожурой, орехи, фасоль, перловая крупа, рыбопродукты, устрицы, крабы, моллюски, черный перец, кукурузное масло, проросшая пшеница, телячья печень, мясо, бобы, горох, сыр.
Теги: Здоровье Вода Витамины Книга Иммунитет
Уважаемые читатели!
Спасибо, что читаете наш блог! Получайте самые интересные публикации раз в месяц оформив подписку. Новым покупателям при первом заказе дарим 12 бутылок (2 упаковки) минеральной воды BioVita или питьевой воды Stelmas. Операторы свяжутся с Вами и уточнят детали. Тел. 8 (800) 100-15-15
Тел. 8 (800) 100-15-15
* Акция для Москвы, МО, Санкт-петербурга, ЛО
Спасибо за подписку на нашу рассылку
Неметаллы. Галогены. Хлор, фтор, бром, йод. Протсые вещества
Неметаллы
Йод в кристаллахХлор. Получение в лабораторииЙод в спиртовом растворе (справа), переход йода в органическое соединение (справа) Хлор, бром, йод, собраны в колбы (слева направо) — представители ряда галогеновХлор, собранный в колбыНеметаллы — это простые вещества. К типичным неметаллам относятся газы и жидкости. Неметаллы в отличии от металлов на много хуже проводят электрический ток, существенно отличаются по физико-механическим свойствам и температуре перехода в агрегатные состояния.
Однако, некоторые неметаллы обладают выраженными металлическими свойствами — блеском (например кристаллическая сера, кристаллический йод, углерод и т. д.).
д.).
В таблице Менделеева металлические свойства простых веществ (или химических элементов) уменьшаются слева направо, а неметаллические свойства увеличиваются. По своей природе это можно объяснить изменением (увеличением!) количества электронов на последнем орбитальном уровне (их ещё называют валентными электронами). Чем более выражены неметаллические свойства у химического элемента, тем он «проще» вступает в химические реакции с типичными металлами, восполняя свою последнюю орбиталь недостающими электронами и образуя при этом прочные (с точки зрения химии) химические соединения.
Хлор
Типичными неметаллами являются газы. Они не проявляют при нормальных условиях ни одного сходного с металлами свойства.
Элемент хлор (Сl2). При нормальных условиях хлор — это желтовато–зелёный газ с резким удушливым запахом. Хлор очень ядовит даже при такой малой концентрации как 0,001 мг на 1 дм3 воздуха. Этот газ в 2.5 раза тяжелее воздуха, поэтому всегда будет находится у самой земли в виде желтовато-зелёного тумана.
Этот газ в 2.5 раза тяжелее воздуха, поэтому всегда будет находится у самой земли в виде желтовато-зелёного тумана.
При содержании хлора в воздухе 0,9 мл/л смерть наступает в течение пяти минут. В небольших количествах (человек чувствует хлор уже при концентрации его в воздухе 0,003 мл/л), он сильно раздражает слизистые оболочки дыхательных путей и вызывает кашель.
Хлор напрямую не взаимодействует с кислородом, азотом, углеродом и инертными газами. Окислительные свойства хлора проявляются в реакциях с простыми веществами (металлическим натрием Na, железом Fe, фосфором P, серой S) и некоторыми сложными веществами.
Хлор содержится в земной коре по массе 0,017%. В некоторых горных районах он покрывает основание грунта и потому приводит к гибели насекомых, мелких грызунов и микроорганизмов. Температура кипения хлора равна (- 33,6 °С), а температура плавления (-100,98 °С).
Хлор относится к ряду галогенов (фтор F2, хлор Cl2, бром Br2, йод I2, астат At2 ), что придаёт ему некоторые особенности в химических реакциях. В реакциях с другими галогенами он вытесняет любой из галогенов, стоящих после него (бром, йод и астат).
В реакциях с другими галогенами он вытесняет любой из галогенов, стоящих после него (бром, йод и астат).
Газообразный хлор отлично растворяется в холодной воде, 1 объём воды растворяет около 2 объёмов хлора с образованием двух кислот: соляной кислоты (HCl) и хлорноватистой (HClO), последняя не стойкая и распадается на атомарный кислород и соляную кислоту. Полученная кислота является одной из сильных кислот.
Хлор имеет прекрасное дезенфицирующее свойство. Он уничтожает практически все живые организмы в сфере своего влияния, что делает его полезным в медицине и домашнем хозяйстве (порошки, хлорка – то же хлорная вода, соды с содержанием хлора). Сухой хлор такой способности не имеет. Раствор хлора в воде носит название «хлорной воды» которая имеет прекрасное свойство отбеливания материалов (тканей, дерева, бумаги и т.д.). Раствор хлора «уничтожает» краску на одежде, поэтому если не хотите, чтобы ваша кофточка или рубашка покрылась белыми пятнами — не используйте такую воду при стирке цветного белья. Достаточно просто поместить влажную крашенную ткань в струю хлора, как вскоре она потеряет свой цвет и превратится в чисто-белую.
Достаточно просто поместить влажную крашенную ткань в струю хлора, как вскоре она потеряет свой цвет и превратится в чисто-белую.
Как хлорная вода влияет на волосы при купании например в бассейне (можно ознакомиться на странице Состав шампуня).
Получение хлора
Хлор — ядовитый газ, тяжелее воздуха, поэтому при реакции будет скапливаться на дне колбы
Для проведения химической реакции нам понадобится перманганат калия (марганцовка) и соляная кислота.
В одну колбу насыпьте немного перманагната калия, присоедините к этой колбе трубку для отвода хлора, который выделится при реакции с марганцовки с соляной кислотой. Другой конец трубки опустите в пустую колбу (её желательно накрыть крышкой (чтобы случайно не вдохнуть!). Желательна такая конструкция, как на картинке слева. Если всё готово, приступим:
Прилейте соляную кислоту к марганцовке. Наблюдайте выделение жёлто-зелёного газа — это хлор. Реакция протекает следующим образом:
Реакция протекает следующим образом:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O
Вещества, которые образуются при реакции (кроме хлора) — 2 соли — хлорид калия KCl и хлорид марганца MnCl2, а также вода.
Фтор
Фтор, собранный в трубкеФторF2 — ярко-жёлтый газ, с оранжевым оттенком (t пл -220 °С, t кип -188°С).
По поводу истинного цвета фтора возникало немало разногласий: из-за необычайно высокой реакционной способности редко кто осмеливался получать этот газ в достаточном количестве в прозрачном сосуде. Но последующие исследования подтвердили окраску фтора.
Фтор взаимодействует почти со всеми простыми веществами, включая тяжёлые инертные газы (Кr (криптон), Хе (ксенон)). Фтор, как и хлор, относится к ряду галогенов.
Бром
Бром Br2 — легколетучая жидкость тёмно-красного цвета (t пл -7 °С, t кип + 59 °С), растворимая в воде (при 20 °С растворяется 3,6 г бром (Вr2) в 100 мл воды) и органических растворителях. Пары брома сильно ядовиты. Ожоги бромом очень болезненны и долго не заживают. Если бром или бромная вода попала на кожу, надо немедленно промыть место ожога большим количеством воды, а затем раствором соды, которая нейтрализует бром.
Пары брома сильно ядовиты. Ожоги бромом очень болезненны и долго не заживают. Если бром или бромная вода попала на кожу, надо немедленно промыть место ожога большим количеством воды, а затем раствором соды, которая нейтрализует бром.
Йод
Йод в кристаллахЙод (I2) (tпл=114 °С, tкип=185 °С) хорошо знаком каждому с детства: 5-процентный водно-спиртовой раствор йода используют для дезинфекции ран и порезов. Если вылить раствор йода в фарфоровую чашечку и оставить на несколько часов, то спирт испарится и выделится кристаллический йод в виде серых кристаллов с металлическим блеском, хорошо растворимых в органических растворителях. При небольшом нагревании кристаллический йод возгоняется, образуя пары фиолетового цвета.
Как и хлор, фтор, бром, йод — тоже принадлежит к семейству галогенов. В обычном состоянии йод — тёмно–серые кристаллы с металлическим блеском. В таком виде его можно расплавить, нагрев до температуры 133,5°С.
В таком виде его можно расплавить, нагрев до температуры 133,5°С.
Кристаллический йод в воде не растворяется, а в спирте растворяется хорошо. Спиртовой раствор йода имеет бурый цвет (он продаётся в аптеке в виде 5-10% раствора йода). Пары йода имеют тёмно-фиолетовый окрас.
Йод – прекрасное профилактическое средство против излучения. Его добавление к пище способствует укреплению щитовидной железы, которая больше всего подвержена радиоактивному влиянию. Для усвоения йода организмом в пищу используют йодированную соль (KI – йодид калия). Эту соль в виде добавок к пищевой соли (NaCl) можно приобрести в продуктовых магазинах.
Любопытно то, что реакционная способность йода в «разноцветных» растворах (фиолетовый и коричневый) — неодинакова. Так, в коричневых растворах йод намного активнее, чем в фиолетовых, например быстрее реагирует с медью. Это объясняется тем, что молекулы йода могут взаимодействовать с молекулами растворителя, образуя комплексы, в которых йод более активен. Именно растворитель играет решающую роль в проявлении активности йода!
Именно растворитель играет решающую роль в проявлении активности йода!
При добавлении растительного масла к раствору йода можно наблюдать переход йода из водной фазы в органическую (экстракцию). Процесс экстракции заметно ускорится, если смесь энергично встряхивать.
Кое-что о пользе йода:
Йод — один из очень важных элементов для организма человека. Нормальная доза для потребления его человеком исчисляется в микрограммах, но его отсутствие в организме — опасно для жизни человека. Йод принимает участие в синтезе гормонов щитовидной железы, которые в свою очередь отвечают за нормальный рост и развитие человеческого организма; йод очень необходим для правильной работы мозга!
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
 Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Фтор и хлора в щелочных породах и гранитах типа А Эби, Г.Н. и Чарнли, Н. Роль галогенов, особенно фтора, в
Петрогенезис гранитов А-типа и связанных с ними пород был предметом изучения.
продолжающееся обсуждение в петрологической литературе. Определение
Содержание галогенов в магме представляет собой серьезную проблему. Целая порода F и Cl
концентрации, даже для мелкозернистых пород, могут не отражать концентрации галогенов.
содержание магмы.Включения расплава, если они доступны, могут давать галоген.
содержание магмы в определенный момент ее эволюции. Галогенсодержащий
минералы, прежде всего биотит и апатит, использовались для оценки HF
и фугитивность HCl (в случае биотита) или непосредственно расплав F и Cl
концентрации (с использованием апатита). Определение F и Cl в
минералы. В минералах F и Cl обычно определяют с помощью электронного микрозонда (ЭМИ).
В частности, в случае F такие определения далеки от рутинных. У нас есть
исследовали аналитические переменные и пришли к следующему
выводы: (1) F и Cl следует определять с помощью расфокусированного луча (от 5 до 10 м)
и низкий ускоряющий потенциал, (2) стандартизацию следует проводить на
F-содержащий минерал, не чувствительный к времени счета (мы используем флюорит),
(3) F и Cl следует определять в начале аналитической последовательности, (4)
рассчитанные значения чувствительны к процедуре коррекции, используемой для уменьшения
данные ZAF против PAP против и т. д.и (5) F-стандарт должен чередоваться с
неизвестных для измерения изменчивости определения F. Оценка расплава F и Cl
концентрации из минеральной химии. По результатам экспериментов,
Муньос (1984, 1992) опубликовал набор уравнений, которые можно использовать для оценки
летучесть паров и расплавов HF и HCl, сосуществующих с биотитом.ВЧ и
Фугитивность HCl можно преобразовать в концентрации с помощью алгоритмов
Пикколи и Кандела (1994). Айценхауэр и Лондон (1997) экспериментально
определили коэффициенты распределения F и Cl для равновесий биотит/расплав от 640 до
680 o C. Модели Муньоса (1992 г.) и Айсенхауэра и Лондона (1997 г.) дают
аналогичные результаты для биотитов с мг# = от 60 до 20. Для мг#с <20
значительное расхождение между значениями F, рассчитанными по двум моделям. Ф
Алгоритм Icenhower and London (1997) не был откалиброван для мг#с <20 и
эту модель не следует использовать для биотитов с мг#с <20. В настоящее время не существует модели распределения F и Cl между амфиболом и расплавом.Мы разработали эмпирическую модель для F разделение между амфиболом и расплавом. Растопить F концентрации оцениваются с использованием измеренных концентраций F в апатите сосуществует с амфиболом. На основании этих измерений мы предполагаем, что следующие (предварительные) уравнения могут быть использованы для оценки концентрации F расплава. Расчет выполнен для амфибол-апатита пары, которые, как предполагается, сокристаллизовались между 950 и 850 o C. D Famph/Fmelt = 1. Возможный эффект давления неизвестен. Щелочная провинция Чилва. Щелочная провинция Чилва расположена в Малави, недалеко от южной оконечности современная восточноафриканская рифтовая система. Провинция литологически разнообразна и включает карбонатиты, базаниты и нефелиниты, нефелин-содалитовые сиениты, нефелиновые сиениты, сиениты и граниты. Все эти камни были установлены между 130 и 120 млн лет назад и, по-видимому, петрогенетически связаны.То Граниты Chilwa классифицируются как граниты A 1 (Eby, 1992) и были предположительно помещен в анорогенную обстановку. Мы проанализировали апатиты, биотиты и амфиболы из всех типов пород, кроме карбонатита, фонолиты и нефелиниты/базаниты. Концентрации F и Cl во всей породе варьируются. То
нефелиниты/базаниты всегда имеют очень низкое содержание Cl (почти или ниже обнаружения)
и имеют до 0,6 мас.% F. Более развитые силикатные породы показывают диапазон как в
Концентрации F и Cl до 0. Все апатиты являются фторапатитами, а Cl находится на уровне или ниже
предел обнаружения. На сегодняшний день все рассчитанные значения F-расплава попадают в ограниченный
диапазон между 0.248 и 0,303 мас.%. По петрографическим признакам апатит является ранним
кристаллизующийся минерал, встречается в виде включений в полевых шпатах и основных породах.
силикаты. Нет очевидной связи между парагенетической ассоциацией
и содержание F. Мы заключаем, что апатиты записывают содержание F через
большую часть истории затвердевания расплава и мало
изменение F. Практически во всех случаях расчетная концентрация F в расплаве равна
больше, чем содержание F, определенное при анализе всей породы. Несколько иную картину представляют биотиты. Расчетные концентрации F в расплаве составляют от 0,1 до 1,0 мас.%. Почти во всех случаях эти значения превышают измеренные концентрации в породе. Они также обычно больше, чем концентрации расплава F, определенные по апатиту. химия. Биотиты появляются относительно поздно в истории кристаллизации магмы и, таким образом, регистрируют значения F для остаточных расплавов. Расчетный Cl концентрация расплава колеблется от 0.02 до 0,2 мас.%. В большинстве случаев эти значения меньше, чем измеренные концентрации Cl в цельной породе. Это наблюдение приводит к вывод о том, что Cl является поздней, вероятно гидротермальной, добавкой к породе, и что содалит, найденный в некоторых ненасыщенных кремнеземом сиениты имеют гидротермальное происхождение. Всего для этой гранитной провинции типа А,
содержание магматического F находится в пределах от 0,2 до 0,4 мас.%, становясь все более
концентрируется вблизи конечной стадии кристаллизации, а содержание магматического Cl
обычно меньше 0. Сравнение
с Аргентиной A 2 граниты. Далквист и др. (2010) недавно сообщили о химии биотита и рассчитали F и
Концентрации Cl для гранитов типа A 2 из западной Аргентины. Мы
получили дополнительные данные для биотитов из сопутствующих гранитных тел. В
Во всех случаях биотит является основной галогенсодержащей фазой и, по-видимому, имеет
кристаллизуется на большей части интервала затвердевания.Все эти граниты имеют
в основном коровый источник с незначительным поступлением мантийного материала. Для Сан Блас
плутон, содержащий оруденение поздней стадии, расплав F = 0,27-0,54 мас.% и
Cl расплав = от 0,03 до 0,11 мас.%. Для батолита Ахала, связанного с U
минерализация, расплав F = от 0,13 до 0,33 мас.% и расплав Cl = от 0,02 до 0,06 мас.%.
Эти значения находятся в том же диапазоне, что и для гранитов типа А 1 .
щелочной провинции Чилва. По крайней мере, с точки зрения этого ограниченного набора данных,
по-видимому, нет никакой разницы в содержании F и Cl в A 1 и A 2 . Ссылки Далквист, Дж. А., Аласино, П. Х., Эби, Г. Н., Галиндо, К., Каске, К., 2010. Неисправность контролируемый каменноугольный магматизм А-типа на протоандийском форланде (Сьерра Пампеанас, Аргентина): геохимические ограничения и петрогенезис. Литос 115, 65-81. Эби, Г. Н., 1992. Химическое подразделение А-типа. гранитоиды: петрогенетическое и тектоническое значение. Геология 20, 641-644. Айценхауэр,
J., London, D., 1997. Распределение фтора и хлора между биотитом и
гранитный расплав: экспериментальная калибровка при 200 МПа ч3О.Вклады в
Минералогия и петрология 127, 17-29. Муньос, JL, 1984. Обмен F-OH и Cl-OH в слюдах с применением к гидротермальным рудные месторождения. В: Bailey, SW (Ed.) Reviews in Mineralogy, Micas, vol. 13. Минералогическое общество Америки, стр. 469–494. Муньос, J.L., 1992. Расчет летучести HF и HCl по составам биотита: пересмотренные уравнения. Геологическое общество Америки, рефераты с программами 24, А221. Пикколи, П., Кандела П., 1994. Апатит в кислых породах: модель для оценки начальные концентрации галогенов в туфе Бишоп (Длинная долина) и Туолумне интрузивные свиты (батолит Сьерра-Невада) магмы. Американский научный журнал 294, 92-135. Вебстер, JD, Tappen, CM., Mandeville, CW, 2009. Поведение разделения хлор и фтор в системе апатит-расплав-флюид. II: кислый силикат системы на 200 МПа.Geochimica et Cosmochimica Acta 73, 559-581. Красный текст представляет изменения, внесенные в тезисы собрания. Электронный версия бумаги Назад
к публикациям. |
Стандартный метод определения общего содержания фтора, хлора и серы в ароматических углеводородах и их смесях путем окислительного пирогидролизного сжигания с последующим ионно-хроматографическим определением (Combustion Ion Chromatography-CIC)
Лицензионное соглашение ASTM
ВАЖНО — ВНИМАТЕЛЬНО ПРОЧИТАЙТЕ ЭТИ УСЛОВИЯ ПЕРЕД ВХОДОМ В ЭТОТ ПРОДУКТ ASTM.
Приобретая подписку и нажимая на это соглашение, вы вступаете в
контракт, и подтверждаете, что прочитали настоящее Лицензионное соглашение, что вы понимаете
его и соглашаетесь соблюдать его условия. Если вы не согласны с условиями настоящего Лицензионного соглашения,
немедленно покиньте эту страницу, не входя в продукт ASTM.
1.Право собственности:
Этот продукт защищен авторским правом как
компиляции и в виде отдельных стандартов, статей и/или документов («Документы») ASTM
(«ASTM»), 100 Barr Harbour Drive, West Conshohocken, PA 19428-2959 USA, за исключением случаев, когда
прямо указано в тексте отдельных документов. Все права защищены. Ты
(Лицензиат) не имеет прав собственности или иных прав на Продукт ASTM или Документы.Это не продажа; все права, право собственности и интерес к продукту или документам ASTM
(как в электронном, так и в печатном виде) принадлежат ASTM. Вы не можете удалять или скрывать
уведомление об авторских правах или другое уведомление, содержащееся в Продукте или Документах ASTM.
Все права защищены. Ты
(Лицензиат) не имеет прав собственности или иных прав на Продукт ASTM или Документы.Это не продажа; все права, право собственности и интерес к продукту или документам ASTM
(как в электронном, так и в печатном виде) принадлежат ASTM. Вы не можете удалять или скрывать
уведомление об авторских правах или другое уведомление, содержащееся в Продукте или Документах ASTM.
2. Определения.
A. Типы лицензиатов:
(i) Индивидуальный пользователь:
один уникальный компьютер с индивидуальным IP-адресом;
(ii) Одноместный:
одно географическое местоположение или несколько
объекты в пределах одного города, входящие в состав единой организационной единицы, управляемой централизованно;
например, разные кампусы одного и того же университета в одном городе управляются централизованно.
(iii) Multi-Site:
организация или компания с
независимое управление несколькими точками в одном городе; или организация или
компания, расположенная более чем в одном городе, штате или стране, с центральным управлением для всех местоположений.
B. Авторизованные пользователи:
любое лицо, подписавшееся
к этому Продукту; если Site License также включает зарегистрированных студентов, преподавателей или сотрудников,
или сотрудник Лицензиата на Одном или Множественном Сайте.
3. Ограниченная лицензия.
ASTM предоставляет Лицензиату ограниченное,
отзывная, неисключительная, непередаваемая лицензия на доступ посредством одного или нескольких
авторизованные IP-адреса и в соответствии с условиями настоящего Соглашения использовать
разрешенных и описанных ниже, каждого Продукта ASTM, на который Лицензиат подписался.
А.Специальные лицензии:
(i) Индивидуальный пользователь:
(a) право просматривать, искать, извлекать, отображать и просматривать Продукт;
(b) право скачивать, хранить или распечатывать отдельные копии
отдельных Документов или частей таких Документов исключительно для собственного использования Лицензиатом.
То есть Лицензиат может получить доступ к электронному файлу Документа (или его части) и загрузить его.
Документа) для временного хранения на одном компьютере в целях просмотра и/или
печать одной копии документа для личного пользования.Ни электронный файл, ни
единственный печатный отпечаток может быть воспроизведен в любом случае. Кроме того, электронный
файл не может распространяться где-либо еще по компьютерным сетям или иным образом. Это
электронный файл нельзя отправить по электронной почте, загрузить на диск, скопировать на другой жесткий диск или
в противном случае разделены. Одна печатная копия может быть распространена среди других только для их
внутреннее использование в вашей организации; его нельзя копировать.Индивидуальный загруженный документ
иным образом не может быть продана или перепродана, сдана в аренду, сдана в аренду, одолжена или сублицензирована.
Это
электронный файл нельзя отправить по электронной почте, загрузить на диск, скопировать на другой жесткий диск или
в противном случае разделены. Одна печатная копия может быть распространена среди других только для их
внутреннее использование в вашей организации; его нельзя копировать.Индивидуальный загруженный документ
иным образом не может быть продана или перепродана, сдана в аренду, сдана в аренду, одолжена или сублицензирована.
(ii) Односайтовые и многосайтовые лицензии:
(a) право просматривать, искать, извлекать, отображать и просматривать Продукт;
(b) право скачивать, хранить или распечатывать отдельные копии
отдельных Документов или частей таких Документов для личных целей Авторизованного пользователя. использовать и передавать такие копии другим Авторизованным пользователям Лицензиата в компьютерной сети Лицензиата;
использовать и передавать такие копии другим Авторизованным пользователям Лицензиата в компьютерной сети Лицензиата;
(c) если образовательное учреждение, Лицензиату разрешается предоставлять печатная копия отдельных Документов отдельным учащимся (Авторизованные пользователи) в классе по месту нахождения Лицензиата;
(d) право отображать, загружать и распространять печатные копии Документов для обучения Авторизованных пользователей или групп Авторизованных пользователей.
(e) Лицензиат проведет всю необходимую аутентификацию и процессы проверки, чтобы гарантировать, что только авторизованные пользователи могут получить доступ к продукту ASTM.
(f) Лицензиат предоставит ASTM список авторизованных
IP-адреса (числовые IP-адреса домена) и, если многосайтовый, список авторизованных сайтов.
Б.Запрещенное использование.
(i) Настоящая Лицензия описывает все разрешенные виды использования. Любой другой использование запрещено, является нарушением настоящего Соглашения и может привести к немедленному прекращению действия настоящей Лицензии.
(ii) Авторизованный пользователь не может производить этот Продукт, или Документы, доступные любому, кроме другого Авторизованного Пользователя, будь то по интернет-ссылке, или разрешив доступ через его или ее терминал или компьютер; или другими подобными или отличными средствами или договоренностями.
(iii) В частности, никто не имеет права передавать, копировать,
или распространять любой Документ любым способом и с любой целью, за исключением случаев, описанных в Разделе
3 настоящей Лицензии без предварительного письменного разрешения ASTM.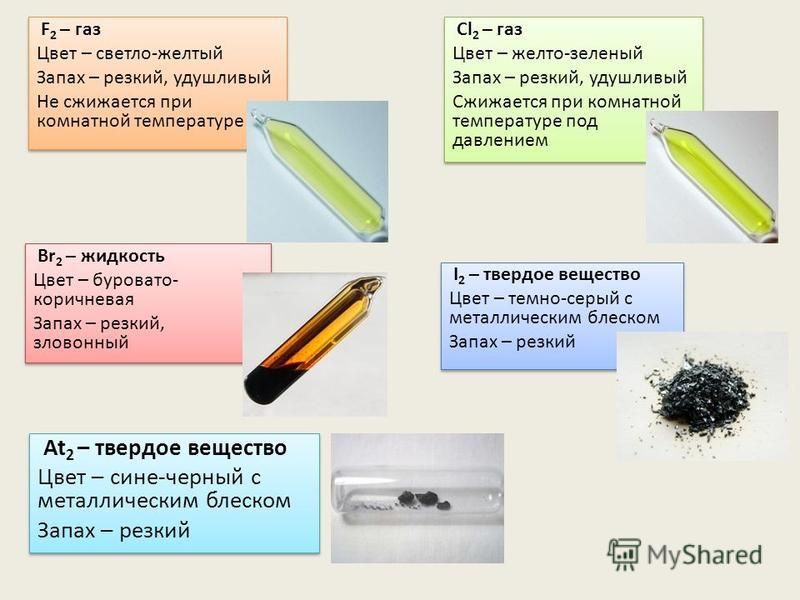 Особенно,
за исключением случаев, описанных в Разделе 3, никто не может без предварительного письменного разрешения
ASTM: (a) распространять или пересылать копию (электронную или иную) любой статьи, файла,
или материал, полученный из любого продукта или документа ASTM; (b) воспроизводить или фотокопировать любые
стандарт, статья, файл или материал из любого продукта ASTM; в) изменять, видоизменять, приспосабливать,
или переводить любой стандарт, статью, файл или материал, полученный из любого продукта ASTM;
(d) включать любой стандарт, статью, файл или материал, полученный из любого продукта ASTM или
Документировать в других произведениях или иным образом создавать любые производные работы на основе любых материалов.
получено из любого продукта или документа ASTM; (e) взимать плату за копию (электронную или
иным образом) любого стандарта, статьи, файла или материала, полученного из любого продукта ASTM или
Документ, за исключением обычных расходов на печать/копирование, если такое воспроизведение разрешено
по разделу 3; или (f) систематически загружать, архивировать или централизованно хранить существенные
части стандартов, статей, файлов или материалов, полученных из любого продукта ASTM или
Документ.
Особенно,
за исключением случаев, описанных в Разделе 3, никто не может без предварительного письменного разрешения
ASTM: (a) распространять или пересылать копию (электронную или иную) любой статьи, файла,
или материал, полученный из любого продукта или документа ASTM; (b) воспроизводить или фотокопировать любые
стандарт, статья, файл или материал из любого продукта ASTM; в) изменять, видоизменять, приспосабливать,
или переводить любой стандарт, статью, файл или материал, полученный из любого продукта ASTM;
(d) включать любой стандарт, статью, файл или материал, полученный из любого продукта ASTM или
Документировать в других произведениях или иным образом создавать любые производные работы на основе любых материалов.
получено из любого продукта или документа ASTM; (e) взимать плату за копию (электронную или
иным образом) любого стандарта, статьи, файла или материала, полученного из любого продукта ASTM или
Документ, за исключением обычных расходов на печать/копирование, если такое воспроизведение разрешено
по разделу 3; или (f) систематически загружать, архивировать или централизованно хранить существенные
части стандартов, статей, файлов или материалов, полученных из любого продукта ASTM или
Документ. Включение печатных или электронных копий в пакеты курсов или электронные резервы,
или для использования в дистанционном обучении, не разрешено настоящей Лицензией и запрещено без
Предварительное письменное разрешение ASTM.
Включение печатных или электронных копий в пакеты курсов или электронные резервы,
или для использования в дистанционном обучении, не разрешено настоящей Лицензией и запрещено без
Предварительное письменное разрешение ASTM.
(iv) Лицензиат не может использовать Продукт или доступ к Продукт в коммерческих целях, включая, помимо прочего, продажу Документов, материалы, платное использование Продукта или массовое воспроизведение или распространение Документов в любой форме; а также Лицензиат не может взимать с Авторизованных пользователей специальные сборы за использование Продукт сверх разумных расходов на печать или административные расходы.
C. Уведомление об авторских правах . Все копии материала из ASTM
Продукт должен иметь надлежащее уведомление об авторских правах от имени ASTM, как показано на начальной странице. каждого стандарта, статьи, файла или материала. Сокрытие, удаление или изменение
уведомление об авторских правах не допускается.
каждого стандарта, статьи, файла или материала. Сокрытие, удаление или изменение
уведомление об авторских правах не допускается.
4. Обнаружение запрещенного использования.
A. Лицензиат несет ответственность за принятие разумных мер для предотвращения запрещенного использования и незамедлительного уведомления ASTM о любых нарушениях авторских прав или запрещенное использование, о котором Лицензиату стало известно. Лицензиат будет сотрудничать с ASTM при расследовании любого такого запрещенного использования и предпримет разумные шаги для обеспечения прекращение такой деятельности и предотвращение ее повторения.
B. Лицензиат должен прилагать все разумные усилия для защиты
Продукт от любого использования, не разрешенного настоящим Соглашением, и уведомляет
ASTM о любом использовании, о котором стало известно или о котором было сообщено.
5. Постоянный доступ к продукту.
ASTM резервирует
право прекратить действие настоящей Лицензии после письменного уведомления, если Лицензиат существенно нарушит
условия настоящего Соглашения.Если Лицензиат не оплачивает ASTM какую-либо лицензию или
абонентской платы в установленный срок, ASTM предоставит Лицензиату 30-дневный период в течение
что бы вылечить такое нарушение. Для существенных нарушений период устранения не предоставляется
связанные с нарушениями Раздела 3 или любыми другими нарушениями, которые могут привести к непоправимым последствиям ASTM.
вред. Если подписка Лицензиата на Продукт ASTM прекращается, дальнейший доступ к
онлайн-база данных будет отклонена.Если Лицензиат или Авторизованные пользователи существенно нарушают
настоящую Лицензию или запрещать использование материалов в любом продукте ASTM, ASTM оставляет за собой право
право отказать Лицензиату в любом доступе к Продукту ASTM по собственному усмотрению ASTM.
6. Форматы доставки и услуги.
A. Некоторые продукты ASTM используют стандартный интернет-формат HTML. ASTM оставляет за собой право изменить такой формат с уведомлением Лицензиата за три [3] месяца, хотя ASTM приложит разумные усилия для использования общедоступных форматов. Лицензиат и Авторизованные пользователи несут ответственность за получение за свой счет подходящие подключения к Интернету, веб-браузеры и лицензии на любое необходимое программное обеспечение для просмотра продуктов ASTM.
B. Продукты ASTM также доступны в Adobe Acrobat
(PDF) Лицензиату и его Авторизованным пользователям, которые несут единоличную ответственность за установку
и настройка соответствующего программного обеспечения Adobe Acrobat Reader.
C. ASTM приложит разумные усилия для обеспечения онлайн-доступа
доступны на постоянной основе. Доступность будет зависеть от периодического
перерывы и простои для обслуживания сервера, установки или тестирования программного обеспечения,
загрузка новых файлов и причины, не зависящие от ASTM. ASTM не гарантирует доступ,
и не несет ответственности за ущерб или возврат средств, если Продукт временно недоступен,
или если доступ становится медленным или неполным из-за процедур резервного копирования системы,
объем трафика, апгрейды, перегрузка запросов к серверам, общие сбои сети
или задержки, или любая другая причина, которая может время от времени делать продукт недоступным
для Лицензиата или Авторизованных пользователей Лицензиата.
7. Условия и стоимость.
A. Срок действия настоящего Соглашения _____________ («Период подписки»). Доступ к Продукту предоставляется только на Период Подписки. Настоящее Соглашение останется в силе после этого для последовательных Периодов подписки при условии, что ежегодная абонентская плата, как таковая, может меняются время от времени, оплачиваются.Лицензиат и/или ASTM имеют право расторгнуть настоящее Соглашение. в конце Периода подписки путем письменного уведомления, направленного не менее чем за 30 дней.
B. Сборы:
8. Проверка.
ASTM имеет право проверять соответствие
с настоящим Соглашением, за свой счет и в любое время в ходе обычной деятельности
часы. Для этого ASTM привлечет независимого консультанта при соблюдении конфиденциальности.
соглашение, для проверки использования Лицензиатом Продукта и/или Документов ASTM. Лицензиат соглашается
разрешить доступ к своей информации и компьютерным системам для этой цели. Проверка
состоится после уведомления не менее чем за 15 дней, в обычные рабочие часы и в
таким образом, чтобы не создавать необоснованного вмешательства в деятельность Лицензиата.Если
проверка выявляет нелицензионное или запрещенное использование продуктов или документов ASTM,
Лицензиат соглашается возместить ASTM расходы, понесенные при проверке и возмещении
ASTM для любого нелицензированного/запрещенного использования. Применяя эту процедуру, ASTM не отказывается от
любое из своих прав на обеспечение соблюдения настоящего Соглашения или на защиту своей интеллектуальной собственности путем
любым другим способом, разрешенным законом.
Для этого ASTM привлечет независимого консультанта при соблюдении конфиденциальности.
соглашение, для проверки использования Лицензиатом Продукта и/или Документов ASTM. Лицензиат соглашается
разрешить доступ к своей информации и компьютерным системам для этой цели. Проверка
состоится после уведомления не менее чем за 15 дней, в обычные рабочие часы и в
таким образом, чтобы не создавать необоснованного вмешательства в деятельность Лицензиата.Если
проверка выявляет нелицензионное или запрещенное использование продуктов или документов ASTM,
Лицензиат соглашается возместить ASTM расходы, понесенные при проверке и возмещении
ASTM для любого нелицензированного/запрещенного использования. Применяя эту процедуру, ASTM не отказывается от
любое из своих прав на обеспечение соблюдения настоящего Соглашения или на защиту своей интеллектуальной собственности путем
любым другим способом, разрешенным законом. Лицензиат признает и соглашается с тем, что ASTM может внедрять
определенная идентифицирующая или отслеживающая информация в продуктах ASTM, доступных на Портале.
Лицензиат признает и соглашается с тем, что ASTM может внедрять
определенная идентифицирующая или отслеживающая информация в продуктах ASTM, доступных на Портале.
9. Пароли:
Лицензиат должен немедленно уведомить ASTM
о любом известном или предполагаемом несанкционированном использовании(ях) своего пароля(ей) или о любом известном или предполагаемом
нарушение безопасности, включая утерю, кражу, несанкционированное раскрытие такого пароля
или любой несанкционированный доступ или использование Продукта ASTM.Лицензиат несет исключительную ответственность
для сохранения конфиденциальности своего пароля (паролей) и для обеспечения авторизованного
доступ и использование Продукта ASTM. Личные учетные записи/пароли не могут быть переданы.
10. Отказ от гарантии:
Отказ от гарантии:
Если не указано иное в настоящем Соглашении,
все явные или подразумеваемые условия, заверения и гарантии, включая любые подразумеваемые
гарантия товарного состояния, пригодности для определенной цели или ненарушения прав
отказываются от ответственности, за исключением случаев, когда такие отказы признаются юридически недействительными.
11. Ограничение ответственности:
В пределах, не запрещенных законом,
ни при каких обстоятельствах ASTM не несет ответственности за любые потери, повреждения, потерю данных или за особые, косвенные,
косвенные или штрафные убытки, независимо от теории ответственности,
возникающие в результате или в связи с использованием продукта ASTM или загрузкой документов ASTM.
Ни при каких обстоятельствах ответственность ASTM не будет превышать сумму, уплаченную Лицензиатом по настоящему Лицензионному соглашению.
12. Общие.
A. Прекращение действия:
Настоящее Соглашение действует до
прекращено. Лицензиат может расторгнуть настоящее Соглашение в любое время, уничтожив все копии
(на бумажном, цифровом или любом носителе) Документов ASTM и прекращении любого доступа к Продукту ASTM.
B. Применимое право, место проведения и юрисдикция:
Это
Соглашение должно толковаться и толковаться в соответствии с законодательством
Содружество Пенсильвании.Лицензиат соглашается подчиняться юрисдикции и месту проведения
в суды штата и федеральные суды Пенсильвании по любому спору, который может возникнуть в соответствии с настоящим
Соглашение. Лицензиат также соглашается отказаться от любых претензий на неприкосновенность, которыми он может обладать.
C. Интеграция:
Настоящее Соглашение представляет собой полное соглашение
между Лицензиатом и ASTM в отношении его предмета. Он заменяет все предыдущие или
одновременные устные или письменные сообщения, предложения, заверения и гарантии
и имеет преимущественную силу над любыми противоречащими или дополнительными условиями любой цитаты, заказа, подтверждения,
или другое сообщение между сторонами, относящееся к его предмету в течение срока действия
настоящего Соглашения.Никакие изменения настоящего Соглашения не будут иметь обязательной силы, если они не будут в письменной форме
и подписан уполномоченным представителем каждой стороны.
D. Назначение:
Лицензиат не может назначать или передавать
свои права по настоящему Соглашению без предварительного письменного разрешения ASTM.
E. Налоги.
Лицензиат должен платить все применимые налоги,
за исключением налогов на чистый доход ASTM, возникающий в результате использования Лицензиатом Продукта ASTM.
и/или права, предоставленные по настоящему Соглашению.
Влияние замещения хлором и фтором на настройку потенциала ионизации комплексов дирутения (ii, ii) с бензоатным мостиком
В виде аддуктов тетрагидрофурана (ТГФ) синтезирован ряд лопастных комплексов дирутения ( II , II ) с различными хлорзамещенными бензоатными лигандами (Cl-ряд) [Ru 2 (Cl 4 PhCO 2 ) 4 (ТГФ) 2 ]; где Cl x PhCO 2 − = o -хлорбензоат, o; м -хлорбензоат, м -Cl ; p -хлорбензоат, p -Cl ; 2,3-дихлорбензоат, 2,3-Cl 2 ; 2,4-дихлорбензоат, 2,4-Cl 2 ; 2,5-дихлорбензоат, 2,5-Cl 2 ; 2,6-дихлорбензоат, 2,6-Cl 2 ; 3,4-дихлорбензоат, 3,4-Cl 2 ; 3,5-дихлорбензоат, 3,5-Cl 2 ; 2,3,4-трихлорбензоат, 2,3,4-Cl 3 ; 2,3,5-трихлорбензоат, 2,3,5-Cl 3 ; 2,4,5-трихлорбензоат, 2,4,5-Cl 3 ; 3,4,5-трихлорбензоат, 3,4,5-Cl 3 ; 2,3,4,5-тетрахлорбензоат, 2,3,4,5-Cl 4 . Эта CL-серия и ранее синтезированные F-серии вместе с четырьмя новыми производными замещенными фторменами, [RU 2
Эта CL-серия и ранее синтезированные F-серии вместе с четырьмя новыми производными замещенными фторменами, [RU 2 x
4 x
PHCO 2 ) 4 (THF ) 2 2 ] (где f x



 Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором. Здесь мы сообщаем о предварительных результатах
продолжающееся изучение содержания галогенов в магмах с использованием содержания F и Cl в
биотита, апатита и амфибола для оценки содержания F и Cl в
сосуществующий расплав.
Здесь мы сообщаем о предварительных результатах
продолжающееся изучение содержания галогенов в магмах с использованием содержания F и Cl в
биотита, апатита и амфибола для оценки содержания F и Cl в
сосуществующий расплав. Для измерений
сделанные на одном и том же ЭМИ, разумная аналитическая ошибка для F составляет +/- 10% относительной
и для Cl +/- 5% относительно при концентрациях на несколько стандартных отклонений выше
предел обнаружения.
Для измерений
сделанные на одном и том же ЭМИ, разумная аналитическая ошибка для F составляет +/- 10% относительной
и для Cl +/- 5% относительно при концентрациях на несколько стандартных отклонений выше
предел обнаружения. Чтобы иметь
последовательные результаты, в наших исследованиях мы использовали модель Munoz (1984,
1992). Для Cl обе модели дают аналогичные результаты. В случае F
расчеты чувствительны к температуре и независимой температуре
требуется смета. Расчет Cl чувствителен к
как температуры, так и давления. Для апатита мы используем самые последние результаты
Вебстера и др. (2009).
Чтобы иметь
последовательные результаты, в наших исследованиях мы использовали модель Munoz (1984,
1992). Для Cl обе модели дают аналогичные результаты. В случае F
расчеты чувствительны к температуре и независимой температуре
требуется смета. Расчет Cl чувствителен к
как температуры, так и давления. Для апатита мы используем самые последние результаты
Вебстера и др. (2009). 03 + 0,06*мг#
03 + 0,06*мг#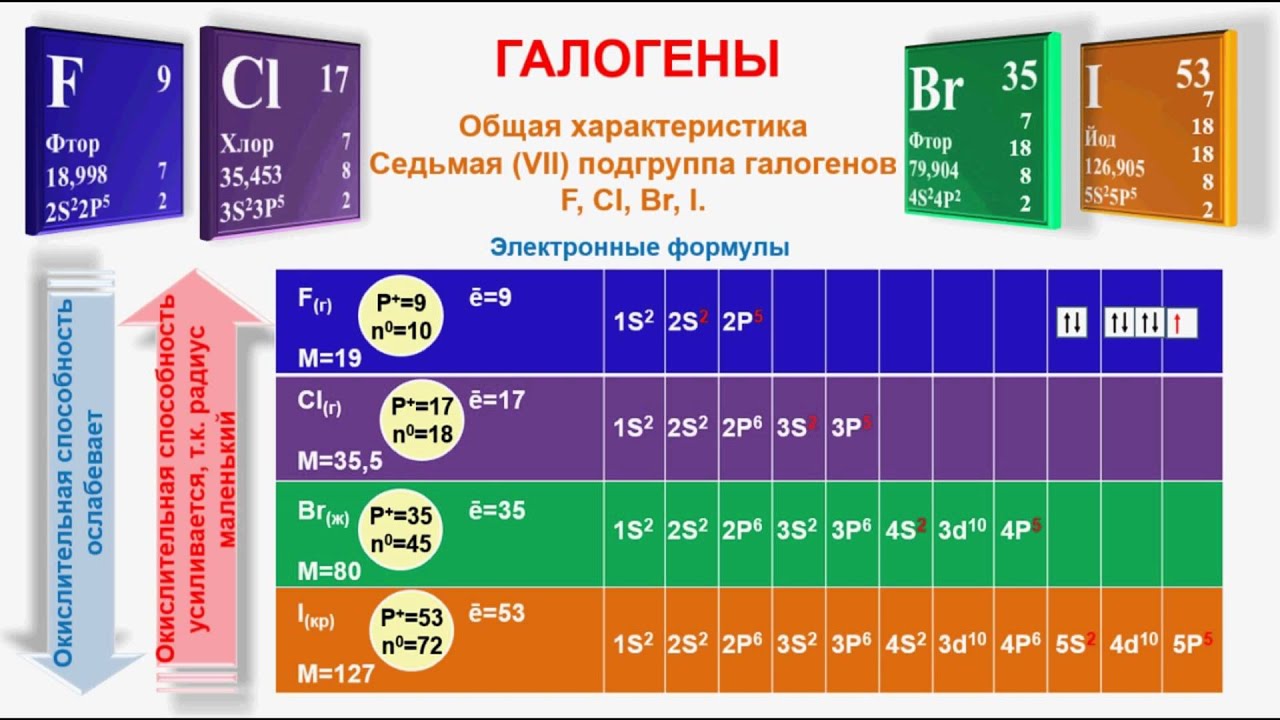 8 мас.% F и 0,7 мас.% Cl. Отношение Cl/F >1
обнаружены для ряда недонасыщенных кремнеземом кислых пород (и некоторых
они содержат содалит). Для сиенитов и гранитов отношения F/Cl равны
обычно меньше 1. В гранитах и сиенитах F колеблется в пределах
0,1 и 0,4 мас.%, а Cl в цельной породе обычно менее 0,1 мас.%.
8 мас.% F и 0,7 мас.% Cl. Отношение Cl/F >1
обнаружены для ряда недонасыщенных кремнеземом кислых пород (и некоторых
они содержат содалит). Для сиенитов и гранитов отношения F/Cl равны
обычно меньше 1. В гранитах и сиенитах F колеблется в пределах
0,1 и 0,4 мас.%, а Cl в цельной породе обычно менее 0,1 мас.%.
 1 мас.%.
1 мас.%. граниты.Это наблюдение действительно ставит под сомнение одно из предполагаемых
характеристики гранитов А-типа, полученные из земной коры, т. е. высокое содержание F.
Далквист и др. (2010) сообщают, что другие граниты (не А-типа) в том же
провинции имеют более низкое содержание F. Таким образом, по крайней мере, на областном уровне
Различие между гранитами типа А и гранитами типа А.
граниты.Это наблюдение действительно ставит под сомнение одно из предполагаемых
характеристики гранитов А-типа, полученные из земной коры, т. е. высокое содержание F.
Далквист и др. (2010) сообщают, что другие граниты (не А-типа) в том же
провинции имеют более низкое содержание F. Таким образом, по крайней мере, на областном уровне
Различие между гранитами типа А и гранитами типа А.

 Ag/Ag + ). Это зависело от (i) количества орто- -заместителей, i.е. не-, моно- и ди- o замещенных групп с квази-гамметовскими параметрами для орто- замещений -Cl и -F ( σ o = -0,217 и -0,272 соответственно ) и (ii) общие константы Гаммета, σ m и σ p для каждой группы. Энергетический уровень ВЗМО, рассчитанный на основе координат атомов твердотельной структуры, сильно зависит от Cl- и F-замещений, а также окислительно-восстановительного потенциала в растворе, что подчеркивает стерический вклад орто- -заместителей в уровень энергии дает отклонение E HOMO < 0.3 эВ и <0,55 эВ для Cl- и F-серий соответственно.
Ag/Ag + ). Это зависело от (i) количества орто- -заместителей, i.е. не-, моно- и ди- o замещенных групп с квази-гамметовскими параметрами для орто- замещений -Cl и -F ( σ o = -0,217 и -0,272 соответственно ) и (ii) общие константы Гаммета, σ m и σ p для каждой группы. Энергетический уровень ВЗМО, рассчитанный на основе координат атомов твердотельной структуры, сильно зависит от Cl- и F-замещений, а также окислительно-восстановительного потенциала в растворе, что подчеркивает стерический вклад орто- -заместителей в уровень энергии дает отклонение E HOMO < 0.3 эВ и <0,55 эВ для Cl- и F-серий соответственно.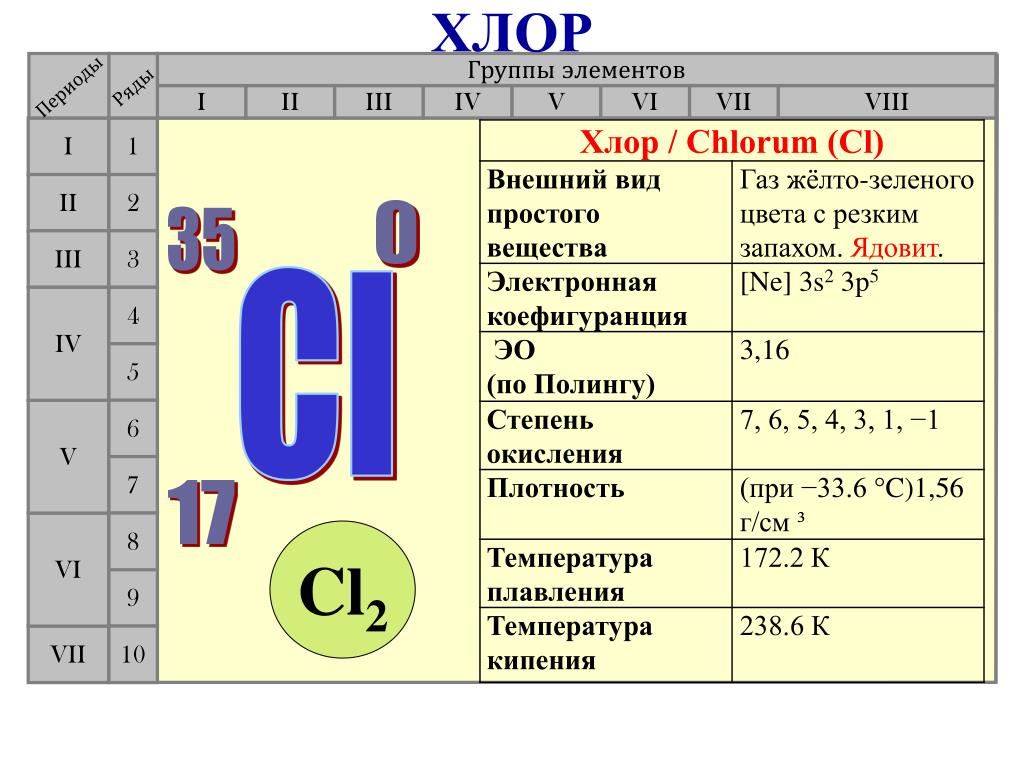 исследователи, которые хотят удалить хлор, фтор и другие отрицательно заряженные ионы из своих растворов.
исследователи, которые хотят удалить хлор, фтор и другие отрицательно заряженные ионы из своих растворов.
 Это не просто побочный продукт клик-химии. Мы видим в нем большой потенциал».
Это не просто побочный продукт клик-химии. Мы видим в нем большой потенциал». Как видно из таблицы \(\PageIndex{1}\), хлорида значительно больше, чем фтора. Кроме того, хотя хлор является электроотрицательным элементом, его электроотрицательность значительно меньше, чем у фтора, что приводит к менее полярной связи.
Как видно из таблицы \(\PageIndex{1}\), хлорида значительно больше, чем фтора. Кроме того, хотя хлор является электроотрицательным элементом, его электроотрицательность значительно меньше, чем у фтора, что приводит к менее полярной связи. 1
1 Хлорид также действует как мостиковый лиганд, в котором один, два или три хлорида могут соединять два металлических центра (рис. \(\PageIndex{1}\)).
Хлорид также действует как мостиковый лиганд, в котором один, два или три хлорида могут соединять два металлических центра (рис. \(\PageIndex{1}\)). В простой картине можно представить, что неподеленная пара концевого галогенида действует как лиганд-донор основания Льюиса для второго кислотного металлического центра Льюиса. Действительно, некоторые мостиковые галогениды асимметричны, что согласуется с этой точкой зрения; однако симметричные могут быть описаны резонансной формой.С точки зрения молекулярных орбиталей мостиковый галогенид представлен комбинацией двух центрированных металлических орбиталей с двумя галогенными орбиталями.
В простой картине можно представить, что неподеленная пара концевого галогенида действует как лиганд-донор основания Льюиса для второго кислотного металлического центра Льюиса. Действительно, некоторые мостиковые галогениды асимметричны, что согласуется с этой точкой зрения; однако симметричные могут быть описаны резонансной формой.С точки зрения молекулярных орбиталей мостиковый галогенид представлен комбинацией двух центрированных металлических орбиталей с двумя галогенными орбиталями. Физические свойства оксидов приведены в таблице \(\PageIndex{2}\). В то время как оксиды хлора не очень стабильны (на самом деле некоторые из них чувствительны к ударам и склонны к взрыву), сопряженные оксикислоты стабильны.
Физические свойства оксидов приведены в таблице \(\PageIndex{2}\). В то время как оксиды хлора не очень стабильны (на самом деле некоторые из них чувствительны к ударам и склонны к взрыву), сопряженные оксикислоты стабильны. 5
5 Лучший синтез ClO 2 включает восстановление хлората калия (KClO 3 ) щавелевой кислотой при 90 ° C, поскольку образующийся CO 2 действует как разбавитель для взрывоопасного ClO 2 .В промышленных масштабах ClO 2 получают экзотермической реакцией хлората натрия с SO 2 в серной кислоте (10.3.6). Фотолиз ClO 2 дает темно-коричневое твердое вещество с формулой Cl 2 O 3 ; однако его легкое взрывное разложение препятствует изучению.
Лучший синтез ClO 2 включает восстановление хлората калия (KClO 3 ) щавелевой кислотой при 90 ° C, поскольку образующийся CO 2 действует как разбавитель для взрывоопасного ClO 2 .В промышленных масштабах ClO 2 получают экзотермической реакцией хлората натрия с SO 2 в серной кислоте (10.3.6). Фотолиз ClO 2 дает темно-коричневое твердое вещество с формулой Cl 2 O 3 ; однако его легкое взрывное разложение препятствует изучению. \(\PageIndex{4}\)c). Гексаоксид дихлора (Cl 2 O 6 ) представляет собой нестабильное красное масло, имеющее в твердом состоянии ионную структуру: [ClO 2 ] + [ClO 4 ] — .
\(\PageIndex{4}\)c). Гексаоксид дихлора (Cl 2 O 6 ) представляет собой нестабильное красное масло, имеющее в твердом состоянии ионную структуру: [ClO 2 ] + [ClO 4 ] — .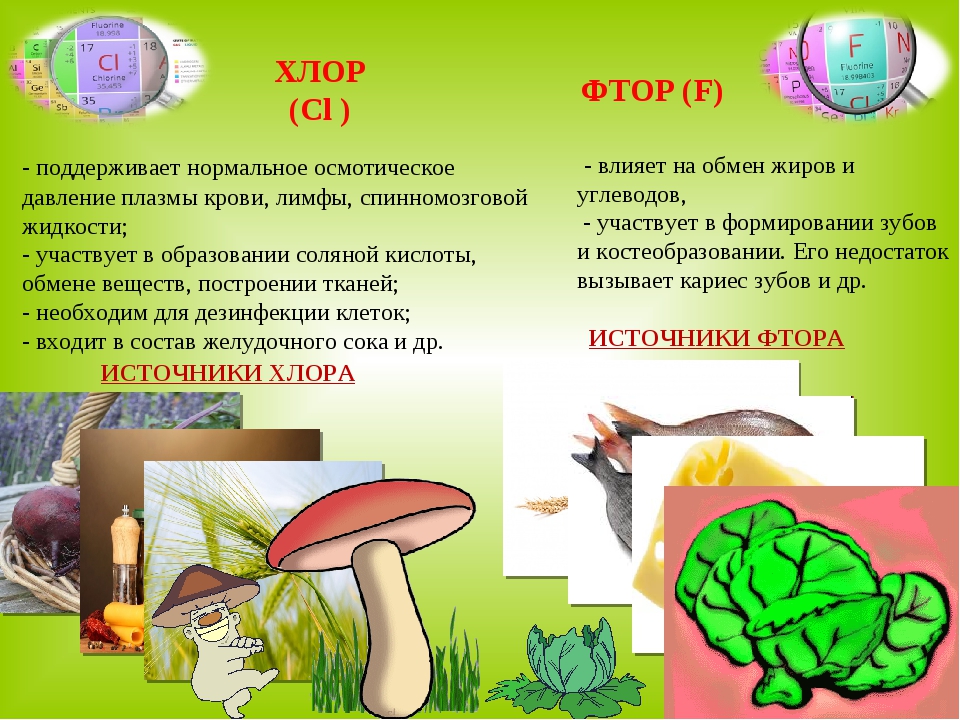 Фторид хлора представляет собой высокореакционный газ (Bp = -100,1 °C), который является сильным фторирующим агентом и получается путем окисления хлора трифторидом хлора (10.3.8).
Фторид хлора представляет собой высокореакционный газ (Bp = -100,1 °C), который является сильным фторирующим агентом и получается путем окисления хлора трифторидом хлора (10.3.8). \(\PageIndex{5}\)a), тогда как структура ClF 5 имеет квадратно-пирамидальную форму с одной неподеленной парой на хлоре ( Рисунок \(\PageIndex{5}\)b).
\(\PageIndex{5}\)a), тогда как структура ClF 5 имеет квадратно-пирамидальную форму с одной неподеленной парой на хлоре ( Рисунок \(\PageIndex{5}\)b).
 Например, HCFC-142b обозначает изомер, в котором все три атома водорода присоединены к одному и тому же атому углерода, а структурная формула записывается как CH 3 CF 2 Cl. Напротив, ГХФУ-142 (без b) относится к расположению, в котором один атом углерода присоединен к двум атомам водорода и одному атому хлора, а другой атом углерода присоединен к третьему атому водорода и двум атомам фтора.Следовательно, он имеет другую структурную формулу (CH 2 ClCHF 2 ).
Например, HCFC-142b обозначает изомер, в котором все три атома водорода присоединены к одному и тому же атому углерода, а структурная формула записывается как CH 3 CF 2 Cl. Напротив, ГХФУ-142 (без b) относится к расположению, в котором один атом углерода присоединен к двум атомам водорода и одному атому хлора, а другой атом углерода присоединен к третьему атому водорода и двум атомам фтора.Следовательно, он имеет другую структурную формулу (CH 2 ClCHF 2 ).
