UNEC – Azərbaycan Dövlət İqtisad Universiteti — Page not found
Why UNEC?
Regionda iqtisad elmini dərindən öyrədən fundamental tədris mərkəzidir;
Tədris prosesi və kadr hazırlığı Amerika və Avropa təhsil sisteminə uyğundur;
İxtisaslar bakalavr, magistr və doktorantura təhsil pillələri üzrə
azərbaycan, ingilis, rus və türk dillərində tədris edilir;
Auditoriyada mərkəz nöqtəsi tələbədir;
Tələbə universiteti iki və daha çox ixtisasla (dual major) bitirə bilər;
Tələbələrin müxtəlif mübadilə proqramlarında iştirak etmək imkanı vardır;
Universitetdə 10 fakültə və 17 kafedra fəaliyyət göstərir;
403 professor və dosent çalışır.
Son xəbərlər Elanlar Bütün xəbərlər ALL ANNOUNCEMENTS
The Journal of Economic Sciences: Theory and Practice
№ 2
ECONOMIC HERITAGE OF HEYDAR ALIYEV
Connect with
rector
-
Graduates
Mikayıl Cabbarov
İqtisadiyyat naziri
-
Graduates
Ceyhun Bayramov
Xarici işlər naziri
-
Graduates
Şahin Mustafayev
Azərbaycan Respublikası Baş Nazirinin müavini
-
Graduates
Səfər Mehdiyev
Dövlət Gömrük Komitəsinin sədri
-
Graduates
Muxtar Babayev
Ekologiya və təbii sərvətlər naziri -
Graduates
Fərid Qayıbov
Gənclər və idman naziri
-
Graduates
Səttar Möhbalıyev
Azərbaycan Həmkarlar İttifaqları Konfederasiyasının sədri
-
Graduates
Vüqar Gülməmmədov
Hesablama Palatasının sədri
-
Graduates
Elman Rüstəmov
AR Baş nazirin müşaviri
Graduates
Vüsal Hüseynov
Dövlət Miqrasiya Xidmətinin rəisi
-
Graduates
Ramin Quluzadə
Azərbaycan Respublikası Prezidentinin İşlər müdiri
-
Graduates
Natiq Əmirov
Azərbaycan Respublikası Prezidentinin İqtisadi islahatlar üzrə köməkçisi
-
Graduates
Kərəm Həsənov
Prezident Administrasiyasının Dövlət nəzarəti məsələləri şöbəsinin müdiri
-
Graduates
Azər Əmiraslanov
Nazirlər Kabineti Aparatının İqtisadiyyat şöbəsinin müdiri -
Graduates
Rövşən Nəcəf
AR Dövlət Neft Şirkətinin prezidenti
-
Graduates
Firudin Qurbanov
Elm və təhsil nazirinin müavini
-
Graduates
İdris İsayev
Elm və təhsil nazirinin müavini
-
Graduates
Sevinc Həsənova
İqtisadiyyat nazirinin müavini
-
Graduates
İlqar Fəti-zadə
Maliyyə nazirinin birinci müavini
-
Graduates
Şirzad Abdullayev
İqtisadiyyat nazirinin müşaviri
-
Graduates
Azər Bayramov
Maliyyə nazirinin müavini
-
Graduates
Sahib Məmmədov
İqtisadiyyat nazirinin müavini
-
Graduates
Məmməd Musayev
Azərbaycan Respublikası Sahibkarlar (İşəgötürənlər) Təşkilatları Milli Konfederasiyasının prezidenti -
Graduates
Vüsal Qasımlı
İqtisadi İslahatların Təhlili və Kommunikasiya Mərkəzinin direktoru
-
Graduates
İlqar Rəhimov
Milli Paralimpiya Komitəsinin prezidenti
-
Graduates
Rüfət Rüstəmzadə
Qida Təhlükəsizliyi Agentliyinin sədr müavini
-
Graduates
Rəşad Mafusov
-
Graduates
Rauf Səlimov
Dövlət Statistika Komitəsi sədrinin müavini
-
Graduates
Cabbar Musayev
Dövlət Statistika Komitəsinin Aparat rəhbəri
-
Graduates
Fərhad Hacıyev
Gənclər və idman nazirinin müavini
-
Graduates
Süleyman Qasımov
AR Dövlət Neft Şirkətinin iqtisadi məsələlər üzrə vitse-prezidenti
-
Graduates
Fərhad Tağı-zadə
General-leytenant
-
Graduates
Ziyad Səmədzadə
Millət vəkili
-
Graduates
Xanhüseyn Kazımlı
Azərbaycan Sosial Rifah Partiyasının sədri
-
Graduates
Mikayıl İsmayılov
AR Dövlət Neft Şirkətinin vitse-prezidenti
-
Graduates
Vahab Məmmədov
-
Graduates
Yusif Yusifov
Dövlət Statistika Komitəsi sədrinin müavini
-
Graduates
Fəxrəddin İsmayılov
Auditorlar Palatası sədrinin müavini
-
Graduates
Xalid Əhədov
Birinci vitse-prezidentin köməkçisi
-
Graduates
Emin Hüseynov
Birinci vitse-prezidentin köməkçisi
-
Graduates
Qəşəm Bayramov
Auditorlar Palatası aparatının rəhbəri
-
Graduates
Rafiq Aslanov
Meliorasiya və Su Təsərrüfatı Açıq Səhmdar Cəmiyyətinin sədr müavini
-
Graduates
Tahir Mirkişili
Millət vəkili, Milli Məclisin İqtisadi siyasət, sənaye və sahibkarlıq komitəsinin sədri
-
Graduates
Əli Məsimli
Millət vəkili
-
Graduates
Vüqar Bayramov
-
Graduates
Eldar Quliyev
Millət vəkili
-
Graduates
Əli Nuriyev
AMEA-nın müxbir üzvü
-
Graduates
İqbal Məmmədov
Millət vəkili
-
Graduates
Şahin Əliyev
Nəqliyyat, Rabitə və Yüksək Texnologiyalar Nazirliyi yanında Elektron Təhlükəsizlik Xidmətinin rəisi
-
Graduates
Şahin Bayramov
Mingəçevir Dövlət Universitetinin rektoru
-
Graduates
Balakişi Qasımov
İctimai Televiziya və Radio Yayımları Şirkətinin baş direktoru
-
Graduates
Elnur Rzayev
Xaçmaz Rayon İcra Hakimiyyətinin başçısı
-
Graduates
Kamran İbrahimov
“Azərpoçt” MMC-nin baş direktor müavini
-
Graduates
Alim Quliyev
Mərkəzi Bankın sədrinin birinci müavini
-
Graduates
Vadim Xubanov
Mərkəzi Bankın sədrinin müavini
-
Graduates
Aftandil Babayev
Mərkəzi Bankın sədrinin müavini
-
Graduates
Anar Həsənov
AccessBankın İdarə Heyətinin Sədri
-
Graduates
Fərid Hüseynov
«Kapital Bank»ın İdarə Heyəti sədrinin I müavini
-
Graduates
Rövşən Allahverdiyev
Kapital Bankın İdarə Heyətinin sədri
-
Graduates
Rza Sadiq
“Bank BTB” Müşahidə Şurasının Sədri
-
Graduates
Elnur Qurbanov
“AFB Bank” ASC-nin Müşahidə Şurasının Sədri
-
Graduates
Zaur Qaraisayev
“AFB Bank” ASC-nin İdarə Heyətinin Sədri
-
Graduates
Kamal İbrahimov
“Baku Steel Company” şirkətinin direktoru
-
Graduates
Vaqif Həsənov
«Qarant Sığorta» ASC-nin İdarə Heyətinin sədri
Elektron Kitabxana
ABCÇDEƏFGĞHXIİJKQLMNOÖPRSŞTUÜVYZ0-9
Налоги и налогообложение в Азербайджане
460 PAGES | DOWNLOAD
Dördüncü sənaye inqilabı
204 PAGES | DOWNLOAD
Mühasibat hesabatı
258 PAGES | DOWNLOAD
İaşə məhsullarının texnologiyası kursundan laboratoriya praktikumu
219 PAGES | DOWNLOAD
Susuz həyat yoxdur
215 PAGES | DOWNLOAD
Elektron kommersiya
212 PAGES | DOWNLOAD
www. president.az
www.mehriban-aliyeva.org
www.heydar-aliyev-foundation.org
www.azerbaijan.az
www.edu.gov.az
www.tqdk.gov.az
www.economy.gov.az
www.science.gov.az
www.azstat.org
www.atgti.az
www.virtualkarabakh.az
www.ecosciences.edu.az
www.polpred.com
president.az
www.mehriban-aliyeva.org
www.heydar-aliyev-foundation.org
www.azerbaijan.az
www.edu.gov.az
www.tqdk.gov.az
www.economy.gov.az
www.science.gov.az
www.azstat.org
www.atgti.az
www.virtualkarabakh.az
www.ecosciences.edu.az
www.polpred.comКакова температура плавления меди
Медь входит в семёрку самых древних металлов, с которыми люди познакомились на самом начальном этапе своего существования. Период с 4 по 3 тысячелетие до нашей эры так и называется медный век в истории развития человечества. Древние люди изготавливали из неё предметы быта, орудия труда и боевое оружие. Это стало возможным благодаря относительно невысокой температуре плавления меди.
Купрум: характеристика элемента
Научное наименование меди Cuprum (Купрум) происходит от названия греческого острова Кипр, где медь начали добывать ещё в середине третьего тысячелетия до нашей эры. В периодической таблице Менделеева химический элемент медь имеет 29 атомный (порядковый) номер, находится в 11 группе четвёртого периода. Принадлежит к пластичным переходным металлам. В чистом виде имеет характерный золотисто-розовый цвет. Чистую медь легко окислить, поэтому в естественных условиях она всегда образует на своей поверхности тонкую оксидную плёнку, которая придаёт ей красноватый оттенок.
Принадлежит к пластичным переходным металлам. В чистом виде имеет характерный золотисто-розовый цвет. Чистую медь легко окислить, поэтому в естественных условиях она всегда образует на своей поверхности тонкую оксидную плёнку, которая придаёт ей красноватый оттенок.
Физические свойства
Это второй металл после серебра по уровню электропроводности, что делает её крайне востребованной в современной электронике. Второе ценное качество — высокая теплопроводность, это позволяет её широко применять во всевозможных теплообменниках и в холодильной аппаратуре.
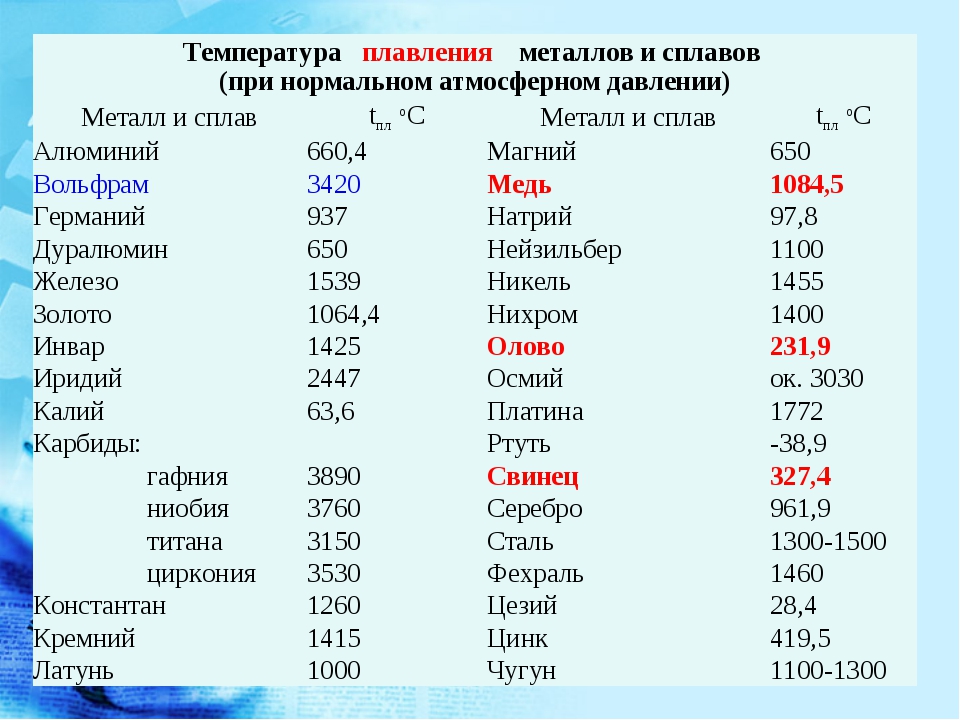
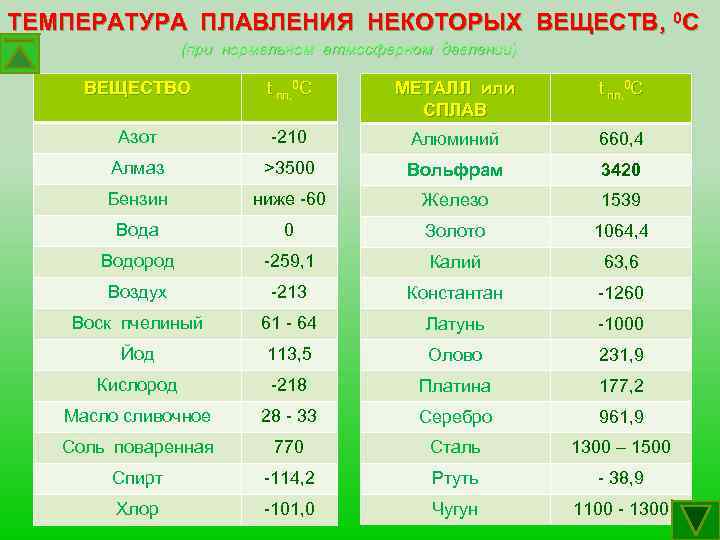
- Температура плавления 1083 градуса.
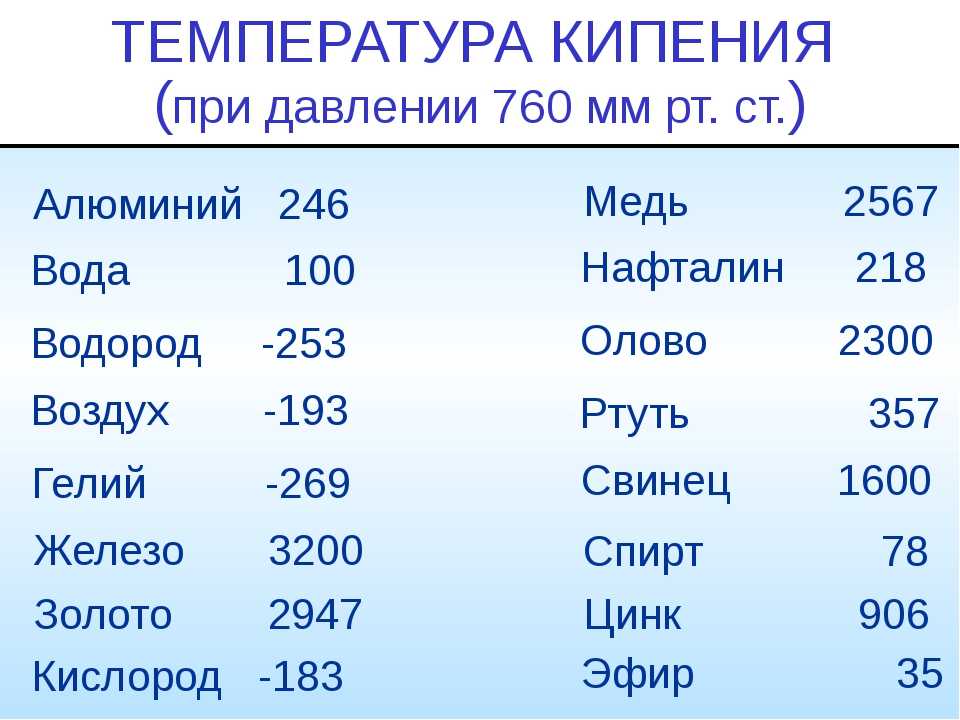
- Температура кипения 2567 градусов.
- Удельное сопротивление при 20 градусах составляет 1,68·10 -3 Ом·м.
- Плотность 8,92 г/см.
Нахождение в природе
В природе встречается в самородном виде и в виде соединений.
Самые крупные месторождения самородной меди находятся в США в районе озера Верхнего. Именно в этом районе был найден самый крупный медный самородок весом 3560 килограмм. А также много самородной меди встречается в рудных горах Германии.
В России и на постсоветском пространстве добыча меди происходит путём извлечения из сульфидной руды. Её можно добыть, извлекая из медного колчедана или халькопирита CuFeS2. Наиболее известны такие месторождения, как Удокан в Забайкалье и Джезказган в Казахстане.
Сульфиты меди чаще всего образуются в так называемых среднетемпературных гидротермальных жилах. Могут образовываться и в осадочных породах в виде медистых песчаников и сланцев.
Как правило, медная руда всегда добывается открытым способом. Процентное содержание чистой меди в руде составляет от 0,2 до 1,0 процента в зависимости от месторождения.
Медные сплавы
Являются самыми первыми металлическими сплавами, получение которых человечество освоило ещё на самой заре своего развития. При какой температуре плавится медь, зависит от того, в каком сплаве она находится. В настоящее время наиболее известны и востребованы такие сплавы, как:
При какой температуре плавится медь, зависит от того, в каком сплаве она находится. В настоящее время наиболее известны и востребованы такие сплавы, как:
- Латунь. Сплав с добавление цинка, содержание которого может доходить до 40%. Цинк повышает пластичность и прочность металла. Температура, при которой латунь плавится, составляет 880 — 950 градусов.
- Бронза. Сплав с оловом, с добавлением некоторых других компонентов, таких как кремний, бериллий, свинец. Получать бронзу из меди человек научился ещё в самом начале бронзового века. Бронза не утратила своей актуальности даже с наступлением века железа, например, ещё в начале 20 века стволы пушек изготавливали из так называемой орудийной бронзы. Температура, при которой бронза начинает плавиться, составляет 930 — 1140 градусов.
- Мельхиор. Кроме меди, содержит в своём составе 5−30% никеля. Никель увеличивает прочность медного сплава и повышает его электрическое сопротивление. Кроме того, сильно повышается коррозионная стойкость.
 Температура плавления — 1170 градусов. По своим внешним характеристикам мельхиор очень похож на серебро, раньше его называли белой медью. Но он обладает более высокой механической прочностью, чем обычное серебро.
Температура плавления — 1170 градусов. По своим внешним характеристикам мельхиор очень похож на серебро, раньше его называли белой медью. Но он обладает более высокой механической прочностью, чем обычное серебро. - Дюраль, или дюралюминий. Основную массу сплава составляет алюминий 93%, на медь приходится 5%, оставшиеся 2% занимают марганец, железо и магний. Название происходит от названия немецкого города Дюрен, где в 1906 году был впервые получен этот высокопрочный сплав алюминия. Одной из его особенностей является тот факт, что его прочностные характеристики с течением времени имеют тенденцию к увеличению. Поэтому он не теряет своей прочности после нескольких лет эксплуатации, как другие металлы. В настоящее время этот сплав является основой самолётостроения.
- Ювелирные сплавы. Сплавы меди с золотом. Тем самым увеличивается устойчивость драгметалла к механическим воздействиям и истиранию.
Переплавка меди дома
Этот металл обладает целым набором полезных свойств, которые делают её весьма желанным металлом в домашнем хозяйстве. А относительно невысокая температура при плавлении и изрядное количество медного лома, которое можно обнаружить на ближайшей свалке, позволяют задавать вопрос о том, как расплавить медь в домашних условиях, не как риторический, а вполне реальный и практический.
А относительно невысокая температура при плавлении и изрядное количество медного лома, которое можно обнаружить на ближайшей свалке, позволяют задавать вопрос о том, как расплавить медь в домашних условиях, не как риторический, а вполне реальный и практический.
График плавления меди
Расплавление любого металла заключается в том, что под воздействием высоких температур разрушается кристаллическая решётка и металл переходит из твёрдого состояния в жидкое. Можно выделить некоторые закономерности, свойственные любому металлу в процессе расплавления:
- Во время нагревания температура внутри металла повышается, но кристаллическая решётка не подвергается разрушению. Металл сохраняет своё твёрдое состояние.
- При достижении температуры плавления, для меди это 1083 градуса, температура внутри металла перестаёт повышаться, несмотря на то что общий нагрев и передача тепла продолжаются.
- После того как вся масса метала переходит в расплавленное состояние, температура внутри металла снова начинает резко повышаться.

В случае процесса охлаждения расплавленного металла происходит всё то же самое, но в обратной последовательности. Сначала происходит резкое снижение температуры внутри металла, затем на значении 1080 градусов падение температуры прекращается до тех пор, пока вся масса метала не перейдёт в твёрдое состояние. После этого температура снова начинает резко падать, пока не сравняется с температурой окружающего воздуха и кристаллизация не завершится окончательно.
Температура кипения
Медь начинает активно выделять углерод в виде пузырьков газа при температуре 2560 градусов. Внешне это очень напоминает кипение воды. На самом деле это процесс активного окисления меди, в результате которого металл теряет практически все свои уникальные свойства. Детали, отлитые из кипящей меди, имеют в своей структуре большое количество пор, которые будут уменьшать механическую прочность материала и ухудшать его декоративные свойства. Потому в процессе плавки необходимо внимательно следить за температурой и не допускать закипания меди.
Потому в процессе плавки необходимо внимательно следить за температурой и не допускать закипания меди.
Способы плавки
Медный лом можно переплавить в домашних условиях разными способами в зависимости от технического оснащения домашней мастерской. При этом нужно иметь в виду, что придётся нагревать медь не до её температуры плавления, а чуть выше — примерно до 1100−1200 градусов.
Для этих целей годятся следующие приспособления:
- Муфельная печь. Наиболее рациональное решение проблемы расплавления меди, так как такая печь позволяет регулировать температуру во время процесса плавки, что очень удобно. Подобные лабораторные печи оснащены специальным окном из жаропрочного стекла, что позволяет постоянно осуществлять визуальный контроль всего процесса.
- Газовая горелка. Ручная газовая горелка размещается под дном ёмкости из тугоплавкого материала, в которой непосредственно будет размещаться медный лом.
 Этот способ предполагает наличие тесного контакта расплавляемой массы металла с воздухом, что будет способствовать усилению процесса окисления расплавляемого металла. Чтобы этому как-то противостоять, на расплавляемую массу сверху насыпают слой древесного угля.
Этот способ предполагает наличие тесного контакта расплавляемой массы металла с воздухом, что будет способствовать усилению процесса окисления расплавляемого металла. Чтобы этому как-то противостоять, на расплавляемую массу сверху насыпают слой древесного угля. - Паяльная лампа. Способ практически ничем не отличается от плавки с помощью газовой горелки. Но в этом случае невозможно достигнуть относительно высоких температур, поэтому он годится для переплавки сплавов меди, которые обладают меньшей температурой плавления, чем чистая медь.
- Кузнечный горн. На раскалённые древесные угли специального костра помещается тугоплавкий тигель с измельчённым металлом. Для ускорения процесса расплавления задействуют обычный бытовой пылесос, включённый в режиме выдувания. Труба пылесоса должна быть небольшого диаметра и иметь металлический наконечник, в противном случае она расплавится. Данный способ подходит для тех, кто занимается плавкой меди дома регулярно и имеет дело с большими объёмами исходного материала, который необходимо отжечь.

- Микроволновая печь. Бытовая мощная микроволновка с небольшими изменениями конструкции может легко плавить довольно большие объёмы медного лома. Для этого необходимо убрать из микроволновки вращающуюся тарелку, а вместо неё поместить соответствующих размеров тигель, который необходимо сделать из тугоплавкого материала, например, из шамотного кирпича.
Пошаговая инструкция
Процесс плавления любого металла происходит поэтапно и подчиняется определённому алгоритму, который одинаков как для промышленного производства, так и для кустарного. Для тех, кто озадачен вопросом плавки меди в домашних условиях, пошаговая инструкция будет выглядеть следующим образом:
- Необходимо взять тугоплавкий тигель. Металл в измельчённом состоянии насыпается в тигель. После этого тигель помещается в предварительно прогретую муфельную печь. С помощью специального окошка наблюдают за процессом расплавления.
- После полного расплавления всего объёма медного лома тигель с помощью специальных длинных щипцов извлекается из печи.

- На поверхности расплавленного металла образуется плёнка его оксида. Эту плёнку необходимо аккуратно сдвинуть в сторону к одной из стенок тигля. Для этих целей используют специальный крючок, изготовленный из тугоплавкого металла.
- После того как металл освобождён от оксидной плёнки, необходимо его очень быстро разлить в предварительно подготовленные формы.
Практические рекомендации
Температура плавления меди в домашних условиях зависит от того, в каком сплаве она содержится.
Техническая чистая медь содержится в проводах и кабелях, а также в обмотках трансформаторов, электродвигателей и генераторов. При этом нужно иметь в виду, что химически чистая медь содержится только в столовых приборах и в прочей кухонной утвари. Во всех остальных случаях в ней присутствуют те или иные вредные компоненты.
В чистом виде обладает повышенной вязкостью в расплавленном состоянии, поэтому отливать из неё изделия сложной конфигурации и небольших размеров очень сложно. Гораздо легче для этих целей использовать латунь.
Гораздо легче для этих целей использовать латунь.
В сплавах бронзы, изготовленных вначале и середине прошлого века, использовали в качестве компонентов мышьяк и сурьму. Поэтому следует избегать расплавления так называемой старинной бронзы, так как пары мышьяка могут привести к отравлению организма.
Благодаря тому, что температура плавления меди достаточно невысокая, этот металл стал одним из первых, которые древние люди начали использовать для изготовления различных инструментов, посуды, украшений и оружия. Самородки меди или медную руду можно было расплавить на костре, что, собственно, и делали наши далекие предки.
Несмотря на активное применение человечеством с древних времен, медь не является самым распространенным природным металлом. В этом отношении она значительно уступает остальным элементам и занимает в их ряду только 23-е место.
Как плавили медь наши предки
Благодаря невысокой температуре , составляющей 1083 градуса Цельсия, наши далекие предки не только успешно получали из руды чистый металл, но и изготавливали различные сплавы на его основе. Чтобы получить такие сплавы, медь нагревали и доводили до жидкого расплавленного состояния. Затем в такой расплав просто добавляли олово или выполняли его восстановление на поверхности расплавленной меди, для чего использовалась оловосодержащая руда (касситерит). По такой технологии получали бронзу – сплав, обладающий высокой прочностью, который использовали для изготовления оружия.
Чтобы получить такие сплавы, медь нагревали и доводили до жидкого расплавленного состояния. Затем в такой расплав просто добавляли олово или выполняли его восстановление на поверхности расплавленной меди, для чего использовалась оловосодержащая руда (касситерит). По такой технологии получали бронзу – сплав, обладающий высокой прочностью, который использовали для изготовления оружия.
Какие процессы происходят при плавлении меди
Что характерно, температуры плавления меди и сплавов, полученных на ее основе, отличаются. При , имеющего меньшую температуру плавления, получают бронзу с температурой плавления 930–1140 градусов Цельсия. А сплав меди с цинком (латунь) плавится при 900–10500 Цельсия.
Во всех металлах в процессе плавления происходят одинаковые процессы. При получении достаточного количества теплоты при нагревании кристаллическая решетка металла начинает разрушаться. В тот момент, когда он переходит в расплавленное состояние, его температура не повышается, хотя процесс передачи ему теплоты при помощи нагрева не прекращается. Температура металла начинает вновь повышаться только тогда, когда он весь перейдет в расплавленное состояние.
Температура металла начинает вновь повышаться только тогда, когда он весь перейдет в расплавленное состояние.
При охлаждении происходит противоположный процесс: сначала температура резко снижается, затем на некоторое время останавливается на постоянной отметке. После того, как весь металл перейдет в твердую фазу, температура снова начинает снижаться до полного его остывания.
Как плавление, так и обратная кристаллизация меди, связаны с параметром удельной теплоты. Данный параметр характеризует удельное количество теплоты, которая требуется для того, чтобы перевести металл из твердого состояния в жидкое. При кристаллизации металла такой параметр характеризует количество теплоты, которое он отдает при остывании.
Более подробно узнать о плавлении меди помогает фазовая диаграмма, показывающая зависимость состояния металла от температуры. Такие диаграммы, которые можно составить для любых металлов, помогают изучать их свойства, определять температуры, при которых они кардинально меняют свои свойства и текущее состояние.
Кроме температуры плавления, у меди есть и температура кипения, при которой расплавленный металл начинает выделять пузырьки, наполненные газом. На самом деле никакого кипения меди не происходит, просто этот процесс внешне очень его напоминает. Довести до такого состояния ее можно, если нагреть до температуры 2560 градусов.
Как понятно из всего вышесказанного, именно невысокую температуру плавления меди можно назвать одной из основных причин того, что сегодня мы можем использовать этот металл, обладающий многими уникальными характеристиками.
Сегодня медь является одним из самых востребованных металлов. Высокий спрос объясняется отличительными характеристиками, присущими этому металлу. Медь проводит электроток лучше любых других металлов, кроме серебра, благодаря этому ее используют в производстве кабелей и электропроводов. Температура плавления меди не высокая, металл пластичный и легко поддается обработке, благодаря этому качеству стало возможным ее применение в строительстве в качестве водопроводных тр. Этот металл имеет высокое сопротивление к внешним раздражающим факторам, поэтому долговечен и может быть использован несколько раз, после переплавки. Это качество меди высоко ценят экологи, поскольку при повторной обработке металла тратится значительно меньшее количество энергии, чем при добыче и обработки руды, к тому же сохраняются земные недра. Добыча медной руды не проходит бесследно, на месте отработанных рудников появляются токсичные озера, наиболее известное во всем мире такое озеро – Беркли-Пит в штате Монтана в США.
Этот металл имеет высокое сопротивление к внешним раздражающим факторам, поэтому долговечен и может быть использован несколько раз, после переплавки. Это качество меди высоко ценят экологи, поскольку при повторной обработке металла тратится значительно меньшее количество энергии, чем при добыче и обработки руды, к тому же сохраняются земные недра. Добыча медной руды не проходит бесследно, на месте отработанных рудников появляются токсичные озера, наиболее известное во всем мире такое озеро – Беркли-Пит в штате Монтана в США.
Необходимая температура для плавления меди
Медь не является легкоплавким металлом
Люди нашли применение меди еще в древние времена, тогда ее добывали в виде самородков. Ввиду низкой температуры, необходимой для осуществления процесса плавления ее стали широко применять для изготовления орудий труда и охоты, самородки можно плавить на костре. В наши дни технология получения металла мало чем отличается от придуманной в древние времена, совершенствуются лишь печи, увеличена скорость обжига и объемы обработки. Здесь возникает уместный вопрос — какая температура плавления меди? Ответ на него можно найти в любом учебнике по физике и химии – медь начинает плавиться при температуре нагрева до 1083 о С.
Здесь возникает уместный вопрос — какая температура плавления меди? Ответ на него можно найти в любом учебнике по физике и химии – медь начинает плавиться при температуре нагрева до 1083 о С.
Кипение меди уменьшает ее прочность
В процессе термического воздействия на металл происходит разрушение его кристаллической решетки, это достигается при определенной температуре, которая в течение некоторого времени остается постоянной. В этот момент и происходит плавка металла. Когда процесс разрушения кристаллов полностью завершен, температура металла снова начинает подниматься, и он переходит в жидкую форму и начинает кипеть. Температура плавления меди значительно ниже, чем та, при которой металл кипит. Процесс кипения начинается с появлением пузырьков, по аналогии с водой. На этом этапе любой металл, в том числе и медь, начинает терять свои характеристики, в основном это отражается на прочности и упругости. Температура кипения меди составляет 2560 о С. Во время остывания металла происходит похожая картина, как и при нагреве – сначала температура опускается до определенного градуса, в этот момент происходит затвердевание, которое длится некоторое время, затем продолжается остывание до обычного состояния.
Как изменяется металл под термическим воздействием
Любой нагрев меди влечет за собой изменение ее характеристик, наиболее значимой является величина ее удельного сопротивления. Медь является проводником электрического тока, при этом металл оказывает сопротивление движению носителям заряда. Отношение площади сечения проводника к оказываемому движению и называется удельным сопротивлением.
Так вот, эта величина для чистой меди составляет 0,0172 ОМ мм 2 /м при 20 о С. Этот показатель может измениться после термической обработки, а также вследствие добавления в состав различных примесей и добавок. Здесь наблюдается обратная зависимость сопротивления меди от температуры – чем выше была температура обработки металла, тем ниже будет ее сопротивление электрическому току. Для обеспечения наилучших электролитических характеристик медной проволоки, ее обрабатывают при 500 о С.
Во время термической обработки можно не только придавать металлу нужную форму и размер, но и создавать различные сплавы. Самыми распространёнными медными сплавами является бронза и латунь. Бронза получается путем смешивания меди с оловом, а латунь – с цинком. Добавление алюминия и стали увеличивает прочность материала, а добавление никеля повышает антикоррозийные свойства. Но стоит заметить, что любая примесь снижает главное свойство – электропроводность, поэтому для изготовления жил электрокабеля используют чистый состав металла.
Самыми распространёнными медными сплавами является бронза и латунь. Бронза получается путем смешивания меди с оловом, а латунь – с цинком. Добавление алюминия и стали увеличивает прочность материала, а добавление никеля повышает антикоррозийные свойства. Но стоит заметить, что любая примесь снижает главное свойство – электропроводность, поэтому для изготовления жил электрокабеля используют чистый состав металла.
Отжиг меди
Под отжигом меди следует понимать процесс ее нагрева с целью дальнейшей обработки и приданию необходимых форм изделию. В ходе отжига металл становится более пластичным и мягким, поддающимся различным трансформациям. При отжиге меди температура достигает 550 о С, она приобретает темно-красный оттенок. После нагрева желательно быстро производить ковку и оправлять изделие на охлаждение.
Если подвергать материал медленному, естественному охлаждению, то возможно образование наклепа, поэтому чаще применяют мгновенное охлаждение путем помещения заготовки в холодную воду. Если превысить допустимую величину нагрева, металл может стать более хрупким и ломким.
Если превысить допустимую величину нагрева, металл может стать более хрупким и ломким.
Во время отжига осуществляется процесс рекристаллизации меди, в ходе которого образуются новые зерна или кристаллы металла, которые не искажены решеткой и отделены от прежних зерен угловыми границами. Новые зерна по размеру могут сильно отличаться от предшественников, при их образовании высвобождается большое количество энергии, увеличивается плотность и появляется наклеп. Рекристаллизация осуществляется только после деформации изделия, и только после достижения ее определенного уровня. Для меди критический уровень деформации составляет 5%, если он не достигнут процесс формирования новых зерен не начнется. Температура рекристаллизации меди составляет 270 о С. Следует отметить, что при этой температуре процесс роста кристаллов только начинается, но он достаточно медленный, поэтому для достижения необходимого результата медь необходимо нагреть до 500 о С, тогда времени для остывания хватит для завершения процесса рекристаллизации.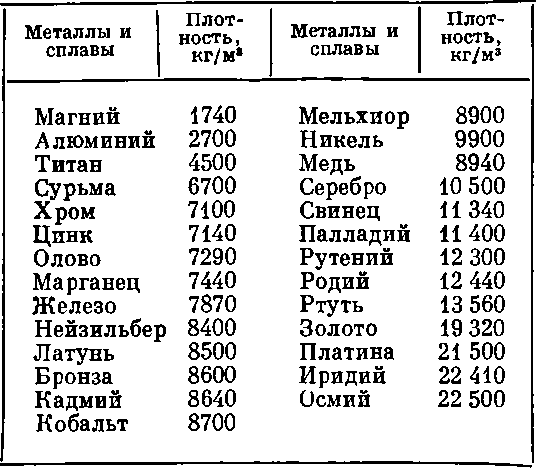
Видео: Плавление меди в микроволновке
Предметы из меди, а также различные изделия, в состав которых она входит, получили широкое распространение в бытовых условиях. Поэтому многие задаются вполне стандартным вопросом: «Как расплавить медь самостоятельно?»
Имея представление о такой технологии, люди научились изготавливать разные предметы из чистого металла, а также получаемых из него сплавов – бронзы и латуни.
Плавление – это процесс, характеризующий постепенный переход металла из стандартного твердого состояния в жидкую консистенцию. Каждому металлическому соединению или металлу в чистом виде свойственная своя температура, под воздействием которой он начинает плавиться.
Немаловажным фактором в данном случае является то, какие примеси входят в состав расплавляемого соединения.
Так, медь начинает плавиться при температуре 1083 градусов по Цельсию. Если к ней добавить олово, то температура плавления снизится и составит примерно 930-1140 градусов по Цельсию.
В данном случае такое колебание обусловлено количеством олова, входящего в сплав. Соединение из меди и цинка плавится при еще более низкой температуре – 900-1050 градусов. Нагревание любых металлов связано с постепенным разрушением решетки, образованной из множества кристаллов.
С нагреванием температура плавления поднимается до максимально необходимой отметки, затем ее рост останавливается и сохраняется на достигнутом уровне до того момента, пока не расплавится весь металл, после чего начинает снижаться.
Остывание – обратный процесс изменения температуры. По мере охлаждения она падает и «замирает» на определенном уровне до тех пор, пока металл полностью не затвердеет.
Медь, разогретая до максимально возможной отметки, закипает при температуре, достигшей отметки в 2560 градусов. По внешнему виду ее кипение схоже с кипением любых жидких веществ, на поверхности которых по мере нагревания появляются пузырьки, и выделяется газ. Так, из меди в процессе кипения выходит углерод, образовавшийся в результате окисления и ее тесного контакта с воздухом.
Технология плавления меди получила широкое применение с древних времен, когда люди с помощью костра расплавляли металл для изготовления стрел, наконечников и другого оружия, и предметов быта.
Плавка меди в домашних условиях также возможна. Для этого понадобятся:
- Тигель, где будет плавиться медь, и щипцы, необходимые для того, чтобы извлечь тигель из печи или снять его с огня.
- Древесный уголь.
- Муфельная печь (лучше, если в ней будет регулироваться температура нагрева).
- Горн.
- Обычный пылесос.
- Форма, в которую выливается расплавленная жидкость.
- Крюк, изготовленный из стальной проволоки.
- Газовая горелка, если нет муфельной печи.
Алгоритм плавления включает несколько поэтапных шагов:
- Металл измельчить и пересыпать в тигель . Причем чем более мелкие фрагменты будут, тем скорее он достигнет расплавленного состояния. Тигель поставить в печь, раскаленную до максимально высокой температуры, необходимой для начала процесса плавления (здесь кстати придется регулятор температур).
 Во многих муфельных печах на двери вырезано окошко. Через него можно безопасно осуществлять наблюдение за процессом.
Во многих муфельных печах на двери вырезано окошко. Через него можно безопасно осуществлять наблюдение за процессом. - По достижении медью жидкого окончательно расплавленного состояния, тигель с помощью щипцов нужно постараться как можно аккуратнее и скорее вынуть из печи . На поверхности жидкого вещества будет образована пленка, ее подвинуть к краю тигля, используя крюк из проволоки. Очищенный от пленки металл максимально быстро перелить в заранее подготовленную форму.
- Если муфельная печь отсутствует, осуществить плавку меди можно с применением обычной газовой горелки . Но тогда медь будет находиться в тесном контакте с воздухом, а сам процесс окисления пройдет значительно быстрее. Поэтому для предотвращения образования толстой пленки на поверхности металла, медь, когда она достигнет жидкого состояния, присыпают растолченным древесным углем.
- Расплавить медь и ее сплавы можно также с помощью горна . Для этого древесный уголь нужно хорошо раскалить и поместить на него тигель с металлом (предварительно измельчить медь).
 Для ускорения нагревательного процесса на уголь направить пылесос, включенный на режиме выдувания. Особое внимание стоит уделить наконечнику трубы. Она должна быть металлической, поскольку пластик расплавится под воздействием высокой температуры.
Для ускорения нагревательного процесса на уголь направить пылесос, включенный на режиме выдувания. Особое внимание стоит уделить наконечнику трубы. Она должна быть металлической, поскольку пластик расплавится под воздействием высокой температуры.
У чистой меди, в состав которой не входят другие соединения, достаточно плохая текучесть. Поэтому делать из нее сложное литье или мелкие детали не рекомендуется.
Тогда стоит использовать сплавы. Например, латунь, оттенок которой светлее остальных. Это говорит о том, что для ее плавления нужны менее высокие температуры.
Температура плавления латуни, бронзы и меди примерно одинаковая. Во всяком случае значения этой характеристики для всех трех данных цветных металлов находятся в одном узком диапазоне температур. Это обусловлено тем, что бронза и латунь являются сплавами меди, свойства которой в значительной степени влияют на их физические характеристики.
Для твердых кристаллических материалов, к коим относятся и металлы, состоящие из чистого (без примесей) вещества, температурой плавления является такой показатель их нагревания, при котором они переходят в другое состояние – жидкое. Причем при этой же температуре чистые вещества (металлы) и застывают. То есть для них такой показатель нагрева является температурой одновременно и плавления, и кристаллизации. А сами металлы, нагретые до температуры их плавления, могут находиться не только в жидком, но и твердом состоянии. Это зависит от того, продолжить подводить к ним дополнительное тепло или дать начать остывать.
Причем при этой же температуре чистые вещества (металлы) и застывают. То есть для них такой показатель нагрева является температурой одновременно и плавления, и кристаллизации. А сами металлы, нагретые до температуры их плавления, могут находиться не только в жидком, но и твердом состоянии. Это зависит от того, продолжить подводить к ним дополнительное тепло или дать начать остывать.
Вообще, по достижении температуры плавления чистое вещество сначала все еще остается твердым. Если продолжить нагрев, то оно станет жидким. Но температура вещества не будет повышаться (меняться) до тех пор, пока оно все полностью не расплавится в рассматриваемой системе (изделии, теле). А когда расплавленное вещество остывает до температуры кристаллизации (плавления), то оно сначала все еще остается жидким. И только если начать дополнительное отведение от него тепла, тогда оно станет переходить в кристаллическое твердое состояние (застывать). Но температура вещества, опять же, не будет меняться (понижаться), пока оно полностью не затвердеет.
У смесей веществ (в том числе и у различных сплавов металлов) нет температуры плавления/кристаллизации. Они совершают переход из одного состояния в другое (из твердого в жидкое и обратно) в некотором определенном интервале степени своего нагрева, граничные значения диапазона которого имеют соответствующее название. Температуру, при которой смеси веществ и сплавы металлов начинают переходить в жидкую фазу (или полностью затвердевают), называют «точкой солидуса». Степень нагрева, при котором происходит полное расплавление (или начинается кристаллизация при остывании), называют «точкой ликвидуса». Но в обиходе чаще говорят: температура солидуса и ликвидуса.
Точно замерить эти температуры как для смесей веществ, так и для сплавов металлов невозможно. Их определяют по специальным расчетным методикам, в которых учитывается точное процентное соотношение в смеси каждого элемента и ряд других параметров.
То есть относительно рассматриваемых металлов можно сделать следующие выводы. Температура плавления есть . Причем, только у чистой. У всех остальных металлов (латуни, бронзы и различных марок меди) ее нет, а есть температуры солидус и ликвидус. Для латуни и бронзы это так, потому что они являются сплавами меди, в которых в зависимости от марки добавлены различные легирующие добавки (другие металлы или иные вещества) и еще есть какие-то примеси. А производимые металлургической промышленностью для различных нужд имеют такие характеристики плавления, так как они тоже производятся легированными и с примесями. Чистую медь изготавливать нецелесообразно, и она уступает по своим характеристикам, требуемым для народного и промышленного ее использования, свойствам выпускаемых из нее марок.
Температура плавления есть . Причем, только у чистой. У всех остальных металлов (латуни, бронзы и различных марок меди) ее нет, а есть температуры солидус и ликвидус. Для латуни и бронзы это так, потому что они являются сплавами меди, в которых в зависимости от марки добавлены различные легирующие добавки (другие металлы или иные вещества) и еще есть какие-то примеси. А производимые металлургической промышленностью для различных нужд имеют такие характеристики плавления, так как они тоже производятся легированными и с примесями. Чистую медь изготавливать нецелесообразно, и она уступает по своим характеристикам, требуемым для народного и промышленного ее использования, свойствам выпускаемых из нее марок.
Температура плавления металлов
Очевидно, что величина температуры ликвидус рассматриваемых металлов будет зависеть от их химического состава. В первую очередь от процентного содержания меди, так как ее в них всегда больше 50 %. И, соответственно, точка ликвидус марок этих металлов будет тем ближе к температуре плавления самой меди, чем ее больше в сплаве.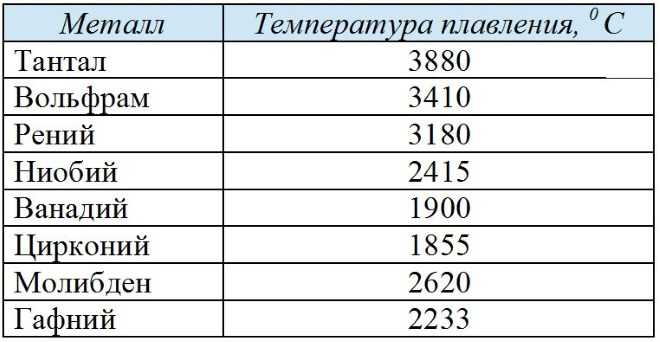 А легирующие металлы или другие вещества и примеси, в зависимости от своего процентного содержания и температуры плавления, будут вносить соответствующую корректировку в сторону понижения либо повышения точки ликвидус у марок меди, бронзы и латуни. Понижать, если своя температура плавления ниже, чем у меди, и повышать, когда выше.
А легирующие металлы или другие вещества и примеси, в зависимости от своего процентного содержания и температуры плавления, будут вносить соответствующую корректировку в сторону понижения либо повышения точки ликвидус у марок меди, бронзы и латуни. Понижать, если своя температура плавления ниже, чем у меди, и повышать, когда выше.
Так, ознакомившись, можно самому догадаться, в какую сторону будет отличаться у них точка ликвидус от температуры плавления чистой меди. Сам подскажет его влияние на эту и другие характеристики данного сплава. А даст возможность судить об отклонениях ее точки ликвидус от температуры плавления меди. С марками меди то же самое, но влияние легирующих добавок и примесей на их точку ликвидус будет рассмотрено отдельно ниже.
Температура плавления чистой меди – 1084,5 °C. А выпускаемые марки меди содержат ничтожно малое по отношению к самому этому металлу количество других веществ. Такое, что даже легирующие элементы, как, например, серебро и никель, наравне с прочими «случайными» веществами, относят в составе марок меди к примесям. Самого этого металла – от 99,93 до 99,99 %. И поэтому точки солидус и ликвидус выпускаемых марок меди очень близки к температуре плавления самого этого металла. Температуры полного расплавления в зависимости от марки: меди – 1083–1084 °C, латуни – 880–1050 °C, а бронзы – 900–1140 °C.
Самого этого металла – от 99,93 до 99,99 %. И поэтому точки солидус и ликвидус выпускаемых марок меди очень близки к температуре плавления самого этого металла. Температуры полного расплавления в зависимости от марки: меди – 1083–1084 °C, латуни – 880–1050 °C, а бронзы – 900–1140 °C.
Изделия из меди
Температурные главным образом зависят от содержания меди и гораздо менее тугоплавкого цинка, являющегося в латунных сплавах основным легирующим элементом. А относительно бронзы следует отметить, что ее так называемые оловянные марки, с легированием оловом, полностью плавятся при температуре 900–950 °C, а не содержащие этот металл, безоловянные – при 950–1140 °C.
Прям совсем уж в домашних условиях плавить эти металлы, да еще потом и отливать из них какие-то заготовки, а тем более изделия, не получится. Надо будет сначала предварительно соответствующим образом подготовить подходящее помещение, обзавестись необходимым оборудованием и инструментом или смастерить самому что-то из требуемого для плавки и литья оснащения.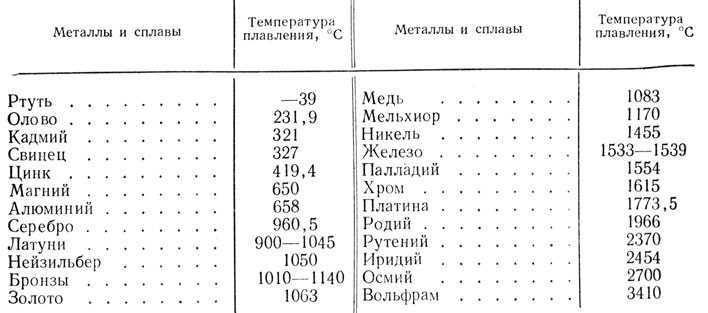 И, разумеется, желательно поточнее выяснить характеристики сплава, с которым предполагается работать. А именно, его состав и температуру ликвидус.
И, разумеется, желательно поточнее выяснить характеристики сплава, с которым предполагается работать. А именно, его состав и температуру ликвидус.
Плавление в домашних условиях
А какие именно необходимо создать условия для работы, подготовить оборудование, оснащение и инструменты, а также технология плавки и литья перечислены и описаны в одной из публикаций сайта. Это статья: . Так как у этого сплава и у марок меди с латунью точки ликвидус близки по своим значениям, а другие свойства, влияющие на процессы плавки и литья, относительно сопоставимы, то и вся технология в кустарных условий для этих металлов идентична. То есть для меди и латуни можно воспользоваться инструкциями-рекомендациями по плавке бронзы из этой статьи.
Медь – это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.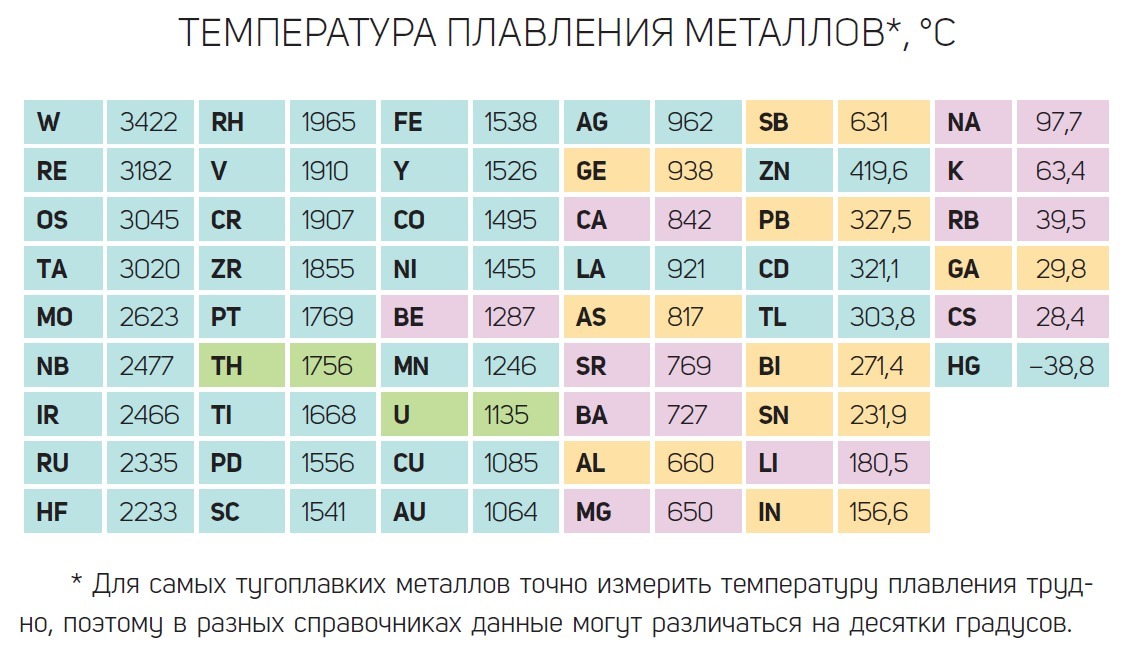
Латинское название Cuprum произошло от имени острова Кипр. Известны факты, что на Кипре ещё в III веке до нашей эры находились медные рудники и местные умельцы выплавляли медь. Купить медь можно в комании «КУПРУМ».
По данным историков, знакомству общества с медью около девяти тысячелетий. Самые древние медные изделия найдены во время археологических раскопок на местности современной Турции. Археологи обнаружили маленькие медные бусинки и пластинки для украшения одежды. Находки датируются рубежом VIII-VII тыс. до нашей эры. Из меди в древности изготавливали украшения, дорогую посуду и различные инструменты с тонким лезвием.
Великим достижением древних металлургов можно назвать получение сплава с медной основой – бронзы.
Основные свойства меди
1. Физические свойства.
На воздухе медь приобретает яркий желтовато-красный оттенок за счёт образования оксидной плёнки. Тонкие же пластинки при просвечивании зеленовато-голубого цвета. В чистом виде медь достаточно мягкая, тягучая и легко прокатывается и вытягивается. Примеси способны повысить её твёрдость.
Примеси способны повысить её твёрдость.
Высокую электропроводность меди можно назвать главным свойством, определяющим её преимущественное использование. Также медь обладает очень высокой теплопроводностью. Такие примеси как железо, фосфор, олово, сурьма и мышьяк влияют на базовые свойства и уменьшают электропроводность и теплопроводность. По данным показателям медь уступает лишь серебру.
Медь обладает высокими значениями плотности, температуры плавления и температуры кипения. Важным свойством также является хорошая стойкость по отношению к коррозии. К примеру, при высокой влажности железо окисляется значительно быстрее.
Медь хорошо поддаётся обработке: прокатывается в медный лист и медный пруток, протягивается в медную проволоку с толщиной, доведённой до тысячных долей миллиметра. Этот металл является диамагнетиком, то есть намагничивается против направления внешнего магнитного поля.
2. Химические свойства.
Медь является сравнительно малоактивным металлом. В нормальных условиях на сухом воздухе её окисления не происходит. Она легко реагирует с галогенами, селеном и серой. Кислоты без окислительных свойств не оказывают воздействия на медь. С водородом, углеродом и азотом химических реакций нет. На влажном воздухе происходит окисление с образованием карбоната меди (II) – верхнего слоя платины.
В нормальных условиях на сухом воздухе её окисления не происходит. Она легко реагирует с галогенами, селеном и серой. Кислоты без окислительных свойств не оказывают воздействия на медь. С водородом, углеродом и азотом химических реакций нет. На влажном воздухе происходит окисление с образованием карбоната меди (II) – верхнего слоя платины.
Медь обладает амфотерностью, то есть в земной коре образует катионы и анионы. В зависимости от условий, соединения меди проявляют кислотные или основные свойства.
Способы получения меди
В природе медь существует в соединениях и в виде самородков. Соединения представлены оксидами, гидрокарбонатами, сернистыми и углекислыми комплексами, а также сульфидными рудами. Самые распространённые руды – это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
1. Пирометаллургический способ включает в себя такие процессы: обогащение и обжиг, плавка на штейн, продувка в конвертере, электролитическое рафинирование.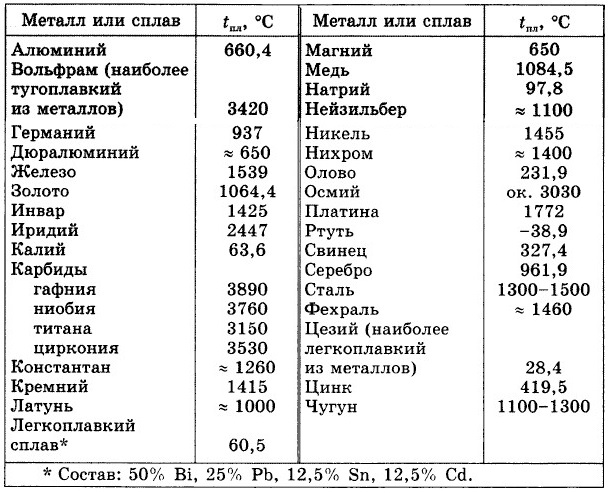
Обогащают медные руды методом флотации и окислительного обжига. Сущность метода флотации заключается в следующем: частицы меди, взвешенные в водной среде, прилипают к поверхности пузырьков воздуха и поднимаются на поверхность. Метод позволяет получить медный порошкообразный концентрат, который содержит 10-35% меди.
Окислительному обжигу подлежат медные руды и концентраты со значительным содержанием серы. При нагреве в присутствии кислорода происходит окисление сульфидов, и количество серы снижается почти в два раза. Обжигу подвергаются бедные концентраты, в которых содержится 8-25% меди. Богатые концентраты, содержащие 25-35% меди, плавят, не прибегая к обжигу.
Следующий этап пирометаллургического способа получения меди – это плавка на штейн. Если в качестве сырья используется кусковая медная руда с большим количеством серы, то плавку проводят в шахтных печах. А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.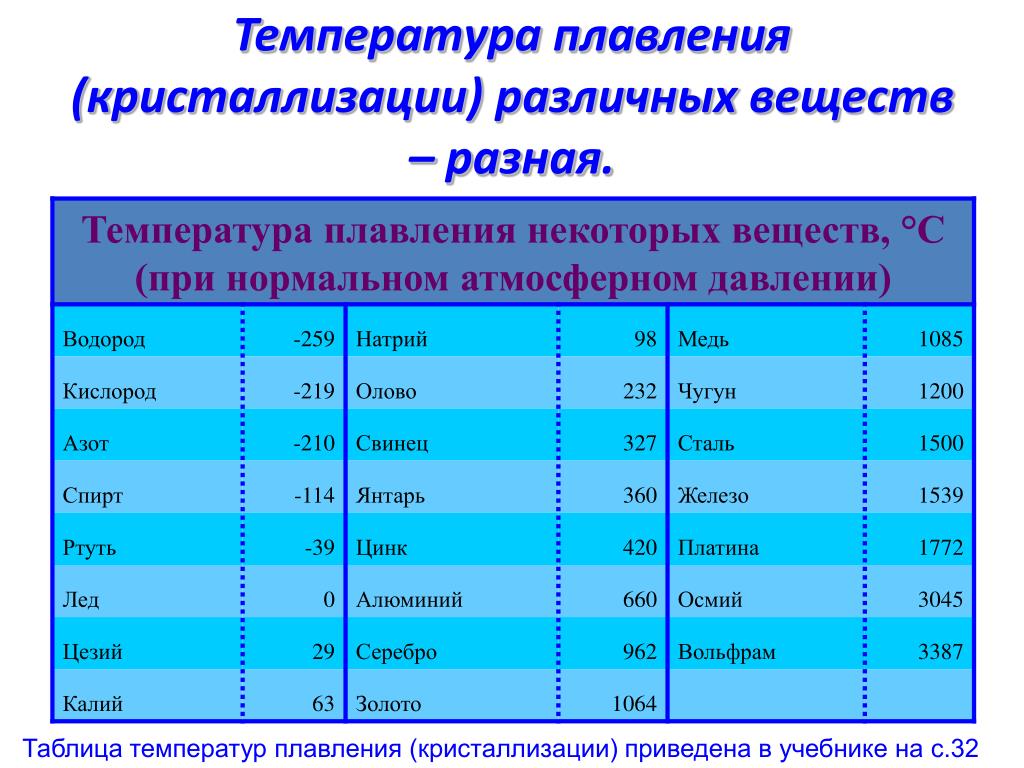
В горизонтальных конвертерах с боковым дутьём медный штейн продувается сжатым воздухом для того, чтобы произошли процессы окисления сульфидов и феррума. Далее образовавшиеся окислы переводят в шлак, а серу в оксид. В конвертере образуется черновая медь, которая содержит 98,4-99,4% меди, железо, серу, а также незначительное количество никеля, олова, серебра и золота.
Черновая медь подлежит огневому, а далее электролитическому рафинированию. Примеси удаляют с газами и переводят в шлак. В результате огневого рафинирования образуется медь с чистотой до 99,5%. А после электролитического рафинирования чистота составляет 99,95%.
2. Гидрометаллургический способ заключается в выщелачивании меди слабым раствором серной кислоты, а затем выделении металлической меди непосредственно из раствора. Такой способ применяется для переработки бедных руд и не допускает попутного извлечения драгоценных металлов вместе с медью.
Применение меди
Благодаря ценным качествам медь и медные сплавы используются в электротехнической и электромашиностроительной отрасли, в радиоэлектронике и приборостроении. Существуют сплавы меди с такими металлами, как цинк, олово, алюминий, никель, титан, серебро, золото. Реже применяются сплавы с неметаллами: фосфором, серой, кислородом. Выделяют две группы медных сплавов: латуни (сплавы с цинком) и бронзы (сплавы с другими элементами).
Существуют сплавы меди с такими металлами, как цинк, олово, алюминий, никель, титан, серебро, золото. Реже применяются сплавы с неметаллами: фосфором, серой, кислородом. Выделяют две группы медных сплавов: латуни (сплавы с цинком) и бронзы (сплавы с другими элементами).
Медь обладает высокой экологичностью, что допускает её использование в строительстве жилых домов. К примеру, медная кровля за счёт антикоррозионных свойств, может прослужить больше ста лет без специального ухода и покраски.
Медь в сплавах с золотом используется в ювелирном деле. Такой сплав увеличивает прочность изделия, повышает стойкость к деформированию и истиранию.
Для соединений меди характерна высокая биологическая активность. В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В медицине медь используют, как антисептическое и вяжущее средство. Она является компонентом глазных капель от конъюнктивита и растворов от ожогов.
Физические свойства и температура плавления золота и его сплавов
Наиболее важными физическими свойствами металлов, являются их точки плавления. Знание этого параметра позволяет эффективно сочетать различные компоненты и создавать удобные, долговечные и высококачественные сплавы. Для каждого вида металлов существует свой порог, при котором они переходят из одной формы вещества в другую. При определённой температуре они начинают плавиться, переходя от твёрдого состояния к жидкому. Если температура достигает критического значения, то металл будет поступать в газообразное состояние, то есть начинается процесс испарения.
- Точка температуры плавления золота, температура плавления сплавов
- Au: общий обзор
- Физические свойства Au
- Плотность металла
- Ковкость и пластичность
- Распространение Au в природе
- Область применения
- Сплавы золота
- Что определяет цвет золотых украшений?
По характеру воздействия температуры, все металлы делятся на три группы.
- Плавкие. Эта группа включает металлы, которые плавятся при температуре ниже 600 °C. Примеры: натрий, цинк, висмут, гал, олово, цезий и другие.
- Среднеплавкие. Плавятся в пределах 600−1600 °C.
- Устойчивые. Более 1600 °C. Примеры: титан, вольфрам, хром и другие.
Возникает резонный вопрос, при какой температуре плавится золото? Точка плавления Au в чистом виде составляет 1063 °C, поэтому его можно отнести ко второй группе.
Следует отметить, что эта классификация применима только для чистых металлов.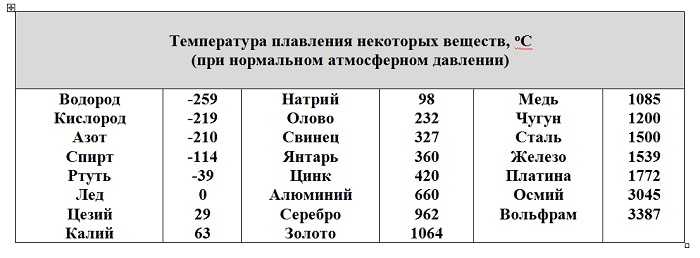 Когда дело доходит до сплавов, значения меняются, и могут отличаться от начального.
Когда дело доходит до сплавов, значения меняются, и могут отличаться от начального.
Точка кипения металлов намного выше, чем в указанных параметрах. Например, если температура плавления этого благородного металла составляет 1063 °C, то точка кипения достигает 2947 °C. Разница почти в два раза!
Au: общий обзор
Аурум или золото — это 79-й элемент в периодической таблице Менделеева. Атомная масса составляет 196,96654 а. е. м. (г/моль). Находится в первой группе периодической таблицы, относится к драгоценным металлам, вместе с:
- платиной;
- серебром;
- палладием.
С точки зрения, химической реакции инертна. Никаких ярко выраженных реакций не возникает. Обладает специфическими физическими свойствами, которые позволяют использовать его в ювелирных изделиях, технологии и промышленности.
Физические свойства Au
Что такого особенного в этом металле, блеск которого привлекает людей на протяжении многих веков и стал символом финансового процветания в мире?
- Цвет.
 Для чистого золота он характеризуется красивым темно-жёлтым цветом с характерным металлическим блеском. В жидком состоянии металл имеет бледно-зелёный цвет. Пары его жёлто-зелёного цвета.
Для чистого золота он характеризуется красивым темно-жёлтым цветом с характерным металлическим блеском. В жидком состоянии металл имеет бледно-зелёный цвет. Пары его жёлто-зелёного цвета. - Твёрдость. Это мягкий металл. В шкале твёрдости (шкала Мооса) показатель составляет 2,5−3.
- Температура плавления Au — 1063 °C.
- Электропроводность хорошая, 75% относительно меди в качестве сверхпроводника.
- Теплопроводность и теплоёмкость отличные. Золотые изделия быстро нагреваются и быстро остывают.
К свойствам, которые позволяют отнести золото к ценным металлам, относят:
- пластичность;
- плотность.
Плотность металла
Само понятие плотность, означает вес вещества на единицу объёма. Этот драгоценный металл имеет большое значение этого параметра. Например, половина стакана чистого золотого песка, будет иметь массу около 1 тыс.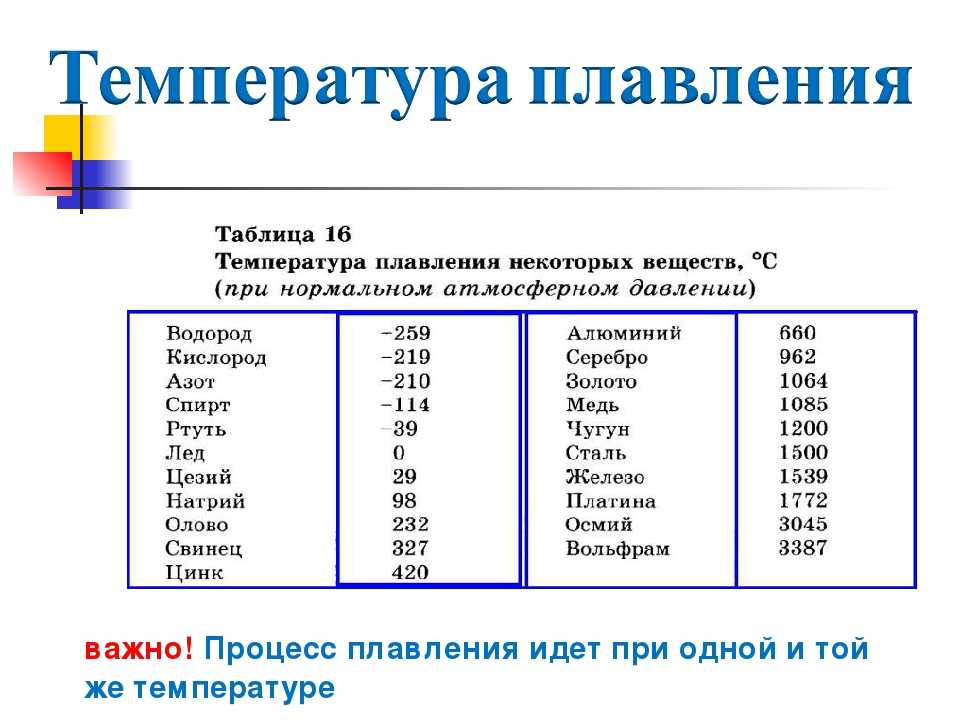 грамм.
грамм.
Плотность золота, очищенная от примесей, составляет 19,3 г/см 3. Говоря о промышленных, естественных породах золота, плотность несколько ниже от 18 до 18,2 г/см 3. Этот показатель позволяет технологически выгодно извлекать металл из горных пород, и делает золото дорогим.
Ковкость и пластичность
Точка температуры плавления золота, а также его высокая пластичность, делают его удобным и покорным в руках людей. Тончайшие листы из золота, которыми покрывают церковные купола, предметы интерьера и дизайна, не теряют яркого и красивого блеска. Из одного грамма, этого удивительного металла, может быть изготовлена очень тонкая проволока, длина которой будет близка к 3 тыс. м. Золото не меняет своих свойств при:
- сжатии;
- скручивании;
- шлифовании;
- прокатки;
- растяжении.
Конечно, такой набор физических свойств не мог оставаться незамеченным людьми, и поэтому золото используется в различных областях науки, техники и промышленности.
Распространение Au в природе
79 элемент периодической таблицы Менделеева, довольно широко распространён в природе, но в небольших количествах. Девяносто девять процентов этого металла, находящегося в самородном виде, заключено в недрах планеты. Но в рассеянном виде. По приблизительным подсчётам от 5 до 10 миллиардов тонн находится в мировом океане, его содержание варьируется от 32 до 64 мг на одну тонну морской воды.
Кроме того, Au содержится, в растениях и животных. Так, в 100 граммах кукурузы содержится 0,5 мкг благородного металла, а в человеке около 10 мг.
Область применения
Люди научились добывать Au для своих потребностей. Но где оно используется?
- Основная отрасль — это, конечно же, ювелирные изделия. Красивые украшения из различных сплавов золота являются главной особенностью финансового богатства почти каждой женщины.
 Они дарятся любимым, их инвестируют, ими восхищаются и ценят.
Они дарятся любимым, их инвестируют, ими восхищаются и ценят. - Бытовая техника. Температура плавления золота, платины и палладия, никеля и других металлов делает их незаменимыми в техническом применении. Au обладает высокой ковкостью и пластичностью в сочетании с химической инертностью позволяет использовать этот металл в мельчайших деталях. В телефонах, телевизорах, калькуляторах и других электронных устройствах.
- Золото — является твёрдой валютой по всему миру, которое никогда не обесценивается. Чтобы не бояться инфляции и дефолта, многие сохраняют свои сбережения в виде металлических слитков.
- Награды за достижения в различных видах спорта и играх проводятся в золоте, серебре и бронзе, что ещё раз подчёркивает их высокую ценность.
Сплавы золота
Изделия, выполненные из благородного металла, делают его не только популярным, но и придают ему определённые свойства. Ювелирные изделия, выполненные из чистого золота, легко деформируются, подвержены царапинам и истёртостям.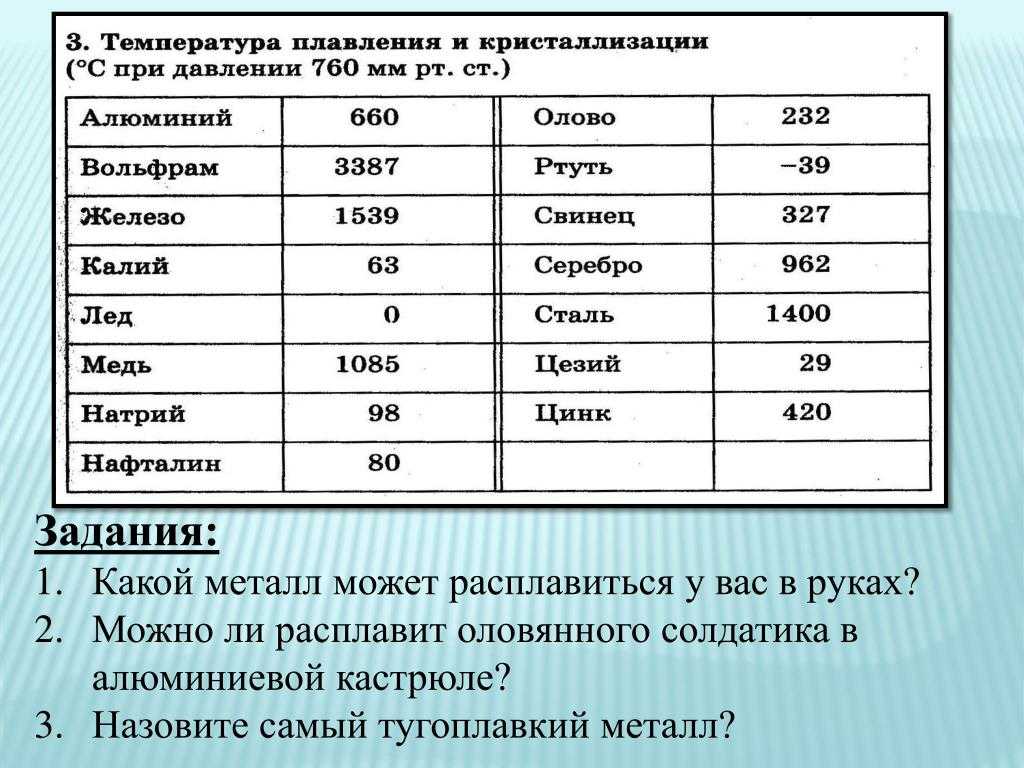 Поэтому часто используются сплавы с другими элементами периодической таблицы, позволяющими избежать этих недостатков.
Поэтому часто используются сплавы с другими элементами периодической таблицы, позволяющими избежать этих недостатков.
- Золото 585 пробы. Этот сплав является самым продаваемым в нашей стране и за рубежом. В состав сплава входит: 58,5% — чистое золото, 34% меди, 7,5% — серебро. Точка плавления составляет 585−840 °С, что намного меньше, чем в случае с чистым образцом. Однако в целом свойства сплава значительно лучше. Медь используется для увеличения прочности и твёрдости. Однако, если её слишком много, то изделие будет подвержено коррозии.
- Золото 999. По существу чистый металл с небольшим количеством меди. Поэтому температура плавления 999 пробы увеличивается по сравнению с предыдущим индексом. Составляет 1063 °C, это те же значения, что и чистого вещества. Изделия из этого мягкого сплава, способны к деформации, поэтому требуют тщательной обработки и проявления большой осторожности.
Что определяет цвет золотых украшений?
Какой цвет приобретёт производимое украшение зависит от типа компонентов в сплаве и их процентном соотношении. Красный оттенок будет иметь продукт, в котором золото и серебро составляют по 25% соответственно, а медь 50%. Белый цвет — если в сплав входят палладий, никель, серебро. Зелёный — серебро и медь. Розовое — серебро, палладий и медь.
Красный оттенок будет иметь продукт, в котором золото и серебро составляют по 25% соответственно, а медь 50%. Белый цвет — если в сплав входят палладий, никель, серебро. Зелёный — серебро и медь. Розовое — серебро, палладий и медь.
Какая температура плавления металлов. Температура кипения и плавления металлов
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления. При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
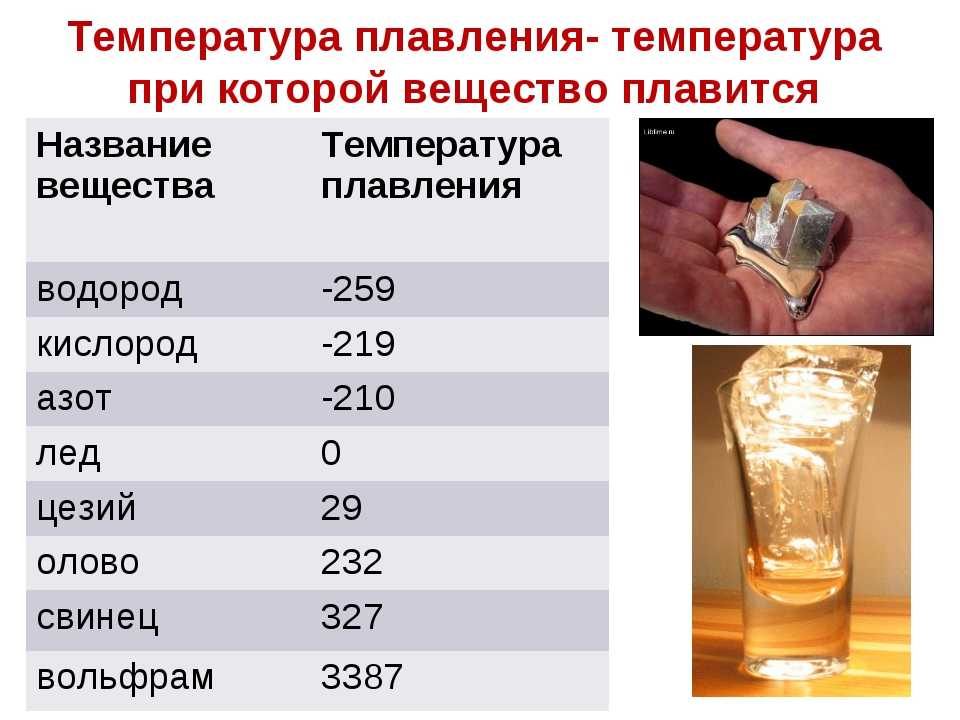
Наиболее низкая температура плавления у ртути — она плавится даже при -39 °C, самая высокая у вольфрама — 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них.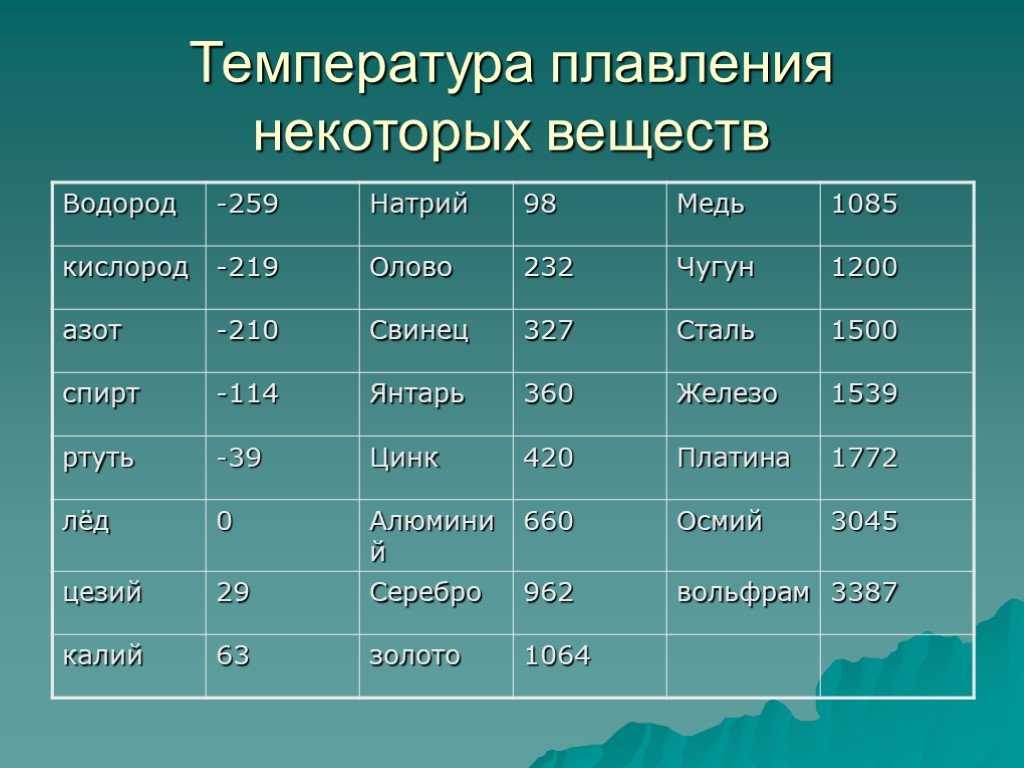 У сплавов она записывается как числовой промежуток.
У сплавов она записывается как числовой промежуток.
Как происходит процесс
Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой — плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании. Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты . Воздействие при этом примерно одинаковое.
Когда происходит нагревание , усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки , сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от градуса, при котором плавятся металлы, они разделяются на:
- легкоплавкие — до 600 °C: свинец, цинк, олово;
- среднеплавкие — от 600 °C до 1600 °C: золото, медь, алюминий, чугун, железо и большая часть всех элементов и соединений;
- тугоплавкие — от 1600 °C: хром, вольфрам, молибден, титан.

В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат. Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина — градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
Таблица характеристик
Металлы и сплавы — непременная основа для ковки , литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота , ограды из чугуна, ножи из стали или браслеты из меди) , для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий — 660 °C;
- температура плавления меди — 1083 °C;
- температура плавления золота — 1063 °C;
- серебро — 960 °C;
- олово — 232 °C. Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
- свинец — 327 °C;
- температура плавления железо — 1539 °C;
- температура плавления стали (сплав железа и углерода) — от 1300 °C до 1500 °C. Она колеблется в зависимости от насыщенности стали компонентами;
- температура плавления чугуна (также сплав железа и углерода) — от 1100 °C до 1300 °C;
- ртуть — -38,9 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл — ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления. Например, у золота он 2660 °C, у алюминия — 2519 °C , у железа — 2900 °C, у меди — 2580 °C, у ртути — 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов — у рения — 5596 °C . Наибольшая температура кипения — у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов . Самым лёгким металлом является литий, самым тяжёлым — осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа — очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах — это теплопроводность металлов . Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл — серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями.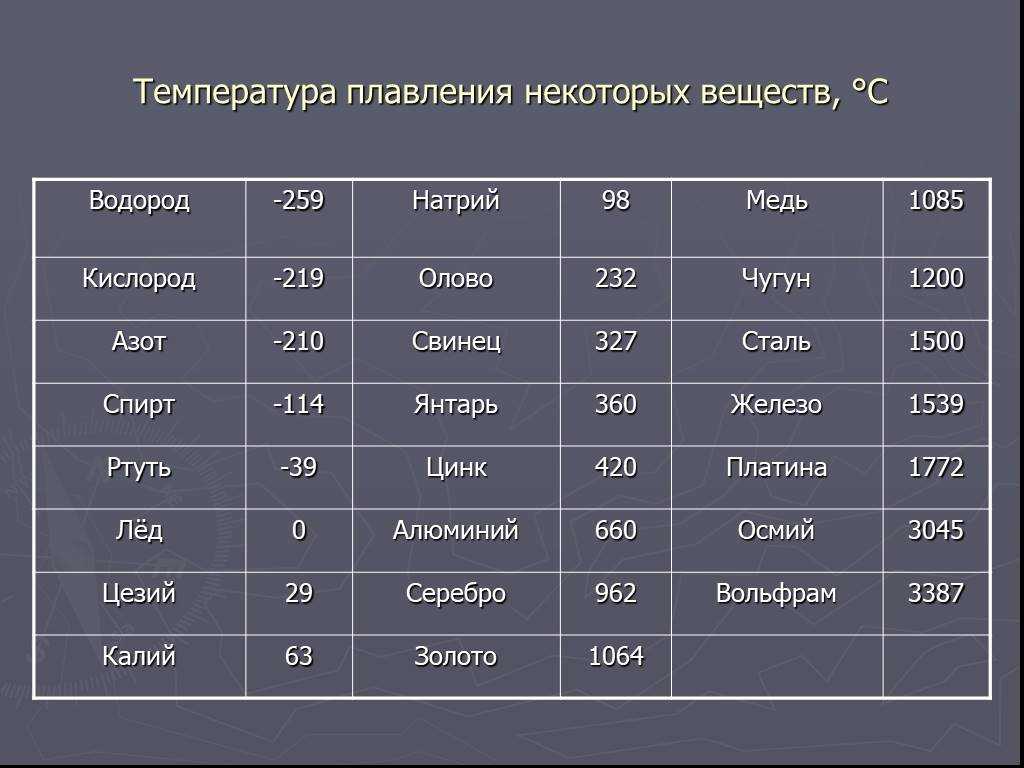 Чёткие характеристики для каждого можно найти в нужной таблице.
Чёткие характеристики для каждого можно найти в нужной таблице.
Температура плавления, наряду с плотностью, относится к физическим характеристикам металлов . Температура плавления металла — температура, при которой металл переходит из твердого состояния, в котором находится в нормальном состоянии (кроме ртути), в жидкое состояние при нагревании. При плавлении объем металла практически не изменяется, поэтому на температуру плавления нормальное атмосферное давление не влияет .
Температура плавления металлов находится в диапазоне от -39 градусов Цельсия до +3410 градусов . Для большинства металлов температура плавления высокая, однако, некоторые металлы можно расплавить в домашних условиях при нагревании на обычной горелке (олово, свинец).
Классификация металлов по температуре плавления
- Легкоплавкие металлы , температура плавления которых колеблется до 600 градусов Цельсия, например цинк, олово, висмут .
- Среднеплавкие металлы , которые плавятся при температуре от 600 до 1600 градусов Цельсия: такие как алюминий, медь, олово, железо .

- Тугоплавкие металлы , температура плавления которых достигает более 1600 градусов Цельсия — вольфрам, титан, хром и др.
- — единственный металл, находящийся при обычных условиях (нормальное атмосферное давление, средняя температура окружающей среды) в жидком состоянии. Температура плавления ртути составляет порядка -39 градусов по Цельсию.
Таблица температур плавления металлов и сплавов
| Металл | Температура плавления, градусов Цельсия |
| Алюминий | 660,4 |
| Вольфрам | 3420 |
| Дюралюмин | ~650 |
| Железо | 1539 |
| Золото | 1063 |
| Иридий | 2447 |
| Калий | 63,6 |
| Кремний | 1415 |
| Латунь | ~1000 |
| Легкоплавкий сплав | 60,5 |
| Магний | 650 |
| Медь | 1084,5 |
| Натрий | 97,8 |
| Никель | 1455 |
| Олово | 231,9 |
| Платина | 1769,3 |
| Ртуть | –38,9 |
| Свинец | 327,4 |
| Серебро | 961,9 |
| Сталь | 1300-1500 |
| Цинк | 419,5 |
| Чугун | 1100-1300 |
При плавлении металла для изготовления металлических изделий-отливок от температуры плавления зависит выбор оборудования, материала для формовки металла и др. Следует также помнить, что при легировании металла другими элементами температура плавления чаще всего снижается .
Следует также помнить, что при легировании металла другими элементами температура плавления чаще всего снижается .
Интересный факт
Не стоит путать понятия «температура плавления металла» и «температура кипения металла» — для многих металлов эти характеристики существенно отличаются: так, серебро плавится при температуре 961 градус по Цельсию, а закипает только при достижении нагрева до 2180 градусов.
Температура плавления металла – это минимальная температура, при которой он переходит из твердого состояния в жидкое. При плавлении его объем практически не изменяется. Металлы классифицируют по температуре плавления в зависимости от степени нагревания.
Легкоплавкие металлы
Легкоплавкие металлы имеют температуру плавления ниже 600°C. Это цинк, олово, висмут. Такие металлы можно расплавить в домашних условиях, разогрев их на плите, или с помощью паяльника. Легкоплавкие металлы используются в электронике и технике для соединения металлических элементов и проводов для движения электрического тока.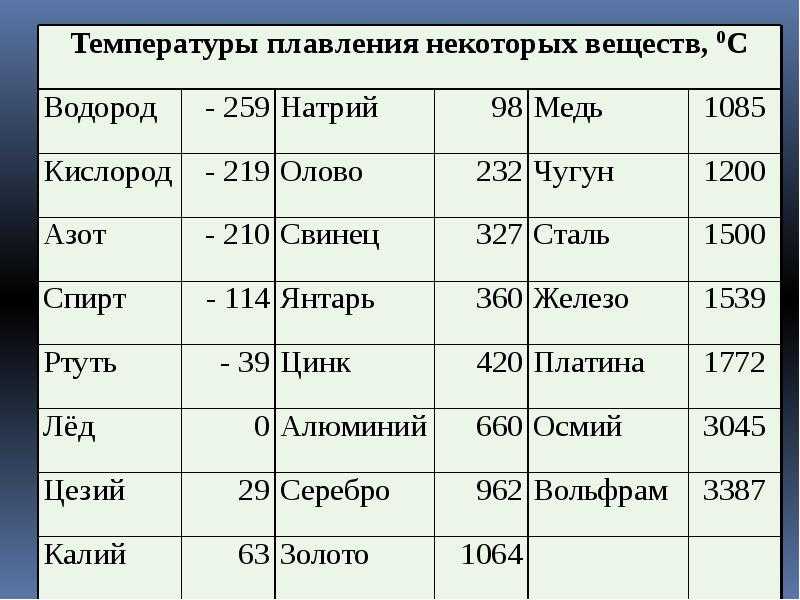 Температура плавления олова составляет 232 градуса, а цинка – 419.
Температура плавления олова составляет 232 градуса, а цинка – 419.
Среднеплавкие металлы
Среднеплавкие металлы начинают переходить из твердого в жидкое состояние при температуре от 600°C до 1600°C. Они используются для изготовления плит, арматур, блоков и других металлических конструкций, пригодных для строительства. К этой группе металлов относятся железо, медь, алюминий, они также входят в состав многих сплавов. Медь добавляют в сплавы драгоценных металлов, таких как золото, серебро, платина. Золото 750 пробы на 25% состоит из лигатурных металлов, в том числе и меди, которая придает ему красноватый оттенок. Температура плавления этого материала равна 1084 °C. А алюминий начинает плавиться при относительно низкой температуре, составляющей 660 градусов Цельсия. Это легкий пластичный и недорогой металл, который не окисляется и не ржавеет, поэтому широко используется при изготовлении посуды. Температура плавления железа равна 1539 градусов. Это один из самых популярных и доступных металлов, его применение распространено в строительстве и автомобильной промышленности.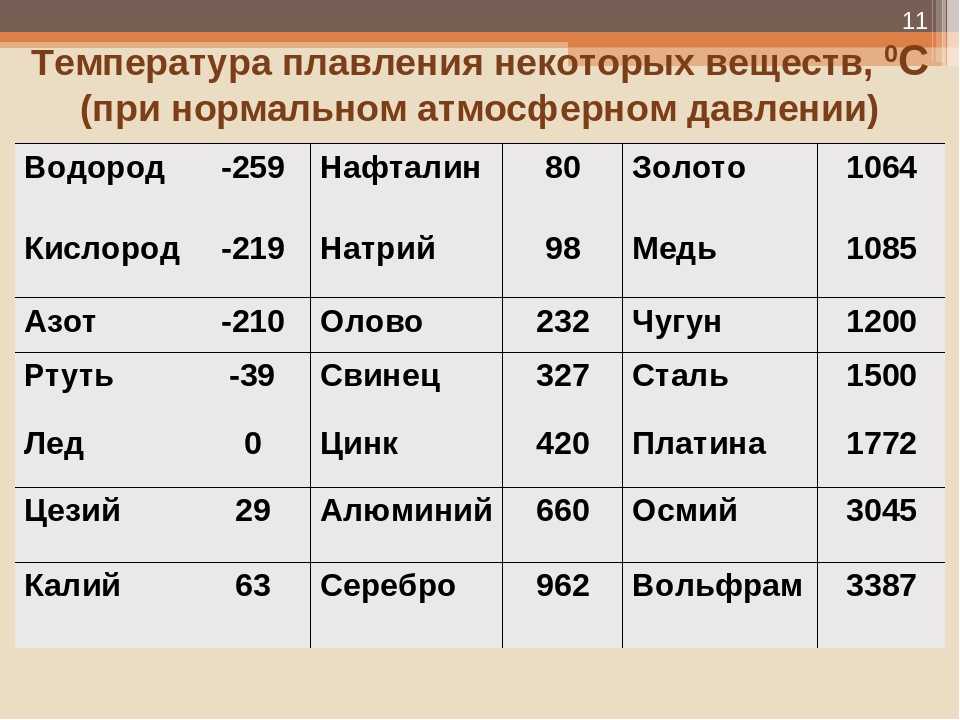 Но ввиду того, что железо подвергается коррозии, его нужно дополнительно обрабатывать и покрывать защитным слоем краски, олифы или не допускать попадания влаги.
Но ввиду того, что железо подвергается коррозии, его нужно дополнительно обрабатывать и покрывать защитным слоем краски, олифы или не допускать попадания влаги.
Тугоплавкие металлы
Температура тугоплавких металлов выше 1600°C. Это вольфрам, титан, платина, хром и другие. Их используют в качестве источников света, машинных деталей, смазочных материалов, а также в ядерной промышленности. Из них изготавливают проволоки, высоковольтные провода и используют для расплавки других металлов с более низкой температурой плавления. Платина начинает переходить из твердого в жидкое состояние при температуре 1769 градусов, а вольфрам – при температуре 3420°C.
Ртуть – единственный металл, находящийся в жидком состоянии при обычных условиях, а именно, нормальном атмосферном давлении и средней температуре окружающей среды. Температура плавления ртути составляет минус 39°C. Этот металл и его пары являются ядовитыми, поэтому он используется только в закрытых емкостях или в лабораториях. Распространенное применение ртути – градусник для измерения температуры тела.
Распространенное применение ртути – градусник для измерения температуры тела.
– первый по значимости и распространенности конструкционный материал. Известен он с глубокой древности, а свойства его таковы, что когда железо научились выплавлять в значимом количестве, металл вытеснил все остальные сплавы. Наступил век железа и, судя по , время это закончится нескоро. Данная статья расскажет вам, какова удельная плотность железа, какая у него температура плавления в чистом виде.
Железо – типичный металл, причем химически активный. Вещество вступает в реакцию при нормальной температуре, а нагрев или повышение влажности значительно увеличивают его реакционноспособность. Железо корродирует на воздухе, горит в атмосфере чистого кислорода, а в виде мелкой пыли способно воспламениться и на воздухе.
Чистому железу присуща ковкость, однако в таком виде металл встречается очень редко. На деле под железом подразумевают сплав с небольшими долями примесей – до 0,8%, которому присущи мягкость и ковкость чистого вещества.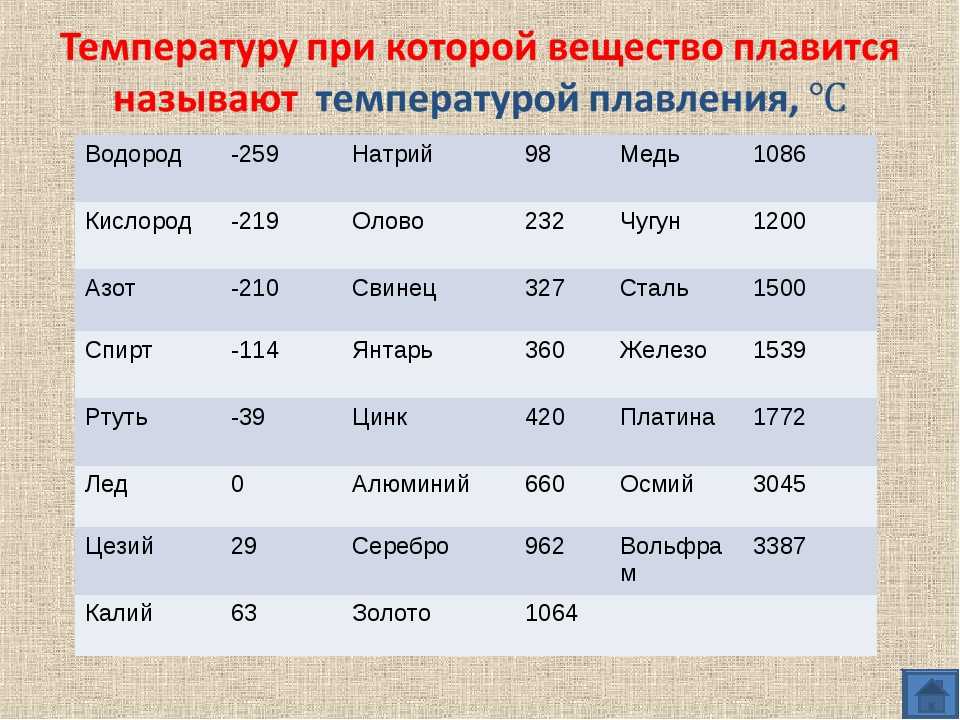 Значение для народного хозяйства имеет сплавы с углеродом – сталь, чугун, нержавеющая сталь.
Значение для народного хозяйства имеет сплавы с углеродом – сталь, чугун, нержавеющая сталь.
Железу присущ полиморфизм: выделяют целых 4 модификации, отличающиеся структурой и параметрами решетки:
- α-Fe – существует от нуля до +769 С. Имеет объемно-центрированную кубическую решетку и является ферромагнетиком, то есть, сохраняет намагниченность в отсутствие внешнего магнитного поля. +769 С – точки Кюри для металла;
- от +769 до +917 С появляется β-Fe. От α-фазы она отличается лишь параметрами решетки. Практически все физические свойства при этом сохраняются за исключением магнитных: железо становится парамагнетиком, то есть, способность намагничиваться оно утрачивает и втягивается в магнитное поле. Металловедение β-фазу как отдельную модификацию не рассматривает. Поскольку переход не влияет на значимые физические характеристики;
- в диапазоне от 917 до 1394 С существует γ-модификация, которой присуща гранецентрированная кубическая решетка;
- при температуре выше +1394 С появляется δ-фаза, для которой характерна объемно-центрированная кубическая решетка.

При высоком давлении, а также при легировании металла некоторыми добавками образуется ε- фаза с гексагонической плотноупакованной решеткой.
Температура фазовых переходов заметно изменяется при легировании тем же углеродом. Собственно, сама способность железа образовать столько модификаций служит основой обработки стали в разных температурных режимах. Без таких переходов металл не получил бы столь широкого распространения.
Теперь настал черед свойств металла железа.
О структуре железа рассказывает этот видеосюжет:
Свойства и характеристики металла
Железо – достаточно легкий, умеренно тугоплавкий металл, серебристо-серого цвета. Легко реагирует с разбавленными кислотами и поэтому считается элементом средней активности. На воздухе – сухом, металл постепенно покрывается пленкой оксида, которая препятствует дальнейшей реакции.
Но при самой небольшой влажности вместо пленки появляется ржавчина – рыхлая и неоднородная по составу. Ржавчина дальнейшей коррозии железа не препятствует.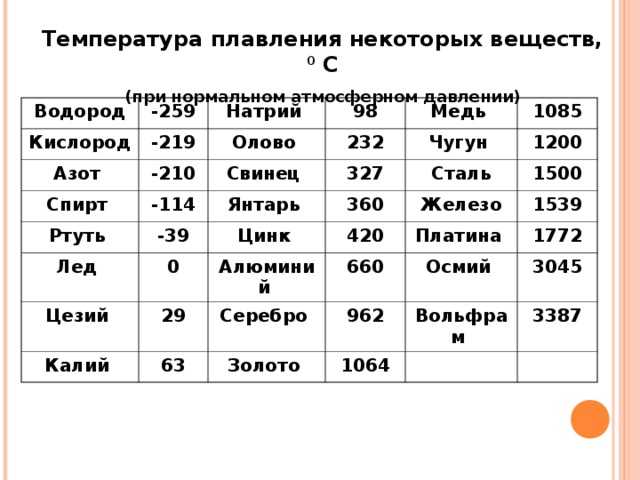 Однако физические свойства металла, а, главное, его сплавов с углеродом таковы, что, несмотря на низкую коррозийную стойкость, использование железа более чем оправдано.
Однако физические свойства металла, а, главное, его сплавов с углеродом таковы, что, несмотря на низкую коррозийную стойкость, использование железа более чем оправдано.
Масса и плотность
Молекулярная масса железа составляет 55,8, что указывает на относительную легкость вещества. А какая же у железа плотность? Такой показатель определяется фазовой модификацией:
- α-Fe – 7,87 г/куб. см при 20 С, и 7,67 г/куб. см при 600 С;
- γ-фаза отличается еще более низкой плотностью – 7,59 г/куб см при 1000С;
- плотность δ-фазы составляет 7,409 г/куб см.
С повышением температуры плотность железа закономерно падает.
А теперь давайте узнаем, какова температура плавления железа по Цельсию, сравнивая ее, например, с или чугуном.
Температурный диапазон
Металл относится к умеренно тугоплавким, что означает сравнительно невысокую температуру изменения агрегатного состояния:
- температура плавления – 1539 С;
- температура кипения – 2862 С;
- температура Кюри, то есть, утраты способности к намагничиванию – 719 С.

Стоит иметь в виду, что когда говорят о температуре плавления или кипения, имеют дело с δ-фазой вещества.
Данное видео поведает вам о физических и химических свойствах железа:
Механические характеристики
Железо и его сплавы настолько распространены, что хотя и стали использоваться позже чем, например, и , стали своеобразными эталонами. Когда сравнивают металлы, указывают на железо: крепче, чем сталь, мягче железа в 2 раза и так далее.
Характеристики приводятся для металла, включающего малые доли примесей:
- твердость по шкале Мооса – 4–5;
- твердость по Бринеллю – 350–450 Мн/кв. м. Причем у химически чистого железа твердость выше – 588–686;
Показатели прочности исключительно сильно зависят от количества и характера примесей. Эта величина регламентируется ГОСТом для каждой марки сплава или чистого метала. Так, предел прочности на сжатие для нелегированной стали составляет 400–550 МПа. При закалке этой марки предел прочности при растяжении увеличивается до 700 МПа.
- ударная вязкость металла составляет 300 Мн/кв м;
- предел текучести –100 Мн/кв. м.
О том, что надо для определения удельной теплоемкости железа, узнаем далее.
Теплоемкость и теплопроводность
Как и всякий металл, железо проводит тепло, хотя показатели его в этой области невысоки: по теплопроводности металл уступает алюминию – в 2 раза меньше, и – в 5 раз.
Теплопроводность при 25 С составляет 74,04 вт/(м·К). Величина зависит от температуры;
- при 100 к теплопроводность составляет 132 [Вт/(м.К)];
- при 300 К – 80,3 [Вт/(м.К)];
- при 400 – 69,4 [Вт/(м.К)];
- а при 1500 – 31,8 [Вт/(м.К)].
- Коэффициент температурного расширения при 20 С – 11,7·10-6.
- Теплоемкость металла определяется его фазовой структурой и довольно сложно зависит от температуры. С повышением до 250 С, теплоемкость медленно увеличивается, затем резко возрастает до достижения точки Кюри, а потом начинается снижаться.
- Удельная теплоемкость в температурном диапазоне от 0 до 1000С составляет 640,57 дж/(кг·К).

Электропроводность
Железо проводит ток, но далеко не так хорошо, как медь и серебро. Удельное электрическое сопротивление металла при нормальных условиях – 9,7·10-8 ом·м.
Поскольку железо является ферромагнетиком, его показатели в этой области более значимы:
- магнитная индукция насыщения составляет 2,18 Тл;
- магнитная проницаемость – 1,45.106.
Токсичность
Металл не представляет опасности для человеческого организма. стали и изготовления изделий из железа могут быть опасными, но только за счет высоких температур и тех добавок, которые используют при производстве различных сплавов. Отходы железа – металлолом, представляют опасность для окружающей среды, но вполне умеренную, поскольку металл ржавеет на воздухе.
Железо не обладает биологической инертностью, поэтому как материал для протезирования не используется. Однако в человеческом организме этот элемент играет одну из важнейших ролей: нарушение в усвоении железа или недостаточное количество последнего в рационе гарантирует в лучшем случае анемию.
Усваивается железо с большим трудом – 5–10% от всего количества, поступаемого в организм, или 10–20%, если наблюдается его недостаток.
- Обычная суточная потребность в железе составляет 10 мг для мужчин и 20 мг для женщин.
- Токсическая доза – 200 мг/сутки.
- Летальная – 7–35 г. Получить такое количество железа практически невозможно, поэтому отравление железом встречается крайне редко.
Железо – металл, чьи физические характеристики, в частности, прочность, можно существенно изменить, прибегая к механической обработке или добавке очень небольшого количества легирующих элементов. Эта особенность в сочетании с доступностью и легкостью добычи металла делает железо самым востребованным конструкционным материалом.
Еще больше о свойствах железа расскажет специалистка в видео ниже:
Металлы плавятся, как правило, при очень высокой температуре, которая может достигать более 3 тыс. градусов. Хотя некоторые из них можно расплавить в домашних условиях, например, свинец или олово. А вот ртуть плавят при температуре минус 39 градусов. В домашних условиях этого добиться не удастся. Температура плавления — это один из важных показателей производства не только самого металла, но и его сплавов. Выплавляя сырье, специалисты учитывают и другие физические и химические свойства руды и металла.
А вот ртуть плавят при температуре минус 39 градусов. В домашних условиях этого добиться не удастся. Температура плавления — это один из важных показателей производства не только самого металла, но и его сплавов. Выплавляя сырье, специалисты учитывают и другие физические и химические свойства руды и металла.
Железо и его свойства
Железо — это химический элемент, который в таблице Менделеева находится под номером 26. Это один из самых распространенных элементов во всей Солнечной системе. Согласно материалам исследований, в составе ядра Земли находится примерно 79−85% этого вещества . В земной коре его тоже присутствует большое количество, но оно уступает алюминию.
В чистом виде металл имеет белый цвет с чуть серебристым оттенком. Он пластичен, но имеющиеся в нем примеси могут определять его физические свойства. Реагирует на магнит.
Железо присутствует в воде. В речных водах его концентрация равна примерно 2 мг/л металла. В морской воде его содержание может быть ниже в сто или даже тысячу раз.
Оксид железа — это основная форма, добыча которой осуществляется и которая находится в природе. Оксидное железо может располагаться в самой верхней части земной коры и быть составляющей осадочных образований.
Элемент, находящийся на двадцать шестом месте в таблице Менделеева, может иметь несколько степеней окисления. Именно они определяют его геохимическую особенность нахождения в определенной среде. В ядре Земли металл присутствует в нейтральной форме.
Добыча полезных ископаемых
Руд, в которых присутствует железо, существует несколько. Однако, в качестве сырья для производства железа в промышленности используют в основном следующие:
- магнезитовую руду;
- гетитовую руду;
- гематитовую руду.
А также часто встречаются такие разновидности руды:
Существует еще минерал под названием мелантерит . Его используют преимущественно в фармацевтической промышленности. Из себя он представляет зелёного цвета хрупкие кристаллы, в которых присутствует стеклянный блеск. Из него производят лекарственные препараты, в составе которых имеется ферум.
Из него производят лекарственные препараты, в составе которых имеется ферум.
Основным месторождением этого металла является Южная Америка, а именно Бразилия.
Плавление железа и необходимая температура
Точкой плавления металла называют такую минимальную температуру, при которой он переходит из твердого состояния в жидкое. При этом в объеме он практически остается неизменным.
Металл могут производить из руды различными способами, но самый основной из них — это доменный . Помимо доменного, используют еще выплавку железа при помощи обжига измельченной руды с примесью глины. Из полученной смеси формируют окатыши, которые обрабатываются в печи с последующим восстановлением водородом. Далее плавление железа осуществляется в электрической печи.
Температура плавления железа весьма высока. Для технически чистого элемента она составляет +1539 °C. В этом веществе присутствует примесь — Сера, которую можно извлечь лишь в жидком виде. Без примесей чистый материал получают при электролизе солей металла.
Классификация металлов по температуре плавления
Разные металлы могут переходить в жидкое состояние при разной температуре. Вследствие этого выделяют определённую классификацию. Их делят следующим образом:
- Легкоплавкие — те элементы, которые могут становиться жидкими уже при температуре ниже 600 градусов. К ним относят цинк, олово, свинец и пр. Их можно расплавить даже в домашних условиях — просто нужно разогреть при помощи плиты или паяльника. Такие виды нашли применение в технике и электронике. Они используются для соединения элементов из металла и движения электрического тока. Олово плавится при 232 градусах, а цинк — при 419 градусах.
- Среднеплавкие — элементы, которые начинают расплавляться при температуре от шестисот до тысячи шестисот градусов. Эти элементы используют по большей части для строительных элементов и металлоконструкций, то есть при создании арматур, плит и строительных блоков. В эту группу входят: железо, медь, алюминий.
 Температура плавления алюминия сравнительно низка и составляет 660 градусов. А вот железо начинает переходить в жидкое состояние лишь при температуре 1539 градусов. Это один из самых распространенных металлов, используемых в промышленности, особенно в автомобильной. Однако железо подвержено коррозии, то есть ржавчине, поэтому ему требуется специальная поверхностная обработка. Его необходимо покрывать краской или олифой, и не допускать попадание влаги.
Температура плавления алюминия сравнительно низка и составляет 660 градусов. А вот железо начинает переходить в жидкое состояние лишь при температуре 1539 градусов. Это один из самых распространенных металлов, используемых в промышленности, особенно в автомобильной. Однако железо подвержено коррозии, то есть ржавчине, поэтому ему требуется специальная поверхностная обработка. Его необходимо покрывать краской или олифой, и не допускать попадание влаги. - Тугоплавкие — это такие материалы, которые расплавляются и становятся жидкими при температуре выше 1600 градусов. В эту группу относят вольфрам, титан, платину, хром и т. п. Они используются в ядерной промышленности и для некоторых машинных деталей. Они могут применяться для расплавки других металлов, изготовления высоковольтных проводов или проволоки. Платину можно расплавить при 1769 градусах, а вольфрам — при 3420 °C.
Единственный элемент, который при обычных условиях находится в жидком состоянии — это ртуть. Температура его плавления составляет минус 39 градусов и его пары являются ядовитыми, поэтому его используют только в лабораториях и закрытых ёмкостях.
Температура его плавления составляет минус 39 градусов и его пары являются ядовитыми, поэтому его используют только в лабораториях и закрытых ёмкостях.
Железом человек начал владеть (ковать, плавить) спустя несколько тысячелетий после освоения работ с медью. Первое самородное железо в виде комков было найдено на Ближнем Востоке в 3000 году А металлургия железа, по мнению специалистов, возникла в нескольких местах планеты, разные народы осваивали этот процесс в разное время. Благодаря этому железо как материал для изготовления орудий труда, охоты и войны вытеснило камень и бронзу.
Первые процессы изготовления железа назывались сыродутными. Суть заключалась в том, что в яму засыпалась железная руда с древесным углем, который разжигали и плотно закупоривали, оставляя дутьевое отверстие, через которое подавался свежий воздух для дутья. В процессе такого нагрева температура плавления железа, конечно, не могла быть достигнута, получалась размягченная масса (крица), в которой находился шлак (зола от топлива, окислы руды и породы).
Далее полученную крицу несколько раз проковывали, удаляя шлак и другие не нужные включения, этот трудоемкий процесс производился по несколько раз, в результате чего из общей массы до финишной операции доходила пятая часть. С изобретением водяного колеса появилась возможность подавать значительное количество воздуха. Благодаря такому дутью температура плавления железа стала достижимой, появился металл в жидком виде.
Этим металлом был чугун, который не ковался, но было замечено, что он хорошо заполняет форму. Это были первые опыты по которое с некоторыми усовершенствованиями и изменениями дошло до наших дней. Со временем был найден способ переработки чугуна в сварочное железо. Куски чугуна загружались с древесным углем, в ходе этого процесса чугун размягчался, происходило окисление примесей, в том числе углерода. В результате чего металл становился густым, температура плавления железа повышалась, т.е. получалось сварочное железо.
Таким образом, металлурги того времени смогли разделить единый процесс на две ступени. Этот двухступенчатый процесс в самой идее сохранился до настоящего времени, изменения в большей степени касаются появлению процессов, происходящих на втором этапе. Чистое железо или металл, имеющий минимум примесей, практического применения почти не имеет. Температура плавления железа по диаграмме железо — углерод находится в точке А, что соответствует 1535 градусам.
Этот двухступенчатый процесс в самой идее сохранился до настоящего времени, изменения в большей степени касаются появлению процессов, происходящих на втором этапе. Чистое железо или металл, имеющий минимум примесей, практического применения почти не имеет. Температура плавления железа по диаграмме железо — углерод находится в точке А, что соответствует 1535 градусам.
Железа наступает при достижении отметки 3200 градусов.
На открытом воздухе железо со временем покрывается оксидной пленкой, во влажной среде появляется рыхлый слой ржавчины. Железо с момента его появления и по сегодняшний день является одним из главных металлов. Используется железо, главным образом, в виде сплавов, которые различаются по свойствам и составу.
При какой температуре плавится железо, зависит от содержания углерода и других компонентов, входящих в состав сплава. Наибольшее применение имеют углеродистые сплавы — чугун и сталь. Сплавы, содержащие углерод более 2%, называют чугуном, менее 2% относятся к стали. Чугун получают в доменных печах, путем переплава обогащенных на аглофабрике руд.
Чугун получают в доменных печах, путем переплава обогащенных на аглофабрике руд.
В мартеновских, электрических и индукционных печах, в конвертерах.
В качестве шихты применяется металлический лом и чугун. Путем окислительных процессов из шихты удаляется лишний углерод и вредные примеси, а добавки легирующих материалов позволяют получить нужную Для получения стали и других сплавов современные металлургия использует технологии электрошлакового переплава, вакуумные, электронно-лучевые и плазменные плавки.
В разработке находятся новые методы плавления стали, предусматривающие автоматизацию процесса и обеспечивающие получение высококачественного металла.
Научные разработки достигли такого уровня, когда можно получать материалы, выдерживающие вакуум и большое давление, большие температурные перепады, агрессивную среду, радиационные излучения и т.п.
В металлургической промышленности одним из основных направлений считается литье металлов и их сплавов по причине дешевизны и относительной простоты процесса. Отливаться могут формы с любыми очертаниями различных габаритов, от мелких до крупных; это подходит как для массового, так и для индивидуального производства.
Отливаться могут формы с любыми очертаниями различных габаритов, от мелких до крупных; это подходит как для массового, так и для индивидуального производства.
Литье является одним из древнейших направлений работы с металлами, и начинается примерно с бронзового века: 7−3 тысячелетия до н. э. С тех пор было открыто множество материалов, что приводило к развитию технологии и повышению требований к литейной промышленности.
В наши дни существует много направлений и видов литья, различающихся по технологическому процессу. Одно остается неизменным — физическое свойство металлов переходить из твердого состояния в жидкое, и важно знать то, при какой температуре начинается плавление разных видов металлов и их сплавов.
Процесс плавления металла
Данный процесс обозначает собой переход вещества из твердого состояния в жидкое. При достижении точки плавления металл может находиться как в твердом, так и в жидком состоянии, дальнейшее возрастание приведет к полному переходу материала в жидкость.
То же самое происходит и при застывании — при достижении границы плавления вещество начнет переходить из жидкого состояния в твердое, и температура не изменится до полной кристаллизации.
При этом следует помнить, что данное правило применимо только для чистого металла. Сплавы не имеют четкой границы температур и совершают переход состояний в некотором диапазоне:
- Солидус — линия температуры, при которой начинает плавиться самый легкоплавкий компонент сплава.
- Ликвидус — окончательная точка плавления всех компонентов, ниже которой начинают появляться первые кристаллы сплава.
Точно измерить температуру плавления таких веществ невозможно, точкой перехода состояний указывается числовой промежуток.
В зависимости от температуры, при которой начинается плавление металлов, их принято разделять на:
- Легкоплавкие, до 600 °C. К ним относятся , цинк, свинец и другие.
- Среднеплавкие, до 1600 °C. Большинство распространенных сплавов, и такие металлы как золото, серебро, медь, железо, алюминий.

- Тугоплавкие, свыше 1600 °C. Титан, молибден, вольфрам, хром.
Также существует и температура кипения — точка, при достижении которой расплавленный металл начнет переход в газообразное состояние. Это очень высокая температура, как правило, в 2 раза превышающая точку расплава.
Влияние давления
Температура плавления и равная ей температура затвердевания зависят от давления, возрастая с его повышением. Это обусловлено тем, что при повышении давления атомы сближаются между собой, а для разрушения кристаллической решетки их нужно отдалить. При повышенном давлении требуется большая энергия теплового движения и соответствующая ей температура плавления увеличивается.
Существуют исключения, когда температура, необходимая для перехода в жидкое состояние, при повышенном давлении уменьшается. К таким веществам относят лёд, висмут, германий и сурьма.
Таблица температур плавления
Любому человеку, связанному с металлургической промышленностью, будь то сварщик, литейщик, плавильщик или ювелир, важно знать температуры, при которых происходит расплав материалов, с которыми он работает. В нижеприведенной таблице указаны точки плавления наиболее распространенных веществ.
В нижеприведенной таблице указаны точки плавления наиболее распространенных веществ.
Таблица температур плавления металлов и сплавов
| Название | T пл, °C |
|---|---|
| Алюминий | 660,4 |
| Медь | 1084,5 |
| Олово | 231,9 |
| Цинк | 419,5 |
| Вольфрам | 3420 |
| Никель | 1455 |
| Серебро | 960 |
| Золото | 1064,4 |
| Платина | 1768 |
| Титан | 1668 |
| Дюралюминий | 650 |
| Углеродистая сталь | 1100−1500 |
| 1110−1400 | |
| Железо | 1539 |
| Ртуть | -38,9 |
| Мельхиор | 1170 |
| Цирконий | 3530 |
| Кремний | 1414 |
| Нихром | 1400 |
| Висмут | 271,4 |
| Германий | 938,2 |
| Жесть | 1300−1500 |
| Бронза | 930−1140 |
| Кобальт | 1494 |
| Калий | 63 |
| Натрий | 93,8 |
| Латунь | 1000 |
| Магний | 650 |
| Марганец | 1246 |
| Хром | 2130 |
| Молибден | 2890 |
| Свинец | 327,4 |
| Бериллий | 1287 |
| Победит | 3150 |
| Фехраль | 1460 |
| Сурьма | 630,6 |
| карбид титана | 3150 |
| карбид циркония | 3530 |
| Галлий | 29,76 |
Помимо таблицы плавления, существует много других вспомогательных материалов. Например, ответ на вопрос, какова температура кипения железа лежит в таблице кипения веществ. Помимо кипения, у металлов есть ряд других физических свойств, как прочность.
Например, ответ на вопрос, какова температура кипения железа лежит в таблице кипения веществ. Помимо кипения, у металлов есть ряд других физических свойств, как прочность.
Помимо способности перехода из твердого в жидкое состояние, одним из важных свойств материала является его прочность — возможность твердого тела сопротивлению разрушению и необратимым изменениям формы. Основным показателем прочности считается сопротивление возникающее при разрыве заготовки, предварительно отожженной. Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Обозначение прочности принято в МПа — Мега Паскалях.
Существуют следующие группы прочности металлов:
- Непрочные. Их сопротивление не превышает 50МПа. К ним относят олово, свинец, мягкощелочные металлы
- Прочные, 50−500МПа. Медь, алюминий, железо, титан. Материалы этой группы являются основой многих конструкционных сплавов.
- Высокопрочные, свыше 500МПа. Например, молибден и .
Таблица прочности металлов
Наиболее распространенные в быту сплавы
Как видно из таблицы, точки плавления элементов сильно разнятся даже у часто встречающихся в быту материалов.
Так, минимальная температура плавления у ртути -38,9 °C, поэтому в условиях комнатной температуры она уже в жидком состоянии. Именно этим объясняется то, что бытовые термометры имеют нижнюю отметку в -39 градусов Цельсия: ниже этого показателя ртуть переходит в твердое состояние.
Припои, наиболее распространенные в бытовом применении, имеют в своем составе значительный процент содержания олова, имеющего точку плавления 231.9 °C, поэтому большая часть припоев плавится при рабочей температуре паяльника 250−400°C.
Помимо этого, существуют легкоплавкие припои с более низкой границей расплава, до 30 °C и применяются тогда, когда опасен перегрев спаиваемых материалов. Для этих целей существуют припои с висмутом, и плавка данных материалов лежит в интервале от 29,7 — 120 °C.
Расплавление высокоуглеродистых материалов в зависимости от легирующих компонентов лежит в границах от 1100 до 1500 °C.
Точки плавления металлов и их сплавов находятся в очень широком температурном диапазоне, от очень низких температур (ртуть) до границы в несколько тысяч градусов. Знание этих показателей, а так же других физических свойств очень важно для людей, которые работают в металлургической сфере. Например, знание того, при какой температуре плавится золото и другие металлы пригодятся ювелирам, литейщикам и плавильщикам.
Знание этих показателей, а так же других физических свойств очень важно для людей, которые работают в металлургической сфере. Например, знание того, при какой температуре плавится золото и другие металлы пригодятся ювелирам, литейщикам и плавильщикам.
Бизнес
Температура плавления и кипения металлов и неметаллов
Содержание
- Процесс плавления металла
- Влияние давления
- Таблица температур плавления
- Прочность металлов
- Наиболее распространенные в быту сплавы
- Как происходит процесс
- В зависимости от градуса, при котором плавятся металлы, они разделяются на:
- Таблица характеристик
- Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- Ответ
- Ответ
В металлургической промышленности одним из основных направлений считается литье металлов и их сплавов по причине дешевизны и относительной простоты процесса. Отливаться могут формы с любыми очертаниями различных габаритов, от мелких до крупных; это подходит как для массового, так и для индивидуального производства.
Литье является одним из древнейших направлений работы с металлами, и начинается примерно с бронзового века: 7−3 тысячелетия до н. э. С тех пор было открыто множество материалов, что приводило к развитию технологии и повышению требований к литейной промышленности.
В наши дни существует много направлений и видов литья, различающихся по технологическому процессу. Одно остается неизменным — физическое свойство металлов переходить из твердого состояния в жидкое, и важно знать то, при какой температуре начинается плавление разных видов металлов и их сплавов.
Процесс плавления металла
Данный процесс обозначает собой переход вещества из твердого состояния в жидкое. При достижении точки плавления металл может находиться как в твердом, так и в жидком состоянии, дальнейшее возрастание приведет к полному переходу материала в жидкость.
То же самое происходит и при застывании — при достижении границы плавления вещество начнет переходить из жидкого состояния в твердое, и температура не изменится до полной кристаллизации.
При этом следует помнить, что данное правило применимо только для чистого металла. Сплавы не имеют четкой границы температур и совершают переход состояний в некотором диапазоне:
- Солидус — линия температуры, при которой начинает плавиться самый легкоплавкий компонент сплава.
- Ликвидус — окончательная точка плавления всех компонентов, ниже которой начинают появляться первые кристаллы сплава.
Точно измерить температуру плавления таких веществ невозможно, точкой перехода состояний указывается числовой промежуток.
В зависимости от температуры, при которой начинается плавление металлов, их принято разделять на:
- Легкоплавкие, до 600 °C. К ним относятся олово, цинк, свинец и другие.
- Среднеплавкие, до 1600 °C. Большинство распространенных сплавов, и такие металлы как золото, серебро, медь, железо, алюминий.
- Тугоплавкие, свыше 1600 °C. Титан, молибден, вольфрам, хром.

Также существует и температура кипения — точка, при достижении которой расплавленный металл начнет переход в газообразное состояние. Это очень высокая температура, как правило, в 2 раза превышающая точку расплава.
Влияние давления
Температура плавления и равная ей температура затвердевания зависят от давления, возрастая с его повышением. Это обусловлено тем, что при повышении давления атомы сближаются между собой, а для разрушения кристаллической решетки их нужно отдалить. При повышенном давлении требуется большая энергия теплового движения и соответствующая ей температура плавления увеличивается.
Существуют исключения, когда температура, необходимая для перехода в жидкое состояние, при повышенном давлении уменьшается. К таким веществам относят лёд, висмут, германий и сурьма.
Таблица температур плавления
Любому человеку, связанному с металлургической промышленностью, будь то сварщик, литейщик, плавильщик или ювелир, важно знать температуры, при которых происходит расплав материалов, с которыми он работает. В нижеприведенной таблице указаны точки плавления наиболее распространенных веществ.
В нижеприведенной таблице указаны точки плавления наиболее распространенных веществ.
Таблица температур плавления металлов и сплавов
| Название | T пл, °C |
|---|---|
| Алюминий | 660,4 |
| Медь | 1084,5 |
| Олово | 231,9 |
| Цинк | 419,5 |
| Вольфрам | 3420 |
| Никель | 1455 |
| Серебро | 960 |
| Золото | 1064,4 |
| Платина | 1768 |
| Титан | 1668 |
| Дюралюминий | 650 |
| Углеродистая сталь | 1100−1500 |
| Чугун | 1110−1400 |
| Железо | 1539 |
| Ртуть | -38,9 |
| Мельхиор | 1170 |
| Цирконий | 3530 |
| Кремний | 1414 |
| Нихром | 1400 |
| Висмут | 271,4 |
| Германий | 938,2 |
| Жесть | 1300−1500 |
| Бронза | 930−1140 |
| Кобальт | 1494 |
| Калий | 63 |
| Натрий | 93,8 |
| Латунь | 1000 |
| Магний | 650 |
| Марганец | 1246 |
| Хром | 2130 |
| Молибден | 2890 |
| Свинец | 327,4 |
| Бериллий | 1287 |
| Победит | 3150 |
| Фехраль | 1460 |
| Сурьма | 630,6 |
| карбид титана | 3150 |
| карбид циркония | 3530 |
| Галлий | 29,76 |
Помимо таблицы плавления, существует много других вспомогательных материалов. Например, ответ на вопрос, какова температура кипения железа лежит в таблице кипения веществ. Помимо кипения, у металлов есть ряд других физических свойств, как прочность.
Например, ответ на вопрос, какова температура кипения железа лежит в таблице кипения веществ. Помимо кипения, у металлов есть ряд других физических свойств, как прочность.
Прочность металлов
Помимо способности перехода из твердого в жидкое состояние, одним из важных свойств материала является его прочность — возможность твердого тела сопротивлению разрушению и необратимым изменениям формы. Основным показателем прочности считается сопротивление возникающее при разрыве заготовки, предварительно отожженной. Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Обозначение прочности принято в МПа — Мега Паскалях.
Существуют следующие группы прочности металлов:
- Непрочные. Их сопротивление не превышает 50МПа. К ним относят олово, свинец, мягкощелочные металлы
- Прочные, 50−500МПа. Медь, алюминий, железо, титан. Материалы этой группы являются основой многих конструкционных сплавов.

- Высокопрочные, свыше 500МПа. Например, молибден и вольфрам.
Таблица прочности металлов
| Металл | Сопротивление, МПа |
|---|---|
| Медь | 200−250 |
| Серебро | 150 |
| Олово | 27 |
| Золото | 120 |
| Свинец | 18 |
| Цинк | 120−140 |
| Магний | 120−200 |
| Железо | 200−300 |
| Алюминий | 120 |
| Титан | 580 |
Наиболее распространенные в быту сплавы
Как видно из таблицы, точки плавления элементов сильно разнятся даже у часто встречающихся в быту материалов.
Так, минимальная температура плавления у ртути -38,9 °C, поэтому в условиях комнатной температуры она уже в жидком состоянии. Именно этим объясняется то, что бытовые термометры имеют нижнюю отметку в -39 градусов Цельсия: ниже этого показателя ртуть переходит в твердое состояние.
Припои, наиболее распространенные в бытовом применении, имеют в своем составе значительный процент содержания олова, имеющего точку плавления 231.9 °C, поэтому большая часть припоев плавится при рабочей температуре паяльника 250−400°C.
Помимо этого, существуют легкоплавкие припои с более низкой границей расплава, до 30 °C и применяются тогда, когда опасен перегрев спаиваемых материалов. Для этих целей существуют припои с висмутом, и плавка данных материалов лежит в интервале от 29,7 — 120 °C.
Расплавление высокоуглеродистых материалов в зависимости от легирующих компонентов лежит в границах от 1100 до 1500 °C.
Точки плавления металлов и их сплавов находятся в очень широком температурном диапазоне, от очень низких температур (ртуть) до границы в несколько тысяч градусов. Знание этих показателей, а так же других физических свойств очень важно для людей, которые работают в металлургической сфере. Например, знание того, при какой температуре плавится золото и другие металлы пригодятся ювелирам, литейщикам и плавильщикам.
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления. При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
Наиболее низкая температура плавления у ртути — она плавится даже при -39 °C, самая высокая у вольфрама — 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Как происходит процесс
Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой — плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании. Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты. Воздействие при этом примерно одинаковое.
Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты. Воздействие при этом примерно одинаковое.
Когда происходит нагревание, усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки, сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от градуса, при котором плавятся металлы, они разделяются на:
- легкоплавкие — до 600 °C: свинец, цинк, олово;
- среднеплавкие — от 600 °C до 1600 °C: золото, медь, алюминий, чугун, железо и большая часть всех элементов и соединений;
- тугоплавкие — от 1600 °C: хром, вольфрам, молибден, титан.
В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат. Он должен быть тем прочнее, чем сильнее будет нагревание.
Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина — градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
Таблица характеристик
Металлы и сплавы — непременная основа для ковки, литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота, ограды из чугуна, ножи из стали или браслеты из меди), для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий — 660 °C;
- температура плавления меди — 1083 °C;
- температура плавления золота — 1063 °C;
- серебро — 960 °C;
- олово — 232 °C.
 Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов; - свинец — 327 °C;
- температура плавления железо — 1539 °C;
- температура плавления стали (сплав железа и углерода) — от 1300 °C до 1500 °C. Она колеблется в зависимости от насыщенности стали компонентами;
- температура плавления чугуна (также сплав железа и углерода) — от 1100 °C до 1300 °C;
- ртуть — -38,9 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл — ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления. Например, у золота он 2660 °C, у алюминия — 2519 °C, у железа — 2900 °C, у меди — 2580 °C, у ртути — 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов — у рения — 5596 °C. Наибольшая температура кипения — у наиболее тугоплавящихся материалов.
Наибольшая температура кипения — у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов. Самым лёгким металлом является литий, самым тяжёлым — осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа — очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах — это теплопроводность металлов. Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл — серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Ответ
- Комментарии
- Отметить нарушение
Ответ
Неметаллы: атомы и простые вещества. Кислород, озон, воздух
Кислород, озон, воздух
Температуры плавления неметаллов также лежат в очень широком интервале: от 3800 °С у графита до -210 °С у азота. Эта особенность свойств неметаллов является следствием образования ими двух типов кристаллических решеток: молекулярной (O2, N2, галогены, белый фосфор и др.) и атомной (алмаз, графит, кремний, бор и др.)
Неметаллы: атомы и простые вещества. Кислород, озон, воздух
Гипермаркет знаний>>Химия>>Химия 9 класс>> Химия: Неметаллы: атомы и простые вещества. Кислород, озон, воздух
Все химические элементы разделяют на металлы и неметаллы в зависимости от строения и свойств их атомов. Также на металлы и неметаллы классифицируют образуемые элементами простые вещества, исходя из их физических и химических свойств.
С металлами вы познакомились в предыдущей главе. Теперь перейдем к рассмотрению неметаллов.
Само слово «неметаллы» указывает, что свойства неметаллических элементов и соответствующих им простых веществ противоположны свойствам металлов.
Если для атомов металлов характерны сравнительно большие радиусы и небольшое число электронов на внешнем уровне (1е-, З- ), атомам неметаллов, наоборот, свойственны небольшие радиусы атомов и число электронов на внешнем энергетическом уровне от 4 до 8 (у бора этих электронов 3, но атомы этого элемента имеют очень небольшой радиус). Отсюда и стремление атомов металлов к отдаче внешних электронов, т. е. восстановительные свойства, а для атомов неметаллов — стремление к приему недостающих до заветной восьмерки электронов, т. е. окислительные свойства.
Среди 109 известных сегодня химических элементов (из них 88 элементов найдено в природе) к неметаллам относят 22 элемента. О расположении металлов и неметаллов в периодической системе элементов мы уже рассказывали в предыдущей главе. Здесь еще раз отметим, что металлы в периодической системе расположены в основном под диагональю В—Аt, а неметаллы — по этой диагонали и над ней.
Свойства простых веществ, образуемых неметаллами, отличаются большим разнообразием. Хотя по сравнению с металлами неметаллов гораздо меньше, для них трудно выделить общие характерные признаки. Судите сами: водород Н2, кислород и озон 02 и 03, фтор F2, хлор Сl2, азот — газы при обычных условиях, бром Вr2 — жидкость, а бор, углерод (алмаз, графит), кремний, фосфор (красный и белый), сера (пластическая и ромбическая), селен, теллур, иод 12, астат — твердые вещества.
Хотя по сравнению с металлами неметаллов гораздо меньше, для них трудно выделить общие характерные признаки. Судите сами: водород Н2, кислород и озон 02 и 03, фтор F2, хлор Сl2, азот — газы при обычных условиях, бром Вr2 — жидкость, а бор, углерод (алмаз, графит), кремний, фосфор (красный и белый), сера (пластическая и ромбическая), селен, теллур, иод 12, астат — твердые вещества.
Если для подавляющего большинства металлов характерен серебристо-белый цвет, то окраска неметаллов — простых веществ охватывает все цвета спектра: красный (красный фосфор, красно-бурый жидкий бром), желтый (сера), зеленый (хлор — желто-зеленый газ), фиолетовый (пары иода).
Температуры плавления неметаллов также лежат в очень широком интервале: от 3800 °С у графита до -210 °С у азота. Эта особенность свойств неметаллов является следствием образования ими двух типов кристаллических решеток: молекулярной (O2, N2, галогены, белый фосфор и др.) и атомной (алмаз, графит, кремний, бор и др.). Разным строением кристаллических решеток объясняется и явление аллотропии (вспомните, что это такое). Например, элемент фосфор образует простое вещество с молекулярной кристаллической решеткой — белый фосфор, молекулы которого имеют состав Р4, и простое вещество с атомной кристаллической решеткой — красный фосфор Р.
Например, элемент фосфор образует простое вещество с молекулярной кристаллической решеткой — белый фосфор, молекулы которого имеют состав Р4, и простое вещество с атомной кристаллической решеткой — красный фосфор Р.
Вторая причина аллотропии связана с разным числом атомов в молекулах простых веществ. Типичный пример — простые вещества, образуемые кислородом: обычный кислород 02 и озон O3.
В отличие от бесцветного кислорода О2, не имеющего запаха, озон — это светло-синий газ с сильным запахом. Вы уже знаете из курса прошлого года, что примесь озона в воздухе, появляющаяся после грозы, дает ощущение приятной свежести; содержится озон и в воздухе сосновых лесов и морского побережья.
В природе озон образуется при электрических разрядах или окислении органических смолистых веществ, а также при действии ультрафиолетовых лучей на кислород. В лаборатории его получают в специальных приборах — озонаторах при действии на кислород тихим (без искр) электрическим разрядом (рис. 16).
озонатор
Озон — гораздо более сильный окислитель, чем кислород. Его молекулы распадаются при обычной температуре с отщеплением атомарного кислорода:
| Этапы работы | Содержание этапа |
| 1. Организационный момент Цель, которая должна быть достигнута учащимися: подготовиться к продуктивной работе на уроке. Цель, которую учитель хочет достичь на данном этапе урока: способствовать подготовке учащихся к продуктивной работе на уроке. Задачи: создать положительный эмоциональный настрой; личностно ориентировать учащихся на работу; дифференцировать работу учащихся на уроке. Методы: словесные. |
Здравствуйте, ребята! Чтобы нам было удобно работать на данном уроке, я предлагаю вам разбиться на группы.  Выберете в группе командира. Он будет руководить
работой группы. Так же вы можете распределить остальные обязанности
между членами группы. Кто будет экспериментатором, т.е. будет отвечать
за проведением опытов. Кто будет теоретиком, т.е. отвечать за правильное
объяснение теории, за формулировки выводов. Если хотите, то все это
можете делать все вместе, сообща. Выберете в группе командира. Он будет руководить
работой группы. Так же вы можете распределить остальные обязанности
между членами группы. Кто будет экспериментатором, т.е. будет отвечать
за проведением опытов. Кто будет теоретиком, т.е. отвечать за правильное
объяснение теории, за формулировки выводов. Если хотите, то все это
можете делать все вместе, сообща. |
| 2. Опрос учащихся по заданному на дом материалу. Цель, которую учитель ставит перед учениками на данном этапе урока: проверить знание учащихся о различии строения вещества в разных агрегатных состояниях; знания понятий «плавление» и «отвердевание», «температура плавления», «температура отвердевания». Цель, которую учитель хочет достичь на данном этапе урока: создать условия для проверки знания учащихся о различии строения
вещества в разных агрегатных состояниях, знания понятий «плавление» и
«отвердевание», «температура плавления», «температура отвердевания». Методы: словесные Метод мотивирования учебной активности учащихся в ходе опроса: соревнование между группами. Методы оценивания ответов учащихся в ходе опроса: похвала, самооценка, оценка. |
А теперь давайте вспомним, что мы изучали на прошлом
уроке? (Агрегатные состояния вещества. Плавление и отвердевание
кристаллических тел). Ребята, в каких агрегатных состояниях может находиться вещество? (Твердом, жидком и газообразном). Какие виды твердых тел существуют в природе? (Кристаллические и аморфные). Как устроено твердое кристаллическое тело? (Имеет строгий порядок расположения молекул, т. е. кристаллическую решётку). Каковы особенности строения жидкостей? (Молекулы расположены близко друг к другу, но без определённого порядка). Каковы особенности строения газов? (Расстояния между молекулами много
больше размеров самих молекул). Что такое плавление? (Процесс перехода вещества из твёрдого состояния в жидкое ). Что такое кристаллизация? (Процесс перехода вещества из жидкого состояния в твёрдое ). Что такое температура плавления? (Температура, при которой вещество плавится, называется температурой плавления вещества). Что называется температурой кристаллизации? (Температура, при которой вещество отвердевает (кристаллизуется), называется температурой отвердевания или кристаллизации). |
| 3. Изучение учебного материала А) Актуализация опорных знаний. Цель, которая должна быть достигнута учащимися: повторить сведения о свойствах молекул; повторить сведения о внутренней энергии вещества и ее изменениях, при
переходе вещества из твердого состояния в жидкое состояние, для открытия
новых знаний. Цель, которую хочет достичь учитель: организовать работу по повторению сведений о внутренней энергии и её изменениях при переходе из твердого в жидкое состояние, создать проблемную ситуацию для подведения к цели урока. Методы: побуждающий от проблемной ситуации диалог. |
А теперь давайте подумаем над следующими вопросами: 1. Как изменяется характер движения молекул при переходе из твердого состояния в жидкое? (Скорость их движения увеличивается). 2. Как изменяется расположение молекул? (Промежутки между молекулами увеличиваются). 3. Как изменяется внутренняя энергия вещества? (Внутренняя энергия вещества увеличивается). 4. Изменяются ли молекулы вещества при плавлении? (Сами молекулы не изменяются). 5. Как изменяется температура вещества при плавлении? 6. 7. Как рассчитать количество теплоты, необходимое для плавления вещества? |
| Б) Постановка учебной задачи Цель: обсудить затруднения и сформулировать цель и тему урока. |
Как вы думаете, достаточно ли у нас знаний для ответа на последние три вопроса? Исходя из этого, сформулируйте цель и тему нашего урока. (Мы продолжим изучение темы «Плавление и кристаллизация», исследуем зависимость температуры вещества от времени плавления, выясним, зависит ли количество поглощенной энергии от рода вещества, и как определяется количество поглощенной энергии при плавлении). |
| 4. Открытие новых знаний. Цель: обсудить проект решения учебной задачи и выяснить зависимость
температуры плавления вещества от времени плавления, зависимость
количества поглощенной энергии от рода вещества, и зависимость
количества поглощенной энергии при плавлении от массы тела. Методы: |
Решаем первую, поставленную нами задачу, как зависит
температура плавления кристаллического вещества от температуры? Ваши
гипотезы. (Она увеличивается, не изменяется, она уменьшается).
Как будем проверять гипотезы? (Проделаем опыт). На ваших столах пробирки с кристаллическими веществами, термометры, сосуды с горячей водой. Назовите план ваших действий по изучению данной зависимости. (Необходимо пробирки поместить в сосуды с горячей водой. Затем в пробирки вставить термометры и проследить за их показаниями при нагревании и плавлением веществ. Установить зависимость температуры от времени и сделать вывод). Работаем очень осторожно, соблюдая правила техники безопасности при
работе со стеклянной посудой и горячими веществами. Скажите, к какому выводу вы пришли. (Температура плавления кристаллического вещества постоянна). Давайте посмотрим, как это будет выглядеть на графике. Рассмотрим график нагревания и плавления льда. Как вы думаете, куда расходуется энергия, передаваемая телу при плавлении? (Она идет на разрушение кристаллической решетки). Рассмотрим аналогичные графики для олова и свинца одинаковой массы. Вещества нагревали на горелках одинаковой мощности, т. е. за равные промежутки времени горелки отдавали одинаковое количество теплоты. Сравните время плавления веществ. (Оно разное.) Что можно сказать о количестве поглощенной при этом энергии? (Оно тоже будет разное). Откройте учебник на странице 35 и прочтите выделенное жирным шрифтом
определение физической величины, о которой у нас сейчас идет речь. (Это
удельная теплота плавления вещества. На странице 37 вашего учебника есть таблица со значениями удельной теплоты плавления некоторых веществ, при температуре плавления и нормальном атмосферном давлении. Из таблицы видно, что удельная теплота плавления алюминия равна 3,9 105 Дж/кг. Это значит, чтобы расплавить 1кг алюминия, взятого при температуре плавления, т. е. при660° С, потребуется 3,9 105 Дж или 390кДж энергии. Удельная теплота плавления стали равна 0,84 105 Дж/кг. Что это значит? (Чтобы расплавить 1кг стали при температуре плавления потребуется 0,84 105 Дж энергии). Чему равна удельная теплота плавления меди? Что означает это число?
(Удельная теплота плавления меди равна 210 кДж/кг. Это значит, чтобы
расплавить 1кг меди необходимо затратить 210 кДж энергии). Итак, для плавления 1кг вещества необходимо количество теплоты равное удельной теплоте плавления. А как рассчитать количество теплоты необходимое для плавления вещества произвольной массы? (Надо удельную теплоту плавления умножить на массу, Q= λm). А теперь давайте посмотрим, как будет выглядеть график охлаждения вещества и его кристаллизации. Обратите внимание, что при охлаждении температура тела уменьшается, температура кристаллизации равна температуре плавления, при этом тело отдаёт количество теплоты, равное количеству теплоты, полученному телом при плавлении. Следовательно, формула для расчета количества теплоты, выделившейся при отвердевании, будет такая же, как и для расчета количества теплоты необходимого для плавления вещества, только энергия будет отрицательной, ведь она не поглощается, а выделяется. А теперь посмотрим, как выглядят рассмотренные нами процессы
нагревания, плавления, остывания и кристаллизации на одном графике. Запомните: 1. При плавлении происходит разрушение кристаллической решётки. Расстояние между частицами вещества увеличивается. Соответственно увеличивается потенциальная энергия частиц. 2. При отвердевании вещества происходит образование кристаллической решетки, потенциальная энергия частиц уменьшается. |
| 5. Закрепление учебного материала. Цель для учащихся: учиться применять полученные знания при решении задач. Цель, которую ставит перед собой учитель: создать условия для применения полученных знаний при решения задач. |
Применим полученные нами знания при решении задач. Какое количество теплоты выделится при кристаллизации 10 граммов серебра при температуре плавления? Какие данные необходимо добавить к условию задачи? (Удельную теплоту
плавления серебра. Рассмотрите график и ответьте на вопросы: в какой момент времени начался процесс плавления вещества? в какой момент времени вещество кристаллизовалось? чему равна температура плавления вещества? температура кристаллизации? сколько длилось: а) нагревание твердого тела; б) плавление вещества; с) остывание жидкости? |
| 6. Контроль знаний Цель: проверка степени усвоения знаний, полученных на уроке. Метод: самооценка, оценка. |
А теперь работаем самостоятельно, по вариантам, на
оценку. 1 вариант: Какое количество теплоты необходимо для того, чтобы расплавить 400г олова взятого при температуре плавления. 2 вариант: Какова масса расплавленного олова, если для плавления олова было
затрачено 35,4кДж? Олово взято при температуре плавления. 3 вариант*: Какое количество теплоты необходимо для того, чтобы расплавить 200см3 алюминия, взятого при 66° С? Сдайте ваши тетради. Посмотрите ответы. Оцените работу. |
| 7. Задание на дом Цель для учащихся: закрепить умение читать графики плавления и кристаллизации, вычислять количество теплоты, необходимое для плавления вещества. Цели, которые хочет достичь учитель, задавая задание на дом: развивать умение читать графики плавления и кристаллизации, вычислять количество теплоты, необходимое для плавления вещества. |
Чтобы закрепить знания, полученные на сегодняшнем
уроке, дома вы будете читать §14 и 15 и отвечать на вопросы к этим
параграфам. Тем, кто желает выбрать задание попроще, я предлагаю
решить задачи 1 и 3 из упражнения 8, а тем, кто желает попробовать силы
в более сложных заданиях, я предлагаю решить задачи 2 и 4 из этого
упражнения. Если у вас возникнут проблемы при решении графической задачи, вам необходимо ещё раз внимательно прочитать параграф 14. Если у вас возникнут проблемы при решении расчётной задачи, вам необходимо ещё раз внимательно прочитать параграф 15, в котором рассматривается пример решения подобной задачи. |
| 8. Рефлексия Цель: осознание учащимися своей учебной деятельности, самооценка результатов деятельности своей и класса. |
Какова была цель нашего урока? (Выяснить зависит ли
температура плавления вещества от времени, зависит ли количество
поглощённой при плавлении энергии от рода вещества, как определяется
количество теплоты, необходимое для плавления тела определённой массы). Удалось ли нам решить поставленные задачи? (Да). Мы с вами рассмотрели все виды задач, связанных с процессом плавления
и кристаллизации? (Нет. Этим нам и предстоит заняться на следующем уроке. Это будет темой нашего урока. Как вы оцениваете свою работу на уроке? Как вы оцениваете работу класса в целом? До свидания! |
Медь — Температура плавления — Температура кипения
Автор
Медь — Температура плавления и кипения
Температура плавления меди 1084,61°2 9000.
Температура кипения меди 2927°C .
Обратите внимание, что эти точки связаны со стандартным атмосферным давлением.
Температура кипения – насыщение
В термодинамике насыщение определяет состояние, при котором смесь пара и жидкости может существовать вместе при данной температуре и давлении. Температура, при которой начинает происходить испарение (кипение) при данном давлении, называется температурой насыщения или точкой кипения . Давление, при котором начинается испарение (кипение) при данной температуре, называется давлением насыщения. Когда ее рассматривают как температуру обратного перехода из пара в жидкость, ее называют точкой конденсации.
Давление, при котором начинается испарение (кипение) при данной температуре, называется давлением насыщения. Когда ее рассматривают как температуру обратного перехода из пара в жидкость, ее называют точкой конденсации.
Точка плавления
В термодинамике точка плавления определяет состояние, при котором твердое тело и жидкость могут существовать в равновесии. Добавление тепла превратит твердое вещество в жидкость без изменения температуры. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда ее рассматривают как температуру обратного перехода от жидкого к твердому, ее называют точкой замерзания или точкой кристаллизации.
Первая теория, объясняющая механизм плавления в объеме, была предложена Линдеманном, который использовал колебание атомов в кристалле для объяснения плавления. Твердые тела похожи на жидкости тем, что оба находятся в конденсированном состоянии, а частицы находятся гораздо ближе друг к другу, чем частицы газа. Атомы в твердом теле тесно связаны друг с другом либо в правильной геометрической решетке (кристаллические твердые тела, которые включают металлы и обычный лед), либо в неправильной (аморфное твердое тело, такое как обычное оконное стекло), и обычно имеют низкую энергию. движение отдельных атомов , ионов или молекул в твердом теле ограничено колебательным движением вокруг фиксированной точки. Когда твердое тело нагревается, его частицы вибрируют быстрее , поскольку твердое тело поглощает кинетическую энергию. В какой-то момент амплитуда колебаний становится настолько большой, что атомы начинают вторгаться в пространство своих ближайших соседей и возмущать их, и начинается процесс плавления. Точка плавления – это температура, при которой разрушающие вибрации частиц твердого тела преодолевают силы притяжения, действующие внутри твердого тела.
Атомы в твердом теле тесно связаны друг с другом либо в правильной геометрической решетке (кристаллические твердые тела, которые включают металлы и обычный лед), либо в неправильной (аморфное твердое тело, такое как обычное оконное стекло), и обычно имеют низкую энергию. движение отдельных атомов , ионов или молекул в твердом теле ограничено колебательным движением вокруг фиксированной точки. Когда твердое тело нагревается, его частицы вибрируют быстрее , поскольку твердое тело поглощает кинетическую энергию. В какой-то момент амплитуда колебаний становится настолько большой, что атомы начинают вторгаться в пространство своих ближайших соседей и возмущать их, и начинается процесс плавления. Точка плавления – это температура, при которой разрушающие вибрации частиц твердого тела преодолевают силы притяжения, действующие внутри твердого тела.
Copper – Properties
| Element | Copper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Atomic Number | 29 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symbol | Cu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Element Category | Transition Metal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза при STP | Твердое вещество | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Атомная масса [а. е.м.] е.м.] | 63,546 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность при STP [г/см3] | 8,92 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron Configuration | [Ar] 3d10 4s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Possible Oxidation States | +1,2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron Affinity [kJ/mol] | 118.4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity [Pauling scale] | 1.9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1st Ionization Energy [eV] | 7.7264 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Year of Discovery | unknown | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discoverer | unknown | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting Point [Celsius scale] | 1084.62 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling Point [Celsius scale] | 2927 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal Conductivity [W/m K] | 401 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Специфическое тепло [J/G K] | 0,38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тепла слияния [KJ/MOL] | 13,05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ОТРЕЙТА ВАПОРИЗИВА0189
– сообщите об этом объявлении Температура плавления металлов и сплавов | Ящик для инструментовЧто такое температура плавления? Температура плавления вещества – это температура, при которой оно переходит из твердого состояния в жидкое при атмосферном давлении; при температуре плавления твердая и жидкая фазы находятся в равновесии. Температура плавления обычных материаловТемпература плавления стали: 1425-1540 °C / 2600-2800 °F Температура плавления золота: 1064 °C / 1947,5 °F. Температура плавления меди: 1084 °C / 1983 °F Температура плавления железа: 1538 °C / 2800 °F Температура плавления свинца: 327,5 °C / 621 °F. Температура плавления серебра: 961 °C / 1761 °F. Загрузить справочный лист: Температуры плавления металлов и чистых элементов
Температуры плавления сплавов
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

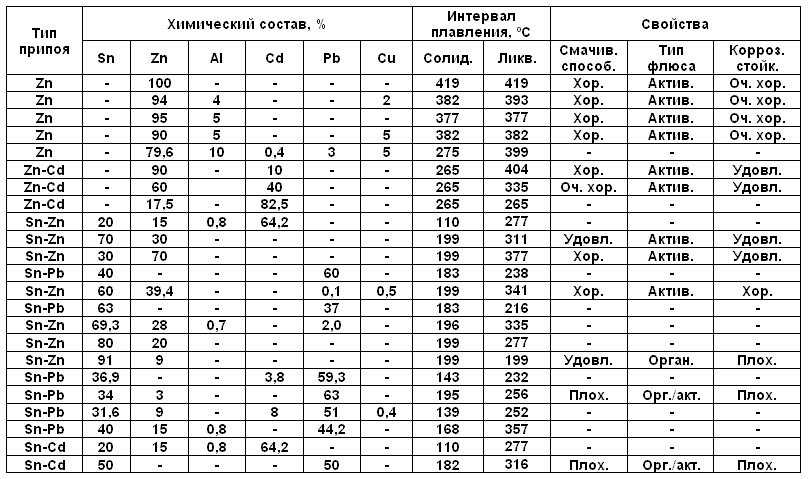 Температура плавления — 1170 градусов. По своим внешним характеристикам мельхиор очень похож на серебро, раньше его называли белой медью. Но он обладает более высокой механической прочностью, чем обычное серебро.
Температура плавления — 1170 градусов. По своим внешним характеристикам мельхиор очень похож на серебро, раньше его называли белой медью. Но он обладает более высокой механической прочностью, чем обычное серебро.
 Этот способ предполагает наличие тесного контакта расплавляемой массы металла с воздухом, что будет способствовать усилению процесса окисления расплавляемого металла. Чтобы этому как-то противостоять, на расплавляемую массу сверху насыпают слой древесного угля.
Этот способ предполагает наличие тесного контакта расплавляемой массы металла с воздухом, что будет способствовать усилению процесса окисления расплавляемого металла. Чтобы этому как-то противостоять, на расплавляемую массу сверху насыпают слой древесного угля.

 Во многих муфельных печах на двери вырезано окошко. Через него можно безопасно осуществлять наблюдение за процессом.
Во многих муфельных печах на двери вырезано окошко. Через него можно безопасно осуществлять наблюдение за процессом. Для ускорения нагревательного процесса на уголь направить пылесос, включенный на режиме выдувания. Особое внимание стоит уделить наконечнику трубы. Она должна быть металлической, поскольку пластик расплавится под воздействием высокой температуры.
Для ускорения нагревательного процесса на уголь направить пылесос, включенный на режиме выдувания. Особое внимание стоит уделить наконечнику трубы. Она должна быть металлической, поскольку пластик расплавится под воздействием высокой температуры. Для чистого золота он характеризуется красивым темно-жёлтым цветом с характерным металлическим блеском. В жидком состоянии металл имеет бледно-зелёный цвет. Пары его жёлто-зелёного цвета.
Для чистого золота он характеризуется красивым темно-жёлтым цветом с характерным металлическим блеском. В жидком состоянии металл имеет бледно-зелёный цвет. Пары его жёлто-зелёного цвета. Они дарятся любимым, их инвестируют, ими восхищаются и ценят.
Они дарятся любимым, их инвестируют, ими восхищаются и ценят.