Температура плавления золота. Температура плавления и кипения металлов
Именно физические свойства
sadržaj
- Температура плавления и кипения металлов
- Золото: общая характеристика
- Физические свойства золота
- Плотность металла
- Ковкость и пластичность
- Нахождение в природе и использование человеком
- Сплавы золота
- Золото 375
- От чего зависит цвет украшений из золота?
Температура плавления и кипения металлов
Для каждого представителя данный показатель свой. Однако предел нагревания есть у всех металлов. При определенной температуре они начинают плавиться, переходя из твердого в жидкое состояние. Если же довести показатель до критического значения, то металл перейдет в газообразное состояние, то есть начнется процесс кипения и испарения.
Если же довести показатель до критического значения, то металл перейдет в газообразное состояние, то есть начнется процесс кипения и испарения.
Поэтому существует целая классификация, отражающая способность металлов к плавлению. Все они делятся на следующие группы.
Легкоплавкие. В данную группу входят те, что плавятся при показателях ниже 600 оС. Пример: цинк, натрий, галлий, висмут, олово, цезий и прочие.
- Среднеплавкие. Показатель в пределах 600-1600 оС. Например, температура плавления золота в чистом виде — 1063 оС, значит, оно относится к этой группе металлов.
- Тугоплавкие. Свыше 1600 оС. Примеры: титан, вольфрам, хром и другие.
Следует заметить, что данная классификация справедлива только для чистых металлов. Когда речь заходит о сплавах, то цифры резко меняются, и значения могут сильно отличаться от исходных показателей.
Температура кипения металлов значительно выше, чем рассмотренный параметр. Так, если температура плавления золота — 1063 оС, то кипения — уже 2947 оС. Различие практически вдвое!
Так, если температура плавления золота — 1063 оС, то кипения — уже 2947 оС. Различие практически вдвое!
Золото: общая характеристика
Aurum, или золото, — это химический элемент под номером 79 в периодической системе. Атомная масса составляет 196,967 единиц. Располагается в I группе, побочной подгруппе. Относится к благородным металлам, наряду с:
- платиной;
- серебром;
- палладием.
С точки зрения химической активности является практически инертным, без особых условий в реакции не вступает. Имеет особые физические свойства, позволяющие применять его в ювелирном деле, технике, промышленности.
Физические свойства золота
Чем же так уникален этот металл, за которым много веков подряд гонятся люди и который стал символом финансового благополучия во всем мире?
- Цвет. Для чистого золота характерен красивый насыщенный желтый цвет с ярко выраженным металлическим блеском.
 Жидкий металл имеет бледно-зеленую окраску. Пары его желто-зеленого цвета.
Жидкий металл имеет бледно-зеленую окраску. Пары его желто-зеленого цвета. - Твердость. По данному параметру золото уступает многим другим представителям, так как является мягким металлом. По шкале твердости веществ (шкала Мооса) данный показатель составляет 2,5-3.
- Температура плавления золота — 1063 оС.
- Электропроводность хорошая, составляет 75 % по отношению к меди как сверхпроводнику.
- Теплопроводность и теплоемкость также отличная. Изделия из золота мгновенно нагреваются и также быстро раскаляются.
Особые свойства, придающие золоту высокую ценность, рассмотрим отдельно. Это:
- ковкость;
- пластичность;
- плотность.
Плотность металла
Сама характеристика плотности означает вес вещества в единице объема. Так вот золото обладает практически максимальным показателем по данному параметру. Так, например, полстакана чистого золотого песка будет иметь вес около 1000 грамм.
Плотность золота, очищенного от примесей, составляет 19,3 г/см3.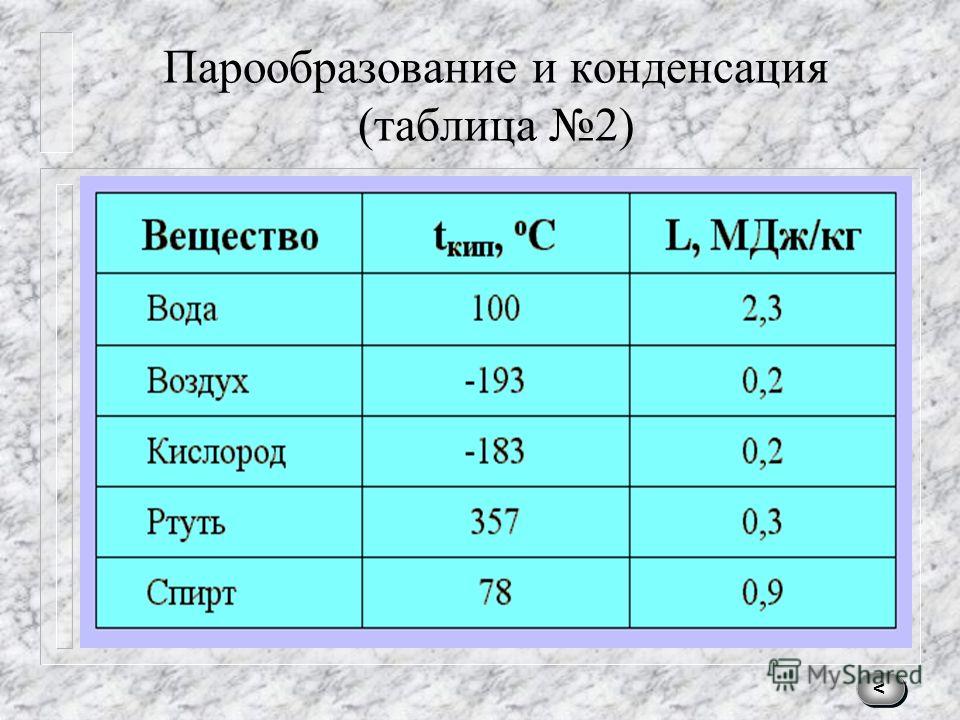 Если же говорить о природных золотосодержащих породах, то в нем показатель несколько ниже — 18-18,2 г/см3. Этот показатель позволяет удобно извлекать рассматриваемый металл из пород. Он же делает золото таким дорогим за совсем небольшое количество по граммам.
Если же говорить о природных золотосодержащих породах, то в нем показатель несколько ниже — 18-18,2 г/см3. Этот показатель позволяет удобно извлекать рассматриваемый металл из пород. Он же делает золото таким дорогим за совсем небольшое количество по граммам.
Ковкость и пластичность
Температура плавления золота, а также его чрезвычайная ковкость и пластичность делают его удобным и послушным в руках опытных людей. Так, на слуху понятие «сусальное золото». Что это такое? Это прокатанные в тончайшие полупрозрачные листы золотые кусочки, которые при этом не теряют своего яркого и красивого блеска. Сусальным золотом можно покрывать поверхности изделий, стены, купола церквей и так далее.
Всего из 1 г этого удивительного металла можно изготовить очень тонкую проволоку, длина которой составит почти 3 тысячи метров! Золото легко подвергается следующим деформациям без потери свойств и целостности структуры:
- сдавливание;
- смятие;
- искривление;
- измельчение;
- прокатывание;
- растяжение;
- придание любой желаемой формы.

Естественно, что такой набор физических свойств не может оставаться незамеченным людьми, и поэтому золото находит применение в самых разных отраслях науки, техники и промышленности.
Нахождение в природе и использование человеком
В первозданном виде золото встречается в природе в форме слитков, песка или вкраплений в горные породы. Россыпи золота — это места их добычи человеком. В смеси с песком, глиной и другими частями оно извлекается, а затем отделяется в чистом виде.
Также золото содержится в:
- растениях;
- животных;
- человеческом организме;
- подземных водах;
- морях и океанах;
- литосфере.
Из всех этих мест люди научились извлекать металл для использования в своих нуждах. Для чего же он нужен?
- Самая главная отрасль — это, конечно, ювелирное дело. Красивые украшения, выполненные из разных сплавов золота, являются главным признаком финансового достояния практически каждой женщины. Их дарят любимым, в них вкладывают деньги, ими восхищаются и их ценят.

- Техника. Температура плавления золота и платины, а также палладия, никеля и некоторых других металлов делает их очень ценными для использования в технических целях. А свойство золота обладать высокой степенью ковкости и пластичности в сочетании с химической инертностью позволяет применять проволоку из этого металла в самых мелких деталях, чипах. Например, телефонах, телевизорах, калькуляторах и других электронных устройствах.
- Золото — твердая валюта по всему миру, которая не обесценивается никогда. Ему не страшны инфляция и дефолт, поэтому многие хранят свои сбережения именно в слитках этого металла.
- Награды за достижения в разных видах спорта, турнирах и играх исполняются из золота, серебра и бронзы, что еще раз подчеркивает их высокую ценность.
Сплавы золота
Перечисленные характеристики металла в чистом виде делают его не только уникальным и востребованным, но также сказываются на качестве изделий. Так, вследствие высокой мягкости, украшения из чистого золота легко деформировать, помять и испортить. Поэтому чаще всего используют сплавы металла с другими представителями периодической системы.
Поэтому чаще всего используют сплавы металла с другими представителями периодической системы.
- Золото 585 пробы. Этот сплав самый продаваемый и распространенный в нашей стране и за рубежом. Из чего же он состоит? 58,5 % — чистое золото, 34 % приходится на медь, 7,5 % — серебро. Температура плавления золота 585 пробы — приблизительно 840 оС, что значительно ниже показателя у чистой навески. Однако в целом свойства сплава гораздо лучше, так как примеси компенсируют недостатки простого металла. Медь служит для увеличения прочности и твердости изделия. Однако если ее будет слишком много, то изделие быстро подвергнется коррозии. Серебро влияет на цвет. Благодаря ему сплав более желтый, блестящий, без примеси зеленого оттенка. То, что температура плавления золота 585 пробы так низка по сравнению с чистым вариантом, говорит о том, что обращаться с изделиями следует крайне осторожно и бережно и не оставлять вблизи открытого огня.
- Золото 999. Это сплав — на основе практически чистого металла с небольшой долей меди.
 Из-за этого температура плавления золота 999 возрастает по сравнению с предыдущим показателем. Она составляет 1063 оС, то есть то же значение, что и для простого вещества. Изделия из такого сплава более мягкие, способны к деформации, поэтому требуют тщательного обращения и особого ухода.
Из-за этого температура плавления золота 999 возрастает по сравнению с предыдущим показателем. Она составляет 1063 оС, то есть то же значение, что и для простого вещества. Изделия из такого сплава более мягкие, способны к деформации, поэтому требуют тщательного обращения и особого ухода.
Золото 375
Температура плавления золота 585 является средним показателем. Ведь существует еще сплав, в котором на долю благородного металла приходится всего 37,5 % (375 проба). У такого варианта показатель плавления вообще близится к 770 оС, что является минимальным значением.
Если говорить о сплаве на основе золота и серебра, то такие варианты вообще не используются. Изделие получится слишком мягким. Поэтому медь присутствует обязательно. Температура плавления серебра и золота приблизительно одинакова, разброс небольшой. У белого металла она составляет 961,8 оС. Поэтому их совместный сплав не слишком понижает общий показатель в продукте.
От чего зависит цвет украшений из золота?
Каким цветом будет отливать украшение на свету, зависит от того, какие добавки в смеси и каково их процентное соотношение. Красный оттенок будет иметь изделие, в котором 50/50 золота и меди-серебра.
Белый — если в смесь ввести палладий, никель и больше серебра. Зеленый — серебро и медь, розовый — серебро, палладий и медь.
Dijelite na društvenim mrežama:
Povezan
Температура плавления и кипения золота © Геостарт
Наиболее важными физическими свойствами металлов, являются их точки плавления. Знание этого параметра позволяет эффективно сочетать различные компоненты и создавать удобные, долговечные и высококачественные сплавы. Для каждого вида металлов существует свой порог, при котором они переходят из одной формы вещества в другую. При определённой температуре они начинают плавиться, переходя от твёрдого состояния к жидкому. Если температура достигает критического значения, то металл будет поступать в газообразное состояние, то есть начинается процесс испарения.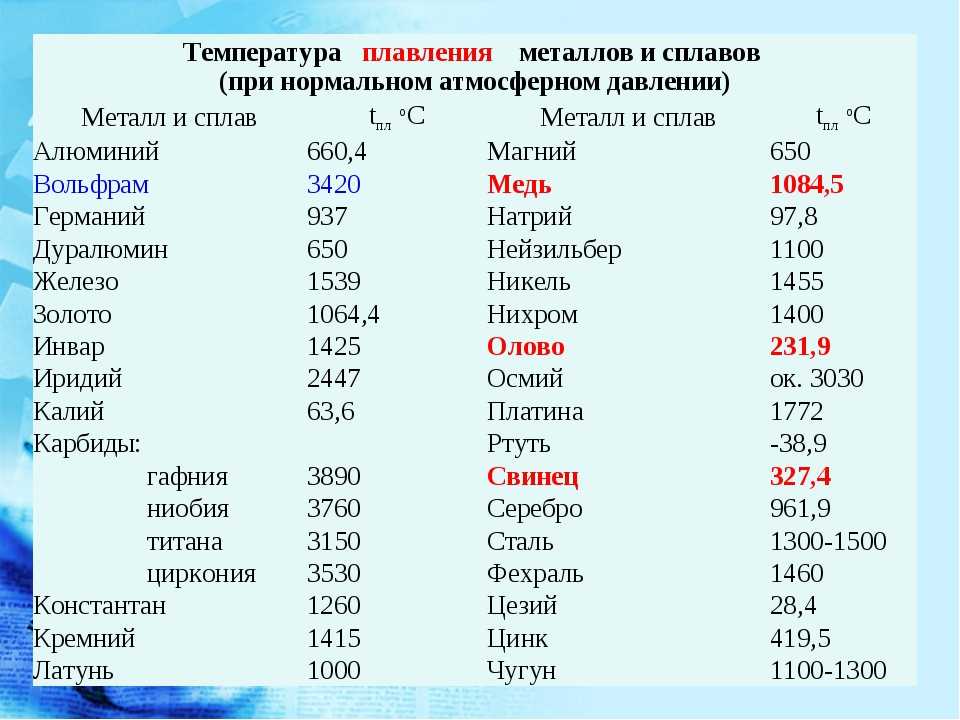
По характеру воздействия температуры, все металлы делятся на три группы.
- Плавкие . Эта группа включает металлы, которые плавятся при температуре ниже 600 °C. Примеры: натрий, цинк, висмут, гал, олово, цезий и другие.
- Среднеплавкие . Плавятся в пределах 600−1600 °C.
- Устойчивые . Более 1600 °C. Примеры: титан, вольфрам, хром и другие.
Возникает резонный вопрос, при какой температуре плавится золото? Точка плавления Au в чистом виде составляет 1063 °C, поэтому его можно отнести ко второй группе.
Следует отметить, что эта классификация применима только для чистых металлов. Когда дело доходит до сплавов, значения меняются, и могут отличаться от начального.
Точка кипения металлов намного выше, чем в указанных параметрах. Например, если температура плавления этого благородного металла составляет 1063 °C, то точка кипения достигает 2947 °C. Разница почти в два раза!
Разница почти в два раза!
Au: общий обзор
Аурум или золото — это 79-й элемент в периодической таблице Менделеева. Атомная масса составляет 196,96654 а. е. м. (г/моль). Находится в первой группе периодической таблицы, относится к драгоценным металлам, вместе с:
- платиной;
- серебром;
- палладием.
С точки зрения, химической реакции инертна. Никаких ярко выраженных реакций не возникает. Обладает специфическими физическими свойствами, которые позволяют использовать его в ювелирных изделиях, технологии и промышленности.
Физические свойства Au
Что такого особенного в этом металле, блеск которого привлекает людей на протяжении многих веков и стал символом финансового процветания в мире?
- Цвет . Для чистого золота он характеризуется красивым темно-жёлтым цветом с характерным металлическим блеском. В жидком состоянии металл имеет бледно-зелёный цвет.
 Пары его жёлто-зелёного цвета.
Пары его жёлто-зелёного цвета. - Твёрдость . Это мягкий металл. В шкале твёрдости (шкала Мооса) показатель составляет 2,5−3.
- Температура плавления Au — 1063 °C.
- Электропроводность хорошая, 75% относительно меди в качестве сверхпроводника.
- Теплопроводность и теплоёмкость отличные. Золотые изделия быстро нагреваются и быстро остывают.
К свойствам, которые позволяют отнести золото к ценным металлам, относят:
- пластичность;
- плотность.
Плотность металла
Само понятие плотность, означает вес вещества на единицу объёма. Этот драгоценный металл имеет большое значение этого параметра. Например, половина стакана чистого золотого песка, будет иметь массу около 1 тыс. грамм.
Плотность золота, очищенная от примесей, составляет 19,3 г/см 3 . Говоря о промышленных, естественных породах золота, плотность несколько ниже от 18 до 18,2 г/см 3 . Этот показатель позволяет технологически выгодно извлекать металл из горных пород, и делает золото дорогим.
Говоря о промышленных, естественных породах золота, плотность несколько ниже от 18 до 18,2 г/см 3 . Этот показатель позволяет технологически выгодно извлекать металл из горных пород, и делает золото дорогим.
Ковкость и пластичность
Точка температуры плавления золота, а также его высокая пластичность, делают его удобным и покорным в руках людей. Тончайшие листы из золота, которыми покрывают церковные купола, предметы интерьера и дизайна, не теряют яркого и красивого блеска. Из одного грамма, этого удивительного металла, может быть изготовлена очень тонкая проволока, длина которой будет близка к 3 тыс. м. Золото не меняет своих свойств при:
- сжатии;
- скручивании;
- шлифовании;
- прокатки;
- растяжении.
Конечно, такой набор физических свойств не мог оставаться незамеченным людьми, и поэтому золото используется в различных областях науки, техники и промышленности.
Распространение Au в природе
Кроме того, Au содержится, в растениях и животных. Так, в 100 граммах кукурузы содержится 0,5 мкг благородного металла, а в человеке около 10 мг.
Область применения
Люди научились добывать Au для своих потребностей. Но где оно используется?
- Основная отрасль — это, конечно же, ювелирные изделия. Красивые украшения из различных сплавов золота являются главной особенностью финансового богатства почти каждой женщины. Они дарятся любимым, их инвестируют, ими восхищаются и ценят.
- Бытовая техника. Температура плавления золота, платины и палладия, никеля и других металлов делает их незаменимыми в техническом применении. Au обладает высокой ковкостью и пластичностью в сочетании с химической инертностью позволяет использовать этот металл в мельчайших деталях. В телефонах, телевизорах, калькуляторах и других электронных устройствах.
- Золото — является твёрдой валютой по всему миру, которое никогда не обесценивается.
 Чтобы не бояться инфляции и дефолта, многие сохраняют свои сбережения в виде металлических слитков.
Чтобы не бояться инфляции и дефолта, многие сохраняют свои сбережения в виде металлических слитков. - Награды за достижения в различных видах спорта и играх проводятся в золоте, серебре и бронзе, что ещё раз подчёркивает их высокую ценность.
Сплавы золота
Изделия, выполненные из благородного металла, делают его не только популярным, но и придают ему определённые свойства. Ювелирные изделия, выполненные из чистого золота, легко деформируются, подвержены царапинам и истёртостям. Поэтому часто используются сплавы с другими элементами периодической таблицы, позволяющими избежать этих недостатков.
- Золото 585 пробы. Этот сплав является самым продаваемым в нашей стране и за рубежом. В состав сплава входит: 58,5% — чистое золото, 34% меди, 7,5% — серебро. Точка плавления составляет 585−840 °С, что намного меньше, чем в случае с чистым образцом. Однако в целом свойства сплава значительно лучше. Медь используется для увеличения прочности и твёрдости.
 Однако, если её слишком много, то изделие будет подвержено коррозии.
Однако, если её слишком много, то изделие будет подвержено коррозии. - Золото 999. По существу чистый металл с небольшим количеством меди. Поэтому температура плавления 999 пробы увеличивается по сравнению с предыдущим индексом. Составляет 1063 °C, это те же значения, что и чистого вещества. Изделия из этого мягкого сплава, способны к деформации, поэтому требуют тщательной обработки и проявления большой осторожности.
Что определяет цвет золотых украшений?
Какой цвет приобретёт производимое украшение зависит от типа компонентов в сплаве и их процентном соотношении. Красный оттенок будет иметь продукт, в котором золото и серебро составляют по 25% соответственно, а медь 50%. Белый цвет — если в сплав входят палладий, никель, серебро. Зелёный — серебро и медь. Розовое — серебро, палладий и медь.
автор Нечаев Арсений |
Температура плавления металлов: таблица и понятие
При сварке происходит воздействие высокой температуры на детали, поэтому очень важно придавать значение температуре плавления металлов, учитывая её в процессе работы, так как данные показатели играют немаловажную роль в параметрах тока.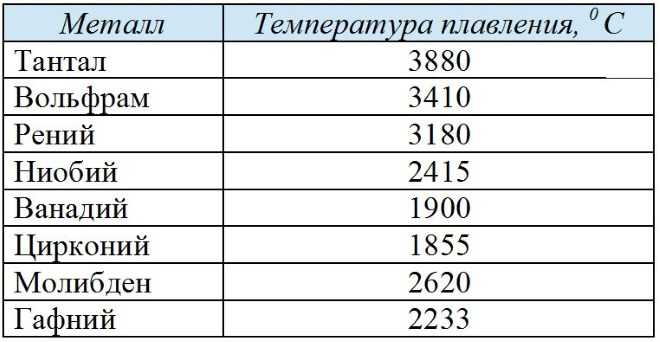 В горелке, при сгорании газа в момент действия электрической дуги, создается тепловая мощь для того, чтобы подвергнуть разрушению кристаллическую решетку металла. Характеристикам плавления металлов уделяют внимание при подборе материала для сооружения узлов, подвергающихся силе трения или же конструкций из металла, которые испытывают воздействие температур.
В горелке, при сгорании газа в момент действия электрической дуги, создается тепловая мощь для того, чтобы подвергнуть разрушению кристаллическую решетку металла. Характеристикам плавления металлов уделяют внимание при подборе материала для сооружения узлов, подвергающихся силе трения или же конструкций из металла, которые испытывают воздействие температур.
Содержание
- Что такое температура плавления?
- Разница между температурой плавления и кипения
- Кристаллические решетки металла
- Температура плавления различных металлов
- Железо
- Чугун
- Сталь, температура плавления
- Нержавеющая сталь
- Алюминий и медь
- Серебро и золото
- Ртуть
- Какой металл обладает самой высокой температурой плавления?
- Таблица температур плавления
- От чего зависит температура плавления?
- Процесс плавления
- Типы сплавов металлов
- Особенности углеродистой стали
- Особенности легированной стали
- Особенности нержавейки
- Особенности инструментальной стали
- Сплав Вуда
- Сплавы для пайки
- Температура плавления неметаллов
Что такое температура плавления?
Чтобы узнать при какой температуре плавится металл, в лабораторных условиях, точку старта в начале процесса плавления вычисляют до сотой градусной доли. При этом данный показатель не находится в зависимости от усилия при давлении на деталь.
При этом данный показатель не находится в зависимости от усилия при давлении на деталь.
При создании определенного давления в условиях вакуума, заготовки из металла имеют одинаковую температуру плавления. Данное явление можно объяснить накоплением энергии внутри вещества, при которой разрушаются связи между молекулами.
Разница между температурой плавления и кипения
Температурой плавления металлов называют точку перехода твердокристаллического вещества в жидкое состояние. В составе расплава у молекул нет собственного места расположения, они удерживаются за счет силы притяжения, поэтому в разжиженном состоянии сохраняется объем, но теряется форма.
В процессе кипения происходит потеря молекулярного объема, а молекулы вяло взаимодействуют друг с другом, двигаясь хаотично в разных направлениях, отставая от поверхности. Температурой кипения называется процесс, при котором уровень давления металлического пара уравновешивается с давлением внешней среды.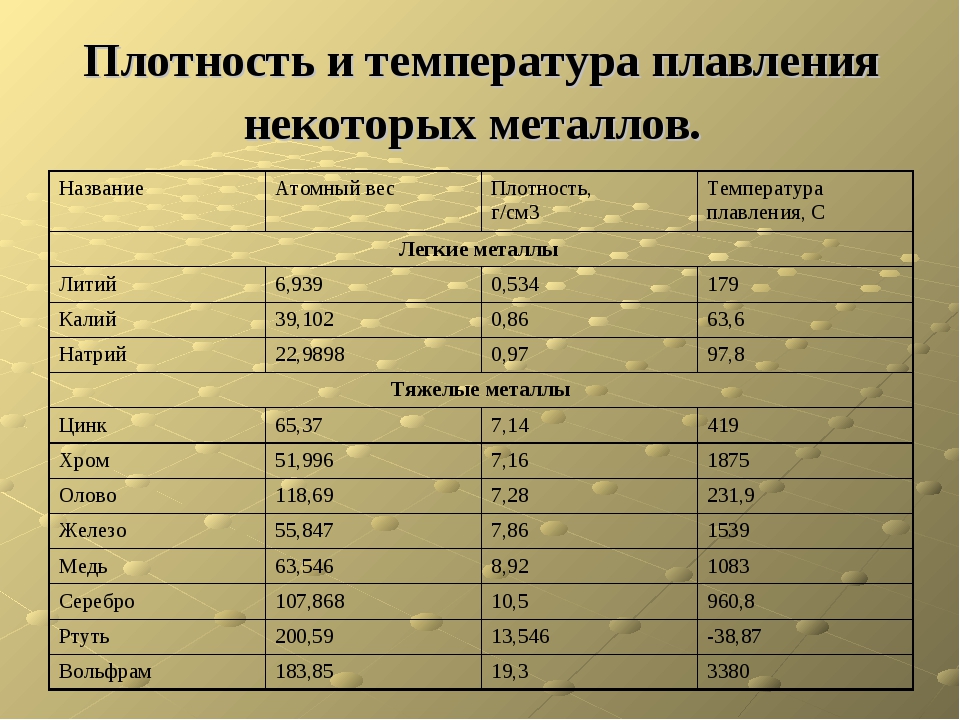
Кристаллические решетки металла
Под воздействием высокой температуры на металлическую деталь, возникают изменения в ее кристаллической решетке на молекулярном уровне. Это увеличивает скорость движения молекул. При критической температуре происходит распад молекулярной структуры металла, потому что межмолекулярные связи не в состоянии производить удержание в узловой структуре решетки. И вместо колеблющихся движений в узле возникают хаотичные, разнонаправленные движения, образуя ванну расплава в точках плавления.
Температура плавления различных металлов
Согласно знаниям из раздела физики, процесс превращения твердого вещества в жидкое имеется лишь у тел с кристаллической решеткой. Температура плавления металлов и сплавов возникает в различном диапазоне значений. Но, с точностью высчитать пограничную температуру фазовых состояний у сплавов весьма проблематично. У чистых элементов имеет значимость каждый градус, если это составы с легкой плавкостью.
Железо
Температура плавления железных составов должна быть высокой. Если элемент обладает технической чистотой, то он плавится при температуре 1 539 °C. В составе его вещества присутствуют включения серы, поэтому для её извлечения необходимо жидкое состояние. Также очищенное железо получается в процессе электролиза солей металла.
Если элемент обладает технической чистотой, то он плавится при температуре 1 539 °C. В составе его вещества присутствуют включения серы, поэтому для её извлечения необходимо жидкое состояние. Также очищенное железо получается в процессе электролиза солей металла.
Чугун
Чугун считается самым лучшим материалом для плавления. Он имеет хорошие показатели жидкой текучести и усадки, поэтому его эффективно использовать в процессе литья. Ниже будут приведены показатели температурного кипения чугуна:
Серая разновидность чугуна, у которой температурный режим доходит до отметки 1 260 °C. А при разливе его в формы, увеличивается до 1 400 °C.
Белая разновидность чугуна, у которого температура поднимается до 1 350 °C.
Одним из немаловажных моментов является то, что температура, которой обладает чугун, на 400 единиц меньше той же стали. Поэтому процесс обработки данного материала менее энергозатратен.
Сталь, температура плавления
Средняя температура плавления стали составляет 1400 °C.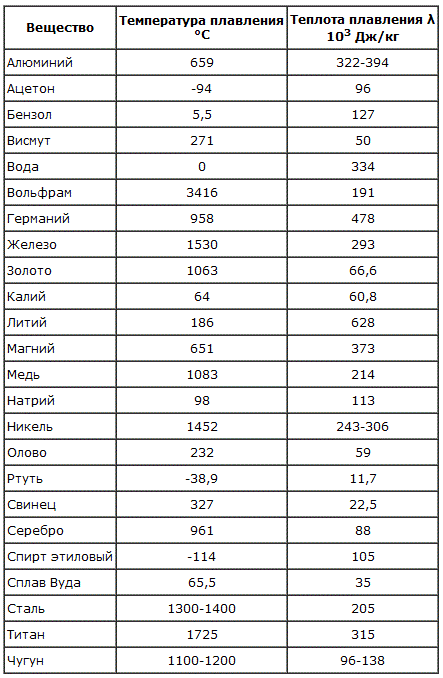
Сталью называется железосодержащий сплав с включением углерода. Её основной характеристикой является прочность. Это достигается за счет того, что она долгое время сохраняет параметры объема и формы. При этом расположение молекул в веществе находится в сбалансированном состоянии. Именно поэтому достигается равновесие между силой притяжения и силой отталкивания.
Диапазон плавления стали выше, чем у чугуна, поэтому она более энергозатратна.
Нержавеющая сталь
Температура плавления нержавеющей стали колеблется в среднем диапазоне между чугуном и сталью. Нержавеющей сталью называется вещество из легированной стали, обладающее антикоррозийными свойствами за счет содержания хрома в своем составе от 11% процентов и больше.
Показатели температуры плавления нержавейки составляют от 1 300 до 15 000 °C.
Алюминий и медь
Температура плавления алюминия составляет 6 600 °C, поэтому он зарекомендовал себя в качестве одного из среднеплавких металлов. Плавление чистых медных составов происходит при температуре 10 830 °C, а сплавов – 930 — 11 400 °C.
Серебро и золото
Серебро в чистом виде плавится при температуре 9 620 °C. При этом при температуре плавления серебра, оно может сравниться с температурой плавления в градусах со сплавами из меди.
Золото плавится при температуре в 10 640 °C.
Ртуть
Ртуть обладает самой низкой температурой плавления с отрицательным значением. Она составляет — 38,80 °C.
Какой металл обладает самой высокой температурой плавления?
У вольфрама самая высокая температура плавления, которая составляет 34 220 °C. Он относится к самым тугоплавким металлам. Очень тяжел, с виду серых оттенков, имеет характерный блеск и практически не поддается стандартной обработке. В помещениях с комнатной температурой быстро ломается и крошится. И ломается из-за того, что содержит включения кислорода и углерода.
Таблица температур плавления
| Легкоплавкие металлы | |
| Литий | + 180 °C |
| Калий | + 63,60 °C |
| Индий | + 156,60 °C |
| Олово | + 2 320 °C |
| Таллий | + 3 040 °C |
| Кадмий | + 3 210 °C |
| Свинец | + 3 270 °C |
| Цинк | + 4 200 °C |
| Среднеплавкие металлы | |
| Магний | + 6 500 °C |
| Алюминий | + 6 600 °C |
| Барий | + 7 270 °C |
| Серебро | + 9 600 °C |
| Золото | +10 630 °C |
| Марганец | + 12 460 °C |
| Медь | + 10 830 °C |
| Никель | + 14 550 °C |
| Кобальт | + 14 950 °C |
| Железо | + 15 390 °C |
| Дюралей | + 6 500 °C |
| Латунь | + 950 – 10 500 °C |
| Чугун | + 1 100 – 13 000 °C |
| Тугоплавкие металлы | |
| Титан | + 16 800 °C |
| Платина | + 17 690 °C |
| Хром | + 19 070 °C |
| Цирконий | + 18 550 °C |
| Ванадий | + 19 100 °C |
| Иридий | + 24 470 °C |
| Молибден | + 26 230 °C |
| Тантал | + 30 170 °C |
| Вольфрам | + 34 200 °C |
От чего зависит температура плавления?
У различных материалов различается, и температура их плавления, при которой происходит коренное перестраивание решетки до состояния жидкости. Металлические изделия и изделия из сплавов имеют следующие особенности:
Металлические изделия и изделия из сплавов имеют следующие особенности:
- У различных материалов различается, и температура их плавления, при которой происходит коренное перестраивание решетки до состояния жидкости. Металлические изделия и изделия из сплавов имеют следующие особенности:
- Они редко встречаются в натуральном виде, т.е. без примесей. Именно состав определяет, какой должна быть температура плавки. В пример можно взять олово, в которое добавляют включения серебра. Благодаря примесям материал начинает становится устойчивым к воздействию температуры.
- Существуют такие сплавы, которые из-за химического состава трансформируются в жидкое состояние, когда столбик термометра поднимается чуть выше отметки в + 1 500 °C. Есть и такие сплавы, которые «держатся», если их нагревать до 30 000 °C.
- Стоит учитывать тот факт, что одним из наиболее важных свойств веществ является их точка плавления. В качестве примера можно привести авиационную технику.
Процесс плавления
Плавление любого металла осуществляется по одинаковой схеме с помощью нагрева внешнего или внутреннего типа.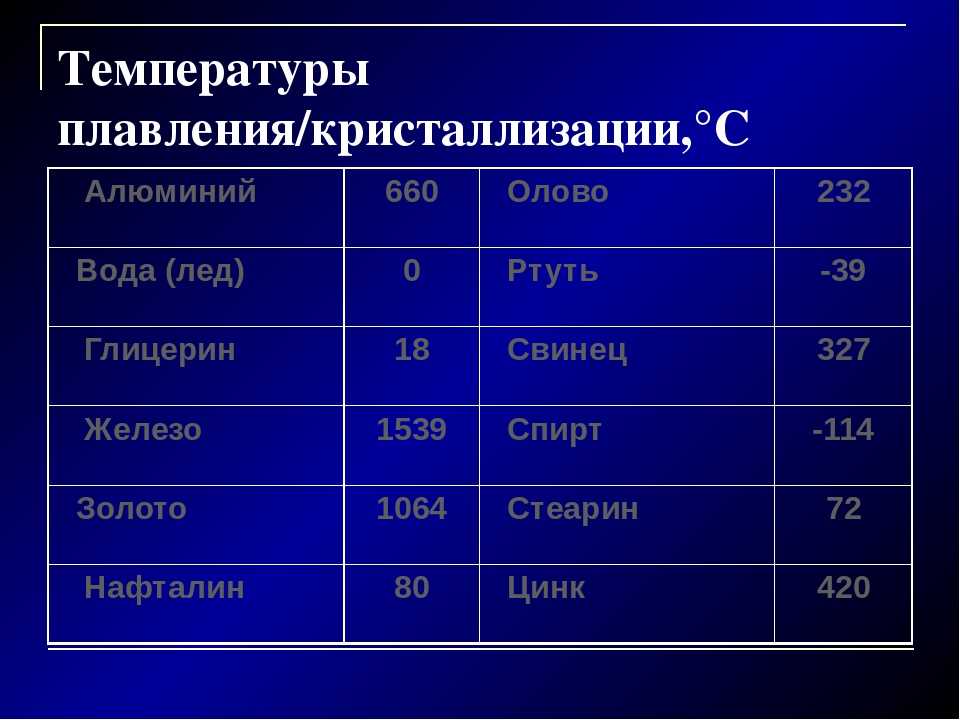 В первом варианте материал подвергается плавке в специальной печи, во втором применяется резистивная методика нагрева. При данной методике через вещество пропускается ток, либо он может быть индукционным нагревом в электромагнитном поле высокой частоты. В обоих случаях достигается одинаковый результат.
В первом варианте материал подвергается плавке в специальной печи, во втором применяется резистивная методика нагрева. При данной методике через вещество пропускается ток, либо он может быть индукционным нагревом в электромагнитном поле высокой частоты. В обоих случаях достигается одинаковый результат.
Типы сплавов металлов
Типы металлических сплавов различаются на основе температуры плавления, поэтому выделяют следующие варианты сплава:
- Легкоплавкий (олово, цинк, свинец, висмут) с температурой плавления не больше 600 °C.
- Среднеплавкий (алюминий, магний, никель, железо) с температурой 600 — 1 600 °C.
- Тугоплавкий (молибден, вольфрам, титан) с температурой более 1 600 °C.
Далее расскажем немного о разновидностях сталей, о сплаве вуда и припоях.
Особенности углеродистой стали
В данном материале содержится примесь углерода, примерно 2,13 %. При этом он лишен легирующих добавок, но есть примеси кремния, марганца и магния.
Особенности легированной стали
Помимо содержания углерода и железа в неё добавляют дополнительные элементы, улучшающие её свойства.
Особенности нержавейки
Нержавеющая сталь отлична от углеродистой из-за содержания элемента хрома в своем составе, благодаря свойствам которого она не подвержена окислению, а, следовательно, покрытию ржавчиной.
Особенности инструментальной стали
Также обладает углеродистым составом (0,8 – 0,9 %). Демонстрирует твердость, прочность, хорошо поддаются обработке. Используется в изготовлении инструментов, например, медицинских.
Сплав Вуда
Представляет собой материал, применяемый при паянии деталей для радиоприемников, а также в гальванической пластике, при работе в лабораторных условиях с ядохимикатами.
Сплавы для пайки
Другое их название – припои. Материалы для припоев бывают различными. Все зависит от того, что входит в состав материалов, которые необходимо соединить. К примеру, алюминий требует один сплав припоя, а вот медь уже совершенно другой.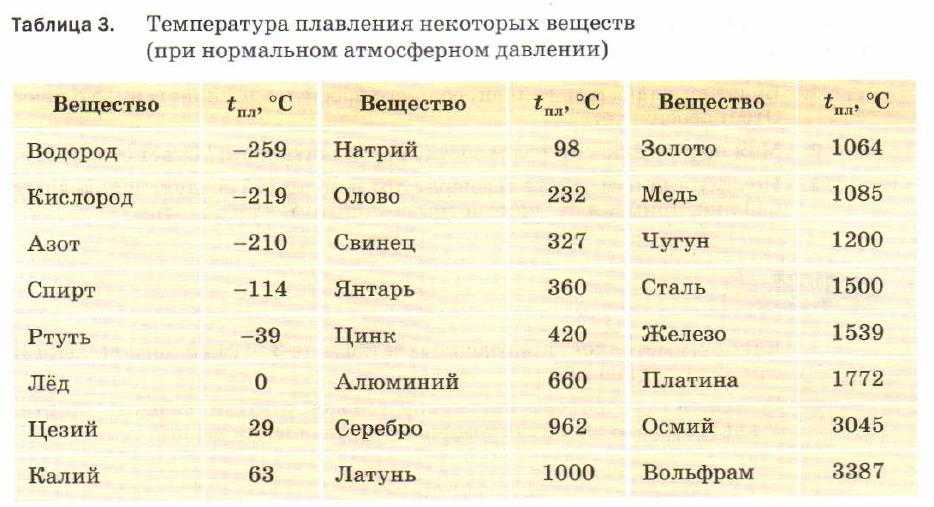
Температура плавления неметаллов
У неметаллов также существует свой диапазон плавления, который колеблется от температуры в 38 000°C, которой обладает графит до температуры в — 2 100 °C у азота. Это потому, что неметаллы способны к образованию кристаллических решеток двух вариантов: молекулярной (у кислорода, азота, фосфора и т.д.) и атомной (графит, алмаз, бор, кремний и т.д.).
Надеемся, что статья была полезной, если остались вопросы — задавайте в комментарии!
серебро| Факты, свойства и использование
серебряный самородок
Просмотреть все материалы
- Похожие темы:
- химический элемент обработка серебра золото изделия из серебра серебрение
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
серебро (Ag) , химический элемент, белый блестящий металл, ценимый за свою декоративную красоту и электропроводность. Серебро находится в группе 11 (Ib) и периоде 5 периодической таблицы, между медью (период 4) и золотом (период 6), а его физические и химические свойства занимают промежуточное положение между этими двумя металлами.
Серебро находится в группе 11 (Ib) и периоде 5 периодической таблицы, между медью (период 4) и золотом (период 6), а его физические и химические свойства занимают промежуточное положение между этими двумя металлами.
| atomic number | 47 |
|---|---|
| atomic weight | 107.868 |
| melting point | 960.8 °C (1,861.4 °F) |
| boiling point | 2,212 ° C (4014 °F) |
| удельный вес | 10,5 (20 °C [68 °F]) |
| степени окисления | +1, +2, +3 |
| [Kr]4 d 10 5 s 1 |
называются драгоценными металлами. Из-за своей сравнительной редкости, ярко-белого цвета, ковкости, пластичности и стойкости к атмосферному окислению серебро уже давно используется в производстве монет, украшений и ювелирных изделий.
 Серебро обладает самой высокой из всех известных металлов электро- и теплопроводностью и используется при изготовлении печатных электрических схем и в качестве осажденного из паровой фазы покрытия для электронных проводников; он также легирован такими элементами, как никель или палладий, для использования в электрических контактах. Серебро также находит применение в качестве катализатора благодаря своей уникальной способности превращать этилен в оксид этилена, который является предшественником многих органических соединений. Серебро — один из самых благородных, то есть наименее химически активных переходных элементов.
Серебро обладает самой высокой из всех известных металлов электро- и теплопроводностью и используется при изготовлении печатных электрических схем и в качестве осажденного из паровой фазы покрытия для электронных проводников; он также легирован такими элементами, как никель или палладий, для использования в электрических контактах. Серебро также находит применение в качестве катализатора благодаря своей уникальной способности превращать этилен в оксид этилена, который является предшественником многих органических соединений. Серебро — один из самых благородных, то есть наименее химически активных переходных элементов. Britannica Quiz
36 вопросов из самых популярных научных викторин Britannica
Насколько хорошо вы знаете астрономию? Как насчет квантовой механики? Эта викторина проведет вас через 36 самых сложных вопросов из самых популярных викторин Britannica о естественных науках. Только лучшие викторины закончат его.
Серебряные украшения и украшения были найдены в царских гробницах, датируемых 4000 г. до н.э. Вполне вероятно, что и золото, и серебро использовались в качестве денег к 800 г. до н. э. во всех странах между Индом и Нилом.
до н.э. Вполне вероятно, что и золото, и серебро использовались в качестве денег к 800 г. до н. э. во всех странах между Индом и Нилом.
Серебро широко распространено в природе, но его общее количество довольно мало по сравнению с другими металлами; металл составляет 0,05 части на миллион земной коры. Практически все сульфиды свинца, меди и цинка содержат некоторое количество серебра. Серебросодержащие руды могут содержать количество серебра от следов до нескольких тысяч тройских унций на тонну эвердупуа, или около 10 процентов.
В отличие от золота, серебро присутствует во многих природных минералах. Для серебра более важными месторождениями с коммерческой точки зрения являются такие соединения, как минералы тетраэдрит и аргентит (сульфид серебра, Ag 2 S), который обычно связан с другими сульфидами, такими как сульфиды свинца и меди, а также с некоторыми другими сульфидами, некоторые из которых также содержат сурьму. Серебро обычно встречается в свинцовых рудах, медных рудах и рудах арсенида кобальта, а также часто связано с золотом в природе. Большая часть серебра получается как побочный продукт из руд, которые добываются и обрабатываются для получения этих других металлов. Месторождения самородного (химически свободного или несвязанного) серебра также имеют промышленное значение.
Большая часть серебра получается как побочный продукт из руд, которые добываются и обрабатываются для получения этих других металлов. Месторождения самородного (химически свободного или несвязанного) серебра также имеют промышленное значение.
Поскольку большинство руд, содержащих серебро, также содержат такие важные металлы, как свинец, медь или цинк или их комбинацию, серебросодержащая фракция этих руд часто извлекается как побочный продукт производства меди и свинца. . Затем из сырой фракции извлекают чистое серебро путем плавки в сочетании с огневым или электрорафинированием. (Для получения информации о восстановлении и аффинаже серебра см. обработка серебра.)
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
| страна | добыча на руднике в 2016 г. (метрические тонны)* | % мировой добычи полезных ископаемых | доказанные запасы 2016 г. | % мировых доказанных запасов** |
|---|---|---|---|---|
| *Оценивать. | ||||
| ** Включая серебро, получаемое из руд цветных металлов. | ||||
| *** Детали не добавляются к общему количеству из-за округления. | ||||
| Источник: Министерство внутренних дел США, Сводные данные о минеральном сырье, 2017 г. | ||||
| Мексика | 5600 | 20,7 | 37000 | 6,5 |
| Перу | 4100 | 15.2 | 120 000 | 21.1 |
| Китай | 3600 | 13.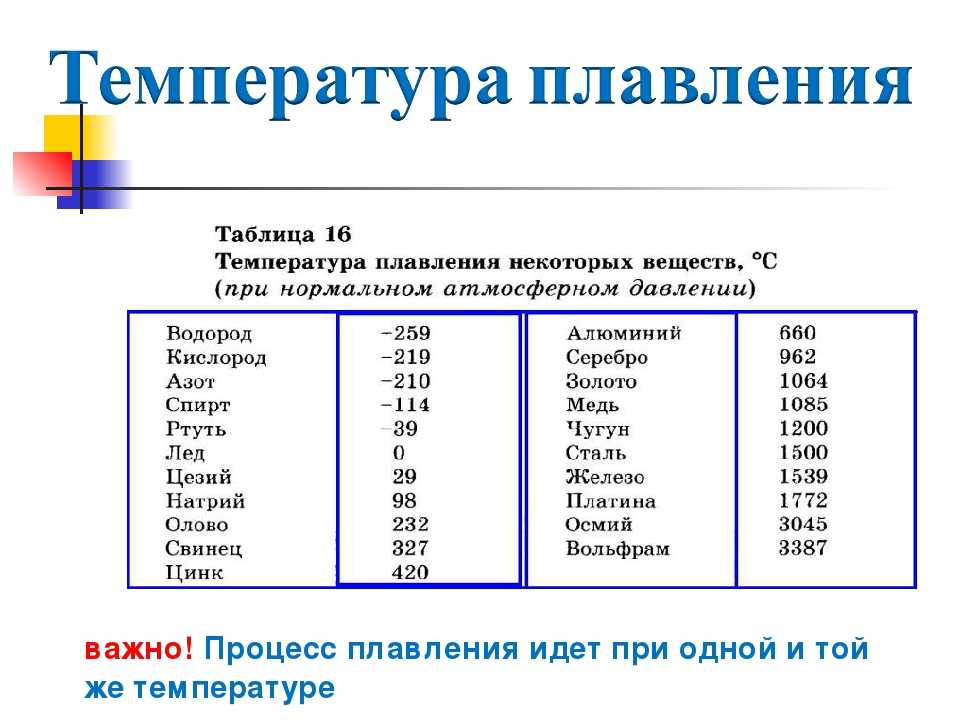 3 3 | 39000 | 6,8 |
| Чили | 1500 | 5.6 | 77000 | 13,5 |
| Австралия | 1400 | 5.2 | 89000 | 15,6 |
| Польша | 1400 | 5.2 | 85 000 | 14,9 |
| Россия | 1400 | 5.2 | 20 000 | 3,5 |
| Боливия | 1300 | 4,8 | 22000 | 3,9 |
| Соединенные Штаты | 1100 | 4.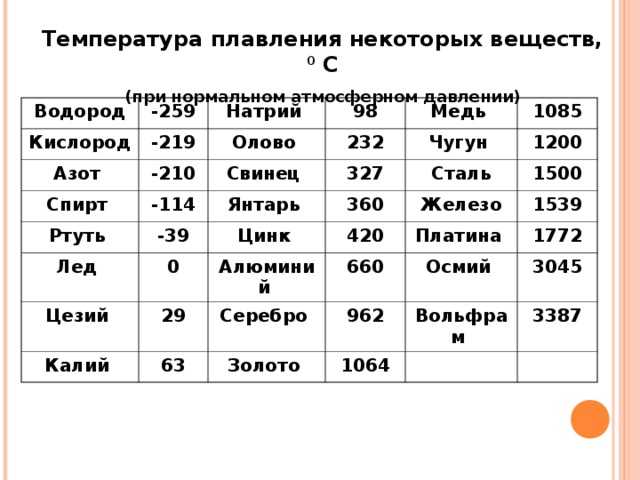 1 1 | 25000 | 4.4 |
| другие страны | 5400 | 20 | 57000 | 10 |
| мировой итог | 27000 | 100*** | 570 000 | 100*** |
Исторически сложилось так, что серебро в основном использовалось в денежной форме в виде резервов серебряных слитков и монет. Однако к 1960-м годам спрос на серебро для промышленных целей, в частности для фотоиндустрии, превысил общий годовой мировой объем производства. В начале 21 века цифровые камеры вытеснили те, в которых использовалась пленка, но спрос на серебро в других секторах, таких как столовое серебро и изделия из серебра с покрытием, украшения, ювелирные изделия, монеты, электронные компоненты и фотогальванические элементы, продолжал оставаться важным.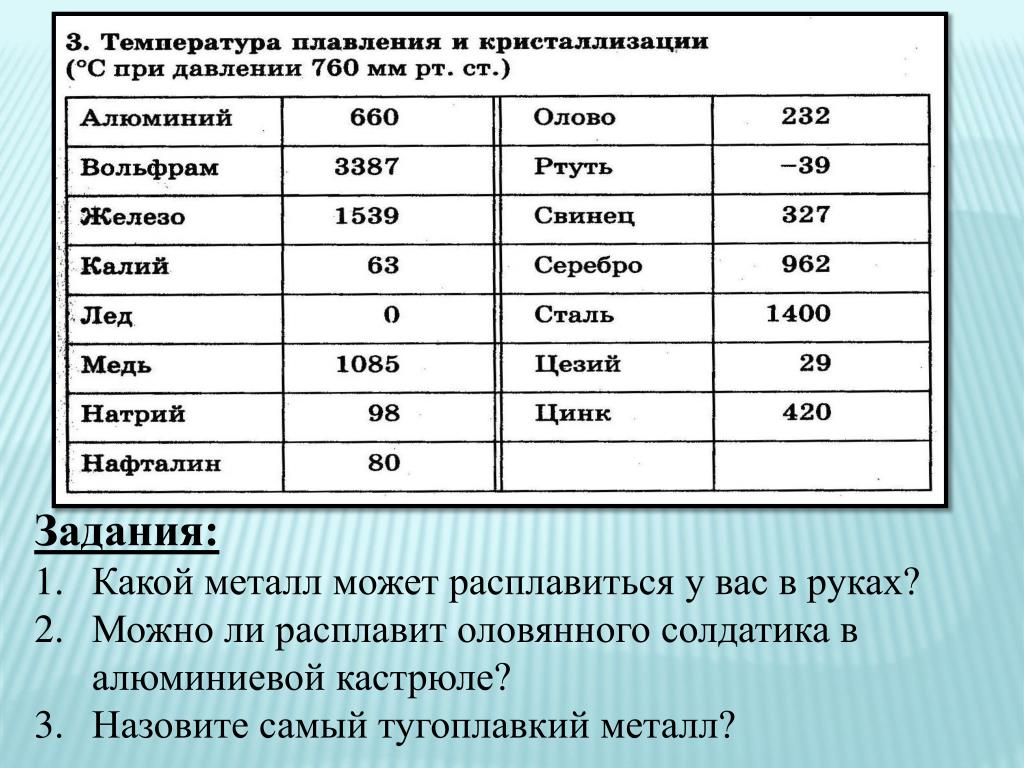
Сплавы серебра с медью тверже, прочнее и легче плавятся, чем чистое серебро, и используются для ювелирных изделий и чеканки монет. Доля серебра в этих сплавах указывается в пробе, что означает количество частей серебра на тысячу сплава. Стерлинговое серебро содержит 92,5 процента серебра и 7,5 процента другого металла, обычно меди; т. е. оно имеет пробу 925. Ювелирное серебро представляет собой сплав, содержащий 80 процентов серебра и 20 процентов меди (чистота 800). Желтое золото, используемое в ювелирных изделиях, состоит из 53 процентов золота, 25 процентов серебра и 22 процентов меди. (Для рассмотрения использования серебра в декоративных и бытовых предметах, см. металлоконструкции.)
Натуральное серебро состоит из смеси двух стабильных изотопов: серебра-107 (51,839%) и серебра-109 (48,161%). Металл не реагирует с влажным воздухом или сухим кислородом, а поверхностно окисляется влажным озоном. Он быстро тускнеет при комнатной температуре из-за воздействия серы или сероводорода. В расплавленном состоянии серебро может растворять до 22-кратного объема кислорода; при затвердевании большая часть кислорода удаляется, явление, известное как выплескивание серебра. Это можно контролировать, добавляя в расплавленное серебро раскислитель, такой как древесный уголь. Серебро легко растворяется в азотной кислоте и в горячей концентрированной серной кислоте. Металл также растворяется в окисляющих кислотах и в растворах, содержащих ионы цианидов, в присутствии кислорода или перекисей. Растворение в растворах цианидов связано с образованием очень стабильного дицианоаргентата [Ag(CN) 2 ] − , ион.
В расплавленном состоянии серебро может растворять до 22-кратного объема кислорода; при затвердевании большая часть кислорода удаляется, явление, известное как выплескивание серебра. Это можно контролировать, добавляя в расплавленное серебро раскислитель, такой как древесный уголь. Серебро легко растворяется в азотной кислоте и в горячей концентрированной серной кислоте. Металл также растворяется в окисляющих кислотах и в растворах, содержащих ионы цианидов, в присутствии кислорода или перекисей. Растворение в растворах цианидов связано с образованием очень стабильного дицианоаргентата [Ag(CN) 2 ] − , ион.
Подобно меди, серебро имеет единственный электрон s вне завершенной оболочки d , но, несмотря на сходство электронных структур и энергий ионизации, между серебром и медью мало сходства.
Соединения
Для серебра исключительно важной степенью окисления во всей его обычной химии является состояние +1, хотя известны состояния +2 и +3.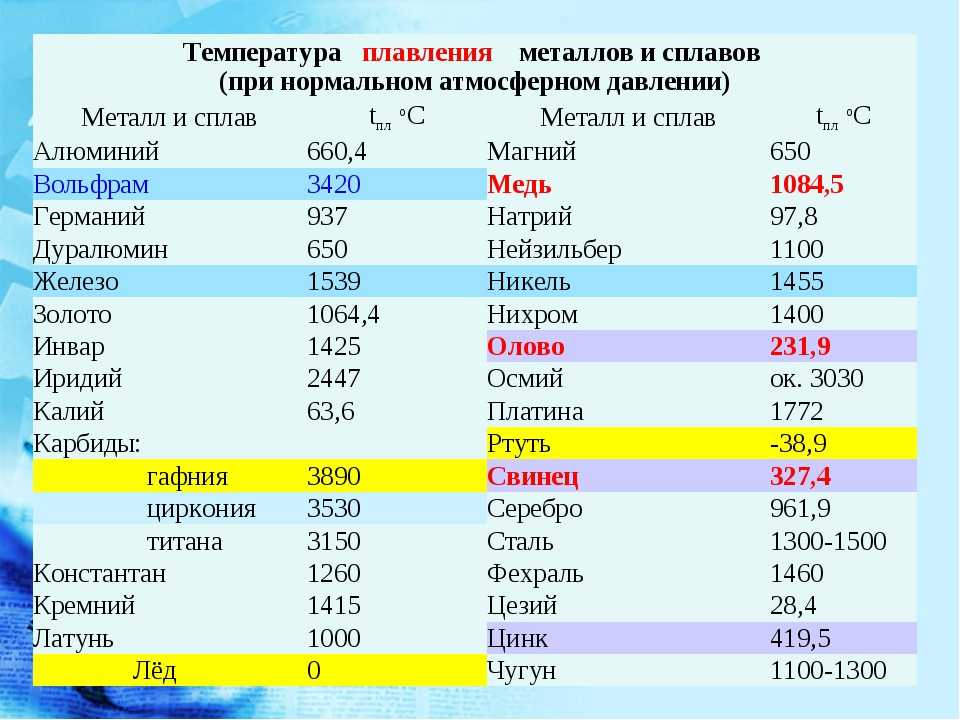
Соединения серебра включают хлорид серебра (AgCl), бромид серебра (AgBr) и йодид серебра (AgI). Каждая из этих солей используется в фотографии. Хлорид серебра служит светочувствительным материалом в бумаге для фотопечати и, вместе с бромидом серебра, в некоторых пленках и пластинах. Йодид также используется в производстве фотобумаги и пленки, а также при засеивании облаков для искусственного вызывания дождя и в некоторых антисептиках. Все три галогенида получены из нитрата серебра (AgNO 3 ), которая является наиболее важной из неорганических солей серебра. Помимо этих других солей, нитрат серебра также является исходным материалом для производства цианида серебра, используемого в серебрении.
Редакторы Британской энциклопедииЭта статья была недавно пересмотрена и обновлена Эриком Грегерсеном.
Серебро — Точка плавления — Точка кипения
Автор
Серебро — Точка плавления и кипения
Температура плавления серебра 961,78°C .
Температура кипения Серебра: 2162°C .
Обратите внимание, что эти точки связаны со стандартным атмосферным давлением.
Температура кипения – насыщение
В термодинамике насыщение определяет состояние, при котором смесь пара и жидкости может существовать вместе при заданной температуре и давлении. Температура, при которой испарение (кипение) начинается при заданном давлении, называется температурой насыщения или точкой кипения . Давление, при котором начинается испарение (кипение) при данной температуре, называется давлением насыщения. Когда ее рассматривают как температуру обратного перехода из пара в жидкость, ее называют точкой конденсации.
Точка плавления
В термодинамике точка плавления определяет состояние, при котором твердое тело и жидкость могут существовать в равновесии.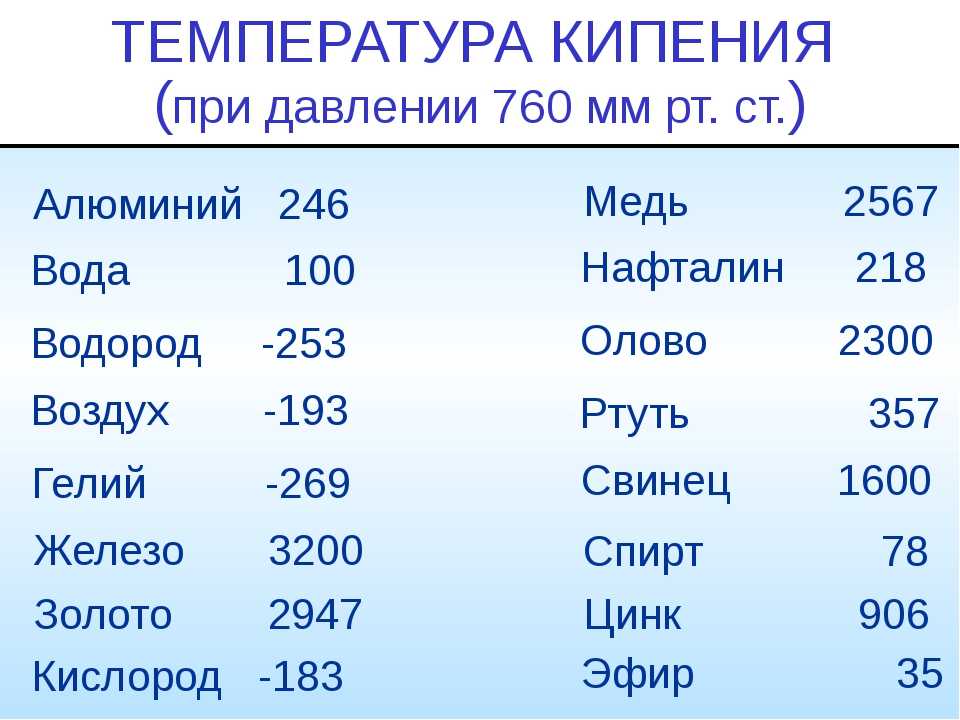 Добавление тепла превратит твердое вещество в жидкость без изменения температуры. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда ее рассматривают как температуру обратного перехода от жидкого к твердому, ее называют точкой замерзания или точкой кристаллизации.
Добавление тепла превратит твердое вещество в жидкость без изменения температуры. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда ее рассматривают как температуру обратного перехода от жидкого к твердому, ее называют точкой замерзания или точкой кристаллизации.
Первая теория, объясняющая механизм плавления в объеме, была предложена Линдеманном, который использовал колебание атомов в кристалле для объяснения плавления. Твердые тела похожи на жидкости тем, что оба находятся в конденсированном состоянии, а частицы находятся гораздо ближе друг к другу, чем частицы газа. Атомы в твердом теле тесно связаны друг с другом либо в правильной геометрической решетке (кристаллические твердые тела, которые включают металлы и обычный лед), либо в неправильной (аморфное твердое тело, такое как обычное оконное стекло), и обычно имеют низкую энергию. движение отдельных атомов , ионов или молекул в твердом теле ограничивается колебательным движением вокруг фиксированной точки. Когда твердое тело нагревается, его частицы вибрируют быстрее , поскольку твердое тело поглощает кинетическую энергию. В какой-то момент амплитуда колебаний становится настолько большой, что атомы начинают вторгаться в пространство своих ближайших соседей и возмущать их, и начинается процесс плавления. Точка плавления – это температура, при которой разрушающие вибрации частиц твердого тела преодолевают силы притяжения, действующие внутри твердого тела.
Когда твердое тело нагревается, его частицы вибрируют быстрее , поскольку твердое тело поглощает кинетическую энергию. В какой-то момент амплитуда колебаний становится настолько большой, что атомы начинают вторгаться в пространство своих ближайших соседей и возмущать их, и начинается процесс плавления. Точка плавления – это температура, при которой разрушающие вибрации частиц твердого тела преодолевают силы притяжения, действующие внутри твердого тела.
Silver – Properties
| Element | Silver | |
|---|---|---|
| Atomic Number | 47 | |
| Symbol | Ag | |
| Element Category | Transition Metal | |
| Фаза при STP | Твердое вещество | |
| Атомная масса [а.е.м.] | 107,8682 | |
| Плотность при STP [г/см3] | 10,49 | |
| Electron Configuration | [Kr] 4d10 5s1 | |
| Possible Oxidation States | +1 | |
| Electron Affinity [kJ/mol] | 125. 6 6 | |
| Electronegativity [Pauling scale] | 1.93 | |
| Первая энергия ионизации [эВ] | 7,5762 | |
| Год открытия | неизвестно | |
| неизвестно | Первооткрыватель0032||
| Термические свойства | ||
| . Точка плавления [Шкала Цельсисия] | 961,78 | |
| . Точка кипячения [Celsius. | Specific Heat [J/g K] | 0.235 |
| Heat of Fusion [kJ/mol] | 11.3 | |
| Heat of Vaporization [kJ/mol] | 250.58 |
| Hydrogen1H | Helium2He | ||||||||||||||||||
| Lithium3Li | Beryllium4Be | Boron5B | Carbon6C | Nitrogen7N | Oxygen8O | Fluorine9F | Neon10Ne | ||||||||||||
| Sodium11Na | Magnesium12Mg | Алюминий13Al | Кремний14Si | Фосфор15P | Сера16S | Хлор17Cl | Argon18Ar | ||||||||||||
| Potassium19K | Calcium20Ca | Scandium21Sc | Titanium22Ti | Vanadium23V | Chromium24Cr | Manganese25Mn | Iron26Fe | Cobalt27Co | Nickel28Ni | Copper29Cu | Zinc30Zn | Gallium31Ga | Germanium32Ge | Мышьяк33As | Селен34Se | Бром35Br | Криптон36Kr | ||
| Rubidium37Rb | Strontium38Sr | Yttrium39Y | Zirconium40Zr | Niobium41Nb | Molybdenum42Mo | Technetium43Tc | Ruthenium44Ru | Rhodium45Rh | Palladium46Pd | Silver47Ag | Cadmium48Cd | Indium49In | Tin50Sn | Antimony51Sb | Теллур52Те | Йод53I | Ксенон54Хе | ||
| Caesium55Cs | Barium56Ba | Lanthanum57La | Hafnium72Hf | Tantalum73Ta | Tungsten74W | Rhenium75Re | Osmium76Os | Iridium77Ir | Platinum78Pt | Gold79Au | Mercury80Hg | Thallium81Tl | Lead82Pb | Bismuth83Bi | Polonium84Po | Астатин85At | Радон86Rn | ||
| Франций87Fr | Radium88Ra | Actinium89Ac | Rutherfordium104Rf | Dubnium105Db | Seaborgium106Sg | Bohrium107Bh | Hassium108Hs | Meitnerium109Mt | Darmstadtium110Ds | Roentgenium111Rg | Copernicium112Cn | Nihonium113Nh | Flerovium114Fl | Moscovium115Mc | Livermorium116Lv | Tennessine117Ts | Оганесон118Ог | ||
| Cerium58Ce | Praseodymium59Pr | Neodymium60Nd | Promethium61Pm | Samarium62Sm | Europium63Eu | Gadolinium64Gd | Terbium65Tb | Dysprosium66Dy | Holmium67Ho | Erbium68Er | Thulium69Tm | Ytterbium70Yb | Лютеций71Lu | ||||||
| Thorium90Th | Protactinium91Pa | Uranium92U | Neptunium93Np | Plutonium94Pu | Americium95Am | Curium96Cm | Berkelium97Bk | Californium98Cf | Einsteinium99Es | Fermium100Fm | Mendelevium101Md | Nobelium102No | Lawrencium103Lr | ||||||
–
–
–
сообщите об этом объявлении
Воспламеняется ли серебро? (Точка плавления и кипения серебра)
Вы столкнулись с изделиями из серебра, такими как украшения и столовые приборы. Серебро также является стандартом во многих других отраслях. Кроме того, он служил глобальным средством обмена. Но есть некоторые уникальные характеристики серебра, которые вы могли заметить и которые, возможно, вызвали у вас некоторые опасения. Серебро легко воспламеняется? Это может быть один из запросов.
Серебро также является стандартом во многих других отраслях. Кроме того, он служил глобальным средством обмена. Но есть некоторые уникальные характеристики серебра, которые вы могли заметить и которые, возможно, вызвали у вас некоторые опасения. Серебро легко воспламеняется? Это может быть один из запросов.
Это один из вопросов, на который мы ответим в этой статье. Мы также можем определить температуры плавления и кипения серебра и их влияние. Узнайте, вредно ли серебро или вызывает коррозию, и насколько оно эффективно в качестве антибактериального средства. Наконец, мы показываем, реагирует ли серебро с водой и может ли оно обнаруживать яд.
Прочтите: Воспламеняется ли лак для ногтей?
Содержание
- Можно ли сжигать серебро?
- При какой температуре плавится серебро?
- При какой температуре кипит серебро?
- Насколько эффективно серебро как антибактериальное средство?
- Уход за ранами
- Медицинские приборы
- Серебро вызывает коррозию?
- Серебро токсично?
- Реагирует ли серебро с водой?
- Может ли серебро обнаруживать яд?
- Заключение
Можно ли сжигать серебро?
Серебро не воспламеняется в твердом состоянии. Если вы хотите сжечь серебро, вам придется растереть его в порошок. В твердом виде серебро не воспламеняется и не горит. Серебро считается очень инертным элементом. Попробуйте полить его кислотой, и вы заметите, что никакой реакции не происходит. Однако серебряная пыль легко воспламеняется и может вызвать взрыв.
Если вы хотите сжечь серебро, вам придется растереть его в порошок. В твердом виде серебро не воспламеняется и не горит. Серебро считается очень инертным элементом. Попробуйте полить его кислотой, и вы заметите, что никакой реакции не происходит. Однако серебряная пыль легко воспламеняется и может вызвать взрыв.
Не подвергайте серебряную пыль воздействию любого источника открытого пламени или искр. Твердая форма серебра с трудом реагирует с кислородом, который сначала плавится, а затем кипит и, в конце концов, сгорает.
При какой температуре плавится серебро?
Серебро плавится при 1763°F (961,8°C). В результате такой температуры плавления вряд ли можно плавить серебро на своей печи! Поскольку большинство домашних пожаров горят при температуре 1112 ° F, серебро не может расплавиться в домашнем пожаре. Однако серебро может расплавиться в полностью сформировавшемся домашнем пожаре, который горит при температуре 1800°F.
Серебро, возможно, не самое высокое в периодической таблице, но все же имеет высокую температуру плавления. Большинство производителей отдают предпочтение серебру в электротехнической и механической промышленности из-за его высокой термостойкости. Однако серебро обычно смешивают с другими металлами, что влияет на его температуру плавления.
Большинство производителей отдают предпочтение серебру в электротехнической и механической промышленности из-за его высокой термостойкости. Однако серебро обычно смешивают с другими металлами, что влияет на его температуру плавления.
Чистое серебро довольно мягкое и в основном изготавливается из слитков, таких как серебряные монеты или слитки. Поскольку чистое серебро легко повреждается, его смешивают с другими металлами, чтобы укрепить его. Примером может служить стерлинговое серебро, из которого обычно делают украшения, монеты и предметы старины. Стерлинговое серебро содержит 92,5% серебра и 7,5% меди или другого металла. Его температура плавления составляет 1639,4 ° F.
Хотите узнать, умеете ли вы плавить серебро? Смотрите:
При какой температуре закипает серебро?
Серебро кипит при 3924°F (2162°C).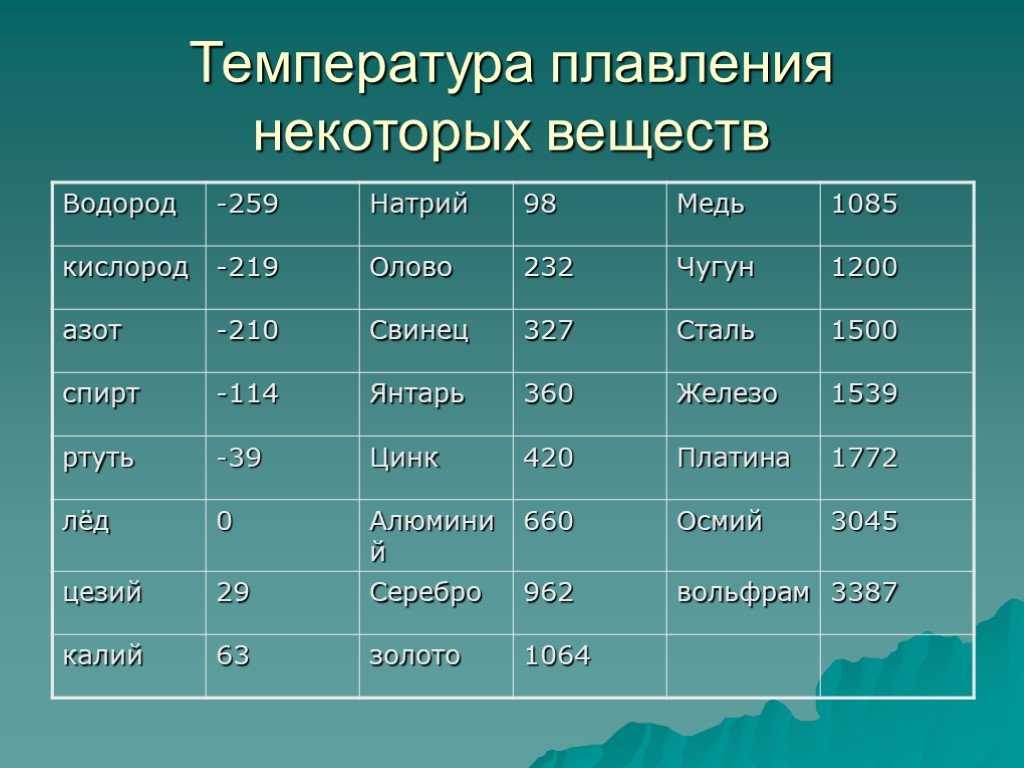 Точка кипения серебра соответствует стандартному атмосферному давлению. Температура кипения – это температура, при которой начинается испарение. Она также известна как точка насыщения. Насыщение в термодинамике — это состояние, при котором смесь пара и жидкости может существовать вместе при данных температуре и давлении.
Точка кипения серебра соответствует стандартному атмосферному давлению. Температура кипения – это температура, при которой начинается испарение. Она также известна как точка насыщения. Насыщение в термодинамике — это состояние, при котором смесь пара и жидкости может существовать вместе при данных температуре и давлении.
Насколько эффективно серебро как антибактериальное средство?
Серебро — превосходное антибактериальное средство. Его электрическая структура эффективно уничтожает некоторые вирусы, грибковые споры и бактерии. Однако серебро эффективно убивает бактерии только в ионной форме, что требует от него потери электрона, чтобы стать положительно заряженным. Эти ионы серебра воздействуют на микроорганизмы различными способами, как показано ниже:
- Клеточные стенки бактерий соединены положительно заряженными ионами серебра, препятствующими проникновению веществ в клетку и выходу из нее.
- Ионы серебра связываются с жизненно важными компонентами клетки, такими как ДНК, не позволяя бактериям выполнять свои основные процессы, такие как репликация.

- Ионы серебра проникают в бактериальную клетку, блокируя дыхательную систему и способность производить энергию. В конце концов, клеточная мембрана бактерий лопнет, что приведет к гибели.
Из-за вышеперечисленных качеств серебро стало фаворитом во многих антибактериальных областях, таких как:
Уход за ранами
Современные технологии сделали возможным использование современных серебросодержащих перевязочных материалов для ран. Поскольку металл обладает некоторыми антимикробными свойствами, ткань, вплетенная в ткань, предотвратит накопление бактерий на отложениях пота и масел. Ткани используются для снижения риска внутрибольничных инфекций и для личной гигиены. Об этом сообщает Королевское химическое общество (RSC).
Эти ткани помогают зашивать хронические раны и язвы, моделировать катетеры для крови и мочевого пузыря, а также перевязывать послеоперационные разрезы. Способность серебра уменьшать или предотвращать инфекции привела к местному применению кремов с антибиотиками серебра для лечения ожогов и хронических ран. Местный антибиотик под названием сульфадиазин серебра (SSD) используется при ожогах, чтобы остановить инфекцию. Крем входит в Примерный перечень основных лекарственных средств ВОЗ.
Местный антибиотик под названием сульфадиазин серебра (SSD) используется при ожогах, чтобы остановить инфекцию. Крем входит в Примерный перечень основных лекарственных средств ВОЗ.
Медицинские приборы
Серебро обычно малотоксично, что делает его наиболее предпочтительным при изготовлении медицинских приборов. Некоторые из медицинских устройств:
- Эндотрахеальные трубки: Серебряное покрытие на трубках снижает вероятность развития вентилятор-ассоциированной пневмонии (ВАП).
- Катетеры из серебряного сплава: Катетеры вызывают меньший дискомфорт для пациента и снижают риск инфекций мочевыводящих путей, связанных с катетером.
- Фотопластинки с галогенидом серебра: В развивающихся странах, где цифровое рентгеновское оборудование обычно недоступно, пластины хорошо работают с рентгеновскими изображениями, обладают высокой точностью и недороги.
Серебро вызывает коррозию?
Поскольку серебро не окисляется легко, оно очень устойчиво к коррозии.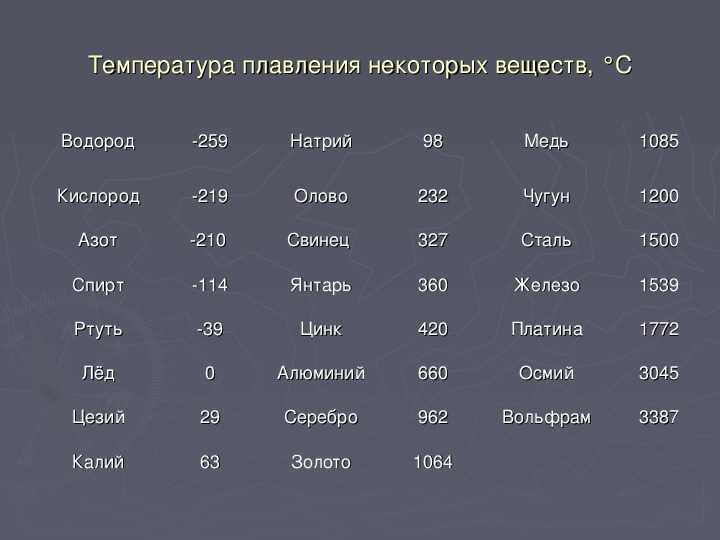 Однако он производит акантит из сульфида серебра (Ag2S) при контакте с серосодержащими газами, такими как сероводород и карбонилсульфид. На поверхности серебра при взаимодействии с воздухом образуется налет из сульфида серебра. Химическая реакция происходит, когда сера воздействует на серебро, оставляя на металле коричнево-черный налет.
Однако он производит акантит из сульфида серебра (Ag2S) при контакте с серосодержащими газами, такими как сероводород и карбонилсульфид. На поверхности серебра при взаимодействии с воздухом образуется налет из сульфида серебра. Химическая реакция происходит, когда сера воздействует на серебро, оставляя на металле коричнево-черный налет.
Хотя химическая реакция обычно протекает постепенно, она оставляет после себя темные трещины и ямки. Однако скорость атаки будет увеличиваться, если будет увеличиваться количество более сильных кислот или солей. Соли ускоряют реакцию, действуя как катализаторы.
Многие производители отдают предпочтение серебру из-за его низкой коррозионной активности. Это привело к различным современным применениям, таким как покрытие подшипников двигателей, зеркал и электрических контактов. В последнее время появилось наноструктурированное серебро и наночастицы серебра. Чаще всего в качестве антибактериального и стерилизующего агента используются наночастицы серебра.
Однако, поскольку серебро не подвергается быстрой коррозии, вас может заинтересовать черный налет, который постепенно появляется на ваших украшениях или серебряных столовых приборах. Серебро – мягкий металл. Поэтому производители часто смешивают его с другими металлами. Ваши серебряные украшения или посуда обычно представляют собой смесь серебра и меди. Причиной черного потускнения является коррозия меди.
Прочтите: огнеопасно ли кокосовое масло?
Серебро токсично?
Агентство по охране окружающей среды (EPA) заявляет, что серебро не является тяжелым металлом и не токсично для млекопитающих. Плесень, грибок, вирусы, простейшие и бактерии не могут выжить. Тот факт, что серебро не является канцерогенным, как считалось ранее, является, пожалуй, самым важным. Канцероген – это агент, вызывающий рак. Этот факт подтвержден токсикологической картой на серебро 9.0020 .
Тот факт, что 100% серебра, потребляемого перорально, выводится из организма в течение нескольких месяцев, является одной из причин, по которой серебро не токсично. Высокие дозы серебра при вдыхании могут раздражать верхние дыхательные пути или слизистые оболочки.
Высокие дозы серебра при вдыхании могут раздражать верхние дыхательные пути или слизистые оболочки.
У людей с аллергией на серебро может развиться контактный дерматит или дискомфорт в глазах. Однако в основном это происходит после контакта с зубными пломбами или порошкообразными растворами серебра. Соединения серебра, обнаруженные в некоторых кремах, могут вызывать обесцвечивание кожи. Проглатывание будет раздражать желудок, если это произойдет.
Длительный контакт с соединениями серебра может оставить пятна на коже, во рту, в горле и в носу. С медицинской точки зрения это состояние известно как аргирия. К сожалению, состояние кожи необратимо, и ученые считают, что это наиболее известное серьезное воздействие серебра на человека.
Реагирует ли серебро с водой?
Независимо от температуры чистая вода не вступает в реакцию с серебром. Только если вода содержит соединения серы, она начнет разрушаться. Сульфид серебра и другие соединения серебра также нерастворимы в воде.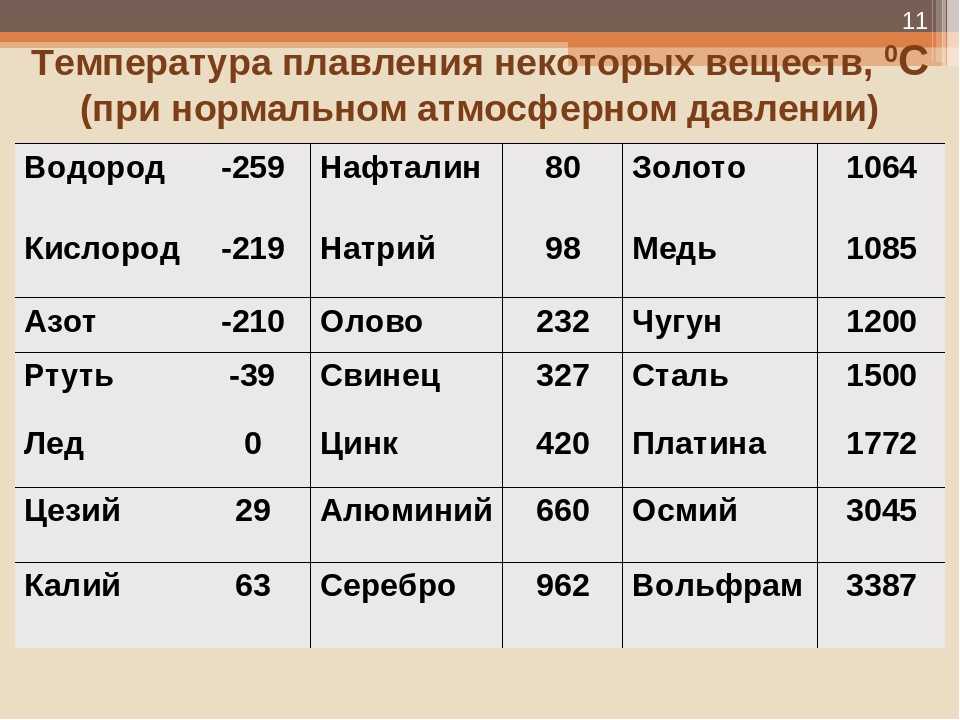 Некоторые соединения серебра, такие как хлорид серебра, в некоторой степени растворимы в воде. Обычно фториды серебра растворяются в воде.
Некоторые соединения серебра, такие как хлорид серебра, в некоторой степени растворимы в воде. Обычно фториды серебра растворяются в воде.
Серебро и его соединения ядовиты для микроорганизмов в воде. Однако вода снижает токсичность серебра для рыб. Естественные концентрации серебра в поверхностных водах не наносят вреда экосистеме.
Серебро эффективно обеззараживает воду благодаря статической природе серебра и воды. Фильтры водоочистителей содержат серебро. Серебро препятствует накоплению в фильтрах бактерий, свинца, хлора, неприятных запахов, частиц и водорослей. Серебро и кислород образуют мощное дезинфицирующее средство для воды.
Может ли серебро обнаруживать яд?
Да, серебро обнаруживает яд. Но серебром обнаружатся только яды, содержащие серу или соединения серы. Несмотря на то, что это нереакционноспособный элемент, серосодержащие соединения вызывают реакцию серебра. Сера присутствует в одном из ядов, известном как мышьяк. Несмотря на то, что сегодня этот яд уже не распространен, некоторые злые люди отравили им других.

 Жидкий металл имеет бледно-зеленую окраску. Пары его желто-зеленого цвета.
Жидкий металл имеет бледно-зеленую окраску. Пары его желто-зеленого цвета.

 Из-за этого температура плавления золота 999 возрастает по сравнению с предыдущим показателем. Она составляет 1063 оС, то есть то же значение, что и для простого вещества. Изделия из такого сплава более мягкие, способны к деформации, поэтому требуют тщательного обращения и особого ухода.
Из-за этого температура плавления золота 999 возрастает по сравнению с предыдущим показателем. Она составляет 1063 оС, то есть то же значение, что и для простого вещества. Изделия из такого сплава более мягкие, способны к деформации, поэтому требуют тщательного обращения и особого ухода.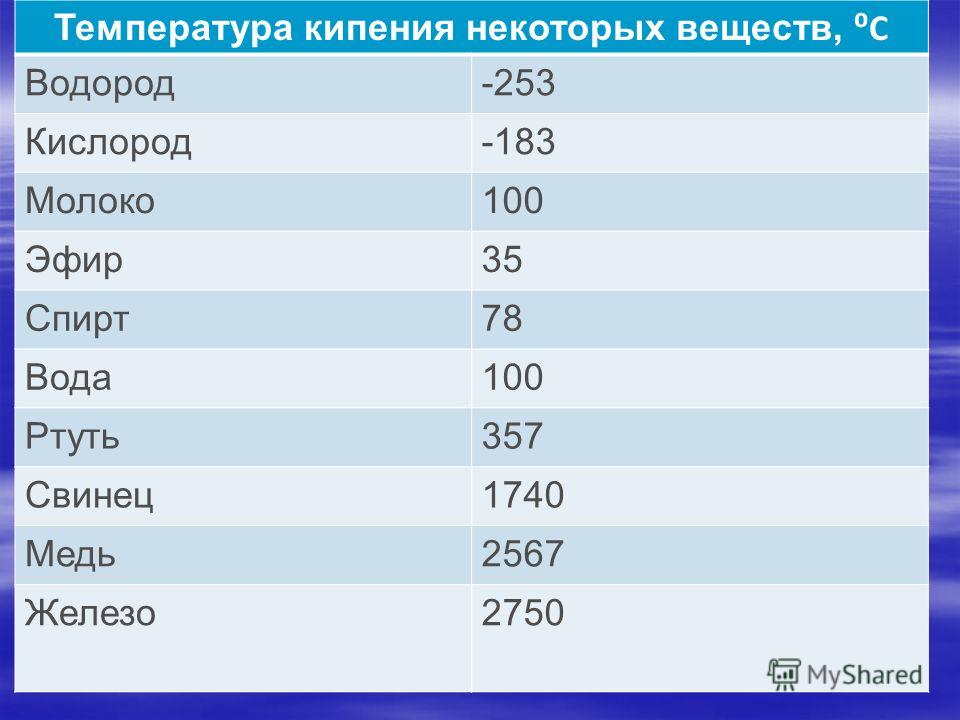 Пары его жёлто-зелёного цвета.
Пары его жёлто-зелёного цвета.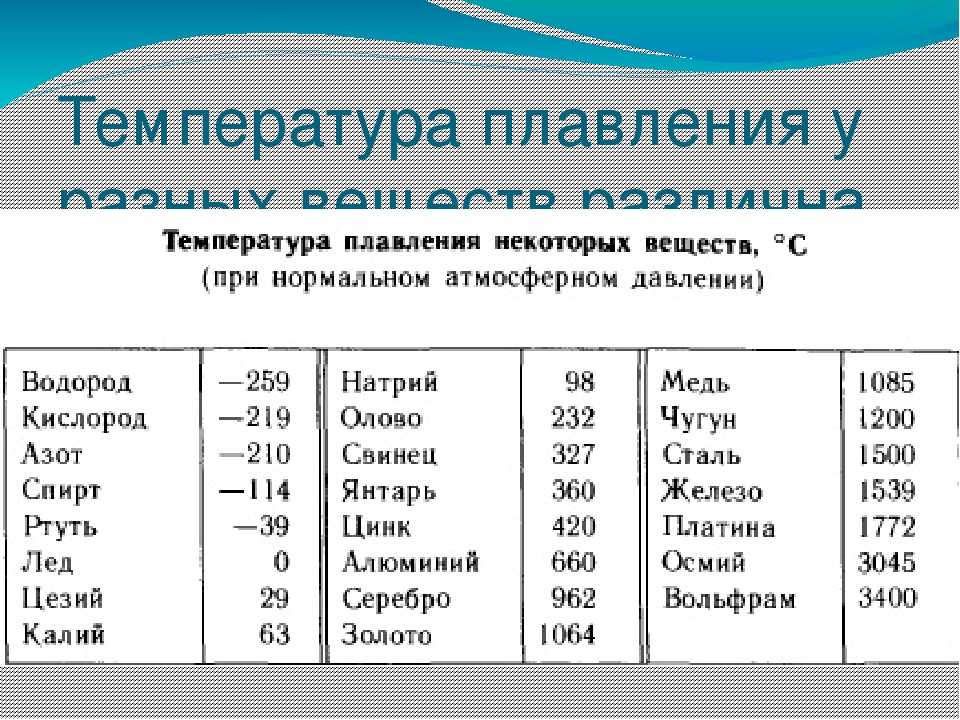 Чтобы не бояться инфляции и дефолта, многие сохраняют свои сбережения в виде металлических слитков.
Чтобы не бояться инфляции и дефолта, многие сохраняют свои сбережения в виде металлических слитков. Однако, если её слишком много, то изделие будет подвержено коррозии.
Однако, если её слишком много, то изделие будет подвержено коррозии.