Свинец расплавили в железной чашке
1. Расплавленный свинец с течением времени перешел в твердое состояние. Какой из графиков соответствует этому процессу?
2. Определите , какая масса льда расплавилась при температуре 0°С и нормальном атмосферном давлении, если льду передать количество теплоты, равное 680 кДж.
3. Определите количество теплоты, необходимое для того, что бы расплавить 0,1 кг свинца, взятого при температуре 20°С.
4. Какое количество теплоты необходимо отобрать у 5 кг воды, имеющей температуру 10 °С, чтобы превратить ее в лед с температурой -30°С?
5. Полярники получают необходимую им воду, растапливая лед. Сколько керосина потребуется сжечь для получения 15л кипяченой воды, если температура окружающей полярников среды равна -40°С? Считайте, что вода получает 50% энергии, выделяющейся при сгорании керосина.
6. Свинец расплавили в железной чашке и довели его температуру до 350°С. Затем чашку вынули из печи и поставили на лабораторный стол.
7. В алюминиевой кастрюле массой 0,5 кг находится 2кг льда при температуре 0°С. На сколько градусов нагрелась вода, образовавшаяся после таяния льда, если было сожжено 50г керосина? КПД нагревателя 50%.
Домашнее задание
1. Воду, взятую при температуре 20°С, превратили в лед с температурой -10°С. Какой из графиков соответствует этому процессу?
2. Найдите отношение количеств теплоты, необходимых для плавления золотого кольца массой 20г и оловянного солдатика массой 50г. Считайте, что кольцо и солдатик предварительно нагреты до температур их плавления.
3. Имеется 10 кг льда при температуре -20°С и нормальном атмосферном давлении. Определите количество теплоты, необходимое для получения из этого льда воды с температурой 80°С.
4. Слиток серебра массой 10г расплавили при нормальном атмосферном давлении.
5. Определите, какое количество свинца, взятого при температуре 0°С, можно расплавить за счет теплоты, полученной при сгорании 1 кг бензина, если КПД нагревателя 80%.
6. На графике приведена зависимость температуры меди, находящейся в плавильной печи, от времени. Из перечисленных ниже процессов выберите те, которые отображены на графике.
7. В кастрюле теплоемкостью 300Дж/°С находилась вода массой 3г при температуре 17°С. В кастрюлю опустили 400г мокрого снега. Сколько воды содержал снег, если после его таяния температура воды стала 7°С?
О3. – В калориметр, где находится 1 кг льда при температуре 0°С, наливают воду, температурой 40°С. Какая температура установится при этом в калориметре? Рассмотрите два случая а) масса воды 1 кг, б) масса воды 4 кг.
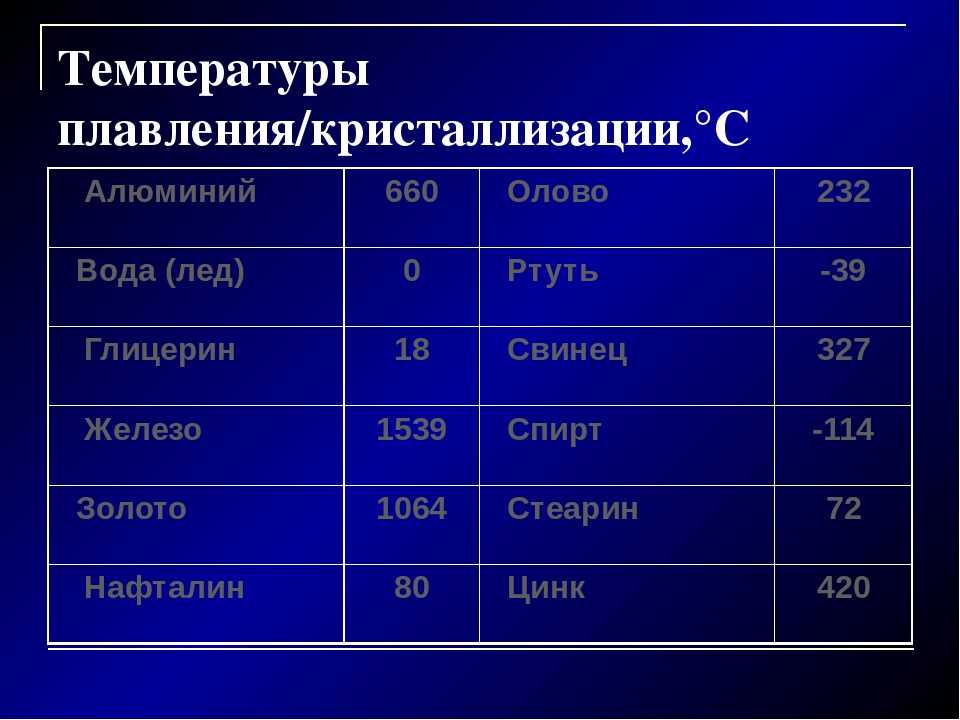
| Вещество | Температура плавления, °C | Теплота плавления λ, 10 3 Дж/кг |
| Азот | -210 | 25,9 |
| Алюминий | 660,4 | |
| Ацетон | -94 | |
| Бензол | 5,5 | |
| Висмут | ||
| Вода (лёд) | 332,4 | |
| Водород | -259,14 | 58,6 |
| Вольфрам | ||
| Германий | ||
| Гелий (при давлении 2,5 МПа) | -272,2 | 5,72 |
| Железо | ||
| Золото | 1064,43 | 66,6 |
| Калий | 60,8 | |
| Кислород | -218,4 | 13,8 |
| Литий | ||
| Магний | ||
| Медь | 1084,5 | |
| Натрий | ||
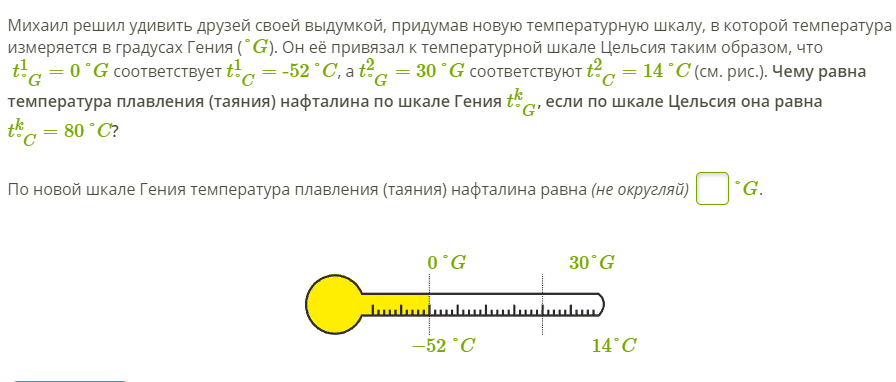
| Нафталин | 80,3 | |
| Никель | 305,6 | |
| Олово | 231,9 |
Тема 4: «Парообразование, конденсация, кипение»
1. Какое количество теплоты надо сообщить 30г воды, взятой при 0°С, чтобы нагреть ее до температуры кипения и затем полностью превратить ее в пар при нормальном атмосферном давлении?
Какое количество теплоты надо сообщить 30г воды, взятой при 0°С, чтобы нагреть ее до температуры кипения и затем полностью превратить ее в пар при нормальном атмосферном давлении?
2. Сколько энергии при нормальном атмосферном давлении надо израсходовать на нагревание 750г воды от 5°С до температуры кипения и для дальнейшего образования 250г водяного пара?
3. Сколько необходимо сжечь спирта, что бы 2 кг льда, взятого при -5°С, расплавить, полученную воду нагреть и 1 кг воды превратить в пар? КПД спиртовки 40%.
4. В калориметре находится вода массой mв=1кг при температуре tв=20°С. Сколько пара, имеющего температуру tп=100°С, нужно впустить в калориметр, что бы температура в нем поднялась до t=40°С?
Домашнее задание
1. Водяной пар массой 300г при нормальном атмосферном давлении и температуре 100°С сконденсировался. Получившуюся воду охладили до 50°С. Какое количество теплоты выделилось при конденсации пара и последующем охлаждении получившейся воды?
2. Определите массу вещества, которую можно превратить в пар при нормальном атмосферном давлении и температуре кипения, сообщив ему количество теплоты, равное 5МДж
Определите массу вещества, которую можно превратить в пар при нормальном атмосферном давлении и температуре кипения, сообщив ему количество теплоты, равное 5МДж
| Вещество | m, кг | Вещество | m, кг |
| Вода | Эфир | ||
| Аммиак | Ртуть | ||
| Спирт | Жидкий воздух |
3. Самый распространенный метод опреснения морской воды состоит в ее выпаривании: растворенные в воде соли в пар не попадают, поэтому после конденсации пара образуется пресная вода. Сколько каменного угля нужно сжечь для опреснения 1т воды? Начальная температура воды 20°С, тепловые характеристики соленой и пресной воды считайте одинаковыми.
4. На газовой горелке нагревается алюминиевый чайник массой 1.2 кг, содержащий 2л воды при температуре 15°С. Вода в чайнике нагрелась до 100°С и 200г ее выпарилось. Каков КПД горелки, если при этом сгорело 0,1 м 3 природного газа?
О4. – В калориметр, содержащий 500г воды при температуре 20°С, впустили водяной пар при температуре 100°С.
В апреле в трубопроводную систему «Дружба», по которой идет экспорт нефти из России через Белоруссию в европейском направлении, попало загрязненное хлоридами сырье. В результате временно прокачка была.
на ввоз в Азербайджан автомобильного бензина AI-95 и AI-92 снижены с 15% до нуля», – отмечается в постановлении правительства.
Также решением правительства ставки по акцизам на импортируемый в страну бензин с содержанием свинца не более 0, 013.
Компания «РН-Востокнефтепродукт», входящая в розничную сеть НК «Роснефть», открыла после реконструкции Вольно-Надеждинскую базу нефтепродуктов в Приморском крае. В рамках модернизации одного из ключевых объектов.
laquo;Рассматривается несколько дат, окончательной даты еще нет», — сказал он.
Ранее глава НАК «Нафтогаз Украины» Андрей Коболев в интервью изданию Handelsblatt заявлял, что очередные трехсторонние переговоры по газу пройдут 17.
Завод в июле увеличил производство всех основных продуктов, а глубина переработки на нем составила 82, 4%, отмечает компания.
«Рост показателей НПЗ связан с нормализацией поставок сырья на завод. В апреле завод.
до 2024 года. В то же время окончательное решение СИБУРа по конфигурации Амурского ГХК будет зависеть от позиции российского правительства по отрицательному акцизу на СУГ.
В материалах «Газпрома» отмечалось, что планируемый объем производства.
Минск планирует до конца года полностью восстановить нефтяной экспорт после ЧП с «Дружбой»
Азербайджан на три месяца обнулил ставки таможенных пошлин на бензин
Роснефть открыла после реконструкции Вольно – Надеждинскую базу нефтепродуктов в Приморье
Минск планирует до конца года полностью восстановить нефтяной экспорт после ЧП с «Дружбой»
Азербайджан на три месяца обнулил ставки таможенных пошлин на бензин
Роснефть открыла после реконструкции Вольно – Надеждинскую базу нефтепродуктов в Приморье
В 2007 ж/д потребление металлопроката составило примерно 13346т. Вышестоящая организация – РЖД.
Вышестоящая организация – РЖД.
В 2007 ж/д потребление металлопроката составило примерно 15825т. Вышестоящая организация – РЖД.
Отрасль: УК: Выпускаемая продукция: кадмий в чушках; свинец в чушках; цинк в чушках. Выпускаемая продукция: кадмий в чушках; свинец в чушках; цинк в чушках.
В 2007г. добыча железной руды составила 3.5 млн.т. (повысилась на 211%), чистая прибыль составила $47.7 млн. (выросла на 103%) Mount Gibson – молодое предприятие австралийской железорудной промышленности. Основанная в Перте в 1996 г., компания владеет.
В 2007 ж/д потребление металлопроката составило примерно 17556т. Вышестоящая организация – РЖД.
В 2007 ж/д потребление металлопроката составило примерно 46674т. Вышестоящая организация – РЖД.
Трансформаторные масла ГК (РосНефть), Т-1500У (РосНефть) в Рязани ООО ТФК «Комтекс» Рязань т. +7 (915) 612-37-79, www.aksioma55.ru Трасформаторное масло Т-1500У (ТУ 38. 401-58-107-94) производится из .
401-58-107-94) производится из .
Карбюризатор древесно-угольный Мешок / 15 кг Гост 2407-83 Древесноугольный карбюризатор предназначается для цементации стальных деталей и представляет собой зерна древесного угля, покрытые пленкой у.
Свинец расплавить не очень сложно. Сделать это можно и самостоятельно, воспользовавшись ёмкостью из алюминия или тонкостенной стали.
Этот металл плавится при невысокой температуре, достичь которую можно посредством обыкновенной газовой конфорки или электрической плиты.
Характеристики свинца
На нашей планете содержится 0,0016% этого металла от совокупной массы земной коры. Этот показатель хоть и небольшой, однако, если его сравнивать с иными химическими элементами — висмутом, золотом, ртутью, то свинец находится на гораздо более высокой позиции.
Преимущественный источник сырьевого материала — сульфидные полиметаллические руды. Металл имеет следующие качества:
- мягкость;
- невысокая температура плавления;
- обрабатывать этот металл можно и самостоятельно.

Этот материал характеризуется грязно-сероватым оттенком. На участке среза металл имеет синеватый отлив, который постепенно становится тусклым. Это связано с окислительным процессом, который происходит благодаря влиянию кислорода. На срезе при этом формируется оксидный слой.
Это тяжёлый металл, его плотность составляет 11,34 г/см³. Этот показатель примерно в полтора раза выше, нежели у обыкновенного железа. Помимо всего прочего, свинец также относится к наиболее мягким металлам.
Его поверхность с лёгкостью царапается даже обыкновенным ножиком или ногтём. Свинец является крайне гибким, расплющить этот металл можно обыкновенной киянкой или молотком. А ещё он нередко используется для литья или плавления своими руками.
Температура плавления
Температурные показатели, при которых свинец начинает закипать — 1751 градус.
Этот металл начинает плавиться при температуре 327,46 градуса по шкале Цельсия. Его литьевые качества полностью сохраняются в пределах от четырёхсот до четырёхсот пятидесяти градусов.
А оксидная плёнка, защищающая материал от воздействия коррозии, начинает плавиться лишь при температуре в 850 градусов Цельсия, что затрудняет сваривание этой разновидности металла с другими. Кроме того, уровень летучести свинца существенно увеличивается при температуре в 700 градусов.
Материал отлично обрабатывается и в охлаждённом виде. Из него можно сделать тонкий слой фольги. Если на этот металл воздействует давление в 2 тонны на квадратный сантиметр, то он приобретает вид монолита.
Проволоку же из него делают посредством продавливания в фильере. Низкая степень прочности на разрыв не позволяет пользоваться обыкновенным волочением для этой цели.
Подготовка к плавлению свинца
Для начала нужно найти ёмкость. Будет отлично, если ручка сосуда будет сделана из какого-нибудь жароустойчивого материала. Для этой цели можно воспользоваться старым кофейником или чайником.
Материал можно плавить и в устаревшей посуде, сделанной из чугуна, пользуясь глубокой и длинной ложкой для заливки.
Если поблизости нет подходящей ёмкости, то можно применить и обыкновенную консервную «жестянку». Однако, здесь следует пользоваться пассатижами, которые будут использоваться для снятия раскалённой посуды с пламени и заливки материала в форму.
Не забывайте, что во время работы нужно быть предельно осторожным. Чтобы упростить процедуру, на одной стороне банки можно сделать небольшой желобок. В таком случае раскалённый металл будет выливаться тоненькой струйкой чётко в необходимое место.
Очищенный от примесей материал можно помельчить, чтобы он расплавился как можно скорее. Ёмкость нужно надёжным образом поставить над горелкой и как следует прогреть. Это нужно сделать для того чтобы избавить поверхность от лишних примесей и влаги.
Процедура плавки
Не нужно пытаться расплавить сразу весь подготовленный свинец, ведь взаимодействовать с раскалённой поверхностью ёмкости будет лишь самый нижний слой.
Сначала расплавьте два-три куска, чтобы сформировалась лужица, после чего постепенно накидывайте новый материал. Так у вас появится возможность сделать рабочую площадь более объёмной.
Так у вас появится возможность сделать рабочую площадь более объёмной.
После плавления с поверхности металла нужно убрать слой мусора, примесей и шлака. Заливка должна осуществляться в нагретую форму. А также свинец характеризуется оперативным застыванием. Материал быстро утрачивает текучесть, становится более густым, в связи с чем не может полностью наполнить собой форму.
Меры безопасности
Дома нереально добиться закипания свинца, так как температура при этом должна быть крайне высокой. Так или иначе, но летучесть этого металла заметно увеличивается уже при 700 градусов.
При повышении температурных показателей, люди, находящиеся рядом, могут пострадать от неблагоприятного воздействия испарений материала.
В том случае, если нет необходимости, не нужно доводить свинец до «красноты». Расплавленный свинец может навредить следующим образом:
- При попадании на поверхность кожного покрова, он может стать причиной сильных ожогов, так как температура плавления свинца довольно высокая.

- Капли металла быстро прожигают предметы одежды.
- Если раскалённый металл попадёт на легковоспламеняющиеся предметы и материалы, то это запросто может стать причиной пожара.
А также следует избегать попадания жидкости в раскалённый металл. В противном случае может появиться фонтан из раскалённых брызг, которые могут доставить много проблем.
Плавить свинец нужно на свежем воздухе или в помещении с хорошей вентиляцией. Нежелательно избегать применения защитных средств. Респиратор или обыкновенная марля способны защитить лёгкие от металлической пыли.
|
⇐ ПредыдущаяСтр 2 из 3Следующая ⇒ 1. Расплавленный свинец с течением времени перешел в твердое состояние. Какой из графиков соответствует этому процессу? 2. Определите , какая масса льда расплавилась при температуре 0°С и нормальном атмосферном давлении, если льду передать количество теплоты, равное 680 кДж. 3. Определите количество теплоты, необходимое для того, что бы расплавить 0,1 кг свинца, взятого при температуре 20°С. 4. Какое количество теплоты необходимо отобрать у 5 кг воды, имеющей температуру 10 °С, чтобы превратить ее в лед с температурой -30°С? 5. Полярники получают необходимую им воду, растапливая лед. Сколько керосина потребуется сжечь для получения 15л кипяченой воды, если температура окружающей полярников среды равна -40°С? Считайте, что вода получает 50% энергии, выделяющейся при сгорании керосина. 6. Свинец расплавили в железной чашке и довели его температуру до 350°С. Затем чашку вынули из печи и поставили на лабораторный стол. Спустя некоторое время температура свинца понизилась до 300°С. Нарисуйте примерный график зависимости температуры t свинца от времени t. 7. В алюминиевой кастрюле массой 0,5 кг находится 2кг льда при температуре 0°С. На сколько градусов нагрелась вода, образовавшаяся после таяния льда, если было сожжено 50г керосина? КПД нагревателя 50%. Домашнее задание 1. Воду, взятую при температуре 20°С, превратили в лед с температурой -10°С. Какой из графиков соответствует этому процессу? 2. Найдите отношение количеств теплоты, необходимых для плавления золотого кольца массой 20г и оловянного солдатика массой 50г. Считайте, что кольцо и солдатик предварительно нагреты до температур их плавления. 3. Имеется 10 кг льда при температуре -20°С и нормальном атмосферном давлении. Определите количество теплоты, необходимое для получения из этого льда воды с температурой 80°С. 4. Слиток серебра массой 10г расплавили при нормальном атмосферном давлении. Какое количество теплоты выделится при кристаллизации этого серебра и последующем его охлаждении до 20°С? 5. Определите, какое количество свинца, взятого при температуре 0°С, можно расплавить за счет теплоты, полученной при сгорании 1 кг бензина, если КПД нагревателя 80%.
6. 7. В кастрюле теплоемкостью 300Дж/°С находилась вода массой 3г при температуре 17°С. В кастрюлю опустили 400г мокрого снега. Сколько воды содержал снег, если после его таяния температура воды стала 7°С?
О3. – В калориметр, где находится 1 кг льда при температуре 0°С, наливают воду, температурой 40°С. Какая температура установится при этом в калориметре? Рассмотрите два случая а) масса воды 1 кг, б) масса воды 4 кг.
Тема 4: «Парообразование, конденсация, кипение» 1. 2. Сколько энергии при нормальном атмосферном давлении надо израсходовать на нагревание 750г воды от 5°С до температуры кипения и для дальнейшего образования 250г водяного пара? 3. Сколько необходимо сжечь спирта, что бы 2 кг льда, взятого при -5°С, расплавить, полученную воду нагреть и 1 кг воды превратить в пар? КПД спиртовки 40%. 4. В калориметре находится вода массой mв=1кг при температуре tв=20°С. Сколько пара, имеющего температуру tп=100°С, нужно впустить в калориметр, что бы температура в нем поднялась до t=40°С? Домашнее задание 1. Водяной пар массой 300г при нормальном атмосферном давлении и температуре 100°С сконденсировался. Получившуюся воду охладили до 50°С. Какое количество теплоты выделилось при конденсации пара и последующем охлаждении получившейся воды? 2.
3. Самый распространенный метод опреснения морской воды состоит в ее выпаривании: растворенные в воде соли в пар не попадают, поэтому после конденсации пара образуется пресная вода. Сколько каменного угля нужно сжечь для опреснения 1т воды? Начальная температура воды 20°С, тепловые характеристики соленой и пресной воды считайте одинаковыми. 4. На газовой горелке нагревается алюминиевый чайник массой 1. О4. – В калориметр, содержащий 500г воды при температуре 20°С, впустили водяной пар при температуре 100°С. Какая температура установится в калориметре, если масса пара равна: а)10г? б)100г? Какой станет масса воды в каждом случае?
⇐ Предыдущая123Следующая ⇒ Читайте также: |
Тело вращается вокруг вертикальной оси по закону φ = 10 +.
 .. -reshimne.ru
.. -reshimne.ru
Новые вопросы
Ответы
Похожие вопросы
На каком расстоянии сила притяжения между двумя телами массой по 200 кг каждое будет равна 3·10-14(как степень) Н?…
С покоящимся на горизонтальной поверхности шаром упруго сталкивается шар в 5 раз большей массы. Удар центральный. Скорость легкого шара после удара больше скорости тяжелого шара в ….раз?…
Стакан с наклонными стенками, наполненный водой до краев, взвешивают на весах. Затем на весах взвешивают этот же стакан с водой, когда в воде плавает деревянный брусок, а вода доходит до краев стакана. Сравнить показания весов. …
…
Определить погрешность, которая может возникнуть, если кинетическую энергию электрона, движущегося со скоростью 0,75 скорости света, подсчитать не по релятивистской формуле, а по классической…
Свинец расплавили в железной чашке и довели его до температуру до 350 градусов затем чашку вынули и поставили на лабораторный стол. спустя некоторое время температура свинца понизилась до 300 градусов. нарисуйте примерный график звисемости свинца от времени…
какое колличество теплоты чтобы превратить лед массой 3 кг взятый при температуре -20 градуов в пар при температуре 100градусов…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Конечная температура после помещения теплого металла в более холодную воду
Конечная температура после помещения теплого металла в более холодную водуКогда теплый металл помещают в более холодную воду, какой получается конечная температура?
Перейти к расчету конечной температуры при смешивании металла и воды: задачи 1 — 15
Перейти к расчету конечной температуры при смешивании двух проб воды
Назад в меню термохимии
Эти задачи аналогичны смешиванию двух количеств воды, за одним небольшим исключением: значения теплоемкости в двух частях уравнения будут разными. Удельная теплоемкость воды останется на уровне 4,184, но значение для металла будет другим. Эти значения сведены в таблицы, а списки выбранных значений есть в большинстве учебников.
Удельная теплоемкость воды останется на уровне 4,184, но значение для металла будет другим. Эти значения сведены в таблицы, а списки выбранных значений есть в большинстве учебников.
Пример #1: Определите конечную температуру, когда кусок железа массой 25,0 г при температуре 85,0 °C помещают в 75,0 г воды при температуре 20,0 °C.
Сначала обсуждение, потом решение. Простите меня, если пункты кажутся очевидными:
а) Более холодная вода будет нагреваться (к ней «притекает» тепловая энергия). Более нагретый металл остынет (из него «вытекает» тепловая энергия).
b) Вся смесь будет иметь температуру ЖЕ . Это очень, очень важно.
c) Энергия, которая «вытекла» (из более теплой воды), равна энергии, которая «втекла» (в более холодную воду)
Ключ решения номер один: Начнем с того, что назовем конечную, конечную температуру «x». Имейте в виду, что И утюг, и вода будут нагреваться до температуры, которую мы называем «х». Кроме того, убедитесь, что вы понимаете, что «x», который мы используем, ЯВЛЯЕТСЯ НЕ Δt, а ОКОНЧАТЕЛЬНОЙ температурой. Это то, для чего мы решаем.
Кроме того, убедитесь, что вы понимаете, что «x», который мы используем, ЯВЛЯЕТСЯ НЕ Δt, а ОКОНЧАТЕЛЬНОЙ температурой. Это то, для чего мы решаем.
Более нагретое железо понижается с 85,0 до х, значит, его Δt равно 85,0 минус х. Более холодная вода нагревается, поэтому ее Δt равно x минус 20,0.
Последний абзац может немного сбить с толку, поэтому давайте сравним его с числовой строкой:
Чтобы вычислить абсолютное расстояние, это большее значение минус меньшее значение, поэтому от 85,0 до х равно 85,0 минус х, а расстояние от х до 20,0 равно х минус 20,0
Ключевое решение номер два: количество энергии, выходящее из теплой воды, равно количеству энергии, выходящей из холодной воды. Это означает:
q потеря = q усиление
Таким образом, путем подстановки имеем:
(25,0) (85,0 — х)(0,45) = (75,0) (х — 20,0) (4,184)
Найдите х
Обратите внимание на использование удельной теплоты сгорания железа. Это 0,45 Дж на грамм-градус Цельсия.
Это 0,45 Дж на грамм-градус Цельсия.
Учитывая, что 75/25 = 3, получаем:
38,25 — 0,45х = 12,552х — 251,04
тогда
13,002x = 289,29
Ответ
22,25 °С
, если вы не слишком придирчивы к значащим цифрам.
Обратите внимание, что температура железа немного падает, в то время как вода перемещается всего на несколько (в данном случае 2,25) градусов. Это типичная ситуация в этом типе проблемы.
Пример #2: Определите конечную температуру, когда 10,0 г алюминия при 130,0 °C смешиваются с 200,0 г воды при 25,0 °C.
Техника расчета не отличается от Примера №1. Обратите внимание, начальная температура металла выше точки кипения воды. В действительности образец может испарить незначительное количество воды, но мы будем считать, что это не так для расчетов.
Решение:
1) Настройте числа:
q алюминий = q вода(10) (130 − x) (0,901) = (200,0 )(x − 25) (4,18)
2) Заметив, что 200/10 = 20, получаю:
117,13 — 0,901х = 83,6х — 2090х = 26,12 °С.
Имейте в виду, что «x» соответствует конечной температуре, а НЕ Δt.
Также я решил эту проблему с 4.18. Выполнение этого с 4.184 дает немного другой ответ. Убедитесь, что вы согласовали со своим учителем значения различных констант, которые он/она хочет, чтобы вы использовали.
Пример №3: Определите конечную температуру, когда 20,0 г ртути при 165,0 °C смешиваются с 200,0 г воды при 60,0 °C. (C p для Hg = 0,14 Дж на грамм-градус Цельсия.)
Мы проигнорируем тот факт, что ртуть жидкая. он не растворяется в воде.
Решение:
(20,0) (165,0 — х) (0,14) = (200,0) (х — 60,0) (4,18)Заметив, что 200/20 = 10, я получаю:
23,1 — 0,14х = 41,8х — 2508
41,94х = 2531,1
х = 60,35 °С
Обратите внимание, что вода перемещается только на 0,35 градуса. Имейте в виду, что существует большое количество воды по сравнению с ртутью, И что для перемещения воды на один градус требуется гораздо больше энергии, чем для того же количества ртути, перемещаемого на один градус.
Пример №4: 10,0 г воды имеют температуру 59,0 °C. Если в калориметр поместить 3,00 г золота при температуре 15,2 °С, какова будет конечная температура воды в калориметре? (Удельная теплоемкость золота составляет 0,128 Дж/г°С.)
Решение:
1) Настройте следующее:
q вода = q золото(10,0) (59,0 − x) (4,184) = (3,00) (x − 15,2) (0,128)
2) Алгебра:
2468,56 — 41,84х = 0,384х — 5,836842,224х = 2474,3968
х = 58,6 °С
Обратите внимание, что в этом случае вода остывает, а золото нагревается. Это противоположно самой распространенной задаче этого типа, но методика решения та же.
Пример №5: 105,0 мл H 2 O изначально имеет комнатную температуру (22,0 °C). Охлажденный стальной стержень (2,00°С) помещают в воду. Если конечная температура системы 21,5 °С, какова масса стального стержня? (удельная теплоемкость воды = 4,184 Дж/г °C; удельная теплоемкость стали = 0,452 Дж/г °C)
Решение:
(105,0 г) (0,5 °C) (4,184 Дж °C -1 г -1 ) = (x) (19,5 °C) (0,452 Дж °C -1 г -1 )х = 24,9 г
Пример #6: Кольцо из чистого золота и кольцо из чистого серебра имеют общую массу 15,0 г. Два кольца нагревают до 62,4°С и опускают в 13,6 мл воды при 22,1°С. Когда достигается равновесие, температура воды составляет 23,9 °С. (Примите плотность воды 0,998 г/мл.)
Два кольца нагревают до 62,4°С и опускают в 13,6 мл воды при 22,1°С. Когда достигается равновесие, температура воды составляет 23,9 °С. (Примите плотность воды 0,998 г/мл.)
(а) Какова масса золотого кольца?
(b) Какова масса серебряного кольца?
Комментарий: теплотворная способность доступна во многих местах в Интернете и в учебниках. Вот пример.
Решение:
1) Основное используемое уравнение:
Полученное или потерянное тепло = (масса) (изменение температуры) (удельная теплоемкость)В более компактной форме: q = (m) (Δt) (C p )
Ниже будут использованы три из них.
2) Две массы, связанные с золотым и серебряным кольцами:
Пусть y = граммы золота
Следовательно, 15,0 − y = грамм серебра
3) Масса воды:
13,6 мл x 0,998 г/мл = 13,5728 г
4) Тепло, получаемое водой:
q = (13,5728 г) x (1,8 °C) (4,184 Дж г¯ 1 °C¯ 1 )кв = 102,2195 Дж
1,8 получается следующим образом: 23,9 − 22,1
5) Когда золотое кольцо и серебряное кольцо остывают, они высвобождают энергию, которая в сумме составляет 102,2195 Дж. Сумма может быть выражена следующим образом:
Сумма может быть выражена следующим образом:
(у) (38,5 °С) (0,129 Дж г¯ 1 °С¯ 1 ) + (15 − у) (38,5 °С) (0,235 Дж г¯ 1 °С¯ 1 ) = 102,2195 ДжПомните, изменение на 1 °C равно изменению на 1 K. Это означает, что 0,129 Дж·г¯ 1 °C¯ 1 — это то же самое, что 0,129 Дж·г¯ 1 К¯ 1
38,5 было получено таким же образом, как и 1,8 чуть выше.
6) Алгебра!
4,9665г + (15 — г) (9,0475) = 102,21954,9665г + 135,7125 – 9,0475г = 102,2195
-4,081г = -33,493
г = 8,21 г золота
15,0 − 8,21 = 6,79г Ag
Пример №7: Кольцо массой 8,352 грамма сделано из золота и серебра. Когда кольцо было нагрето до 94,52 °С, а затем брошено в 13,40 г воды при 20,00 °С, температура воды после достижения теплового равновесия составила 22,00 °С. Какова массовая доля золота и серебра в кольце?
Решение:
Теплота, выделяемая серебром, плюс теплота, выделяемая золотом, равняется теплоте, поглощаемой водой.Установите массу серебра равной «x». Это означает, что масса золота равна 8,352 минус x.
(x) (72,52 °C) (0,235 Дж/г °C) + (8,352 − x) (72,52 °C) (0,129 Дж/г °C) = (13,40 г) (2,00 °C) (4,184 Дж /г °С)
72,52 получается из 94,52 минус 22,00
17,0422х + (8,352 — х) (9,35508) = 112,1312
17,0422х + 78,13362816 — 9,35508х = 112,1312
7,68712x = 33,99757184
х = 4,422667 г
массовых процентов золота: (4,422667 / 8,352) * 100 = 52,95%
Массовая доля серебра: 100,00 − 52,95 = 47,05%
Пример #8: Кубик льда массой 74,0 г при температуре -12,0 °C помещают на блок меди массой 10,5 кг при температуре 23,0 °C, и вся система изолируется от окружающей среды. Через несколько минут лед растаял, и температура системы достигла равновесия. Рассчитайте конечную температуру системы.
Комментарий: не указана ни одна из соответствующих констант. Вам придется искать правильные значения, если вы столкнулись с такой проблемой. Если вы изучите свои источники информации, вы можете обнаружить, что они немного отличаются от значений, которые я использую. Это обычное дело. Многие из используемых значений были определены экспериментально, и разные источники часто содержат немного отличающиеся значения.
Если вы изучите свои источники информации, вы можете обнаружить, что они немного отличаются от значений, которые я использую. Это обычное дело. Многие из используемых значений были определены экспериментально, и разные источники часто содержат немного отличающиеся значения.
Решение:
1) Лед изменяется с −12 до 0:
q = (74,0 г) (12,0 °C) (2,06 Дж/г °C) = 1829,28 Дж
2) Лед тает:
q = (74,0 г / 18,0 г/моль) (6,02) = 24,7489 кДж
3) Жидкая вода подвергается неизвестному повышению температуры до конечного значения x
q = (74,0 г) (x — 0) (4,184 Дж/г°C) = 309,616x
4) Медь теряет тепло и падает до конечного значения x:
q = (10500 г) (23,0 − x) (0,385 Дж/г°C)
5) Количество тепла, отдаваемое медью, равно количеству тепла, полученному водой:
(10500) (23,0 — х) (0,385) = 1829,28 + 24748,9 + 309,616хОбратите внимание, что кДж от таяния льда используется как Дж, а не кДж.
Масса меди выражается в граммах, а не в кг.
(23,0 — х) (4042,5) = 26578,18 + 309,616х
92977,5 — 4042,5х = 26578,18 + 309,616х
66399,32 = 4352,116х
х = 15,2568 °С
x = 15,2 °C (до трех цифр, я следовал правилу округления до 5)
Пример #9: Сколько граммов воды можно нагреть с 25,0 °С до 35,0 °С за счет тепла, выделяемого 85,0 г железа, которое охлаждается с 85,0 °С до 35,0 °С? Удельная теплоемкость железа 0,450 Дж/г °С.
Решение:
1) Сколько тепла теряет утюг?
изменение температуры —> 85,0 °C − 35,0 0 °C = 50,0 °Cq = (масса) (изменение температуры) (удельная теплоемкость)
q = (85,0 г) (50,0 °С) (0,450 Дж/г °С)
q = 1912,5 Дж
2) Предположим, что все 1912,5 Дж идут на нагрев воды:
q = (масса) (изменение температуры) (удельная теплоемкость)1912,5 Дж = (х) (10,0 °С) (4,184 Дж/г °С)
х = 45,7 г
Обратите внимание, что удельная теплоемкость жидкой воды в тексте задачи не приводится.
3) Эту задачу можно было бы решить, приравняв два уравнения и решив относительно «x»:
(85,0 г) (50,0 °C) (0,450 Дж/г °C) = (x) (10,0 °C) (4,184 Дж/г °C)
Пример #10: Найдите массу жидкости H 2 O при 100,0 °C, которую можно вскипятить в газообразное H 2 O при 100,0 °C блоком алюминия массой 130,0 г при температуре 402,0 °C? Предположим, что алюминий способен кипятить воду до тех пор, пока ее температура не упадет ниже 100,0 °С. Теплоемкость алюминия равна 0,900 Дж г¯ 1 °С¯ 1 , а теплота парообразования воды при 100 °С составляет 40,65 кДж моль¯ 1
Решение:
1) Теплота, которую Al может терять при переходе от начальной к конечной температуре:
q = m Δt C pq = (130.) г (302,0 °С) (0,900 Дж г¯ 1 °С¯ 1 ) = 35334 Дж = 35,334 кДж
Для испарения воды доступно 35,334 кДж тепла.
2) Используйте 35,334 кДж и теплоту парообразования воды для вычисления молей, а затем массу испарившейся воды:
q = (ΔH) (моль)35,334 кДж = (40,65 кДж/моль) (х)
х = 0,869225 молей H 2 O
масса H 2 O = (0,869225 моль) (18,015 г/моль) = 15,659грамм
Три сига инжира, это 15,6 г
Бонус Пример: 250-граммовый образец металла нагревают до температуры 98,0 °C. Его помещают в 100 г воды в латунный калориметрический стакан с латунной мешалкой. Общая масса чашки и мешалки составляет 50,0 грамм. Начальная температура воды, мешалки и калориметра 20,0 °С. Конечная равновесная температура системы составляет 30,0 °С. Чему равна удельная теплоемкость металлического образца? (Удельная теплоёмкость латуни 0,0920 кал г¯ 1 C¯ 1 .)
Решение:
1) Количество тепла, выделяемого образцом металла, поглощается (а) водой и (б) латунным калориметром и мешалкой. Какое количество теплоты было захвачено водой?
Какое количество теплоты было захвачено водой?
q = m Δt C pq = (100, г) (10,0 °C) (1,00 г кал. г¯ 1 C¯ 1 )
кв = 1000 кал
Примечание: 1,00 г кал/г¯ 1 C¯ 1 – удельная теплоемкость жидкой воды.
2) Сколько тепла поглотил латунный калориметр и мешалка?
q = m Δt C pq = (50,0 г) (10,0 °C) (0,092 кал г¯ 1 C¯ 1 )
q = 54,28 кал
3) Суммарное тепло, выделяемое металлическим образцом:
1000 кал + 54,28 кал = 1054,28 кал
4) Определите удельную теплоемкость металлического образца:
q = m Δt C p1054,28 кал = (250, г) (68,0 °C) (C p )
C p = 0,062 г кал г¯ 1 C¯ 1
Перейти к расчету конечной температуры при смешивании металла и воды задач 1 — 15
Перейти к расчету конечной температуры при смешивании двух проб воды
Назад в меню термохимии
Конечная температура после помещения теплого металла в более холодную воду: Задачи 1
Конечная температура после помещения теплого металла в более холодную воду: Задачи 1 — 15Когда теплый металл помещают в более холодную воду, какой получается конечная температура?
Проблемы 1–15
Перейти к расчету конечной температуры при смешивании металла и воды
Перейти к расчету конечной температуры при смешивании двух проб воды
Назад в меню термохимии
Задача №1: Кусок медной трубки весом 610 г нагревают до 95,3 °C и помещают в изолированный сосуд, содержащий 45,0 г воды при 36,5 °C. Предполагая отсутствие потерь воды и теплоемкость сосуда 10,0 Дж/К, какова конечная температура системы (C p меди = 0,387 Дж/г-К)?
Предполагая отсутствие потерь воды и теплоемкость сосуда 10,0 Дж/К, какова конечная температура системы (C p меди = 0,387 Дж/г-К)?
Решение:
1) Эту проблему можно резюмировать следующим образом:
q потеряно медью = q получено водой + q получено калориметром
2) Поэтому:
(610, г) (95,3 °C − x) (0,387 Дж·г¯ 1 K¯ 1 ) = (45,0 г) (x − 36,5 °C) (4,184 Дж·г¯ 1 °C ¯ 1 ) + [(10,0 Дж/К) (х — 36,5 °С)]Комментарий: K и °C взаимно исключаются, потому что °C в этой задаче представляет собой разность температур (а не одно конкретное значение) и «размер» одного K = одному °C.
3) Разве алгебра не забавна?
22497,471 — 236,07х = 198,28х — 7237,22424,35х = 29734,691
х = 70,1 °С
Задача №2: Образец вещества массой 45,0 г при 55,0 °C (s = 1,66 кал/г °C) был помещен в калориметр в виде кофейной чашки (c = 4,20 кал/°C), который содержал 50,0 г этилового спирта при 25,0°С (s = 0,590 кал/г°С). Какова результирующая температура?
Какова результирующая температура?
Комментарий перед решением: обратите внимание, что в этой задаче используются калории, а не джоули. На технику решения это не влияет.
Решение:
1) Составьте следующее уравнение:
(масса вещества) (Δt вещества) (C p вещества) = (масса спирта) (Δt спирта) (C p спирта) + (калориметрическая постоянная) (Δt спирта)Существует неявное предположение, что спирт и калориметр начинаются при одной и той же температуре. Это очень надежное предположение.
2) Вставьте соответствующие значения:
(45,0 г) (55,0 − x) (1,66 кал/г °C) = (50,0 г) (x − 25,0) (0,590 кал/г °C) + (4,20 кал/°C) (x − 25,0)
3) Получается алгебра:
4108,5 — 74,7х = 29,5х — 737,5 + 4,2х — 105х = 45,7 °С
Задача №3: Кольцо из чистого золота и кольцо из чистого серебра имеют общую массу 17,0 г. Два кольца нагревают до 65,4°С и опускают в 12,4 мл воды при 22,3°С. Когда достигается равновесие, температура воды составляет 24,7 °С. Какова масса золотого кольца?
Два кольца нагревают до 65,4°С и опускают в 12,4 мл воды при 22,3°С. Когда достигается равновесие, температура воды составляет 24,7 °С. Какова масса золотого кольца?
Решение:
1) Составьте следующее уравнение:
(масса золота) (Δt золота) (C p золота) + (массы серебра) (Δt серебра) (C p серебра) = (массы воды) (Δt воды) (C p воды)
2) Вставьте соответствующие значения:
(х) (40,7 °С) (0,129 Дж г¯ 1 °С¯ 1 ) + (17,0 г − х) (40,7 °С) (0,237 Дж г¯ 1 °С¯ 1 ) = (12,4 г) (2,4 °С) (4,184 Дж г¯ 1 °С¯ 1 )
3) Алгебра:
х = 8,98 г
4) Комментарии:
а) Я посмотрел значения удельной теплоемкости золота и серебра в Интернете. Кстати, вы уже должны были запомнить удельную теплотворную способность жидкой воды.
б) Термины для масс золотых и серебряных колец исходят из того, что их сумма равна 17,0 г.Мы присваиваем «x» массе золотого кольца, поэтому масса серебряного кольца равна 17,0 минус x.
Задача №4: Образец алюминия массой 5,00 г (удельная теплоемкость = 0,89Дж г¯ 1 °С¯ 1 ) и образец железа массой 10,00 г (удельная теплоемкость = 0,45 Дж г¯ 1 °С¯ 1 ) нагревают до 100,0 °С. Затем смесь горячего железа и алюминия по каплям опускают в 91,9 г воды при 23,7°С. Рассчитайте конечную температуру смеси металла и воды, при условии отсутствия потерь тепла в окружающую среду.
Решение:
1) Настройте это:
q Al + q Fe = q вода(5,00 г) (100 °C − x) (0,89 Дж·г¯ 1 °C¯ 1 ) + (10,00 г) (100 °C − x) (0,45 Дж·г¯ 1 °C¯ 1 ) = (91,9 г) (x − 23,7 °C) (4,184 Дж г¯ 1 °C¯ 1 )
2) Проделаем алгебру (и отбросим все единицы):
(445 — 4,45x) + (450 — 4,5x) = 384,5096x — 9112,87752393,4596х = 10007,87752
х = 25,4 °С
Задача №5: Образец металлического железа массой 50,6 г нагревают и помещают в 104,0 г воды при 190,7 ° C в калориметре. Если конечная температура образца железа и воды равна 24,3 °С, какой была температура образца железа, когда его поместили в воду?
Если конечная температура образца железа и воды равна 24,3 °С, какой была температура образца железа, когда его поместили в воду?
Решение:
1) тепло, отдаваемое железом = тепло, получаемое водой:
(масса железа) (Δt железа) (C p железа) = (масса воды) (Δt воды) (C p воды)(50,6 г) (x — 24,3 °C) (0,450 Дж/г °C) = (104,0 г) (4,6 °C) (4,184 Дж/г °C)
4,6 получилось из 24,3 минус 19.7.
x − 24,3 °C – это Δt железа. Он перешел от высокой температуры «x» к более низкой температуре 24,3 ° C.
2) Найдите х:
(50,6x — 1229,58) (0,450) = 2001,625622,77х — 553,311 = 2001,6256
22,77х = 2554,9366
х = 112,2 °С
Задача № 6: Кусок медной трубки весом 505,0 г нагревают до 99,9 °C и помещают в изолированный сосуд, содержащий 59,8 г воды при 24,8 °C. Предполагая отсутствие потерь воды и теплоемкость сосуда 10,0 Дж/К, какова конечная температура системы? (С p меди = 0,387 Дж/г К)
Решение:
Решение не предоставлено.
Обратите внимание, что K и °C отменяются в задаче. Это связано с тем, что (а) температуры в фактических расчетах представляют собой разницу между двумя значениями температуры и (б) «размер» 1 К равен «размеру» 1 ° C.
Задача № 7: Какой объем воды с температурой 18,5 °С необходимо добавить вместе с куском железа массой 1,23 кг (С p = 0,449 Дж/г °С) при температуре 68,5 °С в изолированном сосуде , чтобы конечная температура смеси вода/металл оставалась постоянной и составляла 25,6 °C?
Решение:
тепло, отдаваемое металлом = тепло, получаемое водой(1230 г) (42,9 °C) (0,449 Дж/г °C) = (масса) (4,184 Дж/г °C) (7,1 °C)
масса = 797,562 грамма
округление до 3 цифр кажется разумным
798 мл
Задача №8: A 2,00 x 10 2 г латунного блока при 85,0 °C помещают в чашку из пенопласта, содержащую 2,00 x 10 2 г воды при 50,0 °C. Тепло не передается чашке или окружающей среде. Найдите конечную температуру смеси.
Тепло не передается чашке или окружающей среде. Найдите конечную температуру смеси.
Решение:
Для решения этой проблемы требуется удельная теплоемкость латуни. Используйте этот сайт, чтобы найти значение.
Решение предоставляется читателю.
Задача №9: Для двух одинаковых блоков T f является средним значением начальных температур, так что T f = 1/2 (T 1 + T 2 ). Покажите для системы из двух блоков, полностью изолированных от окружающей среды, что это верно. (Подсказка: так как блоки сделаны из одного и того же материала, они будут иметь одинаковую C стр .)
Решение:
Я буду использовать T 1 для начальной температуры теплого блока и T 2 для начальной температуры холодного блока.тепла, потерянного теплым блоком = количество тепла, полученного холодным блоком
(масса) (ΔT теплая ) (C p ) = (масса) (ΔT холодная ) (C p )
для одинаковых блоков, масса = масса и C p = C p ; следовательно:
ΔТ warm = ΔT cold
T 1 − T f = T f − T 2
2T f = T 1 + T 2
T f = 1/2 (Т 1 + Т 2 )
Задача №10: 50,0 г меди при 200,0 °C помещают в лед при 0,0 °C. Сколько граммов льда растает?
Сколько граммов льда растает?
Решение:
1) Температура меди понизится до нуля по Цельсию, выделив определенное количество тепла:
(50,0 г) (200,0 °С) (0,385 Дж/г °С) = 3850 Дж
2) Все тепло от меди плавит лед:
(334,16 Дж/г) (х) = 3850 Джx = 11,5 г (до трех знаков фиг.)
Задача №11: Предположим, что 0,82 г воды конденсируется на 75,0-граммовом железном блоке, который изначально имеет температуру 24,0 °C.? Если выделяющееся при конденсации тепло идет только на нагрев железного бруска, то какова конечная температура (в °С) железного бруска?
Решение:
(0,82 г / 18,01532 г/моль) (40,7 кДж/моль) = 1,8525673 кДж = 1852,5673 Дж теряется с водойЧтобы продолжить расчет, нужно знать удельную теплоемкость железа. В этом источнике указано 0,444 Дж/г °C.
1852,5673 Дж = (75,0 г) (x) (0,444 Дж/г °C)
x = 55,6 °C изменение
24,0 °С + 55,6 °С = 79,6 °С
Задача №12: 400,0 г железа нагревают в пламени, а затем бросают в химический стакан, содержащий 1,00 кг воды. Исходная температура воды была 20,0 °С, а конечная температура воды и железа после достижения теплового равновесия составила 32,8 °С. Какова была первоначальная температура раскаленного железного стержня? (Предположим, что тепло не передается стакану или окружающему воздуху.)
Исходная температура воды была 20,0 °С, а конечная температура воды и железа после достижения теплового равновесия составила 32,8 °С. Какова была первоначальная температура раскаленного железного стержня? (Предположим, что тепло не передается стакану или окружающему воздуху.)
Решение:
q железо = q вода(400,0 г) (x − 32,8 °C) (0,444 Дж/г °C) = (1000 г) (12,8 °C) (4,184 Дж/г °C)
177,6х — 5825,28 = 53555,2
х = 334,35 °С
Инжир до трех знаков, 334 °C
Задача № 13: Металлический образец массой 30,66 г имеет температуру 81,0 °C, когда его помещают в чашку из пенопласта, содержащую 40,0 г воды при 23,0 °C. Температура воды повысилась до 25,0 °С. Теплоемкость чашки 42 Дж/°С.
а) Сколько джоулей потерял металл в воде?
(б) Какова удельная теплоемкость металла?
(c) Какова атомная масса металла?
(d) Какой это металл?
Решение:
q = [(40,0 г) (2,0 °C) (4,184 Дж/г °C)] + [(42 Дж/°C) (2,0 °C)] = 418,72 Дж (ответ на вопрос а)418,72 Дж = (30,66 г) (56,0 °С) (х)
х = 0,244 Дж/г°С) (ответ на б)
Используйте закон Дюлонга-Пти для атомной массы:
(удельная теплоемкость) умножить на (атомную массу) = 3R
(0,244 Дж/г °C) (x) = (3) (8,31447 Дж/К моль)
х = 102,2 г/моль (ответ на вопрос в)
Примечание: °C и K взаимозаменяемы, потому что «размер» каждой единицы измерения температуры одинаков, 1 °C = 1 K.
Родий ближе всего к 102,9 г/моль (ответ на d)
Поиск удельной теплоемкости для Rh, я нашел 0,242 Дж/г C.
Задача № 14: Неочищенный образец цинка имеет массу 7,35 г. Образец реагирует со 150,00 г разбавленной соляной кислоты внутри калориметра. Масса калориметра 520,57 г, удельная теплоемкость 0,400 Дж/г°С. При протекании реакции температура внутри калориметра повышается с 14,5°С до 29°С.0,7 °С. Какова процентная чистота образца цинка?
Комментарий: мы предполагаем, что плотность раствора HCl составляет 1,00 г/мл, а удельная теплоемкость раствора HCl такая же, как у чистой воды.
Решение:
1) Суммарная энергия, выделяющаяся при реакции цинка с HCl:
q = (масса воды) (Δt) (C p вода) + (масса калориметра) (Δt) (C p калориметр)q = (150,0 г) (15,2 °C) (4,184 Дж/г °C) + (370,57 г) (15,2 °C) (0,400 Дж/(г °C))
q = 9539,52 + 2253,0656 = 11792,5856 Дж
Примечание: 370,57 получается из 520,57 минус 150,00
2) Теперь нам нужно посмотреть, сколько цинка выделяет вышеуказанное количество тепла. Для этого нам понадобится энтальпия этой реакции:
Для этого нам понадобится энтальпия этой реакции:
Zn(т) + 2HCl(водн.) —> ZnCl 2 (водн.) + H 2 (г)Поиск в Интернете (см. задачу 5.66) приводит к значению -152,4 кДж на моль Zn.
Этот расчет:
11792,5856 Дж разделить на 152400 Дж/моль = 0,07738 моль Zn
Тогда этот расчет:
0,07738 моль умножить на 65,409 г/моль = 5,06 г
3) Определите процентное содержание цинка в образце:
(5,06 г / 7,35 г) умножить на 100 = 68,8% (до трех цифр)
Задача № 15: Кусок железа весом 25,75 г и кусок золота весом 28,45 г, каждый при температуре 100,0 °C, были брошены в 570,0 мл воды при температуре 17,70 °C. Молярная теплоемкость железа и золота равна 25,19 Дж моль¯ 1 °C¯ 1 и 25,41 Дж моль¯ 1 °C¯ 1 соответственно. Какова конечная температура воды и кусков металла?
Решение:
1) Установка для решения проблемы:
общее количество джоулей, выделяемых железом + общее количество джоулей, выделяемых золотом = общее количество джоулей, поглощаемых водой(25,75 г / 55,845 г/моль) (100,0 − x) (25,19 Дж/моль °C) + (28,45 г / 196,97 г/моль) (100,0 − x) (25,41 Дж/моль °C) = (570,00 г ) (х — 17,70) (4,184 Дж/г°С)
Найдите x, то есть конечную температуру.
2) Вот что означают некоторые термины:
(25,75 г / 55,845 г/моль) —> моль Fe(28,45 г / 196,97 г/моль) —> моль золота
(100,0 − x) —> изменение температуры Fe и Au (каждая из них начинается при 100 °C и снижается до конечной температуры, обозначенной буквой «x»)
(x − 17,70) —> изменение температуры воды
Обратите внимание, что удельная теплоемкость воды измеряется в граммах, а Fe и Au — в молях. Это нормально, поскольку я использую моли Fe и Au (чтобы компенсировать моль в удельной теплоемкости Fe и Au) и использую граммы воды (чтобы компенсировать граммы в удельной теплоемкости воды). Каждая единица будет отменена должным образом.
Задача № 16: Рассчитайте количество граммов льда, которое растает, если 1000,0 г железа при температуре 500,0 °C бросить в смесь льда и воды. Теплота плавления воды 334,166 Дж/г. Удельная теплоемкость железа = 0,448 Дж/г°С. Предположим, что льда достаточно, чтобы некоторое его количество осталось после достижения теплового равновесия.
Решение:
Последнее предложение имеет решающее значение, потому что оно гарантирует, что температура не изменится, только лед растает, а вся система останется при нуле по Цельсию.
1) Определить энергию, выделяемую железом:
q = (масса) (изменение температуры) удельная теплоемкость)q = (1000,0 г) (500,0 °C) (0,448 Дж/г °C)
q = 224000 Дж
Тот факт, что некоторое количество льда осталось, позволяет нам точно знать, что температура железа упадет с 500,0 °C до 0 °C.
2) Определите лед, который растает:
224000 Дж разделить на 334,166 Дж/г = 670,3 г
3) Эту проблему можно было бы решить так:
(1000,0 г) (500,0 °C) (0,448 Дж/г °C) = x / 334,166 Дж/гЗдесь предполагается, что 100% энергии, теряемой железом, идет на таяние льда.
Задача №17: 18,0 мл воды при 28,0 °C добавляют в горячую сковороду. Вся вода превращается в пар при температуре 100,0 °C. Масса кастрюли 1,25 кг, молярная теплоемкость железа 25,19 Дж/моль °С. Как меняется температура сковороды?
Масса кастрюли 1,25 кг, молярная теплоемкость железа 25,19 Дж/моль °С. Как меняется температура сковороды?
Решение:
1) Определить потребность в энергии для нагрева и кипячения воды:
тепло: q = (18,0 г) (72,0 °C) (4,184 Дж/г °C) = 5422,464 Дж = 5,422464 кДжварить: q = (40,7 кДж/моль) (18,0 г / 18,0 г/моль) = 40,7 кДж
всего: 40,7 кДж + 5,422464 кДж = 46,122464 кДж
Не буду округлять до окончательного ответа.
2) Определить изменение температуры сковороды:
46122,464 Дж = (22,38338 моль) (Δt) (25,19 Дж/моль °C)Δt = 81,8 °С
Обратите внимание, что используются моли железа, а не граммы. Это связано с единицами измерения удельной теплоемкости, предусмотренными в задаче.
Задача № 18: Медный шарик массой 125 граммов находится при температуре 145 °C. Этот шарик помещают в калориметр, содержащий 25,0 граммов льда при температуре -35,0 °C. Какой будет конечная температура медного шарика? (удельная теплоемкость меди = 0,387 Дж/г °C)
Какой будет конечная температура медного шарика? (удельная теплоемкость меди = 0,387 Дж/г °C)
Решение:
Медный шар отдает тепло льду. Весь лед сначала нагреется до 0°С, а затем начнет таять. Когда лед тает, создается система жидкий лед, температура которой остается равной 0 °C. Если медь расплавит весь лёд, то только тогда жидкая вода перейдёт от нуля °С до некоторой конечной, равновесной с медью температуры.
1) Давайте нагреем лед с −35 °C до 0 °C и посмотрим, сколько энергии на это потребуется.
q = (25 г) (35 °C) (2,06 Дж/г °C) q = 1802,5 Дж
2) Посмотрим, что произойдет с температурой меди при удалении 1802,5 Дж.
1802,5 Дж = (125 г) (x) (0,387 Дж/г°C)х = 37,26 °С
145 — 37,26 = 107,74 °С
3) Теперь давайте охладим медный шарик до нуля и посмотрим, сколько энергии при этом высвободится.
q = (125) (107,74) (0,387) = 5211,9225 Дж4) Далее нам нужно выяснить, сколько льда растаяло, используя 5211,9225 Дж энергии.
5211,9225 Дж = (x) (6020 Дж/моль) x = 0,86577 моль0,86577 моль умножить на 18,015 г/моль = 15,6 г
Поскольку изначально у нас было 25 г льда, при таянии 15,6 г льда в системе остается некоторое количество льда. Поскольку весь лед должен растаять, прежде чем мы сможем уйти от 0 °C, мы заключаем, что вся система жидкий лед-медь находится при 0 °C, когда достигается равновесие.
Задача №19: Медный кубик массой 100 граммов нагревают на кипящей водяной бане до 100,0 градусов Цельсия. Куб вынимают из ванны и помещают на очень большой кусок льда, температура которого равна 0,00 по Цельсию. Какова максимальная масса льда, который можно растопить в результате теплообмена, если предположить, что вся тепловая энергия расходуется на таяние льда?
Решение:
1) Определим, сколько энергии выделила медь при плавлении льда:
q = (масса) (Δt) (удельная теплоемкость)q = (100,0 г) (100,0 °C) (0,385 Дж/г °C)
q = 3850 Дж
2) Теперь определяем, сколько льда можно растопить:
q = (масса) (теплота плавления)3850 Дж = (334,166 Дж/г) (х)
х = 17,25 г
инжир до трех знаков, 17,2 г (с использованием правила округления до пяти)
3) Комментарии:
(а) удельную теплоемкость меди можно посмотреть в учебнике или в Интернете.
(б) теплоту плавления можно найти (или рассчитать по молярной теплоте плавления, 6,02 кДж/моль)Задача № 20: Кусок алюминия массой 12,0 г при 22,0 °C помещают в 175,0 мл воды при 85,0 °C и дают достичь теплового равновесия. Какой будет конечная температура? (Другие факторы, такие как передача тепла воздуху, следует игнорировать.) Удельная теплоемкость алюминия составляет 0,215 кал / г ° C.
Решение:
1) Прежде чем приступить к решению, можете ли вы найти ошибку в этом предложенном решении (и дело не в том, что ни на чем нет единиц)?
(175,0) (4,184) (85,0 — Т) = (12) (0,215) (Т — 22,0)Ошибка в неправильном смешивании юнитов. 4,184 — удельная теплоемкость жидкой воды в Дж г¯ 1 °С¯ 1 и 0,215 — удельная теплоемкость алюминия в кал г¯ 1 °С¯ 1 .
Вы не можете использовать эти две тепловые единицы в одной и той же задаче и быть правы.
Единицы измерения должны совпадать, поэтому обе удельные теплоемкости должны быть в Дж г¯ 1 °C¯ 1 или обе должны быть в кал г¯ 1 °С¯ 1 . Вы не можете иметь одно в одном блоке, а другое в другом и все равно быть правильным.
Будьте осторожны с несколькими вариантами ответов на подобные задачи. Один из вариантов наверняка будет ответом, полученным, когда вы совершите вышеуказанную ошибку.
2) Правильная установка (и решение) с использованием калорий:
(175,0) (1,00) (85,0 − T) = (12) (0,215) (T − 22,0)14875 — 175 т = 2,58 т — 56,76
14818,24 = 177,58Т
Т = 83,4 °С
Решение в Дж г¯ 1 °C¯ 1 предоставляется читателю.
Перейти к расчету конечной температуры при смешивании металла и воды
Перейти к расчету конечной температуры при смешивании двух проб воды
Назад в меню термохимии
Калькулятор удельной теплоемкости
Этот калькулятор удельной теплоемкости представляет собой инструмент, который определяет теплоемкость нагретого или охлажденного образца. Удельная теплоемкость – это количество тепловой энергии, которое необходимо передать образцу массой 1 кг, чтобы повысить его температуру на 1 К . Читайте дальше, чтобы узнать, как правильно применить формулу теплоемкости, чтобы получить достоверный результат.
Удельная теплоемкость – это количество тепловой энергии, которое необходимо передать образцу массой 1 кг, чтобы повысить его температуру на 1 К . Читайте дальше, чтобы узнать, как правильно применить формулу теплоемкости, чтобы получить достоверный результат.
💡 Этот калькулятор работает по-разному, поэтому вы также можете использовать его, например, для расчета количества тепла, необходимого для изменения температуры (если вы знаете удельную теплоемкость). Если вам нужно достичь изменения температуры в определенное время, используйте наш калькулятор мощности для нагрева, чтобы узнать требуемую мощность. Чтобы найти удельную теплоемкость из сложного эксперимента, калориметрический калькулятор может значительно ускорить расчеты.
Предпочитаете смотреть , а не читать? Узнайте все, что вам нужно, за 90 секунд с помощью этого видео , которое мы сделали для вас :
Как рассчитать удельную теплоемкость
- Определите, хотите ли вы нагреть образец (передать ему тепловую энергию) или охладить его ( отнять часть тепловой энергии).

- Введите количество подаваемой энергии в виде положительного значения. Если вы хотите охладить образец, введите вычитаемую энергию как отрицательное значение. Например, предположим, что мы хотим уменьшить тепловую энергию образца на 63 000 Дж. Тогда
Ом = -63 000 Дж. - Определите разницу температур между начальным и конечным состоянием образца и введите ее в калькулятор теплоемкости. Если образец охладить, то разница будет отрицательной, а если подогреть – положительной. Допустим, мы хотим охладить образец на 3 градуса. Тогда
ΔT = -3 K. Вы также можете перейти в расширенный режим , чтобы ввести начальное и конечное значения температуры вручную. - Определите массу образца. Будем считать
м = 5 кг. - Рассчитайте удельную теплоемкость как
c = Q / (mΔT). В нашем примере она будет равнас = -63 000 Дж/(5 кг * -3 К) = 4 200 Дж/(кг·К). Это типичная теплоемкость воды.
Если у вас возникли проблемы с единицами измерения, не стесняйтесь использовать наши калькуляторы преобразования температуры или веса.
Формула теплоемкости
Формула удельной теплоемкости выглядит так:
c = Q / (mΔT) Q — количество подведенного или отведенного тепла (в джоулях), m — масса образца, ΔT — разница между начальной и конечной температурами. Теплоемкость измеряется в Дж/(кг·К).
Типовые значения удельной теплоемкости
Вам не нужно использовать калькулятор теплоемкости для большинства распространенных веществ. Значения удельной теплоемкости для некоторых из наиболее популярных из них перечислены ниже.
- лед:
2 100 Дж/(кг·K) - вода:
4 200 Дж/(кг·K) - водяной пар:
2000 Дж/(кг·K) - базальт:
840 Дж/(кг·K) - гранит:
790 Дж/(кг·К) - алюминий:
890 Дж/(кг·K) - железо:
450 Дж/(кг·K) - медь:
380 Дж/(кг·К) - свинец:
130 Дж/(кг·К)
Имея эту информацию, вы также можете рассчитать, сколько энергии вам нужно передать образцу, чтобы повысить или понизить его температуру. Например, вы можете проверить, сколько тепла вам нужно, чтобы довести до кипения кастрюлю с водой, чтобы приготовить макароны.
Например, вы можете проверить, сколько тепла вам нужно, чтобы довести до кипения кастрюлю с водой, чтобы приготовить макароны.
Хотите знать, что на самом деле означает результат? Воспользуйтесь нашим калькулятором потенциальной энергии, чтобы проверить, насколько высоко вы поднимете образец с таким количеством энергии. Или проверьте, как быстро может двигаться образец, с помощью этого калькулятора кинетической энергии.
Часто задаваемые вопросы
Как рассчитать удельную теплоемкость?
- Найдите начальную и конечную температуру, а также массу образца и подведенную энергию.
- Вычтите из конечной и начальной температуры, чтобы получить изменение температуры (ΔT).
- Умножьте изменение температуры на массу образца.
- Разделите подведенное тепло/энергию на продукт.
- Формула
C = Q / (ΔT ⨉ m).
Что такое удельная теплоемкость при постоянном объеме?
Удельная теплоемкость – это количество тепла или энергии, необходимое для изменения одной единицы массы вещества постоянного объема на 1 °C . Формула:
Формула: Cv = Q / (ΔT ⨉ m) .
Какова формула удельной теплоемкости?
Формула удельной теплоемкости Кл вещества с массой m : Кл = Q /(m ⨉ ΔT) . Где Q — добавленная энергия, а ΔT — изменение температуры. Удельная теплоемкость при различных процессах, таких как постоянный объем, Cv и постоянное давление, Cp , связаны друг с другом отношением удельных теплоемкостей, ɣ= Cp/Cv , или газовая постоянная R = Cp-Cv .
В каких единицах измеряется удельная теплоемкость?
Удельная теплоемкость измеряется в Дж/кг К или Дж/кг С , так как это количество тепла или энергии, необходимое в процессе постоянного объема для изменения температуры вещества единицы массы на 1°С или 1° К.
Каково значение удельной теплоемкости воды?
Удельная теплоемкость воды составляет 4179 Дж/кг K , количество теплоты, необходимое для повышения температуры 1 г воды на 1 кельвин.




 На графике приведена зависимость температуры меди, находящейся в плавильной печи, от времени. Из перечисленных ниже процессов выберите те, которые отображены на графике.
На графике приведена зависимость температуры меди, находящейся в плавильной печи, от времени. Из перечисленных ниже процессов выберите те, которые отображены на графике. Какое количество теплоты надо сообщить 30г воды, взятой при 0°С, чтобы нагреть ее до температуры кипения и затем полностью превратить ее в пар при нормальном атмосферном давлении?
Какое количество теплоты надо сообщить 30г воды, взятой при 0°С, чтобы нагреть ее до температуры кипения и затем полностью превратить ее в пар при нормальном атмосферном давлении? Определите массу вещества, которую можно превратить в пар при нормальном атмосферном давлении и температуре кипения, сообщив ему количество теплоты, равное 5МДж
Определите массу вещества, которую можно превратить в пар при нормальном атмосферном давлении и температуре кипения, сообщив ему количество теплоты, равное 5МДж 2 кг, содержащий 2л воды при температуре 15°С. Вода в чайнике нагрелась до 100°С и 200г ее выпарилось. Каков КПД горелки, если при этом сгорело 0,1 м3 природного газа?
2 кг, содержащий 2л воды при температуре 15°С. Вода в чайнике нагрелась до 100°С и 200г ее выпарилось. Каков КПД горелки, если при этом сгорело 0,1 м3 природного газа?
 Масса меди выражается в граммах, а не в кг.
Масса меди выражается в граммах, а не в кг.
