Какая температура плавления свинца? :: SYL.ru
| Свинец | |
| Атомный номер | 82 |
| Внешний вид простого вещества | |
| Свойства атома | |
| Атомная масса (молярная масса) | 207,2 а. е. м. (/моль) |
| Радиус атома | 175 |
| Энергия ионизации (первый электрон) | 715,2 (7,41) кДж/моль () |
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 6p2 |
| Химические свойства | |
| Ковалентный радиус | 147 |
| Радиус иона | (+4e) 84 (+2e) 120 |
| Электроотрицательность (по Полингу) | 1,8 |
| Электродный потенциал | Pb←Pb2+ -0,126 В Pb←Pb4+ 0,80 В |
| Степени окисления | 4, 2 |
| Термодинамические свойства простого вещества | |
| Плотность | 11,3415 /³ |
| Молярная теплоёмкость | 26,65[1]/(·моль) |
| Теплопроводность | 35,3 /(·) |
| Температура плавления | 600,65 |
| Теплота плавления | 4,77 кДж/моль |
| Температура кипения | 2 013 |
| Теплота испарения | 177,8 кДж/моль |
| Молярный объём | 18,3 ³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 4,950 |
| Отношение c/a | n/a |
| Температура Дебая | 88,00 |
| Pb | 82 |
| 207,2 | |
| [Xe]4f145d106s26p2 | |
| Свинец | |
Свинец
— элемент главной подгруппы четвёртой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82. Обозначается символом Pb (лат. Plumbum). Простое вещество свинец (CAS-номер: 7439-92-1) — ковкий, сравнительно легкоплавкий металл серого цвета.
И. Менделеева, с атомным номером 82. Обозначается символом Pb (лат. Plumbum). Простое вещество свинец (CAS-номер: 7439-92-1) — ковкий, сравнительно легкоплавкий металл серого цвета.
Происхождение слова «свинец» неясно. В большинстве славянских языков (болгарском, сербско-хорватском, чешском, польском) свинец называется оловом. Слово с тем же значением, но похожее по произношению на «свинец», встречается только в языках балтийской группы: švinas (литовский), svins (латышский). Латинское же plumbum (тоже неясного происхождения) дало английское слово plumber — водопроводчик (когда-то трубы зачеканивали мягким свинцом), и название венецианской тюрьмы со свинцовой крышей — Пьомбе, из которой по некоторым данным ухитрился бежать Казанова. Известен с глубокой древности. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы — в Древнем Риме. Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов.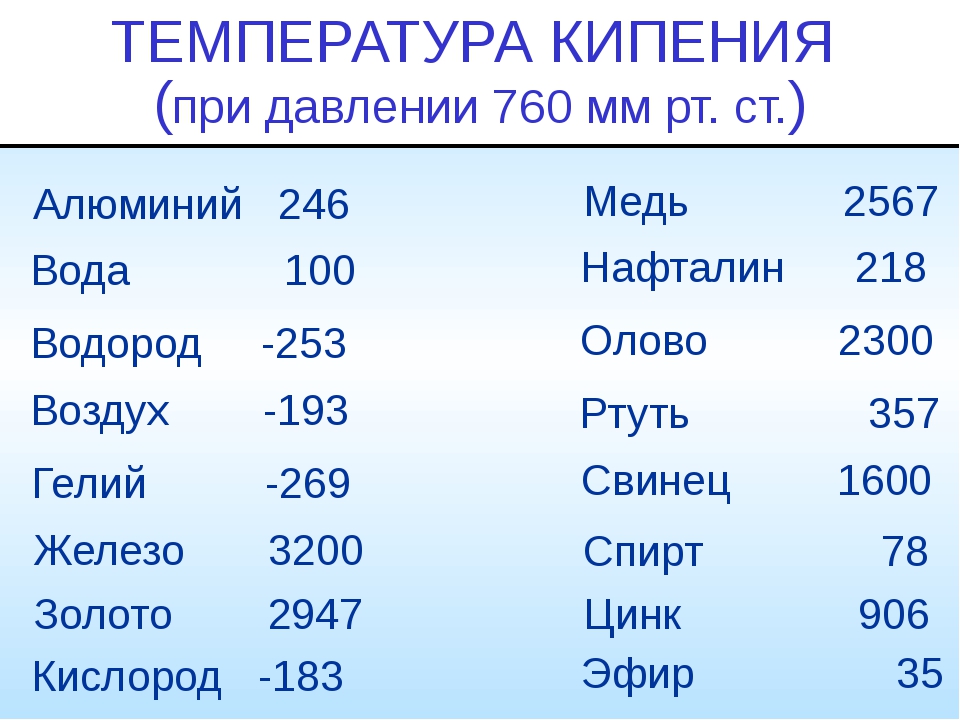 До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
Химические свойства свинца
Электронная формула: KLMN5s25p65d106s26p2, в соответствии с чем он имеет степени окисления +2 и +4. Свинец не очень активен химически. На металлическом разрезе свинца виден металлический блеск, постепенно исчезающий из-за образования тонкой плёнки РbО.
С кислородом образует ряд соединений Рb2О, РbО, РbО2, Рb2О3, Рb3О4. Без кислорода вода при комнатной температуре не реагирует со свинцом, но при большой температуре получают оксида свинца и водород при взаимодействии свинца и горячего водяного пара.
Оксидам РbО и РbО2 соответствуют амфотерные гидрооксиды Рb(ОН)2 и Рb(ОН)4.
При реакции Mg2Pb и разбавленной HCl получается небольшое количество РbН4. Pbh5 — газозообразное вещество без запаха, которое очень легко разлагается на свинец и и водород.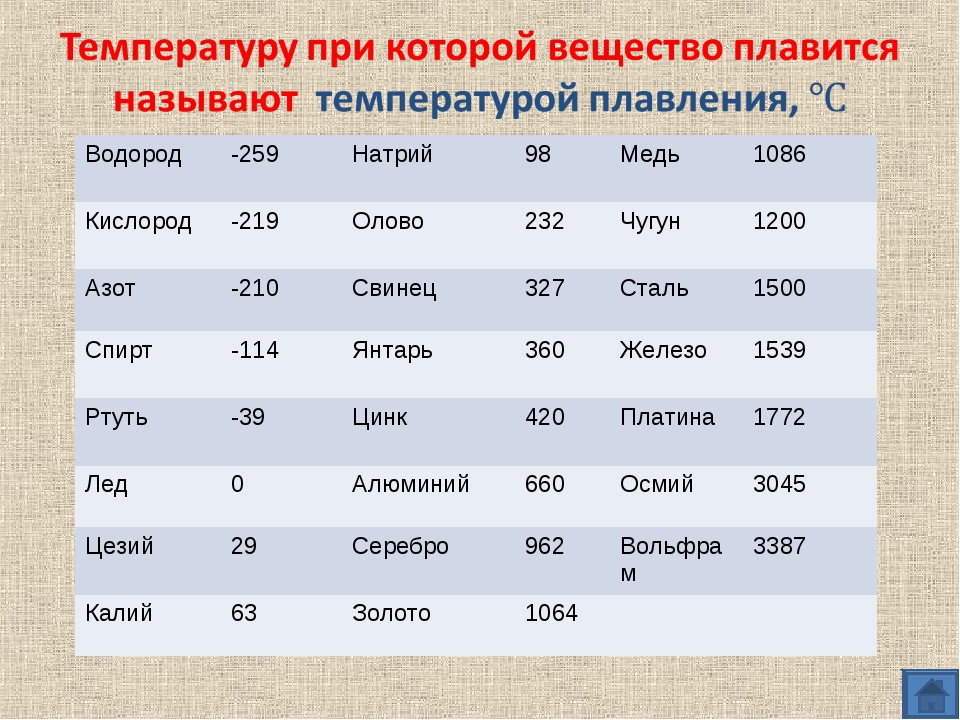 При большой температуре галогены образовывают со свинцом соединения вида РbХ2 (X — соответствующий галоген). Все эти соединения мало растворяются в воде. Могут быть получены галогениды и типа РbХ4. Свинец с азотом прямо не реагирует. Азид свинца Pb(N3)2 получают косвенным путём: взаимодействием растворов солей Рb (II) и соли NaN3. Сульфиды свинца можно получить при нагревании серы со свинцом, образуется сульфид PbS. Сульфид получают также пропусканием сероводорода в растворы солей Pb (II). В ряду напряжений Pb стоит левее водорода, но свинец не вытесняет водород из разбавленных HCl и h3SO4, из-за перенапряжения Н2 на Pb, а также на поверхности металла образуются плёнки трудно-растворимых хлорида РbCl2 и сульфата PbSO4, защищающие металл от дальнейшего действия кислот. Концентрированные кислоты типа h3SO4 и НCl при нагревании действуют на Pb и образуют с ним растворимые комплексные соединения состава Pb(HSO4)2 и Н2[РbCl4]. Азотная, а также некоторые органических кислоты (например, лимонная) растворяют свинец с получением солей Рb(II).
При большой температуре галогены образовывают со свинцом соединения вида РbХ2 (X — соответствующий галоген). Все эти соединения мало растворяются в воде. Могут быть получены галогениды и типа РbХ4. Свинец с азотом прямо не реагирует. Азид свинца Pb(N3)2 получают косвенным путём: взаимодействием растворов солей Рb (II) и соли NaN3. Сульфиды свинца можно получить при нагревании серы со свинцом, образуется сульфид PbS. Сульфид получают также пропусканием сероводорода в растворы солей Pb (II). В ряду напряжений Pb стоит левее водорода, но свинец не вытесняет водород из разбавленных HCl и h3SO4, из-за перенапряжения Н2 на Pb, а также на поверхности металла образуются плёнки трудно-растворимых хлорида РbCl2 и сульфата PbSO4, защищающие металл от дальнейшего действия кислот. Концентрированные кислоты типа h3SO4 и НCl при нагревании действуют на Pb и образуют с ним растворимые комплексные соединения состава Pb(HSO4)2 и Н2[РbCl4]. Азотная, а также некоторые органических кислоты (например, лимонная) растворяют свинец с получением солей Рb(II). По растворимости в воде соли свинца делятся на нерастворимые (напрммер, сульфат, карбонат, хромат, фосфат, молибдат и сульфид), малорастворимые (вроде, хлорид и фторид) и растворимые (к примеру,ацетат, нитрат и хлорат свинца). Соли Pb (IV) могут быть получены электролизом сильно подкисленных серной кислотой растворов солей Рb (II). Соли Pb (IV) присоединяют отрицательные ионы с образованием комплексных анионов, например, плюмбатов (РbО3)2- и (РbО4)4-, хлороплюмбатов (РbCl6)2-, гидроксоплюмбатов [Рb(ОН)6]2- и других. Концентрированные растворы едких щелочей при нагревании реагируют с Pb с выделением водорода и гидроксоплюмбитов типа Х2[Рb(ОН)4]. Еион (Ме=>Ме++e)=7,42 эВ.
По растворимости в воде соли свинца делятся на нерастворимые (напрммер, сульфат, карбонат, хромат, фосфат, молибдат и сульфид), малорастворимые (вроде, хлорид и фторид) и растворимые (к примеру,ацетат, нитрат и хлорат свинца). Соли Pb (IV) могут быть получены электролизом сильно подкисленных серной кислотой растворов солей Рb (II). Соли Pb (IV) присоединяют отрицательные ионы с образованием комплексных анионов, например, плюмбатов (РbО3)2- и (РbО4)4-, хлороплюмбатов (РbCl6)2-, гидроксоплюмбатов [Рb(ОН)6]2- и других. Концентрированные растворы едких щелочей при нагревании реагируют с Pb с выделением водорода и гидроксоплюмбитов типа Х2[Рb(ОН)4]. Еион (Ме=>Ме++e)=7,42 эВ.
Подготовка к плавлению свинца
Для начала нужно найти ёмкость. Будет отлично, если ручка сосуда будет сделана из какого-нибудь жароустойчивого материала. Для этой цели можно воспользоваться старым кофейником или чайником.
Материал можно плавить и в устаревшей посуде, сделанной из чугуна, пользуясь глубокой и длинной ложкой для заливки.
Если поблизости нет подходящей ёмкости, то можно применить и обыкновенную консервную «жестянку». Однако, здесь следует пользоваться пассатижами, которые будут использоваться для снятия раскалённой посуды с пламени и заливки материала в форму.
Не забывайте, что во время работы нужно быть предельно осторожным. Чтобы упростить процедуру, на одной стороне банки можно сделать небольшой желобок. В таком случае раскалённый металл будет выливаться тоненькой струйкой чётко в необходимое место.
Очищенный от примесей материал можно помельчить, чтобы он расплавился как можно скорее. Ёмкость нужно надёжным образом поставить над горелкой и как следует прогреть. Это нужно сделать для того чтобы избавить поверхность от лишних примесей и влаги.
Процедура плавки
Не нужно пытаться расплавить сразу весь подготовленный свинец, ведь взаимодействовать с раскалённой поверхностью ёмкости будет лишь самый нижний слой.
Сначала расплавьте два-три куска, чтобы сформировалась лужица, после чего постепенно накидывайте новый материал. Так у вас появится возможность сделать рабочую площадь более объёмной.
Так у вас появится возможность сделать рабочую площадь более объёмной.
После плавления с поверхности металла нужно убрать слой мусора, примесей и шлака. Заливка должна осуществляться в нагретую форму. А также свинец характеризуется оперативным застыванием. Материал быстро утрачивает текучесть, становится более густым, в связи с чем не может полностью наполнить собой форму.
Основные соединения свинца
Оксиды свинца
Оксиды свинца имеют преимущественно основный или амфотерный характер. Многие из них окрашены в красные, жёлтые, чёрные, коричневые цвета. На фотографии в начале статьи, на поверхности свинцовой отливки, в её центре видны цвета побежалости — это тонкая плёнка оксидов свинца, образовавшаяся из-за окисления горячего металла на воздухе.
Многие из них окрашены в красные, жёлтые, чёрные, коричневые цвета. На фотографии в начале статьи, на поверхности свинцовой отливки, в её центре видны цвета побежалости — это тонкая плёнка оксидов свинца, образовавшаяся из-за окисления горячего металла на воздухе.
Галогениды свинца
Халькогениды свинца
Халькогениды свинца — сульфид свинца, селенид свинца и теллурид свинца — представляют собой кристаллы чёрного цвета, которые являются узкозонными полупроводниками.
Соли свинца
Сульфат свинца Нитрат свинца Ацетат свинца
— свинцовый сахар, относится к очень ядовитым веществам. Ацетат свинца, или свинцовый сахар, Pb(Ch4COO)2·3h3O существует в виде бесцветных кристаллов или белого порошка, медленно выветривающегося с потерей гидратной воды. Соединение хорошо растворимо в воде. Оно обладает вяжущим действием, но так как содержит ионы ядовитого свинца, то применяется как наружное в ветеринарии. Ацетат применяют также в аналитической химии, крашении, ситценабивном деле, как наполнитель шёлка и для получения других соединений свинца. Основной ацетат свинца Pb(Ch4COO)2·Pb(OH)2 — менее растворимый в воде белый порошок — используется для обесцвечивания органических растворов и очистки растворов сахара перед анализом.
Основной ацетат свинца Pb(Ch4COO)2·Pb(OH)2 — менее растворимый в воде белый порошок — используется для обесцвечивания органических растворов и очистки растворов сахара перед анализом.
Применение свинца
Свинец в народном хозяйстве
Нитрат свинца
применяется для производства мощных смесевых взрывчатых веществ. Азид свинца применяется как наиболее широкоупотребляемый детонатор (инициирующее взрывчатое вещество). Перхлорат свинца используется для приготовления тяжелой жидкости (плотность 2,6 г/см³), используемой во флотационном обогащении руд, он иногда применяется в мощных смесевых взрывчатых веществах как окислитель. Фторид свинца самостоятельно, а так же совместно с фторидом висмута, меди, серебра применяется в качестве катодного материала в химических источниках тока. Висмутат свинца, сульфид свинца PbS, иодид свинца применяются в качестве катодного материала в литиевых аккумуляторных батареях. Хлорид свинца PbCl2 в качестве катодного материала в резервных источниках тока. Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников. Двуокись свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но так же на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и др.
Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников. Двуокись свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но так же на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и др.
Свинцовые белила
, основной карбонат Pb(OH)2•PbCO3, плотный белый порошок, — получается из свинца на воздухе под действием углекислого газа и уксусной кислоты. Использование свинцовых белил в качестве красящего пигмента теперь не так распространено, как ранее, из-за их разложения под действием сероводорода h3S. Свинцовые белила применяют также для производства шпатлевки, в технологии цемента и свинцовокарбонатной бумаги. Арсенат и арсенит свинца применяют в технологии инсектицидов для уничтожения насекомых — вредителей сельского хозяйства (непарного шелкопряда и хлопкового долгоносика). Борат свинца Pb(BO2)2·h3O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора. Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония Nh5Cl. Его применяют для приготовления мазей при обработке опухолей. Хромат свинца PbCrO4 известен как хромовый желтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В промышленности хромат применяют в основном в производстве желтых пигментов. Нитрат свинца Pb(NO3)2 — белое кристаллическое вещество, хорошо растворимое в воде. Это вяжущее ограниченного применения. В промышленности его используют в спичечном производстве, крашении и набивке текстиля, окраске рогов и гравировке. Сульфат свинца Pb(SO4)2, нерастворимый в воде белый порошок, применяют как пигмент в аккумуляторах, литографии, в технологии набивных тканей. Сульфид свинца PbS, чёрный нерастворимый в воде порошок, используют при обжиге глиняной посуды и для обнаружения ионов свинца.
Борат свинца Pb(BO2)2·h3O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора. Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония Nh5Cl. Его применяют для приготовления мазей при обработке опухолей. Хромат свинца PbCrO4 известен как хромовый желтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В промышленности хромат применяют в основном в производстве желтых пигментов. Нитрат свинца Pb(NO3)2 — белое кристаллическое вещество, хорошо растворимое в воде. Это вяжущее ограниченного применения. В промышленности его используют в спичечном производстве, крашении и набивке текстиля, окраске рогов и гравировке. Сульфат свинца Pb(SO4)2, нерастворимый в воде белый порошок, применяют как пигмент в аккумуляторах, литографии, в технологии набивных тканей. Сульфид свинца PbS, чёрный нерастворимый в воде порошок, используют при обжиге глиняной посуды и для обнаружения ионов свинца. Поскольку свинец хорошо поглощает γ-излучение, он используется для радиационной защиты в рентгеновских установках и в ядерных реакторах. Кроме того, свинец рассматривается в качестве теплоносителя в проектах перспективных ядерных реакторов на быстрых нейтронах. Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 85-90 % Sn и 15-10 % Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67 % Pb и 33 % Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников. Сплавы свинца с сурьмой обычно применяют для оболочек кабелей и пластин электрических аккумуляторов. Соединения свинца используются в производстве красителей, красок, инсектицидов, стеклянных изделий и как добавки к бензину в виде тетраэтилсвинца (C2H5)4Pb (умеренно летучая жидкость, пары к-рой в малых концентрациях имеют сладковатый фруктовый запах, в больших-неприятный запах; Тпл = 130 °C, Ткип = 80°С/13 мм рт.
Поскольку свинец хорошо поглощает γ-излучение, он используется для радиационной защиты в рентгеновских установках и в ядерных реакторах. Кроме того, свинец рассматривается в качестве теплоносителя в проектах перспективных ядерных реакторов на быстрых нейтронах. Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 85-90 % Sn и 15-10 % Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67 % Pb и 33 % Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников. Сплавы свинца с сурьмой обычно применяют для оболочек кабелей и пластин электрических аккумуляторов. Соединения свинца используются в производстве красителей, красок, инсектицидов, стеклянных изделий и как добавки к бензину в виде тетраэтилсвинца (C2H5)4Pb (умеренно летучая жидкость, пары к-рой в малых концентрациях имеют сладковатый фруктовый запах, в больших-неприятный запах; Тпл = 130 °C, Ткип = 80°С/13 мм рт. ст.; плотн. 1,650 г/см³; nD2v = 1,5198; не раств. в воде, смешивается с орг. растворителями; высокотоксичен, легко проникает через кожу; ПДК = 0,005 мг/м³; ЛД50 = 12,7 мг/кг (крысы, перорально)) для повышения октанового числа.
ст.; плотн. 1,650 г/см³; nD2v = 1,5198; не раств. в воде, смешивается с орг. растворителями; высокотоксичен, легко проникает через кожу; ПДК = 0,005 мг/м³; ЛД50 = 12,7 мг/кг (крысы, перорально)) для повышения октанового числа.
Свинец в медицине
Экономические показатели
Цены на свинец в слитках (марка С1) в 2006 году составили в среднем 1,3—1,5 долл/кг.
Страны, крупнейшие потребители свинца в 2004 году, в тыс. тонн (по данным ILZSG):
| Китай | 1770 |
| ЕС | 1553 |
| США | 1273 |
| Корея | 286 |
Физические характеристики свинца
Свинец, или плюмбум, – это пластичное химическое вещество из группы легкоплавких цветных металлов, обладающее высокой вязкостью, что обеспечивает легкий процесс его обработки. В системе химических элементов это вещество имеет порядковый номер 82 и обозначается сочетанием символов «Pb».
Материал хрупкий и легко реагирует на механическое воздействие – на нем остается выемка даже при нажатии ногтем, его просто разрезать обычным кухонным ножом, однако разломать его на отдельные фрагменты довольно сложно.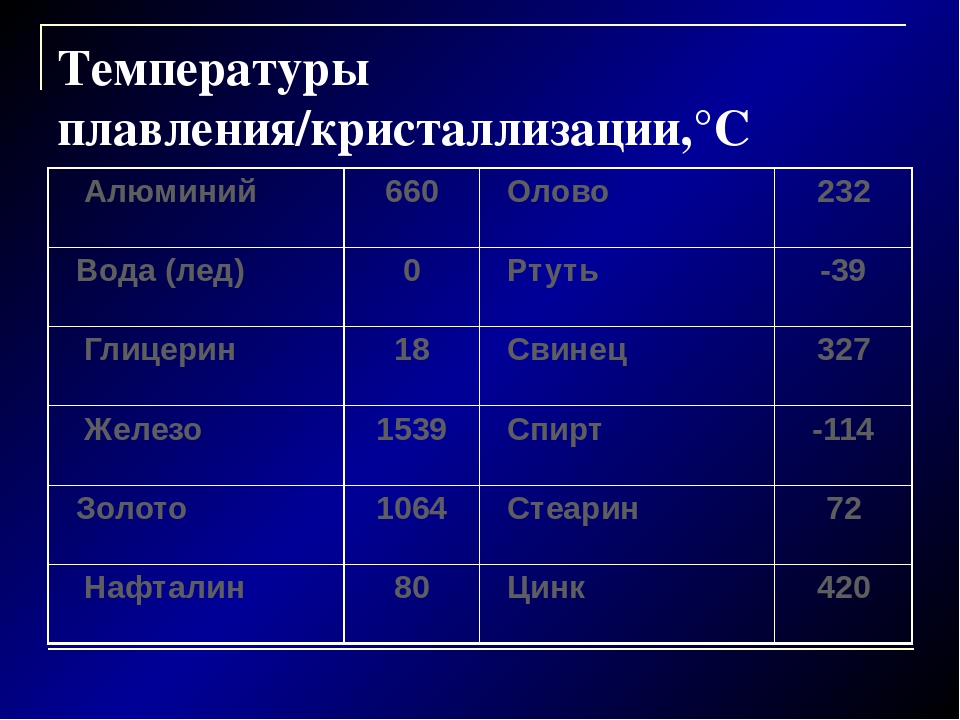 Этот металл имеет серебристо-белый цвет с синеватым оттенком. Он легко окисляется, находясь на открытом воздухе, поэтому свежесделанный срез материала моментально потускнеет.
Этот металл имеет серебристо-белый цвет с синеватым оттенком. Он легко окисляется, находясь на открытом воздухе, поэтому свежесделанный срез материала моментально потускнеет.
Рассматриваемое вещество обладает нижеследующими физическими характеристиками:
- Плотность металла равна 11,3 г/см³;
- Температура плавления свинца составляет +327,46 °C. Процедура литья этого компонента возможна при его доведении до +420-450 °C;
- Температура кипения – 1749 °C выше ноля;
- Удельная теплоемкость металла при комнатной температуре (+18 °C) равняется 127,5 Дж/кг, однако при доведении его до кипения этот показатель возрастает;
- Относительная (удельная) теплота расплавления составляет 25 кДж/кг;
- Удельная электропроводность при нормальных условиях (+18 °C) равна 4,8∙10-4, а это лишь 7,8% от соответствующего показателя серебра, что делает свинец идеальной основой для припоя;
- Металл является токсичным.
Температура плавления свинца дает возможность подогревать компонент в ковше даже на открытом огне с последующим розливом в требуемые формы, например, при изготовлении пуль.
Плавление элемента Pb на открытом огне в чугунной емкости (кустарные условия)
Для информации. Плавка металлов совершается посредством нагревания. Значение перехода твердого вещества в текучее агрегатное состояние (жидкость) именуется температурой плавления. Эта величина зависит от параметров составных компонентов, которые формируют сплав. Например, температура плавления олова равна +232 °C. Составы для пайки, содержащие эти вещества (олово – 59 %, свинец – 40 %), расплавляются при +183,3-190 °C. Если увеличить в подобных припоях содержание олова, то переходная температура будет увеличиваться и стремиться к показателю, при котором плавится олово (+232 °C).
Внешний вид припоя на основе оловянной смеси с содержанием свинца под маркировкой ПОС-61
Температура плавления свинца. Свойства свинца и его соединений
И практически минимальную твердость (можно резать ножом). Температура плавления свинцатакова, что его можно расплавить на костре или в домашних условиях. В чистом виде свинец быстро покрывается оксидной пленкой и тускнеет. При свинец инертен к большинству кислот.
В чистом виде свинец быстро покрывается оксидной пленкой и тускнеет. При свинец инертен к большинству кислот.
Свинца, не имеющего примесей, примерно около 328 градусов. В расплавленном имеет неплохие литейные качества. При заливке свинца в песчаную форму нужно, чтобы металл обладал хорошей жидкотекучестью, с этой целью расплав доводят до температуры, превышающей точку плавления ориентировочно на 100-120 градусов. Легко поддается механической обработке, ковке, высокая пластичность металла позволяет без труда прокатать его до минимальной толщины листа.
Свинца находится в пределах 1749 градусов.
В расплавленном виде имеет заметную летучесть, которая повышается с ростом температуры. Свинцовая пыль, пары оксидов и самого свинца являются ядом для человеческого организма. Наличие в организме 0,3 г свинца или его компонентов приводит к тяжелому отравлению. В процессе кристаллизации свинец подвержен большой усадке, обычно она составляет порядка 3,5%. В земной коре свинец чаще всего содержится в виде соединений, в чистом виде он встречается довольно редко.
Установлено, что главным образом он встречается в виде сульфидов в различных породах.
В качестве примесей в нем могут быть такие элементы, как сурьма, медь, железо, олово, висмут, мышьяк, натрий и пр. Большая часть примесей нежелательна, особенно при изготовлении ответственных деталей, т.к. они приводят к видоизменению химических и механических свойств металла. Цинк и висмут снижают устойчивость свинца к кислотам. Присутствие магния или кальция приводит к повышению прочности, а металл, легированный сурьмой, характеризуется многократным увеличением твердости.
Медь увеличивает стойкость изделия из свинца к воздействию серной кислоты, барий и литий повышают твердость. Температура плавления свинца при наличии примесей не претерпевает значительные изменения. Спектр применения изделий из свинца достаточно широкий. Основными потребителями этого материала считается кабельное и аккумуляторное производство, где он используется в качестве оболочки кабеля и при производстве аккумуляторных пластин.
Из свинца изготавливают дробь и пули. Низкая температура плавления свинца позволяла в прошлые времена охотникам самим делать пули и дробь.
Антикоррозионные способности свинца позволяют применять его для нанесения защитного слоя на предметы, изготовленные из железа. Кроме того, это свойство свинца широко применяется при изготовлении лакокрасочных изделий. Главным компонентом корабельного сурика, которым красят подводную часть корабля, является пигмент, в основе которого лежит свинец.
Свинцовая оболочка кабеля способна защитить от коррозии электрический и телефонный кабель, проложенный под землей и водой, в агрессивной среде. При какой температуре плавится висмут и кадмий, учитывают при изготовлении электрических предохранителей. До сегодняшнего дня востребованы свинцовые аккумуляторы в автомобильной, оборонной и ряде других отраслей экономики. Правда, в последние годы стали активно использовать кадмиево-никелевые аккумуляторы.
Свинец в составе сплавов широко применяется при изготовлении баббитовых подшипников, припоя из олова и свинца, типографских сплавов. Листы, изготовленные из свинца, экранируют рентгеновские лучи и Авария, произошедшая в 1986 году на Чернобыльской АЭС, сопровождалась интенсивным радиоактивным излучением, для того чтобы остановить процесс в реакторе, использовали мешки с дробью и болванками свинца.
Листы, изготовленные из свинца, экранируют рентгеновские лучи и Авария, произошедшая в 1986 году на Чернобыльской АЭС, сопровождалась интенсивным радиоактивным излучением, для того чтобы остановить процесс в реакторе, использовали мешки с дробью и болванками свинца.
Для защиты людей, находящихся на вертолетах, подающих этот груз, были использованы свинцовые листы. Уникальные свойства свинца в этом случае оказались незаменимыми.
Вопрос о том, как расплавить свинец , появляется у многих, как начинающих, так и видавших виды рыболовов. Чай надобность в плавке свинца в домашних условиях вытекает, как водится, из мечты изготовить грузила, блесны и мормышки по своему уникальному эскизу. Нужно сказать, что данный процесс довольно примитивен и не представляет специальных сложностей. Температура плавления свинца равна 327,4 градусам Цельсия. Это дозволяет плавить его в керамических, стальных и даже алюминиевых емкостях прямо на газовой горелке бытовой плиты.
Вам понадобится
- Керамический тигель, либо железная посуда с жаростойкой ручкой.
 Железные щипцы либо лопатка.
Железные щипцы либо лопатка.
Инструкция
1.
2. Подготовьте свинец . Если имеется довольно крупный кусок металла, поделите его на небольшие фрагменты. Если свинец физически объединен с огромным числом чужеродных веществ (как в ветхих аккумуляторах), по вероятности удалите их.
3. Прогрейте емкость, в которой будет производиться плавление. Верно установите емкость над газовой горелкой. Зажгите огонь. Отрегулируйте подачу газа так, дабы пламя было небольшим. Подождите, пока емкость прогреется. Прогрев нужен для выпаривания влаги с поверхности емкости, выгорания органических веществ и предотвращения уничтожения керамической посуды из-за стремительного неравномерного термического растяжения.
4. Расплавьте свинец . Разместите в емкость несколько ломтиков свинца.
Свинец сразу распознается по внешним знакам, он довольно эластичен, не ломается, с легкостью плавится под молотком, имеет темно-серый цвет. Он относится к легкоплавким металлам, потому что плавится при 327 градусах. В том случае если он находится в сплаве с иным металлом, температура плавления может гораздо снизиться либо повыситься. Свинец абсолютно подходит для литейных работ в домашних условиях
Инструкция
1. Достать свинец идеально не трудно, это дозволено сделать в организациях, занимающихся утилизацией сырья. Желанно приобретать больше чистый свинец. Перед началом плавки свинца, приготовьте форму, в которую будете его заливать.
2. В то время пока свинец находится на огне, подготовьте форму для заливки, немножко разогрев ее, что дозволит избежать частичной либо неровной отливки. Позже этого форму зажмите в тисках, прикрепленных к столу. Для этих целей также существуют особые струбцины и формы с приваренными ручками.
3. Как только свинец расплавится, соскребите с его поверхности ножиком либо ложкой каждый мусор. После этого крупный ложкой зачерпните малое число свинца и осмотрительно залейте в форму, заранее поставив ее вблизи кастрюли, потому что он может расплескаться и оставить важные ожоги на руках. Люди, непрерывно работающие со свинцом, выбирают разливать его в форму особой ложкой, имеющей сбоку небольшую выемку.
4. Подождите несколько минут, пока свинец застынет, позже этого освободите форму от тисков, откройте ее. Трудиться класснее в перчатках, потому что форма будет дюже жгучей.
5. Окончательно готовое изделие остынет не менее чем через час. Все издержки из-за неровного прилегания частей формы дозволено обрезать ножиком.
6. Свинец дозволено достать и из обыкновенного аккумулятора. Для этого аккумулятор разберите, слив заблаговременно кислоту и оставив в опрокинутом состоянии на один день. Позже отколите боковые стороны аккумулятора и достаньте свинцовые пластины, которые находятся в резиновых пакетах. Расплавьте их описанным выше методом. А недопустить поверхностное окисление при плавке поможет древесный уголь – примитивно посыпьте его поверх свинца во время плавки.
Обратите внимание!
Невзирая на то, что свинец легко плавится, форму он заполняет дрянней, чем другие легкоплавкие металлы.В холодную форму разливать свинец невозможно, потому что он может при соприкосновении с холодной поверхностью дать брызги.
Свинец знаменит с древнейших времен. Археологи достаточно зачастую находят фигуры божеств и украшения из этого материала. Знаменит свинец и в наше время – из него, скажем, делают грузила для рыболовных снастей. Металл данный достаточно легко плавится, следственно из него отливают статуэтки, бусы и браслеты. Однако, у свинца есть достаточно значительный недочет: он дюже стремительно покрывается оксидной пленкой и теряет сияние.
Что для этого необходимо?
Оксидная пленка на изделии из свинца возникает позже плавки достаточно стремительно. Очищать ее механическим методом идеально напрасно? это достаточно трудоемкий процесс. Помимо того, очищенная поверхность тоже стремительно начнет окисляться. Защитить грузила, статуэтки, бусы либо электроразъемы дозволено с подмогой следующих веществ:- подсолнечного масла;- графитовой смазки;- лака.Приготовьте также пачку бумажных салфеток, а для работы с кислотой – химическую посуду, перчатки и респиратор.Домашние и индустриальные способы
Есть в буквальном смысле домашний метод защитить свинцовую поверхность от коррозии.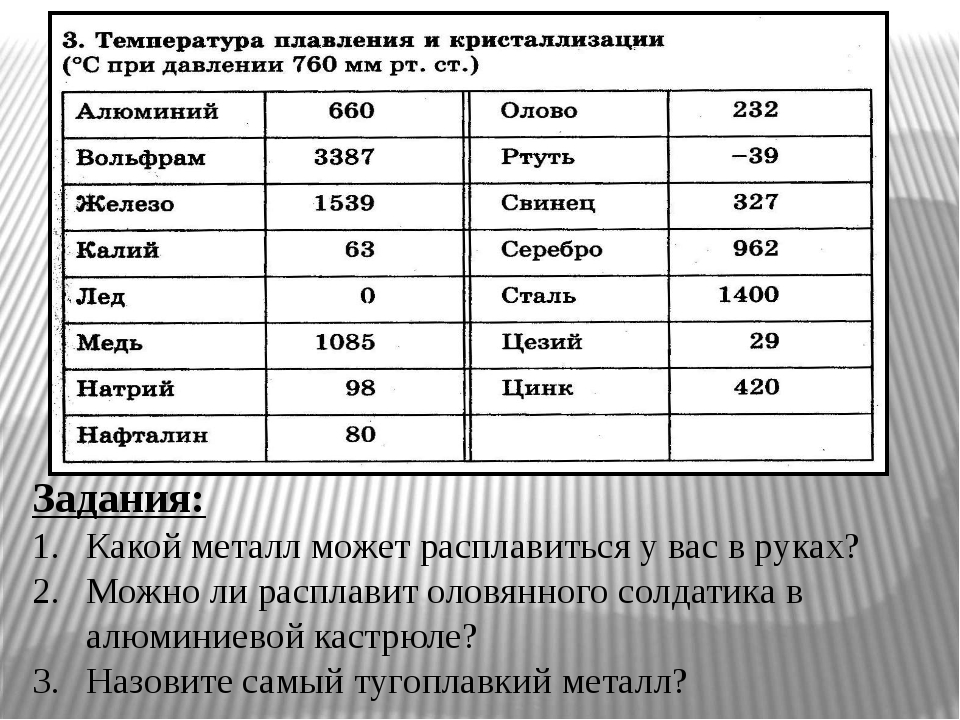 Подсолнечное масло в хозяйстве неизменно найдется. Налейте его в миску и погрузите туда незадолго выплавленную фигурку. Подержите минут пять, достаньте, положите на слой салфеток и дайте высохнуть. На производстве для охраны свинцовых деталей от окисления используется обыкновенно графитовая смазка. Под рукой ее может и не оказаться, но приобрести ее не так трудно. Она встречается в магазинах автозапчастей, хозяйственных, сельхозтехники – словом, там, где продают индустриальное масло. Дозволено заказать графитовую смазку и через интернет-магазин. Свинцовое изделие длинно сохранит сияние. Если изделие крупное, его дозволено примитивно протереть ватным тампоном, смоченном в растительном масле.
Подсолнечное масло в хозяйстве неизменно найдется. Налейте его в миску и погрузите туда незадолго выплавленную фигурку. Подержите минут пять, достаньте, положите на слой салфеток и дайте высохнуть. На производстве для охраны свинцовых деталей от окисления используется обыкновенно графитовая смазка. Под рукой ее может и не оказаться, но приобрести ее не так трудно. Она встречается в магазинах автозапчастей, хозяйственных, сельхозтехники – словом, там, где продают индустриальное масло. Дозволено заказать графитовую смазку и через интернет-магазин. Свинцовое изделие длинно сохранит сияние. Если изделие крупное, его дозволено примитивно протереть ватным тампоном, смоченном в растительном масле.
Рыболовные лаки
Можно покрыть свинцовую статуэтку и лаком по металлу. В магазине, где продают товары для рыболовов, зачастую встречается особый «рыболовный» лак, предуготовленный именно для таких целей. Цвета встречаются самые различные, но если вы хотите сберечь металлический сияние, вам огромнее подойдет бесцветный. Промышленность выпускает и флуоресцентные «рыболовные» лаки.
Промышленность выпускает и флуоресцентные «рыболовные» лаки.
Избавиться от оксида
Если оксидная пленка на поверхности теснее есть, ее дозволено снять концентрированной кислотой. Помните о том, что для химических экспериментов отменнее использовать посуду из химического стекла. Обыкновенная стеклянная банка может оказаться неудовлетворительно крепкой, а применять металлические либо пластиковые предметы и совсем неугодно. Не позабудьте также о мерах предосторожности – с резкими кислотами необходимо трудиться в перчатках. Желанна и защитная маска. Опустите предмет в кислоту, дождитесь, пока исчезнет оксидная пленка. Старательно слейте кислоту. Дайте изделию высохнуть, позже чего смажьте его маслом, графитовой смазкой либо покройте лаком. При работе со свинцом не забывайте, что данный материал токсичен.
Свинец знаменит с глубокой древности. Данный металл необходим во многих отраслях промышленности в силу своих физических и химических свойств. Для применения свинца нужно знать его температуру плавления, что дозволит производить из него надобные материалы и детали.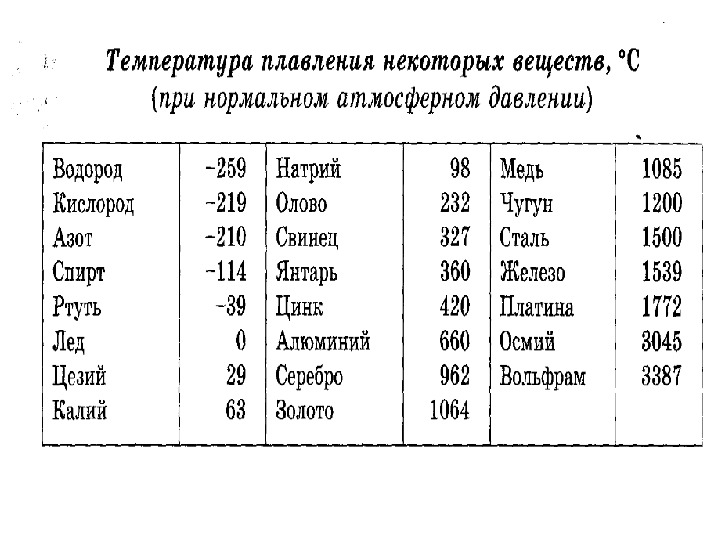 Он легко поддается ковке, дюже грациозен, также такой металл отличает инертность к кислотам при типичной температуре.
Он легко поддается ковке, дюже грациозен, также такой металл отличает инертность к кислотам при типичной температуре.
Области использования свинца
Одним из особенно распространенных вариантов использования свинца является производство пуль, дроби и других снарядов для огнестрельного оружия. А вероятность для охотников мастерить самодельные пули сделана вследствие дешевизне металла и низкой температуре его плавления. Также из свинца изготавливают рыболовные грузила. Вследствие тому, что металл довольно мягкий, его дозволено зафиксировать на леске без применения особых приспособлений, простым обжатием. Свинец владеет также антикоррозионным свойством, следственно его используют для нанесения защитного слоя на изделия из железа и изготовления защитных оболочек для кабелей. Также эта специфика свинца дозволяет применять его при производстве лакокрасочных изделий. В качестве основного компонента корабельного, либо железного, сурика, которым окрашивают подводную часть корабля, применяется пигмент, в состав которого входит свинец.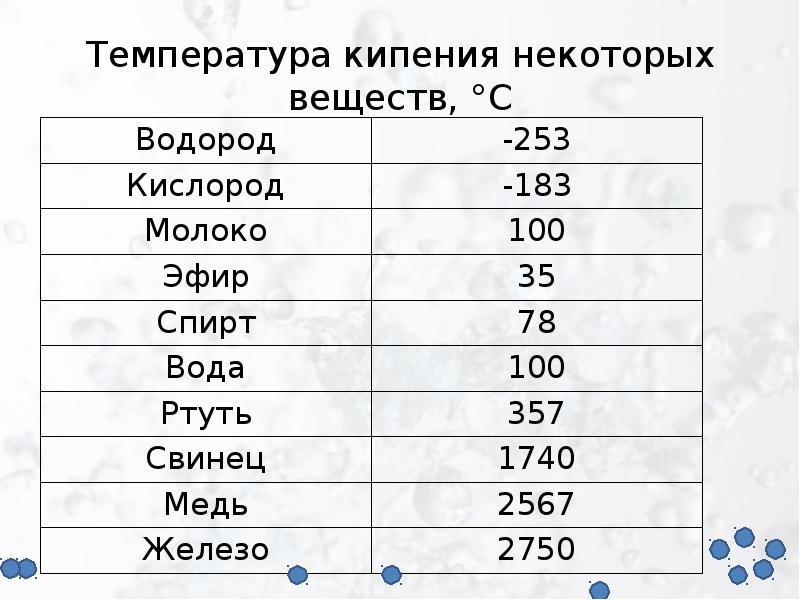 Зачастую данный цветной металл используется в виде сплавов. Листы с примесью свинца, скажем, способны охранять от рентгеновских лучей и радиоактивного излучения. При аварии на Чернобыльской ядерной электростанции, сопровождавшейся насыщенным излучением, применяли мешки с болванками и дробью свинца, дабы остановить небезопасные процессы в реакторе. Для охраны людей, которые находились на подающих данный груз вертолетах, использовались свинцовые листы. Уникальные особенности этого металла в таком случае оказались необходимыми.
Зачастую данный цветной металл используется в виде сплавов. Листы с примесью свинца, скажем, способны охранять от рентгеновских лучей и радиоактивного излучения. При аварии на Чернобыльской ядерной электростанции, сопровождавшейся насыщенным излучением, применяли мешки с болванками и дробью свинца, дабы остановить небезопасные процессы в реакторе. Для охраны людей, которые находились на подающих данный груз вертолетах, использовались свинцовые листы. Уникальные особенности этого металла в таком случае оказались необходимыми.
Температура плавления свинца
Температура плавления чистого свинца, в котором не имеется примесей, составляет 328оС. При плавлении улучшаются литейные качества и без того грациозного свинца. Это дозволяет охотникам в домашних условиях отливать снаряды для оружия. Свинец дозволено расплавить даже в домашних условиях либо на костре.Впрочем для заливки в формы нужно довести металл до жидкотекучего состояния. До такой степени дозволено расплавить свинец при температуре приблизительно на 100-200оС выше температуры плавления.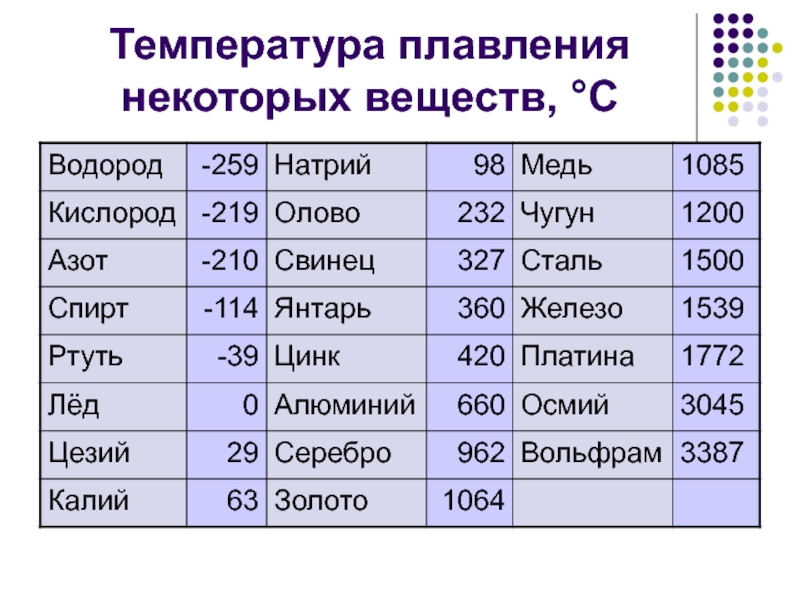 Температура кипения этого металла варьируется в пределах 1749оС.В расплавленном виде он имеет невидимую летучесть, которая возрастает совместно с ростом температуры. Пары свинца, а также его пыль могут вызвать у человека острое отравление. Для тяжелой интоксикации довольна насыщенность в организме 0,3 г свинца либо же его компонентов.
Температура кипения этого металла варьируется в пределах 1749оС.В расплавленном виде он имеет невидимую летучесть, которая возрастает совместно с ростом температуры. Пары свинца, а также его пыль могут вызвать у человека острое отравление. Для тяжелой интоксикации довольна насыщенность в организме 0,3 г свинца либо же его компонентов.
Обратите внимание!
Расплав свинца имеет дюже высокую температуру. Остерегайтесь попадания его на кожу, одежду и легко воспламеняющиеся предметы. Работайте на улице либо в дюже отменно проветриваемом помещении, потому что пары свинца токсичны.
Полезный совет
Расплавить свинец дозволено даже в консервной банке, крепко установив ее над газовой горелкой.
Свинец является химическим элементом из 14 группы, таблицы Д. И. Менделеева. Свинец получил 82 номер. Свинец является ковким и пластичным металлом серебристого оттенка, включая синеватый оттенок. Элемент повсеместнораспространен по поверхности Земли, легко добывается и поддается влиянию. Первые украшения и свинцовые предметы роскоши (Бусинды) с применением металлургической деятельности, дают право утверждения, что плавление металла как свинца, стала первой в истории человечества около 6400 г. до н. э. Самым старым изделием из свинцового сплава считается женская статуэтка в одежде из храма Осириса (3100 – 2900 гг. до н.э.). Древний Рим производил до 80 тыс. тонн свинца в год, в том числе для водопровода. На территории Руси металл нашел применение в обустройстве крыш, для печатей при создании грамот. Происхождения слов «свинец» до сих пор не ясно, на латинском языке название произошло от слова plumber (водопроводчик).
Первые украшения и свинцовые предметы роскоши (Бусинды) с применением металлургической деятельности, дают право утверждения, что плавление металла как свинца, стала первой в истории человечества около 6400 г. до н. э. Самым старым изделием из свинцового сплава считается женская статуэтка в одежде из храма Осириса (3100 – 2900 гг. до н.э.). Древний Рим производил до 80 тыс. тонн свинца в год, в том числе для водопровода. На территории Руси металл нашел применение в обустройстве крыш, для печатей при создании грамот. Происхождения слов «свинец» до сих пор не ясно, на латинском языке название произошло от слова plumber (водопроводчик).
Алхимики связывали элемент с Сатурном. К 1840 г. промышленная революция спровоцировала выработку свинца до уровня 100 тыс. тонн, а ко второй пол. XIX ст. производилось уже 250 тыс. тонн. До 1990 годов элемент активно применяли в типографии.
Свинец характеристика
Компонент редко обнаруживается в самородном виде. Существует более 80 минеральных пород с включением элемента, например: церуссит, галенит, англезит.
Технологические свойства и характеристики металла
Свинец получил типичные особенности и технологические свойства своей группы и характеризуется повышенной тяжестью, и плотностью с традиционным серым оттенком. При контакте с воздухом металл теряет блеск.
Несмотря на высокую плотность металл проявляет существенную мягкость, при комнатной температуре на нем можно оставить след ногтем.
Плотность свинца и его масса
Масса элемента равняется 82, что является причиной большого веса. Кристаллическая решетка получила кубическую форму. В углу модели молекулы и посредине всех граней находится атом.
Высокая масса относит вещество в состав списка тяжелых компонентов. При нагревании плотность материала падает.
Какая температура плавки свинца?
Свинец не является тугоплавким веществом, что выделяет его из прочих плотных элементов. Вещество легко можно деформировать и прокатать в фольгу.
Температура полного плавления свинца – 327,46 °С. Что бы узнать какая точная температура плавления свинца достаточно применить формулу F = 1,8 °C + 32. Таким образом плавление свинца происходит при температуре 620,6 F.
Таким образом плавление свинца происходит при температуре 620,6 F.
Температура кипения элемента наступает при – 1749 °С. Чтобы провести процедуру литья необходимо довести компонент до 400–450 °С.
Стоит отметить что при температуре -7,26 К, компонент получает сверхпроводимость. При плавлении компонент получает текучие свойства, увеличивается вязкость и изменяется поверхностное напряжение.
Механические свойства
Высокая пластичность стала причиной плохих прочностных качеств.
- Сопротивление разрыву – до 13 Мпа (у железа показатель – 250 МПа).
- Твердость по Бринеллю составляет – 3,2 – 8 НВ.
- Предел при сжатии – до 50 Мпа.
- Удлинение материала не более 50-70%.
Теплопроводность в два раза меньше, чем у Феррума, в 11 раз ниже показателя меди и составляет 33,5 вт/(м·К). При комнатной температуре значение теплоемкости – 0,12 кДж/(кг·К).
Электропроводность в нормальных условиях проявляет плохую электропроводность: удельное сопротивление равно 0,22 Ом-кв.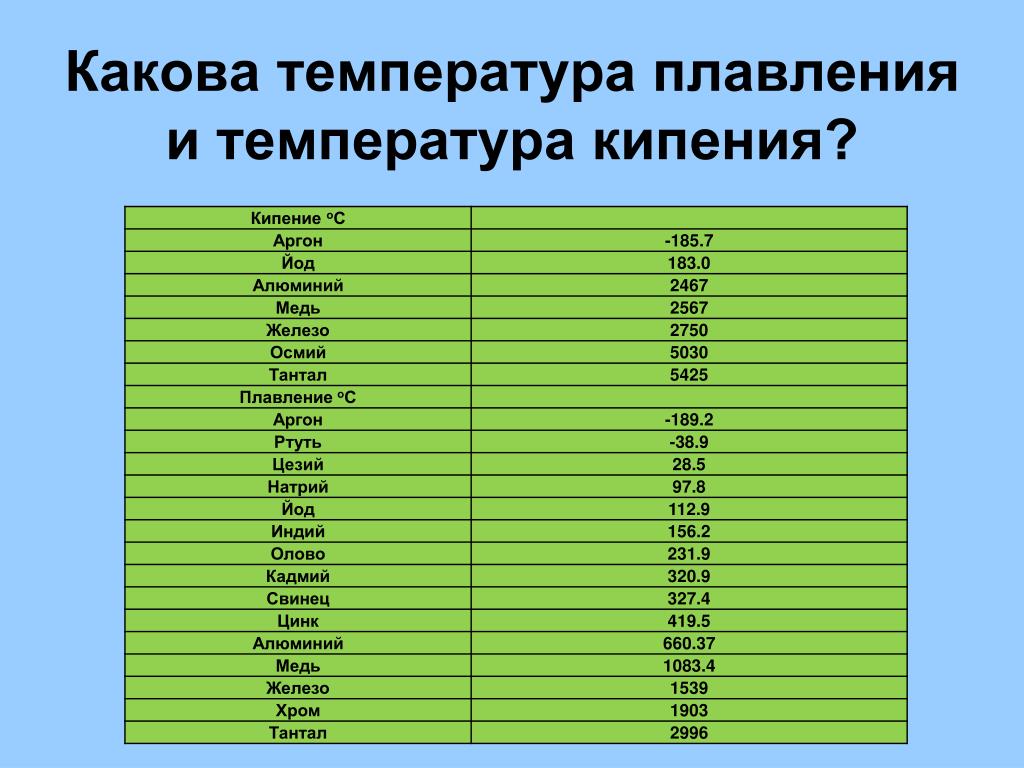 мм/м. У меди такой показатель достигает 0,017.
мм/м. У меди такой показатель достигает 0,017.
Сопротивление коррозии
По своим инертным свойствам свинец приближается к категории благородных металлов. Высокий порог вступления в реакцию и наличие оксидной пленки, обеспечивают высокую сопротивляемость ржавчине. Серная кислота, а также угольный ангидрид, растр сероводорода не воздействует на элемент. В городской местности уровень коррозии может достигать -0,00068 мм/год.
Свинец стойкий к хромовой, концентрированной уксусной, фосфорной кислоте. Компонент быстро разрушается в азотной и разбавленной уксусной кислоте и концентрированной серной (90%).
Области применения свинцовых сплавов
Свинец активно применяется для источника тока полученного химическим путем. Около ¾ всей массы произведенного металла используется для создания свинцовых аккумуляторов. Несмотря на конкуренцию щелочных источников энергии, свинец вырабатывает электричество более высокого напряжения. Элемент применяется для обмоток сверхпроводящих трансформаторных систем. Компонент был одним из первых замеченных веществ со свойствами сверхпроводимости. Свинцовый сплав (баббит) нашел применение в создании подшипников, благодаря антифрикционным свойствам. Свинец широко применяется для создания электрических предохранительных систем благодаря возможности создания легкоплавких соединений с другими металлами (кадмием или оловом).
Компонент был одним из первых замеченных веществ со свойствами сверхпроводимости. Свинцовый сплав (баббит) нашел применение в создании подшипников, благодаря антифрикционным свойствам. Свинец широко применяется для создания электрических предохранительных систем благодаря возможности создания легкоплавких соединений с другими металлами (кадмием или оловом).
20% всего объема компонента идет на создание оболочки силового кабеля для подземных и подводных линий. Свинец начали применять в военном деле во времена Римского государства, в качестве снарядов для катапульты. Современная промышленность производит из свинца пули и другие комплектующие для спортивного инвентаря, боевого и охотничьего оружия. Свинец популярен в качестве универсального припоя, включая случаи, когда соединить метал другим вариантом затруднительно.
Металл активно применяется для защиты от радиоактивного излучения, благодаря своей массе. Благодаря дешевизне компонент устанавливается в рентген кабинетах, и на ядерных полигонах.
Также элемент используется, как часть звукоизоляционного покрытия и в кровельном деле. Также материал используют в сейсмостойких фундаментах строений, и уплотнений между кладкой. Краска со свинцом используется на технических сооружениях (мосты, каркасные строения).
Домашние и промышленные способы
Для выделения и плавления чистого свинца, чаще всего используют галенит, как основу плавки. Способом флотации обогащают концентрат до 40-70%. Далее применяют несколько методов плавления:
- Электротермическое плавление.
- Способ термического плавления Ванюкова (расплавление в жидкой ванне).
- Плавление в шахтной (ватержакетной) печи.
После химической обработки удаляют примеси других элементов, в результате чистота свинца достигает более 99%.
Главными производителями являются: страны ЕС (плавление 2200 килотонн), США (1400), КНР (1200), РФ (1100). Также широкое производство плавления компонента находится в Южной Корейской республике, Украине и Казахстане.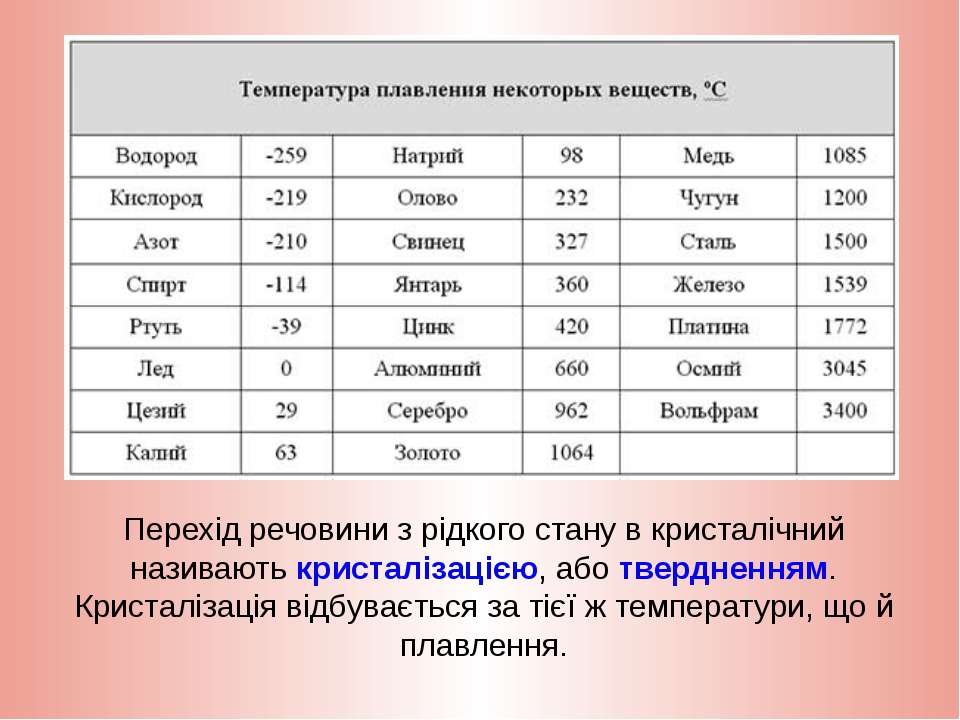
Приготовление расплава
Для начала плавления в домашних условиях подбирается емкость с жаростойкой ручкой, которая выдержит высокую температуру. Для такой функции подходит старый кухонный чайник или подобная бытовая утварь. В домашних условиях можно применять чугунную посуду, при отсутствии других вариантов используют консервные емкости, с использование плоскогубцев в виду высокой температуры операции. Заранее следует предусмотреть будущее место захвата банки инструментом. Для удобства, в жестяной банке можно проделать отверстие в районе ободка. Это даст возможность точно выливать металл с высокой температурой, в нужном месте, без потеков расплавленной массы снаружи емкости.
Обрабатываемый материал размельчают и избавляют массу от лишних включений любыми доступными способами. Чем лучше будет размельчен металл, тем быстрее он расплавится. Емкость необходимо надежно установить над источником огня и прогреть для ликвидации влаги и сторонних примесей.
Кипение свинца достигается при температуре более 1700 °C. В домашних условиях такую температуру создать невозможно, однако при температуре 700 °C элемент проявляет высокую летучесть. Таким образов при отсутствии специального оборудования и практической необходимости, не стоит доводить свинец до температуры с красным оттенком, в виду вредности испарений для окружающих лиц.
В домашних условиях такую температуру создать невозможно, однако при температуре 700 °C элемент проявляет высокую летучесть. Таким образов при отсутствии специального оборудования и практической необходимости, не стоит доводить свинец до температуры с красным оттенком, в виду вредности испарений для окружающих лиц.
Процесс плавления и заливка
В подогреваемую емкость не стоит сразу погружать весь лом. Контактировать с нагретым дном будет только тонкий слой, а остальная приобретенная температура будет рассеиваться в массе свинца. Для эффективной плавки лучше бросить небольшое количество в уже разогретую ванну постепенно помещая остальные части. Это увеличит площадь разогретой массы с высокой температурой.
После разогрева всей массы лома. На поверхности образуется шлаковый слой, который нужно убрать ложкой с длинной ручкой или подобным средством. Если масса получила единую разогретую консистенцию ее стоит переместить в предварительно разогретую форму. Низкая температура плавления провоцирует быстрое застывание в кристаллический вид. Если форма не разогрета, свинец начнет неровно ложится прямо во время заливки, и изделие получится неоднородным с присутствием дефектов.
Если форма не разогрета, свинец начнет неровно ложится прямо во время заливки, и изделие получится неоднородным с присутствием дефектов.
Рыболовные лаки
Свинцовые изделия, статуэтки или рыболовные снасти можно покрывать лаком, используемым рыбаками. У любителей рыбной ловли есть несколько функций для этого ингредиента. Однако с предотвращением оксидного слоя на поверхности, раствор также эффективно справляется. Производят жидкость для придания старым наживкам и грузилом былого блеска.
Методы избавления от оксида
Во время взаимодействия с воздухом между атомами металла и окружающей средой образуется ионная связь. Кислород отдает два электрона. На поверхности быстро возникает окислительный слой. Такая оксидная пленка способна предотвратить дальнейшее воздействие враждебной среды. Пленка, также становится барьером во время передачи электричества.
Оксидная пленка на продукте, изготовленном из свинца появляется через малый промежуток времени. Механическая очистка – довольно трудоемкое и бесполезное занятие. Сразу после успешного снятия слоя, образуя поле, и оголенные атомы вступают в связь с новыми атомами воздуха. Создать защиту для предмета можно при использовании масла подсолнуха. Также актуален вариант с графитовой смазкой и лаком.
Сразу после успешного снятия слоя, образуя поле, и оголенные атомы вступают в связь с новыми атомами воздуха. Создать защиту для предмета можно при использовании масла подсолнуха. Также актуален вариант с графитовой смазкой и лаком.
Для домашнего обихода отлично подходит масло подсолнуха. Масло наливают в миску, после чего в жидкость помещают требуемое изделие из свинца. При правильной выдержки (около 5 минут), необходимо вытянуть изделие из масла и дать ему просохнуть на подготовленных салфетках.
В условиях производства для уменьшения распространения оксидных включений на поверхности деталей применяют графитовую смазку. Смазка не является редкой или дорогостоящей, однако в бытовых условиях она редко оказывается в наличии. Такое средство продается в автомагазинах и хозяйственных торговых точках. При должном отношении свинцовая поверхность будет длительное время демонстрировать блеск.
Если оксидная пленка уже успешно покрыла поверхность, существуют способы ее удаления. Для этого, применяется концентрированный раствор кислоты. Для таких действий необходима специальная подготовка, включая наличие химического стеклянного инвентаря. Обычные столовые банки или миски не подойдут. Реактивные ингредиенты могут нанести вред человеку, оставить ожоги на теле.
Для этого, применяется концентрированный раствор кислоты. Для таких действий необходима специальная подготовка, включая наличие химического стеклянного инвентаря. Обычные столовые банки или миски не подойдут. Реактивные ингредиенты могут нанести вред человеку, оставить ожоги на теле.
Приветствуется использование защитных очков и маски.
Обрабатываемое изделие погружается в кислотный раствор. Необходимо подождать пока пленка оксида будет разрушена. После успешного подъема из раствора обрабатывается поверхность для защиты маслом или лаком.
Техника безопасности
Расплавленный свинец способен произвести значимые увечья и ожоги. Капля мгновенно пропалит одежду и попадет на открытую поверхность кожи. Жидкая форма свинца может при вытекании попасть на легко возгораемые предметы и спровоцировать пожар в помещении. Если в жидкий расплав проникает вода происходит резкая вспышка с распространением мелких брызг металла по всей площади. Такие включения могут попасть на кожу и глаза, что болезненно и опасно для органов человека. Таким образом, обязательно во время работы необходимо использование одежды, которая покроет все тело включая рукава, надевайте головной убор. Ткань должна быть с высокой огнеупорностью и термостойкостью. На лицо необходимо надеть маску и защитные очки.
Таким образом, обязательно во время работы необходимо использование одежды, которая покроет все тело включая рукава, надевайте головной убор. Ткань должна быть с высокой огнеупорностью и термостойкостью. На лицо необходимо надеть маску и защитные очки.
Помещение, в котором проводят плавку, необходимо хорошо проветривать, ввиду токсичности испарения свинца. Если маски нет в наличии используйте ватно-марлевую повязку. При попадании в организм свинец может спровоцировать и усугубить ряд болезненных процессов, накапливаясь в органах, элемент вызывает острое отравление.
Расплавить свинец нетрудно. Это можно сделать даже в домашних условиях, используя подходящую тонкостенную стальную или даже алюминиевую емкость. Температура плавления свинца невысокая. Чтобы ее достичь, достаточно пламени конфорки бытовой газовой или электрической плиты.
Свинец: характеристика
Распространение в общей массе земной коры — 0,0016 %. Это вроде бы и мало, но если сравнивать данный показатель с ближайшими соседями по таблице химических элементов — ртутью, золотом, висмутом, то свинец занимает гораздо более высокое место.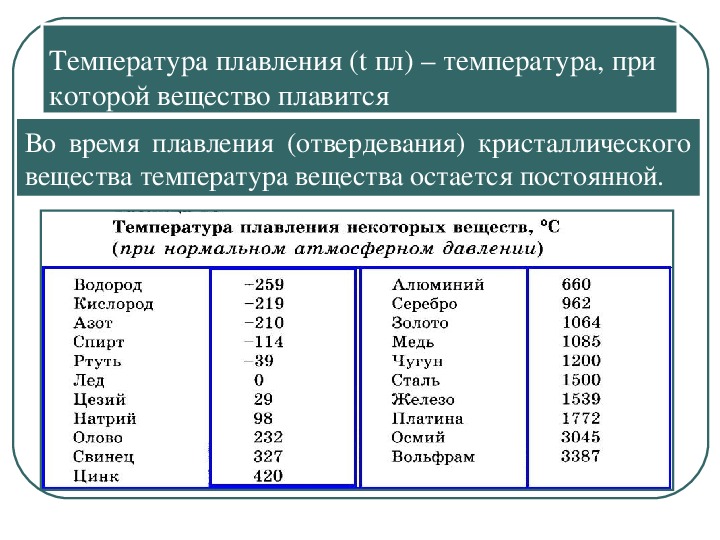 Основной источник сырья для его получения — это полиметаллические сульфидные руды.
Основной источник сырья для его получения — это полиметаллические сульфидные руды.
Материал имеет характерный грязно-серый цвет. На срезе свинец блестит с синеватым отливом, однако вскоре тускнеет. Это происходит окисление при воздействии воздуха. На поверхности среза образуется тонкий слой оксида. Металл тяжелый, его плотность — 11,34 г/см³. Это в полтора раза больше, чем у железа, и вчетверо в сравнении с алюминием.
Кроме того, что температура плавления свинца невысока, он еще является одним из самых мягких металлов. Его можно поцарапать ногтем, порезать ножом. Он достаточно гибкий, плющится молотком. Материал хорошо подходит для плавления и литья даже в домашних условиях.
Технологические свойства: какая температура плавления свинца?
Он плавится при 327,46 °C (600,61 K). Сохраняет высокие технологические литьевые свойства в диапазоне от 400 до 450 °С. Температура кипения свинца равна 1751 °С (2022 K). Пленка оксида, необходимая для защиты от коррозии, плавится только при 850 °С. Такая высокая температура, существенно превышающая режим плавления, усложняет процесс сваривания свинца в сплавах с другими металлами. К тому же при 700 °C летучесть свинца заметно возрастает.
Такая высокая температура, существенно превышающая режим плавления, усложняет процесс сваривания свинца в сплавах с другими металлами. К тому же при 700 °C летучесть свинца заметно возрастает.
В холодном виде материал хорошо поддается обработке. Его можно прокатать в тонкую фольгу. При давлении от 2 т/см² дробленый свинец спрессовывается с образованием монолитной массы. Проволоку из него получают не методом литья, а при продавливании твердого материала через фильеру. Малая разрывная прочность не дает возможности использовать для этих целей обычное волочение.
При какой температуре плавится свинец в составе с другими металлами? Это будет зависеть от состава сплава и соотношения металлов в нем. С одним материалом температура может повыситься, в то же время с другими — быть значительно ниже. К примеру, припой, в основе которого олово (64 %) и свинец (36 %), плавится при 180-200 °С.
Плавление в домашних условиях: подготовка
Необходимо подобрать подходящую емкость, желательно, чтобы ее ручка была из жаростойкого материала. Хорошо для этих целей подойдет старый чайник, кофейник или другая вышедшая из употребления кухонная утварь с удобной рукоятью. Можно расплавить материал и в старой чугунной посуде, а для заливки использовать глубокую ложку с длинной ручкой.
Хорошо для этих целей подойдет старый чайник, кофейник или другая вышедшая из употребления кухонная утварь с удобной рукоятью. Можно расплавить материал и в старой чугунной посуде, а для заливки использовать глубокую ложку с длинной ручкой.
В крайнем случае подойдет и жестяная консервная банка. Но тут не обойтись без плоскогубцев. Ими можно снять с огня разогретую посуду и залить расплавленный свинец в подготовленную форму. Но это следует делать очень осторожно. Для удобства на ободке жестянки лучше сделать желобок. Тогда расплавленный металл выльется тонкой струйкой без подтеков и точно в нужное место. Место для захвата плоскогубцами также следует заранее оборудовать, чтобы не производить лишних манипуляций с посудой и разогретым металлом.
Подготовленный и максимально очищенный от посторонних примесей свинец по возможности измельчают на мелкие кусочки. Так он быстрее будет плавиться. Емкость надежно устанавливается над горелкой и прогревается. Это делается для выгорания с ее поверхности влаги и нежелательных посторонних примесей.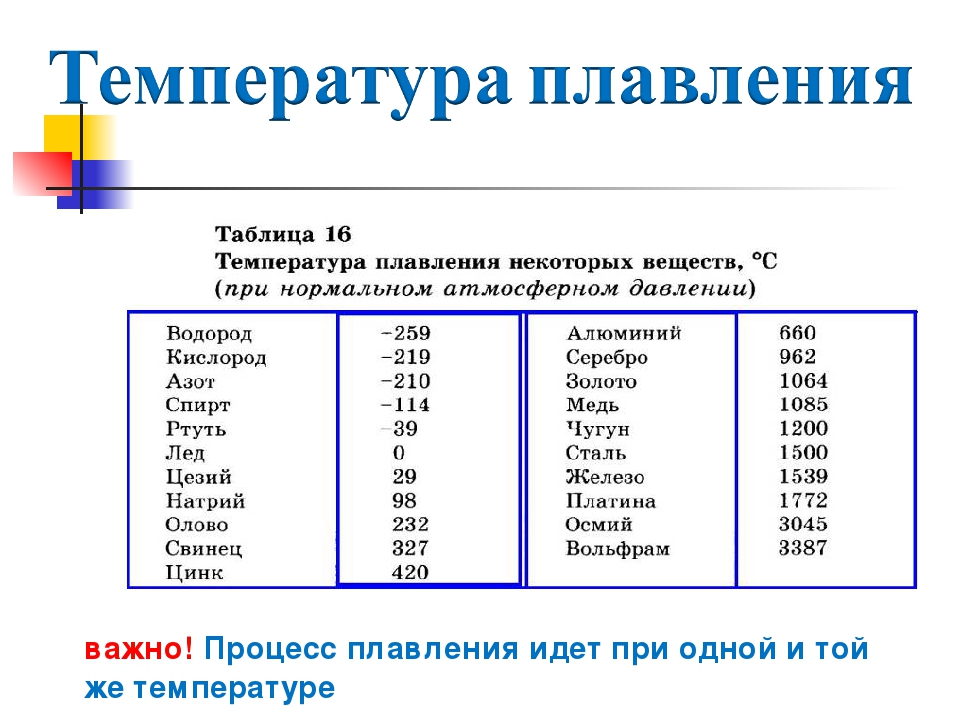
Процесс плавления и заливка
Не стоит загружать в посуду сразу весь объем подготовленного материала. Контактировать с разогретой поверхностью будет только нижний слой свинцового лома, а все, что сверху, будет только забирать на себя тепло и этим замедлять прогрев. Лучше сначала расплавить несколько кусочков, чтобы образовалась лужа, а затем в нее постепенно добавлять новые порции металла. В таком случае увеличивается площадь разогревающей поверхности.
После расплавления всего объема материала металлической лопаткой или ложкой с длинной ручкой с поверхности расплава необходимо снять слой шлака, примесей и мусора. Заливку следует производить в разогретую форму. Сравнительно низкая температура плавления свинца предполагает его быстрое застывание. Особенно заметно это в холодной форме. Материал теряет текучесть, заметно густеет, расплав не заполняет форму, качество отливки ухудшается.
Техника безопасности
Температура кипения свинца очень высока (1751 °C), и достичь ее в домашних условиях нереально. Тем не менее летучесть его уже при 700 °C становится довольно высокой. При существенном превышении температуры плавления находящиеся поблизости люди могут подвергаться негативному воздействию его испарений. Если нет существенной технологической необходимости перегревать расплав, не следует его доводить до красноватого оттенка. Именно это свидетельствует о том, что температура плавления свинца была превышена.
Тем не менее летучесть его уже при 700 °C становится довольно высокой. При существенном превышении температуры плавления находящиеся поблизости люди могут подвергаться негативному воздействию его испарений. Если нет существенной технологической необходимости перегревать расплав, не следует его доводить до красноватого оттенка. Именно это свидетельствует о том, что температура плавления свинца была превышена.
Расплавленный свинец при попадании на кожу может вызвать серьезные ожоги. Его капли прожигают одежду, при попадании на быстровоспламеняющиеся материалы могут вызвать возгорание и, как следствие, пожар, поэтому работать следует осторожно. Недопустимо попадание воды в расплавленный свинец. Это вызывает фонтан серебристых брызг, которые при попадании в глаза могут вызвать крайне нежелательные последствия.
Работать следует в хорошо проветриваемом помещении или на улице. Не стоит пренебрегать средствами индивидуальной защиты. Респиратор или даже ватно-марлевая повязка защитят дыхательные пути от свинцовой пыли. Малые дозы свинца в организме, возможно, сразу и не вызовут последствий. Однако этот материал имеет склонность накапливаться на протяжении жизни и вызывать отравление при превышении допустимых доз.
Малые дозы свинца в организме, возможно, сразу и не вызовут последствий. Однако этот материал имеет склонность накапливаться на протяжении жизни и вызывать отравление при превышении допустимых доз.
Плавим свинец в домашних условиях.
Температура плавления свинца 320 градусов. При изготовлении различных изделий из свинца такие как рыболовные грузила,балансировочные грузики,мы сталкиваемся с проблемой эффективных способов плавки свинца в домашних условиях.Давайте рассмотрим варианты плавки свинца в домашних условиях.
Как плавить свинец?
В домашних условиях, свинец можно плавить разными способами:
1. Свинец можно плавить при помощи огня,на костре
— недостаток данного способа заключается в том,что долго происходит плавление.Необходимо найти место где можно развести костер,так как при плавки свинца начинает развиваться ветром неприятный запах.Особенно если свинец не чистый,а с примесями.Представьте,что вы развели костер,а ваши соседи утроили стирку и ветром дым и запах понесло на их белье. После данного способа плавления свинца,вся ваша одежда будет источать запах костра и свинца. Самое печальное и важное,то что если случайно пойдет дождь и капли воды попадут в расплавленный свинец,то произойдет реакция брызг. Свинец в контакте с водой очень опасен. Ни в коем случае нельзя переливать свиней в влажную емкость!
После данного способа плавления свинца,вся ваша одежда будет источать запах костра и свинца. Самое печальное и важное,то что если случайно пойдет дождь и капли воды попадут в расплавленный свинец,то произойдет реакция брызг. Свинец в контакте с водой очень опасен. Ни в коем случае нельзя переливать свиней в влажную емкость!
2. Многие плавят свинец на газовой плите. Газовая плита обеспечивает быстрый разогрев емкости с свинцом и последующее плавление.Большой недостаток такого метода заключается в том,что вы дышите парами свинца.Так как газовая плита подразумевает под собой,размещение ее в помещении.Можно работать над вытяжкой,если она есть.
3. Сейчас многие используют электротигель
(плавильная печка)для плавки свинца lee- pro 4-20 на 9 кг 220 вольт.Производитель: компания Lee Precision, Inc. (США) Плавит свинец в течении 15-20 минут. Объем тигеля примерно равен 9 кг жидкого свинца.На тигеле есть подставка для формы. Благодаря опоре,он устойчив. в тигеле есть 9 режимов регулировки температуры. В основном все работают в режиме 4-6. Режим 4-6 позволит продлить жизнь нагревательного тэна (спирали) на срок примерено 1-1.5 года. При режиме 9 ,нагревательная спираль трескается в течении месяца и приходит в негодность. данный тигель позволяет вам работать в комфортных условиях. Вы можете работать на улице,в доме. Так как опора тигеля съемная,то вы можете его прикрутить к столбу,стене на уровне груди,это обезопасит вас от вдыхания паров свинца.Тигель необходим для переплавки свинца и сплавов температурой плавления до 350 градусов,литья пуль,картечи, блёсен или свинцовых грузил.Хорошо подходит для литья грузил в больших объёмах.Поставляется без вилки.
В основном все работают в режиме 4-6. Режим 4-6 позволит продлить жизнь нагревательного тэна (спирали) на срок примерено 1-1.5 года. При режиме 9 ,нагревательная спираль трескается в течении месяца и приходит в негодность. данный тигель позволяет вам работать в комфортных условиях. Вы можете работать на улице,в доме. Так как опора тигеля съемная,то вы можете его прикрутить к столбу,стене на уровне груди,это обезопасит вас от вдыхания паров свинца.Тигель необходим для переплавки свинца и сплавов температурой плавления до 350 градусов,литья пуль,картечи, блёсен или свинцовых грузил.Хорошо подходит для литья грузил в больших объёмах.Поставляется без вилки.
- вместимость свинца — 9 кг (20 фунтов)
- рабочее напряжение — 220 В
- потребляемая мощность — 700 Вт
- габаритные размеры ванны — 101 мм (диаметр, 4 дюйма)
- устойчивая основа
- время выхода на заданную температуру приблизительно 20-30 минут
- регулировка температуры плавная (бесступенчатая)
- внимание — поставляется без вилки .

- видео плавим свинец,тигель для свинца видео,Тигель для свинца LEE Pro 4-20 (220 Вольт) Ютуб видео
Использую для плавления свинца электротигель Lee производство США. Перед тем как приобрести, много читал о видах, определился на самом дорогом в линейке LEE c загрузкой 10 кг свинца.
Действительно не ошибся. Во первых Тигель вмещает в себя свинец в жидком состоянии около 9кг.Так же размер тигеля не столь внушительный, как на фото, высота его не более 30 см и ширина 20 см. Когда я получал на почте свой тигель,рассчитывал на размеры с микроволновую печь. В комплектацию тигеля не входит вилка, поэтому с почты поехал в ближайший магазин радиотоваров и приобрел вилку. Приехал домой, зашел в свою мастерскую имени “Папы Карло”, все подсоединил,закинул свинцовые платины и начал ждать. Задал мощность 9,не прошло и 15 минут, свинец начал плавиться. Подставил форму для литья грузил на 160 грамм, поднял ручку клапана и полилось. Не знаю как в других тигелях, на видео в ютубе должна была рвануть мощная свинцовая струя, и за пару секунд наполнить форму для литья грузил. В моем случае, полилась узенькая свинцовая струйка, которая секунд 20 заполняла форму. Грузило получилось никакое, с наплывами.
Не знаю как в других тигелях, на видео в ютубе должна была рвануть мощная свинцовая струя, и за пару секунд наполнить форму для литья грузил. В моем случае, полилась узенькая свинцовая струйка, которая секунд 20 заполняла форму. Грузило получилось никакое, с наплывами.
Меня не устроило качество грузила, и время отливки. Почесав затылок, ещё раз пересмотрев видео, принял решение разобрать тигель и сверлом сначала не большим рассверлить литьевое горлышко в тигеле. Для начала взял самое маленькое сверло и принялся растачивать. Разборка и сборка тигеля с расточкой отняла минут 15.Опять расплавил свинец, и таки да), струя стал шире и грузило получше. Взял сверло побольше и расточил еще шире.
На качество отливки грузила влияют следующие факторы:
1.Форма для литья грузил, должна быть — алюминиевая, потому что когда вы льете 50-100 грузил, грузила плотно впрессовываются в форму, и их приходится вырывать,при таком рывке не выдержит не одна гипсовая и другая форма. Пред заливкой свинца, форму необходимо прокоптить или свечкой или зажигалкой, до тех пор пока внутренняя составляющая не будет в саже, это во первых улучшит детализацию грузила, во вторых грузило легко вынется.
2.Должна быть хорошая подача свинца в форму, широкая струя. Если вы хотите выплавить 1 кг грузил, то необходимо тигель наполнить минимум на 3-4 кг свинца.
3.Льем грузила, когда на жидком свинце появится сине голубая пленка.
В своем случае, я снял с тигеля ножку прикрутил его к столбу под небольшим углом на уровне глаз, мой рост 1,75см, пред отливкой грузил, расплавленный свинец мешаю ложкой, все шлаки и нагар поднимаются на поверхность, снимаю их ложкой и скидываю в кастрюлю с крышкой. Шлак и нагар надежно лежат в кастрюле, а жидкий свинец в тигеле не дает даже запаха. От столба идет вытяжка на улицу, и все свинцовые пары вытягиваются наружу. Через тигель,с января 2012 года было перелито 800-1000 кг свинца, очень доволен электротигелем LEE,в режиме на реле 4,так как идут малые затраты электричества, режимы свыше 4,вас приятно обрадуют при оплате коммунальных услуг, в пол стоимости тигеля точно.)
При плавлении свинца идет потеря его 10-15%,если у вас 10 кг свинца,то грузил вы выплавите 8-9 кг.
Расточка тигеля lee pro 4-20
На фото мои рыболовные грузила
Чудеса пленочного кипения
Описание:
Мы расплавили свинцовый стержень в фарфоровую чашку. Свинец плавится при температуре 327˚С. Затем мы продолжили нагревать свинец, чтобы повысить температуру выше точки плавления.
От такой температуры легко загорается поднесенная спичка. Но способен ли человек выдержать (без вреда для себя) погружение пальца в такой горячий металл?
Сделать это нам помогло пленочное кипение или эффект Лейденфроста.
Объяснение:
Все видели как кипит вода в кастрюле – много пузырьков пара всплывают на поверхность жидкости и лопаются, выпуская пар наружу.
Но если пустую кастрюлю нагреть до температуры, значительно превышающей температуру кипения воды, и затем капнуть в нее немного воды, то моментально произойдет вскипание по всей поверхности соприкосновения капли воды с дном кастрюли.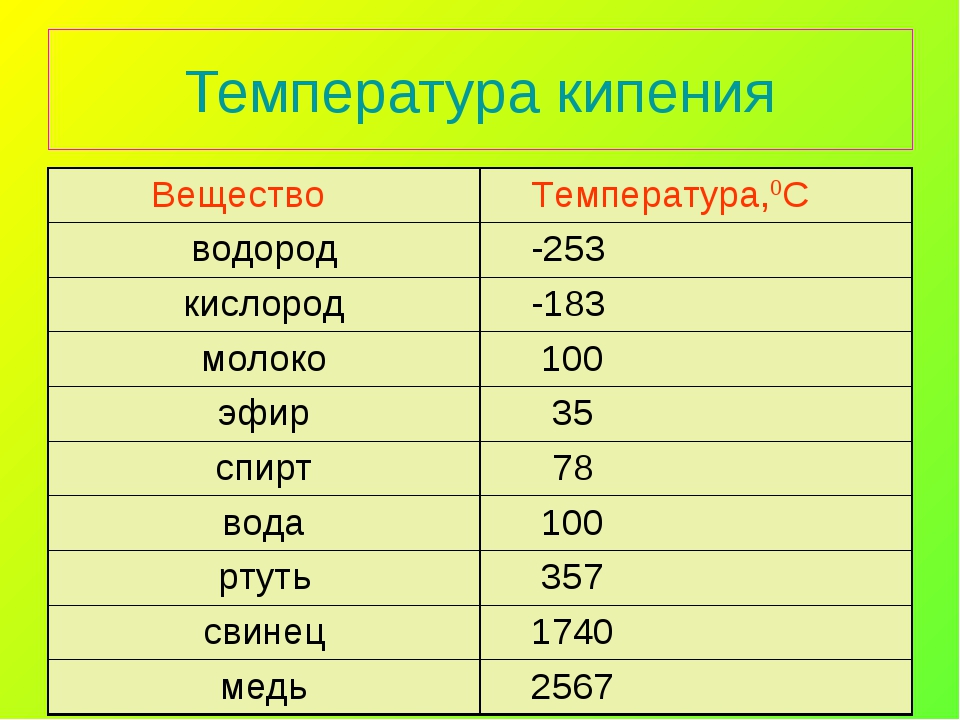 Между каплей и дном кастрюли образуется слой пара в виде тонкой пленки. Такое поведение жидкости получило название пленочного кипения.
Между каплей и дном кастрюли образуется слой пара в виде тонкой пленки. Такое поведение жидкости получило название пленочного кипения.
С пленочным кипением вы тоже встречались: оно происходит, когда смоченным пальцем касаются поверхности нагретого утюга. Еще эффектнее пленочное кипение проявляется, если на раскаленную сковородку капнуть водой: капли начнут бегать по сковородке (смотрите здесь).
Такое явление впервые обнаружил Лейденфрост (в 1756г) роняя на раскаленную ложку капли воды, поэтому пленочное кипение жидкостей еще называют эффектом Лейденфроста.
Эффект Лейденфроста объясняется тем, что в момент первоначального касания капли раскаленной поверхности часть воды бурно вскипает и быстро испаряется. При этом образуется тонкая паровая подушка, поддерживающая каплю над поверхностью и препятствующая дальнейшему интенсивному испарению воды (т.к. пар является плохим проводником тепла).
С явлением пленочного кипения связан старинный фокус по погружению влажной руки в расплавленный свинец. С рукой при этом ничего страшного не происходит, так как между расплавленным металлом и кожей образуется слой пара, некоторое время предохраняющий кожу от ожога.
С рукой при этом ничего страшного не происходит, так как между расплавленным металлом и кожей образуется слой пара, некоторое время предохраняющий кожу от ожога.
Эффектная демонстрация сущности пленочного кипения жидкости погружением в расплавленный свинец влажной руки привлекла внимание и команды «Наука детям».
Внимание! Опыт по погружению руки в расплавленный свинец очень эффектен, но и чрезвычайно опасен, если не соблюдать простейшие правила…
1) Свинец должен быть не только доведен до температуры плавления, но еще и немного перегрет. Это нужно для того, чтобы металл при соприкосновении с влагой пальца не остыл до температуры кристаллизации. Иначе кусок свинца застынет прямо на пальце и ожога уже не избежать.
2) Оксидная пленка с поверхности металла должна быть предварительно снята по той же причине. Она может прилипнуть к пальцу и больно обжечь.
3) Палец должен быть увлажнен, но на нем не должны свисать капли воды. Капля воды, попадая на раскаленную поверхность металла, выбрасывает брызги расплавленного свинца во все стороны.
4) Влага с пальца защищает только пока испаряется (доли секунды). Если палец задержать в расплавленном свинце подольше, ожога не избежать.
5) Пары свинца токсичны! Дышать парами свинца строго не рекомендуется – отравитесь! Проводить эксперимент можно только под вытяжкой или на открытом воздухе, а дышать необходимо через марлевую повязку.
Эффектом пленочного кипения жидкости объясняются и другие чудеса того же рода, как опускание рук в расплавленный металл. К ним относятся лизание языком раскаленной докрасна кочерги, хождение по горящим углям, держание во рту жидкого азота и аналогичные им физические фокусы.
Свинец
Свине́ц — элемент главной подгруппы четвёртой группы, шестого периода периодической системы химических элементов Д.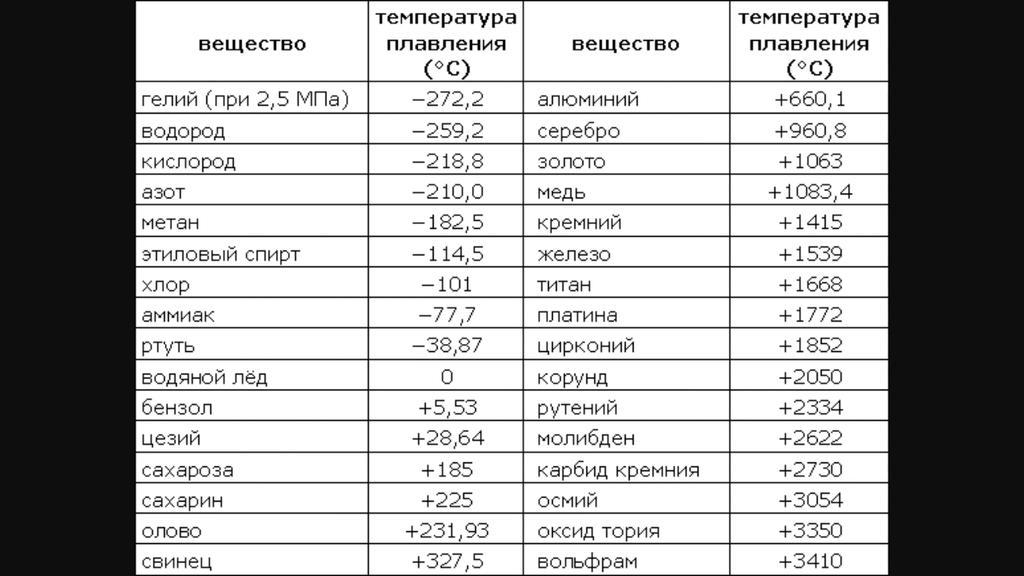 И. Менделеева, с атомным номером 82. Обозначается символом Pb (лат. Plumbum). Простое вещество свинец (CAS-номер: 7439-92-1) — ковкий, сравнительно легкоплавкий металл серого цвета.
И. Менделеева, с атомным номером 82. Обозначается символом Pb (лат. Plumbum). Простое вещество свинец (CAS-номер: 7439-92-1) — ковкий, сравнительно легкоплавкий металл серого цвета.
Происхождение названия
Происхождение слова «свинец» неясно. В большинстве славянских языков (болгарском, сербско-хорватском, чешском, польском) свинец называется оловом. Слово с тем же значением, но похожее по произношению на «свинец», встречается в языках балтийской группы: švinas (литовский), svins (латышский), а также в восточнославянских — украинском (свинець) и белорусском (свінец). Латинское plumbum, употребляемое, помимо остальных, Петронием Арбитром дало английское слово plumber — водопроводчик (в Древнем Риме трубы водопровода были именно из этого металла, как наиболее подходящего для отливки), и название венецианской тюрьмы со свинцовой крышей — Пьомбе, из которой по некоторым данным ухитрился бежать Казанова. Известен с глубокой древности. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы — в Древнем Риме. Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов. До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов. До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
Физические свойства
Свинец имеет довольно низкую теплопроводность, она составляет 35,1 Вт/(м·К) при температуре 0 °C. Металл мягкий, легко режется ножом. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет. Свинец широко используют для защиты от гамма-излучения, как элемент с большим атомным номером (и следовательно большим количеством электронов на один атом), достаточно распространённый в природе, не радиоактивный. Плотность — 11,3415 г/см³ (при 20 °C) Температура плавления — 327,4 °C (621,32 °F; 600,55 K) Температура кипения — 1740 °C (3164 °F; 2013,15 K)
Химические свойства
Свинец не очень активен химически. На металлическом разрезе свинца виден металлический блеск, постепенно исчезающий из-за образования тонкой плёнки PbO. С кислородом образует ряд соединений Pb2О, PbO, Pb2О3, Pb3О4, PbO2. Без кислорода вода при комнатной температуре не реагирует со свинцом, но при большой температуре при взаимодействии свинца и горячего водяного пара получаются оксиды свинца и водород. Оксидам PbO и PbO2 соответствуют амфотерные гидроксиды Pb(ОН)2 и Pb(ОН)4. При реакции Mg2Pb и разбавленной HCl получается небольшое количество PbH4. PbH4 — газообразное вещество без запаха, которое очень легко разлагается на свинец и водород. При большой температуре галогены образовывают со свинцом соединения вида PbX2 (X — соответствующий галоген). Все эти соединения мало растворяются в воде. Могут быть получены галогениды и типа PbX4. Свинец с азотом прямо не реагирует.
На металлическом разрезе свинца виден металлический блеск, постепенно исчезающий из-за образования тонкой плёнки PbO. С кислородом образует ряд соединений Pb2О, PbO, Pb2О3, Pb3О4, PbO2. Без кислорода вода при комнатной температуре не реагирует со свинцом, но при большой температуре при взаимодействии свинца и горячего водяного пара получаются оксиды свинца и водород. Оксидам PbO и PbO2 соответствуют амфотерные гидроксиды Pb(ОН)2 и Pb(ОН)4. При реакции Mg2Pb и разбавленной HCl получается небольшое количество PbH4. PbH4 — газообразное вещество без запаха, которое очень легко разлагается на свинец и водород. При большой температуре галогены образовывают со свинцом соединения вида PbX2 (X — соответствующий галоген). Все эти соединения мало растворяются в воде. Могут быть получены галогениды и типа PbX4. Свинец с азотом прямо не реагирует.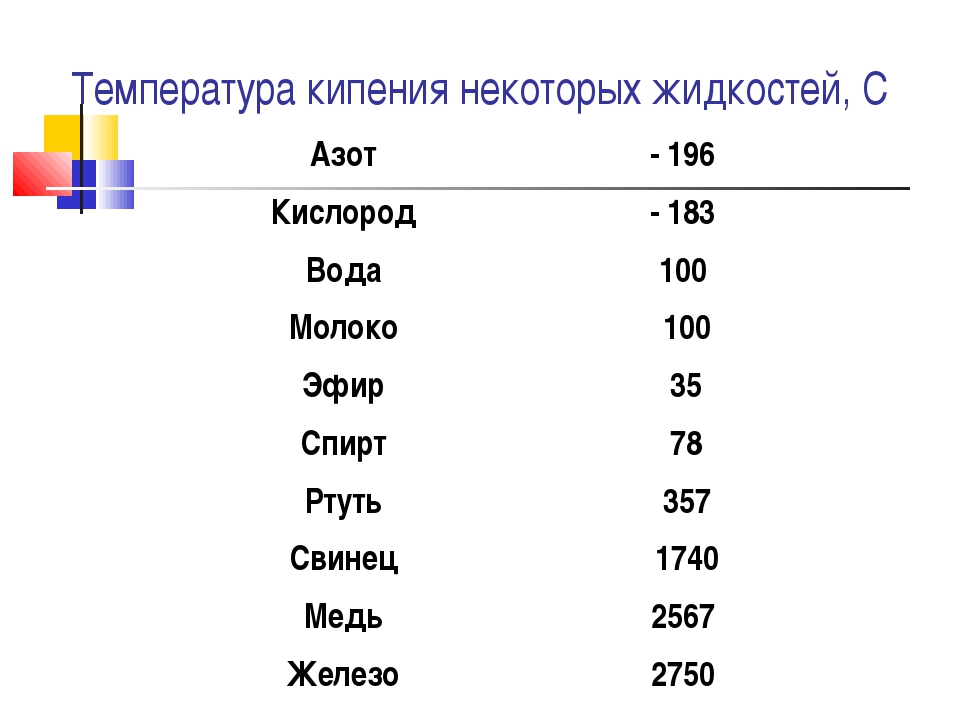 Азид свинца Pb(N3)2 получают косвенным путём: взаимодействием растворов солей Pb(II) и соли NaN3. Сульфиды свинца можно получить при нагревании серы со свинцом, образуется сульфид PbS. Сульфид получают также пропусканием сероводорода в растворы солей Pb(II). В ряду напряжений свинец стоит левее водорода, но свинец не вытесняет водород из разбавленных HCl и H2SO4, из-за перенапряжения Н2 на Pb, а также на поверхности металла образуются плёнки труднорастворимых хлорида PbCl2 и сульфата PbSO4, защищающие металл от дальнейшего действия кислот. Концентрированные кислоты типа H2SO4 и HCl при нагревании действуют на Pb и образуют с ним растворимые комплексные соединения состава Pb(HSO4)2 и Н2[PbCl4]. Азотная, а также некоторые органических кислоты (например, лимонная) растворяют свинец с получением солей Pb(II). По растворимости в воде соли свинца делятся на нерастворимые (например, сульфат, карбонат, хромат, фосфат, молибдат и сульфид), малорастворимые (хлорид и фторид) и растворимые (к примеру, ацетат, нитрат и хлорат свинца).
Азид свинца Pb(N3)2 получают косвенным путём: взаимодействием растворов солей Pb(II) и соли NaN3. Сульфиды свинца можно получить при нагревании серы со свинцом, образуется сульфид PbS. Сульфид получают также пропусканием сероводорода в растворы солей Pb(II). В ряду напряжений свинец стоит левее водорода, но свинец не вытесняет водород из разбавленных HCl и H2SO4, из-за перенапряжения Н2 на Pb, а также на поверхности металла образуются плёнки труднорастворимых хлорида PbCl2 и сульфата PbSO4, защищающие металл от дальнейшего действия кислот. Концентрированные кислоты типа H2SO4 и HCl при нагревании действуют на Pb и образуют с ним растворимые комплексные соединения состава Pb(HSO4)2 и Н2[PbCl4]. Азотная, а также некоторые органических кислоты (например, лимонная) растворяют свинец с получением солей Pb(II). По растворимости в воде соли свинца делятся на нерастворимые (например, сульфат, карбонат, хромат, фосфат, молибдат и сульфид), малорастворимые (хлорид и фторид) и растворимые (к примеру, ацетат, нитрат и хлорат свинца). Соли Pb(IV) могут быть получены электролизом сильно подкисленных серной кислотой растворов солей Pb(II). Соли Pb(IV) присоединяют отрицательные ионы с образованием комплексных анионов, например, плюмбатов (PbO3)2- и (PbO4)4-, хлороплюмбатов [PbCl6]2-, гидроксоплюмбатов [Pb(ОН)6]2- и других. Концентрированные растворы едких щелочей при нагревании реагируют со свинцом с выделением водорода и гидроксоплюмбитов типа [Pb(ОН)4 X2]. Потенциал ионизации Еион=7,42 эВ.
Соли Pb(IV) могут быть получены электролизом сильно подкисленных серной кислотой растворов солей Pb(II). Соли Pb(IV) присоединяют отрицательные ионы с образованием комплексных анионов, например, плюмбатов (PbO3)2- и (PbO4)4-, хлороплюмбатов [PbCl6]2-, гидроксоплюмбатов [Pb(ОН)6]2- и других. Концентрированные растворы едких щелочей при нагревании реагируют со свинцом с выделением водорода и гидроксоплюмбитов типа [Pb(ОН)4 X2]. Потенциал ионизации Еион=7,42 эВ.
Источник: Википедия
Другие заметки по химии
Тенденция перехода от неметалла к металлу в элементах группы 4
- Последнее обновление
- Сохранить как PDF
- Структуры элементов
- Физические свойства элементов
- Точки плавления
- Crittlenity
- Электрическая проводимость
- Точки плавления
- Объяснение тенденций
- Электронгативность
- Ионизация Energies
- Вкладки и атрибуты
На этой странице исследуется тенденция перехода от неметаллического к металлическому поведению элементов группы 4 (углерод (C), кремний (Si), германий (Ge), олово (Sn) и свинец (Pb)).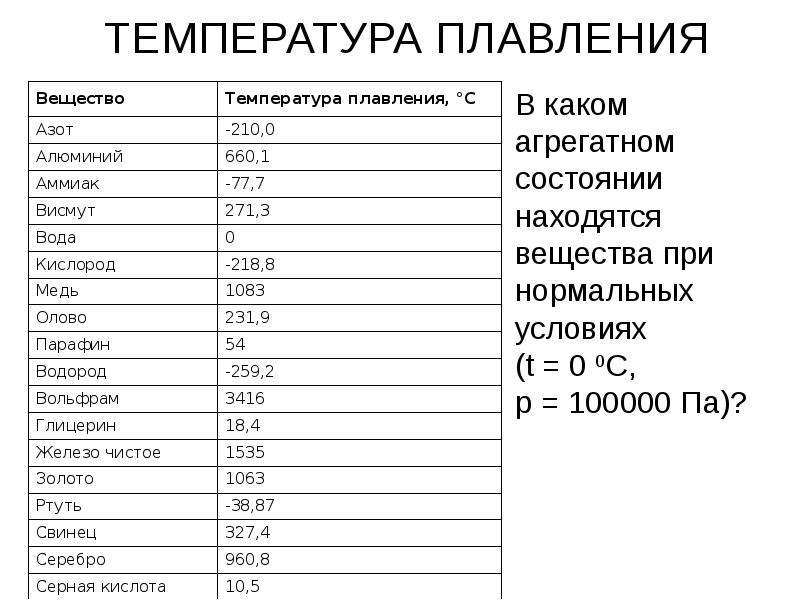 В нем описывается, как эта тенденция проявляется в структурах и физических свойствах элементов, и предпринимаются попытки объяснить эту тенденцию.
В нем описывается, как эта тенденция проявляется в структурах и физических свойствах элементов, и предпринимаются попытки объяснить эту тенденцию.
Конструкции из элементов
Тенденция перехода от неметалла к металлу вниз по группе очевидна в структуре самих элементов. Углерод, находящийся на вершине группы, образует большие сетчатые ковалентные структуры в своих двух наиболее известных аллотропах: алмазе и графите. Алмаз имеет трехмерную структуру атомов углерода, каждый из которых ковалентно связан с 4 другими атомами.На этой диаграмме показана репрезентативная часть этой структуры:
Эта структура также встречается в кремнии и германии, а также в одном из аллотропов олова, «сером олове» или «альфа-олове». Более распространенный аллотроп олова («белое олово» или «бета-олово») является металлическим, его атомы удерживаются вместе металлическими связями. Структура представляет собой искаженное плотно упакованное устройство. В плотноупакованной структуре каждый атом окружен 12 соседними атомами.
В свинце и более тяжелых элементах атомы расположены в 12-координированной металлической структуре.
Из этой информации ясно, что существует тенденция от типичной ковалентности, встречающейся в неметаллах, к металлической связи в металлах с очевидной точкой перегиба между двумя распространенными аллотропами олова.
Физические свойства элементов
Температуры плавления и кипения
Если изучить тенденции изменения температуры плавления и кипения в группе 4, трудно прокомментировать переход от ковалентной к металлической связи. Тенденции отражают растущую слабость ковалентных или металлических связей по мере того, как атомы становятся больше, а связи становятся длиннее.Эта тенденция показана ниже:
Низкое значение температуры плавления олова по сравнению с температурой плавления свинца, предположительно, связано с искажением 12-координатной структуры олова. Значения олова в таблице относятся к металлическому белому олову.
Хрупкость
Гораздо более четкое различие между неметаллами и металлами проявляется при рассмотрении хрупкости элементов.
- Углерод в алмазной аллотропной форме очень твердый, что отражает прочность ковалентных связей.Однако если по алмазу ударить молотком, он расколется.
- Кремний, германий и серое олово (все имеют ту же структуру, что и алмаз) также являются хрупкими твердыми телами.
- Однако белое олово и свинец имеют металлическую структуру. Атомы могут перемещаться без постоянного нарушения металлических связей; это приводит к типичным металлическим свойствам, таким как ковкость и пластичность. В частности, свинец довольно мягкий.
Электропроводность
- Алмаз не проводит электричество.В алмазе все электроны тесно связаны и не могут свободно двигаться.
- Кремний, германий и серое олово являются полупроводниками.
- Белое олово и свинец являются металлическими проводниками.

Эта информация показывает четкую тенденцию между типично неметаллическим поведением проводимости алмаза и типично металлическим поведением белого олова и свинца.
Объяснение тенденций
Одной из важных характеристик металлов является то, что они образуют положительные ионы.В этом разделе рассматриваются факторы, повышающие вероятность образования положительных ионов ниже группы 4.
Электроотрицательность
Электроотрицательность измеряет тенденцию атома притягивать связывающую пару электронов. Его обычно измеряют по шкале Полинга, в которой наиболее электроотрицательному элементу (фтору) присваивается электроотрицательность 4. Чем ниже электроотрицательность атома, тем менее сильно атом притягивает связывающую пару электронов. Это означает, что этот атом будет стремиться потерять пару электронов по направлению к чему-то еще, к чему он присоединен.Таким образом, интересующий нас атом будет стремиться нести либо частичный положительный заряд, либо образовывать положительный ион.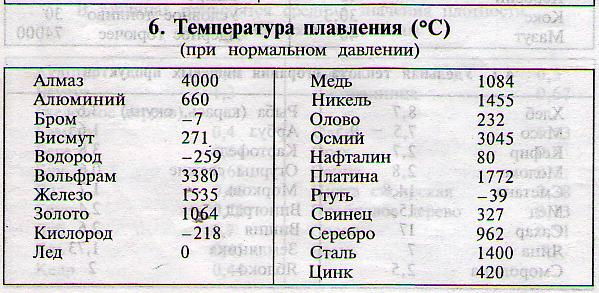
Металлическое поведение обычно связано с низкой электроотрицательностью. Тенденцию электроотрицательности в группе 4 и ее влияние на поведение металлов можно изучить с помощью рисунка ниже:
Электроотрицательность явно уменьшается между углеродом и кремнием, но за пределами кремния определенной тенденции нет. Поэтому, по-видимому, нет никакой связи между тенденцией перехода от неметалла к металлу и значениями электроотрицательности.-\]
и так далее для последующих ионизаций.
Ни один из элементов группы 4 не образует ионов 1+, поэтому рассмотрение только энергии первой ионизации бесполезно. Однако некоторые элементы образуют ионы 2+ и (в некоторой степени) 4+. На первой диаграмме показано, как общая энергия ионизации, необходимая для образования ионов 2+, варьируется в зависимости от группы. Все значения приведены в кДж моль -1 .
Энергии ионизации уменьшаются вниз по группе, хотя у свинца наблюдается небольшое увеличение. Тенденция существует, потому что:
Тенденция существует, потому что:
- Атомы становятся больше из-за дополнительных слоев электронов. Чем дальше внешние электроны от ядра, тем меньше они притягиваются; поэтому их легче удалить.
- Внешние электроны экранируются от полного влияния ядра увеличивающимся числом внутренних электронов.
- Эти два эффекта перевешивают эффект увеличения заряда ядра.
При изучении энергии ионизации, необходимой для образования ионов 4+, картина похожа, но не так проста, как показано ниже (значения снова указаны в кДж моль -1 ):
Для образования ионов 2+ требуется большое количество энергии ионизации, а для образования ионов 4+ требуется еще больше энергии.Однако в каждом случае происходит уменьшение энергии ионизации вниз по группе; это означает, что олово и свинец могут образовывать положительные ионы. Тем не менее, эти цифры не указывают на то, что это вероятно.
Энергии ионизации углерода настолько велики, что он практически не может образовывать простые положительные ионы.
Список элементов по температуре кипения | Химия
Это список химических элементов, отсортированных по температуре кипения, измеренной при нормальном давлении.
| Атомный номер | Имя | Символ | Температура кипения в Кельвинах | °С | по Фаренгейту |
|---|---|---|---|---|---|
| 2 | гелий | Он | 4,22 К | -268,93 °С | -452,07 °F |
| 1 | водород | Х | 20,28 К | -252,87 °С | -423,17 °F |
| 10 | неон | Не | 27.07 К | -246,08 °С | -410,94 °F |
| 7 | азот | Н | 77,36 К | -195,79 °С | -320,42 °F |
| 9 | фтор | Ф | 85,03 К | -188,12 °С | -306,62 °F |
| 18 | аргон | Ар | 87,30 К | -185,85 °С | -302,53 °F |
| 8 | кислород | О | 90.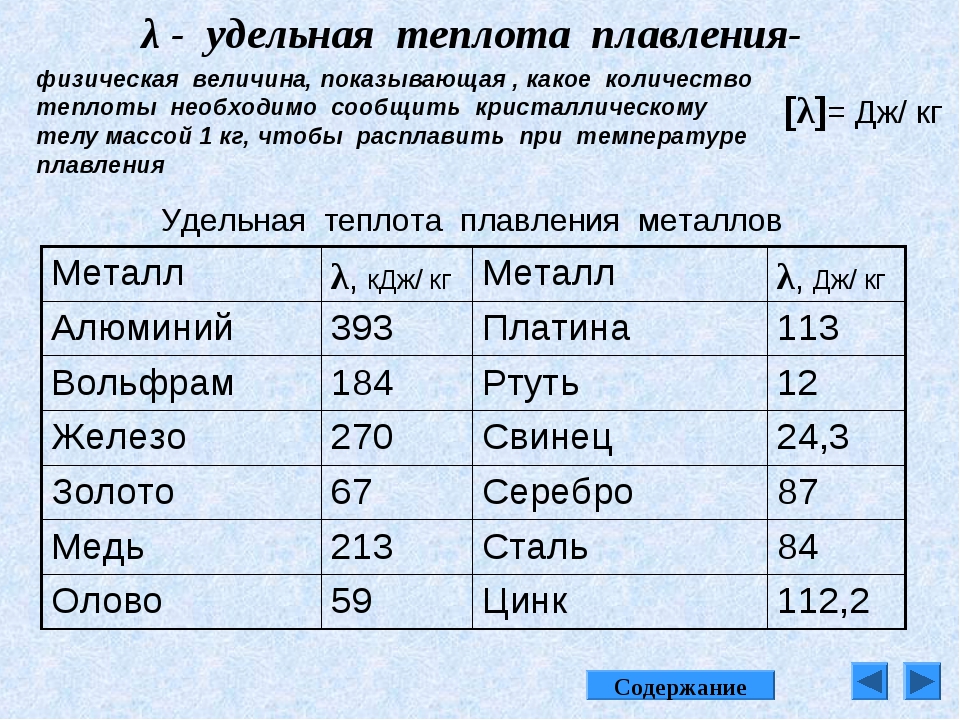 20 К 20 К | -182,95 °С | -297,31 °F |
| 36 | криптон | Кр | 119,93 К | -153,22 °С | -243,8 °F |
| 54 | ксенон | Хе | 165,03 К | -108,12 °С | -162,62 °F |
| 86 | радон | Р-н | 211,3 К | -61,7 °С | -79,1 °F |
| 17 | хлор | Кл | 239.11 К | -34,04 °С | -29,27 °F |
| 35 | бром | Бр | 332,0 К | 58,8 °С | 137,8 °F |
| 53 | йод | я | 457,4 К | 184,3 °С | 363,7 °F |
| 15 | белый фосфор | Р | 553,15 К | 280°С | 536 °F |
| 85 | астат | В | ? 610 К | ? 337 °С 90 167 | ? 639 °F |
| 80 | ртуть | рт.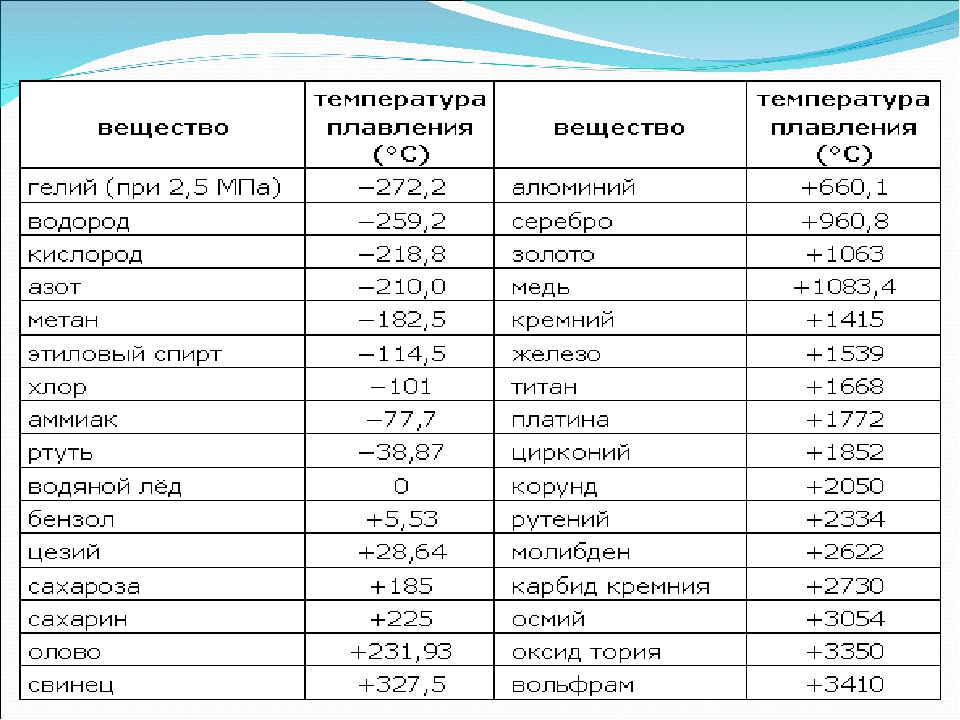 ст. ст. | 630.15 К | 357 °С | 674,6 °F |
| 16 | сера | С | 717,8 К | 444,6 °С | 832,3 °F |
| 33 | мышьяк | Как | 887 К | субл. 614 °С 90 167 | 1137 °F |
| 55 | цезий | цезий | 944 К | 671 °С | 1240 °F |
| 87 | франций | Пт | ? 950 К | ? 677 °С 90 167 | ? 1251 °F |
| 34 | селен | Se | 958 К | 685 °С | 1265 °F |
| 37 | рубидий | руб | 961 К | 688 °С | 1270 °F |
| 97 | берклий | Бк | 983 К | 710 °С | 1310 °F |
| 19 | калий | К | 1032 К | 759 °С | 1398 °F |
| 48 | кадмий | CD | 1040 К | 767 °С | 1413 °F |
| 11 | натрий | Нет | 1156 К | 883 °С | 1621 °F |
| 30 | цинк | Цинк | 1180 К | 907 °С | 1665 °F |
| 84 | полоний | По | 1235 К | 962 °С | 1764 °F |
| 52 | теллур | Те | 1261 К | 988 °С | 1810 °F |
| 12 | магний | мг | 1363 К | 1090°С | 1994 °F |
| 70 | иттербий | Ыб | 1469 К | 1196 °С | 2185 °F |
| 3 | литий | Ли | 1615 К | 1342 °С | 2448 °F |
| 38 | стронций | Старший | 1655 К | 1382 °С | 2520 °F |
| 98 | Калифорния | См. | 1743 К | 1470 °С | 2678 °F |
| 81 | таллий | Тл | 1746 К | 1473 °С | 2683 °F |
| 20 | кальций | Са | 1757 К | 1484 °С | 2703 °F |
| 63 | европий | ЕС | 1802 К | 1529 °С | 2784 °F |
| 83 | висмут | Би | 1837 К | 1564 °С | 2847 °F |
| 51 | сурьма | Сб | 1860 К | 1587 °С | 2889 °F |
| 88 | радий | Ра | 2010 К | 1737 °С | 3159 °F |
| 82 | свинец | Пб | 2022 К | 1749 °С | 3180 °F |
| 62 | самария | См | 2067 К | 1794 °С | 3261 °F |
| 56 | барий | Ба | 2170 К | 1897 °С | 3447 °F |
| 69 | тулий | Тм | 2223 К | 1950 °С | 3542 °F |
| 25 | марганец | Мн | 2334 К | 2061 °С | 3742 °F |
| 49 | индий | В | 2345 К | 2072 °С | 3762 °F |
| 47 | серебро | Аг | 2435 К | 2162 °С | 3924 °F |
| 31 | галлий | Га | 2477 К | 2204 °С | 3999 °F |
| 4 | бериллий | Быть | 2742 К | 2469 °С | 4476 °F |
| 13 | алюминий | Ал | 2792 К | 2519 °С | 4566 °F |
| 29 | медь | Медь | 2835 К | 2562 °С | 4643 °F |
| 66 | диспрозий | Дай | 2840 К | 2567 °С | 4653 °F |
| 50 | олово | Сн | 2875 К | 2602 °С | 4716 °F |
| 95 | америций | Ам | 2880 К | 2607 °С | 4725 °F |
| 24 | хром | Кр | 2944 К | 2671 °С | 4840 °F |
| 67 | гольмий | Хо | 2993 К | 2720 °С | 4928 °F |
| 32 | германий | Гэ | 3106 К | 2833 °С | 5131 °F |
| 21 | скандий | Sc | 3109 К | 2836 °С | 5136 °F |
| 79 | золото | Золото | 3129 К | 2856 °С | 5173 °F |
| 26 | железо | Fe | 3134 К | 2861 °С | 5182 °F |
| 28 | никель | Ni | 3186 К | 2913 °С | 5275 °F |
| 27 | кобальт | Ко | 3200 К | 2927 °С | 5301 °F |
| 46 | палладий | Пд | 3236 К | 2963 °С | 5365 °F |
| 61 | прометий | вечера | 3273 К | 3000 °С | 5432 °F |
| 60 | неодим | Нд | 3347 К | 3074 °С | 5565 °F |
| 96 | кюрий | См | 3383 К | 3110 °С | 5630 °F |
| 89 | актиний | Ас | 3471 К | 3198 °С | 5788 °F |
| 94 | плутоний | Пу | 3501 К | 3228 °С | 5842 °F |
| 68 | эрбий | Er | 3503 К | 3230 °С | 5846 °F |
| 65 | тербий | Тб | 3503 К | 3230 °С | 5846 °F |
| 14 | кремний | Си | 3538 К | 3265 °С | 5909 °F |
| 64 | гадолиний | Гд | 3546 К | 3273 °С | 5923 °F |
| 22 | титан | Ти | 3560 К | 3287 °С | 5949 °F |
| 39 | иттрий | Д | 3609 К | 3336 °С | 6037 °F |
| 71 | лютеций | Лу | 3675 К | 3402 °С | 6156 °F |
| 23 | ванадий | В | 3680 К | 3407 °С | 6165 °F |
| 58 | церий | Се | 3716 К | 3443 °С | 6229 °F |
| 57 | лантан | Ла | 3737 К | 3464 °С | 6267 °F |
| 59 | празеодим | Пр | 3793 К | 3520 °С | 6368 °F |
| 45 | родий | Rh | 3968 К | 3695 °С | 6683 °F |
| 78 | платина | Пт | 4098 К | 3825 °С | 6917 °F |
| 5 | бор | Б | 4200 К | 3927 °С | 7101 °F |
| 93 | нептуний | Нп | 4273 К | 4000°С | 7232 °F |
| 6 | графит (углерод) | С | Сабл 4300 К | 4027 °С | 7281 °F |
| 91 | протактиний | Па | ? 4300 К | ? 4027°С | ? 7281 °F |
| 92 | уран | У | 4404 К | 4131 °С | 7468 °F |
| 44 | рутений | Ру | 4423 К | 4150 °С | 7502 °F |
| 43 | технеций | ТК | 4538 К | 4265 °С | 7709 °F |
| 40 | цирконий | Зр | 4682 К | 4409 °С | 7968 °F |
| 77 | иридий | Ир | 4701 К | 4428 °С | 8002 °F |
| 72 | гафний | Хф | 4876 К | 4603 °С | 8317 °F |
| 42 | молибден | Пн | 4912 К | 4639 °С | 8382 °F |
| 41 | ниобий | № | 5017 К | 4744 °С | 8571 °F |
| 90 | торий | 5061 К | 4788 °С | 8650 °F | |
| 6 | алмаз (углерод) | С | 5100 К | 4827 °С | 8720 °F |
| 76 | осмий | Ос | 5285 К | 5012 °С | 9054 °F |
| 73 | тантал | Та | 5731 К | 5458 °С | 9856 °F |
| 74 | вольфрам | Вт | 5828 К | 5555 °С | 10031 °F |
| 75 | рений | Ре | 5869 К | 5596 °С | 10105 °F |
Температуры кипения этих элементов пока неизвестны:
ТЕНДЕНЦИЯ ОТ НЕМЕТАЛЛА К МЕТАЛЛУ В ГРУППЕ 4 ЭЛЕМЕНТОВ На этой странице исследуется тенденция перехода от неметаллического к металлическому поведению элементов группы 4: углерода (C), кремния (Si), германия (Ge), олова (Sn) и свинца (Pb). Структуры и физические свойства Конструкции из элементов Тенденция перехода от неметалла к металлу по мере продвижения вниз по Группе отчетливо видна в структурах самих элементов. Углерод на вершине группы имеет гигантские ковалентные структуры в двух наиболее известных аллотропах — алмазе и графите. | |
Аллотропы: Две или более формы одного и того же элемента в одном физическом состоянии. Структуры алмаза и графита более подробно рассматриваются на странице о гигантских ковалентных структурах в другой части этого сайта. Вероятно, вам стоит прочитать эту страницу, прежде чем идти дальше. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу. | |
Алмаз имеет трехмерную структуру атомов углерода, каждый из которых ковалентно связан с 4 другими атомами. Точно такая же структура встречается в кремнии и германии и в одном из аллотропов олова — «сером олове» или «альфа-олове». Обычный аллотроп олова («белое олово» или «бета-олово») является металлическим, и его атомы удерживаются вместе металлическими связями. Структура представляет собой искаженное плотно упакованное устройство. В плотной упаковке каждый атом окружен 12 ближайшими соседями. К тому времени, как вы доберетесь до свинца, атомы выстроятся в прямую 12-координированную металлическую структуру. | |
Примечание: Если вы не уверены в металлическом соединении или металлических конструкциях, вам следует перейти по этим ссылкам, прежде чем двигаться дальше. Первая ссылка на самом деле приведет вас ко второй, если вы хотите изучить обе эти темы. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |
Таким образом, существует четкая тенденция от типичной ковалентности, обнаруживаемой в неметаллах, к металлической связи в металлах, при этом переход очевиден в двух совершенно разных структурах, обнаруженных в олове. Физические свойства элементов Точки плавления и кипения Если вы посмотрите на тенденции в температурах плавления и кипения по мере того, как вы спускаетесь по группе 4, очень трудно сделать какие-либо разумные комментарии о переходе от ковалентной к металлической связи. Тенденции отражают растущую слабость ковалентных или металлических связей по мере того, как атомы становятся больше, а связи становятся длиннее. Низкое значение температуры плавления олова по сравнению со свинцом, предположительно, связано с тем, что олово образует искаженную 12-координационную структуру, а не чистую.Значения олова в таблице относятся к металлическому белому олову. | |
Примечание: Данные на этой диаграмме взяты с отличного сайта Webelements Университета Шеффилда. Данные очень сильно различаются в зависимости от того, откуда вы их берете. Я должен признать, что выбрал этот набор, потому что он показывает простые, в основном непрерывные узоры! | |
Хрупкость Если вы посмотрите на хрупкость элементов, то разница между неметаллом и металлом будет гораздо более четкой. Углерод, как и алмаз, конечно, очень твердый, что отражает прочность ковалентных связей. Однако, если по нему ударить молотком, он разобьется. Как только вы приложите достаточно энергии, чтобы разорвать существующие углерод-углеродные связи, все! Кремний, германий и серое олово (все имеют ту же структуру, что и алмаз) также являются хрупкими твердыми телами. Однако белое олово и свинец имеют металлическую структуру. Атомы могут катиться друг по другу без какого-либо постоянного нарушения металлических связей, что приводит к типичным металлическим свойствам, таким как ковкость и пластичность.Свинец, в частности, является довольно мягким металлом. Электропроводность Углерод, как и алмаз, не проводит электричество. В алмазе все электроны тесно связаны и не могут свободно двигаться. | |
Примечание: В графите каждый атом отдает один электрон делокализованной системе электронов, которая поглощает весь его слой.  Эти электроны могут свободно перемещаться, поэтому графит проводит электричество, но это особый случай. Эти электроны могут свободно перемещаться, поэтому графит проводит электричество, но это особый случай. Если вам интересно, связь в графите похожа на значительно расширенную версию связи в бензоле. Каждый атом углерода подвергается гибридизации sp 2 , а затем негибридизованные p-орбитали каждого атома углерода перекрываются в стороны, образуя массивную пи-систему над и под плоскостью листа атомов. | |
В отличие от алмаза (который не проводит электричество), кремний, германий и серое олово являются полупроводниками . | |
Полупроводники: Теория полупроводников лежит за пределами химии уровня А, но вкратце. . . Когда множество атомов объединяются в гигантскую структуру, их атомные орбитали сливаются, образуя огромное количество молекулярных орбиталей, которые располагаются в полосах возрастающей энергии. Одна из них часто описывается как валентная полоса . Другая полоса называется полосой проводимости . Это обычно имеет более высокую энергию, чем валентная зона, и в чем-то вроде алмаза или кремния при абсолютном нуле зона проводимости пуста от электронов. Однако по мере того, как электроны приобретают тепловую энергию при повышении температуры, некоторые электроны могут перепрыгнуть из валентной зоны в зону проводимости, особенно если зазор между ними мал. Как только они оказываются в зоне проводимости, они делокализуются от своих первоначальных атомов и могут свободно двигаться и проводить электричество. В алмазе энергетический зазор между валентной зоной и зоной проводимости слишком велик, чтобы это могло произойти. В кремнии ширина запрещенной зоны достаточно мала, чтобы электроны могли прыгать, поэтому кремний является полупроводником. Если вас это интересует, попробуйте поискать в Google теория зон кремния-полупроводники (или аналогичную). | |
Белое олово и свинец являются нормальными металлическими проводниками электричества. Таким образом, существует четкая тенденция между типично неметаллическим поведением проводимости углерода, такого как алмаз, и типично металлическим поведением белого олова и свинца. Попытка объяснить тенденции Основной характеристикой металлов является то, что они образуют положительные ионы. Что нам нужно сделать, так это посмотреть на факторы, которые увеличивают вероятность образования положительных ионов, когда вы спускаетесь в группу 4. Электроотрицательность Электроотрицательность — это мера тенденции атома притягивать связывающую пару электронов.Обычно его измеряют по шкале Полинга, где наиболее электроотрицательному элементу (фтору) присваивается электроотрицательность 4, . Чем ниже электроотрицательность атома, тем слабее атом притягивает связывающую пару электронов. Металлическое поведение обычно связано с низкой электроотрицательностью. | |
Примечание: Если вы не уверены в электроотрицательности, вам действительно следует прочитать об этом, прежде чем идти дальше. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу. | |
Так что же происходит с электроотрицательностью в группе 4? Уменьшается ли он по мере продвижения вниз по Группе, указывая на тенденцию к металлическому поведению? Хорошо! Он, конечно, падает с углерода на кремний, но с этого момента получается полная неразбериха! Таким образом, кажется, что нет никакой связи между тенденцией перехода от неметалла к металлу и значениями электроотрицательности. | |
Примечание. Данные на этой диаграмме снова взяты с сайта Webelements Шеффилдского университета. Опять же, данные очень сильно различаются в зависимости от того, откуда вы их берете. Но ни в одном из случаев, которые я обнаружил, нет тенденции к снижению электроотрицательности по мере продвижения вниз по группе. Более старые источники данных дают падение от углерода (2.5) на кремний (1,8), но затем присвойте всем остальным элементам группы такое же значение (все 1,8). Если у кого-то, кто читает это, есть простое объяснение отсутствия корреляции между тенденцией к металлическому поведению и значениями электроотрицательности, не могли бы вы связаться со мной по адресу, указанному на странице об этом сайте. | |
Энергия ионизации Если вы думаете об образовании положительных ионов, очевидно, с чего следует начать, — это то, как меняется энергия ионизации по мере того, как вы спускаетесь в группу 4. Энергия ионизации определяется как энергия, необходимая для выполнения каждого из следующих изменений. Они указаны в кДж моль -1 . Первая энергия ионизации:
Вторая энергия ионизации:
. . . и так далее. | |
Примечание: Если вы не уверены в энергии ионизации, вам будет полезно перейти по этой ссылке, прежде чем двигаться дальше. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу. | |
Ни один из элементов группы 4 не образует ионов 1+, поэтому рассмотрение только первой энергии ионизации не очень полезно. Однако некоторые элементы образуют ионы 2+ и (в некоторой степени) 4+. На первой диаграмме показано, как меняется общая энергия ионизации, необходимая для образования ионов 2+, по мере продвижения вниз по Группе. Вы можете видеть, что энергии ионизации имеют тенденцию падать по мере продвижения вниз по Группе, хотя в наблюдается небольшое увеличение свинца. Основной тренд, потому что:
| |
Примечание: Причина необычности свинца обсуждается более подробно на странице о степенях окисления, показанных элементами в группе 4. Это не особенно важно для настоящего обсуждения. | |
Если вы посмотрите на количество энергии ионизации, необходимой для образования 4+ ионов, то картина похожая, но не совсем четкая. | |
Примечание: Увеличение полной энергии ионизации на свинце еще более очевидно в случае возможного образования ионов 4+. Это важно, когда речь идет о предпочтительных степенях окисления свинца. | |
То, что есть Глядя на эти две диаграммы, становится ясно, что вам нужно вложить большое количество энергии ионизации, чтобы образовать 2+ иона, и огромное количество энергии, чтобы сформировать 4+ иона. Однако в каждом случае происходит падение энергии ионизации по мере продвижения вниз по Группе, что повышает вероятность того, что олово и свинец могут образовывать положительные ионы — однако эти цифры не указывают на то, что они могут образовывать положительные ионы. образуют положительные ионы. Энергии ионизации углерода в верхней части группы настолько велики, что он не может образовывать простые положительные ионы. | |
Примечание: Даже для олова и свинца необходимо затратить огромное количество энергии для образования ионов 2+ или 4+.Так почему же они вообще образуют ионы? Вы должны помнить, что есть много других энергетических условий, участвующих в образовании ионного соединения, кроме энергии ионизации. Некоторые из них выделяют большое количество энергии — например, энтальпия решетки, если вы формируете ионное твердое вещество, или энтальпия гидратации, если вы формируете раствор. Вам нужно будет прочитать о циклах Борна-Габера, чтобы полностью понять это, и, возможно, вы захотите изучить раздел энергетики в Chemguide или мою книгу по химическим расчетам. | |
В меню группы 4 . . . В меню неорганической химии. . . В главное меню . . . © Джим Кларк, 2004 г. (последнее изменение: январь 2022 г.) | |
Свинцовый элемент с температурой кипения
Содержимое
- 1 свинцовый элемент
- Свинцовый элемент с 2 точками кипения
- 3 использует элемент из свинца
- 4 отравление свинцом 4.1 человек подверглись отравлению свинцом 4.2 отравление урон выстрел
- 4.1 лица, подвергшиеся отравлению свинцом
- 4.2 отравляющий урон
- 5 Каталожные номера
Компонент свинец
Свинец (на английском языке: Lead) представляет собой металл серебристо-белого или серого цвета, химический символ (Pb) и атомный номер 82, элемент четырнадцатой группы в периодической таблице и минералы свинца. ковкий, рожденный в основном с высокой плотностью, но слабо соединяющий электричество, алхимики и считается одним из древнейших минералов, как известно в древние времена Каштаддамх римлянами непрерывно для изготовления водопроводных труб и тарелок, монет и даже приготовления пищи посуда, обнаруженная в эпоху Цезаря Августа, также использовалась вавилонянами на панелях тела для записи надписей. [1]
[1]
Свинец доступен в земной коре по весу с таким же содержанием олова, в то время как он обеспечивается аналогичным космическим содержанием элементов цезия, а также празеодима, вольфрама и гафния, которые являются редкими элементами для в разумной степени, свинец содержится во многих минералах и редко встречается в природе в свободном виде, это свинец Kbertid или Algalina (на английском языке: галенит), основной источник свинцовой промышленности, также может быть вторичным. содержится в ряде других металлов Kalongelesat англезит , и церуссит церуссит, и извлекают элемент свинца путем обжига в сыром виде, затем плавят в доменной печи и могут быть непосредственно расплавлены без обжига.[1]
Точка кипения свинцового элемента
Достигните точки кипения свинцового элемента 3180 градусов по Фаренгейту, что равно 1749 градусам Цельсия, при этом некоторые свойства этого элемента проявляются: [2]
- Свинец находится в твердом состоянии при 20°С.
- Температура плавления свинца равна 327,462 градуса Цельсия.

- Свинец имеет плотность, равную 11,3 г/см³.
- Число общего окисления свинца равно +2 и -4.
- Относительной атомной массы свинца 207.2.
- Свинец — минерал, устойчивый к коррозии.
Использует свинцовый элемент
Он входит в состав свинца во многих областях применения, включая следующие: [3]
- Свинец является важным элементом в аккумуляторной промышленности, так как он потребляется примерно в 75% от общего объема производства находится в аккумуляторной промышленности, благодаря первому в отрасли аккумулятору под руководством французского физика Гастона Планте Гастон Планте в 1859 году, он произвел современные аккумуляторы, коммерчески известные аккумуляторы, свинцово-кислотные в 1889 году.
- Благодаря высокой плотности свинца при его использовании обеспечивается эффективная защита от рентгеновских лучей и звуковой барьер.
- Свинец добавляется в краску, которая обычно используется в стекольной промышленности.

- Свинец используется в подшипниковой и сварочной промышленности, также важен в производстве каучука и нефтепереработке.
- тетраэтилсвинцовая добавка к бензину в двадцатых годах двадцатого века, которая помогла уменьшить преждевременное зажигание, и Bt или дороги, и ущерб, но вредные и смертельные эффекты привели к увеличению тенденции к избавлению от него, это было заблокирован недавно для всех автомобилей в 1996 году.[4]
- Использование свинца в косметике в шестнадцатом и семнадцатом годах в Европе является обычным явлением, так как он использовался в качестве средства, чтобы показать особую белизну лица в аристократии, королева Елизавета I королева Англии из этих месяцев использует лосьоны, как говорят, что белый лосьон дал ей молодую маску. [4]
Отравление свинцом
Отравление свинцом представляет опасность для здоровья человека, которое имеет весьма разрушительные последствия для нервов, головного мозга и многих различных частей тела, возникает при попадании ацсм проглоченном им человеком, либо вдыхаемом или всасываемом . [5]
[5]
Лица, подвергшиеся отравлению свинцом
Лица подвергаются риску отравления свинцом следующим образом: [6] [5]
- Дети: опасность отравления свинцом особенно их тела развиваются, чтобы поглощать больше свинца, чем взрослые, и их нервозность систем, и их мозг более чувствителен к его вредным воздействиям, в дополнение к этому они более вероятно вступят в контакт с пулями, такими как кладя руки детей на вещи, которые могут нести пыль, а затем прикасаться ко рту, так как возможно, что дети подвергаются воздействию свинца, съедая и выпивая загрязненную воду, или играя в игры, сделанные из свинца, или поедая кусочки краски в старых домах, которые находятся в плохом состоянии, или вдыхание пыли.
- Взрослые и беременные женщины: Взрослые, подверженные риску отравления свинцом, могут подвергаться воздействию многими путями, такими как прием пищи и питьевой воды, загрязненной дробью, или вдыхание пыли в местах, где есть покрытие, содержащее свинец, или посуда и чашки, или ремонт дома, или во время работы на некоторых работах, которые подвержены риску воздействия свинца на работников, таких как производство гончарных изделий, перекраска мебели, изготовление витражей или из-за некоторых косметических средств, народных средств и т.
 д., а также воздействие на беременных женщин. женщин вызывать беспокойство, в частности, так как это может вызвать угрозу для здоровья и роста эмбрионов. [6] возраст 6 лет и менее наиболее уязвим к воздействию свинцового отравления, даже низкие уровни которого могут привести ко многим влияниям Kalmhakl собственное поведение и обучение, рост и замедление, низкий IQ, гиперактивность, анемия, проблемы со слухом, также может вызывать судороги , кома и смерть в редких случаях.
д., а также воздействие на беременных женщин. женщин вызывать беспокойство, в частности, так как это может вызвать угрозу для здоровья и роста эмбрионов. [6] возраст 6 лет и менее наиболее уязвим к воздействию свинцового отравления, даже низкие уровни которого могут привести ко многим влияниям Kalmhakl собственное поведение и обучение, рост и замедление, низкий IQ, гиперактивность, анемия, проблемы со слухом, также может вызывать судороги , кома и смерть в редких случаях. - Вредное воздействие на беременных: выделяется свинец из костей беременных, а также кальций, который может переходить в них к плодам или грудным детям, что может вызвать тяжелые последствия для них Калзбб при преждевременных родах детей или родах малых размеров, женщины и беременные женщины подвергаются риску невынашивания беременности, а также поражению почек и нервной системы ребенка и его головного мозга, а также повышают вероятность возникновения поведенческих проблем.
- Вредное воздействие на взрослых: Свинец оказывает серьезное воздействие и на взрослых, включая повышение артериального давления, воздействие на сердце и сосуды, снижение функции почек, возникновение репродуктивных проблем у женщин и мужчин.
 أ ب «Узнайте о свинце», www.epa.gov, дата обращения 18 декабря 2018 г. Отредактировано.
أ ب «Узнайте о свинце», www.epa.gov, дата обращения 18 декабря 2018 г. Отредактировано.
Шикарно!
Мы сожалеем об этом!
Успешно отправлено, спасибо!
Дополнительные темы
Межмолекулярные силы
Молекула представляет собой наименьшую наблюдаемую группу атомов с уникальными связями, которые представляют собой состав, конфигурацию и характеристики чистого соединения. До сих пор наша главная цель заключалась в том, чтобы открыть и описать способы, которыми атомы соединяются друг с другом, образуя молекулы.Поскольку все наблюдаемые образцы соединений и смесей содержат очень большое количество молекул ( ок. !0 20 ), мы должны также интересоваться взаимодействиями между молекулами, а также их отдельными структурами. Действительно, многие физические характеристики соединений, которые используются для их идентификации (например, точки кипения, температуры плавления и растворимости), обусловлены межмолекулярными взаимодействиями.
Все атомы и молекулы имеют слабое притяжение друг к другу, известное как притяжение Ван-дер-Ваальса .Эта сила притяжения берет свое начало в электростатическом притяжении электронов одной молекулы или атома к ядрам другой. Если бы не было сил Ван-дер-Ваальса, вся материя существовала бы в газообразном состоянии, и жизнь, какой мы ее знаем, была бы невозможна. Следует отметить, что существуют и меньшие силы отталкивания между молекулами, которые быстро возрастают на очень малых межмолекулярных расстояниях.
Точки кипения
Для общих целей полезно рассматривать температуру как меру кинетической энергии всех атомов и молекул в данной системе.С повышением температуры соответственно возрастает сила поступательных и вращательных движений всех молекул, а также колебаний атомов и групп атомов внутри молекул. Опыт показывает, что многие соединения обычно существуют в виде жидкостей и твердых веществ; и что даже газы с низкой плотностью, такие как водород и гелий, могут быть сжижены при достаточно низкой температуре и высоком давлении. Из этого следует четкий вывод, что силы межмолекулярного притяжения значительно различаются и что точка кипения соединения является мерой силы этих сил.Таким образом, чтобы разрушить межмолекулярные притяжения, удерживающие молекулы соединения в конденсированном жидком состоянии, необходимо увеличить их кинетическую энергию за счет повышения температуры образца до характерной температуры кипения соединения.
Из этого следует четкий вывод, что силы межмолекулярного притяжения значительно различаются и что точка кипения соединения является мерой силы этих сил.Таким образом, чтобы разрушить межмолекулярные притяжения, удерживающие молекулы соединения в конденсированном жидком состоянии, необходимо увеличить их кинетическую энергию за счет повышения температуры образца до характерной температуры кипения соединения.
В следующей таблице показаны некоторые факторы, влияющие на силу межмолекулярного притяжения. За формулой каждой записи следует ее формульный вес в скобках и температура кипения в градусах Цельсия.Во-первых, это молекулярный размер. Большие молекулы имеют больше электронов и ядер, которые создают силы притяжения Ван-дер-Ваальса, поэтому их соединения обычно имеют более высокие точки кипения, чем подобных соединений , состоящих из более мелких молекул. Очень важно применять это правило только к однородным соединениям. Примеры, приведенные в первых двух строках, схожи тем, что молекулы или атомы имеют сферическую форму и не имеют постоянных диполей. Молекулярная форма также важна, как показывает вторая группа соединений.Верхний ряд состоит из молекул примерно сферической формы, тогда как изомеры в нижнем ряду имеют молекулы цилиндрической или линейной формы. Силы притяжения между последней группой обычно больше. Наконец, постоянные молекулярные диполи, образованные полярными ковалентными связями, приводят к еще большим силам притяжения между молекулами, при условии, что они обладают подвижностью для выстраивания в соответствующие ориентации. Последние записи в таблице сравнивают неполярные углеводороды с соединениями одинакового размера, имеющими полярные связи с кислородом и азотом.Галогены также образуют полярные связи с углеродом, но они также увеличивают молекулярную массу, что затрудняет различение этих факторов.
Молекулярная форма также важна, как показывает вторая группа соединений.Верхний ряд состоит из молекул примерно сферической формы, тогда как изомеры в нижнем ряду имеют молекулы цилиндрической или линейной формы. Силы притяжения между последней группой обычно больше. Наконец, постоянные молекулярные диполи, образованные полярными ковалентными связями, приводят к еще большим силам притяжения между молекулами, при условии, что они обладают подвижностью для выстраивания в соответствующие ориентации. Последние записи в таблице сравнивают неполярные углеводороды с соединениями одинакового размера, имеющими полярные связи с кислородом и азотом.Галогены также образуют полярные связи с углеродом, но они также увеличивают молекулярную массу, что затрудняет различение этих факторов.
точек кипения (ºC) из выбранных элементов и соединений | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ATOMAR | AR (40) -186 | KR (83) -153 | Xe (131) -109 | |||||||
| Молекулярный | СН 4 (16) -161 | (СН 3 ) 4 С (72) 9. 5 5 | (CH 3 ) 4 SI (88) 27 | CCL 4 (154) 77 | ||||||
| Sharical: | (CH 3 ) 4 C (72) 9.5 | (CH 3 ) 2 CCL 2 (113) 69 9162 (CH 3 ) 3 CC (CH 3 ) 3 (114) 106|||||||||
| Линейный: | CH 3 (CH 2 ) 3 CH 3 (72) 36 | CL (CH 2 ) 3 CL (113) 121 | CH 3 (CH 2 ) 6 CH 3 (114) 126 | |||||||
Молекулярная полярность | ||||||||||
| Non-Polar: | H 2 C=CH 2 (28) -104 | F 2 (38) -188 | CH 3 C≡CCH 3 (54) -32 | CF 4 (88) -130 | ||||||
| POLAR: | H 2 C = O (30) -21 | CH 3 CH = O (44) 20 | (CH 3 ) 3 N (59) 3. 5 5 | (CH 3 ) 2 C = O (58) 56 | ||||||
| HC≡N (27) 26 | CH 3 CHN (41) 82 | (CH 2 ) 3 O (58) 50 | CH 3 NO 2 (61) 101 | |||||||
Температуры плавления кристаллических твердых тел нельзя классифицировать так же просто, как точки кипения. Расстояние между молекулами в кристаллической решетке небольшое и регулярное, а межмолекулярные силы ограничивают движение молекул сильнее, чем в жидком состоянии.Молекулярный размер важен, но форма также имеет решающее значение, поскольку отдельные молекулы должны совместно подходить друг к другу, чтобы силы притяжения в решетке были большими. Молекулы сферической формы обычно имеют относительно высокие температуры плавления, которые в некоторых случаях приближаются к температуре кипения. Это отражает тот факт, что сферы могут собираться вместе более плотно, чем другие формы. Эта чувствительность к структуре или форме является одной из причин того, что точки плавления широко используются для идентификации конкретных соединений.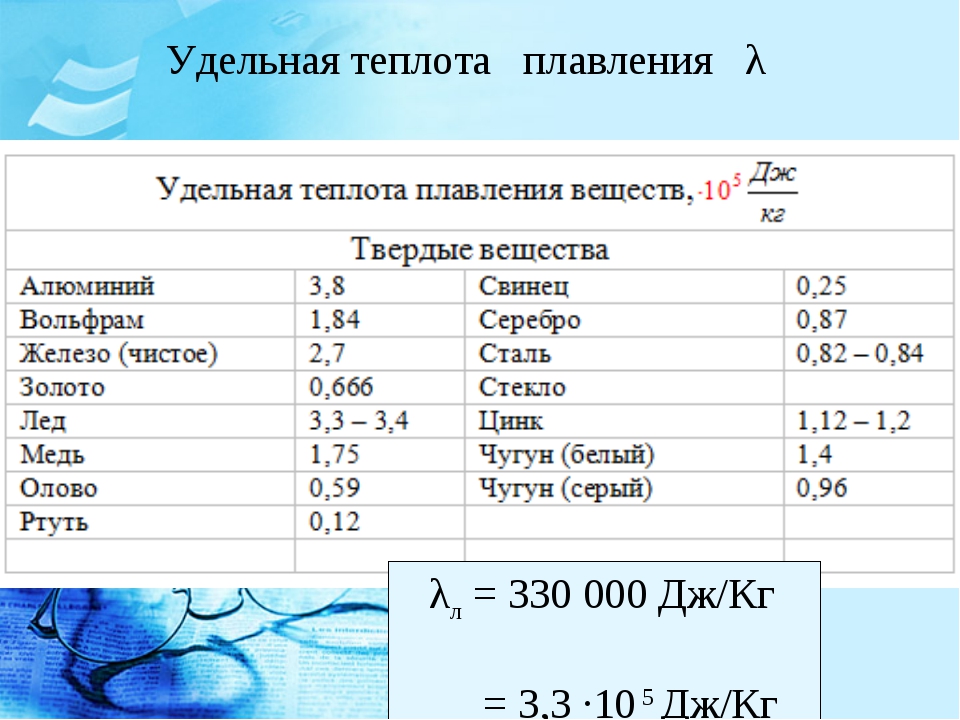 Данные в следующей таблице служат для иллюстрации этих моментов.
Данные в следующей таблице служат для иллюстрации этих моментов.
| Соединение | Формула | Точка кипения | Point | |
|---|---|---|---|---|
| Pentane | CH 3 (CH 2 ) 3 CH 3 | 36ºC | -130ºC | |
| Hexane | CH 3 (CH 2 ) 4 CH 3 | 69ºC | -95ºC | |
| Heptane | CH 3 (CH 2 ) 5 CH 3 | 98ºC | -91ºC | |
| Octane | CH 3 (CH 2 ) 6 CH 3 | 126ºC | -57ºC | |
| Nonane | CH 3 (CH 2 ) 7 CH 3 3 | 151ºC | -54ºC | |
| Decane | CH 3 (CH 2 ) 8 CH 3 | 901 66 174ºC-30ºC | ||
| TetramethylButane | (CH 3 ) 3 C-C (CH 3 ) 3 | 106ºC | + 100ºC |
Обратите внимание, что температуры кипения неразветвленных алканов (от пентана до декана) довольно плавно увеличиваются с увеличением молекулярной массы, но температуры плавления четных углеродных цепей увеличиваются больше, чем температуры плавления нечетных углеродных цепей. Цепи с четными звеньями упаковываются однородно более компактно, чем цепи с нечетными звеньями. Последнее соединение, изомер октана, имеет почти сферическую форму и исключительно высокую температуру плавления (всего на 6º ниже точки кипения).
Цепи с четными звеньями упаковываются однородно более компактно, чем цепи с нечетными звеньями. Последнее соединение, изомер октана, имеет почти сферическую форму и исключительно высокую температуру плавления (всего на 6º ниже точки кипения).
Водородное соединение
Наиболее мощной межмолекулярной силой, влияющей на нейтральные (незаряженные) молекулы, является водородная связь . Если мы сравним точки кипения метана (CH 4 ) -161ºC, аммиака (NH 3 ) -33ºC, воды (H 2 O) 100ºC и фтороводорода (HF) 19ºC, мы увидим больший разброс для эти молекулы аналогичного размера, чем ожидалось из данных, представленных выше для полярных соединений.Это показано графически на следующей диаграмме. Большинство простых гидридов элементов групп IV, V, VI и VII демонстрируют ожидаемое повышение температуры кипения с увеличением молекулярной массы, но гидриды наиболее электроотрицательных элементов (азота, кислорода и фтора) имеют аномально высокие температуры кипения для своей массы.
Исключительно сильное диполь-дипольное притяжение, вызывающее такое поведение, называется водородной связью . Водород образует полярные ковалентные связи с более электроотрицательными атомами, такими как кислород, и, поскольку атом водорода довольно мал, положительный конец диполя связи (водород) может приближаться к соседним нуклеофильным или основным центрам ближе, чем другие полярные связи.Кулоновские силы обратно пропорциональны шестой степени расстояния между диполями, что делает эти взаимодействия относительно сильными, хотя они все еще слабые ( ок. от 4 до 5 ккал на моль) по сравнению с большинством ковалентных связей. Уникальные свойства воды во многом обусловлены прочными водородными связями, возникающими между ее молекулами. На следующей диаграмме водородные связи изображены пурпурными пунктирными линиями.
Молекула, обеспечивающая полярный водород для водородной связи, называется донором . Молекула, которая обеспечивает богатый электронами участок, к которому притягивается водород, называется акцептором . Вода и спирты могут служить как донорами, так и акцепторами, тогда как простые эфиры, альдегиды, кетоны и сложные эфиры могут действовать только как акцепторы. Точно так же первичные и вторичные амины являются как донорами, так и акцепторами, а третичные амины функционируют только как акцепторы. Как только вы научитесь распознавать соединения, которые могут образовывать межмолекулярные водородные связи, станет понятным их относительно высокая температура кипения.Данные в следующей таблице иллюстрируют этот момент.
Молекула, которая обеспечивает богатый электронами участок, к которому притягивается водород, называется акцептором . Вода и спирты могут служить как донорами, так и акцепторами, тогда как простые эфиры, альдегиды, кетоны и сложные эфиры могут действовать только как акцепторы. Точно так же первичные и вторичные амины являются как донорами, так и акцепторами, а третичные амины функционируют только как акцепторы. Как только вы научитесь распознавать соединения, которые могут образовывать межмолекулярные водородные связи, станет понятным их относительно высокая температура кипения.Данные в следующей таблице иллюстрируют этот момент.
| Соединение | Формула | Мол. Вес. | Poince | Point | |
|---|---|---|---|---|---|
| 3 OCH 3 3 | 46 | -24ºC | -138ºC | -138ºC | |
| Ethanol | CH 3 CH 2 О, | 46 | 78ºC | -130ºC | |
| 3 (CH 2 (CH 2 ) 2 О | 60167 | 98ºC | -127ºC | ||
| Диэтиловый эфир | (CH 3 CH 2 ) 2 O 2 O | 74 | -116ºC | -116ºC | |
| Propyl Amine | CH 3 (CH 2 ) 2 NH 2 | 59 | 48ºC | -8-83ºC | |
| CH 3 CH 2 NHCH 3 | 59 | 37ºC | |||
| триметиламин | (CH 3 N 3 N | 59 | 3ºC | -117ºC | |
| HOCH 2 CH 2 OH | 62 | 197ºC | 197ºC | -13ºC | |
| Уксусная кислота | CH 3 CO 2 H | 60162 H | 60167 | 118ºC | 17ºC |
| 2 NCH 2 CH 2 NH 2 | 60 | 118ºC | 8. 5ºC 5ºC |
Спирты кипят значительно выше, чем сравнимые по размеру простые эфиры (первые две записи), а изомерные 1º, 2º и 3º-амины, соответственно, демонстрируют пониженные температуры кипения, при этом два изомера с водородными связями имеют значительно более высокую температуру кипения, чем 3º-амин (записи 5). до 7). Кроме того, водородные связи O-H—O явно прочнее, чем водородные связи N-H—N, как мы видим, сравнивая пропанол с аминами.
Как и ожидалось, наличие двух функций водородной связи в соединении еще больше повышает температуру кипения.Уксусная кислота (девятая запись) — интересный случай. Димерные частицы, показанные справа, удерживаемые вместе двумя водородными связями, являются основным компонентом жидкого состояния. Если это точное представление состава этого соединения, то можно ожидать, что его точка кипения будет эквивалентна температуре кипения соединения C 4 H 8 O 4 (масса формулы = 120). Подходящим приближением такого соединения является тетраметоксиметан (CH 3 O) 4 C, который на самом деле немного больше (масса в формуле = 136) и имеет температуру кипения 114ºC. Таким образом, димерная структура с водородными связями, по-видимому, является хорошим представлением уксусной кислоты в конденсированном состоянии.
Таким образом, димерная структура с водородными связями, по-видимому, является хорошим представлением уксусной кислоты в конденсированном состоянии.
В этом месте стоит отметить родственный принцип. Хотя водородная связь относительно слабая ( ок. от 4 до 5 ккал на моль), когда существует несколько таких связей, результирующая структура может быть довольно прочной. Водородные связи между волокнами целлюлозы придают большую прочность древесине и связанным с ней материалам.
| Для получения дополнительной информации по этому вопросу нажмите здесь. |
|---|
Свойства кристаллических твердых тел |
|---|
Точки плавления
Большинство органических соединений имеют температуру плавления ниже 200 ºC. Некоторые разлагаются перед плавлением, некоторые возгоняются, но большинство подвергается многократному плавлению и кристаллизации без изменения молекулярной структуры. Теперь хорошо известно, что точка замерзания растворителя понижается растворенным веществом, т.е. рассола по сравнению с водой. Если два кристаллических соединения (А и В) тщательно смешать, температура плавления этой смеси обычно снижается и расширяется по сравнению с характерной резкой точкой плавления каждого чистого компонента. | |
Интересная, но менее распространенная смешанная система включает молекулярные компоненты, образующие плотный комплекс или молекулярное соединение , способное существовать в виде дискретных частиц в равновесии с жидкостью того же состава. Такой вид обычно имеет резко конгруэнтную температуру плавления и дает фазовую диаграмму, имеющую вид двух соседних эвтектических диаграмм.Пример такой системы показан справа, молекулярное соединение представлено как A:B или C . Одна такая смесь состоит из α-нафтола, т.пл. 94 ºC, и п-толуидин, т.пл. 43 ºС. Комплекс A:B имеет температуру плавления 54 ºC, а на фазовой диаграмме показаны две точки эвтектики, первая при 50 ºC, вторая при 30 ºC. |
Полиморфизм
Полиморфы соединения представляют собой различные кристаллические формы, в которых расположение молекул в решетке отличается. Эти различные твердые вещества обычно имеют разные температуры плавления, растворимости, плотности и оптические свойства. Многие полиморфные соединения имеют гибкие молекулы, которые могут принимать различные конформации, и рентгенологическое исследование этих твердых тел показывает, что их кристаллические решетки налагают определенные конформационные ограничения. В расплавленном состоянии или в растворе различные полиморфные кристаллы такого типа образуют одну и ту же быстро уравновешивающуюся смесь молекулярных частиц. Полиморфизм похож на гидратированные или сольватированные кристаллические формы, но отличается от них. Было подсчитано, что более 50% известных органических соединений способны к полиморфизму.
В расплавленном состоянии или в растворе различные полиморфные кристаллы такого типа образуют одну и ту же быстро уравновешивающуюся смесь молекулярных частиц. Полиморфизм похож на гидратированные или сольватированные кристаллические формы, но отличается от них. Было подсчитано, что более 50% известных органических соединений способны к полиморфизму.
Тетраацетат рибофуранозы, показанный в верхнем левом углу ниже, был источником ранней загадки, связанной с полиморфизмом. Соединение было впервые получено в Англии в 1946 году и имело температуру плавления 58 ºC.Несколько лет спустя тот же материал, имеющий ту же температуру плавления, был получен независимо друг от друга в Германии и США. Затем американские химики обнаружили, что температура плавления их первых препаратов повысилась до 85 ºC. В конце концов, стало очевидно, что любая лаборатория, в которой была введена форма с более высокой температурой плавления, больше не могла производить форму с более низкой температурой плавления. Микроскопические зародыши стабильного полиморфа в окружающей среде неизбежно направляют кристаллизацию в эту сторону.Данные рентгеновской дифракции показали, что низкоплавкий полиморф является моноклинным, пространственная группа P2. Форма с более высокой температурой плавления была орторомбической, пространственная группа P2 1 2 1 2 1 .
Микроскопические зародыши стабильного полиморфа в окружающей среде неизбежно направляют кристаллизацию в эту сторону.Данные рентгеновской дифракции показали, что низкоплавкий полиморф является моноклинным, пространственная группа P2. Форма с более высокой температурой плавления была орторомбической, пространственная группа P2 1 2 1 2 1 .
Полиморфизм оказался решающим фактором в производстве фармацевтических препаратов, твердых пигментов и полимеров. Некоторые примеры описаны ниже.
Ацетаминофен — распространенный анальгетик (например, тайленол). Обычно его получают в виде моноклинных призм (верхний рисунок) при кристаллизации из воды.Под первым показан менее стабильный орторомбический полиморф, обладающий лучшими физическими свойствами для прессования в таблетки. Хинакридон — важный пигмент, используемый в красках и чернилах. Он имеет жесткую плоскую молекулярную структуру, а в разбавленном растворе имеет светло-желтый цвет. Противоязвенный препарат ранитидин (Зантак) был впервые запатентован компанией Glaxo-Wellcome в 1978 году.Семь лет спустя той же компанией был запатентован второй полиморф ранитидина. Это продлило срок действия лицензии до 2002 г., а усилия по маркетингу генерической формы были сорваны, поскольку было невозможно приготовить первый полиморф, не загрязненный вторым. Относительно простой арилтиофен, получивший обозначение EL1, был получен и изучен химиками компании Eli Lilly. Он показал шесть полиморфных кристаллических форм, изображения которых показаны слева.
| 52 6 1579||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Полиморф | Температура плавления | Комментарии |
|---|---|---|
| I | 17,4 ºC | Производится путем быстрого охлаждения расплава. |
| II | 23,4 ºC | Производится охлаждением расплава со скоростью 2 ºC/мин. |
| III | 26 ºC | Получают превращением формы II при 5-10 ºC. |
| IV | 27 ºC | Получают превращением формы III при хранении при 16-21 ºC. |
| В | 34 ºC | Производится путем закалки (охлаждение, затем небольшой подогрев при перемешивании). |
| VI | 36-37 ºC | Производится из V после выдержки 4 месяцев при комнатной температуре. |
Растворимость в воде
Воду называют «универсальным растворителем», и ее широкое распространение на этой планете и важная роль в жизни делают ее эталоном для дискуссий о растворимости.Вода растворяет многие ионные соли благодаря своей высокой диэлектрической проницаемости и способности сольватировать ионы. Первый уменьшает притяжение между противоположно заряженными ионами, а второй стабилизирует ионы, связываясь с ними и делокализуя плотность заряда. Многие органические соединения, особенно алканы и другие углеводороды, практически нерастворимы в воде. Органические соединения, растворимые в воде, такие как большинство перечисленных в таблице выше, обычно имеют акцепторные и донорные группы водородной связи. Наименее растворимым из перечисленных соединений является диэтиловый эфир, который может служить только акцептором водородной связи и на 75% состоит из углеводородов.Тем не менее, диэтиловый эфир примерно в двести раз более растворим в воде, чем пентан.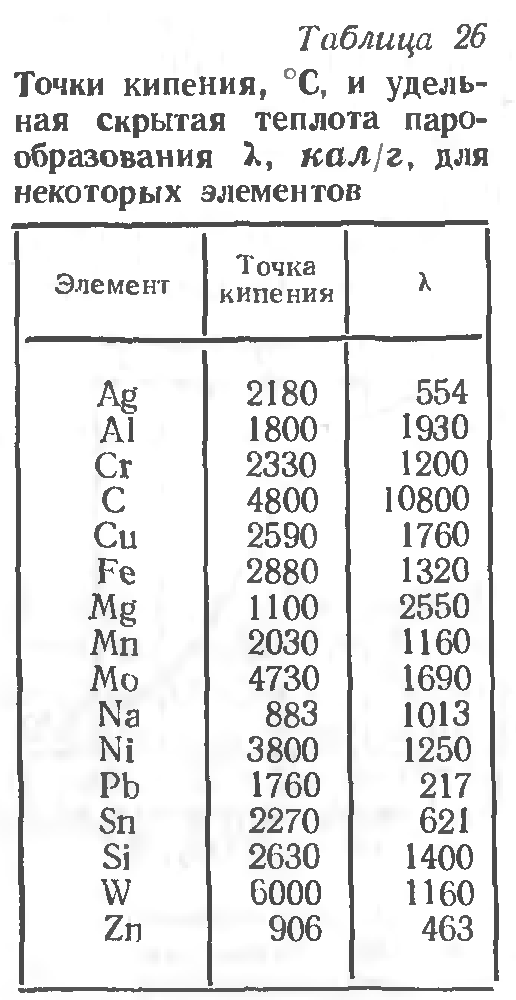
Главной характеристикой воды, которая влияет на эту растворимость, является обширная ассоциация ее молекул друг с другом посредством водородных связей. Эта сеть с водородными связями стабилизируется суммой всех энергий водородных связей, и если бы неполярные молекулы, такие как гексан, были вставлены в сеть, они разрушили бы локальную структуру, не внося никаких собственных водородных связей.Конечно, молекулы гексана испытывают значительное ван-дер-ваальсово притяжение к соседним молекулам, но эти силы притяжения гораздо слабее, чем водородная связь. Следовательно, когда гексан или другие неполярные соединения смешиваются с водой, сильные ассоциативные силы водной сети исключают неполярные молекулы, которые должны существовать в отдельной фазе. Это показано на следующем рисунке, и, поскольку гексан менее плотный, чем вода, гексановая фаза плавает на водной фазе.
Важно помнить об этой тенденции воды исключать неполярные молекулы и группы, поскольку она является фактором структуры и поведения многих сложных молекулярных систем. Обычная номенклатура, используемая для описания молекул и областей внутри молекул, представляет собой гидрофильных для полярных групп с водородными связями и гидрофобных для неполярных частиц.
Обычная номенклатура, используемая для описания молекул и областей внутри молекул, представляет собой гидрофильных для полярных групп с водородными связями и гидрофобных для неполярных частиц.
| Для получения дополнительной информации по этому вопросу нажмите здесь. |
|---|
Выберите проблему Точки кипения Водородная связь Растворимость воды
Эта страница является собственностью Уильяма Ройша.
Комментарии, вопросы и ошибки должны
отправить по адресу [email protected].
Эти страницы предоставлены IOCD для оказания помощи в наращивании потенциала в области химического образования. 05.05.2013
Конец этой дополнительной темы
Подробнее о межмолекулярных силах |
|---|
Межмолекулярные силы и физические свойства
Силы притяжения, существующие между молекулами, ответственны за многие объемные физические свойства, проявляемые веществами.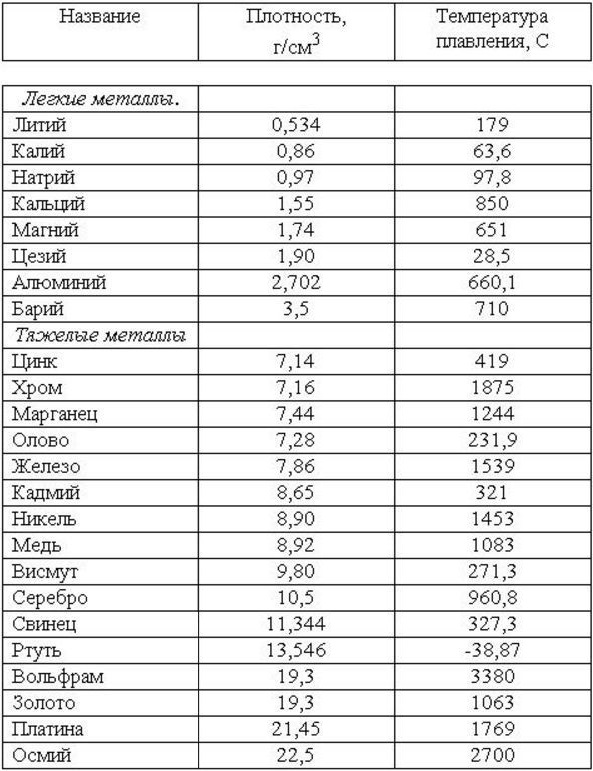 Одни соединения представляют собой газы, другие – жидкости, третьи – твердые вещества. Температуры плавления и кипения чистых веществ отражают эти межмолекулярные силы и обычно используются для идентификации. Из этих двух точка кипения считается наиболее репрезентативной мерой общего межмолекулярного притяжения. Таким образом, точка плавления отражает тепловую энергию, необходимую для преобразования высокоупорядоченного набора молекул в кристаллической решетке в хаотичность жидкости. Расстояние между молекулами в кристаллической решетке небольшое и регулярное, а межмолекулярные силы ограничивают движение молекул сильнее, чем в жидком состоянии.Молекулярный размер важен, но форма также имеет решающее значение, поскольку отдельные молекулы должны совместно подходить друг к другу, чтобы силы притяжения в решетке были большими. Молекулы сферической формы обычно имеют относительно высокие температуры плавления, которые в некоторых случаях приближаются к температуре кипения, что отражает тот факт, что сферы могут упаковываться друг в друга более плотно, чем другие формы.
Одни соединения представляют собой газы, другие – жидкости, третьи – твердые вещества. Температуры плавления и кипения чистых веществ отражают эти межмолекулярные силы и обычно используются для идентификации. Из этих двух точка кипения считается наиболее репрезентативной мерой общего межмолекулярного притяжения. Таким образом, точка плавления отражает тепловую энергию, необходимую для преобразования высокоупорядоченного набора молекул в кристаллической решетке в хаотичность жидкости. Расстояние между молекулами в кристаллической решетке небольшое и регулярное, а межмолекулярные силы ограничивают движение молекул сильнее, чем в жидком состоянии.Молекулярный размер важен, но форма также имеет решающее значение, поскольку отдельные молекулы должны совместно подходить друг к другу, чтобы силы притяжения в решетке были большими. Молекулы сферической формы обычно имеют относительно высокие температуры плавления, которые в некоторых случаях приближаются к температуре кипения, что отражает тот факт, что сферы могут упаковываться друг в друга более плотно, чем другие формы.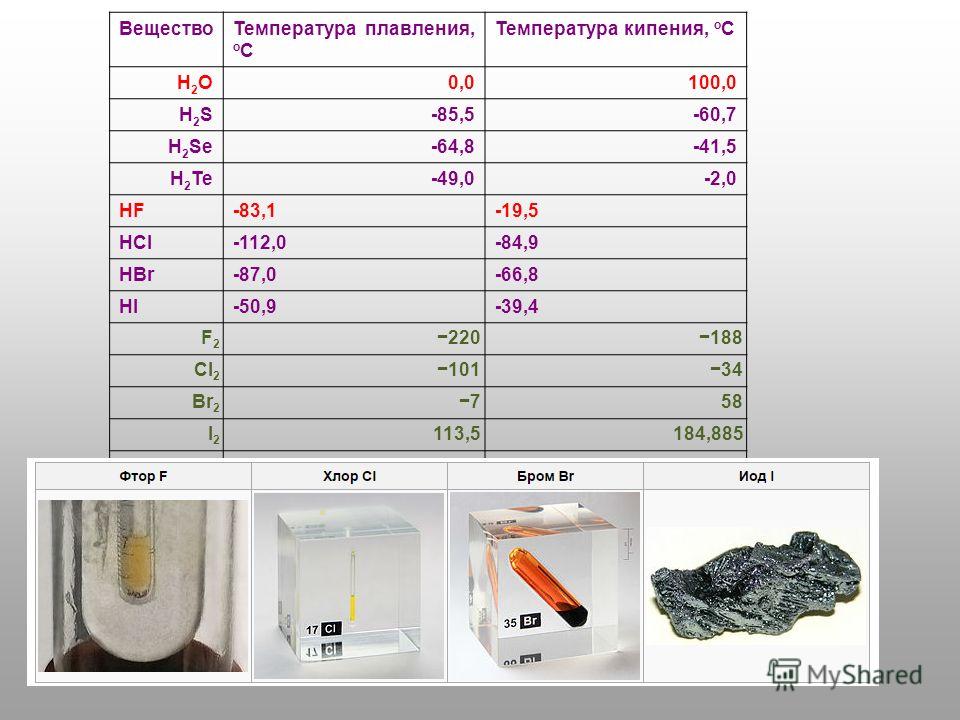 Эта чувствительность к структуре или форме является одной из причин того, что точки плавления широко используются для идентификации конкретных соединений.
Эта чувствительность к структуре или форме является одной из причин того, что точки плавления широко используются для идентификации конкретных соединений.
С другой стороны, точки кипения, по существу, отражают кинетическую энергию, необходимую для высвобождения молекулы из-под кооперативного притяжения жидкого состояния, чтобы она стала свободной и относительно независимой частицей в газообразном состоянии.Все атомы и молекулы имеют слабое притяжение друг к другу, известное как притяжение Ван-дер-Ваальса . Эта сила притяжения берет свое начало в электростатическом притяжении электронов одной молекулы или атома к ядрам другой и получила название лондонской дисперсионной силы .
Следующая анимация иллюстрирует, как близкое сближение двух атомов неона может нарушить распределение их электронов таким образом, что это вызовет дипольное притяжение. Индуцированные диполи являются временными, но их достаточно для сжижения неона при низкой температуре и высоком давлении.
В общем, более крупные молекулы имеют более высокие точки кипения, чем более мелкие молекулы того же типа, что указывает на то, что дисперсионные силы увеличиваются с увеличением массы, числа электронов, числа атомов или некоторой их комбинации. В следующей таблице перечислены температуры кипения ряда элементов и ковалентных соединений, состоящих из молекул, лишенных постоянного диполя. Количество электронов в каждом виде указано в первом столбце, а масса каждого дана в виде надстрочного числа перед формулой.
| # Электроны | Молекулы и температуры кипения ºC | |
|---|---|---|
| 10 | 20 Ne –246 ; 16 CH 4 –162 | |
| 18 | 40 Ar –186 ; 32 SiH 4 –112 ; 30 C 2 H 6 –89 ; 38 Ф 2 –187 | |
| 34-44 | 84 Кр –152 ; 58 С 4 Н 10 –0. 5 ; 72 (CH 3 ) 4 C 10 ; 71 Cl 2 –35 ; 88 CF 4 -130 5 ; 72 (CH 3 ) 4 C 10 ; 71 Cl 2 –35 ; 88 CF 4 -130 | -130|
| 66-76 | 114| 114 [(CH 3 ) 3 C] 2 106; 126 (CH 2 ) 9 174 ; 160 Бр 2 59 ; 154 CCl 4 77 ; 138 С 2 Ж 6 –78 | |
Две десятиэлектронные молекулы показаны в первом ряду.Неон тяжелее метана, но кипит на 84º ниже. Метан состоит из пяти атомов, и дополнительные ядра могут предоставить больше возможностей для индуцированного образования диполей по мере приближения других молекул. Легкость, с которой электроны молекулы, атома или иона вытесняются соседним зарядом, называется поляризуемостью , поэтому мы можем заключить, что метан поляризуется лучше, чем неон. Во второй строке перечислены четыре восемнадцатиэлектронные молекулы. Большинство их температур кипения выше, чем у десятиэлектронных соединений неона и метана, но фтор является исключением, его температура кипения на 25° ниже, чем у метана.Остальные примеры в таблице соответствуют корреляции температуры кипения с общим количеством электронов и числом ядер, но фторсодержащие молекулы остаются исключением.
Во второй строке перечислены четыре восемнадцатиэлектронные молекулы. Большинство их температур кипения выше, чем у десятиэлектронных соединений неона и метана, но фтор является исключением, его температура кипения на 25° ниже, чем у метана.Остальные примеры в таблице соответствуют корреляции температуры кипения с общим количеством электронов и числом ядер, но фторсодержащие молекулы остаются исключением.
Аномальное поведение фтора можно объяснить его очень высокой электроотрицательностью. Ядро фтора так сильно притягивает свои электроны, что они гораздо менее поляризуемы, чем электроны большинства других атомов.
Конечно, отношения точек кипения могут определяться даже более сильными силами притяжения, такими как электростатическое притяжение между противоположно заряженными ионами и между частичным разделением зарядов молекулярных диполей.Следовательно, молекулы, имеющие постоянный дипольный момент, должны иметь более высокие точки кипения, чем эквивалентные неполярные соединения, как показано в следующей таблице.
| # Электроны | Молекулы и температуры кипения ºC | |
|---|---|---|
| 14-18 | 30 C 2 6 H ; 28 H 2 C=CH 2 –104 ; 26 HC≡CH –84 ; 30 H 2 C=O –21 ; 27 HC≡N 26 ; 34 CH 3 -F –78 | |
| 22-26 | 42 CH 3 CH=CH 2 – ; 40 CH 3 C≡CH –23 ; 44 CH 3 CH=O 21 ; 41 CH 3 C≡N 81 ; 46 (СН 3 ) 2 О -24 ; 50.5 CH 3 -Cl –24 ; 52 CH 2 F 2 F 2 -52 | -52 |
| 39-44 | 58 (CH 3 ) 3 CH -12; 56 (СН 3 ) 2 С=СН 2 –7 ; 58 (CH 3 ) 2 C=O 56 ; 59 (CH 3 ) 3 N 3 ; 95 CH 3 -Br 45 ; 85 CH 2 Cl 2 40 ; 70 CHF 3 –84 |
В первом ряду соединений этан, этен и этин не имеют молекулярного диполя и служат полезными эталонами для производных с одинарной, двойной и тройной связью, у которых он есть. Формальдегид и цианистый водород ясно показывают усиленное межмолекулярное притяжение в результате постоянного диполя. Метилфторид является аномальным, как и большинство фторорганических соединений. Во втором и третьем рядах все соединения имеют постоянные диполи, но диполи, связанные с углеводородами (первые два соединения в каждом случае), очень малы. Большие молекулярные диполи возникают главным образом из-за связей с высокоэлектроотрицательными атомами (по отношению к углероду и водороду), особенно если они представляют собой двойные или тройные связи.Таким образом, альдегиды, кетоны и нитрилы, как правило, имеют более высокую температуру кипения, чем эквивалентные по размеру углеводороды и алкилгалогениды. Нетипичное поведение соединений фтора является неожиданным ввиду большой разницы электроотрицательностей между углеродом и фтором.
Формальдегид и цианистый водород ясно показывают усиленное межмолекулярное притяжение в результате постоянного диполя. Метилфторид является аномальным, как и большинство фторорганических соединений. Во втором и третьем рядах все соединения имеют постоянные диполи, но диполи, связанные с углеводородами (первые два соединения в каждом случае), очень малы. Большие молекулярные диполи возникают главным образом из-за связей с высокоэлектроотрицательными атомами (по отношению к углероду и водороду), особенно если они представляют собой двойные или тройные связи.Таким образом, альдегиды, кетоны и нитрилы, как правило, имеют более высокую температуру кипения, чем эквивалентные по размеру углеводороды и алкилгалогениды. Нетипичное поведение соединений фтора является неожиданным ввиду большой разницы электроотрицательностей между углеродом и фтором.
Водородное соединение
Большинство простых гидридов групп IV, V, VI и VII
элементы отображают ожидаемое повышение точки кипения с количеством
электроны и молекулярная масса, но гидриды наиболее
электроотрицательные элементы (азот, кислород и фтор) имеют
аномально высокие температуры кипения, изображенные ранее как
график, а также перечислены справа.
| Группа | Молекулы и температуры кипения ºC |
|---|---|
| VII | HF 19 ; HCl –85; HBr –67; HI –36 |
| VI | H 2 O 100 ; H 2 S –60 ; H 2 Se –41 ; H 2 Te –2 |
| V | NH 3 –33 ; PH 3 –88 ; AsH 3 –62 ; СбХ 3 –18 |
 взаимодействия относительно сильные, хотя и слабые (ок. 4
до 5 ккал на моль) по сравнению с большинством ковалентных связей.Таблица данных справа дает убедительные доказательства существования водородных связей.
В каждой строке первое указанное соединение имеет наименьшее общее количество
электронов и наименьшую массу, но его температура кипения является самой высокой из-за
к водородной связи. Другие соединения в каждом ряду имеют молекулярные
диполей, взаимодействие которых можно было бы назвать водородным
связь, но привлекательность явно намного слабее. Первые два
гидриды элементов IV группы, метана и силана, перечислены в
первой таблице выше, и не обнаруживают каких-либо значительных водородных связей.
взаимодействия относительно сильные, хотя и слабые (ок. 4
до 5 ккал на моль) по сравнению с большинством ковалентных связей.Таблица данных справа дает убедительные доказательства существования водородных связей.
В каждой строке первое указанное соединение имеет наименьшее общее количество
электронов и наименьшую массу, но его температура кипения является самой высокой из-за
к водородной связи. Другие соединения в каждом ряду имеют молекулярные
диполей, взаимодействие которых можно было бы назвать водородным
связь, но привлекательность явно намного слабее. Первые два
гидриды элементов IV группы, метана и силана, перечислены в
первой таблице выше, и не обнаруживают каких-либо значительных водородных связей.Органические соединения, содержащие связи O-H и NH, также проявляют усиленное межмолекулярное притяжение за счет водородных связей. Немного примеры приведены ниже.
| Класс | Молекулы и температуры кипения ºC | ||
|---|---|---|---|
| Кислород Соединения | C 2 H 5 OH; (CH 3 ) 2 O –24 ; (CH 2 ) 2 O 11 9161 2 O 11 Этанол Диметиловый эфир Этиленок оксид | (CH | (CH 3 ) 3 CHOH 124 & (CH 2 ) 4 O 66 | Cyclobutanol Tetrahydrofuran |
| азот Соединения | C 3 H 7 NH 2 50 ; C 2 H 5 NH(CH 3 ) 37 ; (CH 3 ) 3 N 3 пропилмин этилметила амин триметил амин | (CH 2 ) 4 ЧНЧ 2 107 & (CH 2 ) 4 NCH 3 80 Циклопентилмин N-метилпирролидин | |
| комплекс | C 2 H 5 CO 2 H 141161 2 C CO 2 CH 3 57 Пропаной кислоты метилацетат | C 3 H 7 H 7 CONH 2 218 & CH 3 CON (CH 3 CON (CH 3 ) 2 165 Butyramide N, N-диметилацетамид | |
Растворимость в воде
Вода — самая распространенная и важная жидкость на этой планете. При выделении и очистке соединений необходимо учитывать смешиваемость других жидкостей с водой и растворимость твердых веществ в воде. С этой целью в следующей таблице указана смешиваемость с водой (или растворимость) ряда низкомолекулярных органических соединений. Сразу бросается в глаза влияние важных атомов водородной связи, кислорода и азота. В первой строке перечислены несколько углеводородных и хлорсодержащих растворителей. Все они без исключения не смешиваются с водой, хотя интересно отметить, что π-электроны бензола и несвязывающие валентные электроны хлора слегка увеличивают их растворимость по сравнению с насыщенными углеводородами.По сравнению с углеводородами соединения кислорода и азота, перечисленные во втором, третьем и четвертом рядах, более чем в сто раз более растворимы в воде, а многие полностью смешиваются с водой.
При выделении и очистке соединений необходимо учитывать смешиваемость других жидкостей с водой и растворимость твердых веществ в воде. С этой целью в следующей таблице указана смешиваемость с водой (или растворимость) ряда низкомолекулярных органических соединений. Сразу бросается в глаза влияние важных атомов водородной связи, кислорода и азота. В первой строке перечислены несколько углеводородных и хлорсодержащих растворителей. Все они без исключения не смешиваются с водой, хотя интересно отметить, что π-электроны бензола и несвязывающие валентные электроны хлора слегка увеличивают их растворимость по сравнению с насыщенными углеводородами.По сравнению с углеводородами соединения кислорода и азота, перечисленные во втором, третьем и четвертом рядах, более чем в сто раз более растворимы в воде, а многие полностью смешиваются с водой.
| Тип соединения | Особые соединения | Грамм/100 мл | Моль/литр | Конкретные соединения | Грамм/100 мл | Моль/литр | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Углеводороды и Алкилгалогениды | бутан гексан циклогексан | 0. 007 007 0,0009 0,006 | 0,0012 0,0001 0,0007 | Benzene Метиленхлорид хлороформ | 0,07 | 0.07 | 0.07 | 0,009 0.180166 0,07 | Один кислород3 Один Oxygen | 9,0 в сборе 3,6 8,7 | 1,2 в сборе 0,36 0.90 | Этиловый эфир THF Furan Anisole 6.0 Complete 1.0 1.0 | 0,09 | Соединения , имеющих 2 Oycygens Два оксигенов 29166 1,3-пропандиол 2-бутановый кислота бензойная кислота | в сборе в сборе в сборе в сборе | в сборе в сборе в сборе в сборе | 1,2-диметоксиэтан 1,4-диоксан этилацетат γ-бутиролактон | полный полный 8.  0 0 Complete Complete Complete 0,91 Комплекс 9191 9 | |||
| азот , содержащий , содержащие соединения | 6 1-аминобутан циклогексиламин анилин пирролидин Pyrrole | в сборе в сборе 3,4 в сборе 6,0 | в сборе в сборе 0,37 в сборе 0,9 | триэтиламин пиридин пропионитрил 1-нитропропан ДМФ | 5.5 в сборе 10,3 1,5 в сборе | 0,54 в сборе 2,0 0,17 в сборе |
Из приведенных выше данных следует отметить некоторые общие тенденции. Во-первых, спирты (вторая строка, левая колонка) обычно более растворимы, чем простые эфиры того же размера (вторая строка, правая колонка). Это отражает тот факт, что гидроксильная группа может действовать как донор и акцептор водородной связи; тогда как эфирный кислород может служить только акцептором. Повышенная растворимость фенола по сравнению с циклогексанолом может быть связана с его большей кислотностью, а также с пи-электронным эффектом, отмеченным в первой строке.
Повышенная растворимость фенола по сравнению с циклогексанолом может быть связана с его большей кислотностью, а также с пи-электронным эффектом, отмеченным в первой строке.
Циклический эфир ТГФ (тетрагидрофуран) более растворим, чем его аналог с открытой цепью, возможно, потому, что атом кислорода более доступен для водородных связей с молекулами воды. Из-за пониженной основности кислорода в фуране ароматического соединения он гораздо менее растворим. Атом кислорода в анизоле также дезактивируется сопряжением с бензольным кольцом (заметим, что он активирует кольцо в реакциях электрофильного замещения).
Второй атом кислорода резко увеличивает растворимость в воде, что демонстрируют соединения, перечисленные в третьем ряду.Снова гидроксильные соединения перечислены слева.
Азот оказывает солюбилизирующее действие, аналогичное кислороду, как показано соединениями в четвертом ряду. Первичные и вторичные амины, перечисленные в левой колонке, могут действовать как доноры и акцепторы водородных связей. Ароматичность снижает основность пиррола, но увеличивает его кислотность. Соединения в правом столбце способны выполнять только роль акцептора. Низкая растворимость нитросоединения удивительна.
Ароматичность снижает основность пиррола, но увеличивает его кислотность. Соединения в правом столбце способны выполнять только роль акцептора. Низкая растворимость нитросоединения удивительна.
Эта страница является собственностью Уильяма Ройша.
Комментарии, вопросы и ошибки должны
отправить по адресу [email protected].
Эти страницы предоставлены IOCD для оказания помощи в наращивании потенциала в области химического образования. 05.05.2013
Конец этой дополнительной темы
3 тенденции, влияющие на температуру кипения — Мастер органической химии
Уже доступно — Загрузите этот замечательный (бесплатный) 3-страничный раздаточный материал о том, как решать распространенные проблемы с температурой кипения.С 10 примерами решенных задач! (Также содержит все ключевые моменты, обсуждаемые в этом посте)
MOC_Boiling_Point_Handout (PDF)
Выяснение порядка точек кипения — это понимание тенденций . Ключевым моментом здесь является то, что точки кипения отражают силу сил между молекулами. Чем больше они слипаются, тем больше энергии потребуется, чтобы выбросить их в атмосферу в виде газов.
Ключевым моментом здесь является то, что точки кипения отражают силу сил между молекулами. Чем больше они слипаются, тем больше энергии потребуется, чтобы выбросить их в атмосферу в виде газов.
Необходимо учитывать 3 важные тенденции.
- Относительная сила четырех межмолекулярных сил: ионные > водородные связи > диполь-диполь > дисперсионные силы Ван-дер-Ваальса. Влияние каждой из этих сил притяжения будет зависеть от присутствующих функциональных групп.
- Температура кипения увеличивается с увеличением количества атомов углерода.
- Разветвление снижает температуру кипения.
Давайте посмотрим поближе:.
Содержание
- Тенденция №1: Относительная сила четырех межмолекулярных сил или их отсутствие) по температурам плавления и кипения
1.Тенденция № 1: относительная сила четырех межмолекулярных сил.
Сравните различные производные бутанового спирта, показанные ниже. Молекулы диэтилового эфира C4h20O удерживаются вместе за счет диполь-дипольных взаимодействий, возникающих за счет поляризованных связей С-О. Сравните его температуру кипения (35°С) с температурой его изомера бутанола (117°С). Значительно повышенная температура кипения обусловлена тем, что бутанол содержит гидроксильную группу, способную образовывать водородные связи. Тем не менее, силы притяжения в бутаноле бледнеют по сравнению с силами притяжения соли бутоксида натрия, который плавит при чрезвычайно высокой температуре (значительно выше 260 °C) и фактически разлагается, прежде чем он может превратиться в жидкость.
Молекулы диэтилового эфира C4h20O удерживаются вместе за счет диполь-дипольных взаимодействий, возникающих за счет поляризованных связей С-О. Сравните его температуру кипения (35°С) с температурой его изомера бутанола (117°С). Значительно повышенная температура кипения обусловлена тем, что бутанол содержит гидроксильную группу, способную образовывать водородные связи. Тем не менее, силы притяжения в бутаноле бледнеют по сравнению с силами притяжения соли бутоксида натрия, который плавит при чрезвычайно высокой температуре (значительно выше 260 °C) и фактически разлагается, прежде чем он может превратиться в жидкость.
Тогда подумайте о бутане C4h20, который не содержит полярных функциональных групп. Единственными силами притяжения между отдельными молекулами бутана являются относительно слабые дисперсионные силы Ван-дер-Ваальса. В результате бутан кипит при температуре замерзания воды (0°С), что намного ниже даже температуры диэтилового эфира.
Мораль истории : среди молекул с примерно одинаковыми молекулярными массами точки кипения будут определяться присутствующими функциональными группами.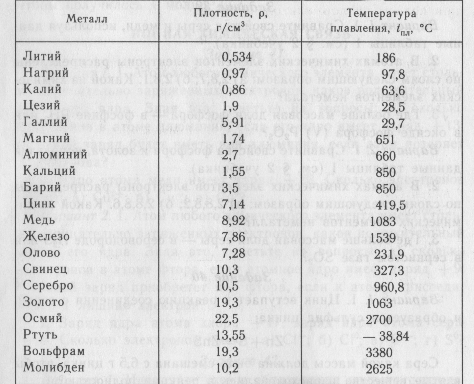
Вы могли бы рассказать аналогичную историю для подобных изомеров амина и карбоновой кислоты, показанных ниже.
Предыдущее обсуждение четырех межмолекулярных сил см. здесь. Ссылку в учебнике Ройша см. здесь.
2. Тенденция №2 – Для молекул с данной функциональной группой температура кипения увеличивается с увеличением молекулярной массы.Посмотрите на резкий рост температуры кипения при увеличении молекулярной массы во всех этих рядах:
Вот вопрос: Как, , межмолекулярные силы увеличиваются при увеличении молекулярной массы?
Основная сила, действующая здесь, — это дисперсионные силы Ван-дер-Ваальса, которые пропорциональны площади поверхности .Поэтому, увеличивая длину цепи, вы также увеличиваете площадь поверхности, а это означает, что вы увеличиваете способность отдельных молекул притягиваться друг к другу.
На интуитивном уровне вы можете сравнить эти длинные молекулы с нитями спагетти: чем длиннее лапша, тем больше усилий требуется, чтобы разорвать ее на части. По мере увеличения длины цепи будут области, в которых они могут очень хорошо выстраиваться рядом друг с другом.
По мере увеличения длины цепи будут области, в которых они могут очень хорошо выстраиваться рядом друг с другом.
По отдельности каждое взаимодействие может не иметь большого значения, но когда вы суммируете их все по длине цепи, дисперсионные силы Ван-дер-Ваальса могут оказывать огромное влияние.
3. Роль симметрии (или ее отсутствия) в температурах плавления и кипенияЭто еще один побочный продукт зависимости дисперсионных сил Ван-дер-Ваальса от площади поверхности – чем более стержнеподобны молекулы, тем лучше. в состоянии они будут выстроиться в линию и связи. Возьмем еще один интуитивный пример с макаронами. Что лучше слипается: спагетти или макароны? Чем более сфероподобна молекула, тем меньше будет площадь ее поверхности и тем меньше будет действовать межмолекулярных ван-дер-ваальсовых взаимодействий.Сравните температуры кипения пентана (36°С) и 2,2-диметилпропана (9°С).
Это также может относиться к молекулам с водородными связями, таким как спирты — сравните, например, точки кипения 1-пентанола с 2-пентанол и 3-пентанол.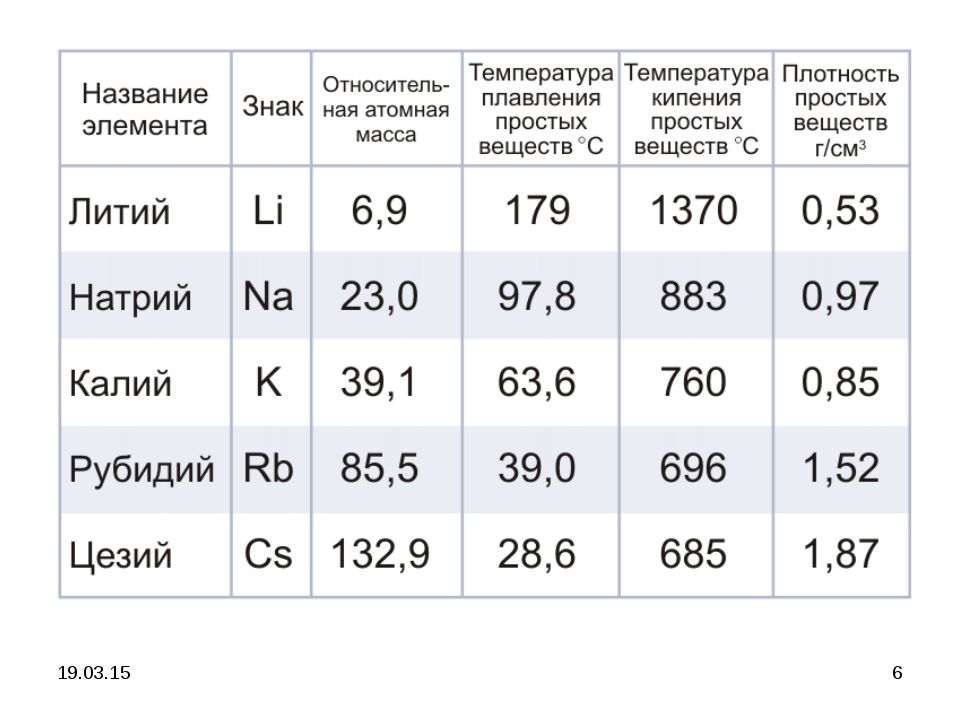 Гидроксильная группа 1-пентанола более «открыта», чем в 3-пентаноле (который окружен двумя объемистыми алкильными группами), поэтому она будет лучше способна образовывать водородные связи со своими собратьями.
Гидроксильная группа 1-пентанола более «открыта», чем в 3-пентаноле (который окружен двумя объемистыми алкильными группами), поэтому она будет лучше способна образовывать водородные связи со своими собратьями.
Таким образом, есть три основных фактора, о которых вам следует подумать, сталкиваясь с вопросом о точках кипения.1) какие межмолекулярные силы будут присутствовать в молекулах? 2) как соотносятся молекулярные массы? 3) как соотносятся симметрии?
Последний быстрый вопрос на дороге (ответ см. в комментариях).
П.С. Новинка! Ознакомьтесь с этим бесплатным 3-страничным раздаточным материалом по решению распространенных задач на экзаменах по температуре кипения!
MOC_Boiling_Point_Handout (PDF)
Замораживание и кипячение
Замораживание и кипячениеПовышение температуры кипения/точка замерзания Депрессия
Снижение давления паров вещества имеет очевидный эффект
по температуре кипения; температура кипения повышается. АД повышается, потому что
требуется больше энергии, чтобы давление паров растворителя достигло
внешнее давление.
АД повышается, потому что
требуется больше энергии, чтобы давление паров растворителя достигло
внешнее давление.
Логика/рисунок, который использовался для объяснения давления паров понижение может быть использовано для объяснения изменения температуры кипения. Там меньше молекул растворителя на поверхности способны к испарению, поэтому давление пара падает. Таким образом, температура кипения должно быть увеличено.
Другим последствием пониженного давления пара является снижение Точка замерзания.Это тоже можно объяснить картинкой.
Вместо изучения границы пар-жидкость мы посмотрите на границу раздела твердое тело-жидкость.
При нормальной температуре плавления твердого вещества определяется для материалов ниже 1 банкомат давления как температуры, при которой твердое тело находится в равновесие с жидкостью.
При температуре замерзания скорость плавления твердого вещества равна
до скорости замерзания жидкости A . Если растворенное вещество
введенная скорость, при которой твердое тело плавится, не меняется, а
поскольку рядом с твердым телом находится меньше молекул жидкости, скорость при
которых жидкость замерзает каплями—( B ) три молекулы плавятся и
замерзает только одно — равновесия больше нет, и твердое тело
тает. Для восстановления равновесия скорость, с которой твердое тело
расплавы должны быть снижены; т. е. температура должна быть снижена.
Для восстановления равновесия скорость, с которой твердое тело
расплавы должны быть снижены; т. е. температура должна быть снижена.
Изменение как точки замерзания, так и точки кипения прямо пропорциональна количеству вещества, растворенного в решение
Это;| и |
Поскольку K является положительным как для повышения точки кипения, так и для депрессия точки замерзания на повышение АД и для понижения точки замерзания необходимо рассчитывать по-другому.
Простой способ запомнить это состоит в том, что для депрессии замерзания — это величина точки замерзания депрессивное (или пониженное) и для повышения точки кипения — это величина, на которую температура кипения повышенный (или приподнятый). Если вы помните направление, то имеете дело с знаки легкие.
Важно отметить, что K b и K f являются
константы для данного материала, но варьируются от материала к
материал.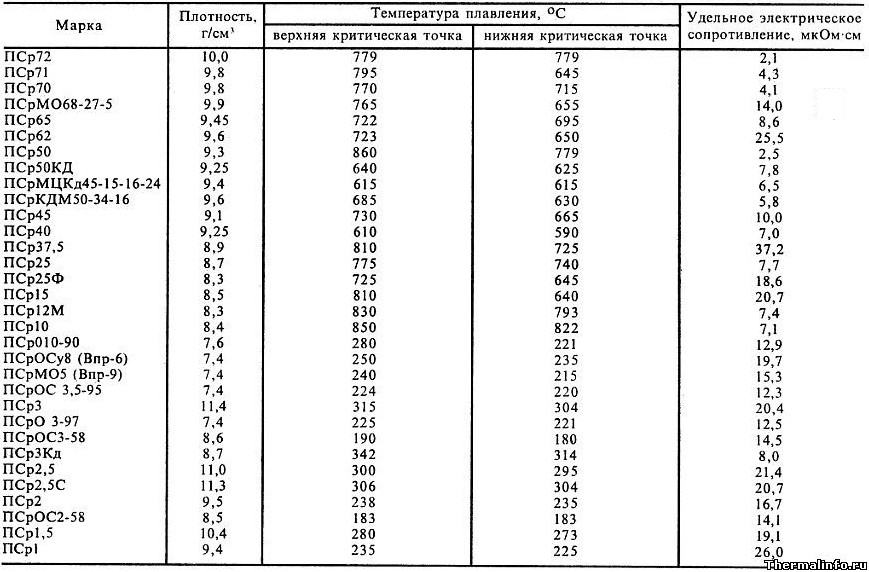

 Железные щипцы либо лопатка.
Железные щипцы либо лопатка.

 В ней описывается, как эта тенденция проявляется в структурах и физических свойствах элементов, и, наконец, делается не совсем удачная попытка объяснить эту тенденцию.
В ней описывается, как эта тенденция проявляется в структурах и физических свойствах элементов, и, наконец, делается не совсем удачная попытка объяснить эту тенденцию. На диаграмме показана небольшая часть этой структуры.
На диаграмме показана небольшая часть этой структуры.
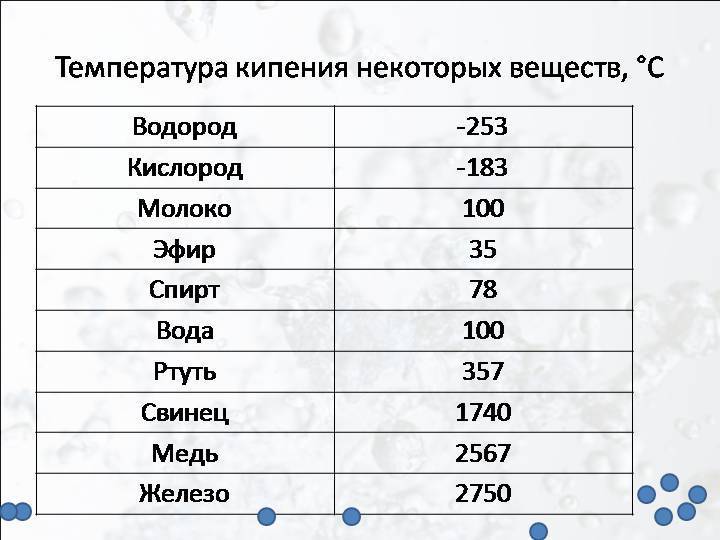
 Молекулярные орбитали в этой полосе удерживают электроны, образующие нормальную ковалентную (или металлическую) связь.
Молекулярные орбитали в этой полосе удерживают электроны, образующие нормальную ковалентную (или металлическую) связь.
 Это означает, что этот атом будет стремиться потерять пару электронов по направлению к чему-то еще, к чему он присоединен. Таким образом, интересующий нас атом будет стремиться нести либо частичный положительный заряд, либо образовывать положительный ион.
Это означает, что этот атом будет стремиться потерять пару электронов по направлению к чему-то еще, к чему он присоединен. Таким образом, интересующий нас атом будет стремиться нести либо частичный положительный заряд, либо образовывать положительный ион. Предполагая, что значения электроотрицательности верны, я совершенно не понимаю этого!
Предполагая, что значения электроотрицательности верны, я совершенно не понимаю этого!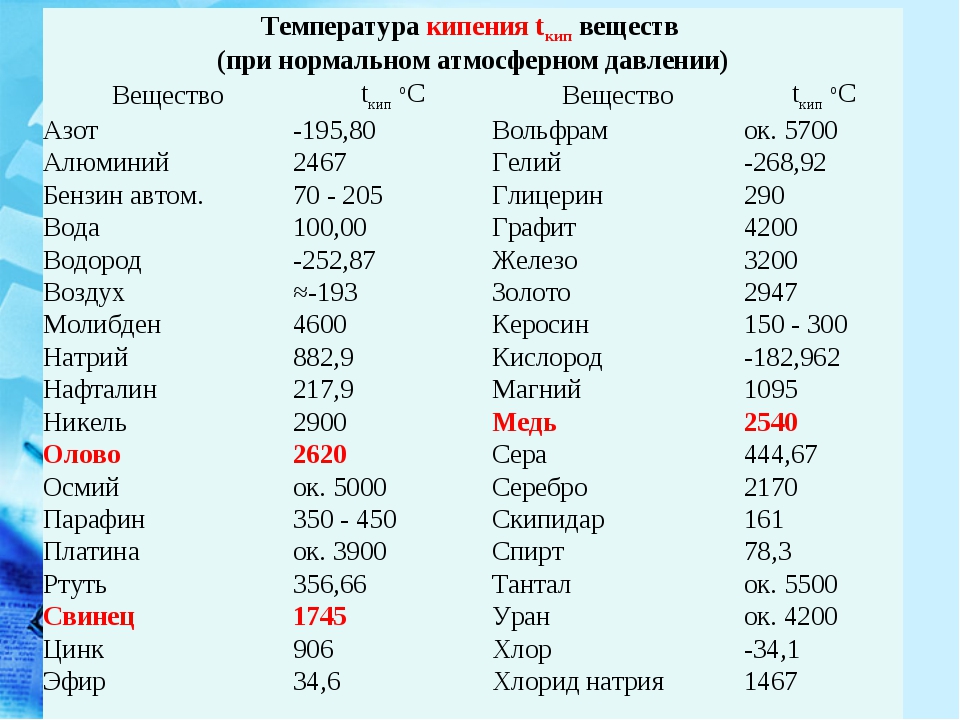
 Все значения даны в кДж моль -1 .
Все значения даны в кДж моль -1 . Опять же, все значения даны в кДж моль 90 104 -1 90 105 .
Опять же, все значения даны в кДж моль 90 104 -1 90 105 .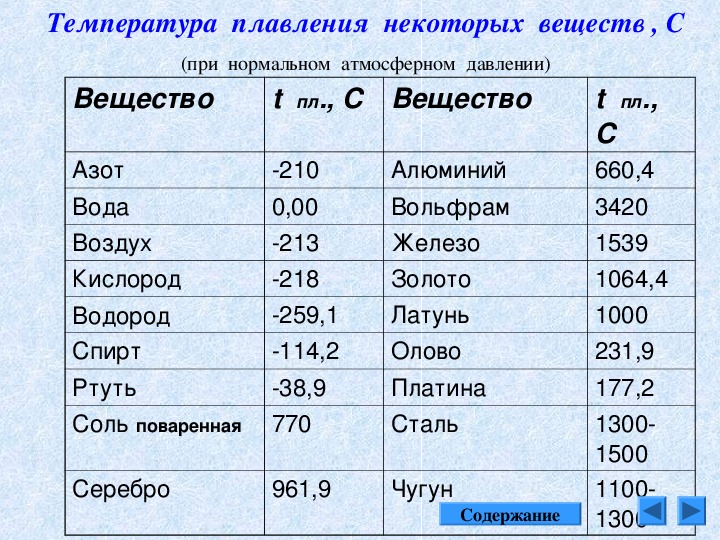
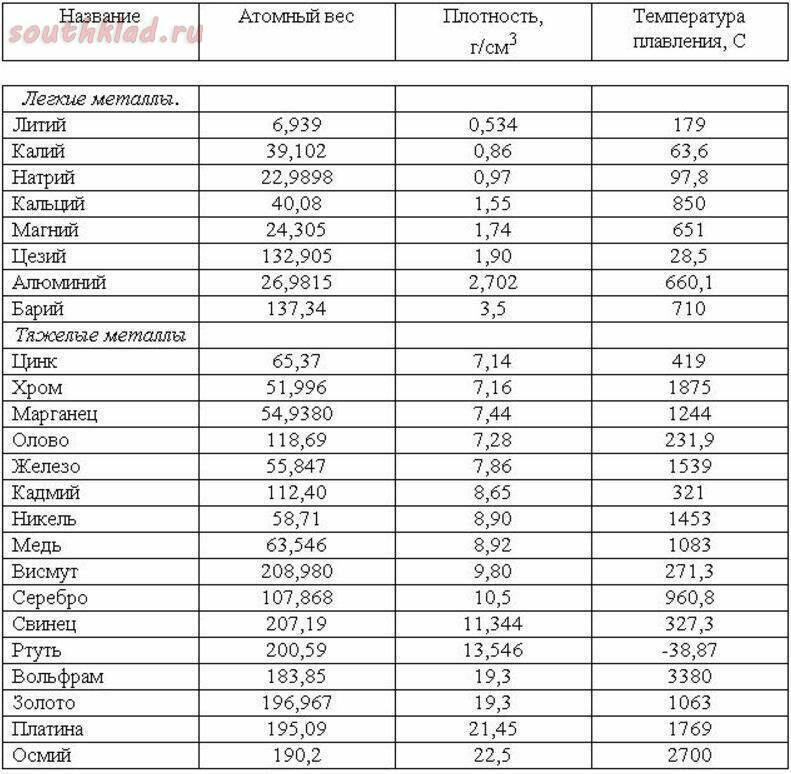

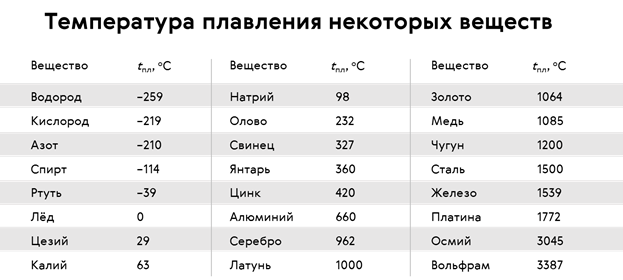
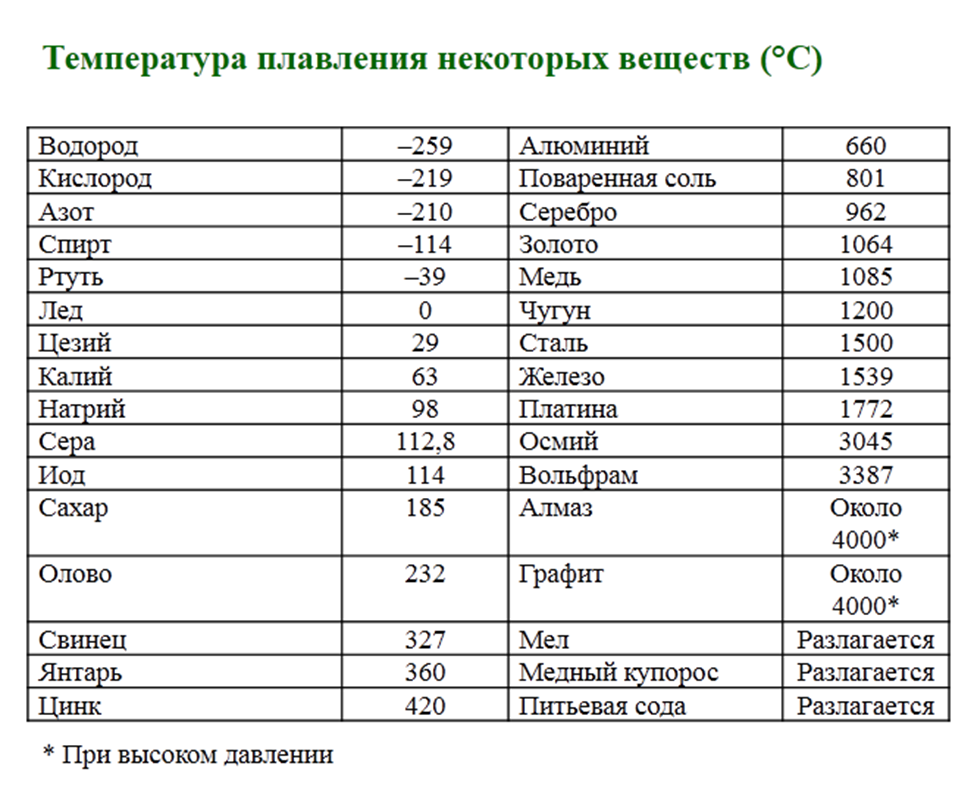 д., а также воздействие на беременных женщин. женщин вызывать беспокойство, в частности, так как это может вызвать угрозу для здоровья и роста эмбрионов.
д., а также воздействие на беременных женщин. женщин вызывать беспокойство, в частности, так как это может вызвать угрозу для здоровья и роста эмбрионов. أ ب «Узнайте о свинце», www.epa.gov, дата обращения 18 декабря 2018 г. Отредактировано.
أ ب «Узнайте о свинце», www.epa.gov, дата обращения 18 декабря 2018 г. Отредактировано. При нагревании чистого кристаллического соединения или охлаждении жидкости изменение температуры образца во времени примерно однородно.Однако, если твердое тело плавится или жидкость замерзает, возникает разрыв, и температура образца остается постоянной до тех пор, пока не завершится фазовый переход. Это поведение показано на диаграмме справа, где зеленый сегмент представляет твердую фазу, светло-синий — жидкость, а красный — температурно-инвариантное равновесие жидкость/твердое тело. Для данного соединения эта температура представляет его точку плавления (или точку замерзания) и является воспроизводимой константой до тех пор, пока внешнее давление не меняется.Длина горизонтальной части зависит от размера образца, поскольку количество тепла, пропорциональное теплоте плавления, должно быть добавлено (или удалено) до завершения фазового перехода.
При нагревании чистого кристаллического соединения или охлаждении жидкости изменение температуры образца во времени примерно однородно.Однако, если твердое тело плавится или жидкость замерзает, возникает разрыв, и температура образца остается постоянной до тех пор, пока не завершится фазовый переход. Это поведение показано на диаграмме справа, где зеленый сегмент представляет твердую фазу, светло-синий — жидкость, а красный — температурно-инвариантное равновесие жидкость/твердое тело. Для данного соединения эта температура представляет его точку плавления (или точку замерзания) и является воспроизводимой константой до тех пор, пока внешнее давление не меняется.Длина горизонтальной части зависит от размера образца, поскольку количество тепла, пропорциональное теплоте плавления, должно быть добавлено (или удалено) до завершения фазового перехода. Это обеспечивает полезные средства для установления идентичности или неидентичности двух или более соединений, поскольку точки плавления многих твердых органических соединений задокументированы и обычно используются в качестве критерия чистоты.
Это обеспечивает полезные средства для установления идентичности или неидентичности двух или более соединений, поскольку точки плавления многих твердых органических соединений задокументированы и обычно используются в качестве критерия чистоты.  В некоторых редких случаях из неполярных соединений сходного размера и кристаллической структуры образуется не конгломерат, а настоящий твердый раствор одного в другом.Плавление или замерзание происходит в широком диапазоне температур, и истинной точки эвтектики не существует.
В некоторых редких случаях из неполярных соединений сходного размера и кристаллической структуры образуется не конгломерат, а настоящий твердый раствор одного в другом.Плавление или замерзание происходит в широком диапазоне температур, и истинной точки эвтектики не существует. Как показано, молекулярные комплексы такого типа обычно имеют стехиометрию 50:50, но известны и другие интегральные соотношения.
Как показано, молекулярные комплексы такого типа обычно имеют стехиометрию 50:50, но известны и другие интегральные соотношения.  Были идентифицированы три полиморфа. Межмолекулярные водородные связи являются важной особенностью всего этого. Цвета кристаллов варьируются от ярко-красного до фиолетового.
Были идентифицированы три полиморфа. Межмолекулярные водородные связи являются важной особенностью всего этого. Цвета кристаллов варьируются от ярко-красного до фиолетового. Со временем или когда он сбрасывается после размягчения, на нем могут появиться белые пятна, он больше не тает во рту и не имеет такого хорошего вкуса, как должен. Это связано с тем, что шоколад имеет более шести полиморфов, и только один из них идеален в качестве кондитерского изделия. Он создается в тщательно контролируемых заводских условиях. Неправильные условия хранения или транспортировки приводят к превращению шоколада в другие полиморфы.
Со временем или когда он сбрасывается после размягчения, на нем могут появиться белые пятна, он больше не тает во рту и не имеет такого хорошего вкуса, как должен. Это связано с тем, что шоколад имеет более шести полиморфов, и только один из них идеален в качестве кондитерского изделия. Он создается в тщательно контролируемых заводских условиях. Неправильные условия хранения или транспортировки приводят к превращению шоколада в другие полиморфы. 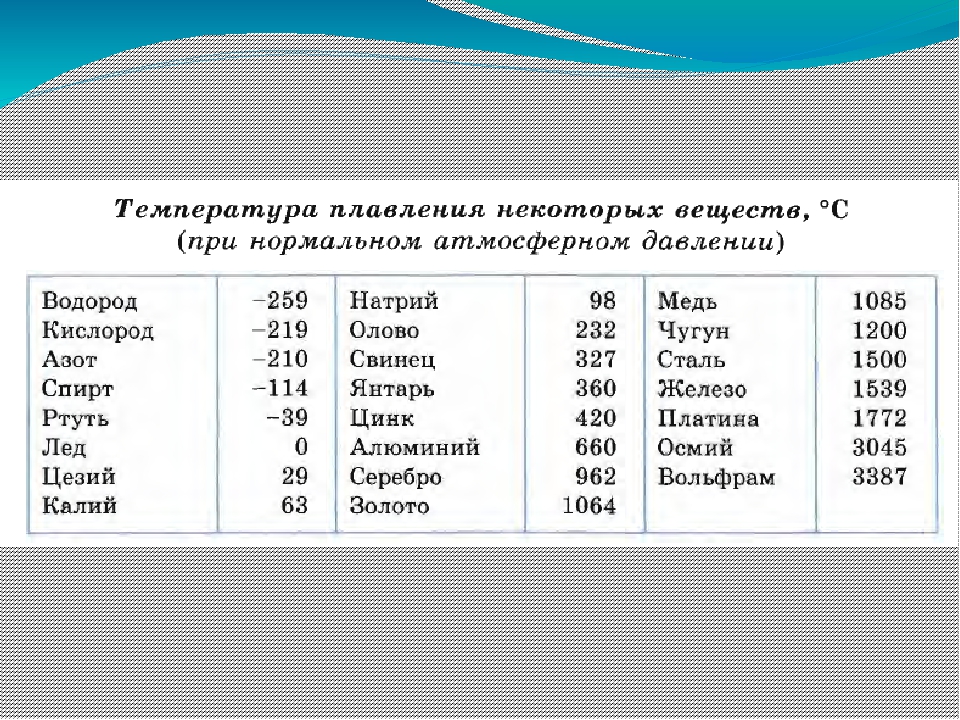 К сожалению, форма VI с более высокой температурой плавления более стабильна и образуется с течением времени.
К сожалению, форма VI с более высокой температурой плавления более стабильна и образуется с течением времени.