Титан температура кипения — Справочник химика 21
Таким образом, механизм дуги можно представить себе следующим. Из катода в результате высокой степени его разогрева (термоэлектронная эмиссия) или наличия около его поверхности больших напряженностей электрического поля (10 —10 в см — автоэлектронная эмиссия) вырывается поток электронов. Первый случай имеет место для материалов катода с высокой температурой плавления и испарения металла (уголь, графит, вольфрам, молибден), благодаря чему температура на их поверхности может достигать в катодных пятнах значений 2 500—3 000° С и выше, когда начинается заметная термоэлектронная эмиссия. Второй случай соответствует материалам с низкой температурой кипения и испарения (ртуть, титан, медь). В области катодного падения поток электронов разгоняется настолько, что за ее пределами происходит интенсивная ионизация частиц газа в дуговом промежутке, причем здесь, по-видимому, весьма существенна роль ступенчатой ионизации.
Как уже указывалось, все исследователи изучали растворимость хлоридов в четыреххлористом титане лишь до температур 120— 130°С, так как при этих условиях температура начала кристаллизации хлоридов близка к температуре кипения растворов.
 [c.156]
[c.156]Плотность титана 4,54 г/сж , температура плавления 1668° С, температура кипения около 3260° С. По внешнему виду титан похож на сталь. Титан имеет переменную валентность, но основная валентность его равна 4. На воздухе при нормальной температуре компактный титан устойчив. При нагревании выше 400° С он окисляется и растворяет азот и водород, отчего становится хрупким. Хрупкость металлу придают также примеси. [c.326]
Титан, цирконий и гафний наиболее заметно различаются по плотности, температуре плавления и температуре кипения. Кроме того, у гафния высокое эффективное поперечное сечение поглощения тепловых нейтронов, равное 105 барн у циркония оно 0,18 0,02 барн. [c.212]
Коррозионная стойкость. В растворах азотной кислоты титан стоек к коррозии как при комнатной температуре, так и прн температуре кипения [31, 32]. Титан широко используется для изготовления реакторов, теплообменников и другого оборудования, применяемого в производстве азотной кислоты (до 70%) прн температурах до 315 С [32].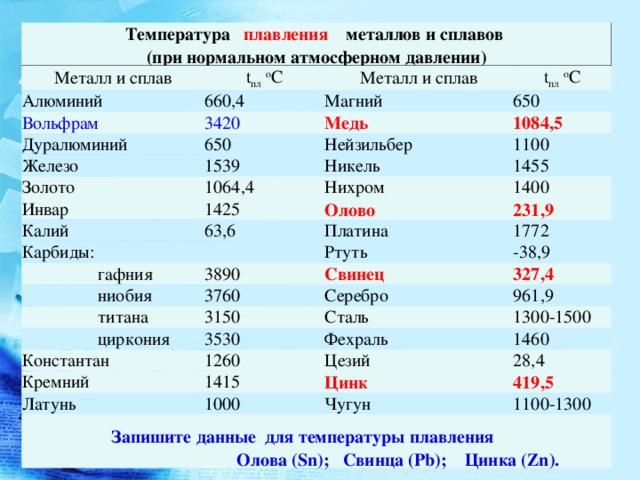
Уксуснокислые щелочи количественно осаждают при температуре кипения титан в виде метатитановой кислоты [c.593]
Титан Р-р 10 100 144 0,002 2 температуры кипения. в [c.816]
Четыреххлористый титан при кипении, а его пары и при более высокой температуре не разлагаются лишь при —2000° С наблюдается некоторое выделение хлора [8]. [c.61]
Наряду с титаном цирконий представляет для современной техники большой интерес. Благодаря совершенной коррозионной стойкости в горячей воде и в водяном паре он нашел широкое применение в атомной энергетике. Цирконий стоек при действии растворов щелочей (независимо от концентрации и температуры), расплавленной щелочи, азотной и соляной кислот (независимо от концентрации и температуры), серной кислоты (при концентрации ниже 70% до температуры кипения), фосфорной. кислоты (при концентрации ниже 55% до температуры кипения), кипящих муравьиной, уксусной и молочной кислот, морской воды. [c.108]
кислоты (при концентрации ниже 55% до температуры кипения), кипящих муравьиной, уксусной и молочной кислот, морской воды. [c.108]
Технический титан ВТ-1 выдерживает действие 90%-ной кипящей смеси низших жирных кислот С]—С4, содержащей 36 и 46% муравьиной кислоты. При повышении температуры выше температуры кипения скорость коррозии титана в этой смеси снижается. В 90%-ной смеси жирных кислот С)—С4, содержащей 46% муравьиной кислоты, при 150 и 180° скорость коррозии ВТ-1 превышает 1 мм/год. Действие смесей низших жирных кислот С]—С4, содержащих меньше 36% муравьиной кислоты, при 150 С титан выдерживает.
С кислородом титан образует следующие оксиды ТЮг — амфо-терный оксид (температура плавления 2128 К, температура кипения 3200 К, при 3200 К разлагается с образованием Т1зОб) Т1з05 — плавится при 2450 К и кипит при 3600 К Т120з — плавится при 2400 К и кипит при 3300 К ТЮ — плавится при 2010 К. Все эти оксиды об- [c.210]
Все эти оксиды об- [c.210]
Получение и свойства титановой кислоты. Перекисные соединения титана. Получение четыреххлористого титана. Определение температуры кипения четыреххлористого титана. Восстановление солей титанила цинком. [c.64]
Для галогенидов четырех исследованных металлов было достигнуто хорошее разделение на сквалане при 200°. Особый интерес представляет разделение ниобия и тантала ввиду большой близости температур кипения их галоидных соединений. Возможно, что разделение НЬ и Та будет еще лучшим при 150°, хотя при меньших температурах только хлорид ниобия проходит через колонку за приемлемый промежуток времени. Олово и титан могут быть легко отделены друг от друга как на окта-декане, так и на сквалане при любой из применявшихся температур. Интересно отметить, что время удерживания хлорида олова(IV), по-видимому, не слишком сильно зависит от природы неподвижной фазы. Это согласуется с отстутствием специфического взаимодействия данного вещества с неподвижной фазой [2]. Более того, значения скрытых теплот испарения, рассчитанные из температурной зависимости удельных объемов удерживания, достаточно близки к значениям теплот, вычисленным из величин давлений паров [7], как это видно из табл. 5.
Более того, значения скрытых теплот испарения, рассчитанные из температурной зависимости удельных объемов удерживания, достаточно близки к значениям теплот, вычисленным из величин давлений паров [7], как это видно из табл. 5.
При замене воздуха на благородные газы гелий и аргон условия возбуждения и характер спектров сильно меняются. В атмосфере аргона и гелия температура разряда достигает 10 000—20 000 К-Вследствие этого линии атомов металлов излучаются периферическими участками дуги в центральной высокотемпературной части разряда атомы почти полностью ионизированы. Наиболее низкая температура электродов устанавливается в атмосфере аргона. Это замедляет скорость испарения элементов и усиливает фракционирование. В аргоне за обычное время (3—5 мин) удается полностью испарить лишь наиболее летучие элементы (мышьяк, кадмий, цинк). Элементы с более высокими температурами кипения (Приложение 1), например алюминий и титан, испаряются лишь частично, а ниобий, тантал и цирконий практически не поступают в разряд.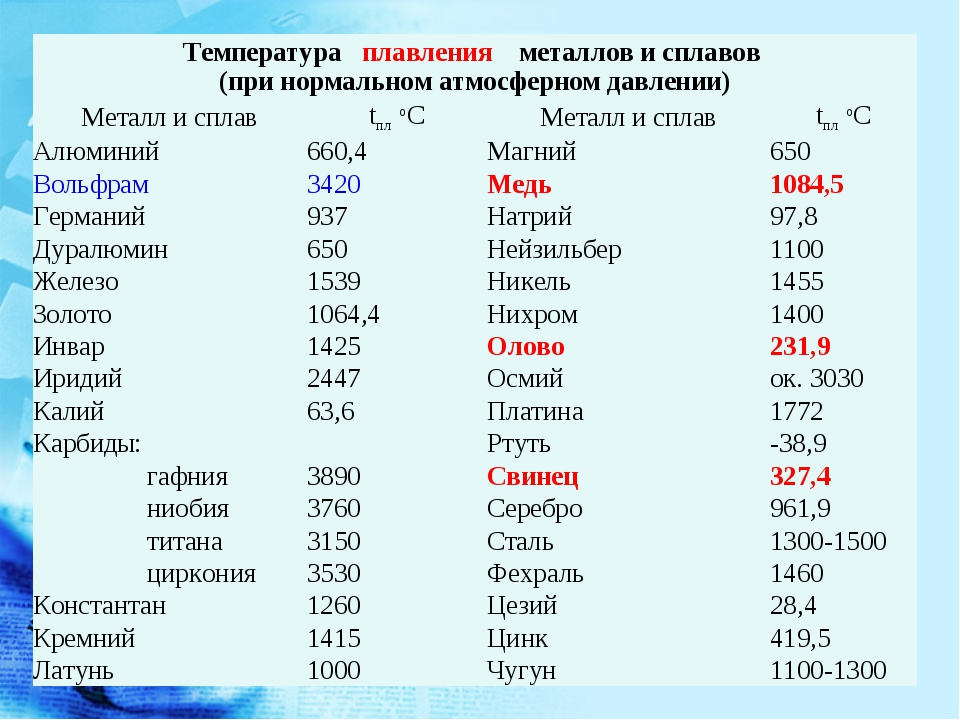
В муравьиной кислоте всех концентраций при температуре до 100°С в условиях воздушной аэрации титан достаточно устойчив. При температуре кипения в муравьиной кислоте концентрации 25% и выше без аэрации титан подвергается сильной коррозии [172]. [c.64]
В концентрированных растворах уксусной кислоты, содержащих уксусный ангидрид, титан подвержен не только довольно значительной общей коррозии, но также и локальному разрушению с образованием питтингов. Для поддержания титана в пассивном состоянии необходимо, чтобы содержание воды в растворе уксусной кислоты при температуре кипения составляло около 0,06% [176]. [c.66]
Заслуживает внимания реализованный на одном из заводов цветной металлургии метод жидкостной абсорбции хлора из анодного газа четыреххлористым титаном. По сравнению с другими абсорбентами ТЮЦ обладает такими преимуществами, как высокая температура кипения, термостабильность, отсутствие коррозионного воздействия на углеродистую и нержавеющие стали.
Как установил Н. Д. Томашов, введение в титан катодных добавок, таких как палладий, платина, рутений, рений и др., приводит к резкому уменьшению скорости коррозии в растворах серной, соляной и фосфорной кислот. Так, например, при содержании 0,2% Р(1 скорость коррозии титана в 5%-ном растворе НгЗО при температуре кипения уменьшается в 50 раз. [c.142]
Каталитическая макрополимеризация изобутилена. Полимеризация изобутилена при температурах ниже —70° С в присутствии катализаторов Фриделя-Крафтса, таких как хлористый алюминий, фтористый бор и четыреххлористый титан, приводит к образованию высокомолекулярных полимеров, обладающих эластическими свойствами [63]. Внесение, например, фтористого бора в жидкий изобутилен при —80° С вызывает мгновенную, почти взрывную реакцию в противоположность этому полимеризация при температуре кипения изобутилена (—6° С) требует индукционного периода и продуктом такой полимеризации являются лшдкие масла.
Цирконий близок к титану по химическим свойствам. Однако цирконий значительно дороже титана и менее пластичен (технологичен), поэтому его коррозионная стойкость важна в тех случаях, когда можно использовать и другие его свойства (например, в атомной энергетике). Цирконий имеет хорошую стойкость в восстановительных средах (коррозионностоек в соляной кислоте любых концентраций при комнатной температуре, а до 20%-ной концентрации — также и при температуре кипения), однако в окислительных средах цирконий стоек лишь в присутствии ионов хлора.
Полимеры простых виниловых эфиров. Процесс полимеризации простых виниловых афиров протекает при температуре, близкой к температуре кипения взятого эфира. В качестве катализатора используют раствор хлорного железа в бутиловом спирте. Могут применяться н катализаторы типа Фриделя-Крафтса хлористый алюминий, хлористый титан, фтористый бор и др. Реакция ироте- [c.285]
Могут применяться н катализаторы типа Фриделя-Крафтса хлористый алюминий, хлористый титан, фтористый бор и др. Реакция ироте- [c.285]
Покрыть колбу асбестом и поместить на электрический колбо-нагреватель. Определить температуру кипения четыреххлористого титана. Перегнать четыреххлористый титан в пробирку с перетяжкой, охлаждаемую сухим льдом , и запаять пробирку. [c.194]
Результаты коррозионных испытаний исследуемых сплавов в растворах серной кислоты различных концентраций при комнатной температуре приведены в табл.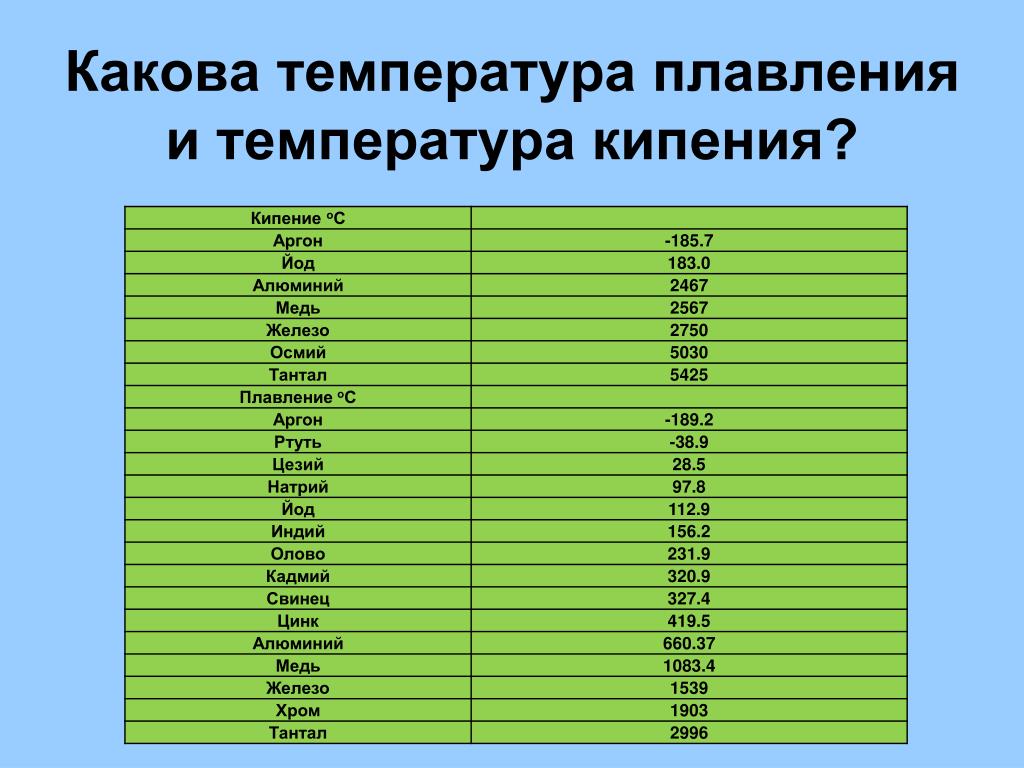 1, а для разбавленных растворов при температуре кипения — на фиг. 2. Испытания показали, что легирование титана палладием даже в небольших количествах (0,1%) значительно повышает коррозионную стойкость титана. Например, при испытаниях Б 40% Н2504 при температуре 18° стойкость сплава титана с 0,1 % Рс1 в 5 раз больше стойкости нелегированного титана. При испытании в кипящем растворе 10 о-ной НгЗОд устойчивость сплава почти в 35 раз выше, чем нелегированного титана. Сплав, содержащий 2% Рс1, значительно более устойчив, чем сплав Т1 — 0,1 -о Рс1 и тем более, чем нелегированный титан. В кипящем растворе 10%-ной НгЗО сплав Т — 2% РЛ в 156 раз более устойчив, чем титан. Повышение количества палладия в сплаве до 5″о незначительно увеличивает коррозионную стойкость титана по сравнению со сплавом, содержащим 2 l палладия. При температуре 18° титан, легированный 0,И о Рс1, оказывается усто1 1-чивым в серной кислоте до 20 a, сплав с 2 и РЛ до 60 и. а сплав с 5 о Р(1 до 80% ПзЗО . [c.176]
1, а для разбавленных растворов при температуре кипения — на фиг. 2. Испытания показали, что легирование титана палладием даже в небольших количествах (0,1%) значительно повышает коррозионную стойкость титана. Например, при испытаниях Б 40% Н2504 при температуре 18° стойкость сплава титана с 0,1 % Рс1 в 5 раз больше стойкости нелегированного титана. При испытании в кипящем растворе 10 о-ной НгЗОд устойчивость сплава почти в 35 раз выше, чем нелегированного титана. Сплав, содержащий 2% Рс1, значительно более устойчив, чем сплав Т1 — 0,1 -о Рс1 и тем более, чем нелегированный титан. В кипящем растворе 10%-ной НгЗО сплав Т — 2% РЛ в 156 раз более устойчив, чем титан. Повышение количества палладия в сплаве до 5″о незначительно увеличивает коррозионную стойкость титана по сравнению со сплавом, содержащим 2 l палладия. При температуре 18° титан, легированный 0,И о Рс1, оказывается усто1 1-чивым в серной кислоте до 20 a, сплав с 2 и РЛ до 60 и. а сплав с 5 о Р(1 до 80% ПзЗО . [c.176]
В горячей (100° или при температуре кипения) 10—15 %-ной соляной кислоте более или менее стойкими являются никельмолибденовые сплавы типа хастеллой А и В, а также бронзы алюминиевые [5], чугун кремнемолибденовый [6], кремнистые стали [7]. Тантал совершенно стоек в концентрированной кислоте при температуре 110°, ниобий в этих условиях корродирует со скоростью 0,01 г м -час и приобретает хрупкость [8]. Титан в 5%-ной НС1 при кипении корродирует со скоростью 15,24 мм/год [51. Двухнормальная соляная кислота разрушает инертную пленку TIO2 даже в присутствии кислорода в кислоте [9]. Если ввести в кипящую 10%-ную НС1 ионы меди или хрома в количестве 0,02—0,03 моля, то коррозию титана можно понизить примерно в 100 раз [10]. [c.256]
Тантал совершенно стоек в концентрированной кислоте при температуре 110°, ниобий в этих условиях корродирует со скоростью 0,01 г м -час и приобретает хрупкость [8]. Титан в 5%-ной НС1 при кипении корродирует со скоростью 15,24 мм/год [51. Двухнормальная соляная кислота разрушает инертную пленку TIO2 даже в присутствии кислорода в кислоте [9]. Если ввести в кипящую 10%-ную НС1 ионы меди или хрома в количестве 0,02—0,03 моля, то коррозию титана можно понизить примерно в 100 раз [10]. [c.256]
При комнатной температуре стойкость титана против коррозии в 5—10%-ном растворе серной кислоты можно считать высокой (скорость коррозии не превышает 0,025 мм год). Однако уже незначительное новышение температуры усиливает коррозию даже в 1 %-ном растворе серной кислоты. Скорость коррозии нри комнатной температуре в фосфорной кислоте невелика, если концентрация ее не превышает30%. Титан обладает особенно высокой стойкостью в азотной кислоте. При температуре кипения титан устойчив в кислоте 6 концентрацией до 65%.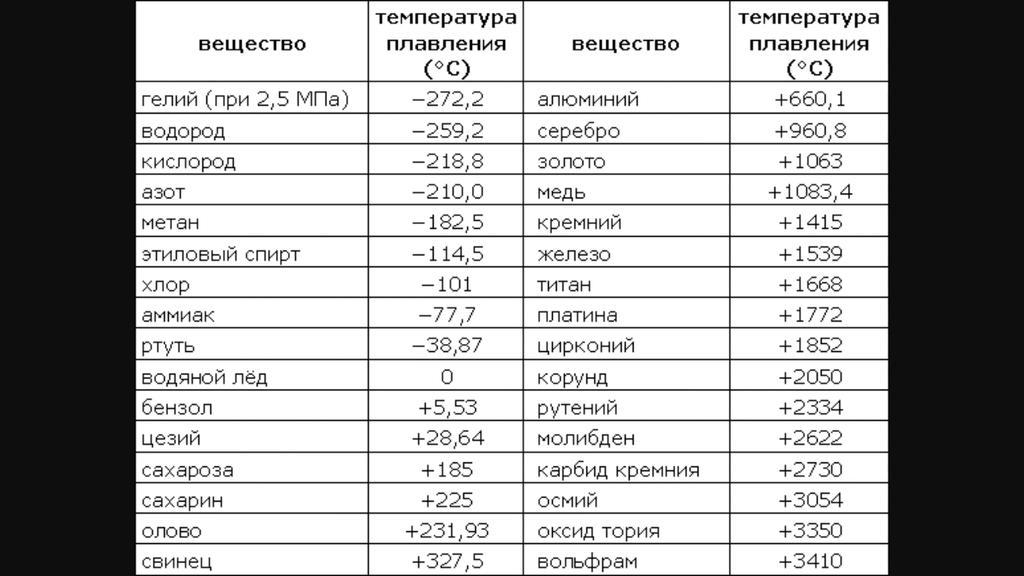 Белая дымящая кислота любой концентрации не действует на титан ни при каких температурах. В царской водке титан совершенно устойчив при комнатной температуре. Хрощовая и сернистая кислоты не оказывают коррозионного воздей- ствия на титан. [c.226]
Белая дымящая кислота любой концентрации не действует на титан ни при каких температурах. В царской водке титан совершенно устойчив при комнатной температуре. Хрощовая и сернистая кислоты не оказывают коррозионного воздей- ствия на титан. [c.226]
Муассан (1905—1906) показал, что в надлежащем жаре электрических печей (доп. 228) обычные металлы, включая в их число Аи, Pt и ее аналоги, Fe и др., ве только плавятся, но и прямо кипят и довольно скоро перегоняются, только титан хотя улетучивается, яо плавится с трудом, т.-е., вероятно, для него температура кипения близка к температуре плавлевня. В парах, он, конечно, соединяется отчасти с азотом воздуха. Поэтому должно ясно видеть, что металлы относительно плавления и летучести ведут себя совершенно точяо так же, как и другие вещества. [c.659]
После охлаждения реакционной трубки до комнатной температуры ее помещают в вертикальном полон ении в короткий сосуд Дьюара с сухим льдом и переносят в бокс, осушенный пятиокисью фосфора. После того как четыреххлористый углерод затвердеет, трубку вынимают из сосуда Дьюара, надрезают ее прибли.чительно посредине напильником или ножом для резки стекла и разламывают пополам. Часть трубки, содержащую продукты реакции, вновь помещают в сухой лед. Отмеряют 1 мл (берется с избытком) гексафторацетилацетона, выливают его в трубку, содержащую затвердевший хлорид металла, вынимают трубку из сухого льда и нагревают ее, держа рукой в резиновой перчатке. После того как четыреххлористый углерод расплавится, начинается реакция и появляются пузырьки хлористого водорода. Скорость их появления определяется температурой. (Четыреххлористый титан очень хорошо растворим в четыреххлористом углероде, и этот раствор весьма бурно реагирует с гексафторацетилацетоном. В связи с этим реагент следует добавлять к раствору тетрахлорида титана в четыреххлористом углероде по каплям.) Конец реакции определяется по прекращению выделения пузырьков хлористого водорода. Охлаждение трубки с содержимым и нагревание до температуры кипения с обратным холодильником позволяют удалить хлористый водород, что способствует полному хелированию некоторых металлов.
После того как четыреххлористый углерод затвердеет, трубку вынимают из сосуда Дьюара, надрезают ее прибли.чительно посредине напильником или ножом для резки стекла и разламывают пополам. Часть трубки, содержащую продукты реакции, вновь помещают в сухой лед. Отмеряют 1 мл (берется с избытком) гексафторацетилацетона, выливают его в трубку, содержащую затвердевший хлорид металла, вынимают трубку из сухого льда и нагревают ее, держа рукой в резиновой перчатке. После того как четыреххлористый углерод расплавится, начинается реакция и появляются пузырьки хлористого водорода. Скорость их появления определяется температурой. (Четыреххлористый титан очень хорошо растворим в четыреххлористом углероде, и этот раствор весьма бурно реагирует с гексафторацетилацетоном. В связи с этим реагент следует добавлять к раствору тетрахлорида титана в четыреххлористом углероде по каплям.) Конец реакции определяется по прекращению выделения пузырьков хлористого водорода. Охлаждение трубки с содержимым и нагревание до температуры кипения с обратным холодильником позволяют удалить хлористый водород, что способствует полному хелированию некоторых металлов.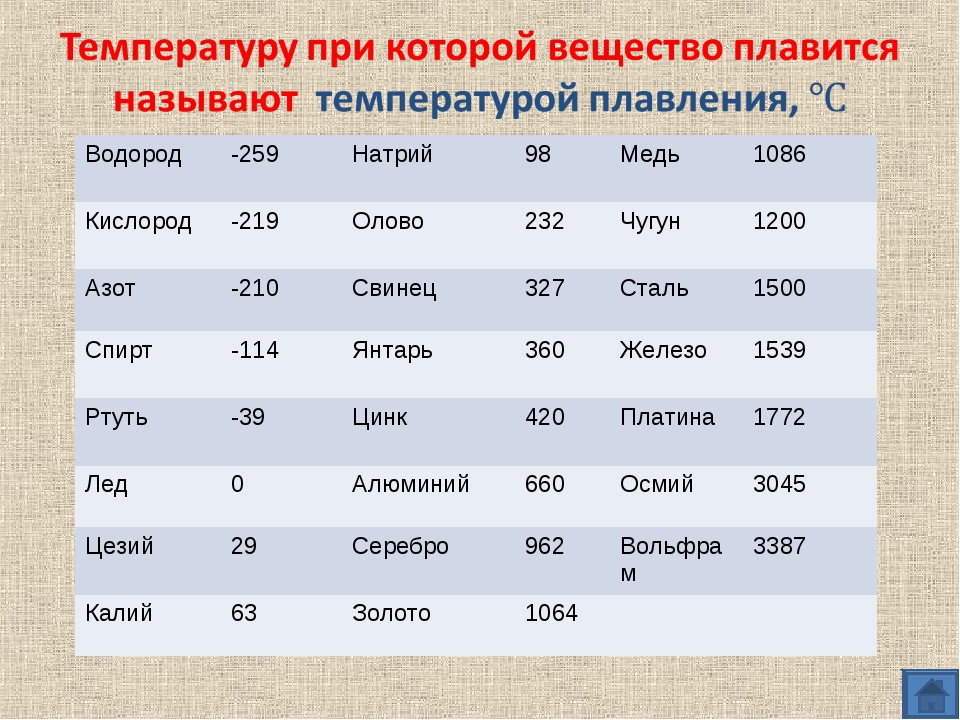 Нанример, при комнатной температуре образуется монохелат ниобия, а при температуре кинения наблюдается медленное превращение в трижды хелированное соединение. Твердый остаток или помутнение обусловлены либо примесями, либо неполным превращением окисла металла. Раствор выливают в сухой калиброванный сосуд емкостью 2 мл ж смывают находящиеся на стенках капли четыреххлористым углеродом с помощью маленькой груши, соединенной с гибким капилляром. Подходящая груша и трубка придаются к хроматографическому дозатору [46]. Трубку промывают не менее пяти раз небольшими порциями четыреххлористого углерода, причем эти растворы добавляются к основному раствору. Раствор разбавляют до требуемого объема, добавляя четыреххлористый углерод, и перемешивают. Растворы, содержащие чувствительные к влаге соединения, можно, поместить в ампулы впредь до использования для хроматографического анализа. Операция требует от получаса до одного часа. [c.118]
Нанример, при комнатной температуре образуется монохелат ниобия, а при температуре кинения наблюдается медленное превращение в трижды хелированное соединение. Твердый остаток или помутнение обусловлены либо примесями, либо неполным превращением окисла металла. Раствор выливают в сухой калиброванный сосуд емкостью 2 мл ж смывают находящиеся на стенках капли четыреххлористым углеродом с помощью маленькой груши, соединенной с гибким капилляром. Подходящая груша и трубка придаются к хроматографическому дозатору [46]. Трубку промывают не менее пяти раз небольшими порциями четыреххлористого углерода, причем эти растворы добавляются к основному раствору. Раствор разбавляют до требуемого объема, добавляя четыреххлористый углерод, и перемешивают. Растворы, содержащие чувствительные к влаге соединения, можно, поместить в ампулы впредь до использования для хроматографического анализа. Операция требует от получаса до одного часа. [c.118]
Если обработать высушенную ТЮг ЛгНгО концентрированной серной кислотой при температуре кипения и высушить затвердевшую массу при 350—400°, то образуется сульфат титанила Т10804 [c. 191]
191]
Следующая операция (в одинаковой мере важная и трудоемкая) — очистка Т1Си от примесей — проводится разными способами и веществами. Четыреххлористый титан в обычных условиях представляет собой жидкость с температурой кипения 136° С. [c.328]
Титан, находящийся в активном состоянии, пассивируется при контакте с нержавеющей сталью в следующих средах 10%-ной H i, 10- и 17,5%-ной h3SO4, 10%-ной (С00Н)2 при комнатной температуре, а также 1%-ной НС1, 1%-ной h3SO4 и 0,5%-ной (СООН)г при температуре кипения [465], [c.182]
Титан
Титан — химический элемент с атомным номером 22. Принадлежит к 4-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к побочной подгруппе IV группы, или к группе IVB), находится в четвёртом периоде таблицы. Атомная масса элемента 47,867(1) а. е. м. Обозначается символом Ti. Простое вещество титан — лёгкий прочный металл серебристо-белого цвета. Обладает высокой коррозионной стойкостью.
Обладает высокой коррозионной стойкостью.
История
Открытие диоксида титана (TiO2) сделали практически одновременно и независимо друг от друга англичанин У. Грегор и немецкий химик М. Г. Клапрот. У. Грегор, исследуя состав магнитного железистого песка (Крид, Корнуолл, Англия, 1791), выделил новую «землю» (оксид) неизвестного металла, которую назвал менакеновой. В 1795 году немецкий химик Клапрот открыл в минерале рутиле новый элемент и назвал его титаном. Спустя два года Клапрот установил, что рутил и менакеновая земля — оксиды одного и того же элемента, за которым и осталось название «титан», предложенное Клапротом. Через 10 лет открытие титана состоялось в третий раз: французский учёный Л. Воклен обнаружил титан в анатазе и доказал, что рутил и анатаз — идентичные оксиды титана.
Первый образец металлического титана получил в 1825 году швед Й. Я. Берцелиус. Из-за высокой химической активности титана и сложности его очистки чистый образец Ti получили голландцы А. ван Аркел и И. де Бур в 1925 году термическим разложением паров иодида титана TiI4.
ван Аркел и И. де Бур в 1925 году термическим разложением паров иодида титана TiI4.
Титан не находил промышленного применения, пока люксембуржец Г. Кролл в 1940 году не запатентовал простой магниетермический метод восстановления металлического титана из тетрахлорида; этот метод процесс Кролла до настоящего времени остаётся одним из основных в промышленном получении титана.
Происхождение названия
Металл получил своё название в честь титанов, персонажей древнегреческой мифологии, детей Геи. Название элементу дал Мартин Клапрот в соответствии со своими взглядами на химическую номенклатуру в противовес французской химической школе, где элемент старались называть по его химическим свойствам. Поскольку немецкий исследователь сам отметил невозможность определения свойств нового элемента только по его оксиду, он подобрал для него имя из мифологии, по аналогии с открытым им ранее ураном.
Нахождение в природе
Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре — 0,57 % по массе, в морской воде — 0,001 мг/л. В ультраосновных породах 300 г/т, в основных — 9 кг/т, в кислых 2,3 кг/т, в глинах и сланцах 4,5 кг/т. В земной коре титан почти всегда четырёхвалентен и присутствует только в кислородных соединениях. В свободном виде не встречается. Титан в условиях выветривания и осаждения имеет геохимическое сродство с Al2O3. Он концентрируется в бокситах коры выветривания и в морских глинистых осадках. Перенос титана осуществляется в виде механических обломков минералов и в виде коллоидов. До 30 % TiO2 по весу накапливается в некоторых глинах. Минералы титана устойчивы к выветриванию и образуют крупные концентрации в россыпях. Известно более 100 минералов, содержащих титан. Важнейшие из них: рутил TiO2, ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит CaTiO3, титанит (сфен) CaTiSiO5. Различают коренные руды титана — ильменит-титаномагнетитовые и россыпные — рутил-ильменит-цирконовые.
Содержание в земной коре — 0,57 % по массе, в морской воде — 0,001 мг/л. В ультраосновных породах 300 г/т, в основных — 9 кг/т, в кислых 2,3 кг/т, в глинах и сланцах 4,5 кг/т. В земной коре титан почти всегда четырёхвалентен и присутствует только в кислородных соединениях. В свободном виде не встречается. Титан в условиях выветривания и осаждения имеет геохимическое сродство с Al2O3. Он концентрируется в бокситах коры выветривания и в морских глинистых осадках. Перенос титана осуществляется в виде механических обломков минералов и в виде коллоидов. До 30 % TiO2 по весу накапливается в некоторых глинах. Минералы титана устойчивы к выветриванию и образуют крупные концентрации в россыпях. Известно более 100 минералов, содержащих титан. Важнейшие из них: рутил TiO2, ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит CaTiO3, титанит (сфен) CaTiSiO5. Различают коренные руды титана — ильменит-титаномагнетитовые и россыпные — рутил-ильменит-цирконовые.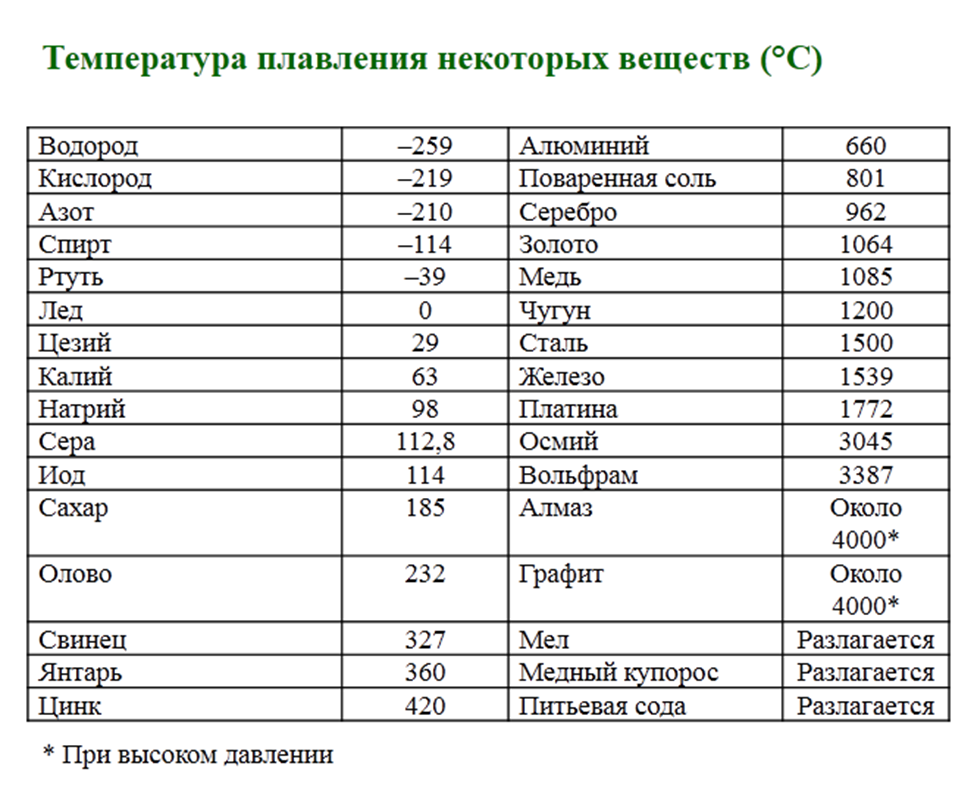
Месторождения
Крупные коренные месторождения титана находятся на территории ЮАР, России, Украины, Канады, США, Китая, Норвегии, Швеции, Египта, Австралии, Индии, Южной Кореи, Казахстана; россыпные месторождения имеются в Бразилии, Индии, США, Сьерра-Леоне, Австралии. В странах СНГ ведущее место по разведанным запасам титановых руд занимает РФ (58,5 %) и Украина (40,2 %). Крупнейшее месторождение в России — Ярегское.
Запасы и добыча
Основные руды: ильменит (FeTiO3), рутил (TiO2), титанит (CaTiSiO5).
По данным на 2002 год, 90 % добываемого титана использовалось на производство диоксида титана TiO2. Мировое производство диоксида титана составляло 4,5 млн т. в год. Подтверждённые запасы диоксида титана (без России) составляют около 800 млн т. На 2006 год, по оценке Геологической службы США, в пересчёте на диоксид титана и без учёта России, запасы ильменитовых руд составляют 603—673 млн т., а рутиловых — 49,7—52,7 млн т.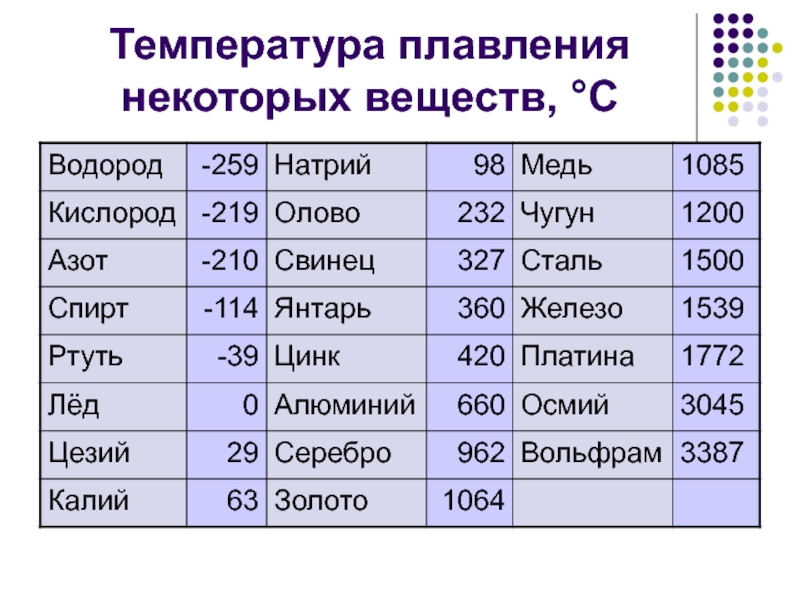 Таким образом, при нынешних темпах добычи мировых разведанных запасов титана (без учёта России) хватит более чем на 150 лет.
Таким образом, при нынешних темпах добычи мировых разведанных запасов титана (без учёта России) хватит более чем на 150 лет.
Россия обладает вторыми в мире, после Китая, запасами титана. Минерально-сырьевую базу титана России составляют 20 месторождений (из них 11 коренных и 9 россыпных), достаточно равномерно рассредоточенных по территории страны. Самое крупное из разведанных месторождений (Ярегское) находится в 25 км от города Ухта (Республика Коми). Запасы месторождения оцениваются в 2 миллиарда тонн руды со средним содержанием диоксида титана около 10 %.
Крупнейший в мире производитель титана — российская компания «ВСМПО-АВИСМА».
Получение
Брусок кристаллического титана (чистота 99,995 %, вес ≈283 г, длина ≈14 см, диаметр ≈25 мм), изготовленный на заводе «Уралредмет» иодидным методом ван Аркеля и де БураКак правило, исходным материалом для производства титана и его соединений служит диоксид титана со сравнительно небольшим количеством примесей. В частности, это может быть рутиловый концентрат, получаемый при обогащении титановых руд.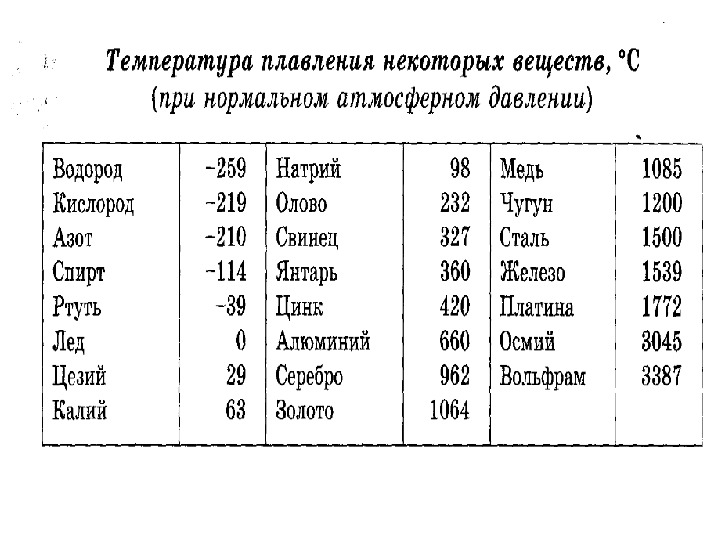 Однако запасы рутила в мире весьма ограничены, и чаще применяют так называемый синтетический рутил или титановый шлак, получаемые при переработке ильменитовых концентратов. Для получения титанового шлака ильменитовый концентрат восстанавливают в электродуговой печи, при этом железо отделяется в металлическую фазу (чугун), а невосстановленные оксиды титана и примесей образуют шлаковую фазу. Богатый шлак перерабатывают хлоридным или сернокислотным способом.
Однако запасы рутила в мире весьма ограничены, и чаще применяют так называемый синтетический рутил или титановый шлак, получаемые при переработке ильменитовых концентратов. Для получения титанового шлака ильменитовый концентрат восстанавливают в электродуговой печи, при этом железо отделяется в металлическую фазу (чугун), а невосстановленные оксиды титана и примесей образуют шлаковую фазу. Богатый шлак перерабатывают хлоридным или сернокислотным способом.
Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4:
- TiO2 + 2C + 2Cl2 → TiCl4 + 2CO
Образующиеся пары TiCl4 при 850 °C восстанавливают магнием:
- TiCl4 + 2Mg → 2MgCl2 + Ti
Кроме этого, в настоящее время начинает получать популярность так называемый процесс FFC Cambridge, названный по именам его разработчиков Дерека Фрэя, Тома Фартинга и Джорджа Чена из Кембриджского университета, где он был создан. Этот электрохимический процесс позволяет осуществлять прямое непрерывное восстановление титана из оксида в расплаве смеси хлорида кальция и негашёной извести (оксида кальция). В этом процессе используется электролитическая ванна, наполненная смесью хлорида кальция и извести, с графитовым расходуемым (либо нейтральным) анодом и катодом, изготовленным из подлежащего восстановлению оксида. При пропускании через ванну тока температура быстро достигает ~1000—1100 °C, и расплав оксида кальция разлагается на аноде на кислород и металлический кальций:
Этот электрохимический процесс позволяет осуществлять прямое непрерывное восстановление титана из оксида в расплаве смеси хлорида кальция и негашёной извести (оксида кальция). В этом процессе используется электролитическая ванна, наполненная смесью хлорида кальция и извести, с графитовым расходуемым (либо нейтральным) анодом и катодом, изготовленным из подлежащего восстановлению оксида. При пропускании через ванну тока температура быстро достигает ~1000—1100 °C, и расплав оксида кальция разлагается на аноде на кислород и металлический кальций:
- 2CaO → 2Ca + O2
Полученный кислород окисляет анод (в случае использования графита), а кальций мигрирует в расплаве к катоду, где и восстанавливает титан из его оксида:
- O2 + C → CO2
- TiO2 + 2Ca → Ti + 2CaO
Образующийся оксид кальция вновь диссоциирует на кислород и металлический кальций, и процесс повторяется вплоть до полного преобразования катода в титановую губку либо исчерпания оксида кальция. Хлорид кальция в данном процессе используется как электролит для придания электропроводности расплаву и подвижности активным ионам кальция и кислорода. При использовании инертного анода (например, диоксида олова), вместо углекислого газа на аноде выделяется молекулярный кислород, что меньше загрязняет окружающую среду, однако процесс в таком случае становится менее стабильным, и, кроме того, в некоторых условиях более энергетически выгодным становится разложение хлорида, а не оксида кальция, что приводит к высвобождению молекулярного хлора.
Хлорид кальция в данном процессе используется как электролит для придания электропроводности расплаву и подвижности активным ионам кальция и кислорода. При использовании инертного анода (например, диоксида олова), вместо углекислого газа на аноде выделяется молекулярный кислород, что меньше загрязняет окружающую среду, однако процесс в таком случае становится менее стабильным, и, кроме того, в некоторых условиях более энергетически выгодным становится разложение хлорида, а не оксида кальция, что приводит к высвобождению молекулярного хлора.
Полученную титановую «губку» переплавляют и очищают. Рафинируют титан йодидным способом или электролизом, выделяя Ti из TiCl4. Для получения титановых слитков применяют дуговую, электронно-лучевую или плазменную переработку.
Физические свойства
Титан — лёгкий серебристо-белый металл. При нормальном давлении существует в двух кристаллических модификациях: низкотемпературный α-Ti с гексагональной плотноупакованной решёткой (гексагональная сингония, пространственная группа C6mmc, параметры ячейки a = 0,2953 нм, c = 0,4729 нм, Z = 2) и высокотемпературный β-Ti с кубической объёмно-центрированной упаковкой (кубическая сингония, пространственная группа Im3m, параметры ячейки a = 0,3269 нм, Z = 2), температура перехода α↔β 883 °C, теплота перехода ΔH=3,8 кДж/моль (87,4 кДж/кг). Большинство металлов при растворении в титане стабилизируют β-фазу и снижают температуру перехода α↔β. При давлении выше 9 ГПа и температуре выше 900 °C титан переходит в гексагональную фазу (ω-Ti). Плотность α-Ti и β-Ti соответственно равна 4,505 г/см³ (при 20 °C) и 4,32 г/см³ (при 900 °C). Атомная плотность α-титана 5,67⋅1022 ат/см³.
Большинство металлов при растворении в титане стабилизируют β-фазу и снижают температуру перехода α↔β. При давлении выше 9 ГПа и температуре выше 900 °C титан переходит в гексагональную фазу (ω-Ti). Плотность α-Ti и β-Ti соответственно равна 4,505 г/см³ (при 20 °C) и 4,32 г/см³ (при 900 °C). Атомная плотность α-титана 5,67⋅1022 ат/см³.
Температура плавления титана при нормальном давлении равна 1670 ± 2 °C, или 1943 ± 2 К (принята в качестве одной из вторичных калибровочных точек температурной шкалы ITS-90. Температура кипения 3287 °C. При достаточно низкой температуре (-80 °C), титан становится довольно хрупким. Молярная теплоёмкость при нормальных условиях Cp = 25,060 кДж/(моль·K), что соответствует удельной теплоёмкости 0,523 кДж/(кг·K). Теплота плавления 15 кДж/моль, теплота испарения 410 кДж/моль. Характеристическая дебаевская температура 430 К. Теплопроводность 21,9 Вт/(м·К) при 20 °C. Температурный коэффициент линейного расширения 9,2·10−6 К−1 в интервале от −120 до +860 °C.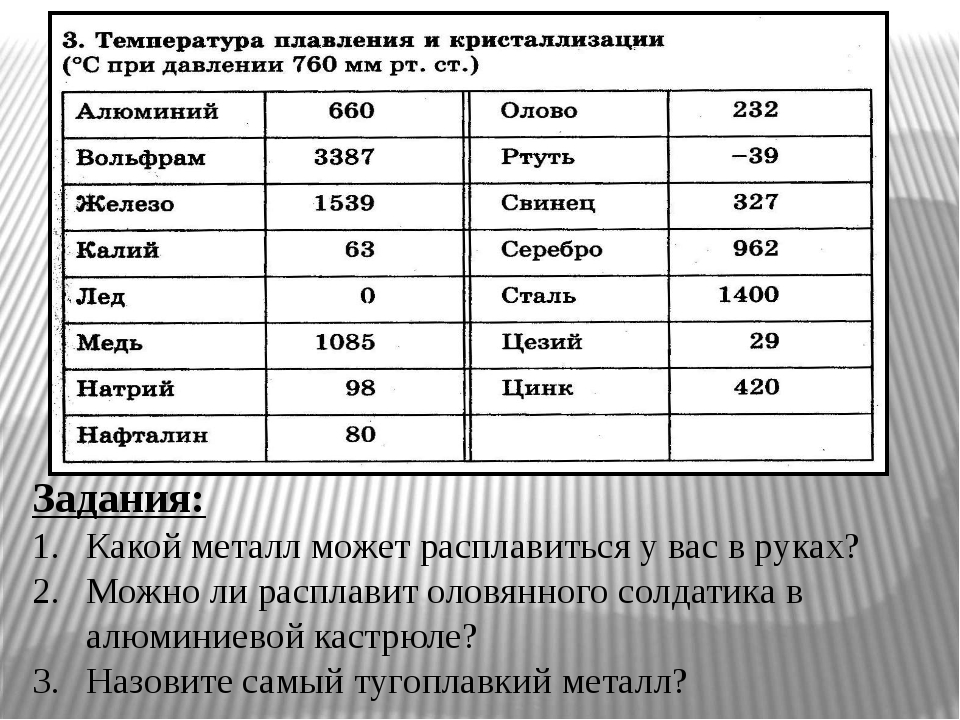 Молярная энтропия α-титана S0 = 30,7 кДж/(моль·К). Для титана в газовой фазе энтальпия формирования ΔH0
Молярная энтропия α-титана S0 = 30,7 кДж/(моль·К). Для титана в газовой фазе энтальпия формирования ΔH0
f = 473,0 кДж/моль, энергия Гиббса ΔG0
f = 428,4 кДж/моль, молярная энтропия S0 = 180,3 кДж/(моль·К), теплоёмкость при постоянном давлении Cp = 24,4 кДж/(моль·K)
Удельное электрическое сопротивление при 20 °C составляет 0,58 мкОм·м (по другим данным 0,42 мкОм·м), при 800 °C 1,80 мкОм·м. Температурный коэффициент сопротивления 0,003 К−1 в диапазоне 0…20 °C.
Пластичен, сваривается в инертной атмосфере. Прочностные характеристики мало зависят от температуры, однако сильно зависят от чистоты и предварительной обработки. Для технического титана твёрдость по Виккерсу составляет 790—800 МПа, модуль нормальной упругости 103 ГПа, модуль сдвига 39,2 ГПа. У высокочистого предварительно отожжённого в вакууме титана предел текучести 140—170 МПа, относительное удлинение 55—70 %, твёрдость по Бринеллю 716 МПа.
Имеет высокую вязкость, при механической обработке склонен к налипанию на режущий инструмент, и поэтому требуется нанесение специальных покрытий на инструмент, различных смазок.
При обычной температуре покрывается защитной пассивирующей плёнкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной).
Температура перехода в сверхпроводящее состояние 0,387 К. При температурах выше 73 кельвин титан парамагнитен. Магнитная восприимчивость при 20 °C составляет 3,2·10−6. Постоянная Холла α-титана равна +1,82·10−13.
Изотопы
Основная статья: Изотопы титана
Известны изотопы титана с массовыми числами от 38 до 63 (количество протонов 22, нейтронов от 16 до 41), и 2 ядерных изомера.
Природный титан состоит из смеси пяти стабильных изотопов: 46Ti (изотопная распространенность 7,95 %), 47Ti (7,75 %), 48Ti (73,45 %), 49Ti (5,51 %), 50Ti (5,34 %).
Среди искусственных изотопов самые долгоживущие 44Ti (период полураспада 60 лет) и 45Ti (период полураспада 184 минуты).
Химические свойства
Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок, а также в тонкой стружке или проволоке титан пирофорен. Титановая пыль имеет свойство взрываться. Температура вспышки — 400 °C. Титановая стружка пожароопасна.
Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF, H3PO4 и концентрированной H2SO4). Титан устойчив к влажному хлору и водным растворам хлора.
Легко реагирует даже со слабыми кислотами в присутствии комплексообразователей, например, с плавиковой кислотой HF он взаимодействует благодаря образованию комплексного аниона [TiF6]2−. Титан наиболее подвержен коррозии в органических средах, так как в присутствии воды на поверхности титанового изделия образуется плотная пассивная плёнка из оксидов и гидрида титана.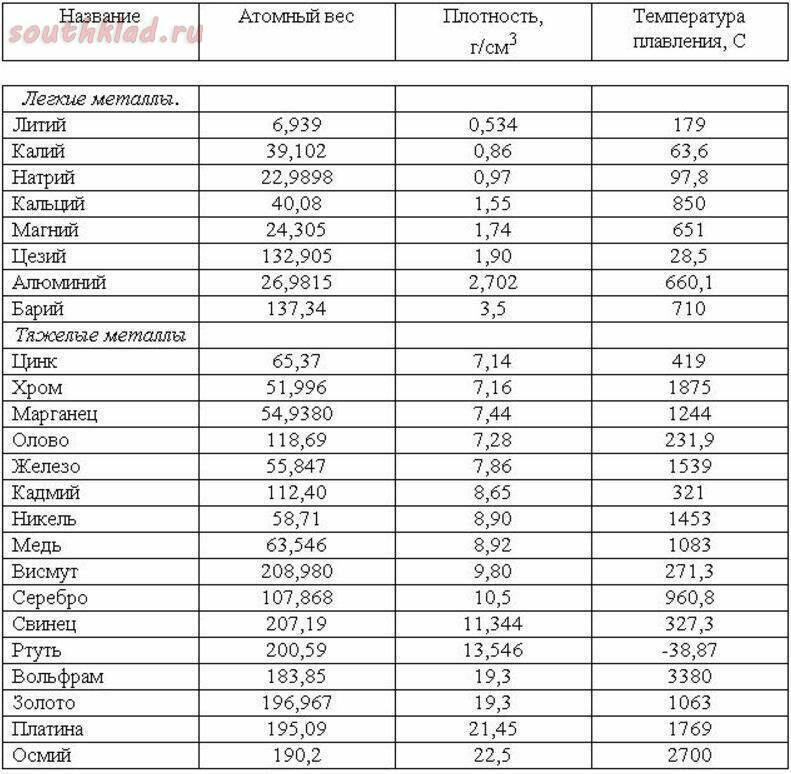 Наиболее заметное повышение коррозионной стойкости титана заметно при повышении содержания воды в агрессивной среде с 0,5 до 8,0 %, что подтверждается электрохимическими исследованиями электродных потенциалов титана в растворах кислот и щелочей в смешанных водно-органических средах.
Наиболее заметное повышение коррозионной стойкости титана заметно при повышении содержания воды в агрессивной среде с 0,5 до 8,0 %, что подтверждается электрохимическими исследованиями электродных потенциалов титана в растворах кислот и щелочей в смешанных водно-органических средах.
При нагревании на воздухе до 1200 °C Ti загорается ярким белым пламенем с образованием оксидных фаз переменного состава TiOx. Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2. Гидроксид TiO(OH)2·xH2O и диоксид TiO2 амфотерны.
TiO2 взаимодействует с серной кислотой при длительном кипячении. При сплавлении с содой Na2CO3 или поташом K2CO3 оксид TiO2 образует титанаты:
- TiO2 + K2CO3 → K2TiO3 + CO2
При нагревании Ti взаимодействует с галогенами (например, с хлором — при 550 °C). Тетрахлорид титана TiCl4 при обычных условиях — бесцветная жидкость, сильно дымящая на воздухе, что объясняется гидролизом TiCl4, содержащимися в воздухе парами воды и образованием мельчайших капелек HCl и взвеси гидроксида титана.
Тетрахлорид титана TiCl4 при обычных условиях — бесцветная жидкость, сильно дымящая на воздухе, что объясняется гидролизом TiCl4, содержащимися в воздухе парами воды и образованием мельчайших капелек HCl и взвеси гидроксида титана.
Восстановлением TiCl4 водородом, алюминием, кремнием, другими сильными восстановителями, получен трихлорид и дихлорид титана TiCl3 и TiCl2 — твёрдые вещества, обладающие сильными восстановительными свойствами. Ti взаимодействует с Br2 и I2.
С азотом N2 выше 400 °C титан образует нитрид TiNx (x = 0.58—1.00). Титан — единственный элемент, который горит в атмосфере азота.
При взаимодействии титана с углеродом образуется карбид титана TiCx (x = 0.49—1.00).
При нагревании Ti поглощает H2 с образованием соединения переменного состава TiHx (x = 2.00—2.98). При нагревании эти гидриды разлагаются с выделением H2.
Титан образует сплавы и интерметаллические соединения со многими металлами.
Применение
В чистом виде и в виде сплавов
Часы из титанового сплаваЗаготовка титанового шпангоута истребителя F-15 до и после прессования на штамповочном прессе компании Alcoa усилием 45 тыс. тонн, май 1985Использование металлического титана во многих отраслях промышленности обусловлено тем, что его прочность примерно равна прочности стали при том, что он на 45 % легче. Титан на 60 % тяжелее алюминия, но прочнее его примерно вдвое.
- Титан в виде сплавов является важнейшим конструкционным материалом в авиа- и ракетостроении, в кораблестроении.
- Металл применяется в химической промышленности (реакторы, трубопроводы, насосы, трубопроводная арматура), военной промышленности (бронежилеты, броня и противопожарные перегородки в авиации, корпуса подводных лодок), промышленных процессах (опреснительных установках, процессах целлюлозы и бумаги), автомобильной промышленности, сельскохозяйственной промышленности, пищевой промышленности, спортивных товарах, ювелирных изделиях, мобильных телефонах, лёгких сплавах и т.
 д.
д. - Титан является физиологически инертным, благодаря чему применяется в медицине (протезы, остеопротезы, зубные имплантаты), в стоматологических и эндодонтических инструментах, украшениях для пирсинга.
- Титановое литьё выполняют в вакуумных печах в графитовые формы. Также используется вакуумное литьё по выплавляемым моделям. Из-за технологических трудностей в художественном литье используется ограниченно. Первой в мировой практике монументальной литой скульптурой из титана является памятник Юрию Гагарину на площади его имени в Москве.
- Титан является легирующей добавкой во многих легированных сталях и большинстве спецсплавов.
- Нитинол (никель-титан) — сплав, обладающий памятью формы, применяемый в медицине и технике.
- Алюминиды титана являются очень стойкими к окислению и жаропрочными, что, в свою очередь, определило их использование в авиации и автомобилестроении в качестве конструкционных материалов.
- Титан является одним из наиболее распространённых геттерных материалов, используемых в высоковакуумных насосах.

Существует множество титановых сплавов с различными металлами. Легирующие элементы разделяют на три группы, в зависимости от их влияния на температуру полиморфного превращения: на бета-стабилизаторы, альфа-стабилизаторы и нейтральные упрочнители. Первые понижают температуру превращения, вторые повышают, третьи не влияют на неё, но приводят к растворному упрочнению матрицы. Примеры альфа-стабилизаторов: алюминий, кислород, углерод, азот. Бета-стабилизаторы: молибден, ванадий, железо, хром, никель. Нейтральные упрочнители: цирконий, олово, кремний. Бета-стабилизаторы, в свою очередь, делятся на бета-изоморфные и бета-эвтектоидообразующие.
Самым распространённым титановым сплавом является сплав Ti-6Al-4V (в российской классификации — ВТ6), содержащий около 6% алюминия и около 4% ванадия. По соотношению кристаллических фаз он классифицируется как (α+β)-сплав. На его производство идёт до 50% добываемого титана.
Ферротитан (сплав титана с железом, содержащий 18—25% титана) используют в чёрной металлургии для раскисления стали и удаления растворённых в ней нежелательных примесей (сера, азот, кислород).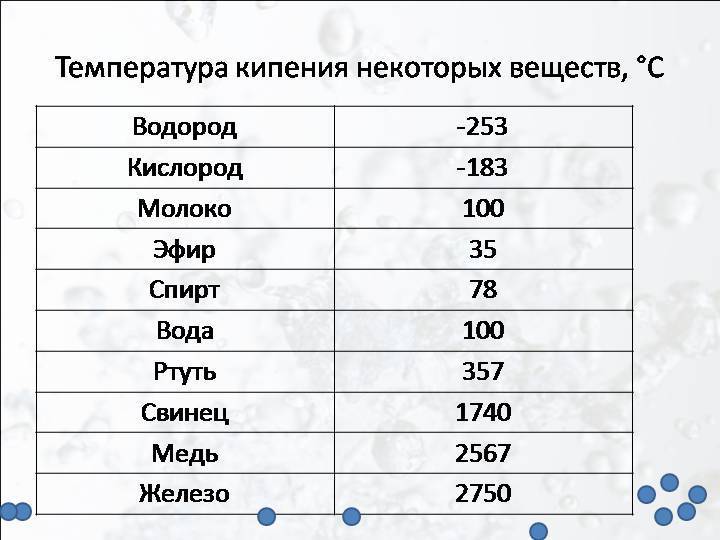
В 1980-х годах около 60-65 % добываемого в мире титана использовалось в строительстве летательных аппаратов и ракет, 15% — в химическом машиностроении, 10% — в энергетике, 8% — в строительстве судов и для опреснителей воды.
В виде соединений
- Белый диоксид титана (TiO2) используется в красках (например, титановые белила), а также при производстве бумаги и пластика. Пищевая добавка E171.
- Титанорганические соединения (например, тетрабутоксититан) применяются в качестве катализатора и отвердителя в химической и лакокрасочной промышленности.
- Неорганические соединения титана применяются в химической электронной, стекловолоконной промышленности в качестве добавки или покрытий.
- Карбид титана, диборид титана, карбонитрид титана — важные компоненты сверхтвёрдых материалов для обработки металлов.
- Нитрид титана применяется для покрытия инструментов, куполов церквей и при производстве бижутерии, так как имеет цвет, похожий на золото.

- Титанат бария BaTiO3, титанат свинца PbTiO3 и ряд других титанатов — сегнетоэлектрики.
- Тетрахлорид титана используется для иридизации стёкла и для создания дымовых завес.
Анализ рынков потребления
В 2005 компания Titanium Corporation опубликовала следующую оценку потребления титана в мире:
- 60 % — краска;
- 20 % — пластик;
- 13 % — бумага;
- 7 % — машиностроение.
Цены
Цена титана составляет $5,9-6,0 за килограмм, в зависимости от чистоты.
Чистота и марка чернового титана (титановой губки) обычно определяется по его твёрдости, которая зависит от содержания примесей.
Диоксид титана
Оксид титана (IV) имеет следующие альтернативные названия: диоксид титана, двуокись титана, титановые белила, пищевой краситель E171. Англоязычные названия: titanium dioxide и, менее правильное, хотя тоже используемое ― titanium oxide.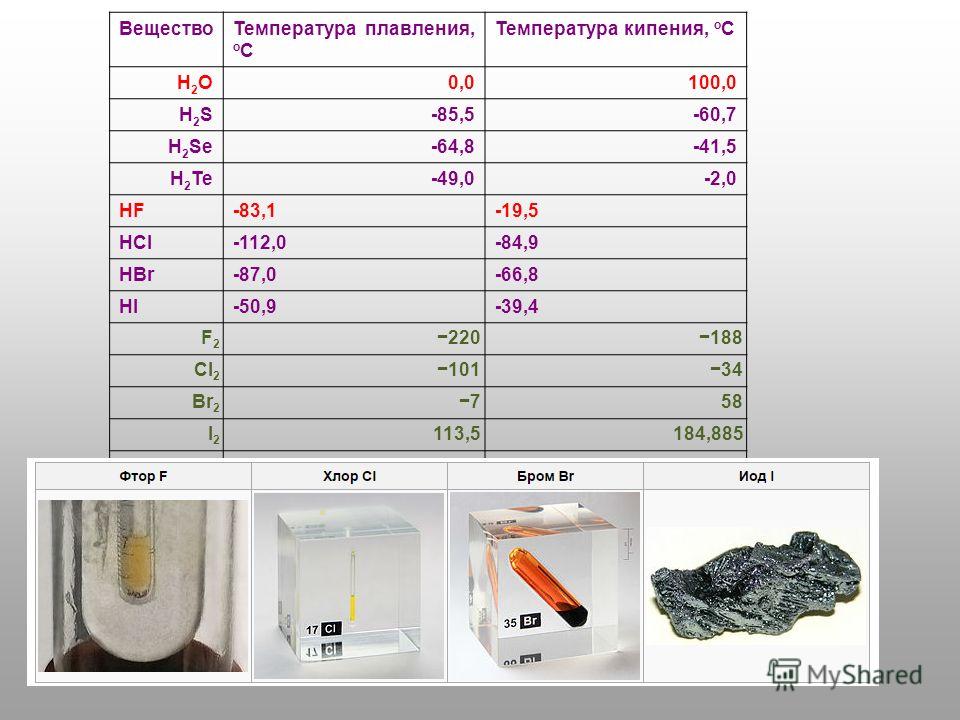
Строение диоксида титана:
Диоксид титана существует в виде нескольких кристаллических модификаций. В природе можно встретить анатаз, рутил и брукит. Следует отметить, что брукит промышленно почти не производится и в природе встречается редко. Анатазная форма также существенно уступает по производству рутильной, так как хуже рассеивает свет и менее атмосферостойка.
Физические свойства диоксида титана:
- Чистый диоксид титана представляет собой бесцветное кристаллическое вещество, желтеющее при нагревании. В тонкораздробленном состоянии ― белый порошок.
- Практически не растворяется в воде и минеральных кислотах, кроме плавиковой и концентрированной серной.
- Температура плавления для рутила: 1870°C.
- Температура кипения для рутила: 2500°C.
- Плотность при 20°C для рутила: 4,235 г/см3.
Химические свойства диоксида титана:
- Диоксид титана является амфотерным оксидом, то есть проявляет как кислотные, так и основные свойства.

- Медленно реагирует с концентрированной серной кислотой, растворяясь в ней с образованием соответствующего сульфата: TiO2+ 2h3SO4 = Ti(SO4)2 + 2h3O
- Также диоксид титана постепенно растворяется в концентрированных растворах щелочей, например, в гидроксиде натрия, образуя титанаты (производные титановой кислоты): TiO2 + 2NaOH = Na2TiO3+ h3O
- При нагревании диоксида титана в атмосфере аммиака образуется нитрид титана: 4TiO2 + 4Nh4 = 4TiN + 6h3O + O2
- Сильными восстановителями, например, активными металлами (Ca, Mg, Na), углеродом или водородом при высокой температуре диоксид титана восстанавливается до низших оксидов. При нагревании с углеродом в атмосфере хлора образуется тетрахлорид титана TiCl 4 ― этот прием используется в промышленном масштабе для очистки титана от различного рода примесей.
Токсические свойства диоксида титана:
- Будучи химически инертным, диоксид титана является малоопасным веществом. В организм может поступать в виде аэрозоля при вдыхании или при приеме внутрь.

- ПДК в воздухе рабочей зоны ― 10 мг/м3 (1998).
Способы производства диоксида титана
Существуют два основных промышленных метода получения TiO2 ― из тетрахлорида титана и ильменитовый (основанный на переработке минерала ильменита FeTiO3):
- В тетрахлоридном методе TiCl 4 либо гидролизуют до гидроксида в жидкой фазе c последующей термообработкой выпавшего осадка, либо проводят гидролиз в парах воды, или же сжигают в токе кислорода.
- Ильменитный метод состоит в обработке ильменитового концентрата серной кислотой. Полученный раствор сульфата титана (IV) очищают и обрабатывают раствором гидроксида натрия, в результате чего получается осадок гидроксида титана (IV). Осадок в дальнейшем подвергают термообработке.
Свойства карбидов металлов (гафния, хрома, титана, вольфрама и др.)
Представлены сведения о химических и физических свойствах карбидов металлов: таких, как гафний, хром, титан, вольфрам и других.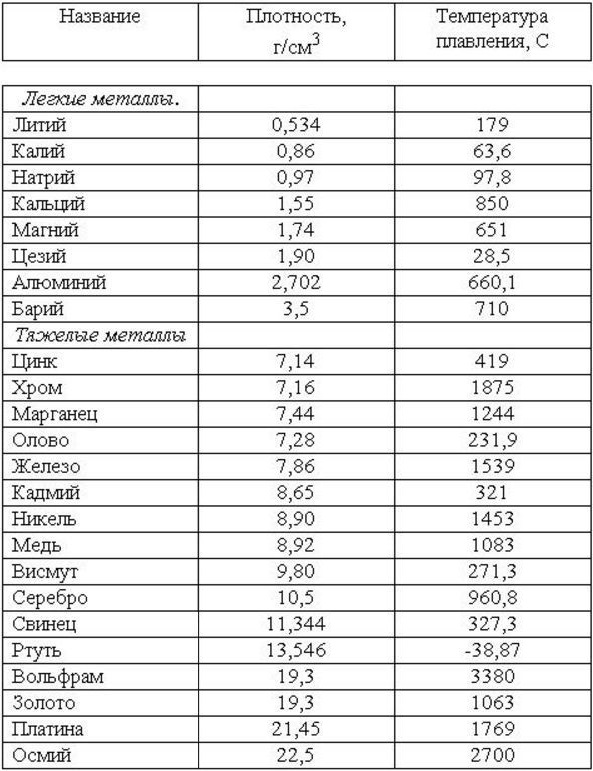 Физические свойства карбидов сведены в отдельные таблицы, в которых указана их плотность, твердость, температура плавления и кипения, а также электрические и тепловые свойства.
Физические свойства карбидов сведены в отдельные таблицы, в которых указана их плотность, твердость, температура плавления и кипения, а также электрические и тепловые свойства.
Карбид гафния GfC
В таблице приведены свойства карбида металла гафния. Карбид гафния представляет собой соединение серого цвета с температурой плавления 3890°С и высокой плотностью, которая при комнатной температуре составляет 12600 кг/м3. Энергия кристаллической решетки GfC равна 117,2·105 кДж/кмоль.
Карбид гафния полностью растворяется в ортофосфорной, азотной и серной кислотах. При температуре около 2000°С он начинает взаимодействовать с тугоплавкими металлами — такими, как молибден, вольфрам, тантал и ниобий.
| Молекулярная масса | 190,5 |
| Тип решетки | Кубическая |
| Плотность, кг/м3 | 12600 |
| Температура плавления, °С | 3890±150 |
| Температура кипения, °С | 4160 |
| Средний ТКЛР в интервале 20-1200°С, α·106, град-1 | 6,1 |
| Молярная теплоемкость при 20°С, кДж/(кмоль·град) | 35,3 |
Теплопроводность карбида гафния с нулевой пористостью при температуре 300°С равна 9,2 Вт/(м·град). При нагревании коэффициент теплопроводности GfC увеличивается. Удельная теплоемкость карбида гафния относительно невысока и при росте температуры слабо увеличивается.
При нагревании коэффициент теплопроводности GfC увеличивается. Удельная теплоемкость карбида гафния относительно невысока и при росте температуры слабо увеличивается.
| 300 | 400 | 600 | 800 | 1000 | 1200 | |
|---|---|---|---|---|---|---|
| Удельная массовая теплоемкость, Дж/(кг·град) | 251 | 251 | 255 | 268 | 281 | 297 |
| Коэффициент теплопроводности, Вт/(м·град) | 9,2 | 10 | 11,7 | 13,8 | 15,9 | 17,2 |
Карбиды хрома
Таблица содержит физические свойства карбидов хрома различного состава. Соединения с формулой Cr23C6 и Cr3C2 имеют серый цвет; Cr7C3 — серебристый.
Карбиды хрома Cr23C6 и Cr7C3 нерастворимы в царской водке. После длительного нагрева при 730…870°С карбид Cr7C3 превращается в Cr23C6. Карбид Cr3C2 нерастворим в воде. Изделия из него также практически нерастворимы в кислотах, их смесях и растворах щелочей. Однако, он может взаимодействовать с цинком при температуре 940°С. Температура начала окисления Cr3C2 составляет 900…1000°С.
После длительного нагрева при 730…870°С карбид Cr7C3 превращается в Cr23C6. Карбид Cr3C2 нерастворим в воде. Изделия из него также практически нерастворимы в кислотах, их смесях и растворах щелочей. Однако, он может взаимодействовать с цинком при температуре 940°С. Температура начала окисления Cr3C2 составляет 900…1000°С.
| Свойства/карбид | Cr4C | Cr23C6 | Cr7C3 | Cr3C2 |
|---|---|---|---|---|
| Молекулярная масса | 220 | 1265 | 400 | 180 |
| Тип решетки | Кубическая | Кубическая | Гексагональная | Ромбическая |
| Плотность, кг/м3 | — | 6970 | 6920 | 6680 |
| Температура плавления, °С | 1520 | 1550 | 1700±50 | 1890 (разлаг. ) ) |
| Средний ТКЛР в интервале 20-800°С, α·106, град-1 | — | 10,1 | 10 | 10,3 |
| Удельная массовая теплоемкость при 20°С, Дж/(кг·град) | — | 493 | 523 | 546 |
| Молярная теплоемкость при 20°С, кДж/(кмоль·град) | — | 84 | 209 | 98 |
| Коэффициент теплопроводности при 20°С, Вт/(м·град) | — | 18,7 | 16,6 | 16,2 |
Карбид титана TiC
Карбид титана TiC представляет собой соединение светло-серого цвета с металлическим блеском. Он химически инертен при комнатной температуре: плохо растворяется в кислотах, их смесях и некоторых щелочах в холодном и нагретом состояниях.
При высоких температурах (выше 2500°С) начинает реагировать с азотом. При взаимодействии с водородом обезуглероживается. Кроме того, окисляется углекислым газом при температурах выше 1200°С. Температура активного окисления карбида титана составляет 1100…1200°С.
Температура активного окисления карбида титана составляет 1100…1200°С.
Область температурной устойчивости TiC достигает 3140°С, он высокостоек в расплавленных легкоплавких металлах и металлах типа меди, алюминия, латунях, чугунах и сталях. Степень черноты карбида титана равна 0,9 (при длине волны 0,655 мкм).
| Молекулярная масса | 59,9 |
| Тип решетки | Кубическая |
| Плотность, кг/м3 | 4930 |
| Температура плавления, °С | 3147±50 |
| Температура кипения, °С | 4305 |
| Твердость по шкале Мооса | 8-9 |
| Средний ТКЛР в интервале 20-2700°С, α·106, град-1 | 9,6 |
| Молярная теплоемкость при 20°С, кДж/(кмоль·град) | 33,7 |
| Удельная массовая теплоемкость при 25°С, Дж/(кг·град) | 842 |
| Коэффициент теплопроводности при 20°С, Вт/(м·град) | 34…39 |
| Удельное электрическое сопротивление при 20°С, ρ·108, Ом·м | 60 |
Карбиды вольфрама W
2C и WCКарбиды вольфрама W2C и WC представляют собой соединения серого цвета. Область температурной устойчивости для W2C составляет до 2750°С; для WC — до 2600°С. Тонкий порошок WC быстро окисляется на воздухе при 500…520°С. Температура начала окисления грубого порошка WC составляет 595°С. При 700°С изменение массы карбида вольфрама WC в результате часового окисления составляет 8,3 мг/(см2·ч).
Область температурной устойчивости для W2C составляет до 2750°С; для WC — до 2600°С. Тонкий порошок WC быстро окисляется на воздухе при 500…520°С. Температура начала окисления грубого порошка WC составляет 595°С. При 700°С изменение массы карбида вольфрама WC в результате часового окисления составляет 8,3 мг/(см2·ч).
При комнатной температуре порошок карбида вольфрама практически не растворяется в сильных концентрированных кислотах. Однако он почти полностью растворим в кипящих H2SO4 и HNO3. При температуре 940°С WC слабо взаимодействует с расплавом цинка.
| Свойства/карбид | W2C | WC |
|---|---|---|
| Молекулярная масса | 379,7 | 195,9 |
| Тип решетки | Гексагональная | |
| Плотность, кг/м3 | 1720 | 1560 |
| Температура плавления, °С | 2730±15 | 2720 |
| Температура кипения, °С | 6000 | |
| Твердость по шкале Мооса | 9-10 | 9 |
| Средний ТКЛР в интервале 20-2000°С, α·106, град-1 | 5,8 | |
| Удельная массовая теплоемкость в интервале 0-100°С, Дж/(кг·град) | — | 184 |
| Молярная теплоемкость при 25°С, кДж/(кмоль·град) | — | 36 |
| Коэффициент теплопроводности при 20°С, Вт/(м·град) | 29,3 | 197 |
Карбид кальция CaC
2В таблице приведены физические свойства карбида кальция CaC2.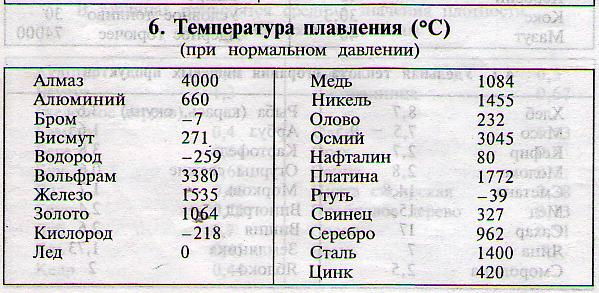 По своим оптическим свойствам химически чистый карбид кальция — большие, почти бесцветные кристаллы с голубоватым оттенком. Технический CaC2 в зависимости от степени чистоты имеет серый, коричнево-желтый или черный цвет.
По своим оптическим свойствам химически чистый карбид кальция — большие, почти бесцветные кристаллы с голубоватым оттенком. Технический CaC2 в зависимости от степени чистоты имеет серый, коричнево-желтый или черный цвет.
Предел температурной устойчивости для карбида кальция равен 2300°С. При температуре 20°С он полностью растворяется в воде (с выделением ацетилена) и концентрированной соляной кислоте.
| Молекулярная масса | 64,1 |
| Тип решетки | Тетрагональная, кубическая |
| Плотность, кг/м3 | 2100 |
| Температура плавления, °С | 2300 (разлаг.) |
| Удельная массовая теплоемкость при 25°С, Дж/(кг·град) | 960 |
| Молярная теплоемкость при 25°С, кДж/(кмоль·град) | 61,3 |
Карбид циркония ZrC
Карбид циркония представляет собой соединение серого цвета с металлическим блеском.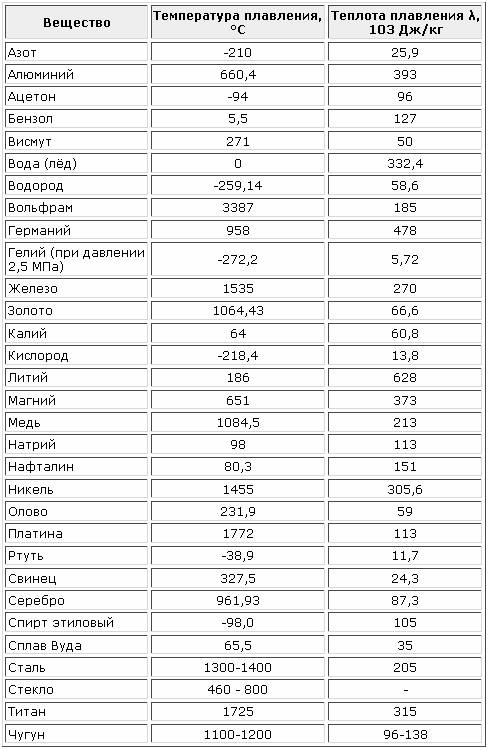 Он химически инертен при комнатной температуре: плохо растворяется в концентрированных кислотах, их смесях и некоторых щелочах, как в холодном, так и нагретом состоянии. Карбид циркония нерастворим в воде, однако взаимодействует с азотом с образованием нитридов.
Он химически инертен при комнатной температуре: плохо растворяется в концентрированных кислотах, их смесях и некоторых щелочах, как в холодном, так и нагретом состоянии. Карбид циркония нерастворим в воде, однако взаимодействует с азотом с образованием нитридов.
Температура активного окисления ZrC составляет 1100…1200°С, область температурной устойчивости — до 3530°С. Карбид циркония стоек в расплавах меди и медных сплавов, стали, чугуна и легкоплавких металлов.
| Молекулярная масса | 103,2 |
| Тип решетки | Кубическая |
| Плотность, кг/м3 | 6730 |
| Температура плавления, °С | 3530 |
| Температура кипения, °С | 5100 |
| Твердость по шкале Мооса | 8-9 |
| Средний ТКЛР в интервале 20-1100°С, α·106, град-1 | 6,74 |
| Молярная теплоемкость при 20°С, кДж/(кмоль·град) | 61,1 |
| Удельная массовая теплоемкость при 25°С, Дж/(кг·град) | 456 |
| Коэффициент теплопроводности при 0°С, Вт/(м·град) | 42 |
| Удельное электрическое сопротивление при 20°С, ρ·108, Ом·м | 50 |
Карбиды ниобия Nb
2C и NbCВ таблице даны физические свойства карбидов ниобия Nb2C и NbC. Плотный карбид ниобия NbC имеет серовато-коричневый или бледно-лиловый металлический цвет. Порошок NbC имеет фиолетовый оттенок.
Плотный карбид ниобия NbC имеет серовато-коричневый или бледно-лиловый металлический цвет. Порошок NbC имеет фиолетовый оттенок.
Карбиды ниобия при комнатной температуре химически инертны, обладают высокой химической стойкостью к действию кислот и их смесей даже в нагретом состоянии. Однако, они растворимы в смеси плавиковой и азотной кислоты.
При нагревании на воздухе NbC слегка обезуглероживается. До температуры 2500°С он устойчив в атмосфере азота. Температура активного окисления карбида ниобия составляет 900…1000°С. Область температурной устойчивости — до 3890°С. Он стоек в расплавах металлов (Cu, Al), имеет высокую твердость по шкале Мооса.
| Свойства/карбид | Nb2C | NbC |
|---|---|---|
| Молекулярная масса | 197,8 | 105 |
| Тип решетки | Гексагональная | Кубическая |
| Плотность, кг/м3 | 7860 | 7560 |
| Температура плавления, °С | 2927 | 3480 |
| Температура кипения, °С | — | 4500 |
| Твердость по шкале Мооса | — | 9-10 |
| Средний ТКЛР в интервале 20-1100°С, α·106, град-1 | 6,5 | |
| Удельная массовая теплоемкость при 20°С, Дж/(кг·град) | 315 | 355 |
| Молярная теплоемкость при 25°С, кДж/(кмоль·град) | 30,36 | 37,35 |
| Коэффициент теплопроводности при 20°С, Вт/(м·град) | — | 19 |
| Удельное электрическое сопротивление при 20°С, ρ·108, Ом·м | 55 | 46 |
Источники:
- Чиркин В.
 С. Теплофизические свойства материалов ядерной техники. М.: Атомиздат, 1967. — 474 с.
С. Теплофизические свойства материалов ядерной техники. М.: Атомиздат, 1967. — 474 с. - Кржижановский Р. Е., Штерн З. Ю. Теплофизические свойства неметаллических материалов (карбиды). Справочник. Л.: Энергия, 1976. — 120 с.
Титан
- Главная
- /
- Прием металлолома
- /
- Лом цветных металлов
- /
- Титан
Титан (Ti), блестящий серебристо-белый переходный элемент, который был открыт в 1791 г. Титан является широко распространенным элементом, который обнаружен во многих минералах, но главным его источником являются ильменит и рутил. Титан обладает стойкостью к коррозиям и нагреванию, он применяется в сталях и различных сплавах, особенно в авиации, при строении космических кораблей и управляемых ракет, где прочность конструкции должна сочетаться с его легкостью. Титан используется при производстве очень твердых сплавов, используемых в военной промышленности, на космических кораблях и автомобилестроении. Оксид титана (VI) применяется как белый пигмент в красках, а также как драгоценный камень титания.
Оксид титана (VI) применяется как белый пигмент в красках, а также как драгоценный камень титания.
Свойства титана: температура кипения 3287 °С, атомный номер 22, атомная масса 47,90, температура плавления 1660 °С, плотность 4,54, наиболее распространенный изотоп 48Ti (73,94%).. Лёгкость, большая прочность в промежутке температур от криогенных (-250 °С) до умеренно высоких (300- 600 °С), отличная коррозионная стойкость дают титану хорошие перспективы использования в качестве конструкционных материалов в большом количестве направлений, например в авиации и других отраслях, таких как машиностроение, судостроение и т.д.
Титан – это серебристого цвета твердый металл, во многом схожий со сталью. Титан является одним из важнейших металлов в самых разных областях промышленности. Обладая всеми своими уникальными свойствами, у титана высокая стоимость, а также потому, что плавка титана производится или в среде инертных газов или в вакууме. Кроме этого, титановые изделия имеют плохие антифрикционные качества, высокую склонность к солевым коррозиям и водородную хрупкость, плохую свариваемость и обрабатываемость резкой.
Применение лома титана.
Титановый лом широко используется в судостроении, ракетостроении, в авиастроении, химическом производстве, автомобилестроении и т.д. Титановые круги, листы и плиты используются при строительстве корпусов атомных подводных лодок. За счет своих антикоррозийных качеств и высокой инертности к химическим реактивам трубы из титана применяются в химической промышленности. Титановая проволока широко применяется в стоматологии, кроме этого, в качестве присадочной проволоки при строении каркасов из титановых сплавов различного назначения, а также и стратегического.
Количество потребления в мире титановых сплавов постоянно растет. Но, не обращая внимания на широкое распространение этого металла, в наше время почти не существуют крупные его месторождения. Поэтому добыча титанового лома играет немаловажную роль в промышленности. Металлургия титана является сложным, дорогостоящим и в то же время вредным для окружающей природной среды процессом. Именно поэтому переработка титанового лома не только уменьшает негативную нагрузку на экологическую среду, но и снижает затраты на переработку чистого титана.
Именно поэтому переработка титанового лома не только уменьшает негативную нагрузку на экологическую среду, но и снижает затраты на переработку чистого титана.
Необходимо отметить, что титановая стружка считается опасным сырьем. Она легко воспламеняема, а также подвержена взрывам. Поэтому необходимо строго соблюдать требования техники безопасности, работать нужно только в спецодежде.
Титановый лом отлично поддаётся переработке. После завершения процесса переработки металл практически полностью сохраняет свои свойства и без проболем используется повторно.
Использование титанового лома даёт возможность значительно снизить себестоимость дорогих титановых сплавов и упростить их производство.
Виды титанового лома, пригодные для приёмки:
- Промышленный титановый лом ( непосредственно сам лом и остатки проката)
- Титановый микс (сломанные детали и комплектующие, загрязненная стружка и обрезки)
- Титановая стружка
- Бытовой титановый лом (бытовые изделия и детали)
Основной целью в переработке титана считается поддержание обедневших запасов титана на нашей планете.
Титан — точка плавления — температура кипения
Титан — температура плавления и температура кипения
Температура плавления титана — 1668°C .
Температура кипения титана 3287°C .
Обратите внимание, что эти точки связаны со стандартным атмосферным давлением.
Температура кипения – насыщение
В термодинамике насыщение определяет состояние, при котором смесь пара и жидкости может существовать вместе при заданной температуре и давлении.Температура, при которой начинает происходить испарение (кипение) при данном давлении, называется температурой насыщения или точкой кипения . Давление, при котором начинается испарение (кипение) при данной температуре, называется давлением насыщения. Когда ее рассматривают как температуру обратного перехода из пара в жидкость, ее называют точкой конденсации.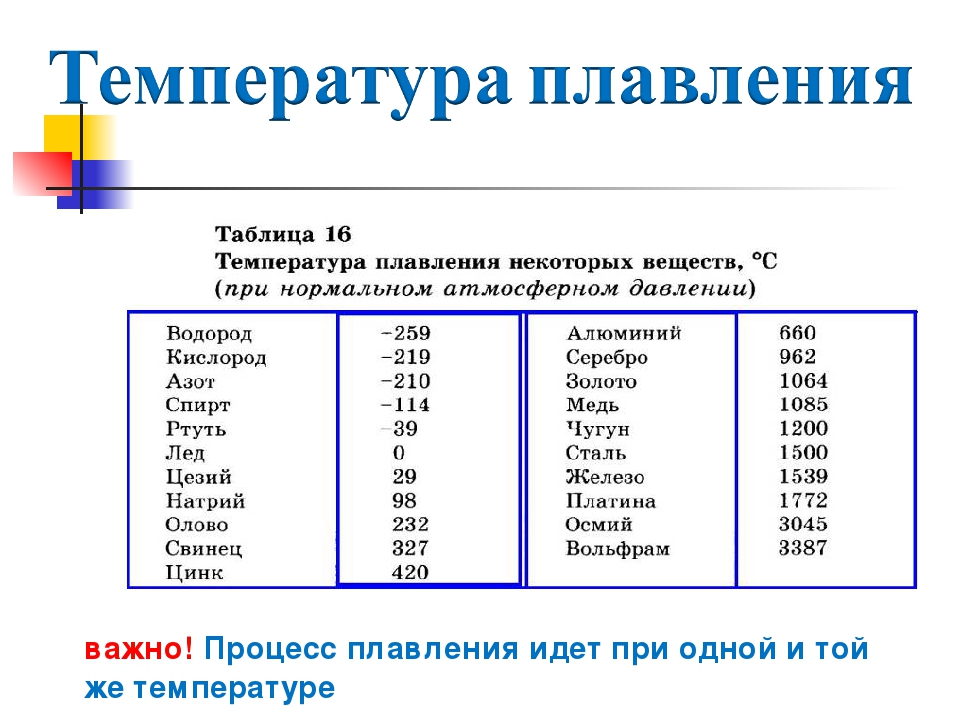
Точка плавления
В термодинамике точка плавления определяет состояние, при котором твердое тело и жидкость могут существовать в равновесии.Добавление тепла превратит твердое вещество в жидкость без изменения температуры. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда ее рассматривают как температуру обратного перехода от жидкого к твердому, ее называют точкой замерзания или точкой кристаллизации.
Первая теория, объясняющая механизм плавления в объеме, была предложена Линдеманном, который использовал колебание атомов в кристалле для объяснения плавления. Твердые тела похожи на жидкости тем, что оба находятся в конденсированном состоянии, а частицы находятся гораздо ближе друг к другу, чем частицы газа.Атомы в твердом теле тесно связаны друг с другом либо в правильной геометрической решетке (кристаллические твердые тела, которые включают металлы и обычный лед), либо в неправильной (аморфное твердое тело, такое как обычное оконное стекло), и обычно имеют низкую энергию. Движение отдельных атомов , ионов или молекул в твердом теле ограничено колебательным движением вокруг неподвижной точки. Когда твердое тело нагревается, его частицы вибрируют быстрее , поскольку твердое тело поглощает кинетическую энергию. В какой-то момент амплитуда колебаний становится настолько большой, что атомы начинают вторгаться в пространство своих ближайших соседей и возмущать их, и начинается процесс плавления.Точка плавления – это температура, при которой разрушающие вибрации частиц твердого тела преодолевают силы притяжения, действующие внутри твердого тела.
Движение отдельных атомов , ионов или молекул в твердом теле ограничено колебательным движением вокруг неподвижной точки. Когда твердое тело нагревается, его частицы вибрируют быстрее , поскольку твердое тело поглощает кинетическую энергию. В какой-то момент амплитуда колебаний становится настолько большой, что атомы начинают вторгаться в пространство своих ближайших соседей и возмущать их, и начинается процесс плавления.Точка плавления – это температура, при которой разрушающие вибрации частиц твердого тела преодолевают силы притяжения, действующие внутри твердого тела.
Titanium — Свойства
| Element | Titanium | |
|---|---|---|
| Атомный номер | 22 | |
| Символ | Ti | |
| Элемент Категория | переходных металлов | |
| Фаза при STP | Твердое вещество | |
Атомная масса [а. е.м.] е.м.] | 47.867 | |
| Плотность на STP [G / CM3] | 4,507 | |
| [AR] 3D2 4S2 | ||
| Возможные окисленные состояния | ||
| +2,3,4 | ||
| Электронная аффинность [KJ / MOL] | 700 | |
| 1.54 | 1,54 | |
| 1-й ионизационный энергия [EV] | 6.8282 | |
| 1 | 1791 | |
| Discoverer | Грегор, William | |
| Thermal Properties | ||
| 1668 | 1668 | |
| кипение [Cellius Scale] | 3287 | |
| , | 21.9 | |
| Удельное тепло [J / G K] | 0.52 | |
| 1 KJ / MOL] | 15.45 | |
| Тепловое тепло [KJ / MOL] | 421 |
–
–
–
ТИТАН
ТИТАНТИТАН
от латинского титаны что означает «первые сыны земли»
Взрыв титановой звезды.big.gif) Нажмите на
изображение, чтобы узнать больше!
Нажмите на
изображение, чтобы узнать больше!
Несколько забавных фактов о титане:
Титан был обнаружен в 1791 г. г-ном Грегором, но он не был назван до 1795 г. Это был первый выделен Хантером в 1910 г. при нагревании TiCl4 с натрием в стальной бомбе при температура от 700-800 C. Это довольно жарко!
Титаниум девятый Самый распространенный металл в земной коре. Это много титана!
Это всего около 6 долларов, чтобы купить фунт титана.Это меньше, чем поход в кино! Это больше похоже на попкорн и поп в кино. черт возьми, я бы взял немного титан.
атомный номер: 22
атомная масса: 47,867 г
распространенных степеней окисления: 2,3,4
внешний вид: красивый блестящий белый металл
температура плавления: 1660 градусов Цельсия
точка кипения: 3287 градусов С
Кристаллическая структура: шестигранник с наибольшей упаковкой
плотность: 4507 кг м3 | msthemelist>
электроотрицательность: 1. 54
Палинговые узлы
54
Палинговые узлы
в основном состоянии: [Ар]3d24s2
источник: титан существует в основном в земной коре, но также может быть найден на солнце и метеориты. Металлический титан очищают перед использованием. Он удален из TiFeO3 или TiO2 по методу Кролла, в котором используются следующие реакции:
2TiFeO3 + 7Cl2 + 6C (900 В) —> 2TiCl4 + 2FeCl3 + 6CO
TiCl4 + 2Mg (1100 С) —-> 2 MgCl2 + Ti
«Это у тебя железная дубина? Ха! неудачник.»
«Клуб Тигр
Тайгер Вудс — большой поклонник титана. Нажать на ссылка выше чтобы узнать больше о Тайгере Вудсе.
Стань профессиональным игроком в гольф! Купить титановые клюшки для гольфа
свойства и применение: Титан прочен, легко
изготовлен, устойчив к коррозии и имеет очень низкую плотность. Эти
свойства делают его сплавы полезными в самолетах и ракетах из-за их
легкий вес и способность выдерживать экстремальные температуры.Это также
популярен в индустрии изготовления велосипедов и даже в ювелирных изделиях. Это так же сильно, как
стали, но на 45% легче. Сейчас он используется Тайгером Вудсом в гольф-клубах.
Он содержится в красках для дома, дымовых завесах и на опреснительных установках. Титан горит в
воздух, и является единственным элементом, который горит в азоте. Он часто используется в
фейерверк. На самом деле, многие фейерверки — это просто перхлорат калия.
(KClO4) в смеси с чистым металлическим титаном. Очень простой процесс,
В самом деле.Похоже на веселую лабораторию!
Эти
свойства делают его сплавы полезными в самолетах и ракетах из-за их
легкий вес и способность выдерживать экстремальные температуры.Это также
популярен в индустрии изготовления велосипедов и даже в ювелирных изделиях. Это так же сильно, как
стали, но на 45% легче. Сейчас он используется Тайгером Вудсом в гольф-клубах.
Он содержится в красках для дома, дымовых завесах и на опреснительных установках. Титан горит в
воздух, и является единственным элементом, который горит в азоте. Он часто используется в
фейерверк. На самом деле, многие фейерверки — это просто перхлорат калия.
(KClO4) в смеси с чистым металлическим титаном. Очень простой процесс,
В самом деле.Похоже на веселую лабораторию!
Для получения дополнительной информации о титан, который вы когда-либо хотели знать:
http://www.titanium.org
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера для приема файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно.Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Химические вещества — тетрахлорид титана | Товары и услуги
Химические вещества Тетрахлорид титана
Тетрахлорид титана используется для различных продуктов; электронные компоненты, катализаторы для производства полиолефинов, перламутровые пигменты, испаряемые материалы и т. д.
приложений
- Титановая губка
- Диоксид титана высокой чистоты (TiO 2 )
- Титанат бария
- Катализатор полимеризации (катализатор Циглера-Натта)
- Водный раствор тетрахлорида титана
Технические характеристики
| Химический состав | ||||||||
|---|---|---|---|---|---|---|---|---|
| Марка | TiCl 4 (%) | Fe (ч/млн) | В (млн) | Si (ч/млн) | Sn (частей на миллион) | Как (частей на миллион) | Sb (ч/млн) | Hazen* номер цвета |
| ТЛТ-1 | 99.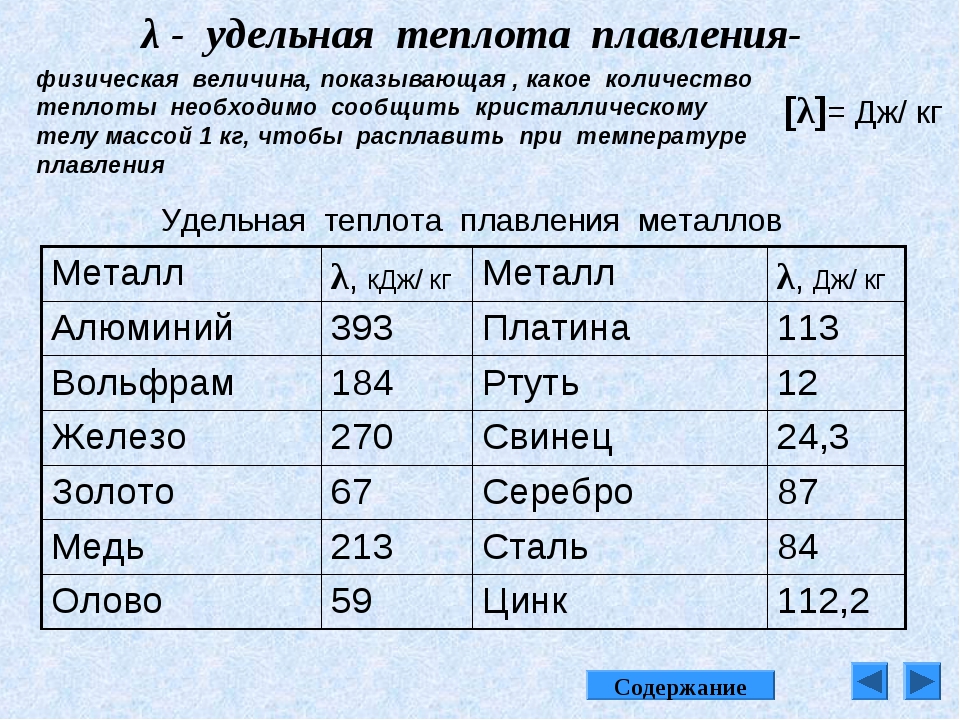 9мин. 9мин. | 10макс. | 10макс. | 5макс. | 30макс. | — | — | 20макс. |
*в соответствии с методом цветовой индикации Американской ассоциации общественного здравоохранения (APHA)
Физические свойства
| Молекулярный вес | 189.73 |
|---|---|
| Точка кипения | 136,4°C (1013,25 гПа) |
| Точка плавления | -25 градусов С |
| Удельный вес | 1,726 (15-20°С) |
| Плотность пара | 197,4 (Кислород=16) |
| Давление паров | logP=7.64433-1947.6/T (P:мм рт. ст.,T:K) ст.,T:K) |
| Критическая температура | 358 градусов С |
| Удельная теплоемкость | 35,7 кал/моль°C (жидкость)(13-99°C) |
| Вязкость | 0,826 CP (20°C) |
| Теплота испарения | 8,96 ккал/моль (25°С) |
| Теплота плавления | 2.24 ккал/моль |
| Теплопроводность | 0,073 ккал/м·ч, град С |
| Поверхностное натяжение | 34,03 дин/см (13°C) |
| Диэлектрическая проницаемость | 2,83 (10°С), 2,79 (20°С) |
| Коэффициент кубического расширения | 0,001086 (0-100°С) |
| Энтропия | 60. 4±2 кал/моль. градус С (25 град С, жидкость) 4±2 кал/моль. градус С (25 град С, жидкость) |
| 84,4±1 кал/моль. градус С (25 град С, пар) | |
| Теплота образования | -198,5±10 ккал/моль (0°С, твердое вещество) |
| -184,3±10 ккал/моль (0 град. С, газ) |
Химические свойства
- 1 — реактивность по отношению к воде
- Сильно реагирует с водой (гидролиз) с большой теплотой реакции.
TiCl 4 +H 2 O → HCl+Ti(OH)nClx - 2 — Реакция на спирт
- Реакция со спиртом с образованием сложного эфира.
TiCl 4 +4ROH+4NH 3 → Ti(OR) 4 +4NH 4 Cl - 3 — Коррозия
- Не вызывает коррозию железа при комнатной температуре, но вызывает коррозию при температуре 200°C и выше.

При взаимодействии с водой образуется коррозионно-активный HCl; для устранения влаги в сосуде и трубе.
| Физические свойства | |||
| Недвижимость | Определение | Условия | Значение |
|---|---|---|---|
| Точка кипения (точка плавления) | Температура, при которой жидкий хлор испаряется | 14.696 фунтов на квадратный дюйм (101,325 кПа) | -29,15°F (-33,97°С) |
| Критическая плотность | Масса единицы объема хлора при критическом давлении и температуре | 35,77 фунт/фут 3 (573,0 кг/м 3 ) | |
| Критическое давление | Давление паров жидкого хлорида при критической температуре | 1157. 0 фунтов на квадратный дюйм 0 фунтов на квадратный дюйм (7977 кПа) | |
| Критическая температура | Температура, выше которой хлор существует только в виде газа, независимо от того, насколько велико давление | 290,75°F (143,75°С) | |
| Критический объем | Объем единицы массы хлора при критическом давлении и температуре | 0.02795 футов 3 / фунт (0,001745 м 3 /кг) | |
| Плотность | Масса единицы объема хлора при определенных условиях температуры и давления. | См. рис. 10.2. | |
| Плотность Cl 2 Газ | 32°F, 14,696 фунт/кв. дюйм абс. (0°C, 101,325 кПа) | 0,2006 фунт/фут 3 (3.213 кг/м 3 ) | |
| Плотность насыщенного Cl 2 Газ | 32°F, 53,51 фунтов на кв. дюйм абс. (0°C, 368,9 кПа) | 0,7632 фунт/фут 3 (12,23 кг/м 3 ) | |
| Плотность насыщенного Cl 2 Жидкость | 32°F, 14,696 фунт/кв. дюйм абс. (0°C, 101,325 кПа) 60°F, 86,58 фунт/кв. дюйм абс. (15.6°С, 597,0 кПа) | 91,56 фунт/фут 3 (1467 кг/м 3 ) 88,76 фунт/фут 3 | |
| Скрытая теплота парообразования | Теплота, необходимая для испарения единицы массы хлора | При нормальной температуре кипения | 123,9 БТЕ/фунт (288,1 кДж/кг) |
| Соотношение объемов жидкости и газа | Вес одного объема жидкого хлора равен весу 456.5 объемов газообразного хлора. | 32°F, 14,696 фунт/кв. дюйм абс. (0°C, 101,325 кПа) | |
| Точка плавления (точка замерзания) | Температура, при которой твердый хлор плавится или жидкий хлор затвердевает | 14,696 фунт/кв. дюйм дюйм (101,325 кПа) | -149,76°F (-100,98°С) |
| Растворимость в воде | Масса хлора, которая может быть растворена в данном количестве воды при данной температуре, когда общее давление паров хлора и воды равно заданному значению. | 60°F, 14,696 фунтов на кв. дюйм (15,6°C, 101,325 кПа) | 6,93 фунта/100 галлонов (8,30 кг/м 3 ) См. рис. 10.3 |
| Удельный вес Cl 2 Газ | Отношение плотности газообразного хлора при стандартных условиях к плотности воздуха при тех же условиях: | 32°F, 14,696 фунт/кв. дюйм абс. (0°C, 101,325 кПа) | 2.485 (Примечание: плотность воздуха без влаги при тех же условиях составляет 1,2929 кг/м 3 ) |
| Удельный вес Cl 2 Жидкость | Отношение плотности насыщенного жидкого хлора к плотности воды при ее максимальной плотности — 39°(4°С) | 32°F (0°С) | 1,467 |
| Удельная теплоемкость | Количество тепла, необходимое для повышения температуры единицы веса хлора на один градус. | ||
| Насыщенный газ при постоянном давлении | 32°F (0°С) 77°F 90 190 (25°С) | 0,1244 БТЕ/фунт °F (0,521 кДж/кг К) 0,1347 БТЕ/фунт °F (0,564 кДж/кг·К) | |
| Насыщенный газ при постоянном объеме | 32°F (0°С) 77°F 90 190 (25°С) | 0.08887 БТЕ/фунт °F (0,372 кДж/кг К) 0,09303 БТЕ/фунт °F (0,3895 кДж/кг·К) | |
| Насыщенная жидкость | 32°F (0°С) 77°F 90 190 (25°С) | 0,2264 БТЕ/фунт °F (0,948 кДж/кг К) 0,2329 БТЕ/фунт °F (0,975 кДж/кг·К) | |
| Соотношение для насыщенного газа | Отношение удельной теплоемкости газа при постоянном давлении к удельной теплоемкости газа при постоянном объеме | 32°F (0°С) 77°F 90 190 (25°С) | 1.400 1,448 |
| Удельный объем | Объем единицы массы хлора при определенных условиях температуры и давления. | ||
| Газ | 32°F, 14,696 фунт/кв. дюйм абс. (0°C, 101,325 кПа) | 4,986 футов 3 /фунт (0,3113 м 3 /кг). | |
| Насыщенный газ | 32°F (0°С) | 1.310 футов 3 /фунт (0,08179 м 3 /кг). | |
| Насыщенная жидкость | 32°F (0°С) | 0,01092 фута 3 /фунт (0,0006818 м 3 /кг) | |
| Давление паров | Абсолютное давление газообразного хлора над жидким хлором, когда они находятся в равновесии | 32°F (0°С) 77°F 90 190 (25°С) | 53.51 фунтов на квадратный дюйм (368,9 кПа) 112,95 фунтов на квадратный дюйм (778,8 кПа) |
| Вязкость | Мера внутреннего молекулярного трения при движении молекул хлора | ||
| Насыщенный газ | 32°F (0°С) 60°F 90 190 (15,6°С) | 0,0125 сП (0.  0125 мПа·с) 0125 мПа·с) 0,0132 сП (0,0132 мПа·с) | |
| Жидкость | 32°F (0°С) 60°F 90 190 (15,6°С) | 0,3863 сП (0,3863 мПа·с) 0,3538 сП (0,3538 мПа·с) | |
Борид титана | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ.г. ТИ-Б-02 , ТИ-Б-03 , ТИ-Б-04 , TI-B-05
Номер CAS: 12045-63-5
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи:
Внутренний, Северная Америка: +1 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2.ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси
Классификация в соответствии с Регламентом (ЕС) № 1272/2008
Вещество не классифицируется как опасное для здоровья или окружающей среды в соответствии с регламентом CLP.
Классификация в соответствии с Директивой 67/548/ЕЕС или Директивой 1999/45/ЕС
Н/Д
Информация об особых опасностях для человека и окружающей среды:
Нет данных
Опасности, не классифицированные иначе
Нет данных
Элементы маркировки
Маркировка в соответствии с Регламентом (ЕС) № 1272/2008
Н/Д
Пиктограммы опасности
Н/Д
Сигнальное слово
Н/Д
Указания на опасность
Н/Д
Классификация WHMIS
Не контролируется
Система классификации
Рейтинги HMIS (шкала 0-рейтинги 4)
. :
Н/Д
vPvB:
Н/Д
РАЗДЕЛ 3.СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ
Вещества
Номер CAS / Название вещества:
12045-63-5 Титан борид
Идентификационный номер(а):
Номер ЕС:
234-961-4
Описание мер первой помощи
При вдыхании:
Обеспечить пострадавшего свежим воздухом. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.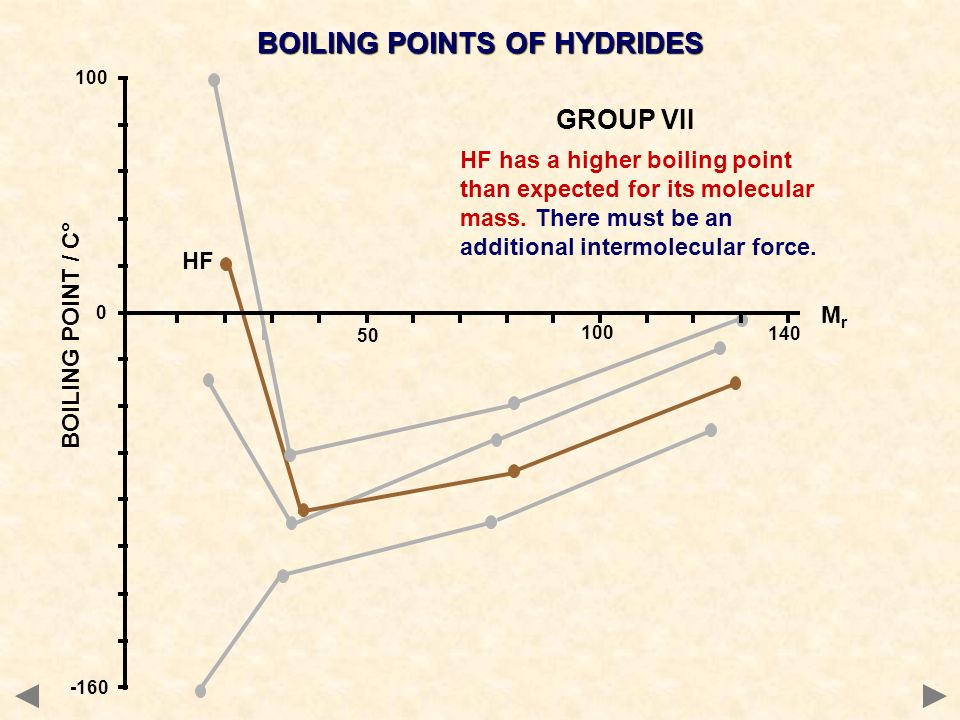
Немедленно обратитесь к врачу.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь к врачу.
При попадании в глаза:
Промыть открытые глаза в течение нескольких минут под проточной водой. Проконсультируйтесь с врачом.
При проглатывании:
Обратиться за медицинской помощью.
Информация для врача
Наиболее важные симптомы и эффекты, как немедленные, так и замедленные
Нет данных
Указание на необходимость немедленной медицинской помощи и специального лечения
Нет данных
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
Средства пожаротушения
Подходящие огнетушащие вещества
Продукт негорючий.Используйте меры пожаротушения, подходящие для окружающего огня.
Особые опасности, исходящие от вещества или смеси
Если этот продукт вовлечен в пожар, могут быть выделены следующие вещества:
Пары оксида металла
Оксид бора
Рекомендации для пожарных
Защитное снаряжение:
Надеть автономный респиратор.
Носите полностью защитный непроницаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры предосторожности для персонала, защитное снаряжение и порядок действий в чрезвычайных ситуациях
Использовать средства индивидуальной защиты.Держите незащищенных людей подальше.
Обеспечьте достаточную вентиляцию.
Меры предосторожности по охране окружающей среды:
Не допускайте попадания материала в окружающую среду без официального разрешения.
Не допускайте попадания продукта в канализацию, канализационные системы или другие водотоки.
Не допускайте проникновения материала в землю или почву.
Методы и материалы для локализации и очистки:
Собрать механически.
Предотвращение вторичных опасностей:
Никаких специальных мер не требуется.
Ссылка на другие разделы
См. Раздел 7 для информации о безопасном обращении
См. Раздел 8 для информации о средствах индивидуальной защиты.
Информацию об утилизации см. в Разделе 13.
в Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Информация о защите от взрывов и пожаров:
Продукт не воспламеняется
Условия для безопасного хранения, включая любые несовместимости
Требования, которым должны соответствовать складские помещения и емкости:
Особых требований нет.
Информация о хранении в одном общем хранилище:
Хранить вдали от окислителей.
Дополнительная информация об условиях хранения:
Хранить контейнер плотно закрытым.
Хранить в прохладном сухом месте в хорошо закрытых контейнерах.
Конкретное конечное использование
Данные отсутствуют
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Дополнительная информация о конструкции технических систем:
Правильно работающий химический вытяжной шкаф, предназначенный для опасных химических веществ и имеющий среднюю скорость потока при не менее 100 футов в минуту.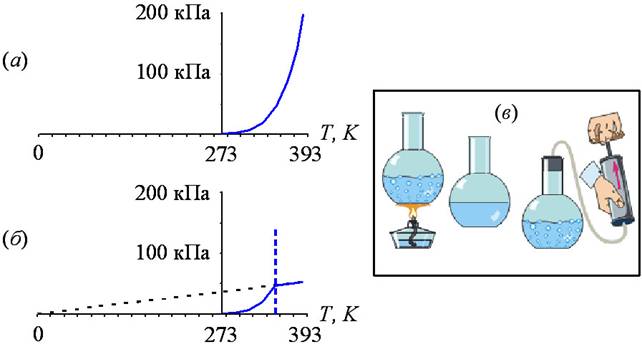
Параметры управления
Компоненты с предельными значениями, требующими контроля на рабочем месте:
Нет.
Дополнительная информация:
Нет данных
Средства контроля воздействия
Средства индивидуальной защиты
Соблюдайте стандартные меры защиты и гигиены при обращении с химическими веществами.
Хранить вдали от пищевых продуктов, напитков и кормов.
Немедленно снимите всю испачканную и зараженную одежду.
Мыть руки перед перерывами и по окончании работы.
Поддерживайте эргономически подходящую рабочую среду.
Дыхательное оборудование:
При наличии высоких концентраций используйте подходящий респиратор.
Защита рук:
Непроницаемые перчатки
Осмотрите перчатки перед использованием.
Пригодность перчаток должна определяться как материалом, так и качеством, последнее из которых может варьироваться в зависимости от производителя.
Время проницаемости материала перчаток (в минутах)
Данные отсутствуют
Защита глаз:
Защитные очки
Защита тела:
Защитная рабочая одежда
РАЗДЕЛ 9.
 ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА Информация об основных физических и химических свойствах
Внешний вид:
Форма: Порошок или твердое вещество в различных формах
Цвет: Серый
Запах: Без запаха
Порог восприятия запаха: Нет данных.
pH: нет данных
Точка плавления/диапазон плавления: 3225 °C (5837 °F)
Точка/диапазон кипения: данные отсутствуют
Температура сублимации/начало: данные отсутствуют
Воспламеняемость (твердое вещество, газ)
Нет данных доступный.
Температура воспламенения: Данные отсутствуют.
Температура разложения: Данные отсутствуют.
Самовоспламенение: Данные отсутствуют.
Опасность взрыва: Данные отсутствуют.
Пределы взрываемости:
Нижний: Данные отсутствуют
Верхний: Данные отсутствуют
Давление пара: неприменимо
Плотность при 20 °C (68 °F): 4,38 г/см 3 (36,551 фунт/гал)
Относительный плотность
Нет данных.
Плотность паров
Н/Д
Скорость испарения
Н/Д
Растворимость в воде (H 2 O): Нерастворим
Коэффициент распределения (н-октанол/вода): Данные отсутствуют.
Вязкость:
Динамическая: Н/Д
Кинематика: Н/Д
Другая информация
Нет данных
РАЗДЕЛ 10.СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность
Данные отсутствуют
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать:
Разложение не происходит, если используется и хранится в соответствии со спецификациями.
Возможность опасных реакций
Реагирует с сильными окислителями.
Условия, которых следует избегатьТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Информация о токсикологическом воздействии
Острая токсичность:
Реестр токсического воздействия химических веществ (RTECS) содержит данные об острой токсичности для компонентов этого продукта.
Значения LD/LC50, важные для классификации:
Нет данных
Раздражение или коррозия кожи:
Может вызывать раздражение
Раздражение или коррозия глаз:
Может вызывать раздражение
Повышение чувствительности:
Неизвестно о сенсибилизирующих эффектах.
Мутагенность зародышевых клеток:
Эффекты неизвестны.
Канцерогенность:
EPA-I: Данных недостаточно для оценки канцерогенного потенциала человека.
Репродуктивная токсичность:
Воздействие не известно.
Специфическая токсичность для системы органов-мишеней — повторное воздействие:
Неизвестно никаких эффектов.
Специфическая системная токсичность на орган-мишень — однократное воздействие:
О влиянии не известно.
Опасность при вдыхании:
Воздействие неизвестно.
От подострой до хронической токсичности:
Эффекты неизвестны.
Дополнительная токсикологическая информация:
Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна.
Раздел 12. Экологическая информация
Токсичность
Токсичность
Водная токсичность:
Нет данных:
Устойчивость и деградальность
Нет данных Доступны
Биоаккумулятивный потенциал
Нет данных Доступны
Мобильность в почве
Нет данных Доступны
Дополнительная экологическая информация:
Не допускать выброс материала в окружающую среду без официального разрешения.
Избегайте попадания в окружающую среду.
Результаты оценки PBT и vPvB
PBT:
н/д
vPvB:
н/д
Другие неблагоприятные эффекты
Нет данных
РАЗДЕЛ 13.СООБРАЖЕНИЯ ПО УТИЛИЗАЦИИ
Методы обработки отходов
Рекомендация
Ознакомьтесь с официальными правилами для обеспечения надлежащей утилизации.
Неочищенная упаковка:
Рекомендация:
Утилизация должна производиться в соответствии с официальными правилами.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, ADN, IMDG, IATA
N/A
Надлежащее отгрузочное наименование ООН
DOT, ADN, IMDG, IATA
N/A
Транспортный класс опасности190 90 DOT, ADR, ADN, IMDG, IATA
Class
N/A
Группа упаковки
DOT, IMDG, IATA
N/A
Опасности для окружающей среды: N/A
Особые меры предосторожности для пользователя
N/A
Приложение II к MARPOL73/78 и IBC Code
N/A
Транспорт/Дополнительная информация: DOT
Морской загрязнитель (DOT): №
РАЗДЕЛ 15.
 НОРМАТИВНАЯ ИНФОРМАЦИЯ
НОРМАТИВНАЯ ИНФОРМАЦИЯ Правила/законодательные акты по безопасности, охране здоровья и окружающей среды, относящиеся к данному веществу или смеси
Национальные правила
Все компоненты этого продукта перечислены в Реестре химических веществ Агентства по охране окружающей среды США.
Все компоненты этого продукта перечислены в Канадском перечне веществ для внутреннего потребления (DSL).
Раздел 313 SARA (списки конкретных токсичных химических веществ)
Вещество не указано.
California Proposition 65
Proposition 65 — Химические вещества, вызывающие рак
Вещество не указано.
Prop 65 — Токсичность для развития
Вещество не указано.
Предложение 65 — Токсичность для развития, женский пол
Вещество не указано.
Prop 65 — Токсичность для развития, мужчины
Вещество не указано.
Информация об ограничении использования:
Только для использования технически квалифицированными лицами.
Другие нормы, ограничения и запретительные нормы
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (ЕС) № 1907/2006.
Вещество не указано.
Необходимо соблюдать условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке и использования.
Вещество не указано.
Приложение XIV Регламента REACH (требуется разрешение на использование)
Вещество не указано.
REACH — Предварительно зарегистрированные вещества
Вещество указано.
Оценка химической безопасности:
Оценка химической безопасности не проводилась.
РАЗДЕЛ 16.ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКИЕ ПРАВА 1997-2021 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКИЕ ПРАВА 1997-2021 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Физические свойства ниобия | Admat Inc.
Ниобий представляет собой кристаллический металлический элемент серого цвета с высокой термостойкостью и другими желаемыми для производителей свойствами. Чаще всего он используется при создании многочисленных металлических сплавов. Небольшие количества ниобия (всего 0.1%) может значительно улучшить эксплуатационные характеристики металла. Admat Inc. предлагает продукты из чистого, сплава и оксида ниобия в различных формах, включая листы, пластины, стержни, проволоку, трубы, полосы, фольгу и оксиды.
Преимущества ниобия
Ниобий известен своей превосходной стойкостью к коррозии и окислению. При воздействии воздуха и влаги образуется прочный слой оксида ниобия. Этот слой действует как защитный барьер, блокируя проникновение дополнительного воздуха и влаги и, как следствие, предотвращая возникновение дальнейшей коррозии.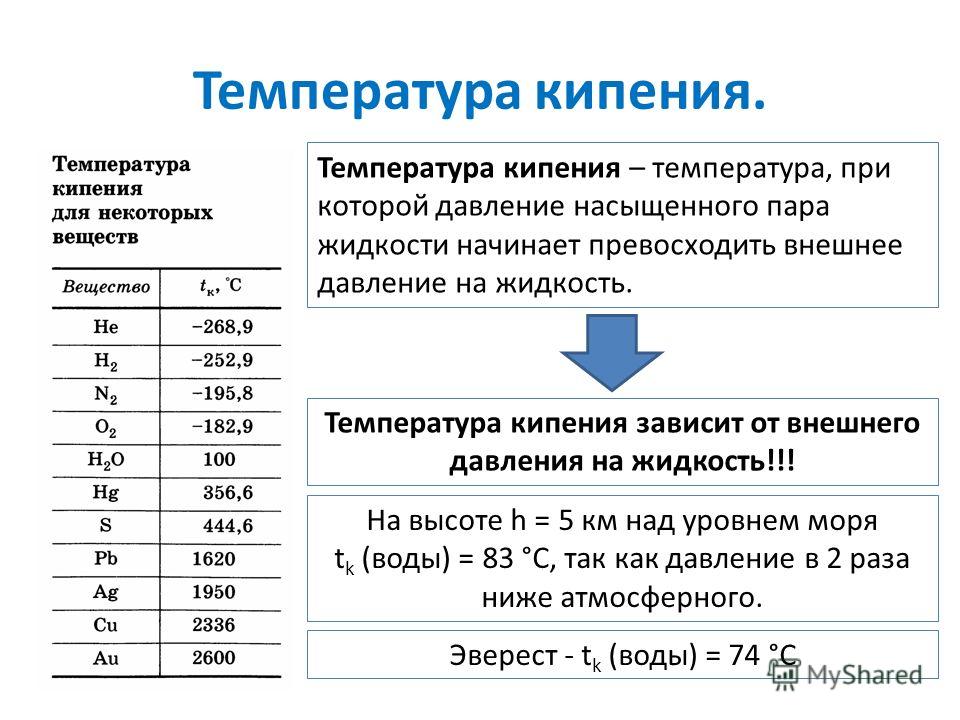
Ниобий — один из пяти тугоплавких металлов; это означает, что он обладает высокой устойчивостью к экстремальным температурам и износу. Его температура плавления 4491 ° F (2477 ° C) делает этот металл и его сплавы идеальными для применения в условиях высокого давления и высоких температур. Несмотря на относительно высокую температуру плавления ниобия, его плотность является самой низкой среди всех тугоплавких металлов, что делает его привлекательным для авиационной промышленности и производства реактивных двигателей.
Ниобий также часто используется для изготовления ювелирных изделий из-за его пластичности, твердости, коррозионной стойкости и гипоаллергенных свойств.Его также можно легко анодировать, чтобы создать множество привлекательных переливающихся цветов.
К другим полезным характеристикам ниобия относятся его сильные сплавляющие и сверхпроводящие свойства, которые необходимы в ряде приложений.
Применение ниобия
Некоторые из наиболее распространенных применений этого элемента включают:
- Производство стали.
 Ниобий обычно используется при микролегировании сталей HSLA для автомобильной и нефтехимической промышленности. Хоть 0.1% этого металла может значительно повысить прочность и стабильность конструкционной стали. Сплавы ниобия и стали часто используются в автомобильной листовой стали и нефте- и газопроводах. Суперсплавы
Ниобий обычно используется при микролегировании сталей HSLA для автомобильной и нефтехимической промышленности. Хоть 0.1% этого металла может значительно повысить прочность и стабильность конструкционной стали. Сплавы ниобия и стали часто используются в автомобильной листовой стали и нефте- и газопроводах. Суперсплавы - . Суперсплавы представляют собой сплавы с высокими эксплуатационными характеристиками, которые обладают исключительной механической прочностью, сопротивлением термической ползучести, стабильностью поверхности и коррозионной стойкостью. В жаропрочных сплавах на основе никеля, кобальта и железа может использоваться до 6,5% ниобия. Эти сплавы особенно полезны в аэрокосмической промышленности для производства компонентов реактивных двигателей, которые могут работать при температурах, превышающих 1832°F (1000°C).
- Сверхпроводящие магниты — при охлаждении ниже температуры перехода ниобия его сопротивление становится незначительным. Специальные ниобиевые сплавы используются в качестве сверхпроводящих проводов типа II для сверхпроводящих магнитов.
 Эти магниты являются важными компонентами оборудования для магнитно-резонансной томографии, используемого в медицинской промышленности.
Эти магниты являются важными компонентами оборудования для магнитно-резонансной томографии, используемого в медицинской промышленности.
Свойства ниобия
Вот некоторые из основных свойств ниобия:
- Символ – Nb
- Номер – 41
- Плотность – 8.57 г/см3
- Атомный вес – 92,906 г/моль
- Кристаллическая структура – объемно-центрированная кубическая
- Точка плавления – 2750 К, 2477°С, 4491°F
- Температура кипения – 5017 К, 4744°С, 8571°F
- Удельное электрическое сопротивление – (0 °C) 152 нОм·м
- Теплопроводность – (300 K) 53,7 Вт·м−1K−1
- Тепловое расширение – 7,3 мкм/(м·K)
Ниобиевые изделия для вашего проекта
Если вы хотите узнать больше о ниобиевых продуктах Admat и о том, как их можно использовать в вашем приложении, свяжитесь напрямую с нашей технической командой или запросите предложение сегодня.
.

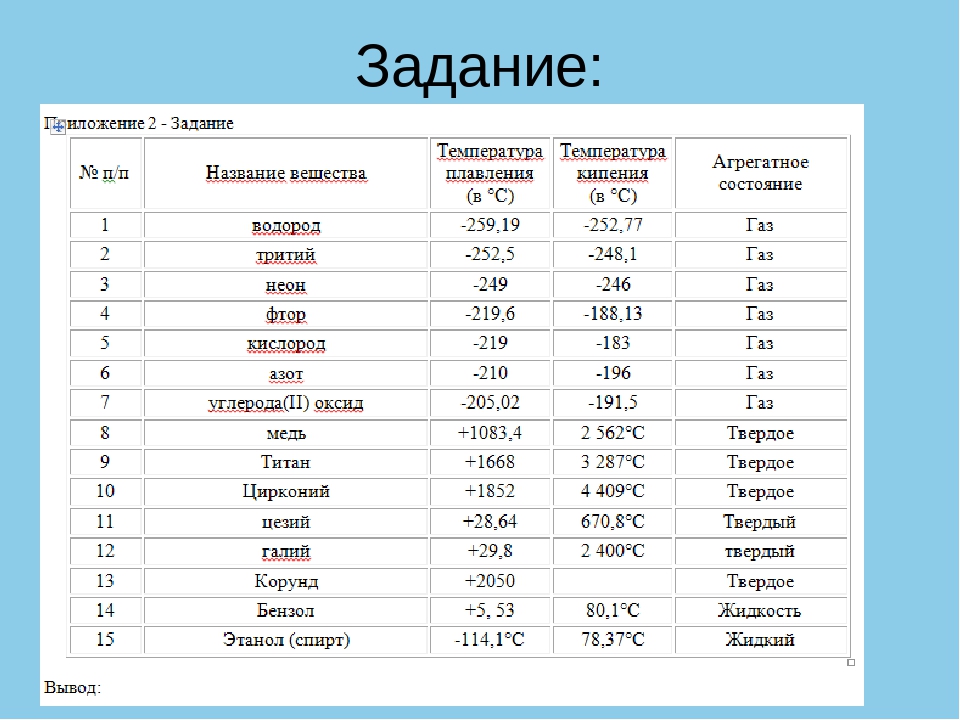 д.
д.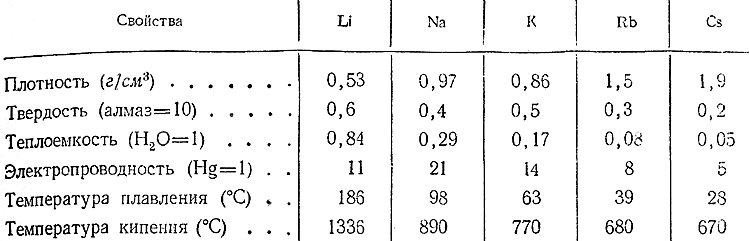
.png)


 С. Теплофизические свойства материалов ядерной техники. М.: Атомиздат, 1967. — 474 с.
С. Теплофизические свойства материалов ядерной техники. М.: Атомиздат, 1967. — 474 с.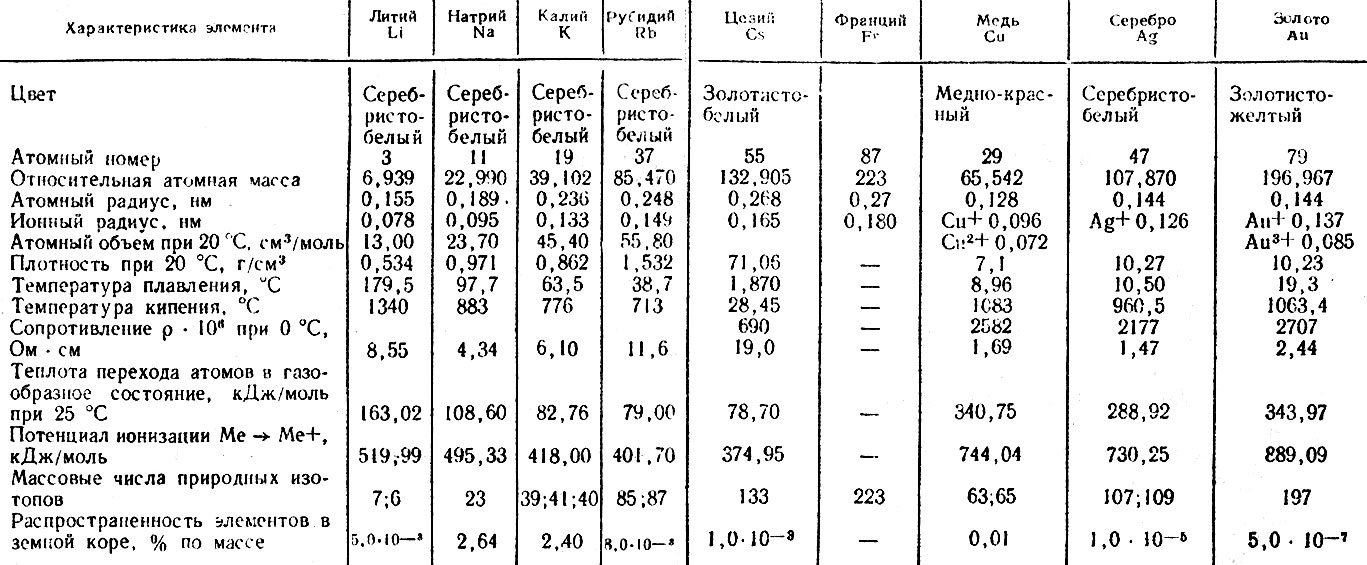

 Ниобий обычно используется при микролегировании сталей HSLA для автомобильной и нефтехимической промышленности. Хоть 0.1% этого металла может значительно повысить прочность и стабильность конструкционной стали. Сплавы ниобия и стали часто используются в автомобильной листовой стали и нефте- и газопроводах.
Ниобий обычно используется при микролегировании сталей HSLA для автомобильной и нефтехимической промышленности. Хоть 0.1% этого металла может значительно повысить прочность и стабильность конструкционной стали. Сплавы ниобия и стали часто используются в автомобильной листовой стали и нефте- и газопроводах. Эти магниты являются важными компонентами оборудования для магнитно-резонансной томографии, используемого в медицинской промышленности.
Эти магниты являются важными компонентами оборудования для магнитно-резонансной томографии, используемого в медицинской промышленности.