Подгруппа титана — Википедия
Подгру́ппа тита́на — химические элементы 4-й группы таблицы Менделеева (по устаревшей классификации — элементы побочной подгруппы IV группы)[1]. По номенклатуре ИЮПАК подгруппа титана содержит в себе титан, цирконий, гафний и резерфордий.
Первые три элемента данной подгруппы находятся в природе в заметных количествах. Они относятся к тугоплавким металлам. Последний представитель — резерфордий — радиоактивный элемент. У него нет стабильных изотопов. Его физические и химические свойства не изучены.
Содержание
- 1 Свойства
- 1.1 Химические свойства
- 1.2 Физические свойства
- 2 История
- 3 Получение
- 4 Нахождение в природе
- 4.1 В организмах
- 5 Применение
- 6 Опасность применения
- 7 Примечания
- 8 Для дополнительного чтения
- 9 Ссылки
Химические свойстваПравить
|
|
|
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Большинство химических свойств было изучено только для первых трёх элементов данной подгруппы.
Как четырёхвалентные элементы образуют различные неорганические соединения, как правило в степени окисления +4. Были получены данные, говорящие об их устойчивости к щелочам. С галогенами образуют соответствующие тетрагалогениды с общей формулой MHal4 (где М: Ti, Zr и Hf). При более высоких температурах реагируют с кислородом, азотом, углеродом, бором, кремнием и серой. Вероятно из-за лантаноидного сжатия, гафний и цирконий имеют практически одинаковые ионные радиусы. Ионный радиус Zr+4 составляет 79 пм, а Hf
Сходство ионных радиусов приводит к образованию схожих по своим свойствам химических соединений[3]. Химия гафния настолько схожа с химией циркония, что их можно различить лишь по физическим свойствам. Основными различиями между двумя элементами следует считать температуру плавления и кипения и растворимость в растворителях[2].
Химия гафния настолько схожа с химией циркония, что их можно различить лишь по физическим свойствам. Основными различиями между двумя элементами следует считать температуру плавления и кипения и растворимость в растворителях[2].
Физические свойстваПравить
Этот раздел не завершён. Вы поможете проекту, исправив и дополнив его. |
| Наименование | Титан | Цирконий | Гафний | Резерфордий |
|---|---|---|---|---|
| Температура плавления | 1941 K (1668 °C) | 2130 K (1857 °C) | 2506 K (2233 °C) | ? |
| Температура кипения | 3560 K (3287 °C) | 4682 K (4409 °C) | 4876 K (4603 °C) | ? |
| Плотность | 4,507 г·см−3 | 6,511 г·см−3 | 13,31 г·см−3 | ? |
| Цвет | серебристо-металлический | серебристо-белый | серебристо-серый | ? |
| Атомный радиус | 140 пм | 155 пм | 155 пм | ? |
Брусок титана
Цирконий
Брусок гафния
Слитки гафния
Цирконий и титан были изучены в XVII веке, в то время как гафний был открыт только в 1923 году.
Вильям Грегор (англ.), Франц-Йозеф Мюллер фон Рейхенштейн (англ.) и Мартин Генрих Клапрот независимо друг от друга обнаружили титан в 1791 и 1795 гг. Клапрот назвал элемент титаном, в честь персонажей греческой мифологии[5]. Также Клапрот обнаружил цирконий в его минеральной форме: циркон, и назвал новый элемент Цирконердом. Существование гафния было предсказано великим русским химиком Д. И. Менделеевым в 1869 году. Генри Мозли посредством рентгеноспектрального анализа вычислил атомный номер гафния — он оказался равен 72. После обнаружения нового элемента Дирк Костер и Дьёрдь де Хевеши первыми принялись за поиски гафния в циркониевых рудах[6]. После его нахождения гафний был изучен двумя первооткрывателями в 1923 году для проверки предсказания Менделеева [7].
По сообщениям, резерфордий был открыт в 1966 году в объединённом институте ядерных исследований в Дубне. Для получения элемента ядра 242Pu бомбардировались ускоренными ядрами 22Ne. Элемент после бомбардировки отделялся с помощью градиентной термохроматографии после реакции с ZrCl4[8]:
- 242
94Pu + 22
10Ne → 264−x
104Rf → 264−x
104RfCl4
Производство данных металлов трудно в связи с их реакционной способностью. Образование нитридов, карбидов и оксидов не позволяет получать годные к применению металлы. Этого можно избежать, применяя процесс Кролла (англ.). Оксиды (MO2) реагируют с углём и хлором, образуя тетрахлориды металлов (MCl4). Затем соли реагируют с магнием, в результате чего получаются очищенные металлы и хлорид магния:
- MO2 + C(кокс) + Cl2 → MCl4 + 2Mg → M + 2MgCl2
Дальнейшая очистка получается химическим переносом (англ.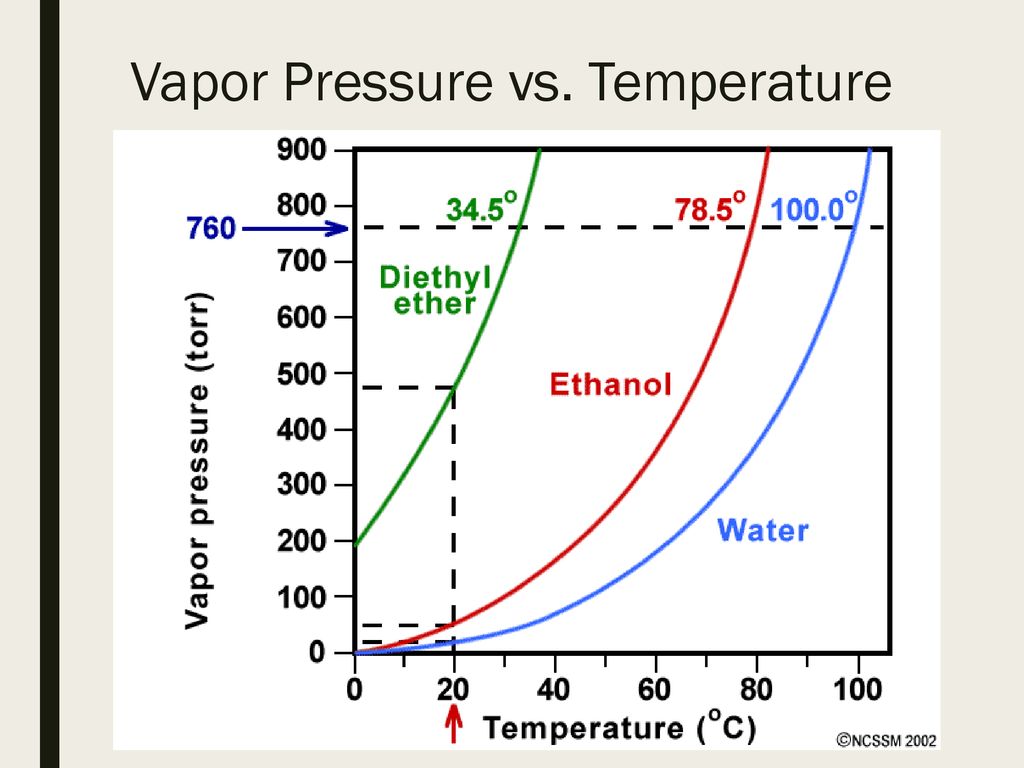 {\circ }C}}M+2I_{2}}}}
{\circ }C}}M+2I_{2}}}}
Нахождение в природеПравить
Нахождение в природе элементов данной группы уменьшается с увеличением атомной массы. Титан является седьмым по распространению элементов на Земле. Его распространенность примерно равна 6320 частей на миллион, в то время как у циркония 162, а у гафния всего 3[10].
Минералами титана являются анатаз и рутил, циркония — циркон, гафний может находиться в незначительном количестве в цирконе. Самыми большими странами-добытчиками являются Австралия, Северная Африка и Канада[11][12][13][14].
В организмахПравить
Элементы данной группы не участвуют в биохимических процессах живых организмов [15]. Химические соединения с этими элементами в большинстве случаев нерастворимы. Титан является одним из немногих d-элементов с неясной биологической ролью в организме. Радиоактивность резерфордия делает его токсичным для живых организмов.
Титан и его сплавы находят своё применение там, где требуются коррозионная стойкость, тугоплавкость и легкость материала. Гафний и цирконий применяются в ядерных реакторах. Гафний имеет высокое сечение захвата тепловых нейтронов, в то время как цирконий — наоборот. Из-за этого свойства цирконий в виде сплавов применяется в качестве облицовки ядерных стержней (ТВЭЛ) в ядерных реакторах[16], в то время как гафний применяется в управляющих стержнях ядерного реактора[17][18].
Гафний и цирконий применяются в ядерных реакторах. Гафний имеет высокое сечение захвата тепловых нейтронов, в то время как цирконий — наоборот. Из-за этого свойства цирконий в виде сплавов применяется в качестве облицовки ядерных стержней (ТВЭЛ) в ядерных реакторах[16], в то время как гафний применяется в управляющих стержнях ядерного реактора[17][18].
Малые количества гафния[19] и циркония применяются в сплавах обоих элементов для улучшения их свойств
Опасность примененияПравить
Титан не является токсичным для человеческого организма в любых дозах[15]. Мелкодисперсный цирконий вызывает раздражение при попадании на кожу, при попадании в глаза может потребоваться медицинская помощь[21]. В США ПДК циркония в рабочих помещениях составляет 5 мг/м³, а короткосрочное содержание не более 10 мг/м³[22]. О токсикологических свойствах гафния известно немного[23].
- ↑ Таблица Менделеева Архивная копия от 17 мая 2008 на Wayback Machine на сайте ИЮПАК
- ↑ 1 2 3 4 Arnold F.
 , Holleman. Lehrbuch der Anorganischen Chemie / Wiberg, Egon; Wiberg, Nils. — 91—100. — Берлин: Walter de Gruyter, 1985. — С. 1056—1057. — ISBN 3110075113.
, Holleman. Lehrbuch der Anorganischen Chemie / Wiberg, Egon; Wiberg, Nils. — 91—100. — Берлин: Walter de Gruyter, 1985. — С. 1056—1057. — ISBN 3110075113. - ↑ 1 2 Hafnium (англ.). Los Alamos National Laboratory (Last Updated: 12/15/2003). Дата обращения: 21 октября 2010. Архивировано 14 января 2001 года.
- ↑ Barksdale, Jelks. Titanium // The Encyclopedia of the Chemical Elements. — Illinois: Reinhold Book Corporation, 1968. — С. 732—738.
- ↑ Weeks, Mary Elvira. Some Eighteenth-Century Metals (англ.) // Журнал Chemical Education : статья. — 1932. — P. 1231–1243.
- ↑ Urbain, M. G. Sur les séries L du lutécium et de l’ytterbium et sur l’identification d’un celtium avec l’élément de nombre atomique 72 (фр.) // Журнал Comptes rendus : статья.
 — 1922. — Livr. 174. — P. 1347–1349.
— 1922. — Livr. 174. — P. 1347–1349. - ↑ Coster, D.
- ↑ Barber, R. C. Discovery of the transfermium elements. Part II: Introduction to discovery profiles. Part III: Discovery profiles of the transfermium elements (англ.) // Greenwood, N. N.; Hrynkiewicz, A. Z.; Jeannin, Y. P.; Lefort, M.; Sakai, M.; Ulehla, I.; Wapstra, A. P.; Wilkinson, D. H. Журнал Pure and Applied Chemistry : статья. — 1993. — Iss. 65, no. 8. — P. 1757–1814. — doi:10.1351/pac199365081757.
- ↑ van Arkel, A. E.; de Boer, J. H. Darstellung von reinem Titanium-, Zirkonium-, Hafnium- und Thoriummetall (нем.) // Журнал Zeitschrift für anorganische und allgemeine Chemie : статья. — 1925. — H. 148, Nr.
 1. — S. 345–350. — doi:10.1002/zaac.19251480133.
1. — S. 345–350. — doi:10.1002/zaac.19251480133. - ↑ Abundance in Earth’s Crust (англ.) (недоступная ссылка). WebElements.com. Дата обращения: 21 октября 2010. Архивировано 23 мая 2008 года.
- ↑ Dubbo Zirconia Project Fact Sheet (англ.) (PDF) (недоступная ссылка). Alkane Resources Limited (June 2007). Дата обращения: 21 октября 2010. Архивировано 2 июля 2012 года.
- ↑ Zirconium and Hafnium (англ.) (PDF) 192–193. US Geological Survey (January 2008). Дата обращения: 21 октября 2010. Архивировано 2 июля 2012 года.
- ↑ Minerals Yearbook Commodity Summaries 2009: Titanium (англ.) (PDF). US Geological Survey (May 2009). Дата обращения: 21 октября 2010. Архивировано 2 июля 2012 года.

- ↑ Gambogi, Joseph Titanium and Titanium dioxide Statistics and Information (англ.). US Geological Survey (January 2009). Дата обращения: 21 октября 2010. Архивировано 2 июля 2012 года.
- ↑ 1 2 Emsley, John. Titanium // Nature’s Building Blocks: An A-Z Guide to the Elements. — Oxford, England, UK: Oxford University Press, 2001. — С. 457–456. — ISBN 0198503407.
- ↑ Schemel, J. H. ASTM Manual on Zirconium and Hafnium. — ASTM International, 1977. — С. 1–5. — 96 с. — ISBN 9780803105058.
- ↑ Hedrick, James B. Hafnium (англ.) (PDF). United States Geological Survey. Дата обращения: 21 октября 2010. Архивировано 2 июля 2012 года.
- ↑ Reactive Metals. Zirconium, Hafnium, and Titanium (англ.
 ) // Industrial and Engineering Chemistry : статья. — 1961. — Iss. 53, no. 2. — P. 97–104. — doi:10.1021/ie50614a019.
) // Industrial and Engineering Chemistry : статья. — 1961. — Iss. 53, no. 2. — P. 97–104. — doi:10.1021/ie50614a019. - ↑ Hebda, John Niobium alloys and high Temperature Applications (англ.) (PDF) (недоступная ссылка). CBMM (2001). Дата обращения: 21 октября 2010. Архивировано 2 июля 2012 года.
- ↑ Matthew J. Donachie, Stephen James Donachie. Superalloys. — ASTM International, 2002. — С. 235–236. — 439 с. — ISBN 9780871707499.
- ↑ International Chemical Safety Cards (англ.). International Labour Organization (October 2004). Дата обращения: 21 октября 2010. Архивировано 2 июля 2012 года.
- ↑ Zirconium Compounds (англ.). National Institute for Occupational Health and Safety (2007). Дата обращения: 21 октября 2010. Архивировано 2 июля 2012 года.

- ↑ Occupational Safety & Health Administration: Hafnium (англ.) (недоступная ссылка). U.S. Department of Labor. Дата обращения: 21 октября 2010. Архивировано 8 марта 2002 года.
Для дополнительного чтенияПравить
- Третьяков Ю. Д. и др. Неорганическая химия / Ред.: Белан Г. И. — Учебник для вузов в двух книгах. — М.: «Химия», 2001. — Т. 1. — 472 с. — (Химия элементов). — 1000 экз. — ISBN 5-7245-1213-0.
- Голуб А. М. Общая и неорганическая химия = Загальна та неорганична хімiя. — Вища школа, 1971. — Т. 2. — 416 с. — 6700 экз.
- Шека И. А., Карлышева К. Ф. Химия гафния. — Киев: «Наукова думка», 1973. — 451 с. — 1000 экз.
- Гринвуд Н. Н., Эрншо А. Титан, цирконий, гафний // Химия элементов = Chemistry of the elements / Пер. с англ. ред. кол. — Учебное пособие. — М.
 : Бином. Лаборатория знаний, 2008. — Т. 2. — С. 293. — 607 с. — (Лучший зарубежный учебник. В 2-х томах). — 2000 экз. — ISBN 978-5-94774-373-9.
: Бином. Лаборатория знаний, 2008. — Т. 2. — С. 293. — 607 с. — (Лучший зарубежный учебник. В 2-х томах). — 2000 экз. — ISBN 978-5-94774-373-9.
Титан
| Титан | |
|---|---|
| Атомный номер | 22 |
| Внешний вид простого вещества | |
| Свойства атома | |
|
Атомная масса (молярная масса) |
47,88 а. е. м. (г/моль) |
| Радиус атома | 147 пм |
|
Энергия ионизации (первый электрон) |
657,8(6,82) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d2 4s2 |
| Химические свойства | |
| Ковалентный радиус | 132 пм |
| Радиус иона | (+4e)68 (+2e)94 пм |
|
Электроотрицательность (по Полингу) |
1,54 |
| Электродный потенциал | -1,63 |
| Степени окисления | 4, 3 |
| Термодинамические свойства простого вещества | |
| Плотность | 4,54 г/см? |
| Молярная теплоёмкость | 25,1 Дж/(K·моль) |
| Теплопроводность |
21. 9 Вт/(м·K) 9 Вт/(м·K) |
| Температура плавления | 1933 K |
| Теплота плавления | 18.8 кДж/моль |
| Температура кипения | 3560 K |
| Теплота испарения | 422,6 кДж/моль |
| Молярный объём | 10,6 см3/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
гексагональная плотноупакованная (?-Ti) |
| Параметры решётки | a=2,951 с=4,697 (?-Ti) A |
| Отношение c/a | 1,587 |
| Температура Дебая | 380 K |
| Ti | 22 |
| 47,88 | |
| [Ar]3d24s2 | |
| Титан | |
Титан — элемент побочной подгруппы четвёртой группы, четвёртого периода периодической системы химических элементов, с атомным номером 22. Обозначается символом Ti (лат. Titanium). Простое вещество титан (CAS-номер: 7440-32-6) — лёгкий металл серебристо-белого цвета. Существует в двух кристаллических модификациях: ?-Ti с гексагональной плотноупакованной решёткой, -Ti с кубической объёмно-центрированной упаковкой, температура перехода α↔β 883 °C
Обозначается символом Ti (лат. Titanium). Простое вещество титан (CAS-номер: 7440-32-6) — лёгкий металл серебристо-белого цвета. Существует в двух кристаллических модификациях: ?-Ti с гексагональной плотноупакованной решёткой, -Ti с кубической объёмно-центрированной упаковкой, температура перехода α↔β 883 °C
История открытия элемента Титан
Схема атома титана
Открытие TiO2 сделали практически одновременно и независимо друг от друга англичанин У. Грегор и немецкий химик М. Г. Клапрот. У. Грегор, исследуя состав магнитного железистого песка (Крид, Корнуолл, Англия, 1789), выделил новую «землю» (окись) неизвестного металла, которую назвал менакеновой. В 1795 г. немецкий химик Клапрот открыл в минерале рутиле новый элемент и назвал его титаном. Спустя два года Клапрот установил, что рутил и менакеновая земля — окислы одного и того же элемента, за которым и осталось название «титан», предложенное Клапротом. Через 10 лет открытие титана состоялось в третий раз. Французский учёный Л. Воклен обнаружил титан в анатазе и доказал, что рутил и анатаз — идентичные окислы титана.
Французский учёный Л. Воклен обнаружил титан в анатазе и доказал, что рутил и анатаз — идентичные окислы титана.
Первый образец металлического титана получил в 1825 году Й. Я. Берцелиус. Из-за высокой химической активности титана и сложности его очистки чистый образец Ti получили голландцы А. ван Аркел и И. де Бур в 1925 термическим разложением паров иодида титана TiI4.
Происхождение названия
Металл получил своё название в честь титанов, персонажей древнегреческой мифологии, детей Геи. Название элементу дал Мартин Клапрот, в соответствии со своими взглядами на химическую номенклатуру в противоход французской химической школе, где элемент старались называть по его химическим свойствам. Поскольку немецкий исследователь сам отметил невозможность определения свойств нового элемента только по его оксиду, он подобрал для него имя из мифологии, по аналогии с открытым им ранее ураном.
Однако согласно другой версии, публиковавшейся в журнале «Техника-Молодежи» в конце 80-х, новооткрытый металл обязан своим именем не могучим титанам из древнегреческих мифов, а Титании — королеве фей в германской мифологии (жена Оберона в шекспировском «Сне в летнюю ночь»). Такое название связано с необычайной «лёгкостью» (малой плотностью) металла.
Такое название связано с необычайной «лёгкостью» (малой плотностью) металла.
Нахождение в природе
Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре 0,57 % по массе. В свободном виде не встречается. Известно более 100 минералов, содержащих титан. Важнейшие из них: рутил TiO2, ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит CaTiO3, титанит CaTiOSiO4, танталит (Fe,Mn)2+Ta2O6 и манганотанталит MnT2O6. Различают коренные руды титана — ильменит-титаномагнетитовые и россыпные — рутил-ильменит-цирконовые.
Запасы и добыча
Основные руды: ильменит (FeTiO3), рутил (TiO2), титанит (CaTiSiO5).
На 2002 год, 90 % добываемого титана использовалось на производство диоксида титана TiO2. Мировое производство диоксида титана составляло 4,5 млн т. в год. Подтвержденные запасы диоксида титана (без России) составляют около 800 млн т.[2]. На 2006 год, по оценке Геологической службы США, в пересчёте на диоксид титана и без учёта России, запасы ильменитовых руд составляют 603—673 млн т., а рутиловых — 49.7—52.7 млн т. При современных темпах добычи мировых разведанных запасов титана (без учёта России) хватит более чем на 150 лет.
в год. Подтвержденные запасы диоксида титана (без России) составляют около 800 млн т.[2]. На 2006 год, по оценке Геологической службы США, в пересчёте на диоксид титана и без учёта России, запасы ильменитовых руд составляют 603—673 млн т., а рутиловых — 49.7—52.7 млн т. При современных темпах добычи мировых разведанных запасов титана (без учёта России) хватит более чем на 150 лет.
Россия обладает вторыми в мире, после Китая, запасами титана. Минерально-сырьевую базу титана России составляют 20 месторождений (из них 11 коренных и 9 россыпных), достаточно равномерно рассредоточенных по территории страны. Самое крупное из разведанных месторождений находится в 25 км от города Ухта (Республика Коми). Запасы месторождения оцениваются в 2 миллиарда тонн.
Крупнейший в мире производитель титана — российская компания «ВСМПО-АВИСМА».
Получение
Брусок кристаллического титана (чистота 99,995 %, вес ?283 г, длина ?14 см, диаметр ?25 мм), изготовленный на заводе «Уралредмет» иодидным методом ван Аркеля и де Бура
Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4: TiO2 + 2C + 2Cl2 =TiCl4 + 2CO
Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4: TiO2 + 2C + 2Cl2 =TiCl4 + 2CO
Образующиеся пары TiCl4 при 850 °C восстанавливают Mg: TiCl4+ 2Mg = 2MgCl2+ Ti
Полученную титановую «губку» переплавляют и очищают. Ильменитовые концентраты восстанавливают в электродуговых печах с последующим хлорированием возникающих титановых шлаков. Рафинируют титан иодидным способом или электролизом, выделяя Ti из TiCl4. Для получения титановых слитков применяют дуговую, электроннолучевую или плазменную переработку.
Физические свойства
Титан — легкий серебристо-белый металл. Существует в двух кристаллических модификациях: ?-Ti с гексагональной плотноупакованной решёткой (a=2,951 A; с=4,697 A; z=2; пространственная группа C6mmc), ?-Ti с кубической объёмноцентрированной упаковкой (a=3,269 A; z=2; пространственная группа Im3m), температура перехода ?-? 883 °C, ?H перехода 3,8 кДж/моль. Точка плавления 1671 °C, точка кипения 3260 °C, плотность ?-Ti и ?-Ti соответственно равна 4,505 (20 °C) и 4,32 (900 °C) г/см?, атомная плотность 5,71×1022 ат/см³. Пластичен, сваривается в инертной атмосфере.
Точка плавления 1671 °C, точка кипения 3260 °C, плотность ?-Ti и ?-Ti соответственно равна 4,505 (20 °C) и 4,32 (900 °C) г/см?, атомная плотность 5,71×1022 ат/см³. Пластичен, сваривается в инертной атмосфере.
Имеет высокую вязкость, при механической обработке склонен к налипанию на режущий инструмент, и поэтому требуется нанесение специальных покрытий на инструмент, различных смазок.
При обычной температуре покрывается защитной пассивирующей пленкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной).
Титановая пыль имеет свойство взрываться. Температура вспышки 400°С.
Химические свойства
Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок горит на воздухе.
Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF,H3PO4 и концентрированной H2SO4).
Легко реагирует даже со слабыми кислотами в присутствии комплексообразователей, например, с плавиковой кислотой HF он взаимодействует благодаря образованию комплексного аниона [TiF6]2-.
При нагревании на воздухе до 1200°C Ti загорается с образованием оксидных фаз переменного состава TiOx. Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2. Гидроксид TiO(OH)2·xH2O и диоксид TiO2амфотерны.
TiO2 взаимодействует с серной кислотой при длительном кипячении. При сплавлении с содой Na2CO3 или поташом K2CO3 оксид TiO2 образует титанат: TiO2+K2CO3=K2TiO3+CO2.
При нагревании Ti взаимодействует с галогенами. Тетрахлорид титана TiCl4 при обычных условиях — желтоватая, сильно дымящая на воздухе жидкость, что объясняется сильным гидролизом TiCl4 содержащимися в воздухе парами воды и образованием мельчайших капелек HCl и взвеси гидроксида титана.
Восстановлением TiCl4водородом, Al, Si, другими сильными восстановителями, получен трихлорид и дихлорид титана TiCl3 и TiCl2 — твердые вещества с сильно восстановительными свойствами. Ti взаимодействует с Br2 и I2.
Ti взаимодействует с Br2 и I2.
С N2 выше 400 °C титан образует нитрид TiNx(x=0,58-1,00). При взаимодействии титана с C образуется карбид титана TiCx (x=0,49-1,00).
При нагревании Ti поглощает H2 с образованием соединения переменного состава TiHх (x=1,0). При нагревании эти гидриды разлагаются с выделением H2. Титан образует сплавы со многими металлами.
Применение
Часы из титанового сплава
В виде сплавов
- Металл применяется в химической промышленности (реакторы, трубопроводы, насосы), лёгких сплавах, остеопротезах. Является важнейшим конструкционным материалом в авиа-, ракето-, кораблестроении.
- Используется в художественном литье[5]
- Титан является легирующей добавкой в некоторых марках стали.
-
Нитинол (никель-титан) — сплав, обладающий памятью формы, применяемый в медицине и технике.

- Алюминиды титана являются очень стойкими к окислению и жаропрочными, что в свою очередь определило их использование в авиации и автомобилестроении в качестве конструкционных материалов.
В виде соединений
- Белый диоксид титана (TiO2) используется в красках (например, титановые белила), а также при производстве бумаги и пластика. Пищевая добавка E171.
- Титанорганические соединения (напр. тетрабутоксититан) применяются в качестве катализатора и отвердителя в химической и лакокрасочной промышленности.
- Неорганические соединения титана применяются в химической электронной, стекловолоконной промышленности в качестве добавки или покрытий.
- Диборид титана — важный компонент сверхтвердых материалов для обработки металлов.
- Нитрид титана применяется для покрытия инструментов.
-
Титанат бария BaTiO3, титанат свинца PbTiO3 и ряд других титанатов —- сегнетоэлектрики.

Анализ рынков потребления
В 2005 компания Titanium Corporation опубликовала следующую оценку потребления титана в мире:
60 % — краска;
20 % — пластик;
13 % — бумага;
7 % — машиностроение.
Цены
15-25 $ за килограмм, в зависимости от чистоты.
Чистота и марка чернового титана (титановой губки) обычно определяется по степени её пластичности.
Физиологическое действие
Нитрид титана
Соединения титана
СПЕЦИФИКАЦИЯ диоксида титана
ОПИСАНИЕ
Химическая формула: TiО2 оксид титана (IV)
Химическая структура: анатазная форма (тетрагональная сингония)
Молекулярная масса: 79,88 г/моль
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Внешний вид: порошок
Цвет: белый
Запах: отсутствует
Удельная плотность: 3,8 г/см3
Показатель преломления: 2,5 (прибл. )
)
Цветовой индекс: 77891 (пигмент белый 6)
Температура плавления: 1843 °С
Температура кипения: 2972 °С
Растворимость: практически не растворим в воде
ТОКСИКОЛОГИЯ
CAS# 13463-67-7 Не опасен
PRETIOX AV-01-FG одобрен немецким институтом ISEGA для использования в продуктах питания и косметике. Соответствие стандартам европейской и американской фармакопеи по микробиологическим показателям подтверждается Немецким институтом FRESENIUS.
ПРИМЕНЕНИЕ
Пигментация продуктов питания, фармацевтики, косметики и т.д.
Продукты питания: как пищевая добавка Е 171 в конфеты, жевательную резинку, кофе и др.
Фармацевтика: краситель для капсул, гранул, таблеток, лейкопластыря.
Косметика: средства макияжа, лаки, зубные пасты, мыла и др.
Другие области применения: папиросная бумага, продукты для домашних животных.
ХРАНЕНИЕ и ОБРАЩЕНИЕ
Диоксид титана PRETIOX AV-01-FG стабилен при нормальных условиях и инертен по отношению к большинству химических веществ. Пожаро- и взрывобезопасен. Не подвергается термодеструкции.
Диоксид титана вообще не классифицируется как опасный для здоровья человека или окружающей среды, а также безопасен при транспортировке.
Хранить в закрытой упаковке; в прохладном, сухом, хорошо проветриваемом помещении.
При нарушении целостности упаковки собрать материал в приспособленный для этого контейнер. Избегайте распыления. Обеспечьте вентиляцию.
Дополнительная информация по безопасности жизнедеятельности представлена в Паспорте безопасности данного продукта.
УПАКОВКА
двойные бумажные мешки по 25 кг нетто
СПЕЦИФИКАЦИЯ
Пункты испытаний | Единицы измерения | Лимиты |
Содержание диоксида титана TiO2 | % | > 99,0 |
Содержание летучих веществ (при 105ºС) | % | < 0,5 |
Растворимые в воде вещества | % | < 0,25 |
Растворимые в кислоте вещества | % | < 0,5 |
Потери при прокаливании (800 °С) | % | < 0,5 |
Белизна | % | > 97,0 |
Содержание оксида алюминия Al2O3 | % | < 0,5 |
Содержание оксида кремния SiO2 | % | < 0,5 |
Содержание мышьяка As (USP метод I) | мг/кг | < 1 |
Содержание сурьмы Sb (кислоторастворимой) | мг/кг | < 2 |
Общее содержание | ||
Содержание цинка Zn | мг/кг | < 50 |
Содержание сурьмы Sb | мг/кг | < 50 |
Содержание хрома Cr | мг/кг | < 20 |
Содержание свинца Pb | мг/кг | < 10 |
Содержание ртути Hg | мг/кг | < 1 |
Содержание кадмия Cd | мг/кг | < 1 |
Содержание железа Fe | мг/кг | < 50 |
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
По вопросам получения дополнительной информации, технического обслуживания, получения образцов продукта обращайтесь к менеджерам нашей компании.
Свойства и области применения чистого титана » Все о металлургии
22.09.2015
Краткие общие сведения
Несмотря на многие ценные свойства титана и большую распространенность его в природе, долго считали, что металлический титан не может быть конструкционным материалом вследствие его хрупкости. Однако, как показали позднейшие исследования, хрупкость титану придают примеси, в частности водород.
В 1925 г. впервые был получен очень чистый йодид-ный титан, который оказался весьма пластичным металлом. Поэтому чистый титан стал перспективным материалом для применения в ряде отраслей техники, в том числе в авиации и ракетостроении.
Основным способом производства технического титана в настоящее время является магние- или натриетермический способ, который заключается в восстановлении очищенного тетрахлорида титана магнием или натрием в атмосфере сухого аргона:
TiCl4 + 2Mg = Ti + 2MgCl2
или
TiCl4 + 4Na = Ti + 4NaCl.
Образующиеся дендриты титана оседают на дно и стенки реакционного сосуда, спекаясь в плотную губчатую массу — титановую губку. Заключительной операцией является превращение титановой губки в слиток, что обычно осуществляют плавкой в дуговой печи с расходуемым электродом, изготовленным прессованием губки.
Для ряда областей применения полученный таким образом технический титан удовлетворяет необходимым требованиям. Однако, чтобы получить титан повышенной пластичности и коррозионной стойкости, необходима более глубокая очистка его от примесей. В этом случае технический титан (или губку) подвергают дополнительной очистке, для чего могут быть применены плавка его в вакуумных печах с электронно-лучевым нагревом, электролитическое рафинирование и йодидное рафинирование. Этот последний способ очистки позволяет получать очень чистый пластичный титан, правда, в относительно небольших масштабах. Возможно осуществление глубокой очистки титана от примесей также с помощью субхлоридного процесса.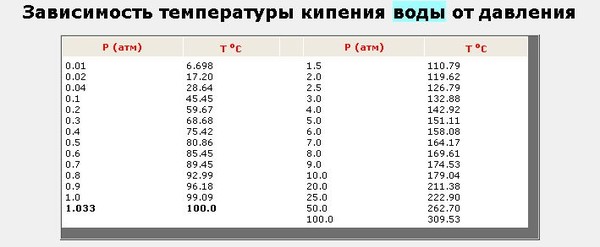
Свойства титана
Титан находится в IV подгруппе первого большого периода системы элементов Д.И. Менделеева и характеризуется следующими основными физическими свойствами: атомный номер 22; атомная масса 47,90; плотность при 20° С 4,505 г/см3; температура плавления 1665° С и температура кипения 3027° С. Упругость паров титана при его температуре плавления составляет всего 0,45*10в-3 мм рт. ст. Скрытая теплота плавления и испарения почти в 2 раза больше, чем у железа.
Чистый титан обладает весьма низкой теплопроводностью — она в 13 раз меньше, чем у алюминия, и в 4 раза меньше, чем у железа. Он имеет довольно высокое удельное электрическое сопротивление, которое существенно зависит от содержания в нем примесей кислорода и азота. Так, удельное электросопротивление йодидного титана составляет 45*10в-6, а технически чистого — около 55*10в-6 ом*см.
Титан — электрохимически активный металл; в ряду напряжений он занимает место между бериллием и марганцем.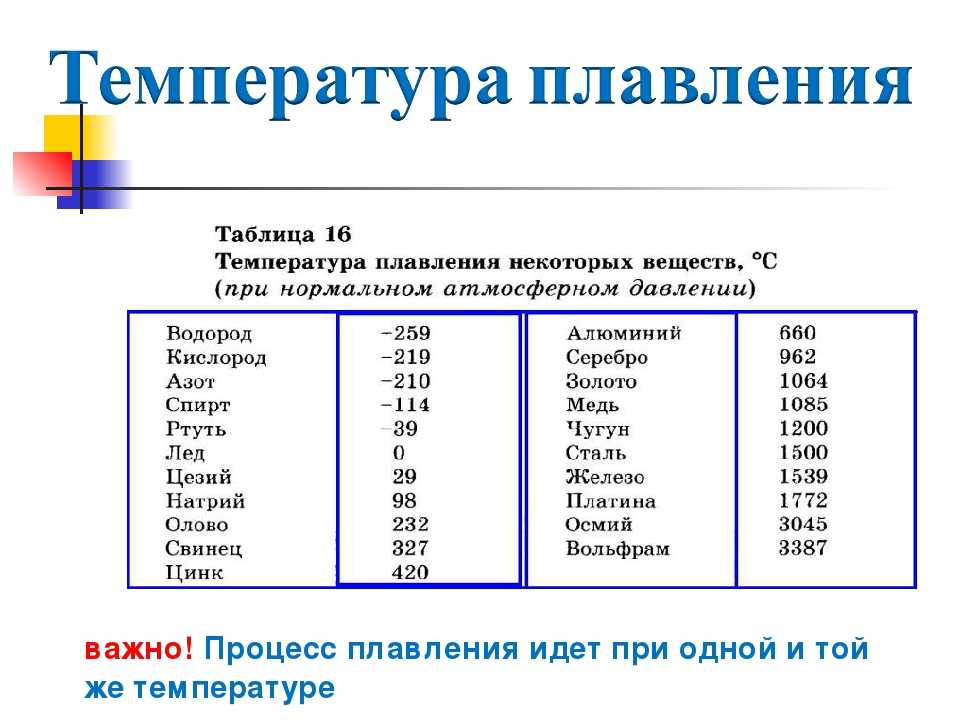 Однако на его поверхности образуется защитная пленка из рутила, которая делает его исключительно стойким против коррозии в весьма агрессивных средах, в том числе и в морской воде.
Однако на его поверхности образуется защитная пленка из рутила, которая делает его исключительно стойким против коррозии в весьма агрессивных средах, в том числе и в морской воде.
Отличающийся слабой химической активностью при обычной температуре чистый титан при ее повышении активно реагирует со многими веществами, особенно с газами: кислородом, азотом, водородом, окисью и двуокисью углерода, водяным паром, аммиаком. Примеси газов делают металл хрупким, не способным к пластической деформации.
Иодидный титан начинает взаимодействовать с кислородом уже при довольно низких температурах: 250—300° С. Технический же титан взаимодействует с кислородом особенно интенсивно при температуре выше 700° С. Весьма активно титан взаимодействует с водородом. Отожженный предварительно в глубоком вакууме титан начинает поглощать водород уже при комнатной температуре. Для чистейшего йодидного титана, отожженного при высокой температуре в вакууме, наибольшая степень поглощения водорода наблюдается при температурах, близких к 300° С.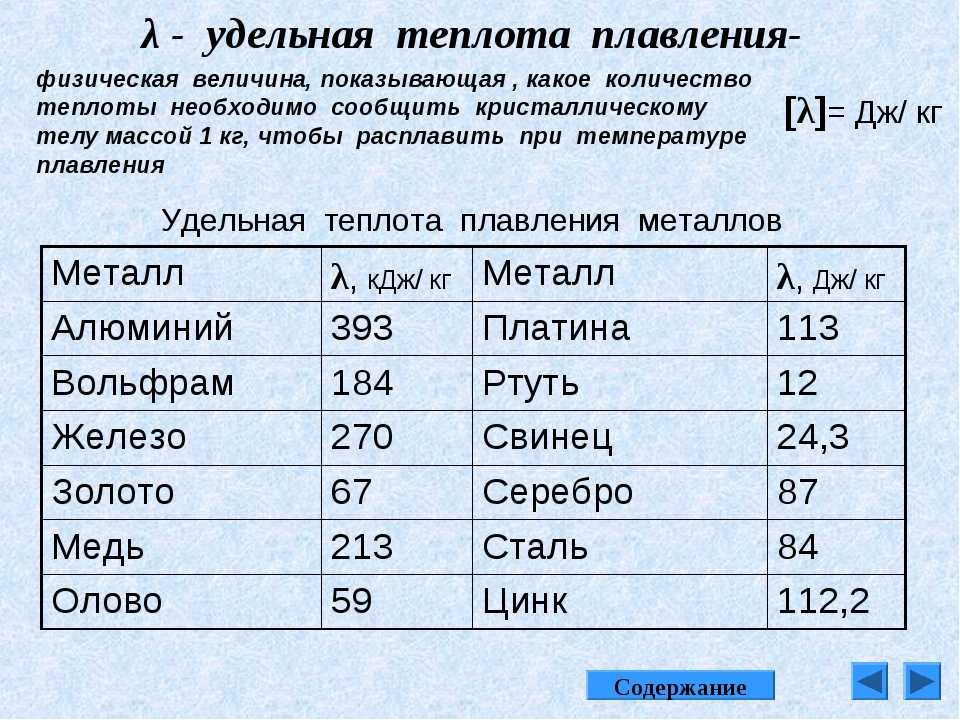 Для технически чистого титана максимум скорости поглощения водорода сдвигается к более высоким температурам — порядка 700—900° С.
Для технически чистого титана максимум скорости поглощения водорода сдвигается к более высоким температурам — порядка 700—900° С.
Механические свойства титана определяются неизбежно присутствующими в нем примесями. Чистейший йодидный титан обладает достаточно высокими пластическими свойствами при сравнительно низкой прочности (σb = 25—30 кГ/мм2; δ = 50—60% и ψ= 70—80%).
Обычными примесями в титане являются кислород, азот, водород, углерод, железо и кремний.
Растворимость кислорода в чистом титане достигает примерно 3% (ат.). Атомы кислорода внедряются в кристаллическую решетку титана и сильно искажают ее. Поэтому кислород (до 0,2% ат.) повышает предел прочности и текучести, а также твердость йодидного титана (рис. 49). Однако при более высоком содержании кислорода титан становится хрупким, что приводит к падению предела его прочности и текучести. Кислород сильно понижает пластические свойства чистого титана в области малых концентраций (до 0,1%), далее он сравнительно мало влияет на пластичность, а уже при больших содержаниях кислорода (более 0,7%) титан полностью теряет способность к пластичности.
Азот взаимодействует с титаном с образованием твердых растворов и нитрида титана. Он еще в большей степени (при содержании до 0,2% N2) упрочняет йодидный титан, чем кислород (рис. 50). Пластические свойства чистого титана при введении азота уменьшаются и при содержании свыше 0,2% (по массе) N2 наступает хрупкое разрушение. Большее упрочняющее влияние азота объясняется тем, что азот сильнее искажает решетку титана, чем кислород, введенный в тех же количествах.
Водород, растворенный в титане, образует с ним твердые растворы внедрения и гидриды TiH и Тih3. Он является весьма вредной примесью в титане, так как резко снижает его ударную вязкость и повышает хладноломкость и ползучесть даже при очень небольших концентрациях (водородная хрупкость). В то же время водород незначительно влияет на прочностные свойства чистого титана, что объясняется меньшим искажением решетки титана растворенными в нем атомами водорода.
Необходимо подчеркнуть одну важную особенность в поведении примеси водорода в титане: если кислород и азот поглощаются титаном необратимо, то водород может быть удален из титана при нагревании в вакууме до 1000—1200° С.
Углерод образует с титаном твердые растворы внедрения, но влияет на механические свойства титана меньше, чем кислород и азот. Прочностные свойства чистого титана повышаются до содержания 0,3% (по массе) углерода; при дальнейшем повышении его содержания свойства титана практически не изменяются.
Примеси железа и кремния образуют с титаном твердые растворы замещения, поэтому оказывают значительно меньшее влияние на механические свойства титана, чем примеси внедрения (т. е. кислород, азот, водород и др.), сильнее искажающие его кристаллическую решетку.
Применение чистого титана
Особо чистый (пластичный) титан характеризуется хорошей способностью к обработке, очень большой стойкостью против коррозии и достаточно высокой жаропрочностью. В силу этого такой титан (а также сплавы на его основе) применяются в ракетной технике, сверхскоростном самолетостроении, судостроении и в электронной технике. В этом последнем случае пластичный титан применяется для изготовления анодов, сеток и других деталей вакуумных генераторных ламп средней и малой мощности. В качестве примера может служить конструкция миниатюрного триода, где из титана выполнены анод и выводы подогревателя, катод и сетки. В силу высокой поглощающей способности по отношению к газам тонкие титановые проволоки применяют в качестве газопоглотителя, навивая их на нагревающиеся участки держателей катода. Чистый титан применяется в качестве упрочняющей присадки к важнейшим сплавам вакуумной техники, а также материала антикатода рентгеновских трубок и для других аналогичных целей.
В качестве примера может служить конструкция миниатюрного триода, где из титана выполнены анод и выводы подогревателя, катод и сетки. В силу высокой поглощающей способности по отношению к газам тонкие титановые проволоки применяют в качестве газопоглотителя, навивая их на нагревающиеся участки держателей катода. Чистый титан применяется в качестве упрочняющей присадки к важнейшим сплавам вакуумной техники, а также материала антикатода рентгеновских трубок и для других аналогичных целей.
- Получение чистого марганца
- Получение чистого кобальта
- Получение чистого никеля
- Получение чистого железа
- Свойства и области применения чистых металлов подгруппы железа
- Получение чистого висмута
- Свойства и области применения чистого висмута
- Способы глубокой очистки свинца
- Свойства и области применения чистого свинца
- Получение чистой ртути
ICSC 1230 — ТЕТРАХЛОРИД ТИТАНА
ICSC 1230 — ТЕТРАХЛОРИД ТИТАНА« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| ТЕТРАХЛОРИД ТИТАНА | ICSC: 1230 (Апрель 2004) |
| CAS #: 7550-45-0 |
| UN #: 1838 |
| EINECS #: 231-441-9 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее. При пожаре выделяет раздражающие или токсичные пары (или газы). При пожаре выделяет раздражающие или токсичные пары (или газы). |
В случае возникновения пожара в рабочей зоне, использовать надлежащие средства пожаротушения. В случае пожара: охлаждать бочки и т.д. распыляя воду. НЕ допускать прямого контакта с водой. |
| ИЗБЕГАТЬ ЛЮБЫХ КОНТАКТОВ! ВО ВСЕХ СЛУЧАЯХ ОБРАТИТЬСЯ К ВРАЧУ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Боли в горле. Кашель. Ощущения жжения. Сбивчивое дыхание. Затрудненное дыхание. Симптомы могут проявляться позже. См. примечания. | Применять вентиляцию, местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. Полусидячее положение. Может потребоваться искусственное дыхание. Обратиться за медицинской помощью. |
| Кожа | Боль. Покраснение. Серьезные ожоги кожи. | Защитные перчатки. Защитная одежда. | Снять загрязненную одежду. Промыть кожу большим количеством воды или принять душ. обратиться за медицинской помощью . |
| Глаза | Боль. Покраснение. Сильные глубокие ожоги. | Использовать маску для лица или средства защиты глаз в комбинации со средствами защиты органов дыхания.. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Ощущение жжения. Боль в животе. Шок или сильная слабость. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. НЕ вызывать рвоту. Обратиться за медицинской помощью . |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Покинуть опасную зону! Проконсультироваться со специалистом! Индивидуальная защита: полный комплект защитной одежды, включая автономный дыхательный аппарат. НЕ допускать попадания этого химического вещества в окружающую среду. Вентилировать. НЕ использовать воду. КислотостойкиеКак можно быстрее собрать пролитую жидкость в закрывающиеся емкости. Удалить оставшуюся жидкость при помощи сухого песка или инертного абсорбента. Затем хранить и утилизировать в соответствии с местными правилами. |
Согласно критериям СГС ООН Транспортировка |
| ХРАНЕНИЕ | |
Отдельно от пищевых продуктов и кормов. Хранить сухим. Хорошо закрывать. Хранить сухим. Хорошо закрывать. |
|
| УПАКОВКА | |
| Не перевозить с продуктами питания и кормами для животных. |
| ТЕТРАХЛОРИД ТИТАНА | ICSC: 1230 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: TiCl4 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| TLV: (as HCl, ceiling value): 0.5 ppm как STEL; A4 (не классифицируется как канцероген для человека) |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
Настоятельно рекомендуется не допускать попадания вещества в окружающую среду. |
| ПРИМЕЧАНИЯ |
|---|
| Бурно реагирует с такими средствами пожаротушения, как вода. В зависимости от степени воздействия, рекомендуется периодическое медицинское обследование. Симптомы отека легких часто не проявляются, пока не пройдет несколько часов, и они усугубляются физическими усилиями. Поэтому крайне важны отдых и медицинское наблюдение. Следует рассмотреть возможность немедленного проведения соответствующей ингаляционной терапии врачом или уполномоченным на это лицом. The decomposition products of this substance may cause effects on the environment. Значение предельно-допустимой концентрации не должно превышаться во время любой части профессионального воздействия. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: C; R: 14-34; S: (1/2)-7/8-26-36/37/39-45 |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Общие сведения о металлургии титана » Ремонт Строительство Интерьер
Титан является одним из наиболее распространенных элементов земной коры. К группе редких металлов он относится чисто условно вследствие того, что разработка промышленных способов получения ковкого титана началась сравнительно недавно.
Титан открыт в 1791 г. Грегором в корнваллийском менаханите и назван менаханитом; в 1795 г. Клапрот исследовал минерал рутил и нашел новый элемент, который назвал титаном. Через несколько лет им было установлено тождество между менаханитом и титаном.
Металлический титан был получен в 1910 г. — через 120 лет после его открытия, что объясняется значительными трудностями получения этого металла.
Благодаря особым физико-химическим свойствам, значение титана в технике быстро возрастает, и за последние десятилетия достигнуты значительные успехи в разработке технологических методов его получения. В табл. 46 приведены свойства титана по сравнению со свойствами других металлов.
В табл. 46 приведены свойства титана по сравнению со свойствами других металлов.
Титан относится к IV группе периодической системы. Атомный вес его 47,9; порядковый номер — 22. Удельный вес титана 4.51; по внешнему виду титан похож на сталь. Температура плавления его 1660 ± 10°; температура кипения около 3400°. Титан имеет переменную валентность, однако главная валентность титана 4.
На воздухе при нормальной температуре компактный титан устойчив. При нагревании выше 400° он окисляется и растворяет кислород и другие газы, в частности азот и водород, отчего становится хрупким. Хрупкость металлу придают также примеси. Порошкообразный титан окисляется на воздухе при сравнительно низкой температуре, с углеродом он образует карбиды высокой твердости с температурой плавления 3140°. Разбавленная серная кислота, а также азотная кислота любой концентрации на него действует очень медленно, равно как и слабые растворы щелочей. Титан растворяется в соляной кислоте, концентрированной серной и плавиковой кислотах, а также в царской водке, и устойчив против коррозии в морской воде.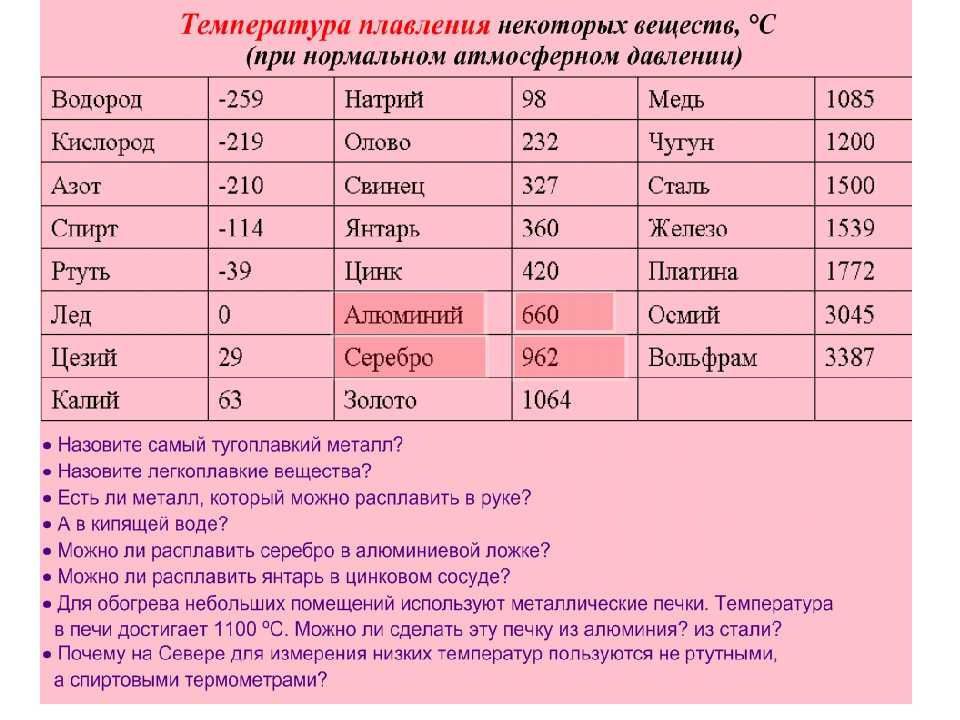
Наибольшее практическое значение имеют следующие соединения титана.
Двуокись титана — белое кристаллическое вещество, обладает амфотерными свойствами, практически не растворима в воде и разбавленных кислотах, растворяется в концентрированных соляной, серной и азотной кислотах только при нагревании и в плавиковой кислоте, встречается в природе в свободном состоянии в виде минералов рутила, анатоза и брукита. Температура плавления ТiO2 1850°, что определяет применение двуокиси титана в составе огнеупоров.
Все галогениды имеют низкую температуру плавления и кипения и подвержены гидролизу в воде.
Практическое значение в технологии производства металлического титана имеет четыреххлористый титан — бесцветная жидкость, получающаяся при действии хлора на двуокись титана; кипит при температуре 136°; удельный вес 1,727; на воздухе дымит вследствие взаимодействия с влагой воздуха с образованием метатитановой и соляной кислот; используется для восстановления из него титана металлотермическим способом.
Титан образует также другие галогениды — фторид и иодид, последний используется для получения металлического титана высокой чистоты методом термической диссоциации.
Титан склонен к образованию комплексных галоидных соединений типа Me2 Ti Гал. Особо важную роль в технологии и аналитике имеют фторотитанаты щелочных металлов, образующиеся при растворении двуокиси титана в плавиковой кислоте с добавлением солей калия или натрия. Для аналитических целей также применяют фосфорнокислые соли и перекисные соединения титана.
До последнего времени большую часть титанового рудного сырья использовали главным образом для производства двуокиси титана, применяемой для изготовления титановых белил.
В настоящее время благодаря разработке технологии производства металлического титана и физико-химическим его свойствам — высокой механической прочности при малом удельном весе и устойчивости против коррозии — титан используется как конструкционный материал.
Свойства титана значительно улучшаются легирующими добавками. Легированный титан может служить заменителем спецсталей и легких сплавов при изготовлении деталей самолетов и военноморских судов. В качестве легирующих добавок, повышающих механические и антикоррозийные свойства титана, применяют марганец, хром, алюминий, ванадий, молибден, кремний, бор, углерод и азот. Порошкообразный титан используют как поглотитель газов (геттер) в электровакуумной технике.
Легированный титан может служить заменителем спецсталей и легких сплавов при изготовлении деталей самолетов и военноморских судов. В качестве легирующих добавок, повышающих механические и антикоррозийные свойства титана, применяют марганец, хром, алюминий, ванадий, молибден, кремний, бор, углерод и азот. Порошкообразный титан используют как поглотитель газов (геттер) в электровакуумной технике.
В производстве сталей титан применяют как раскислитель благодаря его высокому сродству к кислороду, азоту, сере и углероду, что освобождает сталь от межкристаллической коррозии.
Присадка титана в количестве 5—10% к цветным металлам — меди и алюминию — улучшает их физико-механические и антикоррозийные свойства.
Титан широко применяется в твердых и жаропрочных сплавах, состоящих из карбида титана, карбида вольфрама и кобальта, где карбид титана составляет от 10 до 40%.
Из двуокиси титана TiO2 изготовляют титановые белила, а также ферротитан, сплавы с цветными металлами и металлический титан.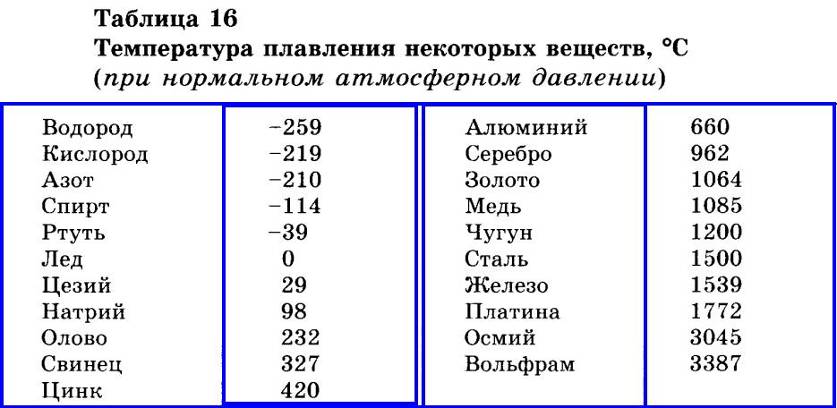
Четыреххлористый титан применяется в военном деле для создания дымовых завес и как исходный продукт при производстве металлического титана.
Титан — Температура плавления — Температура кипения
Автор
Титан — Температура плавления и кипения
Температура плавления титана 1661°C
Температура кипения титана 3287°C .
Обратите внимание, что эти точки связаны со стандартным атмосферным давлением.
Температура кипения – насыщение
В термодинамике, насыщение определяет состояние, при котором смесь пара и жидкости может существовать вместе при заданной температуре и давлении. Температура, при которой начинает происходить испарение (кипение) при данном давлении, называется температурой насыщения или точкой кипения . Давление, при котором начинается испарение (кипение) при данной температуре, называется давлением насыщения. Когда ее рассматривают как температуру обратного перехода из пара в жидкость, ее называют точкой конденсации.
Давление, при котором начинается испарение (кипение) при данной температуре, называется давлением насыщения. Когда ее рассматривают как температуру обратного перехода из пара в жидкость, ее называют точкой конденсации.
Точка плавления
В термодинамике точка плавления определяет состояние, при котором твердое тело и жидкость могут существовать в равновесии. Добавление тепла превратит твердое вещество в жидкость без изменения температуры. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда ее рассматривают как температуру обратного перехода от жидкого к твердому, ее называют точкой замерзания или точкой кристаллизации.
Первая теория, объясняющая механизм плавления в объеме, была предложена Линдеманном, который использовал колебание атомов в кристалле для объяснения плавления. Твердые тела похожи на жидкости тем, что оба находятся в конденсированном состоянии, а частицы находятся гораздо ближе друг к другу, чем частицы газа. Атомы в твердом теле тесно связаны друг с другом либо в правильной геометрической решетке (кристаллические твердые тела, которые включают металлы и обычный лед), либо в неправильной (аморфное твердое тело, такое как обычное оконное стекло), и обычно имеют низкую энергию. движение отдельных атомов , ионов или молекул в твердом теле ограничено колебательным движением вокруг фиксированной точки. Когда твердое тело нагревается, его частицы вибрируют быстрее , поскольку твердое тело поглощает кинетическую энергию. В какой-то момент амплитуда колебаний становится настолько большой, что атомы начинают вторгаться в пространство своих ближайших соседей и возмущать их, и начинается процесс плавления. Точка плавления – это температура, при которой разрушающие вибрации частиц твердого тела преодолевают силы притяжения, действующие внутри твердого тела.
Атомы в твердом теле тесно связаны друг с другом либо в правильной геометрической решетке (кристаллические твердые тела, которые включают металлы и обычный лед), либо в неправильной (аморфное твердое тело, такое как обычное оконное стекло), и обычно имеют низкую энергию. движение отдельных атомов , ионов или молекул в твердом теле ограничено колебательным движением вокруг фиксированной точки. Когда твердое тело нагревается, его частицы вибрируют быстрее , поскольку твердое тело поглощает кинетическую энергию. В какой-то момент амплитуда колебаний становится настолько большой, что атомы начинают вторгаться в пространство своих ближайших соседей и возмущать их, и начинается процесс плавления. Точка плавления – это температура, при которой разрушающие вибрации частиц твердого тела преодолевают силы притяжения, действующие внутри твердого тела.
Titanium – Properties
| Element | Titanium |
|---|---|
| Atomic Number | 22 |
| Symbol | Ti |
| Element Category | Transition Metal |
| Фаза при STP | Твердое вещество |
Атомная масса [а. е.м.] е.м.] | 47,867 |
| Плотность при STP [г/см3] | 4,507 |
| Электронная конфигурация | [AR] 3D2 4S2 |
| Возможные состояния окисления | . ]1,54 |
| 1 -й Ионизационная энергия [EV] | 6,8282 |
| Год открытия | 1791 |
| Discorder | 7071 |
| Discorder | 70719 |
| Discorder | 70711 |
| Discovery | 70719 |
| .0071 | |
| Thermal properties | |
| Melting Point [Celsius scale] | 1668 |
| Boiling Point [Celsius scale] | 3287 |
| Thermal Conductivity [W/m K] | 21.9 |
| Специфическое тепло [J/G K] | 0,52 |
| Тепло слияния [KJ/MOL] | 15,45 |
| Хит испарения [KJ/MOL] | 4211 | . 0188 0188 |
| Hydrogen1H | Helium2He | ||||||||||||||||||
| Lithium3Li | Beryllium4Be | Boron5B | Carbon6C | Nitrogen7N | Oxygen8O | Fluorine9F | Neon10Ne | ||||||||||||
| Sodium11Na | Magnesium12Mg | Алюминий13Al | Кремний14Si | Фосфор15P | Сера16S | Chlorine17Cl | Argon18Ar | ||||||||||||
| Potassium19K | Calcium20Ca | Scandium21Sc | Titanium22Ti | Vanadium23V | Chromium24Cr | Manganese25Mn | Iron26Fe | Cobalt27Co | Nickel28Ni | Copper29Cu | Zinc30Zn | Gallium31Ga | Germanium32Ge | Мышьяк33As | Селен34Se | Бром35Br | Krypton36Kr | ||
| Rubidium37Rb | Strontium38Sr | Yttrium39Y | Zirconium40Zr | Niobium41Nb | Molybdenum42Mo | Technetium43Tc | Ruthenium44Ru | Rhodium45Rh | Palladium46Pd | Silver47Ag | Cadmium48Cd | Indium49In | Tin50Sn | Antimony51Sb | Теллур52Te | Йод53I | Ксенон54Xe | ||
| Caesium55Cs | Barium56Ba | Lanthanum57La | Hafnium72Hf | Tantalum73Ta | Tungsten74W | Rhenium75Re | Osmium76Os | Iridium77Ir | Platinum78Pt | Gold79Au | Mercury80Hg | Thallium81Tl | Lead82Pb | Bismuth83Bi | Полоний84Po | Астатин85At | Радон86Rn | ||
| Francium87Fr | Radium88Ra | Actinium89Ac | Rutherfordium104Rf | Dubnium105Db | Seaborgium106Sg | Bohrium107Bh | Hassium108Hs | Meitnerium109Mt | Darmstadtium110Ds | Roentgenium111Rg | Copernicium112Cn | Nihonium113Nh | Flerovium114Fl | Moscovium115Mc | Livermorium116Lv | Теннесси117Ц | Oganesson118Og | ||
| Cerium58Ce | Praseodymium59Pr | Neodymium60Nd | Promethium61Pm | Samarium62Sm | Europium63Eu | Gadolinium64Gd | Terbium65Tb | Dysprosium66Dy | Holmium67Ho | Erbium68Er | Thulium69Tm | Иттербий70Yb | Лютеций71Lu | ||||||
| Thorium90Th | Protactinium91Pa | Uranium92U | Neptunium93Np | Plutonium94Pu | Americium95Am | Curium96Cm | Berkelium97Bk | Californium98Cf | Einsteinium99Es | Fermium100Fm | Mendelevium101Md | Nobelium102No | Lawrencium103Lr | ||||||
–
–
–
сообщите об этом объявлении
WebWISER — Главная
WISER — это система, предназначенная для оказания помощи аварийно-спасательным службам при инцидентах с опасными материалами. Известные вещества Поиск вещества в базе данных известных веществ WISER. Помогите определить химическое вещество Определите неизвестное химическое вещество на основе его физических свойств, симптомов воздействия, окружающей среды и других критериев. Инструменты Ознакомьтесь с общими инструментами и справочными материалами. Последние новости
WebWISER лучше всего просматривать в следующих браузерах (указанная версия или выше): Internet Explorer 9, Firefox 26, Safari 7 или Google Chrome 30. WISER также доступен как отдельное приложение для ПК и различных мобильных платформ. включая устройства iOS и Android. Посетите домашнюю страницу WISER для бесплатных загрузок и получения дополнительной информации о WISER. | Другие ресурсы для чрезвычайных ситуаций с химическими веществами в NLM
Other Chemical Emergency Resources
|
Диоксид титана | AMERICAN ELEMENTS®
РАЗДЕЛ 1.
 ИДЕНТИФИКАЦИЯ
ИДЕНТИФИКАЦИЯНаименование продукта: Диоксид титана
Номер продукта: Все применимые коды продуктов American Elements, например ТИ-ОКС-02 , ТИ-ОКС-03 , ТИ-ОКС-04 , ТИ-ОКС-05
CAS #: 13463-67-7
Соответствующие идентифицированные использование вещества: Научные исследования и разработка
Подробности добавления:
American Elements
10884 Weyburn Ave.
Los Angeles. : +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи:
Внутренний, Северная Америка: +1 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТЕЙ
Классификация вещества или смеси
Классификация в соответствии с Регламентом (ЕС) № 1272/2008
GHS08 Опасность для здоровья
Carc. 2 h451 Предположительно вызывает рак.
Классификация согласно Директиве 67/548/ЕЕС или Директиве 1999/45/ЕС
Xn; Вреден для здоровья
R40: Ограниченные доказательства канцерогенного действия.
Информация об особых опасностях для человека и окружающей среды:
N/A
Опасности, не классифицированные иначе
Данные отсутствуют
Элементы маркировки
Маркировка в соответствии с Регламентом (ЕС) № 1272/2008
Вещество классифицируется и маркируется в соответствии с Регламентом CLP.
Пиктограммы опасности
GHS08
Сигнальное слово
Предупреждение
Указания на опасность
h451 Предположительно вызывает рак.
Меры предосторожности
P281 При необходимости используйте средства индивидуальной защиты.
P201 Перед использованием получить специальные инструкции.
P202 Не прикасайтесь к устройству до тех пор, пока не будут прочитаны и поняты все меры предосторожности.
P308+P313 ПРИ воздействии или обеспокоенности: обратиться к врачу.
P405 Магазин заперт.
P501 Утилизируйте содержимое/контейнер в соответствии с местными/региональными/национальными/международными нормами.
Классификация WHMIS
D2A — Очень токсичный материал, вызывающий другие токсические эффекты
Система классификации
Оценки HMIS (шкала 0–4)
(Система идентификации опасных материалов) = 1
Пятежеспособность = 0
Физическая опасность = 1
Другие опасности
Результаты оценки PBT и VPVB
PBT:
N/A
VPVB:
N/A
9088 Секция 3.
 Компостиция/Информация 9000 4000 4000444484848888. ./ Наименование вещества:
Компостиция/Информация 9000 4000 4000444484848888. ./ Наименование вещества: 13463-67-7 Оксид титана(IV)
Идентификационный номер(а):
Номер ЕС:
236-675-5
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
Описание мер первой помощи
При вдыхании:
Обеспечить пациента свежим воздухом. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь к врачу.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь к врачу.
При попадании в глаза:
Промыть открытые глаза в течение нескольких минут под проточной водой. Проконсультируйтесь с врачом.
При проглатывании:
Обратитесь за медицинской помощью.
Информация для врача
Наиболее важные симптомы и эффекты, как острые, так и замедленные
Данные отсутствуют
Указание на необходимость немедленной медицинской помощи и специального лечения
Нет данных
РАЗДЕЛ 5.
 ПРОТИВОПОЖАРНЫЕ МЕРЫ
ПРОТИВОПОЖАРНЫЕ МЕРЫ Средства пожаротушения
Подходящие средства пожаротушения
Продукт не воспламеняется. Используйте меры пожаротушения, подходящие для окружающего огня.
Особые опасности, исходящие от вещества или смеси
Если этот продукт вовлечен в пожар, могут быть выделены следующие вещества:
Оксиды титана
Рекомендации для пожарных
Защитное снаряжение:
Надеть автономный респиратор.
Носите полностью защитный непроницаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры предосторожности для персонала, защитное снаряжение и порядок действий в чрезвычайных ситуациях
Использовать средства индивидуальной защиты. Держите незащищенных людей подальше.
Обеспечьте достаточную вентиляцию.
Меры предосторожности по охране окружающей среды:
Не допускайте попадания продукта в канализацию, канализационные системы или другие водотоки.
Не допускайте проникновения материала в землю или почву.
Методы и материалы для локализации и очистки:
Утилизировать загрязненный материал как отходы в соответствии с разделом 13.
Предотвращение вторичных опасностей:
Никаких специальных мер не требуется.
Ссылка на другие разделы
См. Раздел 7 для информации о безопасном обращении
См. Раздел 8 для информации о средствах индивидуальной защиты.
Информацию об утилизации см. в Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Обеспечьте хорошую вентиляцию на рабочем месте.
Информация о защите от взрывов и пожаров:
Продукт не воспламеняется
Условия для безопасного хранения, включая любые несовместимости
Требования, которым должны соответствовать складские помещения и емкости:
Особых требований нет.
Информация о хранении в одном общем хранилище:
Хранить вдали от окислителей.
Дополнительная информация об условиях хранения:
Хранить контейнер плотно закрытым.
Хранить в прохладном, сухом месте в хорошо закрытых контейнерах.
Конкретное конечное использование
Данные отсутствуют
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Дополнительная информация о конструкции технических систем: не менее 100 футов в минуту.
Параметры контроля
Компоненты с предельными значениями, требующими контроля на рабочем месте:
13463-67-7 Оксид титана(IV) (100,0%)
PEL (США) Длительное значение: 15* мг/м 3
*общее количество пыли
REL (США) См. приложение Pocket Guide. A
TLV (США) Долговременное значение: (10) NIC-1* мг/м 3
*респирабельная фракция, NIC-A3
EL (Канада) Долгосрочное значение: 10 мг/м 3
IARC 2B
EV (Канада) Долговременное значение: 10 мг/м 3
общая пыль
Дополнительная информация:
Нет данных
Средства контроля воздействия
Средства индивидуальной защиты
Соблюдайте типичные меры защиты и гигиены при обращении с химическими веществами.
Хранить вдали от пищевых продуктов, напитков и кормов.
Немедленно снимите всю испачканную и зараженную одежду.
Мыть руки перед перерывами и по окончании работы.
Поддерживайте эргономически подходящую рабочую среду.
Дыхательное оборудование:
При наличии высоких концентраций используйте подходящий респиратор.
Защита рук:
Непроницаемые перчатки
Проверяйте перчатки перед использованием.
Пригодность перчаток должна определяться как материалом, так и качеством, последнее из которых может варьироваться в зависимости от производителя.
Время проницаемости материала перчаток (в минутах)
Данные отсутствуют
Защита глаз:
Защитные очки
Защита тела:
Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физико-химических свойствах
Внешний вид:
Форма: Различные формы (порошок/хлопья/кристаллы/гранулы и т.д.)
Цвет: Белый
Запах: Без запаха
Порог запаха : Данные недоступны.
pH: неприменимо
Точка плавления/диапазон плавления: 1830–1850 °C (3326–3362 °F)
Точка/диапазон кипения: 2500-3000 °C (4532-5432 °F)
Температура сублимации / начало: Нет данных
Воспламеняемость (твердое вещество, газ)
Нет данных.
Температура воспламенения: Данные отсутствуют.
Температура разложения: Данные отсутствуют.
Самовоспламенение: Данные отсутствуют.
Опасность взрыва: Данные отсутствуют.
Пределы взрываемости:
Нижний: Данные отсутствуют
Верхний: Данные отсутствуют
Давление паров: Н/Д
Плотность при 20 °C (68 °F): 4,26 г/см 3 (35,55 фунтов/галлон)
Относительная плотность
Данные отсутствуют.
Плотность паров
Н/Д
Скорость испарения
Н/Д
Растворимость в воде (H 2 O): Нерастворим
Коэффициент распределения (н-октанол/вода): Данные отсутствуют.
Вязкость:
Динамическая: Н/Д
Кинематика: Н/Д
Другая информация
Нет данных
РАЗДЕЛ 10.
 СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ Реактивность
Нет данных
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать:
Разложение не происходит, если используется и хранится в соответствии со спецификациями.
Возможность опасных реакций
реагирует с сильными окисливными агентами
Условия, чтобы избежать
Данные. токсичность:
Реестр токсических эффектов химических веществ (RTECS) содержит данные об острой токсичности
для этого вещества.
Значения LD/LC50, важные для классификации:
Нет данных
Раздражение или коррозия кожи:
Может вызывать раздражение
Раздражение или коррозия глаз:
Может вызывать раздражение
Повышение чувствительности:
Неизвестно о сенсибилизирующих эффектах.
Мутагенность зародышевых клеток:
Реестр токсических эффектов химических веществ (RTECS) содержит данные о мутациях для этого вещества.
Канцерогенность:
Предположительно вызывает рак.
IARC-2B: Возможно, канцерогенен для человека: ограниченные доказательства для людей при отсутствии достаточных доказательств для экспериментальных животных.
ACGIH A4: Не классифицируется как канцероген для человека: Недостаточно данных для классификации агента с точки зрения его канцерогенности для людей и/или животных.
Реестр токсических эффектов химических веществ (RTECS) содержит данные о канцерогенности и/или опухолегенности и/или неопластичности этого вещества.
Репродуктивная токсичность:
Воздействие не известно.
Специфическая токсичность для системы органов-мишеней — повторное воздействие:
Неизвестно никаких эффектов.
Специфическая системная токсичность на орган-мишень — однократное воздействие:
Эффекты неизвестны.
Опасность при вдыхании:
Эффекты неизвестны.
От подострой до хронической токсичности:
Реестр токсических эффектов химических веществ (RTECS) содержит данные о многократных дозах токсичности
для этого вещества.
Дополнительная токсикологическая информация:
Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Водная токсичность:
Нет данных
Стойкость и способность к разложению
Нет данных
Потенциал биоаккумуляции
Нет данных
Мобильность в почве: нет данных
8 Дополнительная информация
8 Дополнительная информация
8 в окружающую среду.
Результаты оценки PBT и vPvB
PBT:
н/д
vPvB:
н/д
Другие неблагоприятные эффекты
Нет доступных данных
РАЗДЕЛ 13. СООБРАЖЕНИЯ ПО УТИЛИЗАЦИИ
Методы обработки отходов
Рекомендация
Ознакомьтесь с официальными правилами для обеспечения надлежащей утилизации.
Неочищенная упаковка:
Рекомендация:
Утилизация должна производиться в соответствии с официальными правилами.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, ADN, IMDG, IATA
N/A
Собственное отгрузочное наименование ООН
DOT, ADN, IMDG, IATA
N/A
Класс(ы) опасности при транспортировке
DOT, ADR, ADN, IMDG, IATA
Class
N/A
Группа упаковки
DOT, IMDG, IATA
N/A
Опасности для окружающей среды:
N/A
Особые меры предосторожности для пользователя
N/A
Транспортировка навалом согласно Приложению II к MARPOL73/78 и IBC Code
N/A
Транспорт/Дополнительная информация:
DOT
Морской загрязнитель (DOT):
№
РАЗДЕЛ 15.
 НОРМАТИВНАЯ ИНФОРМАЦИЯ
НОРМАТИВНАЯ ИНФОРМАЦИЯ Правила техники безопасности, охраны здоровья и окружающей среды/ законодательство, относящееся к данному веществу или смеси
Национальные правила
Все компоненты этого продукта перечислены в Реестре химических веществ Агентства по охране окружающей среды США.
Все компоненты этого продукта перечислены в Канадском перечне веществ для внутреннего потребления (DSL).
Раздел 313 SARA (списки конкретных токсичных химических веществ)
Вещество не указано в списке.
Предложение штата Калифорния 65
Предложение 65 — Химические вещества, вызывающие рак
13463-67-7 Оксид титана(IV)
Предложение 65 — Токсичность для развития
Вещество не указано.
Предложение 65 — Токсичность для развития у женщин
Вещество не указано.
Предложение 65 — Токсичность для развития, мужчины
Вещество не указано.
Информация об ограничении использования:
Только для использования технически квалифицированными лицами.
Другие правила, ограничения и запретительные положения
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (ЕС) № 1907/2006.
Вещество не указано.
Условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) в отношении производства, размещения на рынке и использования.
Вещество не указано.
Приложение XIV Регламента REACH (требуется разрешение на использование)
Вещество не указано.
REACH — Предварительно зарегистрированные вещества
Вещество указано.
Оценка химической безопасности:
Оценка химической безопасности не проводилась.
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (ДОСТИГАЕМОСТЬ). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Факты о титане | Живая наука
Новый материал на основе титана имеет пенообразную структуру. (Изображение предоставлено: Fraunhofer IFAM)Есть ли какой-нибудь элемент, напоминающий о прочности, как титан? Названный в честь титанов, греческих мифических богов, 22-й элемент периодической таблицы присутствует в авиалайнерах и клюшках для лакросса, пирсинге, медицинском оборудовании и даже солнцезащитном креме.
Титан устойчив к коррозии, отличается особой прочностью и легкостью. По данным Национальной лаборатории Лос-Аламоса, он такой же прочный, как сталь, но весит всего 45 процентов. И он в два раза прочнее алюминия, но всего на 60 процентов тяжелее.
И он в два раза прочнее алюминия, но всего на 60 процентов тяжелее.
Только факты
- Атомный номер (число протонов в ядре): 22
- Символ атома (в Периодической таблице элементов): Ti
- Атомный вес (средняя масса атома): 47,867
- Плотность : 4,5 грамма на кубический сантиметр
- Фаза при комнатной температуре: твердое вещество
- Температура плавления: 3034,4 градуса по Фаренгейту (1668 градусов Цельсия)
- Температура кипения: 5948,6 F (3287 °C)
- Количество изотопов: 18; пять стабильны
- Наиболее распространенные изотопы: титан-46, титан-47, титан-48, титан-49 и титан-50
Элемент супергероя
Для элемента со сверхспособностями титан имеет подходящую историю происхождения: он выкован в недрах сверхновых или коллапсирующих звезд. Исследование особой умирающей звезды Supernova 19, проведенное в 2012 году.87A, обнаружил, что одна сверхновая может создать массу титана-44, радиоактивного изотопа титана, стоимостью в 100 Земель.
Исследование особой умирающей звезды Supernova 19, проведенное в 2012 году.87A, обнаружил, что одна сверхновая может создать массу титана-44, радиоактивного изотопа титана, стоимостью в 100 Земель.
Титан является девятым по распространенности металлом в земной коре, согласно Chemicool, но он не был открыт до 1791 года. Английский геолог-любитель преподобный Уильям Грегор обнаружил немного черного металлического песка в русле ручья, проанализировал его и обнаружил, что быть смесью магнетита, распространенной формы оксида железа, и нового металла. Грегор назвал его манакканитом в честь прихода, в котором он обнаружил песок.
Четыре года спустя немецкий ученый по имени Мартин Генрих Клапрот, изучая венгерскую руду, обнаружил, что в ней содержится неизвестный ранее химический элемент. Он назвал его титаном, а позже подтвердил, что манакканит Грегора тоже содержит титан.
Согласно Королевскому химическому обществу (RSC), первым, кто перегнал титан в его чистую форму, был М. А. Хантер, сотрудник General Electric. Однако только в 1930-х годах Уильям Дж. Кролл изобрел процесс, который сделал возможным извлечение титана в промышленных масштабах. Так называемый процесс Кролла сначала обрабатывает руду оксида титана хлором с получением хлорида титана. Затем магний или натрий смешивают с хлоридом титана в газообразном аргоне (допуск кислорода в процесс действительно был бы довольно взрывоопасным, учитывая, что титан очень реактивен по отношению к кислороду, согласно RSC). При температуре 2,192 F (1200 C) магний или натрий восстанавливают хлорид титана до чистого титана. По данным RSC, этот процесс примерно в 10 000 раз менее эффективен, чем процесс, используемый для производства железа, что помогает объяснить, почему титан является более дорогим металлом.
А. Хантер, сотрудник General Electric. Однако только в 1930-х годах Уильям Дж. Кролл изобрел процесс, который сделал возможным извлечение титана в промышленных масштабах. Так называемый процесс Кролла сначала обрабатывает руду оксида титана хлором с получением хлорида титана. Затем магний или натрий смешивают с хлоридом титана в газообразном аргоне (допуск кислорода в процесс действительно был бы довольно взрывоопасным, учитывая, что титан очень реактивен по отношению к кислороду, согласно RSC). При температуре 2,192 F (1200 C) магний или натрий восстанавливают хлорид титана до чистого титана. По данным RSC, этот процесс примерно в 10 000 раз менее эффективен, чем процесс, используемый для производства железа, что помогает объяснить, почему титан является более дорогим металлом.
Титан является переходным металлом, что означает, что он может образовывать связи, используя электроны более чем с одной из своих оболочек или энергетических уровней. Он разделяет эту особенность с другими переходными металлами, включая золото, медь и ртуть.
Кто знал?
- По данным RSC, почти каждая магматическая порода — горная порода, образованная в результате затвердевания расплавленной породы — содержит титан.
- По данным компании, Boeing 737 Dreamliner на 15% состоит из титана.
- Титан находится на орбите планеты прямо сейчас: по данным НАСА, Международная космическая станция (МКС) имеет ряд титановых деталей, включая трубы. В рамках проекта Rosetta Project, исследовательского и архивного предприятия, целью которого является сохранение человеческого языка и мышления, за пределы МКС также был отправлен протравленный кусок чистого титана, чтобы посмотреть, как он выдерживает воздействие радиации и суровых условий космоса.
- Земля — не единственное место, где можно найти титан. В 2011 году на спутниковой карте поверхности Луны были обнаружены скопления богатых титаном горных пород. Эти породы часто содержали до 10 процентов титана по сравнению с 1 процентом или около того, обычно наблюдаемым в горных породах Земли.

- Титан можно использовать в качестве сырья для 3D-печати. В 2013 году исследователи Австралийской организации научных и промышленных исследований Содружества напечатали на 3D-принтере пару легких титановых подков для скаковых лошадей. Туфли были стильного ярко-розового цвета.
Двуокись титана
Двуокись титана (TiO 2 ), также называемая оксидом титана(IV) или titania, представляет собой встречающийся в природе оксид титана. Белый пигмент, диоксид титана, используется в красках (как титановые белила или пигментные белила 6) и солнцезащитных кремах из-за его способности преломлять свет и поглощать ультрафиолетовые лучи. По данным Геологической службы США, 95 процентов добытого титана перерабатывается в пигменты диоксида титана, а оставшиеся 5 процентов идут на производство химикатов, металлов, карбидов и покрытий.
Диоксид титана также широко используется в медицине, косметике и зубной пасте, и все чаще используется в качестве пищевой добавки (как E171) для отбеливания продуктов или придания им более непрозрачного вида. Некоторые из наиболее распространенных пищевых продуктов с добавлением Е171 включают глазурь, жевательную резинку, зефир и добавки.
Некоторые из наиболее распространенных пищевых продуктов с добавлением Е171 включают глазурь, жевательную резинку, зефир и добавки.
Нет ограничений на использование диоксида титана в пищевых продуктах. Однако новое исследование на мышах, опубликованное в журнале Gut, показывает, что частицы диоксида титана могут быть очень вредными для кишечника людей с некоторыми воспалительными заболеваниями кишечника.
Исследователи из Цюрихского университета в Швейцарии обнаружили, что, когда клетки кишечника поглощают частицы диоксида титана, слизистая оболочка кишечника мышей, страдающих колитом, воспаляется и повреждается, говорится в пресс-релизе исследования.
Воспалительные заболевания кишечника, такие как болезнь Крона и язвенный колит, в течение многих лет росли в западных странах. Эти состояния характеризуются крайней аутоиммунной реакцией на кишечную флору. В развитии заболевания играют роль несколько факторов, в том числе генетика и факторы окружающей среды, такие как образ жизни и питание. Теперь швейцарские исследователи обнаружили, что наночастицы диоксида титана, обычно встречающиеся в зубной пасте и многих пищевых продуктах, могут еще больше усугубить эту воспалительную реакцию.
Теперь швейцарские исследователи обнаружили, что наночастицы диоксида титана, обычно встречающиеся в зубной пасте и многих пищевых продуктах, могут еще больше усугубить эту воспалительную реакцию.
Кроме того, более высокие концентрации частиц диоксида титана могут быть обнаружены в крови пациентов с язвенным колитом. Это означает, что эти частицы могут всасываться из пищи при определенных заболеваниях, объясняют исследователи в пресс-релизе.
Хотя результаты еще не были подтверждены на людях, исследователи предполагают, что пациентам с колитом следует избегать приема внутрь частиц диоксида титана.
Титан — легкий и прочный металл, часто используемый в машинах, инструментах, спортивном снаряжении и ювелирных изделиях. (Изображение предоставлено: Кристиан Лагерек (открывается в новой вкладке) Shutterstock (открывается в новой вкладке))Текущие исследования
Диоксид титана имеет ошеломляющий набор функций в мире технологий, от приложений для солнечных батарей до биосовместимых датчиков, сказал Джей Нараян, материаловед из Университета штата Северная Каролина.
В 2012 году Нараян и его коллеги сообщили о способе «настройки» диоксида титана, адаптируя его для конкретных приложений. Этот материал имеет две кристаллические структуры, называемые «рутил» и «анатаз», каждая из которых имеет свои свойства и функции. Обычно диоксид титана предпочитает находиться в фазе анатаза ниже 932 F (500 C) и превращается в рутиловую фазу при более высоких температурах.
Выращивая кристалл за кристаллом диоксида титана и выстраивая их на шаблоне из триоксида титана, Нараян и его коллеги смогли определить фазу материала как рутил или анатаз при комнатной температуре, как они сообщили в июне 2012 года в журнал Applied Physics Letters. Совершив еще больший скачок, исследователи смогли интегрировать этот диоксид титана в компьютерные чипы.
«Оксид титана также является очень хорошим материалом для датчиков, поэтому, если он интегрирован с компьютерным чипом, он действует как интеллектуальный датчик», — сказал Нараян Live Science. Поскольку датчик является частью чипа, устройство может реагировать быстрее и эффективнее, чем если бы датчик был отдельным и должен был быть жестко подключен к вычислительной части устройства.
Вывод продукта на рынок потребует снижения производственных затрат, сказал Нараян, но у «настраиваемого» диоксида титана есть и другие перспективы. Поражая материал мощными лазерными импульсами, исследователи могут создавать небольшие дефекты, называемые кислородными вакансиями, где в материале отсутствуют молекулы кислорода. Затем этот материал можно использовать для расщепления воды (H3O) путем кражи кислорода и получения водорода, который затем можно использовать для производства водородного топлива.
«Это дешевый источник энергии — и чистый», — сказал Нараян. Новые методы производства и проектирования расширяют возможности использования титана. В 2012 году Управление военно-морских исследований объявило, что для производства полноразмерного корпуса корабля будет использоваться новый метод сварки титана; По мнению ВМС, эта конструкция является прорывом, потому что титан, как правило, слишком дорог и сложен в производстве для судостроения. Новый метод, называемый сваркой трением с перемешиванием, использует вращающийся металлический штифт для частичного сплавления краев двух кусков титана вместе.
В медицине титановые имплантаты используются для замены или стабилизации сломанной кости. Крошечные титановые имплантаты даже используются для улучшения слуха у людей с некоторыми видами глухоты. Винтовой титановый стержень ввинчивается в череп за ухом и прикрепляется к внешнему блоку обработки звука. Внешний блок улавливает звуки и передает вибрацию через титановый имплантат во внутреннее ухо, минуя любые проблемы со средним ухом.
В 2010 году исследователи объявили о разработке «Tifoam» — структуры пенополиуретана, насыщенного порошком титана. Пористая структура имитирует человеческую кость и позволяет клеткам человеческой кости проникать и сливаться с имплантатом по мере заживления человека, согласно исследованию материала, проведенному в 2013 году в журнале Acta Biomaterialia.
Дополнительный отчет Трейси Педерсен, автора Live Science.
Следуйте за Стефани Паппас на Twitter Google+ . Подпишитесь на нас @livescience , Facebook и Google+ .
Дополнительные ресурсы
- Узнайте больше о титане из Национального ускорительного комплекса Томаса Джефферсона (лаборатория Джефферсона).
- Геологическая служба США предоставляет множество статистических данных и информации о титане.
- Узнайте больше о титане в Королевском химическом обществе.
Стефани Паппас — автор статей для журнала Live Science, освещающего самые разные темы — от геонаук до археологии, человеческого мозга и поведения. Ранее она была старшим автором журнала Live Science, но теперь работает фрилансером в Денвере, штат Колорадо, и регулярно публикует статьи в журналах Scientific American и The Monitor, ежемесячном журнале Американской психологической ассоциации. Стефани получила степень бакалавра психологии в Университете Южной Каролины и диплом о высшем образовании в области научной коммуникации в Калифорнийском университете в Санта-Круз.
титан
титан —
Имена и идентификаторы| Название | Титан |
| Синонимы | Титан, AAS Стандартный раствор TITANIUM AA Стандарт TITANIUM AA | ICP Калибрация | Проверьте стандартный TITANIUME TITANIUM AA | ICP Калибрация | Проверьте стандартный TITANIUME TITANIUM AA | ICP AALIMENTIAL STANKER TITANIUME TITANIUM AA | ICP.  ТИТАН АТОМНО-АБСОРБЦИОННЫЙ СТАНДАРТ ТИТАН АТОМНО-АБСОРБЦИОННЫЙ СТАНДАРТ Titanium foil |
| CAS | 7440-32-6 |
| EINECS | 241-036-9 |
| InChI | InChI=1S/Ti |
titanium —
Physico -химические свойства| Молекулярная формула | Ti |
| Молярная масса | 47,867 |
| Плотность 9007 °C ат.0071 | |
| Melting Point | 1660 °C(lit.) |
| Boling Point | 3287 °C(lit.) |
| Flash Point | 0°C |
| Physical and Chemical Properties | Серебристо-серый металл. Титан А-типа имеет гексагональную форму, а титан β-типа — кубическую форму. Температура перехода составила 882,5°С. Температура плавления (1660±10) °С. Температура кипения 3287°С. Относительная плотность d204,5. Растворим в разбавленной кислоте, нерастворим в холодной и горячей воде. Коррозионная стойкость морской воды очень сильна. Растворим в разбавленной кислоте, нерастворим в холодной и горячей воде. Коррозионная стойкость морской воды очень сильна. |
| Применение | Пластмассовая форма Химическое оборудование Реактор теплообмена Генератор Трубчатый испаритель Адсорбер с неподвижным слоем теплообменник Ребойлер (ребойлер) Головка конденсатора Башня |
титан —
Риск и безопасность| Коды риска | R20/21/22 — Вреден при вдыхании, при контакте с кожей и при проглатывании. R11 — легковоспламеняющийся R17 — Самовозгорание на воздухе R36/38 — Раздражает глаза и кожу. |
| Описание техники безопасности | S16 — Хранить вдали от источников воспламенения. S36/37/39 — Носите подходящую защитную одежду, перчатки и средства защиты глаз/лица. S33 — Примите меры предосторожности против статических разрядов. S27 — Немедленно снять всю загрязненную одежду.  S26 — При попадании в глаза немедленно промыть большим количеством воды и обратиться к врачу. S6 — Держать под… (далее следует название инертного газа). |
титан —
натурсеребристо-серый металл. Титан типа А имеет гексагональную форму до 882,5 ° C. Температура плавления 1 720 °С. Температура кипения 3 5 30. Относительная плотность d20 4,5. Растворим в плавиковой кислоте, азотной кислоте, концентрированной серной кислоте, нерастворим в воде. Коррозионная стойкость морской воды очень сильна.
Последнее обновление:2022-01-01 11:06:23
титан —
Способ получения Сырьем для промышленного производства титана в основном является рутиловая руда или шлак с высоким содержанием титана (содержащий 92% или более TiO2). Процесс производства титановой губки основан на использовании шлака с высоким содержанием титана и нефтяного кокса в качестве сырья для производства тетрахлорида титана. Титановую губку можно получить восстановлением очищенного четыреххлористого титана магнием или натрием в потоке инертного газа.
Титановую губку можно получить восстановлением очищенного четыреххлористого титана магнием или натрием в потоке инертного газа.
Метод восстановительной дистилляции магния: доля шлака с высоким содержанием титана и нефтяного кокса составляет 100 (30 ~ 33), и смесь разбивается до размера менее 160 меш и направляется в печь хлорирования с псевдоожиженным слоем, а газообразный хлор проходит через в нижней части печи, равномерно входят в реакционную секцию корпуса печи и реагируют со смешанным материалом из шлака с высоким содержанием титана и нефтяного кокса. Температура реакции составляла около 850°С. Образующийся газообразный тетрахлорид титана выходит из верхней части печи и поступает в два пылеуловителя сепаратора, соединенных последовательно, так что высококипящие соединения, такие как трихлорид железа, дихлорид железа, дихлорид марганца и трихлорид алюминия, смешанные с газообразным тетрахлоридом титана, осаждаются при нижней части пылесборника сепаратора. Газ повторно вводили в два набора конденсаторов, соединенных последовательно, и газообразный тетрахлорид титана охлаждали до температуры ниже 136°С. Получали неочищенный раствор тетрахлорида титана. Низкокипящие вещества, такие как четыреххлористый кремний, отгоняют при помощи колонны с поплавковым клапаном. После нагревания до 140°С в башне с медной стружкой газифицированный тетрахлорид титана пропускают в башню с медной стружкой, а содержащийся примесь трихлорид ванадила восстанавливают медью до низковалентного хлорида ванадия. Очищенный газообразный тетрахлорид титана, выходящий из верхней части колонны, подвергали реакции восстановления магнием в потоке инертного газа при температуре около 9°С.00°С. Для получения титановой губки. Поскольку полученный губчатый титан также содержит хлорид магния в качестве побочного продукта и непрореагировавший магний, губчатый титан необходимо поместить в вакуум от 0,1 до 10-3 Па, примеси отделить от титана нагреванием примерно до 1000°С.
Получали неочищенный раствор тетрахлорида титана. Низкокипящие вещества, такие как четыреххлористый кремний, отгоняют при помощи колонны с поплавковым клапаном. После нагревания до 140°С в башне с медной стружкой газифицированный тетрахлорид титана пропускают в башню с медной стружкой, а содержащийся примесь трихлорид ванадила восстанавливают медью до низковалентного хлорида ванадия. Очищенный газообразный тетрахлорид титана, выходящий из верхней части колонны, подвергали реакции восстановления магнием в потоке инертного газа при температуре около 9°С.00°С. Для получения титановой губки. Поскольку полученный губчатый титан также содержит хлорид магния в качестве побочного продукта и непрореагировавший магний, губчатый титан необходимо поместить в вакуум от 0,1 до 10-3 Па, примеси отделить от титана нагреванием примерно до 1000°С.
Последнее обновление:2022-01-01 11:06:24
титан —
Применение Титановый сплав имеет высокую прочность, большое количество конструкционных материалов, применяемых в производстве военных сверхзвуковых самолетов, обжатие Компоненты реактивных двигателей , детали корпусов самолетов, корпуса, противопожарные преграды, заклепки, конструктивные элементы авиатранспортной техники, есть «космический металл»; Бронеплиты и лопасти гребных винтов военных объектов и военных кораблей. В гражданской промышленности титан и его сплавы могут применяться при изготовлении различных насосов, клапанов, фильтрационной, испарительной аппаратуры, проволочной сетки и различных деталей машин. Порошкообразный титан можно использовать в качестве поглотителя кислорода в процессе производства электронных ламп.
В гражданской промышленности титан и его сплавы могут применяться при изготовлении различных насосов, клапанов, фильтрационной, испарительной аппаратуры, проволочной сетки и различных деталей машин. Порошкообразный титан можно использовать в качестве поглотителя кислорода в процессе производства электронных ламп.
Последнее обновление:2022-01-01 11:06:24
титан —
Безопасность код опасности: легковоспламеняющееся твердое вещество. GB4.1 класс 41505. № ООН 2678 (порошок стронция). КОД IMDG, стр. 4177, класс 4.1. Каждая партия продукта должна быть разделена на бочки из оцинкованного железа, выстланные пластиковой пленкой, и вес каждой (части) бочки составляет 70 ~ 250, и она запечатана большой открытой крышкой. Титан, восстановленный магнием, должен быть вакуумирован и заполнен аргоном в цилиндре после упаковки. Титан можно защитить без аргона восстановлением натрия. На внешней стороне упаковочной бочки должно быть указано «Влагозащищенный». Хранить следует в проветриваемом, сухом складском помещении. Нельзя штабелировать на открытом воздухе и не смешивать с кислотой, щелочью и другими коррозионно-активными веществами. В процессе транспортировки необходимо избегать дождя и влажности. Во время погрузки и разгрузки следует соблюдать осторожность, чтобы не повредить упаковочную бочку. Тетрахлорид титана, используемый в производственном процессе, может вызывать у людей, страдающих хроническим бронхитом, хроническим гипертрофическим ринитом, фарингитом. Дисфункция вегетативной нервной системы, повышение сухожильных рефлексов, тремор век и рук, гипергидроз. Термические ожоги труднее заживали при воздействии 10% раствора тетрахлорида титана. При воздействии дыма тетрахлорида титана надевайте промышленный противогаз с фильтром. Для защиты глаз и кожи. Если вы случайно попали на кожу, сотрите ее хлопчатобумажной марлей, а затем тщательно промойте водой. Производственное оборудование должно быть закрыто, а цех должен хорошо проветриваться. Для тушения пожара можно использовать сухой порошок и сухой песок, а воду, пену и углекислый газ категорически запрещается.
Нельзя штабелировать на открытом воздухе и не смешивать с кислотой, щелочью и другими коррозионно-активными веществами. В процессе транспортировки необходимо избегать дождя и влажности. Во время погрузки и разгрузки следует соблюдать осторожность, чтобы не повредить упаковочную бочку. Тетрахлорид титана, используемый в производственном процессе, может вызывать у людей, страдающих хроническим бронхитом, хроническим гипертрофическим ринитом, фарингитом. Дисфункция вегетативной нервной системы, повышение сухожильных рефлексов, тремор век и рук, гипергидроз. Термические ожоги труднее заживали при воздействии 10% раствора тетрахлорида титана. При воздействии дыма тетрахлорида титана надевайте промышленный противогаз с фильтром. Для защиты глаз и кожи. Если вы случайно попали на кожу, сотрите ее хлопчатобумажной марлей, а затем тщательно промойте водой. Производственное оборудование должно быть закрыто, а цех должен хорошо проветриваться. Для тушения пожара можно использовать сухой порошок и сухой песок, а воду, пену и углекислый газ категорически запрещается. При сильном нагреве или интенсивном горении взрыв может быть вызван водяным гашением.
При сильном нагреве или интенсивном горении взрыв может быть вызван водяным гашением.
Последнее обновление:2022-01-01 11:06:25

 , Holleman. Lehrbuch der Anorganischen Chemie / Wiberg, Egon; Wiberg, Nils. — 91—100. — Берлин: Walter de Gruyter, 1985. — С. 1056—1057. — ISBN 3110075113.
, Holleman. Lehrbuch der Anorganischen Chemie / Wiberg, Egon; Wiberg, Nils. — 91—100. — Берлин: Walter de Gruyter, 1985. — С. 1056—1057. — ISBN 3110075113.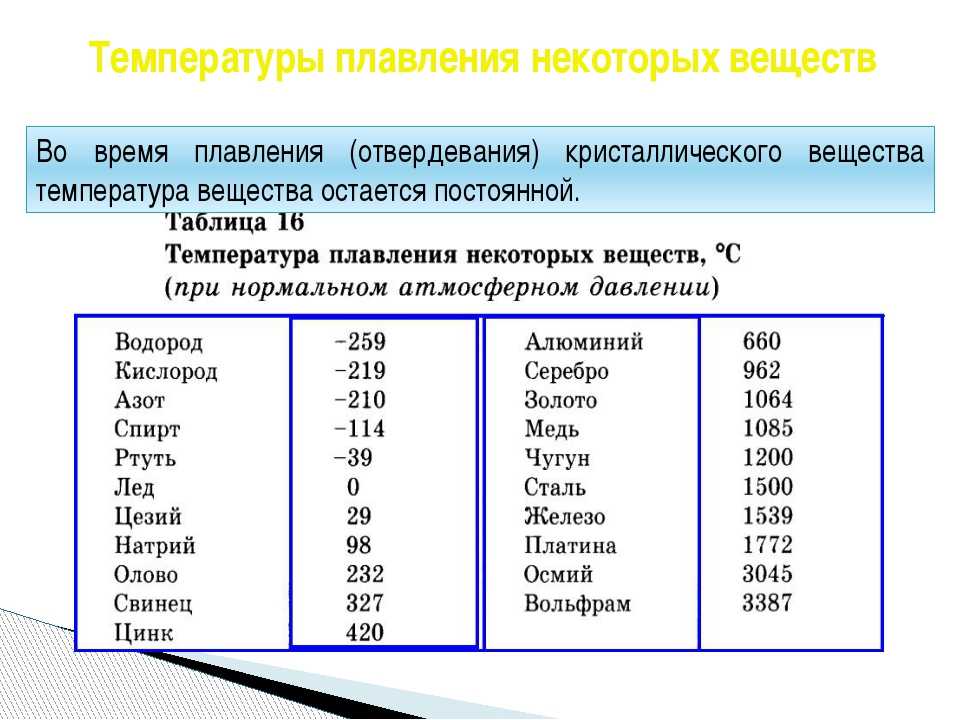 — 1922. — Livr. 174. — P. 1347–1349.
— 1922. — Livr. 174. — P. 1347–1349.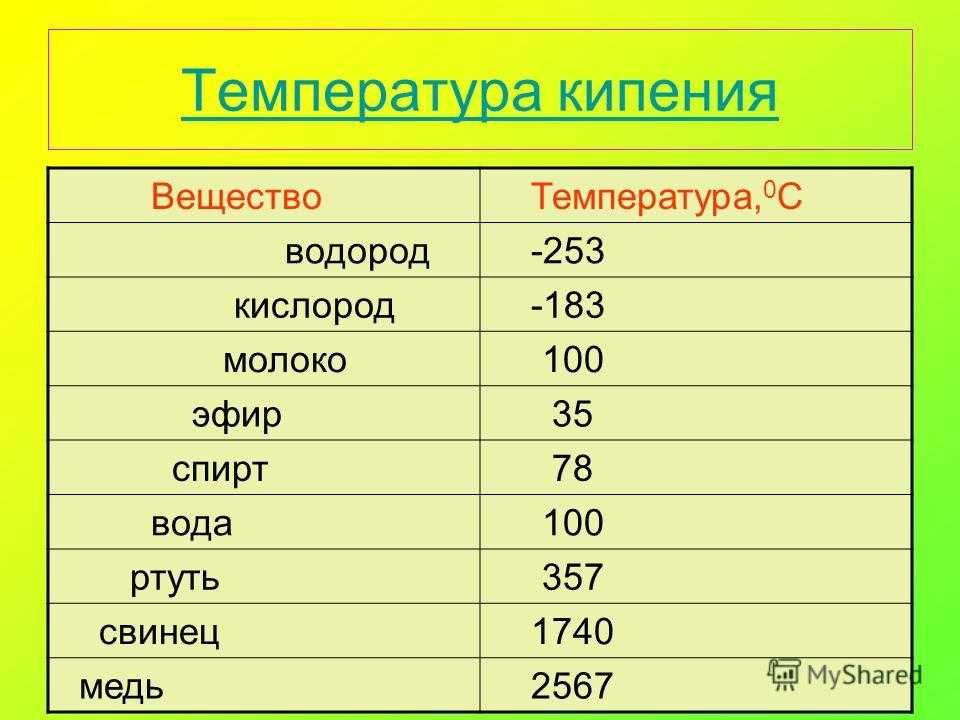 1. — S. 345–350. — doi:10.1002/zaac.19251480133.
1. — S. 345–350. — doi:10.1002/zaac.19251480133.
 ) // Industrial and Engineering Chemistry : статья. — 1961. — Iss. 53, no. 2. — P. 97–104. — doi:10.1021/ie50614a019.
) // Industrial and Engineering Chemistry : статья. — 1961. — Iss. 53, no. 2. — P. 97–104. — doi:10.1021/ie50614a019.
 : Бином. Лаборатория знаний, 2008. — Т. 2. — С. 293. — 607 с. — (Лучший зарубежный учебник. В 2-х томах). — 2000 экз. — ISBN 978-5-94774-373-9.
: Бином. Лаборатория знаний, 2008. — Т. 2. — С. 293. — 607 с. — (Лучший зарубежный учебник. В 2-х томах). — 2000 экз. — ISBN 978-5-94774-373-9.

 При контакте с воздухом образуется соляная кислота. Разъедает многие металлы в присутствии воды.
При контакте с воздухом образуется соляная кислота. Разъедает многие металлы в присутствии воды.
 См Примечания Эффект от воздействия может проявляться с задержкой. Необходимо медицинское обследование.
См Примечания Эффект от воздействия может проявляться с задержкой. Необходимо медицинское обследование.
 WISER предоставляет широкий спектр информации об опасных веществах, в том числе
поддержка идентификации, физические характеристики, информация о здоровье человека и
советы по сдерживанию и подавлению. Для начала настройте свой профиль и
выберите элемент ниже.
WISER предоставляет широкий спектр информации об опасных веществах, в том числе
поддержка идентификации, физические характеристики, информация о здоровье человека и
советы по сдерживанию и подавлению. Для начала настройте свой профиль и
выберите элемент ниже.
 Испанские переводы этого контента скоро появятся.
Испанские переводы этого контента скоро появятся.