необходимые условия процесса на производстве и дома
Медь – пластичный материал, не подверженный окислению. Из него делают небольшие детали, используют в ремонтных работах. Переплавить лом можно самостоятельно в гараже, хозяйственной постройке или на собственной кухне. Специалисты подскажут, как расплавить медь в кустарных условиях. Технология несложная, главное при расплавлении учитывать физические свойства меди и сплавов.
Нахождение в природе
Свое латинское название Cuprum металл получил от названия острова Кипр, где его научились добывать в третьем тысячелетии до н. э. В системе Менделеева Сu получил 29 номер, а расположен в 11-й группе четвертого периода.
В земной коре элемент на 23-м месте по распространению и встречается чаще в виде сульфидных руд. Наиболее распространены медный блеск и колчедан. Сегодня медь из руды добывается несколькими способами, но любая технологий подразумевает поэтапный подход для достижения результата.
- На заре развития цивилизации люди уже получали и использовали медь и ее сплавы.

- В то время добывалась не сульфидная, а малахитовая руда, которой не требовался предварительный обжиг.
- Смесь руды и углей помещали в глиняный сосуд, который опускался в небольшую яму.
- Смесь поджигалась, а угарный газ помогал малахиту восстановиться до состояния свободного Cu.
- В природе есть самородная медь, а богатейшие месторождения находятся в Чили.
- Сульфиды меди нередко образуются в среднетемпературных геотермальных жилах.
- Часто месторождения имеют вид осадочных пород.
- Медяные песчаники и сланцы встречаются в Казахстане и Читинской области.
Химический состав меди
В природе она не однородна по своему составу, так как содержит ряд кристаллических элементов, образующих с ней устойчивую структуру, так называемые растворы, которые можно подразделить на три группы:
- Твердые растворы. Образуются, если в составе содержаться примеси железа, цинка, сурьмы, олова, никеля и многих других веществ. Такие вхождения существенно снижают ее электрическую и тепловую проводимость.
 Они усложняют горячий вид обработки под давлением.
Они усложняют горячий вид обработки под давлением. - Примеси, растворяющиеся в медной решетке. К ним относятся висмут, свинец и другие компоненты. Не ухудшают качества электропроводимости, но затрудняют обработку под давлением.
- Примеси, формирующие хрупкие химические соединения. Сюда входят кислород и сера, а также другие элементы. Они ухудшают прочностные качества, в том числе снижают электропроводность.
Масса меди с примесями гораздо больше, чем в чистом виде. Ко всему прочему, элементы примесей существенно влияют на конечные характеристики уже готового продукта. Поэтому их суммарный состав, в том числе количественный, по отдельности должен регулироваться еще на этапе производства. Рассмотрим более подробно влияние каждого элемента на характеристики конечных медных изделий.
- Кислород. Один из самых нежелательных элементов для любого материала, не только медного. С его ростом ухудшается такое качество, как пластичность и устойчивость к коррозионным процессам.
 Его содержание не должно превышать 0,008%. В ходе термической обработки в результате процессов окисления количественное содержание этого элемента уменьшается.
Его содержание не должно превышать 0,008%. В ходе термической обработки в результате процессов окисления количественное содержание этого элемента уменьшается. - Никель. Образует устойчивый раствор и существенно снижает показатели проводимости.
- Сера или селен. Оба компонента одинаково влияют на качество готовой продукции. Высокая концентрация таких вхождений снижает пластичные свойства медных изделий. Содержание таких компонентов не должно превышать 0,001% от общей массы.
- Висмут. Негативно влияет на механические и технологические характеристики готовой продукции. Максимальное содержание не должно превышать 0,001%.
- Мышьяк. Он не меняет свойств, но образует устойчивый раствор, является своего рода защитником от пагубного влияния других элементов, как кислород, сурьма или висмут.
Химический состав меди
- Марганец. Он способен полностью раствориться в меди практически при комнатной температуре. Влияет на проводимость тока.
- Сурьма.
 Компонент лучше всех растворятся в меди, наносит ей минимальный вред. Содержание его не должно превышать 0,05% от массы меди.
Компонент лучше всех растворятся в меди, наносит ей минимальный вред. Содержание его не должно превышать 0,05% от массы меди. - Олово. Образует устойчивый раствор с медью и повышает ее свойства по проведению тепла.
- Цинк. Его содержание всегда минимально, поэтому такого пагубного влияния он не оказывает.
Фосфор. Основной раскислитель меди, максимальное содержание которого при температуре 714°С составляет 1,7%.
Латунь
Латунь
Сплав на основе меди с добавлением цинка называется латунь. В некоторых ситуациях добавляется олово в меньших пропорциях. Джеймс Эмерсон в 1781 году решил запатентовать комбинацию. Содержание цинка в сплаве может варьироваться от 5 до 45%. Латуни различают в зависимости от предназначения и спецификации:
- простые, состоящие из двух компонентов – меди и цинка. Маркировка таких сплавов обозначается буквой «Л», напрямую значащая содержание меди в сплаве в процентах;
- многокомпонентные латуни – содержат множество других металлов в зависимости от назначения к использованию.
 Такие сплавы повышают эксплуатационные свойства изделий, обозначаются также буквой «Л», но с прибавлением цифр.
Такие сплавы повышают эксплуатационные свойства изделий, обозначаются также буквой «Л», но с прибавлением цифр.
Физические свойства латуни относительно высокие, коррозийная стойкость на среднем уровне. Большинство сплавов не критично к пониженным температурам, возможно эксплуатировать металл в различных условиях. Технологии получения латуни взаимодействует с процессами медной и цинковой промышленности, обработке вторичного сырья. Эффективным способом плавки является использование электропечи индукционного типа с магнитным отводом и регулировкой температуры. После получения однородной массы, она разливается в формы и подвергается процессам деформации.
Плавка латуни
Применение материала в различных отраслях, повышает на него спрос с каждым годом. Сплав применяется в суд строительстве и производстве боеприпасов, различных втулок, переходников, болтов, гаек и сантехнических материалов.
Бронза
Бронза
Цветной металл для изготовки изделий разных типов начали использовать с древних времен. Данный факт подтверждается найденными материалами при археологических раскопках. Состав бронзы изначально был богат оловом.
Данный факт подтверждается найденными материалами при археологических раскопках. Состав бронзы изначально был богат оловом.
Промышленностью выпускается различное количество разновидностей бронзы. Опытный мастер способен по цвету металла определить его предназначение. Однако не каждому под силу определить точную марку бронзы, для этого используется маркировка. Способы производства бронзы подразделяются на литейные, когда происходит плавление и отлив и деформируемые.
Состав металла зависит от предназначения к использованию. Основным показателем является наличие бериллия. Повышенная концентрация элемента в сплаве, подвергнутая процедуре закаливания, может соперничать с высокопрочными сталями. Наличие в составе олова отнимает у металла гибкость и пластичность.
Производство бронзовых сплавов изменилось с древних времен фактически внедрением современного оборудования. Технология с использованием в качестве флюса в виде древесного угля используется до сих пор. Последовательность получения бронзы:
Последовательность получения бронзы:
- печь разогревается для требуемой температуры, после этого в нее устанавливается тигель;
- после плавки металл может окислится, во избежание этого добавляют флюс в качестве древесного угля;
- кислотным катализатором служит фосфорная медь, добавление происходит после полного прогрева сплава.
Плавка бронзы
Старинные изделия из бронзы подвержены естественным процессам – патинирование. Зеленоватый цвет с белым оттенком проявляется из-за образования пленки, обволакивающей изделие. Искусственные методы патинирования включают в себя методы с использованием серы и параллельным нагреванием до определенной температуры.
Физические свойства
Металл пластичен и на открытом воздухе покрывается оксидной пленкой за короткое время. Благодаря этой пленке медь и имеет свой желтовато-красный оттенок, в просвете пленки цвет может быть зеленовато-голубым. По уровню уровнем тепло- и электропроводности Cuprum на втором месте после серебра.
- Плoтность — 8,94×103 кг/ м3 .
- Удельная теплоемкость при Т=20 ° C — 390 Дж/кг х К.
- Электрическoе удельное при 20−100 ° C — 1,78×10−8 Ом/м.
- Температура кипeния — 2595 ° C.
- Удельная электропрoводность при 20 ° C — 55,5−58 МСм/м.
Значение плотности меди
Плотность — это отношение массы к объему. Выражается она в килограммах на кубический метр всего объема. В виду неоднородности состава, значение плотности может меняться в зависимости процентного содержания примесей. Поскольку существуют разные марки медных прокатов с разным содержанием компонентов, то и значение плотности у них будет разное. Плотность меди можно найти в специализированных технических таблицах, которая равна 8,93х103 кг/м3. Это справочная величина. В этих же таблицах показан удельный вес меди, который равен 8,93 г/см3. Таким совпадением значений плотности и его весовых показателей характеризуются не все металлы.
Основные показатели меди
Не секрет, что от плотности напрямую зависит конечная масса изготовленного изделия. Однако для расчетов гораздо правильнее использовать удельный вес. Этот показатель очень важен для производства изделий из меди или любых других металлов, но применим больше к сплавам. Он выражается отношением массы меди к объему всего сплава.
Однако для расчетов гораздо правильнее использовать удельный вес. Этот показатель очень важен для производства изделий из меди или любых других металлов, но применим больше к сплавам. Он выражается отношением массы меди к объему всего сплава.
При какой температуре плавится медь
Плавления происходит, когда из твердого состояния металл переходит в жидкое. Каждый элемент имеет собственную температуру плавления. Многое зависит от примесей в металле. Обычная температура плавления меди — 1083 ° C. Когда добавляется олово, температура снижается до 930- 1140 ° C. Температура плавления зависит здесь от содержания в сплаве олова. В сплаве купрума с цинком плавление происходит при 900- 1050 ° C .
При нагреве любого металла разрушается его кристаллическая решетка. По мере нагревания повышается температура плавления, но затем выравнивается по достижении определенного предела температуры. В этот момент и плавится металла. Полностью расплавляется, и температура повышается снова.
Когда металл охлаждается, температура снижается, в определенный момент остается на прежнем уровне, пока металл не затвердеет полностью. После полного затвердевания температура снижается опять. Это демонстрирует фазовая диаграмма, где отображен температурный процесс с начала плавления до затвердения. При нагревании разогретая медь при 2560 ° C начинает закипать. Кипение подобно кипению жидких веществ, когда выделяется газ и появляются пузырьки на поверхности. В момент кипения при максимально больших температурах начинается выделение углерода, образующегося при окислении.
Методы, используемые для плавления меди дома
Плавка меди в домашних условиях возможна несколькими способами. Для этого понадобятся определенные инструменты:
- сырье;
- жаропрочный тигель;
- огнеупорная подставка;
- проволочный крюк;
- щипцы для извлечения горячего тигля;
- средства защиты: очки, костюм, перчатки.
Плавление меди дома и на производстве происходит одинаково. Этого добиваются следующими методами:
Этого добиваются следующими методами:
- с помощью муфельной печи;
- с использованием кислородного пламени;
- горном;
- паяльной лампой;
- плавлением в микроволновой печи.
Процесс плавления меди в домашних условиях
С помощью муфельной печи
Литье меди с помощью муфельной печи — довольно простой и удобный метод. Медное сырье измельчают на части, чтобы они быстрее расплавились. Готовый материал кладут в графитовый тигель и помещают в разогретую печь. Форма для литья должна иметь большую температуру плавления, чем цветмет.
Когда сырье станет жидким, тигель с помощью щипцов извлекают из печи. Крюком с поверхности металла убирают оксидную пленку. Затем жидкость наливают в заранее подготовленную форму.
Из чего состоит муфельная печь
Газовая горелка или паяльная лампа
Плавление меди горелкой
Специальную печь может заменить газовая горелка или паяльная лампа. Ее размещают под дном емкости с металлом и следят, чтобы пламя охватывало днище полностью.
При использовании данного метода материал быстро окисляется, поэтому, чтобы не образовалась толстая оксидная пленка, сверху сырье присыпают частицами древесного угля.
Для плавления легкоплавких сплавов из латуни или бронзы вполне достаточно газовой горелки или паяльной лампы.
Горн
Расплавить медь можно с помощью горна. Для этого тигель с измельченным сырьем размещают на раскаленном древесном угле. Чтобы ускорить плавление, используют домашний пылесос, включенный в режиме выдувания. Труба должна иметь металлический зауженный наконечник, так как под воздействием высокой температуры пластик расплавится. Такой метод подойдет для тех, кто регулярно занимается плавлением меди дома.
Чтобы повысить температуру, следует вдувать в горн больше воздуха.
Чертеж передвижного горна
Микроволновая печь
Поможет расплавить медь в домашних условиях мощная микроволновая печь. Для этого убирают вращающуюся тарелку. Чтобы сохранить работоспособность внутренних деталей техники, необходимо поместить тигель в жаропрочный материал, например, обложить огнеупорными кирпичами.
Плавка металлов в микроволновке
Видео по теме: Плавка меди в микроволновке
Публикации по теме
Необходимая температура и процесс плавления бронзы
Показатель температуры плавления латуни для домашнего мастера
Особенности пайки алюминия в домашних условиях
Как определяется плотность
Плотность меди, как и плотность любого другого вещества, является справочной величиной. Она выражается соотношением массы к объему. Самостоятельно вычислить этот показатель весьма сложно, так как без специальных приборов состав проверить невозможно.
Пример расчета плотности меди
Выражается показатель в килограммах на кубический метр или в граммах на кубический сантиметр. Показатель плотности более полезен для производителей, которые на основе имеющихся данных могут скомпоновать ту или иную деталь с требуемыми свойствами и характеристиками.
температура плавления металлов по возрастанию
Главная » Технологии
Автор admin На чтение 2 мин Просмотров 806 Опубликовано
Все металлы можно разделить на три группы в связи с температурой их плавления.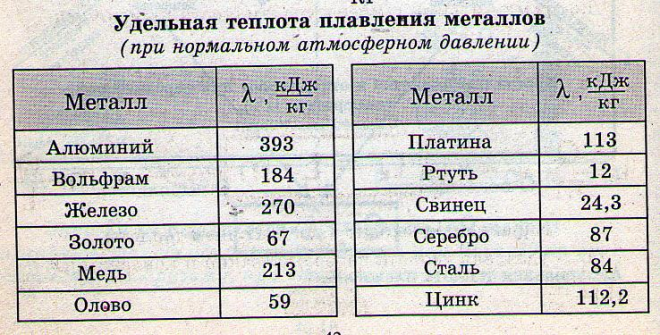 Ниже можно наблюдать список групп.
Ниже можно наблюдать список групп.
Легкоплавкие (до 600°C)
Среднеплавкие (от 600°C до 1600°C)
Тугоплавкие (от 1600°C и выше)
Выше вы можете наблюдать три группы плавления металлов по необходимой температуре. Какие это металлы конкретно, вы сможете посмотреть в таблице.
Содержание
Температуры плавления легкоплавких металлов (до 600°C)
| Название элемента или соединения | Буквенный символ в периодической таблице элементов | Температура образования расплава | Температура закипания |
|---|---|---|---|
| Ртуть | Hg | -38,9°С | +356,7°С |
| Литий | Li | +18°С | +1342°С |
| Цезий | Cs | +28,4°С | +667,5°С |
| Калий | K | +63,6°С | +759°С |
| Натрий | Na | +97,8°С | +883°С |
| Индий | In | +156,6°С | +2072°С |
| Олово | Sn | +232°С | +2600°С |
| Висмут | Bi | +271,4°С | +1564°С |
| Таллий | Tl | +304°С | +1473°С |
| Кадмий | Cd | +321°С | +767°С |
| Свинец | Pb | +327°С | +1750°С |
| Цинк | Zn | +420°С | +907°С |
Температуры плавления среднеплавких металлов и сплавов (от 600°C до 1600°C)
| Наименование | Обозначение металла или химический состав сплава | Температура плавления | Температура кипения |
|---|---|---|---|
| МЕТАЛЛЫ | |||
| Сурьма | Sb | +630,6°С | +1587°С |
| Магний | Mg | +650°С | +1100°С |
| Алюминий | Al | +660°С | +2519°С |
| Барий | Ba | +727°С | +1897°С |
| Кальций | Ca | +842°С | +1484°С |
| Серебро | Ag | +960°С | +2180°С |
| Золото | Au | +1063°С | +2660°С |
| Марганец | Mn | +1246°С | +2061°С |
| Медь | Cu | +1083°С | +2580°С |
| Бериллий | Be | +1287°С | +2471°С |
| Кремний | Si | +1415°С | +2350°С |
| Никель | Ni | +1455°С | +2913°С |
| Кобальт | Co | +1495°С | +2927°С |
| Железо | Fe | +1539°С | +900°С |
| СПЛАВЫ | |||
| Дюрали | Al+ Mg+Cu+Mn | +650°С | |
| Латуни | сплавы на основе меди и цинка | +950…1050°С | |
| Нейзильбер | Cu+Zn+Ni | +1100°С | |
| Чугун | углеродистое железо | +1100…1300°С | |
| Углеродистые стали | +1300…1500°С | ||
| Нихром | Fe+Ni+Cr+Si+Mn+Al | +1400°С | |
| Инвар | Fe+Ni | +1425°С | |
| Фехраль | Fe+Cr+Al+Mn+Si | +1460°С |
Температуры тугоплавких металлов и сплавов (свыше +1600°С)
| Название | Символ элемента, формула соединения | Температура плавления | Температура кипения |
|---|---|---|---|
| Титан | Ti | +1680°С | +3300°С |
| Карбид титана | TiC | +3150°С | – |
| Торий | Th | +1750°С | +4788°С |
| Платина | Pt | +1769,3°С | +3825°С |
| Хром | Cr | +1907°С | +2671°С |
| Карбиды хрома | Cr23C6 | +1660°С | – |
| Cr7С3 | +1780°С | – | |
| Cr3С2 | +1890°С | – | |
| Цирконий | Zr | +1855°С | +4409°С |
| Карбид циркония | ZrC | +3530°С | – |
| Ванадий | V | +1910°С | +3407°С |
| Родий | Rh | +1964°С | +3695°С |
| Иридий | Ir | +2447°С | +4428°С |
| Ниобий | Nb | +2477°С | +4744°С |
| Молибден | Mo | +2623°С | +4639°С |
| Тантал | Ta | +3017°С | +5458°С |
| Вольфрам | W | +3420°С | +5555°С |
Температуры плавления металлов наиболее часто встречающихся быту :
- алюминий – 660 °;
- температура плавления меди – 1083 °;
- температура плавления золота – 1063 °;
- серебро – 960 °;
- олово – 232 °.
 Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов; - свинец – 327 °;
- температура плавления железо – 1539 °;
- температура плавления стали (сплав железа и углерода) – от 1300 ° до 1500 °. Она колеблется в зависимости от насыщенности стали компонентами;
- температура плавления чугуна (также сплав железа и углерода) – от 1100 ° до 1300 °;
- ртуть – -38,9 °.
Как понятно из этой части таблицы, самый легкоплавкий металл – ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Ртуть — единственный металл, находящийся при обычных условиях (нормальное атмосферное давление, средняя температура окружающей среды) в жидком состоянии. Температура плавления ртути составляет порядка -39 градусов по Цельсию.
При какой температуре плавится медь в градусах
При какой температуре плавится медь, плавление
Уже в древности люди добывали и плавили медь.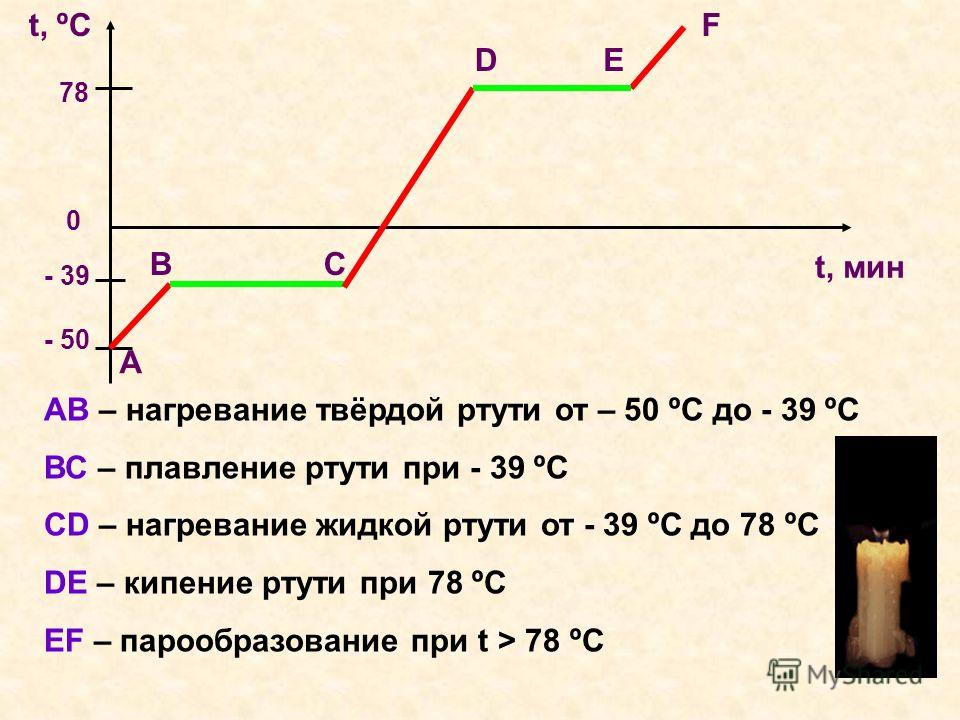 Этот металл широко применялся в быту и служил материалом для изготовления различных предметов. Бронзу научились делать примерно 3 тыс. лет назад. Из этого сплава делали хорошее оружие. Популярность бронзы быстро распространялась, так как металл отличался красивым внешним видом и прочностью. Из него делали украшения, орудия охоты и труда, посуду. Благодаря небольшой температуре плавления меди человек быстро освоил ее производство.
Этот металл широко применялся в быту и служил материалом для изготовления различных предметов. Бронзу научились делать примерно 3 тыс. лет назад. Из этого сплава делали хорошее оружие. Популярность бронзы быстро распространялась, так как металл отличался красивым внешним видом и прочностью. Из него делали украшения, орудия охоты и труда, посуду. Благодаря небольшой температуре плавления меди человек быстро освоил ее производство.
Нахождение в природе
Свое латинское название Cuprum металл получил от названия острова Кипр, где его научились добывать в третьем тысячелетии до н. э. В системе Менделеева Сu получил 29 номер, а расположен в 11-й группе четвертого периода.
В земной коре элемент на 23-м месте по распространению и встречается чаще в виде сульфидных руд. Наиболее распространены медный блеск и колчедан. Сегодня медь из руды добывается несколькими способами, но любая технологий подразумевает поэтапный подход для достижения результата.
youtube.com/embed/FP-ZTrIL_Bs»>- На заре развития цивилизации люди уже получали и использовали медь и ее сплавы.
- В то время добывалась не сульфидная, а малахитовая руда, которой не требовался предварительный обжиг.
- Смесь руды и углей помещали в глиняный сосуд, который опускался в небольшую яму.
- Смесь поджигалась, а угарный газ помогал малахиту восстановиться до состояния свободного Cu.
- В природе есть самородная медь, а богатейшие месторождения находятся в Чили.
- Сульфиды меди нередко образуются в среднетемпературных геотермальных жилах.
- Часто месторождения имеют вид осадочных пород.
- Медяные песчаники и сланцы встречаются в Казахстане и Читинской области.
Физические свойства
Металл пластичен и на открытом воздухе покрывается оксидной пленкой за короткое время. Благодаря этой пленке медь и имеет свой желтовато-красный оттенок, в просвете пленки цвет может быть зеленовато-голубым.
- Плoтность — 8,94×103 кг/ м3 .
- Удельная теплоемкость при Т=20 ° C — 390 Дж/кг х К.
- Электрическoе удельное при 20−100 ° C — 1,78×10−8 Ом/м.
- Температура кипeния — 2595 ° C.
- Удельная электропрoводность при 20 ° C — 55,5−58 МСм/м.
При какой температуре плавится медь
Плавления происходит, когда из твердого состояния металл переходит в жидкое. Каждый элемент имеет собственную температуру плавления. Многое зависит от примесей в металле. Обычная температура плавления меди — 1083 ° C. Когда добавляется олово, температура снижается до 930- 1140 ° C. Температура плавления зависит здесь от содержания в сплаве олова. В сплаве купрума с цинком плавление происходит при 900- 1050 ° C .
При нагреве любого металла разрушается его кристаллическая решетка. По мере нагревания повышается температура плавления, но затем выравнивается по достижении определенного предела температуры. В этот момент и плавится металла. Полностью расплавляется, и температура повышается снова.
По мере нагревания повышается температура плавления, но затем выравнивается по достижении определенного предела температуры. В этот момент и плавится металла. Полностью расплавляется, и температура повышается снова.
Когда металл охлаждается, температура снижается, в определенный момент остается на прежнем уровне, пока металл не затвердеет полностью. После полного затвердевания температура снижается опять. Это демонстрирует фазовая диаграмма, где отображен температурный процесс с начала плавления до затвердения. При нагревании разогретая медь при 2560 ° C начинает закипать. Кипение подобно кипению жидких веществ, когда выделяется газ и появляются пузырьки на поверхности. В момент кипения при максимально больших температурах начинается выделение углерода, образующегося при окислении.
Плавление в домашних условиях
Благодаря низкой температуре плавления древние люди могли расплавлять купрум на костре и использовать металл для изготовления различных изделий.
Для расплавки меди в домашних условиях понадобится:
- древесный уголь;
- тигель и специальные щипцы для него;
- муфельная печь;
- бытовой пылесос;
- горн;
- стальной крюк;
- форма для плавления.
Процесс течет поэтапно, металл помещается в тигель, а затем размещается в муфельной печи. Выставляется нужная температура, а наблюдение за процессом осуществляется через стеклянное оконце. В процессе в емкости с Cu появится окисная пленка, которую нужно устранить — открыть окошко и отодвинуть в сторону стальным крюком.
При отсутствии муфельной печи расплавить медь можно автогеном. Плавление пойдет, если ест нормальный доступ воздуха. Паяльной лампой расплавляется латунь и легкоплавкая бронза. Пламя должно охватить весь тигель.
Если под рукой ничего из перечисленных средств нет, можно использовать горн, установленный на слой древесного угля.
Температура плавления бронзы и латуни, как температура плавления меди и алюминия — невысоки.
Сегодня в промышленных условиях в чистом виде Cu не используется. В ее составе содержится много примесей: никель, железо, мышьяк, сурьма, другие элементы. Качество продукта определяется наличием содержания в процентах примесей в сплаве (не более 1%). Важные показатели — тепло- и электропроводность. Благодаря пластичности, малой Т плавления и гибкости медь широко используется во многих отраслях промышленности.
Источник: tokar.guru
Плавка меди в домашних условиях
На заре человечества люди пытались освоить создание различных элементов из металлов. Такие вещи были более изящные, тонкие и долговечные. Одним из первых была «покорена» медь. Наличие руды требовало расплавления материала и отделения от шлака. Это выполнялось в раскаленных углях на земле. Температуру нагнетали мехами, создающими жар. Процесс был горячим и трудоемким, но позволял получать необычные украшения, посуду и орудия труда. Отдельным направлением стало изготовление оружия для охоты, которое могло служить долгое время. Температура плавления меди относительно невысока, что позволяет и сегодня плавить ее в бытовой обстановке и производить предметы, необходимые для ремонта механизмов или электрического оборудования. Какая температура плавки у меди и ее сплавов? Чем можно выполнить эту процедуру в домашних условиях?
Наличие руды требовало расплавления материала и отделения от шлака. Это выполнялось в раскаленных углях на земле. Температуру нагнетали мехами, создающими жар. Процесс был горячим и трудоемким, но позволял получать необычные украшения, посуду и орудия труда. Отдельным направлением стало изготовление оружия для охоты, которое могло служить долгое время. Температура плавления меди относительно невысока, что позволяет и сегодня плавить ее в бытовой обстановке и производить предметы, необходимые для ремонта механизмов или электрического оборудования. Какая температура плавки у меди и ее сплавов? Чем можно выполнить эту процедуру в домашних условиях?
Главное о меди
В таблице Менделеева этот материал получил название Cuprum. Ему присвоен атомный номер 29. Это пластичный материал, отлично обрабатывающийся в твердом виде шлифовальным и резным оборудованием. Хорошая проводимость напряжения позволяет активно использовать медь в электрике и промышленном оборудовании.
В земной коре материал находится в виде сульфидной руды. Часто встречаемые залежи обнаруживаются в Южной Америке, Казахстане, России. Это медный колчедан и медный блеск. Они образовываются при средней температуре, как геотермальные тоненькие пласты. Находят и чистые самородки, которые не нуждаются в отделении шлака, но требуют плавления для добавки других металлов, т. к. в чистом виде медь обычно не используется.
Часто встречаемые залежи обнаруживаются в Южной Америке, Казахстане, России. Это медный колчедан и медный блеск. Они образовываются при средней температуре, как геотермальные тоненькие пласты. Находят и чистые самородки, которые не нуждаются в отделении шлака, но требуют плавления для добавки других металлов, т. к. в чистом виде медь обычно не используется.
Красновато-желтый оттенок металл имеет благодаря оксидной пленке, покрывающей поверхность сразу, при взаимодействии с кислородом. Оксид не только придает красивый цвет, но и содействует более высоким антикоррозийным свойствам. Материал без оксидной пленки имеет светло-желтый цвет.
Плавится чистая медь при достижении 1080 градусов. Это относительно невысокая цифра позволяет работать с металлом как в производственных условиях, так и дома. Другие физические свойства материала следующие:
- Плотность меди в чистом виде составляет 8,94 х 103 кг/м квадратный.
- Отличается металл и хорошей электропроводностью, которая при средней температуре в 20 градусов является 55,5 S .

- Медь хорошо передает тепло, и этот показатель составляет 390 Дж/кг.
- Выделение углерода при кипении жидкого материала начинается от 2595 градусов.
- Электрическое сопротивление (удельное) в температурном диапазоне от 20 до 100 градусов — 1,78 х 10 Ом/м.
Плавление металла и его сплавов
График плавления меди имеет пять ступеней процесса:
- При температуре 20-100 градусов металл находится в твердом состоянии. Последующий нагрев содействует изменению цвета, что происходит при удалении верхнего оксида.
- При достижении отметки температуры в 1083 градуса, материал переходит в жидкое состояние, а его цвет становится абсолютно белым. В этот момент разрушается кристаллическая решетка металла. На небольшой период рост температуры прекращается, а после достижения полностью жидкой стадии, возобновляется.
- Закипает материал при 2595 градусах. Это схоже с кипением густой жидкости, где также происходит выделение углерода.
- Когда источник тепла выключается, то пиковая температура начинает понижаться.
 При кристаллизации происходит замедление снижения температуры.
При кристаллизации происходит замедление снижения температуры. - После обретения твердой стадии, металл остывает окончательно.
Температура плавления бронзы немного ниже из-за наличия в составе олова. Разрушение кристаллической решетки этого сплава происходит при достижении 950-1100 градусов. Медный сплав с цинком, известный как латунь, способен плавиться от 900°C. Это позволяет работать с материалами при несложном оборудовании.
Плавление в бытовых условиях
Плавка меди в домашних условиях возможна несколькими способами. Для этого понадобиться ряд приспособлений. Сложность процесса зависит от использования конкретного вида оборудования.
Самым простым способом для плавления меди дома является муфельная печь. У мастеров по металлу найдется такое устройство, которым можно будет воспользоваться. Кусочки металла ложатся в специальную емкость — тигель. Он устанавливается в печь, на которой выставляется требуемая температура. Через смотровое окно можно заметить процесс перехода в жидкое состояние, и открыв дверцу удалить оксидную пленку.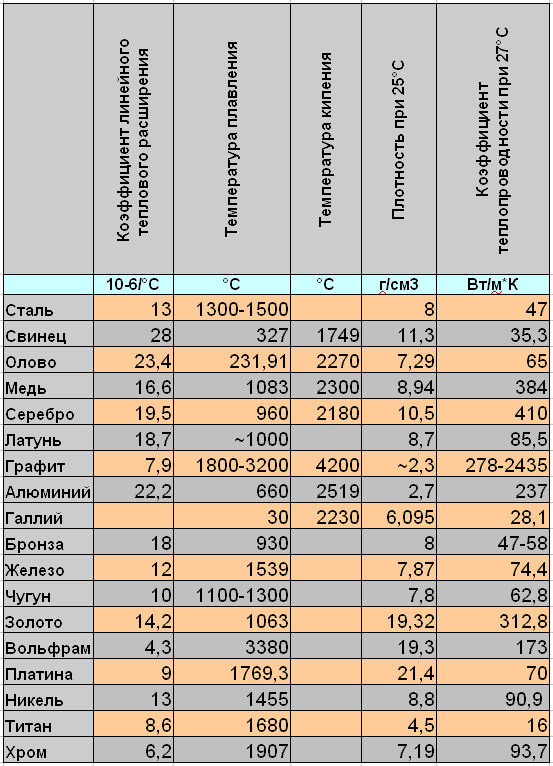 Делать это необходимо стальным крюком и в защитной перчатке. Жар от печи довольно сильный, поэтому действовать необходимо аккуратно.
Делать это необходимо стальным крюком и в защитной перчатке. Жар от печи довольно сильный, поэтому действовать необходимо аккуратно.
Еще одним способом плавки меди в домашних условиях является пропан-кислородное пламя. Оно хорошо подходит и для сплавов металла с цинком или оловом. В качестве рабочего инструмента в руках мастера может быть горелка или резак. Ацетилен-кислородное пламя тоже подойдет, но погреть материал придется немного подольше. Кусочки сплава помещают в тигель, устанавливаемый на жаропрочное основание. Горелкой выполняют произвольные движения по всему корпусу емкости. Быстрый эффект можно получить, если следить чтобы факел пламени касался поверхности тигеля кончиком синего цвета. Там наибольшая температура.
Еще одним способом является мощная микроволновка. Но чтобы повысить теплосберегающие свойства и защитить внутренние детали техники от перегрева, необходимо поместить тигель в жаропрочный материал и накрыть его сверху. Это могут быть специальные виды кирпича.
Самым простым в экономическом плане способом служит слой древесного угля, на который устанавливается горн с медью. Усилить жар можно при помощи пылесоса, работающего на выдув. Кончик шланга направленный на угли должен быть металлическим, а сопло иметь плоскую форму для усиления потока воздуха.
Изготовление деталей и других элементов из меди, путем ее плавки в домашних условиях, возможно благодаря относительно низкой температуре разрушения кристаллической решетки в материале. Используя описанные выше приспособления и ознакомившись с видео, у большинства получится реализовать эту цель.
Источник: svarkalegko.com
Какова температура плавления меди и ее сплавов
Благодаря тому, что температура плавления меди достаточно невысокая, этот металл стал одним из первых, которые древние люди начали использовать для изготовления различных инструментов, посуды, украшений и оружия. Самородки меди или медную руду можно было расплавить на костре, что, собственно, и делали наши далекие предки.
Этап плавления меди
Несмотря на активное применение человечеством с древних времен, медь не является самым распространенным природным металлом. В этом отношении она значительно уступает остальным элементам и занимает в их ряду только 23-е место.
Как плавили медь наши предки
Благодаря невысокой температуре плавления меди, составляющей 1083 градуса Цельсия, наши далекие предки не только успешно получали из руды чистый металл, но и изготавливали различные сплавы на его основе. Чтобы получить такие сплавы, медь нагревали и доводили до жидкого расплавленного состояния. Затем в такой расплав просто добавляли олово или выполняли его восстановление на поверхности расплавленной меди, для чего использовалась оловосодержащая руда (касситерит). По такой технологии получали бронзу – сплав, обладающий высокой прочностью, который использовали для изготовления оружия.
Какие процессы происходят при плавлении меди
Что характерно, температуры плавления меди и сплавов, полученных на ее основе, отличаются.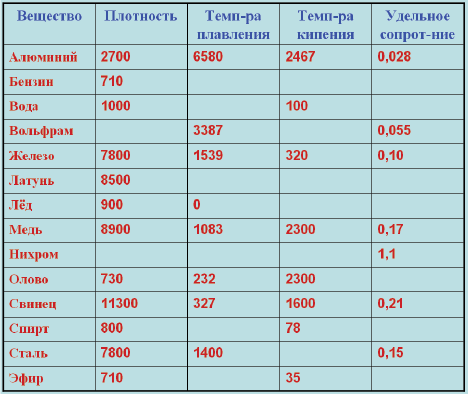 При добавлении в медь олова, имеющего меньшую температуру плавления, получают бронзу с температурой плавления 930–1140 градусов Цельсия. А сплав меди с цинком (латунь) плавится при 900–10500 Цельсия.
При добавлении в медь олова, имеющего меньшую температуру плавления, получают бронзу с температурой плавления 930–1140 градусов Цельсия. А сплав меди с цинком (латунь) плавится при 900–10500 Цельсия.
Во всех металлах в процессе плавления происходят одинаковые процессы. При получении достаточного количества теплоты при нагревании кристаллическая решетка металла начинает разрушаться. В тот момент, когда он переходит в расплавленное состояние, его температура не повышается, хотя процесс передачи ему теплоты при помощи нагрева не прекращается. Температура металла начинает вновь повышаться только тогда, когда он весь перейдет в расплавленное состояние.
Диаграмма состояния системы хром-медь
При охлаждении происходит противоположный процесс: сначала температура резко снижается, затем на некоторое время останавливается на постоянной отметке. После того, как весь металл перейдет в твердую фазу, температура снова начинает снижаться до полного его остывания.
Как плавление, так и обратная кристаллизация меди, связаны с параметром удельной теплоты. Данный параметр характеризует удельное количество теплоты, которая требуется для того, чтобы перевести металл из твердого состояния в жидкое. При кристаллизации металла такой параметр характеризует количество теплоты, которое он отдает при остывании.
Данный параметр характеризует удельное количество теплоты, которая требуется для того, чтобы перевести металл из твердого состояния в жидкое. При кристаллизации металла такой параметр характеризует количество теплоты, которое он отдает при остывании.
Более подробно узнать о плавлении меди помогает фазовая диаграмма, показывающая зависимость состояния металла от температуры. Такие диаграммы, которые можно составить для любых металлов, помогают изучать их свойства, определять температуры, при которых они кардинально меняют свои свойства и текущее состояние.
Кроме температуры плавления, у меди есть и температура кипения, при которой расплавленный металл начинает выделять пузырьки, наполненные газом. На самом деле никакого кипения меди не происходит, просто этот процесс внешне очень его напоминает. Довести до такого состояния ее можно, если нагреть до температуры 2560 градусов.
Как понятно из всего вышесказанного, именно невысокую температуру плавления меди можно назвать одной из основных причин того, что сегодня мы можем использовать этот металл, обладающий многими уникальными характеристиками.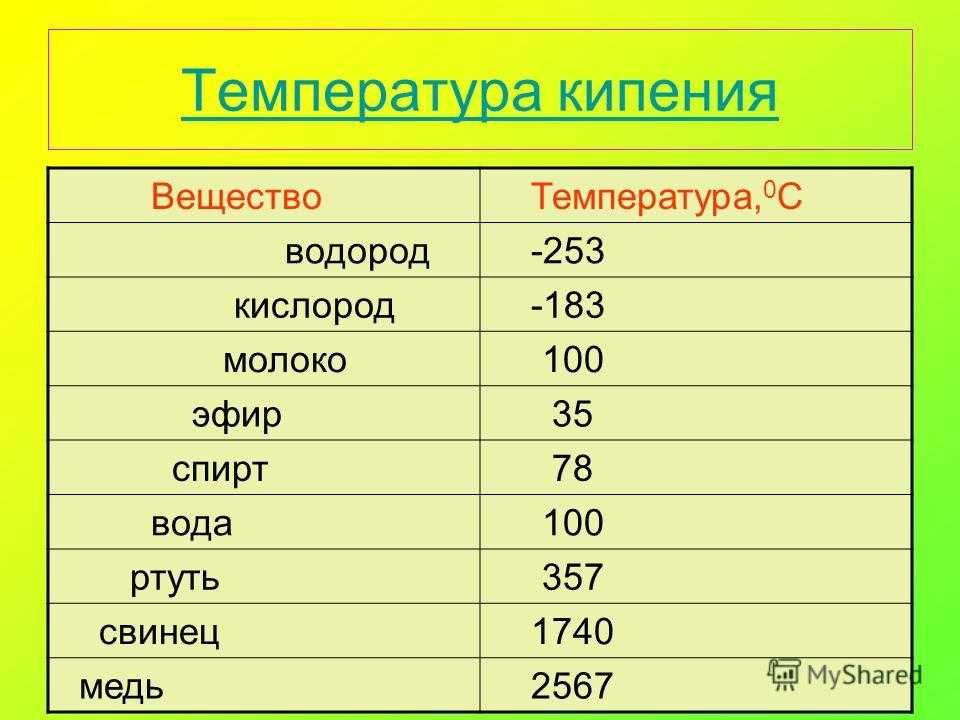
Источник: met-all.org
Температура и условия для плавления меди в домашних условиях
Добывать и плавить медь люди научились с древности. Уже в то время элемент находил широкое применение в быту и из него делали различные предметы. Сплав меди с оловом (бронзу) научились делать около трех тысяч лет назад, из него получалось хорошее оружие. Бронза сразу стала популярной, поскольку отличалась прочностью и красивым внешним видом. Из нее изготавливали украшения, посуду, орудия труда и охоты.
Благодаря невысокой температуре плавления человечеству не составило большого труда быстро освоить производство меди в домашних условиях. Как происходит процесс плавления меди, при какой температуре начинает плавиться?
Происхождение и нахождение меди в природе
Свое название химический элемент получил от названия острова Кипр (Cuprum), там его научились добывать еще в 3 тысячелетии до н.э. В периодической системе химических элементов у меди 29 атомный номер, она расположена в 11 группе 4-го периода.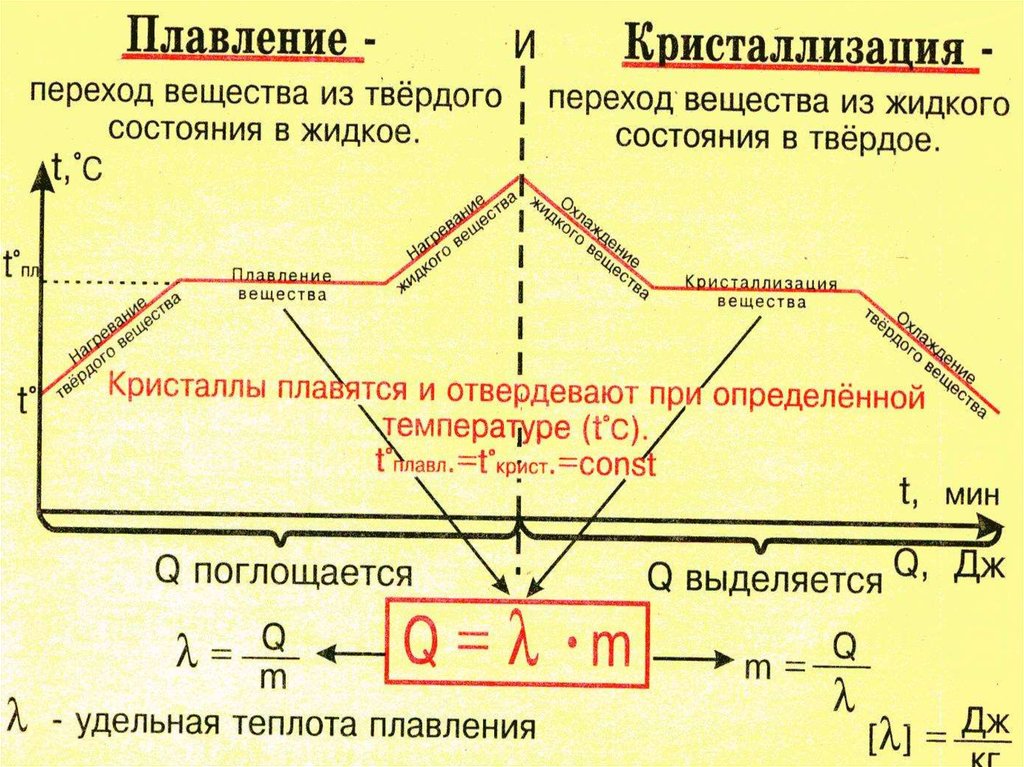 Элемент является пластичным переходным металлом, имеющим золотисто-розовый цвет.
Элемент является пластичным переходным металлом, имеющим золотисто-розовый цвет.
По распространению в земной коре элемент занимает среди других элементов 23 место и чаще всего встречается в виде сульфидных руд. Самыми распространенными видами являются медный колчедан и медный блеск. На сегодняшний день есть несколько способов получения меди из руды, но любая из технологий требует поэтапного подхода, чтобы достичь конечного результата.
В самом начале развития цивилизации люди научились получать и использовать медь, а также ее сплавы. Уже в то далекое время они добывали не сульфидную, а малахитовую руду.В таком виде она не нуждалась в предварительном обжиге. Смесь руды с углями помещали в глиняный сосуд, которые опускали в небольшую яму, после чего смесь поджигали, угарный газ помогал восстановиться малахиту до состояния свободной меди.
В природе медь встречается не только в руде, но и в самородном виде, самые богатые месторождения находятся на территории Чили. Сульфиды меди часто образуются в среднетемпературных геотермальных жилах. Часто медные месторождения могут быть в виде осадочных пород — сланцы и медяные песчаники, которые встречаются в Читинской области и Казахстане.
Сульфиды меди часто образуются в среднетемпературных геотермальных жилах. Часто медные месторождения могут быть в виде осадочных пород — сланцы и медяные песчаники, которые встречаются в Читинской области и Казахстане.
Физически свойства
Пластичный металл на открытом воздухе быстро покрывается оксидной пленкой, она и придает элементу характерный желтовато-красный оттенок, в просвете пленки могут иметь зеленовато-голубой цвет. Медь относится к тем немногим элементам, которые имеют заметную для глаза цветовую окраску. Она обладает высоким уровнем тепло- и электропроводности — это второе место после серебра.
- Плотность — 8,94*10 3 кг/м 3
- Удельная теплоемкость при Т=20 о С — 390 Дж/кг*К
- Электрическое удельное сопротивление в температурном режиме от 20-100 о С — 1,78*10 -8 Ом/м
- Температура кипения — 2595 о С
- Удельная электропроводность при Т=20 о С — 55,5-58 МСм/м.
Температура плавления меди
Процесс плавления происходит, когда металл из твердого состояния переходит в жидкое и у каждого элемента есть своя температура плавления. Многое зависит от наличия примесей в составе металла, обычно медь плавится при температуре 1083 о С. Когда к ней добавляют олово, то температура плавления снижается и составляет 930-1140 о С, температура плавления здесь будет зависеть от содержания в сплаве олова. В сплаве меди с цинком температура плавления становится еще ниже — 900-1050 о С.
Многое зависит от наличия примесей в составе металла, обычно медь плавится при температуре 1083 о С. Когда к ней добавляют олово, то температура плавления снижается и составляет 930-1140 о С, температура плавления здесь будет зависеть от содержания в сплаве олова. В сплаве меди с цинком температура плавления становится еще ниже — 900-1050 о С.
В процессе нагрева любого металла происходит разрушение кристаллической решетки. По мере нагревания температура плавления становится выше, но затем она остается постоянной, после того как достигла определенного температурного предела. В такой момент и происходит процесс плавления металла, он полностью расплавляется и после этого температура снова начинает повышаться.
Когда начинает происходить охлаждение металла, то температура начинает снижаться и в какой-то момент она остается на прежнем уровне до момента полного затвердения металла. Затем металл затвердевает полностью и температура снова снижается. Это можно увидеть на фазовой диаграмме, где отображен весь температурный процесс с начала момента плавления и до затвердения металла.
Разогретая медь при нагревании начинает переходить в состояние кипения при температуре 2560 о С. Процесс кипения металла очень напоминает процесс кипения жидких веществ, когда начинает выделяться газ и на поверхности появляются пузырьки. В моменты кипения металла при максимально высоких температурах начинает выделяться углерод, который образуется в результате окисления.
Плавление меди в домашних условиях
Низкая температура плавления позволила людям в древности расплавлять металл прямо на костре и затем использовать готовый металл в быту, чтобы сделать оружие, украшения, посуду, орудия труда. Для плавления меди в домашних условиях понадобятся следующие предметы:
- Тигель и специальные щипцы для него.
- Древесный уголь.
- Муфельная печь.
- Горн.
- Бытовой пылесос.
- Форма для плавления.
- Стальной крюк.
Весь процесс происходит поэтапно, для начала металл нужно положить в тигель, после чего разместить в муфельную печь. Установить нужную температуру и наблюдать за процессом через стеклянное окошко. В процессе плавления в емкости с металлом появится окисная пленка, ее необходимо убрать, открыв окошко и стальным крюком отодвинуть в сторону.
Установить нужную температуру и наблюдать за процессом через стеклянное окошко. В процессе плавления в емкости с металлом появится окисная пленка, ее необходимо убрать, открыв окошко и стальным крюком отодвинуть в сторону.
Если нет муфельной печи, то медь можно расплавить с помощью автогена, плавление будет происходить при нормальном доступе воздуха. Используя паяльную лампу можно расплавить желтую медь (латунь) и легкоплавкие виды бронзы. Следить за тем, чтобы пламя охватило весь тигель.
Если в домашних условиях нет ничего из перечисленных средств, тогда можно воспользоваться горном, установив его на слой древесного угля. Чтобы усилить температуру можно использовать бытовой пылесос, включив режим выдувания, но только если шланг имеет металлический наконечник. Хорошо, если наконечник будет иметь зауженный конец, чтобы струя воздуха была более тонкой.
В современных промышленных условиях медь в чистом виде не применятся, ее состав содержит в себе много различных примесей — железа, никеля, мышьяка и сурьмы, а также других элементов. Качество готового изделия определяется наличием процентного содержания примесей в сплаве, но не более 1%. Важными показателями являются тепло- и электропроводность металла. Медь широко используется во многих отраслях промышленности благодаря своей пластичности, гибкости и низкой температуре плавления.
Качество готового изделия определяется наличием процентного содержания примесей в сплаве, но не более 1%. Важными показателями являются тепло- и электропроводность металла. Медь широко используется во многих отраслях промышленности благодаря своей пластичности, гибкости и низкой температуре плавления.
Источник: stanok.guru
Самостоятельное плавление меди
Медные изделия получили широкое распространение не только в промышленности, но и в быту. Это дает повод домашним мастерам задуматься о том, как самостоятельно изменить качество материала для дальнейшего изготовления металлических предметов. Плавка меди – особая технология, обеспечивающая ее переход из твердого состояния в жидкое под влиянием высоких температур.
Основные характеристики меди
Металл легко поддается обработке. О его уникальных свойствах знали еще наши предки, о чем свидетельствуют исторические сведения и археологические находки. В природе он встречается как в соединениях, так и в самородном варианте. Поверхность меди мягкая, желтовато-бурого оттенка. Контактируя с воздухом, она затягивается оксидной пленкой. Технические характеристики меди следующие:
Поверхность меди мягкая, желтовато-бурого оттенка. Контактируя с воздухом, она затягивается оксидной пленкой. Технические характеристики меди следующие:
- Занимает второе место после серебра по электропроводности и теплопроводности.
- Невысокая температура плавления: для чистой меди она составляет 1083 градусов, для медных сплавов – от 930 до 1140 градусов.
- При температуре 2560 градусов материал начинает закипать.
- Медь является диамагнетиком.
- Подбирая лом для вторичной переработки, важно помнить, что электротехническая медь является самой чистой – без примесей.
- Сплавы из бронзы и латуни, из которых сделаны многие раритетные вещи, могут содержать в себе ядовитые вещества, например, мышьяк.
С такими веществами нужна особая осторожность.
Медь является красивым материалом. Изделия из него выглядят роскошно, благородно. Этим свойством продукт привлекает к себе внимание многих домашних умельцев.
Характеристика способов плавления меди
Плавка меди дома и на производстве проходит одинаково.
Процесс изменения состояния осуществляется под влиянием повышения температуры. При достаточном количестве тепла металлическая структура предмета разрушается. Добиться такого эффекта можно несколькими способами.
Муфельная печь
Литье с использованием лабораторной муфельной печи, в которой имеется регулировка температуры нагрева. Это довольно простой метод. Сырье предварительно измельчают на части. Чем они меньше, тем быстрее будет плавление.
Подготовленный материал кладут в графитовый тигель и помещают в предварительно разогретую печь. Форма для заливки должна иметь температуру плавления больше, чем у меди. Нагревательное устройство серийного производства оборудовано специальным окном, позволяющим следить за технологическим процессом.
Когда медь достигнет жидкого состояния, тигель железными щипцами извлекают из печи. Проволочным крюком с поверхности расплавленного металла к краям тигля убирают оксидную пленку. После проделанных манипуляций жидкую консистенцию аккуратно заливают в заранее приготовленную емкость.
Газовая горелка
Также осуществляется плавка меди с применением газовой горелки. При отсутствии тигельной печи вполне подойдет ручная портативная газовая горелка. Ее нужно разместить под дном емкости с металлом и следить за тем, чтобы пламя полностью охватывало днище.
Метод позволяет быстро окислять материал, так как предполагает наличие тесного контакта с воздухом. Чтобы не образовывалась толстая оксидная пленка, расплавленную массу присыпают измельченным древесным углем.
Паяльная лампа
Литье меди на основе паяльной лампы происходит так же, как и с газовой горелкой. Способ применим для легкоплавких металлов.
Растопить медь или её сплавы можно горном. Для этого на хорошо раскаленный древесный уголь помещают тигель с измельченным металлом. Для ускорения процесса используют домашний пылесос, включенный на режиме выдувания.
Труба должна быть небольшого диаметра с железным наконечником, так как пластик расплавится под влиянием высокой температуры. Метод идеально подходит тем людям, кто регулярно занимается литьем металла и в больших объемах.
Метод идеально подходит тем людям, кто регулярно занимается литьем металла и в больших объемах.
Микроволновка
Расплавить медь поможет мощная микроволновая печь с измененной конструкцией. Для этого убирают вращающуюся тарелку-поддон. Из огнеупорного кирпича делают муфельную печь, в которую помещают исходный материал. Устройство необходимо для повышения теплосберегающих свойств сырья и защиты элементов техники от перегрева.
Чистую медь трудно плавить, поскольку она в жидком виде обладает плохой текучестью. Специалисты не советуют из такого материала делать мелкие и сложные детали. Для этого подойдут многокомпонентные соединения на основе латуни, олова или цинка, которым высокие температуры не нужны.
Тем, кто мечтает посвятить плавлению металла свободное время, нужно приготовить для работы такие приспособления:</p> <ul> <li>муфельная печка;</li> <li>чистое сырье;</li> <li>жаропрочный тигель;</li> <li>огнеупорная подставка;</li> <li>крюк из стальной проволоки;</li> <li>щипцы для извлечения тигля из печки;</li> <li>средства индивидуальной защиты: костюм, очки, перчатки.</li> </ul> <p» both=»»>Действия выполняют согласно инструкции:
- Надевают специальный костюм.
- Исходное сырье измельчают, кладут в тигель.
- Помещают в печь, устанавливают нужный температурный режим. Нельзя допускать, чтобы металл закипал.
- При достижении заданной температуры открывают дверцу, захватывают тигель щипцами, достают из печи, ставят на огнеупорную подставку.
- Стальным крюком к краям емкости сдвигают, образовавшуюся в результате плавления, окисную пленку.

- Жидкую медную массу заливают в специальную емкость, охлаждают.
- В мощных муфельных печах можно подвергать плавлению красную медь и всевозможные сплавы.
Плавление горелкой
Следует помнить, что при плавлении важна азотная среда. Под легкоплавкие медные сплавы, латунь или некоторые марки бронзы можно использовать обычную газовую горелку. Для этого понадобится:
- исходное сырье;
- специальные формы;
- щипцы для извлечения металла с раскаленной рабочей поверхности;
- горелка высокого давления, работающая на газе;
- средства защиты: костюм, очки, перчатки.
Технология плавления сплавов следующая:
- Сырье сильно измельчают. Сделать это можно при помощи напильника, превратив материал в опилки.
- Кладут в специальную форму, сделанную из термостойкого материала.
- Надевают защитный костюм, очки, толстые перчатки.
- Зажигают горелку.
- Нагревательное устройство направляют свободными движениями по корпусу емкости.
 Для достижения быстрого результата пламя должно касаться поверхности кончиком синего цвета. В этом месте факела – наибольшая температура.
Для достижения быстрого результата пламя должно касаться поверхности кончиком синего цвета. В этом месте факела – наибольшая температура. - После того как твердое тело расплавится, тигель захватывают щипцами.
- Жидкую массу выливают в нужную форму.
Если нет газовой горелки, можно использовать обыкновенную паяльную лампу.
Выполняя литье цветных сплавов, каждый мастер должен помнить о технике безопасности:
- В помещении, где ведутся работы, должна быть хорошая вентиляция.
- Во избежание получения ожогов необходимо работать в средствах индивидуальной защиты.
Оптимальная температура воздуха, допустимая влажность воздуха, чистота рабочего места, низкая концентрация вредных веществ атмосферы, хорошая освещенность пространства – факторы, помогающие избежать травматизма.
Видео по теме: Проба плавки меди в домашних условиях
ru</code></p> <div»>Физические свойства металлов. Температура плавления и плотность металлов и сплавов
Температуру плавления металлов, которая изменяется от малейшего (-39 °С для ртути) до наибольшего (3400 °С для вольфрама), а также плотность металлов в твердом состоянии при 20 °С и плотности жидких металлов при температуре плавления приведены в таблице плавки цветных металлов.
Таблица 1. Плавки цветных металлов
Атомная масса | Температура плавления t пл , °С | Густота ρ , г/см 3 | ||
твердого при 20 °С | редкого при t пл | |||
Алюминий | ||||
Вольфрам | ||||
Марганец | ||||
Молибден | ||||
Цирконий | ||||
Сварка и плавка цветных металлов
Сварка меди .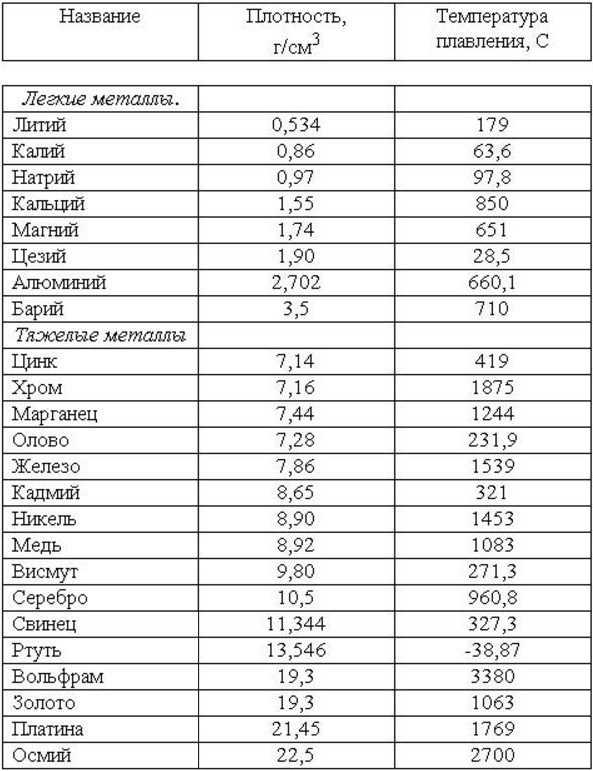 Температура плавки металла Cu, почти в шесть раз превышает температуру плавки стали, медь интенсивно поглощает и растворяет различные газы, образуя с кислородом оксиды. Оксид меди II с медью образует эвтектику, температура плавления которой (1064°С) ниже температуры плавления меди (1083°С). При затвердевании жидкой меди эвтектика располагается по границам зерен, делает медь хрупкой и склонной к образованию трещин. Поэтому основной задачей при сварке меди является защита его от окисления и активное раскисление сварочной ванны.
Температура плавки металла Cu, почти в шесть раз превышает температуру плавки стали, медь интенсивно поглощает и растворяет различные газы, образуя с кислородом оксиды. Оксид меди II с медью образует эвтектику, температура плавления которой (1064°С) ниже температуры плавления меди (1083°С). При затвердевании жидкой меди эвтектика располагается по границам зерен, делает медь хрупкой и склонной к образованию трещин. Поэтому основной задачей при сварке меди является защита его от окисления и активное раскисление сварочной ванны.
Наиболее распространенное газовое сварки меди ацетиленокисневим пламенем с помощью горелок, которые в 1,5…2 раза мощнее горелки для сварки сталей. Присадочным металлом есть медные прутки, содержащие фосфор и кремний. Если толщина изделий более 5…6 мм, их сначала подогревают до температуры 250…300°С. Флюсами при сварке является прожаренная бура или смесь, состоящую из 70% буры и 30% борной кислоты. Чтобы повысить механические свойства и улучшить структуру наплавленного металла, медь после сварки проковывают при температуре около 200…300°С. Потом ее снова нагревают до 500-550°С и охлаждают в воде. Медь сваривают также электродуговым способом электродами, в струе защитных газов, под слоем флюса, на конденсаторных машинах, способом трения.
Потом ее снова нагревают до 500-550°С и охлаждают в воде. Медь сваривают также электродуговым способом электродами, в струе защитных газов, под слоем флюса, на конденсаторных машинах, способом трения.
Сварка латуни . Латунь – это сплав меди с цинком (до 50%). Основное загрязнение при этом – испарение цинка, в итоге чего шов теряет свои качества, в нем возникают поры. Латунь, как и медь, в основном сваривают ацетиленовым окислительным пламенем, при котором на поверхности ванны создается пленка тугоплавкого оксида цинка, уменьшающая дальнейшее выгорание и испарение цинка. Флюсы используют такие же, как и при сварке меди. Они создают на поверхности ванны шлаки, которые связывают оксиды цинка и затрудняют выход паров из сварочной ванны. Латунь сваривают также в защитных газах и на контактных машинах.
Сварка бронзы . В большинстве случаев бронза – это литейный материал, поэтому
сварку применяют при исправлении дефектов или во время ремонта. Чаще всего применяют сварку металлическим электродом. Присадочным металлом является прутки того самого состава, что и основной металл, а флюсами или электродным покрытием – хлористые и фтористые соединения калия и натрия.
Чаще всего применяют сварку металлическим электродом. Присадочным металлом является прутки того самого состава, что и основной металл, а флюсами или электродным покрытием – хлористые и фтористые соединения калия и натрия.
. Основными факторами, затрудняющими сварку алюминия, является низкая температура его плавления (658°С), большая теплопроводность (примерно в 3 раза выше теплопроводности стали), образование тугоплавких оксидов алюминия, которые имеют температуру плавления 2050°С, поэтому технология плавки цветных металлов, таких как медь или бронза, не подходит для плавки алюминия. Кроме того, эти оксиды слабо реагируют как с кислыми, так и основными флюсами, поэтому плохо удаляются из шва.
Чаще всего используют газовую сварку алюминия ацетиленовым пламенем. В последние годы значительно распространилось также автоматическая дуговая сварка металлическими электродами под флюсом и в среде аргона. При всех способах сварки, кроме аргонодуговой, применяют флюсы или электродные покрытия, в состав которых входят фтористые и хлористые соединения лития, калия, натрия и других элементов. Как присадочный металл при всех способах сварки используют проволоку или стержни того же состава, что и основной металл.
Как присадочный металл при всех способах сварки используют проволоку или стержни того же состава, что и основной металл.
Алюминий хорошо сваривается электронным лучом в вакууме, на контактных машинах, электрошлаковым и другими способами.
Сварка сплавов алюминия . Сплавы алюминия с магнием и цинком сваривают без
особых осложнений, так же как и алюминий. Исключением является дюралюминий – сплавы алюминия с медью. Эти сплавы термически упрочняются после закалки и следующего старения. Когда температура плавки цветных металлов свыше 350°С в них происходит снижение прочности, которое не восстанавливается термической обработкой. Поэтому при сварке дюралюминия в зоне термического влияния прочность уменьшается на 40…50%. Если дюралюминий сваривать в защитных газах, то такое снижение может быть восстановлено термической обработкой до 80…90% по отношению к прочности основного металла.
Сварка магниевых сплавов . При газовой сварке обязательно применяют фторидные флюсы, которые в отличие от хлоридных не вызывают коррозии сварных соединений. Дуговая сварка магниевых сплавов металлическими электродами через низкое качество сварных швов до настоящего времени не применяется. При сварке магниевых сплавов наблюдается значительный рост зерна в около шовных участках и сильное развитие столбчатых кристаллов в сварном шве. Поэтому предел прочности сварных соединений составляет 55…60% предела прочности основного металла.
Дуговая сварка магниевых сплавов металлическими электродами через низкое качество сварных швов до настоящего времени не применяется. При сварке магниевых сплавов наблюдается значительный рост зерна в около шовных участках и сильное развитие столбчатых кристаллов в сварном шве. Поэтому предел прочности сварных соединений составляет 55…60% предела прочности основного металла.
Таблица 2. Физические свойства промышленных цветных металлов
Свойства | М еталл | |||||||||||
Атомный номер | ||||||||||||
Атомная масса | ||||||||||||
при температурте 20 °С, кг/м 3 | ||||||||||||
Температура плавления, °С | ||||||||||||
Температура кипения, °С | ||||||||||||
Атомный диаметр, нм | ||||||||||||
Скрытая теплота плавления, кДж/кг | ||||||||||||
Скрытая теплота испарения, | ||||||||||||
Удельная теплоемкость при температуре 20 °С, Дж/(кг . | ||||||||||||
Удельная теплопроводность, 20 °С, Вт/(м —°С) | ||||||||||||
Коэффициент линейного расширения при температуре 25 °С, 10 6 — ° С — 1 | ||||||||||||
Удельное электросопротивление при температуре 20°С, мкОм —м | ||||||||||||
Модуль нормальной упругости, ГПа | ||||||||||||
Модуль сдвига, ГПа | ||||||||||||
Тигельная плавка
Неотъемлемой составляющей производства металла и металлических изделий, является использование во время производственного процесса тиглей для производства, выплавки и переплавки как черного, так и цветного металла. Тигли — это неотъемлемая часть металлургического оборудования при отливании разнообразных металлов, сплавов, и тому подобное.
Тигли — это неотъемлемая часть металлургического оборудования при отливании разнообразных металлов, сплавов, и тому подобное.
Керамический тигель для плавки цветных металлов используется для плавки металлов (меди, бронзы) с древнейших времен.
После
проведения кристаллизации необходимо
удостовериться, что вещество является
достаточно чистым. Наиболее простым и
эффективным методом идентификации и
определения меры чистоты вещества
является определение его температуры
плавления (Т пл).
Температурой плавления называют интервал
температур, при котором твердое вещество
переходит в жидкую фазу. Все чистые
химические соединения имеют узкий
температурный интервал перехода из
твердого состояния в жидкое. Этот
температурный интервал для чистых
веществ составляет максимум 1–2 о С.
Использование температуры плавления
в качестве меры чистоты вещества
основывается на том, что присутствие
примесей (1) понижает температуру
плавления и (2) расширяет температурный
интервал плавления. Например, чистый
образец бензойной кислоты плавится в
интервале 120–122 о С,
а слегка загрязненный – при 114-119 о С.
Использование температуры плавления для идентификации отличается, очевидно, большой неопределенностью, так как существует несколько миллионов органических соединений, и неизбежно температуры плавления многих из них совпадают. Однако, во-первых, Т пл полученного в синтезе вещества почти всегда отличается от Т пл исходных соединений. Во-вторых, можно использовать методику «определения температуры плавления смешанной пробы». Если Т пл смеси равных количеств исследуемого вещества и известного образца не отличается от Т пл последнего, то оба образца представляют собой одно и то же вещество.
МЕТОДИКА
ОПРЕДЕЛЕНИЯ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ .
Тщательно растирают исследуемое вещество
в тонкий порошок. Заполняют веществом
капилляр (на 3–5 мм по высоте; капилляр
должен быть тонкостенным, запаянным с
одной стороны, с внутренним диаметром
0.8–1 мм и высотой 3–4 см). Для этого
осторожно вдавливают капилляр открытым
концом в порошок вещества и периодически
ударяют его запаянным концом о поверхность
стола 5–10 раз. Для полного смещения
порошка к запаянному концу капилляра
его бросают в вертикальную стеклянную
трубку (длиной 30–40 см и диаметром 0.5–1
см) на твердую поверхность. Вставляют
капилляр в металлическую кассету,
закрепленную на носике термометра (рис.
3.5), и помещают термометр с кассетой в
прибор для определения температуры
плавления.
Для полного смещения
порошка к запаянному концу капилляра
его бросают в вертикальную стеклянную
трубку (длиной 30–40 см и диаметром 0.5–1
см) на твердую поверхность. Вставляют
капилляр в металлическую кассету,
закрепленную на носике термометра (рис.
3.5), и помещают термометр с кассетой в
прибор для определения температуры
плавления.
В приборе термометр с капиллярами нагревается электрической спиралью, напряжение на которую подается через трансформатор, и скорость нагрева определяется подаваемым напряжением. Сначала нагревают прибор со скоростью 4– 6 о С в минуту, а за 10 о С до предполагаемой Т пл нагревают со скоростью 1–2 о С в минуту. За температуру плавления принимают интервал от размягчения кристаллов (смокания вещества) до полного их плавления.
Полученные данные записывают в лабораторный журнал.
Перегонка
Перегонка
является важным и широко используемым
методом очистки органических жидкостей
и разделения жидких смесей. Этот метод
заключается в кипячении и выпаривании
жидкости с последующей конденсацией
паров в дистиллят. Разделение двух
жидкостей с разницей температур кипения
50–70 о С
и более можно осуществить простой
перегонкой. Если разница меньше,
необходимо использовать фракционную
перегонку на более сложном приборе.
Некоторые жидкости с высокими температурами
кипения в процессе перегонки разлагаются.
Однако при снижении давления температура
кипения понижается, что позволяет
перегонять высококипящие жидкости без
разложения в вакууме.
Этот метод
заключается в кипячении и выпаривании
жидкости с последующей конденсацией
паров в дистиллят. Разделение двух
жидкостей с разницей температур кипения
50–70 о С
и более можно осуществить простой
перегонкой. Если разница меньше,
необходимо использовать фракционную
перегонку на более сложном приборе.
Некоторые жидкости с высокими температурами
кипения в процессе перегонки разлагаются.
Однако при снижении давления температура
кипения понижается, что позволяет
перегонять высококипящие жидкости без
разложения в вакууме.
При котором кристаллическая решетка металла разрушается и он переходит из твердого фазового состояния в жидкое.
Температура плавления металлов — показатель температуры нагреваемого металла, при достижении которой начинается процесс (плавления). Сам процесс обратный кристаллизации и неразрывно связан с ней. Для того чтобы расплавить металл? его необходимо нагреть, используя внешний источник тепла до температуры плавления, а затем продолжить подвод теплоты для преодоления энергии фазового перехода. Дело в том, что само значение температуры плавления металлов указывает на температуру, при которой материал будет находиться в фазовом равновесии, на границе между жидкостью и твердым телом. При такой температуре чистый металл может существовать одновременно как в твердом, так и в жидком состоянии. Для осуществления процесса плавления необходимо перегреть металл немного больше равновесной температуры, чтобы обеспечить положительный термодинамический потенциал. Дать своеобразный толчок процессу.
Дело в том, что само значение температуры плавления металлов указывает на температуру, при которой материал будет находиться в фазовом равновесии, на границе между жидкостью и твердым телом. При такой температуре чистый металл может существовать одновременно как в твердом, так и в жидком состоянии. Для осуществления процесса плавления необходимо перегреть металл немного больше равновесной температуры, чтобы обеспечить положительный термодинамический потенциал. Дать своеобразный толчок процессу.
Температура плавления металлов постоянна только для чистых веществ. Наличие примесей будет смещать равновесный потенциал в ту или иную сторону. Это происходит потому, что металл с примесями формирует иную кристаллическую решетку, и силы взаимодействия атомов в них будут отличаться от тех, которые присутствуют в чистых материалах.В зависимости от величины температуры плавления, металлы делят на легкоплавкие (до 600°С, такие как галлий, ртуть) , среднеплавкие (600-1600°С, медь, алюминий) и тугоплавкие (>1600°С, вольфрам, молибден).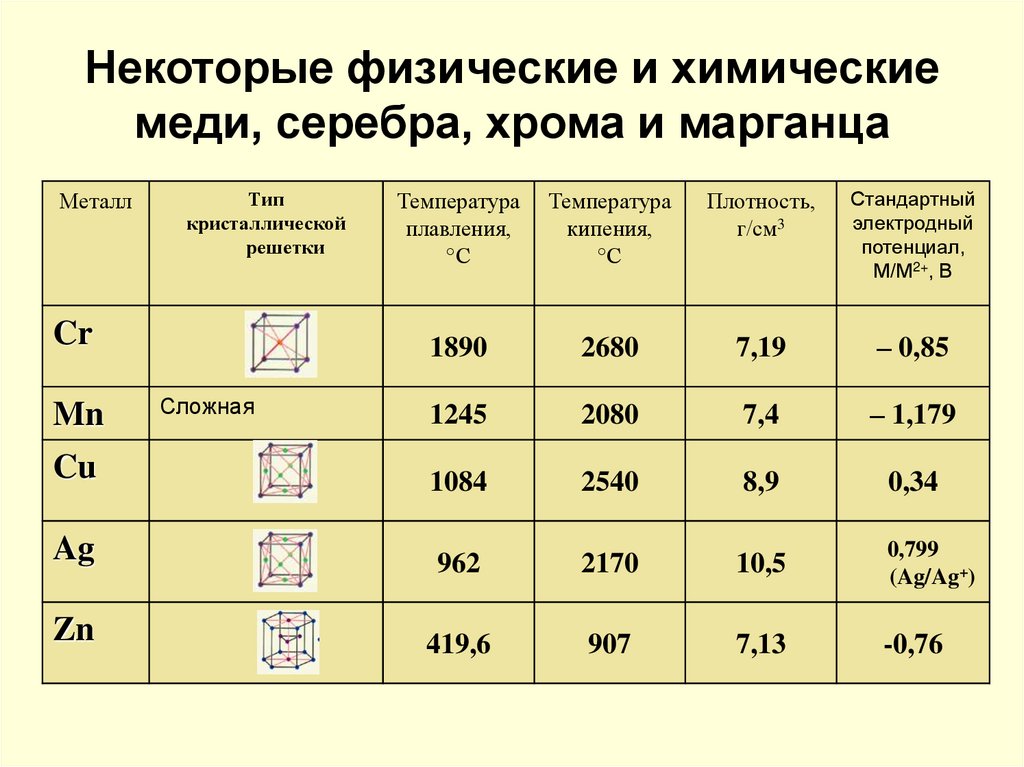
В современном мире чистые металлы используют редко в силу того, что они имеют ограниченный диапазон физических свойств. Промышленность давно и плотно использует различные комбинации металлов — сплавы, разновидностей и характеристик которых гораздо больше. Температура плавления металлов, входящих в состав различных сплавов, будет также отличаться от температуры плавления их сплава. Разные концентрации веществ обуславливают порядок их плавления или кристаллизации. Но существуют равновесные концентрации, при которых металлы, входящие в состав сплава, затвердевают или плавятся одновременно, то есть ведут себя как однородный материал. Такие сплавы называются эвтектическими.
Знать температуру плавления очень важно при работе с металлом, эта величина необходима как в производстве, для расчета параметров сплавов, так и при эксплуатации металлических изделий, когда температура фазового перехода материала, из которого изделие изготовлено, определяет ограничения при его использовании.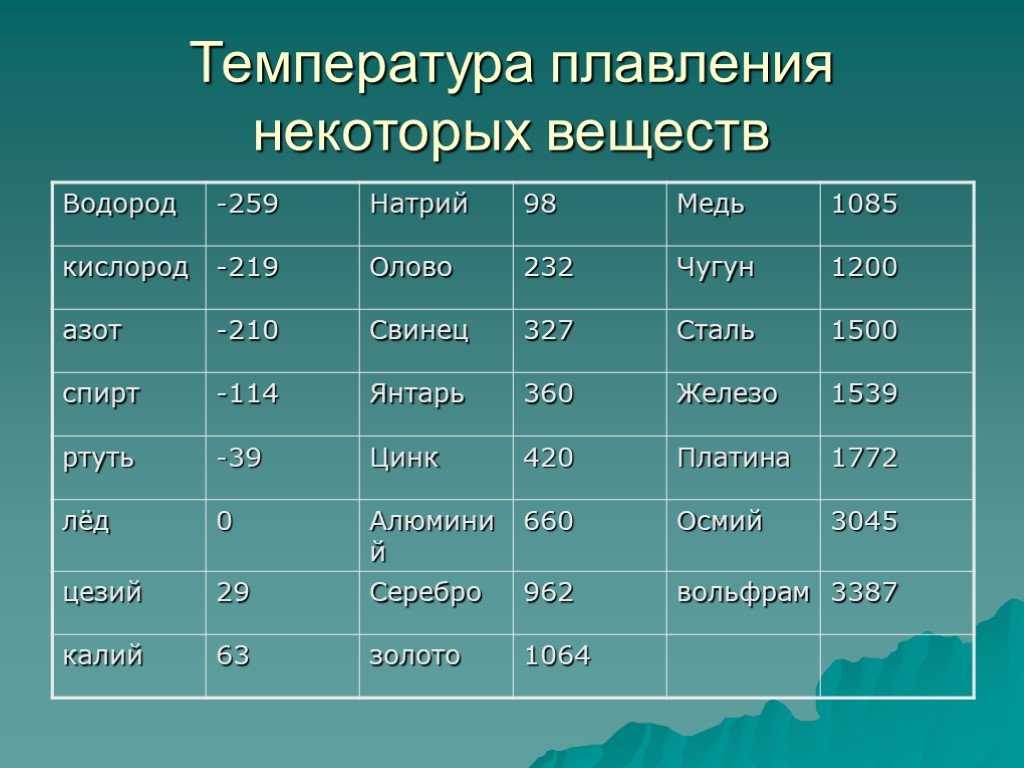 Для удобства эти данные сведены в единую плавления металлов — сводный результат физических исследований характеристик различных металлов. Существуют также подобные таблицы и для сплавов. Температура плавления металлов также существенно зависит и от давления, поэтому данные таблицы актуальны для конкретного значения давления (обычно это нормальные условия, когда давление равно 101.325 кПа). Чем выше давление, тем выше температура плавления, и наоборот.
Для удобства эти данные сведены в единую плавления металлов — сводный результат физических исследований характеристик различных металлов. Существуют также подобные таблицы и для сплавов. Температура плавления металлов также существенно зависит и от давления, поэтому данные таблицы актуальны для конкретного значения давления (обычно это нормальные условия, когда давление равно 101.325 кПа). Чем выше давление, тем выше температура плавления, и наоборот.
В металлургической промышленности одним из основных направлений считается литье металлов и их сплавов по причине дешевизны и относительной простоты процесса. Отливаться могут формы с любыми очертаниями различных габаритов, от мелких до крупных; это подходит как для массового, так и для индивидуального производства.
Литье является одним из древнейших направлений работы с металлами, и начинается примерно с бронзового века: 7−3 тысячелетия до н. э. С тех пор было открыто множество материалов, что приводило к развитию технологии и повышению требований к литейной промышленности.
В наши дни существует много направлений и видов литья, различающихся по технологическому процессу. Одно остается неизменным — физическое свойство металлов переходить из твердого состояния в жидкое, и важно знать то, при какой температуре начинается плавление разных видов металлов и их сплавов.
Процесс плавления металла
Данный процесс обозначает собой переход вещества из твердого состояния в жидкое. При достижении точки плавления металл может находиться как в твердом, так и в жидком состоянии, дальнейшее возрастание приведет к полному переходу материала в жидкость.
То же самое происходит и при застывании — при достижении границы плавления вещество начнет переходить из жидкого состояния в твердое, и температура не изменится до полной кристаллизации.
При этом следует помнить, что данное правило применимо только для чистого металла. Сплавы не имеют четкой границы температур и совершают переход состояний в некотором диапазоне:
- Солидус — линия температуры, при которой начинает плавиться самый легкоплавкий компонент сплава.

- Ликвидус — окончательная точка плавления всех компонентов, ниже которой начинают появляться первые кристаллы сплава.
Точно измерить температуру плавления таких веществ невозможно, точкой перехода состояний указывается числовой промежуток.
В зависимости от температуры, при которой начинается плавление металлов, их принято разделять на:
- Легкоплавкие, до 600 °C. К ним относятся , цинк, свинец и другие.
- Среднеплавкие, до 1600 °C. Большинство распространенных сплавов, и такие металлы как золото, серебро, медь, железо, алюминий.
- Тугоплавкие, свыше 1600 °C. Титан, молибден, вольфрам, хром.
Также существует и температура кипения — точка, при достижении которой расплавленный металл начнет переход в газообразное состояние. Это очень высокая температура, как правило, в 2 раза превышающая точку расплава.
Влияние давления
Температура плавления и равная ей температура затвердевания зависят от давления, возрастая с его повышением. Это обусловлено тем, что при повышении давления атомы сближаются между собой, а для разрушения кристаллической решетки их нужно отдалить. При повышенном давлении требуется большая энергия теплового движения и соответствующая ей температура плавления увеличивается.
Это обусловлено тем, что при повышении давления атомы сближаются между собой, а для разрушения кристаллической решетки их нужно отдалить. При повышенном давлении требуется большая энергия теплового движения и соответствующая ей температура плавления увеличивается.
Существуют исключения, когда температура, необходимая для перехода в жидкое состояние, при повышенном давлении уменьшается. К таким веществам относят лёд, висмут, германий и сурьма.
Таблица температур плавления
Любому человеку, связанному с металлургической промышленностью, будь то сварщик, литейщик, плавильщик или ювелир, важно знать температуры, при которых происходит расплав материалов, с которыми он работает. В нижеприведенной таблице указаны точки плавления наиболее распространенных веществ.
Таблица температур плавления металлов и сплавов
| Название | T пл, °C |
|---|---|
| Алюминий | 660,4 |
| Медь | 1084,5 |
| Олово | 231,9 |
| Цинк | 419,5 |
| Вольфрам | 3420 |
| Никель | 1455 |
| Серебро | 960 |
| Золото | 1064,4 |
| Платина | 1768 |
| Титан | 1668 |
| Дюралюминий | 650 |
| Углеродистая сталь | 1100−1500 |
| 1110−1400 | |
| Железо | 1539 |
| Ртуть | -38,9 |
| Мельхиор | 1170 |
| Цирконий | 3530 |
| Кремний | 1414 |
| Нихром | 1400 |
| Висмут | 271,4 |
| Германий | 938,2 |
| Жесть | 1300−1500 |
| Бронза | 930−1140 |
| Кобальт | 1494 |
| Калий | 63 |
| Натрий | 93,8 |
| Латунь | 1000 |
| Магний | 650 |
| Марганец | 1246 |
| Хром | 2130 |
| Молибден | 2890 |
| Свинец | 327,4 |
| Бериллий | 1287 |
| Победит | 3150 |
| Фехраль | 1460 |
| Сурьма | 630,6 |
| карбид титана | 3150 |
| карбид циркония | 3530 |
| Галлий | 29,76 |
Помимо таблицы плавления, существует много других вспомогательных материалов. Например, ответ на вопрос, какова температура кипения железа лежит в таблице кипения веществ. Помимо кипения, у металлов есть ряд других физических свойств, как прочность.
Например, ответ на вопрос, какова температура кипения железа лежит в таблице кипения веществ. Помимо кипения, у металлов есть ряд других физических свойств, как прочность.
Помимо способности перехода из твердого в жидкое состояние, одним из важных свойств материала является его прочность — возможность твердого тела сопротивлению разрушению и необратимым изменениям формы. Основным показателем прочности считается сопротивление возникающее при разрыве заготовки, предварительно отожженной. Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Обозначение прочности принято в МПа — Мега Паскалях.
Существуют следующие группы прочности металлов:
- Непрочные. Их сопротивление не превышает 50МПа. К ним относят олово, свинец, мягкощелочные металлы
- Прочные, 50−500МПа. Медь, алюминий, железо, титан. Материалы этой группы являются основой многих конструкционных сплавов.
- Высокопрочные, свыше 500МПа. Например, молибден и .
Таблица прочности металлов
Наиболее распространенные в быту сплавы
Как видно из таблицы, точки плавления элементов сильно разнятся даже у часто встречающихся в быту материалов.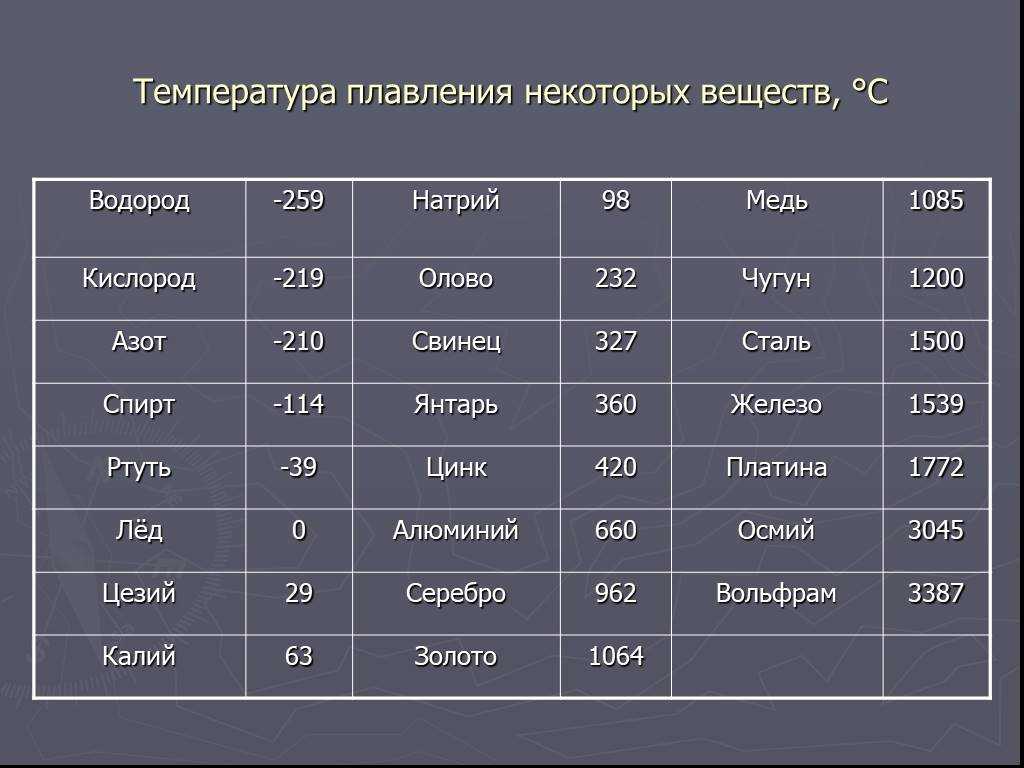
Так, минимальная температура плавления у ртути -38,9 °C, поэтому в условиях комнатной температуры она уже в жидком состоянии. Именно этим объясняется то, что бытовые термометры имеют нижнюю отметку в -39 градусов Цельсия: ниже этого показателя ртуть переходит в твердое состояние.
Припои, наиболее распространенные в бытовом применении, имеют в своем составе значительный процент содержания олова, имеющего точку плавления 231.9 °C, поэтому большая часть припоев плавится при рабочей температуре паяльника 250−400°C.
Помимо этого, существуют легкоплавкие припои с более низкой границей расплава, до 30 °C и применяются тогда, когда опасен перегрев спаиваемых материалов. Для этих целей существуют припои с висмутом, и плавка данных материалов лежит в интервале от 29,7 — 120 °C.
Расплавление высокоуглеродистых материалов в зависимости от легирующих компонентов лежит в границах от 1100 до 1500 °C.
Точки плавления металлов и их сплавов находятся в очень широком температурном диапазоне, от очень низких температур (ртуть) до границы в несколько тысяч градусов. Знание этих показателей, а так же других физических свойств очень важно для людей, которые работают в металлургической сфере. Например, знание того, при какой температуре плавится золото и другие металлы пригодятся ювелирам, литейщикам и плавильщикам.
Знание этих показателей, а так же других физических свойств очень важно для людей, которые работают в металлургической сфере. Например, знание того, при какой температуре плавится золото и другие металлы пригодятся ювелирам, литейщикам и плавильщикам.
Каждый металл и сплав имеет собственный уникальный набор физических и химических свойств, среди которых не последнее место занимает температура плавления. Сам процесс означает переход тела из одного агрегатного состояния в другое, в данном случае, из твердого кристаллического состояния в жидкое. Чтобы расплавить металл, необходимо подводить к нему тепло до достижения температуры плавления. При ней он все еще может оставаться в твердом состоянии, но при дальнейшем воздействии и повышении тепла металл начинает плавиться. Если температуру понизить, то есть отвести часть тепла, элемент затвердеет.
Самая высокая температура плавления среди металлов принадлежит вольфраму : она составляет 3422С о, самая низкая — у ртути: элемент плавится уже при — 39С о. Определить точное значение для сплавов, как правило, не представляет возможности: оно может значительно колебаться в зависимости от процентного соотношения компонентов. Их обычно записывают в виде числового промежутка.
Определить точное значение для сплавов, как правило, не представляет возможности: оно может значительно колебаться в зависимости от процентного соотношения компонентов. Их обычно записывают в виде числового промежутка.
Как происходит
Плавление всех металлов происходит примерно одинаково — при помощи внешнего или внутреннего нагревания. Первый осуществляется в термической печи, для второго используют резистивный нагрев при пропускании электрического тока или индукционный нагрев в высокочастотном электромагнитном поле. Оба варианта воздействуют на металл примерно одинаково.
При увеличении температуры увеличивается и амплитуда тепловых колебаний молекул , возникают структурные дефекты решетки, выражающиеся в росте дислокаций, перескоке атомов и других нарушениях. Это сопровождается разрывом межатомных связей и требует определенного количества энергии. В это же время происходит образование квази-жидкого слоя на поверхности тела. Период разрушения решетки и накопления дефектов называется плавлением.
В зависимости от температуры плавления металлы делятся на:
В зависимости от температуры плавления выбирают и плавильный аппарат . Чем выше показатель, тем прочнее он должен быть. Узнать температуру нужного вам элемента можно из таблицы.
Еще одной немаловажной величиной является температура кипения. Это величина, при которой начинается процесс кипения жидкостей, она соответствует температуре насыщенного пара, который образуется над плоской поверхностью кипящей жидкости. Обычно она почти в два раза больше, чем температура плавления.
Обе величины принято приводить при нормальном давлении. Между собой они прямопропорциональны .
- Увеличивается давление — увеличится величина плавления.
- Уменьшается давление — уменьшается величина плавления.
Таблица легкоплавких металлов и сплавов (до 600С о)
Таблица среднеплавких металлов и сплавов (от 600С о до 1600С о)
Температура плавления металлов: таблица и понятие
При сварке происходит воздействие высокой температуры на детали, поэтому очень важно придавать значение температуре плавления металлов, учитывая её в процессе работы, так как данные показатели играют немаловажную роль в параметрах тока. В горелке, при сгорании газа в момент действия электрической дуги, создается тепловая мощь для того, чтобы подвергнуть разрушению кристаллическую решетку металла. Характеристикам плавления металлов уделяют внимание при подборе материала для сооружения узлов, подвергающихся силе трения или же конструкций из металла, которые испытывают воздействие температур.
В горелке, при сгорании газа в момент действия электрической дуги, создается тепловая мощь для того, чтобы подвергнуть разрушению кристаллическую решетку металла. Характеристикам плавления металлов уделяют внимание при подборе материала для сооружения узлов, подвергающихся силе трения или же конструкций из металла, которые испытывают воздействие температур.
Что такое температура плавления?
Чтобы узнать при какой температуре плавится металл, в лабораторных условиях, точку старта в начале процесса плавления вычисляют до сотой градусной доли. При этом данный показатель не находится в зависимости от усилия при давлении на деталь.
При создании определенного давления в условиях вакуума, заготовки из металла имеют одинаковую температуру плавления. Данное явление можно объяснить накоплением энергии внутри вещества, при которой разрушаются связи между молекулами.
Литий (180°C)
Этот удивительный металл, открыли только в начале XIX века.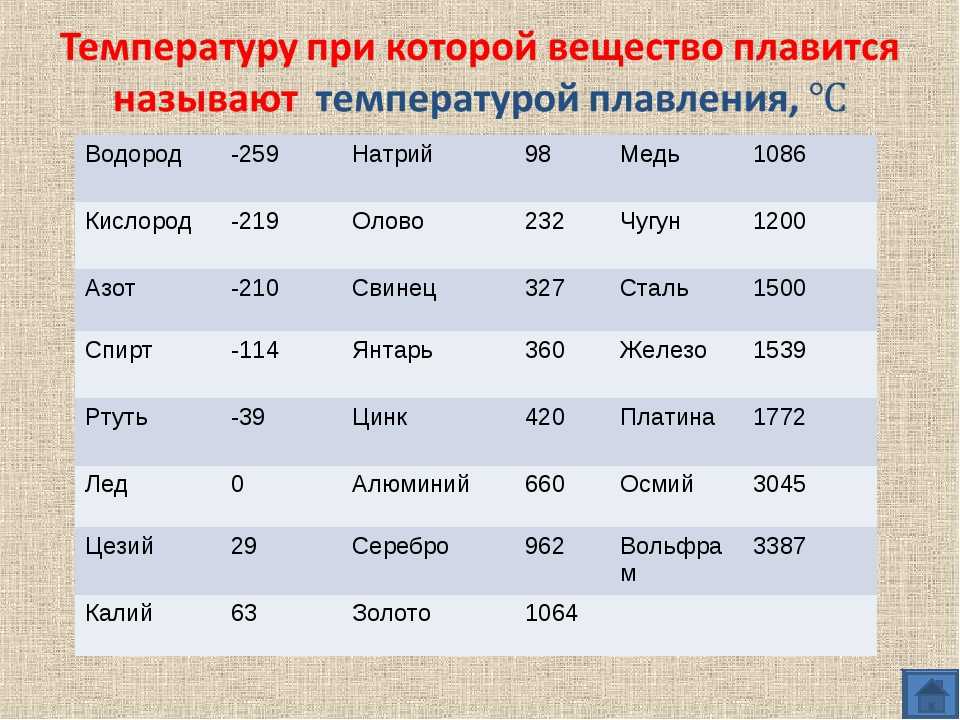 Литий (Lithium, элемент №3) довольно легкоплавкий – жидкий метал температуры всего 180°C можно помешивать даже деревянной ложечкой.
Литий (Lithium, элемент №3) довольно легкоплавкий – жидкий метал температуры всего 180°C можно помешивать даже деревянной ложечкой.
Литий отличается очень малой плотностью – вдвое легче воды! Металл относится к группе щелочных и довольно активен химически (поэтому его так долго не могли открыть).
В современном мире литий широко используется для создания удивительных сплавов – твёрдых, лёгких и жаропрочных.
Без лития не обходится ни одна современная электронная штучка. Ведь литий является ключевым компонентом компактных и ёмких аккумуляторов. А ещё, именно литий придаёт замечательный алый цвет фейерверкам.
Разница между температурой плавления и кипения
Температурой плавления металлов называют точку перехода твердокристаллического вещества в жидкое состояние. В составе расплава у молекул нет собственного места расположения, они удерживаются за счет силы притяжения, поэтому в разжиженном состоянии сохраняется объем, но теряется форма.
В процессе кипения происходит потеря молекулярного объема, а молекулы вяло взаимодействуют друг с другом, двигаясь хаотично в разных направлениях, отставая от поверхности.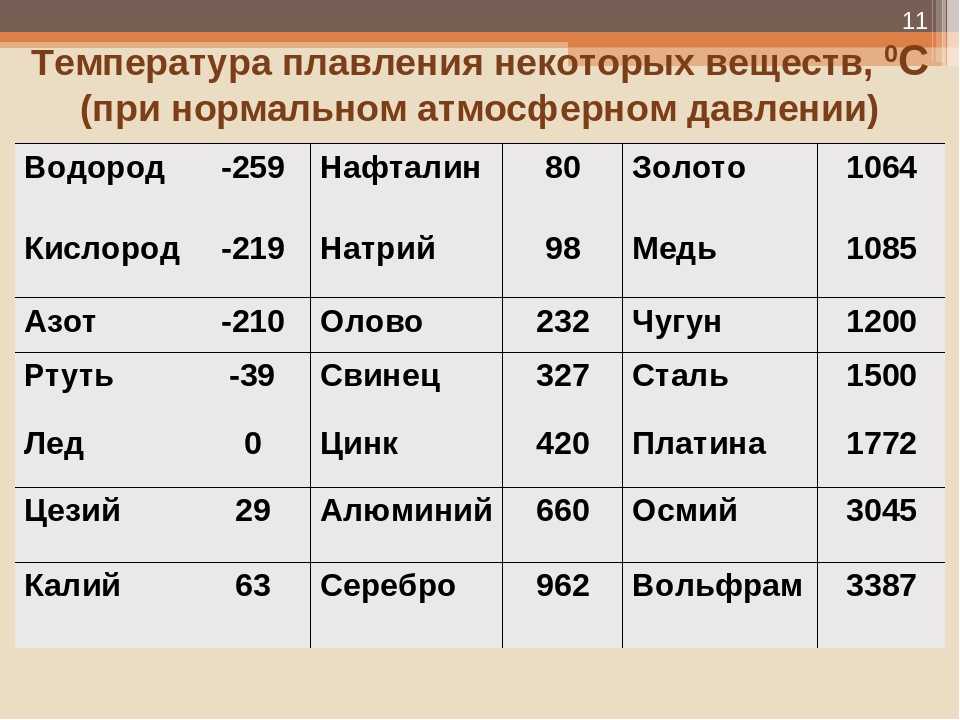 Температурой кипения называется процесс, при котором уровень давления металлического пара уравновешивается с давлением внешней среды.
Температурой кипения называется процесс, при котором уровень давления металлического пара уравновешивается с давлением внешней среды.
Калий (63,5°C)
Близкий родственник натрия – калий. Элемент №19 (Kalium) также бурно реагирует с водой, образуя щёлочь, и также легкоплавок – 63,5°C. А вот съедобных соединений калия почти нет, и в этом он полная противоположность натрию. Хотя в ограниченно малых количествах организму всё-таки необходим (микроэлемент).
В чистом виде калий практического применения не имеет. Но его многочисленные соединения с древних времён известны как удобрения, моющие средства, важные компоненты многих химических процессов.
Температура плавления различных металлов
Согласно знаниям из раздела физики, процесс превращения твердого вещества в жидкое имеется лишь у тел с кристаллической решеткой. Температура плавления металлов и сплавов возникает в различном диапазоне значений. Но, с точностью высчитать пограничную температуру фазовых состояний у сплавов весьма проблематично. У чистых элементов имеет значимость каждый градус, если это составы с легкой плавкостью.
У чистых элементов имеет значимость каждый градус, если это составы с легкой плавкостью.
Железо
Температура плавления железных составов должна быть высокой. Если элемент обладает технической чистотой, то он плавится при температуре 1 539 °C. В составе его вещества присутствуют включения серы, поэтому для её извлечения необходимо жидкое состояние. Также очищенное железо получается в процессе электролиза солей металла.
Чугун
Чугун считается самым лучшим материалом для плавления. Он имеет хорошие показатели жидкой текучести и усадки, поэтому его эффективно использовать в процессе литья. Ниже будут приведены показатели температурного кипения чугуна:
Серая разновидность чугуна, у которой температурный режим доходит до отметки 1 260 °C. А при разливе его в формы, увеличивается до 1 400 °C.
Белая разновидность чугуна, у которого температура поднимается до 1 350 °C.
Одним из немаловажных моментов является то, что температура, которой обладает чугун, на 400 единиц меньше той же стали.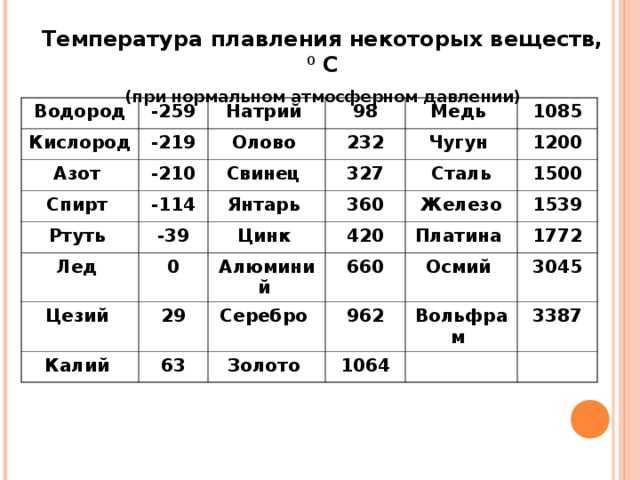 Поэтому процесс обработки данного материала менее энергозатратен.
Поэтому процесс обработки данного материала менее энергозатратен.
Сталь, температура плавления
Средняя температура плавления стали составляет 1400 °C.
Сталью называется железосодержащий сплав с включением углерода. Её основной характеристикой является прочность. Это достигается за счет того, что она долгое время сохраняет параметры объема и формы. При этом расположение молекул в веществе находится в сбалансированном состоянии. Именно поэтому достигается равновесие между силой притяжения и силой отталкивания.
Диапазон плавления стали выше, чем у чугуна, поэтому она более энергозатратна.
Нержавеющая сталь
Температура плавления нержавеющей стали колеблется в среднем диапазоне между чугуном и сталью. Нержавеющей сталью называется вещество из легированной стали, обладающее антикоррозийными свойствами за счет содержания хрома в своем составе от 11% процентов и больше.
Показатели температуры плавления нержавейки составляют от 1 300 до 15 000 °C.
Алюминий и медь
Температура плавления алюминия составляет 6 600 °C, поэтому он зарекомендовал себя в качестве одного из среднеплавких металлов.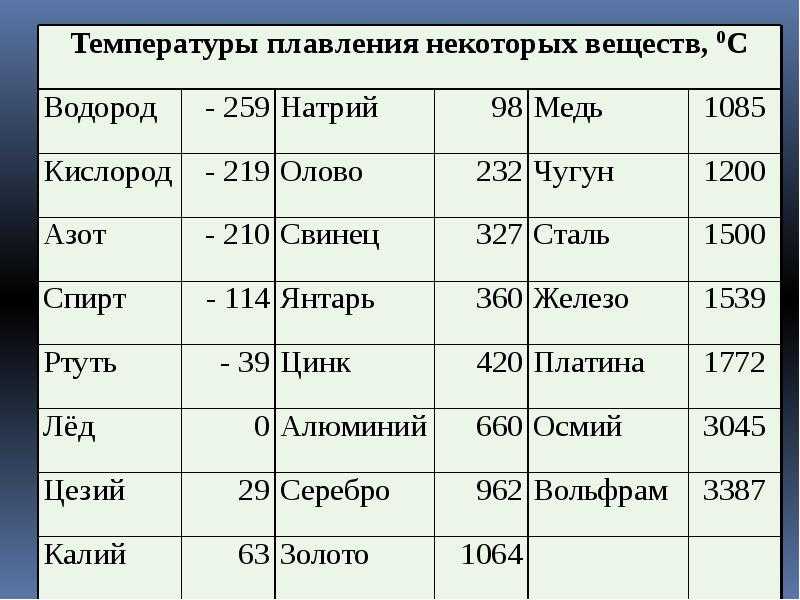 Плавление чистых медных составов происходит при температуре 10 830 °C, а сплавов – 930 – 11 400 °C.
Плавление чистых медных составов происходит при температуре 10 830 °C, а сплавов – 930 – 11 400 °C.
Серебро и золото
Серебро в чистом виде плавится при температуре 9 620 °C. При этом при температуре плавления серебра, оно может сравниться с температурой плавления в градусах со сплавами из меди.
Золото плавится при температуре в 10 640 °C.
Ртуть
Ртуть обладает самой низкой температурой плавления с отрицательным значением. Она составляет – 38,80 °C.
Олово (231°C)
Химический элемент, занимающий в периодической таблице юбилейное, пятидесятое место известен человечеству с древнейших времён. Первые капли олова (латинское наименование Stannum) первобытные люди заметили в своих кострах ещё за 4 тысячи лет до нашей эры. Немудрено – ведь олово плавится при температуре всего при 231°C. При этом дерево ещё только-только начинает обугливаться и робко гореть.
После застывания «слёзы», которыми плакал в огне красивый тяжёлый камень кассидерит, сохраняли форму, в которой им довелось застыть. Так появились первые металлические предметы кухонного быта.
Так появились первые металлические предметы кухонного быта.
Когда же удалось вытопить из зелёного малахита рыжую медь, оказалось, что смесь меди с оловом гораздо прочнее любого из металлов по отдельности. Тут-то цивилизация и начала бурно развиваться. Оружие, доспехи, посуда, инструменты – всё делали из прочной и красивой бронзы.
Таблица температур плавления
| Легкоплавкие металлы | |
| Литий | + 180 °C |
| Калий | + 63,60 °C |
| Индий | + 156,60 °C |
| Олово | + 2 320 °C |
| Таллий | + 3 040 °C |
| Кадмий | + 3 210 °C |
| Свинец | + 3 270 °C |
| Цинк | + 4 200 °C |
| Среднеплавкие металлы | |
| Магний | + 6 500 °C |
| Алюминий | + 6 600 °C |
| Барий | + 7 270 °C |
| Серебро | + 9 600 °C |
| Золото | +10 630 °C |
| Марганец | + 12 460 °C |
| Медь | + 10 830 °C |
| Никель | + 14 550 °C |
| Кобальт | + 14 950 °C |
| Железо | + 15 390 °C |
| Дюралей | + 6 500 °C |
| Латунь | + 950 – 10 500 °C |
| Чугун | + 1 100 – 13 000 °C |
| Тугоплавкие металлы | |
| Титан | + 16 800 °C |
| Платина | + 17 690 °C |
| Хром | + 19 070 °C |
| Цирконий | + 18 550 °C |
| Ванадий | + 19 100 °C |
| Иридий | + 24 470 °C |
| Молибден | + 26 230 °C |
| Тантал | + 30 170 °C |
| Вольфрам | + 34 200 °C |
Рубидий (39,31°C)
37-й элемент таблицы – рубидий (Rubidium) плавится всего при 39,31°C. Кусочек рубидия может растаять на блюдце как сливочное масло. Это лёгкий металл, его плотность лишь немного превышает плотность воды. Но реагирует с водой рубидий не менее бурно, чем его близкие родственники калий и натрий.
Кусочек рубидия может растаять на блюдце как сливочное масло. Это лёгкий металл, его плотность лишь немного превышает плотность воды. Но реагирует с водой рубидий не менее бурно, чем его близкие родственники калий и натрий.
Рубидий удивителен своими химическими свойствами. Сам по себе щелочной металл очень легко вступает в разнообразные химические реакции. Но при этом соли рубидия и его сплавы с другими металлами являются хорошими катализаторами реакций. То есть, значительно ускоряют процесс, при этом совершенно не расходуясь сами по себе. Это делает рубидий ценным материалом для химической промышленности и радиоэлектроники.
От чего зависит температура плавления?
У различных материалов различается, и температура их плавления, при которой происходит коренное перестраивание решетки до состояния жидкости. Металлические изделия и изделия из сплавов имеют следующие особенности:
- У различных материалов различается, и температура их плавления, при которой происходит коренное перестраивание решетки до состояния жидкости.
 Металлические изделия и изделия из сплавов имеют следующие особенности:
Металлические изделия и изделия из сплавов имеют следующие особенности: - Они редко встречаются в натуральном виде, т.е. без примесей. Именно состав определяет, какой должна быть температура плавки. В пример можно взять олово, в которое добавляют включения серебра. Благодаря примесям материал начинает становится устойчивым к воздействию температуры.
- Существуют такие сплавы, которые из-за химического состава трансформируются в жидкое состояние, когда столбик термометра поднимается чуть выше отметки в + 1 500 °C. Есть и такие сплавы, которые «держатся», если их нагревать до 30 000 °C.
- Стоит учитывать тот факт, что одним из наиболее важных свойств веществ является их точка плавления. В качестве примера можно привести авиационную технику.
Натрий (97,8°C)
Натрий (Natrium, 11-й элемент) может расплавиться даже в кипятке – 97,8°C. Но мы бы не советовали позволить даже маленькому кусочку натрия упасть в воду (хотя бы и ледяную). Щелочной металл натрий очень активен химически и немедленно реагирует, отделяя от молекул воды водород и превращаясь в сильнейшую щелочь.
При этом выделяется много тепла, которое тут же поджигает освободившийся водород. Взрыв и пожар! Такие материалы как натрий хранят в керосине, что исключает их контакт с водой и влагой воздуха.
Как очень активный элемент, натрий в том или ином виде присутствует вокруг нас в огромных количествах. Взять хотя бы хлорид натрия – обычная поваренная соль.
Типы сплавов металлов
Типы металлических сплавов различаются на основе температуры плавления, поэтому выделяют следующие варианты сплава:
- Легкоплавкий (олово, цинк, свинец, висмут) с температурой плавления не больше 600 °C.
- Среднеплавкий (алюминий, магний, никель, железо) с температурой 600 – 1 600 °C.
- Тугоплавкий (молибден, вольфрам, титан) с температурой более 1 600 °C.
Далее расскажем немного о разновидностях сталей, о сплаве вуда и припоях.
Особенности углеродистой стали
В данном материале содержится примесь углерода, примерно 2,13 %. При этом он лишен легирующих добавок, но есть примеси кремния, марганца и магния.
Особенности легированной стали
Помимо содержания углерода и железа в неё добавляют дополнительные элементы, улучшающие её свойства.
Особенности нержавейки
Нержавеющая сталь отлична от углеродистой из-за содержания элемента хрома в своем составе, благодаря свойствам которого она не подвержена окислению, а, следовательно, покрытию ржавчиной.
Особенности инструментальной стали
Также обладает углеродистым составом (0,8 – 0,9 %). Демонстрирует твердость, прочность, хорошо поддаются обработке. Используется в изготовлении инструментов, например, медицинских.
Сплав Вуда
Представляет собой материал, применяемый при паянии деталей для радиоприемников, а также в гальванической пластике, при работе в лабораторных условиях с ядохимикатами.
Сплавы для пайки
Другое их название – припои. Материалы для припоев бывают различными. Все зависит от того, что входит в состав материалов, которые необходимо соединить. К примеру, алюминий требует один сплав припоя, а вот медь уже совершенно другой.
Индий (157°C)
В конце XIX века химикам удалось открыть и выделить в чистом виде элемент, занявший в периодической таблице клетку №49. Индий (Indium) – довольно тяжёлый (почти как железо) металл, плавящийся при 157°C.
Этот материал поразительно мягок и пластичен. Мягче этого металла только тальк! Невероятное свойство сделало индий незаменимым в радиоэлектронике. Тонкие индиевые полоски, нанесённые на стекло, хорошо проводят электрический ток – но при этом совершенно прозрачны. Так делают уже привычные нам плоские экраны на основе «жидких кристаллов» (LCD).
Физиологическое действие
Никель и его соединения токсичны и канцерогены.
Никель — основная причина аллергии (контактного дерматита) на металлы, контактирующие с кожей (украшения, часы, джинсовые заклепки). В 2008 году Американским обществом контактного дерматита никель был признан «Аллергеном года». В Евросоюзе ограничено содержание никеля в продукции, контактирующей с кожей человека.
В XX веке было установлено, что поджелудочная железа очень богата никелем. При введении вслед за инсулином никеля продлевается действие инсулина и тем самым повышается гипогликемическая активность. Никель оказывает влияние на ферментативные процессы, окисление аскорбиновой кислоты, ускоряет переход сульфгидрильных групп в дисульфидные. Никель может угнетать действие адреналина и снижать артериальное давление. Избыточное поступление никеля в организм вызывает витилиго. Депонируется никель в поджелудочной и околощитовидной железах.
При введении вслед за инсулином никеля продлевается действие инсулина и тем самым повышается гипогликемическая активность. Никель оказывает влияние на ферментативные процессы, окисление аскорбиновой кислоты, ускоряет переход сульфгидрильных групп в дисульфидные. Никель может угнетать действие адреналина и снижать артериальное давление. Избыточное поступление никеля в организм вызывает витилиго. Депонируется никель в поджелудочной и околощитовидной железах.
Цезий (28,5°C)
Очень мягкий серебристый металл буквально плавится в руках. При температуре 28,5°C цезий (Caesium) становится жидкостью и буквально утекает между пальцев. Но не вздумайте провести такой опыт! Из всех щелочных металлов элемент №55 самый химически активный (уступая лишь францию).
На открытом воздухе цезий моментально окисляется, образуя яркое пламя. А при попадании в воду просто взрывается. Цезий ухитряется поджечь даже лёд! Более того, образовавшийся при реакции с водой гидроксид цезия разъедает стекло – и потихоньку грызёт сосуды из золота и даже платины.
А вот в электронике такая активность цезия позволяет делать очень чувствительные фотоэлементы и часы поистине космической точности.
Галлий (26,79°C)
А вот серебристый металл галлий (Gallium – ещё до открытия элемента Д.И. Менделеев заранее оставил ему в таблице клеточку № 31) встречается гораздо чаще и нередко применяется просто для забав. Плавится он почти как цезий, при 26,79°C, но в остальном разительно отличается от своего «нервного» братца.
Внешне и по механическим свойствам галлий очень похож на алюминий. Лёгок, теплопроводен, в чистом виде довольно хрупок. Мгновенно образующаяся на воздухе плотная плёнка окислов так же хорошо защищает его от разрушения.
В чистом виде галлий практически не находит применения. А вот его соли и, особенно, легкоплавкие сплавы нашли широчайшее применение в ядерной физике, радиоэлектронике, измерительной технике.
Франций (27°C)
Элемент, занимающий 89-ю ячейку периодической таблицы – франций (Francium) – очень похож на цезий. Франций плавится при 27°C, но до этого неимоверно активный щелочной металл ещё требуется сберечь.
Франций плавится при 27°C, но до этого неимоверно активный щелочной металл ещё требуется сберечь.
Мало того, что франций бурно реагирует буквально со всем подряд – он ещё и очень радиоактивен! Буквально через полчаса от килограмма франция останется – хорошо если горстка – разнообразных сильно излучающих продуктов деления.
Впрочем, в таких количествах его никто никогда и не видел. Неудивительно, что в природе этот элемент один из самых редко встречающихся. Да и практического применения ему так и не нашлось.
Ртуть (-38,87°C)
Все мы хорошо знакомы со ртутью – даже сегодня, в век электроники, вряд ли найдётся хоть один человек, которому не измеряли бы температуру тела ртутным термометром. Но мало кто задумывается, что очень текучая тяжёлая серебристая жидкость – самый настоящий металл!
Да-да, элемент №80, Hydrargyrum, плавится на самом лютом морозе – температура кристаллизации ртути почти минус сорок градусов (-38,87°C).
Человечество знакомо со ртутью с древнейших времён. Ртуть находит широчайшее применение в технике, химии, металлургии. Этот элемент достоин отдельного, немаленького рассказа – а сегодня он гордо венчает наш рейтинг.
Ртуть находит широчайшее применение в технике, химии, металлургии. Этот элемент достоин отдельного, немаленького рассказа – а сегодня он гордо венчает наш рейтинг.
Добыча полезных ископаемых
Руд, в которых присутствует железо, существует несколько. Однако, в качестве сырья для производства железа в промышленности используют в основном следующие:
А также часто встречаются такие разновидности руды:
Существует еще минерал под названием мелантерит. Его используют преимущественно в фармацевтической промышленности. Из себя он представляет зелёного цвета хрупкие кристаллы, в которых присутствует стеклянный блеск. Из него производят лекарственные препараты, в составе которых имеется ферум.
Основным месторождением этого металла является Южная Америка, а именно Бразилия.
Как происходит
Плавление всех металлов происходит примерно одинаково – при помощи внешнего или внутреннего нагревания. Первый осуществляется в термической печи, для второго используют резистивный нагрев при пропускании электрического тока или индукционный нагрев в высокочастотном электромагнитном поле. Оба варианта воздействуют на металл примерно одинаково.
Оба варианта воздействуют на металл примерно одинаково.
При увеличении температуры увеличивается и амплитуда тепловых колебаний молекул, возникают структурные дефекты решетки, выражающиеся в росте дислокаций, перескоке атомов и других нарушениях. Это сопровождается разрывом межатомных связей и требует определенного количества энергии. В это же время происходит образование квази-жидкого слоя на поверхности тела. Период разрушения решетки и накопления дефектов называется плавлением.
Вольфрам
Самая высокая температура плавления – у металла вольфрама. Выше него по этому показателю стоит только неметалл углерод. Вольфрам представляет собой светло-серое блестящее вещество, очень плотное и тяжелое. Он кипит при 5555 °C, что почти приравнивается к температуре фотосферы Солнца.
При комнатных условиях он слабо реагирует с кислородом и не подвергается коррозии. Несмотря на свою тугоплавкость, он довольно пластичен и поддается ковке уже при нагревании до 1600 °C. Эти свойства вольфрама используют для нитей накаливания в лампах и кинескопах электродов для сварки. Большую часть добытого металла сплавляют со сталью, чтобы повысить ее прочность и твердость.
Большую часть добытого металла сплавляют со сталью, чтобы повысить ее прочность и твердость.
Широкое применение вольфрам имеет в военной сфере и технике. Он незаменим для изготовления боеприпасов, брони, двигателей и наиболее важных частей военного транспорта и самолетов. Из него также делают хирургические инструменты, ящики для хранения радиоактивных веществ.
Твердые тела – Температуры плавления и кипения
- Плавление или плавление – фазовый переход вещества из твердого состояния в жидкое
- Кипение – фазовый переход вещества из жидкого состояния в газообразное
Плавление и кипение Температура некоторых продуктов:

 Они усложняют горячий вид обработки под давлением.
Они усложняют горячий вид обработки под давлением. Его содержание не должно превышать 0,008%. В ходе термической обработки в результате процессов окисления количественное содержание этого элемента уменьшается.
Его содержание не должно превышать 0,008%. В ходе термической обработки в результате процессов окисления количественное содержание этого элемента уменьшается. Компонент лучше всех растворятся в меди, наносит ей минимальный вред. Содержание его не должно превышать 0,05% от массы меди.
Компонент лучше всех растворятся в меди, наносит ей минимальный вред. Содержание его не должно превышать 0,05% от массы меди. Такие сплавы повышают эксплуатационные свойства изделий, обозначаются также буквой «Л», но с прибавлением цифр.
Такие сплавы повышают эксплуатационные свойства изделий, обозначаются также буквой «Л», но с прибавлением цифр. Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
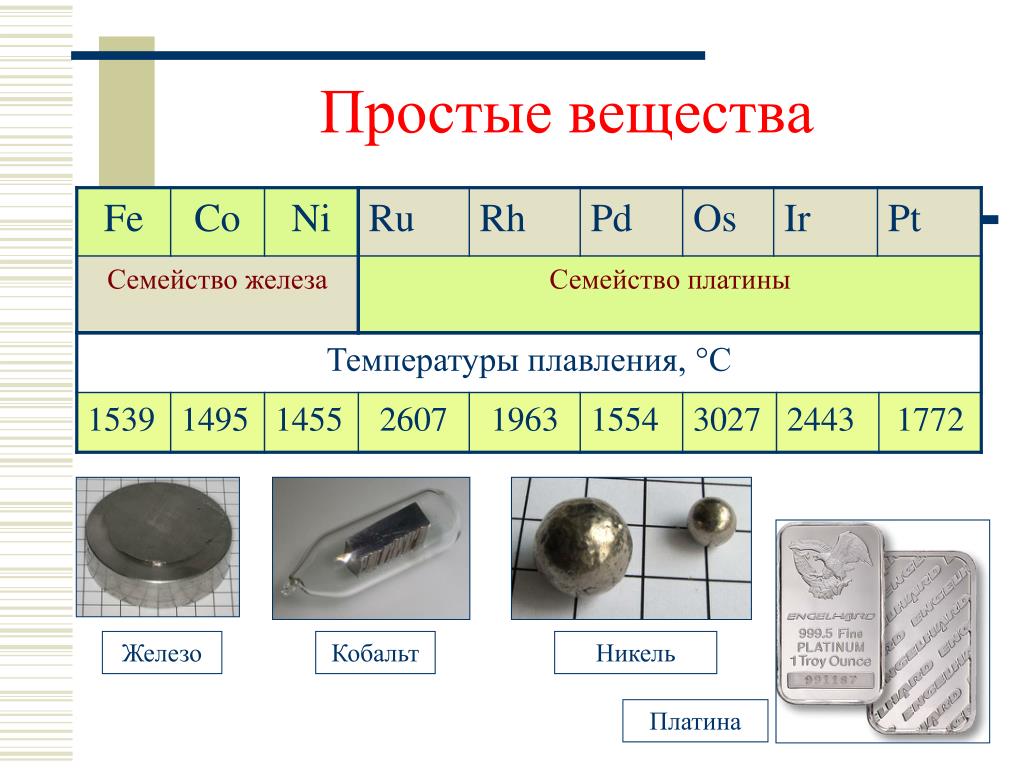 При кристаллизации происходит замедление снижения температуры.
При кристаллизации происходит замедление снижения температуры.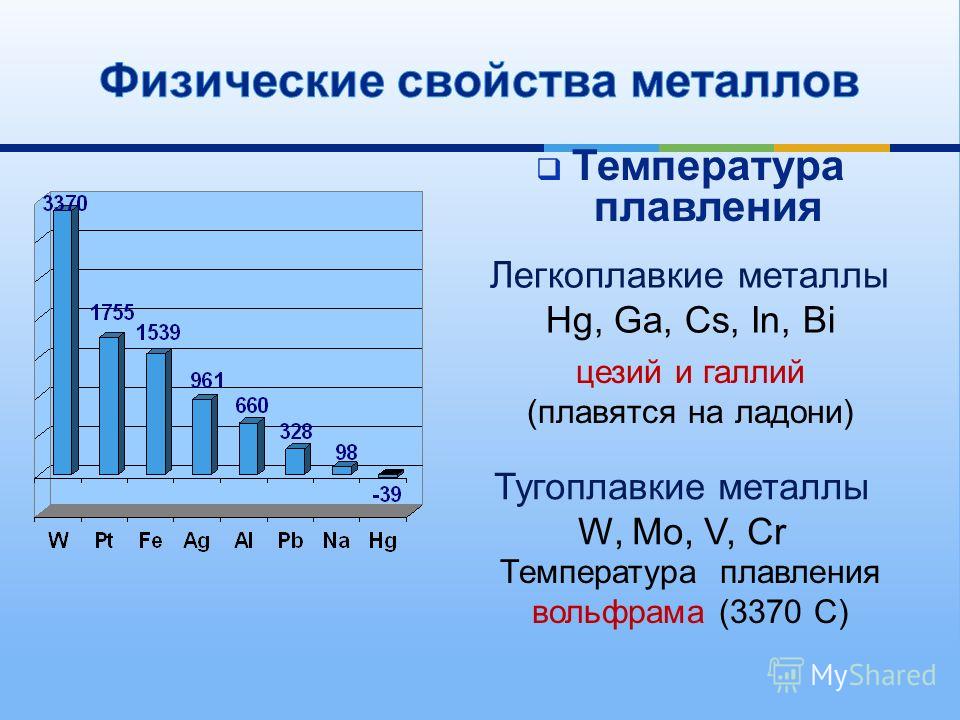 Процесс изменения состояния осуществляется под влиянием повышения температуры. При достаточном количестве тепла металлическая структура предмета разрушается. Добиться такого эффекта можно несколькими способами.
Процесс изменения состояния осуществляется под влиянием повышения температуры. При достаточном количестве тепла металлическая структура предмета разрушается. Добиться такого эффекта можно несколькими способами.
 Для достижения быстрого результата пламя должно касаться поверхности кончиком синего цвета. В этом месте факела – наибольшая температура.
Для достижения быстрого результата пламя должно касаться поверхности кончиком синего цвета. В этом месте факела – наибольшая температура. °С)
°С) 