Плавление титана — Энциклопедия по машиностроению XXL
Обработка титана и его сплавов. Плавление. Для плавления титана и его сплавов применяются электродуговые вакуумные печи с медным водоохлаждаемым кристаллизатором и расходуемым электро-дом. Обычно с целью получения слитков с равномерны.м распределением легирующих элементов и хорошей структурой проводится двойная переплавка металла. Существуют печи, позволяющие выплавлять слитки титана весом 5 m и более, однако, как правило, вес слитков находится в пределах 400—1200 кГ. [c.305]Титан—металл серого цвета. Температура плавления титана (1668 5) °С. Титан имеет две аллотропические модификации до 882 °С существует а-титан (плотность 4,505 г/см ), который кристаллизуется в гексагональной решетке с периодами а = 0,2951 нм и с = 0,4684 нм с/а = 1,587), а при более высоких температурах — Р-титан (при 900 °С плотность 4,32 г/см ), имеющий ОЦК-решетку, период которой а = 0,3282 нм.
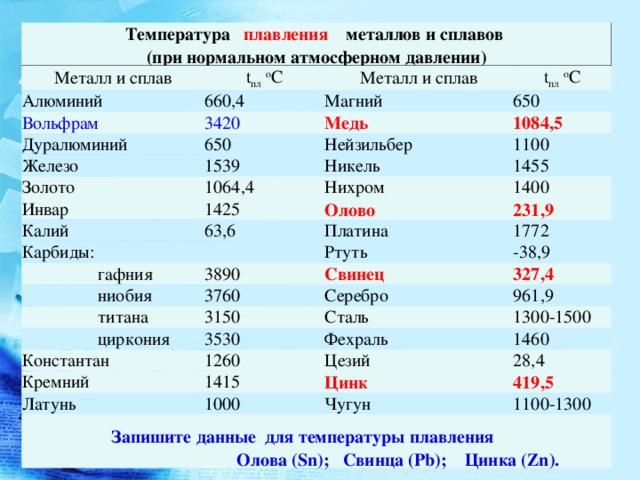
Температура плавления титана 1668 °С, кипения — 3277 °С, плотность при 20 °С 4510 кг/м , твердость 130—154 НВ. Свойства технического титана приведены в табл. 16. [c.139]
Как называют металлы с температурой плавления выше температуры плавления титана [c.14]
D) Температура плавления титана выше железа. Следовательно, Ti никак не может относиться к легкоплавким металлам. [c.124]
В работе [1] приводятся данные о температурах солидуса сплавов, содержащих О—16,5% (ат.) [0—10% (по массе)] А1 однако температура плавления титана принята 1720° С (в настоящее время температура плавления Ti считается [c.82]
Наряду с высокой температурой плавления титана (1670° С) он обладает высокой химической активностью, поэтому для плавки титановых сплавов применяют специальные тигельные печи.
Известны случаи пайки путем диффузии из припоя компонентов-депрессантов (снижающих температуру плавления сплава) в основной материал, предотвращающих или устраняющих образование прослоек интерметаллидов в шве, например при пайке титана и некоторых его сплавов с применением в качестве припоя серебра 168], а также эвтектики N1 — [246], возникающей при контактно-реактивном плавлении титана с прослойкой никеля, внесенной в зазор между соединяемыми деталями при пайке меди ртутью или галлием 137] при пайке свинца ртутью, никелевых сплавов припоями N1 — Р и т. д. [c.162]
Титан и его сплавы в настоящее время широко используются в специальных отраслях техники. Температура плавления титана 1680° С, плотность 4,5 г/сл . Титан имеет низкотемпературную а-фазу и высокотемпературную Р-фазу.
Титан легкий, но тугоплавкий металл. Он сочетает достаточную прочность с высокой пластичностью и коррозионной стойкостью. Температура плавления титана 1665 °С, а плотность 4540 кг/м .
[c.71]
Он сочетает достаточную прочность с высокой пластичностью и коррозионной стойкостью. Температура плавления титана 1665 °С, а плотность 4540 кг/м .
[c.71]
Плотность (удельный вес) титана составляет 4,5 г/см . Температура плавления титана зависит от степени его чистоты, поэтому она колеблется от 1660 до 1680° С. Еще существеннее наличие примесей влияет на механические свойства титана. Иодидный титан, [c.279]
Титан внешне похож на сталь. В земной коре его содержится примерно 0,6%, т. е. больше, чем меди и цинка вместе взятых. Титан почти в 2 раза легче железа (удельный вес 4,5 кГ/сж ). Температура плавления титана 1660° С. Он хорошо, почти как стекло, сопротивляется воздействию кислот. [c.43]
Электроды прессуют из губчатого титана или изготовляют литьем либо ковкой. Для электрошлаковой плавки требуется флюс с высокой температурой кипения (не менее 2000° С = =2273°К), чтобы шлак можно было перегреть выше температуры плавления титана.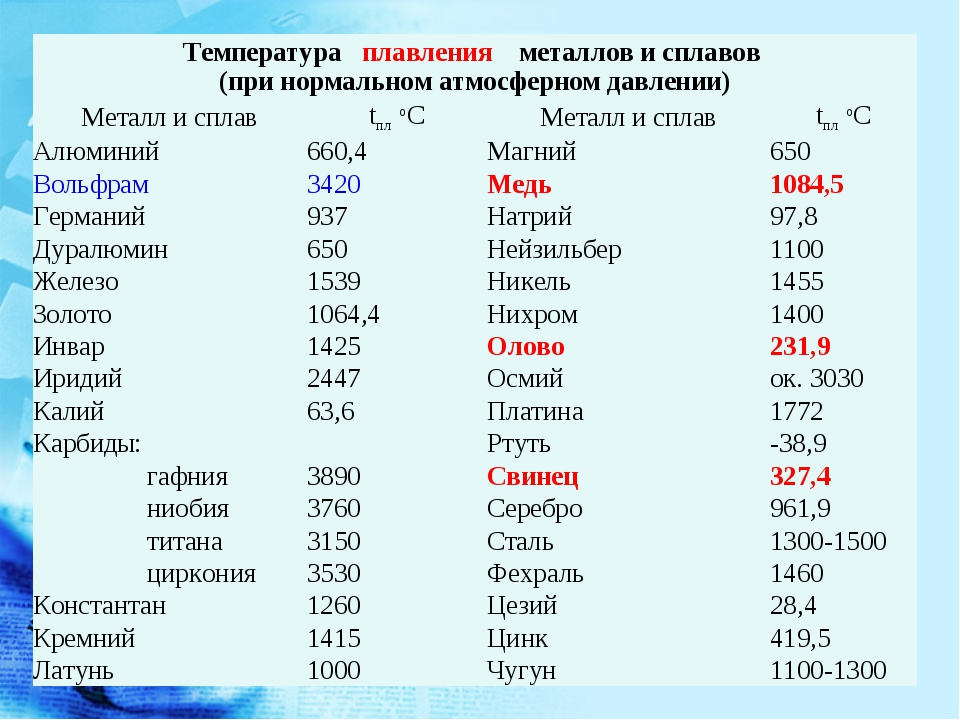 В качестве флюса наиболее подходящим и дешевым оказался фтористый кальций. В результате исследований разработан метод электрошлаковой выплавки титана с хорошими механическими свойствами и поверхностью, не тре-
[c.89]
В качестве флюса наиболее подходящим и дешевым оказался фтористый кальций. В результате исследований разработан метод электрошлаковой выплавки титана с хорошими механическими свойствами и поверхностью, не тре-
[c.89]
Высокая температура плавления титана давала основание предполагать, что на его основе могут быть созданы жаропрочные сплавы. Но здесь возникло серьезное препятствие, заключающееся в химической активности металла при высоких температурах.
Титан — металл серебристо-белою цвета. Титан находится в IV группе Периодической системы Д. И. Менделеева (см. табл. 1). Его порядковый номер 22, атомная масса 47,9. Температура плавления титана 1665 5°С. Титан имеет две аллотропические модификации до 882°С существует а-титан, который кристалли- [c.353]
Точный расчет автора с учетом полиморфного превращения из а в р-модификацию и агрегатного превращения (плавления титана) приводит к уравнению, охватывающему термодинамику первых двух стадий процесса
[c. 239]
239]
| Рис. 84. Влияние азота, кислорода и углерода на твердость плавленого титана |
Титановые сплавы являются новым металлическим материалом, занимающим видное место. Температура плавления титана 1660° С, плотность 4,5 г/сж , с углеродом титан образует очень твердые карбиды. Титан удовлетворительно куется, прокатывается и прессуется, обладает высокой стойкостью против коррозии в пресной и морской воде, а также в некоторых кислотах. [c.60]
Температура плавления титана высокой чистоты 1668 4°С температура кипения 3260° С. Скрытая теплота плавления 5,0 ккал/моль скрытая теплота испарения 112,5 ккал/моль [5]. Теплоемкость а-титана Ср = =5,28+2,4Г-10-3 кал/(моль-°С).
[c.5]
Теплоемкость а-титана Ср = =5,28+2,4Г-10-3 кал/(моль-°С).
[c.5]
Титан — металл серебристо-белого цвета, имеющий малую плотность (4,5 г/см ). Температура плавления титана 1672 + 5 °С в зависимости от степени его чистоты.
Титан имеет атомный номер 22, атомную массу 47,90 и плотность 4,507 г см при 25° С. Титан имеет две кристаллические модификации а до 882,5° Сир при более высокой температуре. Температура плавления титана 1660° С и температура кипения 3260° С. [c.471]
Для титана характерны высокая прочность и пластичность при малом удельном весе. Высокая температура плавления титана обусловливает получение на его основе жаропрочных сплавов, а низкий коэффициент линейного расширения — высокую сопротивляемость титановых сплавов термической усталости. Высокая коррозионная стойкость титана позволяет использовать титановые сплавы для работы в различных агрессивных средах. [c.22]
В настоящее время разработано несколько способов сварки плавлением титана с медью, предусматривающих применение промежуточных металлов — вставок из тантала или ниобия и ванадия, а также сплавов титана со стабильной р-структурой.
Плавление. Для плавления титана и его сплавов широкое применение получили дуговые печи с охлаждаемым водой медным тиглем, где плавление происходит в атмосфере нейтральных газов или в вакууме. Электрод изготовляют из вольфрама или графита, однако при этом наблюдается загрязнение металла вольфрамом до 0,1% или углеродом до 0,2%. Для получения титана, свободного от загрязнений, применяют расходуемый титановый электрод. [c.460]
Данные рис. 50 показьгаают, что при плавлении титана можно достичь превышения температуры центральной зоны расплава на 300 °С над температурой плавления т и при температуре поверхности гарнисажа на 300 °С ниже пл- [c.107]
Титан Т1 (Titanium). Порядковый номер 22, атомный вес 47,90. Аморфный титан является серым порошком в чистом виде кристаллический титан ещё не получен. Температура плавления титана очень высока ISIS», низкой температуре довольно устойчив.
Производство карбида титана из смеси порошка титана с сажей в зависимости от технологических условий может осуществляться несколькими способами 1) прямым синтезом без плавления титана 2) псевдоплавлением 3) методом самораспространяющегося высокотемпературного синтеза (СВС). [c.14]
Олово понижает температуру плавления титана. Координаты эвтектической точки (PTi) + Т1з8п соответствуют 17 ат. % Sn и 1620 °С [М] 18 ат. % Sn и 1605 С [X]. Результаты экспериментальных работ по влиянию Sn на переход (aTi) (PTi) неоднозначны. Однако минимум в области (а + Р) подтверждается данными, полученными разными методами Х, Э, Ш]. [c.331]
Область определения, основной уровень и интервалы, варьирования факторов. Фактор Xi. Учнтыаая температурные интервалы недопустимого роста зерна в сплаве ОТ4, начала контактно-реактив-ного плавления титана с никелем, устойчивого су1цествования нн-терметаллидов, температуры рекристаллизации паяемого материала, была выбрана область определения для температурного интервала пайки от 950 до Ю50 С. [c.223]
[c.223]
Как известно, упрочнение от наклепа действительно при температурах до 0,4—0,5 Тпл, следовательно, для титана — до 500—700° С (абсолютная температура плавления титана принята равной 1940 К). Температура рекристаллизации и фактические режимы отжига титановых сплавов укладываются в этот интервал и даже превышают его. Например, температура рекристаллизашт нелегированного титана составляет 600° С, а силава титана с 5% А1 — 800°С [3]. Рабочие температуры современных жаропрочных титановых сплавов ниже и в большинстве случаев ограипчпваются пределами 350—550° С. Поэтому даже с учетом меньшей жаропрочности титана следует считать, что упрочнение пакленом может быть применено в некоторых случаях для повышения жаропрочности титана и его сплавов, по крайней мере, при кратковременном воздействии высоких температур.
В реакторе четыреххлористый титан, взаимодействуя с жидким магнием восстанавливается, а металлический THtan оседает преимущественно по стенкам тигля выше уровня жидкого магния. Так как температура в реакторе намного ниже температуры плавления титана, то получается он в виде губчатой массы, состоящей из зерен твердого титана. Эта губчатая масса постепенно заполняет весь реактор, образуя в ряде случаев непрерывный мост. Корку титана пробивают ломиком через специальные отверстия 7 в крышке или разрушают, повышая давление инертного газа. Хлористый магний оседает на дно реактора, откуда его периодически выпускают через летку 8 либо отсасывают сифоном. Металлический магний дополнительно вводят в реактор в твердом или жидком виде с помощью специальных подгрузочных кассет. Полученная губчатая масса титана содержит хлористый и металлический магний. Эти примеси подлежат
[c.83]
Так как температура в реакторе намного ниже температуры плавления титана, то получается он в виде губчатой массы, состоящей из зерен твердого титана. Эта губчатая масса постепенно заполняет весь реактор, образуя в ряде случаев непрерывный мост. Корку титана пробивают ломиком через специальные отверстия 7 в крышке или разрушают, повышая давление инертного газа. Хлористый магний оседает на дно реактора, откуда его периодически выпускают через летку 8 либо отсасывают сифоном. Металлический магний дополнительно вводят в реактор в твердом или жидком виде с помощью специальных подгрузочных кассет. Полученная губчатая масса титана содержит хлористый и металлический магний. Эти примеси подлежат
[c.83]
Титан — металл серебристо-белого цвета. Титан находится в IV группе периодической системы (см. табл. 1), порядковый номер 22, атомный вес 47,9. Температура плавления титана 1665 5° С. Титан имеет две аллотропические модификации до 882° С существует а-титан, который кристаллизуется в ГПУ-решетке с периодами а = 2,9503 йХ и с = 4,8631 кХ (с/а = 1,5873), а при более высоких температурах — р-титан, имеющий ОЦК решетку, период которой а = 3,3132 кХ (прп 900° С).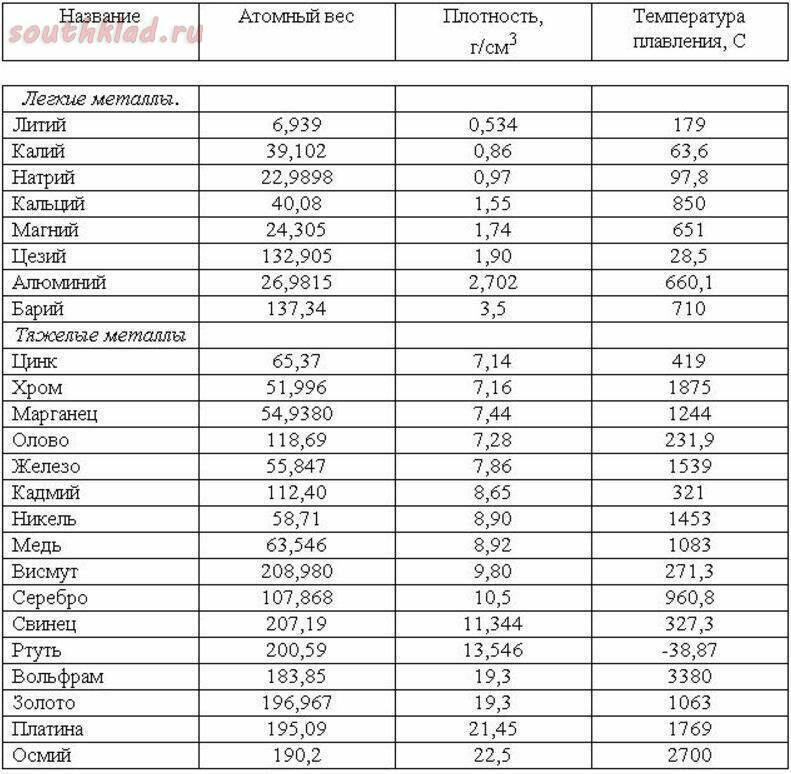 Плотность а-титана составляет 4,505 г/см и р-тптаиа при температуре 900° С — 4 32 г/см . Коэффициент линейного расширения титана (20—100) 8,3 10 мм/(мм-град) и теплопроводность прп температуре 50° С составляет 0,0369 кал (см-сек-град). Технический титан изготовляется чистой ВТ1-00 (99,53% Т1), ВТ1-0 (99,48% Т ) и ВТ1-1 (99,44% Т1).
[c.341]
Плотность а-титана составляет 4,505 г/см и р-тптаиа при температуре 900° С — 4 32 г/см . Коэффициент линейного расширения титана (20—100) 8,3 10 мм/(мм-град) и теплопроводность прп температуре 50° С составляет 0,0369 кал (см-сек-град). Технический титан изготовляется чистой ВТ1-00 (99,53% Т1), ВТ1-0 (99,48% Т ) и ВТ1-1 (99,44% Т1).
[c.341]
Специфические физические свойства титана наряду с вышерассдютренными особенностями сварки определяют ряд дополнительных особенностей. Высокая температура плавления гитана требует применения при сварке плавлением концентрированных источников тепла. Однако в связи с более низким, чем у стали, коэффициентом теплопроводности, более высоким электрическим сопротивлением и меньшей теплоемкостью для сварки плавлением титана тратится меньше энергии, чем для углеродистых сталей. Энергетические показатели и режпмы сварки титана близки к таковым нержавеющих аустенитных сталей. Тнтан немагнитен, поэтому ири сварке исключается дутье дуги. В связи с сочетанием низких коэффициентов теплопроводности, линейного расширения и модуля упругости величина остаточных
[c.352]
В связи с сочетанием низких коэффициентов теплопроводности, линейного расширения и модуля упругости величина остаточных
[c.352]
Титан и его сплавы. Титан относится к группе тугоплавких металлов. Температура плавления титана 1665 qz 5° С, плотность 4,5 г/см . Предел прочности при растяукении чистого титана Ов = 250 МН/м , удлинение б = 70% технического титана, со-дер кащего примеси, Ов = 300 -i- 550 МН/м , б = 20 ч- 30%, т. е. чем больше примесей содержится в титане, тем выше его прочность и ниже пластичность. Однако отношение a ly (удельная прочность) титана значительно выше, чем у многих легированных конструкционных сталей. Вследствие этого при замене стали титановыми сплавами можно при равной прочности получить до 40% экономии по массе детали. Несмотря на высокую температуру плавления, титан имеет более низкую жаропрочность, чем сплавы на основе железа и никеля. Предельная температура использования титана и его сплавов не выше 550—600° С. При более высокой температуре титан и его сплавы легко окисляются и поглощают водород. [c.24]
[c.24]
В последнее время появился ряд патентов, посвященных плазмохимическим процессам восстановления титана в большинстве из ни ( предлагается использовать в качестве энергоносителя и восстановителя плазму водорода (преимущественно дуговую) . Продуктами реакции являются металлический титан (порошок или расплавленный металл) и хлористый водород. Предложен также способ металлотермического восстановления титана в плазме водорода, которую используют только каж энергоноситель, а восстановителем служит натрий или магний. Процесс ведут в паровой фазе при температурах, превышающих температуры плавления титана и испарения хлорида металла-восстановителя. В результате получают расплавленный титан и парообразную смесь металла-восстановителя, титан собирают в ванне, а пары соли конденсируют в теплообменных аппаратах. Таким образом, принципиально возможно осуществле- [c.46]
Высокая температура плавления титана обусловливает требование тугоплавкости флк са.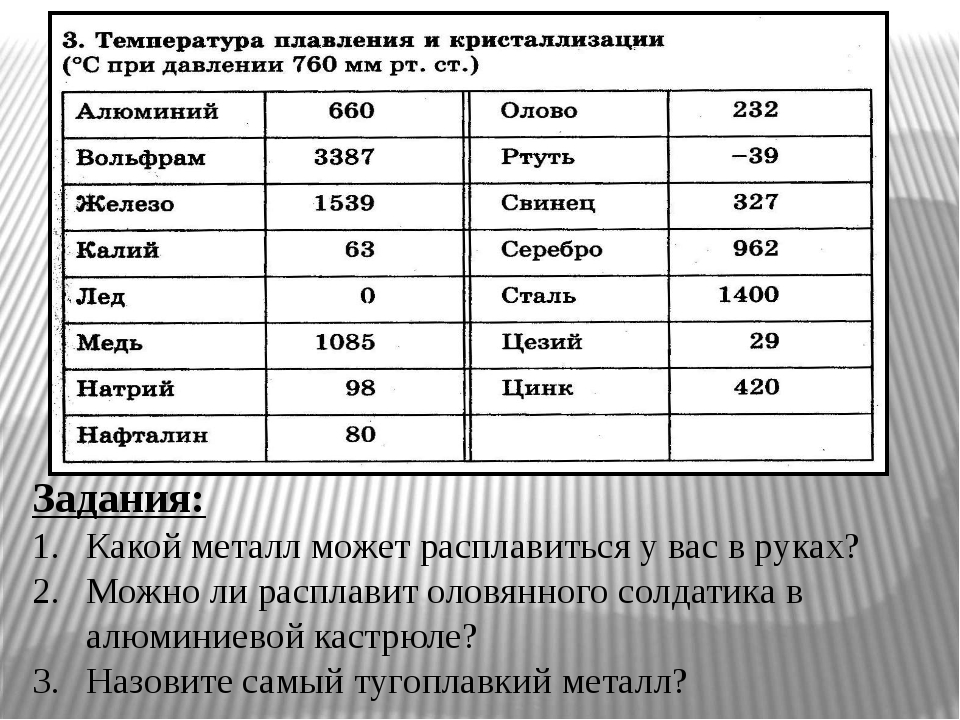 Плотность флюса не должна превышать плотность жидкого т ггана 4,11 г/см (см. табл. 5.1). Флюс должен обеспечивать стабильность прошесса сварки, хорошее формирование шва, отсутствие в н.ем пор, трещин, шлаковых включений и других дефектов. Шлаковая корка должна лег ю отделяться от поверхности шва.
[c.409]
Плотность флюса не должна превышать плотность жидкого т ггана 4,11 г/см (см. табл. 5.1). Флюс должен обеспечивать стабильность прошесса сварки, хорошее формирование шва, отсутствие в н.ем пор, трещин, шлаковых включений и других дефектов. Шлаковая корка должна лег ю отделяться от поверхности шва.
[c.409]
Восстановление четыреххлористого титана Т1Си магнием происходит при температурах значительно ниже температуры плавления титана, поэтому титан в данном случае получается в виде спеченных кристаллов, которые называют губкой. Губку после дистилляции в вакууме или после выщелачивания водой хлористого магния переплавляют в среде аргона. [c.120]
При сварке плавлением титана с алюминием при расплавлении титана невозможно избежать охрупчивания шва. Незначительная растворимость титана в алюминии и большая скорость образования химических соединений между металлами способствуют получению хрупких реактивных фаз в сварных швах. Сварные соединения с такими швами хрзшки и непригодны к эксплуатации. Используя различие температур плавления титана и алюминия, сварку можно вести без расплавления титана при наличии жидкой ванны алюминия. При этом кратковременность взаимодействия жидкого алюминия с титаном и применение технологических мер могут существенно уменьшить количество хрупких фаз в сварном шве.
[c.201]
Используя различие температур плавления титана и алюминия, сварку можно вести без расплавления титана при наличии жидкой ванны алюминия. При этом кратковременность взаимодействия жидкого алюминия с титаном и применение технологических мер могут существенно уменьшить количество хрупких фаз в сварном шве.
[c.201]
Титан плавления — Справочник химика 21
Титан имеет довольно высокую (1668 °С) температуру плавления и плотность 4,5 г/см . Благодаря высокой удельной прочности и превосходным противокоррозионным свойствам его широко применяют в авиационной технике. В настоящее время его используют также для изготовления оборудования химических производств. В ряду напряжений титан является активным металлом расчетный стандартный потенциал для реакции Т + + 2ё Л составляет —1,63 В . В активном состоянии он может окисляться с переходом в раствор в виде ионов Т » [1]. Металл легко пассивируется в аэрированных водных растворах, включая разбавленные кислоты и щелочи. В пассивном состоянии титан покрыт нестехиометрической оксидной пленкой усредненный состав пленки соответствует ТЮ . Полупроводниковые свойства пассивирующей пленки обусловлены в основном наличием кислородных анионных вакансий и междоузельных ионов Т , которые выполняют функцию доноров электронов и обеспечивают оксиду проводимость /г-типа. Потенциал титана в морской воде близок к потенциалу нержавеющих сталей. Фладе-потенциал имеет довольно отрицательное значение (Ер = —0,05В) [2, 3], что указывает на устойчивую пассивность металла. Нарушение пассивности происходит только под действием крепких кислот и щелочей и сопровождается значительной коррозией. [c.372]
В пассивном состоянии титан покрыт нестехиометрической оксидной пленкой усредненный состав пленки соответствует ТЮ . Полупроводниковые свойства пассивирующей пленки обусловлены в основном наличием кислородных анионных вакансий и междоузельных ионов Т , которые выполняют функцию доноров электронов и обеспечивают оксиду проводимость /г-типа. Потенциал титана в морской воде близок к потенциалу нержавеющих сталей. Фладе-потенциал имеет довольно отрицательное значение (Ер = —0,05В) [2, 3], что указывает на устойчивую пассивность металла. Нарушение пассивности происходит только под действием крепких кислот и щелочей и сопровождается значительной коррозией. [c.372]
Титан и его сплавы хорошо обрабатываются давлением всеми известными способами ковкой, прокаткой, штамповкой и др. Титан обладает высокой температурой плавления 1670°С, что определяет возможность разработки жаропрочных сплавов на его основе. Малый коэффициент линейного расширения обеспечивает надежность использования титана в условиях периодического изменения теплового состояния.
 Однако он неудовлетворительно работает при трении из-за его склонности к задиранию и заеданию. Значительного повышения износостойкости титана и его сплавов удалось достигнуть комплексным насыщением хромом и кремнием парофазным методом [11]. При этом повысилась износостойкость титана более чем в 3—5 раза, а коэффициент трения [c.66]
Однако он неудовлетворительно работает при трении из-за его склонности к задиранию и заеданию. Значительного повышения износостойкости титана и его сплавов удалось достигнуть комплексным насыщением хромом и кремнием парофазным методом [11]. При этом повысилась износостойкость титана более чем в 3—5 раза, а коэффициент трения [c.66] Простые вещества. Физические и химические свойства. В компактном состоянии все три элемента V—КЬ—Та представляют собой металлы светло-серого цвета, хорошо поддающиеся механической обработке в чистом состоянии. Все эти металлы характеризуются кристаллическими структурами с координационным числом 8 (ОЦК). Для металлов это сравнительно неплотная упаковка. В сочетании с более высокими температурами плавления элементов подгруппы ванадия по сравнению с титаном и его аналогами факт неплотной упаковки указывает иа возрастание ковалентного вклада в химическую связь. Это обусловлено увеличением числа иеспаренных электроиов на заполняющейся дефектной (п—1) -оболочке. Закономерность изменения параметров кристаллических решеток хорошо коррелирует с величинами атомных радиусов. [c.301]
Закономерность изменения параметров кристаллических решеток хорошо коррелирует с величинами атомных радиусов. [c.301]
Химические свойства. Титан, цирконий и гафний представляют очень большой интерес в связи С тем, что их восстановительная активность весьма сильно зависит от температуры. При обычных температурах титан, цирконий и гафний имеют чрезвычайно низкую восстановительную активность и обладают высокой коррозионной устойчивостью в большинстве агрессивных сред. С повышением температуры восстановительная активность металлов растет и у титана при температуре его плавления является одной из самых высоких среди металлов. [c.79]
Как уже было указано, титан, цирконий и гафний (особенно в расплавленном виде) способны интенсивно реагировать с азотом при высоких температурах с образованием рядов твердых растворов, а также нитридов, из которых преимущественную роль играют мононитриды МеЫ. Нитриды титана, циркония и гафния — кристаллические очень твердые и тугоплавкие металлоподобные вещества. Температуры их плавления соответственно равны 2930, 2950, 3310° С. [c.85]
Температуры их плавления соответственно равны 2930, 2950, 3310° С. [c.85]
Из двойных металлических систем с образованием непрерывных твердых растворов рассмотрим систему титан — цирконий. -титан образует непрерывный ряд твердых растворов с р-цирконием, а а-ти-тан — непрерывный ряд твердых растворов с а-цирконием. На диаграмме состояния системы (рис. 16) нижние кривые соответствуют превращению твердых растворов Р-титана с р-цирконием в твердые растворы а-титана с а-цирконием. Кривые превращения проходят через минимум (68% циркония. 540 С). Верхние кривые соответствуют плавлению твердых растворов р-титана с р-цирконием. Кривые плавления проходят через минимум (46% циркония, 1560 С). [c.86]
Во многих случаях в системах, образованных титаном, цирконием или гафнием с другими металлами, возникают интерметаллические соединения. Как правило, они сравнительно непрочны. С некоторыми металлами только а-видоизменения образуют интерметаллиды, а р-видоизменения образуют с этими металлами только твердые растворы. Интерметаллические соединения титана, циркония и гафния с этими металлами существуют только при сравнительно низких температурах и разлагаются при температурах полиморфных превращений а р. Большинство интерметаллических соединений титана, циркония и гафния нацело разлагаются при плавлении, и только некоторые из них остаются частично неразложенными. С титаном, цирконием и гафнием образуют соединения металлы, расположенные в периодической системе правее У1В-группы, т. е. сравнительно мало активные. [c.86]
Интерметаллические соединения титана, циркония и гафния с этими металлами существуют только при сравнительно низких температурах и разлагаются при температурах полиморфных превращений а р. Большинство интерметаллических соединений титана, циркония и гафния нацело разлагаются при плавлении, и только некоторые из них остаются частично неразложенными. С титаном, цирконием и гафнием образуют соединения металлы, расположенные в периодической системе правее У1В-группы, т. е. сравнительно мало активные. [c.86]
Фазы внедрения образуются и при взаимодействии титана, циркония и гафния с углеродом и азотом. Растворимость этих элементов в титане и его аналогах значительно меньше, чем водорода, хотя они также образуют твердые растворы внедрения. Поскольку атомные радиусы углерода и азота больше, чем водорода, предельный состав фаз внедрения в этом случае отвечает формуле ЭС и ЭЫ, т. е. заполняются только октаэдрические пустоты в ГЦК решетке. Эти фазы относятся к наиболее тугоплавким. Ниже приводим температуры плавления карбидов и нитридов в сопоставлении с температурами плавления металлов [c.243]
Ниже приводим температуры плавления карбидов и нитридов в сопоставлении с температурами плавления металлов [c.243]
Плотность титана 4,54 г/сж , температура плавления 1668° С, температура кипения около 3260° С. По внешнему виду титан похож на сталь. Титан имеет переменную валентность, но основная валентность его равна 4. На воздухе при нормальной температуре компактный титан устойчив. При нагревании выше 400° С он окисляется и растворяет азот и водород, отчего становится хрупким. Хрупкость металлу придают также примеси. [c.326]
Таким образом, механизм дуги можно представить себе следующим. Из катода в результате высокой степени его разогрева (термоэлектронная эмиссия) или наличия около его поверхности больших напряженностей электрического поля (10 —10 в см — автоэлектронная эмиссия) вырывается поток электронов. Первый случай имеет место для материалов катода с высокой температурой плавления и испарения металла (уголь, графит, вольфрам, молибден), благодаря чему температура на их поверхности может достигать в катодных пятнах значений 2 500—3 000° С и выше, когда начинается заметная термоэлектронная эмиссия. Второй случай соответствует материалам с низкой температурой кипения и испарения (ртуть, титан, медь). В области катодного падения поток электронов разгоняется настолько, что за ее пределами происходит интенсивная ионизация частиц газа в дуговом промежутке, причем здесь, по-видимому, весьма существенна роль ступенчатой ионизации. Образовавшиеся положительные ионы под действием поля направляются к катоду и разогревают его вторичные и первичные электроны направляются через столб дуги в направлении анода. На их пути происходят новые соударения (главным образом термическая ионизация) и образование новых заряженных частиц, что компенсирует их исчезновение в более холодных частях столба путем рекомбинации и диффузии. При попадании на анод отрицательные частицы нейтрализуются, выбивая из него некоторое количество положительных ионов, устремляющихся через столб дуги к катоду. Плазма столба в целом нейтральна, т. е. концентрация положительных и отрицательных частиц одинакова, но из-за того, что подвижность электронов по [c.
Второй случай соответствует материалам с низкой температурой кипения и испарения (ртуть, титан, медь). В области катодного падения поток электронов разгоняется настолько, что за ее пределами происходит интенсивная ионизация частиц газа в дуговом промежутке, причем здесь, по-видимому, весьма существенна роль ступенчатой ионизации. Образовавшиеся положительные ионы под действием поля направляются к катоду и разогревают его вторичные и первичные электроны направляются через столб дуги в направлении анода. На их пути происходят новые соударения (главным образом термическая ионизация) и образование новых заряженных частиц, что компенсирует их исчезновение в более холодных частях столба путем рекомбинации и диффузии. При попадании на анод отрицательные частицы нейтрализуются, выбивая из него некоторое количество положительных ионов, устремляющихся через столб дуги к катоду. Плазма столба в целом нейтральна, т. е. концентрация положительных и отрицательных частиц одинакова, но из-за того, что подвижность электронов по [c. 29]
29]
Прочность металлической связи возрастает с ростом числа валентных электронов, участвующих в ее образовании, о чем можно судить по температурам плавления. Титан, цирконий и гафний имеют по 4 валентных электрона (хотя точно не известно, сколько электронов они отдают на образование металлической связи), их температуры плавления выше температур плавления, например, металлов третьей группы, но ниже температур плавления металлов V и VI групп, имеющих большее число валентных электронов. [c.211]
Титан, цирконий и гафний наиболее заметно различаются по плотности, температуре плавления и температуре кипения. Кроме того, у гафния высокое эффективное поперечное сечение поглощения тепловых нейтронов, равное 105 барн у циркония оно 0,18 0,02 барн. [c.212]
Химическая активность компактных Ti, Zr, Hf зависит от чистоты металла и температуры. При обычной температуре они исключительно инертны по отношению к атмосферным газам их поверхность неограниченное время остается блестящей.
 Высокая стойкость к окислению обусловлена рядом факторов высокими температурами плавления самих металлов и их двуокисей, обладающих малой летучестью, образованием окисных или окисно-нитридных пленок, защищающих поверхность металла. Взаимодействие компактных металлов с кислородом начинается при 200—250°, однако скорость окисления ничтожна, более того, со временем она уменьшается, так как образующаяся тонкая и плотная окисная пленка, обладающая высокой адгезией к металлам, защищает их от дальнейшего окисления. Защитные свойства пленки сохраняются до 500—600°. При более высокой температуре скорость окисления увеличивается из-за того, что окисная пленка теряет защитные свойства. С ростом ее толщины уменьшается адгезия к металлу, в ней развиваются трещины, она частично осыпается. Тем не менее титан в интервале 600—1200° более стоек к окислению, чем нержавею-ш,ая сталь. [c.212]
Высокая стойкость к окислению обусловлена рядом факторов высокими температурами плавления самих металлов и их двуокисей, обладающих малой летучестью, образованием окисных или окисно-нитридных пленок, защищающих поверхность металла. Взаимодействие компактных металлов с кислородом начинается при 200—250°, однако скорость окисления ничтожна, более того, со временем она уменьшается, так как образующаяся тонкая и плотная окисная пленка, обладающая высокой адгезией к металлам, защищает их от дальнейшего окисления. Защитные свойства пленки сохраняются до 500—600°. При более высокой температуре скорость окисления увеличивается из-за того, что окисная пленка теряет защитные свойства. С ростом ее толщины уменьшается адгезия к металлу, в ней развиваются трещины, она частично осыпается. Тем не менее титан в интервале 600—1200° более стоек к окислению, чем нержавею-ш,ая сталь. [c.212] Титан можно вводить в электролит в виде различных соединений. Электролиз ведут ниже температуры плавления титана, поэтому он получается в виде небольших кристаллов. Процесс сопровождается образованием на катоде продуктов неполного восстановления, которые могут перемещаться к аноду и окисляться на нем, что снижает выход по току. Уменьшить образование соединений низших степеней окисления можно подбором режима электролиза, состава электролита и отделением анодного пространства пористой диафрагмой [45, 57, 58]. [c.276]
Процесс сопровождается образованием на катоде продуктов неполного восстановления, которые могут перемещаться к аноду и окисляться на нем, что снижает выход по току. Уменьшить образование соединений низших степеней окисления можно подбором режима электролиза, состава электролита и отделением анодного пространства пористой диафрагмой [45, 57, 58]. [c.276]
Другой причиной, препятствующей определению р и а двойных сплавов на основе железа, является высокая химическая активность ряда элементов. Нет пока материалов, которые могли бы контактировать, не взаимодействуя, с жидким титаном, цирконием, ванадием и рядом лантанидов. Изучение р и сг двойных систем на основе железа во всем концентрационном интервале также ограничено высокой температурой плавления одного из компонентов (бор, гафний, ниобий, тантал, молибден, вольфрам, рений, рутений, родий, осмий, иридий). [c.39]
Г фиий, а также искусственно полученный элемент курчатовин (№ 104). Конфигурация электронной оболочки атомов этих элементов такая же, как у титана, — d s . Аналоги титана цирконий и гафний являются тяжелыми металлами — их плотности соответственно 6,45 и 13,31 г/см температуры их плавления также выше, чем у титана 1852 и 2225°С. Цирконий и гафний образуют разнообразные соединения, в устойчивых и наиболее характерных из которых цирконий и гафний четырехвалентны. Устойчивость соединений, в которых эти элементы трех- и двухвалентны, невелика п убывает в направлении Ti—Zr — Hf. В этом же направлении возрастает металлическая активность этих элементов. Цирконий и гафний, подобно титану, существуют в двух полиморфных видо-измеР ениях — а и р. Также подобно титану цирконий и гафпин при обычных температурах химически неактивны и коррозионноустойчивы, а при высокой температуре реагируют с кислородом, азотом н другими элементарными окислителями. [c.275]
Аналоги титана цирконий и гафний являются тяжелыми металлами — их плотности соответственно 6,45 и 13,31 г/см температуры их плавления также выше, чем у титана 1852 и 2225°С. Цирконий и гафний образуют разнообразные соединения, в устойчивых и наиболее характерных из которых цирконий и гафний четырехвалентны. Устойчивость соединений, в которых эти элементы трех- и двухвалентны, невелика п убывает в направлении Ti—Zr — Hf. В этом же направлении возрастает металлическая активность этих элементов. Цирконий и гафний, подобно титану, существуют в двух полиморфных видо-измеР ениях — а и р. Также подобно титану цирконий и гафпин при обычных температурах химически неактивны и коррозионноустойчивы, а при высокой температуре реагируют с кислородом, азотом н другими элементарными окислителями. [c.275]
Металлический титан обладает очень высокой прочностью он легок (плотность 4,44 г-см» ), огнеупорен (т. пл. 1800°С) и коррозионноустойчив. С 1950 г. начат промышленный выпуск металлического титана, который применяют всюду, где необходим легкий и прочный металл с высокой температурой плавления так, он служит конструкционным материалом для обшивки тех участков крыла самолета, на которые попадают выбрасываемые мотором раскаленные газы. [c.574]
[c.574]
Магиий медлеппо реагирует с сухим хлором вплоть до температуры плавления металла. Серебро в хлоре и хлористом водороде не разрушается при температурах до 425° С. Титан, обладая прекрасной стойкостью во влажном газообразном хлоре, подвергается сильному разрушению в сухом хлоре, что приводит да> [c.157]
Как указано выше, титан способен интенсивно реагировать с азотом при высоких температурах с образованием ряда тверлых растворов, а также нитридов, из которых преимущественную роль играет нитрид T N. Нитрид титана — кристаллическое, очень твердое (по твердости приближается к алмазу) металлоподобное вещество с температурой плавления 2930°С. Этот нитрид проводит электрический ток, причем электрическая проводимость его уменьшается с повышением температуры, что указывает па его металлический характер. Химически нитрид титана д0В0Л1зН0 инертен. С элементарным титаном образует фазы переменного состава, в основном состоящие из TiзN (субнитрид) и ограниченных твердых растворов. [c.270]
[c.270]
Как уже указывалось, титан способен взаимодействовать с углеродом лишь при высоких температурах. В системе титан — углерод при этих условиях образуются очень твердые сплавы, содержащие карбид титана Т1С — кристаллическое металлоподобное вещество с температурой плавления 3140°С, и ряд твердых растворов. Карбид титана проводит электрический ток, легко сплавляется с металлами и другими карбидами, образуя при этом иногда чрезвычайно твердые тугоплавкие сплавы. При обычной температуре карбид титана довольно инертен, при высоких же температурах ведет себя подобно элементарному титану — реагирует с галогенами, кислородом, серой, азотом, а таклсе с кислотами и солями — окислителями с образованием продуктов, аналогичных получающимся при действии на элементарный титан. Подобные карбиду соединения титан образует с фосфором (фосфиды), кремнием (силиды), бором (бориды). [c.270]
Диоксид титана ТЮ2 известен в виде трех модификаций рутила, анатаза и брукита. Наиболее стабильная фаза — рутил. Температура плавления его 1870°. Во всех этих формах титан находится в шестерной координации. В структуре рутила октаэдры [Т10б] соединяются между собой вершинами и двумя ребрами, в бруките — [c.118]
Наиболее стабильная фаза — рутил. Температура плавления его 1870°. Во всех этих формах титан находится в шестерной координации. В структуре рутила октаэдры [Т10б] соединяются между собой вершинами и двумя ребрами, в бруките — [c.118]
Резкий скачок в промышленном производстве А1 произошел в 80-х годах прошлого столетия, когда было технически освоено получение алюминия электролизом расплавленного раствора глинозема в криолите. Теория электрометаллургии была создана П. П. Фе-дотьевым. Отечественные ученые разработали метод получения глинозема нз нефелина. Глинозем — тугоплавкий материал, температура плавления чистого А1 0з 2072 °С, и для ее понижения добавляют преимущественно криолит Мал[А1Рг,1. При этом температура плавления понижается до 960 °С. Получение А ведут в специальных электрических печах. Продажный металл содержит примерно 99% А1. Главными примесями являются железо, кремний, титан, натрий, углерод, фториды и др. Для получения алюминия высокой степени чистоты его подвергают электролитическому рафинированию. Используют также процесс нагревания А1 в парах А1Рз (транспортную реакцию) [c.271]
Используют также процесс нагревания А1 в парах А1Рз (транспортную реакцию) [c.271]
Скандий широкого применения в технике пока не находит, но является перспективным. Скандий при почти равной плотности с алюминием имеет температуру плавления примерно на 750 выше. В связи с этим он мог бы представить интерес как конструкционный материал в авиа- и ракетостроении (для ядерного авиационного двигателя), представляют интерес и сплавы скандия с титаном, обладающие высокой прочностью. Сплавы скандия с висмутом или сурьмой являются сверхпроводящими материалами. Светотехника располагает возможностью резко повысить чувствительность к инфракрасным лучам цинкосульфидных фосфоров добавлением скандия. [c.70]
Титан входит в состав многих сплавов. Добавляемый к рас плавленной стали (получение ферротитана), он соединяется с со держаш,пмнся в ней кислородом и азотом и предотвраш,ает образе вание пустот, литье получается однородным (тнтан как дегазант) [c. 193]
193]
Металлохимия элементов подгруппы титана. Физико-химические характеристики титана и его аналогов дефектность -электронной оболочки, средние по величине значения потенциалов ионизации и атомных радиусов, высокие температуры плавления и типичные для металлов плотноупаковапные структуры — обусловливают многообразие металлохимических возможностей этих элементов. Титан, цирконий и гафний образуют непрерывные твердые растворы друг с другом в обеих модификациях. Тройная система Ti—Zr—Hf является единственным примером системы, в которой реализуются два вида непрерывных твердых трехкомпонентных растворов в двух модификациях (рис. 47). Со многими переходными металлами они [c.242]
С кислородом воздуха титан и цирконий энергично образуют диоксиды титан при 1200°, цирконий —при 650° С. В атмосфере азота оба горят, образуя нитриды типа 3N. Это очень твердые вещества переменного состава, с металлической проводимостью, температура плавления порядка 3000° С.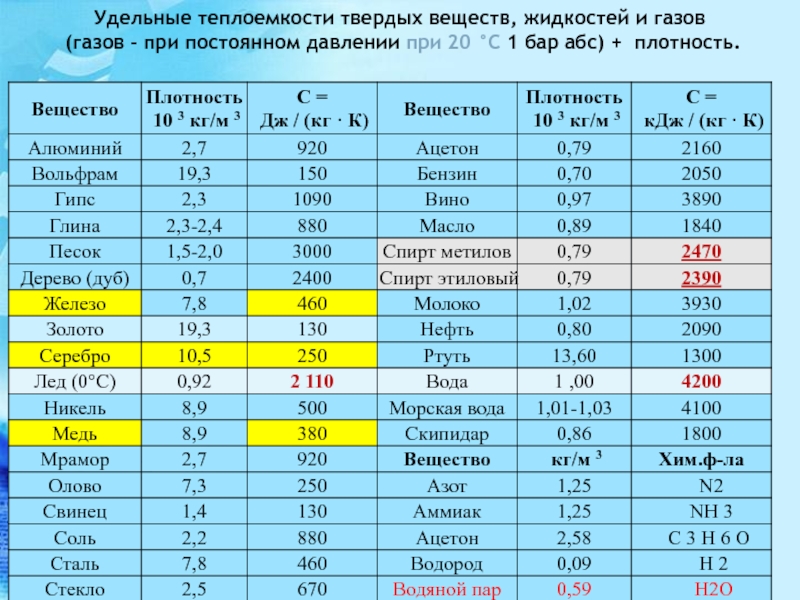 Нитрид циркония — один из самых прочных в термодинамическом отношении нитридов. Состав его ZrNi изменяется от д = О до л = 0,42, энтальпия образования соответственно изменяется от —90,7 до —56,1 ккал ф.вес, а свободная энергия образования Д бивариантной системе — в зависимости от температуры и давления азота [49, стр. 251 ) [c.330]
Нитрид циркония — один из самых прочных в термодинамическом отношении нитридов. Состав его ZrNi изменяется от д = О до л = 0,42, энтальпия образования соответственно изменяется от —90,7 до —56,1 ккал ф.вес, а свободная энергия образования Д бивариантной системе — в зависимости от температуры и давления азота [49, стр. 251 ) [c.330]
Закись ТЮ, окись TI2O3 и промежуточные фазы можно получить, действуя на TIO2 восстановителями титаном, магнием, цинком, углеродом и водородом, Повыщение температуры способствует получению соединений с меньшим содержанием кислорода. Так, при восстановлении титаном в интервале 900—1000° образуется преимущественно TI2O3, а при 1400—1500° — ТЮ. Все окислы титана имеют высокую температуру плавления (табл. 54). Закись, окись и промежуточные фазы сравнительно устой- [c.216]
Восстанавливают Ti в герметичном стальном реакторе (реторте) в атмосфере аргона или гелия (рис. 82). В реактор заливают расплавленный магний и при 800° сверху подают жидкий Ti li.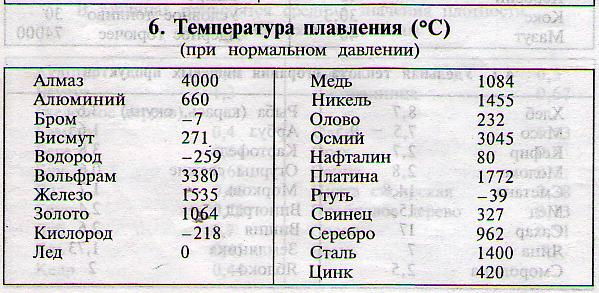 Температурный интервал, в котором проводится восстановление, невелик нижний предел— температура плавления Mg (714°), верхний предел обусловлен следующим. Титан, взаимодействуя с материалом реторты — железом, образует эвтектический сплав с т. пл. 1085°. При 1085° реактор проплавляется, выше 900° усиливается загрязнение титана железом, которое переносится через газовую фазу хлоридом железа (II), образующимся при взаимодействии Ti l со стенками реторты и расплавленным магнием, растворяющим металлическое железо. При 900° растворимость железа в магнии равна 0,17%. Вследствие экзотермич-ности реакций температура повышается до 1400°. Такая температура допустима только в центральной зоне реактора, у стенок же не должна превышать намного 900°. Поэтому реактор охлаждают воздухом. [c.270]
Температурный интервал, в котором проводится восстановление, невелик нижний предел— температура плавления Mg (714°), верхний предел обусловлен следующим. Титан, взаимодействуя с материалом реторты — железом, образует эвтектический сплав с т. пл. 1085°. При 1085° реактор проплавляется, выше 900° усиливается загрязнение титана железом, которое переносится через газовую фазу хлоридом железа (II), образующимся при взаимодействии Ti l со стенками реторты и расплавленным магнием, растворяющим металлическое железо. При 900° растворимость железа в магнии равна 0,17%. Вследствие экзотермич-ности реакций температура повышается до 1400°. Такая температура допустима только в центральной зоне реактора, у стенок же не должна превышать намного 900°. Поэтому реактор охлаждают воздухом. [c.270]
Для электролиза удобен гексафторотитанат калия K2TiFg. Его электролизом получен титан, не уступающий по качеству лучшим сортам магниетермического титана. Недостаток процесса — увеличение вязкости и температуры плавления электролита вследствие накопления в нем КЕ [34, 45, 58]. [c.277]
[c.277]
Свойства титана, циркония и гафиия. Титан, шрконий и гафний — сеоебристо-белые тугоплавкие металлы. Они образуют по две аллотропических модификации а-форма устойчива при комнатной температуре, а р-(зЬоржа —при высоких температурах. Плотность, теМ пературы плавления и кипения, а также электрическая проводимость возрастают от титана к гафнию, причем последняя для гафния в 3 раза выше, чем для титана. [c.460]
Характерной особенностью элементов подгруппы титана является образование твердых растворов и фаз внедрения с легкими неметаллами (Н, В, С, N1 О). Это обстоятельство накладывает заметный отпечаток на металлохимию этих элементов. Титан и его аналоги обладают способностью сильно поглощать водород. Фазам внедрения отвечают номинальные составы ЭН и ЭН2(Т1Н2, 2гН и 2гН2, НШ и НШг)- Для этих фаз характерна ГЦК-решетка. Фазы внедрения образуются и при взаимодействии титана, циркония и гафния с тлеродом и азотом. Растворимость этих элементов в титане и его аналогах значительно меньше, чем водорода, хотя они также образуют твердые растворы внедрения. Поскольку атомные радиусы углерода и азота больше, чем водорода, предельный состав фаз внедрения в этом случае отвечает формуле ЭС и ЭК, т.е. заполняются только октаэдрические пустоты в ГЦК-решетке. Эти фазы относятся к наиболее тугоплавким. Ниже приведены температуры плавления карбидов и нитридов металлов подгруппы титана [c.396]
Поскольку атомные радиусы углерода и азота больше, чем водорода, предельный состав фаз внедрения в этом случае отвечает формуле ЭС и ЭК, т.е. заполняются только октаэдрические пустоты в ГЦК-решетке. Эти фазы относятся к наиболее тугоплавким. Ниже приведены температуры плавления карбидов и нитридов металлов подгруппы титана [c.396]
Титан — серебристо-белый металл. Его плотность равна 4,5 г/см а температура плавления составляет 1668 °С, Чистьп титан прочен и пластичен. [c.261]
По коррозионной стойкости Мо значительно превосходит высоконикелевые сплавы и титан. Согласно приведенным выше данным, в Н2 SO4, как и в дрзггих кислотах (НС1, h3SO4), по коррозионной стойкости молибден занимает промежуточное положение между ниобием и танталом (см. рис. 41, 42). Необходимо отметить, что ни различие в химическом составе молибденового сплава, ни технология его изготовления (вакуум-плавлен-ный, спеченный), ни структурное состояние (наклепанный, рекристаллизованный) не влияют на скорость общей коррозии, определяемую весовым методом.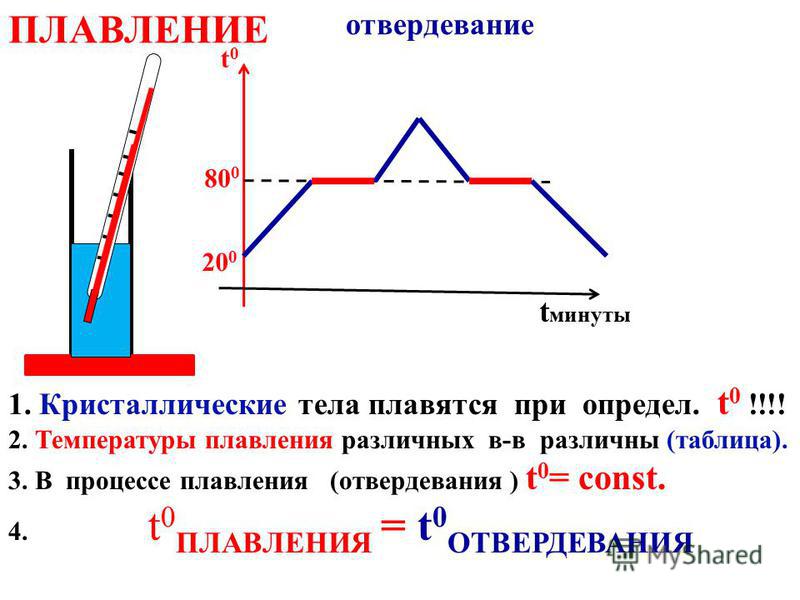 В связи с этим все промышленные сплавы, если их рассматривать как коррозионностойкие, можно объединить под общим названием — молибден. Несмотря на одинаковую скорость общей коррозии, [c.90]
В связи с этим все промышленные сплавы, если их рассматривать как коррозионностойкие, можно объединить под общим названием — молибден. Несмотря на одинаковую скорость общей коррозии, [c.90]
Возможно и другое объяснение несоответствия имеющихся экспериментальных данных и ожидаемых результатов. Титан с железом образует прочный интерметаллид TiFej с температурой плавления 1530° С. Здесь вероятна такая же ситуация, как и в случае системы Fe — В. Решать этот вопрос можно только постановкой корректных экспериментов. [c.41]
Сварка титана и его сплавов – Осварке.Нет
Потребность в сварке титана и его сплавов обоснованна его преимуществами по сравнению с другими конструкционными материалами — высокая коррозионная стойкость во многих средах и высокая граница прочности от 450 до 1500 МПа при низкой густоте (4,5 г/см3).
С одной стороны физические свойства и высокая температура плавления титана (1660 °C) требуют использовать для его сварки сконцентрированные источники тепла. В то же время низкий коэффициент теплопроводности и высокое электрическое сопротивление титана создают условия, когда для сварки требуется использовать меньше электрической энергии. У титана практически отсутствуют магнитные свойства, поэтому магнитного дутья при сварке не возникает.
В то же время низкий коэффициент теплопроводности и высокое электрическое сопротивление титана создают условия, когда для сварки требуется использовать меньше электрической энергии. У титана практически отсутствуют магнитные свойства, поэтому магнитного дутья при сварке не возникает.
Основной трудностью сварки титана считается его способность активно взаимодействовать с газами при высоких температурах. При обычных температурах окружающей среды титан достаточно спокойный материал, но с повышением температуры кислород начинает растворяться в титане, что приводит к повышению прочности и снижению пластичности. Длительное воздействие кислорода на нагретый выше 450 °C титан создает на нем слой окалины, состоящий из окислов титана (Ti02). Этот слой является источником кислорода и причиной образования трещин при сварке титана. Поэтому содержание кислорода в титановых сплавах не должно быть выше 0,15%.
Азот сильно повышает прочность титана и снижает пластичность. При температуре 800 °C азот с титаном образуют нитрит титана, температура плавления которого достигает 2950 °C.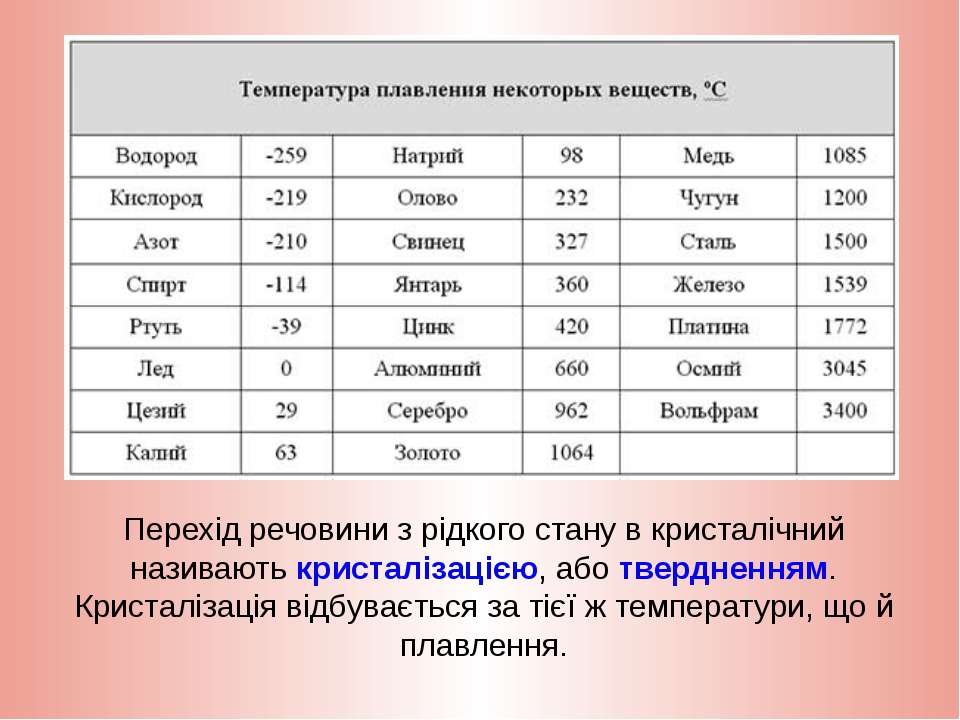 Поэтому граничное содержание азота в титановых сплавах не должно превышать 0,04-0,05%.
Поэтому граничное содержание азота в титановых сплавах не должно превышать 0,04-0,05%.
Водород, даже в небольших количествах в титане, является причиной хрупкости и негативного влияния кислорода и азота. В свою очередь титан имеет большую склонность к поглощению водорода, в результате чего образуется гидрид титана. При нагревании проходит разложение гидрида титана и восстанавливается ударная вязкость. Гидриды возникшие в средине зерен металла и на их границах, имеют большой объем, приводят к появлению трещин. Водород также считают источником образования пор. Для сварки необходимо использовать сплавы с минимальным содержанием водорода (не более 0,01%), а присадочный материал отжигать.
Углерод приводит к снижению пластичности титана и его сплавов. Низкая растворяемость углерода в титане приводит к выделению карбидов и повышению прочности со снижением пластичности.
Способы сварки титана
Активность титана во взаимодействии с кислородом, азотом и водородом требует использовать для сварки надежную газовую защиту от этих газов. Достаточно надежную защиту можно получить при использовании дуговой сварки в инертных газах (аргон, гелий) или при использовании флюс-пасты, которую наносят на кромки свариваемых деталей.
Достаточно надежную защиту можно получить при использовании дуговой сварки в инертных газах (аргон, гелий) или при использовании флюс-пасты, которую наносят на кромки свариваемых деталей.
Газовая сварка, сварка покрытыми электродами, угольным электродом титана и его сплавов не используется. Этими способами невозможно обеспечить высокое качество сварных соединений, через недостаточную защиту зоны сварки и активность титана с атмосферными газами.
Для соединения титановых деталей используют следующие виды сварки:
Требования к технологии сборки титановых изделий и присадочного материала
Сварка конструкций с титана и его сплавов требует выполнять сборку деталей с особенной точностью и ответственностью, потому что точность сборки и чистота кромок значительно влияют на качество сварного соединения.
Для защиты от окисления обратной стороны соединения и уменьшения деформации изделие собирают на стальных или медных подкладках. Через центральную часть подкладки во время сварки продувают защитный газ. При этом кромки должны плотно прилегать к подкладке по всей длине.
При этом кромки должны плотно прилегать к подкладке по всей длине.
Выполнять сборку соединений рекомендуют в приспособлениях, только при их отсутствии применяют прихватки. Детали из технического титана прихватывают без использования присадки. Для прихватки легированных сплавов используют присадочный материал. Длину прихваток становит 30-50 мм. Прихватки выполняют с обратной стороны шва для избежания перегрева. В начале и конце сварочного соединения прихватывают технологические пластины для зажигания дуги (начала сварки) и выведения кратера. Зазор между кромками при сварке титана не более 0,3-0,5 мм, а притупление кромок — не более 10% толщины металла.
Сварочную проволоку, прутки и пластины должны иметь чистую, не насыщенную водородом и не загрязненную маслом поверхность. Если присадочный металл загрязнен, его очищают пескоструйным методом, травят или используют механическую обработку. Для удобства ручной аргонодуговой сварки присадку рубают на прутки длиной 300-400 мм для удобства. Проволоку диаметром от 1,2 до 7,0 мм поставляют после вакуумного отжига при температуре 900-1000°C на протяжении 4 часов.
Проволоку диаметром от 1,2 до 7,0 мм поставляют после вакуумного отжига при температуре 900-1000°C на протяжении 4 часов.
Титановые сплавы | Металлургия для чайников
Титан Металл
Титан был обнаружен в Корнуолле, Англия, Уильямом Грегором в 1791 году и назван Мартином Генрихом Клапротом в честь титанов греческой мифологии. Элемент встречается в составе ряда месторождений полезных ископаемых, главным образом рутила и ильменита, широко распространенных в земной коре и литосфере, почти во всех живых существах, горных породах, водоемах и почвах. основные минеральные руды с помощью процесса Кролла или процесса Хантера.
Его наиболее распространенное соединение, диоксид титана, является популярным фотокатализатором и используется в производстве белых пигментов. Другие соединения включают тетрахлорид титана (TiCl4), компонент дымовых завес и катализаторов, и трихлорид титана (TiCl3), который используется в качестве катализатора при производстве полипропилена.

Титановое обручальное кольцо
Металлический элемент, титан, известен своим высоким соотношением прочности и веса. Это прочный металл с низкой плотностью, достаточно пластичный (особенно в бескислородной среде), блестящий и металлически-белого цвета.Относительно высокая температура плавления (более 1650 ° C или 3000 ° F) делает его полезным в качестве тугоплавкого металла. Он парамагнетик и имеет довольно низкую электрическую и тепловую проводимость.
Титановый кристалл
Коммерческие сорта титана (чистота 99,2%) имеют предел прочности при растяжении около 63 000 фунтов на квадратный дюйм (434 МПа), что соответствует пределу прочности обычных низкосортных стальных сплавов, но они на 45% легче. Титан на 60% плотнее алюминия, но более чем в два раза прочнее наиболее часто используемого алюминиевого сплава 6061-T6.Некоторые титановые сплавы (например, Beta C) достигают прочности на растяжение более 200 000 фунтов на квадратный дюйм (1400 МПа). Однако титан теряет прочность при нагревании выше 430 ° C (806 ° F).
Титан на двигателе A380
Обработка металлического титана происходит в 4 основных этапа:
- Превращение титановой руды в «губку» с получением пористой формы
- Плавление губки или губки с лигатурой для получения слитка
- Первичное производство, при котором слиток превращается в продукцию общего проката, такую как заготовки, прутки, плиты, листы, полосы и трубы
- Вторичное изготовление готовых форм из проката.
Титановая губка
Поскольку металл реагирует с кислородом при высоких температурах, его нельзя получить путем восстановления его диоксида. Поэтому металлический титан в промышленных масштабах производится с помощью процесса Кролла, сложного и дорогого периодического процесса. (Относительно высокая рыночная стоимость титана в основном связана с его обработкой, при которой жертвуется другой дорогой металл, магний. В процессе Кролла оксид сначала превращается в хлорид путем карбохлорирования, при котором газообразный хлор пропускают через раскаленный докрасна рутил или ильменит.
 в присутствии углерода для получения TiCl4.Его конденсируют и очищают фракционной перегонкой, а затем восстанавливают расплавленным магнием при 800 °C в атмосфере аргона.
в присутствии углерода для получения TiCl4.Его конденсируют и очищают фракционной перегонкой, а затем восстанавливают расплавленным магнием при 800 °C в атмосфере аргона.Диоксид титана
Недавно разработанный метод, Кембриджский процесс FFC, может в конечном итоге заменить процесс Кролла. Этот метод использует порошок диоксида титана (который представляет собой очищенную форму рутила) в качестве исходного сырья для получения конечного продукта, который представляет собой порошок или губку. Если используются порошки смешанных оксидов, продукт представляет собой сплав, который производится с гораздо меньшими затратами, чем традиционный многостадийный процесс плавления.Кембриджский процесс FFC может сделать титан менее редким и дорогим материалом для аэрокосмической промышленности и рынка предметов роскоши, и его можно увидеть во многих продуктах, которые в настоящее время производятся с использованием алюминия и специальных сортов стали.
Диаграмма Пурбе для титана в чистой воде, хлорной кислоте или гидроксиде натрия
Обычные титановые сплавы производятся путем восстановления. Например, восстанавливают купротитан (рутил с добавлением меди), ферроуглеродистый титан (ильменит восстанавливают коксом в электропечи) и манганотитан (рутил с марганцем или оксидами марганца).
Например, восстанавливают купротитан (рутил с добавлением меди), ферроуглеродистый титан (ильменит восстанавливают коксом в электропечи) и манганотитан (рутил с марганцем или оксидами марганца).
2 FeTiO3 + 7 Cl2 + 6 C — 2 TiCl4 + 2 FeCl3 + 6 CO (900 °C)
TiCl4 + 2 Mg — 2 MgCl2 + Ti (1100 °С)
Титановые сплавыCommon производятся путем восстановления. Например, восстанавливают купротитан (рутил с добавлением меди), ферроуглеродистый титан (ильменит восстанавливают коксом в электропечи) и манганотитан (рутил с марганцем или оксидами марганца).
Титановое кольцо
Титановые сплавы представляют собой металлические материалы, содержащие смесь титана и других химических элементов.Такие сплавы обладают очень высокой прочностью на растяжение и ударной вязкостью (даже при экстремальных температурах), малым весом, исключительной коррозионной стойкостью и способностью выдерживать экстремальные температуры.
Применение титановых сплавов
Однако высокая стоимость как сырья, так и обработки ограничивает их использование в военных целях, самолетах, космических кораблях, медицинских устройствах, шатунах на дорогих спортивных автомобилях и некоторых видах спортивного оборудования премиум-класса и бытовой электронике. Производители автомобилей Porsche и Ferrari также используют титановые сплавы в компонентах двигателей из-за их долговечных свойств в этих условиях двигателя с высокими нагрузками.
Производители автомобилей Porsche и Ferrari также используют титановые сплавы в компонентах двигателей из-за их долговечных свойств в этих условиях двигателя с высокими нагрузками.
Фазовая диаграмма Ti-V
Кристаллическая структура титана при температуре окружающей среды и давлении представляет собой плотноупакованную гексагональную альфа-фазу с отношением c/a 1,587. При температуре около 890°C титан претерпевает аллотропное превращение в объемно-центрированную кубическую бета-фазу, которая остается стабильной до температуры плавления. Некоторые легирующие элементы повышают температуру перехода из альфа-бета (например, альфа-стабилизаторы), в то время как другие понижают температуру перехода (например, бета-стабилизаторы).Алюминий, галлий, германий, углерод, кислород и азот являются альфа-стабилизаторами. Молибден, ванадий, тантал, ниобий, марганец, железо, хром, кобальт, никель, медь и кремний являются бета-стабилизаторами.
Стол из титана — модуль упругости
Титановые сплавыобычно подразделяются на четыре основные категории:
- Коммерчески чистые сплавы .
 Существует пять классов так называемого коммерчески чистого или нелегированного титана, классы ASTM с 1 по 4 и 7.Каждый сорт имеет разное количество примесей, причем 1-й сорт является самым чистым. Прочность на растяжение варьируется от 172 МПа для класса 1 до 483 МПа для класса 4.
Существует пять классов так называемого коммерчески чистого или нелегированного титана, классы ASTM с 1 по 4 и 7.Каждый сорт имеет разное количество примесей, причем 1-й сорт является самым чистым. Прочность на растяжение варьируется от 172 МПа для класса 1 до 483 МПа для класса 4. - Альфа-сплавы , которые содержат только нейтральные легирующие элементы (такие как олово) и/или альфа-стабилизаторы (такие как алюминий или кислород). Они не подлежат термической обработке. Альфа-сплавы титана — это сплавы, которые обычно содержат алюминий и олово, хотя они также могут содержать молибден, цирконий, азот, ванадий, ниобий, тантал и кремний.Альфа-сплавы обычно не поддаются термической обработке, но они поддаются сварке и обычно используются для криогенных применений, деталей самолетов и оборудования для химической обработки.
- Почти альфа-сплавы содержат небольшое количество пластичной бета-фазы. Помимо стабилизаторов альфа-фазы, сплавы, близкие к альфа-фазе, легируют 1-2% стабилизаторов бета-фазы, таких как молибден, кремний или ванадий.

- Альфа- и бета-сплавы , которые являются метастабильными и обычно включают некоторое сочетание альфа- и бета-стабилизаторов и которые могут подвергаться термической обработке.Альфа-бета-сплавы могут быть упрочнены путем термической обработки и старения, и поэтому могут подвергаться производству, пока материал еще пластичен, а затем подвергаться термической обработке для упрочнения материала, что является большим преимуществом. Сплавы используются в деталях самолетов и авиационных турбин, оборудовании для химической обработки, морском оборудовании и протезах.
- Бета-сплавы , которые являются метастабильными и содержат достаточное количество бета-стабилизаторов (таких как молибден, кремний и ванадий), чтобы они могли сохранять бета-фазу при закалке, и которые также могут подвергаться обработке на твердый раствор и старению для повышения прочности.Наименьшая группа титановых сплавов, бета-сплавы, обладают хорошей прокаливаемостью, хорошей способностью к холодной штамповке при обработке на твердый раствор и высокой прочностью при старении.
 Бета-сплавы немного более плотные, чем другие титановые сплавы, и имеют плотность от 4840 до 5060 кг/м3. Это наименее жаропрочные сплавы, они свариваемы и могут иметь предел текучести до 1345 МПа. Они используются для более тяжелых целей на самолетах.
Бета-сплавы немного более плотные, чем другие титановые сплавы, и имеют плотность от 4840 до 5060 кг/м3. Это наименее жаропрочные сплавы, они свариваемы и могут иметь предел текучести до 1345 МПа. Они используются для более тяжелых целей на самолетах.
Фазовая диаграмма Титан — алюминий
Как правило, титан в бета-фазе прочнее, но менее пластичен, а титан в альфа-фазе более пластичен.Альфа-бета-фаза титана имеет промежуточное механическое свойство. Диоксид титана растворяется в металле при высоких температурах, и его образование происходит очень энергично. Эти два фактора означают, что весь титан, за исключением наиболее тщательно очищенного, имеет значительное количество растворенного кислорода и поэтому может считаться сплавом Ti-O. Выделения оксидов обеспечивают некоторую прочность (как обсуждалось выше), но плохо поддаются термообработке и могут существенно снизить ударную вязкость сплава.
Фазовая диаграмма Титан — Fe
Многие сплавы также содержат титан в качестве незначительной добавки, но, поскольку сплавы обычно классифицируются в соответствии с тем, какой элемент образует большую часть материала, они обычно не считаются «титановыми сплавами» как таковыми.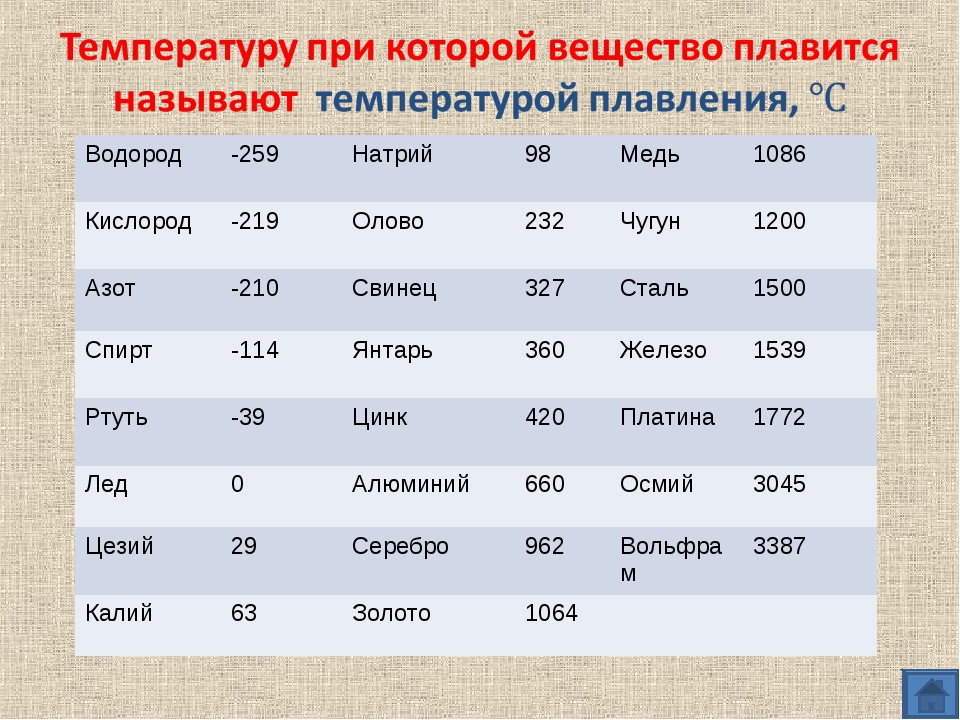 См. подстатью о применении титана.
См. подстатью о применении титана.
Фазовая диаграмма Ti-Ni-Al
Титан сам по себе является прочным и легким металлом. Он такой же прочный, как сталь, но на 45% легче. Кроме того, он в два раза прочнее алюминия, но всего на 60% тяжелее. Титан не подвергается коррозии в морской воде и поэтому используется в гребных валах, такелаже и других частях лодок, которые подвергаются воздействию морской воды. Титан и его сплавы используются в самолетах, ракетах и ракетах, где важны прочность, малый вес и устойчивость к высоким температурам.Кроме того, поскольку титан не вступает в реакцию в организме человека, он и его сплавы используются для создания искусственных бедер, штифтов для вправления костей и других биологических имплантатов.
ASTM определяет ряд стандартов сплавов со схемой нумерации для удобства поиска.
- Марки 1-4 нелегированные и считаются коммерчески чистыми или «CP». Как правило, предел прочности при растяжении и текучести для этих «чистых» сортов увеличивается с номером марки.
 Разница в их физических свойствах обусловлена прежде всего количеством межузельных элементов.Они используются для защиты от коррозии, где важны стоимость и простота изготовления и сварки.
Разница в их физических свойствах обусловлена прежде всего количеством межузельных элементов.Они используются для защиты от коррозии, где важны стоимость и простота изготовления и сварки. - Марка 5, также известная как Ti6Al4V, Ti-6Al-4V или Ti 6-4, является наиболее часто используемым сплавом. Он имеет химический состав: 6% алюминия, 4% ванадия, 0,25% (максимум) железа, 0,2% (максимум) кислорода и остальное титана. Класс 5 широко используется в аэрокосмической, медицинской, морской и химической промышленности. Используется для шатунов в ДВС. Он значительно прочнее технически чистого титана, имея при этом такие же жесткость и тепловые свойства (за исключением теплопроводности, которая примерно на 60% ниже у Grade 5 Ti, чем у CP Ti).Среди его многочисленных преимуществ, он поддается термообработке. Этот сорт представляет собой превосходное сочетание прочности, коррозионной стойкости, свариваемости и технологичности. Как следствие, его использование многочисленно, например, для военных самолетов или турбин.
 Он также используется в хирургических имплантатах. Как правило, он используется при температурах до 400 градусов по Цельсию. Его свойства очень похожи на свойства нержавеющей стали серии 300, особенно 316. Он имеет плотность примерно 4420 кг/м3, модуль Юнга 110 ГПа и предел прочности при растяжении 1000 МПа.Для сравнения, отожженная нержавеющая сталь типа 316 имеет плотность 8000 кг/м3, модуль 193 ГПа и предел прочности при растяжении всего 570 МПа. А закаленный алюминиевый сплав 6061 имеет 2700 кг/м3, 69 ГПа и 310 МПа соответственно.
Он также используется в хирургических имплантатах. Как правило, он используется при температурах до 400 градусов по Цельсию. Его свойства очень похожи на свойства нержавеющей стали серии 300, особенно 316. Он имеет плотность примерно 4420 кг/м3, модуль Юнга 110 ГПа и предел прочности при растяжении 1000 МПа.Для сравнения, отожженная нержавеющая сталь типа 316 имеет плотность 8000 кг/м3, модуль 193 ГПа и предел прочности при растяжении всего 570 МПа. А закаленный алюминиевый сплав 6061 имеет 2700 кг/м3, 69 ГПа и 310 МПа соответственно. - класс 6 содержит 5% алюминия и 2,5% олова. Он также известен как Ti-5Al-2,5Sn. Этот сплав используется в планерах и реактивных двигателях из-за его хорошей свариваемости, стабильности и прочности при повышенных температурах.
- Grade 7 содержит от 0,12 до 0,25% палладия.Этот сорт аналогичен сорту 2. Небольшое количество добавленного палладия придает ему повышенную стойкость к щелевой коррозии при низких температурах и высоком pH.
- Марка 7H содержит от 0,12 до 0,25% палладия.
 Этот сорт имеет повышенную коррозионную стойкость.
Этот сорт имеет повышенную коррозионную стойкость. - Марка 9 содержит 3,0% алюминия и 2,5% ванадия. Этот сорт представляет собой компромисс между простотой сварки и производства «чистых» сортов и высокой прочностью класса 5. Он обычно используется в авиационных трубах для гидравлики и в спортивном оборудовании.
- Марка 11 содержит от 0,12 до 0,25% палладия. Этот сорт имеет повышенную коррозионную стойкость.
- Марка 12 содержит 0,3% молибдена и 0,8% никеля.
- Марки 13, 14 и 15 содержат 0,5 % никеля и 0,05 % рутения.
- Марка 16 содержит от 0,04 до 0,08% палладия. Этот сорт имеет повышенную коррозионную стойкость.
- Марка 16Н содержит от 0,04 до 0,08% палладия.
- Марка 17 содержит от 0,04 до 0,08% палладия. Этот сорт имеет повышенную коррозионную стойкость.
- Марка 18 содержит 3 % алюминия, 2,5 % ванадия и от 0,04 до 0,08 % палладия. Этот класс идентичен классу 9 по механическим характеристикам. Добавленный палладий придает ему повышенную коррозионную стойкость.

- Марка 19 содержит 3% алюминия, 8% ванадия, 6% хрома, 4% циркония и 4% молибдена.
- Марка 20 содержит 3% алюминия, 8% ванадия, 6% хрома, 4% циркония, 4% молибдена и от 0,04% до 0,08% палладия.
- Марка 21 содержит 15 % молибдена, 3 % алюминия, 2.7% ниобия и 0,25% кремния.
- Марка 23 содержит 6% алюминия, 4% ванадия, 0,13% (максимум) кислорода. Повышенная пластичность и вязкость разрушения при некотором снижении прочности.
- Марка 24 содержит 6% алюминия, 4% ванадия и от 0,04% до 0,08% палладия.
- Марка 25 содержит 6% алюминия, 4% ванадия, от 0,3% до 0,8% никеля и от 0,04% до 0,08% палладия.
- Марки 26, 26H и 27 содержат от 0,08 до 0,14% рутения.
- Марка 28 содержит 3% алюминия, 2.5% ванадия и от 0,08 до 0,14% рутения.
- Марка 29 содержит 6% алюминия, 4% ванадия и от 0,08 до 0,14% рутения.
- Марки 30 и 31 содержат 0,3% кобальта и 0,05% палладия.
- Марка 32 содержит 5 % алюминия, 1 % олова, 1 % циркония, 1 % ванадия и 0,8 % молибдена.

- Марки 33 и 34 содержат 0,4 % никеля, 0,015 % палладия, 0,025 % рутения и 0,15 % хрома.
- Марка 35 содержит 4,5 % алюминия, 2 % молибдена, 1.6% ванадия, 0,5% железа и 0,3% кремния.
- Марка 36 содержит 45% ниобия.
- Марка 37 содержит 1,5% алюминия.
- Марка 38 содержит 4% алюминия, 2,5% ванадия и 1,5% железа. Этот сорт был разработан в 1990-х годах для использования в качестве брони. Железо уменьшает количество ванадия, необходимого в качестве бета-стабилизатора. Его механические свойства очень похожи на класс 5, но обладает хорошей способностью к холодной обработке, аналогичной классу 9.
Вам также может понравиться
Случайные сообщения
- Что такое нержавеющая сталь?
Нержавеющая сталь — это название группы коррозионностойких и жаропрочных сталей.Их замечательная стойкость… - Алюминиевый сплав
Алюминий является очень универсальным металлом и может быть отлит в любой известной форме. Его можно катать, штамповать, волочить, прясть, профилировать…
Его можно катать, штамповать, волочить, прясть, профилировать… - Что такое нанотехнология?
Нанотехнология — это инженерный метод, при котором полностью функционирующие устройства производятся на молекулярном уровне. … - Аустенит (гамма-железо)
Аустенит, также известный как гамма-фазное железо, представляет собой металлический немагнитный аллотроп железа или твердый раствор железа, с… - Fe-Fe3C T-T-T Diagram
Кривые превращения время-температура соответствуют началу и концу превращений, которые продолжаются в р…
Титан | Encyclopedia.com
Справочная информация
Титан известен как переходный металл в периодической таблице элементов, обозначаемый символом Ti. Это легкий серебристо-серый материал с атомным номером 22 и атомным весом 47,90. Он имеет плотность 4510 кг/м 3 , что находится где-то между плотностью алюминия и нержавеющей стали.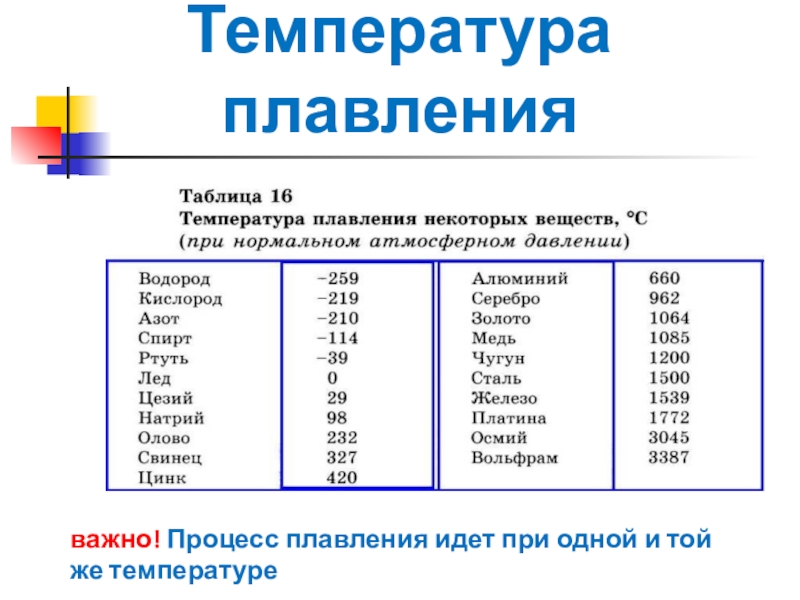 Он имеет температуру плавления примерно 3032°F (1667°C) и температуру кипения 5948°F (3287°C). Химически он ведет себя подобно цирконию и кремнию. Обладает отличной коррозионной стойкостью и высоким соотношением прочности к весу.
Он имеет температуру плавления примерно 3032°F (1667°C) и температуру кипения 5948°F (3287°C). Химически он ведет себя подобно цирконию и кремнию. Обладает отличной коррозионной стойкостью и высоким соотношением прочности к весу.
Титан является четвертым по распространенности металлом, составляющим около 0,62% земной коры. Редко встречающийся в чистом виде, титан обычно присутствует в таких минералах, как анатаз, брукит, ильменит, лейкоксен, перовскит, рутил и сфен. Хотя титана относительно много, он по-прежнему дорог, потому что его трудно изолировать.Ведущими производителями титановых концентратов являются Австралия, Канада, Китай, Индия, Норвегия, ЮАР и Украина. В Соединенных Штатах основными штатами-производителями титана являются Флорида, Айдахо, Нью-Джерси, Нью-Йорк и Вирджиния.
Были разработаны тысячи титановых сплавов, которые можно разделить на четыре основные категории. Их свойства зависят от их основной химической структуры и того, как с ними обращаются во время производства. Некоторые элементы, используемые для изготовления сплавов, включают алюминий, молибден, кобальт, цирконий, олово и ванадий.Сплавы альфа-фазы имеют самую низкую прочность, но поддаются формованию и сварке. Альфа плюс бета сплавы обладают высокой прочностью. Сплавы, близкие к альфа, имеют среднюю прочность, но хорошее сопротивление ползучести. Сплавы бета-фазы обладают самой высокой прочностью среди всех титановых сплавов, но им также не хватает пластичности.
Некоторые элементы, используемые для изготовления сплавов, включают алюминий, молибден, кобальт, цирконий, олово и ванадий.Сплавы альфа-фазы имеют самую низкую прочность, но поддаются формованию и сварке. Альфа плюс бета сплавы обладают высокой прочностью. Сплавы, близкие к альфа, имеют среднюю прочность, но хорошее сопротивление ползучести. Сплавы бета-фазы обладают самой высокой прочностью среди всех титановых сплавов, но им также не хватает пластичности.
Титан и его сплавы имеют множество применений. Аэрокосмическая промышленность является крупнейшим потребителем изделий из титана. Он полезен для этой отрасли из-за его высокого отношения прочности к весу и высокотемпературных свойств.Обычно он используется для деталей самолетов и крепежных деталей. Эти же свойства делают титан полезным для производства газотурбинных двигателей. Он используется для таких деталей, как лопатки компрессора, кожухи, капоты двигателей и теплозащитные экраны.
Поскольку титан обладает хорошей коррозионной стойкостью, он является важным материалом для отделки металлов. Здесь он используется для изготовления змеевиков теплообменников, приспособлений и футеровки. Устойчивость титана к хлору и кислоте делает его важным материалом для химической обработки.Он используется для различных насосов, клапанов и теплообменников на линии химического производства. В нефтеперерабатывающей промышленности для труб конденсаторов используются титановые материалы из-за их коррозионной стойкости. Это свойство также делает его полезным для оборудования, используемого в процессе опреснения.
Здесь он используется для изготовления змеевиков теплообменников, приспособлений и футеровки. Устойчивость титана к хлору и кислоте делает его важным материалом для химической обработки.Он используется для различных насосов, клапанов и теплообменников на линии химического производства. В нефтеперерабатывающей промышленности для труб конденсаторов используются титановые материалы из-за их коррозионной стойкости. Это свойство также делает его полезным для оборудования, используемого в процессе опреснения.
Титан используется в производстве человеческих имплантатов, потому что он хорошо совместим с человеческим телом. Одним из наиболее заметных недавних применений титана является искусственное сердце, впервые имплантированное человеку в 2001 году.Другие области применения титана — замена тазобедренного сустава, кардиостимуляторы, дефибрилляторы, а также локтевые и тазобедренные суставы.
Наконец, титановые материалы используются в производстве многочисленных потребительских товаров. Он используется в производстве таких вещей, как обувь, украшения, компьютеры, спортивный инвентарь, часы и скульптуры. Как титан
диоксид, он используется в качестве белого пигмента в пластике, бумаге и краске. Он даже используется в качестве белого пищевого красителя и солнцезащитного крема в косметических продуктах.
Он используется в производстве таких вещей, как обувь, украшения, компьютеры, спортивный инвентарь, часы и скульптуры. Как титан
диоксид, он используется в качестве белого пигмента в пластике, бумаге и краске. Он даже используется в качестве белого пищевого красителя и солнцезащитного крема в косметических продуктах.
История
Большинство историков приписывают открытие титана Уильяму Грегору.В 1791 году он работал с менаханитом (минералом, найденным в Англии), когда обнаружил новый элемент и опубликовал свои результаты. Через несколько лет этот элемент был заново открыт в рудном рутиле М. Х. Клапротом, немецким химиком. Клапрот назвал этот элемент титаном в честь мифологических гигантов Титанов.
И Грегор, и Клапрот работали с соединениями титана. Первое значительное выделение почти чистого титана было осуществлено в 1875 году Кирилловым в России. Выделение чистого металла не было продемонстрировано до 1910 года, когда Мэтью Хантер и его коллеги прореагировали тетрахлорид титана с натрием в нагретой стальной бомбе. Этот процесс производил отдельные кусочки чистого титана. В середине 1920-х годов группа голландских ученых создала небольшие проволоки из чистого титана, проведя реакцию диссоциации тетраиодида титана.
Этот процесс производил отдельные кусочки чистого титана. В середине 1920-х годов группа голландских ученых создала небольшие проволоки из чистого титана, проведя реакцию диссоциации тетраиодида титана.
Эти демонстрации побудили Уильяма Кролла начать эксперименты с различными методами эффективного выделения титана. Эти ранние эксперименты привели к разработке процесса выделения титана путем восстановления магнием в 1937 году. Этот процесс, теперь называемый процессом Кролла, до сих пор является основным процессом производства титана.Первые продукты из титана были представлены примерно в 1940-х годах и включали такие вещи, как проволока, листы и стержни.
В то время как работа Кролла продемонстрировала метод производства титана в лабораторных масштабах, потребовалось еще почти десятилетие, прежде чем его можно было адаптировать для крупномасштабного производства. Эта работа проводилась Горным бюро США с 1938 по 1947 год под руководством Р. С. Дина. К 1947 году они внесли различные модификации в процесс Кролла и произвели почти 2 тонны металлического титана. В 1948 году DuPont открыла первое крупномасштабное производство.
В 1948 году DuPont открыла первое крупномасштабное производство.
Этот крупномасштабный метод производства позволил использовать титан в качестве конструкционного материала. В 1950-х годах он использовался в основном в аэрокосмической промышленности при строительстве самолетов. Поскольку во многих областях применения титан превосходил сталь, отрасль быстро росла. К 1953 году годовой объем производства достиг 2 миллионов фунтов (907 200 кг), и основным потребителем титана были военные США. В 1958 году спрос на титан значительно упал, потому что военные переключили свое внимание с пилотируемых самолетов на ракеты, для которых больше подходила сталь.С тех пор в титановой промышленности наблюдались различные циклы высокого и низкого спроса. За прошедшие годы было обнаружено множество новых применений и отраслей промышленности для титана и его сплавов. Сегодня около 80% титана используется в аэрокосмической промышленности и 20% в других отраслях.
Сырье
Титан получают из различных руд, встречающихся в природе на Земле. Основные руды, используемые для производства титана, включают ильменит, лейкоксен и рутил. Другие известные источники включают анатаз, перовскит и сфен.
Основные руды, используемые для производства титана, включают ильменит, лейкоксен и рутил. Другие известные источники включают анатаз, перовскит и сфен.
Ильменит и лейкоксен являются титаносодержащими рудами. Ильменит (FeTiO3) содержит примерно 53% диоксида титана. Лейкоксен имеет аналогичный состав, но содержит около 90% диоксида титана. Они встречаются в отложениях твердых пород или на пляжах и аллювиальных песках. Рутил представляет собой относительно чистый диоксид титана (TiO2). Анатаз является еще одной формой кристаллического диоксида титана и совсем недавно стал важным коммерческим источником титана. Оба они встречаются в основном в пляжных и песчаных отложениях.
Перовскит (CaTiO3) и сфен (CaTi-SiO5) — кальциевые и титановые руды. Ни один из этих материалов не используется в коммерческом производстве титана из-за сложности удаления кальция. В будущем, вероятно, перовскит можно будет использовать в коммерческих целях, поскольку он содержит почти 60% диоксида титана и содержит только кальций в качестве примеси. Сфен содержит кремний в качестве второй примеси, что еще больше затрудняет выделение титана.
Сфен содержит кремний в качестве второй примеси, что еще больше затрудняет выделение титана.
Помимо руд, другие соединения, используемые в производстве титана, включают газообразный хлор, углерод и магний.
Производство
Процесс
Титан производится с использованием процесса Кролла. Этапы включают экстракцию, очистку, производство губки, создание сплава, а также формование и придание формы. В Соединенных Штатах многие производители специализируются на разных этапах этого производства. Например, есть производители, которые просто производят губку, другие, которые только плавят и создают сплав, а третьи производят конечный продукт. В настоящее время ни один производитель не выполняет все эти шаги.
Добыча
- 1 В начале производства производитель получает титановые концентраты из шахт. В то время как рутил можно использовать в его естественной форме, ильменит обрабатывается для удаления железа, так что он содержит не менее 85% диоксида титана.
 Эти материалы помещаются в реактор с псевдоожиженным слоем вместе с газообразным хлором и углеродом. Материал нагревают до 1652°F (900°C), последующая химическая реакция приводит к образованию нечистого тетрахлорида титана (TiCl4) и монооксида углерода.Примеси возникают из-за того, что на старте не используется чистый диоксид титана. Следовательно, различные нежелательные хлориды металлов, которые образуются, должны быть удалены.
Эти материалы помещаются в реактор с псевдоожиженным слоем вместе с газообразным хлором и углеродом. Материал нагревают до 1652°F (900°C), последующая химическая реакция приводит к образованию нечистого тетрахлорида титана (TiCl4) и монооксида углерода.Примеси возникают из-за того, что на старте не используется чистый диоксид титана. Следовательно, различные нежелательные хлориды металлов, которые образуются, должны быть удалены.
Очистка
- 2 Прореагировавший металл помещают в большие перегонные чаны и нагревают. На этом этапе примеси отделяют с помощью фракционной перегонки и осаждения. Это действие удаляет хлориды металлов, включая железо, ванадий, цирконий, кремний и магний.
Производство губки
- 3 Затем очищенный тетрахлорид титана в виде жидкости переносят в реактор из нержавеющей стали.Затем добавляют магний и нагревают контейнер примерно до 2012°F (1100°C). Аргон закачивается в контейнер, чтобы удалить воздух и предотвратить загрязнение кислородом или азотом.
 Магний реагирует с хлором, образуя жидкий хлорид магния. Это оставляет чистый титан в твердом состоянии, поскольку температура плавления титана выше, чем у реакции.
Магний реагирует с хлором, образуя жидкий хлорид магния. Это оставляет чистый титан в твердом состоянии, поскольку температура плавления титана выше, чем у реакции. - 4 Твердый титан удаляют из реактора бурением и затем обрабатывают водой и соляной кислотой для удаления избытка магния и хлорида магния.Полученное твердое тело представляет собой пористый металл, называемый губкой.
Создание сплава
- 5 Губка из чистого титана затем может быть преобразована в пригодный для использования сплав в дуговой печи с плавящимся электродом. На этом этапе губка смешивается с различными добавками сплава и металлоломом. Точная пропорция губки к материалу сплава определяется в лаборатории перед производством. Затем эта масса спрессовывается в компакты и сваривается вместе, образуя губчатый электрод.
- 6 Затем губчатый электрод помещают в вакуумную дуговую печь для плавления.В этом медном контейнере с водяным охлаждением электрическая дуга используется для расплавления губчатого электрода с образованием слитка.
 Весь воздух в контейнере либо удаляется (образуется вакуум), либо атмосфера заполняется аргоном для предотвращения загрязнения. Как правило, слиток
переплавляли еще один или два раза, чтобы получить коммерчески приемлемый слиток. В Соединенных Штатах большинство слитков, произведенных этим методом, весят около 9000 фунтов (4082 кг) и имеют диаметр 30 дюймов (76,2 см).
Весь воздух в контейнере либо удаляется (образуется вакуум), либо атмосфера заполняется аргоном для предотвращения загрязнения. Как правило, слиток
переплавляли еще один или два раза, чтобы получить коммерчески приемлемый слиток. В Соединенных Штатах большинство слитков, произведенных этим методом, весят около 9000 фунтов (4082 кг) и имеют диаметр 30 дюймов (76,2 см). - 7 После изготовления слиток вынимают из печи и проверяют на наличие дефектов.Поверхность может быть обработана по желанию заказчика. Затем слиток можно отправить производителю готовой продукции, где его можно измельчить и изготовить из него различные изделия.
Побочные продукты/отходы
При производстве чистого титана образуется значительное количество хлорида магния. Этот материал перерабатывается в перерабатывающей ячейке сразу после его производства. Ячейка рециркуляции сначала отделяет металлический магний, а затем собирает газообразный хлор.Оба эти компонента повторно используются в производстве титана.
Будущее
Будущие достижения в производстве титана, скорее всего, будут связаны с улучшением производства слитков, разработкой новых сплавов, снижением производственных затрат и применением в новых отраслях промышленности. В настоящее время существует потребность в слитках большего размера, чем могут быть произведены в имеющихся печах. Продолжаются исследования по разработке более крупных печей, которые могут удовлетворить эти потребности. Также ведутся работы по поиску оптимального состава различных титановых сплавов.В конечном счете, исследователи надеются, что специализированные материалы с контролируемой микроструктурой будут легко производиться. Наконец, исследователи изучают различные методы очистки титана. Недавно ученые из Кембриджского университета объявили о способе получения чистого титана непосредственно из диоксида титана. Это может существенно снизить производственные затраты и повысить доступность.
Где узнать больше
Книги
Отмер, К. Энциклопедия химической технологии. Нью-Йорк: Марсель Деккер, 1998.
Энциклопедия химической технологии. Нью-Йорк: Марсель Деккер, 1998.
Министерство внутренних дел США Геологическая служба США. Ежегодник минералов, том 1. Вашингтон, округ Колумбия: Типография правительства США, 1998.
Периодические издания
Фримантл, М. «Титан, извлеченный непосредственно из TiO2». Новости химии и техники (25 сентября 2000 г.).
Эйлон Д. «Титан для энергетики и промышленности». Металлургическое общество AIME (1987).
Другое
Веб-страница WebElements., декабрь 2001 г.
Perry Romanowski
Титановые сплавы – обзор
12.1.1 Зачем использовать титановые сплавы?
Титановые сплавы широко разрабатывались как коммерческие сплавы на протяжении более 60 лет, выполняя требования к материалам с высоким отношением прочности к весу при повышенных температурах, которые первоначально использовались в аэрокосмической и оборонной промышленности.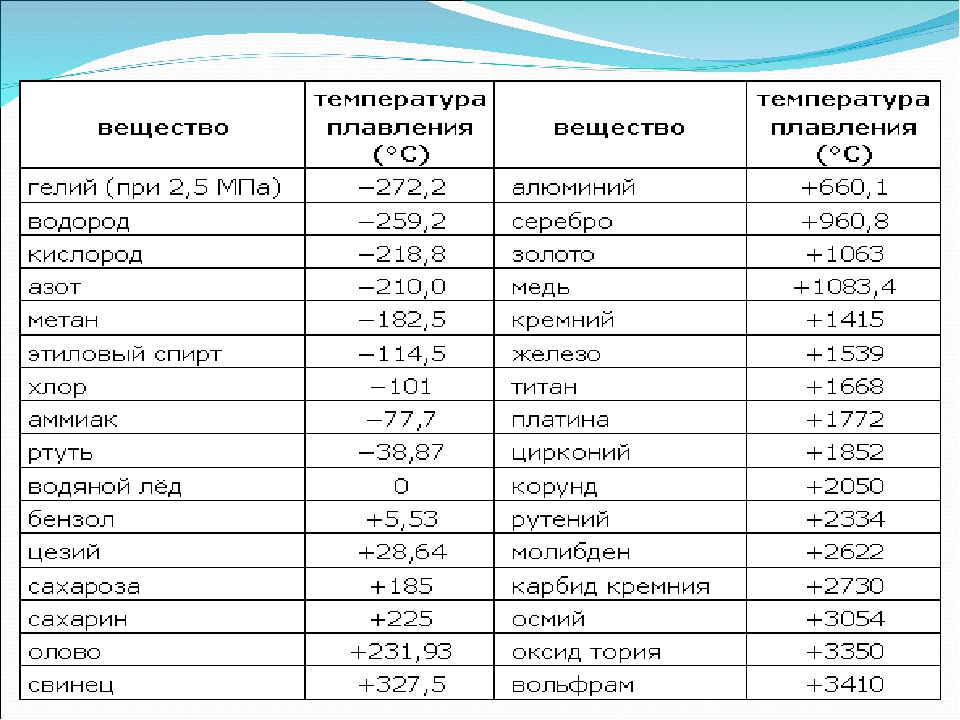 Более 80% титановых сплавов используются в этих отраслях промышленности, в основном в кованой форме, но многие другие применения ограничены из-за их плохих трибологических и окислительных свойств, а также высокой относительной стоимости, которая примерно в пять раз выше, чем у сталей и алюминиевых сплавов.
Более 80% титановых сплавов используются в этих отраслях промышленности, в основном в кованой форме, но многие другие применения ограничены из-за их плохих трибологических и окислительных свойств, а также высокой относительной стоимости, которая примерно в пять раз выше, чем у сталей и алюминиевых сплавов.
Титан и его сплавы обладают превосходной коррозионной стойкостью в дождевой и морской воде благодаря образованию защитной оксидной пленки. Эти пленки были признаны и использованы в химической промышленности, а также нашли применение в стоматологии и медиках в протезах для имплантации в тело человека. Титан имеет высокую температуру плавления, 1678 °C, что указывает на то, что сплавы будут демонстрировать хорошее сопротивление ползучести в широком диапазоне температур.
12.1.2 Необходимость обработки поверхности
Хотя титановые сплавы также обладают хорошей усталостной прочностью, они имеют высокий коэффициент трения (μ) в районе 0,6 как друг относительно друга, так и по отношению к другим сплавам, а также по отношению к другим сплавам. металлические материалы, такие как полимеры, а это означает, что они обладают низкой износостойкостью. Плохие трибологические свойства обычно связаны с переносом титана на сопрягаемые поверхности, что приводит к сильному адгезионному износу. В некоторых случаях ситуацию можно облегчить применением смазок, например, при контакте титановых сплавов с полимерами.Повышение износостойкости за счет смазочных материалов, как правило, уменьшается с температурой. По этой причине поверхностные модификации титановых сплавов использовались для увеличения поверхностной прочности, снижения коэффициента трения и снижения склонности к переносу материала и адгезионному износу (Heyman, 1992). В дополнение к аэрокосмическим применениям привлекательные высокотемпературные свойства титановых сплавов были распространены на наземные турбины. Это особенно характерно для Японии (Ямада, 1996).Преимущество титановых сплавов в плотности по сравнению с такими сталями, как Cr-Mo-V и 12% Cr, привело к их использованию в конце низкого давления паровых турбин.
металлические материалы, такие как полимеры, а это означает, что они обладают низкой износостойкостью. Плохие трибологические свойства обычно связаны с переносом титана на сопрягаемые поверхности, что приводит к сильному адгезионному износу. В некоторых случаях ситуацию можно облегчить применением смазок, например, при контакте титановых сплавов с полимерами.Повышение износостойкости за счет смазочных материалов, как правило, уменьшается с температурой. По этой причине поверхностные модификации титановых сплавов использовались для увеличения поверхностной прочности, снижения коэффициента трения и снижения склонности к переносу материала и адгезионному износу (Heyman, 1992). В дополнение к аэрокосмическим применениям привлекательные высокотемпературные свойства титановых сплавов были распространены на наземные турбины. Это особенно характерно для Японии (Ямада, 1996).Преимущество титановых сплавов в плотности по сравнению с такими сталями, как Cr-Mo-V и 12% Cr, привело к их использованию в конце низкого давления паровых турбин. В условиях эксплуатации эрозия удара жидкости является общепризнанным механизмом повреждения, связанным с движущимися лопастями (Робинсон и Рид, 1995). Потеря материала, происходящая с передних кромок лопаток, является результатом кумулятивных повреждений от ударов капель воды, образующихся при конденсации пара на поздних ступенях паровой турбины.Удар каждой капли создает кратковременную высокую локальную силу. Силы давления, как правило, перпендикулярны направлению удара, тогда как силы, вызванные разбрызгиванием или выбросом струи при диспергировании капли, тангенциальны к ударяемой поверхности. Эти два набора сил вызывают характерные точечные или туннельные повреждения поверхности (Hu и др. , 1997). Следовательно, защита поверхностей лопастей необходима, если они должны функционировать эффективно и в приемлемых коммерческих экономических пределах.Использование лазерной инженерии поверхности для разработки этой защиты путем создания поверхностных покрытий на титановых сплавах имеет некоторые преимущества по сравнению с альтернативными методами нанесения покрытий (Жечева и др.
В условиях эксплуатации эрозия удара жидкости является общепризнанным механизмом повреждения, связанным с движущимися лопастями (Робинсон и Рид, 1995). Потеря материала, происходящая с передних кромок лопаток, является результатом кумулятивных повреждений от ударов капель воды, образующихся при конденсации пара на поздних ступенях паровой турбины.Удар каждой капли создает кратковременную высокую локальную силу. Силы давления, как правило, перпендикулярны направлению удара, тогда как силы, вызванные разбрызгиванием или выбросом струи при диспергировании капли, тангенциальны к ударяемой поверхности. Эти два набора сил вызывают характерные точечные или туннельные повреждения поверхности (Hu и др. , 1997). Следовательно, защита поверхностей лопастей необходима, если они должны функционировать эффективно и в приемлемых коммерческих экономических пределах.Использование лазерной инженерии поверхности для разработки этой защиты путем создания поверхностных покрытий на титановых сплавах имеет некоторые преимущества по сравнению с альтернативными методами нанесения покрытий (Жечева и др.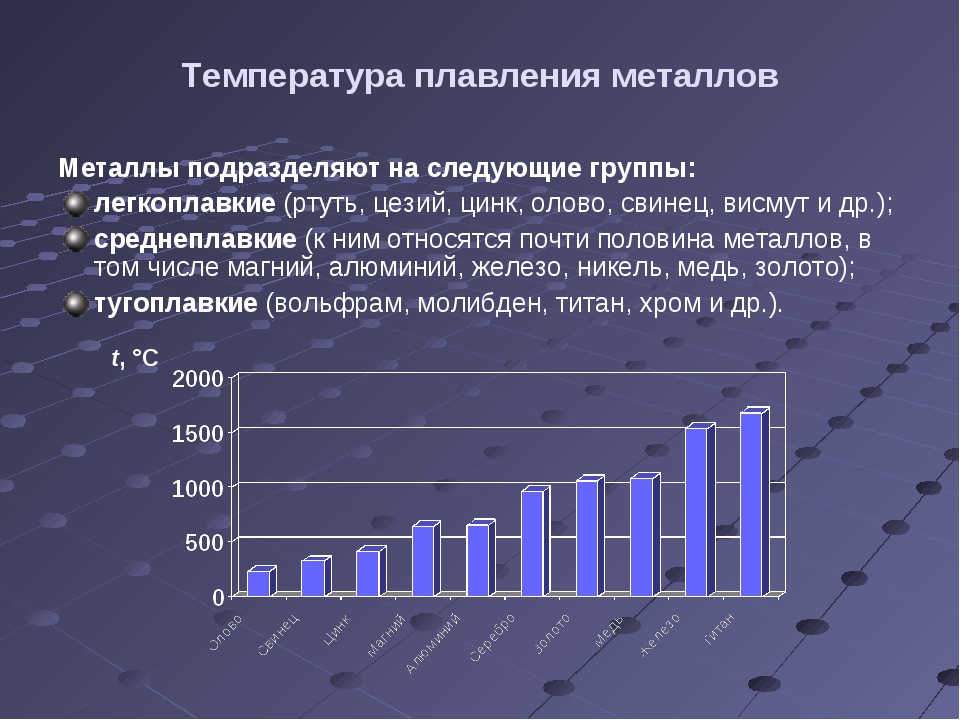 , 2005). К ним относятся точный контроль ширины и глубины модификации поверхности, а также возможность с помощью рабочих столов, управляемых компьютером, обрабатывать сложные формы и нацеливаться на определенные области компонента. Методы лазерной обработки поверхности были рассмотрены Tian et al. (2005), который включил краткое, но полезное описание биомедицинских приложений, не рассмотренных в настоящей главе (которая концентрируется на более подробном рассмотрении того, что, по сути, является функционально градиентными слоями для приложений структурной инженерии).
, 2005). К ним относятся точный контроль ширины и глубины модификации поверхности, а также возможность с помощью рабочих столов, управляемых компьютером, обрабатывать сложные формы и нацеливаться на определенные области компонента. Методы лазерной обработки поверхности были рассмотрены Tian et al. (2005), который включил краткое, но полезное описание биомедицинских приложений, не рассмотренных в настоящей главе (которая концентрируется на более подробном рассмотрении того, что, по сути, является функционально градиентными слоями для приложений структурной инженерии).
Все о титане
химический элемент в периодической таблице, имеющий символ Ti и атомный номер 22. Это легкий, прочный, блестящий, устойчивый к коррозии (включая устойчивость к морской воде и хлору) переходный металл бело-серебристо-металлического цвета. Титан используется в прочных легких сплавах (особенно с железом и алюминием) и в виде порошка с другими материалами, такими как графитовые композиты. Его наиболее распространенное соединение, диоксид титана, используется в белых пигментах.Примерами использования белого пигмента, состоящего из оксида титана, являются корректирующая жидкость и обычно используемая белая краска для перекрашивания стен. Он также используется в зубной пасте, белой краске для дорожной разметки и в белых фейерверках. Вещества, содержащие титан, называются титаносодержащими.
Его наиболее распространенное соединение, диоксид титана, используется в белых пигментах.Примерами использования белого пигмента, состоящего из оксида титана, являются корректирующая жидкость и обычно используемая белая краска для перекрашивания стен. Он также используется в зубной пасте, белой краске для дорожной разметки и в белых фейерверках. Вещества, содержащие титан, называются титаносодержащими.
Элемент встречается в многочисленных минералах, основными источниками которых являются рутил и ильменит, широко распространенные на Земле. Существуют две аллотропные формы и пять встречающихся в природе изотопов этого элемента; от 46Ti до 50Ti, причем 48Ti является наиболее распространенным (73.8%). Одной из наиболее примечательных характеристик титана является то, что он такой же прочный, как сталь, но имеет только 60% своей плотности. Свойства титана химически и физически аналогичны свойствам циркония.
Примечательные характеристики
Титан хорошо известен своей отличной устойчивостью к коррозии; он почти так же устойчив, как платина, и способен выдерживать воздействие кислот, влажного газообразного хлора и растворов поваренной соли. Чистый титан не растворяется в воде, но растворяется в концентрированных кислотах.Металлический элемент также хорошо известен своим высоким соотношением прочности и веса. Это легкий, прочный металл с низкой плотностью, который в чистом виде довольно пластичен (особенно в бескислородной среде), легко обрабатывается, блестит и имеет металлически-белый цвет. Относительно высокая температура плавления этого элемента делает его полезным в качестве тугоплавкого металла. Технические чистые сорта титана имеют предел прочности при растяжении, равный пределу прочности высокопрочных низколегированных сталей, но легче на 43 %. Титан на 60% тяжелее алюминия, но более чем в два раза прочнее алюминиевого сплава 6061-T6; эти числа могут существенно различаться из-за различных составов сплавов и переменных обработки.
Чистый титан не растворяется в воде, но растворяется в концентрированных кислотах.Металлический элемент также хорошо известен своим высоким соотношением прочности и веса. Это легкий, прочный металл с низкой плотностью, который в чистом виде довольно пластичен (особенно в бескислородной среде), легко обрабатывается, блестит и имеет металлически-белый цвет. Относительно высокая температура плавления этого элемента делает его полезным в качестве тугоплавкого металла. Технические чистые сорта титана имеют предел прочности при растяжении, равный пределу прочности высокопрочных низколегированных сталей, но легче на 43 %. Титан на 60% тяжелее алюминия, но более чем в два раза прочнее алюминиевого сплава 6061-T6; эти числа могут существенно различаться из-за различных составов сплавов и переменных обработки.
Этот металл образует пассивное и защитное оксидное покрытие (приводящее к коррозионной стойкости) при воздействии повышенных температур на воздухе, но при комнатной температуре он не тускнеет. Металл, который сгорает при нагревании на воздухе до 610°С и выше (образуя диоксид титана), также является одним из немногих элементов, сгорающих в чистом газообразном азоте (сгорает при 800°С и образует нитрид титана). Титан устойчив к разбавленной серной и соляной кислоте, а также к газообразному хлору, растворам хлора и большинству органических кислот.Он парамагнитен (слабо притягивается к магнитам) и имеет очень низкое электрическое сопротивление и теплопроводность.
Металл, который сгорает при нагревании на воздухе до 610°С и выше (образуя диоксид титана), также является одним из немногих элементов, сгорающих в чистом газообразном азоте (сгорает при 800°С и образует нитрид титана). Титан устойчив к разбавленной серной и соляной кислоте, а также к газообразному хлору, растворам хлора и большинству органических кислот.Он парамагнитен (слабо притягивается к магнитам) и имеет очень низкое электрическое сопротивление и теплопроводность.
Эксперименты показали, что природный титан становится радиоактивным после бомбардировки его дейтронами, испускающими в основном позитроны и жесткие гамма-лучи. Металл представляет собой диморфный аллотроп с гексагональной альфа-формой, очень медленно изменяющейся в кубическую бета-форму при температуре около 880 ° C. Когда он раскален докрасна, металл соединяется с кислородом, а когда он достигает 550 ° C, он соединяется с хлором.Он также реагирует с другими галогенами и поглощает водород.
Приложения
Около 95% производимого титана потребляется в виде диоксида титана (TiO2), ярко-белого перманентного пигмента с хорошей кроющей способностью в красках, бумаге, зубной пасте и пластмассах. Краски, изготовленные из диоксида титана, являются отличными отражателями инфракрасного излучения и поэтому широко используются астрономами и в красках для наружных работ. Он также используется в цементе, в драгоценных камнях, в качестве оптического глушителя в бумаге (Smook 2002) и в качестве упрочняющего агента в удочках из композитного графита и клюшках для гольфа.В последнее время его начали использовать в очистителях воздуха (в качестве фильтрующего покрытия) или в оконной пленке на зданиях, которые при воздействии ультрафиолетового света (солнечного или искусственного) и содержания влаги в воздухе превращают неотфильтрованные загрязнения воздуха в гидроксильные радикалы. .
Краски, изготовленные из диоксида титана, являются отличными отражателями инфракрасного излучения и поэтому широко используются астрономами и в красках для наружных работ. Он также используется в цементе, в драгоценных камнях, в качестве оптического глушителя в бумаге (Smook 2002) и в качестве упрочняющего агента в удочках из композитного графита и клюшках для гольфа.В последнее время его начали использовать в очистителях воздуха (в качестве фильтрующего покрытия) или в оконной пленке на зданиях, которые при воздействии ультрафиолетового света (солнечного или искусственного) и содержания влаги в воздухе превращают неотфильтрованные загрязнения воздуха в гидроксильные радикалы. .
Благодаря высокой прочности на растяжение (даже при высоких температурах), малому весу, чрезвычайной коррозионной стойкости и способности выдерживать экстремальные температуры титановые сплавы используются в самолетах, броне, военно-морских кораблях, космических кораблях и ракетах.Он используется в стальных сплавах для уменьшения размера зерна и в качестве раскислителя, а также в нержавеющей стали для снижения содержания углерода. Титан часто сплавляют с алюминием (для уменьшения размера зерна), ванадием, медью (для упрочнения), железом, марганцем, молибденом и другими металлами.
Титан часто сплавляют с алюминием (для уменьшения размера зерна), ванадием, медью (для упрочнения), железом, марганцем, молибденом и другими металлами.
Сварные титановые трубы используются в химической промышленности из-за их коррозионной стойкости и все чаще используются в бурении нефтяных скважин, особенно на шельфе, благодаря своей прочности, легкому весу и коррозионной стойкости.
Титан, легированный ванадием, используется во внешней обшивке самолетов, противопожарных стенках, шасси и гидравлических трубах.Приблизительно 58 тонн металла используется в Boeing 777, 43 в 747, 18 в 737, 24 в Airbus A340, 17 в A330 и 12 в A320, согласно годовому отчету Titanium Metals за 2004 год. Корпорация. Как правило, более новые модели используют больше, а широкофюзеляжные — больше всего. A380 может использовать 77 тонн, в том числе около 10 или 11 тонн в двигателях.
Использование титана в потребительских товарах, таких как теннисные ракетки, клюшки для гольфа, велосипеды, лабораторное оборудование, наручные часы, обручальные кольца и портативные компьютеры, становится все более распространенным явлением.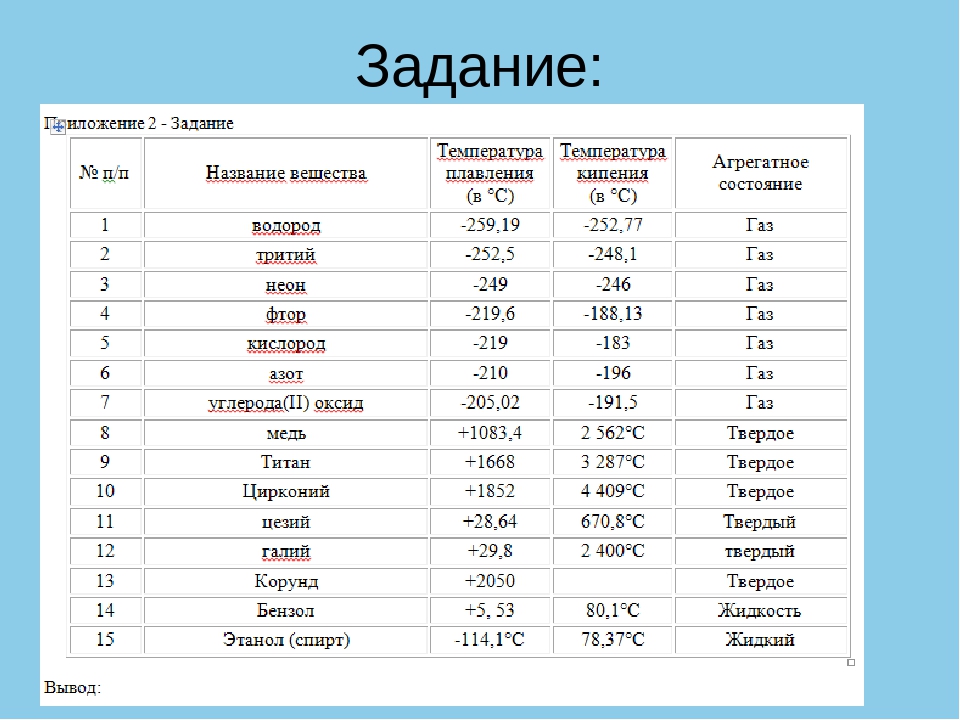
Другое использование:
- Благодаря отличной стойкости к морской воде он используется для изготовления гребных валов и такелажа, а также в теплообменниках опреснительных установок и нагревателях-чиллерах для морских аквариумов, а в последнее время и водолазных ножей.
- Благодаря своей прочности и инертности к морской воде, а также значительным запасам руды в России он был основным материалом, используемым при строительстве многих передовых российских подводных лодок, в том числе самых глубоководных на сегодняшний день военных подводных лодок класса «Альфа» и «Майк». а также класс Тайфун.
- Используется для производства относительно мягких искусственных драгоценных камней.
- Тетрахлорид титана (TiCl4), бесцветная жидкость, используется для иризации стекла, а поскольку он сильно дымит во влажном воздухе, его также используют для изготовления дымовых завес и для письма в небе.
- Помимо того, что диоксид титана является очень важным пигментом, он также используется в солнцезащитных кремах из-за его устойчивости к ультрафиолетовому излучению.

- Поскольку этот металл считается физиологически инертным, он используется в имплантатах для замены суставов, таких как тазобедренные суставы и гильзы, а также для изготовления медицинского оборудования, а также для облицовки труб и резервуаров в пищевой промышленности.Поскольку титан не является ферромагнитным, пациентов с титановыми имплантатами можно безопасно обследовать с помощью магнитно-резонансной томографии (удобно для долгосрочных имплантатов). Титан
- также используется для хирургических инструментов, используемых в хирургии под визуальным контролем.
- Его инертность и способность окрашиваться в привлекательный цвет делают его популярным металлом для пирсинга.
- Титан обладает необычной способностью к остеоинтеграции, что позволяет использовать его в зубных имплантатах. Эта способность также используется некоторыми ортопедическими имплантатами.Ортопедические применения также используют более низкий модуль упругости титана, чтобы более точно соответствовать модулю кости, для восстановления которой предназначены такие устройства.
 В результате скелетные нагрузки более равномерно распределяются между костью и имплантатом, что приводит к меньшей частоте деградации кости из-за защиты от напряжения и перипротезных переломов костей, которые возникают на границах ортопедических имплантатов, которые действуют как концентраторы напряжения. Однако жесткость титановых сплавов по-прежнему более чем в два раза превышает жесткость кости, что в конечном итоге приводит к деградации суставов. Титановые сплавы
В результате скелетные нагрузки более равномерно распределяются между костью и имплантатом, что приводит к меньшей частоте деградации кости из-за защиты от напряжения и перипротезных переломов костей, которые возникают на границах ортопедических имплантатов, которые действуют как концентраторы напряжения. Однако жесткость титановых сплавов по-прежнему более чем в два раза превышает жесткость кости, что в конечном итоге приводит к деградации суставов. Титановые сплавы - также используются в оправах для очков. В результате получается довольно дорогая, но очень прочная и долговечная рама. В этом приложении находят применение как традиционные сплавы, так и сплавы с памятью формы.
- Многие туристы используют титановое снаряжение, в том числе кухонную посуду, столовые приборы, фонари и колышки для палаток. Хотя эти титановые изделия немного дороже, чем традиционные альтернативы из стали или алюминия, они могут быть значительно легче без ущерба для прочности.Однако некоторые утверждают, что тепловые свойства титановой посуды делают ее непригодной для серьезного кулинарного применения.

- Титан все чаще используется в древках клюшек для лакросса.
- Титан все чаще используется в решетках крикетных шлемов.
- Титан может быть анодирован для получения различных цветов.[1][2]
- Титан также присутствует в фейерверках.
- Титан выпускается в виде фольги, листа, проволоки, гранул, губки, наноразмерного активированного порошка, порошка, сетки и стержня.
Титан иногда использовался в строительстве: 150-футовый (45-метровый) памятник Юрию Гагарину, первому человеку, отправившемуся в космос, в Москве сделан из титана из-за привлекательного цвета металла и ассоциации с ракетной техникой. Музей Гуггенхайма в Бильбао и библиотека Серритос были первыми зданиями в Европе и Северной Америке соответственно, обшитыми титановыми панелями.
История
Титан был обнаружен в Крид, Корнуолл в Англии, геологом-любителем преподобным Уильямом Грегором в 1791 году.Он признал присутствие нового элемента в ильмените и назвал его менахитом (альтернативно пишется манакканит) в честь близлежащего округа Манаккан [3].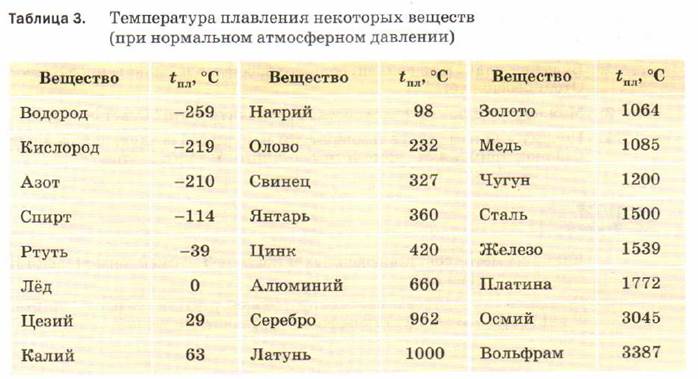 Примерно в то же время Франц Йозеф Мюллер также произвел подобное вещество, но не смог его идентифицировать. Этот элемент был заново открыт несколько лет спустя немецким химиком Мартином Генрихом Клапротом в рутиловой руде. Клапрот подтвердил, что это новый элемент, и в 1795 году назвал его в честь титанов греческой мифологии.
Примерно в то же время Франц Йозеф Мюллер также произвел подобное вещество, но не смог его идентифицировать. Этот элемент был заново открыт несколько лет спустя немецким химиком Мартином Генрихом Клапротом в рутиловой руде. Клапрот подтвердил, что это новый элемент, и в 1795 году назвал его в честь титанов греческой мифологии.
Металл всегда было трудно извлечь из различных руд.Чистый металлический титан (99,9%) был впервые получен в 1910 г. Мэтью А. Хантером путем нагревания TiCl4 с натрием в стальной бомбе при 700-800°С в процессе Хантера. Металлический титан не использовался вне лаборатории до 1946 года, когда Уильям Джастин Кролл доказал, что титан можно производить в промышленных масштабах путем восстановления тетрахлорида титана магнием в процессе Кролла, который используется до сих пор.
В 1950-1960-х годах Советский Союз пытался монополизировать мировой рынок титана в качестве тактики в период холодной войны, чтобы предотвратить его использование американскими военными. Несмотря на эти усилия, США получили большое количество титана, когда европейская компания создала прикрытие для его покупки иностранными спецслужбами США. Действительно, титан для очень успешного американского разведывательного самолета SR-71 был приобретен в Советском Союзе в разгар холодной войны.
Несмотря на эти усилия, США получили большое количество титана, когда европейская компания создала прикрытие для его покупки иностранными спецслужбами США. Действительно, титан для очень успешного американского разведывательного самолета SR-71 был приобретен в Советском Союзе в разгар холодной войны.
К 1956 г. производство титановой продукции в США превысило 6 млн кг/год.(1)
Возникновение
Металлический титан всегда связан с другими элементами в природе.Это девятый по распространенности элемент в земной коре (0,63% по массе) и присутствует в большинстве изверженных горных пород и образовавшихся из них отложениях (а также в живых существах и естественных водоемах). Он широко распространен и встречается преимущественно в минералах анатазе, бруките, ильмените, перовските, рутиле, титаните (сфене), а также во многих железных рудах. Из этих минералов только ильменит и рутил имеют важное экономическое значение, но даже их трудно найти в высоких концентрациях. Поскольку он легко реагирует с кислородом и углеродом при высоких температурах, трудно получить чистый металлический титан, кристаллы или порошок. Значительные месторождения титановой руды существуют в Австралии, Новой Зеландии, Скандинавии, Северной Америке и Малайзии. Большие количества также были обнаружены в районе Квале в Кении, месторождениях, права на добычу которых принадлежат канадской фирме Tiomin.
Поскольку он легко реагирует с кислородом и углеродом при высоких температурах, трудно получить чистый металлический титан, кристаллы или порошок. Значительные месторождения титановой руды существуют в Австралии, Новой Зеландии, Скандинавии, Северной Америке и Малайзии. Большие количества также были обнаружены в районе Квале в Кении, месторождениях, права на добычу которых принадлежат канадской фирме Tiomin.
Этот металл содержится в метеоритах, на Солнце и в звездах М-типа. Камни, доставленные с Луны во время миссии «Аполлон-17», состоят из 12 камней.1% TiO2. Титан также содержится в угольной золе, растениях и даже в человеческом теле (хотя он безвреден, он не считается важным элементом).
Изоляция
Поскольку металл реагирует с воздухом при высоких температурах, его нельзя получить путем восстановления его двуокиси. Поэтому металлический титан в промышленных масштабах производится с помощью процесса Кролла, сложного и дорогостоящего периодического процесса, разработанного в 1946 году Уильямом Джастином Кроллом. В процессе Кролла оксид сначала превращается в хлорид путем карбохлорирования, при котором газообразный хлор пропускают через раскаленный докрасна рутил или ильменит в присутствии углерода для получения TiCl4.Его конденсируют и очищают фракционной перегонкой, а затем восстанавливают расплавленным магнием при 800°С в атмосфере аргона.
В процессе Кролла оксид сначала превращается в хлорид путем карбохлорирования, при котором газообразный хлор пропускают через раскаленный докрасна рутил или ильменит в присутствии углерода для получения TiCl4.Его конденсируют и очищают фракционной перегонкой, а затем восстанавливают расплавленным магнием при 800°С в атмосфере аргона.
Более новый процесс, Кембриджский процесс FFC, может заменить старый процесс Кролла. Этот метод использует исходный порошок диоксида титана (который представляет собой очищенную форму рутила) для получения конечного продукта, который представляет собой порошок или губку. Если используются порошки смешанных оксидов, продукт представляет собой сплав по гораздо более низкой цене, чем традиционный многостадийный процесс плавления.Есть надежда, что Кембриджский процесс FFC сделает титан менее редким и дорогим материалом для аэрокосмической промышленности и рынка предметов роскоши, и его можно будет увидеть во многих продуктах, которые в настоящее время производятся с использованием алюминия и специальных сортов стали.
Титан был очищен до сверхвысокой чистоты в небольших количествах, когда Антон Эдуард ван Аркель и Ян Хендрик де Бур в 1925 году открыли процесс йодида, или кристаллического бруска, путем реакции с йодом и разложения образовавшихся паров над горячей нитью на чистый металл.
Оксид титана производится в промышленных масштабах путем измельчения его минеральной руды и смешивания ее с карбонатом калия и водным раствором плавиковой кислоты. Это дает фторотитанат калия (K2TiF6), который экстрагируют горячей водой и разлагают аммиаком с образованием гидратированного оксида аммиака. Это, в свою очередь, воспламеняется в платиновом сосуде, в результате чего образуется чистый диоксид титана.
Обычные титановые сплавы производятся путем восстановления. Например; восстанавливают купротитан (рутил с добавлением меди), ферроуглеродистый титан (ильменит восстанавливают коксом в электропечи) и манганотитан (рутил с марганцем или оксидами марганца).
Соединения
В химии титана преобладает степень окисления +4, но также распространены соединения со степенью окисления +3.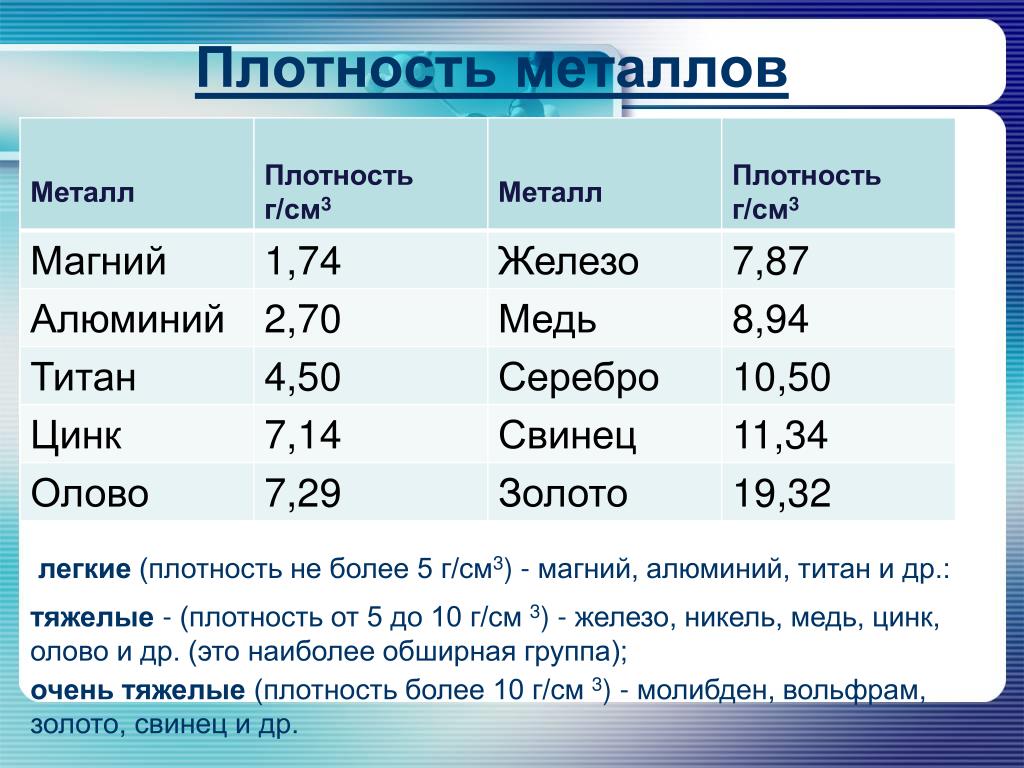 Из-за этой высокой степени окисления многие соединения титана имеют высокую степень ковалентной связи.
Из-за этой высокой степени окисления многие соединения титана имеют высокую степень ковалентной связи.
Хотя металлический титан встречается относительно редко, из-за стоимости экстракции диоксид титана (также называемый титаном (IV), титановыми белилами или даже диоксидом титана) дешев, нетоксичен, легко доступен в больших объемах и очень широко используется в качестве белого пигмента в краска, эмаль, лак, пластик и строительный цемент.Порошок TiO2 химически инертен, устойчив к выгоранию на солнце и очень непрозрачен: это позволяет ему придавать чистый и блестящий белый цвет коричневым или серым химическим веществам, из которых состоит большинство бытовых пластмасс. В природе это соединение встречается в минералах анатазе, бруките и рутиле.
Краска на основе диоксида титана хорошо переносит суровые температуры, в некоторой степени самоочищается и выдерживает морскую среду. Чистый диоксид титана имеет очень высокий показатель преломления и оптическую дисперсию выше, чем у алмаза. Звездчатые сапфиры и рубины получают свой астеризм из-за присутствующего в них диоксида титана. Титанаты представляют собой соединения, изготовленные из диоксида титана. Титанат бария обладает пьезоэлектрическими свойствами, что позволяет использовать его в качестве преобразователя при взаимном преобразовании звука и электричества. Эфиры титана образуются в результате реакции спиртов и тетрахлорида титана и используются для водонепроницаемости тканей.
Звездчатые сапфиры и рубины получают свой астеризм из-за присутствующего в них диоксида титана. Титанаты представляют собой соединения, изготовленные из диоксида титана. Титанат бария обладает пьезоэлектрическими свойствами, что позволяет использовать его в качестве преобразователя при взаимном преобразовании звука и электричества. Эфиры титана образуются в результате реакции спиртов и тетрахлорида титана и используются для водонепроницаемости тканей.
Нитрид титана часто используется для покрытия режущих инструментов, таких как сверла. Он также находит применение в качестве декоративной отделки золотого цвета и в качестве барьерного металла при производстве полупроводников.
Хлорид титана (IV) (тетрахлорид титана, TiCl4, иногда называемый «щекоткой») представляет собой бесцветную слабокислую жидкость, которая используется в качестве промежуточного продукта при производстве оксида титана (IV) для краски. Он широко используется в органической химии в качестве кислоты Льюиса, например, в альдольной конденсации Мукаямы. Титан также образует низший хлорид, хлорид титана (III) (TiCl3), который используется в качестве восстановителя.
Титан также образует низший хлорид, хлорид титана (III) (TiCl3), который используется в качестве восстановителя.
Дихлорид титаноцена является важным катализатором образования углерод-углеродных связей.Изопропоксид титана используется для эпоксидирования по Шарплессу. Другие соединения включают; Бромид титана (используется в металлургии, суперсплавах, высокотемпературной электропроводке и покрытиях) и карбид титана (находится в высокотемпературных режущих инструментах и покрытиях).
Изотопы
Встречающийся в природе титан состоит из 5 стабильных изотопов; 46Ti, 47Ti, 48Ti, 49Ti и 50Ti, причем 48Ti является наиболее распространенным (73,8% естественного содержания). Охарактеризованы одиннадцать радиоизотопов, наиболее стабильным из которых является 44Ti с периодом полураспада 63 года, 45Ti с периодом полураспада 184 года.8 минут, 51Ti с периодом полураспада 5,76 минуты и 52Ti с периодом полураспада 1,7 минуты. Все остальные радиоактивные изотопы имеют период полураспада менее 33 секунд, а большинство из них имеют период полураспада менее половины секунды.
Изотопы титана имеют атомный вес от 39,99 а.е.м. (40Ti) до 57,966 а.е.м. (58Ti). Основной модой распада до наиболее распространенного стабильного изотопа 48Ti является захват электронов, а основной модой после — бета-излучение. Первичными продуктами распада до 48Ti являются изотопы элемента 21 (скандия), а первичными продуктами после — изотопы элемента 23 (ванадия).
Эта статья находится под лицензией GNU Free Documentation License. Он использует материал из статьи Википедии «Титан».
Взгляд на точечные дефекты и примеси в титане из первых принципов
Титан в чистом виде при комнатной температуре и атмосферном давлении кристаллизуется в ГПУ-структуре с пространственной группой симметрии P6 3 /mmc (международная космическая группа № 194). Кристаллическая структура содержит два атома на примитивную ячейку. 32 Параметры решетки, определенные из экспериментов и теоретических исследований, показаны в таблице 1, где значения, вычисленные с использованием обменно-корреляционных функционалов, таких как аппроксимация локальной плотности (LDA 33 ) и две различные параметризации приближения обобщенного градиента (GGA ), PW’91 34 и PBE сравниваются.
полные энергии, рассчитанные из DFT.Энергия образования определяется как D}} \right) — E_{{\mathrm{Ti}} — {\mathrm{host}}} — pn_X\mu _X$$
(1)
Здесь, E f (D) — энергия образования дефекта D, измеряемая в эВ/суперячейка, E Supercell (D) и E Ti−хозяин — полная энергия дефекта и чистой суперячейки соответственно. мк Х — химический потенциал для видов X и n X — количество таких примесей в дефектной суперъячейке. p = ±1 в зависимости от того, удаляется ли атом из суперячейки-хозяина или добавляется к ней для создания дефектной суперячейки. Концентрация точечных дефектов пропорциональна экспоненте энергии образования. Энергия образования также помогает определить коэффициент диффузии для кинематики дефектов. 38 Однако первые принципы определения энергии пласта, рассчитанной по формуле. (1) зависит от выбора μ X ; следовательно, правильный выбор химических потенциалов улучшает интерпретацию энергий образования. В нашем исследовании мк X Значения выбираются из чистого состояния примесей, называемых химическими потенциалами «элементов», а оксиды соответствующих элементов-примесей называются химическими потенциалами «оксидов».Подробно об источниках μ X , а их роль в термодинамике представлена во вспомогательной информации.
Концентрация точечных дефектов пропорциональна экспоненте энергии образования. Энергия образования также помогает определить коэффициент диффузии для кинематики дефектов. 38 Однако первые принципы определения энергии пласта, рассчитанной по формуле. (1) зависит от выбора μ X ; следовательно, правильный выбор химических потенциалов улучшает интерпретацию энергий образования. В нашем исследовании мк X Значения выбираются из чистого состояния примесей, называемых химическими потенциалами «элементов», а оксиды соответствующих элементов-примесей называются химическими потенциалами «оксидов».Подробно об источниках μ X , а их роль в термодинамике представлена во вспомогательной информации.
Мы отмечаем, что LDA и GGA не могут предсказать свойства основного состояния сильно коррелированных систем, особенно оксидов переходных металлов, проявляющих сегнетоэлектричество, сверхпроводимость, переходы металл-изолятор и магнетизм. Проблема более остра для полупроводниковых свойств и магнитных свойств и не так серьезна для простых металлических элементов.Ситуацию можно в идеале преодолеть, включив специфический для элемента и орбитально селективный кулоновский член отталкивания на месте, называемый методом Хаббарда U (метод DFT + U ). Однако нет единого мнения об использовании конкретного значения U для всех расчетов, поскольку эти значения не подлежат передаче. Фактическое значение U меняется в зависимости от элементов переходных металлов и их соответствующих соединений. Это еще более осложняется тем фактом, что значение U не должно быть одинаковым для разных кристаллических структур одного и того же элемента или соединения.Таким образом, полная энергия зависит от значения U в методе DFT + U . Поскольку полная энергия является основой нашего анализа, мы пытаемся здесь избежать двусмысленности, которая может возникнуть из-за включения двух разных уровней теории, DFT и DFT + U и варьирования значения U индивидуально для каждого элемента.
Проблема более остра для полупроводниковых свойств и магнитных свойств и не так серьезна для простых металлических элементов.Ситуацию можно в идеале преодолеть, включив специфический для элемента и орбитально селективный кулоновский член отталкивания на месте, называемый методом Хаббарда U (метод DFT + U ). Однако нет единого мнения об использовании конкретного значения U для всех расчетов, поскольку эти значения не подлежат передаче. Фактическое значение U меняется в зависимости от элементов переходных металлов и их соответствующих соединений. Это еще более осложняется тем фактом, что значение U не должно быть одинаковым для разных кристаллических структур одного и того же элемента или соединения.Таким образом, полная энергия зависит от значения U в методе DFT + U . Поскольку полная энергия является основой нашего анализа, мы пытаемся здесь избежать двусмысленности, которая может возникнуть из-за включения двух разных уровней теории, DFT и DFT + U и варьирования значения U индивидуально для каждого элемента.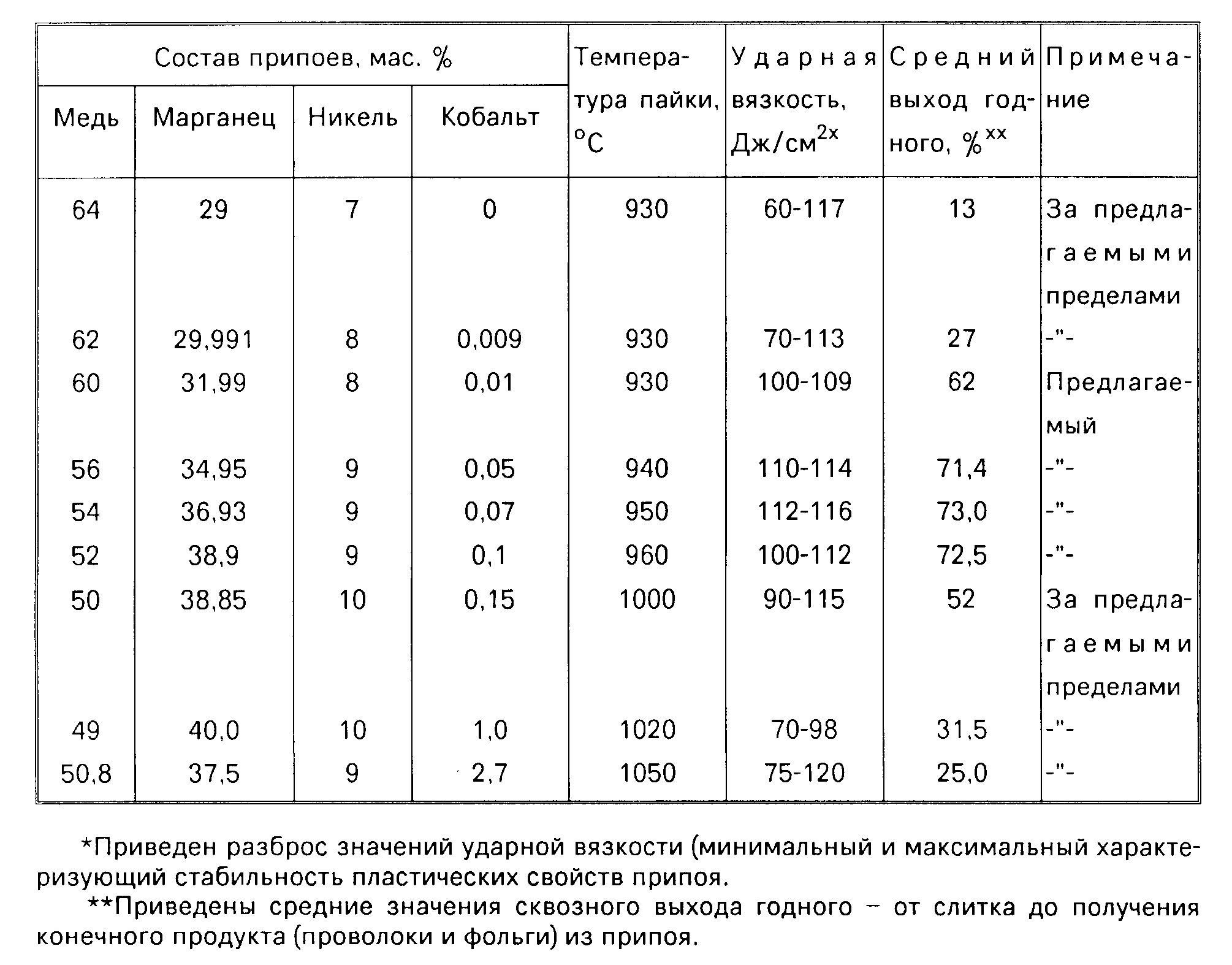
Собственные междоузлия
Атомы титана, занимающие междоузлия в решетке, являются собственными междоузлиями. В ГПУ-кристаллической решетке дефект внутреннего внедрения может располагаться в шести узлах элементарной ячейки, как показано на рис.1. 39 Они называются ортогональными (О) и тетраэдрическими (Т) позициями. Примеси в базально-тетраэдрических (BT) и базально-октаэдрических (BO) позициях лежат в базисной плоскости, на полпути между двумя соседними позициями T и позициями O вдоль направления c соответственно. Краудионы представляют собой промежуточные положения между центром связи Ti-Ti, и были идентифицированы две разные конфигурации: базальный (CB) и небазальный (CN) краудионы. В отличие от этих примесных узлов, которые могут содержать только один примесный атом на узел, димероподобные межузельные точечные дефекты состоят из двух атомов.Два атома димероподобной примеси смещены симметрично относительно вакантного узла решетки. Из-за гексагональной симметрии существуют две ориентации димероподобных точечных дефектов.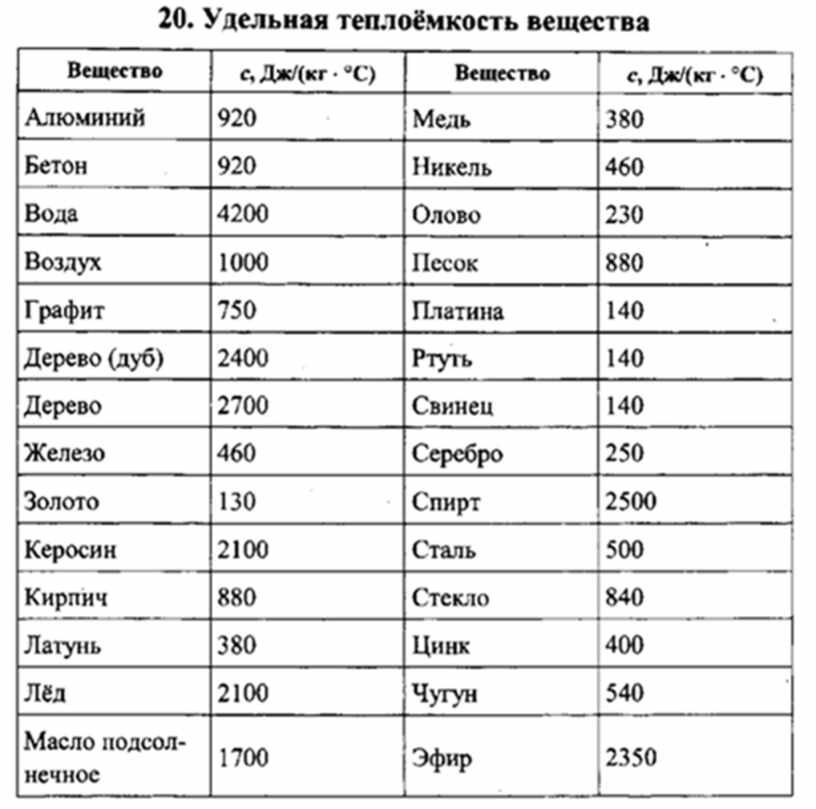 Конфигурация гантели, ориентированная вдоль направления c (DC), и конфигурация гантели, лежащая в базовой плоскости (DB), являются уникальным выбором. Конфигурации DC и DB представляют собой разделенные межстраничные объявления, которые являются своего рода собственными межстраничными объявлениями. Положения всех восьми междоузельных конфигураций показаны на схематическом изображении рис.1. Энергии образования суммированы для восьми собственных междоузельных конфигураций в Ti, перечисленных в таблице 2. Суперячейка состоит из периодического повторения примитивных единиц решетки ГПУ, внутри которых размещены примесные атомы. Эта суперячейка геометрически оптимизирована схемой сопряженных градиентов, чтобы минимизировать внутреннюю деформацию. Характерные положения примеси в оптимизированной суперячейке устанавливаются путем изучения ее ближайшего соседа. Разность энергий образования и полная разность энергий для изолированных дефектов собственного внедрения одинаковы.Однако энергия образования имеет преимущество, так как позволяет сравнивать расщепленную энергетику внедрения со случаями конфигураций дефектов замещения и внедрения.
Конфигурация гантели, ориентированная вдоль направления c (DC), и конфигурация гантели, лежащая в базовой плоскости (DB), являются уникальным выбором. Конфигурации DC и DB представляют собой разделенные межстраничные объявления, которые являются своего рода собственными межстраничными объявлениями. Положения всех восьми междоузельных конфигураций показаны на схематическом изображении рис.1. Энергии образования суммированы для восьми собственных междоузельных конфигураций в Ti, перечисленных в таблице 2. Суперячейка состоит из периодического повторения примитивных единиц решетки ГПУ, внутри которых размещены примесные атомы. Эта суперячейка геометрически оптимизирована схемой сопряженных градиентов, чтобы минимизировать внутреннюю деформацию. Характерные положения примеси в оптимизированной суперячейке устанавливаются путем изучения ее ближайшего соседа. Разность энергий образования и полная разность энергий для изолированных дефектов собственного внедрения одинаковы.Однако энергия образования имеет преимущество, так как позволяет сравнивать расщепленную энергетику внедрения со случаями конфигураций дефектов замещения и внедрения.
Схематическая кристаллическая структура, показывающая положения различных типов собственных междоузлий в решетке ГПУ Ti. Положения тетраэдрического (Т), ортогонального (О), базового тетраэдрического (ВТ), базового ортогонального (ВО), краудиона в базисной (CB) и небазальной (CN) плоскостях, а также расщепленного междоузлия вдоль c -направление (DC) и в базисной плоскости (DB).В таблице 2 приведена относительная стабильность этих дефектов в основе Ti
Таблица 2 Сравнение E f (в эВ на суперячейку) для восьми конфигураций собственных междоузлий (показаны на рис. 1) Длина связи слитого междоузлия была рассчитана как 1,663 и 1,930 Å для DC и DB соответственно. Исходные геометрии были выбраны путем выбора конфигурации с наименьшей полной энергией после проверки зависимости полной энергии от длины связи примесной пары в чистой решетке. Энергии образования приведены в табл. 2 для начального ( E f U ) и расслабленный ( E f R ) суперячейки для различных конфигураций. Другими словами, E f U указывает энергию примесных межузельных димеров, когда атомы-хозяева не релаксированы. Разница в энергии (Δ E f UR = E f U − E f R ) объясняет выигрыш в химической энергии за счет локальных искажений решетки.Длины связей Ti–Ti составляют 1,430 и 1,463 Å для конфигураций CN и CB соответственно, что составляет примерно половину равновесной постоянной решетки. Δ E f UR выглядит большим для собственных межстраничных объявлений Crowdion; 9,4 и 9,8 эВ для CB и CN, соответственно, из-за звездной величины E f U , который уже велик из-за дополнительного атома Ti между равновесными связями Ti–Ti.
Энергии образования приведены в табл. 2 для начального ( E f U ) и расслабленный ( E f R ) суперячейки для различных конфигураций. Другими словами, E f U указывает энергию примесных межузельных димеров, когда атомы-хозяева не релаксированы. Разница в энергии (Δ E f UR = E f U − E f R ) объясняет выигрыш в химической энергии за счет локальных искажений решетки.Длины связей Ti–Ti составляют 1,430 и 1,463 Å для конфигураций CN и CB соответственно, что составляет примерно половину равновесной постоянной решетки. Δ E f UR выглядит большим для собственных межстраничных объявлений Crowdion; 9,4 и 9,8 эВ для CB и CN, соответственно, из-за звездной величины E f U , который уже велик из-за дополнительного атома Ti между равновесными связями Ti–Ti. По сравнению с этим разность энергий Δ E f UR минимален для разделенных междоузельных конфигураций, DC и DB, поскольку два примесных атома расположены в междоузельной области близко к их равновесному разделению из-за способа подготовки моделей DC и DB.
По сравнению с этим разность энергий Δ E f UR минимален для разделенных междоузельных конфигураций, DC и DB, поскольку два примесных атома расположены в междоузельной области близко к их равновесному разделению из-за способа подготовки моделей DC и DB.
Мы обнаружили, что конфигурация BO является наиболее благоприятной конфигурацией собственного междоузлия. Энергия конфигурации CB аналогична энергии конфигурации BO.{\mathrm{U}}\) в таблице 2).
Пары вакансия-междоузлия
Энергия образования атома, отсутствующего в узле решетки, т. е. вакансии ( V Ti , не путать с ванадием, замещенным на узле Ti, V Ti ), равна рассчитывается как
$$E_f\left( {V_{{\mathrm{Ti}}}} \right) = E\left( {{\mathrm{Ti}} + V_{{\mathrm{Ti}}}} \справа) — \mu _{{\mathrm{Ti}}}$$
(2)
, где E — полная энергия, а значение μ Ti , полученное из объема Ti, равно 1. 94 эВ, что аналогично значению, полученному из расчетов ультрамягких псевдопотенциалов. 40 Энергии вакансий Ti получены в аналогичном диапазоне с разными обменно-корреляционными функционалами, 41 которые завышены по сравнению с полученными в эксперименте (1,55 эВ в ссылке 42 и 1,27 эВ из спектроскопии позитронной аннигиляции в работе 43 ). Расхождение связано с отсутствием обменной корреляции на основе плотности для учета точной обработки электронной корреляции. 44 Существует способ преодолеть ограничения GGA, добавив поправочный член Хаббарда U . Однако в нашем исследовании он не использовался из-за неоднозначности, которую он вносит в трактовку химических потенциалов, что влияет на расчет энергий образования. Энергетика показывает, что величина энергии образования вакансий сравнима с собственными междоузлиями, см. табл. 2. Таким образом, можно предположить, что и вакансии, и собственные междоузлия, вероятно, одновременно реагируют на термодинамические возмущения, которые можно объединить, чтобы получить механизм миграции атома Ti для прыжка из положения в решетке в ближайшее междоузельное положение.
94 эВ, что аналогично значению, полученному из расчетов ультрамягких псевдопотенциалов. 40 Энергии вакансий Ti получены в аналогичном диапазоне с разными обменно-корреляционными функционалами, 41 которые завышены по сравнению с полученными в эксперименте (1,55 эВ в ссылке 42 и 1,27 эВ из спектроскопии позитронной аннигиляции в работе 43 ). Расхождение связано с отсутствием обменной корреляции на основе плотности для учета точной обработки электронной корреляции. 44 Существует способ преодолеть ограничения GGA, добавив поправочный член Хаббарда U . Однако в нашем исследовании он не использовался из-за неоднозначности, которую он вносит в трактовку химических потенциалов, что влияет на расчет энергий образования. Энергетика показывает, что величина энергии образования вакансий сравнима с собственными междоузлиями, см. табл. 2. Таким образом, можно предположить, что и вакансии, и собственные междоузлия, вероятно, одновременно реагируют на термодинамические возмущения, которые можно объединить, чтобы получить механизм миграции атома Ti для прыжка из положения в решетке в ближайшее междоузельное положение. Рассмотрение μ Ti , полученных из объемных моделей Ti, связано с ситуацией, когда решетка вакансий находится в термодинамическом равновесии с совершенным объемным Ti. Однако это может быть нереалистичным в технологических процессах, особенно если интересующий смещенный атом Ti остается глубоко в объемном образце, образуя вторичные фазы с другими дефектами/примесями в решетке. Наиболее тривиальным случаем для нашего обсуждения были бы дефектные комплексы, состоящие из вакансии и примеси собственного внедрения.
Рассмотрение μ Ti , полученных из объемных моделей Ti, связано с ситуацией, когда решетка вакансий находится в термодинамическом равновесии с совершенным объемным Ti. Однако это может быть нереалистичным в технологических процессах, особенно если интересующий смещенный атом Ti остается глубоко в объемном образце, образуя вторичные фазы с другими дефектами/примесями в решетке. Наиболее тривиальным случаем для нашего обсуждения были бы дефектные комплексы, состоящие из вакансии и примеси собственного внедрения.
Чтобы получить представление о комплексах дефектов, мы рассчитали энергию образования пары V Ti – междоузельный Ti в зависимости от разделения отдельных компонентов, т.е. вакансии титана, V Ti и межузельный атом титана. Модели Supercell были подготовлены с промежуточным Ti в конфигурации BO, а V Ti созданы в разных положениях, так что расстояние V Ti от промежуточного Ti равно 2. 15, 4,20, 4,58, 6,44 и 9,23 Å. После минимизации внутренних сил в суперячейках (геометрическая оптимизация) обнаружено, что для первых трех более коротких расстояний между парами межузельный Ti будет притягиваться к пустому узлу решетки, что может привести к устранению дефекта. Однако при больших расстояниях 6,44 и 9,23 Å взаимодействие между V Ti и межузельным атомом титана экранируется атомами-хозяевами между ними. В результате V Ti и межузельный атом Ti оказываются в ловушке локальных минимумов энергии без заметного изменения их разделительного расстояния.Энергии образования для трех кратчайших расстояний идентичны и почти на 3,9 эВ меньше, чем энергии образования двух больших расстояний. В идеале с точки зрения энергетики можно было бы ожидать, что вакансии и междоузлия должны аннигилировать друг с другом и, таким образом, восстанавливать окружение идеальной ГПУ-решетки, если эти дефекты находятся в непосредственной близости.
15, 4,20, 4,58, 6,44 и 9,23 Å. После минимизации внутренних сил в суперячейках (геометрическая оптимизация) обнаружено, что для первых трех более коротких расстояний между парами межузельный Ti будет притягиваться к пустому узлу решетки, что может привести к устранению дефекта. Однако при больших расстояниях 6,44 и 9,23 Å взаимодействие между V Ti и межузельным атомом титана экранируется атомами-хозяевами между ними. В результате V Ti и межузельный атом Ti оказываются в ловушке локальных минимумов энергии без заметного изменения их разделительного расстояния.Энергии образования для трех кратчайших расстояний идентичны и почти на 3,9 эВ меньше, чем энергии образования двух больших расстояний. В идеале с точки зрения энергетики можно было бы ожидать, что вакансии и междоузлия должны аннигилировать друг с другом и, таким образом, восстанавливать окружение идеальной ГПУ-решетки, если эти дефекты находятся в непосредственной близости.
Примеси внедрения и замещения
Энергии образования примесей в положениях внедрения и замещения в ГПУ-решетке Ti рассчитаны из «элементных» химических потенциалов ( μ элемент ) и «оксидных» химических потенциалов ( μ оксид ), см. вспомогательную информацию, которая указана в таблицах 3 и 4 соответственно.Например, на рис. 2а показаны рассчитанные энергии образования примеси О в Ti. Энергии образования в нижнем диапазоне получены из полной энергии молекулы O 2 , что можно интерпретировать как термодинамическое состояние с богатой кислородом средой, в то время как энергии образования в верхнем диапазоне получены из TiO 2 в структура рутила, которую можно интерпретировать как термодинамическое состояние с дефицитом кислорода в окружающей среде. Горизонтальные пунктирные линии на этом рисунке обозначают конфигурацию с наименьшей энергией образования в каждом случае.Замечено, что атом O предпочитает октаэдрическое междоузлие, когда в окружающей среде дефицит кислорода. С другой стороны, в среде с богатым запасом кислорода термодинамически стабильной фазой являются пары примесей кислорода, приводящие к конфигурациям DB и DC (см. рис. 1). Относительные различия энергий образования позиций внедрения и замещения для двух типов химического окружения можно оценить по данным рис.
вспомогательную информацию, которая указана в таблицах 3 и 4 соответственно.Например, на рис. 2а показаны рассчитанные энергии образования примеси О в Ti. Энергии образования в нижнем диапазоне получены из полной энергии молекулы O 2 , что можно интерпретировать как термодинамическое состояние с богатой кислородом средой, в то время как энергии образования в верхнем диапазоне получены из TiO 2 в структура рутила, которую можно интерпретировать как термодинамическое состояние с дефицитом кислорода в окружающей среде. Горизонтальные пунктирные линии на этом рисунке обозначают конфигурацию с наименьшей энергией образования в каждом случае.Замечено, что атом O предпочитает октаэдрическое междоузлие, когда в окружающей среде дефицит кислорода. С другой стороны, в среде с богатым запасом кислорода термодинамически стабильной фазой являются пары примесей кислорода, приводящие к конфигурациям DB и DC (см. рис. 1). Относительные различия энергий образования позиций внедрения и замещения для двух типов химического окружения можно оценить по данным рис. 2а.
2а.
Сравнение энергий образования примесных элементов в различных междоузлиях и на замещении сайт. Примесь O выбрана в качестве примера в ( a ). Нижний и верхний диапазоны энергий образования получены с использованием μ оксида и μ элемента , полученного из молекулы O 2 и твердого вещества TiO 2 , соответственно, значения которых показаны пунктирными горизонтальными линиями. б Минимальное значение энергий образования исследуемых примесей от двух источников химических потенциалов. Символы соответствуют конфигурациям примесей, как в ( и ). Энергии образования данных для выбранных элементов 3d, 4d и 5d показаны на заштрихованном (желтом) фоне
Чем ниже энергия образования конфигурации дефекта, тем выше вероятность обнаружения такого дефекта в образце.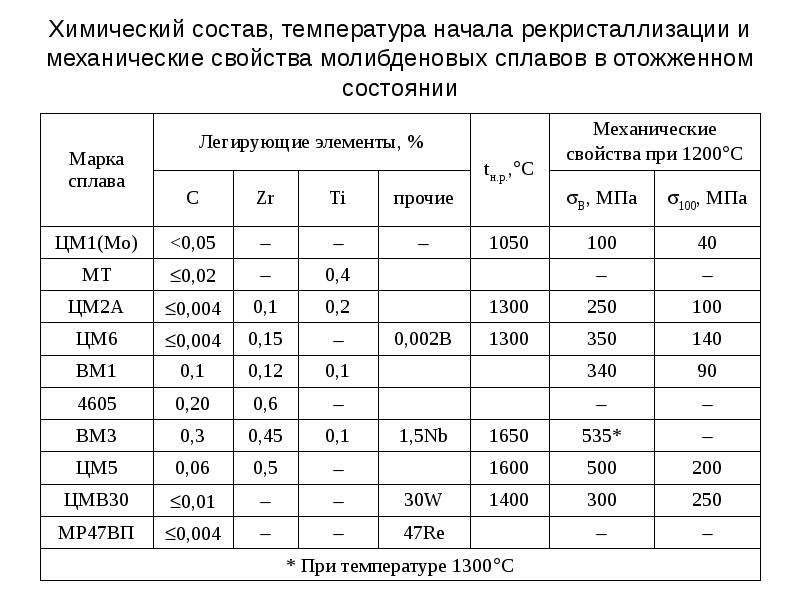 На рис. 2b показаны самые низкие энергии образования, полученные для различных элементов, от H (атомный номер = 1) до Ca (атомный номер = 20), за исключением элементов благородных газов He и Ne.Дополнительные выбранные элементы из переходных металлов серий 3d, 4d и 5d, V, Ni, Cu, Zr, Mo, Ag, Ta, W, Au и Pb, рассматриваются для того, чтобы сравнить тенденции энергий образования элементов для относительно больший размер атома. Энергии образования этих случаев показаны в заштрихованной области рис. 2б. Красной линией отмечен тренд самых низких энергий образования (среди различных конфигураций примесей) на рис.Энергии образования, полученные из μ оксида , отмечены синей линией на том же рисунке. Обнаружено, что эти химические потенциальные обработки приводят к двум различным тенденциям в отношении самых низких энергий пласта.
На рис. 2b показаны самые низкие энергии образования, полученные для различных элементов, от H (атомный номер = 1) до Ca (атомный номер = 20), за исключением элементов благородных газов He и Ne.Дополнительные выбранные элементы из переходных металлов серий 3d, 4d и 5d, V, Ni, Cu, Zr, Mo, Ag, Ta, W, Au и Pb, рассматриваются для того, чтобы сравнить тенденции энергий образования элементов для относительно больший размер атома. Энергии образования этих случаев показаны в заштрихованной области рис. 2б. Красной линией отмечен тренд самых низких энергий образования (среди различных конфигураций примесей) на рис.Энергии образования, полученные из μ оксида , отмечены синей линией на том же рисунке. Обнаружено, что эти химические потенциальные обработки приводят к двум различным тенденциям в отношении самых низких энергий пласта.
Как правило, металлические примеси, независимо от размера их атомов и воздействия типа химической среды (учитывая два различных химических потенциала), благоприятствуют местам замещения. С другой стороны, обычные высокоэлектроотрицательные элементы, такие как C, N, O, F, S и Cl, не благоприятствуют сайту замены.Вместо этого элементы C, N и Cl предпочитают октаэдрические междоузлия для двух химических сред. H, O и S стабилизируют различные примесные конфигурации при различной обработке химическим потенциалом: октаэдрические примесные конфигурации для μ оксида и примесно-димерные (DB и DC) конфигурации для μ элемента . Фтор является единственным элементом, который образует примесь-димер в Ti для обоих типов химических потенциалов. Следует подчеркнуть, что H, который легко мог потерять свой электрон, образуя катион H + , фактически ведет себя аналогично электроотрицательным элементам, будучи введенным в качестве примеси в Ti.Этот результат подтверждает анализ переноса заряда, в котором наблюдается, что H приобретает электроны от соседних атомов Ti, что обсуждается в следующем разделе.
С другой стороны, обычные высокоэлектроотрицательные элементы, такие как C, N, O, F, S и Cl, не благоприятствуют сайту замены.Вместо этого элементы C, N и Cl предпочитают октаэдрические междоузлия для двух химических сред. H, O и S стабилизируют различные примесные конфигурации при различной обработке химическим потенциалом: октаэдрические примесные конфигурации для μ оксида и примесно-димерные (DB и DC) конфигурации для μ элемента . Фтор является единственным элементом, который образует примесь-димер в Ti для обоих типов химических потенциалов. Следует подчеркнуть, что H, который легко мог потерять свой электрон, образуя катион H + , фактически ведет себя аналогично электроотрицательным элементам, будучи введенным в качестве примеси в Ti.Этот результат подтверждает анализ переноса заряда, в котором наблюдается, что H приобретает электроны от соседних атомов Ti, что обсуждается в следующем разделе.
Анализ заряда
Химическая гибридизация играет важную роль в определении конфигурации примесных атомов в решетке-хозяине. Идеальной мерой силы орбитальной гибридизации является перенос заряда между примесью и атомами-хозяевами. Анализ заряда по Бейдеру 45,46 обеспечивает количественную оценку сопровождаемого переноса заряда.{{\ mathrm {hybridized}}} \) — это вычисленный заряд Бейдера после достижения самосогласованных полевых решений. Согласно этому определению отрицательные значения для Δ q B ( X ) будет означать накопление заряда по соседству с атомным положением X (определение согласуется с определением заряда электрона, рассматриваемого как отрицательное), в то время как положительное значение будет означать потерю заряда с атомного положения X к окружающим.Тенденция Δ q B Ожидается, что ( X ) для примеси и атомов-хозяев будут обратно пропорциональны, поскольку потеря или приобретение заряда в месте примеси должно коррелировать с изменениями заряда в соседних атомах-хозяевах.
Идеальной мерой силы орбитальной гибридизации является перенос заряда между примесью и атомами-хозяевами. Анализ заряда по Бейдеру 45,46 обеспечивает количественную оценку сопровождаемого переноса заряда.{{\ mathrm {hybridized}}} \) — это вычисленный заряд Бейдера после достижения самосогласованных полевых решений. Согласно этому определению отрицательные значения для Δ q B ( X ) будет означать накопление заряда по соседству с атомным положением X (определение согласуется с определением заряда электрона, рассматриваемого как отрицательное), в то время как положительное значение будет означать потерю заряда с атомного положения X к окружающим.Тенденция Δ q B Ожидается, что ( X ) для примеси и атомов-хозяев будут обратно пропорциональны, поскольку потеря или приобретение заряда в месте примеси должно коррелировать с изменениями заряда в соседних атомах-хозяевах. Отрицательные значения Δ q B являются общими для электроотрицательных примесей, таких как C, N, O и F. Перенос заряда на соседний носитель Ti (<Δ q B (Ti)>) усредняется по ближайшим соседним координациям 4, 6 и 12 для примесного атома, расположенного в тетраэдрической, октаэдрической и замещенной примесных позициях соответственно.
Отрицательные значения Δ q B являются общими для электроотрицательных примесей, таких как C, N, O и F. Перенос заряда на соседний носитель Ti (<Δ q B (Ti)>) усредняется по ближайшим соседним координациям 4, 6 и 12 для примесного атома, расположенного в тетраэдрической, октаэдрической и замещенной примесных позициях соответственно.
Перенос заряда между атомами примеси и ближайшими соседними атомами-хозяевами Ti в зависимости от атомного номера (кроме инертных газов) показан на рис. 3а для октаэдрических и примесных позиций замещения. Перенос заряда следует той же тенденции периодов в периодической таблице для обоих примесных узлов. Средний перенос заряда на Ti ниже по величине, потому что несколько атомов Ti из соседней области связываются с атомом примеси. Перенос заряда на примесные атомы в октаэдрических междоузлиях и позициях замещения различается в зависимости от среднего переноса заряда Ti, как показано на рис. 3б. Синие и черные сплошные линии представляют собой линии тренда для данных о примесях в октаэдрических положениях внедрения и замещения соответственно. Из рис. 3б видно, что перенос заряда на примеси в случаях замещения (наклон черной линии) в целом больше, чем для октаэдрических положений примеси (наклон синей линии). Та же информация также изображена на рис. 3а, где мы отмечаем разницу в значениях переноса заряда между случаями замещения (закрашенные квадраты) и интерстициального (незаштрихованные кружки).Как уже указывалось в предыдущем разделе, H в металлическом Ti имеет отрицательные значения Δ q B как для случаев замещения, так и для случаев внедрения (см. рис. 3a,b), предполагая, что он действует как примесь, притягивающая электроны, подобно C, O и F.
3б. Синие и черные сплошные линии представляют собой линии тренда для данных о примесях в октаэдрических положениях внедрения и замещения соответственно. Из рис. 3б видно, что перенос заряда на примеси в случаях замещения (наклон черной линии) в целом больше, чем для октаэдрических положений примеси (наклон синей линии). Та же информация также изображена на рис. 3а, где мы отмечаем разницу в значениях переноса заряда между случаями замещения (закрашенные квадраты) и интерстициального (незаштрихованные кружки).Как уже указывалось в предыдущем разделе, H в металлическом Ti имеет отрицательные значения Δ q B как для случаев замещения, так и для случаев внедрения (см. рис. 3a,b), предполагая, что он действует как примесь, притягивающая электроны, подобно C, O и F.
a соседние атомы Ti. b Сравнение тенденции переноса заряда для примесей в октаэдрических положениях внедрения и замещения
Предпочтительные конфигурации для рассматриваемых элементов представлены на рис. 4, где энергии образования примесей замещения сравниваются с минимальной энергией образования из конфигураций внедрения. Обнаружено, что сильно электроотрицательные элементы, H, C, N, O, F, S и Cl, благоприятствуют интерстициальным позициям (см. рис. 2b). Химическая гибридизация играет более решающую роль, чем другие конкурирующие термины. Линия y = х — случай, когда равновероятны как примеси замещения, так и примеси внедрения, и чем дальше от этой линии, тем выше вероятность как примесей внедрения, так и примесей замещения.Случаи примесей P и Ni отклоняются от ожидаемого поведения. Другими словами, энергии их образования лежат относительно близко к линии y = x . Интуитивно ожидается, что P будет благоприятствовать интерстициальному положению, в то время как Ni, как ожидается, будет благоприятствовать замещающему сайту. Пересмотр исходных соединений, из которых получен химический потенциал, потенциально может помочь исправить это несоответствие. Кроме того, для Ni трудность может заключаться в значении химических потенциалов, которое определяется оксидным соединением NiO.
4, где энергии образования примесей замещения сравниваются с минимальной энергией образования из конфигураций внедрения. Обнаружено, что сильно электроотрицательные элементы, H, C, N, O, F, S и Cl, благоприятствуют интерстициальным позициям (см. рис. 2b). Химическая гибридизация играет более решающую роль, чем другие конкурирующие термины. Линия y = х — случай, когда равновероятны как примеси замещения, так и примеси внедрения, и чем дальше от этой линии, тем выше вероятность как примесей внедрения, так и примесей замещения.Случаи примесей P и Ni отклоняются от ожидаемого поведения. Другими словами, энергии их образования лежат относительно близко к линии y = x . Интуитивно ожидается, что P будет благоприятствовать интерстициальному положению, в то время как Ni, как ожидается, будет благоприятствовать замещающему сайту. Пересмотр исходных соединений, из которых получен химический потенциал, потенциально может помочь исправить это несоответствие. Кроме того, для Ni трудность может заключаться в значении химических потенциалов, которое определяется оксидным соединением NiO. NiO является примером соединения, в котором приближение GGA не учитывает сильные эффекты электронной корреляции. 47
NiO является примером соединения, в котором приближение GGA не учитывает сильные эффекты электронной корреляции. 47
Сравнение энергий образования места замещения (по оси абсцисс) и наиболее благоприятной междоузельной конфигурации (по оси ординат). Линия y = x показывает четкое разделение и предполагает благоприятную конфигурацию точечных дефектов
3 Типы титановых сплавов и их применение
3 типа титановых сплавов и их применение
Просмотры сообщений: 3044
Титан представляет собой аллотроп с температурой плавления 1668°С.При температуре ниже 882 °С он имеет плотноупакованную структуру гексагональной решетки и называется α-титаном; выше 882 °С он имеет объемно-центрированную кубическую структуру решетки и называется β-титаном. Используя различные характеристики вышеупомянутых двух структур титана, люди добавляют соответствующие легирующие элементы для постепенного изменения температуры фазового перехода и фазового состава для получения титановых сплавов с различными структурами.
Титановые сплавы
При комнатной температуре титановые сплавы имеют три матричных структуры, а титановые сплавы делятся на следующие три категории: α-сплавы, (α + β)-сплавы и β-сплавы.
1. Титановые сплавы αЭто однофазный сплав, состоящий из твердого раствора α-фазы. Будь то при комнатной температуре или при более высокой температуре практического применения, это α-фаза со стабильной структурой, более высокой износостойкостью, чем у чистого титана, и высокой стойкостью к окислению.
При температуре 500℃~600℃ еще сохраняет свою прочность и сопротивление ползучести, но не поддается упрочнению термической обработкой, а прочность при комнатной температуре не высока.
2. β Титановые сплавы Это однофазный сплав, состоящий из твердого раствора β-фазы, который уже до термической обработки имеет высокую прочность. После закалки и старения сплав дополнительно упрочняется, а прочность при комнатной температуре может достигать 1372~1666 МПа. Однако его термическая стабильность плохая, поэтому он не подходит для использования при высоких температурах.
Однако его термическая стабильность плохая, поэтому он не подходит для использования при высоких температурах.
Это двухфазный сплав с хорошими комплексными свойствами, хорошей структурной стабильностью, хорошей ударной вязкостью, хорошей пластичностью и свойствами высокотемпературной деформации, который можно обрабатывать горячим давлением, закалкой и старением для упрочнения сплава.
Прочность после термообработки примерно на 50-100% выше, чем в отожженном состоянии. Этот сплав обладает высокой жаропрочностью и может длительно работать при температуре от 400°С до 500°С, а его термостойкость уступает α-сплаву титана.
Среди 3 типов титановых сплавов , которые мы упоминали выше, наиболее часто используются α-титановый сплав и α + β-титановый сплав; α-титановый сплав имеет наилучшую обрабатываемость, за ним следует α + β-титановый сплав, а β-титановый сплав является худшим.
4. Использование титановых сплавов Титановый сплав
Использование титановых сплавов Титановый сплавобладает такими преимуществами, как высокая прочность, небольшая плотность, хорошие механические свойства, хорошая ударная вязкость и коррозионная стойкость.
Титановый сплавв основном используется для изготовления компонентов компрессора авиационного двигателя, а также деталей конструкции ракет, ракет и высокоскоростных самолетов.
Титановый сплав— новый важный конструкционный материал, используемый в аэрокосмической промышленности. Его удельный вес, прочность и рабочая температура находятся между алюминием и сталью, но он прочнее алюминия и стали и обладает отличной коррозионной стойкостью в морской воде и сверхнизкими температурами.
Использование титановых сплавов
Применение титанового сплава в области космических аппаратов в основном связано с высокой удельной прочностью, коррозионной стойкостью и низкотемпературной стойкостью титанового сплава для изготовления различных сосудов под давлением, топливных баков, крепежных изделий, ремней для приборов, рам и ракетных корпусов. Искусственный спутник Земли, пилотируемый космический корабль и космический шаттл также используют сварные детали из пластин из титанового сплава.
Искусственный спутник Земли, пилотируемый космический корабль и космический шаттл также используют сварные детали из пластин из титанового сплава.
Благодарим вас за чтение наших статей и надеемся, что эта статья поможет вам лучше понять типов титановых сплавов и их применение.Если вы хотите узнать больше о титановом сплаве или других тугоплавких металлах , вы можете посетить Advanced Refractory Metals ( ARM ) для получения дополнительной информации.
Штаб-квартира в Лейк-Форест, Калифорния, ARM является ведущим производителем и поставщиком тугоплавких металлов , таких как вольфрам, молибден, тантал, рений, титан, и цирконий . Мы обеспечиваем наших клиентов высококачественной продукцией из тугоплавких металлов по очень конкурентоспособной цене.
Явление осаждения соединений титана в алюминиевых расплавах и механизм затухания лигатуры Al-5Ti-0,62C
Лигатура Al-5Ti-0,62C была приготовлена методом термического взрыва в расплавленном алюминии.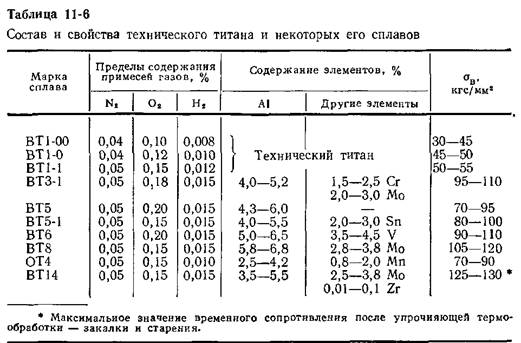 Проведен процесс переплавки и рафинирования технически чистого алюминия, получены образцы осадков с разным временем термообработки. Сканирующая электронная микроскопия (SEM), рентгеновская дифракция (XRD), оптическая микроскопия (OM) и другие методы использовались для анализа микроструктуры осадков на дне образцов, чтобы исследовать механизм выцветания Al-Ti. -C рафинирование сплава.Результаты показали, что в переплавленной лигатуре Al-5Ti-0,62C существовало очевидное явление выделения соединений титана и что в выделениях присутствовали как соединения TiC, так и соединения TiAl 3 ; в рафинированных образцах чистого алюминия преципитаты представлены в основном соединениями TiC. Осаждение соединений титана при плавке алюминия является основной причиной ослабления эффекта рафинирования лигатуры Al-Ti-C.
Проведен процесс переплавки и рафинирования технически чистого алюминия, получены образцы осадков с разным временем термообработки. Сканирующая электронная микроскопия (SEM), рентгеновская дифракция (XRD), оптическая микроскопия (OM) и другие методы использовались для анализа микроструктуры осадков на дне образцов, чтобы исследовать механизм выцветания Al-Ti. -C рафинирование сплава.Результаты показали, что в переплавленной лигатуре Al-5Ti-0,62C существовало очевидное явление выделения соединений титана и что в выделениях присутствовали как соединения TiC, так и соединения TiAl 3 ; в рафинированных образцах чистого алюминия преципитаты представлены в основном соединениями TiC. Осаждение соединений титана при плавке алюминия является основной причиной ослабления эффекта рафинирования лигатуры Al-Ti-C.
1. Введение
Благодаря хорошему эффекту измельчения зерна измельчители алюминиевых сплавов широко используются в процессе плавки и литья алюминия и его сплавов [1]. В настоящее время наиболее часто используются измельчители зерна серии Al-Ti-B [2]. Однако во время их использования было обнаружено, что частицы TiB 2 легко агрегируются и осаждаются и даже проявляют так называемое явление отравления измельчителей зерна в процессе плавки и литья, что значительно снижает эффект измельчения зерна измельчителями зерна и приводит к в крупных зернах, что повлияет на последующие характеристики литейных слитков [3–5]. В последние годы все большее внимание уделяется измельчителям зерна Al-Ti-C.Исследования показали, что в некоторых случаях [6] Al-Ti-C проявляет лучший рафинирующий эффект, чем Al-Ti-B, а большое разнообразие источников C может способствовать более экологичному производству [7]. Лигатура Al-Ti-C считается измельчителем зерна, имеет хорошую применимость и является наиболее изученной [8-11]. Взаимосвязь препаративной технологии, микроструктуры лигатуры Al-Ti-C и ее рафинирующего действия, а также механизмы их коллективного рафинирования и отравления изучались как в стране, так и за рубежом [12-14].
В настоящее время наиболее часто используются измельчители зерна серии Al-Ti-B [2]. Однако во время их использования было обнаружено, что частицы TiB 2 легко агрегируются и осаждаются и даже проявляют так называемое явление отравления измельчителей зерна в процессе плавки и литья, что значительно снижает эффект измельчения зерна измельчителями зерна и приводит к в крупных зернах, что повлияет на последующие характеристики литейных слитков [3–5]. В последние годы все большее внимание уделяется измельчителям зерна Al-Ti-C.Исследования показали, что в некоторых случаях [6] Al-Ti-C проявляет лучший рафинирующий эффект, чем Al-Ti-B, а большое разнообразие источников C может способствовать более экологичному производству [7]. Лигатура Al-Ti-C считается измельчителем зерна, имеет хорошую применимость и является наиболее изученной [8-11]. Взаимосвязь препаративной технологии, микроструктуры лигатуры Al-Ti-C и ее рафинирующего действия, а также механизмы их коллективного рафинирования и отравления изучались как в стране, так и за рубежом [12-14]. Поскольку исследователи продолжают углублять свое понимание явления измельчения зерна, они предложили множество теорий [15], направленных на механизмы измельчения зерна, но до настоящего времени не было предложено единых взглядов. Механизмы измельчения зерна алюминия и алюминиевых сплавов очень сложны, поэтому до сих пор очень сложно полностью решить процессы и механизмы их измельчения. В настоящем исследовании мы стремились провести углубленный анализ механизмов рафинирования выцветания сплава Al-Ti-C посредством анализа явления выделения в процессе переплавки Al-5Ti-0.лигатура 62С и процесс рафинирования технически чистого алюминия; это позволит прояснить приготовление и применение, а также уточнение механизма выцветания сплавов Al-Ti-C.
Поскольку исследователи продолжают углублять свое понимание явления измельчения зерна, они предложили множество теорий [15], направленных на механизмы измельчения зерна, но до настоящего времени не было предложено единых взглядов. Механизмы измельчения зерна алюминия и алюминиевых сплавов очень сложны, поэтому до сих пор очень сложно полностью решить процессы и механизмы их измельчения. В настоящем исследовании мы стремились провести углубленный анализ механизмов рафинирования выцветания сплава Al-Ti-C посредством анализа явления выделения в процессе переплавки Al-5Ti-0.лигатура 62С и процесс рафинирования технически чистого алюминия; это позволит прояснить приготовление и применение, а также уточнение механизма выцветания сплавов Al-Ti-C.
2. Экспериментальные материалы и методы
Основные материалы, использованные в экспериментах, включали порошок Al (99,6%), порошок Ti (99,3%), порошок C (99,8%) и технически чистый алюминий. Поставщик, размер частиц порошков и чистота приведены в таблице 1. Основное сырье было получено путем смешивания в шарах и холодного прессования в готовые блоки.Мольное соотношение состава сборных блоков, содержащих порошки Al, Ti и C, составляло 5 : 2 : 1. Сборные блоки прошли реакцию теплового взрыва в чистом расплавленном алюминии при температуре 780 °С [16, 17].
Основное сырье было получено путем смешивания в шарах и холодного прессования в готовые блоки.Мольное соотношение состава сборных блоков, содержащих порошки Al, Ti и C, составляло 5 : 2 : 1. Сборные блоки прошли реакцию теплового взрыва в чистом расплавленном алюминии при температуре 780 °С [16, 17].
+
| ||||||||||||||||||||||||||||||||
Одно качество AL-5TI-0.Лигатура 62С помещалась в тигель Al 2 O 3 для нагрева и плавления. При температуре 730 °С сплав Al-5Ti-0,62C плавился и выдерживался в течение 30, 60, 120 или 180 мин перед естественным охлаждением в тигле. Эксперимент по измельчению зерна проводили в печи сопротивления колодезного типа. Некоторое количество технически чистого алюминия расплавляли в тигле Al 2 O 3 и при повышении температуры алюминиевого расплава до °С после рафинирования, перемешивания и снятия пены добавляли Al-5Ti- 0.Лигатура 62С с массовой долей 0,4%. После того как лигатура Al-5Ti-0,62C была добавлена в алюминиевый расплав, его достаточно перемешали, чтобы он расплавился и хорошо перемешался. Его выдерживали в течение 20 или 120 мин до естественного охлаждения в тигле. Чтобы исследовать роль перемешивания расплава в осаждении, очищенный образец, который был изготовлен с помощью вышеуказанных методов и выдержан в течение 120 минут, был достаточно перемешан перед тем, как дать ему остыть естественным путем.
Его выдерживали в течение 20 или 120 мин до естественного охлаждения в тигле. Чтобы исследовать роль перемешивания расплава в осаждении, очищенный образец, который был изготовлен с помощью вышеуказанных методов и выдержан в течение 120 минут, был достаточно перемешан перед тем, как дать ему остыть естественным путем.
Охлажденный и затвердевший образец извлекали из тигля, а слиток распиливали продольно точно по центру.Все образцы были обработаны наждачной бумагой, отполированы и протравлены реактивом (60 % HCl + 30 % HNO 3 + 5 % HF + 5 % H 2 O, объемные доли). Наконец, был проведен анализ фазового состава, морфологии микроструктуры и компонентов сплава с помощью рентгеновского дифрактометра RigakuD/max-A (XRD, PW 3040/60, PANalytical, Rotterdam, Holland), большого оптического микроскопа ( OM, MEF3, Leica Inc, Австрия) и сканирующий электронный микроскоп JSM-7500 (SEM, SSX-550 с оборудованием EDS, Shimadzu Corporation, Киото, Япония).
3. Результаты и обсуждение
3.
 1. Микроструктуры сплавов Al-5Ti-0,62C
1. Микроструктуры сплавов Al-5Ti-0,62CНа рис. 1 показана рентгенограмма сплавов Al-5Ti-0,62C. Сплав Al-5Ti-0,62C состоит из Al, TiAl 3 и TiC. На рис. 2(а) показана фотография ОМ сплава Al-5Ti-0,62C. Мы наблюдали на алюминиевой подложке сплава Ал-5Ти-0,62С большое количество равномерно распределенных полосовидных или комкообразных веществ размером примерно 20–55 µ м в длину и 8–12 мк. μ м в ширину, а также мелкие черные частицы.На рисунках 2(b) и 2(c) показано СЭМ-изображение полосообразных веществ и мелких черных частиц. В табл. 2 приведены результаты анализа энергетического спектра химического состава точки А в глыбообразных веществах и точки В в мелких частицах на рис. 2. Из табл. 2 видно, что в точке А в полосообразных веществах , молярная массовая доля элементарного Al составляла 69,72%, молярная массовая доля элементарного Ti составляла 21,85%, а молярное массовое отношение между элементарным Al и элементарным Ti составляло 3.19. В точке B в мелких частицах молярная массовая доля элементарного C составляла 27,98%, молярная массовая доля элементарного Ti составляла 25,52%, а молярное массовое отношение между элементарным C и элементарным Ti составляло 1,1. Согласно результатам анализа рентгенограммы сплава Al-5Ti-0,62C, мы могли видеть, что полосообразные вещества на рисунке 2(b) были TiAl 3 , а мелкие черные частицы на рисунке 2(c ) были TiC. Из вышеприведенного анализа мы знали, что в сплавах Al-5Ti-0,62C, использованных в эксперименте, было обнаружено большое количество полосообразных или комкообразных частиц TiAl 3 и TiC, распределенных дисперсным и однородным образом.
| Номер точки | (Al) /% | (Ti) /% | (С) /% | |
| 69,72 | 21.85 | 80971 | 8.43 | |
| B | 46.50 | 25.50 | 25.52 | 27.98 |
3.2. Изучение явления осаждения соединения титана
На рис. 3 представлены макрофотографии продольного сечения образцов, полученных после переплава Al-5Ti-0.Лигатура 62С в течение различных периодов термообработки. Как видно из рис. 3, после различных периодов термической обработки переплава во всех макроскопических образцах наблюдалось явление явного расслоения. На рис. 4 представлена микроструктура переплавленной лигатуры Al-5Ti-0,62C при времени термообработки 180 мин. Как видно из рис. 4(а), после переплавки и термоконсервации в течение 180 мин в микроструктуре верхней части образца, показанного на рис. 3(г), практически отсутствуют частицы.Однако на участке стратификации появилось сильное явление сегрегации (рис. 4(b)), а на нижнем участке стратификации появилось большое количество слоев осадка, состоящих в основном из агрегированных частиц и полосообразных или комкообразных веществ ( Рисунок 4(с)). В табл. 3 представлены результаты ЭДС химических составов в точке А полосообразных веществ в наплавленном слое и в точке В черных агрегированных частиц на границе зерен. Таблица 3 иллюстрирует, что в точке А полосообразных веществ молярная массовая доля элементарного алюминия составляла 77.38 %, молярная массовая доля элементарного Ti составила 22,62 %, а молярное массовое отношение между элементарным Al и элементарным Ti составило 3,4, в то время как в точке B агрегированных частиц молярная массовая доля элементарного C составила 25,29 %, молярная массовая доля элементарного Ti составляла 22,31%, а молярно-массовое отношение между элементарным C и элементарным Ti составляло 1,1; это подтвердило, что полосообразные вещества в осаждающем слое представляли собой TiAl 3 , а агрегированные частицы представляли собой TiC. На рис. 5 представлена микроструктура слоев осадков на дне образцов переплавленного Al-5Ti-0.Лигатура 62С после различного времени термообработки. Как видно, после разного времени переплава лигатуры Al-5Ti-0,62C осадки на дне образцов по-прежнему представляли собой в основном агрегированные частицы и полосообразные или комкообразные вещества. По данным РЭМ-изображения (рис. 6) и результатов ЭДС химических составов черных агрегированных частиц на границе зерен (табл. 4) и слоев осадков на дне образца переплавленной лигатуры Al-5Ti-0,62C после термообработки в течение 180 минут мы заметили, что осадки на дне образца все еще были TiAl 3 и TiC.
| Номер точки | (Al) /% | (Ti) /% | (С) /% |
| 77,38 | 22.62 | — | |
| B | 52,40 | 22,31 | 25,29 |
| |||||||||||||||||||||
На рис. 7 показаны осадки в нижней части образцов после различных времен термической обработки при рафинировании технически чистого алюминия лигатурой Al-5Ti-0,62C. Из рис. 7(а) видно, что после термообработки в течение 20 мин на дне образца образовался небольшой осадок; но при времени термообработки 120 мин на дне образца появлялось большое количество осадка.Как видно из результатов картографического анализа выделений на дне образцов, рафинированных лигатурой Al-5Ti-0,62C, после 120 мин термообработки (рис. 8), частицы, агрегировавшие на границе зерен, были богатыми. в элементах Ti и C. На рис. 9 показаны линейное сканирование и спектр ЭДС агрегатов на границе зерен α -Al на рис. 8 (а). По результатам линейного сканирования (рис. 9(а)) и точечного анализа (рис. 9(б)) частиц на границе зерна можно заметить, что осадки на дне образца на рис. 8(а) были в основном частицы TiC добавляют к Al-5Ti-0.лигатура 62С; то есть произошло осаждение TiC. Мелких комочков или полосок TiAl 3 в осадках рафинированного образца не обнаружено, что связано с тем, что в случае меньшего количества добавленного сплава; TiAl 3 , добавленный в расплав алюминия, расплавлялся за короткий промежуток времени, прежде чем он оседал на дно образца и становился растворенным Ti [18] в расплаве алюминия.
3.3. Обсуждение механизма затухания доработки АЛ-5Ти-0.62C Alloy
Из приведенного выше анализа мы заметили, что расплав лигатуры Al-5Ti-0,62C сильно расслоился в процессе термообработки и что это расслоение было вызвано погружением TiAl 3 и TiC в жидкий алюминий в виде под действием гравитации. Растворение происходило, когда TiAl 3 находился в расплавленном алюминии в течение длительного периода времени, а преимущественный рост происходил в процессе затвердевания после полного растворения; скорость вертикального роста плоскости, кристаллические атомы которой в объемно-центрированном кубе расположены наиболее рыхло, была наибольшей, а скорость роста плотноупакованной плоскости была наименьшей [19].В процессе погружения из-за плохой смачиваемости между частицами TiC и расплавом алюминия существовала очень высокая межфазная энергия на границе между частицами TiC и жидким алюминием. Частицы TiC, исключенные жидким алюминием, агрегировались так, что в некоторых областях наблюдалась высокая плотность частиц TiC, которые могли даже прилипнуть друг к другу. По формуле Стокса [20] скорость опускания в расплаве частиц радиусом менее 0,1 см рассчитывается по следующей формуле: , где – скорость опускания частиц, – радиус частиц, ρ 1 — плотность частиц, ρ 2 — плотность алюминиевой жидкости, μ — вязкость расплавленного алюминия.Видно, что скорость опускания частиц в основном зависит от объема частиц, разницы между плотностью частиц и расплавленного алюминия и вязкости алюминиевой жидкости. Следовательно, когда частицы TiC собираются в более крупные кластеры частиц, осаждение TiC будет еще больше ускоряться. Из-за структурной наследственности лигатуры Al-Ti-C [21] явления осаждения имеют аспекты в процессе рафинирования, аналогичные аспектам процесса переплавки, так что как частицы TiAl 3 , так и частицы TiC, введенные в процессе рафинирования агрегируют и выпадают в осадок, и они различаются только своей продолжительностью.Когда очень небольшое количество лигатуры Al-5Ti-0,62C добавляется в расплавленный алюминий, большая часть TiAl 3 растворяется в расплавленном алюминии и высвобождает атомы Ti в процессе погружения. Поскольку Ti проявляет слабую активность между TiC и алюминиевым расплавом [18], эти атомы Ti сегрегируют вокруг частиц TiC, образуя «зону, богатую Ti на границе раздела TiC/ α -Al» [18, 22], и становятся гетерогенное ядро зародышеобразования α (A1) при затвердевании расплава алюминия.При увеличении времени термообработки расплава алюминия на дне образца осаждается большое количество частиц TiC; это позволяет при затвердевании расплава лишь небольшому количеству остаточного TiC в средней и верхней части образца образовать «зону, богатую Ti на границе раздела TiC/ α -Al» и стать частицами зародышеобразования. Затем это вызывает явление затухания уточнения.
Для изучения роли перемешивания расплава в процессе измельчения зерна и его влияния на осаждение TiC было разрешено достаточное перемешивание перед естественным охлаждением образца измельчения после термообработки в течение 120 мин.Как видно из рис. 10, осадок на дне образца для рафинирования, который был достаточно перемешан и выдержан в течение 120 мин при нагревании, практически отсутствовал. На рис. 11 представлены макрофотографии, полученные без перемешивания и при достаточном перемешивании до охлаждения образцов рафинирования после термообработки в течение 120 мин. Как видно из рисунка 11, существуют значительные различия в размерах зерен между верхом и низом неперемешиваемого образца: зерна в верхней части образца крупные, а в нижней части мелкие, а чем ближе к низу , тем мельче зерна (рис. 11(а)).Разница в размере зерен между верхней и нижней частью образца после достаточного перемешивания перед естественным охлаждением значительно уменьшилась, при этом размер зерен стал практически однородным (рис. 11(b)). Это показывает, что действие перемешивания может заставить части частиц TiC перераспределяться диспергированным образом, чтобы восстановить эффект измельчения.
4. Выводы
(i) Лигатура Al-5Ti-0,62C демонстрирует явный феномен осаждения соединений титана в расплаве алюминия.

 Существует пять классов так называемого коммерчески чистого или нелегированного титана, классы ASTM с 1 по 4 и 7.Каждый сорт имеет разное количество примесей, причем 1-й сорт является самым чистым. Прочность на растяжение варьируется от 172 МПа для класса 1 до 483 МПа для класса 4.
Существует пять классов так называемого коммерчески чистого или нелегированного титана, классы ASTM с 1 по 4 и 7.Каждый сорт имеет разное количество примесей, причем 1-й сорт является самым чистым. Прочность на растяжение варьируется от 172 МПа для класса 1 до 483 МПа для класса 4.
 Бета-сплавы немного более плотные, чем другие титановые сплавы, и имеют плотность от 4840 до 5060 кг/м3. Это наименее жаропрочные сплавы, они свариваемы и могут иметь предел текучести до 1345 МПа. Они используются для более тяжелых целей на самолетах.
Бета-сплавы немного более плотные, чем другие титановые сплавы, и имеют плотность от 4840 до 5060 кг/м3. Это наименее жаропрочные сплавы, они свариваемы и могут иметь предел текучести до 1345 МПа. Они используются для более тяжелых целей на самолетах. Разница в их физических свойствах обусловлена прежде всего количеством межузельных элементов.Они используются для защиты от коррозии, где важны стоимость и простота изготовления и сварки.
Разница в их физических свойствах обусловлена прежде всего количеством межузельных элементов.Они используются для защиты от коррозии, где важны стоимость и простота изготовления и сварки. Он также используется в хирургических имплантатах. Как правило, он используется при температурах до 400 градусов по Цельсию. Его свойства очень похожи на свойства нержавеющей стали серии 300, особенно 316. Он имеет плотность примерно 4420 кг/м3, модуль Юнга 110 ГПа и предел прочности при растяжении 1000 МПа.Для сравнения, отожженная нержавеющая сталь типа 316 имеет плотность 8000 кг/м3, модуль 193 ГПа и предел прочности при растяжении всего 570 МПа. А закаленный алюминиевый сплав 6061 имеет 2700 кг/м3, 69 ГПа и 310 МПа соответственно.
Он также используется в хирургических имплантатах. Как правило, он используется при температурах до 400 градусов по Цельсию. Его свойства очень похожи на свойства нержавеющей стали серии 300, особенно 316. Он имеет плотность примерно 4420 кг/м3, модуль Юнга 110 ГПа и предел прочности при растяжении 1000 МПа.Для сравнения, отожженная нержавеющая сталь типа 316 имеет плотность 8000 кг/м3, модуль 193 ГПа и предел прочности при растяжении всего 570 МПа. А закаленный алюминиевый сплав 6061 имеет 2700 кг/м3, 69 ГПа и 310 МПа соответственно. Этот сорт имеет повышенную коррозионную стойкость.
Этот сорт имеет повышенную коррозионную стойкость.
 Его можно катать, штамповать, волочить, прясть, профилировать…
Его можно катать, штамповать, волочить, прясть, профилировать…  Эти материалы помещаются в реактор с псевдоожиженным слоем вместе с газообразным хлором и углеродом. Материал нагревают до 1652°F (900°C), последующая химическая реакция приводит к образованию нечистого тетрахлорида титана (TiCl4) и монооксида углерода.Примеси возникают из-за того, что на старте не используется чистый диоксид титана. Следовательно, различные нежелательные хлориды металлов, которые образуются, должны быть удалены.
Эти материалы помещаются в реактор с псевдоожиженным слоем вместе с газообразным хлором и углеродом. Материал нагревают до 1652°F (900°C), последующая химическая реакция приводит к образованию нечистого тетрахлорида титана (TiCl4) и монооксида углерода.Примеси возникают из-за того, что на старте не используется чистый диоксид титана. Следовательно, различные нежелательные хлориды металлов, которые образуются, должны быть удалены. Магний реагирует с хлором, образуя жидкий хлорид магния. Это оставляет чистый титан в твердом состоянии, поскольку температура плавления титана выше, чем у реакции.
Магний реагирует с хлором, образуя жидкий хлорид магния. Это оставляет чистый титан в твердом состоянии, поскольку температура плавления титана выше, чем у реакции.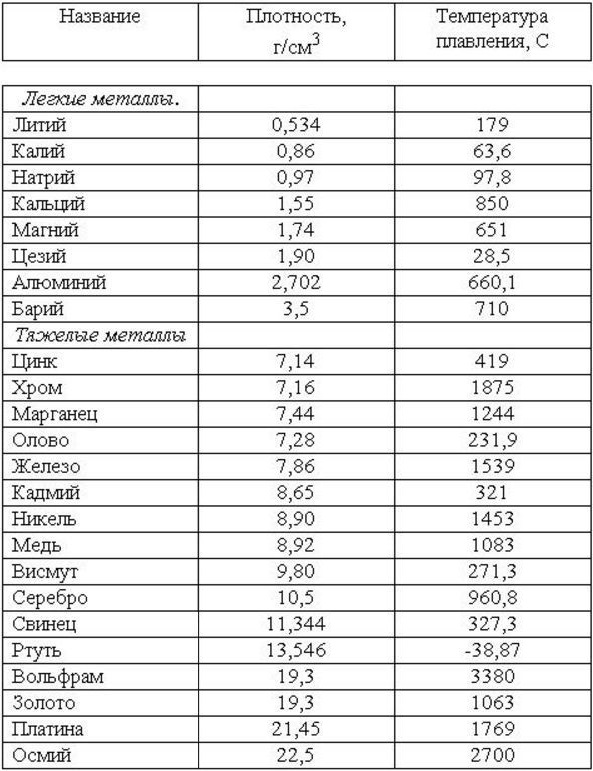 Весь воздух в контейнере либо удаляется (образуется вакуум), либо атмосфера заполняется аргоном для предотвращения загрязнения. Как правило, слиток
переплавляли еще один или два раза, чтобы получить коммерчески приемлемый слиток. В Соединенных Штатах большинство слитков, произведенных этим методом, весят около 9000 фунтов (4082 кг) и имеют диаметр 30 дюймов (76,2 см).
Весь воздух в контейнере либо удаляется (образуется вакуум), либо атмосфера заполняется аргоном для предотвращения загрязнения. Как правило, слиток
переплавляли еще один или два раза, чтобы получить коммерчески приемлемый слиток. В Соединенных Штатах большинство слитков, произведенных этим методом, весят около 9000 фунтов (4082 кг) и имеют диаметр 30 дюймов (76,2 см).
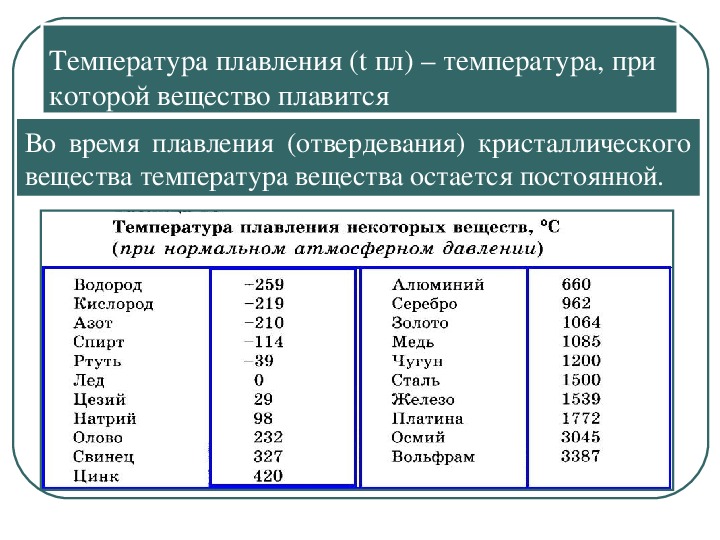 В результате скелетные нагрузки более равномерно распределяются между костью и имплантатом, что приводит к меньшей частоте деградации кости из-за защиты от напряжения и перипротезных переломов костей, которые возникают на границах ортопедических имплантатов, которые действуют как концентраторы напряжения. Однако жесткость титановых сплавов по-прежнему более чем в два раза превышает жесткость кости, что в конечном итоге приводит к деградации суставов.
В результате скелетные нагрузки более равномерно распределяются между костью и имплантатом, что приводит к меньшей частоте деградации кости из-за защиты от напряжения и перипротезных переломов костей, которые возникают на границах ортопедических имплантатов, которые действуют как концентраторы напряжения. Однако жесткость титановых сплавов по-прежнему более чем в два раза превышает жесткость кости, что в конечном итоге приводит к деградации суставов.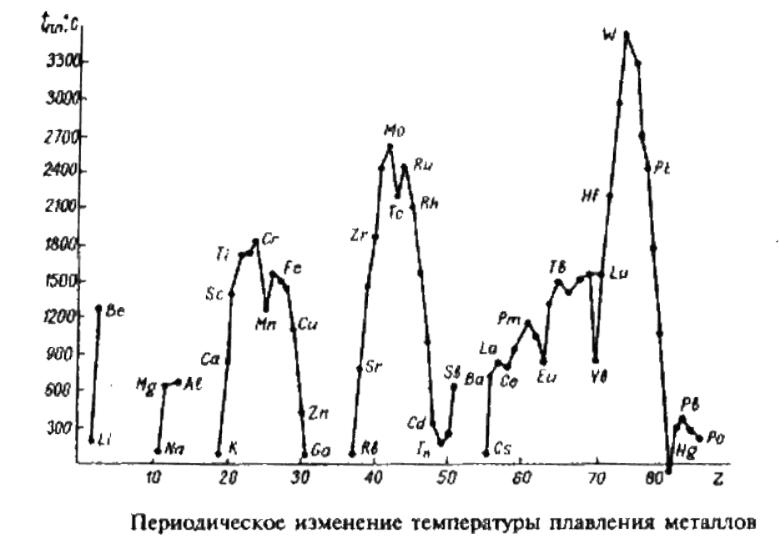
 Ltd.
Ltd.