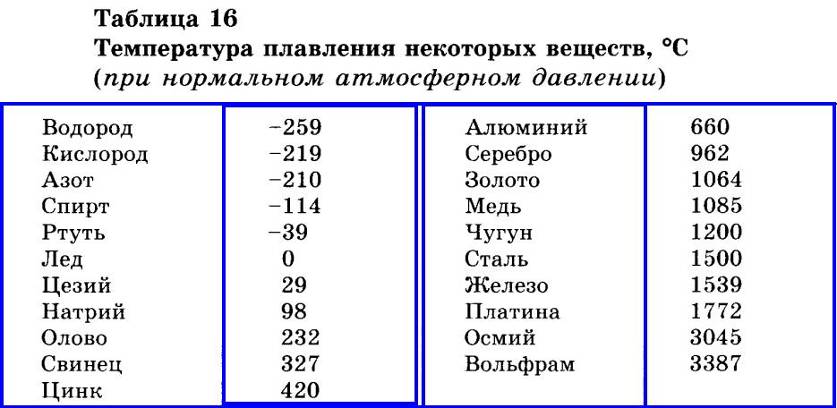
Температура плавления и основные свойства железа, классификация металлов
Металлы плавятся, как правило, при очень высокой температуре, которая может достигать более 3 тыс. градусов. Хотя некоторые из них можно расплавить в домашних условиях, например, свинец или олово. А вот ртуть плавят при температуре минус 39 градусов. В домашних условиях этого добиться не удастся. Температура плавления — это один из важных показателей производства не только самого металла, но и его сплавов. Выплавляя сырье, специалисты учитывают и другие физические и химические свойства руды и металла.
- Железо и его свойства
- Добыча полезных ископаемых
- Плавление железа и необходимая температура
- Классификация металлов по температуре плавления
Железо и его свойства
Железо — это химический элемент, который в таблице Менделеева находится под номером 26. Это один из самых распространенных элементов во всей Солнечной системе. Согласно материалам исследований, в составе ядра Земли находится примерно 79−85% этого вещества.
В чистом виде металл имеет белый цвет с чуть серебристым оттенком. Он пластичен, но имеющиеся в нем примеси могут определять его физические свойства. Реагирует на магнит.
Железо присутствует в воде. В речных водах его концентрация равна примерно 2 мг/л металла. В морской воде его содержание может быть ниже в сто или даже тысячу раз.
Оксид железа — это основная форма, добыча которой осуществляется и которая находится в природе. Оксидное железо может располагаться в самой верхней части земной коры и быть составляющей осадочных образований.
Элемент, находящийся на двадцать шестом месте в таблице Менделеева, может иметь несколько степеней окисления. Именно они определяют его геохимическую особенность нахождения в определенной среде. В ядре Земли металл присутствует в нейтральной форме.
Добыча полезных ископаемых
Руд, в которых присутствует железо, существует несколько.
- магнезитовую руду;
- гетитовую руду;
- гематитовую руду.
А также часто встречаются такие разновидности руды:
- леллингит;
- сидерит;
- марказит;
- ильменит;
- ярозит.
Существует еще минерал под названием мелантерит. Его используют преимущественно в фармацевтической промышленности. Из себя он представляет зелёного цвета хрупкие кристаллы, в которых присутствует стеклянный блеск. Из него производят лекарственные препараты, в составе которых имеется ферум.
Основным месторождением этого металла является Южная Америка, а именно Бразилия.
Плавление железа и необходимая температура
Точкой плавления металла называют такую минимальную температуру, при которой он переходит из твердого состояния в жидкое. При этом в объеме он практически остается неизменным.
Металл могут производить из руды различными способами, но самый основной из них — это доменный. Помимо доменного, используют еще выплавку железа при помощи обжига измельченной руды с примесью глины. Из полученной смеси формируют окатыши, которые обрабатываются в печи с последующим восстановлением водородом. Далее плавление железа осуществляется в электрической печи.
Помимо доменного, используют еще выплавку железа при помощи обжига измельченной руды с примесью глины. Из полученной смеси формируют окатыши, которые обрабатываются в печи с последующим восстановлением водородом. Далее плавление железа осуществляется в электрической печи.
Температура плавления железа весьма высока. Для технически чистого элемента она составляет +1539 °C. В этом веществе присутствует примесь — Сера, которую можно извлечь лишь в жидком виде. Без примесей чистый материал получают при электролизе солей металла.
Классификация металлов по температуре плавления
Разные металлы могут переходить в жидкое состояние при разной температуре. Вследствие этого выделяют определённую классификацию. Их делят следующим образом:
- Легкоплавкие — те элементы, которые могут становиться жидкими уже при температуре ниже 600 градусов. К ним относят цинк, олово, свинец и пр. Их можно расплавить даже в домашних условиях — просто нужно разогреть при помощи плиты или паяльника.
 Такие виды нашли применение в технике и электронике. Они используются для соединения элементов из металла и движения электрического тока. Олово плавится при 232 градусах, а цинк — при 419 градусах.
Такие виды нашли применение в технике и электронике. Они используются для соединения элементов из металла и движения электрического тока. Олово плавится при 232 градусах, а цинк — при 419 градусах. - Среднеплавкие — элементы, которые начинают расплавляться при температуре от шестисот до тысячи шестисот градусов. Эти элементы используют по большей части для строительных элементов и металлоконструкций, то есть при создании арматур, плит и строительных блоков. В эту группу входят: железо, медь, алюминий. Температура плавления алюминия сравнительно низка и составляет 660 градусов. А вот железо начинает переходить в жидкое состояние лишь при температуре 1539 градусов. Это один из самых распространенных металлов, используемых в промышленности, особенно в автомобильной. Однако железо подвержено коррозии, то есть ржавчине, поэтому ему требуется специальная поверхностная обработка. Его необходимо покрывать краской или олифой, и не допускать попадание влаги.
- Тугоплавкие — это такие материалы, которые расплавляются и становятся жидкими при температуре выше 1600 градусов.
 В эту группу относят вольфрам, титан, платину, хром и т. п. Они используются в ядерной промышленности и для некоторых машинных деталей. Они могут применяться для расплавки других металлов, изготовления высоковольтных проводов или проволоки. Платину можно расплавить при 1769 градусах, а вольфрам — при 3420 °C.
В эту группу относят вольфрам, титан, платину, хром и т. п. Они используются в ядерной промышленности и для некоторых машинных деталей. Они могут применяться для расплавки других металлов, изготовления высоковольтных проводов или проволоки. Платину можно расплавить при 1769 градусах, а вольфрам — при 3420 °C.
Единственный элемент, который при обычных условиях находится в жидком состоянии — это ртуть. Температура его плавления составляет минус 39 градусов и его пары являются ядовитыми, поэтому его используют только в лабораториях и закрытых ёмкостях.
Вольфрам | Plansee
Вольфрам применяется везде, где приходится работать с высокой температурой. Ведь по жаропрочности с ним не сравнится ни один другой металл! У вольфрама из всех металлов самая высокая температура плавления и, соответственно, самая высокая рабочая температура. Он также отличается исключительно низким коэффициентом теплового расширения и высоким уровнем стабильности формы. Вольфрам практически неразрушим. Из этого материала мы изготавливаем, например, компоненты для высокотемпературных печей, ламп, медицинской техники и систем нанесения тонких покрытий.
Вольфрам практически неразрушим. Из этого материала мы изготавливаем, например, компоненты для высокотемпературных печей, ламп, медицинской техники и систем нанесения тонких покрытий.
| Атомный номер | 74 |
| Номер CAS | 7440-33-7 |
| Атомная масса | 183,84 [г/моль] |
| Точка плавления | 3420 °C |
| Точка кипения | 5555 °C |
| Плотность при 20 °C | 19,25 [г/см3] |
| Кристаллическая структура | кубическая объемноцентрированная |
| Коэффициент линейного теплового расширения при 20 °C | 4,4 × 10-6 [м/(мК)] |
| Теплопроводность при 20 °C | 164 [Вт/(мК)] |
| Удельная теплоемкость при 20 °C | 0,13 [Дж/(гК)] |
| Электропроводность при 20 °C | 18,2 × 106 [См/м] |
| Удельное электрическое сопротивление при 20 °C | 0,055 [(Ом·мм2)/м] |
Ассортимент материалов
Чистый вольфрам или сплав?Качеству нашей продукции можно доверять.
| Элемент | Типичное макс. значение [мкг/г] |
Гарантированное макс. значение [мкг/г] |
| Al | 1 | 15 |
| Cr | 3 | 20 |
| Cu | 1 |
10 |
| Fe | 8 |
30 |
| K | 1 |
10 |
| Mo | 12 | 100 |
| Ni |
2 |
20 |
| Si | 1 |
20 |
| C | 6 |
30 |
| H | 0 | 5 |
| N | 1 |
5 |
| O | 2 |
20 |
| Cd | 1 | 5 |
| Hg | 0 | 1 |
| Pb | 1 |
5 |
Присутствие Сr (VI) и органических примесей исключено в принципе из-за процесса производства (многократная термообработка при температуре выше 1000 °C в атмосфере Н2)
| Материал | Химический состав (масс.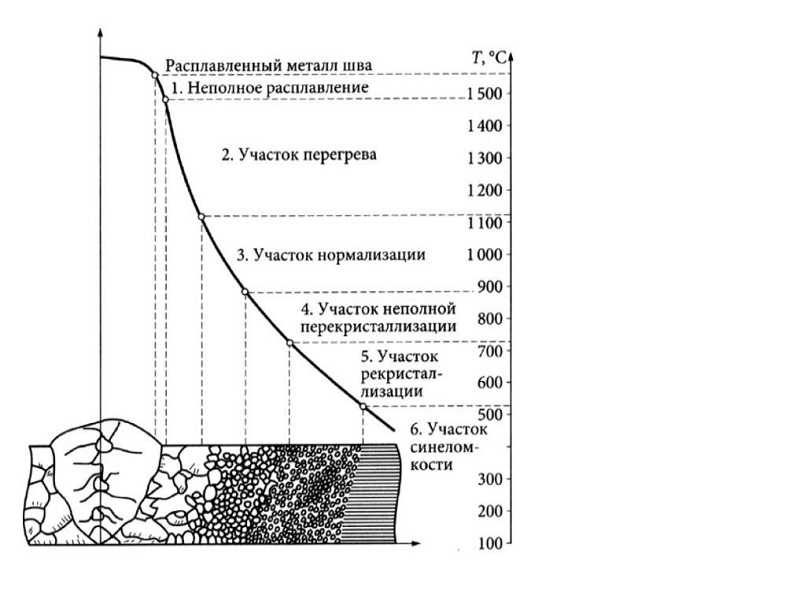 %) %) |
|
| W (чистый) | > 99,97 % W |
|
| W-UHP (высокой чистоты) | > 99,9999 % W | |
| WK65 |
60–65 мкг/г K | |
| WVM | 30–70 мкг/г K | |
| WVMW | 15–40 мкг/г K | |
| WL | WL05 WL10 WL15 WL20 |
0,5 % La2O3 1,0 % La2O3 1,5 % La2O3 2,0 % La2O3 |
| WC20 | 2,0 % CeO2 | |
| WRe |
WRe05 WRe26 |
5,0 % Re 26,0 % Re |
| WCu* | 10–40 % Cu | |
| Тяжелые сплавы высокой плотности на основе вольфрама* |
Densimet® Inermet® Denal® |
1,5–10 % Ni, Fe, Mo 5–10 % Ni, Cu 2,5–10 % Ni, Fe, Co |
* Подробную информацию о наших металломатричных композитах на основе вольфрама можно найти на странице материалов W-MMC.
Мы оптимизируем свойства вольфрам в зависимости от планируемого применения. За счет различных легирующих добавок можно регулировать следующие характеристики:
- физические свойства (температура плавления, плотность, электропроводность, теплопроводность, тепловое расширение, работа выхода электронов и др.)
- механические свойства (прочность, ползучесть, пластичность и др.)
- обрабатываемость (механическая обработка, поведение при деформации, свариваемость)
- рекристаллизационные свойства (температура рекристаллизации)
Но это еще не все! Используя особые технологии производства, мы можем изменять и другие свойства вольфрама в широком диапазоне. Результат: вольфрамовые сплавы с различным набором свойств, максимально адаптированные к требованиям конкретной области применения.
WK65 (вольфрам-калий)
Мы добавляем в вольфрам 60–65 мкг/г калия и используем получаемый материал для производства проволоки с вытянутой многослойной микроструктурой.
 Такая микроструктура придает материалу превосходные высокотемпературные свойства, например хорошее сопротивление ползучести и стабильность формы. При использовании специальных технологий производства материал WK65 может выдерживать больше нагрузок, чем WVM.
Такая микроструктура придает материалу превосходные высокотемпературные свойства, например хорошее сопротивление ползучести и стабильность формы. При использовании специальных технологий производства материал WK65 может выдерживать больше нагрузок, чем WVM.WVM (вольфрам для вакуумной металлизации)
Сплав WVM состоит практически из чистого вольфрама, легированного минимальным количеством калия. Мы выпускаем WVM преимущественно в форме прутков и проволоки, которые идут на изготовление спиралей испарителей, нитей накала и компонентов оборудования для эпитаксии. Также выпускается листовой WVM, из которого изготавливают лодочки испарителей. Благодаря легированию специальными присадками и продуманной термомеханической обработке материал получает многослойную «штапельную» микроструктуру, которая обеспечивает повышенную стабильность формы при высокой температуре.
WVMW (WVM-вольфрам)
Материалы WVMW и S-WVMW были разработаны специально для изготовления анодов диаметром более 15 мм в короткодуговых лампах.
 Для обоих композитов мы применяем практически чистый вольфрам с небольшой добавкой калия. S-WVMW идеально подходит для стержней диаметром больше 30 мм. Специальные технологии производства, которые мы используем для изготовления S-WVMW, позволяют добиваться высокой плотности материала в стержневом сердечнике.
Для обоих композитов мы применяем практически чистый вольфрам с небольшой добавкой калия. S-WVMW идеально подходит для стержней диаметром больше 30 мм. Специальные технологии производства, которые мы используем для изготовления S-WVMW, позволяют добиваться высокой плотности материала в стержневом сердечнике.WL (вольфрам – оксид лантана)
Мы добавляем в наш вольфрам 0,5, 1,0, 1,5 или 2 масс. % оксида лантана (La2O3), чтобы повысить его сопротивление ползучести и температуру рекристаллизации. Наш материал WL также легче поддается механической обработке благодаря равномерному распределению частиц оксида в его структуре. Работа выхода электронов у WL значительно ниже, чем у чистого вольфрама. По этой причине WL широко используется для изготовления источников ионов и электродов ламп.
WC20 (вольфрам – оксид церия)
Композит WC20 применяется для изготовления сварочных электродов.
 Мы добавляем в вольфрам 2 масс. % оксида церия и получаем материал с более низкой работой выхода электронов, улучшенными характеристиками зажигания и увеличенным ресурсом по сравнению с чистым вольфрамом.
Мы добавляем в вольфрам 2 масс. % оксида церия и получаем материал с более низкой работой выхода электронов, улучшенными характеристиками зажигания и увеличенным ресурсом по сравнению с чистым вольфрамом.WRe (вольфрам-рений)
Для обеспечения большей пластичности и более низкой температуры перехода из хрупкого в вязкое состояние мы легируем вольфрам рением. Помимо прочего, вольфрам-рений имеет более высокую температуру рекристаллизации и более высокое сопротивление ползучести. Мы используем WRe в стандартных составах — WRe05 и WRe26 — в качестве материала для термоэлементов, которые должны выдерживать температуру более 2000 °C. Этот материал также используется в аэрокосмической промышленности.
Свойства
Хорош во всех отношениях. Свойства вольфрамаВольфрам относится к группе тугоплавких металлов, то есть металлов, температура плавления которых выше, чем у платины (1772 °C). В тугоплавких металлах энергия связи между отдельными атомами особенно высока. Такие металлы отличаются высокой температурой плавления и одновременно низким давлением пара, хорошей жаропрочностью, а в случае вольфрамо-медных композитов — еще и высоким модулем упругости. Для них также характерны низкий коэффициент теплового расширения и относительно высокая плотность.
Такие металлы отличаются высокой температурой плавления и одновременно низким давлением пара, хорошей жаропрочностью, а в случае вольфрамо-медных композитов — еще и высоким модулем упругости. Для них также характерны низкий коэффициент теплового расширения и относительно высокая плотность.
Вольфрам имеет самую высокую температуру плавления среди всех металлов, а также чрезвычайно высокий модуль упругости. В целом его свойства аналогичны молибдену. Оба металла относятся к одной группе в периодической системе химических элементов. Однако некоторые свойства вольфрама более ярко выражены по сравнению с молибденом. Благодаря превосходным термическим свойствам вольфрам легко выдерживает самые высокие температуры.
Чтобы придать выпускаемому вольфраму и его сплавам нужные свойства, мы используем разные виды и количества легирующих элементов и соответствующим образом настраиваем технологический процесс.
Мы используем преимущественно легированные вольфрамовые материалы. Например, в WVM и WК65 добавляется небольшое количество калия.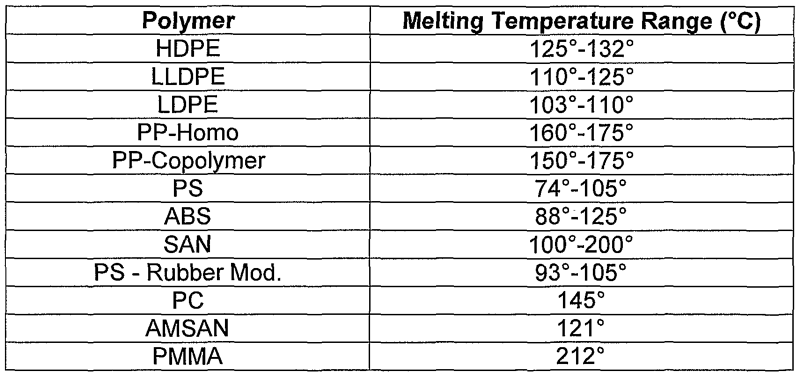 Калий положительно влияет на механические свойства материала, особенно при высоких температурах. Добавлением La2O3 можно не только улучшить обрабатываемость сплава, но и, что особенно важно, снизить работу выхода электронов, что позволит использовать вольфрам для изготовления катодов.
Калий положительно влияет на механические свойства материала, особенно при высоких температурах. Добавлением La2O3 можно не только улучшить обрабатываемость сплава, но и, что особенно важно, снизить работу выхода электронов, что позволит использовать вольфрам для изготовления катодов.
Рений мы добавляем, чтобы повысить пластичность вольфрама. Медь же улучшает электропроводность материала. Благодаря хорошей обрабатываемости наши тяжелые сплавы подходят также для производства изделий сложной геометрии. Они могут использоваться, например, в качестве материала для экранирующих пластин или амортизирующих и абсорбирующих компонентов.
Какими физическими свойствами обладает вольфрам?
Вольфрам обладает самой высокой точкой плавления среди всех тугоплавких металлов, довольно низким коэффициентом теплового расширения и относительно высокой плотностью. Нельзя также не отметить хорошую электропроводность и превосходную теплопроводность этого металла.
 Все эти свойства выражены в вольфраме гораздо сильнее, чем в молибдене. В периодической системе химических элементов вольфрам отнесен к той же группе, что и молибден, но располагается на период ниже.
Все эти свойства выражены в вольфраме гораздо сильнее, чем в молибдене. В периодической системе химических элементов вольфрам отнесен к той же группе, что и молибден, но располагается на период ниже.Физические свойства вольфрама также зависят от температуры. Ниже приведены сравнительные графики основных характеристик материала.
На графике (вверху справа, в виде синей полосы разброса) показаны значения коэффициента эмиссии вольфрама в зависимости от температуры (взяты из публикаций и научных трудов). Значения коэффициента эмиссии, определенные экспериментально на образцах Plansee в стандартном состоянии поставки, находятся в верхней части полосы разброса.
Какими механическими свойствами обладает вольфрам?
Мы регулируем чистоту материала, определяем вид и количество легирующих компонентов и изменяем микроструктуру вольфрама путем особой термомеханической обработки, сочетающей в себе термообработку и формование. В результате получаем оптимальные материалы с нужным набором механических свойств для конкретных задач.
 Вольфрам по своим механическим свойствам сходен с молибденом. Как и в случае с молибденом, эти свойства зависят от температуры испытания. Вольфрам имеет самую высокую температуру плавления среди всех металлов: 3420 °C. Высокая теплостойкость и высокий модуль упругости обуславливают хорошее сопротивление ползучести.
Вольфрам по своим механическим свойствам сходен с молибденом. Как и в случае с молибденом, эти свойства зависят от температуры испытания. Вольфрам имеет самую высокую температуру плавления среди всех металлов: 3420 °C. Высокая теплостойкость и высокий модуль упругости обуславливают хорошее сопротивление ползучести.Как и молибден, вольфрам имеет кубическую объемноцентрированную кристаллическую решетку и, следовательно, такой же характерный переход из хрупкого в вязкое состояние. Температуру перехода из хрупкого в вязкое состояние можно снизить путем деформации и легирования. Прочность возрастает с увеличением степени деформации. Однако, в отличие от других металлов, пластичность при этом также увеличивается. Для улучшения пластичности в вольфрам чаще всего добавляют рений.
ЛегированиеЛегирование пришло к нам из латинского языка (ligare — «связывать») через немецкий (legieren — «сплавлять»). В металлургии под легированием понимается введение одного или нескольких легирующих элементов, содержание которых часто измеряется в микрограммах.
 Также часто используется термин «микролегирование». Содержание добавок при таком легировании достигает нескольких сотен микрограммов. Количество добавок часто измеряют в миллионных долях, обозначаемых как «ppm». Термин ppm происходит от английского parts per million, что означает «частей на миллион», т.е. 10-6.
Также часто используется термин «микролегирование». Содержание добавок при таком легировании достигает нескольких сотен микрограммов. Количество добавок часто измеряют в миллионных долях, обозначаемых как «ppm». Термин ppm происходит от английского parts per million, что означает «частей на миллион», т.е. 10-6.Если вы планируете использовать вольфрам при высоких температурах, следует учитывать его температуру рекристаллизации. Ведь при повышении степени рекристаллизации снижается не только его прочность, но и пластичность. Легирование мелкими частицами оксида (например, оксида лантана или оксида церия) повышает температуру рекристаллизации и сопротивление ползучести вольфрама. Чем сильнее давление деформации, тем ощутимее действие оксидов, структура которых при термомеханической обработке становится еще более мелкозернистой.
В таблице приведена температура рекристаллизации наших вольфрамовых материалов при различной степени деформации.
Материал Температура [°C] при 100 % рекристаллизации (длительность отжига — 1 час) Степень деформации = 90 % Степень деформации = 99,99 % W (чистый) 1350 — WVM — 2000 WL10 1500 2500 WL15 1550 2600 WRe05 1700 — WRe26 1750 — При работе с вольфрамом необходимо тонкое чутье.
 Формование без обработки резанием, такое как гибка или отбортовка, должно осуществляться при температуре выше точки перехода из хрупкого в вязкое состояние. У вольфрама эта температура выше, чем у молибдена. Чем толще обрабатываемый лист, тем больше должна быть температура предварительного нагрева. Для резки и штамповки температура предварительного нагрева должна быть выше, чем для отбортовки. Вольфрам с трудом поддается машинной обработке. А вот наши сплавы вольфрама с оксидом лантана обрабатывать легче. Тем не менее уровень износа инструмента при этом также очень высок, что может привести к выщерблению. Если у вас остались вопросы по механической обработке тугоплавких металлов, наши опытные специалисты всегда готовы вас проконсультировать.
Формование без обработки резанием, такое как гибка или отбортовка, должно осуществляться при температуре выше точки перехода из хрупкого в вязкое состояние. У вольфрама эта температура выше, чем у молибдена. Чем толще обрабатываемый лист, тем больше должна быть температура предварительного нагрева. Для резки и штамповки температура предварительного нагрева должна быть выше, чем для отбортовки. Вольфрам с трудом поддается машинной обработке. А вот наши сплавы вольфрама с оксидом лантана обрабатывать легче. Тем не менее уровень износа инструмента при этом также очень высок, что может привести к выщерблению. Если у вас остались вопросы по механической обработке тугоплавких металлов, наши опытные специалисты всегда готовы вас проконсультировать.Какими химическими свойствами обладает вольфрам?
При относительной влажности ниже 60 % вольфрам устойчив к коррозии. В более влажном воздухе на нем образуются цветные налеты, но менее выраженные, чем у молибдена.
 Стеклянные расплавы, водород, азот, инертные газы, металлические расплавы и оксидные керамические расплавы воздействуют на вольфрам незначительно, даже при очень высоких температурах, если они не содержат дополнительных окислителей.
Стеклянные расплавы, водород, азот, инертные газы, металлические расплавы и оксидные керамические расплавы воздействуют на вольфрам незначительно, даже при очень высоких температурах, если они не содержат дополнительных окислителей.В таблице ниже приведены антикоррозионные свойства вольфрама. Если не указано иное, эти данные относятся к чистым растворам, не содержащих воздуха или азота. Инородные химически активные вещества даже в незначительных концентрациях могут сильно влиять на стойкость к коррозии. У вас есть вопросы по такой сложной проблеме, как коррозия? К вашим услугам наш опыт и собственная лаборатория по исследованию коррозии.
СРЕДА УСТОЙЧИВ (+), НЕУСТОЙЧИВ (-) ПРИМЕЧАНИЕ Вода Холодная и теплая вода < 80 °C + Горячая вода > 80 °C, деаэрированная + Пар до 700 °C + Кислоты Плавиковая кислота, HF + < 100 °C Соляная кислота, HCI + Фосфорная кислота, H3PO4 + < 270 °C Серная кислота, H2SO4 + < 70 %, < 190 °C Азотная кислота, HNO3 + Царская водка, HNO3 + 3 HCl + < 30 °C Органические кислоты + Щелочи Раствор аммиака, NH4OH + Гидроксид калия, KOH + < 50 %, < 100 °C Гидроксид натрия, NaOH + < 50 %, < 100 °C Галогены Фтор, F2 — Хлор, Cl2 + < 250 °C Бром, Br2 + < 450 °C Йод, I2 + < 450 °C Неметаллы Бор, B + < 1200 °C Углерод, C + < 1200 °C Кремний, Si + < 900 °C Фосфор, P + < 800 °C Сера, S + < 500 °C Газы* Аммиак, NH3 + < 1000 °C Монооксид углерода (окись углерода), CO + < 1400 °C Диоксид углерода (углекислый газ), CO2 + < 1200 °C Углеводороды + < 1200 °C Воздух и кислород, O2 + < 500 °C Инертные газы (He, Ar, N2) + Водород, H2 + Водяной пар + < 700 °C * Особое значение имеет точка росы газа.  Влажность может привести к окислению.
Влажность может привести к окислению.Плавление Стекловарение* + < 1700 °C Алюминий, Al + < 700 °C Бериллий, Be — Висмут, Bi + < 1400 °C Цезий, Cs + < 1200 °C Церий, Ce + < 800 °C Медь, Cu + < 1300 °C Европий, Eu + < 800 °C Галлий, Ga + < 1000 °C Золото, Au + < 1100 °C Железо, Fe — Свинец, Pb + < 1100 °C Литий, Li + < 1600 °C Магний, Mg + < 1000 °C Ртуть, Hg + < 600 °C Никель, Ni — Плутоний, Pu + < 700 °C Калий, K + < 1200 °C Рубидий, Rb + < 1200 °C Самарий, Sm + < 800 °C Скандий, Sc + < 1400 °C Серебро, Ag + Натрий, Na + < 600 °C Олово, Sn + < 980 °C Уран, U + < 900 °C Цинк, Zn + < 750 °C Материалы для печестроения Оксид алюминия, Al2O3 + < 1900 °C Оксид бериллия, BeO + < 2000 °C Графит, C + < 1200 °C Магнезит, MgCO3 + < 1600 °C Оксид магния, MgO + < 1600 °C Карбид кремния, SiC + < 1300 °C Оксид циркония, ZrO2 + < 1900 °C Коррозионная стойкость вольфрама
| W |
WK65 |
WVM |
WL | |
| Содержание легирующих элементов (в массовых процентах) |
99,97 % Вт | 60–65 мкг/г K | 30–70 мкг/г K |
0,5 % La2O3 1,0 % La2O3 1,5 % La2O3 2,0 % La2O3 |
| Теплопроводность | ∼ | ∼ | ∼ | ∼ |
| Стойкость к высоким температурам / сопротивление ползучести |
∼ | ++ | ++ + |
+ |
| Температура рекристаллизации | ∼ | ++ | ++ | + |
| Мелкозернистость | ∼ | + | + | + |
| Пластичность |
∼ | + | + | + |
| Обрабатываемость/деформируемость |
∼ | + | + | ++ |
| Работа выхода электронов | ∼ | ∼ | ∼ | — |
∼ на уровне чистого W + выше, чем у чистого W ++ значительно выше, чем у чистого W — ниже, чем у чистого W — значительно ниже, чем у чистого W
| WC20 | WRe | WCu | |
| Содержание легирующих элементов (в массовых процентах) |
2 % CeO2 | 5 % / 26 % Re | 10–40 % Cu |
| Теплопроводность | ∼ | — |
+ |
| Стойкость к высоким температурам / сопротивление ползучести |
+ | + | — |
| Температура рекристаллизации | + | + | |
| Мелкозернистость | + | ∼ | |
| Пластичность |
+ | ++ | ++ |
| Обрабатываемость/деформируемость |
++ | + | ++ |
| Работа выхода электронов | + |
∼ на уровне чистого W + выше, чем у чистого W ++ значительно выше, чем у чистого W — ниже, чем у чистого W — значительно ниже, чем у чистого W
Особенности и область применения
Показатели качества
Благодаря уникальным свойствам вольфрам находит особое применение в промышленности. Ниже представлены три примера его использования.
Ниже представлены три примера его использования.
Отличное сопротивление ползучести и высокая чистота
Из нашего вольфрама получаются отличные тигли для плавления и отверждения в отрасли выращивания кристаллов сапфира. Высокая чистота материала предотвращает загрязнение кристаллов, а хорошее сопротивление ползучести гарантирует постоянство формы. Даже самые высокие температуры не влияют на результат процесса.
Исключительная чистота материала и хорошая электропроводность
Самый низкий коэффициент теплового расширения среди всех металлов и хорошая электропроводность делают вольфрам идеальным материалом для тонких покрытий. Хорошая электропроводность и низкая степень диффузии в соседние слои делают вольфрам незаменимым в тонкопленочных транзисторах, например тех, которые используются в экранах TFT-LCD. Разумеется, материал высочайшей чистоты для покрытий в виде мишеней для напыления можно приобрести у нас.
 Ни у одного из других производителей вы не найдете вольфрамовые мишени в таком широком диапазоне форматов.
Ни у одного из других производителей вы не найдете вольфрамовые мишени в таком широком диапазоне форматов.Длительный срок службы и самая высокая температура плавления
Благодаря длительному сроку службы при самых высоких температурах наши вольфрамовые тигли и стержни оправок легко выдерживают даже воздействие расплавленного кварцевого стекла. Использование вольфрама высокой степени чистоты позволяет избежать образования пузырьков и обесцвечивания кварцевого расплава.
Добыча
Естественные месторождения и переработка рудыВольфрам был впервые обнаружен в Средние века в Рудных горах (на границе между Саксонией и Богемией) в процессе восстановления олова. Однако в то время он считался нежелательным сопутствующим элементом. Вольфрамовая руда способствовала образованию шлака в процессе восстановления олова и тем самым снижала выход олова из руды. Название металла произошло от немецкого Wolf Rahm — волчья слюна, поскольку считалось, что его руда «пожирает олово, как волк съедает овцу». В 1752 году химик Аксель Фредрик Кронштедт открыл тяжелый металл, который назвал Tung Sten, что в переводе с шведского означает «тяжелый камень». Лишь спустя 30 лет Карлу Вильгельму Шееле удалось получить вольфрамовую кислоту из руды. И всего спустя два года ассистенты Шееле — братья Хуан Хосе и Фаусто де Элюар — восстановили триоксид вольфрама, получив чистый вольфрам. Сегодня именно эти два брата считаются настоящими открывателями вольфрама. Название wolframium и соответствующий химический знак W были предложены Йёнсом Якобом Берцелиусом.
В 1752 году химик Аксель Фредрик Кронштедт открыл тяжелый металл, который назвал Tung Sten, что в переводе с шведского означает «тяжелый камень». Лишь спустя 30 лет Карлу Вильгельму Шееле удалось получить вольфрамовую кислоту из руды. И всего спустя два года ассистенты Шееле — братья Хуан Хосе и Фаусто де Элюар — восстановили триоксид вольфрама, получив чистый вольфрам. Сегодня именно эти два брата считаются настоящими открывателями вольфрама. Название wolframium и соответствующий химический знак W были предложены Йёнсом Якобом Берцелиусом.
В природе вольфрамовая руда в основном встречается в виде вольфрамита ((Fe/Mn)WO4) и шеелита (CaWO4). Крупнейшие месторождения вольфрама находятся в Китае, России и США. В Австрии также есть шеелит, он добывается в Миттерзилле в районе Фельбертауэрн.
В зависимости от месторождения вольфрамовые руды содержат от 0,3 до 2,5 массового процента WO3. Путем дробления, шлифовки, флотации и обжига можно увеличить содержание WO3 примерно до 60 %.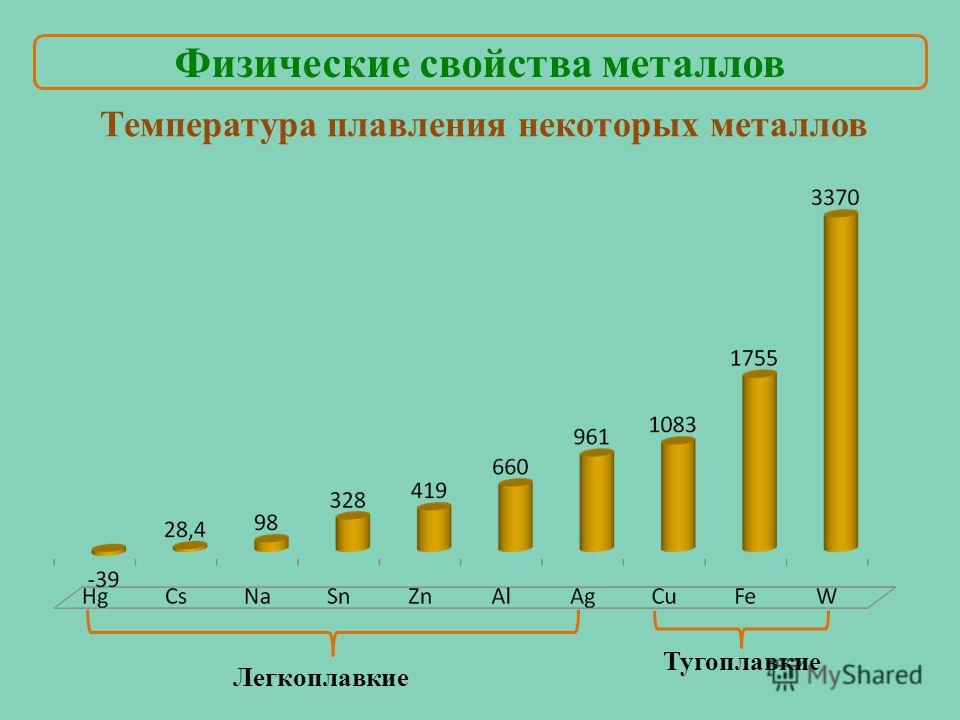 Оставшиеся примеси устраняются путем гидролиза раствором едкого натра. Полученный вольфрамат натрия превращают в паравольфрамат аммония (APW) в процессе ионообменной экстракции.
Оставшиеся примеси устраняются путем гидролиза раствором едкого натра. Полученный вольфрамат натрия превращают в паравольфрамат аммония (APW) в процессе ионообменной экстракции.
Восстановление производится в водородной атмосфере при температуре от 500 до 1000 °C:
| WO3+ 3H2 › W + 3H2O |
Наша аффилированная компания GTP специализируется на переработке, извлечении и восстановлении паравольфрамата аммония (APW). GTP поставляет нам металлический вольфрам высокой чистоты и стабильно высокого качества.
На страницу GTPЗакупки в соответствии с RMAP
Часть поставляемого на рынки вольфрама происходит из так называемых «конфликтных источников», то есть добывается в зонах военных конфликтов: прежде всего в Демократической Республике Конго (ДРК) и соседних странах. Мы осознаем свою ответственность перед обществом и принципиально не используем сырье, которое может быть связано с такими конфликтами.
По собственной инициативе мы подтверждаем безупречное происхождение нашего вольфрама особым сертификатом. В этом документе в соответствии с инициативой RMI (Responsible Minerals Initiative), ранее известной как CFSP, подтверждается использование вольфрамового сырья из этически благонадежных источников. Аудиторский комитет RBA и GeSI подтвердил, что зарегистрированная в Тованде компания Global Tungsten & Powders (GTP) — часть Plansee Group — закупает вольфрам в соответствии с требованиями RMAP. Для клиентов Plansee этот сертификат также является независимым доказательством того, что Plansee Group получает вольфрам из бесконфликтных источников.
Подробнее о принципе устойчивостиПроизводственный процесс
Как все это делается? Методами порошковой металлургии!Что такое порошковая металлургия? В настоящее время, как известно, большинство промышленных металлов и сплавов, таких как сталь, алюминий и медь, получают в виде черновых отливок с использованием литейных форм. В порошковой металлургии плавление не применяется: изделия создаются путем прессования металлических порошков и последующей термической обработки (спекания) ниже температуры плавления материала. Три важные составляющие порошковой металлургии — металлический порошок, прессование, спекание. Все эти составляющие находятся под нашим полным контролем, и мы можем оптимизировать их собственными силами.
В порошковой металлургии плавление не применяется: изделия создаются путем прессования металлических порошков и последующей термической обработки (спекания) ниже температуры плавления материала. Три важные составляющие порошковой металлургии — металлический порошок, прессование, спекание. Все эти составляющие находятся под нашим полным контролем, и мы можем оптимизировать их собственными силами.
Почему мы выбрали порошковую металлургию? Порошковая металлургия позволяет получать материалы с температурой плавления более 2000 °C. Производство будет экономически выгодным даже при выпуске небольших объемов продукции. Порошковые смеси с индивидуально подобранным составом позволяют получать исключительно однородные материалы с регулируемыми свойствами.
Вольфрамовый порошок смешивается с легирующими присадками (если таковые предусмотрены) и подвергается холодному изостатическому прессованию с давлением до 2000 бар. Полученная прессовка спекается в специальных печах при температуре выше 2000 °C. При этом формируется особая микроструктура и значительно увеличивается плотность материала. Особые свойства (высокую жаропрочность и твердость либо специальные характеристики текучести) нашим материалам придают верно подобранные методы формования, такие как ковка, прокатка, волочение. Идеальная согласованность всех этапов производства — вот секрет высочайшего качества нашей продукции, непревзойденной чистоты материалов и полного соответствия самым жестким стандартам.
При этом формируется особая микроструктура и значительно увеличивается плотность материала. Особые свойства (высокую жаропрочность и твердость либо специальные характеристики текучести) нашим материалам придают верно подобранные методы формования, такие как ковка, прокатка, волочение. Идеальная согласованность всех этапов производства — вот секрет высочайшего качества нашей продукции, непревзойденной чистоты материалов и полного соответствия самым жестким стандартам.
Восстановление
Смешивание, плавление
Прессование
Спекание
Формовка
Термообработка
Механическая обработка
Контроль качества
Повторное использование
ОксидMolymet (Чили) — крупнейшая в мире компания по переработке молибденовых рудных концентратов и наш основной поставщик триоксида молибдена. Plansee Group является акционером Molymet с долей участия 21,15 %. Global Tungsten & Powders (США) — подразделение Plansee Group и наш основной поставщик вольфрамового порошка.
Plansee Group является акционером Molymet с долей участия 21,15 %. Global Tungsten & Powders (США) — подразделение Plansee Group и наш основной поставщик вольфрамового порошка.
Ассортимент продукции
| Материал | Листы и пластины [толщина] | Прутки [диаметр] | Проволока [диаметр] |
| W | 0,025–20 мм | 0,3–90 мм | 0,025–1,50 мм |
| W-UHP | На заказ | ||
| WK65 | 0,010–1,50 мм | ||
| WVM | 0,05–5 мм | 0,3–12,99 мм | 0,050–1,50 мм |
| WVMW | 13–45 мм | ||
| WL05/WL10/WL15 | На заказ | 0,3–90 мм | |
| WC20 | На заказ | ||
| WRe05/WRe26 | На заказ | 0,4–1,50 мм |
Если у вас остались вопросы по перечисленным выше размерам или вы хотите приобрести полуфабрикаты из других материалов, например WCu или INERMET®, свяжитесь с нами.
Интернет-магазин
Здесь вы можете легко и быстро заказать листовой и полосовой металл, прутки, проволоку, а также другую продукцию из вольфрама и вольфрамовых сплавов, любых размеров.
Загрузки
Требуется дополнительная информация о вольфраме и его сплавах? Все необходимые сведения можно найти в технических паспортах наших продуктов.
Вопросы и ответы
Ответы на часто задаваемые вопросы о вольфраме
Является ли вольфрам металлом?
Вольфрам — это тугоплавкий (жаростойкий) металл, который относится к группе переходных металлов. Его химический символ — латинская буква «W», а атомный номер — 74. Тугоплавкими называют металлы, температура плавления которых выше, чем у платины (1772 °C).
Какими свойствами обладает вольфрам?
Ни один металл не сравнится с вольфрамом по жаропрочности. У вольфрама самая высокая точка плавления среди металлов, и он не разрушается даже при очень высоких температурах.
 Вольфрам также отличается исключительно низким коэффициентом теплового расширения, высоким уровнем стабильности формы и хорошей электропроводностью.
Вольфрам также отличается исключительно низким коэффициентом теплового расширения, высоким уровнем стабильности формы и хорошей электропроводностью.Где применяется вольфрам?
Благодаря уникальным механическим и химическим свойствам вольфрам отлично подходит для применения в сложных средах с целым спектром жестких требований. Из этого материала мы изготавливаем, например, компоненты для высокотемпературных печей, ламп, медицинской техники и систем нанесения тонких покрытий.
Откуда произошло название «вольфрам»?
Вольфрам был впервые обнаружен в Средние века в Рудных горах (на границе между Саксонией и Богемией) в процессе восстановления олова. Однако в то время он считался нежелательным сопутствующим элементом. Вольфрамовая руда способствовала образованию шлака в процессе восстановления олова и тем самым снижала выход олова из руды. Название металла произошло от немецкого Wolf Rahm — волчья слюна, поскольку считалось, что его руда «пожирает олово, как волк съедает овцу».
 В 1752 году химик Аксель Фредрик Кронштедт открыл тяжелый металл, который назвал Tung Sten, что в переводе с шведского означает «тяжелый камень». Лишь спустя 30 лет Карлу Вильгельму Шееле удалось получить вольфрамовую кислоту из руды. И всего спустя два года ассистенты Шееле — братья Хуан Хосе и Фаусто де Элюар — восстановили триоксид вольфрама, получив чистый вольфрам. Сегодня именно эти два брата считаются настоящими открывателями вольфрама. Название wolframium и соответствующий химический знак W были предложены Йёнсом Якобом Берцелиусом.
В 1752 году химик Аксель Фредрик Кронштедт открыл тяжелый металл, который назвал Tung Sten, что в переводе с шведского означает «тяжелый камень». Лишь спустя 30 лет Карлу Вильгельму Шееле удалось получить вольфрамовую кислоту из руды. И всего спустя два года ассистенты Шееле — братья Хуан Хосе и Фаусто де Элюар — восстановили триоксид вольфрама, получив чистый вольфрам. Сегодня именно эти два брата считаются настоящими открывателями вольфрама. Название wolframium и соответствующий химический знак W были предложены Йёнсом Якобом Берцелиусом.Где добывают вольфрам?
В природе вольфрамовая руда в основном встречается в виде вольфрамита ((Fe/Mn)WO4) и шеелита (CaWO4). Крупнейшие месторождения вольфрама находятся в Китае, России и США. В Австрии также есть шеелит, он добывается в Миттерзилле в районе Фельбертауэрн.
Другие материалы
4295.94
Mo
Molybdän
73180.95
Ta
Тантал
W-MMC
Metal Matrix Composites
Сплав железа и меди: область применения
Из этого материала вы узнаете:
- Сплав железа и меди в чистом виде – редкость
- Классификация сплавов меди
- Характеристики сплавов меди
- Основные сферы применения сплавов меди
- Самые распространенные сплавы меди
Сплав железа и меди как таковой не существует. Причины – разные температуры плавления и свойства растворимости. По сути, получается нечто вроде слоеного пирога. Однако и такой результат смешивания двух металлов с успехом используется в самых разных сферах.
Причины – разные температуры плавления и свойства растворимости. По сути, получается нечто вроде слоеного пирога. Однако и такой результат смешивания двух металлов с успехом используется в самых разных сферах.
Большее распространение получили сплавы меди с другими металлами: алюминием, оловом, свинцом, с добавлением никеля и др. О свойствах медных сплавов, а также интересные факты о сплаве железа и меди вы узнаете из нашего материала.
Сплав железа и меди в чистом виде – редкость
Существование сплава железа и меди вполне возможно. Фазовая диаграмма с этими двумя элементами имеет следующий вид:
На ней заметно, что фазовые поля «ααFe» и «Cu» значительно сужаются к краям диаграммы. Это значит, что в одном веществе нельзя растворить большое количество другого.
Растворимость железа в фазах меди и меди в фазах железа ограничена. Так, в фазе аустенита (гамма-Fe) можно растворить не более 18% меди. Для этого необходима высокая температура (около +1400 °С), которая резко должна смениться комнатной для предотвращения повторного разделения. Все, что получится в других условиях, – двухфазная смесь, которую нельзя назвать сплавом железа и меди.
Все, что получится в других условиях, – двухфазная смесь, которую нельзя назвать сплавом железа и меди.
Также по диаграмме заметно, что возникновение интерметаллических соединений невозможно. Если именно их вы подразумевали под сплавом, то ошибались.
Следовательно, сплав имеет эвтектоидную микроструктуру со сменяющими друг друга слоями материала, насыщенного железом и медью. Точная микроструктура и формула сплава железа и меди зависит от составных компонентов.
Лигатура медь-железо имеет формулу CuFe. Ее используют для алюминиевой бронзы и определенных латунных сплавов в роли рафинера. Также сфера применения лигатуры распространяется на повышение качества других сплавов, а именно улучшение коррозионной стойкости медно-никелевых сплавов и механических свойств низколегированных медных сплавов.
VT-metall предлагает услуги:
Есть несколько разновидностей сплавов железа и меди, в которых доля железа варьируется от 1% до 2,5%. Медные сплавы отличаются высокой прочностью, благодаря которой могут использоваться в трубках конденсаторов и электрических контактах с хорошей электропроводностью (около 65 % IAC).
Это сплавы вариации серии C19xxxx, например, C19200, C19500, C19600.
Классификация сплавов меди
Медь – это крайне значимый материал, который сопровождал человечество практически всю жизнь. Первобытные люди использовали в качестве орудий труда именно медные изделия. При этом способы обработки металла в разные времена отличались.
Раньше было принято обрабатывать медь холодным методом, о чем говорят археологические находки в пределах современной Северной Америки. Традиции по использованию меди сохранялись еще до приезда Христофора Колумба. Медную руду начали добывать около 7 тысяч лет назад, и благодаря податливости материала он быстро стал востребованным. Даже спустя столько лет медь не теряет своей актуальности.
Металл отличается красноватым цветом, который ему придает кислород. Если этот компонент полностью убрать, то оттенок станет желтым. Насыщенность цвета также зависит от валентности. Так, карбонаты меди имеют выраженный синий либо зеленый тон. Начищенная медь придаст металлу яркий блеск.
По электропроводимости медь занимает почетное второе место, уступая лишь серебру. Благодаря своим качествам ее используют в электронике. Однако важно помнить недостатки металла. Один из основных – плохое взаимодействие с кислородом. На свежем воздухе медь покрывается пленкой, связанной с процессом окисления.
Медный оксид можно получить прокаливанием гидрокарбоната меди либо нитрата на воздухе. Данное соединение способно окисляющим образом влиять на органические соединения.
Медный купорос дает растворение материала в серной кислоте. Сфера применения полученного вещества – химическая промышленность. Медный купорос используют и для профилактики вредителей на огороде.
Примеси способны по-разному воздействовать на характер медного сплава. По данному критерию выделяется три группы:
- Первая группа включает в себя соединения, создающие твердые вещества. Среди них: сурьма, цинк, железо, олово, фосфор, сурьма, никель и др.
- Во вторую группу входят соединения, имеющие низкую растворимость в меди.
 Из-за их наличия обработка давлением становится сложнее. Однако стоит отметить, что электропроводность остается практически неизменной. Пример таких соединений – свинец и висмут.
Из-за их наличия обработка давлением становится сложнее. Однако стоит отметить, что электропроводность остается практически неизменной. Пример таких соединений – свинец и висмут. - В третьей группе содержатся вещества, создающие вместе с медью хрупкие соединения (кислород, сера).
Характеристики сплавов меди
Сплав меди может иметь разные характеристики, которые зависят от примесей и их количества. Например, прочность, коррозионную стойкость, низкий коэффициент трения. На практике часто используются смеси меди с магнием, цинком, марганцем и алюминием. При этом в промышленности можно найти и другие варианты сплавов.
Чтобы определить состав по Межгосударственному стандарту, необходимо использовать классификацию из специальной таблицы. Там указана маркировка меди и перечислены ее главные характеристики:
- Так, в марках М1 и М1р, М2 и М2р, М3 и М3р содержание меди одинаковое, а буква «р» означает наличие фосфора (до 0,04% от общего количества вещества) и меньшее количество кислорода (до 0,01%).
 В марках с обычным количеством кислорода его доля составляет от 0,05 до 0,08%.
В марках с обычным количеством кислорода его доля составляет от 0,05 до 0,08%. - В марках М00 и М1 содержится как минимум 99,9% меди.
- Марка М0 состоит из меди на 99,95%.
- Для М0б содержание металла – около 99,97%.
- Вещество с обозначением М2 состоит из меди на 99,7%.
- Для марки М3 характерна доля металла, составляющая 99,5%.
- В марке М4 основное вещество занимает 99% от общего количества сплава.
- Буква «б» в составе марки означает полное отсутствие кислорода. Так, в М0б его нет, а в М0 содержится около 0,02%.
Основные характеристики сплавов с содержанием меди:
- Способность сопротивляться коррозии, которая особенно выражена у веществ с полированной поверхностью. Она проявляется при воздействии на сплав пресной воды. Кислотная среда ухудшает коррозионную стойкость. Например, мельхиор (сплав из железа, никеля и меди) в кислотной среде (при контакте с водой) обретает зеленоватый оттенок.

- Прочность, что позволяет использовать материал в промышленных целях. Так, при высоких удельных и знакопеременных нагрузках часто применяют детали из сплава меди с железом и марганцем.
- Антифрикционность, что дает сплаву устойчивость к трению. Так, например, бронза применяется в производстве подшипников даже без использования смазки. Это происходит именно благодаря идеально гладкой поверхности. Сплав железа с медью и серебром также обладает хорошими антифрикционными свойствами.
- Теплопроводность и электропроводность. Эти свойства позволяют делать из медного сырья электропроводные кабели.
Медные сплавы могут использоваться в разных сферах деятельности: в самолето- и судостроении, ювелирном деле, при создании часовых механизмов и других приспособлений, в которых вероятно возникновение трения двух парных компонентов.
Если говорить о сплавах, в которых также есть железо, то на практике чаще всего применяют сплав из меди, железа и олова, сплав из меди, алюминия и железа, а также сплав из меди, цинка и железа.
Основные сферы применения сплавов меди
В производстве используется как медь в чистом виде (катодная медь), так и полуфабрикаты, сделанные на ее основе. Особенно это касается катанок, проката и других промышленных изделий. Характеристики и сфера применения зависят от доли примесей в общем продукте. В марке может содержаться от 10 до 50 добавок.
Чтобы сделать высокоточный и чистый металл, потребуется медь именно той марки, в которой нет кислорода. Для криогенной промышленности его отсутствие – важнейший критерий. В противном случае изделие не будет соответствовать условиям использования. Однако в других сферах применения подойдут и те виды, в которых есть кислород.
Рассмотрим их более подробно:
- М00 и М0 могут использоваться для создания высокочастотных и электропроводниковых деталей. Полученные изделия обычно создаются на заказ и считаются дорогими.
- М001ф и М001бб подойдут для изготовления электрических шин и медной проволоки с маленьким диаметром сечения.

- М1 и марки с таким же содержанием меди (М1р, М1ф, М1ре) используются в качестве проводников электрического тока. Небольшое количество олова позволяет их задействовать в производстве высококачественной бронзы. Также их часто включают в состав прутьев для сварки чугуна и электродов.
- М2, М2р и М2к – идеальный вариант для деталей, производимых в криогенной промышленности. Так как литой прокат подвергается обработке под давлением, для него тоже подойдут перечисленные марки.
- Из М3, М3р и М3к создают плоский и прессованный прокат, а также проволоку для электромеханической сварки деталей из чугуна и меди.
Самые распространенные сплавы меди
В сплавах меди и железа последнее выступает легирующим компонентом. Также таковым может выступать золото, марганец или цинк. Их доля в общем количестве составляет менее 10 %. Единственное исключение из правил – латунь. Ее концентрация может быть больше заявленной, конкретное число будет зависеть от условий применения.
Среди основных видов медных сплавов следует выделить:
- Смесь меди и железа. Для обоих металлов характерны похожие химические показатели. Основное отличие заключается в температуре плавления, поэтому сплав железа и меди имеет пористую структуру.
- Смесь с оловом. Сплав меди и олова использовали еще в давние времена. Так, в Древней Греции из смеси создавали настоящие произведения искусства, которые сейчас являются огромной ценностью для людей. Разумеется, современные характеристики сплава значительно отличаются от тех, которые существовали тысячи лет назад. Во многом это связано с улучшенными методиками производства. Сейчас для создания сплава применяются дуговые электропечи, а защита от окисления обеспечивается вакуумом. Закаливание смеси позволяет достичь высокого уровня пластичности и прочности.
Рекомендуем статьи
- Сплавы железа: известные и не очень разновидности
- Сплав железа с никелем: его свойства и особенности
- Углеродистые конструкционные стали: виды и преимущества
- Алюминиевая бронза.
 Это смесь алюминия и меди, которая имеет коррозионную стойкость и способность к деформации. Ее используют в производстве деталей, которые планируется подвергать воздействию высокой температуры.
Это смесь алюминия и меди, которая имеет коррозионную стойкость и способность к деформации. Ее используют в производстве деталей, которые планируется подвергать воздействию высокой температуры. - Смесь меди со свинцом. Для материала характерна антифрикционность и высокая прочность, по большей части обеспечиваемая свинцом.
- Латунь. Сплав содержит два или три основных компонента.
- Нейзильбер. Так называют сплав, где содержится медь, цинк и никель, доля которого составляет 6–34 %. Несмотря на то, что материал дешевле мельхиора, он имеет такие же качества и внешние признаки.
Сплавы из меди активно используются в автомобилестроении и производстве оборудования аграрного и химического назначения. Устойчивость к коррозии позволяет применять смеси в создании сверхпроводниковой техники.
Мягкая медь отлично подойдет для деталей, которые имеют трудновыполнимый узор. Она обладает всеми необходимыми свойствами, в первую очередь – вязкостью и пластичностью. Проволока из такого сплава будет отлично гнуться, а еще ее можно паять вместе с золотыми и серебряными поверхностями. Также смеси хорошо взаимодействуют с эмалью, при этом не расслаиваясь и не растрескиваясь.
Проволока из такого сплава будет отлично гнуться, а еще ее можно паять вместе с золотыми и серебряными поверхностями. Также смеси хорошо взаимодействуют с эмалью, при этом не расслаиваясь и не растрескиваясь.
Медь – металл, который действительно необходим в современных условиях. С ним получаются широко используемые сплавы железа и меди, алюминия и меди, олова и меди и не только. Антикоррозионные, антифрикционные и теплопроводные свойства позволяют применять смеси в производстве деталей.
Почему следует обращаться именно к нам
Мы с уважением относимся ко всем клиентам и одинаково скрупулезно выполняем задания любого объема.
Наши производственные мощности позволяют обрабатывать различные материалы:
- цветные металлы;
- чугун;
- нержавеющую сталь.
При выполнении заказа наши специалисты применяют все известные способы механической обработки металла. Современное оборудование последнего поколения дает возможность добиваться максимального соответствия изначальным чертежам.
Для того чтобы приблизить заготовку к предъявленному заказчиком эскизу, наши специалисты используют универсальное оборудование, предназначенное для ювелирной заточки инструмента для особо сложных операций. В наших производственных цехах металл становится пластичным материалом, из которого можно выполнить любую заготовку.
Преимуществом обращения к нашим специалистам является соблюдение ими ГОСТа и всех технологических нормативов. На каждом этапе работы ведется жесткий контроль качества, поэтому мы гарантируем клиентам добросовестно выполненный продукт.
Благодаря опыту наших мастеров на выходе получается образцовое изделие, отвечающее самым взыскательным требованиям. При этом мы отталкиваемся от мощной материальной базы и ориентируемся на инновационные технологические наработки.
Мы работаем с заказчиками со всех регионов России. Если вы хотите сделать заказ на металлообработку, наши менеджеры готовы выслушать все условия. В случае необходимости клиенту предоставляется бесплатная профильная консультация.
Как выплавлялась сталь | Политехнический музей
© Petr Štefek
17 октября 1855 г. английский изобретатель Генри Бессемер запатентовал новый процесс изготовления стали. Политех решил проследить историю развития металлургии от глиняных кузнечных горнов до мартеновских печей с магнезитовой футеровкой.
Цивилизация — это металл, начиная с первых неловких попыток обработки самородных металлов, и до ультрасовременных сложных сплавов. Недаром историки разделяют развитие человечества на этапы, начиная с каменного века: медный, бронзовый и, наконец, железный.
Самородные металлы встречаются довольно редко, поэтому начиная с медного века люди учились выплавлять их из руды. Хотя первое знакомство человека с железом сегодня относят еще к 3–4 тысячелетию до н.э., считается, что «настоящий» железный век наступил лишь около VIII в. до н.э. Во всяком случае, в 1200 г. до н.э. древние греки воевали с троянцами еще медным и бронзовым оружием.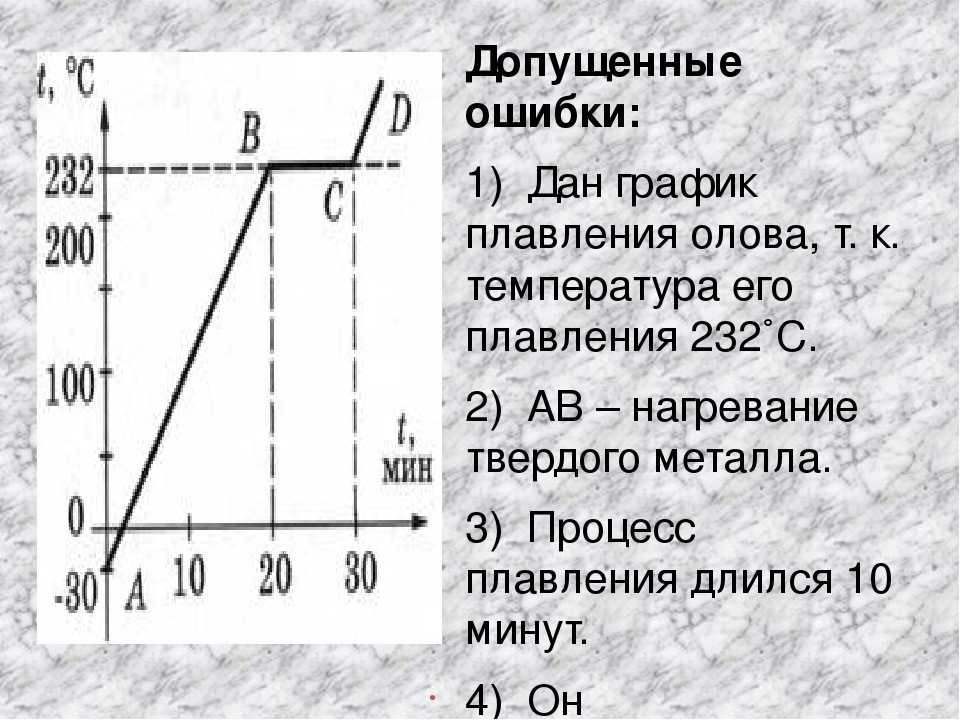
Получать медь и бронзу (сплав меди с оловом) не особенно сложно. Во-первых, самородная медь распространена достаточно широко. Во-вторых, температура ее плавления — около 1350 °С, и в простейшем случае достаточно насыпать руду в каменный или глиняный тигель, и поставить его в кузнечный горн. Вскоре можно будет отделить шлак от вполне чистого металла.
Дорога к веку железа
Температура плавления железа — уже почти 1540 °С. Его получение потребовало печей более совершенной конструкции и более горячих. Чтобы повысить разогрев, воздух в них нагнетали мехами, а сами глиняные печи часто делали «глухими»: чтобы извлечь готовый металл и шлаки, печь приходилось разбирать, а для новой плавки складывать заново. Вдобавок, поддерживать высокую температуру удавалось только в небольших по размерам объемах. Производительность такой металлургии была невысока, а выплавленное железо исключительно дорогим.
Полудоменная печь XV века с водяным дутьем (Штирия)
Широко доступным железо стало только в XIV–XV вв. , когда появились доменные печи, выплавка в которых может происходить непрерывно — разбирать ее нет нужды. Железная руда, чередуясь с топливом, засыпается в доменную печь сверху, а снизу подается разогретый воздух и извлекается шлак, а также чугун, сплав железа со сравнительно высоким количеством углерода.
, когда появились доменные печи, выплавка в которых может происходить непрерывно — разбирать ее нет нужды. Железная руда, чередуясь с топливом, засыпается в доменную печь сверху, а снизу подается разогретый воздух и извлекается шлак, а также чугун, сплав железа со сравнительно высоким количеством углерода.
Первым топливом доменных печей стал уголь — сперва древесный, потом каменный, — а с XVIII в. его вытесняет кокс, продукт нагревания угля без доступа кислорода.
Температура в доменной печи так высока, что складывать ее потребовалось из кирпичей, сделанных лишь из особых, огнеупорных сортов глины. В те годы самой стойкой показала себя белая глина (каолин), состоящая, в основном, из водных силикатов алюминия. Глину обжигали, чтобы удалить воду и спечь, получив шамот, затем его перемалывали и после добавления дополнительных ингредиентов формовали в кирпичи.
Стоит заметить, что кузнецы Средних веков относились к чугуну пренебрежительно: при всей своей высокой твердости, он исключительно хрупок и обычной ковке молотом не поддавался. Однако после того, как из него стали лить ядра, пушки, а затем рельсы и мосты, именно он стал основным для черной металлургии. «Доменно–каолинная» технология просуществовала несколько столетий, вплоть до начала XIX в.
Однако после того, как из него стали лить ядра, пушки, а затем рельсы и мосты, именно он стал основным для черной металлургии. «Доменно–каолинная» технология просуществовала несколько столетий, вплоть до начала XIX в.
Стальная революция
Следующий прорыв связан с созданием технологий получения из чугуна еще более удобных сплавов железа — сталей. Для этого требуется всего лишь снизить содержание углерода, однако долгое время добиться этого можно было лишь очень долгим и сложным способом, включавшим дополнительную проковку. Сталь не была массовой до тех пор, пока в 1780-х не появился новый революционный метод пудлингования.
В пудлинговой печи контакта чугуна с топливом не происходило. Уголь сгорал в очаге, тепло от которого направлялось к рабочему пространству, превращая загруженный чугун в тестообразную массу. При этом стены печи покрывали слоем глины, смешанной с оксидами железа, которые помогали углероду в расплавленном чугуне окисляться. При огромной температуре и за счет особого покрытия углерод и примеси выгорали, и в расплаве появлялись кристаллы достаточно чистого железа. Собрав их в комок, рабочие вытаскивали его из печи и отправляли на проковку.
При огромной температуре и за счет особого покрытия углерод и примеси выгорали, и в расплаве появлялись кристаллы достаточно чистого железа. Собрав их в комок, рабочие вытаскивали его из печи и отправляли на проковку.
Вскоре для пудлинговых и доменных печей было найдено и новое огнеупорное покрытие, способное выдерживать температуры, намного выше, чем шамот. Кремнезем — диоксид кремния — при нагревании спекается в огнеупорную стекловидную массу. Уже в 1820-х в Англии, где вовсю бушевала промышленная революция, была разработана технология получения огнеупорных кирпичей из богатой кремнеземом динасовой глины.
Вскоре доменные и пудлинговые печи начинают работу во всех развитых странах: с 1819 г. — во Франции, с 1835 г. — в Австрии, а в 1837 г. и в России открылся первый пудлинговый Камско-Воткинский завод. Металлургия стала обеспечивать возрастающие потребности человечества в «черном» металле. Континенты рассекли железные дороги, в моря вышли железные пароходы, артиллерия вооружилась внушительными пушками.
Между Бессемером и Мартеном
Потребности цивилизации в стали все росли, и технологии быстро совершенствовались. В середине XIX в. Генри Бессемер нашел, что «обезуглероживание» чугуна станет более эффективным, если сквозь ванну с расплавом продувать воздух. Однако бессемеровской переделке поддавался далеко не любой чугун: если он содержал фосфор, то при нагревании до красного каления резко терял всю свою прочность.
Изобретатель Генри Бессемер
Железные руды с низким содержанием фосфора достаточно редки, удалить же его из чугуна в печи не позволяла простая химия: шамотные и динасовые кирпичи создают в ней кислую среду, в которой нужные реакции не протекают. Решение нашлось лишь в 1877 г., когда Сидни Томас и Перси Джилькрист получили патент на новую технологию переделки чугуна — с добавлением связывающей фосфор извести и с облицовкой печи из материалов, содержащих щелочные оксиды магния и кальция.
В самой Англии к новому процессу отнеслись с недоверием. Вплоть до начала ХХ в. металл, изготовленный по этой технологии, ценился не слишком высоко, и даже фирма Lloyd’s брала повышенную плату за страхование судов, изготовленных из «томасовского» металла. Такой консерватизм обошелся англичанам дорого: к концу XIX в. Германия, вооружившись методом Томаса, стала металлургическим и промышленным лидером Европы.
Вплоть до начала ХХ в. металл, изготовленный по этой технологии, ценился не слишком высоко, и даже фирма Lloyd’s брала повышенную плату за страхование судов, изготовленных из «томасовского» металла. Такой консерватизм обошелся англичанам дорого: к концу XIX в. Германия, вооружившись методом Томаса, стала металлургическим и промышленным лидером Европы.
Распространение томасовского процесса привело к тому, что с 1880-х внутренние поверхности сталеплавильных печей все чаще отделывали щелочными (основными) огнеупорами. Изготовленные, например, из минерала магнезита, они позволили поднять температуру до 1700 °С и открыли дорогу новой металлургической технологии — пришло время мартеновских печей.
Эра Мартена
Идею о превращении мягкого железа в сталь погружением его в расплав чугуна еще в 1722 г. высказал Рене Реомюр (тот самый, который изобрел спиртовой термометр и предложил свою температурную шкалу). Однако температура для этого требовалась настолько высокая, что реализовать процесс было невозможно вплоть до появления печей нового типа.
Первый шаг к ним сделал Фридрих Сименс, придумавший подавать в печь воздух, предварительно прошедший через систему труб и как следует прогретый. А завершил работу Пьер Мартен, который в 1860-х запатентовал процесс, позволявший расплавлять чугун, загружать его металлоломом или рудой — и получать сталь нужного качества и состава.
Первые мартеновские печи облицовывались по-старинке, денисовскими кирпичами, но вскоре их вытеснили более выносливые основные огнеупоры, получаемые из обожженного магнезита. Помимо прочего, они позволяли работать с большим спектром железных руд — и в 1880 г. на территории современной Польши была получена первая сталь, выплавленная в мартеновской печи с использованием магнезитовых огнеупоров.
В следующие десятилетия весь мир принялся осваивать внезапно ставший таким важным магнезит. Его добыча и производство из него огнеупорных изделий одно за другим начинаются в Австро-Венгрии, Германии, США, а около 1896 г.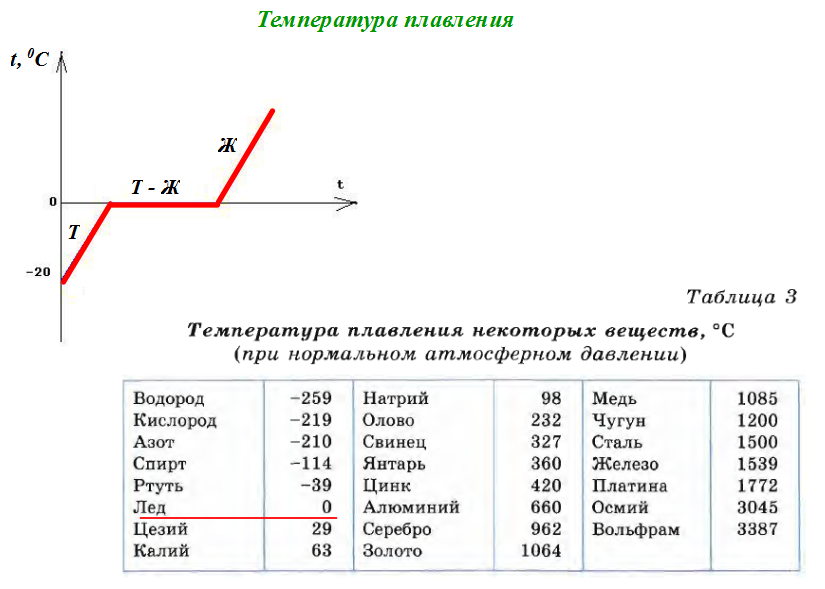 и на Урале было открыто огромное Саткинское месторождение. С началом нового века здесь открывается новый магнезитовый завод — впоследствии одно из передовых предприятий советской промышленности, а сегодня — ключевая часть компании «Магнезит», ведущего поставщика огнеупорных изделий для всей российской металлургии. Впрочем, это уже совсем другая история.
и на Урале было открыто огромное Саткинское месторождение. С началом нового века здесь открывается новый магнезитовый завод — впоследствии одно из передовых предприятий советской промышленности, а сегодня — ключевая часть компании «Магнезит», ведущего поставщика огнеупорных изделий для всей российской металлургии. Впрочем, это уже совсем другая история.
Цинк и его сплавы — производство, свойства, виды и применение
Цинк — хрупкий голубовато-белый металл. В природе без примесей не встречается. В 1738 году Уильям Чемпион добыл чистые пары цинка с помощью конденсации. В периодической системе Менделеева находится под номером 30 и обозначается символом Zn.
Свойства цинка
Химические свойства цинка
Цинк — активный металл. При комнатной температуре тускнеет и покрывается слоем оксида цинка.
- Вступает в реакцию со многими неметаллами: фосфором, серой, кислородом.
- При повышении температуры взаимодействует с водой и сероводородом, выделяя водород.

- При сплавлении с щелочами образует цинкаты — соли цинковой кислоты.
- Реагирует с серной кислотой, образуя различные вещества в зависимости от концентрации кислоты.
- При сильном нагревании вступает в реакции со многими газами: газообразным хлором, фтором, йодом.
- Не реагирует с азотом, углеродом и водородом.
Физические свойства цинка
Цинк — твердый металл, но становится пластичным при 100–150 °C. При температуре выше 210 °С может деформироваться. Температура плавления — очень низкая для металлов. Несмотря на это, цинк имеет хорошую электропроводность.
- Плотность — 7,133 г/см³.
- Теплопроводность — 116 Вт/(м·К).
- Температура плавления цинка — 419,6 °C.
- Температура кипения — 906,2 °C.
- Удельная теплота испарения — 114,8 кДж/моль.
- Удельная теплота плавления — 7,28 кДж/моль.
- Удельная магнитная восприимчивость — 0,175·10-6.

- Предел прочности при растяжении — 200–250 Мн/м2.
Подробный химический состав цинка различных марок указан в таблице ниже.
| Обозначение марок | Цинк, не менее | Примесь, не более | |||||||
| свинец | кадмий | железо | медь | олово | мышьяк | алюминий | всего | ||
| ЦВ00 | 99,997 | 0,00001 | 0,002 | 0,00001 | 0,00001 | 0,00001 | 0,0005 | 0,00001 | 0,003 |
| ЦВ0 | 99,995 | 0,003 | 0,002 | 0,002 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,005 |
| ЦВ | 99,99 | 0,005* | 0,002 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,01 |
| Ц0А | 99,98 | 0,01 | 0,003 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,02 |
| Ц0 | 99,975 | 0,013 | 0,004 | 0,005 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,025 |
| Ц1 | 99,95 | 0,02 | 0,01 | 0,01 | 0,002 | 0,001 | 0,0005 | 0,005 | 0,05 |
| Ц2 | 98,7 | 1,0 | 0,2 | 0,05 | 0,005 | 0,002 | 0,01 | 0,010** | 1,3 |
| Ц3 | 97,5 | 2,0 | 0,2 | 0,1 | 0,05 | 0,005 | 0,01 | — | 2,5 |
* В цинке, применяемом для производства сплава марки ЦАМ4-1о, массовая доля свинца должна быть не более 0,004%. ** В цинке, применяемом для проката, массовая доля алюминия должна быть не более 0,005%.
** В цинке, применяемом для проката, массовая доля алюминия должна быть не более 0,005%.
|
|||||||||
Содержание примесей в цинке зависит от способа производства и качества сырья.
В России основной процент цинка получают гидрометаллургическим способом — металл восстанавливают из солей в растворах. Такой способ позволяет получить наиболее чистый металл. Но часть цинка обрабатывают при высоких температурах. Такой метод называют пирометаллургическим.
Свинец — особая примесь в цинке, так как основная его часть оседает из-за нерастворимых анодов, содержащихся в металле. Катодный цинк, помимо всех указанных примесей, состоит из хлора и фтора.
Как примеси изменяют свойства цинка
Производители ограничивают содержание кадмия, олова и свинца в литейных сплавах цинка, чтобы подавить межкристаллитную коррозию.
Олово — вредная примесь. Металл не растворяется и выделяется из расплава — способствует ломкости цинковых отливок. Кадмий напротив — растворяется в цинке и снижает его пластичность в горячем состоянии. Свинец увеличивает растворимость металла в кислотной среде.
Кадмий напротив — растворяется в цинке и снижает его пластичность в горячем состоянии. Свинец увеличивает растворимость металла в кислотной среде.
Железо повышает твердость цинка, но снижает его прочность. Вместе с тем оно усложняет процесс заполнения форм при литье.
Медь увеличивает твердость цинка, но уменьшает его пластичность и стойкость при коррозии. Содержание меди также мешает рекристаллизации цинка.
Наиболее вредная примесь — мышьяк. Даже при небольшом ее количестве металл становится хрупким и менее пластичным.
Чтобы избежать растрескивания кромок при горячей прокатке цинка, содержание сурьмы не должна быть выше 0,01%. В горячем состоянии она увеличивает твердость цинка, лишая его хорошей пластичности.
Сплавы цинка
Сплавы на цинковой основе с добавлением меди, магния и алюминия имеют низкую температуру плавления и обладают хорошей текучестью. Они легко поддаются обработке, свариванию и паянию.
Латунь
Различают латуни двухкомпонентные и многокомпонентные.
Двухкомпонентная латунь — сплав цинка с высоким содержанием меди. Существует желтая латунь с медью в количестве 67%, золотистая медь или томпак — 75%, и зеленая — 60%. Такие сплавы могут деформироваться при температуре 300 °C.
Многокомпонентные латуни, помимо 2-х основных металлов, состоят из других добавок: никеля, железа, свинца или марганца. Каждый из элементов влияет на свойства сплава.
ЦАМ
ЦАМ — семейство цинковых сплавов. В их состав входят магний, алюминий и медь. Такие сплавы цинка используются в литейном производстве. В них содержится алюминий в количестве 4%.
Основная область применения сплавов ЦАМ — литье цинка под давлением. Сплавы этого семейства обладают низкой температурой плавления и хорошими литейными свойствами. Их высокопрочность позволяет производить прочные и сложные детали.
Вирениум
Сплав состоит из цинка (24,5%), меди (70%), никеля (5,5%).
Производств цинка
Добыча металла
Цинк как самородный металл в природе не встречается. Добывается из полиметаллических руд, содержащих 1–4% металла в виде сульфида, а также меди, свинца, золота, серебра, висмута и кадмия. Руды обогащаются селективной флотацией и получаются цинковые концентраты (50–60% Zn).
Добывается из полиметаллических руд, содержащих 1–4% металла в виде сульфида, а также меди, свинца, золота, серебра, висмута и кадмия. Руды обогащаются селективной флотацией и получаются цинковые концентраты (50–60% Zn).
Концентраты цинка обжигают в печах. Сульфид цинка переводится в оксид ZnO. При этом выделяется сернистый газ SO2, который используется в производстве серной кислоты.
Получение металла
Существуют два способа получения чистого цинка из оксида ZnO.
Самый древний метод — дистилляционный. Обожженный концентрированный состав подвергают термообработке, чтобы придать ему зернистость и газопроницаемость.
Затем концентрат восстанавливают коксом или углем при температуре 1200–1300 °C. В процессе образуются пары металла, которые конденсируют и разливают в изложницы. Жидкий металл отстаивают от железа и свинца при температуре 500 °C. Так достигается цинк чистотой 98,7%.
Иногда используется сложная и дорогая обработка цинка ректификацией — разделением смесей за счет обмена теплом между паром и жидкостью. Такая чистка позволяет получить металл чистотой 99,995% и извлечь кадмий.
Такая чистка позволяет получить металл чистотой 99,995% и извлечь кадмий.
Второй метод производства цинка — электролитический. Обожженный концентрат обрабатывается серной кислотой. Готовый сульфатный раствор очищается от примесей, после чего подвергается электролизу в свинцовых ваннах. Цинк дает осадок на алюминиевых катодах. Полученный металл удаляют с ванн и плавят в индукционных печах. После этого получается электролитный цинк чистотой 99,95%.
Литье металла
Горячий цинк — жидкий и текучий металл. Благодаря таким свойствам он легко заполняется в литейные формы.
Примеси влияют на величину натяжения поверхности цинка. Технологические свойства металла можно улучшить, добавив небольшое количество лития, магния, олова, кальция, свинца или висмута.
Чем выше температура перегрева цинка, тем лучше он заполняет формы. При литье металла в чугунные изложницы его объем уменьшается на 1,6%. Это затрудняет получение крупных и длинных цинковых отливок.
Применение цинка
Для защиты металлов от коррозии
Чистый цинк используется для защиты металлов от коррозии. Основу покрывают тонкой пленкой. Этот процесс называется металлизацией.
Основу покрывают тонкой пленкой. Этот процесс называется металлизацией.
В автомобильной отрасли
Сплавы на цинковой основе используют для оформления декора автомобильного салона, в производстве ручек дверей, замков, зеркал и корпусов стеклоочистителей.
В автомобильные покрышки добавляют окись цинка, которая повышает качество резины.
В батарейках, аккумуляторах и других химических источниках тока цинк используется как материал для отрицательного электрода. В производстве электромобилей применяются цинк-воздушные аккумуляторы, которые обладают высокой удельной энергоемкостью.
В производстве ювелирных украшений
Ювелиры добавляют цинк в сплавы на основе золота. В итоге они легко поддаются ковке и становятся пластичными — прочно соединяют мелкие детали изделия между собой.
Металл также осветляет ювелирные изделия, поэтому его часто используют в изготовлении белого золота.
В медицине
Окись цинка применяется в медицине как антисептическое средство. Окись добавляют в мази и другие составы для заживления ран.
Окись добавляют в мази и другие составы для заживления ран.
Благодаря своим свойствам, цинк широко применяется в различных областях промышленности. Металл пользуется спросом из-за относительно низкой цены и хороших физических свойств.
Каталог -> Каталог тяжелых сплавов -> Производство тяжелых сплавов на основе вольфрама.
ОАО «Победит» выпускает широкую номенклатуру тяжелых сплавов на основе вольфрама или просто тяжелых вольфрамовых сплавов (ВТС),
Тяжелые сплавы получают только методом порошковой металлургии. Методы литья не могут быть применены в связи с большой разницей температур плавления и плотности используемых в сплаве металлов.
Вольфрам, содержание которого в тяжелых сплавах варьируется в пределах от 76% до 97%, является самым тугоплавким металлом из известных человечеству (температура плавления 3410ºС). Он имеет очень высокую плотность и твердость, одну из самых высоких среди металлов. В то же время, вольфрам является довольно хрупким материалом, что делает его обработку затруднительной и не позволяет получать изделия сложной формы.
В то же время, вольфрам является довольно хрупким материалом, что делает его обработку затруднительной и не позволяет получать изделия сложной формы.
Для снижения твердости, придания пластичности и обрабатываемости, придания прочностных характеристик в сплав вводятся металлы группы железа: никель, железо, кобальт. Для повышения электро- и теплопроводности, а также придания диамагнитных свойств, в сплав вводится медь.
Тяжелые сплавы являются композитным материалом, представленные двухфазной структурой из зерен вольфрама округлой формы (ү – фазу распределенной в матрице (связке), представляющей собой твердый раствор вольфрама в Ni-Feили Ni-Cuсплошной матрице (α фаза).
Получают тяжелые сплавы из смесей порошков вольфрама, никеля, железа или меди, взятых в соответствующих пропорциях, Из смеси прессуются заготовки, которые спекаются в защитной атмосфере в присутствии жидкой фазы при 1350-1500ºС, В присутствии жидкой фазы происходит частичное растворение вольфрама в жидкой фазе, перенос вольфрама и рекристаллизация частиц вольфрама с образованием почти сферических частиц, в десятки раз превосходящих по размеру частиц исходного порошка вольфрама. Последующая термическая обработка в вакууме позволяет улучшить механические свойства тяжелых сплавов.
Последующая термическая обработка в вакууме позволяет улучшить механические свойства тяжелых сплавов.
Получение тяжелых сплавов с матрицей из чистой меди отличается от систем W-Ni-Feи W-Ni-Cuв силу практической нерастворимости вольфрама в чистой меди. В этом случае сплав получают пропиткой пористого вольфрамового каркаса расплавленной медью, и основано на затекании в поры жидкой меди под действием капиллярных сил. Пористый каркас из вольфрама получают прессованием и спеканием вольфрамового порошка соответствующего гранулометрического состава.
Тяжелые сплавы пластичны, легко обрабатываются резанием и давлением. Их физико-механические свойства зависят от количества и размеров вольфрамовых зерен (ү — фаза), отношения Ni: Feили Ni: Cuв связке (α — фаза), легирующих добавок и условий получения.
Сплавы W-Ni-Cu, W-Cu(ВНМ, ВМ) менее прочны, чем W-Ni-Fe(ВНЖ), но обладают более высокой тепло- и электропроводностью, диамагнитны.
Плотность тяжелых сплавов варьируется от 13,0 до 18,0 г/см³.
Твердость сплавов марок ВНЖ находится в пределах 20-30 HRC, а марок ВНМ – 24-30 HRC.
Механо-термическая обработка сплавов ВНЖ (обжатие с последующим отжигом) увеличивает твердость до 36-42 HRC.
Сплавы имеют невысокий коэффициент термического расширения (4,0-5,5) х 10-6.
Предел прочности на растяжение варьируется в интервале от 530 до 1200 МПа.
Относительное удлинение от 0,3% до 30%.
Сплавы марки ВМ имеют высокую электро- и теплопроводность, достигающие 50% электро- и теплопроводности меди.
Наибольшую популярность у потребителей имеют выпускаемые ОАО «Победит» марки сплавов:
|
Наименование |
Содержание Ni, % |
Содержание Fe, % |
Содержание Cu, % |
|
ВНЖ 7-3 |
7,0 |
3,0 |
— |
|
ВНЖ-95 |
3,5 |
2,0 |
— |
|
ВНЖ-90 |
2,5 |
0,5 |
— |
|
ВНМ 5-3 |
5,0 |
— |
3,0 |
|
ВНМ 3-2 |
3,0 |
— |
2,0 |
|
ВД 20 |
2,0 |
— |
18,0 |
|
ВМ (5-20) |
— |
— |
5-20 |
|
ВМ (20-30) |
— |
— |
20-30 |
Благоприятное сочетание ценных свойств тяжелых сплавов определяет их широкий диапазон применения.
Тяжелые сплавы используются для экранов, защищающих от проникающей радиации более эффективно, чем свинцовые. При плотности тяжелого сплава 16,5 г/см³ коэффициент поглощения ү- излучения в 1,5 раза выше, чем у свинца. Поэтому из тяжелых сплавов изготавливают контейнеры для радиоактивных изотопов, щели и коллиматоры для гамма-дефектоскопов.
Ввиду высокой плотности тяжелые сплавы используются для изготовления маховиков, противовесов, виброгасителей, балансиров, регуляторов центрифуг, роторов гироскопов, гирокомпасов, противовесов элеронов самолетов и т. д. Высокая плотность сплавов используется при изготовлении кинетических поражающих элементов при производстве боеприпасов.
Высокая проводимость и устойчивость к электроискровой эрозии сплавов ВНМ, ВМ используется при изготовлении штампов для электровысадочных процессов, электродов контактной сварки и электроэрозионной обработки, контактов высоковольтных выключателей, работающих в особо тяжелых условиях.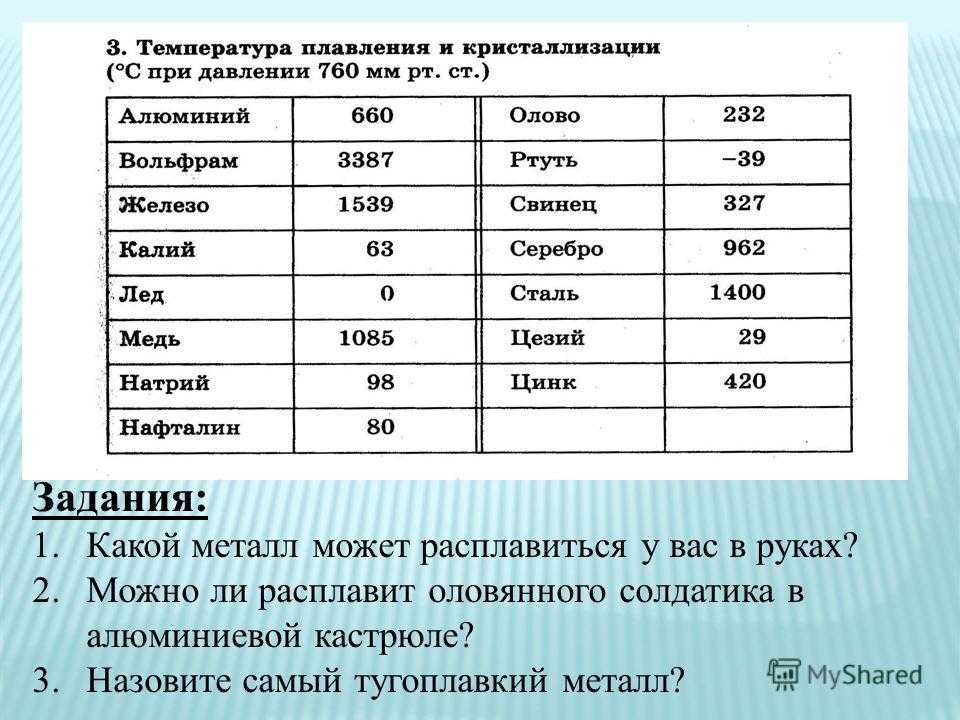
В электронной технике данные сплавы используют для изготовления термокомпенсаторов.
Изделия из тяжелых сплавов и продукты их переработки безвредны для здоровья и экологически безопасны.
Научно-техническое подразделение ОАО «Победит» ведет постоянные работы по совершенствованию технологии производства тяжелых сплавов. В случае необходимости, может быть проведена доработка состава и технологии производства определенных видов изделий по требованию заказчика с целью наиболее полного удовлетворения пожеланий потребителя по физико-механическим свойствам спеченных материалов. Работы проводятся в форме НИР, ОКР изготовления опытных партий, проведения испытаний изделий у заказчика.
Ниже приводятся основные параметры выпускаемых сплавов марок ВНЖ, ВНМ и ВМ общепромышленного применения:
|
Наименование компонента |
Тип сплава |
||||||||
|
W-Ni-Fe |
W-Ni-Cu |
W-Cu |
|||||||
|
содержание, % |
|||||||||
|
W |
70 |
90 |
95 |
97 |
92 |
95 |
80 |
95-80 |
80-70 |
|
Ni |
20 |
7 |
3,5 |
2 |
5 |
3 |
2 |
— |
— |
|
Fe |
10 |
3 |
1,5 |
1 |
— |
— |
— |
— |
— |
|
Cu |
— |
— |
— |
— |
3 |
2 |
18 |
5-20 |
20-30 |
|
Технические характеристики |
|||||||||
|
Плотность, г/см³ |
13,07 |
16,8 |
17,6 |
18,0 |
17,0 |
17,9 |
15,0 |
14,5 |
12,0 |
|
Прочность на разрыв МПа, кгс/мм²/ |
686 70 |
882 90 |
900 92 |
900 92 |
583 60 |
650 69 |
— 69 |
583 60 |
390 40 |
|
Относительное удлинение, % |
3,1 |
18,0 |
7,0 |
5,0 |
2,1 |
1,0 |
3,0 |
2,5 |
4,5 |
|
Твердость, HRC HB |
30 — |
29 — |
27 — |
28 — |
24 — |
27 — |
— 210 |
23 — |
20 — |
|
Коэффициент теплового расширения, 1х10-6/к |
— |
4,62 |
4,60 |
4,50 |
5,60 |
— |
5,60 |
4,40 |
5,60 |
|
Электрическая проводимость, % проводимости чистой меди |
— |
10 |
13 |
17 |
17 |
— |
19 |
42 |
45 |
|
Теплопроводность, Вт/(мК) |
— |
80 |
93 |
95 |
120 |
— |
110 |
198 |
235 |
Примечание:
Представленные в таблице величины являются типовыми, справочными и не подлежат использованию в технических условиях в полном объеме.
ТЕМПЕРАТУРА ПЛАВЛЕНИЯ УГЛЕРОДИСТОЙ И НЕРЖАВЕЮЩЕЙ СТАЛИ! – Общие технические знания
Дата: 5 января 2019 г. Автор: Тхань Нгуен Ле 2 комментария
Температура плавления – это температура , при которой вещество переходит из твердого состояния в жидкое.
Температуры плавления некоторых металлов и сплавов:
| Металл | Точка плавления | |
|---|---|---|
| ( или С) | ( или F) | |
| Адмиралтейская латунь | 900 – 940 | 1650 – 1720 |
| Алюминий | 660 | 1220 |
| Алюминиевый сплав | 463 – 671 | 865 – 1240 |
| Алюминий Бронза | 1027 – 1038 | 1881 – 1900 |
| Сурьма | 630 | 1170 |
| Баббит | 249 | 480 |
| Бериллий | 1285 | 2345 |
| Бериллиевая медь | 865 – 955 | 1587 – 1750 |
| Висмут | 271,4 | 520,5 |
| Латунь, красный | 1000 | 1832 |
| Латунь, желтая | 930 | 1710 |
| Кадмий | 321 | 610 |
| Хром | 1860 | 3380 |
| Кобальт | 1495 | 2723 |
| Медь | 1084 | 1983 |
| Мельхиор | 1170 – 1240 | 2140 – 2260 |
| Золото, чистое 24K | 1063 | 1945 |
| Хастеллой С | 1320 – 1350 | 2410 – 2460 |
| Инконель | 1390 – 1425 | 2540 – 2600 |
| Инколой | 1390 – 1425 | 2540 – 2600 |
| Иридий | 2450 | 4440 |
| Железо, кованое | 1482 – 1593 | 2700 – 2900 |
| Чугун, серое литье | 1127 – 1204 | 2060 – 2200 |
| Чугун, ковкий | 1149 | 2100 |
| Свинец | 327,5 | 621 |
| Магний | 650 | 1200 |
| Магниевый сплав | 349 – 649 | 660 – 1200 |
| Марганец | 1244 | 2271 |
| Марганцевая бронза | 865 – 890 | 1590 – 1630 |
| Меркурий | -38,86 | -37,95 |
| Молибден | 2620 | 4750 |
| Монель | 1300 – 1350 | 2370 – 2460 |
| Никель | 1453 | 2647 |
| Ниобий (Колумбий) | 2470 | 4473 |
| Осмий | 3025 | 5477 |
| Палладий | 1555 | 2831 |
| Фосфор | 44 | 111 |
| Платина | 1770 | 3220 |
| Плутоний | 640 | 1180 |
| Калий | 63,3 | 146 |
| Красная латунь | 990 – 1025 | 1810 – 1880 |
| Рений | 3186 | 5767 |
| Родий | 1965 | 3569 |
| Рутений | 2482 | 4500 |
| Селен | 217 | 423 |
| Кремний | 1411 | 2572 |
| Серебро, Монета | 879 | 1615 |
| Серебро, чистое | 961 | 1761 |
| Серебро, Стерлинг | 893 | 1640 |
| Натрий | 97,83 | 208 |
| Сталь, углерод | 1425 – 1540 | 2600 – 2800 |
| Сталь, нержавеющая сталь | 1510 | 2750 |
| Тантал | 2980 | 5400 |
| Торий | 1750 | 3180 |
| Олово | 232 | 449,4 |
| Титан | 1670 | 3040 |
| Вольфрам | 3400 | 6150 |
| Уран | 1132 | 2070 |
| Ванадий | 1900 | 3450 |
| Желтая латунь | 905 – 932 | 1660 – 1710 |
| Цинк | 419,5 | 787 |
| Цирконий | 1854 | 3369 |
Цвета закалки стали:
Диапазоны температур плавления для нержавеющих сталей:
Нержавеющие стали являются сплавами и, следовательно, плавятся и замерзают не при фиксированной температуре, как металлические элементы, а в диапазоне температур, зависящем от химический состав стали.
Легирующие добавки также подавляют (снижают) диапазон плавления. Чистое железо (Fe) имеет фиксированную температуру плавления 1535°C, хром (Cr) 1890°C и никель (Ni) 1453°C по сравнению с диапазоном 1400-1450°C для нержавеющей стали типа 304.
| Диапазон плавления | Марки стали |
| 13:25-14:00 | 1,4547 (254SMO) 1 |
| 1370-1480 | 440А, 1.4125 (440С) |
| 1375-1400 | 1.4401 (316), 1.4404) 316L |
| 1385-1445 | 1.4462 (2205) 1 |
| 14:00-14:20 | 1.4310 (301) |
| 14:00-1425 | 1.4886 (330), 1.4541 (321), 1.4550 (347) |
| 14:00-1440 | 1.4542 (17-4PH) |
| 14:00-14:50 | 1.4372 (201), 1.4301 (304), 1.4307 (304L), 1.4303 (305), 1. 4833 (309), 1.4845 (310) 4833 (309), 1.4845 (310) |
| 1425-1510 | 430, 446 |
| 1450-1510 | 420 |
| 1480-1530 | 409, 410, 416, |
Максимальные рабочие температуры на воздухе для нержавеющих сталей:
+ Типы аустенитной нержавеющей стали
См. таблицу ниже:
+ Ферритные, дуплексные и мартенситные типы нержавеющей стали
более низкие температуры, поскольку они имеют более низкую прочность при повышенных температурах, чем аустенитные типы.
Дуплексные нержавеющие стали также могут быть склонны к охрупчиванию, поэтому, несмотря на содержание в них хрома, можно предположить, что они могут быть пригодными для эксплуатации при повышенных температурах. Это семейство сталей ограничено европейским стандартом для сосудов под давлением EN 10028-7 максимальной температурой 250°C. их температура термической обработки при отпуске превышена, что ограничивает их пригодность для работы при повышенных температурах.
304 | 870 | 925 |
309 | 980 | 1095 |
310 | 1035 | 1150 |
316 | 870 | 925 |
321 | 870 | 925 |
410 | 815 | 705 |
416 | 760 | 675 |
420 | 735 | 620 |
430 | 870 | 815 |
2111HTR | 1150 | 1150 |
Сводка максимальных рабочих температур:
| Марка | Основные легирующие элементы (%) | Макс.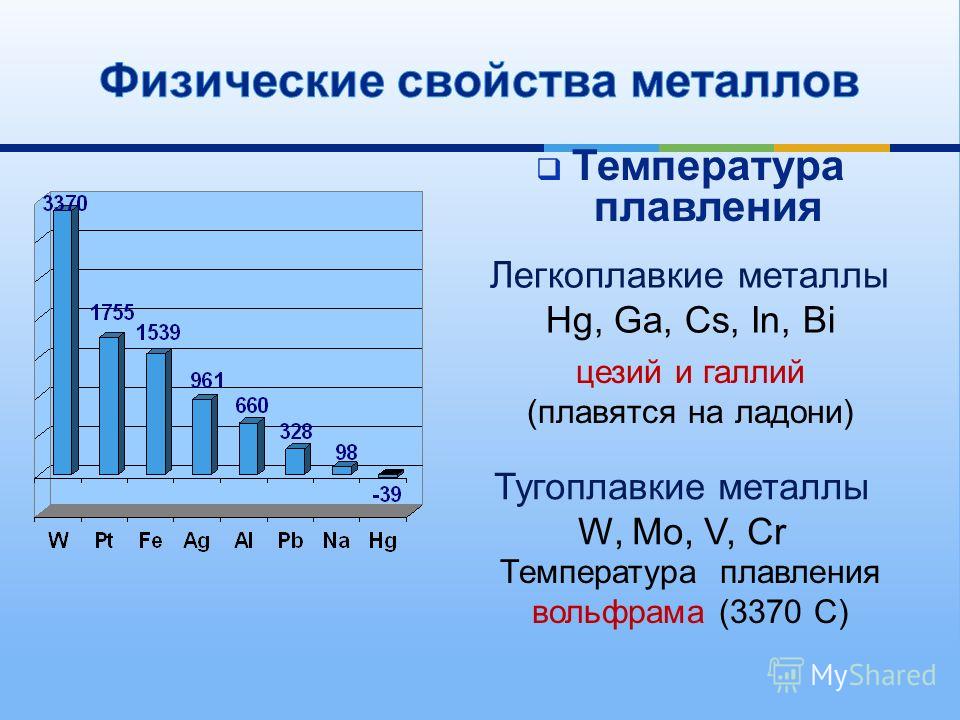 Сервис Темп. (степень С) Сервис Темп. (степень С) | Источник | ||
|---|---|---|---|---|---|
| AISI | ЕН | Кр | Другие | . | . |
| Ферритные типы | . | . | . | . | |
| 405 | 1.4002 | 12 | 0,2 Ал | 815 | АСМ |
| . | 1.4724 | 12 | 1,0 Ал | 850 | ЕН 10095 |
| 430 | 1.4016 | 17 | . | 870 | АСМ |
| . | 1.4742 | 17 | 1,0 Ал | 1000 | ЕН 10095 |
| . | . | . | . | . | . |
| 446 | 1.4749 | 26 | 0,15-0,20 С, 0,2 Н | 1100 | ЕН 10095 |
| Аустенитные типы | . | . | . | . | |
| 304 | 1.4301 | 18 | 8 Ni | 870 | АСМ |
| 321 | 1.4541 | 18 | 9 Ni | 870 | АСМ |
| . | 1.4878 | 18 | 9 Ni | 850 | ЕН 10095 |
| 316 | 1.4401 | 17 | 11 Ni, 2 Мо | 870 | АСМ |
| 309 | 1.4833 | 22 | 12 Ni | 1000 | ЕН 10095 |
| 310 | 1.4845 | 25 | 20 Ni | 1050 | ЕН 10095 |
| . | 1.4835 | 20 | 10 Ni, 1,5 Si, 0,15 N, 0,04 Ce | 1150 | ЕН 10095 |
| 330 | 1.4886 | 18 | 34 Ni, 1,0 Si | 1100 | ЕН 10095 |
Документ для справки:
+ https://www. engineeringtoolbox.com/melting-temperature-metals-d_860.html
engineeringtoolbox.com/melting-temperature-metals-d_860.html
+ https://www.bssa.org.uk/topics. php?article=103
Нравится:
Нравится Загрузка…
Новая теория объясняет, как металлы плавятся и замерзают
Компьютерная модель дает представление о том, что происходит в момент плавления металла. Атомы справа на изображении расположены в кристаллической решетке, а слева они растворились в жидкости. (Иллюстрация: Ульф Р. Педерсен)
Физики обнаружили, как работает процесс плавления при экстремальных давлениях, таких как те, что находятся внутри ядра Земли.
Хенрик Бендикс
Ученые разработали новую теорию замерзания и плавления таких металлов, как железо или медь.
Новые результаты опубликованы онлайн в научном журнале Nature Communications.
Ученые, стоящие за новым исследованием, надеются, что теория приблизит их к пониманию того, как металлы развиваются под экстремальным давлением внутри Земли и как жидкие металлы затвердевают, отдавая тепло окружающей среде и охлаждаясь.
Температура плавления увеличивается с давлением
Новые результаты показывают, как температура плавления вещества — точка плавления — изменяется при более высоком давлении.
Новая модель описывает, как кристалл превращается в жидкость при различных давлениях. Предсказания модели соответствуют фактическим наблюдениям. (Иллюстрация: Ульф Педерсен)
«Температура плавления обычно увеличивается, когда мы увеличиваем давление. Например, железо плавится при температуре 1538 градусов по Цельсию при давлении в одну атмосферу. Но при высоком давлении ядра Земли железо сначала плавится при температуре более 5000 градусов», — говорит ведущий автор Ульф Рорбек Педерсен из Университета Роскилле, Дания.
«Вопрос в том, как меняются явления таяния и замерзания при повышении давления. Интересным предположением является теория Линдеманна 1910 года», — говорит Педерсен.
Когда вы нагреваете кристалл, молекулы начинают двигаться, поскольку они вибрируют вокруг своих положений внутри кристалла. Линдеманн предполагает, что в какой-то момент вибрации становятся настолько сильными, что кристалл просто разрушается и плавится.
«Теперь мы впервые можем понять, насколько сильными должны быть вибрации, прежде чем кристалл расплавится, и это зависит от давления, что противоречит тому, что думал Линдеманн», — говорит Педерсен.
Теперь физики могут предсказать, как быстро расплавится жидкость при достижении точки плавления и, наоборот, как быстро организуются атомы, когда вещество начнет кристаллизоваться.
Подробнее: Прорыв в физике может привести к новому взгляду на магнетизм
Взгляд на то, как долго экзопланеты сохраняют тепло
Теперь физики могут начать отвечать на такие ключевые вопросы, как: почему металл плавится и замерзает при определенном давлении? Затем они могут рассчитать, как этот процесс меняется в разных условиях, например, при экстремальных давлениях.
«Я надеюсь, что нашу теорию можно будет использовать для моделирования экстремальных условий, которые встречаются в центре Земли и на других планетах, включая экзопланеты», — говорит Педерсен.
«Теория может сказать нам, как быстро растут внутренние кристаллы, что упрощает расчет времени, необходимого для остывания планеты», — говорит он.
Новые результаты могут показать, как долго экзопланеты — планеты, вращающиеся вокруг звезд, отличных от Солнца, — могут оставаться теплыми достаточно долго, чтобы поддерживать жидкую воду на своей поверхности и, следовательно, жизнь.
Подробнее: Новое открытие: малые планеты имеют круговые орбиты
————-
Прочтите датскую версию этой статьи на Videnskab.dk
Перевод: Кэтрин Джекс
Научные ссылки
- Термодинамика замерзания и плавления. Nature Communications, 17/8 2016, DOI: 10.1038/ncomms12386
Внешние ссылки
- Ulf Rørbæk Pedersen
Связанный контент
Новое открытие: малые планеты имеют круговые орбиты
Ученые разрабатывают новый метод измерения орбит планет.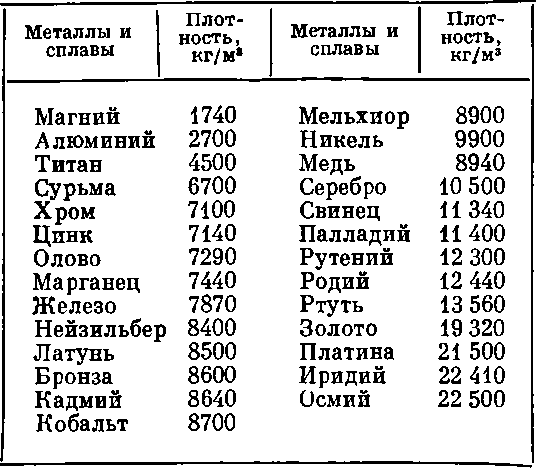 Это может дать важные подсказки о том, как сформировались планеты и есть ли на них потенциал для жизни.
Это может дать важные подсказки о том, как сформировались планеты и есть ли на них потенциал для жизни.
2012 г.: Планета X движется по курсу столкновения с Землей?
Согласно интернет-группам, которые считают, что в 2012 году Земля столкнется с Планетой X, также известной как Нибиру, приближается конец света. Но астрономы говорят, что ничто не указывает на то, что конец света не за горами.
НАСА обнаружило самую маленькую планету в истории
Космический телескоп НАСА «Кеплер» обнаружил самую маленькую из всех известных планет за пределами нашей Солнечной системы. Он такой же маленький, как наша собственная Луна.
Познакомьтесь с планетой-близнецом Земли
Все взгляды и все телескопы устремлены на недавно открытую планету, поразительно похожую на нашу.
Недавно открытая планетная система меняет наше представление о формировании планет
Новые данные миссии НАСА «Кеплер» открыли то, что считалось трудным: планетарная система, которая вращается вокруг двух звезд. Нам нужно изменить наши теории, говорит датский астроном.
физика videnskab.dk природные науки Дания
Какова температура плавления железа? Температура, цвет и свойства
Железо — самый распространенный элемент на Земле, даже больше, чем кислород. Он встречается в основном в земной коре, которую добывают и используют самыми разными способами, в том числе для оружия, мостов и зданий по всему миру.
Чтобы железо можно было превратить во что-то полезное, его нужно сначала расплавить. После расплавления элемент становится пластичным, и им легко манипулировать, когда кузнецы и мастера по металлу придают ему желаемую форму.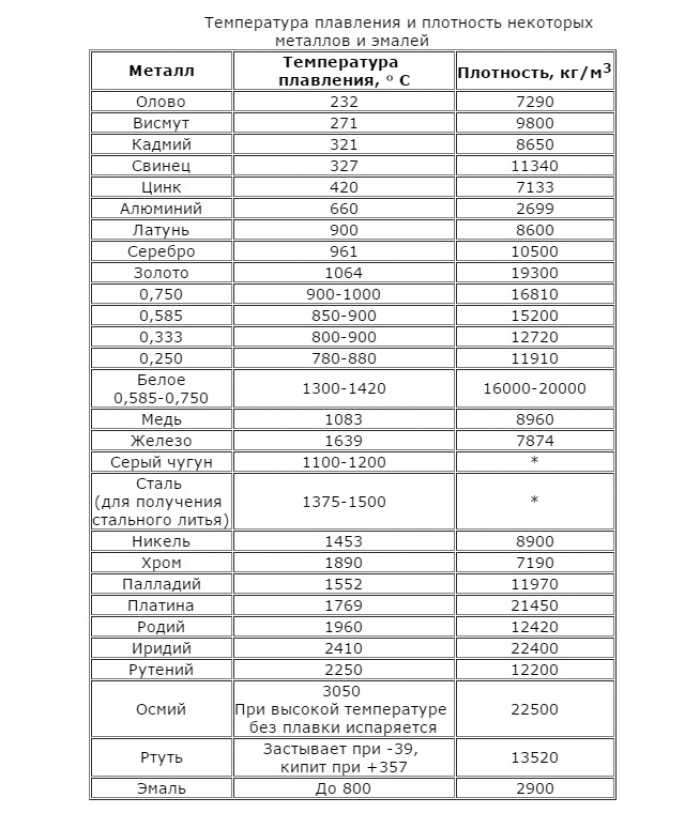
Железо — самый распространенный элемент на Земле, даже больше, чем кислород. Он встречается в основном в земной коре, которую добывают и используют самыми разными способами, в том числе для оружия, мостов и зданий по всему миру.
Чтобы железо можно было превратить во что-то полезное, его нужно сначала расплавить. После расплавления элемент становится пластичным, и им легко манипулировать, когда кузнецы и мастера по металлу придают ему желаемую форму.
Температура плавления железа 1583°C (2800°F) . Когда наука о металлургии была впервые разработана около 1200 г. до н.э. анатолийскими (современными турецкими) хеттами, они плавили свои «черные камни, которые плавятся», используя маленькие керамические тигли. Сегодня кузнецы и слесари плавят железо в горнах, работающих на пропане, газе, угле или древесном угле. После расплавления они придают железу форму, используя такие инструменты, как молотки, наковальни и долота.
Цвет является хорошим индикатором температуры железа и степени его плавления. При нагревании он окрашивается в разные цвета: красный, оранжевый, желтый, а затем белый. Лучшая температура для ковки обычно находится между оранжевым и желтым цветом, когда материал особенно яркий. Это называется «ковочное тепло».
При нагревании он окрашивается в разные цвета: красный, оранжевый, желтый, а затем белый. Лучшая температура для ковки обычно находится между оранжевым и желтым цветом, когда материал особенно яркий. Это называется «ковочное тепло».
Хотя плавление и плавка часто путают, это два разных процесса с уникальными целями. Железо плавится, чтобы превратить его в полезные вещи, а плавка — это способ извлечения неблагородного металла из руды, например серебра или меди. Плавка часто используется для производства чугуна, который затем может быть преобразован в гораздо более полезную сталь.
Железо является странным химическим веществом из-за того, как его атомы упорядочиваются при воздействии тепла. При обычной комнатной температуре его атомы находятся в неплотно упакованном открытом расположении. Когда тепло применяется после 912°C атомы становятся еще более плотно упакованными, что является странным явлением. Когда достигается 1394 °C, атомы снова разрыхляются, а затем, наконец, плавятся, когда температура достигает 1538 °C. Эта причудливость железа — одна из причин, по которой сталь такая прочная и крепкая.
Эта причудливость железа — одна из причин, по которой сталь такая прочная и крепкая.
Сталь — это сплав железа, который также используется в самых разных целях, в том числе для инструментов, автомобилей и других машин. Температура плавления стали составляет от 1371 до 1537°C (от 2500 до 2800°F). Как сплав железа и углерода, «примесь» углерода в железе является причиной более низкой температуры плавления. Это происходит с любым материалом, который имеет примесь, потому что добавленный химикат разрушает структуру связи и делает вещество менее энергетически выгодным, облегчая его плавление.
Property | |
Element | |
Atomic number | |
Atomic weight | 55. |
Период | |
D-блок | |
Температура плавления | 1,538°F |
Boiling point | 3,000°C (5,432°F) |
Specific gravity | 7. |
Oxidation states | +2, +3, +4, +6 |
Electron configuration | [Ar]3d64s2 |
Density (g cm−3) | |
Relative atomic mass | 55.845 |
Key isotopes | |
Electrons per shell | 2, 8, 14, 2 |
References
- Jessica Stoller -Конрад, 2015, Почему плавка железа такой странный процесс, Futurity
3.02: Физические и химические свойства
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 178121
Цели обучения
Для отделения физических свойств от химических.
Все вещества обладают физическими и химическими свойствами. Физические свойства — это характеристики, которые ученые могут измерить без изменения состава исследуемого образца, такие как масса, цвет и объем (объем пространства, занимаемый образцом). Химические свойства описывают характерную способность вещества реагировать с образованием новых веществ; они включают его воспламеняемость и подверженность коррозии. Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Физическое свойство
Физическое свойство — это характеристика вещества, которую можно наблюдать или измерять без изменения свойств вещества. Серебро — это блестящий металл, который очень хорошо проводит электричество. Из него можно формовать тонкие листы, это свойство называется ковкостью. Соль тусклая и ломкая и проводит электричество, когда она растворена в воде, что она делает довольно легко. Физические свойства вещества включают цвет, твердость, ковкость, растворимость, электропроводность, плотность, температуры плавления и температуры кипения.
Для элементов цвет не сильно отличается от одного элемента к другому. Подавляющее большинство элементов бесцветные, серебристые или серые. Некоторые элементы имеют отличительные цвета: сера и хлор — желтые, медь (разумеется) медного цвета, а элементарный бром — красный. Однако плотность может быть очень полезным параметром для идентификации элемента. Из материалов, существующих в твердом состоянии при комнатной температуре, йод имеет очень низкую плотность по сравнению с цинком, хромом и оловом. Золото имеет очень высокую плотность, как и платина. Чистая вода, например, имеет плотность 0,998 г/см 3 при 25°C. Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать».
Некоторые элементы имеют отличительные цвета: сера и хлор — желтые, медь (разумеется) медного цвета, а элементарный бром — красный. Однако плотность может быть очень полезным параметром для идентификации элемента. Из материалов, существующих в твердом состоянии при комнатной температуре, йод имеет очень низкую плотность по сравнению с цинком, хромом и оловом. Золото имеет очень высокую плотность, как и платина. Чистая вода, например, имеет плотность 0,998 г/см 3 при 25°C. Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать».
| Вещество | Плотность при 25°C (г/см3) |
|---|---|
| кровь | 1,035 |
| жировые отложения | 0,918 |
| цельное молоко | 1,030 |
| масло кукурузное | 0,922 |
| майонез | 0,910 |
| мед | 1.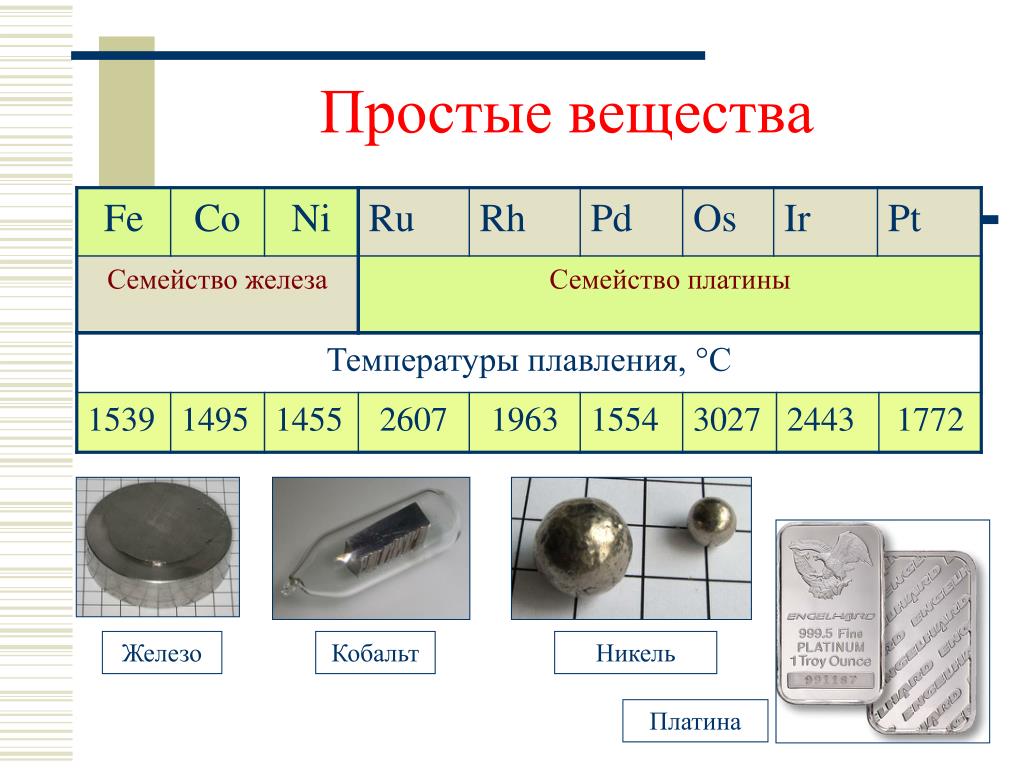 420 420 |
- Твердость помогает определить, как можно использовать элемент (особенно металл). Многие элементы довольно мягкие (например, серебро и золото), в то время как другие (например, титан, вольфрам и хром) намного тверже. Углерод — интересный пример твердости. В графите («грифеле» карандашей) углерод очень мягкий, в то время как углерод в алмазе примерно в семь раз твёрже.
Точки плавления и кипения являются уникальными идентификаторами, особенно для соединений. Помимо получения некоторого представления об идентичности соединения, можно получить важную информацию о чистоте материала.
Химические свойства
Химические свойства вещества описывает его «потенциал» подвергаться некоторым химическим изменениям или реакциям в силу своего состава. Какие элементы, электроны и связи присутствуют, чтобы дать потенциал для химических изменений. Довольно сложно определить химическое свойство, не используя слово «изменение». В конце концов вы сможете взглянуть на формулу соединения и указать некоторые химические свойства. В настоящее время это очень трудно сделать, и от вас не ожидается, что вы сможете это сделать. Например, водород может воспламениться и взорваться при определенных условиях — это химическое свойство. Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.
Какие элементы, электроны и связи присутствуют, чтобы дать потенциал для химических изменений. Довольно сложно определить химическое свойство, не используя слово «изменение». В конце концов вы сможете взглянуть на формулу соединения и указать некоторые химические свойства. В настоящее время это очень трудно сделать, и от вас не ожидается, что вы сможете это сделать. Например, водород может воспламениться и взорваться при определенных условиях — это химическое свойство. Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.
Химическое свойство железа заключается в том, что оно способно соединяться с кислородом с образованием оксида железа, химическое название ржавчины (Рисунок \(\PageIndex{2}\)).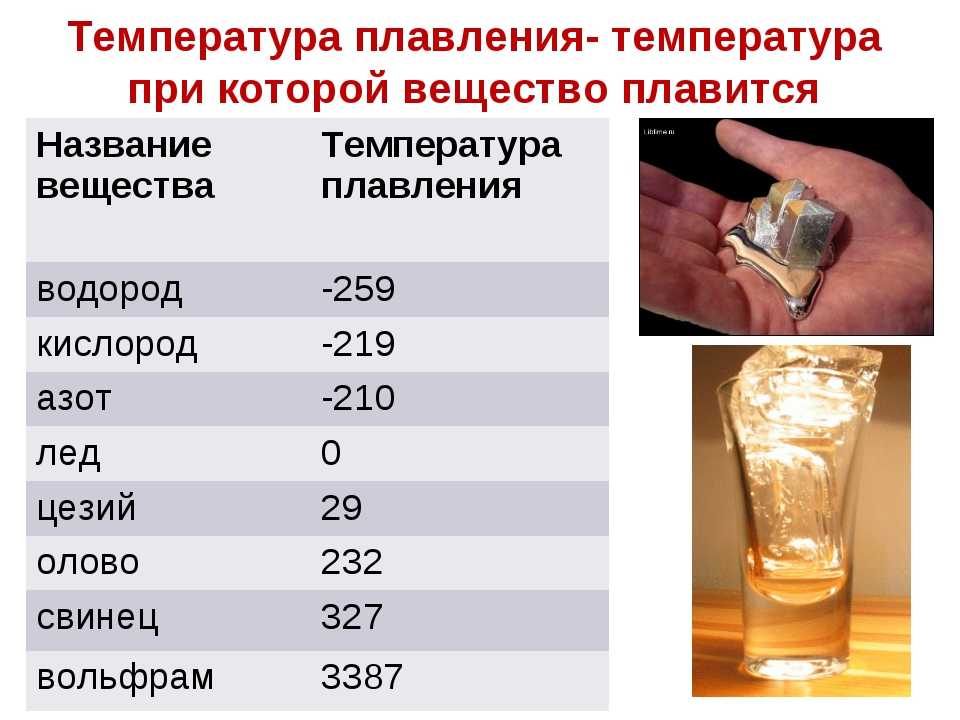 Более общим термином для ржавчины и других подобных процессов является коррозия. Другими терминами, которые обычно используются при описании химических изменений, являются горение, гниение, взрыв, разложение и брожение. Химические свойства очень полезны при идентификации веществ. Однако, в отличие от физических свойств, химические свойства можно наблюдать только тогда, когда вещество находится в процессе превращения в другое вещество.
Более общим термином для ржавчины и других подобных процессов является коррозия. Другими терминами, которые обычно используются при описании химических изменений, являются горение, гниение, взрыв, разложение и брожение. Химические свойства очень полезны при идентификации веществ. Однако, в отличие от физических свойств, химические свойства можно наблюдать только тогда, когда вещество находится в процессе превращения в другое вещество.
| Физическая собственность | Химические свойства |
|---|---|
| Металлический галлий плавится при 30 o C | Железный металл ржавеет. |
Ртуть — очень плотная жидкость. | Зеленый банан при созревании становится желтым. |
| Золото блестит. | Горит сухой лист бумаги. |
Пример \(\PageIndex{1}\)
Какое из следующих химических свойств железа?
- Железо корродирует во влажном воздухе
- Плотность = 7,874 г/см 3
- Железо в чистом виде мягкое.
- Железо плавится при 1808 К.
РАСТВОР
Железо разъедается на воздухе — единственное химическое свойство железа из списка.
Упражнение \(\PageIndex{1A}\)
Какое из перечисленных ниже физических свойств материи?
- коррозионная активность
- рН (кислотность)
- плотность
- воспламеняемость
- Ответ:
- в
Упражнение \(\PageIndex{1B}\)
Какое из следующих свойств является химическим?
- воспламеняемость
- температура плавления
- точка кипения
- плотность
- Ответ:
- и
Резюме
Физическое свойство – это характеристика вещества, которую можно наблюдать или измерять без изменения свойств вещества.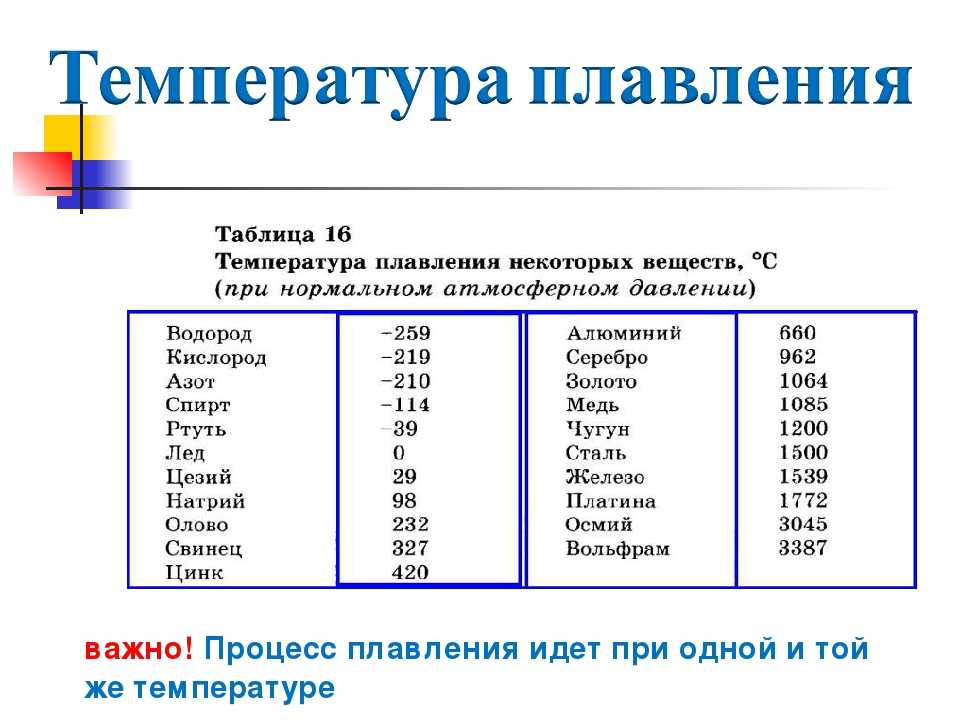 Физические свойства включают цвет, плотность, твердость, температуры плавления и кипения. Химическое свойство описывает способность вещества подвергаться определенному химическому изменению. Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.
Физические свойства включают цвет, плотность, твердость, температуры плавления и кипения. Химическое свойство описывает способность вещества подвергаться определенному химическому изменению. Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.
Авторы
Мариса Альвиар-Агню (Городской колледж Сакраменто)
Генри Агнью (Калифорнийский университет в Дэвисе)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- CC BY-NC-SA
- Показать страницу Оглавление
- № на стр.

- Теги
- химическая замена
- Химические свойства
- компаунд
- элемент
- гетерогенная смесь
- гомогенная смесь
- материя
- металл
- смеси
- неметалл
- фаза
- Физическое изменение
- Физические свойства
- полуметаллы
- источник-хим-156311
- источник-хим-171900
- источник-хим-177346
- источник-хим-177886
- источник-хим-64003
- состояние
- вещество
Теплопроводность алюминия, меди, железа и вольфрама при температуре от 1 К до температуры плавления (Технический отчет)
Теплопроводность алюминия, меди, железа и вольфрама при температуре от 1 К до точки плавления (Технический отчет) ) | ОСТИ.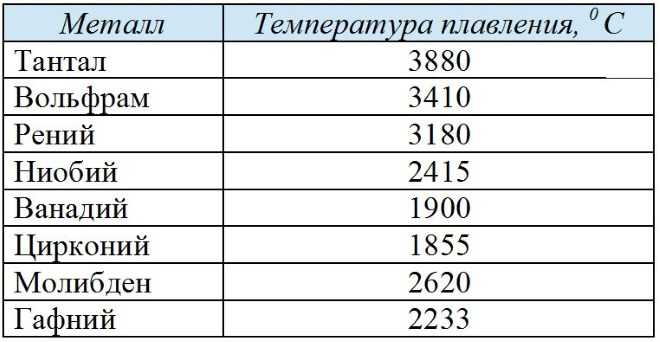 GOV
GOVперейти к основному содержанию
- Полная запись
- Другие родственные исследования
Данные по теплопроводности технически чистых образцов алюминия, меди, железа и вольфрама были собраны, закодированы, критически проанализированы и сопоставлены с аналитическими методами, основанными на теоретических и эмпирических уравнениях. Полученные функции представлены и использованы для построения таблиц и графиков зависимости теплопроводности от температуры и коэффициента остаточного удельного сопротивления (RRR). Прилагается аннотированная библиография ссылок. Обсуждаются изменения теплопроводности, вызванные химическими примесями, физическими дефектами, размерными эффектами и магнитными полями.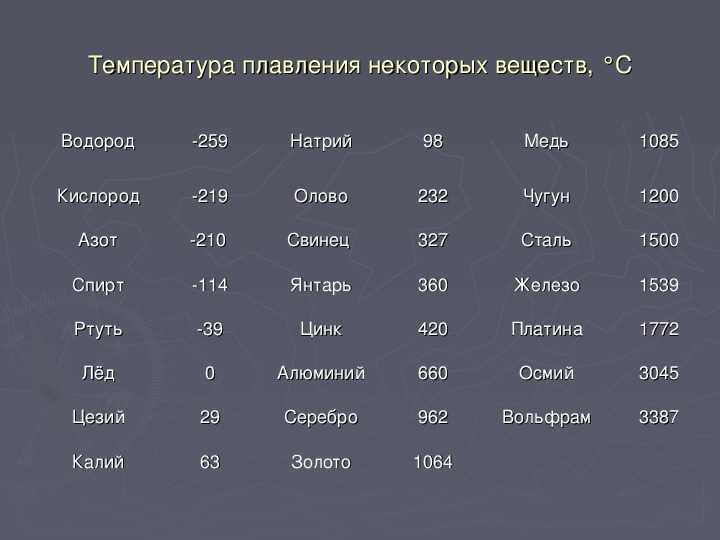 Сглаженные значения представлены для температур от 1 К до температуры, близкой к температуре плавления, и для большого диапазона значений RRR.
Сглаженные значения представлены для температур от 1 К до температуры, близкой к температуре плавления, и для большого диапазона значений RRR.
- Авторов:
- Хуст, Дж. Г.; Ланкфорд, А.Б.
- Дата публикации:
- Исследовательская организация:
- Национальное бюро стандартов, Боулдер, Колорадо (США). Отдел химических инженерных наук.
- Идентификатор ОСТИ:
- 6225458
- Номер(а) отчета:
- ПБ-84-235878; НБСИР-84/3007
- Тип ресурса:
- Технический отчет
- Страна публикации:
- США
- Язык:
- Английский
- Тема:
- 36 МАТЕРИАЛОВЕДЕНИЕ; АЛЮМИНИЙ; ТЕПЛОПРОВОДНОСТЬ; МЕДЬ; УТЮГ; ВОЛЬФРАМ; КРИОГЕНИКА; СОСТАВ ДАННЫХ; ДЕФЕКТЫ; ПРИМЕСИ; МАГНИТНЫЕ ПОЛЯ; РАЗМЕР; ТЕМПЕРАТУРНАЯ ЗАВИСИМОСТЬ; ДАННЫЕ; ЭЛЕМЕНТЫ; ИНФОРМАЦИЯ; МЕТАЛЛЫ; ЧИСЛЕННЫЕ ДАННЫЕ; ФИЗИЧЕСКИЕ СВОЙСТВА; ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА; ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ; 360104* – Металлы и сплавы – Физические свойства
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Hust, JG, and Lankford, AB. Теплопроводность алюминия, меди, железа и вольфрама при температурах от 1 K до точки плавления . США: Н. П., 1984.
Веб.
Теплопроводность алюминия, меди, железа и вольфрама при температурах от 1 K до точки плавления . США: Н. П., 1984.
Веб.
Копировать в буфер обмена
Hust, JG, & Lankford, AB. Теплопроводность алюминия, меди, железа и вольфрама при температурах от 1 K до точки плавления . Соединенные Штаты.
Копировать в буфер обмена
Хаст, Дж. Г., и Ланкфорд, А. Б., 1984.
«Теплопроводность алюминия, меди, железа и вольфрама при температурах от 1 К до точки плавления». Соединенные Штаты.
Копировать в буфер обмена
@статья{osti_6225458,
title = {Теплопроводность алюминия, меди, железа и вольфрама при температурах от 1 К до точки плавления},
автор = {Хаст, Дж. Г. и Ланкфорд, А. Б.},
Г. и Ланкфорд, А. Б.},
abstractNote = {Данные по теплопроводности технически чистых образцов алюминия, меди, железа и вольфрама были собраны, закодированы, критически проанализированы и сопоставлены с аналитическими методами, основанными на теоретических и эмпирических уравнениях. Полученные функции представлены и использованы для построения таблиц и графиков зависимости теплопроводности от температуры и коэффициента остаточного удельного сопротивления (RRR). Прилагается аннотированная библиография ссылок. Обсуждаются изменения теплопроводности, вызванные химическими примесями, физическими дефектами, размерными эффектами и магнитными полями. Сглаженные значения представлены для температур от 1 К до температуры, близкой к температуре плавления, и для большого диапазона значений RRR.},
дои = {},
URL-адрес = {https://www.osti.gov/biblio/6225458},
журнал = {},
номер =,
объем = ,
место = {США},
год = {1984},
месяц = {6}
}
Копировать в буфер обмена
Дополнительную информацию о получении полнотекстового документа см. в разделе «Доступность документа». Постоянные посетители библиотек могут искать в WorldCat библиотеки, в которых может храниться этот предмет. Имейте в виду, что многие технические отчеты не каталогизированы в WorldCat.
в разделе «Доступность документа». Постоянные посетители библиотек могут искать в WorldCat библиотеки, в которых может храниться этот предмет. Имейте в виду, что многие технические отчеты не каталогизированы в WorldCat.
Экспорт метаданных
Сохранить в моей библиотеке
Вы должны войти в систему или создать учетную запись, чтобы сохранять документы в своей библиотеке.
Аналогичных записей в сборниках OSTI.GOV:
- Аналогичные записи
Древняя металлургия Обзор для студентов колледжей
Иордания: древняя металлургия Перейти на главную страницу сайта,
страница ресурсов для учащихся.
Содержимое создано: 31 октября 2001 г.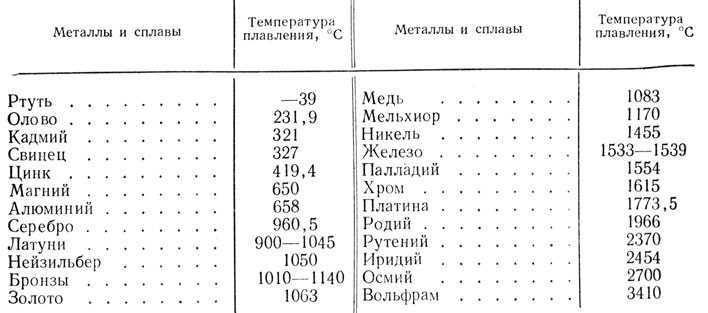 , изменено 15 апреля 2014 г.
, изменено 15 апреля 2014 г.
Последнее изменение файла:
связанные страницы: Древняя ткань, Основные каменные инструменты
Металлургия — это процесс обработки металла в артефакты (инструменты и игрушки). Хотя небольшое количество металлов находится в относительно чистой форме, большинство из них необходимо извлекать из более сложных руд путем удаления «примесей» (неметаллов или других металлов) из смешанной руды.
Конечно, можно растирать металлическую руду и откалывать куски, и некоторые очень ранние инструменты из «колотого камня» действительно были сделаны из колотой руды. Также можно слегка изменить форму необработанной руды путем растирания — в зависимости от твердости сплава — и результат иногда можно использовать в качестве инструмента. Однако металлические руды, обработанные таким образом, никогда не имели большого значения в истории человечества. (Например, по сравнению с измельченным обсидианом, измельченная железная руда представляет собой гораздо менее полезный инструмент. ) Вместо этого пригодные для использования металлические инструменты включают в себя нагрев и/или ковку металла, чтобы превратить его во что-то пригодное для использования.
) Вместо этого пригодные для использования металлические инструменты включают в себя нагрев и/или ковку металла, чтобы превратить его во что-то пригодное для использования.
Структура страницы:
|
|
Вернуться наверх.
Материалы: Медь
Медный самородок весом 2492 кг (5495 фунтов), найденный в 1936 году во время добычи полезных ископаемых в горах Врангеля, примерно в 300 милях к востоку от Анкориджа. Крайне редко можно найти самородок меди такого размера или такой чистоты.
Крайне редко можно найти самородок меди такого размера или такой чистоты.
Музей Севера, Фэрбенкс
Медь (сокращенно Cu) — относительно мягкий металлический элемент розовато-красноватого цвета. Технически это скорее «переходный элемент», чем металл, хотя в историческом контексте его удобно рассматривать как металл. Одним из наиболее распространенных карбонатов меди является малахит, который использовался в древности как поделочный камень.
Медь обычно устойчива к коррозии. Но когда он подвергается воздействию воздуха, открытая поверхность окисляется, изменяя красно-розовый цвет, или взаимодействует с окружающей серой, образуя тонкую «патину» сине-зеленого сульфата меди.
Медь редко встречается полностью несмешанной с другим материалом. (Нажмите на меня.) Но, тем не менее, это иногда встречается в почти чистых самородках. Как и другие металлы, он иногда появляется в контексте палеолита, когда люди пытались обрабатывать его с помощью техники раскалывания камня. Однако он не был обработан как металл до 6000-5000 лет до нашей эры. Первое использование было для бус и других украшений, так как медь сама по себе слишком мягкая для изготовления многих полезных инструментов.
Однако он не был обработан как металл до 6000-5000 лет до нашей эры. Первое использование было для бус и других украшений, так как медь сама по себе слишком мягкая для изготовления многих полезных инструментов.
Поскольку медь добывается в шахте, она, как и другие добываемые металлы, довольно нечистая.
Частная коллекция
Несмотря на это ограничение, медь стала использоваться все шире и шире, и археологи, особенно работающие на Ближнем Востоке, иногда говорят о медном веке или периоде «халколита» (кал-ко-ЛИТ-ик) примерно с 5000 до н.э. 3000 г. до н.э. в этом регионе, или с конца неолита до начала бронзового века. (Другие предпочитают термин «энеолит» для этого периода.) (Очевидно, что не все части мира жили по одному и тому же графику или даже использовали достаточное количество меди, чтобы такой термин, как «энеолитический период», имел какой-либо смысл.)
В знак того, насколько важной стала торговля медью, латинское слово Cuprum, «медь», по-видимому, первоначально было названием острова Кипр, известного своей добычей меди, примерно так же, как английский термин «китай» происходит от названия страны, которая дала миру особенно изысканную керамику.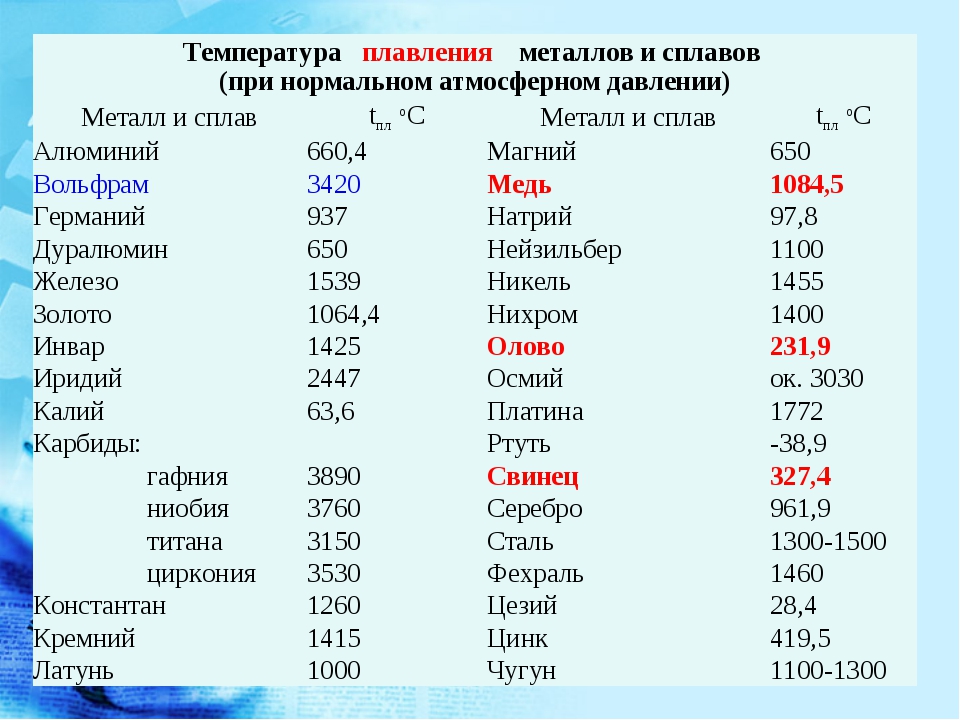
Поперечное сечение куска медной руды, показывающее высокую примесь другого материала.
Частная коллекция
Как уже отмечалось, медная руда, хотя и встречается во многих регионах, редко бывает чистой. (А большие самородки, подобные показанному здесь, очень редки.) Поэтому от него мало пользы, пока он не будет вытащен из запутанного в другом материале. Медь плавится при температуре около 1083°C (1981°F). Когда древние гончары экспериментировали с воздействием более высоких температур на керамику, они также начали разрабатывать методы, которые могли бы создавать достаточно высокую температуру, чтобы медь могла расплавиться в достаточной степени, чтобы ее можно было отделить от других материалов, с которыми она была найдена. (См. ниже, плавка.)
Вероятно, раньше было замечено, что в некоторых случаях небольшие примеси некоторых других материалов упрочняют медные изделия или облегчают обработку металла, и встречаются различные сплавы, некоторые из которых, возможно, были преднамеренными. Действительно, различие между артефактами из нечистой меди и ранними бронзовыми не всегда сразу бросается в глаза.
Действительно, различие между артефактами из нечистой меди и ранними бронзовыми не всегда сразу бросается в глаза.
Вернуться наверх.
Материалы: Бронза
Из-за высокого содержания меди бронза, обычно красноватого цвета, постепенно покрывается сине-зеленой патиной по мере того, как поверхность взаимодействует с кислородом и другими элементами в воздухе. Нестабильную патину часто можно стереть или стереть, и поэтому она может быть неровной, как показано на этой китайской бронзовой фигуре XX века. Рисунок 9.0575 Частная коллекция
Безусловно, в древности предпочтительным медным сплавом и сплавом была бронза. Бронза представляет собой комбинацию меди и олова, обычно примерно восемь или девять частей меди на одну часть олова. В некоторых случаях были добавлены дополнительные элементы. Как уже отмечалось, медь сама по себе является довольно мягким металлом и лишь незначительно пригодна для изготовления инструментов.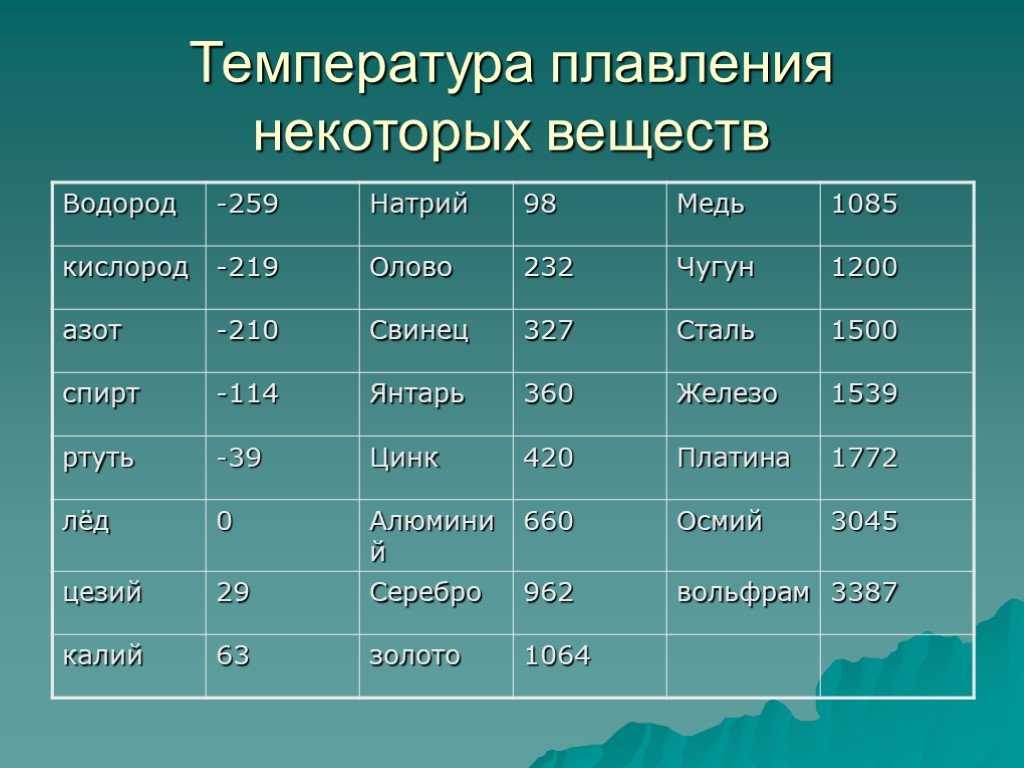 Итак, если на то пошло, это жесть. Но введение олова в медь обеспечивает большую твердость, чем у любого из металлов по отдельности, а также облегчает литье.
Итак, если на то пошло, это жесть. Но введение олова в медь обеспечивает большую твердость, чем у любого из металлов по отдельности, а также облегчает литье.
Увеличение количества олова в сплаве намного выше 10% приводит к большей хрупкости, и изготовленные таким образом инструменты легко ломаются. Однако сплавы с большим содержанием олова — потин (до 20 % олова) и спекулум (более 30 % олова) — использовались в некоторых частях Европы для изготовления ранних монет, поскольку в случае с монетами острота не представляла серьезной проблемы.
Медь встречается во многих местах мира, хотя и не повсеместно. Олово, напротив, встречается довольно редко. Таким образом, производство бронзы зависит от удачного местоположения и/или успешной торговли, и в древнем мире она всегда была предметом роскоши, даже когда из нее делали «полезные» продукты. Таким образом, контроль над медными и оловянными рудниками и связанными с ними торговыми путями стал важен для богатства и престижа многих народов, а когда широкое распространение получило бронзовое оружие, он также стал важен для их безопасности.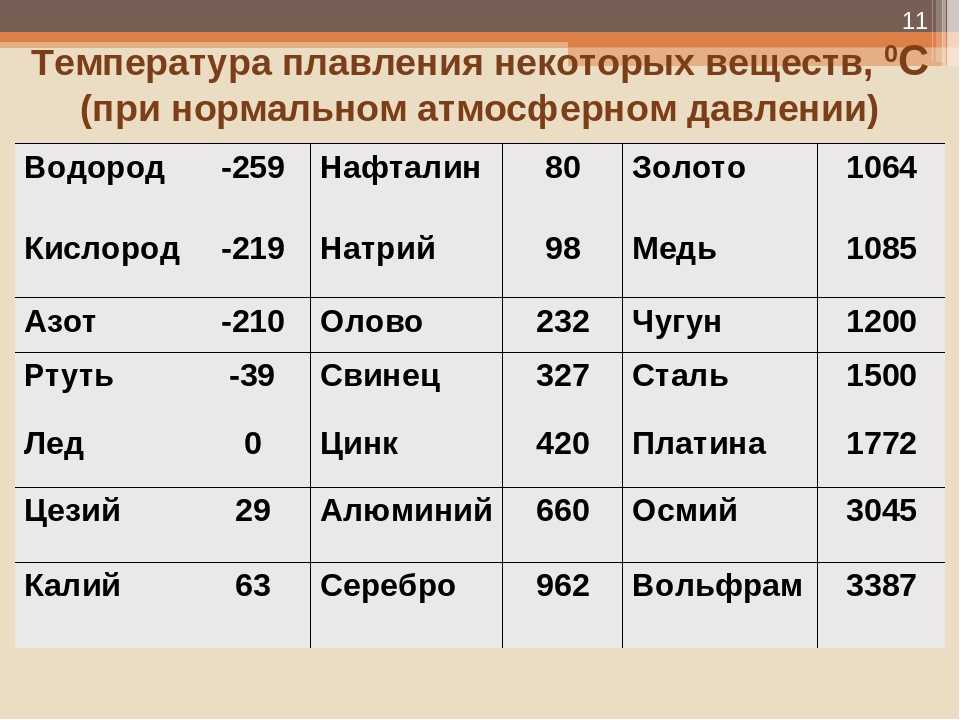
Бронза предпочтительна для общественных скульптур, но не является нерушимой. Окисленная медная патина не только зеленеет, но и может переноситься дождевыми стоками и даже окрашивать каменную основу.
Сурьмяная бронза
Простая бронза, сделанная только из олова и меди, обычно не дает острой кромки (хотя ее можно заточить ударом). Введение сурьмы в дополнение к олову и меди дает более твердую бронзу, которая лучше удерживает режущую кромку и с меньшей вероятностью изгибается при использовании.
Мышьяковая бронза
Как и сурьма, мышьяк, добавленный в олово и медь (до 3% от общего количества), дает более твердый конечный продукт. В любом случае мышьяк довольно часто встречается в виде примеси в ранней бронзе, и небольшие его количества, вероятно, не были преднамеренными или особенно заметными в конечном продукте. Однако к тому времени, когда доля мышьяка в бронзе достигает двух-трех процентов, эффекты становятся вполне заметными и предположительно преднамеренными.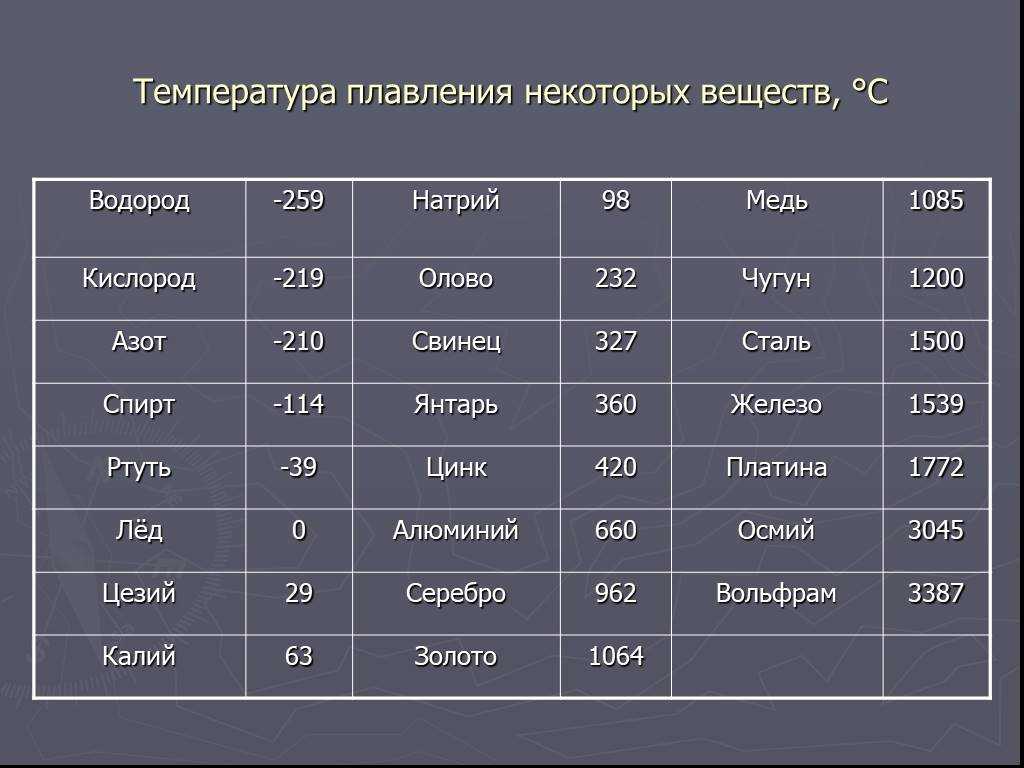 Именно к этим изделиям обычно применяется термин «мышьяковая бронза».
Именно к этим изделиям обычно применяется термин «мышьяковая бронза».
Свинцовая бронза
Смешивание свинца с медно-оловянным сплавом дает «свинцовую бронзу», которая может содержать до 10% свинца. Свинец в сплаве не становится частью его кристаллической структуры, увеличивая текучесть соединения, когда оно находится в расплавленном состоянии. Это облегчает отливку , особенно отливку мелкодетализированных художественных объектов. Однако свинцовая бронза мягче обычной бронзы и, следовательно, менее способна удерживать режущую кромку, что делает ее менее подходящей для многих типов инструментов.
Бронзовый век
Термин «Бронзовый век» относится к тем периодам во всем мире, когда бронза широко использовалась. Конкретные даты, конечно, варьируются от региона к региону, а также варьируются в зависимости от жесткости определения «общего использования». Считается, что бронзовый век в любом данном месте закончился, когда обобщение железа привело к началу железного века, столь же проблематичного термина.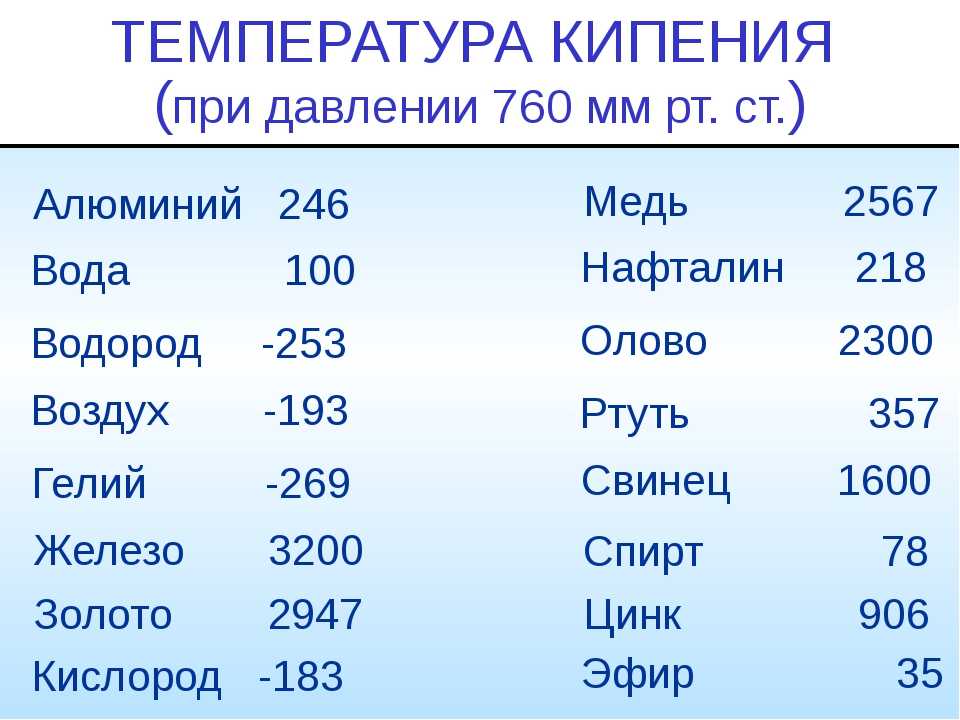
Латунь
Латунь представляет собой сплав меди с цинком и обычно состоит из от десяти до сорока процентов цинка. Из небольших количеств других руд производят латунь специального назначения. (Например, олово и алюминий повышают устойчивость к коррозии.) Цинковую руду (называемую каламином) трудно смешать с медной рудой, однако латунь появляется в археологических записях позже, а также встречается гораздо реже, чем бронза.
Вернуться к началу.
Материалы: железо и сталь
Железо — один из самых распространенных (и самых дешевых) металлических элементов на планете. Фактически по весу он составляет около 5% земной коры, где встречается в виде ряда малопримесных «железных руд»: гематита, лимонита, магнетита и др.
Только около 1200 г. до н.э. железо стало основным материалом для производства инструментов, потому что температуры, необходимые для обработки руды, превышали самые древние.1942 г. смогли достичь печи.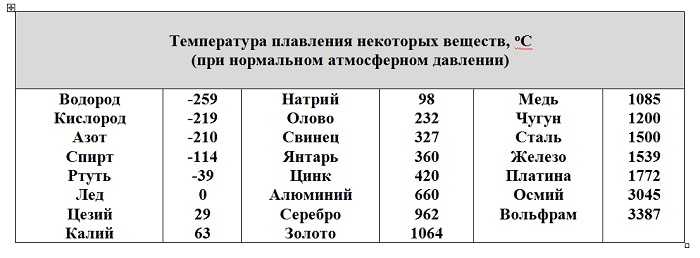 Чистое железо имеет температуру плавления 1535°С. Предел древней печи был около 1150°C. (Вспомним, для сравнения, что медь имеет температуру плавления 1083 °C. Древние печи для обжига глины иногда также достигали температуры в этом диапазоне, но редко превышали ее.)
Чистое железо имеет температуру плавления 1535°С. Предел древней печи был около 1150°C. (Вспомним, для сравнения, что медь имеет температуру плавления 1083 °C. Древние печи для обжига глины иногда также достигали температуры в этом диапазоне, но редко превышали ее.)
В конце концов было обнаружено, что введение в смесь трех-четырех процентов углерода может иногда понизить температуру плавления (в конечном счете до 1150°, т. е. как раз на пределе печи). К сожалению, углерод также имеет тенденцию способствовать хрупкости получаемых продуктов. Поэтому контролируемое введение углерода в железную руду остается критически важным аспектом производства чугуна и стали. (Углерод не используется в производстве бронзы.)
Однако Carbon был не единственной технологической инновацией. Конструкция печи и топливо были важны для достижения необходимых температур. Твердые породы, например, из Центральной Африки, горят сильнее, чем мягкие породы. (Это, вероятно, является причиной особенно широкого распространения железа в некоторых районах Африки.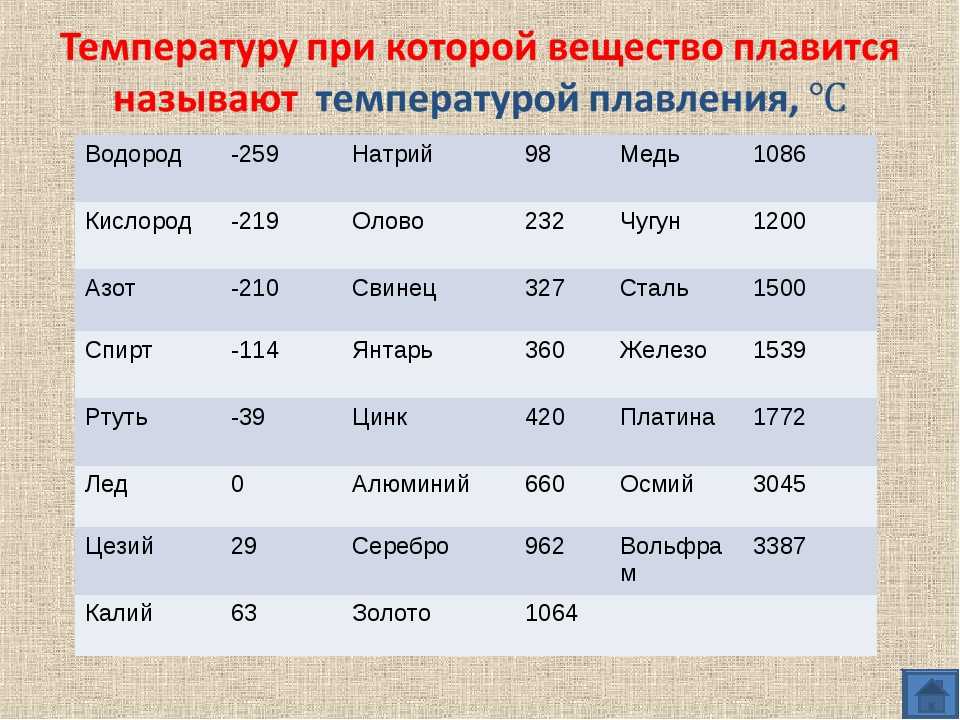 ) Кроме того, использование древесного угля вместо дров позволило получить еще более горячий огонь. То же самое произошло и с открытием угля в качестве топлива. Точно так же использование мехов для нагнетания воздуха в печь приводило к более быстрому горению и более быстрому выделению тепла за счет увеличения количества кислорода, доступного для огня.
) Кроме того, использование древесного угля вместо дров позволило получить еще более горячий огонь. То же самое произошло и с открытием угля в качестве топлива. Точно так же использование мехов для нагнетания воздуха в печь приводило к более быстрому горению и более быстрому выделению тепла за счет увеличения количества кислорода, доступного для огня.
Железный котел XIX века с железной подставкой из Уэльса. Практически идентичные предметы были распространены по всей Северной Европе и Северной Америке.
Музей жизни Уэльса, Кардифф
Безуглеродистое железо, разогретое до максимума древних печей, еще не достигнув температуры плавления, можно было растолочь (ковать) для очистки и придания ему формы даже без примеси углерода. Железо, обработанное таким образом и содержащее лишь незначительное количество углерода, называется «кованым железом», и его производство требует значительных затрат времени. С другой стороны, железо с высоким содержанием углерода и, как следствие, с более низкой температурой плавления можно плавить и формовать, и оно называется «чугун». В Европе успешное литье чугуна датируется примерно 1300-ми годами нашей эры. Однако в Китае чугунное литье датируется 500-ми годами до нашей эры, когда чугун начали использовать для производства сельскохозяйственных орудий.
В Европе успешное литье чугуна датируется примерно 1300-ми годами нашей эры. Однако в Китае чугунное литье датируется 500-ми годами до нашей эры, когда чугун начали использовать для производства сельскохозяйственных орудий.
Даже после того, как технология была известна, производство железа было непростым и могло легко выйти из строя, если руда была недостаточно пористой, или если было слишком много доступного кислорода, или если куски древесного угля, используемые для введения углерода, были слишком большими. Важно помнить, что на протяжении всей истории больше групп знали о железе и ценили его, чем могли производить или обрабатывать его. (Нажмите на меня.)
Термин «Железный век» относится к тем периодам во всем мире, когда железо стало широко использоваться. Конкретные даты, конечно, варьируются от региона к региону, а также жесткость определения «общего использования». Одна дата, которую иногда называют самым ранним производством железа, — около 2000 г.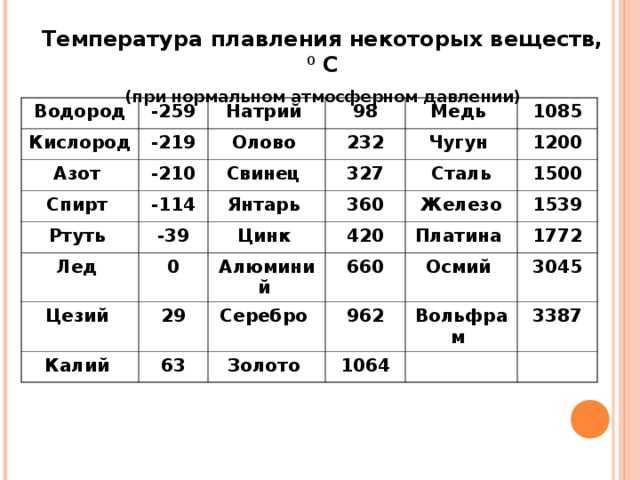 до н.э. (для Турции). Железо появилось в Африке к 600 г. до н.э., вероятно, из Юго-Западной Азии через Египет, Нубию и Сахельский коридор, идущий к югу от Сахары, а к 300-м годам началась значительная обработка железа на территории современной Нигерии. В большинстве частей мира использование железа в значительной степени вытеснило предшествующее использование бронзы, и, следовательно, «железный век» пришел на смену «бронзовому веку». За исключением северо-востока, в Африке не было бронзового века, где железо напрямую вытесняло использование каменных орудий.
до н.э. (для Турции). Железо появилось в Африке к 600 г. до н.э., вероятно, из Юго-Западной Азии через Египет, Нубию и Сахельский коридор, идущий к югу от Сахары, а к 300-м годам началась значительная обработка железа на территории современной Нигерии. В большинстве частей мира использование железа в значительной степени вытеснило предшествующее использование бронзы, и, следовательно, «железный век» пришел на смену «бронзовому веку». За исключением северо-востока, в Африке не было бронзового века, где железо напрямую вытесняло использование каменных орудий.
Сталь представляет собой сплав углерода и железа (металлический элемент, а не готовый продукт). Он содержит меньше углерода (от 0,2 до 1,5%), чем чугун, но больше, чем кованое железо. Высокоуглеродистая сталь более твердая и хрупкая, а низкое содержание углерода делает изделие более мягким и легким в обработке.
Обычно следы весла из других металлов, таких как хром, никель, медь, вольфрам и т. д., также добавляются для производства сортов стали с немного другими характеристиками.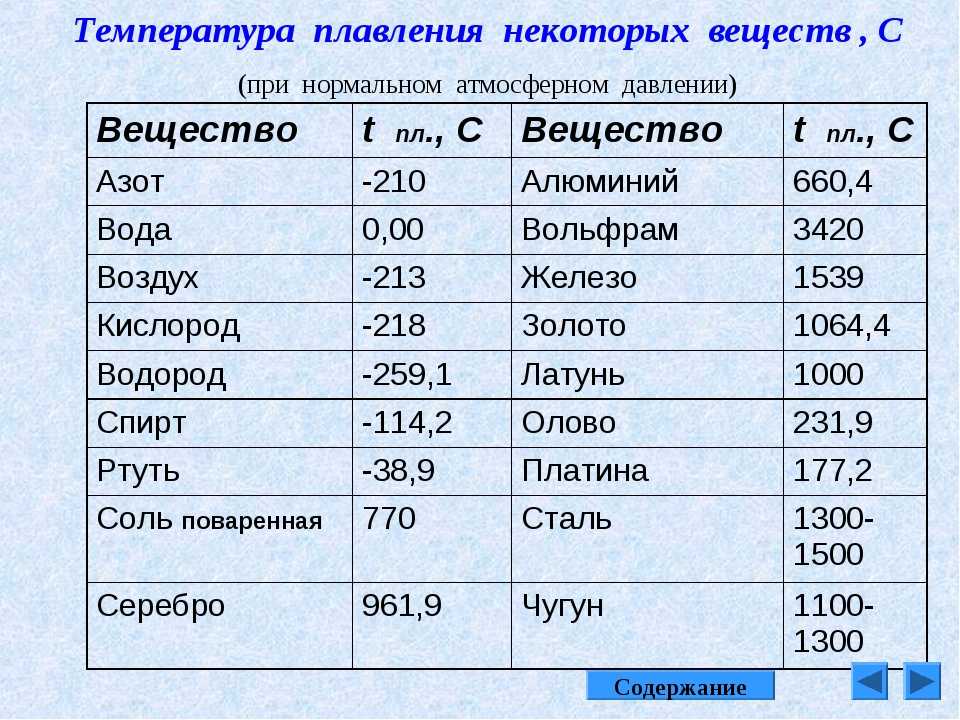
Производство стали требует удаления большего количества примесей из железной руды, чем производство железа, часто за счет применения большего количества тепла, чем могли производить древние печи.
Легко думать о стали как о железной руде, к которой добавляют углерод, но в реальном производстве это часто был чугун, из которого удаляли углерод, процесс, называемый « обезуглероживанием », и в Китае было несколько процессов для достижения этого. использовался начиная с династии Хань 汉 (206 г. до н.э. — 220 г. н.э.).
В общем, сталь лучше железа, поскольку она менее хрупкая, но ее характеристики зависят от количества углерода в сплаве. Введение других металлических руд позволяет производить стали специального назначения, такие как нержавеющая сталь, изготовленная из хрома.
Важным методом в современном и позднем историческом производстве стали является «закалка», то есть нагрев металла, а затем снова быстрое снижение его температуры путем погружения его в воду. (См. ниже.) Результатом является резкое увеличение прочности металла, прочность, которую можно увеличить еще больше, повторяя процесс. Самая ранняя закаленная сталь, о которой мы знаем, датируется примерно 1200 г. до н.э. или около того. (Гомер ссылается на этот процесс.) Но сталь было слишком сложно производить надежным образом, чтобы она стала широко использоваться в то время.
(См. ниже.) Результатом является резкое увеличение прочности металла, прочность, которую можно увеличить еще больше, повторяя процесс. Самая ранняя закаленная сталь, о которой мы знаем, датируется примерно 1200 г. до н.э. или около того. (Гомер ссылается на этот процесс.) Но сталь было слишком сложно производить надежным образом, чтобы она стала широко использоваться в то время.
Очевидно, что между железом и сталью существует тонкая грань, и некоторые металлические изделия трудно отнести к тому или иному типу. Методы повышения температуры печи, контроля содержания углерода и закалки после нагревания металла до нужной температуры были центральными в производстве инструментов на основе железной руды, которые на самом деле превосходили бронзовые, а не просто дешевле.
Вернуться наверх.
Материалы: свинец
Эта купель с крышкой, датируемая 1170 годом, была отлита из мягкого свинца. Свинец использовался для крестильных купелей в Великобритании, начиная с 300-х годов.
Церковь аббатства Святых Петра и Павла, Дорчестер, Англия
Свинец редко встречается сам по себе, а обычно является побочным продуктом переработки других руд. Это также конечная стадия радиоактивного распада некоторых нестабильных металлов, таких как уран или радий.
Тускло-серого цвета, свинец довольно мягкий. Например, в отчете об охоте своего отца в середине 1800-х годов Вахини, женщина из хидатса, отмечает, что «в качестве выстрела он использовал пули, кусочки свинца, которые он вырезал из прутка и жевал, чтобы сделать их круглыми, как пули. В те дни порох и дробь было трудно достать». (Wahenee 1927:18) Свинец также имеет низкую температуру плавления, что делает его готовым сплавом с другими металлами, а также хорошим металлом для литья артефактов при сравнительно низких температурах. Кроме того, свинец достаточно тяжелый, так что его хорошо использовать в гирях. Таким образом, археологически мы находим свинцовые артефакты довольно ранних времен.
Использование свинца в керамической глазури может быть опасным, особенно когда температура обжига низкая или глазурь доходит до горлышка сосуда. Мексиканская керамика начала XX века, как и этот предмет, приобрела сомнительную репутацию среди туристов и мексиканцев, несмотря на свою привлекательность.
Различные металлы, такие как олово, иногда смешивались (и используются) с кремнеземом в керамических глазурях, которым они придают твердую блестящую поверхность, цвет которой можно контролировать с помощью комбинации материалов. (Самый известный пример — фаянс [фаянс].) Однако большинство металлов имеют температуру плавления выше мощности древних печей (или в некоторых случаях простых навозных костров), используемых в производстве керамики. Примесь свинца могла создавать сплавы с температурой плавления в диапазоне относительно низкотемпературного керамического производства. Когда были доступны более высокие температуры, свинец все еще часто увеличивал гибкость глазури, а также ее блеск. По этой причине свинец издавна ассоциировался с производством эффектной керамической глазури и фарфоровой посуды.
По этой причине свинец издавна ассоциировался с производством эффектной керамической глазури и фарфоровой посуды.
Свинец, взвешенный в краске, также может помочь получить твердую, обычно блестящую, долговечную поверхность.
Свинец — это токсин, который постепенно накапливается в организме, пока не достигнет порогового значения и не начнет вызывать симптомы. К сожалению, эффект настолько постепенный, что на протяжении многих веков то, что мы теперь знаем как отравление свинцом, не было связано конкретно со свинцом. Постепенное отравление свинцом может произойти из-за воды, подаваемой по свинцовым трубам, которые иногда использовались, например, в Древнем Риме, или из-за вина, подаваемого из свинцовых сосудов, хотя токсичность, по-видимому, значительно меньше (до незначительной) в большинстве легированных форм.
Поскольку свинец использовался в качестве ингредиента керамических глазурей, он оказался источником потенциального отравления для пользователей керамики, обжигаемой при низких температурах. Некоторые продукты, такие как апельсиновый сок, взаимодействуют со свинцовой глазурью, что особенно быстро втягивает свинец в пищу. По этой причине в настоящее время большинство гончаров обычно исключает свинец из керамической глазури, а те, кто все же использует его, ограничивают его внешней отделкой предметов, не предназначенных для пищевых продуктов.
Некоторые продукты, такие как апельсиновый сок, взаимодействуют со свинцовой глазурью, что особенно быстро втягивает свинец в пищу. По этой причине в настоящее время большинство гончаров обычно исключает свинец из керамической глазури, а те, кто все же использует его, ограничивают его внешней отделкой предметов, не предназначенных для пищевых продуктов.
Вернуться наверх.
Материалы: Олово
Олово традиционно представляло собой сплав олова с другими мягкими, пригодными для обработки металлами с низкой температурой плавления, такими как медь, сурьма или иногда свинец. Именно мягкость металлов в сплаве объясняет легкость художественной обработки оловянной посуды, но такая же мягкость означает, что на них легко помяться.
Многие из нас ассоциируют свинец с оловом, и в большинстве словарей олово описывается как сплав олова и свинца. Оказывается, в древности так и было. Однако современные производители олова стараются заверить покупателей, что их олово не содержит свинца. На самом деле, некоторое количество олова всегда не содержало свинца. Посетитель этого веб-сайта предоставил следующую дополнительную информацию:
На самом деле, некоторое количество олова всегда не содержало свинца. Посетитель этого веб-сайта предоставил следующую дополнительную информацию:
Мелкие оловянные изделия 16, 17 и 18 веков представляли собой в основном сплавы легкообрабатываемых легкоплавких металлов с оловом в качестве основного металла и добавками меди, сурьмы, иногда висмута.
Свинец присутствовал только в более «дешевых» оловянных изделиях, например «лай-метал» (20% свинца) и «черный металл» (50% свинца). Такие «более дешевые» пьютеры представляли проблему токсичности при использовании в качестве контейнеров для еды и напитков, поскольку свинец мог выщелачиваться.
Эти оловянные изделия были заменены в середине 1700-х годов «Britannia Metal», сплавом олова (85%), сурьмы (10%), цинка (3%), меди (1%), а иногда и висмута.
Вернуться наверх.
Материалы: Золото
Эта знаменитая золотая маска из Микен является примером использования тонких золотых листов, предназначенных для получения максимального поверхностного блеска при минимальном количестве материала.
Микены, Греция
Золото встречается само по себе или в смеси с другими рудами. Он мягкий, с ним легко работать, и в большинстве случаев он не вступает в химическую реакцию. Он в значительной степени невосприимчив к потускнению или другим повреждениям поверхности.
Таким образом, с древнейших времен золото считалось «нетленным» и ценилось как за это (и связанный с ним символизм), так и за его сравнительную редкость и поверхностный блеск.
Однако золото довольно мягкое, и золотые изделия соответственно непрочны. Поэтому его обычно либо сплавляют с другими металлами (такими как медь), либо используют в качестве поверхностного покрытия на предметах из более прочного (и дешевого) материала.
Золото перерабатывается в плоские чешуйки и помещается между листами блестящей неабсорбирующей бумаги для более плоского растирания.
Центральная Мьянма
Золото, выкованное в тонкие листы, можно прессовать или растирать поверх или в форму для создания барельефа. Этот процесс известен как репуссе. (Реже репуссе получают, кладя золотой лист на мягкую поверхность и ударяя по нему молотком с желаемым рисунком.)
Этот процесс известен как репуссе. (Реже репуссе получают, кладя золотой лист на мягкую поверхность и ударяя по нему молотком с желаемым рисунком.)
Ремесленник многократно отбивает золотой лист, защищенный неабсорбирующей бумагой и закрепленный в рамке, пока он не станет почти порошкообразным для использования в качестве сусального золота.
Центральная Мьянма
Высокая стоимость и сравнительная мягкость золота означают, что многие древние предметы, такие как короны, браслеты и погребальные маски, были сделаны этим способом. К сожалению, они были довольно хрупкими и похожими на фольгу, и в археологических контекстах часто можно обнаружить, что они были раздавлены или смяты.
Золото можно перерабатывать в еще более тонкие листы и применять в виде фольги — сусального золота — для производства тонкого металлического покрытия на предметах из дерева или другого материала, и действительно, это, пожалуй, наиболее распространенная форма, сохранившаяся археологически. Это позволяет использовать золото в качестве поверхности на внутренних и внешних архитектурных деталях, от дверных проемов дворцов до крыш храмов, а также на более мелкие предметы, от баночек для косметики до обложек книг.
Это позволяет использовать золото в качестве поверхности на внутренних и внешних архитектурных деталях, от дверных проемов дворцов до крыш храмов, а также на более мелкие предметы, от баночек для косметики до обложек книг.
г.
«Сусальное золото» используется в качестве поверхности поверх других материалов в мебели и в архитектурном декоре.
Украшение перемычки, Рундальский дворец, Пилсрундале, Латвия
Еще в 2000-х годах до нашей эры в Месопотамии, по-видимому, применяли «золочение с истощением». В этой технике сплав золота и серебра прикреплялся в виде тонкой фольги к медной основе. Затем объект покрывали материалом (например, солью), который разъедал серебро, которое можно было постепенно смыть в виде черного порошка. Наконец, золото можно было аккуратно отполировать. Эта техника, возможно, не подходила для очень тонкой работы, такой как примеры сусального золота, показанные здесь, но поверхность была упругой, и объект выглядел (и, возможно, мог быть выдан) из чистого золота. (Истощение позолоты трудно увидеть археологически, поскольку то, что осталось, — это золото и основа, а серебро исчезло в процессе производства.)
(Истощение позолоты трудно увидеть археологически, поскольку то, что осталось, — это золото и основа, а серебро исчезло в процессе производства.)
Деревянная обложка для Diamond Stura, покрытая сусальным золотом. Тибет, XVI век. Поскольку золото можно выковать очень тонко, сусальное золото позволяет создавать предметы, покрытые золотом, в отличие от любого другого металла.
Музей Нортона Саймона, Пасадена
В наше время процесс гальванического покрытия позволяет наносить слой золота толщиной в один атом на соответствующие восприимчивые поверхности. Таким образом, очень тонкий слой золота теперь используется для улучшения проводимости компьютерных соединений, в качестве покрытия даже относительно дешевых украшений или в качестве тонкого покрытия на сашими, которые претенциозные посетители японских ресторанов едят как символ статуса.
Куски золота, напротив, очень плотные и тяжелые. Многие китайцы считают, что поедание куска золота было аристократическим методом самоубийства в имперские времена, поскольку тяжелый кусок переполнял пищеварительный тракт и вызывал внутреннее кровотечение и смерть.
Сплав золота и серебра (который может встречаться в природе или быть создан преднамеренно) называется электрум и иногда считается более ценным, чем чистое золото. Золото также можно сплавлять с медью в различных пропорциях для получения 9Тумбага 1942 года , которая широко использовалась в древнем Перу. Поскольку цвет тумбаги варьировался в зависимости от доли включенной меди (обычно менее 50%), перуанские золотообработчики могли использовать цветовые контрасты для создания рисунков в золотых изделиях.
Вернуться наверх.
Материалы: Серебро
В отличие от золота, серебро редко встречается в чистом виде в достаточном количестве, чтобы его можно было использовать. Обычно его добывали путем плавки других руд, из которых его можно считать почти побочным продуктом. В древности обычной рудой, используемой для производства серебра, был галенит или сульфид свинца, хотя, по-видимому, также использовался карбонат свинца (церуссит).
Серебряное дело в Центральной Мьянме.
После того, как чаша сформирована, поверхностные рисунки грубо прибиваются изнутри, после чего они обрабатываются легким постукиванием снаружи.
Как и в случае с золотом, серебро всегда было достаточно редким, поэтому почти все, что было сделано из него, было украшением или предметом престижа, а не инструментом как таковым.
Серебро, как и свинец, — очень мягкий металл, легко повреждаемый при использовании сам по себе, поэтому его часто сплавляли с другими металлами для повышения твердости. Обычно для этой цели применялась примесь небольшого количества меди. Однако большинство сплавов серебра остаются довольно мягкими и сравнительно легко превращаются в предметы искусства. Из-за его высокой стоимости в сочетании с его мягкостью серебро часто используется в тонких пластинах, подходящих для ювелирных изделий, рамок для картин, декоративных сосудов и т. Д., Или оно прикрепляется к более прочному материалу основы. Серебро нельзя растолочь в такой же тонкий слой, как золото, и поэтому его нельзя легко прижать или напылить на поверхность, такую как резное дерево или гипс, без потери рисунка лежащей под ним резьбы.
Серебро нельзя растолочь в такой же тонкий слой, как золото, и поэтому его нельзя легко прижать или напылить на поверхность, такую как резное дерево или гипс, без потери рисунка лежащей под ним резьбы.
Вернуться наверх.
Методы
Вверху: Слитки — это просто металлические блоки любой удобной формы, сырье для ремесленников.
Внизу: В Китае в качестве денег стали использоваться слитки особой формы. В приведенном ниже примере XIX века представлены 50 официальных таэлей весом около 1,9 кг из стандартного серебряного сплава.
Британский музей
Горное дело и слитки
Крайне редко какой-либо металл можно найти в чистом виде, и поэтому при добыче полезных ископаемых в качестве побочного продукта используется много дополнительного материала. Первый шаг в металлообработке всегда включает отделение нужного металла от необработанной руды, в которой он содержится естественным образом, а затем использование металла (иногда в сплаве с другими металлами) для производства чего-либо.
Практически вся металлообработка включает в себя нагрев металла для его размягчения или плавления, а в древности требуемые температуры часто представляли собой самые пределы доступных технологий нагрева. Не все металлы можно было полностью расплавить, потому что древние печи просто не могли достаточно нагреться.
Логично предположить, что удаление примесей из металла (плавление) и превращение его во что-то не обязательно должно происходить одновременно, и всегда было принято перерабатывать только что извлеченный металл в слитки в форме шариков или стержней, удобные для хранения или доставки. Позже, когда пришло время что-то изготавливать, материал в слитке нужно было только нагреть, и он сразу был готов к использованию.
Вверху: Римские слитки I века (слева направо) меди, олова и свинца. ( Musée d’Arles )
Внизу: Стеклянные слитки с кораблекрушения 14 века до н.э. ( Музей подводной археологии, Бодрум, Турция )
Очевидно, для этого требовалось дважды нагревать металл: один раз для его очистки и изготовления слитков, а затем для переплавки слитков для доработки. Но были преимущества. Производство слитков могло осуществляться дешевой рабочей силой рядом с местом добычи полезных ископаемых, и значительное количество горных отходов (или шлака) могло скапливаться там в насыпях мусора, как правило, вдали от большинства центров проживания людей. Фактическое ремесленное производство могло быть расположено ближе к предполагаемому рынку, в более густонаселенных местах, вдали от источников руды. И, что еще более важно, нужно было перемещать только слитки; не было необходимости перевозить отходы.
Но были преимущества. Производство слитков могло осуществляться дешевой рабочей силой рядом с местом добычи полезных ископаемых, и значительное количество горных отходов (или шлака) могло скапливаться там в насыпях мусора, как правило, вдали от большинства центров проживания людей. Фактическое ремесленное производство могло быть расположено ближе к предполагаемому рынку, в более густонаселенных местах, вдали от источников руды. И, что еще более важно, нужно было перемещать только слитки; не было необходимости перевозить отходы.
(Стекло также хранилось в слитках, а затем плавилось и отливалось в формы по мере необходимости, отделяя иногда секретный процесс создания стекла от процесса обработки стекла. На изображении здесь показаны стеклянные слитки, окрашенные следами меди, кобальта и марганца.)
Вернуться наверх.
Плавка
Плавка — это основной процесс, с помощью которого из металлических руд получают пригодный для обработки металл. Минералы в медных рудах восстанавливаются до меди путем смешивания углерода с рудой и нагревания смеси примерно до 1100°C. (Это можно сделать непосредственно с медноокисными рудами. Медные сульфидные руды сначала нагревают в контакте с воздухом.) При этой температуре металл, уже жидкий, стекает на дно печи, а оставшееся вещество ( шлак ) всплывает наверх, откуда его удаляют. (Шлак обычно включает большое количество кремния и родственных ему материалов и образует отработанные кучи стеклообразного или шлакоподобного материала.) Хотя это звучит просто, в древности, и особенно до изобретения мехов, было трудно достичь необходимого температуры, а извлечение меди из шлака на самом деле было трудным, грязным и чрезвычайно трудоемким делом. (Нажмите, чтобы увидеть картинку.)
Минералы в медных рудах восстанавливаются до меди путем смешивания углерода с рудой и нагревания смеси примерно до 1100°C. (Это можно сделать непосредственно с медноокисными рудами. Медные сульфидные руды сначала нагревают в контакте с воздухом.) При этой температуре металл, уже жидкий, стекает на дно печи, а оставшееся вещество ( шлак ) всплывает наверх, откуда его удаляют. (Шлак обычно включает большое количество кремния и родственных ему материалов и образует отработанные кучи стеклообразного или шлакоподобного материала.) Хотя это звучит просто, в древности, и особенно до изобретения мехов, было трудно достичь необходимого температуры, а извлечение меди из шлака на самом деле было трудным, грязным и чрезвычайно трудоемким делом. (Нажмите, чтобы увидеть картинку.)
г.
Этот «хвост» или кусок шлакоподобного мусора современного медеплавильного завода содержит широкий спектр материалов.
Частная коллекция
При плавке получается кусок металла (называемый блум ), подготовленный для следующего шага. В случае с медью этот этап часто представляет собой литье. (См. ниже.)
В случае с медью этот этап часто представляет собой литье. (См. ниже.)
Железо имеет более высокую температуру плавления, чем медь. Но ниже температуры плавления железо все же может стать губчатым и поддающимся обработке горячей ковки (ковкой), которая помогает извлечь часть оставшихся примесей. (См. ниже.)
Холодная штамповка
Более мягкие металлы, в том числе медь и бронза, могут быть обработаны методом холодной ковки, особенно после того, как они были выплавлены для удаления примесей. Поскольку ковка вредна для кристаллической структуры, кованный металл становится более хрупким. Кристаллическая структура может быть «сброшена» с помощью отжига , процесса последовательного нагрева и медленного охлаждения, описанного ниже.
Ковка (горячая штамповка)
Кузнечное железо, которое намного тверже меди, требует повторного нагрева блюма, пока он не станет красным. Затем его отбивают на наковальне, в ходе этого процесса физически удаляются различные примеси (обычно кремнезем), оставшиеся после плавки. Многократное нагревание и ковка производят все более чистое (и прочное) железо. В то же время, поскольку железо слегка податливо, когда оно раскалено докрасна, кузнец может придать железу желаемую форму.
Многократное нагревание и ковка производят все более чистое (и прочное) железо. В то же время, поскольку железо слегка податливо, когда оно раскалено докрасна, кузнец может придать железу желаемую форму.
Горячая ковка не работает с бронзой, которая становится слишком хрупкой при высоких температурах.
Вернуться наверх.
Отжиг
Вверху: Глиняная форма для литья лезвия меча из Британии бронзового века ( Ashmolean Museum, Oxford )
Внизу: Железная форма для литья двух бронзовых серпов из Центрального Китая около 300 г. до н.э. ( Китайский национальный музей, Пекин )
Отжиг — это процесс медленного повторного нагрева литого или кованого металла до тех пор, пока он не станет раскаленным докрасна. Это восстанавливает его кристаллическую структуру и необходимо после многократной ковки металла. Ковка формирует металл и удаляет примеси, но также ослабляет его кристаллическую структуру, делая металл твердым, но хрупким и легко растрескивающимся. В случае инструментов, у которых важны острые кромки (например, ножи), иногда предпочтительнее оставлять их неотожженными после окончательной обработки молотком, поскольку твердость (и, следовательно, способность удерживать острую кромку) может быть более важной, чем потенциальная хрупкость (отсюда и склонность к поломке).
В случае инструментов, у которых важны острые кромки (например, ножи), иногда предпочтительнее оставлять их неотожженными после окончательной обработки молотком, поскольку твердость (и, следовательно, способность удерживать острую кромку) может быть более важной, чем потенциальная хрупкость (отсюда и склонность к поломке).
Закалка
Закалка, как упоминалось выше, относится к нагреву железа (легированного углеродом) до высокой температуры — по крайней мере, до порога 725 ° C, когда оно становится красным, — а затем к быстрому охлаждению его погружением в воду. Этот процесс не оказывает полезного действия на чистое железо или бронзу, но для железа с некоторой примесью углерода он дает значительное увеличение твердости, и он стал рутинной частью производства таких предметов, как стальные мечи.
Кастинг
Полностью расплавленный металл можно отлить, то есть залить в форму, если форма имеет структурную целостность, чтобы выдерживать нагрев. Поскольку железо не полностью плавилось при температурах, которые могли производить древние мастера по металлу, железо обычно обрабатывали другими методами (за пределами Китая), но обычно отливали свинец, медь и бронзу, а формы были обнаружены в культурах металлообработки по всему миру. Мир. (Разница в температурах плавления сделала железо возможным материалом для изготовления формы для изготовления инструментов из других металлов. Хотя такую форму было бы трудно изготовить, ее можно было использовать в течение длительного времени.)
Поскольку железо не полностью плавилось при температурах, которые могли производить древние мастера по металлу, железо обычно обрабатывали другими методами (за пределами Китая), но обычно отливали свинец, медь и бронзу, а формы были обнаружены в культурах металлообработки по всему миру. Мир. (Разница в температурах плавления сделала железо возможным материалом для изготовления формы для изготовления инструментов из других металлов. Хотя такую форму было бы трудно изготовить, ее можно было использовать в течение длительного времени.)
Специализированный метод литья металлов, применяемый при изготовлении особо сложных предметов, называется методом выплавки по выплавляемым моделям.
Вернуться наверх.
Два интерактивных контрольных теста доступны, чтобы перепроверить ваше понимание тем на этой странице: Викторина 1 Викторина 2.
Источники
Эта страница основана на широком диапазоне источников, многие из которых давно забыты, а также на советах нескольких друзей и коллег.

 Такие виды нашли применение в технике и электронике. Они используются для соединения элементов из металла и движения электрического тока. Олово плавится при 232 градусах, а цинк — при 419 градусах.
Такие виды нашли применение в технике и электронике. Они используются для соединения элементов из металла и движения электрического тока. Олово плавится при 232 градусах, а цинк — при 419 градусах. В эту группу относят вольфрам, титан, платину, хром и т. п. Они используются в ядерной промышленности и для некоторых машинных деталей. Они могут применяться для расплавки других металлов, изготовления высоковольтных проводов или проволоки. Платину можно расплавить при 1769 градусах, а вольфрам — при 3420 °C.
В эту группу относят вольфрам, титан, платину, хром и т. п. Они используются в ядерной промышленности и для некоторых машинных деталей. Они могут применяться для расплавки других металлов, изготовления высоковольтных проводов или проволоки. Платину можно расплавить при 1769 градусах, а вольфрам — при 3420 °C. Такая микроструктура придает материалу превосходные высокотемпературные свойства, например хорошее сопротивление ползучести и стабильность формы. При использовании специальных технологий производства материал WK65 может выдерживать больше нагрузок, чем WVM.
Такая микроструктура придает материалу превосходные высокотемпературные свойства, например хорошее сопротивление ползучести и стабильность формы. При использовании специальных технологий производства материал WK65 может выдерживать больше нагрузок, чем WVM. Для обоих композитов мы применяем практически чистый вольфрам с небольшой добавкой калия. S-WVMW идеально подходит для стержней диаметром больше 30 мм. Специальные технологии производства, которые мы используем для изготовления S-WVMW, позволяют добиваться высокой плотности материала в стержневом сердечнике.
Для обоих композитов мы применяем практически чистый вольфрам с небольшой добавкой калия. S-WVMW идеально подходит для стержней диаметром больше 30 мм. Специальные технологии производства, которые мы используем для изготовления S-WVMW, позволяют добиваться высокой плотности материала в стержневом сердечнике. Мы добавляем в вольфрам 2 масс. % оксида церия и получаем материал с более низкой работой выхода электронов, улучшенными характеристиками зажигания и увеличенным ресурсом по сравнению с чистым вольфрамом.
Мы добавляем в вольфрам 2 масс. % оксида церия и получаем материал с более низкой работой выхода электронов, улучшенными характеристиками зажигания и увеличенным ресурсом по сравнению с чистым вольфрамом.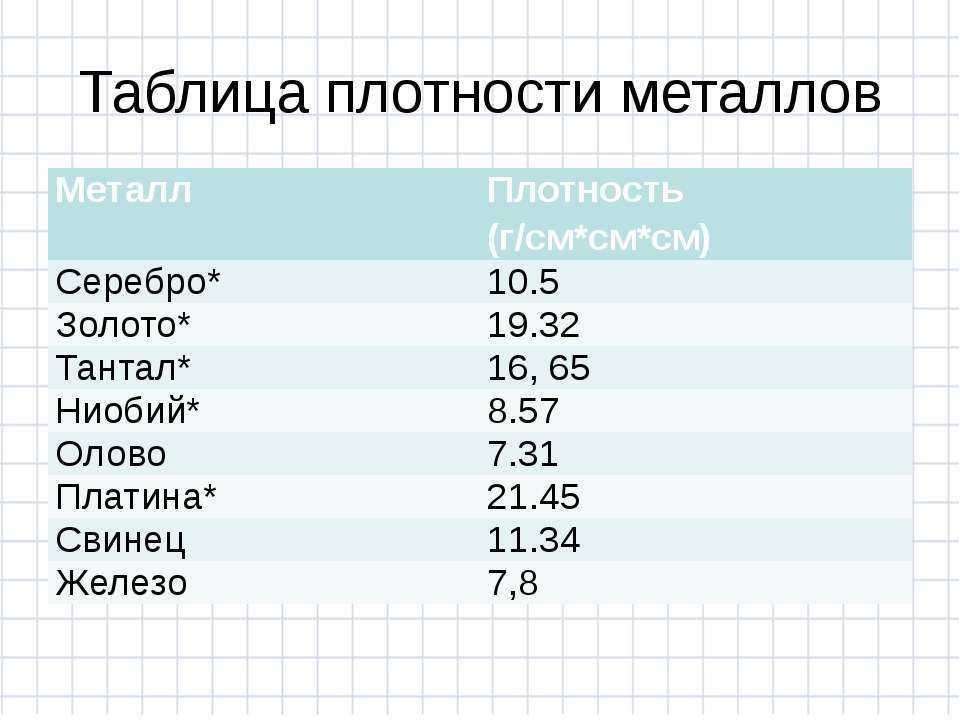 Все эти свойства выражены в вольфраме гораздо сильнее, чем в молибдене. В периодической системе химических элементов вольфрам отнесен к той же группе, что и молибден, но располагается на период ниже.
Все эти свойства выражены в вольфраме гораздо сильнее, чем в молибдене. В периодической системе химических элементов вольфрам отнесен к той же группе, что и молибден, но располагается на период ниже. Вольфрам по своим механическим свойствам сходен с молибденом. Как и в случае с молибденом, эти свойства зависят от температуры испытания. Вольфрам имеет самую высокую температуру плавления среди всех металлов: 3420 °C. Высокая теплостойкость и высокий модуль упругости обуславливают хорошее сопротивление ползучести.
Вольфрам по своим механическим свойствам сходен с молибденом. Как и в случае с молибденом, эти свойства зависят от температуры испытания. Вольфрам имеет самую высокую температуру плавления среди всех металлов: 3420 °C. Высокая теплостойкость и высокий модуль упругости обуславливают хорошее сопротивление ползучести. Также часто используется термин «микролегирование». Содержание добавок при таком легировании достигает нескольких сотен микрограммов. Количество добавок часто измеряют в миллионных долях, обозначаемых как «ppm». Термин ppm происходит от английского parts per million, что означает «частей на миллион», т.е. 10-6.
Также часто используется термин «микролегирование». Содержание добавок при таком легировании достигает нескольких сотен микрограммов. Количество добавок часто измеряют в миллионных долях, обозначаемых как «ppm». Термин ppm происходит от английского parts per million, что означает «частей на миллион», т.е. 10-6. Формование без обработки резанием, такое как гибка или отбортовка, должно осуществляться при температуре выше точки перехода из хрупкого в вязкое состояние. У вольфрама эта температура выше, чем у молибдена. Чем толще обрабатываемый лист, тем больше должна быть температура предварительного нагрева. Для резки и штамповки температура предварительного нагрева должна быть выше, чем для отбортовки. Вольфрам с трудом поддается машинной обработке. А вот наши сплавы вольфрама с оксидом лантана обрабатывать легче. Тем не менее уровень износа инструмента при этом также очень высок, что может привести к выщерблению. Если у вас остались вопросы по механической обработке тугоплавких металлов, наши опытные специалисты всегда готовы вас проконсультировать.
Формование без обработки резанием, такое как гибка или отбортовка, должно осуществляться при температуре выше точки перехода из хрупкого в вязкое состояние. У вольфрама эта температура выше, чем у молибдена. Чем толще обрабатываемый лист, тем больше должна быть температура предварительного нагрева. Для резки и штамповки температура предварительного нагрева должна быть выше, чем для отбортовки. Вольфрам с трудом поддается машинной обработке. А вот наши сплавы вольфрама с оксидом лантана обрабатывать легче. Тем не менее уровень износа инструмента при этом также очень высок, что может привести к выщерблению. Если у вас остались вопросы по механической обработке тугоплавких металлов, наши опытные специалисты всегда готовы вас проконсультировать. Стеклянные расплавы, водород, азот, инертные газы, металлические расплавы и оксидные керамические расплавы воздействуют на вольфрам незначительно, даже при очень высоких температурах, если они не содержат дополнительных окислителей.
Стеклянные расплавы, водород, азот, инертные газы, металлические расплавы и оксидные керамические расплавы воздействуют на вольфрам незначительно, даже при очень высоких температурах, если они не содержат дополнительных окислителей. Влажность может привести к окислению.
Влажность может привести к окислению.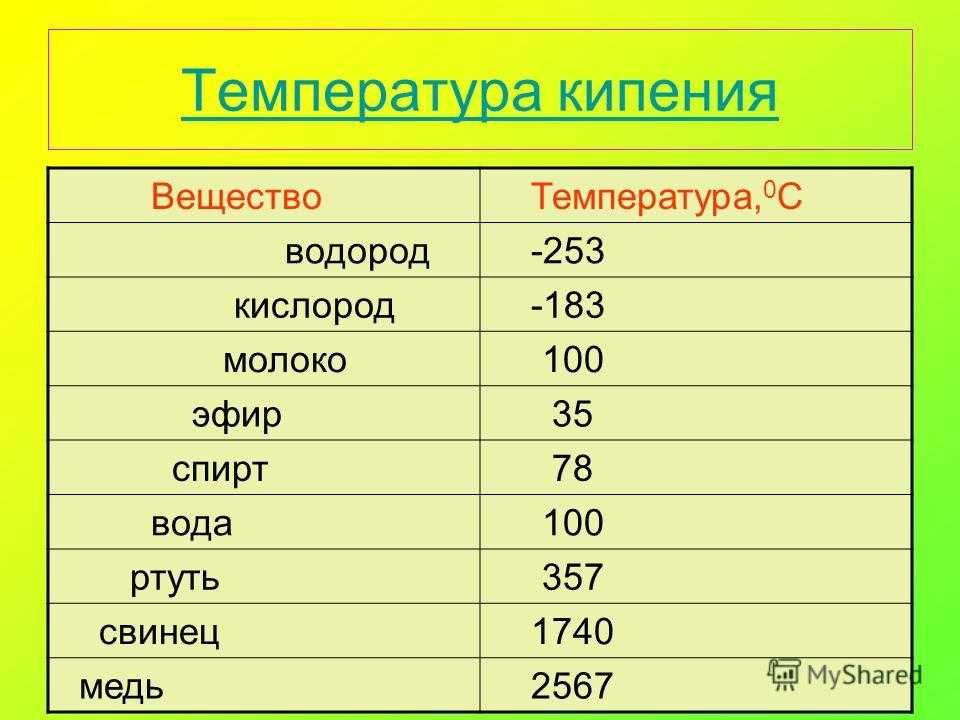 Ни у одного из других производителей вы не найдете вольфрамовые мишени в таком широком диапазоне форматов.
Ни у одного из других производителей вы не найдете вольфрамовые мишени в таком широком диапазоне форматов. Вольфрам также отличается исключительно низким коэффициентом теплового расширения, высоким уровнем стабильности формы и хорошей электропроводностью.
Вольфрам также отличается исключительно низким коэффициентом теплового расширения, высоким уровнем стабильности формы и хорошей электропроводностью. В 1752 году химик Аксель Фредрик Кронштедт открыл тяжелый металл, который назвал Tung Sten, что в переводе с шведского означает «тяжелый камень». Лишь спустя 30 лет Карлу Вильгельму Шееле удалось получить вольфрамовую кислоту из руды. И всего спустя два года ассистенты Шееле — братья Хуан Хосе и Фаусто де Элюар — восстановили триоксид вольфрама, получив чистый вольфрам. Сегодня именно эти два брата считаются настоящими открывателями вольфрама. Название wolframium и соответствующий химический знак W были предложены Йёнсом Якобом Берцелиусом.
В 1752 году химик Аксель Фредрик Кронштедт открыл тяжелый металл, который назвал Tung Sten, что в переводе с шведского означает «тяжелый камень». Лишь спустя 30 лет Карлу Вильгельму Шееле удалось получить вольфрамовую кислоту из руды. И всего спустя два года ассистенты Шееле — братья Хуан Хосе и Фаусто де Элюар — восстановили триоксид вольфрама, получив чистый вольфрам. Сегодня именно эти два брата считаются настоящими открывателями вольфрама. Название wolframium и соответствующий химический знак W были предложены Йёнсом Якобом Берцелиусом.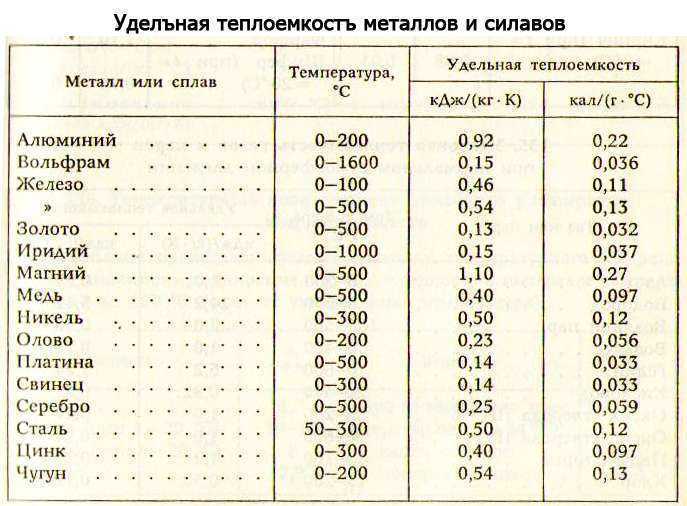 Из-за их наличия обработка давлением становится сложнее. Однако стоит отметить, что электропроводность остается практически неизменной. Пример таких соединений – свинец и висмут.
Из-за их наличия обработка давлением становится сложнее. Однако стоит отметить, что электропроводность остается практически неизменной. Пример таких соединений – свинец и висмут. В марках с обычным количеством кислорода его доля составляет от 0,05 до 0,08%.
В марках с обычным количеством кислорода его доля составляет от 0,05 до 0,08%.

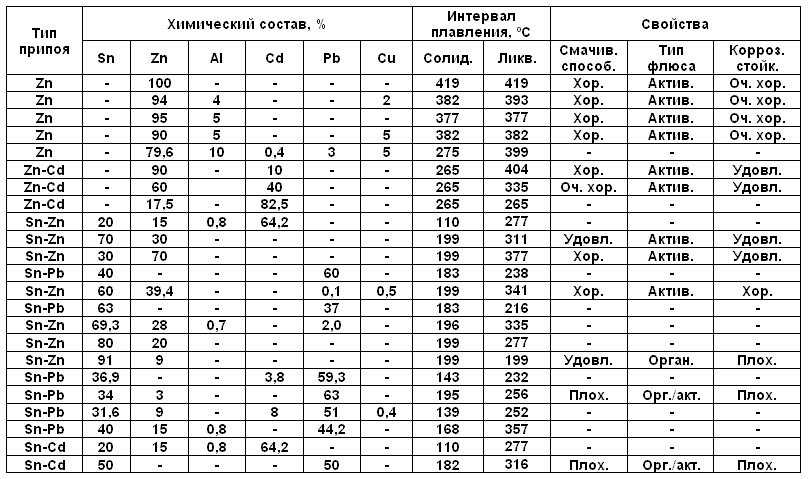 Это смесь алюминия и меди, которая имеет коррозионную стойкость и способность к деформации. Ее используют в производстве деталей, которые планируется подвергать воздействию высокой температуры.
Это смесь алюминия и меди, которая имеет коррозионную стойкость и способность к деформации. Ее используют в производстве деталей, которые планируется подвергать воздействию высокой температуры.

 847
847 86 (20 °C)
86 (20 °C)