Титан, свойства атома, химические и физические свойства
Титан, свойства атома, химические и физические свойства.
Ti 22 Титан
47,867(1) 1s2 2s2 2p6 3s2 3p6 3d2 4s2
Титан — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 22. Расположен в 4-й группе (по старой классификации — побочной подгруппе четвертой группы), четвертом периоде периодической системы.
Атом и молекула титана. Формула титана. Строение титана
Изотопы и модификации титана
Свойства титана (таблица): температура, плотность, давление и пр.
Физические свойства титана
Химические свойства титана. Взаимодействие титана. Реакции с титаном
Получение титана
Применение титана
Таблица химических элементов Д.И. Менделеева
Атом и молекула титана. Формула титана. Строение титана:
Титан (лат. Titanium, назван в честь титанов) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ti и атомным номером 22. Расположен в 4-й группе (по старой классификации – побочной подгруппе четвертой группы), четвертом периоде периодической системы.
Titanium, назван в честь титанов) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ti и атомным номером 22. Расположен в 4-й группе (по старой классификации – побочной подгруппе четвертой группы), четвертом периоде периодической системы.
Титан – амфотерный металл. Относится к переходным металлам. Относится к группе группе лёгких, редких, тугоплавких, цветных металлов.
Титан обозначается символом Ti.
Как простое вещество титан при нормальных условиях представляет собой лёгкий, прочный металл серебристо-белого цвета.
Молекула титана одноатомна.
Химическая формула титана Ti.
Электронная конфигурация атома титана 1s2 2s2 2p6 3s2 3p6 3d2 4s2. Потенциал ионизации (первый электрон) атома титана равен 658,81 кДж/моль (6,828120(12) эВ).
Строение атома титана. Атом титана состоит из положительно заряженного ядра (+22), вокруг которого по четырем оболочкам движутся 22 электрона. При этом 20 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку титан расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома титана на 3d-орбитали находятся два неспаренных электрона. На внешнем энергетическом уровне атома титана – на s-орбитали находится два спаренных электрона. В свою очередь ядро атома титана состоит из 22 протонов и 26 нейтронов.
В свою очередь ядро атома титана состоит из 22 протонов и 26 нейтронов.
Радиус атома титана (вычисленный) составляет 176 пм.
Атомная масса атома титана составляет 47,867(1) а. е. м.
Титан обладает высокой коррозионной стойкостью.
Титан, свойства атома, химические и физические свойства
Изотопы и модификации титана:
Свойства титана (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Титан |
| 102 | Прежнее название | |
| 103 | Латинское название | Titanium |
| 104 | Английское название | Titanium |
| 105 | Символ | Ti |
| 106 | Атомный номер (номер в таблице) | 22 |
| 107 | Тип | Металл |
| 108 | Группа | Амфотерный, переходный, лёгкий, редкий, тугоплавкий, цветной металл |
| 109 | Открыт | Уильям Грегор, Великобритания, 1791 г. , Мартин Генрих Клапрот, Германия, 1795 г. , Мартин Генрих Клапрот, Германия, 1795 г. |
| 110 | Год открытия | 1791 г. |
| 111 | Внешний вид и пр. | Лёгкий, прочный металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации титана: – α-титан с гексагональной плотноупакованной решёткой, – β-титан с кубической объёмно-центрированной решеткой. |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга* | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | |
| 119 | Содержание в земной коре (по массе) | 0,66 % |
| 120 | Содержание в морях и океанах (по массе) | 1,0·10-7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,0003 % |
| 122 | Содержание в Солнце (по массе) | 0,0004 % |
| 123 | Содержание в метеоритах (по массе) | 0,054 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 47,867(1) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d2 4s2 |
| 203 | Электронная оболочка | K2 L8 M10 N2 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный)* | 176 пм |
| 205 | Эмпирический радиус атома* | 140 пм |
| 206 | Ковалентный радиус* | 160 пм |
| 207 | Радиус иона (кристаллический) | Ti2+ 100 (6) пм, Ti3+ 81 (6) пм, Ti4+ 56 (4) пм, 74,5 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 22 электрона, 22 протона, 26 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 4-ая группа (по старой классификации – побочная подгруппа 4-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -2, -1, 0, +1, +2, +3, +4 |
| 302 | Валентность | II, III, IV |
| 303 | Электроотрицательность | 1,54 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 658,81 кДж/моль (6,828120(12) эВ) |
| 305 | Электродный потенциал | Ti2+ + 2e– → Ti, Eo = -1,630 В, Ti3+ + e– → Ti2+, Eo = -0,368 В, Ti4+ + e– → Ti3+, Eo = +0,092 В, Ti4+ + 4e– → Ti, Eo = -0,88 В |
| 306 | Энергия сродства атома к электрону | 7,289(5) кДж/моль (0,07554(5) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 4,506 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 4,11 г/см3 (при 1668 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 1668 °C (1941 K, 3034 °F) |
| 403 | Температура кипения* | 3287 °C (3560 K, 5949 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 14,15 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 425 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,514 Дж/г·K (при 0 °C), 0,524 Дж/г·K (при 25 °C), 0,568 Дж/г·K (при 200 °C) |
| 410 | Молярная теплоёмкость* | 25,060 Дж/(K·моль) |
| 411 | Молярный объём | 10,62059 см³/моль |
| 412 | Теплопроводность | 21,9 Вт/(м·К) (при стандартных условиях), 21,9 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-титан |
| 512 | Структура решётки | Гексагональная плотноупакованная
|
| 513 | Параметры решётки | a = 2,951 Å, с = 4,697 Å |
| 514 | Отношение c/a | 1,587 |
| 515 | Температура Дебая | 380 K |
| 516 | Название пространственной группы симметрии | P6 |
| 517 | Номер пространственной группы симметрии | 194 |
| 521 | Кристаллическая решётка #2 | β-титан |
| 522 | Структура решётки | Кубическая объёмно-центрированная
|
| 523 | Параметры решётки | a = 3,269 Å |
| 524 | Отношение c/a | |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | Im_ 3m |
| 527 | Номер пространственной группы симметрии | |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-32-6 |
Примечание:
204* Радиус атома (вычисленный) титана согласно [3] составляет 147 пм.
205* Эмпирический радиус титана согласно [1] составляет 147 пм.
206* Ковалентный радиус титана согласно [1] и [3] составляет 160±8 пм и 132 пм соответственно.
401* Плотность титана согласно [3] и [4] составляет 4,54 г/см3 (при 0 °C и при иных стандартных условиях, состояние вещества – твердое тело) и 4,505 г/см3 (при 20 °C и при иных стандартных условиях, состояние вещества – твердое тело) соответственно.
402* Температура плавления титана согласно [3] составляет 1943 °C (1670 К, 3529,4 °F).
403* Температура кипения титана согласно [4] составляет 3330 °C (3603,15 К, 6026 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) титана согласно [3] и [4] составляет 18,8 кДж/моль и 15 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) титана согласно [3] и [4] составляет 422,6 кДж/моль и 410 кДж/моль соответственно.
410* Молярная теплоемкость титана согласно [3] составляет 25,1 Дж/(K·моль).
Физические свойства алюминия:
Химические свойства титана. Взаимодействие титана. Реакции с титаном:
Получение титана:
Применение титана:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26.
 Железо
Железо - 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60.
 Неодим
Неодим - 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93.
 Нептуний
Нептуний - 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Titanium
- https://de.wikipedia.
 org/wiki/Titan_(Element)
org/wiki/Titan_(Element) - https://ru.wikipedia.org/wiki/Титан_(элемент) [Россия]
- http://chemister.ru/Database/properties.php?dbid=1&id=232
- https://chemicalstudy.ru/titan-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
титан атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле титана
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 1 908
Физические и механические свойства титана
Физические и особенно механические свойства титана сильно зависят от чистоты металла. Примеси кислорода, водорода, азота и углерода растворяются в титане и делают его хрупким.
Примеси кислорода, водорода, азота и углерода растворяются в титане и делают его хрупким.
Важнейшей особенностью титана как металла являются его уникальные физические свойства: высокая прочность, твердость, низкая плотность и др., которые существенно не меняются при высоких температурах, что позволяет широко использовать титан как конструкционный материал.
Прочность металла — это его способность сопротивляться разрушению и необратимому изменению формы (пластические деформации). Удельная прочность сплавов титана может быть повышена в 1,5–2 раза. Титан обладает значительной твердостью: он в 12 раз тверже алюминия, в 4 раза – железа и меди. Еще одна важная характеристика металла – предел текучести. Чем он выше, тем лучше детали из этого металла сопротивляются эксплуатационным нагрузкам. Предел текучести у титана почти в 18 раз выше, чем у алюминия.
Титан является пограничным между лёгкими и тяжёлыми металлами, границей является плотность 5 г/см3.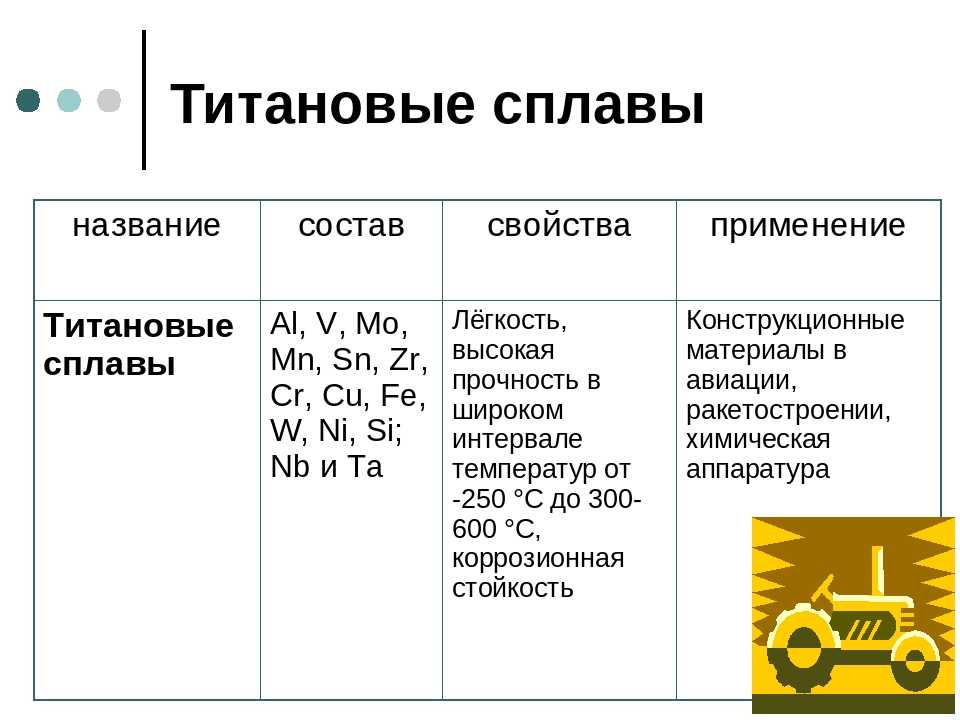 Титан относят к легким металлам, его плотность при 0 °С составляет 4,517 г/см3, а при 100 °С – 4,506 г/см3.
Титан относят к легким металлам, его плотность при 0 °С составляет 4,517 г/см3, а при 100 °С – 4,506 г/см3.
Титан весьма тугоплавкий металл. Долгое время считалось, что он плавится при 1800 °С, однако в середине 1950-х гг. английские ученые Диардорф и Хейс установили температуру плавления для чистого элементарного титана 1668±3 °С. По своей тугоплавкости титан уступает лишь таким металлам, как вольфрам, тантал, ниобий, рений, молибден, платиноиды, цирконий, но среди конструкционных металлов он стоит на первом месте.
Титан существует в двух полиморфных модификациях, a–до 882 ºС, b – выше 882 ºС. При превращении a в b-титан, увеличение объема составляет 5,5%, а плотность уменьшается до 4,32 г/см3.
Титан более чем в 1,5 раза тяжелее алюминия (2,7 г/см3), но зато в 1,5 раза легче железа (7,8 г/см3). Занимая по удельной плотности промежуточное положение между алюминием и железом, титан во много раз превосходит их по механическим свойствам, которые хорошо сохраняются до 500 – 700 °С.
Прочность титана в 18 раз выше, чем у алюминия. Удельная прочность сплавов титана может быть повышена в 1,5–2 раза.
Твердость титана в 12 раз больше, чем у алюминия, в 4 раза – железа и меди.
Титан долгие годы, вплоть до получения чистого металла, рассматривали как очень хрупкий материал. Связано это было с наличием в титане примесей, особенно водорода, азота, кислорода, углерода и др. Если увеличение содержания кислорода и азота сразу сказывается на механических свойствах, то влияние водорода более сложное и может проявляться не сразу, а в процессе эксплуатации изделия. Недооценка этого влияния при первых шагах применения титана приводила к серьезным авариям. Многочисленные случаи неожиданных хрупких разрушений готовых титановых конструкций в авиации США даже стали причиной некоторого кризиса в производстве титана в 1945–1955 гг. Сегодня же водород специально вводят в титановые сплавы, как легирующий элемент. Это позволяет сильно упростить многие технологические операции при изготовлении титановых изделий (горячую обработку давлением, резание, сварку, формовку) и улучшить их свойства. При необходимости водород удаляют отжигом в вакууме.
При необходимости водород удаляют отжигом в вакууме.
Титан имеет замечательное свойство – исключительную стойкость в условиях кавитации, т. е. при усиленной «бомбардировке» металла в жидкой или воздушной среде пузырьками воздуха, которые образуются при быстром движении или вращении металлической детали в данной среде. Эти пузырьки воздуха, лопаясь на поверхности металла, вызывают очень сильные микроудары жидкости о поверхность движущегося тела. Они быстро разрушают многие материалы и металлы, а вот титан прекрасно противостоит кавитации. Испытания в морской воде быстро вращающихся дисков из титана и других металлов показали, что при вращении в течение двух месяцев титановый диск практически не потерял в массе. Внешние края его, где скорость вращения и кавитация максимальны, не изменились. Другие диски не выдержали испытания: у всех внешние края оказались поврежденными, а многие из них вовсе разрушились.
Титан обладает еще одним удивительным свойством – «памятью». В сплаве с некоторыми металлами (особенно с никелем и водородом), он «запоминает» форму изделия, которую из него сделали при определенной температуре. Если такое изделие потом деформировать, например, свернуть в пружину, изогнуть, то оно останется в таком положении на долгое время. После нагревания до той температуры, при которой это изделие было сделано, оно принимает первоначальную форму. Это свойство титана широко используется в космической технике: разворачиваются вынесенные в космическое пространство большие антенны, до этого компактно сложенные на корабле. Также это свойство стали использовать медики для бескровных операций на сосудах: в больной, суженный сосуд вводится проволочка из титанового сплава, а потом она, разогреваясь до температуры тела, скручивается в первоначальную пружинку и расширяет сосуд.
В сплаве с некоторыми металлами (особенно с никелем и водородом), он «запоминает» форму изделия, которую из него сделали при определенной температуре. Если такое изделие потом деформировать, например, свернуть в пружину, изогнуть, то оно останется в таком положении на долгое время. После нагревания до той температуры, при которой это изделие было сделано, оно принимает первоначальную форму. Это свойство титана широко используется в космической технике: разворачиваются вынесенные в космическое пространство большие антенны, до этого компактно сложенные на корабле. Также это свойство стали использовать медики для бескровных операций на сосудах: в больной, суженный сосуд вводится проволочка из титанового сплава, а потом она, разогреваясь до температуры тела, скручивается в первоначальную пружинку и расширяет сосуд.
Дата добавления: 2021-09-25; просмотров: 95; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Химические свойства титана
Титан важный металл, разработанный в 1950-х годах. Благодаря его превосходным физическим и химическим свойствам, многие страны мира успешно исследовали и разработали его. В настоящее время титан широко используется в авиации, авиакосмической, химической, нефтяной, энергетической, медицинской, строительной, спортивной и других областях. В этой статье мы рассмотрим химические свойства титана . .
Благодаря его превосходным физическим и химическим свойствам, многие страны мира успешно исследовали и разработали его. В настоящее время титан широко используется в авиации, авиакосмической, химической, нефтяной, энергетической, медицинской, строительной, спортивной и других областях. В этой статье мы рассмотрим химические свойства титана . .
Химические свойства титана
Химические свойства титана — химическая реакцияПри более высоких температурах титан может реагировать со многими элементами и соединениями. Различные элементы можно разделить на четыре категории . согласно их различным реакциям с титаном:
Первая категория: галогеновые и кислородные элементы и титан образуют соединения с ковалентной и ионной связями;
Вторая категория: переходные элементы, водород, бериллий, группа бора, группа углерода и элементы группы азота, а также титан образуют интерметаллические соединения и ограниченные твердые растворы;
Третья категория:цирконий , гафний группа ванадия, группа хрома, скандий и титан образуют бесконечный твердый раствор;
Четвертая категория: инертные газы, щелочные металлы, щелочноземельные металлы, редкоземельные элементы (кроме скандия), актиний, торий и т. д. не вступают в реакцию или практически не реагируют с титаном.
д. не вступают в реакцию или практически не реагируют с титаном.
Газообразный фтористый водород реагирует с титаном с образованием TiF4 при нагревании; формула реакции следующая:Ti + 4HF =TiF4 + 2h3 + 135,0 ккал.
Неводная жидкость фтористого водорода может образовывать плотную пленку из тетрафторида титана на поверхности титана, которая может препятствовать погружению HF в титан.
Плавиковая кислота — сильнейший растворитель титана. Даже 1% фтористоводородная кислота может бурно реагировать с титаном:2Ti + 6HF =2TiF3 + 3h3.
2. HCI и хлоридГазообразный хлористый водород может вызывать коррозию титана, а сухой хлористый водород реагирует с титаном с образованием TC4 при температуре выше 300 ° C:Ti + 4HCl =TiCl4 + 2h3 + 94,75 ккал. .
Соляная кислота с концентрацией менее 5% не реагирует с титаном при комнатной температуре, а 20% -ная соляная кислота реагирует с титаном при комнатной температуре с образованием фиолетового TiCl3:2Ti + 6HCl =2TiCl 3 + 3H 2.
При повышении температуры даже разбавленная соляная кислота разъедает титан. Различные безводные хлориды, такие как магний, марганец, железо, никель, медь, цинк, ртуть, олово, кальций, натрий, барий и ионы Nh5 + и их водные растворы, не реагируют с титаном, поэтому титан в этих хлоридах хорошо стабильность.
3. Серная кислота и сероводород Титан явно вступает в реакцию с 5% серной кислотой. При комнатной температуре около 40% серной кислоты имеет самую быструю скорость коррозии титана. Когда концентрация составляет 40-60%, скорость коррозии снижается, но когда концентрация достигает 80%, скорость коррозии снова достигает максимальной. Нагретая разбавленная кислота или 50% концентрированная серная кислота может реагировать с титаном с образованием сульфата титана:Ti + H 2 SO 4 =TiSO 4 + H 2, 2Ti + 3H 2 SO 4 =Ti 2 (SO 4 ) 3 + 3H 2.
Нагретая концентрированная серная кислота может быть восстановлена титаном с образованием SO2:2Ti + 6h3SO4 =Ti2 (SO4) 3 + 3SO2 + 6h3O + 202 ккал. При нормальной температуре титан реагирует с сероводородом, образуя на его поверхности защитную пленку, которая может предотвратить дальнейшую реакцию между сероводородом и титаном. Но при высоких температурах сероводород реагирует с титаном с выделением водорода:Ti + h3S =TiS + h3 + 70 ккал.
Химические свойства титана
Титановый порошок начинает реагировать с сероводородом при 600 ° C с образованием сульфида титана, в то время как основным продуктом реакции при 900 ° C является TiS, а при 1200 ° C — Ti2S3.
4. Азотная кислота и царская водка Плотный титан с гладкой поверхностью имеет хорошую устойчивость к азотной кислоте, поскольку азотная кислота может быстро образовывать прочную оксидную пленку на поверхности титана. Но титан с шероховатой поверхностью, особенно губчатый титан или порошок титана , может реагировать с горячей разбавленной азотной кислотой:3Ti + 4HNO3 + 4h3O =3h5TiO4 + 4NO,
Но титан с шероховатой поверхностью, особенно губчатый титан или порошок титана , может реагировать с горячей разбавленной азотной кислотой:3Ti + 4HNO3 + 4h3O =3h5TiO4 + 4NO,
3Ti + 4HNO3 + h3O =3h3TiO3 + 4NO.
Концентрированная азотная кислота также может реагировать с титаном при температуре выше 70 ℃:Ti + 8HNO 3 =Ti (NO 3 ) 4 + 4НЕТ 2 + 4H 2 О.
При комнатной температуре титан не вступает в реакцию с царской водкой. При высоких температурах титан может реагировать с царской водкой с образованием TiCl2:Ti + 8HNO3 =Ti (NO3) 4 + 4NO2 + 4h3O.
Одним словом, химические свойства титана очень тесно связаны с температурой, существующей формой и чистотой.
Заключение Благодарим вас за то, что прочитали нашу статью, и мы надеемся, что она поможет вам лучше понять химические свойства титана . . Если вы хотите узнать больше о титане и других тугоплавких металлах посетите страницу Advanced Refractory Metals (ARM) для получения дополнительной информации.
Advanced Refractory Metals со штаб-квартирой в Лейк-Форест, Калифорния, Америка является одним из ведущих производителей и поставщиков тугоплавких металлов по всему миру. Мы предлагаем нашим клиентам высококачественные тугоплавкие металлические изделия, такие как вольфрам, молибден, тантал, рений, титан, и цирконий по очень конкурентоспособной цене.
Физические свойства титана 5 интересных фактов о тантале
Элемент Титан — Атом титана
Титан является химическим элементом
с символом Ti и атомным номером
22. Иногда его называют «металл космической эры», [2] он имеет низкую плотность и является прочным,
блестящие, коррозионностойкие (в т. ч.
морская вода, царская водка и хлор) переход
металл серебристого цвета.
ч.
морская вода, царская водка и хлор) переход
металл серебристого цвета.
Титан был обнаружен в Корнуолле, Англия, Уильям Грегор в 1791 году и назван Мартином Генрихом Клапротом в честь Титаны греческой мифологии.
Элемент встречается в пределах нескольких
месторождения полезных ископаемых, в основном рутила и
ильмениты, которые широко распространены
в земной коре и литосфере,
и встречается почти у всех живых существ,
горные породы, водоемы и почвы. [3] Металл
извлекается из основного минерала
руды по способу Кролла [4] или процесс Хантера. Самый распространенный
соединение, диоксид титана, является популярным
фотокатализатор и используется в производстве
из белых пигментов. [5] Другие соединения включают титан
тетрахлорид (TiCl 4 ), компонент
дымовых завес и катализаторов; и титан
трихлорид (TiCl 3 ), который
используется в качестве катализатора в производстве
из полипропилена. [3]
Самый распространенный
соединение, диоксид титана, является популярным
фотокатализатор и используется в производстве
из белых пигментов. [5] Другие соединения включают титан
тетрахлорид (TiCl 4 ), компонент
дымовых завес и катализаторов; и титан
трихлорид (TiCl 3 ), который
используется в качестве катализатора в производстве
из полипропилена. [3]
Титан может быть сплавлен с железом, алюминием,
ванадий, молибден и другие элементы,
производить прочные легкие сплавы для
аэрокосмическая (реактивные двигатели, ракеты и космические корабли),
военный, промышленный процесс (химикаты
и нефтехимии, опреснительные установки,
целлюлозно-бумажная), автомобильная, сельскохозяйственная,
медицинские протезы, ортопедические имплантаты,
стоматологические и эндодонтические инструменты и файлы,
зубные имплантаты, спортивные товары, ювелирные изделия,
мобильные телефоны и другие приложения. [3]
[3]
Два наиболее полезных свойства
металлическая форма — коррозионная стойкость и
самое высокое соотношение прочности и веса
любой металл. [6] В нелегированном состоянии,
титан такой же прочный, как некоторые стали,
но на 45% легче. [7] Существуют две аллотропные формы [8] и
пять встречающихся в природе изотопов этого
элемент, от 46 Ti до 50 Ti,
при этом 48 Ti является наиболее распространенным
(73,8%). [9] Титановые
свойства химически и физически
похож на цирконий, потому что оба
имеют одинаковое количество валентных электронов
и находятся в одной группе в периодическом
стол.
Физический свойства
Металлический элемент, титан признан благодаря высокому соотношению прочности и веса. [8] Это прочный металл с низкая плотность, которая достаточно пластична (особенно в бескислородной среде), [3] блестящий, и металлически-белого цвета. [10] Относительно высокая температура плавления (более чем 1 650 °C или 3 000 °F) делает его полезным в качестве тугоплавкого металла. Он парамагнетик и имеет довольно низкую электро- и теплопроводность. [3]
Технические (чистота 99,2%) марки титана
иметь предел прочности при растяжении около
63 000 фунтов на квадратный дюйм (434 МПа), что равно
обычные низкосортные стальные сплавы, но
На 45% легче. [7] Титан на 60% плотнее алюминия,
но более чем в два раза прочнее [7] как наиболее часто используемый алюминий 6061-T6
сплав. Некоторые титановые сплавы (например,
Бета C) достигают прочности на растяжение более
200 000 фунтов на квадратный дюйм (1400 МПа). [11] Однако титан
теряет прочность при нагревании выше 430 °C
(806 °F). [12]
[7] Титан на 60% плотнее алюминия,
но более чем в два раза прочнее [7] как наиболее часто используемый алюминий 6061-T6
сплав. Некоторые титановые сплавы (например,
Бета C) достигают прочности на растяжение более
200 000 фунтов на квадратный дюйм (1400 МПа). [11] Однако титан
теряет прочность при нагревании выше 430 °C
(806 °F). [12]
Достаточно твердый (хотя и не такой твердый
как некоторые марки термообработанной стали),
немагнитный и плохой проводник тепла
и электричество. Обработка требует мер предосторожности,
так как материал будет размягчаться и раздражаться, если
острые инструменты и правильные методы охлаждения
не используются. Как те, что сделаны из стали,
титановые конструкции имеют предел выносливости
что гарантирует долговечность в некоторых приложениях. [10] Специальные титановые сплавы
жесткость также обычно не так хороша
как и другие материалы, такие как алюминиевые сплавы
и углеродное волокно, поэтому оно меньше используется для
конструкций, требующих высокой жесткости.
Как те, что сделаны из стали,
титановые конструкции имеют предел выносливости
что гарантирует долговечность в некоторых приложениях. [10] Специальные титановые сплавы
жесткость также обычно не так хороша
как и другие материалы, такие как алюминиевые сплавы
и углеродное волокно, поэтому оно меньше используется для
конструкций, требующих высокой жесткости.
Металл представляет собой диморфный аллотроп,
гексагональная альфа-форма превращается в телоцентрированную
кубическая (решетчатая) форма β при 882 °C
(1620 °F). [12] Удельная теплоемкость альфа-формы увеличивается
резко как то греется к этому переходу
температура, но затем падает и остается
довольно постоянна для β-формы независимо от
температуры. [12] Подобно цирконию и гафнию, дополнительный
существует омега-фаза, которая термодинамически
стабилен при высоких давлениях, но метастабилен
при атмосферном давлении. Эта фаза обычно
шестиугольный ( идеальный ) или тригональный ( искаженный )
и может рассматриваться как результат мягкого
продольный акустический фонон β
фаза, вызывающая коллапс плоскостей (111)
атомов. [13]
[12] Подобно цирконию и гафнию, дополнительный
существует омега-фаза, которая термодинамически
стабилен при высоких давлениях, но метастабилен
при атмосферном давлении. Эта фаза обычно
шестиугольный ( идеальный ) или тригональный ( искаженный )
и может рассматриваться как результат мягкого
продольный акустический фонон β
фаза, вызывающая коллапс плоскостей (111)
атомов. [13]
Ссылки
- Andersson, N. et al. (2003 г.). «Спектры излучения TiH и TiD вблизи 938 нм». J. Chem.
физ. 118 : 10543. doi:10.1063/1.
 1539848. http://bernath.uwaterloo.ca/media/257.pdf.
1539848. http://bernath.uwaterloo.ca/media/257.pdf. - Уильям Л. Мастертон; Сесиль Н. Херли (2008). Химия: принципы и реакции (6-е изд.). Cengage Обучение. п. 18. ISBN 0495126713. http://books.google.com/?id=teubNK-b2bsC&pg=PT44&lpg=PT44&dq=titanium+%22space-age+metal%22&q=titanium%20%22space-age%20metal%22.
- «Титан». Британская энциклопедия . 2006. http://www.britannica.com/eb/article-
43/titanium. Проверено 29 декабря 2006 г. .
- Лиде, Д.Р., изд. (2005), CRC Справочник Химия и физика (86-е изд.), Бока-Ратон (Флорида): CRC Press, ISBN 0-8493-0486-5
- Кребса,
Роберт Э.
 (2006). История и
Использование химических элементов нашей Земли:
Справочное руководство (2-е издание) .
Вестпорт, Коннектикут: Гринвуд
Нажимать. ISBN 0313334382.
(2006). История и
Использование химических элементов нашей Земли:
Справочное руководство (2-е издание) .
Вестпорт, Коннектикут: Гринвуд
Нажимать. ISBN 0313334382. - Мэтью Дж. Доначи-младший (1988). ТИТАН: Технический Руководство . Металлс Парк, Огайо: ASM International. п. 11. ISBN 0871703092.
- Барксдейл 1968, с. 738
- «Титан». Энциклопедия Колумбии (6-е изд.). Нью-Йорк: Колумбийский университет
Нажимать.
 2000–2006 гг. ISBN 0-7876-5015-3.
http://www.answers.com/Титан.
2000–2006 гг. ISBN 0-7876-5015-3.
http://www.answers.com/Титан. - Барбалас, Кеннет Л. (2006). «Периодическая таблица элементов: Ti — титан». http://environmentalchemistry.com/yogi/periodic/Ti-pg2.html#Nuclides. Проверено 26 декабря 2006 г. .
- Ствертка, Альберт (1998). «Титан». Руководство к Элементам (пересмотренная ред.). Оксфордский университет Нажимать. стр. 81–82. ISBN 0–19-508083-1.
- Мэтью Дж. Доначи-младший (1988). Титан: технический
Руководство . Металлс Парк, Огайо: ASM International.
Приложение J, таблица J.2. ISBN 0871703092.

- Барксдейл 1968, с. 734
- Сикка, Южная Каролина; Вохра, Ю.К., Чидамбарам, Р. (1982).
«Омега-фаза в материалах». Прогресс в
Материаловедение 27 :
245–310. дои: 10.1016/0079-6425(82)
-0.
Атомный номер, свойства, применение и побочные эффекты
Титан — химический элемент, занимающий 4 -я -я группа и 4-й -й -й период периодической таблицы. Символ титанового элемента — Ti. Это элемент переходного металла с атомным номером 22. Титан является 2-м -м элементом первого ряда переходных металлов. Sc присутствует перед титаном в ряду переходных элементов 1 st , а Zr помещается ниже титана в периодической таблице. Zr также является переходным металлом, входящим в серию переходных элементов 2 и . Титан не имеет сходства по физическим и химическим свойствам с Zr, хотя они имеют одинаковое число валентных электронов и находятся в одной группе. Так как титан находится в 4 -я группа , это d – блочный элемент. Титан имеет серебристо-серо-белый металлический вид.
Zr также является переходным металлом, входящим в серию переходных элементов 2 и . Титан не имеет сходства по физическим и химическим свойствам с Zr, хотя они имеют одинаковое число валентных электронов и находятся в одной группе. Так как титан находится в 4 -я группа , это d – блочный элемент. Титан имеет серебристо-серо-белый металлический вид.
Титан был открыт британским священником и минералогом Уильямом Грегором в 1791 году и впервые выделен Йонсом Якобом Берцелиусом в 1825 году. Слово титан происходит от греческого слова титаны, которое используется в греческой мифологии. Согласно греческой мифологии, Титаны — сыновья богини Земли. Элемент титан был назван немецким химиком Мартином Генрихом Клапротом.
Титан является 7--м -м наиболее распространенным металлическим элементом и 9--м -м наиболее распространенным элементом в земной коре. Он в основном встречается в виде оксидов в магматических породах. Встречается также в литосфере. Титан присутствует почти во всех живых существах, водоемах, горных породах и почве. Для коммерческого использования титан в основном получают путем извлечения ильменитовой (FeTiO 3 ) и рутиловой (TiO 2 ) руд в основном двумя способами: процессом Кролла или процессом Хантера.
Титан присутствует почти во всех живых существах, водоемах, горных породах и почве. Для коммерческого использования титан в основном получают путем извлечения ильменитовой (FeTiO 3 ) и рутиловой (TiO 2 ) руд в основном двумя способами: процессом Кролла или процессом Хантера.
В природе можно найти две аллотропные формы титана. Доступны пять встречающихся в природе изотопов титана, которые являются стабильными. Помимо этого, у него также есть много синтетических изотопов. Из синтетических изотопов 44 Ti является наиболее стабильным с периодом полураспада 63 года. Его 5 естественных изотопов: 46 Ti, 47 Ti, 48 Ti, 49 Ti и 50 Ti. Из встречающихся в природе изотопов 48 Ti — самый распространенный изотоп. Его сплавы также доступны с другими элементами, такими как железо, алюминий, ванадий и молибден.
атомного номера титана и электронная конфигурация
Атомальное число титана составляет 22. его электронная конфигурация — 1S 2 2S 2 2P 6 3S 2 3P 6 3D 2 40007 2 3P 6 3D 2 2 2 3P 6 3D 2 4. или может быть записано как
его электронная конфигурация — 1S 2 2S 2 2P 6 3S 2 3P 6 3D 2 40007 2 3P 6 3D 2 2 2 3P 6 3D 2 4. или может быть записано как
Ar-Ar 3d 2 4s 2 . У него 2 электрона в К-оболочке, 8 электронов в L-оболочке, 10 электронов в М-оболочке и 2 электрона в самой внешней оболочке N.
Свойства титана
Физические и химические свойства титана. Физические и химические свойства титана перечислены ниже.
Стандартный атомный вес титана 47,867.
Имеет серебристо-серо-белый металлический цвет.
Температура плавления 1668 ℃.
Температура кипения титана 3287 ℃.
Показывает гексагональную плотноупакованную (ГПУ) кристаллическую структуру.
Имеет низкую плотность. Его плотность составляет 4,506 г см- 3 .
Это блестящий переходный элемент с высокой прочностью
По шкале Полинга его электроотрицательность составляет 1,54.
Имеет много изотопов. Его 5 изотопов стабильны и встречаются в природе: 46 Ti, 47 Ti, 48 Ti, 49 Ti и 50 Ti. Хотя его ключевым изотопом является 48 Ti, который является наиболее распространенным изотопом титана.
Устойчив к коррозии. Он не подвергается коррозии разбавленной серной кислотой и соляной кислотой.
Он не подвергается коррозии разбавленной серной кислотой и соляной кислотой.
Имеет самое высокое отношение прочности к плотности среди всех металлических элементов.
Он является парамагнитным и имеет сравнительно низкую электро- и теплопроводность по сравнению с другими металлами.
Пластичный и немагнитный материал.
Реакция с кислородом – Титан реагирует с кислородом воздуха при температуре 1200 ℃. Реакция приведена ниже —
Ti + O 2 1200 ℃ → TIO 2
TI + 2H 2 O → TIO 2 + 2H 2 9999 6 2TI + 2 2 999 6 2TI + 2 2 999 6 2TI + 2 2 999 6 2TI + 2 2 999 6 2TI + 2 2 999 2TI 2 2019201920192019 2192019 2 2 → TiN
Реакция с галогенами.
 Титан реагирует с галогенами, такими как F, Cl, Br и I. Он реагирует с хлором при 550 ℃ и образует тетрахлорид титана. Ниже приведена реакция –
Титан реагирует с галогенами, такими как F, Cl, Br и I. Он реагирует с хлором при 550 ℃ и образует тетрахлорид титана. Ниже приведена реакция –
Ti + 2Cl 2 → TiCl 4
With fluorine — Ti + 2F 2 → TiF 4
With bromine — Ti + 2Br 2 → TiBr 4
With йод — Ti + 2l 2 → Til 4
Использование титана
Титан очень полезен в различных областях, в основном благодаря своим свойствам, таким как самое высокое отношение прочности к плотности, коррозионная стойкость и т.д. виды использования перечислены ниже –
Диоксид титана используется в производстве белых пигментов.
TiO 2 используется в качестве фотокатализатора в различных реакциях.

Трихлорид титана используется в производстве полипропилена и во многих других реакциях в качестве катализатора.
Тетрахлорид титана используется в дымовых завесах. Он также используется в качестве катализатора.
Титановые сплавы прочны, долговечны и легки, поэтому они обычно используются в ракетах, реактивных двигателях и космических кораблях.
Он также используется в военной, автомобильной, целлюлозно-бумажной промышленности и сельском хозяйстве.
Титан в виде порошка используется в пиротехнике.
В нержавеющей стали используется для уменьшения процентного содержания углерода.

Титановые сплавы также используются в рекреационных целях.
Титановые белила используются в красках, белой бумаге, зубной пасте, пластмассах и т. д.
Используется в удочках и клюшках для гольфа в качестве укрепляющего средства.
Его оксид TiO 2 также используется в производстве цемента и драгоценных камней.
Благодаря своей инертности и устойчивости к коррозии титан также широко используется в ювелирных изделиях.
Он также широко используется в медицине. Он в основном используется в зубных имплантатах, замене суставов и т. д.
Он также используется в косметике и электронике.

Побочное действие титана
Титан является нетоксичным элементом и не может поглощаться тканями человека. По этой причине, даже если мы потребляем титан различными способами, он не оказывает вредного воздействия на организм, поскольку выходит из организма, не поглощаясь им. Титан в виде порошка представляет значительную пожаро- и взрывоопасность.
Сводка по титану в табличной форме
Titanium | ||
Symbol | Ti | |
Discovered By | British clergyman and mineralogist William Gregor in 1791 | |
First Isolated by | Йонс Якоб Берцелиус в 1825 году | |
Назван | немецким химиком Мартином Генрихом Клапротом | |
Atomic number | 22 | |
Standard atomic weight | 47. | |
Crystal Structure | Hexagonal close-packed (hcp) | |
Состояние при 20℃ | Твердое | |
0439 Boiling point | 3287 ℃ | |
Period | 4 th | |
Group | 4 th | |
Block | D | |
Электронная конфигурация | 1S 2 2S 2 2P 6 3S 2 3P 6 0008 3d 2 4S 2 или AR-AR 3D 2 4S 2 | |
Основные свойства | . | В качестве белых пигментов и в самолетах, реактивных двигателях, ракетах |
Недостатки | Титановый порошок может вызвать пожар и взрыв | |
На этом наш обзор темы «Титан» заканчивается. Мы надеемся, что вам понравилось обучение, и вы смогли понять концепции. Мы надеемся, что после прочтения этой статьи вы сможете решить задачи, основанные на теме. Если вы ищете решения проблем с учебниками NCERT, основанные на этой теме, войдите на веб-сайт Vedantu или загрузите приложение Vedantu Learning. Таким образом, вы сможете получить доступ к бесплатным PDF-файлам с решениями NCERT, а также к примечаниям к изменениям, пробным тестам и многому другому.
Природное изобилие
Титан — десятый по распространенности элемент на планете. Он почти всегда находится в магматических породах и образовавшихся из них отложениях. Он содержится в минералах ильмените, рутиле и сфене, а также в титанатах и многочисленных железных рудах.
Он содержится в минералах ильмените, рутиле и сфене, а также в титанатах и многочисленных железных рудах.
Промышленный титан получают путем восстановления хлорида титана (IV) магнием. Сульфатный метод» и «хлоридный метод», оба из которых начинаются с минерала ильменита, используются для коммерческого производства оксида титана (IV).
Диоксид титана
(TiO 2 ), широко известный как оксид титана (IV) или диоксид титана, представляет собой природный оксид титана. Диоксид титана, белый пигмент, используется в картинах (как титановые белила или пигментные белила 6) и солнцезащитных кремах из-за его способности преломлять свет и поглощать УФ-излучение. 95 процентов добытого титана используется для производства пигментов диоксида титана, а остальные 5 процентов используются для производства химикатов, металлов, карбидов и покрытий (по данным Геологической службы США).
Он также широко используется в медицине, косметике и зубной пасте, и все чаще используется в качестве пищевой добавки (как E171) для отбеливания или придания предметам большей непрозрачности. Глазурь, жевательная резинка, зефир и добавки являются одними из наиболее популярных пищевых продуктов, содержащих Е171.
Глазурь, жевательная резинка, зефир и добавки являются одними из наиболее популярных пищевых продуктов, содержащих Е171.
Титан — Sciencemadness Wiki
Титан — это переходный металл с символом Ti и атомным номером 22. Это сероватый, легкий металл, который обладает высокой коррозионной стойкостью, но может быть преобразован в несколько степеней окисления, большинство обычно +4 и +3.
Содержание
- 1 Свойства
- 1.1 Физические свойства
- 1.2 Химические свойства
- 2 Изоляция
- 3 Наличие
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 ссылок
- 6.1 Соответствующие темы Sciencemadness
Свойства
Физические свойства
Титан — серый металл с низкой плотностью, всего на 60 % больше, чем у алюминия, но в два раза прочнее. Это распространенный огнеупорный материал, который ценится за свои механические свойства. Он слегка парамагнитен и существует в трех аллотропах. Его электропроводность относительно плоха для металла.
Это распространенный огнеупорный материал, который ценится за свои механические свойства. Он слегка парамагнитен и существует в трех аллотропах. Его электропроводность относительно плоха для металла.
Химические свойства
Хотя титан не проявляет реакционной способности, поскольку он не подвержен коррозии и в целом устойчив к воздействию концентрированных кислот или оснований, он имеет очень сильное сродство к кислороду. Его реакционная способность маскируется образованием на поверхности пассивирующего оксидного слоя диоксида титана. Титан воспламеняется при температуре выше 1200 °C с образованием на воздухе оксида и нитрида. Поэтому плавка титана должна производиться в инертной атмосфере. Пламя белое, но слегка желтоватое по сравнению с пламенем магния.
Титан (IV) является наиболее распространенной степенью окисления элемента. Соединения титана(IV) чрезвычайно трудно растворяются в водном растворе, так как ион TiO 2+ (титанил) существует только в очень кислых условиях.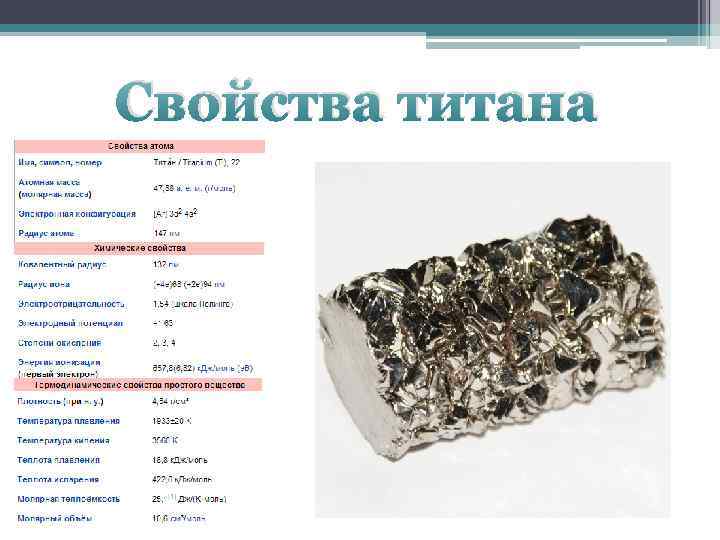 Тем не менее, это может быть произведено очень легко. Наиболее распространенным соединением титана (IV) является оксид. Хлорид титана (IV) представляет собой мощную кислоту Льюиса, которая гидролизуется до хлористого водорода и диоксида титана в присутствии воды. Титан(IV) также образует устойчивые пероксокомплексы, которые имеют довольно яркую окраску.
Тем не менее, это может быть произведено очень легко. Наиболее распространенным соединением титана (IV) является оксид. Хлорид титана (IV) представляет собой мощную кислоту Льюиса, которая гидролизуется до хлористого водорода и диоксида титана в присутствии воды. Титан(IV) также образует устойчивые пероксокомплексы, которые имеют довольно яркую окраску.
Соединения титана(III) также доступны любителям. При добавлении к горячей концентрированной соляной кислоте титан растворяется с образованием хлорида титана (III), который существует в виде фиолетового раствора. Большинство соединений титана (III) имеют голубовато-фиолетовый цвет из-за неподеленного d-электрона, однако этот фиолетовый цвет не очень силен из-за низкой вероятности перехода. Это хорошая отправная точка для производства многих соединений титана, таких как оксид титана (III). Смешанные фторокомплексы титана (III, IV) могут быть получены, хотя они недостаточно изучены.
Металл также довольно легко растворяется в горячей серной кислоте с концентрацией 50 мас. %, образуя фиолетовый сульфат Ti(III). Таким образом можно получить стабильные растворы с содержанием Ti 2 (SO 4 ) 3 примерно до 30 мас.%. При добавлении к этим растворам раствора CsCl выпадают квасцы CsTi(III).
%, образуя фиолетовый сульфат Ti(III). Таким образом можно получить стабильные растворы с содержанием Ti 2 (SO 4 ) 3 примерно до 30 мас.%. При добавлении к этим растворам раствора CsCl выпадают квасцы CsTi(III).
Соединения титана(II) также существуют, но их очень трудно получить, так как они восстанавливают многие материалы, включая воду.
Изоляция
Титан можно получить восстановлением тетрахлорида титана магнием, хотя эта реакция сложна для химика-любителя, поскольку и титан, и его хлорид чувствительны к воде и воздуху. В промышленности эту реакцию проводят в вакууме (процесс Кролла).
Более простой способ получения металлического титана — термитная реакция между диоксидом титана и алюминием. Однако сама по себе реакция не протекает гладко, и вместо этого ее необходимо усиливать побочной реакцией между алюминием и сульфатом кальция или каким-либо другим усилителем. Если желательны большие конкреции металла, можно использовать примерно одну часть фторида кальция на каждые две части диоксида титана, чтобы помочь смеси расплавиться.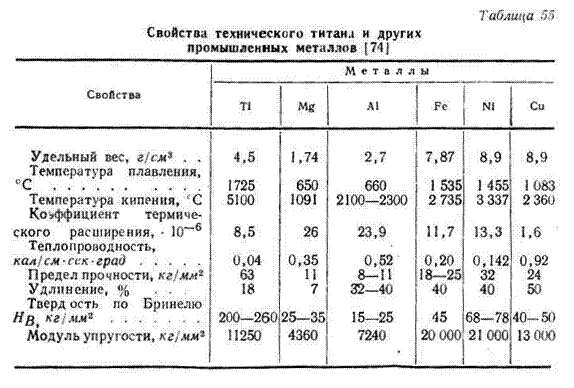 Полученный титан содержит около 10 % Al, часть в виде легированного металла, часть в виде включений глиноземистого шлака. Полученный Ti также не пластичен, так как пластичный Ti может быть получен только с помощью анаэробного процесса Кролла.
Полученный титан содержит около 10 % Al, часть в виде легированного металла, часть в виде включений глиноземистого шлака. Полученный Ti также не пластичен, так как пластичный Ti может быть получен только с помощью анаэробного процесса Кролла.
Доступность
Серьги из анодированного титана
Доступен более 50 видов титана. Классы с 1 по 4 представляют собой чистый титан, причем наибольшей примесью являются замены атомов кислорода в кристаллической решетке. Остальные марки представляют собой титановые сплавы.
Проекты
- Титановые салюты, бенгальские огни и прочая пиротехника
- Термит с сульфатом кальция
- Синтез тетрахлорида титана
- Титановые электроды
- Галогенные соли титана
- Анодирование металлического титана дает широкий спектр цветов:
Обращение
Безопасность
Титановый порошок и стружка могут быть легковоспламеняющимися.

 Железо
Железо Неодим
Неодим Нептуний
Нептуний org/wiki/Titan_(Element)
org/wiki/Titan_(Element) 1539848. http://bernath.uwaterloo.ca/media/257.pdf.
1539848. http://bernath.uwaterloo.ca/media/257.pdf. (2006). История и
Использование химических элементов нашей Земли:
Справочное руководство (2-е издание) .
Вестпорт, Коннектикут: Гринвуд
Нажимать. ISBN 0313334382.
(2006). История и
Использование химических элементов нашей Земли:
Справочное руководство (2-е издание) .
Вестпорт, Коннектикут: Гринвуд
Нажимать. ISBN 0313334382.  2000–2006 гг. ISBN 0-7876-5015-3.
http://www.answers.com/Титан.
2000–2006 гг. ISBN 0-7876-5015-3.
http://www.answers.com/Титан.
 Титан реагирует с галогенами, такими как F, Cl, Br и I. Он реагирует с хлором при 550 ℃ и образует тетрахлорид титана. Ниже приведена реакция –
Титан реагирует с галогенами, такими как F, Cl, Br и I. Он реагирует с хлором при 550 ℃ и образует тетрахлорид титана. Ниже приведена реакция –


 867
867 использование
использование